Лекарственное средство для лечения рака
Формула / Реферат
1. Лекарственное средство для предупреждения и/или лечения рака, которое содержит в качестве активного ингредиента вещество, выбранное из группы, состоящей из соединения, представленного следующей формулой (I), и его фармакологически приемлемой соли, гидрата и сольвата:
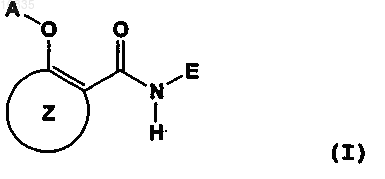
где А представляет собой атом водорода или ацетильную группу,
Е представляет собой 2,5-дизамещенную фенильную группу или 3,5-дизамещенную фенильную группу, где по меньшей мере один из указанных заместителей является трифторметильной группой, а другой заместитель выбран из группы, состоящей из
атома галогена;
нитрогруппы;
C1-6-алкильной группы;
галогенированной C1-6-алкильной группы;
C1-6-алкоксигруппы;
галогенированной C1-6-алкоксигруппы;
C1-6-алкилсульфанильной группы;
C1-6-алкилоксикарбонильной группы;
карбоксигруппы;
5-6-членной неароматической гетероциклической группы, которая включает по меньшей мере один из трех видов гетероатомов, входящих в кольцо, выбранных из атома кислорода, атома азота и атома серы, где указанная гетероциклическая группа необязательно замещена одной или несколькими галогенированными C1-6-алкильными группами; и С6-10-арилоксигруппы, необязательно замещенной одним или несколькими заместителями, выбранными из группы, состоящей из
атома галогена,
цианогруппы,
C1-6-алкильной группы и
C1-6-алкоксигруппы,
монозамещенную тиазол-2-ильную группу или дизамещенную тиазол-2-ильную группу, где указанные заместители выбраны из группы, состоящей из
атома галогена,
цианогруппы,
C1-6-алкильной группы, необязательно замещенной одним или несколькими заместителями, выбранными из группы, состоящей из
карбоксигруппы и
C1-6-алкилоксикарбонильной группы;
галогенированной C1-6-алкильной группы;
С6-10-арильной группы, необязательно замещенной одним или несколькими заместителями, выбранными из группы, состоящей из
атома галогена и
галогенированной C1-6-алкильной группы;
C1-6-алкилкарбонильной группы;
С6-10-арилкарбонильной группы;
C1-6-алкилоксикарбонильной группы;
6-членной неароматической гетероциклической группы, которая включает по меньшей мере один из трех видов гетероатомов, входящих в кольцо, выбранных из атома кислорода, атома азота и атома серы, где указанная гетероциклическая группа необязательно замещена одним или несколькими заместителями, выбранными из группы, состоящей из
С1-6-алкильной группы и С6-10-арильной группы;
С7-16-аралкильной группы;
карбамоильной группы, необязательно замещенной одним или несколькими заместителями, выбранными из группы, состоящей из
C1-6-алкильной группы и С7-16-аралкильной группы;
карбоксигруппы,
кольцо Z представляет собой бензольное кольцо, необязательно замещенное одним или несколькими заместителями, выбранными из группы, состоящей из атома галогена; нитрогруппы; цианогруппы; C1-6-алкоксигруппы; C1-8-алкильной группы, необязательно замещенной одним или несколькими заместителями, выбранными из группы, состоящей из
гидроксильной группы, C1-6-алкилоксииминогруппы и С7-16-аралкилоксииминогруппы;
С2-6-алкенильной группы, необязательно замещенной одним или несколькими заместителями, выбранными из группы, состоящей из
С6-10-арильной группы,
цианогруппы,
C1-6-алкилоксикарбонильной группы и
карбоксигруппы;
С2-6-алкинильной группы, необязательно замещенной одним или несколькими заместителями, выбранными из группы, состоящей из
С6-10-арильной группы и
три (С1-6-алкил) силильной группы;
галогенированной C1-6-алкильной группы;
С6-10-арильной группы, необязательно замещенной одним или несколькими заместителями, выбранными из группы, состоящей из
атома галогена и
галогенированной C1-6-алкильной группы;
С7-16-аралкильной группы;
5-9-членной гетероарильной группы, которая включает по меньшей мере один из трех видов гетероатомов, входящих в кольцо, выбранных из атома кислорода, атома азота и атома серы, где указанная гетероарильная группа необязательно замещена одной или несколькими C1-6-алкильными группами;
C1-6-алкилкарбонильной группы;
6-членной неароматической гетероциклической карбонильной группы, которая включает по меньшей мереодин из трех видов гетероатомов, входящих в кольцо, выбранных из атома кислорода, атома азота и атома серы, где указанная гетероциклическая группа необязательно замещена одной или несколькими С7-16-аралкильными группами;
5-членной гетероарилсульфонильной группы, которая включает по меньшей мере один из трех видов гетероатомов, входящих в кольцо, выбранных из атома кислорода, атома азота и атома серы;
карбоксигруппы;
C1-6-алкилоксикарбонильной группы;
карбамоильной группы, необязательно замещенной одним или несколькими заместителями, выбранными из группы, состоящей из
С6-10-арильной группы, необязательно замещенной одной или несколькими галогенированными
C1-6-алкильными группами, и
C1-6-алкильной группы;
сульфамоильной группы, необязательно замещенной одним или несколькими заместителями, выбранными из группы, состоящей из
С6-10-арильной группы, необязательно замещенной одной или несколькими галогенированными
C1-6-алкильными группами, и
C1-6-алкильной группы;
аминогруппы, необязательно замещенной одним или несколькими заместителями, выбранными из группы, состоящей из
C1-6-алкильной группы,
C1-6-алкилкарбонильной группы,
С6-10-арилкарбонильной группы,
C1-6-алкилсульфонильной группы и
С6-10-арилсульфонильной группы;
уреидогруппы, необязательно замещенной одной или несколькими С6-10-арильными группами;
тиоуреидогруппы, необязательно замещенной одной или несколькими С6-10-арильными группами;
диазенильной группы, необязательно замещенной одной или несколькими С6-10-арильными группами, где указанные арильные группы необязательно замещены одним или несколькими заместителями, выбранными из группы, состоящей из
нитрогруппы и
6-членной гетероарилсульфамоильной группы; и
гидроксильной группы.
2. Лекарственное средство по п.1, где А обозначает атом водорода или ацетильную группу,
Е обозначает 2,5-дизамещенную фенильную группу, где по меньшей мере один из указанных заместителей обозначает трифторметильную группу, а другой заместитель выбран из группы, состоящей из
атома галогена;
нитрогруппы;
C1-6-алкильной группы;
галогенированной C1-6-алкильной группы;
C1-6-алкоксигруппы;
галогенированной C1-6-алкоксигруппы;
C1-6-алкилсульфанильной группы;
C1-6-алкилоксикарбонильной группы;
карбоксигруппы;
5-6-членной неароматической гетероциклической группы, которая включает по меньшей мере один из трех видов гетероатомов, входящих в кольцо, выбранных из атома кислорода, атома азота и атома серы, необязательно замещенной одной или несколькими галогенированными C1-6-алкильными группами; и
С6-10-арилоксигруппы, необязательно замещенной одним или несколькими заместителями, выбранными из группы, состоящей из
атома галогена,
цианогруппы,
C1-6-алкильной группы и
C1-6-алкоксигруппы,
кольцо Z обозначает бензольное кольцю, необязательно замещенное одним или несколькими заместителями, выбранными из группы, состоящей из
атома галогена;
нитрогруппы;
цианогруппы;
C1-6-алкоксигруппы;
C1-8-алкильной группы, необязательно замещенной одним или несколькими заместителями, выбранными из группы, состоящей из
гидроксильной группы, C1-6-алкилоксииминогруппы и С7-16-аралкилоксииминогруппы;
С2-6-алкенильной группы, необязательно замещенной одним или несколькими заместителями, выбранными из группы, состоящей из
С6-10-арильной группы,
цианогруппы,
C1-6-алкилоксикарбонильной группы и
карбоксигруппы;
С2-6-алкинильной группы, необязательно замещенной одним или несколькими заместителями, выбранными из группы, состоящей из
С6-10-арильной группы и
три(C1-6-алкил)силильной группы;
галогенированной C1-6-алкильной группы;
С6-10-арильной группы, необязательно замещенной одним или несколькими заместителями, выбранными из группы, состоящей из
атома галогена и
галогенированной C1-6-алкильной группы;
С7-16-аралкильной группы;
5-9-членной гетероарильной группы, которая включает по меньшей мере один из трех видов гетероатомов, входящих в кольцо, выбранных из атома кислорода, атома азота и атома серы, необязательно замещенной одной или несколькими C1-6-алкильными группами;
C1-6-алкилкарбонильной группы;
6-членной неароматической гетероциклической карбонильной группы, которая включает по меньшей мере один из трех видов гетероатомов, входящих в кольцо, выбранных из атома кислорода, атома азота и атома серы, необязательно замещенной одной или несколькими С7-16-аралкильными группами;
5-членной гетероарилсульфонильной группы, которая включает по меньшей мере один из трех видов гетероатомов, входящих в кольцо, выбранных из атома кислорода, атома азота и атома серы;
карбоксигруппы;
C1-6-алкилоксикарбонильной группы;
карбамоильной группы, необязательно замещенной одним или несколькими заместителями, выбранными из группы, состоящей из
С6-10-арильной группы, необязательно замещенной одной или несколькими галогенированными
C1-6-алкильными группами, и
C1-6-алкильной группы;
сульфамоильной группы, необязательно замещенной одним или несколькими заместителями, выбранными из группы, состоящей из
С6-10-арильной группы, необязательно замещенной одной или несколькими галогенированными
C1-6-алкильными группами, и
C1-6-алкильной группы;
аминогруппы, необязательно замещенной одним или несколькими заместителями, выбранными из группы, состоящей из
C1-6-алкильной группы,
C1-6-алкилкарбонильной группы,
С6-10-арилкарбонильной группы,
С1-6-алкилсульфонильной группы и
С6-10-арилсульфонильной группы;
уреидогруппы, необязательно замещенной одной или несколькими С6-10-арильными группами;
тиоуреидогруппы, необязательно замещенной одной или несколькими С6-10-арильными группами;
диазенильной группы, необязательно замещенной одной или несколькими С6-10-арильными группами, где указанные арильные группы необязательно замещены одним или несколькими заместителями, выбранными из группы, состоящей из
нитрогруппы и
6-членной гетероарилсульфамоильной группы; и
гидроксильной группы.
3. Лекарственное средство по п.2, где А обозначает атом водорода,
Е обозначает 2,5-дизамещенную фенильную группу, где по меньшей мере один из указанных заместителей обозначает трифторметильную группу, а другой заместитель выбран из группы, состоящей из
атома галогена;
нитрогруппы;
C1-6-алкильной группы;
галогенированной C1-6-алкильной группы;
C1-6-алкоксигруппы;
галогенированной C1-6-алкоксигруппы;
C1-6-алкилсульфанильной группы;
5-6-членной неароматической гетероциклической группы, которая включает по меньшей мере один из трех видов гетероатомов, входящих в кольцо, выбранных из атома кислорода, атома азота и атома серы, необязательно замещенной одной или несколькими галогенированными C1-6-алкильными группами; и
С6-10-арилоксигруппы, необязательно замещенной одним или несколькими заместителями, выбранными из группы, состоящей из
атома галогена;
цианогруппы;
C1-6-алкильной группы и
C1-6-алкоксигруппы,
а следующая часть формулы (Iz-1) в общей формуле, содержащей кольцо Z

представлена следующей формулой (Iz-2):
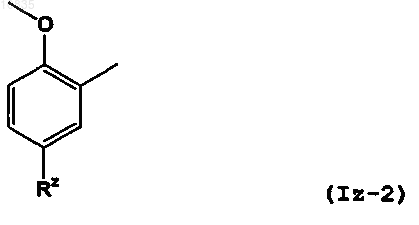
где Rz обозначает
атом водорода;
атом галогена;
нитрогруппу;
цианогруппу;
C1-6-алкоксигруппу;
C1-8-алкильную группу, необязательно замещенную одним или несколькими заместителями, выбранными из группы, состоящей из
гидроксильной группы;
C1-6-алкилоксииминогруппы и
С7-16-аралкилоксииминогруппы;
С2-6-алкенильную группу, необязательно замещенную одним или несколькими заместителями, выбранными из группы, состоящей из
С6-10-арильной группы;
цианогруппы;
C1-6-алкилоксикарбонильной группы и
карбоксигруппы;
С2-6-алкинильную группу, необязательно замещенную одним или несколькими заместителями, выбранными из группы, состоящей из
С6-10-арильной группы и
три(C1-6-алкил)силильной группы;
галогенированную C1-6-алкильную группу;
С6-10-арильную группу, необязательно замещенную одним или несколькими заместителями, выбранными из группы, состоящей из
атома галогена и
галогенированной C1-6-алкильной группы;
С7-16-аралкильную группу;
5-9-членную гетероарильную группу, которая включает по меньшей мере один из трех видов гетероатомов, входящих в кольцо, выбранных из атома кислорода, атома азота и атома серы, необязательно замещенную одной или несколькими C1-6-алкильными группами;
C1-6-алкилкарбонильную группу;
6-членную неароматическую гетероциклическую карбонильную группу, которая включает по меньшей мере один из трех видов гетероатомов, входящих в кольцо, выбранных из атома кислорода, атома азота и атома серы, необязательно замещенную одной или несколькими С7-16-аралкильными группами;
5-членную гетероарилсульфонильную группу, которая включает по меньшей мере один из трех видов гетероатомов, входящих в кольцо, выбранных из атома кислорода, атома азота и атома серы;
карбоксигруппу;
C1-6-алкилоксикарбонильную группу;
карбамоильную группу, необязательно замещенную одним или несколькими заместителями, выбранными из группы, состоящей из
С6-10-арильной группы, необязательно замещенной одной или несколькими галогенированными
C1-6-алкильными группами, и
C1-6-алкильной группы;
сульфамоильную группу, необязательно замещенную одним или несколькими заместителями, выбранными из группы, состоящей из
С6-10-арильной группы, необязательно замещенной одной или несколькими галогенированными
C1-6-алкильными группами, и
С1-6-алкильной группы;
аминогруппу, необязательно замещенную одним или несколькими заместителями, выбранными из группы, состоящей из
C1-6-алкильной группы,
C1-6-алкилкарбонильной группы,
С6-10-арилкарбонильной группы,
C1-6-алкилсульфонильной группы и
С6-10-арилсульфонильной группы;
уреидогруппу, необязательно замещенную одной или несколькими С6-10-арильными группами;
тиоуреидогруппу, необязательно замещенную одной или несколькими С6-10-арильными группами; или
диазенильную группу, необязательно замещенную одной или несколькими С6-10-арильными группами, где указанные арильные группы являются необязательно замещенными одним или несколькими заместителями, выбранными из группы, состоящей из
нитрогруппы и
6-членной гетероарилсульфамоильной группы.
4. Лекарственное средство по п.3, где
Rz обозначает атом галогена,
Е обозначает группу, выбранную из следующей группы заместителей d-2е [Группа заместителей d-2е]:
2-хлор-5-(трифторметил)фенильная группа,
2,5-бис(трифторметил)фенильная группа,
2-фтор-5-(трифторметил)фенильная группа,
2-нитро-5-(трифторметил)фенильная группа,
2-метил-5-(трифторметил)фенильная группа,
2-метокси-5-(трифторметил)фенильная группа,
2-метилсульфанил-5-(трифторметил)фенильная группа,
2-(1-пирролидинил)-5-(трифторметил)фенильная группа,
2-морфолино-5-(трифторметил)фенильная группа,
2-бром-5-(трифторметил)фенильная группа,
2-(2-нафтилокси)-5-(трифторметил)фенильная группа,
2-(2,4-дихлорфенокси)-5-(трифторметил)фенильная группа,
2-[4-(трифторметил)пиперидин-1-ил]-5-(трифторметил)фенильная группа,
2-(2,2,2-трифторэтокси)-5-(трифторметил)фенильная группа,
2-(2-метоксифенокси)-5-(трифторметил)фенильная группа,
2-(4-хлор-3,5-диметилфенокси)-5-(трифторметил)фенильная группа,
2-пиперидино-5-(трифторметил)фенильная группа,
2-(4-метилфенокси)-5-(трифторметил)фенильная группа,
2-(4-хлорфенокси)-5-(трифторметил)фенильная группа,
2-(4-цианофенокси)-5-(трифторметил)фенильная группа и 2-(4-метоксифенокси)-5-(трифторметил) фенильная группа.
5. Лекарственное средство по п.4, где Rz обозначает атом галогена,
Е обозначает 2,5-бис(трифторметил)фенильную группу.
6. Лекарственное средство по п.5, где Rz обозначает атом брома,
Е обозначает 2,5-бис(трифторметил)фенильную группу.
7. Лекарственное средство по любому из пп.2-3, где Е обозначает 2,5-бис(трифторметил)фенильную группу.
8. Лекарственное средство по п.1, где
А обозначает атом водорода или ацетильную группу,
Е обозначает 3,5-дизамещенную фенильную группу, где по меньшей мере один из указанных заместителей обозначает трифторметильную группу, а другой заместитель выбран из группы, состоящей из
атома галогена;
нитрогруппы;
C1-6-алкильной группы;
галогенированной C1-6-алкильной группы;
C1-6-алкоксигруппы;
галогенированной C1-6-алкоксигруппы;
C1-6-алкилсульфанильной группы;
C1-6-алкилоксикарбонильной группы;
карбоксигруппы;
5-6-членной неароматической гетероциклической группы, которая включает по меньшей мере один из трех видов гетероатомов, входящих в кольцо, выбранных из атома кислорода, атома азота и атома серы, необязательно замещенной одним или несколькими галогенированными С1-6-алкильными группами; и
С6-10-арилоксигруппы, необязательно замещенной одним или несколькими заместителями, выбранными из группы, состоящей из
атома галогена,
цианогруппы,
C1-6-алкильной группы и
C1-6-алкоксигруппы,
кольцо Z обозначает бензольное кольцо, необязательно замещенное одним или несколькими заместителями, выбранными из группы, состоящей из
атома галогена;
нитрогруппы;
цианогруппы;
C1-6-алкоксигруппы;
C1-8-алкильной группы, необязательно замещенной одним или несколькими заместителями, выбранными из группы, состоящей из
гидроксильной группы,
C1-6-алкилоксииминогруппы и
С7-16-аралкилоксииминогруппы;
С2-6-алкенильной группы, необязательно замещенной одним или несколькими заместителями, выбранными из группы, состоящей из
С6-10-арильной группы,
цианогруппы,
C1-6-алкилоксикарбонильной группы и
карбоксигруппы;
С2-6-алкинильной группы, необязательно замещенной одним или несколькими заместителями, выбранными из группы, состоящей из
С6-10-арильной группы и
три(C1-6-алкил)силильной группы;
галогенированной C1-6-алкильной группы;
С6-10-арильной группы, необязательно замещенной одним или несколькими заместителями, выбранными из группы, состоящей из
атома галогена и
галогенированной C1-6-алкильной группы;
С7-16-аралкильной группы;
5-9-членной гетероарильной группы, которая включает по меньшей мере один из трех видов гетероатомов, входящих в кольцо, выбранных из атома кислорода, атома азота и атома серы, необязательно замещенной одной или несколькими C1-6-алкильными группами;
C1-6-алкилкарбонильной группы;
6-членной неароматической гетероциклической карбонильной группы, которая включает по меньшей мере один из трех видов гетероатомов, входящих в кольцо, выбранных из атома кислорода, атома азота и атома серы, необязательно замещенной одной или несколькими С7-16-аралкильными группами;
5-членной гетероарилсульфонильной группы, которая включает по меньшей мере один из трех видов гетероатомов, входящих в кольцо, выбранных из атома кислорода, атома азота и атома серы;
карбоксигруппы;
C1-6-алкилоксикарбонильной группы;
карбамоильной группы, необязательно замещенной одним или несколькими заместителями, выбранными из группы, состоящей из
С6-10-арильной группы, необязательно замещенной одной или несколькими галогенированными
C1-6-алкильными группами, и
С1-6-алкильной группы;
сульфамоильной группы, необязательно замещенной одним или несколькими заместителями, выбранными из группы, состоящей из
С6-10-арильной группы, необязательно замещенной одной или несколькими галогенированными
C1-6-алкильными группами, и
C1-6-алкильной группы;
аминогруппы, необязательно замещенной одним или несколькими заместителями, выбранными из группы, состоящей из
C1-6-алкильной группы,
С1-6-алкилкарбонильной группы,
С6-10-арилкарбонильной группы,
C1-6-алкилсульфонильной группы и
С6-10-арилсульфонильной группы;
уреидогруппы, необязательно замещенной одной или несколькими С6-10-арильными группами;
тиоуреидогруппы, необязательно замещенной одной или несколькими С6-10-арильными группами;
диазенильной группы, необязательно замещенной одной или несколькими С6-10-арильными группами, где указанные арильные группы необязательно замещены одним или несколькими заместителями, выбранными из группы, состоящей из
нитрогруппы и
6-членной гетероарилсульфамоильной группы; и
гидроксильной группы.
9. Лекарственное средство по п.8, где А обозначает атом водорода,
Е обозначает 3,5-дизамещенную фенильную группу, где по меньшей мере один из указанных заместителей обозначает трифторметильную группу, а другой заместитель выбран из группы, состоящей из
атома галогена;
галогенированной C1-6-алкильной группы;
C1-6-алкоксигруппы;
C1-6-алкилоксикарбонильной группы и
карбоксигруппы;
следующая часть формулы (Iz-1) в общей формуле, содержащей кольцо Z

представлена следующей формулой (Iz-2)
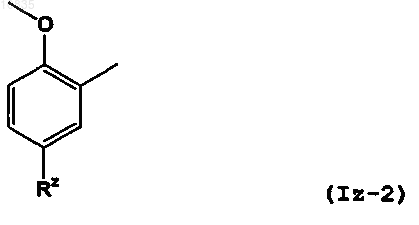
где Rz обозначает
атом водорода;
атом галогена;
нитрогруппу;
цианогруппу;
C1-6-алкоксигруппу;
C1-8-алкильную группу, необязательно замещенную одним или несколькими заместителями, выбранными из группы, состоящей из
гидроксильной группы,
C1-6-алкилоксииминогруппы и
С7-16-аралкилоксииминогруппы;
С2-6-алкенильную группу, необязательно замещенную одним или несколькими заместителями, выбранными из группы, состоящей из
С6-10-арильной группы,
цианогруппы,
C1-6-алкилоксикарбонильной группы и
карбоксигруппы;
С2-6-алкинильную группу, необязательно замещенную одним или несколькими заместителями, выбранными из группы, состоящей из
С6-10-арильной группы и
три(C1-6-алкил)силильной группы;
галогенированную С1-6-алкильную группу;
С6-10-арильную группу, необязательно замещенную одним или несколькими заместителями, выбранными из группы, состоящей из
атома галогена и
галогенированной C1-6-алкильной группы;
С7-16-аралкильную группу;
5-9-членную гетероарильную группу, которая включает по меньшей мере один из трех видов гетероатомов, входящих в кольцо, выбранных из атома кислорода, атома азота и атома серы, необязательно замещенную одной или несколькими C1-6-алкильными группами;
C1-6-алкилкарбонильную группу;
6-членную неароматическую гетероциклическую карбонильную группу, которая включает по меньшей мере один из трех видов гетероатомов, входящих в кольцо, выбранных из атома кислорода, атома азота и атома серы, необязательно замещенную одной или несколькими С7-16-аралкильными группами;
5-членную гетероарилсульфонильную группу, которая включает по меньшей мере один из трех видов гетероатомов, входящих в кольцо, выбранных из атома кислорода, атома азота и атома серы;
карбоксигруппу;
C1-6-алкилоксикарбонильную группу;
карбамоильную группу, необязательно замещенную одним или несколькими заместителями, выбранными из группы, состоящей из
С6-10-арильной группы, необязательно замещенной одной или несколькими галогенированными
C1-6-алкильными группами, и
C1-6-алкильной группы;
сульфамоильную группу, необязательно замещенную одним или несколькими заместителями, выбранными из группы, состоящей из
С6-10-арильной группы, необязательно замещенной одной или несколькими галогенированными
C1-6-алкильными группами, и
C1-6-алкильной группы;
аминогруппу, необязательно замещенную одним или несколькими заместителями, выбранными из группы, состоящей из
C1-6-алкильной группы,
C1-6-алкилкарбонильной группы,
С6-10-арилкарбонильной группы,
C1-6-алкилсульфонильной группы и
С6-10-арилсульфонильной группы;
уреидогруппу, необязательно замещенную одной или несколькими С6-10-арильными группами;
тиоуреидогруппу, необязательно замещенную одной или несколькими С6-10-арильными группами; или
диазенильную группу, необязательно замещенную одной или несколькими С6-10-арильными группами, где указанные арильные группы необязательно замещены одним или несколькими заместителями, выбранными из группы, состоящей из
нитрогруппы и
6-членной гетероарилсульфамоильной группы.
10. Лекарственное средство по п.9, где Rz обозначает атом галогена,
Е обозначает группу, выбранную из следующей группы заместителей d-4е [Группа заместителей d-4е]:
3,5-бис(трифторметил)фенильная группа,
3-фтор-5-(трифторметил)фенильная группа,
3-бром-5-(трифторметил)фенильная группа,
3-метокси-5-(трифторметил)фенильная группа,
3-метоксикарбонил-5-(трифторметил)фенильная группа и
3-карбокси-5-(трифторметил)фенильная группа.
11. Лекарственное средство по п.10, где Rz обозначает атом галогена, Е обозначает 3,5-бис(трифторметил)фенильную группу.
12. Лекарственное средство по п.11, где Rz обозначает атом хлора, Е обозначает 3,5-бис(трифторметил)фенильную группу.
13. Лекарственное средство по любому из пп.8-10, где Е обозначает 3,5-бис(трифторметил)фенильную группу.
14. Лекарственное средство по п.1, где А обозначает атом водорода или ацетильную группу,
Е обозначает монозамещенную тиазол-2-ильную группу или дизамещенную тиазол-2-ильную группу, где указанные заместители выбраны из группы, состоящей из
атома галогена;
цианогруппы;
C1-6-алкильной группы, необязательно замещенной одним или несколькими заместителями, выбранными из группы, состоящей из
карбоксигруппы и C1-6-алкилоксикарбонильной группы;
галогенированной C1-6-алкильной группы;
С6-10-арильной группы, необязательно замещенной одним или несколькими заместителями, выбранными из группы, состоящей из
атома галогена и галогенированной C1-6-алкильной группы;
C1-6-алкилкарбонильной группы;
С6-10-арилкарбонильной группы;
C1-6-алкилоксикарбонильной группы;
6-членной неароматической гетероциклической группы, которая включает по меньшей мере один из трех видов гетероатомов, входящих в кольцо, выбранных из атома кислорода, атома азота и атома серы, необязательно замещенной одним или несколькими заместителями, выбранными из группы, состоящей из С1-6-алкильной группы и С6-10-арильной группы;
С7-16-аралкильной группы;
карбамоильной группы, необязательно замещенной одним или несколькими заместителями, выбранными из группы, состоящей из
C1-6-алкильной группы и С7-16-аралкильной группы; и
карбоксигруппы,
кольцо Z обозначает бензольное кольцо, необязательно замещенное одним или несколькими заместителями, выбранными из группы, состоящей из
атома галогена;
нитрогруппы;
цианогруппы;
C1-6-алкоксигруппы;
C1-8-алкильной группы, необязательно замещенной одним или несколькими заместителями, выбранными из группы, состоящей из
гидроксильной группы,
C1-6-алкилоксииминогруппы и
С7-16-аралкилоксииминогруппы;
С2-6-алкенильной группы, необязательно замещенной одним или несколькими заместителями, выбранными из группы, состоящей из
С6-10-арильной группы,
цианогруппы,
C1-6-алкилоксикарбонильной группы и
карбоксигруппы;
С2-6-алкинильной группы, необязательно замещенной одним или несколькими заместителями, выбранными из группы, состоящей из
С6-10-арильной группы и
три(C1-6-алкил)силильной группы;
галогенированной C1-6-алкильной группы;
С6-10-арильной группы, необязательно замещенной одним или несколькими заместителями, выбранными из группы, состоящей из
атома галогена и
галогенированной C1-6-алкильной группы;
С7-16-аралкильной группы;
5-9-членной гетероарильной группы, которая включает по меньшей мере один из трех видов гетероатомов, входящих в кольцо, выбранных из атома кислорода, атома азота и атома серы, необязательно замещенной одной или несколькими C1-6-алкильными группами;
С1-6-алкилкарбонильной группы;
6-членной неароматической гетероциклической карбонильной группы, которая включает по меньшей мере один из трех видов гетероатомов, входящих в кольцо, выбранных из атома кислорода, атома азота и атома серы, необязательно замещенной одной или несколькими С7-16-аралкильными группами;
5-членной гетероарилсульфонильной группы, которая включает по меньшей мере один из тЁхх видов гетероатомов, входящих в кольцо, выбранных из атома кислорода, атома азота и атома серы;
карбоксигруппы;
C1-6-алкилоксикарбонильной группы;
карбамоильной группы, необязательно замещенной одним или несколькими заместителями, выбранными из группы, состоящей из
С6-10-арильной группы, необязательно замещенной одной или несколькими галогенированными
C1-6-алкильными группами, и
C1-6-алкильной группы;
сульфамоильной группы, необязательно замещенной одним или несколькими заместителями, выбранными из группы, состоящей из
С6-10-арильной группы, необязательно замещенной одной или несколькими галогенированными
C1-6-алкильными группами, и
C1-6-алкильной группы;
аминогруппы, необязательно замещенной одним или несколькими заместителями, выбранными из группы, состоящей из
C1-6-алкильной группы,
C1-6-алкилкарбонильной группы,
С6-10-арилкарбонильной группы,
C1-6-алкилсульфонильной группы и
С6-10-арилсульфонильной группы;
уреидогруппы, необязательно замещенной одной или несколькими С6-10-арильными группами;
тиоуреидогруппы, необязательно замещенной одной или несколькими С6-10-арильными группами;
диазенильной группы, необязательно замещенной одной или несколькими С6-10-арильными группами, где указанные арильные группы необязательно замещены одним или несколькими заместителями, выбранными из группы, состоящей из
нитрогруппы и
6-членной гетероарилсульфамоильной группы; и
гидроксильной группы.
15. Лекарственное средство по п.14, где А обозначает атом водорода,
Е обозначает монозамещенную тиазол-2-ильную группу или дизамещенную тиазол-2-ильную группу, где указанные заместители выбраны из группы, состоящей из
атома галогена;
цианогруппы;
C1-6-алкильной группы, необязательно замещенной одним или несколькими заместителями, выбранными из группы, состоящей из
карбоксигруппы и C1-6-алкилоксикарбонильной группы;
галогенированной C1-6-алкильной группы;
С6-10-арильнрй группы, необязательно замещенной одним или несколькими заместителями, выбранными из группы, состоящей из
атома галогена и
галогенированной C1-6-алкильной группы;
C1-6-алкилкарбонильной группы;
С6-10-арилкарбонильной группы;
С1-6-арилоксикарбонильной группы;
6-членной неароматической гетероциклической группы, которая включает по меньшей мере один из трех видов гетероатомов, входящих в кольцо, выбранных из атома кислорода, атома азота и атома серы, необязательно замещенной одним или несколькими заместителями, выбранными из группы, состоящей из C1-6-алкильной группы и С6-10-арильной группы;
С7-16-аралкильной группы;
карбамоильной группы, необязательно замещенной одним или несколькими заместителями, выбранными из группы, состоящей из
C1-6-алкильной группы и С7-16-аралкильной группы; и
карбоксигруппы,
а следующая часть формулы (Iz-1) в общей формуле, содержащей кольцо Z

представлена следующей формулой (Iz-2):
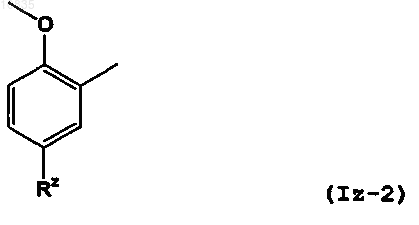
где Rz обозначает
атом водорода;
атом галогена;
нитрогруппу;
цианогруппу;
C1-6-алкоксигруппу;
C1-8-алкильную группу, необязательно замещенную одним или несколькими заместителями, выбранными из группы, состоящей из
гидроксильной группы, C1-6-алкилоксииминогруппы и С7-16-аралкилоксииминогруппы;
С2-6-алкенильную группу, необязательно замещенную одним или несколькими заместителями, выбранными из группы, состоящей из
С6-10-арильной группы,
цианогруппы,
C1-6-алкилоксикарбонильной группы и
карбоксигруппы;
С2-6-алкинильную группу, необязательно замещенную одним или несколькими заместителями, выбранными из группы, состоящей из
С6-10-арильной группы и
три(C1-6-алкил)силильной группы;
галогенированную C1-6-алкильную группу;
С6-10-арильную группу, необязательно замещенную одним или несколькими заместителями, выбранными из группы, состоящей из
атома галогена и
галогенированной C1-6-алкильной группы;
С7-16-аралкильную группу;
5-9-членную гетероарильную группу, которая включает по меньшей мере один из трех видов гетероатомов, входящих в кольцо, выбранных из атома кислорода, атома азота и атома серы, необязательно замещенную одной или несколькими С1-6-алкильными группами;
C1-6-алкилкарбонильную группу;
6-членную неароматическую гетероциклическую карбонильную группу, которая включает по меньшей мере один из трех видов гетероатомов, входящих в кольцо, выбранных из атома кислорода, атома азота и атома серы, необязательно замещенную одной или несколькими С7-16-аралкильными группами;
5-членную гетероарилсульфонильную группу, которая включает по меньшей мере один из трех видов гетероатомов, входящих в кольцо, выбранных из атома кислорода, атома азота и атома серы;
карбоксигруппу;
C1-6-алкилоксикарбонильную группу;
карбамоильную группу, необязательно замещенную одним или несколькими заместителями, выбранными из группы, состоящей из
С6-10-арильной группы, необязательно замещенной одной или несколькими галогенированными
C1-6-алкильными группами, и
C1-6-алкильной группы;
сульфамоильную группу, необязательно замещенную одним или несколькими заместителями, выбранными из группы, состоящей из
С6-10-арильной группы, необязательно замещенной одной или несколькими галогенированными
C1-6-алкильными группами, и
C1-6-алкильной группы;
аминогруппу, необязательно замещенную одним или несколькими заместителями, выбранными из группы, состоящей из
C1-6-алкильной группы,
C1-6-алкилкарбонильной группы,
С6-10-арилкарбонильной группы,
C1-6-алкилсульфонильной группы и
С6-10-арилсульфонильной группы;
уреидогруппу, необязательно замещенную одной или несколькими С6-10-арильными группами;
тиоуреидогруппу, необязательно замещенную одной или несколькими С6-10-арильными группами; или
диазенильную группу, необязательно замещенную одной или несколькими С6-10-арильными группами, где указанные арильные группы необязательно замещены одним или несколькими заместителями, выбранными из группы, состоящей из
нитрогруппы и
6-членной гетероарилсульфамоильной группы.
16. Лекарственное средство по п.15, где Rz обозначает атом галогена,
Е обозначает группу, выбранную из следующей группы заместителей d-5е и группы заместителей d-6е [Группа заместителей d-5е]:
5-бром-4-[(1,1-диметил)этил]тиазол-2-ильная группа,
5-бром-4-(трифторметил)тиазол-2-ильная группа,
5-циано-4-[(1,1-диметил)этил]тиазол-2-ильная группа,
5-метилтиазол-2-ильная группа,
4,5-диметилтиазол-2-ильная группа,
5-метил-4-фенилтиазол-2-ильная группа,
5-(4-фторфенил)-4-метилтиазол-2-ильная группа,
4-метил-5-[3-(трифторметил)фенил]тиазол-2-ильная группа,
4-[(1,1-диметил)этил]-5-этилтиазол-2-ильная группа,
4-этил-5-фенилтиазол-2-ильная группа,
4-изопропил-5-фенилтиазол-2-ильная группа,
4-бутил-5-фенилтиазол-2-ильная группа,
4-[(1,1-диметил)этил]-5-[(2,2-диметил)пропионил]тиазол-2-ильэря группа,
4-[(1,1-диметил)этил]-5-(этоксикарбонил)тиазол-2-ильная группа,
4-[(1,1-диметил)этил]-5-пиперидинотиазол-2-ильная группа,
4-[(1,1-диметил)этил]-5-морфолинотиазол-2-ильная группа,
4-[(1,1-диметил)этил]-5-(4-метилпиперазин-1-ил)тиазол-2-ильная группа,
4-[(1,1-диметил)этил]-5-(4-фенилпиперазин-1-ил)тиазол-2-ильная группа,
5-карбоксиметил-4-фенилтиазол-2-ильная группа,
4,5-дифенилтиазол-2-ильная группа,
4-бензил-5-фенилтиазол-2-ильная группа,
5-фенил-4-(трифторметил)тиазол-2-ильная группа,
5-ацетил-4-фенилтиазол-2-ильная группа,
5-бензоил-4-фенилтиазол-2-ильная группа,
5-этоксикарбонил-4-фенилтиазол-2-ильная группа,
5-этоксикарбонил-4-(пентафторфенил)тиазол-2-ильная группа,
5-метилкарбамоил-4-фенилтиазол-2-ильная группа,
5-этилкарбамоил-4-фенилтиазол-2-ильная группа,
5-изопропилкарбамоил-4-фенилтиазол-2-ильная группа,
5-(2-фенилэтил)карбамоил-4-фенилтиазол-2-ильная группа,
5-этоксикарбонил-4-(трифторметил)тиазол-2-ильная группа,
5-карбокси-4-[(1,1-диметил)этил]тиазол-2-ильная группа,
5-(этоксикарбонил)метил-4-фенилтиазол-2-ильная группа,
5-карбокси-4-фенилтиазол-2-ильная группа и
5-пропилкарбамоил-4-фенилтиазол-2-ильная группа;
[Группа заместителей d-6е]:
4-[(1,1-диметил)этил]тиазол-2-ильная группа,
4-фенилтиазол-2-ильная группа,
4-[(3,5-бис(трифторметил)фенил]тиазол-2-ильная группа,
4-(2,4-дихлорфенил)тиазол-2-ильная группа,
4-(3,4-дихлорфенил)тиазол-2-ильная группа,
4-[4-(трифторметил)фенил]тиазол-2-ильная группа,
4-(2,5-дифторфенил)тиазол-2-ильная группа,
4-(4-метоксифенил)тиазол-2-ильная группа,
4-[3-(трифторметил)фенил]тиазол-2-ильная группа и
4-(пентафторфенил)тиазол-2-ильная группа.
17. Лекарственное средство по п.16, где R2 обозначает атом галогена, Е обозначает 4-[(1,1-диметил)этил]-5-[(2,2-диметил)пропионил]тиазол-2-ильную группу.
18. Применение соединения, представленного формулой (I), как определено в любом из пп.1-17, для приготовления лекарственного средства для предупреждения и/или лечения рака.
19. Применение по п.18 соединения как определено в п.6 для приготовления лекарственного средства для предупреждения и/или лечения рака.
20. Применение по п.18 соединения как определено в п.12 для приготовления лекарственного средства для предупреждения и/или лечения рака.
21. Лекарственное средство для ингибирования пролиферации раковых клеток, включающее в качестве активного ингредиента соединение по любому из пп.1-17.
22. Применение соединения, представленного формулой (I), как определено в любом из пп.1-17 для приготовления лекарственного средства для ингибирования пролиферации раковых клеток.
Текст
010835 Область, к которой относится изобретение Настоящее изобретение относится к лекарственному средству, которое может ингибировать пролиферацию беспорядочно растущих раковых клеток и которое может быть использовано для профилактического и/или терапевтического лечения рака путем индуцирования апоптоза по сути бессмертных раковых клеток. Предшествующий уровень В патенте США 4358443, производные N-фенилсалициламида описаны как ингибиторы роста растений. В описании Европейского патента 0221211, в публикации непрошедшей экспертизу заявки на патент Японии (KOKAI)(Sho) 62-99329 и в описании патента США 6117859, указанные производные описаны как противовоспалительные средства. Кроме того, в публикациях международной заявки WO 99/65499, международной заявки WO 02/49632 и международной заявки WO 02/076918, эти производные описаны как ингибиторы NF-kB. В публикациях международной заявки WO 99/65499, международной заявки WO 02/49632 и международной заявки WO 02/076918 было высказано предположение,что N-фенилсалициламидные производные могут быть использованы в качестве противораковых средств. Однако в этих работах абсолютно отсутствуют какие-либо данные, которые непосредственно указывали бы на возможность использования этих производных в качестве противораковых средств. Кроме того, в публикации международной заявки WO 99/65449, лишь небольшое число соединений было протестировано на ингибирующую активность против NF-kB, а что касается положений заместителей на анилиновой части, то было исследовано очень ограниченное число соединений. В публикации международной заявки WO 02/051397, N-фенилсалициламидные производные описаны как ингибиторы продуцирования цитокинов. Описание изобретения Целью настоящего изобретения является получение противораковых средств, обладающих превосходной эффективностью и незначительными побочными эффектами. Авторами настоящего изобретения был проведены различные исследования на противораковое действие салициламидных производных,которые, как предполагается, имеют низкую токсичность. В результате этих исследований было обнаружено, что N-замещенные салициламидные производные, а в частности, N-арилсалициламидные производные, обладают высокой активностью в отношении стимуляции апоптоза раковых клеток, и что указанные производные, даже в пределах своих эффективных доз, не дают побочных эффектов, обычно наблюдаемых при использовании известных противораковых средств, например, таких побочных эффектов, как нарушение функции печени, нарушение функции почек или миелосупрессия. Кроме того, авторами настоящего изобретения были проведены аналогичные исследования гидроксиарильных производных, которые является аналогами указанных соединений. И результаты этих исследований были положены в основу настоящего изобретения. Таким образом, настоящее изобретение раскрывает: 1. Лекарственное средство для предупреждения и/или лечения рака, которое содержит в качестве активного ингредиента вещество, выбранное из группы, состоящей из соединения, представленного следующей формулой (I), и его фармакологически приемлемой соли, гидрата и сольвата где А представляет собой атом водорода или ацетильную группу,Е представляет собой 2,5-дизамещенную фенильную группу или 3,5-дизамещенную фенильную группу, где по меньшей мере один из указанных заместителей является трифторметильной группой, а другой заместитель выбран из группы, состоящей из атома галогена; нитрогруппы;C1-6-алкилоксикарбонильной группы; карбоксигруппы; 5-6-членной неароматической гетероциклической группы, которая включает по меньшей мере один из трех видов гетероатомов, входящих в кольцо, выбранных из атома кислорода, атома азота и атома серы, где указанная гетероциклическая группа необязательно замещена одной или несколькими галогенированными C1-6-алкильными группами; и С 6-10-арилоксигруппы, необязательно замещенной одним или несколькими заместителями, выбран-1 010835 ными из группы, состоящей из атома галогена,цианогруппы,C1-6-алкильной группы иC1-6-алкоксигруппы,монозамещенную тиазол-2-ильную группу или дизамещенную тиазол-2-ильную группу, где указанные заместители выбраны из группы, состоящей из атома галогена,цианогруппы,C1-6-алкильной группы, необязательно замещенной одним или несколькими заместителями, выбранными из группы, состоящей из карбоксигруппы иC1-6-алкилоксикарбонильной группы; галогенированной C1-6-алкильной группы; С 6-10-арильной группы, необязательно замещенной одним или несколькими заместителями, выбранными из группы, состоящей из атома галогена и галогенированной C1-6-алкильной группы;C1-6-алкилоксикарбонильной группы; 6-членной неароматической гетероциклической группы, которая включает по меньшей мере один из трех видов гетероатомов, входящих в кольцо, выбранных из атома кислорода, атома азота и атома серы, где указанная гетероциклическая группа необязательно замещена одним или несколькими заместителями, выбранными из группы, состоящей изC1-6-алкильной группы и С 6-10-арильной группы; С 7-16-аралкильной группы; карбамоильной группы, необязательно замещенной одним или несколькими заместителями, выбранными из группы, состоящей изC1-6-алкильной группы и С 7-16-аралкильной группы; карбоксигруппы,кольцо Z представляет собой бензольное кольцо, необязательно замещенное одним или несколькими заместителями, выбранными из группы, состоящей из атома галогена; нитрогруппы; цианогруппы; C1-6-алкоксигруппы;C1-8-алкильной группы, необязательно замещенной одним или несколькими заместителями, выбранными из группы, состоящей из гидроксильной группы,C1-6-алкилоксииминогруппы и С 7-16-аралкилоксииминогруппы; С 2-6-алкенильной группы, необязательно замещенной одним или несколькими заместителями, выбранными из группы, состоящей из С 6-10-арильной группы,цианогруппы,C1-6-алкилоксикарбонильной группы и карбоксигруппы; С 2-6-алкинильной группы, необязательно замещенной одним или несколькими заместителями, выбранными из группы, состоящей из С 6-10-арильной группы и три(C1-6-алкил)силильной группы; галогенированной C1-6-алкильной группы; С 6-10-арильной группы, необязательно замещенной одним или несколькими заместителями, выбранными из группы, состоящей из атома галогена и галогенированной C1-6-алкильной группы; С 7-16-аралкильной группы; 5-9-членной гетероарильной группы, которая включает по меньшей мере один из трех видов гетероатомов, входящих в кольцо, выбранных из атома кислорода, атома азота и атома серы, где указанная гетероарильная группа необязательно замещена одной или несколькими C1-6-алкильными группами;C1-6-алкилкарбонильной группы; 6-членной неароматической гетероциклической карбонильной группы, которая включает по меньшей мере один из трех видов гетероатомов, входящих в кольцо, выбранных из атома кислорода, атома азота и атома серы, где указанная гетероциклическая группа необязательно замещена одной или не-2 010835 сколькими С 7-16-аралкильными группами; 5-членной гетероарилсульфонильной группы, которая включает по меньшей мере один из трех видов гетероатомов, входящих в кольцо, выбранных из атома кислорода, атома азота и атома серы; карбоксигруппы;C1-6-алкилоксикарбонильной группы; карбамоильной группы, необязательно замещенной одним или несколькими заместителями, выбранными из группы, состоящей из С 6-10-арильной группы, необязательно замещенной одной или несколькими галогенированнымиC1-6-алкильной группы; сульфамоильной группы, необязательно замещенной одним или несколькими заместителями, выбранными из группы, состоящей из С 6-10-арильной группы, необязательно замещенной одной или несколькими галогенированнымиC1-6-алкильной группы; аминогруппы, необязательно замещенной одним или несколькими заместителями, выбранными из группы, состоящей изC1-6-алкильной группы,C1-6-алкилкарбонильной группы,С 6-10-арилкарбонильной группы,C1-6-алкилсульфонильной группы и С 6-10-арилсульфонильной группы; уреидогруппы, необязательно замещенной одной или несколькими С 6-10-арильными группами; тиоуреидогруппы, необязательно замещенной одной или несколькими С 6-10-арильными группами; диазенильной группы, необязательно замещенной одной или несколькими С 6-10-арильными группами, где указанные арильные группы необязательно замещены одним или несколькими заместителями,выбранными из группы, состоящей из нитрогруппы и 6-членной гетероарилсульфамоильной группы; и гидроксильной группы. 2. Лекарственное средство по п.1, где А обозначает атом водорода или ацетильную группу, Е обозначает 2,5-дизамещенную фенильную группу, где по меньшей мере один из указанных заместителей обозначает трифторметильную группу, а другой заместитель выбран из группы, состоящей из атома галогена; нитрогруппы;C1-6-алкилоксикарбонильной группы; карбоксигруппы; 5-6-членной неароматической гетероциклической группы, которая включает по меньшей мере один из трех видов гетероатомов, входящих в кольцо, выбранных из атома кислорода, атома азота и атома серы, необязательно замещенной одной или несколькими галогенированными C1-6-алкильными группами; и С 6-10-арилоксигруппы, необязательно замещенной одним или несколькими заместителями, выбранными из группы, состоящей из атома галогена, цианогруппы,C1-6-алкильной группы иC1-6-алкоксигруппы,кольцо Z обозначает бензольное кольцо, необязательно замещенное одним или несколькими заместителями, выбранными из группы, состоящей из атома галогена; нитрогруппы; цианогруппы; C1-6 алкоксигруппы;C1-8-алкильной группы, необязательно замещенной одним или несколькими заместителями, выбранными из группы, состоящей из гидроксильной группы,C1-6-алкилоксииминогруппы и С 7-16-аралкилоксииминогруппы; С 2-6-алкенильной группы, необязательно замещенной одним или несколькими заместителями, выбранными из группы, состоящей из С 6-10-арильной группы,цианогруппы,C1-6-алкилоксикарбонильной группы и карбоксигруппы; С 2-6-алкинильной группы, необязательно замещенной одним или несколькими заместителями, выбранными из группы, состоящей из-3 010835 С 6-10-арильной группы и три (C1-6-алкил) силильной группы; галогенированной C1-6-алкильной группы; С 6-10-арильной группы, необязательно замещенной одним или несколькими заместителями, выбранными из группы, состоящей из атома галогена и галогенированной С 1-6-алкильной группы; С 7-16-аралкильной группы; 5-9-членной гетероарильной группы, которая включает по меньшей мере один из трех видов гетероатомов, входящих в кольцо, выбранных из атома кислорода, атома азота и атома серы, необязательно замещенной одной или несколькими C1-6-алкильными группами;C1-6-алкилкарбонильной группы; 6-членной неароматической гетероциклической карбонильной группы, которая включает по меньшей мере один из трех видов гетероатомов, входящих в кольцо, выбранных из атома кислорода, атома азота и атома серы, необязательно замещенной одной или несколькими С 7-16-аралкильными группами; 5-членной гетероарилсульфонильной группы, которая включает по меньшей мере один из трех видов гетероатомов, входящих в кольцо, выбранных из атома кислорода, атома азота и атома серы; карбоксигруппы;C1-6-алкилоксикарбонильной группы; карбамоильной группы, необязательно замещенной одним или несколькими заместителями, выбранными из группы, состоящей из С 6-10-арильной группы, необязательно замещенной одной или несколькими галогенированнымиC1-6-алкильной группы; сульфамоильной группы, необязательно замещенной одним или несколькими заместителями, выбранными из группы, состоящей из С 6-10-арильной группы, необязательно замещенной одной или несколькими галогенированнымиC1-6-алкильной группы; аминогруппы, необязательно замещенной одним или несколькими заместителями, выбранными из группы, состоящей из C1-6-алкильной группы,C1-6-алкилкарбонильной группы,С 6-10-арилкарбонильной группы,C1-6-алкилсульфонильной группы и С 6-10-арилсульфонильной группы; уреидогруппы, необязательно замещенной одной или несколькими С 6-10-арильными группами; тиоуреидогруппы, необязательно замещенной одной или несколькими С 6-10-арильными группами; диазенильной группы, необязательно замещенной одной или несколькими С 6-10-арильными группами, где указанные арильные группы необязательно замещены одним или несколькими заместителями,выбранными из группы, состоящей из нитрогруппы, и 6-членной гетероарилсульфамоильной группы и гидроксильной группы. 3. Лекарственное средство по п.2, где А обозначает атом водорода,Е обозначает 2,5-дизамещенную фенильную группу, где по меньшей мере один из указанных заместителей обозначает трифторметильную группу, а другой заместитель выбран из группы, состоящей из атома галогена; нитрогруппы; C1-6-алкильной группы; галогенированной C1-6-алкильной группы; C1-6-алкоксигруппы; галогенированной C1-6-алкоксигруппы;C1-6-алкилсульфанильной группы; 5-6-членной неароматической гетероциклической группы,которая включает по меньшей мере один из трех видов гетероатомов, входящих в кольцо, выбранных из атома кислорода, атома азота и атома серы, необязательно замещенной одной или несколькими галогенированными C1-6-алкильными группами; и С 6-10-арилоксигруппы, необязательно замещенной одним или несколькими заместителями, выбранными из группы, состоящей из атома галогена,цианогруппы,C1-6-алкильной группы иC1-6-алкоксигруппы,а следующая часть формулы (Iz-1) в общей формуле, содержащей кольцо Z представлена следующей формулой (Iz-2):C1-8-алкильную группу, необязательно замещенную одним или несколькими заместителями, выбранными из группы, состоящей из гидроксильной группы,C1-6-алкилоксииминогруппы и С 7-16-аралкилоксииминогруппы; С 2-6-алкенильную группу, необязательно замещенную одним или несколькими заместителями, выбранными из группы, состоящей из С 6-10-арильной группы,цианогруппы,C1-6-алкилоксикарбонильной группы и карбоксигруппы; С 2-6-алкинильную группу, необязательно замещенную одним или несколькими заместителями, выбранными из группы, состоящей из С 6-10-арильной группы и три (C1-6-алкил) силильной группы; галогенированную С 1-6-алкильную группу; С 6-10-арильную группу, необязательно замещенную одним или несколькими заместителями, выбранными из группы, состоящей из атома галогена и галогенированной C1-6-алкильной группы; С 7-16-аралкильную группу; 5-9-членную гетероарильную группу, которая включает по меньшей мере один из трех видов гетероатомов, входящих в кольцо, выбранных из атома кислорода, атома азота и атома серы, необязательно замещенную одной или несколькими C1-6-алкильными группами;C1-6-алкилкарбонильную группу; 6-членную неароматическую гетероциклическую карбонильную группу, которая включает по меньшей мере один из трех видов гетероатомов, входящих в кольцо, выбранных из атома кислорода,атома азота и атома серы, необязательно замещенную одной или несколькими С 7-16-аралкильными группами; 5-членную гетероарилсульфонильную группу, которая включает по меньшей мере один из трех видов гетероатомов, входящих в кольцо, выбранных из атома кислорода, атома азота и атома серы; карбоксигруппу;C1-6-алкилоксикарбонильную группу; карбамоильную группу, необязательно замещенную одним или несколькими заместителями, выбранными из группы, состоящей из С 6-10-арильной группы, необязательно замещенной одной или несколькими галогенированнымиC1-6-алкильными группами, и C1-6-алкильной группы; сульфамоильную группу, необязательно замещенную одним или несколькими заместителями, выбранными из группы, состоящей из С 6-10-арильной группы, необязательно замещенной одной или несколькими галогенированнымиC1-6-алкильной группы; аминогруппу, необязательно замещенную одним или несколькими заместителями, выбранными из группы, состоящей изC1-6-алкилсульфонильной группы и С 6-10-арилсульфонильной группы; уреидогруппу, необязательно замещенную одной или несколькими С 6-10-арильными группами; тиоуреидогруппу, необязательно замещенную одной или несколькими С 6-10-арильными группами; диазенильную группу, необязательно замещенную одной или несколькими С 6-10-арильными группами, где указанные арильные группы являются необязательно замещенными одним или несколькими заместителями, выбранными из группы, состоящей из нитрогруппы и 6-членной гетероарилсульфамоильной группы. 4. Лекарственное средство по п.3, где R2 обозначает атом галогена,Е обозначает группу, выбранную из следующей группы заместителей -2 е [Группа заместителей 2 е]: 2-хлор-5-(трифторметил)фенильная группа,2,5-бис(трифторметил)фенильная группа,2-фтор-5-(трифторметил)фенильная группа,2-нитро-5-(трифторметил)фенильная группа,2-метил-5-(трифторметил)фенильная группа,2-метокси-5-(трифторметил)фенильная группа,2-метилсульфанил-5-(трифторметил)фенильная группа,2-(1-пирролидинил)-5-(трифторметил)фенильная группа,2-морфолино-5-(трифторметил)фенильная группа,2-бром-5-(трифторметил)фенильная группа,2-(2-нафтилокси)-5-(трифторметил)фенильная группа,2-(2,4-дихлорфенокси)-5-(трифторметил)фенильная группа,2-[4-(трифторметил)пиперидин-1-ил]-5-(трифторметил)фенильная группа,2-(2,2,2-трифторэтокси)-5-(трифторметил)фенильная группа,2-(2-метоксифенокси)-5-(трифторметил)фенильная группа,2-(4-хлор-3,5-диметилфенокси)-5-(трифторметил)фенильная группа,2-пиперидино-5-(трифторметил)фенильная группа,2-(4-метилфенокси)-5-(трифторметил)фенильная группа,2-(4-хлорфенокси)-5-(трифторметил)фенильная группа,2-(4-цианофенокси)-5-(трифторметил)фенильная группа и 2-(4-метоксифенокси)-5-(трифторметил)фенильная группа. 5. Лекарственное средство по п.4, где Rz обозначает атом галогена,Е обозначает 2,5-бис(трифторметил)фенильную группу. 6. Лекарственное средство по п.5, где Rz обозначает атом брома,Е обозначает 2,5-бис(трифторметил)фенильную группу. 7. Лекарственное средство по любому из пп.2-3, где Е обозначает 2,5-бис(трифторметил)фенильную группу. 8. Лекарственное средство по п.1, где А обозначает атом водорода или ацетильную группу,Е обозначает 3,5-дизамещенную фенильную группу, где по меньшей мере один из указанных заместителей обозначает трифторметильную группу, а другой заместитель выбран из группы, состоящей из атома галогена; нитрогруппы;C1-6-алкилоксикарбонильной группы; карбоксигруппы; 5-6-членной неароматической гетероциклической группы,которая включает по меньшей мере один из трех видов гетероатомов, входящих в кольцо, выбранных из атома кислорода, атома азота и атома серы, необязательно замещенной одним или несколькими галогенированными C1-6-алкильными группами; и С 6-10-арилоксигруппы, необязательно замещенной одним или несколькими заместителями, выбранными из группы, состоящей из атома галогена, цианогруппы, C1-6-алкильной группы и C1-6-алкоксигруппы,кольцо Z обозначает бензольное кольцо, необязательно замещенное одним или несколькими заместителями, выбранными из группы, состоящей изC1-8-алкильной группы, необязательно замещенной одним или несколькими заместителями, выбранными из группы, состоящей из гидроксильной группы,C1-6-алкилоксииминогруппы и С 7-16-аралкилоксииминогруппы; С 2-6-алкенильной группы, необязательно замещенной одним или несколькими заместителями, выбранными из группы, состоящей из С 6-10-арильной группы,цианогруппы,C1-6-алкилоксикарбонильной группы и карбоксигруппы; С 2-6-алкинильной группы, необязательно замещенной одним или несколькими заместителями, выбранными из группы, состоящей из С 6-10-арильной группы и три (C1-6-алкил)силильной группы; галогенированной C1-6-алкильной группы; С 6-10-арильной группы, необязательно замещенной одним или несколькими заместителями, выбранными из группы, состоящей из атома галогена и галогенированной C1-6-алкильной группы; С 7-16-аралкильной группы; 5-9-членной гетероарильной группы, которая включает по меньшей мере один из трех видов гетероатомов, входящих в кольцо, выбранных из атома кислорода, атома азота и атома серы, необязательно замещенной одной или несколькими C1-6-алкильными группами;C1-6-алкилкарбонильной группы; 6-членной неароматической гетероциклической карбонильной группы, которая включает по меньшей мере один из трех видов гетероатомов, входящих в кольцо, выбранных из атома кислорода, атома азота и атома серы, необязательно замещенной одной или несколькими С 7-16-аралкильными группами; 5-членной гетероарилсульфонильной группы, которая включает по меньшей мере один из трех видов гетероатомов, входящих в кольцо, выбранных из атома кислорода, атома азота и атома серы; карбоксигруппы;C1-6-алкилоксикарбонильной группы; карбамоильной группы, необязательно замещенной одним или несколькими заместителями, выбранными из группы, состоящей из С 6-10-арильной группы, необязательно замещенной одной или несколькими галогенированнымиC1-6-алкильными группами, и C1-6-алкильной группы; сульфамоильной группы, необязательно замещенной одним или несколькими заместителями, выбранными из группы, состоящей из С 6-10-арильной группы, необязательно замещенной одной или несколькими галогенированнымиC1-6-алкильной группы; аминогруппы, необязательно замещенной одним или несколькими заместителями, выбранными из группы, состоящей изC1-6-алкильной группы,C1-6-алкилкарбонильной группы,С 6-10-арилкарбонильной группы,C1-6-алкилсульфонильной группы и С 6-10-арилсульфонильной группы; уреидогруппы, необязательно замещенной одной или несколькими С 6-10-арильными группами; тиоуреидогруппы, необязательно замещенной одной или несколькими С 6-10-арильными группами; диазенильной группы, необязательно замещенной одной или несколькими С 6-10-арильными группами, где указанные арильные группы необязательно замещены одним или несколькими заместителями,выбранными из группы, состоящей из нитрогруппы и 6-членной гетероарилсульфамоильной группы; и гидроксильной группы. 9. Лекарственное средство по п.8, где А обозначает атом водорода,Е обозначает 3,5-дизамещенную фенильную группу, где по меньшей мере один из указанных заместителей обозначает трифторметильную группу, а другой заместитель выбран из группы, состоящей изC1-6-алкилоксикарбонильной группы и карбоксигруппы; следующая часть формулы (Iz-1) в общей формуле, содержащей кольцо Z представлена следующей формулой (Iz-2):C1-8-алкильную группу, необязательно замещенную одним или несколькими заместителями, выбранными из группы, состоящей из гидроксильной группы,C1-6-алкилоксииминогруппы и С 7-16-аралкилоксииминогруппы; С 2-6-алкенильную группу, необязательно замещенную одним или несколькими заместителями, выбранными из группы, состоящей из С 6-10-арильной группы,цианогруппы,C1-6-алкилоксикарбонильной группы и карбоксигруппы; С 2-10-алкинильную группу, необязательно замещенную одним или несколькими заместителями, выбранными из группы, состоящей из С 6-10-арильной группы и три(C1-6-алкил)силильной группы; галогенированную C1-6-алкильную группу; С 6-10-арильную группу, необязательно замещенную одним или несколькими заместителями, выбранными из группы, состоящей из атома галогена и галогенированной C1-6-алкильной группы; С 7-16-аралкильную группу; 5-9-членную гетероарильную группу, которая включает по меньшей мере один из трех видов гетероатомов, входящих в кольцо, выбранных из атома кислорода, атома азота и атома серы, необязательно замещенную одной или несколькими C1-6-алкильными группами; C1-6-алкилкарбонильную группу; 6-членную неароматическую гетероциклическую карбонильную группу, которая включает по меньшей мере один из трех видов гетероатомов, входящих в кольцо, выбранных из атома кислорода,атома азота и атома серы, необязательно замещенную одной или несколькими С 7-16-аралкильными группами; 5-членную гетероарилсульфонильную группу которая включает по меньшей мере один из трех видов гетероатомов, входящих в кольцо, выбранных из атома кислорода, атома азота и атома серы; карбоксигруппу;C1-6-алкилоксикарбонильную группу; карбамоильную группу, необязательно замещенную одним или несколькими заместителями, выбранными из группы, состоящей из С 6-10-арильной группы, необязательно замещенной одной или несколькими галогенированнымиC1-6-алкильными группами, и C1-6-алкильной группы; сульфамоильную группу, необязательно замещенную одним или несколькими заместителями, выбранными из группы, состоящей из С 6-10-арильной группы, необязательно замещенной одной или несколькими галогенированнымиC1-6-алкильной группы; аминогруппу, необязательно замещенную одним или несколькими заместителями, выбранными из группы, состоящей из C1-6-алкильной группы,C1-6-алкилкарбонильной группы,-8 010835 С 6-10-арилкарбонильной группы,C1-6-алкилсульфонильной группы и С 6-10-арилсульфонильной группы; уреидогруппу, необязательно замещенную одной или несколькими С 6-10-арильными группами; тиоуреидогруппу, необязательно замещенную одной или несколькими С 6-10-арильными группами; или диазенильную группу, необязательно замещенную одной или несколькими С 6-10-арильными группами, где указанные арильные группы необязательно замещены одним или несколькими заместителями,выбранными из группы, состоящей из нитрогруппы и 6-членной гетероарилсульфамоильной группы. 10. Лекарственное средство по п.9, где Rz обозначает атом галогена,Е обозначает группу, выбранную из следующей группы заместителей -4 е [Группа Заместителей 4 е]: 3,5-бис(трифторметил)фенильная группа, 3-фтор-5-(трифторметил)фенильная группа, 3-бром-5(трифторметил)фенильная группа, 3-метокси-5-(трифторметил)фенильная группа, 3-метоксикарбонил-5(трифторметил)фенильная группа и 3-карбокси-5-(трифторметил)фенильная группа. 11. Лекарственное средство по п.10, где Rz обозначает атом галогена,Е обозначает 3,5-бис(трифторметил)фенильную группу. 12. Лекарственное средство по п.11, где Rz обозначает атом хлора,Е обозначает 3,5-бис(трифторметил)фенильную группу. 13. Лекарственное средство по любому из пп.8-10, где Е обозначает 3,5-бис(трифторметил)фенильную группу. 14. Лекарственное средство по п.1, где А обозначает атом водорода или ацетильную группу,Е обозначает монозамещенную тиазол-2-ильную группу или дизамещенную тиазол-2-ильную группу, где указанные заместители выбраны из группы, состоящей из атома галогена; цианогруппы;C1-6-алкильной группы, необязательно замещенной одним или несколькими заместителями, выбранными из группы, состоящей из карбоксигруппы иC1-6-алкилоксикарбонильной группы; галогенированной С 1-6-алкильной группы; С 6-10-арильной группы, необязательно замещенной одним или несколькими заместителями, выбранными из группы, состоящей из атома галогена и галогенированной C1-6-алкильной группы;C1-6-алкилоксикарбонильной группы; 6-членной неароматической гетероциклической группы, которая включает по меньшей мере один из трех видов гетероатомов, входящих в кольцо, выбранных из атома кислорода, атома азота и атома серы, необязательно замещенной одним или несколькими заместителями, выбранными из группы, состоящей изC1-6-алкильной группы и С 6-10-арильной группы; С 7-16-аралкильной группы; карбамоильной группы, необязательно замещенной одним или несколькими заместителями, выбранными из группы, состоящей изC1-6-алкильной группы и С 7-16-аралкильной группы; и карбоксигруппы,кольцо Z обозначает бензольное кольцо, необязательно замещенное одним или несколькими заместителями, выбранными из группы, состоящей из атома галогена; нитрогруппы; цианогруппы;C1-8-алкильной группы, необязательно замещенной одним или несколькими заместителями, выбранными из группы, состоящей из гидроксильной группы,C1-6-алкилоксииминогруппы и С 7-16-аралкилоксииминогруппы; С 2-6-алкенильной группы, необязательно замещенной одним или несколькими заместителями, выбранными из группы, состоящей из С 6-10-арильной группы,цианогруппы,C1-6-алкилоксикарбонильной группы и карбоксигруппы;-9 010835 С 2-6-алкинильной группы, необязательно замещенной одним или несколькими заместителями, выбранными из группы, состоящей из С 6-10-арильной группы и три(C1-6-алкил)силильной группы; галогенированной C1-6-алкильной группы; С 6-10-арильной группы, необязательно замещенной одним или несколькими заместителями, выбранными из группы, состоящей из атома галогена и галогенированной C1-6-алкильной группы; С 7-16-аралкильной группы; 5-9-членной гетероарильной группы, которая включает по меньшей мере один из трех видов гетероатомов, входящих в кольцо, выбранных из атома кислорода, атома азота и атома серы, необязательно замещенной одной или несколькими С 1-6-алкильными группами; C1-6-алкилкарбонильной группы; 6-членной неароматической гетероциклической карбонильной группы, которая включает по меньшей мере один из трех видов гетероатомов, входящих в кольцо, выбранных из атома кислорода, атома азота и атома серы, необязательно замещенной одной или несколькими С 7-16-аралкильными группами; 5-членной гетероарилсульфонильной группы, которая включает по меньшей мере один из трех видов гетероатомов, входящих в кольцо, выбранных из атома кислорода, атома азота и атома серы; карбоксигруппы;C1-6-алкилоксикарбонильной группы; карбамоильной группы, необязательно замещенной одним или несколькими заместителями, выбранными из группы, состоящей из С 6-10-арильной группы, необязательно замещенной одной или несколькими галогенированными C16-алкильными группами, иC1-6-алкильной группы; сульфамоильной группы, необязательно замещенной одним или несколькими заместителями, выбранными из группы, состоящей из С 6-10-арильной группы, необязательно замещенной одной или несколькими галогенированными C1-6-алкильными группами, иC1-6-алкильной группы; аминогруппы, необязательно замещенной одним или несколькими заместителями, выбранными из группы, состоящей изC1-6-алкильной группы,C1-6-алкилкарбонильной группы,С 6-10-арилкарбонильной группы,C1-6-алкилсульфонильной группы и С 6-10-арилсульфонильной группы; уреидогруппы, необязательно замещенной одной или несколькими С 6-10-арильными группами; тиоуреидогруппы, необязательно замещенной одной или несколькими С 6-10-арильными группами; диазенильной группы, необязательно замещенной одной или несколькими С 6-10-арильными группами, где указанные арильные группы необязательно замещены одним или несколькими заместителями,выбранными из группы, состоящей из нитрогруппы и 6-членной гетероарилсульфамоильной группы; и гидроксильной группы. 15. Лекарственное средство по п.14, где А обозначает атом водорода,Е обозначает монозамещенную тиазол-2-ильную группу или дизамещенную тиазол-2-ильную группу, где указанные заместители выбраны из группы, состоящей из атома галогена; цианогруппы;C1-6-алкильной группы, необязательно замещенной одним или несколькими заместителями, выбранными из группы, состоящей из карбоксигруппы и C1-6-алкилоксикарбонильной группы; галогенированной C1-6-алкильной группы; С 6-10-арильной группы, необязательно замещенной одним или несколькими заместителями, выбранными из группы, состоящей из атома галогена и галогенированной C1-6-алкильной группы;C1-6-арилоксикарбонильной группы; 6-членной неароматической гетероциклической группы,которая включает по меньшей мере один из трех видов гетероатомов, входящих в кольцо, выбранных из атома кислорода, атома азота и атома серы, необязательно замещенной одним или несколькими заместителями, выбранными из группы, состоящей из- 10010835 карбамоильной группы, необязательно замещенной одним или несколькими заместителями, выбранными из группы, состоящей изC1-6-алкильной группы и С 7-16-аралкильной группы; и карбоксигруппы,а следующая часть формулы (Iz-1) в общей формуле, содержащей кольцо Z представлена следующей формулой (Iz-2):C1-8-алкильную группу, необязательно замещенную одним или несколькими заместителями, выбранными из группы, состоящей из гидроксильной группы,C1-6-алкилоксииминогруппы и С 7-16-аралкилоксииминогруппы; С 2-6-алкенильную группу, необязательно замещенную одним или несколькими заместителями, выбранными из группы, состоящей из С 6-10-арильной группы,цианогруппы,C1-6-алкилоксикарбонильной группы и карбоксигруппы; С 2-6-алкинильную группу, необязательно замещенную одним или несколькими заместителями, выбранными из группы, состоящей из С 6-10-арильной группы и три (C1-6-алкил) силильной группы; галогенированную C1-6-алкильную группу; С 6-10-арильную группу, необязательно замещенную одним или несколькими заместителями, выбранными из группы, состоящей из атома галогена и галогенированной C1-6-алкильной группы; С 7-16-аралкильную группу; 5-9-членную гетероарильную группу, которая включает по меньшей мере один из трех видов гетероатомов, входящих в кольцо, выбранных из атома кислорода, атома азота и атома серы, необязательно замещенную одной или несколькими C1-6-алкильными группами;C1-6-алкилкарбонильную группу; 6-членную неароматическую гетероциклическую карбонильную группу, которая включает по меньшей мере один из трех видов гетероатомов, входящих в кольцо, выбранных из атома кислорода,атома азота и атома серы, необязательно замещенную одной или несколькими С 7-16-аралкильными группами; 5-членную гетероарилсульфонильную группу, которая включает по меньшей мере один из трех видов гетероатомов, входящих в кольцо, выбранных из атома кислорода, атома азота и атома серы; карбоксигруппу; С 1-6-алкилоксикарбонильную группу; карбамоильную группу, необязательно замещенную одним или несколькими заместителями, выбранными из группы, состоящей из С 6-10-арильной группы, необязательно замещенной одной или несколькими галогенированными C1-алкильными группами, и 6C1-6-алкильной группы; сульфамоильную группу, необязательно замещенную одним или несколькими заместителями, выбранными из группы, состоящей из С 6-10-арильной группы, необязательно замещенной одной или несколькими галогенированными C1-6-алкильными группами, иC1-6-алкильной группы; аминогруппу, необязательно замещенную одним или несколькими заместителями, выбранными из группы, состоящей из C1-6-алкильной группы, C1-6-алкилкарбонильной группы, С 6-10-арилкарбонильной группы, C1-6-алкилсульфонильной группы и С 6-10-арилсульфонильной группы; уреидогруппу, необязательно замещенную одной или несколькими С 6-10-арильными группами; тиоуреидогруппу, необязательно замещенную одной или несколькими С 6-10-арильными группами; или диазенильную группу, необязательно замещенную одной или несколькими С 6-10-арильными группами, где указанные арильные группы необязательно замещены одним или несколькими заместителями,выбранными из группы, состоящей из нитрогруппы и 6-членной гетероарилсульфамоильной группы. 16. Лекарственное средство по п.15, где Rz обозначает атом галогена,Е обозначает группу, выбранную из следующей группы заместителей -5 е и группы заместителей[Группа заместителей -6 е]: 4-[(1,1-диметил)этил]тиазол-2-ильная группа,4-фенилтиазол-2-ильная группа,4-[(3,5-бис(трифторметил)фенил]тиазол-2-ильная группа,4-(2,4-дихлорфенил)тиазол-2-ильная группа,4-(3,4-дихлорфенил)тиазол-2-ильная группа,4-[4-(трифторметил)фенил]тиазол-2-ильная группа,4-(2,5-дифторфенил)тиазол-2-ильная группа,4-(4-метоксифенил)тиазол-2-ильная группа,4-[3-(трифторметил)фенил]тиазол-2-ильная группа и 4-(пентафторфенил)тиазол-2-ильная группа. 17. Лекарственное средство по п.16, где Rz обозначает атом галогена,- 12010835 Е обозначает 4-[(1,1-диметил)этил]-5-[(2,2-диметил)пропионил]тиазол-2-ильную группу. Кроме того, изобретение касается применения соединения, представленного формулой (I) как определено в любом из пп.1-17, для приготовления лекарственного средства для предупреждения и/или лечения рака, предпочтительно соединения как определено в п.6, еще более предпочтительно соединения как определено в п.12. Следующим аспектом изобретения является лекарственное средство для ингибирования пролиферации раковых клеток включающее в качестве активного ингредиента соединение по любому из пп.1-17. Изобретение касается также применения соединения, представленного формулой (I) как определено в любом из пп.1-17 для приготовления лекарственного средства для ингибирования пролиферации раковых клеток. Соединения, представленные общей формулой (1), могут быть получены, например, методами,описанными в нижеследующей реакционной схеме. Реакционная схема где каждый из А, кольца Z и Е имеет значения, определенные для общей формулы (I), А 101 представляет собой атом водорода или защитные группы для гидроксигруппы (предпочтительно, алкильную группу,такую как метильная группа и т.п.; аралкильную группу, такую как бензильная группа и т.п.; ацетильную группу, алкоксиалкильную группу, такую как метоксиметильная группа и т.п.; замещенную силильную группу, такую как триметилсилильная группа или т.п.), каждый из R и R101 представляет собой атом водорода, C1-С 6 алкильную группу или т.п., Е 101 представляет собой Е или предшественник Е в определении общей формулы (I), G представляет собой гидроксигруппу, атомы галогена (предпочтительно, атом хлора), углеводород-оксигруппу (предпочтительно, арилоксигруппу, которая может быть замещена атомом галогена), ацилоксигруппу, имидооксигруппу или т.п.(Первая стадия) Амид (3) может быть получен путем дегидроконденсации производного карбоновой кислоты (1) и амина (2). Эту реакцию осуществляют при температуре от 0 до 180 С, в отсутствии растворителя или в апротонном растворителе, в присутствии агента, галогенирующего кислоту, или дегидроконденсирующего агента, и в присутствии или в отсутствии основания. Примерами галогенирующего агента являются тионилхлорид, тионилбромид, сульфурилхлорид,оксихлорид фосфора, трихлорид фосфора, пентахлорид фосфора или т.п. Если А 101 представляет собой атом водорода, то предпочтительным является трихлорид фосфора, а если А 101 представляет собой ацетильную группу и т.п., то предпочтительным является оксихлорид фосфора. Примерами дегидроконденсирующего агента являются N,N'-дициклогексилкарбодиимид, гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида, дифенилфосфорилазид или т.п. Примерами оснований являются неорганические основания, такие как карбонат натрия, карбонат калия, бикарбонат натрия или т.п., или органические основания, такие как пиридин, триэтиламин, N,N'-диэтиланилин или т.п. Примерами апротонных растворителей являются дихлорметан, дихлорэтан, хлороформ, тетрагидрофуран, 1,4-диоксан, бензол,толуол, монохлорбензол, о-дихлорбензол, N,N'-диметилформамид, N-метилпирролидон или т.п., причем,если реакцию осуществляют в присутствии агента, галогенирующего кислоту, то особенно предпочтительными являются толуол, монохлорбензол, о-дихлорбензол. Нужное соединение может быть также получено, например, методом, описанным в Journal of Medicinal Chemistry (USA), 1998, Vol.41, 16, p.2939-2945 или аналогичным методом, где из карбоновой кислоты получают хлорангидрид, а затем его подвергают реакции с амином, имеющим Е 101. Если G представляет собой гидроксигруппу, то в качестве предпочтительных реакционных условий могут быть использованы реакционные условия, описанные в Archiv der Pharmazie (Germany), 1998, Vol. 331,1, p.3-6. Типы производных карбоновой кислоты (1) и амина (2) не имеют конкретных ограничений, и в вышеуказанной реакции могут быть использованы новые соединения, синтезированные хорошо известным методом, описанным в литературе, или коммерчески доступные реагенты.(Вторая стадия) Если амид (3) имеет защитную группу и/или предпочтительный заместитель для модификации функциональной группы, например аминогруппы и защищенной аминогруппы или ее предшественника; карбоксигруппы и защищенной карбоксигруппы или ее предшественника; гидроксигруппы и защищенной гидроксигруппы, или ее предшественника, то нужное целевое соединение (4) может быть получено путем снятия защиты и/или модификации функциональной группы на данной стадии. Для проведения- 13010835 реакции могут быть использованы различные хорошо известные методы. Для реакции снятия защиты и модификации функциональной группы могут быть использованы, например, методы, описанные в "Protective Groups in Organic Synthesis" (USA), Theodora W. Green, Peter G.M. Wuts, Eds., Third edition, Apr. in 1999, John WileySons and "Handbook of Reagents for Organic Synthesis" (USA), 4 Volumes, Jun. in 1999,John WileySons, а для реакции модификации функциональной группы могут быть использованы, например, методы, описанные в работе "Palladium Reagents in Organic Synthesis" (USA), Richard F. Heck,1985, Academic Press and "Palladium Reagents and Catalysts: Innovations in Organic Synthesis" (USA),J.Tsuji, 1999, John WileySons, или т.п. Соединения, представленные общей формулой (I) и полученные вышеупомянутыми методами, могут быть выделены и очищены методами, хорошо известными специалистам, такими как, например, экстракция, осаждение, фракционированная хроматография, фракционированная кристаллизация, суспендирование, промывка и перекристаллизация. Кроме того, каждая из фармацевтически приемлемых солей соединения настоящего изобретения, его гидрат и сольват могут быть получены методами, хорошо известными специалистам. В примерах, представленных в настоящей заявке, подробно описаны методы получения типичных соединения общей формулы (I). Поэтому, каждый специалист может получить любое соединение общей формулы (I) в соответствии с описанием вышеупомянутых общих методов получения соединений и конкретных методов получения соединения, описанных в примерах, путем выбора соответствующих реакционноспособных исходных материалов, реакционноспособных реагентов и реакционных условий, и путем внесения в эти методы, если это необходимо, соответствующих модификаций и изменений. Соединения, представленные общей формулой (I), обладают противораковым действием, а поэтому, лекарственное средство, содержащее указанные соединения в качестве активного ингредиента, может быть использовано для профилактического и/или терапевтического лечения рака. В описании настоящего изобретения, термин "предупреждение и/или лечение рака" или его синонимы должны интерпретироваться в более широком смысле как ингибирующее действие на раковую трансформацию ткани или клеток, ингибирующее действие на метастазирование рака, увеличение срока действия противораковых средств, действие, направленное на подавление толерантности к присутствующему лекарственному противораковому средству, действие направленное на снижение кахексии при раке, профилактическое действие, направленное на предупреждение рецидивов, действие, способствующее увеличению продолжительности жизни пациентов, страдающих раком или т.п., а также действие, направленное на уничтожение раковых клеток или ингибирование прогрессирования рака, и эти термины не должны интерпретироваться в ограниченном смысле. Лекарственное средство настоящего изобретения может быть использовано для профилактического и/или терапевтического лечения рака кожи, меланомы, рака почек,рака легких, рака печени, рака молочной железы, рака матки, рака поджелудочной железы и других солидных раковых опухолей, саркомы, остеосаркомы, метастатической инвазии при раке, малигнизации участков воспаления, кахексии при раке, метастазов рака, лейкоза, такого как острый миелоидный лейкоз, множественной миеломы, лимфомы Леннерта, злокачественной лимфомы, развития резистентности раковых опухолей к канцеростатическим препаратам, малигнизация патологических очагов, пораженных гепатитом и циррозом, малигнизации полипов толстой кишки, опухоли головного мозга, опухоли нервной ткани, саркоидоза или т.п. Однако заболевания, которые могут быть подвергнуты лечению лекарственными средствами настоящего изобретения, не ограничиваются вышеперечисленными раковыми заболеваниями. В качестве активного ингредиента лекарственного средства настоящего изобретения могут быть использованы вещества одного или нескольких видов, выбранных из группы, состоящей из соединения,представленного общей формулой (I), его фармакологически приемлемых солей, гидратов и сольватов. Вышеупомянутое вещество, per se, может быть введено в виде лекарственного средства настоящего изобретения, однако, предпочтительно, чтобы лекарственное средство настоящего изобретения было введено в форме фармацевтической композиции, содержащей вышеупомянутое вещество в качестве активного ингредиента в сочетании с одним или несколькими фармакологически приемлемыми фармацевтическими добавками. В вышеупомянутых фармацевтических композициях содержание активного ингредиента по отношению к фармацевтическим добавкам составляет от 1 до 90 мас.%. Фармацевтические композиции настоящего изобретения могут быть введены в форме фармацевтических композиций для перорального введения, например, в виде гранул, измельченных гранул, порошков, жестких капсул, мягких капсул, сиропа, эмульсии, суспензии или раствора, либо они могут быть введены в виде фармацевтических композиций для парентерального введения, например, в виде инъекций для внутривенного введения, внутримышечного введения или подкожного введения, а также в форме капельного вливания, суппозиториев, подкожного абсорбента, препаратов для абсорбции через слизистую оболочку, капель в нос, ушных капель, глазных капель и ингаляторов. Препараты, изготовленные в форме фармацевтических композиций в виде порошков, могут быть, при необходимости, растворены и использованы в качестве инъекций или капельного вливания. Для получения фармацевтических композиций могут быть использованы твердые или жидкие фармацевтические добавки. Фармацевтическими добавками могут быть органические или неорганические- 14010835 вещества. Если необходимо приготовить твердый пероральный препарат, то для получения препаратов в форме таблеток, таблеток с покрытием, гранул, порошков, капсул и т.п. стандартными методами, к активному ингредиенту добавляют наполнитель, а также связующие агенты, дезинтегратор, смазывающий агент, краситель, корректирующие агенты. Примерами наполнителей являются лактоза, сахароза, глюкоза, кукурузный крахмал, крахмал, тальк, сорбит, кристаллическая целлюлоза, декстрин, каолин, карбонат кальция и диоксид кремния. Примерами связующих агентов являются поливиниловый спирт, поливиниловый эфир, этилцеллюлоза, метилцеллюлоза, аравийская камедь, камедь трагаканта, желатин, шеллак,гидроксипропилцеллюлоза, гидроксипропилметилцеллюлоза, цитрат кальция, декстрин и пектин. Примерами смазывающего агента являются стеарат магния, тальк, полиэтиленгликоль, двуокись кремния и гидрогенизированное растительное масло. В качестве красителя может быть использован любой агент,разрешенный для применения при изготовлении стандартных фармацевтических средств. В качестве корректирующих агентов могут быть использованы какао-порошок, ментол, ароматическая кислота,масло перечной мяты, d-борнеол, коричный порошок и т.п. Эти таблетки и гранулы могут иметь сахарное покрытие, желатиновое покрытие или другое подходящее покрытие, если это необходимо. При необходимости могут быть добавлены консерванты, антиоксидант и т.п. В жидких препаратах для перорального введения, таких как эмульсии, сиропы, суспензии и растворы, могут быть использованы стандартные неактивные разбавители, например, вода или растительное масло. В эти препараты, помимо неактивных разбавителей, могут быть добавлены адъюванты, такие как смачивающие агенты, суспендирующие добавки, подсластители, ароматизаторы, красители или консерванты. После получения жидкого препарата этот препарат может быть введен в капсулы, изготовленные из абсорбируемого вещества, такого как желатин. Примерами растворителей или суспендирующих агентов, используемых в препаратах для парентерального введения, таких как инъекции или суппозитории,являются, вода, пропиленгликоль, полиэтиленгликоль, бензиловый спирт, этилолеат и лецитин. Примерами материалов для основы, используемых в суппозиториях, являются масло какао, эмульгируемое масло какао, лауриловое масло и витепсол (witepsol). Методы получения вышеупомянутых препаратов не имеют конкретных ограничений, и в этих целях могут быть использованы любые методы, известные специалистам. Если данную композицию получают в форме инъекций, то могут быть использованы носители, такие как, например, разбавители, включая воду, этанол, макрогель, пропиленгликоль, лимонная кислота,уксусная кислота, фосфорная кислота, молочная кислота, лактат натрия, серная кислота и гидроксид натрия; модификаторы рН и буферные растворы, включая цитрат натрия, ацетат натрия и фосфат натрия; стабилизаторы, такие как пиросульфит натрия, этилендиаминтетрауксусная кислота, тиогликолевая кислота и тиолактат. При изготовлении данного препарата, в целях придания ему изотоничности, может быть добавлено достаточное количество соли, глюкозы или глицерина, и, кроме того, могут быть использованы стандартный солюбилизатор и седативное средство или местный анестетик. В препарат в форме мази, такой как паста, крем и гель, могут быть добавлены, если это необходимо,материалы, обычно используемые в качестве основы, стабилизатор, смачивающий агент и консервант, и такой препарат может быть получен путем смешивания компонентов стандартным методом. В качестве материала для основы могут быть использованы, например, белое вазелиновое масло, полиэтилен, парафин, глицерин, производное целлюлозы, полиэтиленгликоль, силикон и бентонит. В качестве консерванта могут быть использованы параоксиметилбензоат, параоксиэтилбензоат, параоксипропилбензоат и т.п. При изготовлении препарата в форме пластыря на поверхность подложки стандартным методом могут быть нанесены вышеупомянутые мазь, крем, гель или паста и т.п В качестве подложки предпочтительно использовать хлопчатобумажную ткань, штапельное волокно и синтетическое волокно или нетканый материал, а также пленку или пенопласт, изготовленный из мягкого винилхлорида и полиуретана и т.п. Доза лекарственного средства настоящего изобретения не имеет конкретных ограничений. В основном для перорального введения доза для взрослого человека может составлять от 0,01 до 5000 мг массы соединения настоящего изобретения в день. Может оказаться предпочтительным увеличить или снизить вышеуказанную дозу в зависимости от возраста, патологического состояния и симптомов пациента. Вышеуказанная доза может быть введена один раз в день или 2-3 раза в день в виде дробных доз через соответствующие интервалы, либо она может быть введена периодически через несколько дней. Если данное лекарственное средство используется в виде инъекции, то доза соединения настоящего изобретения для взрослого человека может составлять от 0,001 до 100 мг массы соединения настоящего изобретения в день. Примеры Настоящее изобретение будет более подробно проиллюстрировано на нижеследующих примерах. Однако объем настоящего изобретения не ограничивается этими примерами. Номер соединений в нижеследующих примерах соответствует номеру, указанному в таблице. В этих примерах также представлены коммерчески доступные соединения, которые были закуплены и использованы для исследований. Для таких соединений указаны поставщики этих реагентов и кодовые номера каталога. Пример 1. Получение соединения 1. 3,5-бис(трифторметил)анилин (500 мг, 2,2 ммоль) и пиридин (0,5 мл) добавляли к раствору О- 15010835 ацетилсалицилоилхлорида (345 мг, 1,7 ммоль) в бензоле (10 мл) в атмосфере аргона и смесь перемешивали при комнатной температуре в течение 1 ч. Реакционную смесь выливали в 2 н. соляную кислоту и экстрагировали этилацетатом. После последовательной промывки этилацетатного слоя водой и насыщенным раствором соли и сушки над безводным сульфатом натрия остаток, полученный путем выпаривания растворителя при пониженном давлении, очищали колоночной хроматографией на силикагеле (нгексан:этилацетат = 3:1) и получали указанное в заголовке соединение (570 мг, 84,2%) в виде белого твердого вещества. Т.пл. 124-125 С. 1 Н-ЯМР(ДМСО-d6):2,36 (3 Н, с), 7,19 (1 Н, дд, J=8,0, 1,2 Гц), 7,39 (1 Н, тд, J=7,6, 1,2 Гц), 7,57 (1 Н,ддд, J=8,0, 7,6, 1,6 Гц), 7,65 (1 Н, с), 7,83 (1 Н, ДД, J=8,0, 1,6 Гц), 8,11 (2 Н, с), 8,31 (1 Н, с). Пример 2. Получение соединения 2. 2 н. водный гидроксид натрия (0,5 мл, 1 ммоль) добавляли к раствору 2-ацетокси-N-[3,5 бис(трифторметил)фенил]бензамида (соединение 1, 100 мг, 0,25 ммоль) в этаноле (5 мл) и смесь перемешивали при комнатной температуре в течение 1 ч. Реакционную смесь выливали в 2 н. соляную кислоту и экстрагировали этилацетатом. Затем этилацетатный слой последовательно промывали водой и насыщенным раствором соли, сушили над безводным сульфатом натрия и остаток, полученный путем выпаривания растворителя при пониженном давлении, перекристаллизовывали из смеси н-гексан/этилцетат, в результате чего получали указанное в заголовке соединение (40 мг, 45,1%) в виде белого твердого вещества. Т.пл. 179-180 С. 1H-ЯМР (ДМСО-d6):6,96-7,02 (2 Н, м), 7,45 (1 Н, ддд, J=8,0, 7,2, 1,6 Гц), 7,81 (1 Н, с), 7,87 (1 Н, дд,J=8,0, 1,6 Гц), 8,46 (2 Н, с), 10,80 (1 Н, с), 11,26 (1 Н, с). Пример 3. Получение соединения 3. Смесь 5-фторсалициловой кислоты (156 мг, 1 ммоль), 3,5-бис(трифторметил)анилина (229 мг, 1 ммоль), трихлорида фосфора (44 мкл, 0,5 ммоль) и монохлорбензола (5 мл) кипятили с обратным холодильником в течение 3 ч в атмосфере аргона. После охлаждения реакционной смеси до комнатной температуры, ее разбавляли этилацетатом (50 мл). Затем этилацетатный слой последовательно промывали водой и насыщенным раствором соли, сушили над безводным сульфатом натрия и остаток, полученный путем выпаривания при пониженном давлении, очищали колоночной хроматографией на силикагеле (нгексан:этилацетат=6:1), в результате чего получали указанное в заголовке соединение (215 мг, 58,7%) в виде белого твердого вещества. 1 Н-ЯМР(ДМСО-d6):7,04 (1 Н, ддд, J=9,0, 4,5, 1,2 Гц), 7,30-7,37 (1 Н, м), 7,66 (1 Н, ддд, J=9,0, 3,3, 1,2 Гц), 7,84 (1 Н, с), 8,46 (2 Н, с), 10,85 (1 Н, с), 11,21 (1 Н, ушир.с). Если соединения нижеследующих примеров получали способом, описанным в примере 3, то в качестве галогенирующего кислоту агента использовали трихлорид фосфора. В качестве реакционного растворителя использовали монохлорбензол, толуол или т.п. Пример 4. Получение соединения 4. С использованием 5-хлорсалициловой кислоты и 3,5-бис(трифторметил)анилина в качестве исходных соединений проводили процедуру, описанную в примере 3, в результате чего получали указанное в заголовке соединение. Выход: 85,5%. 1 Н-ЯМР (ДМСО-d6):7,05 (1 Н, д, J=8,7 Гц), 7,49 (1 Н, дд, J=8,7, 2,7 Гц), 7,85 (1 Н, с), 7,87 (1 Н, д,J=2,7 Гц), 8,45 (2 Н, с), 10,85 (1 Н, с), 11,39 (1 Н, с). Пример 5. Получение соединения 5. Ацетилхлорид (234 мг, 3,3 ммоль) добавляли к раствору N-[3,5-бис(трифторметилфенил)]-5-хлор-2 гидроксибензамида (соединение 4; 1,51 г, 3 ммоль) и пиридина (285 мг, 3,6 ммоль) в тетрагидрофуране (6 мл) при охлаждении льдом и смесь перемешивали при комнатной температуре в течение 1 ч. К остатку, полученному путем выпаривания растворителя при пониженном давлении, добавляли 2 н. соляную кислоту и смесь экстрагировали этилацетатом. Затем этилацетатный слой последовательно промывали водой и насыщенным раствором соли, сушили над безводным сульфатом магния и остаток, полученный путем выпаривания при пониженном давлении, перекристаллизовывали из смеси н-гексан/этилацетат, в результате чего получали указанное в заголовке соединение (1,06 г, 83,0%) в виде белого твердого вещества. 1H-ЯМР (ДМСО-d6):2,22 (3 Н, с), 7,35 (1 Н, д, J=9,0 Гц), 7,71 (1 Н, дд, J=8,7, 2,7 Гц), 7,85 (1 Н, с),7,88 (1 Н, д, J=2,7 Гц), 8,37 (2 Н, с), 11,05 (1 Н, ушир.с). Если соединения нижеследующих примеров получали способом, описанным в примере 5, то в качестве основания использовали органические основания, такие как пиридин, триэтиламин или т.п. В качестве реакционного растворителя использовали дихлорметан, тетрагидрофуран, бензол или т.п. Пример 6. Получение соединения 6. С использованием 5-бромсалициловой кислоты и 3,5-бис(трифторметил)анилина в качестве исходных соединений проводили процедуру, описанную в примере 3, в результате чего получали указанное в заголовке соединение. Выход: 88,5%. 1 Н-ЯМР(ДМСО-d6):6,98 (1 Н, д, J=8,8 Гц), 7,59 (1 Н, дд, J=8,8, 2,8 Гц), 7,83 (1 Н, с), 7,98 (1 Н, д,J=2,8 Гц), 8,43 (2 Н, с), 10,82 (1 Н, с), 11,37 (1 Н, с).- 16010835 Указанное соединение было также получено нижеследующим методом. Порошокообразное железо (30 мг, 0,54 ммоль) и бром (0,02 мл, 0,39 ммоль) добавляли к раствору 2 ацетокси-N-[3,5-бис(трифторметил)]бензамида (соединение 1; 100 мг, 0,25 ммоль) в тетрахлорметане(8 мл) и смесь перемешивали при 50 С в течение 4 ч. После охлаждения реакционной смеси до комнатной температуры ее выливали в водный NaHSO4 и экстрагировали этилацетатом. Этилацетатный слой промывали водой и насыщенным раствором соли и сушили над безводным сульфатом натрия. Остаток,полученный путем выпаривания растворителя при пониженном давлении, очищали колоночной хроматографией на силикагеле (н-гексан:этилацетат = 4:1) и получали указанное в заголовке соединение (600 мг, 54,9%) в виде белого твердого вещества. Пример 7. Получение соединения 7. С использованием 5-иодсалициловой кислоты и 3,5-бис(трифторметил)анилина в качестве исходных соединений проводили процедуру, описанную в примере 3, в результате чего получали указанное в заголовке соединение. Выход: 62,2%. 1 Н-ЯМР(ДМСО-d6):6,86 (1 Н, д, J=8,4 Гц), 7,74 (1 Н, дд, J=8,7, 2,4 Гц), 7,84 (1 Н, с), 8,13 (1 Н, д,J=2,1 Гц), 8,84 (2 Н, с), 10,82 (1 Н, с), 11,41 (1 Н, с). Пример 8. Получение соединения 8. С использованием 5-нитросалициловой кислоты и 3,5-бис(трифторметил)анилина в качестве исходных соединений проводили процедуру, описанную в примере 3, в результате чего получали указанное в заголовке соединение. Выход: 57,2%. 1 Н-ЯМР(ДМСО-d6):7,18 (1 Н, д, J=9,0 Гц), 7,86 (1 Н, с), 8,31 (1 Н, дд, J=9,0, 3,0 Гц), 8,45 (2 Н, с),8,70 (1 Н, д, J=3,0 Гц), 11,12 (1 Н, с). Пример 9. Получение соединения 9.(1) Бензиловый эфир 2-бензилокси-5-формилбензойной кислоты. Смесь 5-формилсалициловой кислоты (4,98 г, 30 ммоль), бензилбромида (15,39 г, 90 ммоль), карбоната калия (16,59 г, 120 ммоль) и метилэтилкетона (350 мл) кипятили с обратным холодильником в течение 8 ч. После охлаждения растворитель выпаривали при пониженном давлении. К остатку добавляли 2 н. соляную кислоту и смесь экстрагировали этилацетатом. Слой промывали водой и насыщенным раствором соли и сушили над безводным сульфатом магния. Остаток, полученный путем выпаривания растворителя при пониженном давлении, очищали колоночной хроматографией на силикагеле (нгексан:этилацетат = 3:1), суспендировали и промывали изопропиловым эфиром при кипячении с обратным холодильником, в результате чего получали указанное в заголовке соединение (5,98 г, 57,5%) в виде белого твердого вещества. 1 Н-ЯМР(CDCl3):5,27 (2 Н, с), 5,37 (2 Н, с), 7,15 (1 Н, д, J=9,0 Гц), 7,26-7,46 (10 Н, м), 7,99 (1 Н, дд,J=9,0, 2,4 Гц), 8,36 (1 Н, д, J=2,4 Гц), 9,91 (1 Н, с).(2) Бензиловый эфир 2-бензилокси-5-цианобензойной кислоты. Смесь бензилового эфира 2-бензилокси-5-формилбензойной кислоты (693 мг, 2 ммоль), гидрохлорида гидроксиламина (167 мг, 2,4 ммоль) и N-метилпирролидона (3 мл) перемешивали при 115 С в течение 4 ч. После охлаждения реакционной смеси добавляли 2 н. соляную кислоту (5 мл) и воду (30 мл), и смесь экстрагировали этилацетатом. Органический слой промывали 2 н. водным гидроксидом натрия,водой и насыщенным раствором соли, и сушили над безводным сульфатом магния. Остаток, полученный путем выпаривания растворителя при пониженном давлении, суспендировали и промывали изопропиловым эфиром при кипячении с обратным холодильником, в результате чего получали указанное в заголовке соединение (527 мг, 76,7%) в виде белого твердого вещества. 1 Н-ЯМР(СDС 13):5,23 (2 Н, с), 5,35 (2 Н, с), 7,08 (1 Н, д, J=8,7 Гц), 7,33-7,43 (10 Н, м), 7,70 (1 Н, дд,J=8,7, 2,4 Гц), 8,13 (1 Н, д, J=2,4 Гц).(3) 5-Цианосалициловая кислота. Этанол (10 мл) и тетрагидрофуран (10 мл) добавляли к бензиловому эфиру 2-бензилокси-5 цианобензойной кислоты (446 мг, 1,3 ммоль) и 5% палладию на угле (45 мг) и смесь гидрировали при комнатной температуре в течение 2 ч. После отфильтровывания нерастворившегося вещества, растворитель выпаривали при пониженном давлении, в результате чего получали указанное в заголовке соединение (212 мг, 100,0%) в виде белого твердого вещества. 1 Н-ЯМР(ДМСО-d6):7,02 (1 Н, д, J=8,7 Гц), 7,82 (1 Н, дд, J=8,7, 2,4 Гц), 8,12 (1 Н, д, J=2,1 Гц).(4) N-[3,5-бис(трифторметил)фенил]-5-циано-2-гидроксибензамид (соединение 9). С использованием 5-цианосалициловой кислоты и 3,5-бис(трифторметил)анилина в качестве исходных соединений проводили процедуру, описанную в примере 3, в результате чего получали указанное в заголовке соединение. Выход: 16,6%. 1H-ЯМР(ДМСО-d6):7,15 (1 Н, д, J=8,7 Гц), 7,85 (1 Н, с), 7,86 (1 Н, дд, J=8,7, 2,1 Гц), 8,22 (1 Н, д,J=2,4 Гц), 8,43 (2 Н, с), 10,93 (1 Н, с), 12,00 (1 Н, ушир.с). Пример 10. Получение соединения 10. С использованием 5-метилсалициловой кислоты и 3,5-бис(трифторметил)анилина в качестве исходных соединений проводили процедуру, описанную в примере 3, в результате чего получали указан- 17010835 ное в заголовке соединение. Выход: 54,9%. 1(1) 5-[(1,1-диметил)этил]салициловая кислота. Сульфамовую кислоту (1,76 г, 18,1 ммоль) и дигидрофосфат натрия (7,33 г, 47 ммоль) добавляли к раствору 5-[(1,1-диметил)этил]-2-гидроксибензальдегида (2,15 г, 12,1 ммоль) в 1,4-диоксане (100 мл) и воде (40 мл). К полученной смеси, при охлаждении льдом, добавляли раствор хлорита натрия (1,76 г,15,5 ммоль) в воде (10 мл) и эту смесь перемешивали в течение 1 ч. Затем к смеси добавляли сульфит натрия (1,80 г, 14,3 ммоль) и смесь перемешивали 30 мин. К реакционной смеси добавляли концентрированную соляную кислоту, и рН доводили до 1. Остаток, полученный путем выпаривания 1,4-диоксана при пониженном давлении, экстрагировали этилацетатом. Органический слой промывали водой и насыщенным раствором соли и сушили над безводным сульфатом магния. Остаток, полученный путем выпаривания растворителя при пониженном давлении, промывали н-гексаном, при суспендировании, и получали указанное в заголовке соединение (1,81 г, 77,4%) в виде белого порошка. 1 Н-ЯМР(ДМСО-d6):1,26 (9 Н, с), 6,90 (1 Н, д, J=9,0 Гц), 7,58 (1 Н, дд, J=8,7, 2,4 Гц), 7,75 (1 Н, д,J=2,4 Гц), 11,07 (1 Н, ушир.с).(2) N-[3,5-бис(трифторметил)фенил]-5-[(1,1-диметил)этил]-2-гидроксибензамид (соединение 11). С использованием 5-[(1,1-диметил)этил]салициловой кислоты и 3,5-бис(трифторметил)анилина в качестве исходных соединений проводили процедуру, описанную в примере 3, в результате чего получали указанное в заголовке соединение. Выход: 53,8%. 1 Н-ЯМР(ДМСО-d6):1,30 (9 Н, с), 6,96 (1 Н, д, J=8,7 Гц), 7,50 (1 Н, дд, J=8,7, 2,4 Гц), 7,82 (1 Н, д,J=2,4 Гц), 7,83 (1 Н, с), 8,46 (2 Н, с), 10,80 (1 Н, с), 11,12 (1 Н, с). Пример 12. Получение соединения 12.(1) Метиловый эфир 5-ацетил-2-бензилоксибензойной кислоты. Смесь метилового эфира 5-ацетилсалициловой кислоты (13,59 г, 70 ммоль), бензилбромида (17,96 г,105 ммоль), карбоната калия (19,35 г, 140 ммоль) и метилэтилкетона (350 мл) кипятили с обратным холодильником в течение 8 ч. После охлаждения растворитель выпаривали при пониженном давлении. К остатку добавляли 2 н. соляную кислоту и смесь экстрагировали этилацетатом. Этилацетатный слой промывали водой и насыщенным раствором соли, сушили над безводным сульфатом магния и концентрировали, и остаток перекристаллизовывали из изопропилового эфира, в результате чего получали указанное в заголовке соединение (14,20 г, 71,4%) в виде белого твердого вещества. 1 Н-ЯМР(CDCl3):2,58 (3 Н, с), 3,93 (3 Н, с), 5,27 (2 Н, с), 7,07 (1 Н, д, J=8,7 Гц), 7,26-7,43 (3 Н, м),7,47-7,50 (2 Н, м), 8,07 (1 Н, дд, J=8,7, 2,4 Гц), 8,44 (1 Н, д, J=2,4 Гц).(2) 5-Ацетил-2-бензилоксибензойная кислота. 2 н. Гидроксид натрия (11 мл) добавляли к раствору метилового эфира 5-ацетил-2-бензилоксибензойной кислоты (5,69 мг, 20 ммоль) в смешанном растворителе метанола/тетрагидрофурана (20 мл+ 20 мл) и смесь перемешивали в течение 8 ч. К остатку, полученному путем выпаривания растворителя при пониженном давлении, добавляли 2 н. соляную кислоту и смесь экстрагировали дихлорметаном. Затем дихлорметановый слой последовательно промывали водой и насыщенным раствором соли, сушили над безводным сульфатом магния, и остаток, полученный путем выпаривания растворителя при пониженном давлении, промывали изопропиловым эфиром, в результате чего получали указанное в заголовке соединение (4,92 г, 91,0%) в виде белого твердого вещества. 1 Н-ЯМР(ДМСО-d6):2,55 (3 Н, с), 5,32 (2 Н, с), 7,30-7,43 (4 Н, м), 7,49-7,52 (2 Н, м), 8,09 (1 Н, дд,J=9,0, 2,7 Гц), 8,22 (1 Н, д, J=2,4 Гц).(3) 5-Ацетил-2-бензилокси-N-[3,5-бис(трифторметил)фенил]бензамид. Оксихлорид фосфора (1,85 мл, 19,8 ммоль) добавляли к раствору 5-ацетил-2-бензилоксибензойной кислоты (4,87 мг, 18 ммоль), 3,5-бис(трифторметил)анилина (4,54 г, 19,8 ммоль) и пиридина (5,70 г, 72 ммоль) в смешанном растворителе тетрагидрофурана/дихлорметана (72 мл + 36 мл), охлаждая при этом льдом, после чего смесь перемешивали при комнатной температуре в течение 12 ч. К остатку, полученному путем выпаривания растворителя при пониженном давлении, добавляли 1 н. соляную кислоту (100 мл) и смесь экстрагировали этилацетатом. После этого этилацетатный слой последовательно промывали водой и насыщенным раствором соли, сушили над безводным сульфатом магния, а затем остаток, полученный путем выпаривания растворителя при пониженном давлении, очищали колоночной хроматографией на силикагеле (н-гексан : этилацетат = 3:12:1), в результате чего получали указанное в заголовке соединение (5,47 г, 63,1%) в виде желтовато-зеленых кристаллов. 1 Н-ЯМР(ДМСО-d6):2,57 (3 Н, с), 7,11 (1 Н, д, J=8,7 Гц), 7,86 (1 Н, с), 8,05 (1 Н, дд, J=8,4, 2,1 Гц),8,44 (1 Н, д, J=2,1 Гц), 8,47 (2 Н, с), 10,96 (1 Н, с), 11,97 (1 Н, ушир.с). Если соединения нижеследующих примеров получали способом, описанным в примере 12(3), то в качестве галогенирующего кислоту агента использовали оксихлорид фосфора. В качестве основания использовали пиридин. В качестве реакционного растворителя использовали дихлорметан, тетрагидрофу- 18010835 ран или т.п.(4) 5-Ацетил-N-[3,5-бис(трифторметил)фенил]-2-гидроксибензамид (соединение 12). Этанол (6 мл) и тетрагидрофуран (72 мл) добавляли к 5-ацетил-2-бензилокси-N-[3,5-бис(трифторметил)фенил]бензамиду (602 мг, 1,25 ммоль) и 5% палладию на угле (60 мг) и смесь гидрировали при комнатной температуре в течение 30 мин в атмосфере водорода. После отфильтровывания нерастворившегося вещества остаток, полученный путем выпаривания растворителя при пониженном давлении, перекристаллизовывали из смеси н-гексан-этилацетат, в результате чего получали указанное в заголовке соединение (230 мг, 47,0%) в виде белого твердого вещества. 1 Н-ЯМР(ДМСО-d6) :2,59 (3 Н, с), 5,35 (2 Н, с), 7,32-7,36 (3 Н, м), 7,43 (1 Н, д, J=8,7 Гц), 7,52-7,55(2 Н, м), 7,82 (1 Н, с), 8,16 (1 Н, дд, J=8,7, 2,4 Гц), 8,25 (1 Н, д, J=2,4 Гц), 8,31 (2 Н, с), 10,89 (1 Н, с). Пример 13. Получение соединения 13. Борогидрид натрия (23,6 мг, 0,62 ммоль) добавляли к суспензии 5-ацетил-N-[3,5-бис(трифторметил) фенил]-2-гидроксибензамида (соединение 12; 50,5 мг, 0,13 ммоль) в этаноле (2 мл) и смесь перемешивали при комнатной температуре в течение 12 ч. Реакционную смесь выливали в разбавленную соляную кислоту и экстрагировали этилацетатом. Затем этилацетатный слой промывали водой и насыщенным раствором соли, сушили над безводным сульфатом натрия и остаток, полученный путем выпаривания растворителя при пониженном давлении, промывали смесью изопропиловый эфир/н-гексан, при суспендировании, в результате чего указанное в заголовке соединение (39,7 г, 78,3%) в виде белого порошка. 1(1 Н, с). Пример 14. Получение соединения 14. Пиридин (45 мкл, 0,56 ммоль) и гидрохлорид. О-метилгидроксиламина (25,8 мг, 0,31 ммоль) добавляли к раствору 5-ацетил-N-[3, 5-бис (трифторметил) фенил]-2-гидроксибензамида (соединения 12; 100,0 мг, 0,26 ммоль) в этаноле (3 мл) и смесь кипятили с обратным холодильником в течение 1 ч. После охлаждения реакционной смеси до комнатной температуры, ее выливали в разбавленную соляную кислоту и экстрагировали этилацетатом. Затем этилацетатный слой промывали водой и насыщенным раствором соли, сушили над безводным сульфатом натрия, и остаток, полученный путем выпаривания растворителя при пониженном давлении, очищали колоночной хроматографией на силикагеле (н-гексан:этилацетат = 4:1), в результате чего получали указанное в заголовке соединение (102,1 г, 95,3%) в виде белых кристаллов. 1H-ЯМР(ДМСО-d6):2,19 (3 Н, с), 3,91 (3 Н, с), 7,05 (1 Н, д, J=8,7 Гц), 7,77 (1 Н, дд, J=8,7, 2,4 Гц),7,85 (1 Н, с), 8,09 (1 Н, д, J=2,4 Гц), 8,47 (2 Н, с), 10,87 (1 Н, с), 11,48 (1 Н, с). Пример 15. Получение соединения 15. С использованием 5-ацетил-N-[3,5-бис(трифторметил)фенил]-2-гидроксибензамида (соединения 12) и гидрохлорида O-бензилгидроксиламина в качестве исходных соединений проводили процедуру,описанную в примере 14, в результате чего получали указанное в заголовке соединение. Выход: 79,9%. 1 Н-ЯМР(ДМСО-d6):2,24 (3 Н, с), 5,20 (2 Н, с), 7,04 (1 Н, д, J=8,7 Гц), 7,29-7,47 (5 Н, м), 7,76 (1 Н, дд,J=8,7, 2,4 Гц), 7,85 (1 Н, с), 8,07 (1 Н, д, J=2,1 Гц), 8,46 (2 Н, с), 10,87 (1 Н, с), 11,47 (1 Н, с). Пример 16. Получение соединения 16.(1) 5-(2,2-Дицианоэтен-1-ил)-2-гидроксибензойная кислота. 5-Формилсалициловую кислоту (332 мг, 2 ммоль) добавляли к раствору малононитрила (132 мг, 2 ммоль) в этаноле (6 мл). Затем при охлаждении льдом добавляли бензиламин (0,1 мл) и смесь перемешивали при комнатной температуре в течение 2 ч. Образовавшиеся желтые кристаллы фильтровали и перекристаллизовывали из этанола, в результате чего получали указанное в заголовке соединение (139,9 мг,32,7%) в виде светло-желтого твердого вещества. 1 Н-ЯМР(ДМСО-d6) :7,12 (1 Н, д, J=8,7 Гц), 8,09 (1 Н, дд, J=8,7, 2,4 Гц), 8,41 (1 Н, с), 8,50 (1 Н, д,J=2,4 Гц).(2) N-[3,5-бис(трифторметил)фенил]-5-(2, 2-дицианоэтен-1-ил)-2-гидроксибензамид (соединение 16). С использованием 5-(2,2-дицианоэтен-1-ил)-2-гидроксибензойной кислоты и 3,5-бис(трифторметил)анилина в качестве исходных соединений проводили процедуру, описанную в примере 3, в результате чего получали указанное в заголовке соединение. Выход: 9,1%. 1 Н-ЯМР(ДМСО-d6):7,13 (1 Н, д, J=9,0 Гц), 7,83 (1 Н, с), 8,04 (1 Н, дд, J=9,0, 2,4 Гц), 8,36 (1 Н, с),8,38 (1 Н, д, J=2,4 Гц), 8,43 (2 Н, с), 11,43 (1 Н, с). Пример 17. Получение соединения 17.(1) 5-[(2-Циано-2-метоксикарбонил)этен-1-ил]-2-гидроксибензойная кислота. Смесь 5-формилсалициловой кислоты (332 мг, 2 ммоль), метилового эфира цианоуксусной кислоты(198 мг, 2 ммоль), уксусной кислоты (6 мл) и триэтиламина (0,2 мл) кипятили с обратным холодильником в течение 5 ч. После охлаждения реакционной смеси до комнатной температуры ее выливали в воду,и образовавшиеся кристаллы фильтровали и перекристаллизовывали из н-гексана, в результате чего по- 19010835 лучали указанное в заголовке соединение (327,7 мг, 66,3%) в виде светло-желтого твердого вещества. 1 Н-ЯМР(ДМСО-d6):3,85 (3 Н, с), 7,15 (1 Н, д, J=8,7 Гц), 8,20 (1 Н, дд, J=8,7, 2,4 Гц), 8,37 (1 Н, с),8,66 (1 Н, д, J=2,4 Гц).(2) Метиловый эфир 3-(N-[3,5-бис(трифторметил)фенил]карбамоил-4-гидроксифенил)-2-цианоакриловой кислоты (соединение 17). С использованием 5-[(2-циано-2-метоксикарбонил)этен-1-ил]-2-гидроксибензойной кислоты и 3,5 бис(трифторметил)анилина в качестве исходных соединений проводили процедуру, описанную в примере 3, в результате чего получали указанное в заголовке соединение. Выход: 66,3%. 1 Н-ЯМР(ДМСО-d6):3,85 (3 Н, с), 7,19 (1 Н, д, J=9,0 Гц), 7,85 (1 Н, с), 8,20 (1 Н, дд, J=8,7, 2,1 Гц),8,33 (1 Н, с), 8,45 (2 Н, с), 8,50 (1 Н, д, J=2,1 Гц), 11,00 (1 Н, с), 11,03 (1 Н, с). Пример 18. Получение соединения 18. 2 н. Гидроксид натрия (0,11 мл, 0,22 ммоль) добавляли к раствору метилового эфира 3-(N-[3,5 бис(трифторметил)фенил]карбамоил-4-гидроксифенил)-2-цианоакриловой кислоты (соединение 17; 50 мг, 0,11 ммоль) в этаноле (5 мл) и смесь перемешивали при комнатной температуре в течение 3 ч. Реакционную смесь выливали в разбавленную соляную кислоту и экстрагировали этилацетатом. Затем органический слой промывали насыщенным раствором соли, сушили над безводным сульфатом магния и остаток, полученный путем выпаривания растворителя при пониженном давлении, перекристаллизовывали из этилацетата, в результате чего указанное в заголовке соединение (13,5 г, 30,4%) в виде светложелтого твердого вещества. 1 Н-ЯМР(ДМСО-d6):7,12 (1 Н, д, J=8,4 Гц), 7,84 (1 Н, с), 7,94 (1 Н, дд, J=8,4, 2,1 Гц), 8,38 (1 Н, д,J=2,1 Гц), 8,45 (2 Н, с), 9,87 (1 Н, с), 11,41 (1 Н, с). Пример 19. Получение соединения 19. Смесь N-[3,5-бис(трифторметил)фенил]-2-гидрокси-5-иодбензамида (соединение 7; 475 мг, 1 ммоль), стирола (130 мг, 1,25 ммоль), ацетата палладия (4,5 мг, 0,02 ммоль), трис(орто-толил)фосфина(12,2 мг, 0,04 ммоль), диизопропиламина (388 мг, 3 ммоль) и N,N-диметилформами да (2 мл) кипятили с обратным холодильником в течение 8 ч. После охлаждения реакционной смеси до комнатной температуры добавляли воду и смесь экстрагировали этилацетатом. Затем этилацетатный слой последовательно промывали водой и насыщенным раствором соли, сушили над безводным сульфатом магния и остаток,полученный путем выпаривания растворителя при пониженном давлении, очищали колоночной хроматографией на силикагеле (н-гексан:изопропиловый эфир = 2:11:1) и получали указанное в заголовке соединение (173 мг, 38,3%) в виде светло-желтого твердого вещества. 1(1 Н, ушир.с). Пример 20. Получение соединения 20. Тетракис(трифенилфосфин)палладий (23 мг, 0,02 ммоль) и иодид меди (4 мг, 0,02 ммоль) добавляли к раствору N-[3,5-бис(трифторметил)фенил]-2-гидрокси-5-иодбензамида (соединение 7; 950 мг, 2 ммоль), триметилсилилацетилена (246 мг, 2,5 ммоль) и триэтиламина (2 мл) в N,N-диметилформамиде (4 мл) в атмосфере аргона и смесь перемешивали при 40 С в течение 2 ч. После охлаждения реакционной смеси до комнатной температуры эту смесь выливали в этилацетат (100 мл) и 1 н. лимонную кислоту (100 мл), а затем перемешивали и фильтровали через целит. После этого этилацетатный слой последовательно промывали водой и насыщенным раствором соли, сушили над безводным сульфатом магния и остаток,полученный путем выпаривания растворителя при пониженном давлении, очищали колоночной хроматографией на силикагеле (н-гексан:этилацетат =19:1) и кристаллизовали из н-гексана, в результате чего получали указанное в заголовке соединение (286 мг, 32,1%) в виде белых кристаллов. 1H-ЯМР(ДМСО-d6) :0,23 (9 Н, с), 7,00 (1 Н, д, J=8,7 Гц), 7,54 (1 Н, дд, J=8,7, 2,4 Гц), 7,85 (1 Н, с),7,98 (1 Н, д, J=2,1 Гц), 8,46 (2 Н, с), 10,86 (1 Н, с), 11,69 (1 Н, с). Пример 21. Получение соединения 21. 2 н. Гидроксид натрия (1 мл) добавляли к раствору N-[3,5-бис(трифторметил)фенил]-2-гидрокси-5[(триметилсилил)этинил]бензамида (соединения 20; 233 мг, 0,5 ммоль) в метаноле (1 мл) и смесь перемешивали при комнатной температуре в течение 1 ч. Реакционную смесь выливали в 2 н. соляную кислоту и экстрагировали этилацетатом. Затем этилацетатный слой последовательно промывали водой и насыщенным раствором соли, сушили над безводным сульфатом магния и остаток, полученный путем выпаривания растворителя при пониженном давлении, кристаллизовали из смеси этанол/вода, в результате чего получали указанное в заголовке соединение (67 мг, 35,9%) в виде светло-серых кристаллов. 1H-ЯМР(ДМСО-d6) :4,11 (1 Н, с), 7,02 (1 Н, д, J=8,4 Гц), 7,55 (1 Н, дд, J=8,4, 2,1 Гц), 7,85 (1 Н, с),7,98 (1 Н, д, J=2,1 Гц), 8,46 (2 Н, с), 8,46 (2 Н, с), 10,86 (1 Н, с), 11,62 (1 Н, с). Пример 22. Получение соединения 22. С использованием N-[3,5-бис(трифторметил)фенил]-2-гидрокси-5-иодбензамида (соединения 7) и фенилацетилена в качестве исходных соединений проводили процедуру, описанную в примере 20, в результате чего получали указанное в заголовке соединение. Выход: 40,8%.(3 мл) в атмосфере аргона и смесь перемешивали при комнатной температуре в течение 5 мин. Затем добавляли дигидроксифенилборан (57 мг, 0,47 ммоль) и 1 моль/л водного карбоната натрия (1,3 мл) и смесь кипятили с обратным холодильником в течение 2 ч. После охлаждения реакционной смеси до комнатной температуры ее выливали в разбавленную соляную кислоту и экстрагировали этилацетатом. Затем этилацетатный слой последовательно промывали водой и насыщенным раствором соли, сушили над безводным сульфатом натрия и остаток, полученный путем выпаривания растворителя при пониженном давлении, очищали колоночной хроматографией на силикагеле (н-гексан:этилацетат = 6:13:1) и получали указанное в заголовке соединение (109 мг, 61,1%) в виде белых кристаллов. 1H-ЯМР(ДМСО-d6):7,12 (1 Н, д, J=8,7 Гц), 7,33-7,38 (1 Н, м), 7,48 (2 Н, т, J=7,5 Гц), 7,67-7,70 (2 Н,м), 7,79 (1 Н, дд, J=8,4, 2,4 Гц), 7,87 (1 Н, с), 8,17 (1 Н, д, J=2,4 Гц), 8,49 (2 Н, с), 10,92 (1 Н, с), 11,4 (1 Н, с). Пример 24. Получение соединения 24. С использованием N-[3,5-бис(трифторметил)фенил]-2-гидрокси-5-(фенилэтинил)бензамида (соединения 22) в качестве исходного соединения проводили процедуру, описанную в примере 12(4), в результате чего получали указанное в заголовке соединение. Выход: 86,2%. 1 Н-ЯМР(ДМСО-d6) :2,88 (4 Н, с), 6,93 (1 Н, д, J=8,1 Гц), 7,15-7,34 (6 Н, м), 7,76 (1 Н, д, J=2,4 Гц),7,84 (1 Н, с), 8,47 (2 Н, с), 10,79 (1 Н, с), 11,15 (1 Н, с). Пример 25. Получение соединения 25. С использованием 2-гидрокси-5-(трифторметил)бензойной кислоты и 3,5-бис(трифторметил) анилина в качестве исходных соединений проводили процедуру, описанную в примере 3, в результате чего получали указанное в заголовке соединение. Выход: 44,7%. 1[2-гидрокси-5-(трифторметил)бензойная кислота: см. "Chemical and Pharmaceutical Bulletin", 1996,Vol. 44, 4, p.734-745]. Пример 26. Получение соединения 26. С использованием 2-гидрокси-5-(пентафторэтил)бензойной кислоты и 3,5-бис(трифторметил)анилина в качестве исходных соединений проводили процедуру, описанную в примере 3, в результате чего получали указанное в заголовке соединение. Выход 65,7%. 1[2-гидрокси-5-(пентафторэтил)бензойная кислота: см. "Chemical and Pharmaceutical Bulletin", 1996,Vol. 44, 4, p.734-745]. Пример 27. Получение соединения 27. С использованием 2-гидрокси-5-(пиррол-1-ил)бензойной кислоты и 3,5-бис(трифторметил)анилина в качестве исходных соединений проводили процедуру, описанную в примере 3, в результате чего получали указанное в заголовке соединение. Выход: 57,8%. 1H-ЯМР(ДМСО-d6):6,27 (2 Н, дд, J=2,4, 1,8 Гц), 7,10 (1 Н, д, J=9,0 Гц), 7,29 (2 Н, дд, J=2,4, 1,8 Гц),7,66 (1 Н, дд, J=9,0, 2,7 Гц), 7,86 (1 Н, с), 7,98 (1 Н, д, J=2,4 Гц), 8,47 (2 Н, с), 10,89 (1 Н, с), 11,24 (1 Н, с). Пример 28. Получение соединения 28. С использованием N-[3,5-бис(трифторметил)фенил]-2-гидрокси-5-иодбензамида (соединения 7) и 2-тиофенбороновой кислоты в качестве исходных соединений проводили процедуру, описанную в примере 23, в результате чего получали указанное в заголовке соединение. Выход: 44,4%. 1 Н-ЯМР(ДМСО-d6):7,08 (1 Н, д, J=8,4 Гц), 7,14 (1 Н, дд, J=5,4, 3,6 Гц), 7,45 (1 Н, дд, J=3,6, 1,2 Гц),7,51 (1 Н, дд, J=5,1, 0,9 Гц), 7,75 (1 Н, дд, J=8,4, 2,4 Гц), 7,59 (1 Н, с), 8,08 (1 Н, д, J=2,4 Гц), 8,48 (2 Н, с),10,91 (1 Н, с), 11,38 (1 Н, с). Пример 29. Получение соединения 29. С использованием N-[3,5-бис(трифторметил)фенил]-2-гидрокси-5-иодбензамида (соединения 7) и 3-тиофенбороновой кислоты в качестве исходных соединений проводили процедуру, описанную в примере 23, в результате чего получали указанное в заголовке соединение. Выход: 38,7%. 1(1) 2-Бензилокси-5-(2-бромацетил)-N-[3,5-бис(трифторметил)фенил]бензамид. Трибромид фенилтриметиламмония (3,75 г, 10 ммоль) добавляли к раствору 5-ацетил-2 бензилокси-N-[3,5-бис(трифторметил)фенил]-2-бензамида (соединение примера 12(3); 4,81 г, 10 ммоль) в тетрагидрофуране (30 мл) и смесь перемешивали при комнатной температуре в течение 12 ч.- 21010835 Реакционную смесь выливали в воду и экстрагировали этилацетатом. Затем этилацетатный слой последовательной промывали водным бисульфитом натрия, водой и насыщенным раствором соли, сушили над безводным сульфатом магния и остаток, полученный путем выпаривания растворителя при пониженном давлении, очищали хроматографией на силикагеле (н-гексан:этилацетат = 4:1) и перекристаллизовывали из этилацетата/н-гексана, в результате чего получали указанное в заголовке соединение (2,39 г, 42,7%) в виде белого твердого вещества. 1(2) 2-Бензилокси-N-[3,5-бис(трифторметил)фенил]-5-(2-метилтиазол-4-ил)бензамид. Смесь 2-бензилокси-5-(2-бромацетил)-N-[3,5-бис(трифторметил)фенил]бензамида (280 мг, 0,5 ммоль), тиоацетамида (41 мг, 0,55 ммоль), бикарбоната натрия (50 мг, 0,6 ммоль) и этанола (15 мл) кипятили с обратным холодильником в течение 1 ч. После охлаждения реакционной смеси до комнатной температуры ее выливали в воду и экстрагировали этилацетатом. Затем этилацетатный слой последовательно промывали водой и насыщенным раствором соли, сушили над безводным сульфатом магния и остаток, полученный путем выпаривания растворителя при пониженном давлении, очищали колоночной хроматографией на силикагеле (гексан:этилацетат=4:1), в результате чего получали указанное в заголовке соединение (181 мг, 67,5%) в виде белого твердого вещества. 1 Н-ЯМР(ДМСО-d6) :2,72 (3 Н, с), 5,29 (2 Н, с), 7,33-7,36 (3 Н, м), 7,40 (1 Н, д, J=9,0 Гц), 7,54-7,57(3) N-[3,5-бис(трифторметил)фенил]-2-гидрокси-5-(2-метилтиазол-4-ил)бензамид (соединение 30). Этанол (10 мл) добавляли к 2-бензилокси-N-[3,5-бис(трифторметил)фенил]-5-(2-метилтиазол-4 ил)бензамиду (160 мг, 0,3 ммоль) и 10% палладию на угле (240 мг) и смесь перемешивали в течение 3,5 ч в атмосфере водорода. Реакционную смесь фильтровали, и растворитель выпаривали при пониженном давлении с получением указанного в заголовке соединения (103,4 мг, 7 9,2%) в виде белого твердого вещества. 1 Н-ЯМР(ДМСО-d6):2,72 (3 Н, с), 7,08 (1 Н, д, J=8,7 Гц), 7,83 (1 Н, с), 7,85 (1 Н, с), 8,01 (1 Н, дд, J=8,7,2,4 Гц), 8,42 (1 Н, д, J=2,1 Гц), 8,50 (2 Н, с), 10,96 (1 Н, с), 11,40 (1 Н, с). Пример 31. Получение соединения 31. Смесь 2-бензилокси-5-(2-бромацетил)-N-[3,5-бис(трифторметил)фенил]бензамида (соединение примера 12(3); 280 мг, 0,5 ммоль), 2-аминопиридина (51,8 мг, 0,55 ммоль), бикарбоната натрия (50 мг, 0,6 ммоль) и этанола (10 мл) кипятили с обратным холодильником в течение 2 ч. После охлаждения реакционной смеси до комнатной температуры ее выливали в водный бикарбонат натрия и экстрагировали этилацетатом. Затем этилацетатный слой промывали водой и насыщенным раствором соли, сушили над безводным сульфатом магния и остаток, полученный путем выпаривания растворителя при пониженном давлении, очищали колоночной хроматографией на силикагеле (н-гексан:этилацетат = 1:2) и получали белое твердое вещество (130,3 мг, 45,9%). Затем смесь этого твердого вещества (108 г, 0,19 ммоль), 10% палладия на угле (11 мг), этанола (8 мл) и этилацетата (8 мл) перемешивали в течение 7 ч в атмосфере водорода. Реакционную смесь фильтровали и остаток, полученный путем выпаривания растворителя при пониженном давлении, очищали колоночной хроматографией на силикагеле (н-гексан:этилацетат = 1:3) и получали указанное в заголовке соединение (18,3 мг, 20,2%) в виде белого твердого вещества. 1(50 мл) смесь кипятили с обратным холодильником в течение 8 ч. После охлаждения реакционной смеси до комнатной температуры ее выливали в разбавленную соляную кислоту и экстрагировали этилацетатом. Этилацетатный слой промывали водой и насыщенным раствором соли, сушили над безводным сульфатом магния и остаток, полученный путем выпаривания растворителя при пониженном давлении,очищали колоночной хроматографией на силикагеле (гексан:этилацетат=3:1) и перекристаллизовывали из смеси н-гексан/этилацетат, в результате чего получали указанное в заголовке соединение (3,96 г,76,3%) в виде белого твердого вещества. 1 Н-ЯМР(ДМСО-d6) :3,38 (3 Н, с), 5,28 (2 Н, с), 7,12 (1 Н, д, J=9,0 Гц), 7,81 (1 Н, с), 7,82 (1 Н, дд,J=8,7, 2,4 Гц), 7,88 (1 Н, д, J=2,4 Гц), 8,40 (2 Н, с), 10,87 (1 Н, с).(2) N-[3,5-бис(Трифторметил)фенил]-2-метоксиметокси-5-(пиридин-2-ил)бензамид. Три-н-бутил(2-пиридил)олово (0,13 мл, 0,41 ммоль) и дихлорбис(трифенилфосфин)палладий (32,1 мг, 0,05 ммоль) добавляли к раствору N-[3,5-бис(трифторметил)фенил]-5-иод-2-метоксиметоксибен- 22010835 замида (0,20 мг, 0,39 ммоль) в N,N-диметилформамиде (8 мл) и смесь перемешивали при 100 С в течение 1,5 ч. После охлаждения реакционной смеси до комнатной температуры ее выливали в воду и экстрагировали этилацетатом. Затем этилацетатный слой последовательно промывали водой и насыщенным раствором соли, сушили над безводным сульфатом натрия и остаток, полученный путем выпаривания растворителя при пониженном давлении, очищали колоночной хроматографией на силикагеле (нгексан:этилацетат = 2:11:1) и получали указанное в заголовке соединение (37,9 мг, 20,8%) в виде белого порошка. 1 Н-ЯМР(СDСl3):3,64 (3 Н, с), 5,53 (2 Н, с), 7,23-7,28 (1 Н, м), 7,36 (1 Н, д, J=8,7 Гц), 7,65 (1 Н, с),7,77-7,84 (2 Н, м), 8,20 (2 Н, с), 8,31 (1 Н, дд, J=8,7, 2,4 Гц), 8,68-8,70 (1 Н, м), 8,83 (1 Н, д, J=2,4 Гц), 10,12(3) N-[3,5-бис(трифторметил)фенил]-2-гидрокси-5-(пиридин-2-ил)бензамид (соединение 32). Метанол (3 мл) и концентрированную соляную кислоту (0,5 мл) добавляли к N-[3,5-бис(трифторметил)фенил]-2-метоксиметокси-5-(пиридин-2-ил)бензамиду (37,9 мг, 0,08 ммоль) и смесь кипятили с обратным холодильником в течение 2 ч. После охлаждения реакционной смеси до комнатной температуры, ее выливали в насыщенный водный бикарбонат натрия и экстрагировали этилацетатом. Затем этилацетатный слой последовательно промывали водой и насыщенным раствором соли, сушили над безводным сульфатом натрия и остаток, полученный путем выпаривания растворителя при пониженном давлении, очищали колоночной хроматографией на силикагеле (н-гексан:этилацетат = 2:1) и получали указанное в заголовке соединение (16,2 мг, 47,2%) в виде белого порошка. 1(1 Н, с), 11,53 (1 Н, с). Пример 33. Получение соединения 33. С использованием 5-метоксисалициловой кислоты и 3,5-бис(трифторметил)анилина в качестве исходных соединений проводили процедуру, описанную в примере 3, в результате чего получали указанное в заголовке соединение. Выход: 56,8%. 1(1) Метиловый эфир 5-ацетил-2-метоксибензойной кислоты. Метилиодид (2,5 мл, 40,1 ммоль) добавляли к смеси метилового эфира 5-ацетилсалициловой кислоты (5,00 г, 25,7 ммоль), карбоната натрия (7,10 г, 51,4 ммоль) и N,N-диметилформамида (25 мл) при охлаждении льдом, и смесь перемешивали при комнатной температуре в течение 3 ч. Реакционную смесь выливали в воду, нейтрализовали соляной кислотой и экстрагировали этилацетатом. Затем этилацетатный слой последовательно промывали водой и насыщенным раствором соли, сушили над безводным сульфатом натрия, и остаток, полученный путем выпаривания растворителя при пониженном давлении,промывали при суспендировании (изопропиловый эфир/н-гексан), в результате чего получали указанное в заголовке соединение (5,17 г, 96,5%) в виде белых; кристаллов. 1 Н-ЯМР(CDCl3):2,59 (3 Н, с), 3,92 (3 Н, с), 3,99 (3 Н, с), 7,04 (1 Н, д, J=8,7 Гц), 8,12 (1 Н, дд, J=8,7, 2,4 Гц), 8,41 (1 Н, д, J=2,4 Гц).(2) Метиловый эфир 5-изобутирил-2-метоксибензойной кислоты. Метилиодид (0,5 мл, 8,03 ммоль) добавляли к смеси метилового эфира 5-ацетил-2-метоксибензойной кислоты (0,50 мг, 2,40 ммоль), трет-бутоксида калия (0,81 г, 7,22 ммоль) и тетрагидрофурана(10 мл) и смесь перемешивали при комнатной температуре в течение 1 ч. Реакционную смесь выливали в воду, нейтрализовали соляной кислотой и экстрагировали этилацетатом. Затем этилацетатный слой последовательно промывали водой и насыщенным раствором соли, сушили над безводным сульфатом натрия и остаток, полученный путем выпаривания растворителя при пониженном давлении, очищали колоночной хроматографией на силикагеле (н-гексан:этилацетат=3:12:1) и получали указанное в заголовке соединение (143,1 мг, 25,2%) в виде светло-желтого масла. 1(3) 5-Изобутирил-2-метоксибензойная кислота. 2 н. Водный гидроксид натрия (1 мл) добавляли к раствору метилового эфира 5-изобутирил-2 метоксибензойной кислоты (143,1 мг, 0,60 ммоль) в метаноле (5 мл) и смесь кипятили с обратным холодильником в течение 1 ч. После охлаждения реакционной смеси до комнатной температуры ее выливали в 2 н. соляную кислоту и экстрагировали этилацетатом. Затем этилацетатный слой последовательно промывали водой и насыщенным раствором соли, сушили над безводным сульфатом натрия и выпаривали при пониженном давлении с получением указанного в заголовке соединения (134 мг, количественный выход) в виде белых кристаллов. 1(4) 5-Изобутирил-N-[3,5-бис(трифторметил)фенил]-2-метоксибензамид. С использованием 5-изобутирил-2-метоксибензойной кислоты и 3,5-бис(трифторметил)анилина в качестве исходных соединений проводили процедуру, описанную в примере 3, в результате чего получали указанное в заголовке соединение. Выход: 61,4%. 1 Н-ЯМР(CDCl3):1,23 (6 Н, д, J=6,9 Гц), 3,64 (1 Н, м), 4,20 (3 Н, с), 7,18 (1 Н, д, J=8,7 Гц), 7,65 (1 Н, с),8,19 (2 Н, с), 8,22 (1 Н, дд, J=8,7, 2,1 Гц), 8,88 (1 Н, д, J=2,1 Гц), 9,98 (1 Н, с).(5) N-[3,5-бис(Трифторметил)фенил]-2-гидрокси-5-изобутирилбензамид (соединение 24). Смесь 5-изобутирил-N-[3,5-бис(трифторметил)фенил]-2-метоксибензамида (143,4 мг, 0,33 ммоль),2,4,6-коллидина (3 мл) и иодида лития (53,1 мг, 0,40 ммоль) кипятили с обратным холодильником в течение 1 ч. После охлаждения реакционной смеси до комнатной температуры ее выливали в 2 н. соляную кислоту и экстрагировали этилацетатом. Затем этилацетатный слой последовательно промывали насыщенным раствором соли, сушили над безводным сульфатом натрия и остаток, полученный путем выпаривания растворителя при пониженном давлении, очищали колоночной хроматографией на силикагеле(н-гексан:этилацетат=3:1) и кристаллизовали из смеси этилацетат/изопропиловый эфир с получением указанного в заголовке соединения (90,3 мг, 65,3%) в виде белых кристаллов. 1 Н-ЯМР(ДМСО-d6):1,12 (6 Н, д, J=6, 9 Гц), 3,66 (1 Н, м), 7,12 (1 Н, д, J=8,4 Гц), 7,85 (1 Н, с), 8,07(1 Н, дд, J=8,4, 2,4 Гц), 8,45 (1 Н, д, J=2,4 Гц), 8,47 (2 Н, с), 10,93 (1 Н, с), 11,95 (1 Н, ушир.с). Пример 35. Получение соединения 35. С использованием 1-метилового эфира 4-гидроксиизофталевой кислоты и 3,5-бис(трифторметил) анилина в качестве исходных соединений проводили процедуру, описанную в примере 3, в результате чего получали указанное в заголовке соединение. Выход: 91,5%. 1 Н-ЯМР(ДМСО-d6):3,85 (3 Н, с), 7,12 (1 Н, д, J=8,4 Гц), 7,86 (1 Н, с), 8,02 (1 Н, дд, J=8,7, 2,4 Гц),8,46-8,47 (3 Н, м), 10,96 (1 Н, с), 12,03 (1 Н, ушир.с).[1-метиловый эфир 4-гидроксиизофталевой кислоты: см. "Journal of the Chemical Society" (England),1956, p.3099-3107]. Пример 36. Получение соединения 36. 2 н. водный гидроксид натрия (14 мл) добавляли к суспензии метилового эфира N-[3,5-бис(трифторметил)фенил]-2-гидроксиизофталевой кислоты (соединения 35; 2,85 мг, 7 ммоль) в смешанном растворителе метанола/тетрагидрофурана (14 мл + 14 мл) и смесь кипятили с обратным холодильником в течение 2 ч. После охлаждения реакционной смеси до комнатной температуры ее добавляли в 2 н. соляную кислоту (20 мл) и образовавшееся твердое вещество фильтровали, промывали водой, сушили и получали указанное в заголовке соединение (2,68 г, 97,4%) в виде белых кристаллов. 1 Н-ЯМР(ДМСО-d6) :7,10 (1 Н, д, J=8,7 Гц), 7,82 (1 Н, с), 7,86 (1 Н, с), 8,01 (1 Н, дд, J=8,7, 2,4 Гц),8,47 (2 Н, с), 8,48 (1 Н, д, J=2,4 Гц), 10,97 (1 Н, с), 11,98 (1 Н, ушир.с). Если соединения нижеследующих примеров получали способом, описанным в примере 36, то в качестве основания использовали неорганические основания, такие как гидроксид натрия, карбонат калия или т.п. В качестве реакционного растворителя использовали воду, метанол, этанол, тетрагидрофуран или т.п., взятые отдельно или в виде смеси. Пример 37. Получение соединения 37. С использованием 4-гидроксиизофталевой кислоты (182 мг, 1 ммоль), 3,5-бис(трифторметил)анилина (687 мг, 3 ммоль), трихлорида фосфора (87 мкл, 1 ммоль) и толуола (10 мл) проводили процедуру,описанную в примере 3, в результате чего получали указанное в заголовке соединение (151 мг, 25,0%) в виде белых кристаллов. 1 Н-ЯМР(ДМСО-d6):7,18 (1 Н, д, J=8,7 Гц), 7,82 (1 Н, с), 7,86 (1 Н, с), 8,11 (1 Н, дд, J=8,7, 2,4 Гц),8,50 (2 Н, с), 8,54 (2 Н, с), 8,56 (1 Н, д, J=2,4 Гц), 10,79 (1 Н, с), 10,99 (1 Н, с), 11,84 (1 Н, ушир.с). Пример 38. Получение соединения 38.(1) Метиловый эфир 4-бензилокси-N-[3,5-бис(трифторметил)фенил]изофталамовой кислоты. Раствор метилового эфира N-[3,5-бис(трифторметил)фенил]-4-гидроксиизофталамовой кислоты(соединения 35; 8,15 г, 20 ммоль) в N,N-диметилформамиде (100 мл) добавляли к суспензии гидрид натрия (60%, 1,04 г, 26 ммоль) в N,N-диметилформамиде (100 мл) при охлаждении льдом и смесь перемешивали при комнатной температуре в течение 1 ч. Затем добавляли раствор бензилбромида (4,45 г, 26 ммоль) в N,N-диметилформамиде (10 мл) и смесь перемешивали при 60 С в течение 3 ч. После охлаждения реакционной смеси до комнатной температуры ее выливали в воду со льдом и экстрагировали этилацетатом. Затем этилацетатный слой последовательно промывали водой и насыщенным раствором соли,сушили над безводным сульфатом магния и остаток, полученный путем выпаривания растворителя при пониженном давлении, перекристаллизовывали из смеси этилацетата/н-гексан, в результате чего получали указанное в заголовке соединение (5,38 г, 54,1%) в виде белого твердого вещества. 1 Н-ЯМР(ДМСО-d6) :3,87 (3 Н, с), 5,33 (2 Н, с), 7,33-7,36 (3 Н, м), 7,46 (1 Н, д, J=8,7 Гц), 7,53-7,56(2) 4-Бензилокси-N-[3, 5-бис (трифторметил) фенил] -2-гидроксиизофталамовая кислота. С использованием метилового эфира 4-бензилокси-N-[3,5-бис-(трифторметил)фенил]изофталамо- 24010835 вой кислоты в качестве исходного соединения проводили процедуру, описанную в примере 36, в результате чего получали указанное в заголовке соединение. Выход: 79,7%. 1 Н-ЯМР(ДМСО-d6):5,32 (2 Н, с), 7,32-7,34 (3 Н, м), 7,43 (1 Н, д, J=8,7 Гц), 7,52-7,56 (2 Н, м), 7,81(3) 4-Бензилокси-N3-[3, 5-бис(трифторметил) фенил]-N1,N1-диметилизофталамид. Гидрохлорид 1-(3-диметиламинопропил)-3-этилкарбодиимида (далее сокращенно называемый WSCHCl; 95 мг, 0,50 ммоль) добавляли к раствору 4-бензилокси-N-[3,5-бис(трифторметил)фенил] изофталамовой кислоты (242 мг, 0,50 ммоль), гидрохлорида диметиламина (41 мг, 0,50 ммоль) и триэтиламина (51 мкл, 0,50 ммоль) в тетрагидрофуране (5 мл), при охлаждении льдом, и эту смесь перемешивали при комнатной температуре в течение 3 ч. Реакционную смесь выливали в воду и экстрагировали этилацетатом. Затем этилацетатный слой последовательно промывали разбавленной соляной кислотой, водой и насыщенным раствором соли и сушили над безводным сульфатом магния, а затем остаток, полученный путем выпаривания растворителя при пониженном давлении, очищали колоночной хроматографией на силикагеле (н-гексан:этилацетат = 1:4), в результате чего получали указанное в заголовке соединение (165 мг,64,9%) в виде белого твердого вещества. 1H-ЯМР(ДМСО-d6):2,99 (6 Н, с), 5,29 (2 Н, с), 7,32-7,38 (4 Н, м), 7,52-7,56 (2 Н, м), 7,64 (1 Н, дд,J=8,7, 2,1 Гц), 7,73 (1 Н, д, J=2,1 Гц), 7,80 (1 Н, с), 8,28 (2 Н, с), 10,83 (1 Н, с). Если соединения нижеследующих примеров получали способом, описанным в примере 38(3), то в качестве основания использовали органические основания, такие как пиридин, триэтиламин или т.п. В качестве реакционного растворителя использовали дихлорметан, тетрагидрофуран или т.п., взятые отдельно или в виде смеси.(4) N3-[3,5-бис(трифторметил)фенил]-4-гидрокси-N1,N1-диметилизофталамид (соединение 38). Смесь 4-бензилокси-N3-[3, 5-бис (трифторметил) фенил] -N1,N1-диметилизофталамида (141 мг, 0,28 ммоль), 5% палладия на угле (14 мг), этанола (5 мл) и этилацетата (5 мл) перемешивали при комнатной температуре в течение 1 ч в атмосфере водорода. Реакционную смесь фильтровали и фильтрат упаривали при пониженном давлении, в результате чего получали указанное в заголовке соединение (106 мг, 91,2%) в виде белого твердого вещества. 1 Н-ЯМР(ДМСО-d6):2,98 (6 Н, с), 7,02 (1 Н, д, J=8,7 Гц), 7,52 (1 Н, дд, J=8,7, 2,1 Гц), 7,84 (1 Н, с),7,95 (1 Н, д, J=2,1 Гц), 8,46 (2 Н, с), 11,10 (1 Н, ушир.с), 11,63 (1 Н, ушир.с). Пример 39. Получение соединения 39.(1) 2-Бензилокси-N-[3,5-бис(трифторметил)фенил]-5-(пиперидин-1-карбонил)бензамид. С использованием 4-бензилокси-N-[3,5-бис(трифторметил)фенил]изофталамовой кислоты (соединения примера 38(2 и пиперидина в качестве исходных соединений проводили процедуру, описанную в примере 38(3), в результате чего получали указанное в заголовке соединение. Выход: 56,4% 1(2) N-[3,5-бис(трифторметил)фенил]-2-гидрокси-5-(пиперидин-1-карбонил)бензамид (соединение 39). С использованием 2-бензилокси-N-[3,5-бис(трифторметил)фенил]-5-(пиперидин-1-карбонил)бензамида в качестве исходного соединения проводили процедуру, описанную в примере 38(4), в результате чего получали указанное в заголовке соединение. Выход: 96,3%, белое твердое вещество. 1 Н-ЯМР(ДМСО-d6) :1,51 (4 Н, ушир.с), 1,60-1,65 (2 Н, м), 3,47 (4 Н, ушир.с), 7,04 (1 Н, д, J=8,4 Гц),7,48 (1 Н, дд, J=8,4, 2,1 Гц), 7,85 (1 Н, с), 7,92 (1 Н, д, J=2,1 Гц), 8,46 (2 Н, с), 10,99 (1 Н, с), 11,64 (1 Н,ушир.с). Пример 40. Получение соединения 40.(1) 2-Бензилокси-5-(4-бензилпиперидин-1-карбонил)-N-[3,5-бис(трифторметил)фенил]бензамид. С использованием 4-бензилокси-N-[3,5-фенил]изофталамовой кислоты (соединения примера 38(2 и 4-бензилпиперидина в качестве исходных соединений проводили процедуру, описанную в примере 38(3), в результате чего получали указанное в заголовке соединение. Выход: 76,7%. 1(2) N-[3,5-бис(Трифторметил)фенил]-2-гидрокси-5-(4-бензилпиперидин-1-карбонил)бензамид (соединение 40). С использованием 2-бензилокси-5-(4-бензилпиперидин-1-карбонил)-N-[3,5-бис(трифторметил) фенил]бензамида в качестве исходного соединения проводили процедуру, описанную в примере 38(4), в результате чего получали указанное в заголовке соединение. Выход: 54,3%, белое твердое вещество. 1 Н-ЯМР(ДМСО-d6):1,08-1,22 (2 Н, м), 1,59-1,62 (2 Н, м), 1,77-1,80 (1 Н, м), 2,50-2,55 (2 Н, м), 2,87(1) 2-метокси-5-сульфамоилбензойная кислота. 2 н. водный гидроксид натрия (30 мл, 60 ммоль) добавляли к раствору метил-2-метокси-5 сульфамоилбензоата (4,91 г, 20 ммоль) в метаноле (30 мл) и смесь перемешивали при комнатной температуре в течение 1 ч. Реакционную смесь выливали в 2 н. соляную кислоту и образовавшееся твердое вещество фильтровали с получением указанного в заголовке соединения (455 г, 98,3%) в виде белого твердого вещества. 1 Н-ЯМР(ДМСО-d6):3,89 (3 Н, с), 7,30 (1 Н, д, J=8,7 Гц), 7,32 (2 Н, с), 7,92 (1 Н, дд, J=8,7, 2,7 Гц),8,09 (1 Н, д, J=2,7 Гц), 13,03 (1 Н, ушир.).(2) N-[3,5-бис(Трифторметил)фенил]-2-метокси-5-сульфамоилбензамид. С использованием 2-метокси-5-сульфамоилбензойной кислоты и 3,5-бис(трифторметил)анилина в качестве исходных соединений проводили процедуру, описанную в примере 12(3), в результате чего получали указанное в заголовке соединение. Выход: 24,2%. 1 Н-ЯМР(ДМСО-d6):3,97 (3 Н, с), 7,38 (2 Н, с), 7,39 (1 Н, д, J=8,7 Гц), 7,85 (1 Н, с), 7,96 (1 Н, дд, J=8,7,2,4 Гц), 8,06 (1 Н, д, J=2,4 Гц), 8,43 (2 Н, с), 10,87 (1 Н, с).(3) N-[3,5-бис(Трифторметил)фенил]-5-диметилсульфамоил-2-метоксибензамид. Суспензию N-[3,5-бис(трифторметил)фенил]-2-метокси-5-сульфамоилбензамида (442 мг, 1,0 ммоль), метилиодида (710 мг, 5,0 ммоль), карбоната натрия (415 мг, 3,0 ммоль) и ацетонитрила (10 мл) кипятили с обратным холодильником в течение 3 ч. После охлаждения реакционной смеси до комнатной температуры ее выливали в воду и экстрагировали этилацетатом. Затем этилацетатный слой последовательно промывали водой и насыщенным раствором соли, сушили над безводным сульфатом магния и остаток, полученный путем выпаривания растворителя при пониженном давлении, перекристаллизовывали из смеси н-гексан/этилацетат, в результате чего получали указанное в заголовке соединение (207 мг,44,1%) в виде белого твердого вещества. 1(4) N-[3,5-бис(Трифторметил)фенил]-5-диметилсульфамоил-2-гидроксибензамид (соединение 41) С использованием N-[3,5-бис(трифторметил)фенил]-5-диметилсульфамоил-2-метоксибензамида в качестве исходного соединения проводили процедуру, описанную в примере 34(5), в результате чего получали указанное в заголовке соединение. Выход: 45,5%. 1(1) N-[3,5-бис(трифторметил)фенил]-2-метокси-5-(пиррол-1-сульфонил)бензамид. Смесь N-[3,5-бис(трифторметил)фенил]-2-метокси-5-сульфамоилбензамида (соединения примера 41(2); 442 мг, 1 ммоль), 2,5-диметокситетрагидрофурана (159 мг, 1,2 ммоль) и уксусной кислоты (5 мл) кипятили с обратным холодильником в течение 2 ч. После охлаждения реакционной смеси до комнатной температуры ее выливали в воду и экстрагировали этилацетатом. Затем этилацетатный слой последовательно промывали водой, насыщенным водным бикарбонатом натрия и насыщенным раствором соли,сушили над безводным сульфатом магния и остаток, полученный путем выпаривания растворителя при пониженном давлении, очищали хроматографией на силикагеле (н-гексан:этилацетат = 3:2), в результате чего получали указанное в заголовке соединение (436,5 мг, 88,6%) в виде белого твердого вещества. 1 Н-ЯМР(ДМСО-d6) :3,96 (3 Н, с), 6,36 (2 Н, дд, J=2,4, 2,1 Гц), 7,37 (2 Н, дд, J=2,4, 2,1 Гц), 7,42 (1 Н,д, J=9,0 Гц), 7,85 (1 Н, с), 8,80 (1 Н, дд, J=9,0, 2,4 Гц), 8,18 (1 Н, д, J=2,7 Гц), 8,38 (2 Н, с), 10,92 (1 Н, с).(2) N-[3,5-бис(трифторметил)фенил]-2-гидрокси-5-(пиррол-1-сульфонил)бензамид (соединение 42). С использованием N-[3,5-бис(трифторметил)фенил]-2-метокси-5-(пиррол-1-сульфонил)бензамида в качестве исходного соединения проводили процедуру, описанную в примере 34(5), в результате чего получали указанное в заголовке соединение. Выход: 79,4%. 1 Н-ЯМР(ДМСО-d6):6,36 (2 Н, дд, J=2,4, 2,1 Гц), 7,18 (1 Н, д, J=9,0 Гц), 7,34 (2 Н, дд, J=2,4, 2,1 Гц),7,86 (1 Н, с), 7,99 (1 Н, дд, J=9,0, 2,7 Гц), 8,31 (1 Н, д, J=2,7 Гц), 8,42 (2 Н, с), 10,98 (1 Н, с). Пример 43. Получение соединения 43. С использованием N-[3,5-бис(трифторметил)фенил]-2-гидрокси-5-нитробензамида (соединения 8) в качестве исходного соединения проводили процедуру, описанную в примере 38(4), в результате чего получали указанное в заголовке соединение. Выход: 98,0%. 1 Н-ЯМР(ДМСО-d6):4,79 (2 Н, ушир.с), 6,76 (1 Н, д, J=2,1 Гц), 6,76 (1 Н, с), 7,09 (1 Н, дд, J=2,1, 1,2 Гц), 7,80 (1 Н, с), 8,45 (2 Н, с), 10,30 (1 Н, ушир.), 10,84 (1 Н, с). Пример 44. Получение соединения 44. С использованием 5-диметиламиносалициловой кислоты и 3,5-бис(трифторметил)анилина в каче- 26010835 стве исходных соединений проводили процедуру, описанную в примере 3, в результате чего получали указанное в заголовке соединение. Выход: 28,8%. 1(10 мл) при охлаждении льдом и смесь перемешивали в течение 1 ч. Реакционную смесь выливали в воду и экстрагировали этилацетатом. Затем этилацетатный слой последовательно промывали водой и насыщенным раствором соли, сушили над безводным сульфатом магния и остаток, полученный путем выпаривания растворителя при пониженном давлении, очищали колоночной хроматографией на силикагеле(н-гексан:этилацетат = 4:2), в результате чего получали указанное в заголовке соединение (121 мг, 25,7%) в виде белого твердого вещества. 1H-ЯМР(ДМСО-d6):7,04 (1 Н, д, J=8,7 Гц), 7,51-7,62 (3 Н, м), 7,81 (1 Н, дд, J=8,7, 2,4 Гц), 7,83 (1 Н,с), 7,98 (2 Н, д, J=7,2 Гц), 8,22 (1 Н, д, J=2,4 Гц), 8,49 (2 Н, с), 10,27 (1 Н, с), 10,89 (1 Н, с), 11,07 (1 Н, с). Пример 46. Получение соединения 46. 4-диметиламинопиридин (3 мг) и фенилизоцианат (30 мкл, 0,28 ммоль) добавляли к раствору 5 амино-N-[3,5-бис(трифторметил)фенил]-2-гидроксибензамида (соединение 43; 100,2 мг, 0,28 ммоль) в ацетонитриле (4 мл) и смесь перемешивали при 60 С в течение 5 мин. После охлаждения реакционной смеси до комнатной температуры остаток, полученный путем выпаривания растворителя при пониженном давлении, очищали колоночной хроматографией на силикагеле (н-гексан:этилацетат = 1:1), в результате чего получали указанное в заголовке соединение (54,8 мг, 41,2%) в виде светло-коричневого твердого вещества. 1 Н-ЯМР(ДМСО-d6) :6,93-6,98 (1 Н, м), 6,97 (1 Н, д, J=9,3 Гц),7,27 (2 Н, т, J=7,8 Гц), 7,34-7,46 (2 Н,м), 7,50 (1 Н, дд, J=9,0, 2,4 Гц), 7,83 (1 Н, с), 7,88 (1 Н, с), 8,47 (2 Н, с), 8,56 (1 Н, с), 8,63 (1 Н, с), 10,87 (1 Н,с), 10,89 (1 Н, с). Пример 47. Получение соединения 47. С использованием 5-амино-N-[3,5-бис(трифторметил)фенил]-2-гидроксибензамида (соединения 43) и фенилизотиоцианата в качестве исходных соединений проводили процедуру, описанную в примере 46, в результате чего получали указанное в заголовке соединение. Выход: 66,3%. 1 Н-ЯМР(ДМСО-d6):7,00 (1 Н, д, J=8,4 Гц), 7,13 (1 Н, тт, J=7,5, 1,2 Гц),7,34 (2 Н, т, J=7,8 Гц), 7,457,51 (3 Н, м), 7,84 (1 Н, с), 7,87 (1 Н, д, J=2,7 Гц), 8,47 (2 Н, с), 9,65 (1 Н, с), 9,74 (1 Н, с), 10,84 (1 Н, с), 11,32(1 Н, с). Пример 48. Получение соединения 48. С использованием 5-[(4-нитрофенил)диазенил]салициловой кислоты и 3,5-бис(трифторметил)анилина в качестве исходных соединений проводили процедуру, описанную в примере 3, в результате чего получали указанное в заголовке соединение. Выход: 11,3%. 1 Н-ЯМР(ДМСО-d6) :7,23 (1 Н, д, J=9,0 Гц), 7,87 (1 Н, с), 8,06 (2 Н, д, J=9,0 Гц), 8,10 (1 Н, дд, J=9,0,2,4 Гц), 8,44 (2 Н, д, J=9,0 Гц), 8,50 (2 Н, с), 8,53 (1 Н, д, J=2,4 Гц), 11,13 (1 Н, с), 12,14 (1 Н, ушир.). Пример 49. Получение соединения 49. С использованием 5-([(4-пиридин-2-ил)сульфамоил]фенилдиазенил)салициловой кислоты и 3,5 бис(трифторметил)анилина в качестве исходных соединений проводили процедуру, описанную в примере 3, в результате чего получали указанное в заголовке соединение. Выход: 7,9%. 1(1) 4-Ацетиламино-5-хлор-2-метоксибензойная кислота. С использованием метилового эфира 4-ацетиламино-5-хлор-2-метоксибензойной кислоты в качестве исходного соединения проводили процедуру, описанную в примере 36, в результате чего получали указанное в заголовке соединение. Выход: 88,0%. 1(2) 4-Ацетиламино-N-[3,5-бис(трифторметил)фенил]-5-хлор-2-метоксибензамид. С использованием 4-ацетиламино-5-хлор-2-метоксибензойной кислоты и 3,5-бис(трифторметил) анилина в качестве исходных соединений проводили процедуру, описанную в примере 12(3), в результате чего получали указанное в заголовке соединение. Выход: 23,8% 1- 27010835 качестве исходного соединения проводили процедуру, описанную в примере 34(5), в результате чего получали указанное в заголовке соединение. Выход: 72,8% 1 Н-ЯМР(ДМСО-d6):2,17 (3 Н, с), 7,75 (1 Н, с), 7,82 (1 Н, с), 7,95 (1 Н, с), 8,44 (2 Н, с), 9,45 (1 Н, с),11,16 (1 Н, ушир.с), 11,63 (1 Н, ушир.с). Пример 51. Получение соединения 51. С использованием 4-хлорсалициловой кислоты и 3,5-бис(трифторметил)анилина в качестве исходных соединений проводили процедуру, описанную в примере 3, в результате чего получали указанное в заголовке соединение. Выход: 55,8% 1 Н-ЯМР(ДМСО-d6):7,05-7,08 (2 Н, м), 7,84-7,87 (2 Н, м), 8,45 (2 Н, с), 10,84 (1 Н, с), 11,64 (1 Н,ушир.с). Пример 52. Получение соединения 52. С использованием 6-гидроксисалициловой кислоты и 3,5-бис(трифторметил)анилина в качестве исходных соединений проводили процедуру, описанную в примере 3, в результате чего получали указанное в заголовке соединение. Выход: 86,9%. 1(2 Н, ушир. с), 11,96 (1 Н, ушир.с). Пример 53. Получение соединения 53. С использованием 4-метилсалициловой кислоты и 3,5-бис(трифторметил)анилина в качестве исходных соединений проводили процедуру, описанную в примере 3, в результате чего получали указанное в заголовке соединение. Выход: 42,9%. 1H-ЯМР(ДМСО-d6):2,32 (3 Н, с), 6,82 (1 Н, д, J=6,6 Гц), 6,84 (1 Н, с), 7,83 (1 Н, с), 7,84 (1 Н, д, J=8,5 Гц), 8,47 (2 Н, с), 10,76 (1 Н, с), 11,44 (1 Н, с). Пример 54. Получение соединения 54. С использованием 5-бром-4-гидроксисалициловой кислоты и 3,5-бис(трифторметил)анилина в качестве исходных соединений проводили процедуру, описанную в примере 3, в результате чего получали указанное в заголовке соединение. Выход: 82,4%. 1H-ЯМР(CDCl3):5,89 (1 Н, с), 6,70 (1 Н, с), 7,69 (2 Н, с), 7,95 (1 Н, с), 8,12 (2 Н, с), 11,62 (1 Н, с). Пример 55. Получение соединения 55. С использованием 4-гидроксисалициловой кислоты и 3,5-бис(трифторметил)анилина в качестве исходных соединений проводили процедуру, описанную в примере 3, в результате чего получали указанное в заголовке соединение. Выход: 29,9%. 1H-ЯМР(ДМСО-d6):6,37 (1H, д, J=2,5 Гц), 6,42 (1H, дд, J=8,8, 2,5 Гц), 7,81 (1H, с), 7,86 (1H, д,J=8,5 Гц), 8,44 (2H, с), 10,31 (1 Н, с), 10,60 (1 Н, с), 11,77 (1 Н, с). Пример 56. Получение соединения 56. С использованием 3,5-дихлорсалициловой кислоты и 3,5-бис(трифторметил)анилина в качестве исходных соединений проводили процедуру, описанную в примере 3, в результате чего получали указанное в заголовке соединение. Выход: 44,8%. 1(1 Н, с). Пример 57. Получение соединения 57. С использованием 3-гидроксисалициловой кислоты и 3,5-бис(трифторметил)анилина в качестве исходных соединений проводили процедуру, описанную в примере 3, в результате чего получали указанное в заголовке соединение. Выход: 22,7%. 1 Н-ЯМР(ДМСО-d6):6,81 (1 Н, т, J=8,0 Гц), 7,01 (1 Н, дд, J=8,0, 1,5 Гц), 7,35 (1 Н, дд, J=8,0, 1,5 Гц),7,84 (1 Н, с), 8,46 (2 Н, с), 9,56 (1 Н, с), 10,79 (1 Н, с), 10,90 (1 Н, ушир.с). Пример 58. Получение соединения 58. С использованием 3-метилсалициловой кислоты и 3,5-бис(трифторметил)анилина в качестве исходных соединений проводили процедуру, описанную в примере 3, в результате чего получали указанное в заголовке соединение. Выход: 54,9%. 1 Н-ЯМР(ДМСО-d6):2,22 (3 Н, с), 6,94 (1 Н, т, J=7,4 Гц), 7,42 (1 Н, д, J=7,4 Гц), 7,84-7,85 (2 Н, м),8,47 (2 Н, с), 10,87 (1 Н, с), 11,87 (1 Н, с). Пример 59. Получение соединения 59. С использованием 3-метоксисалициловой кислоты и 3,5-бис(трифторметил)анилина в качестве исходных соединений проводили процедуру, описанную в примере 3, в результате чего получали указанное в заголовке соединение. Выход: 34,6%. 1 Н-ЯМР(ДМСО-d6):3,85 (3 Н, с), 6,94 (1 Н, т, J=8,0 Гц), 7,20 (1 Н, дд, J=8,0, 1,4 Гц), 7,44 (1 Н, дд,J=8,0, 1,4 Гц), 7,84 (1 Н, с), 8,45 (2 Н, с), 10,82 (1 Н, с), 10,94 (1 Н, ушир.с). Пример 60. Получение соединения 60. С использованием 5-[(1,1, 3, 3-тетраметил)бутил]салициловой кислоты и 3,5-бис(трифторметил) анилина в качестве исходных соединений проводили процедуру, описанную в примере 3, в результате чего получали указанное в заголовке соединение. Выход: 64,2%. Н-ЯМР(ДМСО-d6):0,70 (9 Н, с), 1,35 (6 Н, с), 1,72 (2 Н, с), 6,95 (1 Н, д, J=8,4 Гц), 7,50 (1 Н, дд, J=8,0,2,1 Гц), 7,83 (1 Н, с), 7,84 (1 Н, д, J=2,1 Гц), 8,46 (1 Н, с), 10,77 (1 Н, с), 11,20 (1 Н, с). Пример 61. Получение соединения 61. С использованием 3,5,6-трихлорсалициловой кислоты и 3,5-бис(трифторметил)анилина в качестве исходных соединений проводили процедуру, описанную в примере 3, в результате чего получали указанное в заголовке соединение. Выход: 26,2%. 1H-ЯМР(ДМСО-d6):7,88 (1 Н, с), 7,93 (1 Н, с), 8,33 (2 Н, с), 10,88 (1 Н, с), 11,36 (1 Н, с). Пример 62. Получение соединения 62. С использованием 3,5-бис[(1,1-диметил)этил]салициловой кислоты и 3,5-бис(трифторметил) анилина в качестве исходных соединений проводили процедуру, описанную в примере 3, в результате чего получали указанное в заголовке соединение. Выход: 65,0%. 1H-ЯМР(ДМСО-d6):1,34 (9 Н, с), 1,40 (9 Н, с), 7,49 (1 Н, д, J=2,2 Гц), 7,82 (1 Н, д, J=2,2 Гц), 7,91 (1 Н,с), 8,40 (2 Н, с), 10,82 (1 Н, с), 12,44 (1 Н, с). Пример 63. Получение соединения 63. С использованием 6-фторсалициловой кислоты и 3,5-бис(трифторметил)анилина в качестве исходных соединений проводили процедуру, описанную в примере 3, в результате чего получали указанное в заголовке соединение. Выход: 35,9%. 1 Н-ЯМР(ДМСО-d6):6,73-6,82 (2 Н, м), 7,32 (1 Н, ддд, J=1,4, 8,5, 15,3 Гц), 7,83 (1 Н, с), 8,39 (2 Н, с),10,50 (1 Н, д, J=1,4 Гц), 11,11 (1 Н, с). Пример 64. Получение соединения 64. С использованием 3-хлорсалициловой кислоты и 3,5-бис(трифторметил)анилина в качестве исходных соединений проводили процедуру, описанную в примере 3, в результате чего получали указанное в заголовке соединение. Выход: 61,3%. 1H-ЯМР(ДМСО-d6):7,05 (1 Н, дд, J=7,6, 8,0 Гц), 7,69 (1 Н, дд, J=1,4, 13,3 Гц), 7,90 (1 Н, с), 7,93 (1 Н,дд, J=1,4, 8,0 Гц), 8,44 (2 Н, с), 11,01 (1 Н, с), 11,92 (1 Н, ушир.с). Пример 65. Получение соединения 65. С использованием 4-метоксисалициловой кислоты и 3,5-бис(трифторметил)анилина в качестве исходных соединений проводили процедуру, описанную в примере 3, в результате чего получали указанное в заголовке соединение. Выход: 14,2%. 1H-ЯМР(ДМСО-d6):3,81, (3 Н, с), 6,54 (1 Н, д, J=2,5 Гц), 6,61 (1 Н, дд, J=2,5, 8,8 Гц), 7,83 (1 Н, с),7,95 (1 Н, д, J=8,8 Гц), 8,45 (2 Н, с), 10,69 (1 Н, с), 11,89 (1 Н, с). Пример 66. Получение соединения 66. С использованием 6-метоксисалициловой кислоты и 3,5-бис(трифторметил)анилина в качестве исходных соединений проводили процедуру, описанную в примере 3, в результате чего получали указанное в заголовке соединение. Выход: 63,1%. 1H-ЯМР(ДМСО-d6):3,24 (3 Н, с), 6,03 (1 Н, д, J=8,0 Гц), 6,05 (1 Н, д, J=8,5 Гц), 6,71 (1 Н, дд, J=8,2,8,5 Гц), 7,25 (1 Н, с), 7,88 (2 Н, с), 9,67 (1 Н, с), 10,31 (1 Н, с). Пример 67. Получение соединения 67. С использованием 5-амино-N-[3,5-бис(трифторметил)фенил]-2-гидроксибензамида (соединения 43) и метансульфонилхлорида в качестве исходных соединений проводили процедуру, описанную в примере 45, в результате чего получали указанное в заголовке соединение. Выход: 22,6%. 1H-ЯМР(ДМСО-d6):2,93 (3 Н, с), 7,02 (1 Н, д, J=8,4 Гц), 7,31 (1 Н, дд, J=8,4, 2,7 Гц), 7,68 (1 Н, д,J=2,7 Гц), 7,83 (1 Н, с), 8,46 (2 Н, с), 9,48 (1 Н, с), 10,85 (1 Н, с), 11,15 (1 Н, с). Пример 68. Получение соединения 68. С использованием 5-амино-N-[3,5-бис(трифторметил)фенил]-2-гидроксибензамида (соединения 43) и бензолсульфонилхлорида в качестве исходных соединений проводили процедуру, описанную в примере 45, в результате чего получали указанное в заголовке соединение. Выход: 45,3%. 1(2 Н, м), 7,81 (1 Н, с), 8,42 (2 Н, с), 10,03 (1 Н, с), 10,87 (1 Н, с), 11,13 (1 Н, ушир.с). Пример 69. Получение соединения 69. С использованием 5-амино-N-[3,5-бис(трифторметил)фенил]-2-гидроксибензамида (соединения 43) и ацетилхлорида в качестве исходных соединений проводили процедуру, описанную в примере 45, в результате чего получали указанное в заголовке соединение. Выход: 44,8%. 1 Н-ЯМР(ДМСО-d6):2,02 (3 Н, с), 6,97 (1 Н, д, J=8,7 Гц), 7,61 (1 Н, дд, J=8,7, 2,7 Гц), 7,82 (1 Н, с),7,99 (1 Н, д, J=2,7 Гц), 8,46 (2 Н, с), 9,90 (1 Н, с), 10,85 (1 Н, с), 10,94 (1 Н, с). Пример 70. Получение соединения 70. С использованием N-[3,5-бис(трифторметил)фенил]-2-метокси-5-сульфамоилбензамида (соединения примера 41(2 в качестве исходного соединения проводили процедуру, описанную в примере 34(5),в результате чего получали указанное в заголовке соединение. Выход: 59,9%. 1- 29010835 Пример 71. Получение соединения 71. С использованием 1-гидроксинафталин-2-карбоновой кислоты и 3,5-бис(трифторметил)анилина в качестве исходных соединений проводили процедуру, описанную в примере 3, в результате чего получали указанное в заголовке соединение. Выход: 65,5%. 1H-ЯМР(ДМСО-d6):7,51 (1 Н, д, J=9,0 Гц), 7,60 (1 Н, тд, J=7,8, 0,9 Гц), 7,70 (1 Н, тд, J=7,8, 0,9 Гц),7,89 (1 Н, с), 7,93 (1 Н, д, J=8,4 Гц), 8,09 (1 Н, д, J=9,0 Гц), 8,33 (1 Н, д, J=8,7 Гц), 8,51 (2 Н, с), 10,92 (1 Н, с),13,36 (1 Н, с). Пример 72. Получение соединения 72. С использованием 3-гидроксинафталин-2-карбоновой кислоты и 3,5-бис(трифторметил)анилина в качестве исходных соединений проводили процедуру, описанную в примере 3, в результате чего получали указанное в заголовке соединение. Выход: 46,9%. 1 Н-ЯМР(ДМСО-d6):7,36-7,41 (2 Н, м), 7,50-7,55 (1 Н, м), 7,79 (1 Н, д, J=8,2 Гц), 7,85 (1 Н, д, J=0,6 Гц), 7,96 (1 Н, д, J=8,0 Гц), 8,51 (2 Н, с), 10,98 (1 Н, с), 11,05 (1 Н, с). С использованием 2-гидроксинафталин-1-карбоновой кислоты и 3,5-бис(трифторметил)анилина в качестве исходных соединений проводили процедуру, описанную в примере 3, в результате чего получали указанное в заголовке соединение. Выход: 30,2%. 1 Н-ЯМР(ДМСО-d6):7,27 (1 Н, д, J=8,8 Гц), 7,32-7,38 (1 Н, м), 7,45-7,50 (1 Н, м), 7,72 (1 Н, д, J=8,5 Гц), 7,82-7,93 (3 Н, м), 8,50 (1 Н, с), 10,28 (1 Н, с), 11,07 (1 Н, ушир.с). Пример 74. Получение соединения 74.(1) 4-Бром-3-гидрокситиофен-2-карбоновая кислота. Раствор метилового эфира 4-бромтиофен-2-карбоновой кислоты (500 мг, 2,1 ммоль) и гидроксида натрия (261 мг, 6,3 ммоль) в смешанном растворителе метанола/воды (2,5 мл + 2,5 мл) кипятили с обратным холодильником в течение 2 ч. После охлаждения реакционной смеси до комнатной температуры добавляли 2 н. соляную кислоту для доведения смеси до рН 1 и эту смесь разбавляли этилацетатом. Затем этилацетатный слой последовательно промывали водой и насыщенным раствором соли, сушили над безводным сульфатом натрия. Растворитель выпаривали при пониженном давлении с получением указанного в заголовке соединения (326 мг, 69,4%) в виде красно-коричневого порошка. 1 Н-ЯМР (CDCl3) : 4,05 (1 Н, ушир.с), 7,40 (1 Н, с).(2) 4-бром-3-гидрокси-N-[3,5-бис(трифторметил)фенил]тиофен-2-карбоксамид (соединение 74). С использованием 4-бром-3-гидрокситиофен-2-карбоновой кислоты и 3,5-бис(трифторметил)анилина в качестве исходных соединений проводили процедуру, описанную в примере 3, в результате чего получали указанное в заголовке соединение. Выход: 82,4%. 1H-ЯМР (CDCl3):7,42 (1 Н, с), 7,67 (1 Н, ушир.с), 7,78 (1 Н, ушир.с), 8,11 (2 Н, с), 9,91 (1 Н, ушир.с). Пример 75. Получение соединения 75. Оксихлорид фосфора (0,112 мл, 1,2 ммоль) добавляли к раствору 5-хлор-2-гидроксиникотиновой кислоты (174 мг, 1 ммоль), 3,5-бис(трифторметил)анилина (275 мг, 1,2 ммоль) и пиридина (316 мг, 4 ммоль) в тетрагидрофуране/дихлорметане (20 мл + 10 мл) и смесь перемешивали при комнатной температуре в течение 2 ч. Реакционную смесь выливали в этилацетат (100 мл) и 0,2 н. соляную кислоту (100 мл), фильтровали через целит после перемешивания в течение 30 мин, и водный слой экстрагировали этилацетатом. Затем объединенный этилацетатный слой последовательно промывали водой и насыщенным раствором соли, сушили над безводным сульфатом магния, и остаток, полученный путем выпаривания растворителя при пониженном давлении, очищали колоночной хроматографией на силикагеле (нгексан:этилацетат = 2:11:1), промывали этанолом при суспендировании и получали указанное в заголовке соединение (183 мг, 47,6%) в виде белых кристаллов. Т.пл. 270 С. 1 Н-ЯМР(ДМСО-d6):7,83 (1 Н, с), 8,15 (1 Н, д, J=3,3 Гц), 8,36 (1 Н, д, J=3,0 Гц), 8,40 (2 Н, с), 12,43(1 Н, с). Если соединения нижеследующих примеров получали способом, описанным в примере 75, то в качестве конденсирующего агента (галогенирующего кислоту агента) использовали оксихлорид фосфора. В качестве основания использовали пиридин. В качестве реакционного растворителя использовали дихлорметан, тетрагидрофуран или т.п., взятые отдельно или в виде смеси друг с другом. Пример 76. Получение соединения 76. С использованием 3-гидроксипиридин-2-карбоновой кислоты и 3,5-бис(трифторметил)анилина в качестве исходных соединений проводили процедуру, описанную в примере 75, в результате чего получали указанное в заголовке соединение. Выход: 45,0%. 1H-ЯМР (CDCl3) :7,40 (1 Н, дд, J=8,4, 1,8 Гц), 7,46 (1 Н, дд, J=8,4, 4,2 Гц), 7,68 (1 Н, с), 8,16 (1 Н, дд,J=4,2, 1,2 Гц), 8,25 (2 Н, с), 10,24 (1 Н, с), 11,42 (1 Н, с). Пример 77. Получение соединения 77. В атмосфере аргона раствор 6-хлороксииндола (184 мг, 1,1 ммоль) в тетрагидрофуране (5 мл) и триэтиламине (0,3 мл) добавляли к раствору 3,5-бис(трифторметил)фенилизоцианата (255 мг, 1,0 ммоль) в тетрагидрофуране (5 мл), и смесь перемешивали при комнатной температуре в течение 4 ч. Реакционную смесь выливали в разбавленную соляную кислоту и экстрагировали этилацетатом. Этилацетатный слой
МПК / Метки
МПК: A61K 31/404, A61K 31/18, A61K 31/381, A61K 31/426, A61K 31/437, A61K 31/422, A61K 31/4164, A61K 31/167, A61K 31/421, A61K 31/40, A61K 31/4402
Метки: лекарственное, рака, лечения, средство
Код ссылки
<a href="https://eas.patents.su/30-10835-lekarstvennoe-sredstvo-dlya-lecheniya-raka.html" rel="bookmark" title="База патентов Евразийского Союза">Лекарственное средство для лечения рака</a>
Предыдущий патент: Пиридилзамещённые порфириновые соединения и способы их применения
Следующий патент: Способ ферментации плазмидной днк
Случайный патент: Производные хинолилпропилпиперидина и их применение в качестве антимикробных средств












