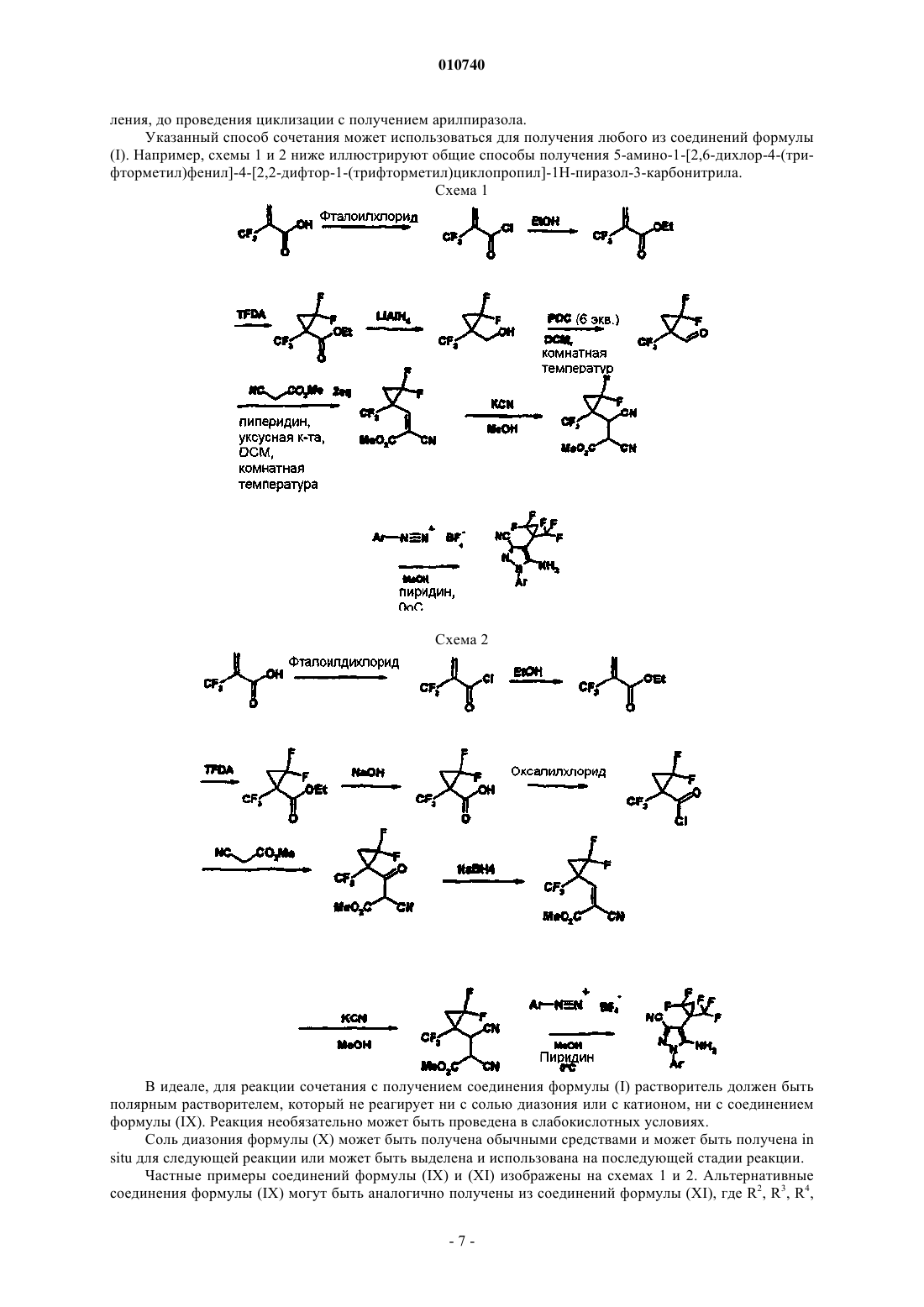
Замещённые арилпиразолы в качестве противопаразитарных средств
Номер патента: 10740
Опубликовано: 30.10.2008
Авторы: Робертс Ли Ричард, Гетин Дэвид Моррис, Уолш Найджел Дерек Артур, Чубб Натан Энтони Логан, Холл Ким Томас, Биллен Денис
Формула / Реферат
1. Производное 1-арил-4-циклопропилпиразола формулы (I)
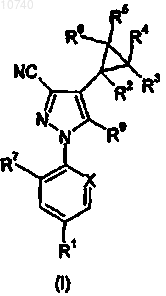
в которой
R1 означает CF3, OCF2H, OCF3, -SCF3, -SO2CF3 или SF5;
R2 означает Н, фтор или С1-4алкил, необязательно замещенный 1-3 атомами галогена, независимо выбранными из хлора и фтора;
R3, R4, R5 и R6 независимо означают Н, хлор или фтор;
R7 означает Cl или фтор;
X означает CR8 или N, где R8 означает Cl или фтор; и
R9 означает NRaRb;
Ra выбран из водорода, C1-6алкила, С(О)OC1-6алкила, где каждая из указанных групп может включать один или два необязательных заместителя, независимо выбранных, где химически возможно, из галогена, het или диС1-6алкиламино;
Rb выбран из водорода, C1-6алкила, С(О)OC1-6алкила, где каждая из указанных групп может включать один или два необязательных заместителя, независимо выбранных, где химически возможно, из галогена или диС1-6алкиламино;
или Ra и Rb вместе с атомом N, к которому они присоединены, могут образовывать 5-членное гетероциклическое кольцо, содержащее дополнительно атом О, где указанное гетероциклическое кольцо может нести заместитель оксогруппу; и
het представляет собой 5-6-членную гетероциклическую группу, которая является ароматической или неароматической и которая содержит 1 или 2 гетероатома азота;
или его фармацевтически приемлемая соль;
при условии, что по меньшей мере один из R2, R3, R4, R5 или R6 является фтором.
2. Соединение по п.1, где R1 означает CF3 или SF5.
3. Соединение по п.1 или 2, где R2 означает F, CF3 или CHF2.
4. Соединение по любому из пп.1-3, где R3 и R4, оба означают фтор и R5 и R6 означают водород.
5. Соединение по любому из пп.1-4, где R2 означает CF3, R3 и R4, оба означают фтор и R5 и R6 означают водород.
6. Соединение по любому из пп.1-5, где X означает CR8 и R7 и R8, оба означают хлор.
7. Соединение по любому из пп.1-6, где R9 выбран из NH2, C1-6алкоксикарбониламино, с необязательным замещением в алкильной части 1 или 2 группами, выбранными из атома фтора, диС1-6алкиламино и het, C1-6алкиламино, с необязательным замещением в алкильной группе 1 или 2 группами, выбранными из атома фтора, и het.
8. Соединение по любому из пп.1-7, где R9 означает NH2.
9. Соединение, выбранное из следующих соединений, включающих
5-амино-1-[2,6-дихлор-4-пентафтортиофенил]-4-[2,2-дифтор-1-(трифторметил)циклопропил]-1Н-пиразол-3-карбонитрил;
5-амино-1-[2,6-дихлор-4-(трифторметил)фенил]-4-[2,2-дифтор-1-(трифторметил)циклопропил]-1Н-пиразол-3-карбонитрил;
5-амино-1-[2,6-дихлор-4-(трифторметил)фенил]-4-(1,2,2-трифторциклопропил)-1Н-пиразол-3-карбонитрил;
5-амино-1-[2,6-дихлор-4-(трифторметил)фенил]-4-(пентафторциклопропил)-1Н-пиразол-3-карбонитрил;
5-амино-4-(2,2-дихлор-1-фторциклопропил)-1-[2,6-дихлор-4-(трифторметил)фенил]-1Н-пиразол-3-карбонитрил;
5-амино-1-[2,6-дихлор-4-пентафтортиофенил]-4-(пентафторциклопропил)-1Н-пиразол-3-карбонитрил;
5-амино-1-[2,6-дихлор-4-пентафтортиофенил]-4-(1,2,2-трифторциклопропил)-1Н-пиразол-3-карбонитрил;
5-амино-1-[2,6-дихлор-4-(трифторметил)фенил]-4-[1-(дифторметил)-2,2-дифторциклопропил]-1Н-пиразол-3-карбонитрил;
5-амино-1-[2,6-дихлор-4-(трифторметил)фенил]-4-(2,2-дифторциклопропил)-1Н-пиразол-3-карбонитрил;
5-амино-4-[2,2-дифтор-1-(трифторметил)циклопропил]-1-[2,6-дифтор-4-(трифторметил)фенил]-1Н-пиразол-3-карбонитрил;
5-амино-1-[2,6-дихлор-4-пентафтортиофенил]-4-[1-(дифторметил)-2,2-дифторциклопропил]-1Н-пиразол-3-карбонитрил;
5-амино-4-{1-[хлор(фтор)метил]-2,2-дифторциклопропил}-1-[2,6-дихлор-4-(трифторметил)фенил]-1Н-пиразол-3-карбонитрил;
5-амино-1-[2,6-дихлор-4-(трифторметил)фенил]-4-[1-(дифторметил)-2,2,3,3-тетрафторциклопропил]-1Н-пиразол-3-карбонитрил;
5-амино-1-[2,6-дихлор-4-(трифторметил)фенил]-4-[2,2,3,3-тетрафтор-1-(трифторметил)циклопропил]-1Н-пиразол-3-карбонитрил;
1-[2,6-дихлор-4-(трифторметил)фенил]-4-[2,2-дифтор-1-(трифторметил)циклопропил]-5-(метиламино)-1Н-пиразол-3-карбонитрил;
5-амино-1-[2,6-дихлор-4-(трифторметокси)фенил]-4-[2,2-дифтор-1-(трифторметил)циклопропил]-1Н-пиразол-3-карбонитрил;
5-амино-1-[2,6-дихлор-4-(трифторметокси)фенил]-4-[1-(дифторметил)-2,2,3,3-тетрафторциклопропил]-1Н-пиразол-3-карбонитрил;
5-амино-1-[2,6-дихлор-4-(трифторметокси)фенил]-4-[1-(дифторметил)-2,2-дифторциклопропил]-1Н-пиразол-3-карбонитрил;
5-амино-1-[2,6-дихлор-4-(трифторметил)фенил]-4-[2,2-дифтор-1-(фторметил)циклопропил]-1Н-пиразол-3-карбонитрил;
5-амино-1-[2,6-дихлор-4-(трифторметил)фенил]-4-(2,2-дифтор-1-метилциклопропил)-1Н-пиразол-3-карбонитрил;
5-амино-1-{2,6-дихлор-4-[(трифторметил)тио]фенил}-4-[2,2-дифтор-1-(трифторметил)циклопропил]-1Н-пиразол-3-карбонитрил;
3-циано-1-[2,6-дихлор-4-(трифторметил)фенил]-4-[2,2-дифтор-1-(трифторметил)циклопропил]-1Н-пиразол-5-илэтилкарбамат;
1-[2,6-дихлор-4-(трифторметил)фенил]-4-[2,2-дифтор-1-(трифторметил)циклопропил]-5-(2-оксо-1,3-оксазолидин-3-ил)-1Н-пиразол-3-карбонитрил;
5-амино-1-[3-хлор-5-(трифторметил)пиридин-2-ил]-4-[2,2-дифтор-1-(трифторметил)циклопропил]-1Н-пиразол-3-карбонитрил;
3-циано-1-[2,6-дихлор-4-(трифторметил)фенил]-4-[2,2-дифтор-1-(трифторметил)циклопропил]-1Н-пиразол-5-ил-2-(диметиламино)этилкарбамат;
3-циано-1-[2,6-дихлор-4-(трифторметил)фенил]-4-[2,2-дифтор-1-(трифторметил)циклопропил]-1Н-пиразол-5-ил-2,2,2-трифторэтилкарбамат;
5-амино-1-{2,6-дихлор-4-[(трифторметил)сульфонил]фенил}-4-[2,2-дифтор-1-(трифторметил)циклопропил]-1Н-пиразол-3-карбонитрил;
1-[2,6-дихлор-4-(трифторметил)фенил]-4-[2,2-дифтор-1-(трифторметил)циклопропил]-5-[(пиридин-4-илметил)амино]-1Н-пиразол-3-карбонитрил;
5-амино-1-[2,6-дихлор-4-(дифторметокси)фенил]-4-[2,2-дифтор-1-(трифторметил)циклопропил]-1Н-пиразол-3-карбонитрил;
5-амино-1-[2,6-дихлор-4-пентафтортиофенил]-4-[1-(дифторметил)-2,2,3,3-тетрафторциклопропил]-1Н-пиразол-3-карбонитрил;
3-циано-1-[2,6-дихлор-4-(трифторметил)фенил]-4-[2,2-дифтор-1-(трифторметил)циклопропил]-1Н-пиразол-5-ил-изопропилкарбамат;
3-циано-1-[2,6-дихлор-4-(трифторметил)фенил]-4-[2,2-дифтор-1-(трифторметил)циклопропил]-1Н-пиразол-5-илпиридин-4-илметилкарбамат;
3-циано-1-[2,6-дихлор-4-(трифторметил)фенил]-4-[2,2-дифтор-1-(трифторметил)циклопропил]-1Н-пиразол-5-ил]пиридин-3-илметилкарбамат;
3-циано-1-[2,6-дихлор-4-(трифторметил)фенил]-4-[2,2-дифтор-1-(трифторметил)циклопропил]-1Н-пиразол-5-илпиридин-2-илметилкарбамат;
3-циано-1-[2,6-дихлор-4-(трифторметил)фенил]-4-[2,2-дифтор-1-(трифторметил)циклопропил]-1Н-пиразол-5-ил-1Н-имидазол-5-илметилкарбамат;
3-циано-1-[2,6-дихлор-4-(трифторметил)фенил]-4-[2,2-дифтор-1-(трифторметил)циклопропил]-1Н-пиразол-5-ил-2-пирролидин-1-илэтилкарбамат и
5-амино-4-{1-[хлор(дифтор)метил]-2,2-дифторциклопропил}-1-[2,6-дихлор-4-(трифторметил)фенил]-1Н-пиразол-3-карбонитрил
или его фармацевтически приемлемую соль.
10. Фармацевтическая или ветеринарная композиция, содержащая соединение формулы (I) или его фармацевтически приемлемую соль и подходящий эксципиент или носитель.
11. Применение соединения формулы (I) или его фармацевтически приемлемой соли в получении противопаразитарного лекарственного средства для человека или животного.
Текст
010740 Настоящее изобретение относится к пиразольным производным, обладающим противопаразитарными свойствами. Соединения изобретения представляют собой фторированные циклопропиларилпиразолы, и более конкретно изобретение относится к 1-арил-4-циклопропилпиразолам, где имеется по меньшей мере один фтор, присоединенный к циклопропильному кольцу. В международной заявке на патент WO9824767, европейской заявке на патент ЕР 933363 и ЕР 957094 описаны 4-циклопропиларилпиразолы, обладающие противопаразитарной активностью для борьбы с членистоногими. Соединения из уровня техники не всегда демонстрируют хорошую активность или длинную продолжительность действия против паразитов. Точно так же некоторые противопаразитарные средства пригодны только для узкого спектра паразитов. Задача настоящего изобретения состоит в том, чтобы преодолеть различные недостатки или улучшить свойства соединений из уровня техники. Таким образом, целью изобретения является получение арилпиразола, обладающего улучшенной активностью по сравнению с соединениями из уровня техники в отношении паразитов. Соединения изобретения имеют особенно хорошую способность в отношении борьбы с широким спектром членистоногих, как показано результатами тестов, демонстрирующих их потенциал и эффективность. В частности, соединения согласно настоящему изобретению значительно более активны против блох, чем подобные соединения из уровня техники. Другой целью изобретения является получение соединений с большой продолжительностью действия. Наиболее предпочтительно соединения управляют инвазией членистоногих в течение по меньшей мере 28 дней. Увеличенная продолжительность действия, вообще, приписывается расширенному периоду полужизни соединения in vivo в организме млекопитающего. Также желательно, чтобы соединения согласно настоящему изобретению имели улучшенный фармакокинетический профиль, улучшенную безопасность, улучшенную стабильность и улучшенную растворимость. Таким образом, согласно настоящему изобретению предложено соединение формулы (I)R2 означает Н, фтор или С 1-4 алкил, необязательно замещенный 1-5 атомами галогена, независимо выбранными из хлора и фтора;Ra выбран из водорода, C1-6 алкила, С(О)OC1-6 алкила, где каждая из указанных групп может включать один или несколько необязательных заместителей, независимо выбранных, где химически возможно, из галогена, het и диС 1-6 алкиламино;Rb выбран из водорода, С 1-6 алкила и C(O)OC1-6 алкила, где каждая из указанных групп может включать один или несколько необязательных заместителей, независимо выбранных, где химически возможно, из галогена и диС 1-6 алкиламино; или Ra и Rb вместе с атомом N, к которому они присоединены, могут образовывать 5-членное гетероциклическое кольцо, содержащее дополнительно О, где указанное гетероциклическое кольцо может нести один или несколько необязательных заместителей, выбранных из оксогруппы; иhet представляет собой 5-6-членную гетероциклическую группу, которая является ароматической или неароматической и которая содержит 1 или 2 гетероатомов, выбранных из азота; или его фармацевтически приемлемая соль; при условии, что по меньшей мере один из R2, R3, R4, R5 или R6 является фтором. В соединениях согласно формуле (I) С 1-6 галогеналкил или С 1-6 галогеналкокси означает С 1-6 алкил или С 1-6 алкокси, замещенный 1-5 атомами хлора или фтора, выбранными независимо. Кроме того, "галоген" означает группу, выбранную из фтора, брома, хлора, брома или йода. Предпочтительно R1 означает CF3 или SF5, предпочтительно CF3.-1 010740 Предпочтительно R2 означает CF3 или CHF2, предпочтительно CF3. В альтернативном предпочтительном варианте осуществления R2 означает фтор. Предпочтительно R3, R4, R5 и R6 независимо означают Н или фтор. Предпочтительно R2 означает CF3 и R3, R4, R5 и R6 независимо представляют собой 2, 3 или 4 атома фтора, более предпочтительно 2 атома фтора, наиболее предпочтительно R3 и R4 и R5 и R6 означают Н. Аналогично предпочтительно R2 означает CHF2 и R3, R4, R5 и R6 независимо представляют собой 2,3 или 4 атома фтора, более предпочтительно 2 атома фтора, наиболее предпочтительно R3 и R4 и R5 и R6 означают Н. Аналогично предпочтительно R2 означает фтор и R3, R4, R5 и R6 независимо представляют собой 2,3 или 4 атома фтора, более предпочтительно R3 и R4, оба являются фтором и R5 и R6 означают Н или всеR3, R4, R5 и R6 означают фтор. Предпочтительно X означает CR8. Более предпочтительно R8 означает хлор. Другие предпочтительные соединения представляют собой соединения, где R7 и R8 являются одинаковыми. Более предпочтительно R7 и R8 означают Cl. Предпочтительно Ra означает C(O)OC1-6 алкил, например этил, пропил или изопропил, с необязательным заместителем, выбранным из 1-5 групп атомов фтора, например, с образованием 2,2,2-трифторэтила, диС 1-6 алкиламино, например диметиламино, и het, например пирролидинила, пиридила и имидазолила. Более предпочтительно Ra означает этоксикарбонил, диметиламиноэтоксикарбонил, 2,2,2-трифторэтоксикарбонил, изопропоксикарбонил, 4-пиридилметоксикарбонил, 3-пиридилметоксикарбонил, 2-пиридилметоксикарбонил, 1 Н-имидазол-5-илметоксикарбонил или 2-пирролидин-1-илэтоксикарбонил. Также предпочтительно Ra означает С 1-6 алкил, например метил, с необязательным заместителем,выбранным из 1-5 групп атомов фтора, например, с образованием трифторметила, С 3-8 циклоалкила, например циклогексила, фенила и het, например пиридила, например 4-пиридила, пиперидинила, морфолинила, пирролидинила или пиперазинила. Более предпочтительно Ra означает метил или 4-пиридилметил. Также предпочтительно Ra и Rb вместе с атомом N, к которому они присоединены, образуют пирролидинил, пиперидинил, пиперазинил, морфолинил или 2-оксооксазолидинил, например 2-оксо-1,3-оксазолидин-3-ил, более предпочтительно 2-оксо-1,3-оксазолидин-3-ил. Предпочтительно Rb означает водород. Предпочтительно или альтернативно R9 выбирают из NH2, С 1-6 алкоксикарбониламино с необязательным замещением в алкоксигруппе 1-5 группами, выбранными из атома фтора, диС 1-6 алкиламино, иhet, и С 1-6 алкиламино, с необязательным замещением в алкильной группе 1-5 группами, выбранными из атома фтора, С 3-8 циклоалкила, фенила и het. Наиболее предпочтительно R9 означает NH2. Предпочтительные индивидуальные соединения изобретения выбраны из следующих соединений,включающих 5-амино-1-[2,6-дихлор-4-пентафтортиофенил]-4-[2,2-дифтор-1-(трифторметил)циклопропил]-1Hпиразол-3-карбонитрил; 5-амино-1-[2,6-дихлор-4-(трифторметил)фенил]-4-[2,2-дифтор-1-(трифторметил)циклопропил]-1 Нпиразол-3-карбонитрил; 5-амино-1-[2,6-дихлор-4-(трифторметил)фенил]-4-(1,2,2-трифторциклопропил)-1H-пиразол-3-карбонитрил; 5-амино-1-[2,6-дихлор-4-(трифторметил)фенил]-4-(пентафторциклопропил)-1H-пиразол-3-карбонитрил; 5-амино-4-(2,2-дихлор-1-фторциклопропил)-1-[2,6-дихлор-4-(трифторметил)фенил]-1H-пиразол-3 карбонитрил; 5-амино-1-[2,6-дихлор-4-пентафтортиофенил]-4-(пентафторциклопропил)-1H-пиразол-3-карбонитрил; 5-амино-1-[2,6-дихлор-4-пентафтортиофенил]-4-(1,2,2-трифторциклопропил)-1H-пиразол-3-карбонитрил; 5-амино-1-[2,6-дихлор-4-(трифторметил)фенил]-4-[1-(дифторметил)-2,2-дифторциклопропил]-1Hпиразол-3-карбонитрил; 5-амино-1-[2,6-дихлор-4-(трифторметил)фенил]-4-(2,2-дифторциклопропил)-1H-пиразол-3-карбонитрил; 5-амино-4-[2,2-дифтор-1-(трифторметил)циклопропил]-1-[2,6-дифтор-4-(трифторметил)фенил]-1Hпиразол-3-карбонитрил; 5-амино-1-[2,6-дихлор-4-пентафтортиофенил]-4-[1-(дифторметил)-2,2-дифторциклопропил]-1Hпиразол-3-карбонитрил; 5-амино-4-1-[хлор(фтор)метил]-2,2-дифторциклопропил-1-[2,6-дихлор-4-(трифторметил)фенил]1H-пиразол-3-карбонитрил; 5-амино-1-[2,6-дихлор-4-(трифторметил)фенил]-4-[1-(дифторметил)-2,2,3,3-тетрафторциклопропил]1H-пиразол-3-карбонитрил; 5-амино-1-[2,6-дихлор-4-(трифторметил)фенил]-4-[2,2,3,3-тетрафтор-1-(трифторметил)циклопропил]1H-пиразол-3-карбонитрил; 1-[2,6-дихлор-4-(трифторметил)фенил]-4-[2,2-дифтор-1-(трифторметил)циклопропил]-5-(метиламино)1H-пиразол-3-карбонитрил; 5-амино-1-[2,6-дихлор-4-(трифторметокси)фенил]-4-[2,2-дифтор-1-(трифторметил)циклопропил]1H-пиразол-3-карбонитрил; 5-амино-1-[2,6-дихлор-4-(трифторметокси)фенил]-4-[1-(дифторметил)-2,2,3,3-тетрафторциклопропил]-2 010740 1H-пиразол-3-карбонитрил; 5-амино-1-[2,6-дихлор-4-(трифторметокси)фенил]-4-[1-(дифторметил)-2,2-дифторциклопропил]-1Hпиразол-3-карбонитрил; 5-амино-1-[2,6-дихлор-4-(трифторметил)фенил]-4-[2,2-дифтор-1-(фторметил)циклопропил]-1Hпиразол-3-карбонитрил; 5-амино-1-[2,6-дихлор-4-(трифторметил)фенил]-4-(2,2-дифтор-1-метилциклопропил)-1H-пиразол-3 карбонитрил; 5-амино-1-2,6-дихлор-4-[(трифторметил)тио]фенил-4-[2,2-дифтор-1-(трифторметил)циклопропил]1H-пиразол-3-карбонитрил; 3-циано-1-[2,6-дихлор-4-(трифторметил)фенил]-4-[2,2-дифтор-1-(трифторметил)циклопропил]-1Hпиразол-5-илэтилкарбамат; 1-[2,6-дихлор-4-(трифторметил)фенил]-4-[2,2-дифтор-1-(трифторметил)циклопропил]-5-(2-оксо-1,3 оксазолидин-3-ил)-1H-пиразол-3-карбонитрил; 5-амино-1-[3-хлор-5-(трифторметил)пиридин-2-ил]-4-[2,2-дифтор-1-(трифторметил)циклопропил]1H-пиразол-3-карбонитрил; 3-циано-1-[2,6-дихлор-4-(трифторметил)фенил]-4-[2,2-дифтор-1-(трифторметил)циклопропил]-1Hпиразол-5-ил-2-(диметиламино)этилкарбамат; 3-циано-1-[2,6-дихлор-4-(трифторметил)фенил]-4-[2,2-дифтор-1-(трифторметил)циклопропил]-1Hпиразол-5-ил-2,2,2-трифторэтилкарбамат; 5-амино-1-2,6-дихлор-4-[(трифторметил)сульфонил]фенил-4-[2,2-дифтор-1-(трифторметил)циклопропил]-1H-пиразол-3-карбонитрил; 1-[2,6-дихлор-4-(трифторметил)фенил]-4-[2,2-дифтор-1-(трифторметил)циклопропил]-5-[(пиридин 4-илметил)амино]-1H-пиразол-3-карбонитрил; 5-амино-1-[2,6-дихлор-4-(дифторметокси)фенил]-4-[2,2-дифтор-1-(трифторметил)циклопропил]-1Hпиразол-3-карбонитрил; 5-амино-1-[2,6-дихлор-4-пентафтортиофенил]-4-[1-(дифторметил)-2,2,3,3-тетрафторциклопропил]1H-пиразол-3-карбонитрил; 3-циано-1-[2,6-дихлор-4-(трифторметил)фенил]-4-[2,2-дифтор-1-(трифторметил)циклопропил]-1Hпиразол-5-илизопропилкарбамат; 3-циано-1-[2,6-дихлор-4-(трифторметил)фенил]-4-[2,2-дифтор-1-(трифторметил)циклопропил]-1Hпиразол-5-ил-пиридин-4-илметилкарбамат; 3-циано-1-[2,6-дихлор-4-(трифторметил)фенил]-4-[2,2-дифтор-1-(трифторметил)циклопропил]-1 Нпиразол-5-ил]пиридин-3-илметилкарбамат; 3-циано-1-[2,6-дихлор-4-(трифторметил)фенил]-4-[2,2-дифтор-1-(трифторметил)циклопропил]-1Hпиразол-5-ил-пиридин-2-илметилкарбамат; 3-циано-1-[2,6-дихлор-4-(трифторметил)фенил]-4-[2,2-дифтор-1-(трифторметил)циклопропил]-1Hпиразол-5-ил-1H-имидазол-5-илметилкарбамат; 3-циано-1-[2,6-дихлор-4-(трифторметил)фенил]-4-[2,2-дифтор-1-(трифторметил)циклопропил]-1Hпиразол-5-ил-2-пирролидин-1-илэтилкарбамат и 5-амино-4-1-[хлор(дифтор)метил]-2,2-дифторциклопропил-1-[2,6-дихлор-4-(трифторметил)фенил]1H-пиразол-3-карбонитрил или их фармацевтически приемлемые соли или пролекарства. Более предпочтительные индивидуальные соединения изобретения выбирают из следующих соединений, включающих 5-амино-1-[2,6-дихлор-4-(трифторметил)фенил]-4-[2,2-дифтор-1-(трифторметил)циклопропил]-1Hпиразол-3-карбонитрил;(-)-5-амино-1-[2,6-дихлор-4-(трифторметил)фенил]-4-[2,2-дифтор-1-(трифторметил)циклопропил]1H-пиразол-3-карбонитрил; 5-амино-1-[2,6-дихлор-4-(трифторметил)фенил]-4-[1-(дифторметил)-2,2-дифторциклопропил]-1Hпиразол-3-карбонитрил; 5-амино-1-[2,6-дихлор-4-пентафтортиофенил]-4-[1-(дифторметил)-2,2-дифторциклопропил]-1Hпиразол-3-карбонитрил; 5-амино-4-1-[хлор(фтор)метил]-2,2-дифторциклопропил-1-[2,6-дихлор-4-(трифторметил)фенил]1H-пиразол-3-карбонитрил; 5-амино-1-[2,6-дихлор-4-(трифторметил)фенил]-4-[1-(дифторметил)-2,2,3,3-тетрафторциклопропил]1H-пиразол-3-карбонитрил и 5-амино-1-[2,6-дихлор-4-(трифторметил)фенил]-4-[2,2,3,3-тетрафтор-1-(трифторметил)циклопропил]1H-пиразол-3-карбонитрил или их фармацевтически приемлемые соли. Специалисту в данной области будет очевидно, что чувствительные функциональные группы могут требовать присоединения и удаления защитных групп в ходе синтеза соединения изобретения. Это может быть достигнуто обычными способами, например, как описано в "Protective Groups in Organic Synthesis",-3 010740TW Green and PGM Wuts, John Wiley and Sons Inc. (1999) и приведенных там ссылках. Таким образом, следующие способы являются примерами общих методов синтеза, которые могут быть использованы для получения соединения изобретения. 1. Соединение формулы (I) может быть получено циклопропанированием алкена формулы (II) в которой R1, R2, R3, R4, R7 и X имеют значения, определенные выше для формулы (I), и R9' означает R9 или N-защищенный R9, с последующим, если необходимо, удалением защитной группы. Подходящая защита включает имидоформамидную защиту, например с использованием N,N-диметилимидоформамида,защитная группа которого может быть удалена в нормальных условиях. Соединения формулы (II) могут быть подвергнуты взаимодействию с карбеноидными соединениями CR5R6, где R5 и R6 имеют значения,определенные выше для формулы (I), которые могут быть получены in situ. Например, когда R5=R6=F,реакционноспособное соединение, такое как триметилсилилдифтор(фторсульфонил)ацетат (TFDA), может быть подвергнуто взаимодействию с соединением формулы (II), где R9' представляет собой N-защищенный R9, с дополнительным неполярным растворителем при повышенной температуре в присутствии фторида натрия с получением продукта формулы (I) после удаления защитной группы. Другие определенные способы включают обработку хлороформа основанием, предпочтительно в условиях катализа фазового переноса, термолизис подходящего металлорганического предшественника, такого как арилтрифторметил, трихлорметил, трибромметил или производное фенил(трифторметил)ртути, или обработку диазоалканом в присутствии катализатора переходного металла и обработку диазоалканом в отсутствие катализатора переходного металла с последующим термолизисом промежуточного пиразолина, или получение из сульфурилида. Соединение формулы (II), где R9' представляет собой N-защищенную группу, может быть получено из соединения формулы (IV) в которой X' является бромом или йодом и R1, R7 и X имеют значения, определенные выше для формулы(IIa), например, путем катализируемой переходным металлом реакции перекрестного сочетания между соединением (IV) и подходящим реагентом винилирования в подходящем, необязательно дегазированном, растворителе. Предпочтительно переходный металл представляет собой палладий, и реагентом винилирования является органотин, органобороновая кислота или производное органоцинка. Альтернативно, соединение (IV) может быть нагрето при кипячении с обратным холодильником с предпочтительно замещенными алкенилбороновыми кислотами в присутствии тетракис(трифенилфосфин)палладия(0) и гидрокарбоната натрия в подходящем растворителе. Альтернативно, соединение (IV) может быть обработано соединением органоцинка, например активированным цинком (типа цинка Rieke), в инертной атмосфере с подходящим бромалкеном, таким как бромтрифторэтилен или бромдифторэтилен, в апротонном растворителе в присутствии соединения палладия(0), такого как тетракис(трифенилфосфин)палладий(0), при повышенной температуре. Альтернативно, соединение (IV) может быть обработано активированным цинком (цинк Rieke) в апротонном растворителе с получением органоцинката, который может быть подвергнут перекрестному сочетанию с галогеналкеном в присутствии соединений палладия(II),таких как дихлорбис(трифенилфосфин)палладий(II), и восстановителя, такого как гидрид диизобутилалюминия, при кипячении с обратным холодильником в апротонном растворителе. Соединения формулы (IV) могут быть пригодны для получения промежуточных продуктов формулы (V) Так, соединение формулы (IV) может быть обработано реагентом Гриньяра, таким как изопропилмагнийхлорид, в инертных условиях с использованием апротонного растворителя при пониженной температуре с последующей обработкой хлорангидридом или ангидридом хлоралкановой кислоты; после нагревания до комнатной температуры получают желаемое кетонное соединение, представленное формулой (V). Соединения формулы (V) могут использоваться для получения соединений формулы (II), в которойR3 и R4 означают Н и R9 является N-защищенным. Так, соединение формулы (V) может быть метиленировано обработкой реагентом Виттига в инертных условиях при пониженной температуре в растворителе, таком как тетрагидрофуран. Соединения формулы (II), где R9 является N-защищенным, могут также быть получены из соединений формулы (V) обработкой галогеналкеном, таким как дибромдифторметан, в присутствии трифенилфосфина и цинка Rieke в апротонном растворителе. Альтернативно, соединения формулы (II), где R9 является N-защищенным, могут быть получены из соединений формулы (IV) с использованием подходящего третичного спирта с последующими стандартными процедурами хлорирования-дегидрохлорирования. Соединение формулы (IV) может быть получено из соединения формулы (VI), в которой R1, R7 и X имеют значения, определенные выше для формулы (I), двумя стандартными стадиями бромирования/йодирования и присоединения защитной группы, каждая из которых может быть выполнена первой. Соединения формулы (VI) могут быть легко защищены, например, как имидоформамид, и могут быть затем преобразованы непосредственно в соединения формулы (V) взаимодействием с реакционноспособным ангидридом кислоты в аполярном растворителе. 2. Соединение формулы (I) может быть также получено путем генерации необходимых карбеноидных соединений из пиразолсодержащего предшественника и их обработки подходящим алкеном. Например, алкильная соль металла, предпочтительно лития, соединения формулы (VII) где Ar означает фенил или нафтил, каждый из которых может быть замещен С 1-С 4 алкилом, С 1-С 4 алкокси или галогеном, и R1, R2, R7, R9 и X имеют значения, определенные выше, может быть термически разложена в присутствии катализатора переходного металла, такого как родий(II)ацетат, и алкена формулы (VIII)-5 010740 где R3, R4, R5 и R6 имеют значения, определенные выше для формулы (I), необязательно в подходящем растворителе, таком как дихлорметан, и необязательно под давлением с получением соединения формулы (I). 3. Соединения формулы (I) могут быть получены реакцией Яппа-Клингеманна. Эта реакция описана в Org. React., 1959, 10, 143-178. Обычно необходимо выполнить дополнительные стадии синтеза, чтобы получить 3,4,5-тризамещенные пиразолы с различными другими 4-заместителями. Более того, группы, которые могут быть введены таким образом, ограничены производными изначально введенных 4-заместителей. Однако авторы разработали способ, которым 3,4,5-трехзамещенные 1-арилпиразолы могут быть получены непосредственно реакцией, которая включает сочетание арилдиазониевых соединений с соответственно замещенным предшественником, несущим желаемый заместитель. Желаемый заместитель вводят в С-4 положение в объеме способа, который не включает перегруппировки. Кроме того, реакция приводит непосредственно к тризамещенному пиразолу. Это снимает потребность в длинной процедуре синтеза и в нескольких исследованиях промежуточных продуктов и приводит к хорошим выходам. Этот способ имеет значительное преимущество в том отношении, что С-4 заместитель может быть встроен в первоначальное тетразамещенное производное этана, которое является одним из исходных веществ, и которое вводят в реакцию с арилдиазониевыми соединениями, получая пиразол. Контроль положения замещения на полученном пиразольном кольце в реакции получается абсолютным. Кроме того, очень широкий ряд 4-заместителей может быть введен легко и непосредственно. Таким образом, соединение формулы (I), где R9 является NH2, может быть получено взаимодействием соединения формулы (IX)R1-R8 имеют значения, определенные выше в отношении соединений формулы (I);L означает активирующую группу иZ означает соответствующий противоион,с последующим удалением группы L. Противоион Z- может быть любым подходящим противоионом, обычно используемым в реакциях диазония. Предпочтительно Z- означает галоген, HSO4- или тетрафторборат и наиболее предпочтительно является тетрафторборатом. Группа L означает электронакцепторную группу, которая стабилизирует промежуточный анион в ходе способа. Таким образом, предпочтительно L означает группу, которая является способной к стабилизации отрицательного заряда на смежном атоме углерода. Группа L должна также быть удаляемой. L может быть удалена в основных условиях, например основным гидролизом, или может быть удалена восстановлением и/или отщеплением. Группа L важна, поскольку служит для направления реакции соединений диазония с соединением формулы (IX), но затем ее удаляют на последующих стадиях реакции. Предпочтительно L является сложноэфирная группа или группа COR10. Более предпочтительно L является группой,выбранной из -C(O)pR11, где р=1 или 2, (R11O)2PO, COOR11 и -COR10, где R10 выбирают из С 1-8 алкила,диС 1-8 алкиламино, С 1-8 алкилтио, С 3-8 циклоалкила, (CH2)nPh и (CH2)nгетероарила, где n=0, 1 или 2, где каждая из указанных групп может быть необязательно замещена по любому атому углерода 1 или несколькими группами, выбранными независимо из галогена, гидрокси, циано, нитро, С 1-4 алкокси, С 1-4 галогеналкокси, С 1-4 алканоила, С 1-4 галогеналканоила, С 1-4 алкилсульфинила, С 1-4 галогеналкилсульфинила, С 1-4 алкилсульфонила, С 1-4 галогеналкилсульфонила, С 3-8 циклоалкила и С 3-8 галогенциклоалкила; и R10 может быть водородом; и где R11 выбирают из C1-8 алкила, С 3-8 циклоалкила, (CH2)nPh и (СН 2)nгетероарила, гдеn=0, 1 или 2, где каждая из этих групп может быть необязательно замещена по любому атому углерода 1 или несколькими группами, выбранными независимо из галогена, гидрокси, циано, нитро, С 1-4 алкокси,С 1-4 галогеналкокси, С 1-4 алканоила, С 1-4 галогеналканоила, С 1-4 алкилсульфинила, С 1-4 галогеналкилсульфинила, С 1-4 алкилсульфонила, С 1-4 галогеналкилсульфонила, С 3-8 циклоалкила и С 3-8 галогенциклоалкила; иR11 может быть водородом. Предпочтительно L означает группу, выбранную из COR10 и COOR11. Наиболее предпочтительно L означает -СООМе или -COOEt. В определенных случаях природа удаляемой группы L означает, что полученное промежуточное соединение находится в неправильной степени окисления. Таким образом, где необходимо, могут быть добавлены одна или более стадий реакции, чтобы гарантировать достижение правильной степени окис-6 010740 ления, до проведения циклизации с получением арилпиразола. Указанный способ сочетания может использоваться для получения любого из соединений формулы(I). Например, схемы 1 и 2 ниже иллюстрируют общие способы получения 5-амино-1-[2,6-дихлор-4-(трифторметил)фенил]-4-[2,2-дифтор-1-(трифторметил)циклопропил]-1 Н-пиразол-3-карбонитрила. Схема 1 В идеале, для реакции сочетания с получением соединения формулы (I) растворитель должен быть полярным растворителем, который не реагирует ни с солью диазония или с катионом, ни с соединением формулы (IX). Реакция необязательно может быть проведена в слабокислотных условиях. Соль диазония формулы (X) может быть получена обычными средствами и может быть получена insitu для следующей реакции или может быть выделена и использована на последующей стадии реакции. Частные примеры соединений формулы (IX) и (XI) изображены на схемах 1 и 2. Альтернативные соединения формулы (IX) могут быть аналогично получены из соединений формулы (XI), где R2, R3, R4,-7 010740R5, R6 и L имеют значения, определенные выше, например, обработкой соединения формулы (XI) источником цианидных ионов. Соединения формулы (XI) могут быть получены восстановлением и затем дегидратацией соединения формулы (XII) Соединения формулы (XII) могут, например, быть получены конденсацией алкилцианоалканоата,например метилцианоацетата, с хлорангидридом кислоты в апротонном растворителе, таком как дихлорметан, в присутствии кислоты Льюиса, такой как хлорид магния, и слабого основания, такого как триэтиламин, при пониженной температуре. Альтернативно, как показано на схеме 1, соединения формулы (XI) могут быть получены конденсацией по Knoevenagel подходящего альдегида с алкилалканоатом, таким как метилцианоацетат. Эффективные условия для получения циклопропилзамещенных соединений с использованием триметилсилил-2,2-дифтор-2-(фторсульфонил)ацетата (TFDA), дифторкарбенового источника, описаныDolbier et al., в J. Fluor Chem., 2004, 125, 459. Соединения формулы (XIII) могут также использоваться в реакции Яппа-Клингеманна после взаимодействия с соединениями формулы (X) для синтеза соединений формулы (VI) по аналогии с указанными условиями. Соединения формулы (XIII), где L означает CO2C1-C6 алкил, синтезируются медленным добавлением гликолонитрила, необязательно при пониженных температурах, к С 1-С 6 алкилцианоацетату в апротонном растворителе, таком как диметилформамид, с последующим добавлением основания, такого как карбонат калия. Промежуточные соединения формулы (VIII), (XI) и (XII) также могут быть получены или по аналогии со схемами 1 и 2 или при использовании обычных методик синтеза в соответствии со стандартными учебниками по органической химии или описаниями в литературе из легкодоступных исходных веществ с использованием подходящих реагентов и условий реакции. 4. В другом аспекте изобретение относится к способам получения соединений формулы (I) из альтернативных соединений формулы (I). Например, соединения, где R9 означает NRaRb, где Ra и Rb имеют значения, как они определены в формуле (I), могут быть получены стандартными реакциями из соединения формулы (I), где R9 означает NH2. Соединения формулы (VI) могут быть получены из соединений формулы (XIV) где CO2R11 представляет собой подходящую сложноэфирную группу, путем превращения сложного эфи-8 010740 ра в амид(XV) с последующим восстановлением оксихлоридом фосфора при повышенной температуре. Соединения формулы (XIV) могут быть получены взаимодействием подходящего сложного эфира 3-циано-2-оксопропионовой кислоты, например этилового эфира, с соответственно замещенным гидразином соединения (XVII) в спиртовом растворителе при повышенной температуре с последующим добавлением основания, такого как карбонат натрия, и нагреванием. Соединения формулы (XVII) легко можно получить, используя нормальные условия, например замещение соответствующего фторпроизводного гидразиновым реагентом, таким как гидразинмоногидрат,при кипячении с обратным холодильником в спиртовом растворителе, таком как этанол. Кроме того, специалистам в данной области известны изменения и альтернативы описанных способов, которые позволяют получить соединения, определенные формулой (I). Специалисту в данной области также будет понятно, что, в пределах некоторых из описанных способов, порядок используемых стадий синтеза может быть различен и будет зависеть, среди прочего, от таких факторов, как природа других функциональных групп в специфическом субстрате, наличие ключевых промежуточных соединений и стратегия защитной группы (в случае ее использования). Понятно, что такие факторы будут также влиять на выбор реагента для использования в указанных стадиях синтеза. Специалисту в данной области понятно, что соединения изобретения могут быть получены и другими способами, кроме описанных, адаптацией описанных в данном описании способов и/или адаптацией способов, известных в данной области, например в описанном выше уровне техники, или с использованием стандартных учебников, таких как "Comprehensive Organic Transformations - A Guide to FunctionalGroup Transformations", RC Larock, Wiley-VCH (1999 или более поздние издания). Следует понимать, что синтетические способы превращения, приведенные в данном описании, являются только примерами и они могут быть выполнены в различных последовательностях для эффективного получения целевых соединений. Специалист в области химии по своему усмотрению и на основании своей квалификации выберет наиболее эффективную последовательность реакций для синтеза данного целевого соединения. Настоящее изобретение также относится к промежуточным соединениям формулы (IA) где R1-R7, X, и Ra, и Rb имеют значения, определенные для соединений формулы (I), и где предпочтительные значения R1-R7 и X также действительны для формулы (IA). В отношении формулы (IA), предпочтительно Ra=Rb=метил. Следует понимать, что соединения формулы (I) могут содержать 1 или несколько асимметрических атомов углерода, таким образом, соединения изобретения могут существовать в виде двух или более стереоизомеров. В объем настоящего изобретения входят все стереоизомеры, такие как энантиомеры и диастереоизомеры, все геометрические изомеры и таутомерные формы соединений формулы (I), включая соединения, показывающие более чем один тип изомерии, и смеси одной или нескольких этих форм. Также включены соли присоединения кислоты или оснований, где противоион оптически активен, например Dлактат или L-лизин, или рацемические, например DL-тартрат или DL-аргинин. Геометрические изомеры могут быть отделены обычными методами, известными специалистам в данной области, например хроматографией и фракционной кристаллизацией. Обычные способы получения/выделения индивидуальных энантиомеров включают хиральный синтез из подходящего оптически чистого предшественника или разделение рацемата (или рацемата соли или производного) с использованием, например, хиральной высокоэффективной жидкостной хромато-9 010740 графии (ВЭЖХ). Альтернативно, рацемат (или рацемический предшественник) может быть подвергнут взаимодействию с подходящим оптически активным соединением, например спиртом, или, в случае, если соединение формулы (I) содержит кислотную или основную группу, с кислотой или основанием, такими как винная кислота или 1-фенилэтиламин. Конечная диастереомерная смесь может быть разделена хроматографией и/или фракционной кристаллизацией, и один или оба диастереоизомера могут быть преобразованы в соответствующий чистый энантиомер(ы) средствами, известными специалисту в данной области. Хиральные соединения изобретения (и их хиральные предшественники) могут быть получены в энантиомерно-обогащенной форме с использованием хроматографии, обычно ВЭЖХ, на асимметричной смоле с подвижной фазой, состоящей из углеводорода, обычно гептана или гексана, содержащей от 0 до 50% изопропанола, обычно от 2 до 20%, и от 0 до 5% алкиламина, обычно 0,1% диэтиламина. Концентрация элюата приводит к обогащенной смеси. Стереоизомерные конгломераты могут быть разделены обычными методами, известными специалисту в данной области; см., например, "Stereochemistry of Organic Compounds" by E.L. Eliel (Wiley, NewYork, 1994). Фармацевтически приемлемые с точки зрения ветеринарии и сельского хозяйства соли присоединения кислот некоторых из соединений формулы (I) могут также быть получены обычным способом. Например, раствор свободного основания может быть обработан подходящей кислотой, или неразбавленной, или в подходящем растворителе, и конечная соль может быть выделена фильтрованием или выпариванием реакционного растворителя при пониженном давлении. Для обзора подходящих солей см."Handbook of Pharmaceutical Salts: Properties, Selection, and Use", Stahl and Wermuth (Wiley-VCH, Weinheim,Germany, 2002). Соединения изобретения могут существовать как в несольватированной, так и сольватированной формах. Термин "сольват" используется в данном описании для обозначения молекулярного комплекса,включающего соединение изобретения и одну или несколько молекул фармацевтически приемлемого растворителя, например этанола. Термин "гидрат" используется, когда указанным растворителем является вода. Соединения изобретения, то есть соединения формулы (I), обладают противопаразитарной активностью у людей, животных и растений. Они особенно полезны для лечения эктопаразитов. Относительно применения соединений изобретения для млекопитающих, изобретение относится к фармацевтической противопаразитарной композиции, включающей соединение формулы (I), или его фармацевтически приемлемую соль, или их фармацевтически приемлемый сольват, вместе с фармацевтически приемлемым разбавителем или носителем, который может быть адаптирован для перорального, парентерального или местного введения; соединению формулы (I), или его фармацевтически приемлемой соли, или их фармацевтически приемлемому сольвату, или фармацевтической композиции, содержащей любое из указанных соединений, для применения в качестве лекарственного средства; применению соединения формулы (I), или его фармацевтически приемлемой соли, или их фармацевтически приемлемого сольвата, или фармацевтической композиции, содержащей любое из указанных соединений, для получения лекарственного средства для лечения паразитарной инвазии; и способу лечения паразитарной инвазии у млекопитающего, который включает введение указанному млекопитающему эффективного количества соединения формулы (I), или его фармацевтически приемлемой соли, или их фармацевтически приемлемого сольвата, или фармацевтической композиции, содержащей любое из указанных соединений. Согласно другому аспекту изобретение относится к способу борьбы с членистоногими, нематодами растений или гельминтами в очаге, который включает обработку очага (например, путем нанесения или введения) эффективным количеством соединения общей формулы I или его пестицидно приемлемой соли. Настоящее изобретение включает все фармацевтически приемлемые изотопически-маркированные соединения формулы (I), где 1 или несколько атомов заменены атомами, имеющими тот же атомный номер, но атомную массу или массовое число, отличное от атомной массы или массового числа, обычно встречающегося в природе. Примеры изотопов, подходящих для включения в соединения изобретения, включают изотопы водорода типа 2 Н и 3 Н, углерода типа 11 С, 13 С и 14 С, хлора типа 36Cl, фтора типа 18F, йода типа 123I и 125I, азота типа 13N и 15N, кислорода типа 15O, 17O и 18O, фосфора типа 32 Р и серы типа 35S. Соединения изобретения могут также быть смешаны с одним или несколькими биологически активными соединениями или средствами, включая инсектициды, акарициды, глистогонные средства, фунгициды, нематоциды, антипротозойные средства, бактерициды, регуляторы роста, энтомопатогенные бактерии, вирусы или грибы, для получения многокомпонентного пестицида, дающего еще более широкий спектр фармацевтической, ветеринарной или сельскохозяйственной полезности. Таким образом, настоящее изобретение также относится к композиции, содержащей биологически эффективное количество соединений изобретения и эффективное количество по меньшей мере одного дополнительного биологически активного соединения или средства, и которая может дополнительно содержать одно или несколь- 10010740 ко поверхностно-активных веществ, твердых разбавителей или жидких разбавителей. Частные случаи дополнительных активных соединений включают описанные в патентной заявке ВеликобританииGB0406137.0 на стр. 37-41. Соединения изобретения, предназначенные для фармацевтического применения, могут вводиться в виде кристаллических или аморфных продуктов. Они могут быть получены, например, в виде прессованных форм, порошков или пленок такими способами, как осаждение, кристаллизация, лиофилизация,или сушка распылением, или сушка упариванием. С этой целью может быть использована сушка под действием микроволн или радиоволн. Соединения могут вводиться индивидуально или в комбинации с одним или несколькими другими соединениями изобретения или в комбинации с одним или несколькими другими лекарственными средствами (или в виде любой их комбинации). Обычно они будут вводиться как состав в комбинации с одним или несколькими фармацевтически приемлемыми эксципиентами. Термин "эксципиент" используется в данном описании для обозначения любого ингредиента, кроме соединения(й) изобретения. Выбор эксципиента будет в большой степени зависеть от таких факторов, как способ введения, влияние эксципиента на растворимость и стабильность и природа лекарственной формы. Фармацевтические композиции, подходящие для доставки соединений изобретения, и способы их получения будут очевидны для специалиста в данной области. Такие композиции и способы их получения могут быть найдены, например, в "Remington's Pharmaceutical Sciences", 19th Edition (Mack PublishingCompany, 1995). Относительно их применения млекопитающим, соединения могут вводиться индивидуально или в составе, подходящем для определенного предусматриваемого использования, специфических разновидностей получающего лечение млекопитающего и имеющегося паразита. Способы, которыми могут вводиться соединения, включают пероральное введение в виде капсулы,болюса, таблетки, порошков, лепешек, жевательных резинок, мульти- и наночастиц, гелей, твердого раствора, пленок, спреев или жидкого состава. Жидкие формы включают суспензии, растворы, сиропы, кисели и эликсиры. Такие составы могут использоваться как наполнители в мягких или твердых капсулах и обычно включают носители, например воду, этанол, полиэтиленгликоль, пропиленгликоль, метилцеллюлозу или подходящее масло, и один или несколько эмульгаторов и/или суспендирующих агентов. Жидкие составы также могут быть получены восстановлением твердого вещества, например, из пакетика. Пероральные кисели обычно получают растворением или суспендированием активного ингредиента в подходящей среде. Такие композиции, пригодные для перорального введения, могут быть получены путем смешивания активного ингредиента с подходящим тонкораздробленным разбавителем, и/или дезинтегрирующим агентом, и/или связующим, и/или лубрикантом и т.д. Другие возможные ингредиенты включают антиоксиданты, красители, ароматизаторы, консерванты и вещества, маскирующие вкус. Для пероральных дозированных форм, в зависимости от дозы, лекарственное средство может составлять от 1 до 80 мас.%, обычно от 5 до 60 мас.%, от массы дозированной формы. Примеры дезинтеграторов включают эфир гликолят натрия крахмала, натрийкарбоксиметилцеллюлозу, кальцийкарбоксилметилцеллюлозу, натрийкроскармеллозу, кросповидон, поливинилпирролидон, метилцеллюлозу,микрокристаллическую целлюлозу, (низший алкил)замещенную гидроксипропилцеллюлозу, крахмал,предварительно желатинированный крахмал и альгинат натрия. Вообще, дезинтегратор составляет от 1 до 25 мас.%, предпочтительно от 5 до 20 мас.%, от массы дозированной формы. Связующие обычно используются для придания составу таблетки когезивных свойств. Подходящие связующие включают микрокристаллическую целлюлозу, желатин, сахара, полиэтиленгликоль, природные и синтетические смолы, поливинилпирролидон, предварительно желатинированный крахмал, гидроксипропилцеллюлозу и гидроксипропилметилцеллюлозу. Примеры разбавителей включают лактозу (моногидрат, высушенный распылением моногидрат, безводный и т.п.), маннит, ксилит, декстрозу, сахарозу,сорбит, микрокристаллическую целлюлозу, крахмал и двухосновный дигидрат фосфата кальция. Формы для перорального применения могут также необязательно включать поверхностно-активные вещества, такие как лаурилсульфат натрия и полисорбат 80, и вещества, облегчающие скольжение, такие как диоксид кремния и талька. В случае их присутствия, поверхностно-активные вещества могут составлять от 0,2 до 5 мас.% от массы таблетки, и вещества, облегчающие скольжение, могут составлять от 0,2 до 1 мас.% от массы таблетки. Лубриканты включают стеарат магния, стеарат кальция, стеарат цинка, стеарилфумарат натрия и смеси стеарата магния с лаурилсульфатом натрия. Лубриканты обычно составляют от 0,25 до 10 мас.%,предпочтительно от 0,5 до 3 мас.%, от массы таблетки. Например, таблетки включают приблизительно до 80% лекарственного средства, приблизительно от 10 приблизительно до 90 мас.% связующего, приблизительно от 0 приблизительно до 85 мас.% разбавителей, приблизительно от 2 приблизительно до 10 мас.% дезинтеграторов и приблизительно от 0,25 приблизительно до 10 мас.% лубрикантов. Состав таблеток обсуждается в "Pharmaceutical Dosage Forms: Tablets, Vol. 1", H. Lieberman and L.- 11010740 Соединения могут наноситься местно на кожу или слизистую оболочку, т.е. дермально или чрескожно. Конкретные составы для этой цели включают составы для орошения, составы для местного нанесения, составы для погружения, спрей, мусс, шампунь, порошковый состав, гели, гидрогели, лосьоны,растворы, кремы, мази, присыпки, перевязывания, пены, пленки, пластыри для кожи, пластинки, имплантаты, губки, волокна, бандажи и микроэмульсии. Также могут использоваться липосомы. Типичные носители включают спирт, воду, минеральное масло, вазелиновое масло, белый вазелин, глицерин, полиэтиленгликоль и пропиленгликоль. Могут быть включены усилители проникновения, см., например, J.Pharm. Sci., 88 (10), 955-958 Finnin и Morgan (октябрь 1999). Составы для орошения или для точечного нанесения могут быть получены путем растворения активного ингредиента в приемлемом жидком носителе, таком как бутилдигликоль, жидкий парафин или нелетучий сложный эфир, необязательно с добавлением летучего компонента, такого как пропан-2-ол. Альтернативно, составы для орошения или для точечного нанесения или спреи могут быть получены инкапсуляцией; они оставляют остаток активного средства на поверхности тела животного. Инъецируемые составы могут быть получены в форме стерильного раствора, который может содержать другие вещества, например достаточное количество солей или глюкозы, чтобы сделать раствор изотоническим в отношении крови. Приемлемые жидкие носители включают растительные масла, такие как кунжутное масло, глицериды, такие как триацетин, сложные эфиры, такие как бензилбензоат, изопропилмиристат и производные жирной кислоты и пропиленгликоля, а также органические растворители, такие как пирролидин-2-он и глицеринформаль. Составы получают растворением или суспендированием активного ингредиента в жидком носителе, так, что конечный состав содержит от 0, 01 до 10 мас.% активного ингредиента. Альтернативно, соединения могут вводиться парентерально или инъекцией непосредственно в кровоток, мышцу или во внутренний орган. Подходящие средства для парентерального введения включают внутривенный, внутриартериальный, интраперитонеальный, внутриоболочечный, внутрижелудочковый,интрауретральный, надчревный, внутричерепной, внутримышечный и подкожный пути. Подходящие устройства для парентерального введения включают инжекторы с иглой (включая микроиглу), инжекторы без иглы и методики инфузии. Парентеральные составы представляют собой обычно водные растворы, которые могут содержать эксципиенты, такие как соли, углеводы и буферные агенты (предпочтительно до рН от 3 до 9), однако, для некоторых применений они могут быть более предпочтительно составлены в виде стерильного неводного раствора или в виде высушенной порошковой формы, которая используется в сочетании с подходящим носителем, таким как стерильная апирогенная вода. Получение парентеральных составов в стерильных условиях, например, лиофилизацией может легко быть осуществлено с использованием стандартных фармацевтических методик, известных специалистам в данной области. Растворимость соединений формулы (I), используемых в получении парентеральных растворов,может быть увеличена при помощи подходящих способов получения состава, таких как введение усиливающих растворимость агентов. Такие составы получают обычным способом в соответствии со стандартной медицинской или ветеринарной практикой. Эти составы варьируют в отношении массы активного соединения, содержавшегося в них, в зависимости от разновидностей подвергаемого лечению животного, серьезности и типа инфекции и массы тела организма. Для парентерального, местного и перорального введения типичные диапазоны дозы активного ингредиента составляют от 0,01 до 100 мг на кг массы тела животного. Предпочтительно диапазон составляет от 0,1 до 10 мг на кг. Составы могут быть с немедленным и/или изменяемым регулируемым высвобождением. Составы регулируемого высвобождения включают составы модифицированного высвобождения, включая отсроченное, задержанное, импульсное, контролируемое, нацеленное или запрограммированное высвобождение. Подходящие составы модифицированного высвобождения в целях изобретения описаны в патенте США 6106864. Детали других подходящих технологий высвобождения, типа высокоэнергетической дисперсии и осмотических и покрытых частиц, могут быть найдены у Verma et al., в Pharmaceutical TechnologyOn-line, 25 (2), 1-14 (2001). Использование жевательной резинки для получения контролируемого высвобождения описано в WO 00/35298. Альтернативно, соединения изобретения могут быть составлены в виде твердой, полутвердой формы или в форме тиксотропной жидкости для введения в виде имплантируемого депо, обеспечивающего модифицированное высвобождение активного соединения. Примеры таких составов включают покрытые лекарственным средством стенты и микросферы PGLA. В качестве альтернативы соединения могут вводиться животному, не являющемуся человеком, с кормом, и с этой целью может быть получена концентрированная добавка к корму или заранее приготовленная смесь для смешивания с нормальным кормом. Соединения изобретения полезны для борьбы с членистоногими вредителями. Они могут, в частности, использоваться в областях ветеринарии, животноводства и здравоохранения против членистоногих,которые являются внутренними или внешними паразитами позвоночных, особенно теплокровных позвоночных, включая человека и домашних животных, таких как собаки, кошки, рогатый скот, овцы, козы,лошади, свиньи, домашняя птица и рыбы, кроме того, в области борьбы с вредителями растений, почвы и другими вредителями окружающей среды.- 12010740 Жидкие композиции изобретения могут, в добавление к нормальным сельскохозяйственным применениям, применяться, например, для обработки субстратов или участков, зараженных или склонных к заражению членистоногими (или другими вредителями, с которыми борются соединения изобретения),включая жилые помещения, наружные или внутренние складские или производственные помещения,емкости или оборудование или стоячую или проточную воду. Все эти водные дисперсии или эмульсии или смеси для спреев могут быть нанесены, например, на зерновые культуры любыми подходящими средствами, в основном, распылением, в количествах обычно в интервале приблизительно от 100 до приблизительно 1200 л распыляемой смеси на гектар, но которые могут быть более высокими или низкими (например, низкий или ультранизкий объем), в зависимости от потребности или способа нанесения. Соединения или композиции согласно изобретению наносят на растения, и в особенности на корни или листья, на которых находятся вредители, подлежащие уничтожению. Другая методика нанесения соединений или композиций согласно изобретению включает внесение с поливной водой, то есть добавление состава, содержащего активный ингредиент, в поливную воду. Такая поливка может быть осуществлена с помощью спринклера для лиственных пестицидов, или это может быть поливка земли или подземная ирригация для почвенных или для системных пестицидов. Концентрированные суспензии, которые могут быть нанесены распылением, готовят таким образом, чтобы получить стабильный жидкий продукт, который не осаждается (тонкий помол) и обычно содержит приблизительно от 10 до приблизительно 75 мас.% активного ингредиента, приблизительно от 0,5 до приблизительно 30% поверхностно-активных агентов, приблизительно от 0,1 до приблизительно 10% тиксотропных добавок, приблизительно от 0 до приблизительно 30% подходящих добавок, таких как пеногасители, антикоррозийные добавки, стабилизаторы, агенты, способствующие проникновению,адгезивы, и в качестве носителя содержит воду или органическую жидкость, в которой активный ингредиент плохо растворим или нерастворим. Некоторые органические твердые или неорганические соли могут быть растворены в носителе, чтобы способствовать предотвращению осаждения, или в качестве антифризов для воды. Смачиваемые порошки (или порошки для распыления) обычно получают так, чтобы они содержали приблизительно от 10 до приблизительно 80 мас.% активного ингредиента, приблизительно от 20 до приблизительно 90% твердого носителя, приблизительно от 0 до приблизительно 5% смачивающего вещества, приблизительно от 3 до приблизительно 10% диспергирующего агента и, необязательно, приблизительно от 0 до приблизительно 80% одного или более стабилизаторов и/или других добавок, таких как агенты, способствующие проникновению, адгезивы, антислеживающиеся агенты, пигменты и т.п. Чтобы получить такие смачиваемые порошки, активный ингредиент(ы) тщательно смешивают в подходящей мешалке с дополнительными веществами, которыми может быть пропитан пористый наполнитель, и размалывают, используя мельницу или другую подходящую дробилку. Таким образом получают смачиваемые порошки, смачиваемость и суспендируемость которых являются предпочтительными. Они могут быть суспендированы в воде для получения любой желаемой концентрации, и эту суспензию можно применять в особенности для нанесения на листву растения."Вододиспергируемые гранулы (WG)" (гранулы, которые легко диспергируются в воде) имеют составы, которые являются, в основном, близкими к составам смачиваемых порошков. Они могут быть получены грануляцией составов, описанных для смачиваемых порошков, или влажным путем (контактированием тонкораздробленного активного ингредиента с инертным наполнителем и небольшим количеством воды, например 1-20 мас.%, или с водным раствором диспергирующего агента или связующего с последующим высушиванием и просеиванием), или сухим путем (компактирование с последующим размалыванием и просеиванием). Количества и концентрации составленных композиций могут варьировать в зависимости от способа применения, или природы композиций, или их применения. Вообще говоря, композиции для применения в борьбе с членистоногими, нематодами растений, гельминтами или протозойными вредителями обычно содержат приблизительно от 0,00001 до приблизительно 95%, в частности приблизительно от 0,0005 до приблизительно 50 мас.% одного или нескольких соединений формулы (I), или их пестицидно приемлемых солей, или всех активных ингредиентов (то есть соединения формулы (I) или его пестицидно приемлемой соли, вместе с другими веществами, токсичными для членистоногих или нематод растений,глистогонными средствами, антикокцидиальными средствами, синергистами, микроэлементами или стабилизаторами). Фактически применяемые композиции и норма их применения будут выбраны для достижения желаемого эффекта(ов) фермером, скотоводом, медицинским или ветеринарным практиком,оператором борьбы с вредителями или другим специалистом в данной области. Соединения изобретения также полезны для борьбы с членистоногими вредителями растений. Активное соединение обычно наносят на очаг, в котором необходимо осуществить борьбу с членистоногими,в количестве приблизительно от 0,005 до приблизительно 25 кг активного соединения на гектар (га) обрабатываемого очага, предпочтительно от 0,02 до 2 кг/га. В идеальных условиях, в зависимости от вредителя,с которым борются, более низкая доза может обеспечить адекватную защиту. С другой стороны, неблагоприятные погодные условия и другие факторы могут потребовать, чтобы активный ингредиент использовался в более высоких количествах. Для нанесения на листья может применяться доза от 0,01 до 1 кг/га.- 13010740 Предпочтительно очагом является поверхность растения или почва вокруг растения, которое обрабатывают. Соединения изобретения имеют особое значение для борьбы с членистоногими, которые являются вредными для или являются распространителями или носителями заболеваний в организме человека и домашних животных, например вышеприведенных, и более предпочтительно для борьбы с клещами,зуднями, вшами, блохами, мошками и жигалками, вредными и миазными мухами. Они особенно полезны в борьбе с членистоногими, которые присутствуют внутри организмов домашних животных или которые кормятся в или на коже или сосут кровь животного, и для этой цели они могут вводиться перорально,парентерально, подкожно или местно. Они также ценны в защите древесины (на корню, срубленной, преобразованной, складированной или структурной) от нашествия пилильщиков, или жуков, или термитов. Они находят применение в защите складированных продуктов, таких как зерно, фрукты, орехи, специи и табак, целых, перемолотых или составленных в продукты, от моли, жука и клеща. Также защищают складированные животные продукты, такие как кожа, волосы, шерсть и перья в натуральном или переработанном виде (например, ковры или текстиль) от моли и жуков; также защищают мясо и рыбу от жука, клеща и мухи. Твердые или жидкие композиции для местного нанесения на древесину, складированные продукты или домашние товары обычно содержат приблизительно от 0,00005 до приблизительно 90%, в частности приблизительно от 0,001 до приблизительно 10 мас.%, одного или более соединений формулы (I) или их пестицидно приемлемых солей. Настоящее изобретение также относится к способу санации здоровых животных, включающему нанесение на животное соединения формулы (I) или ветеринарно приемлемой соли. Цель такой санации состоит в том, чтобы уменьшить или исключить заражение людей паразитами, которых несет животное,и улучшить состояние окружающей среды, которую населяют люди. Соединения изобретения полезны в борьбе с членистоногими вредителями. Они могут, в частности,применяться в областях ветеринарии, животноводства и здравоохранения против членистоногих, которые являются внутренними или внешними паразитами позвоночных, особенно теплокровных позвоночных, включая человека и домашних животных, таких как собаки, кошки, рогатый скот, овцы, козы, лошади, свиньи, домашняя птица и рыбы, например Acarina, включая клещей (например, Ixodes spp.,Boophilus spp. (например, Boophilus microplus), Amblyomma spp., Hyalomma spp., Rhipicephalus spp. (например, Rhipicephalus appendiculatus), Haemaphysalis spp., Dermacentor spp., Omithodorus spp. (например,Omithodorus moubata), клещи (например, Damalinia spp., Dermanyssus gallinae, Sarcoptes spp. (например,Sarcoptes scabiei), Psoroptes spp., Chorioptes spp., Demodex spp., Eutrombicula spp.; двукрылых (например, Aedes spp., Anopheles spp., Muscidae spp. (например, Stomoxys calcitrans и Haematobia irritans), Hypoderma spp., Gastrophilus spp., Simulium spp.); Hemiptera (например, Triatoma spp.); Phthiraptera (например,Damalinia spp., Linognathus spp.); Siphonaptera (например, Ctenocephalides spp.); Dictyoptera (например,Periplaneta spp., Blatella spp.) и Hymenoptera (например, Monomorium pharaonis). Для устранения сомнения ссылка на "лечение" включает терапевтическое, паллиативное и профилактическое лечение, ссылка на "борьбу" (с паразитами и/или вредителями и т.д.) включает уничтожение,отпугивание, изгнание, вывод из строя, удержание, удаление, облегчение, минимизацию, ликвидацию. Для измерения биологических активностей заявленных соединений используют скрининг мембранного питания блох. Проба включает тестирование in vitro против Ctenocephalides felis, проводимое согласно следующей общей методике. Блох выращивают in vitro, используя кровь собаки. 25-30 взрослых Ctenocephalides felis (блоха кошачья) отбирают и помещают в испытательную камеру (50 мл пенопластовая трубка с тонкой нейлоновой петлей, запечатывающей конец). Цитратную кровь собаки получают, добавляя водный раствор цитрата натрия (10 мл, 20% мас./об., 20 г цитрата натрия в 100 мл воды) к крови собаки (250 мл). Тестируемые соединения растворяют в ДМСО с получением рабочего сток-раствора 4 мг/мл. Сток-раствор (12,5 мл) добавляют к цитратной крови собаки (5 мл), чтобы обеспечить начальную тестируемую концентрацию 10 мг/мл. Для тестирования при 30 мг/мл получают рабочие сток-растворы 12 мг/мл. Цитратную кровь собаки, содержащую тестируемое соединение (5 мл, 10 мг/мл), помещают в пластмассовую чашку Петри, которую сохраняют при 37 С на горячей прокладке. Парафильм натягивают сверху, чтобы сформировать напряженную мембрану для питания через нее блох. Испытательную камеру, содержащую блох, аккуратно помещают на мембрану из парафильма, и блохи начинают кормление. Блохам дают кормиться в течение 2 ч и испытательные камеры затем удаляют и сохраняют в течение ночи при комнатной температуре. Блох наблюдают и регистрируют процент уничтоженных блох. Соединения, активные при 10 мг/мл, проверяют в более низких дозах. Для активных молекул 4 точечных значения доза-ответ (10, 3, 1, 0,3, 0,1 мг/мл) повторяют n=5. Данные выносят на график, чтобы получить значения ED80. Все проиллюстрированные примерами соединения согласно настоящему изобретению, которые были проверены, имеют ED80 в отношении блох, менее или равный 3, в отличие от релевантных контрольных соединений из уровня техники, например 3-циано-5-аминоарилпиразольных соединений, которые имеют галоген на 4-циклопропильном кольце, описанных в WO98/24767. Например, 5-амино-3-циано-4- 14010740(2,2-дибромциклопропил)-1-(2,6-дихлорфенил-4-трифторметил)пиразол был неактивным в описанном выше скрининге ED80 при 30 мг/мл. В следующих экспериментальных деталях получали спектральные данные ядерного магнитного резонанса, используя спектрометры Inova Varian 300, Inova Varian 400, Mercury Varian 400, Varian Unityplus 400, Bruker AC 300 МГц, Bruker AM 250 МГц или Varian Т 60 МГц, где наблюдаемые химические изменения являются совместимыми с предложенными структурами. Массовые спектральные данные были получены на спектрометре Finnigan Masslab Navigator, Fisons Instrument Trio 1000 или Hewlett PackardGCMS System Model 5971. Расчетные и наблюдаемые ионы относятся к изотопной композиции самой низкой массы. ВЭЖХ означает высокоэффективную жидкостную хроматографию. Комнатная температура составляет от 20 до 25 С. Пример 1. 5-Амино-1-[2,6-дихлор-4-пентафтортиофенил]-4-[2,2-дифтор-1-(трифторметил)циклопропил]1 Н-пиразол-3-карбонитрил. К раствору соединения получения 1 (62 мг, 0,12 ммоль) в метаноле (10 мл) добавляли п-толуолсульфоновую кислоту (0,5 г, 2,63 ммоль) и реакционную смесь нагревали при кипячении с обратным холодильником в течение ночи. Реакционную смесь вливали в насыщенный раствор гидрокарбоната натрия(50 мл) и полученную смесь экстрагировали этилацетатом (220 мл). Объединенные экстракты сушили(MgSO4) и концентрировали в вакууме. Неочищенный продукт растворяли в ацетонитриле (1,5 мл) и воде (0,9 мл) и раствор очищали автоматизированной препаративной жидкостной хроматографией (система(от 45:55 до 5:95). Соответствующие фракции объединяли и концентрировали в вакууме, получая указанное в заголовке рацемическое соединение (22 мг).MS (ES): M/Z [MH+] 523,2; вычисленная масса для C14H6Cl2F10N4S+Н составляет 523,0. 1 Н-ЯМР (CDCl3): 2,05-2,20 (1 Н), 2,42-2,53 (1 Н), 3,83-3,99 (2 Н), 7,87-7,93 (2 Н). Рацемическое соединение примера 1 растворяли в смеси этанол:гексан (2:3) и энантиомеры разделяли автоматизированной препаративной жидкостной хроматографией (система Gilson, колонка 25020 ммID Chiralcel OD, 10 мкм) с использованием смеси этанол:гексан [5:95] в качестве подвижной фазы. Соответствующие фракции объединяли и концентрировали, получая два энантиомерно обогащенных продукта примера 1 а и примера 1b. Пример 1a.MS (ES): МН+523,0, для C14H6Cl2F10N4S+Н вычислено 523,0. ВЭЖХ: (система Gilson, колонка 25020 мм ID Chiralcel OD, 10 мкм), этанол:гексан (5:95), время удерживания 12,23 мин, энантиомерная чистота 100%. Пример 2. 5-Амино-1-[2,6-дихлор-4-(трифторметил)фенил]-4-[2,2-дифтор-1-(трифторметил)циклопропил]-1 Н-пиразол-3-карбонитрил. К раствору соединения получения 2 (234 мг, 0,45 ммоль) в метаноле (10 мл) добавляли п-толуолсульфоновую кислоту (500 мг, 2,63 ммоль) и реакционную смесь нагревали при кипячении с обратным холодильником в течение ночи. К реакционной смеси добавляли этилацетат (100 мл) и органическую фазу отделяли, промывали насыщенным водным раствором гидрокарбоната натрия (2100 мл), сушили (MgSO4) и концентрировали в вакууме. Остаток очищали хроматографией на колонках (силикагель, 20 г), элюируя смесью дихлорметан:пентан (2:1). Соответствующие фракции объединяли и концентрировали, получая указанное в заголовке рацемическое соединение (160 мг) в виде твердого вещества светло-желтого цвета.MS (ES): M/Z [MH+] 465,1; вычисленная масса для C15H6Cl2F8N4+Н составляет 465,0. 1H-ЯМР (CDCl3): 2,05-2,20 (1 Н), 2,42-2,53 (1 Н), 3,86-3,95 (2 Н), 7,74-7,79 (2 Н). Рацемическое соединение примера 2 растворяли в смеси этанол:гексан (1:1) и энантиомеры разделяли автоматизированной препаративной жидкостной хроматографией (система Gilson, колонка 25020 ммID Chiralcel OD, 10 мкм) с использованием смеси этанол:гексан (1:9) в качестве подвижной фазы. Соответствующие фракции объединяли и концентрировали, получая два энантиомерно обогащенных продукта примера 2 а и примера 2b. Пример 2 а.MS (ES): МН+464,8, для C15H6Cl2F8N4+Н вычислено 465,0. ВЭЖХ: (система Gilson, колонка 25020 мм ID Chiralcel OD, 10 мкм), этанол:гексан (1:9), время удерживания 14,63 мин, энантиомерная чистота 100%, (+) изомер. Аналогичным образом получали следующее.- 15010740 Пример 3. 5-Амино-1-[2,6-дихлор-4-(трифторметил)фенил]-4-(1,2,2-трифторциклопропил)-1 Н-пиразол 3-карбонитрил. Из соединения получения 3 (22 мг, 0,047 ммоль), получая указанное в заголовке соединение (9,4 мг).MS (ES): M/Z [MH+] 415,1; вычисленная масса для C14H6Cl2F6N4+Н составляет 415,0. 1H-ЯМР (CDCl3): 2,16-2,27 (2 Н), 4,02-4,12 (2 Н), 7,76-7,80 (2 Н). Пример 4. 5-Амино-1-[2,6-дихлор-4-(трифторметил)фенил]-4-(пентафторциклопропил)-1 Н-пиразол 3-карбонитрил. Из соединения получения 4 (32 мг, 0,063 ммоль), получая указанное в заголовке соединение (10 мг).MS (ES): M/Z [MH+] 451,1; вычисленная масса для C14H4Cl2F8N4+Н составляет 451,0. 1H-ЯМР (CDCl3): 4,16-4,24 (2 Н), 7,77-7,81 (2 Н). Пример 5. 5-Амино-4-(2,2-дихлор-1-фторциклопропил)-1-[2,6-дихлор-4-(трифторметил)фенил]-1 Нпиразол-3-карбонитрил. Из соединения получения 5 (29 мг, 0,06 ммоль), получая указанное в заголовке соединение (5 мг) в виде твердого вещества белого цвета.MS (ES): M/Z [MH+] 446,8; вычисленная масса для C14H6Cl4F4N4+Н составляет 447,0. 1 Н-ЯМР (CDCl3): 2,25-2,34 (1 Н), 2,41-2,47 (1 Н), 4,09-4,18 (2 Н), 7,75-7,80 (2 Н). Пример 6. 5-Амино-1-[2,6-дихлор-4-пентафтортиофенил]-4-(пентафторциклопропил)-1 Н-пиразол-3 карбонитрил. Из соединения получения 6 (40 мг, 0,07 ммоль), получая указанное в заголовке соединение (20 мг) в виде твердого вещества белого цвета.MS (ES): M/Z [MH+] 509,2; вычисленная масса для C13H4Cl2F10N4S+Н составляет 509,0. 1H-ЯМР (CDCl3): 4,16-4,22 (2 Н), 7,91-7,93 (2 Н). Пример 7. 5-Амино-1-[2,6-дихлор-4-пентафтортиофенил]-4-(1,2,2-трифторциклопропил)-1 Н-пиразол 3-карбонитрил. Из соединения получения 7 (92 мг, 0,17 ммоль), получая указанное в заголовке соединение (46 мг).MS (ES): M/Z [MH+] 472,9; вычисленная масса для C13H6Cl2F8N4S+Н составляет 473,0. 1 Н-ЯМР (CDCl3): 2,14-2,27 (2 Н), 4,05-4,14 (2 Н), 7,89-7,92 (2 Н). Пример 8. 5-Амино-1-[2,6-дихлор-4-(трифторметил)фенил]-4-[1-(дифторметил)-2,2-дифторциклопропил]1 Н-пиразол-3-карбонитрил. К раствору соединения получения 23 (4,0 г, 8,0 ммоль) в 1,4-диоксане (50 мл) добавляли метанол (5 мл) и хлористо-водородную кислоту (10% в воде, 5 мл). Реакционную смесь нагревали при кипячении с обратным холодильником в течение 4 ч. К реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия, водную фазу отделяли и экстрагировали этилацетатом (320 мл). Объединенные органические фазы сушили (MgSO4) и концентрировали в вакууме. Остаток очищали хроматографией на колонках (силикагель, 70 г) при градиентном элюировании смесью петролейный эфир:диэтиловый эфир(от 1:0 до 0:1). Соответствующие фракции объединяли и концентрировали, получая рацемическое соединение примера 8 (3,2 г).MS (ES): M/Z [MH+] 448,9; вычисленная масса для C15H7Cl2F7N4+Н составляет 447,0. 1 Н-ЯМР (CDCl3): 2,04-2,11 (1 Н), 2,13-2,20 (1 Н), 3,82-3,90 (2 Н), 5,63-5,89 (1 Н), 7,73-7,79 (2 Н). Рацемическое соединение примера 8 (88 мг) растворяли в смеси этанол:гексан (1:1) и энантиомеры разделяли автоматизированной препаративной жидкостной хроматографией (система Gilson, колонка 25020 мм ID Chiralcel OD, 10 мкм) с использованием смеси этанол:гексан (2:8) в качестве подвижной фазы. Соответствующие фракции объединяли и концентрировали, получая соединение примера 8 а (40 мг) и примера 8b (40 мг). Пример 8 а.MS (ES): МН+446,8, для C15H7Cl2F7N4+Н вычислено 447,0. ВЭЖХ: (система Gilson, колонка 25020 мм ID Chiralcel OD, 10 мкм), этанол:гексан (2:8), время удерживания 17,4 мин, энантиомерная чистота 100%. Пример 9. 5-Амино-1-[2,6-дихлор-4-(трифторметил)фенил]-4-(2,2-дифторциклопропил)-1 Н-пиразол 3-карбонитрил. К раствору соединения получения 31 (560 мг, 1,40 ммоль) и фториду натрия (4,0 мг, 0,12 ммоль) в толуоле (0,8 мл) при 100 С добавляли триметилсилил-2,2-дифтор-2-(фторсульфонил)ацетат (700 мг, 2,8 ммоль) в течение 1 ч, используя шприц. Реакционную смесь нагревали при кипячении с обратным холодильником в течение 1 ч. К охлажденной реакционной смеси добавляли силикагель и раствор концентрировали в вакууме. Смесь продукт:силикагель частично очищали хроматографией на колонках при элюировании смесью диэтиловый эфир:гексан (1:1) и содержащие продукт фракции концентрировали в вакууме. К остатку добавляли метанол (5 мл) и хлористо-водородную кислоту (2 н., 5 мл) и реакционную смесь на- 16010740 гревали при кипячении с обратным холодильником в течение 6 ч. Реакционную смесь концентрировали в вакууме и остаток распределяли между диэтиловым эфиром и водой (20 мл). Два слоя разделяли, органический слой сушили (MgSO4) и концентрировали в вакууме. Остаток очищали хроматографией на колонках при градиентном элюировании смесью диэтиловый эфир:гексан (от 1:2 до 1:1). Соответствующие фракции объединяли и концентрировали, получая соединение примера 9 (96 мг) в виде твердого вещества белого цвета.MS (ES): M/Z [MH+] 397,1; вычисленная масса для C14H7Cl2F5N4+Н составляет 397,0. 1H-HMP (CDCl3): 1,74-1,83 (1 Н), 1,95-2,05 (1 Н), 2,44-2,56 (1 Н), 3,72-3,84 (2 Н), 7,76-7,81 (2 Н). Аналогично примеру 2 получали следующее. Пример 10. 5-Амино-4-[2,2-дифтор-1-(трифторметил)циклопропил]-1-[2,6-дифтор-4-(трифторметил) фенил]-1 Н-пиразол-3-карбонитрил. Из соединения получения 10 (250 мг, 0,51 ммоль), получая указанное в заголовке соединение (11 мг).MS (ES): M/Z [MH+] 433,0; вычисленная масса для C15H6F10N4+Н составляет 433,1. 1 Н-ЯМР (CDCl3): 2,02-2,09 (2 Н), 2,29-2,42 (1 Н), 4,63-4,76 (1 Н), 7,30-7,37 (2 Н). Аналогично примеру 8 получали следующее. Пример 11. 5-Амино-1-[2,6-дихлор-4-пентафтортиофенил]-4-[1-(дифторметил)-2,2-дифторциклопропил]1 Н-пиразол-3-карбонитрил. Из соединения получения 11 (655 мг, 1,17 ммоль), получая указанное в заголовке рацемическое соединение (284 мг).MS (ES): M/Z [MH+] 504,9; вычисленная масса для C14H7Cl2F9N4S+Н составляет 505,0. 1 Н-ЯМР (CDCl3): 2,00-2,09 (1 Н), 2,12-2,20 (1 Н), 3,87-3,96 (2 Н), 5,61-5,90 (1 Н), 7,88-7,91 (2 Н). Рацемическое соединение примера 11 растворяли в смеси этанол:гексан (1:1) и энантиомеры разделяли автоматизированной препаративной жидкостной хроматографией (система Gilson, колонка 25020 мм IDChiralcel OD, 10 мкм) с использованием смеси этанол:гексан (2:8) в качестве подвижной фазы. Соответствующие фракции объединяли и концентрировали, получая два обогащенных продукта примера 11 а и примера 11b. Пример 11 а.MS (ES): МН+504,9, для C14H7C12F9N4S+Н вычислено 505,0. ВЭЖХ: (система Gilson, колонка 25020 мм ID Chiralcel OD, 10 мкм), этанол:гексан (2:8), время удерживания 13,89 мин, энантиомерная чистота 100%. Пример 12. 5-Амино-4-1-[хлор(фтор)метил]-2,2-дифторциклопропил-1-[2,6-дихлор-4-(трифторметил)фенил]-1 Н-пиразол-3-карбонитрил. Из соединения получения 12 (100 мг, 0,19 ммоль), получая указанное в заголовке рацемическое соединение (20 мг).MS (ES): M/Z [MH+] 462,8; вычисленная масса для C15H7Cl3F6N+Н составляет 463,0. 1H-ЯМР (CDCl3): 2,03-2,11 (1 Н), 2,16-2,25 (1 Н), 3,84-3,95 (2 Н), 6,02-6,16 (1 Н), 7,73-7,80 (2 Н). Рацемическое соединение примера 12 растворяли в смеси этанол:гексан (1:1) и энантиомеры разделяли автоматизированной препаративной жидкостной хроматографией (система Gilson, колонка 25020 ммID Chiralcel OD, 10 мкм) с использованием смеси этанол:гексан (2:8) в качестве подвижной фазы. Соответствующие фракции объединяли и концентрировали, получая два энантиомерно обогащенных продукта примера 12 а и примера 12b. Пример 12 а.MS (ES): МН+462,9, для C15H7Cl3F6N4+Н вычислено 463,0. ВЭЖХ: (система Gilson, колонка 25020 мм ID Chiralcel OD, 10 мкм), этанол:гексан (2:8), время удерживания 21,44 мин, энантиомерная чистота 100%. Пример 13. 5-Амино-1-[2,6-дихлор-4-(трифторметил)фенил]-4-[1-(дифторметил)-2,2,3,3-тетрафторциклопропил]-1 Н-пиразол-3-карбонитрил. Из соединения получения 13 (48 мг, 0,09 ммоль), получая указанное в заголовке соединение (17 мг).MS (ES): M/Z [MH+] 482,7; вычисленная масса для C15H5Cl2F9N4+Н составляет 483,0. 1 Н-ЯМР (CDCl3): 3,84-3,91 (2 Н), 5,95-6,24 (1 Н), 7,76-7,79 (2 Н). Пример 14. 5-Амино-1-[2,6-дихлор-4-(трифторметил)фенил]-4-[2,2,3,3-тетрафтор-1-(трифторметил) циклопропил]-1 Н-пиразол-3-карбонитрил. Из соединения получения 14 (7 мг, 0,01 ммоль), получая указанное в заголовке соединение (4 мг).MS (ES): M/Z [MH+] 500,9; вычисленная масса для C15H4Cl2F10N4+Н составляет 501,0.- 17010740 Пример 15. 1-[2,6-Дихлор-4-(трифторметил)фенил]-4-[2,2-дифтор-1-(трифторметил)циклопропил]5-(метиламино)-1 Н-пиразол-3-карбонитрил. К раствору соединения примера 2 (500 мг, 1,08 ммоль) в триэтоксиметане (13,4 мл) добавляли концентрированную хлористо-водородную кислоту (несколько капель). Реакционную смесь нагревали при кипячении с обратным холодильником в течение 2,5 ч. Реакционную смесь концентрировали в вакууме,остаток повторно растворяли в толуоле и повторно концентрировали (2). К раствору остатка в этаноле(10 мл) при 0 С добавляли борогидрид натрия (90 мг, 2,37 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли уксусную кислоту (0,5 мл) и воду (10 мл) и смесь экстрагировали этилацетатом (310 мл). Объединенные органические фазы сушили (MgSO4) и концентрировали в вакууме. Остаток очищали хроматографией на колонках (силикагель) при загрузке в толуол и элюировании толуолом. Соответствующие фракции объединяли и концентрировали, получая рацемическое соединение примера 15 (323 мг).MS (ES): M/Z [MH+] 478,8; вычисленная масса для C16H8Cl2F8N4+Н составляет 479,0. 1H-ЯМР (CDCl3): 2,07-2,23 (1 Н), 2,42-2,58 (1 Н), 2,71-2,76 (3 Н), 3,51-3,66 (1 Н), 7,73-7,77 (2 Н). Рацемическое соединение примера 15 растворяли в смеси этанол:гексан (1:1) и энантиомеры разделяли автоматизированной препаративной жидкостной хроматографией (система Gilson, колонка 25020 ммID Chiralcel OD, 10 мкм) с использованием смеси этанол:гексан (1:9) в качестве подвижной фазы. Соответствующие фракции объединяли и концентрировали, получая два энантиомерно обогащенных продукта примера 15 а и примера 15b. Пример 15 а.MS (ES): МН+478,9, для C16H8Cl2F8N4+Н вычислено 479,0. ВЭЖХ: (система Gilson, колонка 25020 мм ID Chiralcel OD, 10 мкм), этанол:гексан (1:9), время удерживания 11,26 мин, энантиомерная чистота 100%. Аналогично примеру 8 получали следующее. Пример 16. 5-Амино-1-[2,6-дихлор-4-(трифторметокси)фенил]-4-[2,2-дифтор-1-(трифторметил)циклопропил]-1 Н-пиразол-3-карбонитрил. Из соединения получения 15 (1,0 г, 1,86 ммоль), получая указанное в заголовке рацемическое соединение (630 мг).MS (ES): M/Z [MH+] 480,9; вычисленная масса для C15H6Cl2F8N4O+Н составляет 481,0. 1 Н-ЯМР (CDCl3): 2,05-2,18 (1 Н), 2,41-2,52 (1 Н), 3,87-3,95 (2 Н), 7,37-7,40 (2 Н). Рацемическое соединение примера 16 растворяли в смеси этанол:гексан (1:1) и энантиомеры разделяли автоматизированной препаративной жидкостной хроматографией (система Gilson, колонка 25020 ммID Chiralcel OD, 10 мкм) с использованием смеси этанол:гексан (5:95) в качестве подвижной фазы. Соответствующие фракции объединяли и концентрировали, получая два энантиомерно обогащенных продукта примера 16 а и примера 16b. Пример 16 а.MS (ES): МН+480,9, для C15H6Cl2F8N4O+Н вычислено 481,0. ВЭЖХ: (система Gilson, колонка 25020 мм ID Chiralcel OD, 10 мкм), этанол:гексан (5:95), время удерживания 9,91 мин, энантиомерная чистота 100%. Пример 17. 5-Амино-1-[2,6-дихлор-4-(трифторметокси)фенил]-4-[1-(дифторметил)-2,2,3,3-тетрафторциклопропил]-1 Н-пиразол-3-карбонитрил. Из соединения получения 16 (50 мг, 0,09 ммоль), получая указанное в заголовке соединение (10 мг).MS (ES): M/Z [MH+] 498,9; вычисленная масса для C15H5Cl2F9N4O+Н составляет 499,0. 1H-ЯМР (CDCl3): 3,86-3,91 (2 Н), 5,95-6,23 (1 Н), 7,38-7,40 (2 Н). Пример 18. 5-Амино-1-[2,6-дихлор-4-(трифторметокси)фенил]-4-[1-(дифторметил)-2,2-дифторциклопропил]-1 Н-пиразол-3-карбонитрил. Из соединения получения 17 (3,6 г, 7,0 ммоль), получая указанное в заголовке рацемическое соединение (3,0 г).MS (ES): M/Z [MH+] 463,0; вычисленная масса для C15H7Cl2F7N4O+Н составляет 463,0. 1H-ЯМР (CDCl3): 2,00-2,08 (1 Н), 2,10-2,19 (1 Н), 3,82-4,00 (2 Н), 5,60-5,90 (1 Н), 7,35-7,40 (2 Н). Рацемическое соединение примера 18 растворяли в смеси этанол:гексан (1:2) и энантиомеры разделяли автоматизированной препаративной жидкостной хроматографией (система Gilson, колонка 25020 ммID Chiralcel OD, 10 мкм) с использованием смеси этанол:гексан (1:9) в качестве подвижной фазы. Соот- 18010740 ветствующие фракции объединяли и концентрировали, получая два энантиомерно обогащенных продукта примера 18 а и примера 18b. Пример 18 а.MS (ES): MH+463,0, для C15H7Cl2F7N4O+Н вычислено 463,0. ВЭЖХ: (система Gilson, колонка 25020 мм ID Chiralcel OD, 10 мкм), этанол:гексан (1:9), время удерживания 31,58 мин, энантиомерная чистота 100%. Пример 19. 5-Амино-1-[2,6-дихлор-4-(трифторметил)фенил]-4-[2,2-дифтор-1-(фторметил)циклопропил]1 Н-пиразол-3-карбонитрил. Из соединения получения 18 (100 мг, 0,21 ммоль), получая указанное в заголовке рацемическое соединение (17 мг).MS (ES): M/Z [MH+] 428,9; вычисленная масса для C15H8Cl2F6N4+Н составляет 429,0. 1 Н-ЯМР (CDCl3): 1,84-1,93 (1 Н), 1,93-2,02 (1 Н), 3,68-4,06 (2 Н), 4,42-4,82 (2 Н), 7,73-7,78 (2 Н). Рацемическое соединение примера 19 растворяли в смеси этанол:гексан (1:1) и энантиомеры разделяли автоматизированной препаративной жидкостной хроматографией (система Gilson, колонка 25020 ммID Chiralcel OD, 10 мкм) с использованием смеси этанол:гексан (1:9) в качестве подвижной фазы. Соответствующие фракции объединяли и концентрировали, получая два энантиомерно обогащенных продукта примера 19 а и примера 19b. Пример 19 а.MS (ES): МН+429,0, для C15H8Cl2F6N4+Н вычислено 429,01. ВЭЖХ: (система Gilson, колонка 25020 мм ID Chiralcel OD, 10 мкм), этанол:гексан (1:9), время удерживания 20,89 мин, энантиомерная чистота 100%. Пример 20. 5-Амино-1-[2,6-дихлор-4-(трифторметил)фенил]-4-(2,2-дифтор-1-метилциклопропил)1 Н-пиразол-3-карбонитрил. Из соединения получения 19 (80 мг, 0,17 ммоль), получая указанное в заголовке соединение (56 мг).MS (ES): M/Z [MH+] 411,0; вычисленная масса для C15H9Cl2F5N4+Н составляет 411,0. 1 Н-ЯМР (CDCl3): 1,46-1,50 (3 Н), 1,56-1,63 (1 Н), 1,69-1,78 (1 Н), 3,62-3,76 (2 Н), 7,72-7,77 (2 Н). Пример 21. 5-Амино-1-2,6-дихлор-4-[(трифторметил)тио]фенил-4-[2,2-дифтор-1-(трифторметил) циклопропил]-1 Н-пиразол-3-карбонитрил. Из соединения получения 20 (1,8 г, 3,3 ммоль, получая указанное в заголовке соединение (1,1 г).MS (ES): M/Z [MH+] 496,9; вычисленная масса для C15H6Cl2F8N4S+Н составляет 496,9. 1H-ЯМР (CDCl3): 2,05-2,18 (1 Н), 2,42-2,52 (1 Н), 3,86-3,97 (2 Н), 7,75-7,80 (2 Н). Пример 22. 3-Циано-1-[2,6-дихлор-4-(трифторметил)фенил]-4-[2,2-дифтор-1-(трифторметил)циклопропил]-1 Н-пиразол-5-илэтилкарбамат. К раствору соединения примера 2 а (100 мг, 0,20 ммоль) в N,N-диметилформамиде (3 мл) добавляли гидрид натрия (10 мг, 0,20 ммоль), затем 1-хлорэтилэтиловкарбонат (37 мг, 0,24 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь концентрировали в вакууме и остаток растворяли в ацетонитриле (2 мл). Раствор очищали автоматизированной препаративной жидкостной хроматографией (система Gilson, колонка 150 мм 30 мм LUNA II С 18 10 мкм) с использованием градиента ацетонитрил:вода (от 60:40 до 95:5). Соответствующие фракции объединяли и концентрировали, получая соединение примера 22 (50 мг).MS (ES): M/Z [MH+] 536,9; вычисленная масса для C18H10Cl2F8N4O2+Н составляет 537,0. 1 Н-ЯМР (CDCl3): 1,07-1,14 (3 Н), 2,09-2,19 (1 Н), 2,48-2,57 (1 Н), 3,99-4,06 (2 Н), 6,16-6,24 (1 Н), 7,71-7,76 (2 Н). Аналогичным образом получали следующее. Пример 23. 1-[2,6-Дихлор-4-(трифторметил)фенил]-4-[2,2-дифтор-1-(трифторметил)циклопропил]5-(2-оксо-1,3-оксазолидин-3-ил)-1 Н-пиразол-3-карбонитрил. Из соединения примера 2 а (135 мг, 0,30 ммоль) и 2-бромэтилхлорформиата (60 мг, 0,33 ммоль), получая указанное в заголовке соединение (47 мг).MS (ES): M/Z [MH+] 534,9; вычисленная масса для C18H8Cl2F8N4O2+Н составляет 535,0. 1 Н-ЯМР (CDCl3): 2,31-2,39 (1 Н), 2,54-2,64 (1 Н), 4,00-4,10 (2 Н), 4,43-4,50 (2 Н), 7,75-7,78 (2 Н). Аналогично примеру 8 получали следующее. Пример 24. 5-Амино-1-[3-хлор-5-(трифторметил)пиридин-2-ил]-4-[2,2-дифтор-1-(трифторметил) циклопропил]-1 Н-пиразол-3-карбонитрил. Из соединения получения 22 (164 мг, 0,34 ммоль), получая указанное в заголовке соединение (60 мг).MS (ES): M/Z [MH+] 432,0; вычисленная масса для C14H6ClF8N5+H составляет 432,0.H-ЯМР (CDCl3): 2,02-2,19 (1 Н), 2,40-2,54 (1 Н), 5,13-5,22 (2H), 8,19-8,23 (1H), 8,63-8,67 (1H). Пример 25. Гидрохлоридная соль 2-(диметиламино)этил-3-циано-1-[2,6-дихлор-4-(трифторметил) фенил]-4-[2,2-дифтор-1-(трифторметил)циклопропил]-1 Н-пиразол-5-илкарбамата. К раствору соединения примера 2 а (100 мг, 0,22 ммоль) в смеси безводный дихлорметан:толуол(3:2, 2 мл) добавляли пиридин (40 мкл, 0,50 ммоль) и молекулярные сита (4 ). Полученный раствор добавляли к фосгену (20% в толуоле, 1,7 н., 300 мкл, 0,50 ммоль), при 0 С и в атмосфере азота, и реакционную смесь оставляли на 1 ч. Добавляли 2-(диметиламино)этанол (1 мл) и реакционную смесь оставляли на ночь, затем концентрировали в вакууме. Остаток растворяли в ацетонитриле (1,8 мл) и раствор очищали автоматизированной препаративной жидкостной хроматографией (система Gilson, колонка 150 мм 30 ммLUNA II С 18 10 мкм) с использованием градиента ацетонитрил:трифторуксусная кислота (0,1%) (от 35:65 до 95:5). Соответствующие фракции объединяли и концентрировали и к остатку добавляли хлористо-водородную кислоту, получая соединение примера 25 (100 мг).MS (ES): M/Z [MH+] 580,0; вычисленная масса для C20H15Cl2F8N5O2+Н составляет 580,1. 1H-ЯМР (CDCl3): 2,21-2,30 (1 Н), 2,47-2,56 (2 Н), 2,84-2,88 (6 Н), 3,19-3,24 (2 Н), 4,27-4,39 (2 Н), 7,717,74 (2 Н). Аналогичным образом получали следующее. Пример 26. 3-Циано-1-[2,6-дихлор-4-(трифторметил)фенил]-4-[2,2-дифтор-1-(трифторметил)циклопропил]-1 Н-пиразол-5-ил-2,2,2-трифторэтилкарбамат. Из соединения примера 2 а (100 мг, 0,22 ммоль) и 2,2,2-трифтопентанола, получая указанное в заголовке соединение (100 мг).MS (ES): M/Z [MH+] 590,9; вычисленная масса для C18H7Cl2F11N4O2+Н составляет 591,0. 1H-ЯМР (ДМСО): 2,61-2,71 (1 Н), 2,89-2,99 (1 Н), 4,62-4,73 (2 Н), 8,26-8,29 (2 Н), 10,89-10,97 (1 Н). Пример 27. 5-Амино-1-2,6-дихлор-4-[(трифторметил)сульфонил]фенил-4-[2,2-дифтор-1-(трифторметил)циклопропил]-1 Н-пиразол-3-карбонитрил. Смесь соединения примера 21 (600 мг, 1,2 ммоль) и 2-хлорпероксибензойной кислоты (929 мг, 5,4 ммоль) в дихлорметане (20 мл) перемешивали при комнатной температуре в течение 48 ч. Реакционную смесь промывали водным раствором гидроксида натрия, затем водой и рассолом. Органическую фазу сушили и концентрировали в вакууме. Остаток очищали флэш-хроматографией (силикагель) при градиентном элюировании смесью толуол:дихлорметан (от 1:0 до 0:1). Соответствующие фракции объединяли и концентрировали в вакууме. Остаток растворяли в смеси ацетонитрил:вода (1 мл) и раствор очищали автоматизированной препаративной жидкостной хроматографией (система Gilson, колонка 150 мм 30 ммLUNA II С 18 10 мкм) с использованием градиента ацетонитрил:вода (от 60:40 до 95:5). Соответствующие фракции объединяли и концентрировали, получая соединение примера 27 (27 мг).MS (ES): M/Z [MH+] 529,0; вычисленная масса для C15H6Cl2F8N4O2S+Н составляет 529,0. 1H-ЯМР (ДМСО): 2,11-2,22 (1 Н), 2,59-2,70 (1 Н), 6,68-6,73 (2 Н), 8,55-8,59 (2 Н). Пример 28. 1-[2,6-Дихлор-4-(трифторметил)фенил]-4-[2,2-дифтор-1-(трифторметил)циклопропил]5-[(пиридин-4-илметил)амино]-1 Н-пиразол-3-карбонитрил. К раствору соединения получения 25 (200 мг, 0,36 ммоль) в безводном метаноле (10 мл), в атмосфере азота и при 0 С, добавляли борогидрид натрия (34 мг, 0,90 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 2 ч. К реакционной смеси добавляли воду и рН смеси доводили до рН 2 добавлением хлористо-водородной кислоты (4 н.). Смесь нейтрализовали добавлением насыщенного водного раствора карбоната натрия, экстрагировали этилацетатом (310 мл), объединенные экстракты сушили (MgSO4) и концентрировали в вакууме. Остаток растворяли в смеси ацетонитрил:вода (3,6 мл) и раствор очищали автоматизированной препаративной жидкостной хроматографией (система Gilson, колонка 150 мм 30 мм LUNA II С 18 10 мкм) с использованием градиента ацетонитрил:вода (от 55:45 до 95:5). Соответствующие фракции концентрировали, получая соединение примера 28 (34 мг).MS (ES): M/Z [MH+] 556,0; вычисленная масса для C21H11Cl2F8N5+Н составляет 556,0. 1 Н-ЯМР (CDCl3): 2,20-2,34 (1 Н), 2,53-2,67 (1 Н), 4,10-4,17 (1 Н), 4,18-4,28 (2 Н), 7,01-7,05 (2 Н), 7,607,63 (2 Н), 8,44-8,48 (2 Н). Аналогично примеру 2 получали следующее. Пример 29. 5-Амино-1-[2,6-дихлор-4-(дифторметокси)фенил]-4-[2,2-дифтор-1-(трифторметил)циклопропил]-1 Н-пиразол-3-карбонитрил. Из соединения получения 26 (110 мг, 0,21 ммоль), получая указанное в заголовке соединение (48 мг).MS (ES): M/Z [MH+] 463,0; вычисленная масса для C15H7Cl2F7N4O+Н составляет 463,0. 1H-ЯМР (CDCl3): 2,01-2,19 (1 Н), 2,38-2,51 (1 Н), 3,83-3,98 (2 Н), 6,38-6,77 (1 Н), 7,27-7,32 (2 Н). Пример 30. 5-Амино-1-[2,6-дихлор-4-пентафтортиофенил]-4-[1-(дифторметил)-2,2,3,3-тетрафторциклопропил]-1 Н-пиразол-3-карбонитрил. Из соединения получения 27 (138 мг, 0,23 ммоль), получая указанное в заголовке соединение (100 мг).MS (ES): M/Z [MH+] 541,0; вычисленная масса для C14H5Cl2F11N4S+Н составляет 541,0. 1- 20010740 Аналогично примеру 25 получали следующее. Пример 31. 3-Циано-1-[2,6-дихлор-4-(трифторметил)фенил]-4-[2,2-дифтор-1-(трифторметил)циклопропил]-1 Н-пиразол-5-илизопропилкарбамат. Из соединения примера 2 а (50 мг, 0,11 ммоль) и 2 пропанола, получая указанное в заголовке соединение (44 мг).MS (ES): M/Z [MH+] 551,0; вычисленная масса для C19H12Cl2F8N4O2+Н составляет 551,0. 1H-ЯМР (ДМСО): 0,96-1,04 (6 Н), 2,61-2,71 (1 Н), 2,87-2,99 (1 Н), 4,59-4,67 (1 Н), 8,28-8,32 (2 Н), 10,1510,22 (1 Н). Пример 32. Гидрохлоридная соль 3-циано-1-[2,6-дихлор-4-(трифторметил)фенил]-4-[2,2-дифтор-1(трифторметил)циклопропил]-1 Н-пиразол-5-илпиридин-4-илметилкарбамата. Из соединения примера 2 а (50 мг, 0,11 ммоль) и пиридин-4-метанола, получая указанное в заголовке соединение (5 мг).MS (ES): M/Z [MH+] 600,0; вычисленная масса для C22H11Cl2F8N5O2+Н составляет 600,0. 1 Н-ЯМР (CD3OD): 2,24-2,35 (1 Н), 2,55-2,65 (1 Н), 5,21-5,23 (2 Н), 7,65-7,68 (2 Н), 7,92-7,94 (2 Н), 8,64-8,68 (2 Н). Пример 33. Гидрохлоридная соль 3-циано-1-[2,6-дихлор-4-(трифторметил)фенил]-4-[2,2-дифтор-1(трифторметил)циклопропил]-1 Н-пиразол-5-ил]пиридин-3-илметилкарбамата. Из соединения примера 2 а (50 мг, 0,11 ммоль) и пиридин-3-метанола, получая указанное в заголовке соединение (24 мг).MS (ES): M/Z [MH+] 600,0; вычисленная масса для C22H11Cl2F8N5O2+Н составляет 600,0. 1H-ЯМР (ДМСО): 2,63-2,73 (1 Н), 2,84-2,95 (1 Н), 5,11-5,16 (2 Н), 7,68-7,74 (1 Н), 7,95-8,01 (1 Н), 8,208,26 (2 Н), 8,61-8,64 (1 Н), 8,68-8,73 (1 Н), 10,55-10,68 (1 Н). Пример 34. Гидрохлоридная соль 3-циано-1-[2,6-дихлор-4-(трифторметил)фенил]-4-[2,2-дифтор-1(трифторметил)циклопропил]-1 Н-пиразол-5-илпиридин-2-илметилкарбамата. Из соединения примера 2 а (50 мг, 0,11 ммоль) и пиридин-2-метанола, получая указанное в заголовке соединение (31 мг).MS (ES): M/Z [MH+] 600,0; вычисленная масса для C22H11Cl2F8N5O2+Н составляет 600,0. 1 Н-ЯМР (ДМСО): 2,65-2,75 (1 Н), 2,86-2,97 (1 Н), 5,05-5,11 (2 Н), 7,11-7,16 (1 Н), 7,31-7,37 (1 Н), 7,777,82 (1 Н), 8,21-8,28 (2 Н), 8,46-8,51 (1 Н), 10,56-10,70 (1 Н). Пример 35. Гидрохлоридная соль 3-циано-1-[2,6-дихлор-4-(трифторметил)фенил]-4-[2,2-дифтор-1(трифторметил)циклопропил]-1 Н-пиразол-5-ил-1 Н-имидазол-5-илметилкарбамата. Из соединения примера 2 а (50 мг, 0,11 ммоль) и 5-(гидроксиметил)имидазола, получая указанное в заголовке соединение (2 мг).MS (ES): M/Z [MH+] 589,0; вычисленная масса для C20H10Cl2F8N6O2+Н составляет 589,0. Пример 36. Гидрохлоридная соль 3-циано-1-[2,6-дихлор-4-(трифторметил)фенил]-4-[2,2-дифтор-1(трифторметил)циклопропил]-1 Н-пиразол-5-ил-2-пирролидин-1-илэтилкарбамата. Из соединения примера 2 а (50 мг, 0,11 ммоль) и 1-(2-гидроксиэтил)пиридина, получая указанное в заголовке соединение (10 мг).MS (ES): M/Z [MH+] 606,1; вычисленная масса для C22H17Cl2F8N5O2+Н составляет 606,1. 1H-ЯМР (CD3OD): 1,93-2,01 (4 Н), 2,31-2,38 (1 Н), 2,56-2,64 (1 Н), 3,18-3,23 (4 Н), 3,30-3,35 (2 Н), 4,214,26 (2 Н), 7,95-7,99 (2 Н). Аналогично примеру 8 получали следующее. Пример 37. 5-Амино-4-1-[хлор(дифтор)метил]-2,2-дифторциклопропил-1-[2,6-дихлор-4-(трифторметил)фенил]-1 Н-пиразол-3-карбонитрил. Из соединения получения 55 (124 мг, 0,23 ммоль), получая указанное в заголовке соединение (17 мг).MS (ES): M/Z [MH+] 480,9; вычисленная масса для C15H6Cl3F7N4+Н составляет 480,96. 1H-ЯМР (CDCl3): 2,08-2,24 (1 Н), 2,46-2,61 (1 Н), 3,87-4,00 (2 Н), 7,75-7,79 (2 Н). Рацемическое соединение примера 37 растворяли в смеси этанол:гексан (1:4) и энантиомеры разделяли автоматизированной препаративной жидкостной хроматографией (система Gilson, колонка 25020 ммID Chiralcel IA, 5 мкм) с использованием смеси этанол:гексан (5:95) в качестве подвижной фазы. Соответствующие фракции объединяли и концентрировали, получая один энантиомерно чистый продукт,пример 37 а, и несколько смешанных фракций. Пример 37 а.MS (ES): МН+481,0, для C15H6Cl3F7N4+Н вычислено 481,0. ВЭЖХ: (система Gilson, колонка 25020 мм ID Chiralcel OD, 10 мкм), этанол:гексан (5:95), время удерживания 10,55 мин, энантиомерная чистота 98%. Следующие получения иллюстрируют синтез некоторых промежуточных соединений, используемых в получении соединений из предыдущих примеров. Получение 1. N'-3-Циано-1-[2,6-дихлор-4-(пентафтортио)фенил]-4-[2,2-дифтор-1-(трифторметил) циклопропил]-1 Н-пиразол-5-ил-N,N-диметилимидоформамид. Смесь соединения получения 32 (264 мг, 0,5 ммоль), метилбензоата (100 мл) и фторида натрия (6 мг) нагревали при 105 С в атмосфере азота. Триметилсилил-2,2-дифтор-2-(фторсульфонил)ацетат (197 мл,- 21010740 1,0 ммоль) добавляли по каплям в течение 1 ч и реакционную смесь перемешивали при 105 С. Затем в течение 7 ч добавляли триметилсилил-2,2-дифтор-2-(фторсульфонил)ацетат (700 мл, 3,6 ммоль), поддерживая температуру реакционной смеси равной 105 С. К реакционной смеси добавляли дихлорметан (15 мл) и раствор промывали насыщенным водным гидрокарбонатом натрия. Органическую фазу отделяли, сушили (MgSO4) и концентрировали в вакууме. Остаток очищали, используя картридж Isolute (силикагель, 20 г), элюируя толуолом. Соответствующие фракции объединяли и концентрировали, получая соединение получения 1 (62 мг) в виде твердого вещества грязно-белого цвета.MS (ES): M/Z [MH+] 578,3; вычисленная масса для C17H11Cl2F10N5S+Н составляет 578,0. 1H-ЯМР (CDCl3): 2,15-2,20 (1 Н), 2,45-2,55 (1 Н), 2,79-2,81 (3 Н), 3,01-3,03 (3 Н), 7,79-7,81 (2 Н), 7,887,90 (1 Н). Аналогичным образом получали следующее. Получение 2. N'-3-Циано-1-[2,6-дихлор-4-(трифторметил)фенил]-4-[2,2-дифтор-1-(трифторметил) циклопропил]-1 Н-пиразол-5-ил-N,N-диметилимидоформамид. Из соединения получения 33 (160 мг, 0,34 ммоль), получая указанное в заголовке соединение (94 мг) в виде твердого вещества светло-желтого цвета.MS (ES): M/Z [MH+] 520,2; вычисленная масса для C18H11Cl2F8N5+Н составляет 520,0. 1 Н-ЯМР (CDCl3): 1,99-2,31 (2 Н), 2,74-2,80 (3 Н), 2,99-3,00 (3 Н), 7,64-7,69 (2 Н), 7,82-8,02 (1 Н). Получение 3. N'-3-Циано-1-[2,6-дихлор-4-(трифторметил)фенил]-4-[(1R)-1,2,2-трифторциклопропил]1 Н-пиразол-5-ил-N,N-диметилимидоформамид. К раствору соединения получения 34 (11 мг, 0,026 ммоль) в толуоле (0,2 мл) в атмосфере азота добавляли фенил(трифторметил)ртуть (45 мг, 0,13 ммоль) и йодид натрия (59 мг, 0,39 ммоль). Реакционную смесь нагревали при 85 С в течение 18 ч. К реакционной смеси добавляли толуол (5 мл) и раствор фильтровали через Arbocel, полностью удаляя остатки Hg. Фильтрат концентрировали в вакууме, получая соединение получения 3 (22 мг).MS (ES): M/Z [MH+] 470,2; вычисленная масса для C17H11Cl2F6N5+Н составляет 470,0. 1 Н-ЯМР (CDCl3): 2,08-2,31 (2 Н), 2,81-2,84 (3 Н), 3,04-3,08 (3 Н), 7,65-7,69 (2 Н), 7,85-7,88 (1 Н). Аналогичным образом получали следующее. Получение 4. N'-[3-Циано-1-[2,6-дихлор-4-(трифторметил)фенил]-4-(пентафторциклопропил)-1 Нпиразол-5-ил]-N,N-диметилимидоформамид. Из соединения получения 35 (46 мг, 0,1 ммоль), получая указанное в заголовке соединение (35 мг) в виде твердого вещества белого цвета.MS (ES): M/Z [MH+] 506,2; вычисленная масса для C17H9Cl2F8N5+Н составляет 506,0. 1H-ЯМР (CDCl3): 2,85-2,87 (3 Н), 3,07-3,09 (3 Н), 7,67-7,69 (2 Н), 7,69-7,71 (1 Н). Получение 5. N'-3-Циано-4-(2,2-дихлор-1-фторциклопропил)-1-[2,6-дихлор-4-(трифторметил)фенил]1 Н-пиразол-5-ил-N,N-диметилимидоформамид. Из соединения получения 34 (42 мг, 0,1 ммоль) и фенил(трихлорметил)ртути (40 мг, 0,1 ммоль), получая указанное в заголовке соединение (29 мг) в виде твердого вещества белого цвета. 1 Н-ЯМР (CDCl3): 2,31-2,34 (1 Н), 2,35-2,38 (1 Н), 2,82-2,86 (3 Н), 3,09-3,13 (3 Н), 7,66-7,69 (2 Н), 7,998,03 (1 Н). Получение 6. N'-[3-Циано-1-[2,6-дихлор-4-(пентафтортио)фенил]-4-(пентафторциклопропил)-1 Нпиразол-5-ил]-N,N-диметилимидоформамид. К раствору соединения получения 37 (102 мг, 0,20 ммоль) в метилбензоате (4 мл) добавляли фторид натрия (3 мг). Смесь нагревали при 130 С и в течение 10 ч добавляли триметилсилил-2,2-дифтор-2-(фторсульфонил)ацетат (1 мл, 0,33 ммоль). Реакционную смесь концентрировали в вакууме и остаток очищали хроматографией на колонках (силикагель, 10 г), элюируя толуолом. Соответствующие фракции объединяли и концентрировали, получая соединение получения 6 (75 мг) в виде твердого вещества светло-желтого цвета.MS (ES): M/Z [MH+] 564,2; вычисленная масса для C16H9Cl2F10N5S+Н составляет 564,0. 1 Н-ЯМР: 2,86-2,90 (3 Н), 3,07-3,10 (3 Н), 7,69-7,72 (1 Н), 7,80-7,85 (2 Н). Аналогично получению 3 получали следующее. Получение 7. N'-[3-Циано-1-[2,6-дихлор-4-(пентафтортио)фенил]-4-(1,2,2-трифторциклопропил)1 Н-пиразол-5-ил]-N,N-диметилимидоформамид. Из соединения получения 38 (100 мг, 0,21 ммоль), получая указанное в заголовке соединение (90 мг) в виде твердого вещества белого цвета.MS (ES): M/Z [MH+] 527,9; вычисленная масса для C16H11Cl2F8N5S+Н составляет 528,0. 1 Н-ЯМР (CDCl3): 2,09-2,29 (2 Н), 2,82-2,86 (3 Н), 3,04-3,09 (3 Н), 7,79-7,83 (2 Н), 7,85-7,88 (1 Н). Получение 8. N'-3-Циано-1-[2,6-дихлор-4-(трифторметил)фенил]-4-[1-(дифторметил)винил]-1 Нпиразол-5-ил-N,N-диметилимидоформамид. К суспензии метилатрифенилфосфонийбромида (8,9 г, 25,0 ммоль) в тетрагидрофуране (80 мл) при-10 С добавляли по каплям бутиллитий (1,6 М в гексане, 16 мл, 25,0 ммоль). Смесь перемешивали при комнатной температуре в течение 20 мин, затем добавляли соединение получения 39 (7,6 г, 16,7 ммоль) в тетрагидрофуране (16,5 мл). Реакционную смесь перемешивали при комнатной температуре в течение- 22010740 ночи. К реакционной смеси добавляли воду и смесь экстрагировали этилацетатом (2x50 мл). Объединенные органические фазы разделяли и концентрировали на силикагеле. Смесь силикагель:продукт очищали хроматографией на колонках, элюируя дихлорметаном. Соответствующие фракции объединяли и концентрировали, получая соединение получения 8 (5,2 г).MS (ES): M/Z [MH+] 454,0; вычисленная масса для C17H12Cl2F5N5+Н составляет 452,1. 1H-ЯМР (CDCl3): 2,74-2,76 (3 Н), 2,91-2,94 (3 Н), 5,77-5,79 (1 Н), 5,91-5,94 (1 Н), 6,16-6,45 (1 Н), 7,627,64 (1 Н), 7,65-7,68 (2 Н). Получение 9. Этиловый эфир 3-циано-2-оксопропионовой кислоты. Может быть получен согласно Achmatowicz, О., Jr.; Szymoniak, J. Tetrahedron (1982), 38 (9), 1299-1302. Аналогично получению 1 получали следующее. Получение 10. N'-3-Циано-4-[2,2-дифтор-1-(трифторметил)циклопропил]-1-[2,6-дифтор-4-(трифторметил)фенил]-1 Н-пиразол-5-ил-N,N-диметилимидоформамид. Из соединения получения 40 (250 мг, 0,57 ммоль), получая указанное в заголовке соединение (250 мг).MS (ES): M/Z [MH+] 488,1; вычисленная масса для C18H11F10N5+Н составляет 488,1. Аналогично получению 3 получали следующее. Получение 11. N'-3-Циано-1-[2,6-дихлор-4-(пентафтортиофенил]-4-[1-(дифторметил)-2,2-дифторциклопропил]-1 Н-пиразол-5-ил-N,N-диметилимидоформамид. Из соединения получения 41 (820 мг, 1,61 ммоль), получая указанное в заголовке соединение (655 мг).MS (ES): M/Z [MH+] 559,9; вычисленная масса для C17H12Cl2F9N5S+Н составляет 560,0. 1 Н-ЯМР (CDCl3): 1,81-1,90 (1 Н), 2,03-2,12 (1 Н), 2,76-2,79 (3 Н), 2,99-3,01 (3 Н), 5,64-5,93 (1 Н), 7,787,81 (2 Н), 7,87-7,89 (1 Н). Получение 12. N'-4-1-[Хлор(фтор)метил]-2,2-дифторциклопропил-3-циано-1-[2,6-дихлор-4-(трифторметил)фенил]-1 Н-пиразол-5-ил-N,N-диметилимидоформамид. Из соединения получения 42 (150 мг, 0,32 ммоль), получая указанное в заголовке соединение (100 мг).MS (ES): M/Z [MH+] 517,9; вычисленная масса для C18H12Cl3F6N5+Н составляет 518,0. 1H-ЯМР (CDCl3): 1,86-1,97 (1 Н), 2,05-2,15 (1 Н), 2,73-2,80 (3 Н), 2,95-3,01 (3 Н), 6,06-6,22 (1 Н), 7,637,71 (2 Н), 7,88-7,94 (1 Н). Получение 13. N'-3-Циано-1-[2,6-дихлор-4-(трифторметил)фенил]-4-[1-(дифторметил)-2,2,3,3-тетрафторциклопропил]-1 Н-пиразол-5-ил-N,N-диметилимидоформамид. Из соединения получения 43 (200 мг, 0,41 ммоль), получая указанное в заголовке соединение (48 мг).MS (ES): M/Z [MH+] 537,8; вычисленная масса для C18H10Cl2F9N5+Н составляет 538,0. Получение 14. N'-3-Циано-1-[2,6-дихлор-4-(трифторметил)фенил]-4-[2,2,3,3-тетрафтор-1-(трифторметил)циклопропил]-1 Н-пиразол-5-ил-N,N-диметилимидоформамид. Из соединения получения 44 (28 мг, 0,06 ммоль), получая указанное в заголовке соединение (7 мг).MS (ES): M/Z [MH+] 555,8; вычисленная масса для C18H9Cl2F10N5+Н составляет 556,0. 1H-ЯМР (CDCl3): 2,79-2,81 (3 Н), 2,99-3,00 (3 Н), 7,65-7,67 (1 Н), 7,67-7,69 (2 Н). Получение 15. N'-3-Циано-1-[2,6-дихлор-4-(трифторметокси)фенил]-4-[2,2-дифтор-1-(трифторметил) циклопропил]-1 Н-пиразол-5-ил-N,N-диметилимидоформамид. Используя набор Diazald, раствор Diazald в диэтиловом эфире (45 мл) добавляли по каплям к раствору гидроксида калия (1 М, 89 мл) в воде и этаноле (10 мл) при приблизительно 50 С. Смесь охлаждали до -30 С и после полного добавления Diazld к смеси добавляли диэтиловый эфир (10 мл). Перегонку продолжали до обесцвечивания дистиллята и раствор диазометана добавляли к соединению получения 45 (1,0 г, 1,92 ммоль) в диэтиловом эфире (30 мл). Реакционную смесь оставляли при комнатной температуре в течение ночи. Лишний диазометан разрушали добавлением уксусной кислоты и реакционную смесь оставляли для испарения, получая соединение получения 15 (1,0 г).MS (ES): M/Z [MH+] 536,0; вычисленная масса для C18H11Cl2F8N5O+Н составляет 536,0. Аналогично получению 3 получали следующее. Получение 16. N'-3-Циано-1-[2,6-дихлор-4-(трифторметокси)фенил]-4-[1-(дифторметил)-2,2,3,3 тетрафторциклопропил]-1 Н-пиразол-5-ил-N,N-диметилимидоформамид. Из соединения получения 47 (650 мг, 1,3 ммоль) в толуоле, получая указанное в заголовке соединение (50 мг) в виде смеси продуктов.MS (ES): M/Z [MH+] 553,9; вычисленная масса для C18H10Cl2F9N5O+Н составляет 554,0. Получение 17. N'-3-Циано-1-[2,6-дихлор-4-(трифторметокси)фенил]-4-[1-(дифторметил)-2,2-дифторциклопропил]-1 Н-пиразол-5-ил-N,N-диметилимидоформамид. Из соединения получения 48 (3,60 г, 7,7 ммоль), получая указанное в заголовке соединение (3,6 г).MS (ES): M/Z [MH+] 518,1; вычисленная масса для C18H12Cl2F7N5O+Н составляет 518,0. 1H-ЯМР (CDCl3): 1,82-1,91 (1 Н), 2,02-2,11 (1 Н), 2,74-2,79 (3 Н), 2,97-3,00 (3 Н), 5,64-5,93 (1 Н), 7,267,31 (2 Н), 7,83-7,87 (1 Н). Получение 18. N'-3-Циано-1-[2,6-дихлор-4-(трифторметил)фенил]-4-[2,2-дифтор-1-(фторметил) циклопропил]-1 Н-пиразол-5-ил-N,N-диметилимидоформамид. Из соединения получения 49 (100 мг, 0,23 ммоль), получая указанное в заголовке соединение (100 мг).MS (ES): M/Z [MH+] 484,0; вычисленная масса для C18H13Cl2F6N5+Н составляет 484,1. Получение 19. N'-[3-Циано-1-[2,6-дихлор-4-(трифторметил)фенил]-4-(2,2-дифтор-1-метилциклопропил)1 Н-пиразол-5-ил]-N,N-диметилимидоформамид. Из соединения получения 50 (137 мг, 0,33 ммоль), получая указанное в заголовке соединение (80 мг).MS (ES): M/Z [MH+] 466,0; вычисленная масса для C18H14Cl2F5N5+Н составляет 466,1. Аналогично получению 15 получали следующее. Получение 20. N'-3-Циано-1-2,6-дихлор-4-[(трифторметил)тио]фенил-4-[2,2-дифтор-1-(трифторметил)циклопропил]-1 Н-пиразол-5-ил-N,N-диметилимидоформамид. Из соединения получения 51 (2,50 г, 4,6 ммоль), получая указанное в заголовке соединение (1,8 г).MS (ES): M/Z [MH+] 552,9; вычисленная масса для C18H11Cl2F8N5S+Н составляет 552,0. Получение 21. (2,6-Дифтор-4-трифторметилфенил)гидразин. Смесь 1,2,3-трифтор-5-(трифторметил)бензола (300 г, 1,5 ммоль) и гидразинмоногидрата (300 г, 6,0 ммоль) в этаноле (1200 мл) нагревали при кипячении с обратным холодильником в течение ночи. Реакционную смесь концентрировали в вакууме и остаток перекристаллизовывали из 2-пропанола, получая соединение получения 21 (194 г).MS (ES): M/Z [MH+] 213,2; вычисленная масса для C7H5F5N2+Н составляет 213,1. 1H-ЯМР (CDCl3): 3,81-4,08 (2 Н), 5,23-5,41 (1 Н), 7,03-7,14 (2 Н). Аналогично получению 3 получали следующее. Получение 22. N'-1-[3-Хлор-5-(трифторметил)пиридин-2-ил]-3-циано-4-[2,2-дифтор-1-(трифторметил) циклопропил]-1 Н-пиразол-5-ил-N,N-диметилимидоформамид. Из соединения получения 52 (800 мг, 1,83 ммоль), получая указанное в заголовке соединение (260 мг).MS (ES): M/Z [MH+] 487,2; вычисленная масса для C17H11ClF8N6+Н составляет 487,1. Получение 23. N'-3-Циано-1-[2,6-дихлор-4-(трифторметил)фенил]-4-[1-(дифторметил)-2,2-дифторциклопропил]-1 Н-пиразол-5-ил-N,N-диметилимидоформамид. Из соединения получения 8 (4,52 г, 10,0 ммоль), получая указанное в заголовке соединение (4,0 г).MS (ES): M/Z [MH+] 501,92; вычисленная масса для C18H12Cl2F7N5+Н составляет 502,04. 1 Н-ЯМР (CDCl3): 1,82-1,91 (1 Н), 2,03-2,11 (1 Н), 2,73-2,78 (3 Н), 2,97-3,01 (3 Н), 5,66-5,93 (1 Н), 7,637,69 (2 Н), 7,85-7,89 (1 Н). Получение 24. Этил-2,3-дицианопропаноат. Может быть получен согласно Hainzl, D.; Cole, L.M.; Casida, J.E. Chemical Research in Toxicology(1998), 11 (12), 1529-1535. Получение 25. 1-[2,6-Дихлор-4-(трифторметил)фенил]-4-[2,2-дифтор-1-(трифторметил)циклопропил]5-[(1E)-пиридин-4-илметилен]амино-1 Н-пиразол-3-карбонитрил. К соединению примера 2 а (120 мг, 0,26 ммоль) и 4 молекулярным ситам в толуоле (10 мл) добавляли изоникотинальдегид (550 мл, 6,71 ммоль) и п-толуолсульфоновую кислоту (каталитическое количество, 5 мг). Реакционную смесь нагревали при кипячении с обратным холодильником, используя прибор Дина Старка, в течение 9 дней. К реакционной смеси добавляли воду и рН смеси доводили до рН 2 добавлением хлористо-водородной кислоты (4 н.). Смесь нейтрализовали добавлением насыщенного водного раствора карбоната натрия, экстрагировали этилацетатом (320 мл), объединенные экстракты сушили(MgSO4) и концентрировали в вакууме, получая соединение получения 25 (200 мг).MS (ES): M/Z [MH+] 554,0; вычисленная масса для C21H9Cl2F8N5+Н составляет 554,0. Аналогично получению 15 получали следующее. Получение 26. N'-3-Циано-1-[2,6-дихлор-4-(дифторметокси)фенил]-4-[2,2-дифтор-1-(трифторметил) циклопропил]-1 Н-пиразол-5-ил-N,N-диметилимидоформамид. Из получения 53 (104 мг, 0,21 ммоль), получая указанное в заголовке соединение (110 мг).MS (ES): M/Z [MH+] 518,0; вычисленная масса для C18H12Cl2F7N5O+Н составляет 518,0. 1 Н-ЯМР (CDCl3): 2,05-2,21 (1 Н), 2,41-2,55 (1 Н), 2,77-2,81 (3 Н), 2,98-3,00 (3 Н), 6,36-6,72 (1 Н), 7,187,21 (2 Н), 7,22-7,24 (1 Н). Аналогично получению 3 получали следующее. Получение 27. N'-3-Циано-1-[2,6-дихлор-4-пентафтортиофенил]-4-[1-(дифторметил)-2,2,3,3-тетрафторциклопропил]-1 Н-пиразол-5-ил-N,N-диметилимидоформамид. Из соединения получения 54 (618 мг, 1,13 ммоль), получая указанное в заголовке соединение (138 мг).MS (ES): M/Z [MH+] 596,1; вычисленная масса для C17H10Cl2F11N5S+Н составляет 596,0. 1 Н-ЯМР (CDCl3): 2,78-2,81 (3 Н), 2,99-3,02 (3 Н), 5,95-6,24 (1 Н), 7,76-7,79 (1 Н), 7,79-7,82 (2 Н). Получение 28. 2,6-Дихлор-4-дифторметоксианилин. К раствору 4-[(дифторметокси)метил]анилина (15,0 г, 94,3 ммоль) в ацетонитриле (150 мл) добавляли N-хлорсукцинимид (25,2 г, 18,9 ммоль) и реакционную смесь перемешивали в атмосфере азота в течение 2 ч. Реакционную смесь концентрировали в вакууме и остаток распределяли между диэтиловым эфиром (500 мл) и водой (125 мл). Органический слой отделяли, промывали водным раствором тиосульфата натрия, водой и рассолом, сушили (MgSO4) и обрабатывали активированным углем. Раствор фильтровали и концентрировали в вакууме. Остаток экстрагировали гексаном (2300 мл) и объединенные экс- 24010740 тракты концентрировали в вакууме, получая соединение получения 28 (13,8 г).MS (ES): M/Z [MH+] 228; вычисленная масса для C7H5Cl2F2NO+Н составляет 227,98. Получение 29. 5-Амино-1-[2,6-дифтор-4-(трифторметил)фенил]-1 Н-пиразол-3-этилкарбоксилат. К раствору соединения получения 9 (92,6 г, 0,66 ммоль) в этаноле (2 л) добавляли соединение получения 21 (95,0 г, 0,45 ммоль) и реакционную смесь нагревали при кипячении с обратным холодильником в течение ночи. Реакционную смесь охлаждали и добавляли гидрокарбонат натрия (36,0 г, 0,43 ммоль). Смесь нагревали при кипячении с обратным холодильником в течение ночи. Реакционную смесь концентрировали в вакууме и к остатку добавляли диэтиловый эфир (1 л). Раствор фильтровали, промывали водой, хлористо-водородной кислотой и снова водой, сушили и концентрировали в вакууме. Остаток очищали хроматографией на колонках (силикагель, 70 г), элюируя толуолом. Соответствующие фракции объединяли и концентрировали, получая соединение получения 29 (40 г).MS (ES): M/Z [MH+] 336,1; вычисленная масса для C13H10F5N3O2+Н составляет 336,1. Получение 30. 5-Амино-1-(2,6-дихлор-4-дифторметоксифенил)-1 Н-пиразол-3-карбонитрил. К серной кислоте (концентрированной, 21 мл) при 15 С добавляли нитрит натрия (4,8 г, 69,6 ммоль). После перемешивания в течение 1 ч добавляли ледяную уксусную кислоту (17,3 мл), затем соединение получения 28 (13,8 г, 60,3 ммоль) в уксусной кислоте (33,8 мл), которое добавляли по каплям, поддерживая температуру смеси ниже 25 С. Раствор нагревали при 50 С в течение 1 ч, охлаждали и добавляли по каплям к смеси получения 24 (10,6 г, 69,6 ммоль), уксусной кислоты (42,8 мл) и смеси лед:вода (55 мл) при 0 С. Реакционную смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли дихлорметан (300 мл) и смесь перемешивали. Два слоя разделяли и органический слой промывали водой. К органическому слою добавляли гидроксид аммония (концентрированный, 125 мл) и лед и смесь перемешивали при 5 С в течение 4 ч. Органический слой снова отделяли и перемешивали в течение ночи с активированным углем. Смесь фильтровали через Celite и фильтрат концентрировали в вакууме. Остаток очищали хроматографией на колонках (Biotage, силикагель, 90 г), элюируя дихлорметаном. Соответствующие фракции объединяли и концентрировали, получая соединение получения 30 (3,1 г).MS (ES): M/Z [MH+] 319,0; вычисленная масса для C11H6Cl2F2N4O+Н составляет 319,0. 1H-ЯМР (CDCl3): 3,60-3,88 (2 Н), 6,38-6,75 (1 Н), 7,22-7,23 (1 Н), 7,27-7,29 (2 Н). Получение 31. N'-3-Циано-1-[2,6-дихлор-4-(трифторметил)фенил]-4-винил-1 Н-пиразол-5-ил-N,Nдиметилимидоформамид. Раствор соединения получения 57 (500 мг, 1,44 ммоль) в N,N-диметилформамиддиметилацетале (6 мл) нагревали при кипячении с обратным холодильником в течение 1 ч. Реакционную смесь охлаждали и концентрировали в вакууме. К остатку добавляли диэтиловый эфир (10 мл), затем гексан, до осаждения. Раствор концентрировали в токе азота, получая неочищенный продукт. Неочищенный продукт промывали гексаном и сушили в вакууме, получая соединение получения 31 (560 мг) в виде твердого вещества светло-желтого цвета.MS (ES): M/Z [MH+] 402,2; вычисленная масса для C16H12Cl2F3N5+H составляет 402,1. 1H-ЯМР (CDCl3): 2,81-2,87 (3 Н), 3,00-3,05 (3 Н), 5,29-5,36 (1 Н), 5,91-6,00 (1 Н), 6,35-6,46 (1 Н), 7,647,67 (1 Н), 7,68-7,72 (2 Н). Получение 32. N'-3-Циано-1-[2,6-дихлор-4-(пентафтортио)фенил]-4-[1-(трифторметил)винил]-1 Нпиразол-5-ил-N,N-диметилимидоформамид. Смесь соединения получения 58 (4,0 г, 7,1 ммоль), получения 59 (3,0 г, 14,0 ммоль), водного раствора гидрокарбоната натрия (1 М, 40 мл), толуола (100 мл) и метанола (40 мл) дегазировали и помещали в атмосферу азота. К смеси добавляли тетракис(трифенилфосфин)палладий(0) (360 мг), реакционную смесь дегазировали и нагревали при кипячении с обратным холодильником в течение 8 ч. Реакционную смесь распределяли между водой (50 мл) и диэтиловым эфиром (75 мл). Два слоя разделяли и водный слой повторно экстрагировали диэтиловым эфиром (350 мл). Объединенные органические фазы сушили(Na2SO4) и концентрировали в вакууме. Остаток очищали, используя картридж Isolute (силикагель, 25 г) при градиентном элюировании смесью этилацетат:циклогексан (от 1:3 до 1:1). Соответствующие фракции объединяли и концентрировали и остаток повторно хроматографировали, используя картридж Isolute(силикагель, 70 г), элюируя толуолом. Содержащие продукт фракции концентрировали, получая соединение получения 32 (1,34 г).MS (ES): M/Z [MH+] 528,0; вычисленная масса для C16H11Cl2F8N5S+Н составляет 528,0. 1H-HMP (CDCl3): 2,74-2,78 (3 Н), 2,92-2,97 (3 Н), 5,85-5,89 (1 Н), 6,20-6,24 (1 Н), 7,63-7,66 (1 Н), 7,797,82 (2 Н). Аналогично получению 31 получали следующее. Получение 33. N'-3-Циано-1-[2,6-дихлор-4-(трифторметил)фенил]-4-[1-(трифторметил)винил]-1 Нпиразол-5-ил-N,N-диметилимидоформамид. Из соединения получения 60 (170 мг, 0,41 ммоль), получая указанное в заголовке соединение (140 мг) в виде твердого вещества белого цвета.MS (ES): M/Z [MH+] 470,2; вычисленная масса для C17H11Cl2F6N5+Н составляет 470,0. 1 Н-ЯМР (CDCl3): 2,76-2,80 (3 Н), 2,96-3,00 (3 Н), 5,90-5,92 (1 Н), 6,23-6,26 (1 Н), 7,66-7,68 (1 Н), 7,69- 25010740 7,72 (2 Н). Получение 34. N'-[3-Циано-1-[2,6-дихлор-4-(трифторметил)фенил]-4-(1-фторвинил)-1 Н-пиразол-5 ил]-N N-диметилимидоформамид. К раствору соединения получения 62 (2,9 г, 5,7 ммоль) и получения 61 (2,5 г, 7,5 ммоль) в N,N-диметилформамиде (50 мл) в атмосфере азота добавляли тетракис(трифенилфосфин)палладий(0) (330 мг,0,3 ммоль). Реакционную смесь нагревали при 80 С в течение 4 ч. К реакционной смеси добавляли воду(150 мл) и смесь экстрагировали этилацетатом (150 мл). Объединенные экстракты промывали водой(2100 мл) и насыщенным концентрированным раствором соли (100 мл), сушили (MgSO4) и концентрировали в вакууме. Остаток растирали в гексане, осадок собирали фильтрованием и сушили, получая соединение получения 34 (2,35 г) в виде твердого коричневого вещества. 1 Н-ЯМР (CDCl3): 2,76-2,78 (3 Н), 2,99-3,01 (3 Н), 4,92-5,10 (2 Н), 7,66-7,68 (2 Н), 7,70-7,73 (1 Н). Получение 35. N'-[3-Циано-1-[2,6-дихлор-4-(трифторметил)фенил]-4-(трифторвинил)-1 Н-пиразол-5 ил]-N,N-диметилимидоформамид. К суспензии дихлор-бис(трифенилфосфин)палладия (70 мг) в тетрагидрофуране (2 мл) добавляли диизобутилалюминийгидрид (1,5 М в толуоле, 133 мл). К полученному раствору добавляли бромфторэтилен (200 ммоль), затем соединение получения 64 (1,0 ммоль) и реакционную смесь нагревали при кипячении с обратным холодильником в атмосфере азота в течение ночи. Реакционную смесь распределяли между этилацетатом (50 мл) и водой, органическую фазу отделяли, промывали рассолом, сушили(MgSO4) и концентрировали в вакууме. Остаток очищали, используя колонку Isolute (силикагель, 20 г),элюируя дихлорметаном. Соответствующие фракции объединяли и концентрировали и остаток растворяли в гексане. Полученный осадок отделяли и сушили, получая соединение получения 35 (200 мг) в виде твердого кристаллического вещества.MS (ES): M/Z [MH+] 456,2; вычисленная масса для C16H9Cl2F6N5+Н составляет 456,0. 1H-ЯМР (CDCl3): 2,77-2,80 (3 Н), 3,02-3,05 (3 Н), 7,67-7,69 (2 Н), 7,74-7,77 (1 Н). Получение 36. 2,6-Дихлор-4-трифторметилтиоанилин. К раствору соединения получения 97 (4,8 г, 25,0 ммоль) в ацетонитриле (50 мл) при 50 С добавлялиN-хлорсукцинимид (6,7 г, 50,0 ммоль). Реакционную смесь перемешивали при 50 С в течение 1 ч. К реакционной смеси добавляли воду (150 мл) и смесь экстрагировали дихлорметаном (100 мл). Объединенные экстракты сушили (MgSO4) и концентрировали в вакууме, получая соединение получения 36 (1,0 г). Получение 37. N'-[3-Циано-1-[2,6-дихлор-4-(пентафтортио)фенил]-4-(трифторвинил)-1 Н-пиразол-5 ил]-N,N-диметилимидоформамид. Суспензию цинка Rieke в тетрагидрофуране (5%, 26 мл, 20 ммоль) перемешивали в атмосфере азота. Атмосферу азота заменяли бромтрифторэтиленом (приблизительно 40 ммоль) и раствор перемешивали в течение еще 3 ч. Азот пропускали через раствор и избытку цинка давали выпасть в осадок, оставляя раствор супернатанта желаемого цинкового реагента. К раствору соединения получения 58 (2,24 г,4,0 ммоль) и тетракис(трифенилфосфин)палладия(0) (231 мг) в тетрагидрофуране (5 мл) добавляли раствор цинкового реагента (12 мл, приблизительно 5,0 ммоль). Реакционную смесь нагревали при кипячении с обратным холодильником в атмосфере азота в течение 5 ч. К реакционной смеси добавляли избыток водной уксусной кислоты (разбавленной) и смесь экстрагировали дихлорметаном (150 мл). Экстракты промывали рассолом, сушили (MgSO4) и концентрировали в вакууме. Остаток очищали, используя колонку Isolute (силикагель, 50 г), элюируя толуолом. Соответствующие фракции объединяли и концентрировали, получая соединение получения 37 (913 мг).MS (ES): M/Z [MH+] 514,2; вычисленная масса для C15H9Cl2F8N5S+Н составляет 514,0. 1H-ЯМР (CDCl3): 2,79-2,82 (3 Н), 3,03-3,06 (3 Н), 7,75-7,77 (1 Н), 7,80-7,83 (2 Н). Аналогично получению 34 получали следующее. Получение 38. N'-[3-Циано-1-[2,6-дихлор-4-пентафтортиофенил]-4-(1-фторвинил)-1 Н-пиразол-5 ил]-N,N-диметилимидоформамид. Из соединений получения 58 (380 мг, 0,68 ммоль) и получения 61 (295 мг, 0,88 ммоль), получая указанное в заголовке соединение (85 мг).MS (ES): M/Z [MH+] 477,9; вычисленная масса для C15H11Cl2F6N5S+Н составляет 478,0. 1H-ЯМР (CDCl3): 2,77-2,81 (3 Н), 2,99-3,03 (3 Н), 4,92-5,09 (2 Н), 7,70-7,73 (1 Н), 7,79-7,82 (2 Н). Получение 39. N'-[3-Циано-1-[2,6-дихлор-4-(трифторметил)фенил]-4-(дифторацетил)-1 Н-пиразол-5 ил]-N,N-диметилимидоформамид. К раствору соединения получения 62 (12,5 г, 25,0 ммоль) в тетрагидрофуране (50 мл) при -30 С добавляли по каплям изопропилмагнийхлорид (2 М в тетрагидрофуране, 13,75 мл, 27,5 ммоль). Реакционную смесь перемешивали при -30 С в течение 30 мин, затем добавляли хлорангидрид дифторуксусной кислоты (2 М в тетрагидрофуране, 18,75, 37,5 ммоль). Реакционной смеси давали нагреться до комнатной температуры. К реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия и смесь экстрагировали этилацетатом (3). Объединенные органические фазы промывали насыщенным раствором хлорида натрия, сушили (MgSO4) и концентрировали в вакууме. Остаток перекристаллизовывали из диэтилового эфира добавлением петролейного эфира, получая соединение получения 39 (7,6 г).H-ЯМР (CDCl3): 2,78-2,82 (3 Н), 3,08-3,12 (3 Н), 6,41-6,69 (1 Н), 7,67-7,71 (2 Н), 8,49-8,52 (1 Н). Получение 40. N'-3-Циано-1-[2,6-дифтор-4-(трифторметил)фенил]-4-[1-(трифторметил)винил]-1 Нпиразол-5-ил-N,N-диметилимидоформамид. К соединению получения 66 (2,0 г, 4,26 ммоль) и тетракис(трифенилфосфин)палладия(0) (246 мг,0,21 ммоль) в N,N-диметилформамиде (70 мл) добавляли раствор соединения получения 65 в тетрагидрофуране (15,75 мл, 6,3 ммоль). Реакционную смесь нагревали в 110 С в течение ночи в приборе, оборудованном ловушкой Дина-Старка. Реакционную смесь концентрировали в вакууме и остаток очищали флэш-хроматографией (силикагель), элюируя толуолом. Соответствующие фракции объединяли и концентрировали, получая соединение получения 40 (1,5 г).MS (ES): M/Z [MH+] 438,0; вычисленная масса для C17H11F8N5+Н составляет 438,1. 1H-ЯМР (CDCl3): 2,78-2,81 (3 Н), 2,95-2,99 (3 Н), 5,84-5,87 (1 Н), 6,20-6,23 (1 Н), 7,28-7,33 (2 Н), 7,647,68 (1 Н). Получение 41. N'-3-Циано-1-[2,6-дихлор-4-пентафтортиофенил]-4-[1-(дифторметил)винил]-1 Н-пиразол-5-ил-N,N-диметилимидоформамид. К раствору метилтрифенилфосфонийбромида (1,80 г, 5,05 ммоль) в тетрагидрофуране (20 мл) при 0 С добавляли н-бутиллитий (1,6 н. в гексане, 3,2 мл, 5,05 ммоль) через шприц. После перемешивания в течение 15 мин добавляли соединение получения 67 (1,72 г, 3,37 ммоль) в тетрагидрофуране (10 мл) и реакционную смесь перемешивали при комнатной температуре в течение 2,5 ч. К реакционной смеси добавляли воду (50 мл) и смесь экстрагировали этилацетатом (330 мл). Объединенные органические фазы сушили (MgSO4) и концентрировали в вакууме. Остаток очищали хроматографией на колонках (силикагель) при градиентном элюировании смесью этилацетат:гексан (от 1:4 до 1:2). Соответствующие фракции объединяли и концентрировали, получая соединение получения 41 (1,40 г).MS (ES): M/Z [MH+] 509,9; вычисленная масса для C16H12Cl2F7N5S+Н составляет 510,0. 1 Н-ЯМР (CDCl3): 2,75-2,78 (3 Н), 2,91-2,95 (3 Н), 5,76-5,78 (1 Н), 5,91-5,94 (1 Н), 6,14-6,43 (1 Н), 7,637,65 (1 Н), 7,79-7,82 (2 Н). Аналогично получению 41 получали следующее. Получение 42. N'-4-1-[Хлор(фтор)метил]винил-3-циано-1-[2,6-дихлор-4-(трифторметил)фенил]1 Н-пиразол-5-ил-N,N-диметилимидоформамид. Из соединения получения 68 (800 мг, 1,70 ммоль), получая указанное в заголовке соединение (800 мг).MS (ES): M/Z [MH+] 468,1; вычисленная масса для C17H12Cl3F4N5+Н составляет 468,0. 1 Н-ЯМР (CDCl3): 2,75-2,78 (3 Н), 2,91-2,94 (3 Н), 5,67-5,70 (1 Н), 5,91-5,95 (1 Н), 6,72-6,86 (1 Н), 7,657,68 (2 Н), 7,70-7,73 (1 Н). Получение 43. N'-3-Циано-1-[2,6-дихлор-4-(трифторметил)фенил]-4-[1-(дифторметил)-2,2-дифторвинил]-1 Н-пиразол-5-ил-N,N-диметилимидоформамид. К раствору трифенилфосфина (524 мг, 2,0 ммоль) в N,N-диметилформамиде (5 мл) в атмосфере азота добавляли дибромдифторметан (420 мг, 2,0 ммоль). Смесь перемешивали при комнатной температуре в течение 30 мин, затем добавляли соединение получения 39 (454 мг, 1,0 ммоль) в N,N-диметилформамиде (1 мл). К смеси добавляли цинк Rieke (130 мг, 2,0 ммоль) и реакционную смесь перемешивали в течение 1 ч. Реакционную смесь концентрировали в вакууме и остаток очищали флэш-хроматографией(силикагель) при элюировании дихлорметаном. Соответствующие фракции объединяли и концентрировали, получая соединение получения 43 (410 мг).MS (ES): M/Z [MH+] 487,8; вычисленная масса для C17H10Cl2F7N5+Н составляет 488,0. 1(25 мл) и раствор перемешивали в атмосфере азота. 2-Бромпентафторпропен (1,05 г, 5,0 ммоль) конденсировали в охлажденный сосуд в атмосфере азота и медленно добавляли к цинковому раствору через шприц. Реакционную смесь перемешивали при комнатной температуре в течение 12 ч. К соединению получения 62 (1,04 г, 2,0 ммоль) и тетракис(трифенилфосфин)палладия(0) (120 мг) в атмосфере азота добавляли раствор цинкового реагента в N,N-диметилформамиде (12 мл, приблизительно 4,0 ммоль). Реакционную смесь перемешивали при 90 С в течение 3 ч и затем при 100 С в течение 6 ч. Реакционную смесь распределяли между этилацетатом и разбавленной хлористо-водородной кислотой. Органический слой отделяли, сушили (MgSO4) и концентрировали в вакууме. Остаток очищали, используя колонкуIsolute (силикагель, 50 г), элюируя толуолом. Содержащие продукт фракции концентрировали и остаток растворяли в смеси ацетонитрил:вода:диметилсульфоксид (12:1:3, 1,6 мл). Полученный раствор очищали автоматизированной препаративной жидкостной хроматографией (система Gilson, 15030 ммLUNA C18 5 мкм) с использованием градиента ацетонитрил:вода (от 65:35 до 95:5). Соответствующие фракции концентрировали в вакууме, получая соединение получения 44 (28 мг).MS (ES): M/Z [MH+] 506,0; вычисленная масса для C17H9Cl2F8N5+Н составляет 506,0. Н-ЯМР (CDCl3): 2,74-2,81 (3 Н), 2,96-3,02 (3 Н), 7,62-7,66 (1 Н), 7,66-7,71 (2 Н). Получение 45. N'-3-Циано-1-[2,6-дихлор-4-(трифторметокси)фенил]-4-[2,2-дифтор-1-(трифторметил) винил]-1 Н-пиразол-5-ил-N,N-диметилимидоформамид. К раствору соединения получения 71 (6,7 г, 13,7 ммоль) в N,N-диметилформамиде (60 мл) добавляли трифенилфосфин (21,6 г, 82,3 ммоль) и дибромдифторметан (8,6 г, 41,2 ммоль). Реакционную смесь перемешивали в атмосфере азота при комнатной температуре в течение 5 дней. Реакционную смесь концентрировали в вакууме и остаток очищали флэш-хроматографией (силикагель) при градиентном элюировании смесью толуол:дихлорметан (от 1:0 до 1:2). Соответствующие фракции объединяли и концентрировали, получая соединение получения 45 (2,8 г).MS (ES): M/Z [MH+] 522,0; вычисленная масса для C17H9Cl2F8N5O+Н составляет 522,0. Получение 46. Этил-2,3-дицианопропаноат. К раствору этилцианоацетата (916,0 г, 8,10 моль) в N,N-диметилформамиде (2,5 л) добавляли медленно гликольнитрил (700,0 г, 6,75 моль) в воде (55% раствор). К смеси добавляли карбонат калия (932,7 г,6,75 моль) в течение 1,5 ч, контролируя, чтобы температура реакции не повышалась выше 30 С. Реакционную смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь фильтровали и рН фильтрата доводили до рН 3 добавлением кислоты. Органическую фазу отделяли и частично концентрировали в вакууме. К концентрату добавляли диэтиловый эфир (1 л) и раствор промывали водой (51 л), сушили (MgSO4) и концентрировали в вакууме, получая соединение получения 46 (803 г). 1H-ЯМР (CDCl3): 1,28-1,34 (3 Н), 2,95-3,01 (2 Н), 3,84-3,89 (1 Н), 4,27-4,33 (2 Н). Аналогично получению 43 получали следующее. Получение 47. N'-3-Циано-1-[2,6-дихлор-4-(трифторметокси)фенил]-4-[1-(дифторметил)-2,2-дифторвинил]-1 Н-пиразол-5-ил-N,N-диметилимидоформамид. Из соединения получения 72 (1,1 г, 2,3 ммоль), получая указанное в заголовке соединение (650 мг). 1(3,91 г, 14,0 ммоль) в циклогексане (50 мл) перемешивали при 50 С в течение 45 мин и затем охлаждали до 10 С. Добавляли раствор соединения получения 72 (4,40 г, 9,36 ммоль) в дихлорметане (20 мл) и реакционной смеси давали нагреться до комнатной температуры. Реакционную смесь концентрировали в вакууме и остаток очищали флэш-хроматографией (силикагель) при градиентном элюировании смесью толуол:дихлорметан (от 1:0 до 0:1). Соответствующие фракции объединяли и концентрировали, получая соединение получения 48 (3,6 г).MS (ES): M/Z [MH+] 468,0; вычисленная масса для C17H12Cl2F5N5O+Н составляет 468,0. 1H-ЯМР (CDCl3): 2,74-2,78 (3 Н), 2,90-2,95 (3 Н), 5,76-5,80 (1 Н), 5,89-5,93 (1 Н), 6,16-6,46 (1 Н), 7,277,31 (2 Н), 7,58-7,62 (1 Н). Аналогичным образом получали следующее. Получение 49. N'-3-Циано-1-[2,6-дихлор-4-(трифторметил)фенил]-4-[1-(фторметил)винил]-1 Н-пиразол-5-ил-N,N-диметилимидоформамид. Из соединения получения 73 (370 мг, 0,85 ммоль), получая указанное в заголовке соединение (242 мг).MS (ES): M/Z [MH+] 434,0; вычисленная масса для C17H13Cl2F4N5+Н составляет 434,1. 1H-ЯМР (CDCl3): 2,78-2,81 (3 Н), 2,92-2,95 (3 Н), 4,95-4,98 (1 Н), 5,07-5,10 (1 Н), 5,61-5,64 (2 Н), 7,617,64 (1 Н), 7,65-7,68 (2 Н). Получение 50. N'-3-Циано-1-[2,6-дихлор-4-(трифторметил)фенил]-4-изопропенил-1 Н-пиразол-5 ил-N,N-диметилимидоформамид. К раствору тетрабутиламмонийхлорида (204 мг, 0,69 ммоль) в ацетонитриле (7 мл) добавляли молекулярные сита (4 , 3,0 г). Через 30 мин раствор декантировали и добавляли к соединению получения 74(100 мг, 0,23 ммоль). Полученную смесь охлаждали до -10 С и добавляли по каплям тионилхлорид (33,5 мл,0,46 ммоль). После перемешивания в течение 15 мин добавляли метилмеркаптид натрия (32 мг, 0,46 ммоль) и реакционной смеси давали нагреться до комнатной температуры в течение ночи. Реакционную смесь концентрировали в вакууме и к остатку добавляли дихлорметан (50 мл). Раствор промывали водой (335 мл),сушили (MgSO4) и концентрировали в вакууме. Остаток пропускали через силикагель, элюируя дихлорметаном. Фильтрат концентрировали в вакууме, получая соединение получения 50 (137 мг).MS (ES): M/Z [MH+] 416,0; вычисленная масса для C17H14Cl2F3N5+Н составляет 416,1. 1 Н-ЯМР (CDCl3): 2,01-2,03 (3 Н), 2,76-2,78 (3 Н), 2,93-2,97 (3 Н), 5,20-5,22 (1 Н), 5,30-5,33 (1 Н), 7,597,60 (1 Н), 7,64-7,67 (2 Н). Аналогично получению 43 получали следующее. Получение 51. N'-3-Циано-1-2,6-дихлор-4-[(трифторметил)тио]фенил-4-[2,2-дифтор-1-(трифторметил)винил]-1 Н-пиразол-5-ил-N,N-диметилимидоформамид. Из соединения получения 75 (6,50 г, 12,9 ммоль), получая указанное в заголовке соединение (2,5 г).MS (ES): M/Z [MH+] 537,9; вычисленная масса для C17H9Cl2F8N5S+Н составляет 538,0. Н-ЯМР (CDCl3): 2,74-2,77 (3 Н), 2,96-2,99 (3 Н), 7,60-7,63 (1 Н), 7,68-7,72 (2 Н). Аналогично получению 48 получали следующее. Получение 52. N'-1-[3-Хлор-5-(трифторметил)пиридин-2-ил]-3-циано-4-[1-(трифторметил)винил]1 Н-пиразол-5-ил-N,N-диметилимидоформамид. Из соединения получения 76 (1,00 г, 2,3 ммоль), получая указанное в заголовке соединение (820 мг).MS (ES): M/Z [MH+] 437,0; вычисленная масса для C16H11ClF6N+Н составляет 437,1. 1 Н-ЯМР (CDCl3): 2,89-2,91 (3 Н), 2,98-3,01 (3 Н), 5,96-5,98 (1 Н), 6,26-6,28 (1 Н), 7,65-7,68 (1 Н), 8,148,16 (1 Н), 8,69-8,71 (1 Н). Аналогично получению 43 получали следующее. Получение 53. N'-3-Циано-1-[2,6-дихлор-4-(дифторметокси)фенил]-4-[2,2-дифтор-1-(трифторметил) винил]-1 Н-пиразол-5-ил-N,N-диметилимидоформамид. Из соединения получения 77 (425 мг, 0,9 ммоль), получая указанное в заголовке соединение (107 мг).MS (ES): M/Z [MH+] 504,0; вычисленная масса для C17H10Cl2F7N5O+Н составляет 504,0. 1H-ЯМР (CDCl3): 2,77-2,80 (3 Н), 2,96-2,99 (3 Н), 6,36-6,72 (1 Н), 7,20-7,22 (2 Н), 7,58-7,60 (1 Н). Получение 54. N'-3-Циано-1-[2,6-дихлор-4-пентафтортиофенил]-4-[1-(дифторметил)-2,2-дифторвинил]1 Н-пиразол-5-ил-N,N-диметилимидоформамид. Из соединения получения 67 (1,02 г, 2,0 ммоль), получая указанное в заголовке соединение (612 мг).MS (ES): M/Z [MH+] 546,1; вычисленная масса для C16H10Cl2F9N5S+Н составляет 546,0. Аналогично получению 3 получали следующее. Получение 55. N'-4-1-[Хлор(дифтор)метил]-2,2-дифторциклопропил-3-циано-1-[2,6-дихлор-4(трифторметил)фенил]-1 Н-пиразол-5-ил-N,N-диметилимидоформамид. Из соединения получения 78 (100 мг, 0,2 ммоль), получая указанное в заголовке соединение (124 мг).MS (ES): M/Z [MH+] 535,9; вычисленная масса для C18H11Cl3F7N5+Н составляет 536,0. Получение 56. 5-Амино-1-[2,6-дифтор-4-(трифторметил)фенил]-1 Н-пиразол-3-карбоксамид. Смесь соединения получения 29 (600 мг, 1,79 ммоль), метанол (5 мл) и гидроксид аммония (5 мл) нагревали при 50 С в течение 5 ч. Реакционную смесь концентрировали в вакууме и остаток очищали хроматографией на колонках (силикагель), элюируя дихлорметаном:этилацетатом (1:1). Соответствующие фракции объединяли и концентрировали, получая указанное в заголовке соединение (210 мг).MS (ES): M/Z [MH+] 307,1; вычисленная масса для C11H7F5N4O+Н составляет 307,06. 1H-ЯМР (CD3OD): 5,93-5,95 (1 Н), 7,58-7,64 (2 Н). Получение 57. 5-Амино-1-[2,6-дихлор-4-(трифторметил)фенил]-4-винил-1 Н-пиразол-3-карбонитрил. Может быть получен согласно ЕР 933363 А 1, WO9824767 или WO9804530. Аналогично получению 31 получали следующее. Получение 58. N'-3-Циано-1-[2,6-дихлор-4-(пентафтортио)фенил]-4-йод-1 Н-пиразол-5-ил-N,N-диметилимидоформамид. Из соединения получения 79 (52 г, 103 ммоль), получая указанное в заголовке соединение (45 г) в виде твердого вещества светло-коричневого цвета. 1H-ЯМР (CDCl3): 2,77-2,81 (3 Н), 3,02-3,05 (3 Н), 7,78-7,81 (2 Н), 8,21-8,24 (1 Н). Получение 59. 1-(Трифторметил)винилбороновая кислота. К магниевой стружке (5,83 г, 0,24 моль) в тетрагидрофуране (400 мл) добавляли по каплям триметилборат (68,13 мл, 0,6 моль). Реакционную смесь охлаждали до 0 С и добавляли по каплям 2-бром 3,3,3-трифторпропен (20,75 мл, 0,2 моля). Реакционной смеси давали нагреться до комнатной температуры и перемешивали в атмосфере азота в течение ночи. Реакционную смесь снова охлаждали до 0 С и добавляли по каплям хлористо-водородную кислоту (5 М, 200 мл), контролируя, чтобы температура раствора оставалась ниже 10 С. Реакционную смесь перемешивали в атмосфере азота в течение 48 ч. К реакционной смеси добавляли диэтиловый эфир (100 мл) и воду (200 мл), получая две фазы. Водный слой отделяли и экстрагировали диэтиловым эфиром (100 мл). Объединенные органические фазы промывали водой (100 мл), сушили (MgSO4) и концентрировали в вакууме. К остатку добавляли циклогексан (50 мл),что приводило к формированию осадка. Осадок отделяли, декантируя раствор, промывали циклогексаном и сушили в вакууме, получая соединение получения 59 (2,62 г, 0,02 моля) в виде твердого вещества белого цвета. 1H-ЯМР (ДМСО): 5,50-5,57 (1 Н), 5,80-5,88 (1 Н), 6,22-6,36 (2 Н). Получение 60. 5-Амино-1-[2,6-дихлор-4-(трифторметил)фенил]-4-[1-(трифторметил)винил]-1 Н-пиразол-3-карбонитрил. К смеси получения 82 (223 мг, 0,5 ммоль) и получения 59 (212 мг, 1,0 ммоль) добавляли в атмосфере азота дегазированный раствор тетракис(трифенилфосфин)палладия(0) (2 мол.%, 23 мг) в толуоле (10 мл) и метаноле (2 мл). К полученной смеси добавляли водный раствор карбоната натрия (1 М, 2 мл) и двухфазную реакционную смесь нагревали в атмосфере азота при 85 С в течение 22 ч. Реакционную смесь охлаждали, разбавляли диэтиловым эфиром и отделяли органический слой. Затем смесь промывали водой (25 мл), сушили (MgSO4) и концентрировали в токе азота. Остаток очищали, используя картриджIsolute (силикагель, 10 г) при градиентном элюировании смесью циклогексан:дихлорметан (от 3:2 до- 29010740 1:1). Соответствующие фракции объединяли и концентрировали, получая соединение получения 60 (138 мг).MS (ES): M/Z [МН+] 415,1; вычисленная масса для C14H6Cl2F6N4+Н составляет 415,0. 1H-ЯМР (CDCl3): 3,90-3,98 (2 Н), 5,96-5,99 (1 Н), 6,25-6,28 (1 Н), 7,80-7,82 (2 Н). Получение 61. Трибутил(1-фторвинил)станнан. К раствору соединения получения 83 (4,7 г, 19,4 ммоль) в сухом N,N-диметилформамиде (50 мл) в атмосфере азота добавляли бис(трибутилтин)оксид (6 мл, 11,7 ммоль) и фторид цезия (500 мг, 1,94 ммоль). Реакционную смесь перемешивали в течение ночи при комнатной температуре. Реакционную смесь разбавляли водой (100 мл) и экстрагировали смесью гексана и диэтилового эфира (3:1, 150 мл). Экстракты промывали водой (250 мл) и насыщенным концентрированным раствором соли (50 мл), сушили(MgSO4) и концентрировали в вакууме, получая соединение получения 61 (5,1 г) в виде бесцветного масла. 1H-ЯМР (CDCl3): 0,85-0,89 (9 Н), 0,91-1,06 (6 Н), 1,27-1,35 (7 Н), 1,40-1,63 (6 Н), 4,41-4,64 (1 Н), 5,145,43 (1 Н). Аналогично получению 31 получали следующее. Получение 62. N'-3-Циано-1-[2,6-дихлор-4-(трифторметил)фенил]-4-йод-1 Н-пиразол-5-ил-N,Nдиметилимидоформамид. Из соединения получения 82 (0,5 г, 1,12 ммоль), получая указанное в заголовке соединение в виде твердого кристаллического вещества желтого цвета.MS (ES): M/Z [MH+] 502,1; вычисленная масса для C14H9Cl2F3IN5+Н составляет 501,9. 1 Н-ЯМР (CDCl3): 2,78-2,82 (3 Н), 3,03-3,08 (3 Н), 7,67-7,71 (2 Н), 8,23-8,27 (1 Н). Получение 63. N'-3-Циано-1-[2,6-дихлор-4-(дифторметокси)фенил]-1 Н-пиразол-5-ил-N,N-диметилимидоформамид. Из соединения получения 30 (3,1 г, 9,7 ммоль), получая указанное в заголовке соединение (3,5 г).MS (ES): M/Z [MH+] 374,0; вычисленная масса для C14H11Cl2F2N5O+Н составляет 374,0. 1 Н-ЯМР (CDCl3): 2,76-2,80 (3 Н), 2,99-3,03 (3 Н), 6,14-6,17 (1 Н), 6,35-6,72 (1 Н), 7,11-7,15 (1 Н), 7,217,24 (1 Н), 7,70-7,73 (1 Н). Получение 64. (3-Циано-1-[2,6-дихлор-4-(трифторметил)фенил]-5-[(1E)-(диметиламино)метилен] амино-1 Н-пиразол-4-ил)(йод)цинк. К раствору соединения получения 62 (5,02 г, 10,0 ммоль) в тетрагидрофуране (24 мл) в атмосфере азота добавляли цинк Rieke (1,31 г, 20,0 ммоль) в виде жидкого раствора в тетрагидрофуране (26 мл). Реакционную смесь перемешивали в течение ночи при комнатной температуре. Избытку металлического цинка давали выпасть в осадок и раствор, содержащий соединение получения 64 (0,2 моль на литр), использовали непосредственно на следующей стадии. Получение 65.(43 мл) в атмосфере азота добавляли 2-бром-3,3,3-трифторпроп-1-ен (14,0 г, 80,0 ммоль). Реакционную смесь перемешивали в течение ночи и раствор соединения получения 65 использовали без дальнейшей очистки. Аналогично получению 31 получали следующее. Получение 66. N'-3-Циано-1-[2,6-дифтор-4-(трифторметил)фенил]-4-йод-1 Н-пиразол-5-ил-N,Nдиметилимидоформамид. Из соединения получения 84 (2,2 г, 5,3 ммоль), получая указанное в заголовке соединение (2,3 г). 1 Н-ЯМР (CDCl3): 2,79-2,82 (3 Н), 3,03-3,06 (3 Н), 7,27-7,33 (2 Н), 8,22-8,25 (1 Н). Аналогично получению 39 получали следующее. Получение 67. N'-[3-Циано-1-[2,6-дихлор-4-пентафтортиофенил]-4-(дифторацетил)-1 Н-пиразол-5 ил]-N,N-диметилимидоформамид. Из соединения получения 58 (2,50 г, 4,47 ммоль) изопропилмагний (1,72 г).MS (ES): M/Z [MH+] 511,8; вычисленная масса для C15H10Cl2F7N5OS+Н составляет 512,0. 1H-ЯМР (CDCl3): 2,81-2,83 (3 Н), 3,09-3,13 (3 Н), 6,41-6,69 (1 Н), 7,82-7,85 (2 Н), 8,51-8,54 (1 Н). Получение 68. N'-4-[Хлор(фтор)ацетил]-3-циано-1-[2,6-дихлор-4-(трифторметил)фенил]-1 Н-пиразол 5-ил-N,N-диметилимидоформамид. Из соединения получения 62 (1,0 г, 1,99 ммоль) изопропилмагний (800 мг).MS (ES): M/Z [MH+] 470,0; вычисленная масса для C16H10Cl3F4N5O+Н составляет 470,0. 1 Н-ЯМР (CDCl3): 2,79-2,84 (3 Н), 3,07-3,12 (3 Н), 7,20-7,24 (1 Н), 7,67-7,71 (2 Н), 8,45-8,48 (1 Н). Получение 69. 5-Амино-1-(3-хлор-5-трифторметилпиридин-2-ил)-1 Н-пиразол-3-карбонитрил. Может быть получен согласно ЕР 500209. Получение 70. 5-Амино-1-2,6-дихлор-4-[(трифторметил)тио]фенил-1 Н-пиразол-3-карбонитрил. Нитрит натрия (224 мг, 3,25 ммоль) аккуратно добавляли к серной кислоте (концентрированной, 1 мл),контролируя, чтобы температура не повышалась выше 30 С. После перемешивания при 15 С в течение 1 ч
МПК / Метки
МПК: C07D 231/38, C07D 403/12, C07D 401/12, A01N 43/56, C07D 401/04
Метки: замещённые, арилпиразолы, средств, качестве, противопаразитарных
Код ссылки
<a href="https://eas.patents.su/30-10740-zameshhyonnye-arilpirazoly-v-kachestve-protivoparazitarnyh-sredstv.html" rel="bookmark" title="База патентов Евразийского Союза">Замещённые арилпиразолы в качестве противопаразитарных средств</a>
Предыдущий патент: Средство, нормализующее функции головного мозга, и способ его получения
Следующий патент: Применение полипептидов цитокина zcyto человека и мыши и антител к данным полипептидам для лечения различных заболеваний
Случайный патент: Фармацевтическая композиция с контролируемым высвобождением, содержащая карведилол