Способ прицельного воздействия на определенные популяции клеток с помощью конъюгатов из майтансиноида и агента клеточного связывания, соединенных через нерасщепляемый линкер, конъюгаты и способы получения таких конъюгатов
Номер патента: 10508
Опубликовано: 30.10.2008
Авторы: Лутц Роберт, Стивс Рита, Ксие Хонгсхенг, Ковтун Елена, Чари Рави
Формула / Реферат
1. Конъюгат из майтансиноида и агента клеточного связывания следующей формулы:
![]()
2. Конъюгат из майтансиноида и агента клеточного связывания следующей формулы:
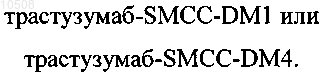
3. Конъюгат из майтансиноида и агента клеточного связывания следующей формулы:
![]()
4. Конъюгат из майтансиноида и агента клеточного связывания следующей формулы:

5. Способ прицельной доставки майтансиноидов к выбранной популяции клеток in vitro, включающий контактирование популяции клеток или ткани, предположительно содержащей выбранную популяцию клеток, с конъюгатом из майтансиноида и агента клеточного связывания, в котором один или несколько майтансиноидов ковалентно соединено с агентом клеточного связывания через нерасщепляемый линкер, а агент клеточного связывания связывается с клетками выбранной популяции клеток.
6. Способ устранения клеток in vitro, включающий контактирование клеток с конъюгатом из майтансиноида и агента клеточного связывания, в котором один или несколько майтансиноидов ковалентно соединено с агентом клеточного связывания через нерасщепляемый линкер, а агент клеточного связывания связывается с клетками.
7. Способ применения in vitro для обработки аутологичных клеток костного мозга перед их пересадкой тому же самому субъекту для того, чтобы устранить больные или раковые клетки; клеток костного мозга перед их пересадкой для того, чтобы устранить компетентные Т-клетки и предотвратить реакцию "трансплантат против хозяина"; клеточных культур для того, чтобы устранить все клетки за исключением желательных вариантов, не экспрессирующих целевой антиген; либо клеточных культур для того, чтобы устранить варианты клеток, экспрессирующие нежелательный антиген; причем способ включает обработку клеток эффективным количеством конъюгата из майтансиноида и агента клеточного связывания, в котором один или несколько майтансиноидов ковалентно соединено с агентом клеточного связывания через нерасщепляемый линкер, а агент клеточного связывания связывается с клетками, подлежащими устранению.
8. Способ по п.5 или 6, в котором агент клеточного связывания представляет собой антитело трастузумаб.
9. Способ по п.6, в котором агент клеточного связывания представляет собой перестроенное (resurfaced) антитело С242.
10. Способ по п.5 или 6, в котором агент клеточного связывания представляет собой антитело против CanAg, антитело против CD19, антитело против CD33, антитело против CALLA, антитело против EGFR, антитело против CD56, антитело против IGF-IR или антитело против Her2.
11. Способ по п.5 или 6, в котором агент клеточного связывания представляет собой перестроенное (resurfaced) антитело Му9-6, KS77 или N901.
12. Способ по п.5 или 6, в котором агент клеточного связывания представляет собой антитело трастузумаб, антитело В4 или антитело huC242.
13. Способ по п.5 или 6, в котором агент клеточного связывания представляет собой антитело huC242.
14. Способ по любому из пп.5-13, где нерасщепляемый линкер, по существу, устойчив к расщеплению под действием кислоты, расщеплению под действием света, расщеплению пептидазами, расщеплению эстеразами или расщеплению дисульфидной связи.
15. Способ по любому из пп.5-13, где нерасщепляемый линкер не содержит атома серы.
16. Способ по п.15, где линкер происходит из молекулы на основе дикарбоновой кислоты.
17. Способ по п.16, где линкер происходит из молекулы на основе a,w-дикарбоновой кислоты, причем a,w-дикарбоновая кислота соответствует общей формуле HOOC-X1-Yn-Zm-COOH, где X означает линейный или разветвленный алкил, алкенил или алкинил, содержащий от 2 до 20 атомов углерода, Y означает циклоалкил или циклоалкенил, содержащий от 3 до 10 атомов углерода, Z означает замещенную или незамещенную ароматическую группу, содержащую от 6 до 10 атомов углерода, либо замещенную или незамещенную гетероциклическую группу, в которой гетероатом выбран из N, О или S, причем l, m и n поодиночке равны 0 или 1 при условии, что все вместе они не равны 0 одновременно.
18. Способ по п.17, где a,w-дикарбоновая кислота представляет собой адипиновую кислоту, глутаровую кислоту, пимелиновую кислоту, гексен-1,6-диовую кислоту, пентен-1,5-диовую кислоту, циклогександиовую кислоту или циклогексендиовую кислоту.
19. Способ по любому из пп.5-13, где нерасщепляемый линкер содержит атом серы.
20. Способ по п.19, где нерасщепляемый линкер происходит из молекулы на основе малеимида.
21. Способ по п.20, где нерасщепляемый линкер происходит из молекулы на основе малеимида, выбранной из группы, состоящей из N-сукцинимидил-4-(малеимидометил)циклогексанкарбоксилата (SMCC), N-сукцинимидил-4-(N-малеимидометил)циклогексан-1-карбокси-6-амидокапроата (LC-SMCC), N-сукцинимидилового эфира k-малеимидоундекановой кислоты (KMUA), N-сукцинимидилового эфира g-малеимидомасляной кислоты (GMBS), N-гидроксисукцинимидного эфира e-малеимидокапроновой кислоты (EMCS), m-малеимидобензоил-N-гидроксисукцинимидного эфира (MBS), N-(a-малеимидацетокси)сукцинимидного эфира (AMAS), сукцинимидил-6-((b-малеимидопропионамидо)гексаноата (SMPH), N-сукцинимидил-4-(n-малеимидофенил)бутирата (SMPB) и N-(n-малеимидофенил)изоцианата (PMPI).
22. Способ по п.21, где нерасщепляемый линкер происходит из SMCC.
23. Способ по п.19, где нерасщепляемый линкер происходит из молекулы на основе галоидацетила.
24. Способ по п.23, где нерасщепляемый линкер происходит из молекулы на основе галоидацетила, выбранной из группы, состоящей из N-сукцинимидил-4-(иодацетил)аминобензоата (SIAB), N-сукцинимидилиодацетата (SIA), N-сукцинимидилбромацетата (SBA) и N-сукцинимидил-3-(бромацетамидо)пропионата (SBAP).
25. Способ по п.24, где нерасщепляемый линкер происходит из SIAB.
26. Способ по любому из пп.5-13, где линкер находится на одной из групп: гидроксиле С-3, гидроксиметиле С-14, гидроксиле С-15 или десметиле С-20 по меньшей мере одного майтансиноида.
27. Способ по любому из пп.5-13, где по меньшей мере один майтансиноид представляет собой сложный эфир майтансинола, содержащий N-метилаланин.
28. Способ по любому из пп.5-13, где по меньшей мере один майтансиноид представляет собой сложный эфир майтансинола, содержащий N-метилцистеин.
29. Способ по любому из пп.5-13, в котором по меньшей мере один майтансиноид представлен формулой II'-L, II'-D или II'-D,L:
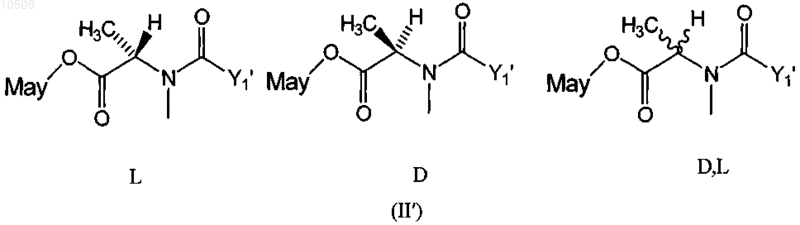
где Yl' означает (CR7R8)l(CR9=CR10)p(CуC)qAo(CR5R6)mDu(CR11=CR12)r(CуC)sBt(CR3R4)nCR1R2S-,
причем R1-R12 независимо друг от друга означают линейный алкил или алкенил, содержащий от 1 до 10 атомов углерода, разветвленный или циклический алкил или алкенил, содержащий от 3 до 10 атомов углерода, фенил, замещенный фенил, либо гетероциклический ароматический или гетероциклоалкильный радикал, и, кроме того, R2-R12 могут означать Н;
А, В и D независимо друг от друга означают циклический алкил или циклический алкенил, содержащий от 3 до 10 атомов углерода, простой или замещенный арил, либо гетероциклический ароматический или гетероциклоалкильный радикал;
l, m, n, о, р, q, r, s, t и u независимо друг от друга означают 0 или целое число от 1 до 5, при условии, что по меньшей мере два из l, m, n, о, р, q, r, s, t и u не равны 0; и
May означает майтансиноид, несущий боковую цепь на гидроксиле С-3, гидроксиметиле С-14, гидроксиле С-15 или десметиле С-20.
30. Способ по любому из пп.5-13, в котором по меньшей мере один майтансиноид представлен формулой II-L, II-D или II-D,L
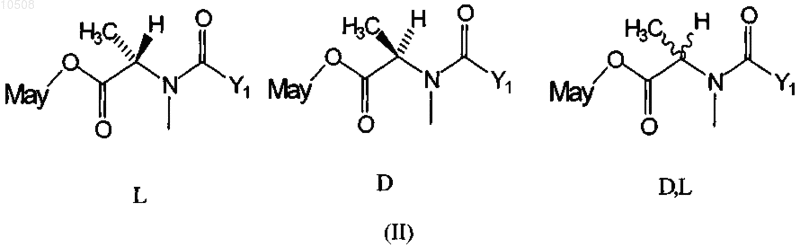
где Y1 означает (CR7R8)l(CR5R6)m(CR3R4)nCR1R2S-, причем R1-R8 независимо друг от друга означают линейный алкил или алкенил, содержащий от 1 до 10 атомов углерода, разветвленный или циклический алкил или алкенил, содержащий от 3 до 10 атомов углерода, фенил, замещенный фенил, либо гетероциклический ароматический или гетероциклоалкильный радикал, и, кроме того, R2-R8 могут означать Н;
l, m и n независимо друг от друга означают целое число от 1 до 5, и, кроме того, n может быть равно 0 и
May означает майтансиноид, несущий боковую цепь на гидроксиле С-3, гидроксиметиле С-14, гидроксиле С-15 или десметиле С-20.
31. Способ по любому из пп.5-13, в котором по меньшей мере один майтансиноид представлен формулой 41'
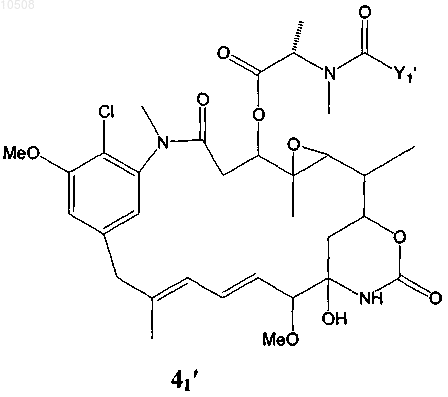
где Yl' означает (CR7R8)l(CR9=CR10)p(CуC)qAo(CR5R6)mDu(CR11=CR12)r(CуC)sBt(CR3R4)nCR1R2S-,
причем R1-R12 независимо друг от друга означают линейный алкил или алкенил, содержащий от 1 до 10 атомов углерода, разветвленный или циклический алкил или алкенил, содержащий от 3 до 10 атомов углерода, фенил, замещенный фенил, либо гетероциклический ароматический или гетероциклоалкильный радикал, и, кроме того, R2-R12 могут означать Н;
А, В и D независимо друг от друга означают циклический алкил или циклический алкенил, содержащий от 3 до 10 атомов углерода, простой или замещенный арил, либо гетероциклический ароматический или гетероциклоалкильный радикал; и
l, m, n, о, р, q, r, s, t и u независимо друг от друга означают 0 или целое число от 1 до 5 при условии, что по меньшей мере два из l, m, n, о, р, q, r, s, t и u не равны 0.
32. Способ по любому из пп.5-13, в котором по меньшей мере один майтансиноид представлен формулой 41
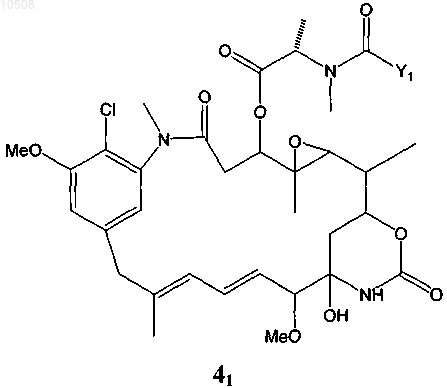
где Y1 означает (CR7R8)l(CR5R6)m(CR3R4)nCR1R2S-, причем R1-R8 независимо друг от друга означают линейный алкил или алкенил, содержащий от 1 до 10 атомов углерода, разветвленный или циклический алкил или алкенил, содержащий от 3 до 10 атомов углерода, фенил, замещенный фенил, либо гетероциклический ароматический или гетероциклоалкильный радикал, и кроме того, R2-R8 могут означать Н; и
l, m и n независимо друг от друга означают целое число от 1 до 5 и, кроме того, n может быть равно 0.
33. Способ по любому из пп.29-32, где R1 означает метил и R2 означает Н, либо R1 и R2 означают метил.
34. Способ по любому из пп.29-32, где R1 означает метил, R2 означает Н, R5, R6, R7 и R8 означают Н, l и m равны 1 и n равно 0; либо в котором R1 и R2 означают метил, R5, R6, R7 и R8 означают Н, l и m равны 1 и n равно 0.
35. Способ по любому из пп.5-13, в котором по меньшей мере один майтансиноид представляет собой DM1.
36. Способ по любому из п.п.5-13, в котором по меньшей мере один майтансиноид представляет собой DM3.
37. Способ по любому из пп.5-13, в котором по меньшей мере один майтансиноид представляет собой DM4.
38. Способ по любому из пп.5-13, в котором майтансиноид модифицирован не содержащим серы перекрестно сшивающим реагентом, образуя соединение формулы 5
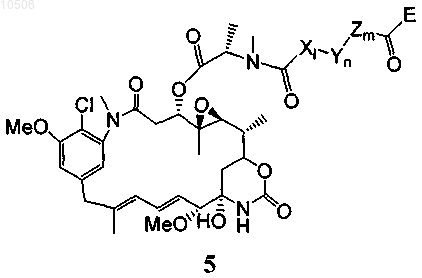
где X означает линейный или разветвленный алкил, алкенил или алкинил, содержащий от 2 до 20 атомов углерода, Y означает циклоалкил или циклоалкенил, содержащий от 3 до 10 атомов углерода, Z означает замещенную или незамещенную ароматическую группу, содержащую от 6 до 10 атомов углерода, либо замещенную или незамещенную гетероциклическую группу, в которой гетероатом выбран из N, О или S, причем l, m и n поодиночке равны 0 или 1 при условии, что все вместе они не равны 0 одновременно, и Е вместе с карбонильной группой образует активный эфир, такой как N-гидроксисукцинимидиловый и сульфосукцинимидиловый эфиры, N-гидроксифталимидиловый эфир, N-гидроксисульфофталимидиловый эфир, ортонитрофениловый эфир, паранитрофениловый эфир, 2,4-динитрофениловый эфир, 3-сульфонил-4-нитрофениловый эфир, 3-карбокси-4-нитрофениловый эфир, пентафторфениловый эфир и сульфонилтетрафторфениловый эфир.
39. Способ по любому из пп.5-13, в котором майтансиноид модифицирован не содержащим серы перекрестно сшивающим реагентом, образуя соединение формулы 6
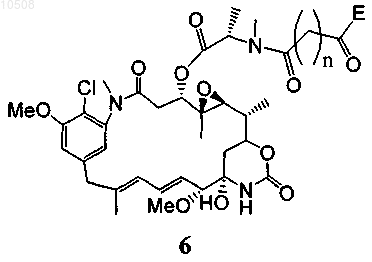
где n означает целое число от 3 до 24, а Е вместе с карбонильной группой образует активный эфир, такой как N-гидроксисукцинимидиловый и сульфосукцинимидиловый эфиры, N-гидроксифталимидиловый эфир, N-гидроксисульфофталимидиловый эфир, ортонитрофениловый эфир, паранитрофениловый эфир, 2,4-динитрофениловый эфир, 3-сульфонил-4-нитрофениловый эфир, 3-карбокси-4-нитрофениловый эфир, пентафторфениловый эфир и сульфонилтетрафторфениловый эфир.
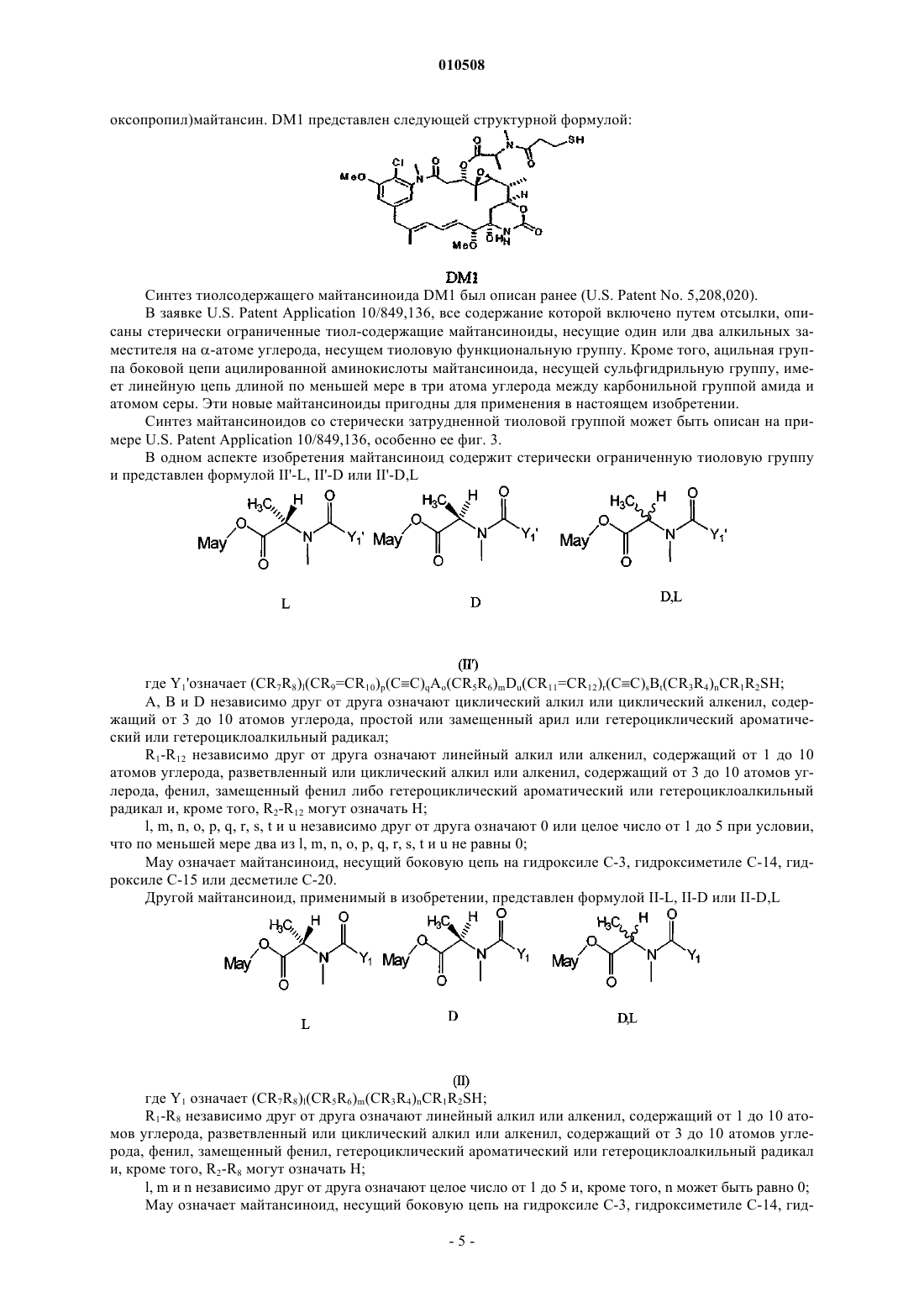
40. Способ по любому из пп.5-13, в котором майтансиноид модифицирован не содержащим серы перекрестно сшивающим реагентом, образуя соединение формулы 7
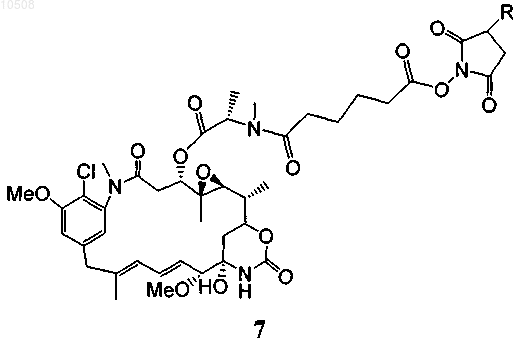
где R означает Н или SO3-Na+.
41. Способ по любому из пп.5-7, в котором агент клеточного связывания представляет собой антитело, одноцепочечное антитело или фрагмент антитела, который специфически связывается с клеткой-мишенью.
42. Способ по любому из пп.5-7, в котором агент клеточного связывания представляет собой перестроенное (resurfaced) антитело, перестроенное одноцепочечное антитело или фрагмент перестроенного антитела, который специфически связывается с клеткой-мишенью.
43. Способ по любому из пп.5-7, в котором агент клеточного связывания представляет собой гуманизированное антитело, гуманизированное одноцепочечное антитело или фрагмент гуманизированного антитела, который специфически связывается с клеткой-мишенью.
44. Способ по любому из пп.5-7, в котором агент клеточного связывания представляет собой моноклональное антитело, одноцепочечное моноклональное антитело или фрагмент моноклонального антитела, который специфически связывается с клеткой-мишенью.
45. Способ по любому из пп.5-7, в котором агент клеточного связывания представляет собой перестроенное (resurfaced) моноклональное антитело, перестроенное одноцепочечное моноклональное антитело или фрагмент перестроенного моноклонального антитела, который специфически связывается с клеткой-мишенью.
46. Способ по любому из пп.5-7, в котором агент клеточного связывания представляет собой гуманизированное моноклональное антитело, гуманизированное одноцепочечное моноклональное антитело или фрагмент гуманизированного моноклонального антитела, который специфически связывается с клеткой-мишенью.
47. Способ по любому из пп.5-7, в котором конъюгат из майтансиноида и агента клеточного связывания, включающий нерасщепляемый линкер, менее токсичен, чем конъюгат из майтансиноида и агента клеточного связывания, включающий по меньшей мере один майтансиноид, соединенный с агентом клеточного связывания через расщепляемый линкер.
48. Способ по любому из пп.5-7, в котором конъюгат из майтансиноида и агента клеточного связывания обладает почти таким же плазменным клиренсом, как и само антитело.
49. Способ по любому из пп.5-7, в котором максимальная переносимая доза у конъюгата из майтансиноида и агента клеточного связывания, включающего нерасщепляемый линкер, больше, чем у конъюгата из майтансиноида и агента клеточного связывания, включающего по меньшей мере один майтансиноид, соединенный с агентом клеточного связывания через расщепляемый линкер.
50. Способ по любому из пп.5-7, в котором продолжительность биологической активности у конъюгата из майтансиноида и агента клеточного связывания, включающего нерасщепляемый линкер, больше, чем у конъюгата из майтансиноида и агента клеточного связывания, включающего по меньшей мере один майтансиноид, соединенный с агентом клеточного связывания через расщепляемый линкер.
51. Способ по любому из пп.5-7, в котором активность в отношении антиген-отрицательных клеток у конъюгата из майтансиноида и агента клеточного связывания, включающего нерасщепляемый линкер, меньше, чем у конъюгата из майтансиноида и агента клеточного связывания, включающего по меньшей мере один майтансиноид, соединенный с агентом клеточного связывания через расщепляемый линкер.
52. Способ по любому из пп.5-7, в котором конъюгат из майтансиноида и агента клеточного связывания проявляет минимальную неспецифическую активность (bystander activity).
53. Способ по п.5 или 6, в котором агент клеточного связывания связывается с раковыми клетками; зараженными вирусами клетками, зараженными микроорганизмами клетками, зараженными паразитами клетками, аутоиммунными клетками, активированными клетками, миелоидными клетками, активированными Т-клетками, В-клетками или меланоцитами; клетками, экспрессирующими антигены CD33, CD19, CanAg, CALLA или Her2; либо клетками, экспрессирующими рецептор инсулиноподобного фактора роста, рецептор эпидермального фактора роста или рецептор фолата.
54. Способ по п.5 или 6, в котором агент клеточного связывания связывается с клетками, выбранными из группы, состоящей из клеток рака молочной железы, клеток рака простаты, клеток рака яичников, клеток рака толстой и прямой кишки, клеток рака желудка, клеток плоскоклеточного рака, клеток мелкоклеточного рака легких, клеток рака яичек и клеток нейробластомы.
55. Способ по п.5 или 6, в котором агент клеточного связывания представляет собой антитело, одноцепочечное антитело, фрагмент антитела, который специфически связывается с клеткой-мишенью, моноклональное антитело, одноцепочечное моноклональное антитело или фрагмент моноклонального антитела, который специфически связывается с клеткой-мишенью, химерное антитело, фрагмент химерного антитела, который специфически связывается с клеткой-мишенью, доменное антитело, фрагмент доменного антитела, который специфически связывается с клеткой-мишенью, лимфокин, гормон, витамин, фактор роста, колониестимулирующий фактор или молекулу переносчика питательного вещества.
56. Способ по п.5 или 6, в котором агент клеточного связывания представляет собой интерферон, IL-2, IL-3, IL-4, IL-6, инсулин, рилизинг-фактор тиреотропина, меланоцитстимулирующий гормон, стероидный гормон, соматостатин, EGF, TGF-a, FGF, G-CSF, VEGF, MCSF, GM-CSF, фолиевую кислоту, трансферрин, эстроген, аналог эстрогена, андроген или аналог андрогена.
57. Способ по п.5 или 6, в котором агент клеточного связывания представляет собой химерное антитело, фрагмент химерного антитела, доменное антитело или фрагмент доменного антитела, который специфически связывается с клеткой-мишенью.
58. Способ по п.5 или 6, в котором агент клеточного связывания представляет собой моноклональное антитело, одноцепочечное моноклональное антитело или фрагмент моноклонального антитела, который специфически связывается с раковыми клетками.
59. Способ по п.5 или 6, в котором агент клеточного связывания представляет собой перестроенное (resurfaced) моноклональное антитело, перестроенное одноцепочечное моноклональное антитело или фрагмент перестроенного моноклонального антитела, который специфически связывается с раковыми клетками.
60. Способ по п.5 или 6, в котором агент клеточного связывания представляет собой гуманизированное моноклональное антитело, гуманизированное одноцепочечное моноклональное антитело или фрагмент гуманизированного моноклонального антитела, который специфически связывается с раковыми клетками.
61. Способ по п.5 или 6, в котором агент клеточного связывания представляет собой химерное антитело, фрагмент химерного антитела, доменное антитело или фрагмент доменного антитела, который специфически связывается с раковыми клетками.
62. Способ по п.5 или 6, в котором агент клеточного связывания представляет собой моноклональное антитело, одноцепочечное моноклональное антитело или фрагмент моноклонального антитела, который специфически связывается с клетками рака толстой и прямой кишки или клетками рака молочной железы.
63. Способ по п.5 или 6, в котором агент клеточного связывания представляет собой перестроенное (resurfaced) моноклональное антитело, перестроенное одноцепочечное моноклональное антитело или фрагмент перестроенного моноклонального антитела, который специфически связывается с клетками рака толстой и прямой кишки или клетками рака молочной железы.
64. Способ по п.5 или 6, в котором агент клеточного связывания представляет собой гуманизированное моноклональное антитело, гуманизированное одноцепочечное моноклональное антитело или фрагмент гуманизированного моноклонального антитела, который специфически связывается с клетками рака толстой и прямой кишки или клетками рака молочной железы.
65. Способ по п.5 или 6, в котором агент клеточного связывания представляет собой перестроенное (resurfaced) моноклональное антитело, перестроенное одноцепочечное моноклональное антитело или фрагмент перестроенного моноклонального антитела, который специфически связывается с клетками рака молочной железы.
66. Способ по п.5 или 6, в котором агент клеточного связывания представляет собой гуманизированное моноклональное антитело, гуманизированное одноцепочечное моноклональное антитело или фрагмент гуманизированного моноклонального антитела, который специфически связывается с клетками рака молочной железы.
67. Конъюгат из майтансиноида и агента клеточного связывания, в котором один или несколько майтансиноидов соединено с агентом клеточного связывания через нерасщепляемый линкер, а агент клеточного связывания связывается с клетками-мишенями, представляющими собой больные или инфицированные клетки при заболевании, для применения в способе лечения заболеваний, выбранных из группы, состоящей из опухолей, аутоиммунных заболеваний, отторжения трансплантатов, реакции "трансплантат против хозяина", вирусных инфекций и паразитарных инфекций, причем способ включает введение нуждающемуся в лечении субъекту эффективного количества данного конъюгата.
68. Конъюгат по п.67, где опухоли выбраны из группы, состоящей из рака легких, молочной железы, толстой кишки, простаты, почек, поджелудочной железы, яичников и лимфатических органов.
69. Конъюгат по п.67, где аутоиммунные заболевания выбраны из группы, состоящей из системной волчанки, ревматоидного артрита и множественного склероза.
70. Конъюгат по п.67, где отторжения трансплантатов выбраны из группы, состоящей из отторжения почечных трансплантатов, отторжения сердечных трансплантатов и отторжения трансплантатов костного мозга.
71. Конъюгат по п.67, где вирусные инфекции выбраны из группы, состоящей из CMV, ВИЧ и СПИД.
72. Конъюгат по п.67, в котором паразитарные инфекции выбраны из группы, состоящей из лямблиоза, амебиоза и шистосомоза.
73. Конъюгат по любому из пп.67-72, т котором конъюгат является конъюгатом, охарактеризованным в любом из пп.14-40.
74. Конъюгат по п.67, в котором агент клеточного связывания является конъюгатом, охарактеризованным в любом из пп.9-13.
75. Конъюгат из майтансиноида и агента клеточного связывания, в котором по меньшей мере один майтансиноид соединен с агентом клеточного связывания через нерасщепляемый линкер, при условии, что если агентом клеточного связывания является антитело, то линкер не происходит из перекрестно сшивающего реагента, выбранного из группы, состоящей из сукцинимидил-4-(N-малеимидометил)циклогексан-1-карбоксилата (SMCC), сульфо-SMCC, m-малеимидобензоил-N-гидроксисукцинимидного эфира (MBS), сульфо-MBS и N-сукцинимидил-иодацетата (SIA).
76. Конъюгат из майтансиноида и агента клеточного связывания по п.75, при условии, что агентом клеточного связывания не является антитело.
77. Конъюгат из майтансиноида и агента клеточного связывания по п.75 или 76, в котором конъюгат является конъюгатом, охарактеризованным в любом из пп.14-40.
78. Конъюгат из майтансиноида и агента клеточного связывания по п.75 или 76, в котором агент клеточного связывания связывается с раковыми клетками; зараженными вирусами клетками, зараженными микроорганизмами клетками, зараженными паразитами клетками, аутоиммунными клетками, активированными клетками, миелоидными клетками, активированными Т-клетками, В-клетками или меланоцитами; клетками, экспрессирующими антигены CD33, CD19, CanAg, CALLA или Her2; либо клетками, экспрессирующими рецептор инсулино-подобного фактора роста, рецептор эпидермального фактора роста или рецептор фолата.
79. Конъюгат из майтансиноида и агента клеточного связывания по п.78, в котором агент клеточного связывания связывается с клетками, выбранными из группы, состоящей из клеток рака молочной железы, клеток рака простаты, клеток рака яичников, клеток рака толстой и прямой кишки, клеток рака желудка, клеток плоскоклеточного рака, клеток мелкоклеточного рака легких, клеток рака яичек и клеток нейробластомы.
80. Конъюгат из майтансиноида и агента клеточного связывания по п.75, в котором агент клеточного связывания является агентом, охарактеризованным в любом из пп.9, 13, 41-44, 55, 57-64 и 66.
81. Конъюгат из майтансиноида и агента клеточного связывания по п.75 или 76, в котором агент клеточного связывания представляет собой лимфокин, гормон, витамин, фактор роста, колониестимулирующий фактор или молекулу переносчика питательного вещества.
82. Конъюгат из майтансиноида и агента клеточного связывания по п.75 или 76, в котором агент клеточного связывания является агентом, охарактеризованным в любом из пп.47-52 и 56.
83. Конъюгат из майтансиноида и агента клеточного связывания по п.75, в котором агент клеточного связывания является агентом, охарактеризованным в любом из пп.10-12.
84 Конъюгат из майтансиноида и агента клеточного связывания по п.83, в котором майтансиноид представляет собой DM1, DM2 или DM3.
85. Композиция, включающая конъюгат из майтансиноида и агента клеточного связывания по любому из пп.75-84, а также носитель.
86. Способ получения конъюгата из майтансиноида и агента клеточного связывания по п.75 или 76, включающий:
(a) обеспечение агента клеточного связывания,
(b) модифицирование агента клеточного связывания с помощью перекрестно сшивающего реагента и
(c) конъюгирование модифицированного агента клеточного связывания с майтансиноидом или тиолсодержащим майтансиноидом, обеспечивая при этом нерасщепляемый линкер между агентом клеточного связывания и майтансиноидом или тиолсодержащим майтансиноидом для образования конъюгата.
87. Способ получения конъюгата из майтансиноида и агента клеточного связывания по п.75 или 76, включающий:
(а) обеспечение майтансиноида или тиолсодержащего майтансиноида,
(b) модифицирование майтансиноида или тиолсодержащего майтансиноида с помощью перекрестно сшивающего реагента для образования нерасщепляемого линкера и
(c) конъюгирование модифицированного майтансиноида или тиолсодержащего майтансиноида с агентом клеточного связывания, обеспечивая при этом нерасщепляемый линкер между агентом клеточного связывания и майтансиноидом или тиолсодержащим майтансиноидом для образования конъюгата.
88. Способ получения конъюгата из майтансиноида и агента клеточного связывания по п.75 или 76, включающий:
(a) обеспечение майтансиноида,
(b) модифицирование майтансиноида с помощью не содержащего серы перекрестно сшивающего реагента для получения сложного эфира майтансиноида, и
(c) конъюгирование сложного эфира майтансиноида с агентом клеточного связывания, обеспечивая при этом нерасщепляемый линкер между агентом клеточного связывания и майтансиноидом для образования конъюгата.
89. Соединение формулы 5
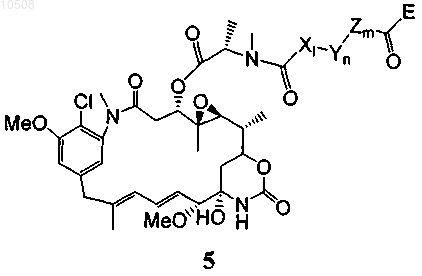
где X означает линейный или разветвленный алкил, алкенил или алкинил, содержащий от 2 до 20 атомов углерода, Y означает циклоалкил или циклоалкенил, содержащий от 3 до 10 атомов углерода, Z означает замещенную или незамещенную ароматическую группу, содержащую от 6 до 10 атомов углерода, либо замещенную или незамещенную гетероциклическую группу, в которой гетероатом выбран из N, О или S, причем l, m и n поодиночке равны 0 или 1 при условии, что все вместе они не равны 0 одновременно, и Е вместе с карбонильной группой образует активный эфир, такой как N-гидроксисукцинимидиловый и сульфосукцинимидиловый эфиры, N-гидроксифталимидиловый эфир, N-гидроксисульфофталимидиловый эфир, ортонитрофениловый эфир, паранитрофениловый эфир, 2,4-динитрофениловый эфир, 3-сульфонил-4-нитрофениловый эфир, 3-карбокси-4-нитрофениловый эфир, пентафторфениловый эфир и сульфонилтетрафторфениловый эфир.
90. Соединение формулы 6
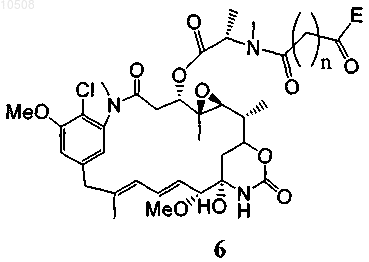
где n означает целое число от 3 до 24, а Е вместе с карбонильной группой образует активный эфир, такой как N-гидроксисукцинимидиловый и сульфосукцинимидиловый эфиры, N-гидроксифталимидиловый эфир, N-гидроксисульфофталимидиловый эфир, ортонитрофениловый эфир, паранитрофениловый эфир, 2,4-динитрофениловый эфир, 3-сульфонил-4-нитрофениловый эфир, 3-карбокси-4-нитрофениловый эфир, пентафторфениловый эфир и сульфонилтетрафторфениловый эфир.
91. Соединение формулы 7
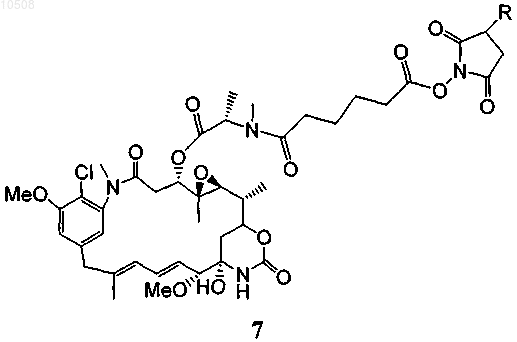
где R означает Н или SO3-Na+.
Текст
010508 Данная заявка претендует на преимущества Provisional U.S. Patent Application Serial No. 60/509,901 от 10 октября 2003 г., все содержание которой включено путем отсылки. Область техники, к которой относится изобретение Способ по настоящему изобретению касается прицельного воздействия на определенные популяции клеток с помощью конъюгатов из майтансиноида и агента клеточного связывания, соединенных через нерасщепляемый линкер. Другой способ по настоящему изобретению представляет собой способ получения конъюгата. Композиция по настоящему изобретению касается новых конъюгатов из майтансиноида и агента клеточного связывания, у которых майтансиноид соединен через нерасщепляемый линкер с агентом клеточного связывания. Другая композиция по настоящему изобретению касается новых сложных эфиров майтансиноидов. Уровень техники Майтансиноиды являются сильно цитотоксичными веществами. Майтансин был впервые выделенKupchan et al. из восточноафриканского кустарника Maytenus serrata и оказался в 100-1000 раз более цитотоксичным, чем традиционные средства химиотерапии рака типа метотрексата, даунорубицина и винкристина (U.S. Patent No. 3,896,111). Впоследствии было установлено, что некоторые микробы тоже вырабатывают майтансиноиды, такие как майтансинол и С-3-эфиры майтансинола (U.S. Patent No. 4,151,042). Также были описаны синтетические С-3-эфиры майтансинола и аналоги майтансинола (Kupchan et al., 21 J. Med. Chem. 31-37 (1978); Higashide et al., 270 Nature 721-722 (1977); Kawai et al., 32 Chem.Pharm. Bull. 3441-3451 (1984. Примеры аналогов майтансинола, из которых были получены С-3-эфиры,включают майтансинол с модификациями в ароматическом кольце (напр., дехлоро) или на С-9, С-14(напр., гидроксилированная метильная группа), С-15, С-18, С-20 и С-4,5. Природные и синтетические С-3-эфиры можно разбить на две группы: а) С-3-эфиры простых карбоновых кислот (U.S. Patent Nos. 4,248,870; 4,265,814; 4,308,268; 4,308,269; 4,309,428; 4,317,821; 4322,348; и 4,331,598), иb) C-3-эфиры производных N-метил-L-аланина (U.S. Patent Nos. 4,137,230 и 4,260,608; Kawai et al.,32 Chem. Pharm. Bull. 3441-3451 (1984. Эфиры группы (b) оказались значительно более цитотоксичными, чем эфиры группы (а). Майтансин является ингибитором митоза. Обработка клеток L1210 майтансином in vivo, как сообщалось, ведет к тому, что 67% клеток застревают в митозе. Необработанные контрольные клетки проявляли показатель митоза, составляющий от 3,2 до 5,8% (Sieber et al., 43 Bibl. Haematol. 495-500 (1976. Эксперименты с яйцеклетками морских ежей и двустворчатых моллюсков показали, что майтансин ингибирует митоз, препятствуя образованию микротрубочек путем ингибирования полимеризации белка микротрубочек -тубулина (Remillard et al., 189 Science 1002-1005 (1975.In vitro майтансин ингибирует суспензии лейкемических клеток мышей Р 388, L1210 и LY5178 в дозах от 10-3 до 10-1 мкг/мл, причем линия Р 388 оказалась наиболее чувствительной. Майтансин также оказался активным ингибитором роста клеток носоглоточной карциномы человека in vitro, а линия острого лимфобластного лейкоза человека С.Е.М. ингибировалась даже при таких низких концентрациях, как 10-7 мкг/мл(Wolpert-DeFillipes et al., 24 Biochem. Pharmacol. 1735-1738 (1975. Майтансин также оказался активным in vivo. Рост опухолей в системе лимфоцитарной лейкемии Р 388 ингибировался в 50-100-кратном диапазоне доз, что свидетельствует о высоком терапевтическом индексе; также наблюдалась значительная ингибиторная активность в системе лейкемии мышей L1210, в системе легочной карциномы человека Lewis и в системе меланокарциномы человека В-16 (Kupchan, 33Fed. Proc. 2288-2295 (1974. Поскольку майтансиноиды сильно токсичны, ожидалось, что они окажутся полезными при лечении многих заболеваний, таких как рак. Эти ожидания пока еще не реализованы. Клинические испытания майтансина оказались неблагоприятными из-за целого ряда побочных эффектов (Issel et al., 5 CancerTreat. Rev. 199-207 (1978. Вредные эффекты на центральную нервную систему и желудочно-кишечные симптомы были ответственны за то, что некоторые пациенты отказались от дальнейшей терапии (Issel at 204), причем оказалось, что майтансин связан с периферической невропатией, которая может быть кумулятивной (Issel at 207). Соответственно, стали применять прицельные методы для избирательной доставки лекарственных средств к намеченным клеткам. Исследовали как расщепляемые, так и нерасщепляемые линкеры для нескольких лекарств, но в большинстве случаев, включая и майтансиноиды, испытания на цитотоксичностьin vitro показали, что конъюгаты лекарств с антителами редко достигают такой же цитотоксической силы, как свободные неконъюгированные лекарства. Таким образом, установилось общее мнение, что для того, чтобы прицельная доставка майтансиноидов была эффективной, связь между майтансиноидом и агентом клеточного связывания должна быть расщепляемой. Кроме того, в области иммунотоксинов конъюгаты, содержащие линкеры с дисульфидными мостиками между моноклональным антителом и каталитически активным белковым токсином, оказались более цитотоксичными, чем конъюгаты, содержащие другие линкеры. См. Lambert et al., 260 J. Biol. Chem. 12035-12041(1985); Lambert et al., in Immunotoxins 175-209 (A. Frankel, ed. 1988); и Ghetie et al., 48 CancerRes. 2610-2617 (1988). Это было приписано высокой внутриклеточной концентрации глутатиона, способ-1 010508 ствующей эффективному расщеплению дисульфидной связи между молекулой антитела и токсином. Недавно было показано, что конъюгаты из майтансиноидов, соединенных с антителом ТА.1 против клеток рака молочной железы Her2 через нерасщепляемый линкер SMCC, оказались в 200 раз менее активными,чем конъюгаты из майтансиноидов, соединенных с TA.1 через линкер с расщепляемой дисульфидной связью (Chari et al., 52 Cancer Res. 127-133 (1992. Таким образом, велись поиски цитотоксических конъюгатов, соединенных через дисульфидсодержащие расщепляемые линкеры. Shen et al. описали превращение метотрексата в производное меркаптоэтиламида с последующей конъюгацией его с поли-D-лизином через дисульфидную связь (260 J.Biol. Chem. 10905-10908 (1985. Также было описано получение конъюгата из содержащего трисульфид токсического препарата калихеамицина с антителом (Menendez et al., Fourth International Conference onMonoclonal Antibody Immunoconjugates for Cancer, San Diego, Abstract 81 (1989. В патентах U.S. Patent Nos. 5,208,020 и 5,416,064, все содержание которых явным образом включено в настоящее изобретение путем отсылки, раскрыты цитотоксические конъюгаты, включающие агенты клеточного связывания, связанные со специфическими производными майтансиноидов через расщепляемые линкеры типа линкеров, содержащих дисульфидные группы, линкеров, содержащих кислотолабильные группы, линкеров, содержащих фотолабильные группы, линкеров, содержащих пептидазолабильные группы, и линкеров, содержащих эстеразолабильные группы. В патенте U.S. Patent No. 6,333,410 В 1, все содержание которого явным образом включено в настоящее изобретение путем отсылки, раскрыт способ получения и очистки тиолсодержащих майтансиноидов для присоединения агентов клеточного связывания, а в патенте U.S. Patent No. 6,441,163 В 1, все содержание которого явным образом включено в настоящее изобретение путем отсылки, раскрыт одностадийный способ получения цитотоксических конъюгатов из майтансиноидов и агентов клеточного связывания, в котором линкером служит дисульфидсодержащий расщепляемый линкер. Кроме того, в патенте U.S. Patent No. 5,208,020 приведены конъюгаты между майтансиноидами и антителами с нерасщепляемыми линкерами, у которых линкер включает малеимидную группу. Однако в этой ссылке не содержится каких-либо экспериментальных данных, свидетельствующих, что такие конъюгаты эффективны при лечении заболеваний. И вот теперь неожиданно обнаружилось, что цитотоксические конъюгаты из майтансиноидов и агентов клеточного связывания, соединенных через нерасщепляемые линкеры, являются чрезвычайно активными и во многих случаях имеют неожиданные преимущества перед конъюгатами из майтансиноидов и агентов клеточного связывания с расщепляемыми линкерами. Сущность изобретения Описанные ниже иллюстративные, неограничивающие воплощения настоящего изобретения преодолевают вышеизложенные недостатки и другие недостатки, не изложенные выше. К тому же от настоящего изобретения не требуется преодолевать недостатки, описанные выше, а описанное ниже иллюстративное, неограничивающее воплощение настоящего изобретения может и не преодолеть какие-то проблемы, изложенные выше. Один из аспектов настоящего изобретения составляет способ прицельной доставки майтансиноидов к выбранной популяции клеток, включающий контактирование популяции клеток или ткани, предположительно содержащей клетки из данной выбранной клеточной популяции, с конъюгатом из майтансиноида и агента клеточного связывания, в котором один или несколько майтансиноидов соединено с агентом клеточного связывания через нерасщепляемый линкер. Другой аспект настоящего изобретения составляет способ лечения опухолей, аутоиммунных заболеваний, отторжения трансплантатов, реакции "трансплантат против хозяина", вирусных инфекций, паразитарных инфекций и других заболеваний, которые можно лечить методом прицельной терапии, в котором нацеливающим агентом служит агент клеточного связывания, причем данный способ включает введение нуждающемуся в лечении субъекту эффективного количества конъюгата из майтансиноида и агента клеточного связывания, в котором один или несколько майтансиноидов соединено с агентом клеточного связывания либо фармацевтически приемлемой композиции или сольвата данного конъюгата. Следующий аспект настоящего изобретения составляет конъюгат из майтансиноида и агента клеточного связывания, в котором один или несколько майтансиноидов соединено с агентом клеточного связывания через нерасщепляемый линкер. Следующий аспект настоящего изобретения составляет композиция, включающая вышеописанный конъюгат. Следующий аспект настоящего изобретения составляет способ получения вышеописанного конъюгата. Следующий аспект настоящего изобретения составляют новые сложные эфиры майтансиноидов. Краткое описание фигур На фиг. 1 представлена структура SMCC. На фиг. 2 представлена структура DM1. На фиг. 3 в виде графика представлены результаты анализа связывания антитела huC242 по сравнению с конъюгатом антитело-майтансиноид huC242-SMCC-DM1 методом FACS.-2 010508 На фиг. 4 в виде графика представлена цитотоксичность huC242-SMCC-DM1. На фиг. 5 представлена эксклюзионная хроматография huC242-SMCC-DM1. На фиг. 6 А-С и фиг. 7 в виде графика представлена цитотоксичность huC242-SMCC-DM1 по сравнению с конъюгатами, полученными с помощью дисульфидсодержащих линкеров. На фиг. 8A-D в виде графика представлена цитотоксичность конъюгатов SMCC-DM1, соединенных с различными агентами клеточного связывания. На фиг. 9 в виде графика представлена цитотоксичность конъюгата антитело-майтансиноидhuC242-SIAB-DM1. На фиг. 10 А в виде графика представлена противоопухолевая активность huC242-SMCC-DM1 против ксенотрансплантатов рака толстой кишки человека COLO205 на мышах SCID. На фиг. 10 В в виде графика представлена противоопухолевая активность huC242-SMCC-DM1 против ксенотрансплантатов рака желудка человека SNU16 на мышах SCID. На фиг. 10C в виде графика представлена противоопухолевая активность трастузумаб-SMCC-DM1 против ксенотрансплантатов опухоли человека MCF7 на мышах SCID. На фиг. 11 в виде графика представлены показатели клиренса huC242-SMCC-DM1 по сравнению с конъюгатами, полученными с помощью дисульфид-содержащих линкеров. На фиг. 12 А-С в виде графика представлены результаты исследования острой токсичности huC242SMCC-DM1 по сравнению с конъюгатами, полученными с помощью дисульфидсодержащих линкеров. На фиг. 13 представлена продолжительность остановки клеточного цикла и разрушение клеток под действием huC242-SMCC-DM1 по сравнению с конъюгатами, полученными с помощью дисульфидсодержащих линкеров. На фиг. 14 А-С представлено минимальное постороннее действие huC242-SMCC-DM1 по сравнению с конъюгатами, полученными с помощью дисульфидсодержащих линкеров. На фиг. 15 представлены репрезентативные структуры перекрестно сшивающих реагентов на основе малеимида. На фиг. 16 представлены репрезентативные структуры перекрестно сшивающих агентов на основе галоидацетила. На фиг. 17 представлена структура конъюгатов антитело-SMCC-DM1. На фиг. 18 представлена структура конъюгатов антитело-SIAB-DM1. На фиг. 19 представлена структура конъюгатов антитело-SMCC-DM4. На фиг. 20 представлена структура конъюгатов антитело-SIAB-DM1. На фиг. 21 представлен синтез конъюгата из майтансиноида и агента клеточного связывания, соединенных через не содержащий S нерасщепляемый линкер. На фиг. 22 в виде графика представлена цитотоксичность конъюгата huC242-не содержащий S нерасщепляемый линкер-DM1. На фиг. 23 в виде графика представлены результаты анализа связывания конъюгата huC242-не содержащий S нерасщепляемый линкер-DM1 методом FACS. На фиг. 24 в виде графика представлены результаты анализа связывания антитела трастузумаб по сравнению с конъюгатом антитело-майтансиноид трастузумаб-SMCC-DM1 на чашках ECD с HER2. На фиг. 25 в виде графика представлена цитотоксичность и специфичность трастузумаб-SMCCDM1. На фиг. 26 представлена эксклюзионная хроматография трастузумаб-SMCC-DM1. На фиг. 27 в виде графика представлены результаты анализа связывания антитела трастузумаб по сравнению с конъюгатом антитело-майтансиноид трастузумаб-SIAB-DM1 на чашках ECD с HER2. На фиг. 28 в виде графика представлена цитотоксичность и специфичность трастузумаб-SIAB-DM 1. На фиг. 29 представлена эксклюзионная хроматография трастузумаб-SIAB-DM1. Осуществление изобретения В данной области известно, что существующие препараты очень трудно модифицировать без уменьшения их цитотоксического потенциала. Однако U.S. Patent Nos. 6,441,163 B1, 6,333,410 B1,5,416,064 и 5,208,029 свидетельствуют, что можно создать сильнодействующие цитотоксические вещества присоединением майтансиноидов к соответствующим агентам клеточного связывания через расщепляемые линкеры, в особенности расщепляемые линкеры, содержащие дисульфидные группы. Конъюгаты из майтансиноидов и агентов клеточного связывания позволяют в полной мере применять цитотоксическое действие майтансиноидов заданным образом только против нежелательных клеток, избегая при этом побочных эффектов, вызванных непреднамеренным повреждением здоровых клеток. Авторы настоящего изобретения неожиданно открыли, что майтансиноиды, соединенные с агентами клеточного связывания через нерасщепляемые линкеры, во многих существенных отношениях превосходят майтансиноиды, соединенные через расщепляемые линкеры. В частности, по сравнению с конъюгатами, содержащими расщепляемые линкеры, конъюгаты с нерасщепляемыми линкерами проявляют эквивалентную противораковую активность in vitro и in vivo, но проявляют заметное снижение коэффициента плазменного клиренса и токсичности. Итак, настоящее изобретение предусматривает улучшенный способ прицельного воздействия на-3 010508 клетки, в особенности клетки, подлежащие разрушению, такие как раковые клетки (в особенности клетки твердых опухолей), зараженные вирусами клетки, зараженные микроорганизмами клетки, зараженные паразитами клетки, аутоиммунные клетки (клетки, вырабатывающие антитела), активированные клетки(участвующие в отторжении трансплантатов или реакции "трансплантат против хозяина") или любого другого типа больные или аномальные клетки, и при этом проявляющий минимум побочных эффектов. Используемый в способе изобретения конъюгат содержит один или несколько майтансиноидов, соединенных с агентом клеточного связывания через нерасщепляемый линкер. В одном способе получения конъюгата агент клеточного связывания, к примеру антитело, сначала подвергают модификации с помощью перекрестно сшивающего реагента типа SMCC. На второй стадии реакционноспособный майтансиноид типа DM1, обладающий тиоловой группой, подвергают реакции с модифицированным антителом и получают конъюгаты антитело-майтансиноид. В качестве альтернативы майтансиноид может быть подвергнут модификации с помощью перекрестно сшивающего реагента перед проведением реакции с агентом клеточного связывания. См., к примеру, U.S. Patent No. 6,441,163 B1. Подходящие майтансиноиды Майтансиноиды, подходящие для применения в настоящем изобретении, хорошо известны в данной области и могут быть выделены из природных источников известными методами, получены методами генетической инженерии (см. Yu et al., 99 PNAS 7986-7973 (2002 или получены синтезом в соответствии с известными методами. Примеры подходящих майтансиноидов включают майтансинол и аналоги майтансинола. Примеры подходящих аналогов майтансинола включают аналоги, содержащие модифицированное ароматическое кольцо, и аналоги, содержащие модификации по другим положениям. Конкретные примеры подходящих аналогов майтансинола, содержащих модифицированное ароматическое кольцо, включают:(3) С-20-деметокси, С-20-ацилокси (-OCOR),дехлоро (U.S. Patent No. 4,294,757) (получают ацилированием с помощью ацилхлоридов). Конкретные примеры подходящих аналогов майтансинола, содержащих модификации по другим положениям, включают:(4) С-15-гидрокси/ацилокси (U.S. Patent No. 4,364,866) (получают превращением майтансинола под действием Streptomyces);(6) С-18-N-деметил (U.S. Patent Nos. 4,362,663 и 4,322,348) (получают деметилированием майтансинола под действием Streptomyces) и(7) 4,5-дезокси (U.S. Patent No. 4,371,533) (получают восстановлением майтансинола с помощью трихлорида титана/LAH). Известно, что многие положения у майтансинола полезны в качестве положений для образования связей, в зависимости от типа связи. Например, для образования сложноэфирной связи подходят такие положения: положение С-3 с гидроксильной группой, положение С-14, модифицированное гидроксиметилом, положение С-15, модифицированное гидроксильной группой, и положение С-20 с гидроксильной группой. Однако предпочтительно положение С-3 и особенно предпочтительно положение С-3 у майтансинола. В соответствии с настоящим изобретением предпочтительный майтансинол содержит свободную тиоловую группу. К особенно предпочтительным майтансинолам, содержащим свободную тиоловую группу, относятся С-3-сложные эфиры майтансинола и его аналогов, содержащие N-метилаланин и содержащие N-метилцистеин. К предпочтительным сложным эфирам относятся сложные эфиры майтансинола, содержащие N-метилаланин и содержащие N-метилцистеин. Синтез эфиров майтансинола, содержащих свободную тиоловую группу, был описан ранее, например в U.S. Patent No. 5,208,020; Chari et al.,52 Cancer Res., 127-131 (1992); и Liu et al., 93 Proc. Natl. Acad. Sci., 8618-8623 (1996). Кроме того, U.S.Patent No. 6,333,410 B1, все содержание которого включено путем отсылки, предусматривает усовершенствованный способ получения и очистки тиолсодержащих майтансиноидов, пригодных для присоединения агентов клеточного связывания. Во многих конъюгатах настоящего изобретения, приведенных ниже, используется тиолсодержащий майтансиноид DM1, который официально именуется N2-деацетил-N2-(3-меркапто-1-4 010508 оксопропил)майтансин. DM1 представлен следующей структурной формулой: Синтез тиолсодержащего майтансиноида DM1 был описан ранее (U.S. Patent No. 5,208,020). В заявке U.S. Patent Application 10/849,136, все содержание которой включено путем отсылки, описаны стерически ограниченные тиол-содержащие майтансиноиды, несущие один или два алкильных заместителя на -атоме углерода, несущем тиоловую функциональную группу. Кроме того, ацильная группа боковой цепи ацилированной аминокислоты майтансиноида, несущей сульфгидрильную группу, имеет линейную цепь длиной по меньшей мере в три атома углерода между карбонильной группой амида и атомом серы. Эти новые майтансиноиды пригодны для применения в настоящем изобретении. Синтез майтансиноидов со стерически затрудненной тиоловой группой может быть описан на примере U.S. Patent Application 10/849,136, особенно ее фиг. 3. В одном аспекте изобретения майтансиноид содержит стерически ограниченную тиоловую группу и представлен формулой II'-L, II'-D или II'-D,L где Y1'означает (CR7R8)l(CR9=CR10)p(CC)qAo(CR5R6)mDu(CR11=CR12)r(CC)sBt(CR3R4)nCR1R2SH; А, В и D независимо друг от друга означают циклический алкил или циклический алкенил, содержащий от 3 до 10 атомов углерода, простой или замещенный арил или гетероциклический ароматический или гетероциклоалкильный радикал;R1-R12 независимо друг от друга означают линейный алкил или алкенил, содержащий от 1 до 10 атомов углерода, разветвленный или циклический алкил или алкенил, содержащий от 3 до 10 атомов углерода, фенил, замещенный фенил либо гетероциклический ароматический или гетероциклоалкильный радикал и, кроме того, R2-R12 могут означать Н;l, m, n, о, р, q, r, s, t и u независимо друг от друга означают 0 или целое число от 1 до 5 при условии,что по меньшей мере два из l, m, n, о, р, q, r, s, t и u не равны 0;May означает майтансиноид, несущий боковую цепь на гидроксиле С-3, гидроксиметиле С-14, гидроксиле С-15 или десметиле С-20. Другой майтансиноид, применимый в изобретении, представлен формулой II-L, II-D или II-D,LR1-R8 независимо друг от друга означают линейный алкил или алкенил, содержащий от 1 до 10 атомов углерода, разветвленный или циклический алкил или алкенил, содержащий от 3 до 10 атомов углерода, фенил, замещенный фенил, гетероциклический ароматический или гетероциклоалкильный радикал и, кроме того, R2-R8 могут означать Н;l, m и n независимо друг от друга означают целое число от 1 до 5 и, кроме того, n может быть равно 0;May означает майтансиноид, несущий боковую цепь на гидроксиле С-3, гидроксиметиле С-14, гид-5 010508 роксиле С-15 или десметиле С-20. Другой полезный майтансиноид представлен формулой 4'1 где заместители соответствуют определениям для приведенной выше формулы II'. Другой предпочтительный майтансиноид представлен формулой 41 где заместители соответствуют определениям для приведенной выше формулы II. Предпочтительны любые из вышеописанных соединений, у которых R1 означает Н и R2 означает метил либо R1 и R2 означают метил. Особенно предпочтительны любые из вышеописанных соединений, у которых R1 означает Н, R2 означает метил, R5, R6, R7 и R8 означают Н, l и m равны 1 и n равно 0, а также те, у которых R1 и R2 означают метил, R5, R6, R7 и R8 означают Н, l и m равны 1 и n равно 0. Кроме того, предпочтительны L-аминоацильные стереоизомеры. Примеры линейных алкилов или алкенилов, содержащих от 1 до 10 атомов углерода, включают (не ограничиваясь этим) метил, этил, пропил, бутил, пентил, гексил, пропенил, бутенил и гексенил. Примеры разветвленных алкилов или алкенилов, содержащих от 3 до 10 атомов углерода, включают (не ограничиваясь этим) изопропил, изобутил, втор-бутил, трет-бутил, 1-этилпропил, изобутенил и изопентенил. Примеры циклических алкилов или алкенилов, содержащих от 3 до 10 атомов углерода, включают(не ограничиваясь этим) циклопропил, циклобутил, циклопентил, циклогексил, циклопентенил и циклогексенил. Простые арилы включают арилы, содержащие от 6 до 10 атомов углерода, а замещенные арилы включают арилы, содержащие от 6 до 10 атомов углерода и несущие по меньшей мере один алкильный заместитель, содержащий от 1 до 4 атомов углерода, или алкоксильный заместитель типа метокси, этокси, либо галогеновый заместитель или нитрозаместитель. Примеры простых арилов, содержащих от 6 до 10 атомов углерода, включают (не ограничиваясь этим) фенил и нафтил. Примеры замещенных арилов включают (не ограничиваясь этим) нитрофенил, динитрофенил. Гетероциклические ароматические радикалы включают группы, содержащие 3-10-членное кольцо,содержащее один или два гетероатома, выбранных из N, О или S. Примеры гетероциклических ароматических радикалов включают (не ограничиваясь этим) пиридил, нитропиридил, пирролил, оксазолил, тиенил, тиазолил и фурил. Гетероциклоалкильные радикалы включают циклические соединения, содержащие 3-10-членные кольцевые системы, содержащие один или два гетероатома, выбранных из N, О или S. Примеры гетероциклоалкильных радикалов включают (не ограничиваясь этим) дигидрофурил, тет-6 010508 рагидрофурил, пирролидинил, пиперидинил, пиперазинил и морфолино. К особенно предпочтительным майтансиноидам, имеющим боковую цепь, содержащую стерически затрудненную тиоловую связь, относятся майтансиноиды N2'-деацетил-N2'-(4-меркапто-1-оксопентил) майтансин (называемый DM3) и N2'-деацетил-N2'-(4-метил-4-меркапто-1-оксопентил)майтансин (называемый DM4). DM3 и DM4 представлены следующими структурными формулами: Агенты клеточного связывания Эффективность соединений изобретения в качестве терапевтических средств зависит от тщательного выбора надлежащего агента клеточного связывания. Агенты клеточного связывания могут быть любого типа, известного в настоящее время или ставшего известным, и включают пептиды и непептиды. В общем, они могут представлять собой антитела (в особенности, моноклональные антитела), лимфокины,гормоны, факторы роста, витамины, молекулы-переносчики питательных веществ (типа трасферрина) или любые другие молекулы или вещества клеточного связывания, которые специфически связываются с мишенью. Более конкретные примеры агентов клеточного связывания, которые могут быть использованы,включают поликлональные и моноклональные антитела, включая полностью человеческие антитела; одноцепочечные антитела (поликлональные и моноклональные); фрагменты антител (поликлональных и моноклональных), такие как Fab, Fab', F(ab')2 и Fv (Parham,131 J. Immunol. 2895-2902 (1983); Spring et al., 113 J. Immunol. 470-478 (1974); Nisonoff et al., 89 Arch.Biochem. Biophys. 230-244 (I960; химерные антитела и их антиген-связывающие фрагменты; доменные антитела (dAbs) и их антиген-связывающие фрагменты, включая антитела camelid (Desmyter et al., 3 Nature Struct. Biol. 752,1996); антитела акул, называемые новыми рецепторами антигенов (IgNAR) (Greenberg et al., 374 Nature 168,1995; Stanfield et al., 305 Science 1770-1773, 2004); интерфероны (напр., -, -, -); лимфокины типа IL-2, IL-3, IL-4, IL-6; гормоны типа инсулина, TRH (рилизинг-фактор тиреотропина), MSH (меланоцит-стимулирующий гормон), стероидные гормоны типа андрогенов и эстрогенов; факторы роста и колониестимулирующие факторы типа EGF, TGF-, FGF, VEGF, G-CSF, M-CSF иGM-CSF (Burgess, 5 Immunology Today 155-158 (1984; трансферрин (O'Keefe et al., 260 J. Biol. Chem. 932-937 (1985; и витамины типа фолата. Методы моноклональных антител позволяют получать чрезвычайно специфичные агенты клеточного связывания в виде специфических моноклональных антител. Особенно хорошо в данной области известны методы получения моноклональных антител при иммунизации мышей, крыс, хомяков или любых других млекопитающих представляющим интерес антигеном, таким как интактные клетки-мишени,антигены, выделенные из клеток-мишеней, целые вирусы, ослабленные целые вирусы и вирусные белки типа белков вирусной оболочки. Также можно использовать сенситизированные клетки человека. Другой метод получения моноклональных антител состоит в использовании фаговых библиотек scFv (одноцепочечных вариабельных областей), в особенности scFv человека (напр., см. Griffiths et al., U.S. Patent Nos. 5,885,793 и 5,969,108; McCafferty et al., WO 92/01047; Liming et al., WO 99/06587). Кроме того, можно использовать и перестроенные (resurfaced) антитела, раскрытые в U.S. Patent No. 5,639,641, а также гуманизированные антитела. Выбор надлежащего агента клеточного связывания является предметом выбора, который зависит от конкретной популяции клеток-мишеней, но в общем предпочтительны моноклональные антитела человека, если таковые доступны. Например, моноклональное антитело J5 - это мышиное антитело типа IgG2a, которое специфично к общему антигену острого лимфобластного лейкоза (CALLA) (Ritz et al, 283 Nature 583-585 (1980 и мо-7 010508 жет использоваться, если клетки-мишени экспрессируют CALLA, как при заболевании острым лимфобластным лейкозом. Моноклональное антитело MY9 - это мышиное антитело типа IgG1, которое специфически связывается с антигеном CD33 (J.D. Griffin et al., 8 Leukemia Res., 521 (1984 и может использоваться, если клетки-мишени экспрессируют CD33, при заболевании острым миелогенным лейкозом (AML). Аналогичным образом моноклональное антитело анти-В 4, также называемое В 4, - это мышиныйIgG1, который связывается с антигеном CD19 на В-клетках (Nadler et al., 131 J. Immunol. 244-250 (1983 и может использоваться, если клетки-мишени представляют собой В-клетки или больные клетки, экспрессирующие этот антиген, как при не-Ходжкинской лимфоме или хроническом лимфобластном лейкозе. Кроме того, моноклональное антитело С 242, которое связывается с антигеном CanAg (U.S. PatentNo. 5,552,293), может использоваться для лечения экспрессирующих CanAg опухолей, таких как рак толстой и прямой кишки, поджелудочной железы, немелкоклеточный рак легких и рак желудка. HuC242 это гуманизированная форма моноклонального антитела С 242, которая описана в U.S. Patent No. 5,552,293, а ее гибридома депонирована в ЕСАСС за номером 90012601. Гуманизированная форма может быть получена либо методом CDR-grafting (U.S. Patent Nos. 5,585,089; 5,693,761; и 5,693,762), либо методом восстановления (U.S. Patent No. 5,639,641). HuC242 также может использоваться для лечения экспрессирующих CanAg опухолей, таких как рак толстой и прямой кишки, поджелудочной железы, немелкоклеточный рак легких и рак желудка. Кроме того, антитело трастузумаб может использоваться для лечения рака молочной железы и других форм рака, таких как рак простаты и рак яичников, при которых экспрессируется антиген Her2. Также полезны антитела против IGF-IR, которые связываются с рецептором инсулинподобного фактора роста. Для лечения рака яичников и рака простаты можно с успехом использовать, к примеру, антитела против MUC1 типа анти-HMFG-2 (Taylor-Papadimitriou et al., 28 Int. J. Cancer 17-21, 1981) или hCTM01J591 (Liu et al., Cancer Res. 3629-3634, 1997), соответственно. Для прицельного воздействия на определенные популяции клеток можно использовать и другие молекулы, помимо антител. Например, GM-CSF, который связывается с миелоидными клетками, можно использовать в качестве агента клеточного связывания для прицельного воздействия на больные клетки при остром миелогенном лейкозе. Кроме того, IL-2, который связывается с активированными Тклетками, можно использовать для профилактики отторжения трансплантатов, для терапии и предупреждения реакции "трансплантат против хозяина" и для лечения острого Т-клеточного лейкоза. MSH, который связывается с меланоцитами, можно использовать для лечения меланомы. Фолиевая кислота может использоваться для прицельного воздействия на фолатный рецептор, экспрессируемый на опухолях яичников и других опухолях. Эпидермальный фактор роста (EGF) можно использовать для прицельного воздействия на плоскоклеточный рак при раке легких и головы и шеи. Соматостатин можно использовать для прицельного воздействия на нейробластомы и другие типы опухолей. На рак молочной железы и рак яичек можно с успехом воздействовать прицельно с помощью эстрогена (или его аналогов) или андрогена (или его аналогов), соответственно, в качестве агентов клеточного связывания. Перекрестно сшивающие реагенты Майтансиноид соединяется с агентом клеточного связывания при помощи перекрестно сшивающего реагента, который при реакции образует нерасщепляемый линкер между майтансиноидом и агентом клеточного связывания. В настоящем изобретении "линкер" означает любую химическую группировку, которая ковалентно соединяет агента клеточного связывания с майтансиноидом. В некоторых случаях часть линкера происходит из майтансиноида. Например, тиол-содержащий майтансиноид DM1 (фиг. 2) является производным природного майтансиноида - майтансина и обеспечивает часть линкера. Боковая цепь при гидроксильной группе С-3 майтансина оканчивается на -СО-СН 3, а боковая цепь DM1 оканчивается на -COCH2-CH2-SH. Поэтому конечный линкер собирается из двух кусков: перекрестно сшивающий реагент входит в состав агента клеточного связывания, а боковая цепь происходит из DM1. Расщепляемые линкеры - это линкеры, которые могут быть расщеплены в мягких условиях, т.е. условиях, при которых активность препарата на основе майтансиноида не затрагивается. Многие известные линкеры попадают в эту категорию и описаны ниже. Дисульфид-содержащие линкеры - это линкеры, которые расщепляются путем обмена дисульфидов, который может происходить в физиологических условиях. Кислотолабильные линкеры - это линкеры, которые расщепляются при кислом значении рН. Например, определенные внутриклеточные компартменты, такие как эндосомы и лизосомы, имеют кислое значение рН (рН 4-5) и обеспечивают условия, подходящие для расщепления кислотолабильных линкеров. Фотолабильные линкеры полезны на поверхности тела и во многих полостях организма, которые доступны для освещения. Кроме того, инфракрасный свет может проникать в ткани. Некоторые линкеры могут расщепляться пептидазами. Только некоторые пептиды легко расщеп-8 010508 ляются внутри клетки или снаружи, напр., см. Trouet et al., 79 Proc. Natl. Acad. Sci. USA, 626-629 (1982) иUmemoto et al., 43 Int. J. Cancer, 677-684 (1989). Кроме того, пептиды состоят из -аминокислот и пептидных связей, которые в химическом отношении представляют собой амидные связи между карбоксильной группой одной аминокислоты и -аминогруппой второй аминокислоты. Другие амидные связи,такие как связь между карбоксильной группой и -аминогруппой лизина, не считаются пептидными связями и считаются нерасщепляемыми. Некоторые линкеры могут расщепляться эстеразами. Опять же только некоторые эфиры могут расщепляться эстеразами, находящимися внутри клетки или снаружи. Сложные эфиры образуются при конденсации карбоновой кислоты и спирта. Простые эфиры - это эфиры, образуемые простыми спиртами,такими как алифатические спирты и небольшие циклические и небольшие ароматические спирты. Так,авторы настоящего изобретения обнаружили, что эстеразы не расщепляют эфир в положении С-3 майтансина, так как спиртовый компонент этого эфира, майтансинол, является очень большим и сложным. Нерасщепляемый линкер - это любая химическая группировка, которая способна соединить майтансиноид с агентом клеточного связывания устойчиво и ковалентно и не подпадает под категории, приведенные выше в качестве расщепляемых линкеров. Так, нерасщепляемые линкеры практически устойчивы к расщеплению под действием кислоты, расщеплению под действием света, расщеплению пептидазами, расщеплению эстеразами и расщеплению дисульфидной связи."По существу, устойчив" к расщеплению означает, что химическая связь в линкере или по соседству с линкером по меньшей мере у 80%, предпочтительно по меньшей мере у 85%, более предпочтительно по меньшей мере у 90%, еще более предпочтительно по меньшей мере у 95% и наиболее предпочтительно по меньшей мере у 99% популяции конъюгата между агентом клеточного связывания и майтансиноидом остается нерасщепляемой под действием кислоты, фотолабильного расщепляющего реагента, пептидазы, эстеразы либо химического или физиологического соединения, расщепляющего химическую связь(к примеру, дисульфидную связь) в расщепляемом линкере, на протяжении нескольких часов или нескольких дней при обработке любым из вышеописанных реагентов. Кроме того, "нерасщепляемый" означает способность химической связи в линкере или по соседству с линкером противостоять расщеплению, вызванному кислотой, фотолабильным расщепляющим реагентом, пептидазой, эстеразой либо химическим или физиологическим соединением, расщепляющим дисульфидную связь, в условиях, при которых майтансиноид или агент клеточного связывания не теряет своей активности. Средний специалист в этой области сможет легко отличить нерасщепляемый линкер от расщепляемого линкера. Примером соответствующего контроля при тестировании линкера, по существу, на устойчивость к расщеплению служит линкер с химической связью типа дисульфидной связи, который подвержен расщеплению любым из реагентов, описанных выше. Протестировать линкер на практическую устойчивость к расщеплению можно, измеряя стабильность конъюгатов методами ELISA, ВЭЖХ или иным подходящим способом за период времени, длящийся от нескольких часов до нескольких дней, обычно от 4 часов до 5 дней. Методом ELISA можно измерить уровень стабильного конъюгата в плазме. Нерасщепляемые линкеры также отличаются тем, что время полужизни in vivo у конъюгатов, содержащих нерасщепляемые линкеры, обычно примерно на 20% выше, чем у конъюгатов, содержащих расщепляемые линкеры. У мышей время полужизни in vivo конъюгатов IgG-майтансиноид, соединенных через нерасщепляемые линкеры, составляет по меньшей мере 4 дня. Подходящие перекрестно сшивающие реагенты, образующие нерасщепляемые линкеры между майтансиноидом и агентом клеточного связывания, хорошо известны в данной области и могут образовывать нерасщепляемые линкеры, содержащие атом серы (к примеру, SMCC) или без атома серы. Предпочтительные перекрестно сшивающие реагенты, образующие нерасщепляемые линкеры между майтансиноидом и агентом клеточного связывания, включают малеимидную или галоидацетильную группировку. По настоящему изобретению такие нерасщепляемые линкеры происходят из малеимидной или галоидацетильной группировки. К сшивающим реагентам, содержащим малеимидную группировку,относятся N-сукцинимидил-4-(малеимидометил)циклогексанкарбоксилат (SMCC), N-сукцинимидил-4(N-малеимидометил)циклогексан-1-карбокси-6-амидокапроат, представляющий собой "длинноцепочечный" аналог SMCC (LC-SMCC), N-сукцинимидиловый эфир -малеимидоундекановой кислоты (KMUA),N-сукцинимидиловый эфир -малеимидомасляной кислоты (GMBS), N-гидроксисукцинимидный эфир малеимидокапроновой кислоты (EMCS), m-малеимидобензоил-N-гидроксисукцинимидный эфир (MBS),N-(-малеимидацетокси)сукцинимидный эфир (AMAS), сукцинимидил-6-(-малеимидопропионамидо) гексаноат (SMPH), N-сукцинимидил-4-(р-малеимидофенил)бутират (SMPB) и N-(p-малеимидофенил) изоцианат (PMPI) (см. репрезентативные структуры малеимидных перекрестно сшивающих реагентов на фиг. 15). Эти сшивающие реагенты образуют нерасщепляемые линкеры, происходящие из малеимидных группировок. К сшивающим реагентам, содержащим галоидацетильную группировку, относятся N-сукцинимидил-4-(иодацетил)аминобензоат (SLAB), N-сукцинимидилиодацетат (SIA), N-сукцинимидилбром-9 010508 ацетат (SBA) и N-сукцинимидил-3-(бромацетамидо)пропионат (SBAP) (см. репрезентативные структуры галоидацетильных перекрестно сшивающих реагентов на фиг. 16). Эти перекрестно сшивающие реагенты образуют нерасщепляемые линкеры, происходящие из галоидацетильных группировок. Несмотря на то, что активные эфиры, приведенные на фиг. 15 и 16, состоят из N-сукцинимидиловых и сульфосукцинимидиловых эфиров, можно использовать и другие активные эфиры, к примеруN-гидроксифталимидиловые эфиры, N-гидроксисульфофталимидиловые эфиры, ортонитрофениловые эфиры, паранитрофениловые эфиры, 2,4-динитрофениловые эфиры, 3-сульфонил-4-нитрофениловые эфиры, 3-карбокси-4-нитрофениловые эфиры, пентафторфениловые эфиры и сульфонилтетрафторфениловые эфиры. Особенно предпочтительны перекрестно сшивающие реагенты, которые образуют нерасщепляемые линкеры, не содержащие атома серы. На фиг. 21 представлена молекула майтансиноида, обработанная сшивающим реагентом, происходящим из ,-дикарбоновой кислоты (алкан- или алкендиовая кислота,у которой алкан или алкен содержит 3-24 атома углерода). При реакции с агентом клеточного связывания такой сшивающий реагент образует нерасщепляемый линкер, не содержащий серы (не содержащийS нерасщепляемый линкер). Молекулы майтансиноида на фиг. 21 получают следующим образом. Сначала получают моноэфир адипиновой кислоты (также известной как гександиовая кислота или 1,6-гександикарбоновая кислота) при обработке одним эквивалентом 2-триметил-силилэтанола в присутствии дициклогексилкарбодиимида. Активация оставшейся карбоксильной группы изобутилхлорформатом и последующая реакция с Nметил-L-аланином дает ацилированный N-метил-L-аланин. Реакция с майтансинолом в присутствии дициклогексилкарбодиимида и хлорида цинка и последующее удаление защитной группы триметилсилила с помощью тетрабутиламмония фторида дает эфир майтансиноида, несущий свободную карбоксильную группу. Этерификация карбоксильной группы при реакции с сульфо-N-гидроксисукцинимидом в присутствии дициклогексилкарбодиимида дает активный эфир майтансинола, который может реагировать с агентом клеточного связывания с образованием нерасщепляемого конъюгата, не содержащего атома серы. Нерасщепляемые линкеры, не содержащие атома серы, могут быть получены и из других молекул на основе дикарбоновых кислот, используя вышеописанный метод. К подходящим другим молекулам на основе дикарбоновых кислот относятся (не ограничиваясь этим) ,-дикарбоновые кислоты общей формулы IV В формуле IV X означает линейный или разветвленный алкил, алкенил или алкинил, содержащий от 2 до 20 атомов углерода, Y означает циклоалкил или циклоалкенил, содержащий от 3 до 10 атомов углерода, Z означает замещенную или незамещенную ароматическую группу, содержащую от 6 до 10 атомов углерода, либо замещенную или незамещенную гетероциклическую группу, у которой гетероатом выбран из N, О или S, причем l, m и n поодиночке равны 0 или 1 при условии, что все вместе они не равны 0 одновременно. Майтансиноиды, содержащие после обработки активный эфир, который может непосредственно реагировать с агентом клеточного связывания с образованием конъюгата, содержащего нерасщепляемый линкер, не содержащий S, могут быть представлены формулой 5 где X, Y, Z, l, m и n определены выше как для формулы IV, а также Е вместе с карбонильной группой образует активный эфир, такой как N-гидроксисукцинимидиловый и сульфосукцинимидиловый эфиры, N-гидроксифталимидиловый эфир, N-гидроксисульфофталимидиловый эфир, ортонитрофениловый эфир, паранитрофениловый эфир, 2,4-динитрофениловый эфир, 3-сульфонил-4-нитрофениловый эфир, 3-карбокси-4-нитрофениловый эфир, пентафторфениловый эфир и сульфонилтетрафторфениловый эфир. Предпочтительным является дериватизованный майтансиноид, представленный формулой 6 где n означает целое число от 3 до 24, а Е соответствует определению для майтансиноида формулы 5. Более предпочтительное воплощение составляет производный майтансиноид, представленный формулой 7 где R означает Н или SO3-Na+. Соединения формул 5, 6 и 7 являются новыми майтансиноидами. Примеры линейных алкилов, алкенилов или алкинилов, содержащих от 2 до 20 атомов углерода,включают (не ограничиваясь этим) этил, пропил, бутил, пентил, гексил, пропенил, бутенил и гексенил. Примеры разветвленных алкилов, алкенилов или алкинилов, содержащих от 2 до 20 атомов углерода, включают (не ограничиваясь этим) изопропил, изобутил, втор-бутил, трет-бутил, изопентил, 1 этилпропил, изобутенил, изопентенил, этинил, пропинил (пропаргил), 1-бутинил, 2-бутинил и 1 гексинил. Примеры циклоалкилов или циклоалкенилов, содержащих от 3 до 10 атомов углерода, включают(не ограничиваясь этим) циклопропил, циклобутил, циклопентил, циклогексил, циклопентенил, циклогексенил и циклогептадиенил. Примеры ароматических групп, содержащих от 6 до 10 атомов углерода, включают (не ограничиваясь этим) фенил и нафтил. Примеры замещенных ароматических групп включают (не ограничиваясь этим) нитрофенил и динитрофенил. Гетероциклические ароматические группы включают (не ограничиваясь этим) группы, содержащие 3-10-членное кольцо, содержащее один или два гетероатома, выбранных из N, О или S. Примеры замещенных и незамещенных гетероциклических ароматических групп включают (не ограничиваясь этим) пиридил, нитропиридил, пирролил, оксазолил, тиенил, тиазолил и фурил. Гетероциклоалкильные радикалы включают (не ограничиваясь этим) циклические соединения, содержащие 3-10-членные кольцевые системы, содержащие один или два гетероатома, выбранных из N, О или S. Примеры гетероциклоалкильных радикалов включают (не ограничиваясь этим) дигидрофурил, тетрагидрофурил, тетрагидропирролил, пиперидинил, пиперазинил и морфолино. Примеры ,-дикарбоновых кислот общей формулы HOOC-X1-Yn-Zm-COOH включают (не ограничиваясь этим) адипиновую кислоту, глутаровую кислоту, пимелиновую кислоту, гексен-1,6-диовую кислоту, пентен-1,5-диовую кислоту, циклогександиовую кислоту и циклогексендиовую кислоту. Синтез цитотоксических конъюгатов Конъюгаты из агентов клеточного связывания и майтансиноидов могут быть образованы любыми методами, известными в настоящее время или разработанными позже. Способы конъюгирования агентов клеточного связывания с майтансиноидами, в общем, включают две стадии реакции. В одном методе, описанном в U.S. Patent No. 5,208,020, агент клеточного связывания типа антитела может быть модифицирован с помощью перекрестно сшивающего реагента для введения одной или нескольких, обычно 1-10, реакционноспособных групп. Затем модифицированный агент клеточного связывания подвергают реакции с одним или несколькими тиолсодержащими майтансиноидами для получения конъюгата.- 11010508 Альтернативно, как изложено в U.S. Patent No. 6,441,163 В 1, можно сначала модифицировать тиолсодержащий майтансиноид с помощью перекрестно сшивающего реагента, после чего модифицированный майтансиноид подвергнуть реакции с агентом клеточного связывания. Например, тиолсодержащий майтансиноид можно подвергнуть реакции с малеимидными соединениями, приведенными на фиг. 15,либо с галоацетильными соединениями, приведенными на фиг. 16, получая тиоэфир майтансиноида, несущий активный сукцинимидиловый или сульфосукцинимидиловый эфир. Реакция этих майтансиноидов, содержащих активированную группировку линкера, с агентом клеточного связывания составляет другой метод получения нерасщепляемого конъюгата из агента клеточного связывания и майтансиноида. В другом аспекте изобретения, как изложено выше, можно сначала обработать майтансиноид, не содержащий атома серы, перекрестно сшивающим реагентом на основе дикарбоновой кислоты, а затем провести реакцию с агентом клеточного связывания, получая конъюгат, в котором майтансиноид соединен с агентом клеточного связывания через не содержащий S нерасщепляемый линкер. Как правило, в среднем присоединяют 1-10 майтансиноидов к одному антителу. Конъюгат можно подвергнуть очистке на колонке Sephadex G-25. Все содержание U.S. Patent Nos. 5,208,020 и 6,441,163 В 1 явным образом включено в настоящее изобретение путем отсылки. Репрезентативными конъюгатами по изобретению являются производные типа антителомайтансиноид, производные типа фрагмент антитела-майтансиноид, конъюгаты из майтансиноида и фактора роста типа производных эпидермального фактора роста (EGF) и майтансиноида, конъюгаты гормон-майтансиноид типа производных из меланоцит-стимулирующего гормона (MSH) и майтансиноида, производных из тиреоид-стимулирующего гормона (TSH) и майтансиноида, производных из эстрогена и майтансиноида, производных из аналога эстрогена и майтансиноида, производных из андрогена и майтансиноида, производных из аналога андрогена и майтансиноида, а также конъюгаты витаминмайтансиноид, к примеру фолат-майтансиноид. Конъюгаты майтансиноидов с антителами, фрагментами антител, белковыми гормонами, белковыми факторами роста и другими белками получают таким же образом. Например, пептиды и антитела можно модифицировать с помощью приведенных выше нерасщепляемых перекрестно сшивающих реагентов. Раствор антитела в водном буфере можно инкубировать с молярным избытком сшивающего реагента для модификации антител, такого как сукцинимидил-4-(N-малеимидометил)циклогексан-1 карбоксилат (SMCC), сульфо-SMCC, m-малеимидобензоил-N-гидроксисукцинимидный эфир (MBS),сульфо-MBS, сукцинимидилиодацетат или N-сукцинимидил-4-(иодацетил)аминобензоат (SIAB), Nсукцинимидил-4-(N-малеимидометил)циклогексан-1-карбокси-6-амидокапроат, представляющий собойRector et al., 24 J. Immunol. Meth. 321-336 (1978); и Inman et al., 2 Bioconjugate Chem. 458-463 (1991). После этого модифицированные антитела обрабатывают тиолсодержащим майтансиноидом (1,25 молярных эквивалентов на малеимидную или иодацетильную группу) для получения конъюгата. Смеси инкубируют в течение ночи примерно при 4 С. Конъюгаты антитело-майтансиноид очищают гельфильтрацией на колонке Sephadex G-25. Число молекул майтансиноида, связанных с молекулой антитела, можно определить спектрофотометрически, измеряя соотношение значений поглощения при 252 нм и 280 нм. Как правило, в среднем, с одним антителом соединяются 1-10 майтансиноидов. Предпочтительный способ заключается в модификации антител с помощью сукцинимидил-4-(Nмалеимидометил)циклогексан-1-карбоксилата (SMCC) для введения малеимидных групп с последующей реакцией модифицированных антител с тиолсодержащим майтансиноидом, получая соединенный через тиоэфир конъюгат. Опять же получают конъюгаты, содержащие 1-10 молекул препарата на молекулу антитела. Примеры конъюгатов антитело-майтансиноид представлены на фиг. 17-20. Аналогичным образом, к примеру, можно подвергнуть этерификации агенты клеточного связывания - эстрогены и андрогены, такие как эстрадиол и андростендиол, по гидроксильной группе С-17 при реакции с содержащим защищенную тиоловую группу хлоридом карбоновой кислоты типа 3-Sацетилпропаноилхлорида. Можно использовать и другие способы этерификации, как описано в литера- 12010508 туре (Haslam, 36 Tetrahedron 2400-2433 (1980. Затем андроген или эстроген, содержащий блокированный или свободный тиол, можно подвергнуть реакции с тиолсодержащим майтансиноидом для получения конъюгатов. Конъюгаты могут быть очищены методом колоночной хроматографии на силикагеле или методом ВЭЖХ. Особенно предпочтительный способ заключается в модификации майтансинола перекрестно сшивающим реагентом, образующим линкер, не содержащий атомов серы, после чего модифицированный майтансиноид подвергают реакции с антителом для получения конъюгатов. Терапевтическая эффективность цитотоксических конъюгатов изобретения Конъюгаты из агента клеточного связывания и майтансиноида по изобретению можно оценить на их способность к подавлению пролиферации различных линий клеток in vitro. Например, для оценки цитотоксичности этих конъюгатов можно использовать такие клеточные линии, как линия карциномы толстой кишки человека COLO205, линия клеток меланомы человека A375, линия клеток миелоидного лейкоза человека HL60, линия карциномы молочной железы человека SKBR3 или линия клеток эпидермоидной карциномы человека КВ. Исследуемые клетки можно подвергнуть воздействию соединений в течение 24 ч и измерить долю выживших клеток при прямом определении известными методами (напр.,см. Goldmacher et al., 135 J. Immunol. 3648-3651 (1985); и Goldmacher et al., 102 J. Cell Biol. 1312-1319(1986. Затем можно рассчитать значения IC50 из результатов определения. Высокая цитотоксичность может быть определена как проявление токсичности со значением IC50(ингибирующая концентрация токсического вещества, при которой доля выживших составляет 0,5) около 10-8 М или меньше при измерении in vitro на клетках SKBR3 после 24-часового воздействия препарата. Активность in vitro и специфичность к мишени конъюгатов антитело-майтансиноид настоящего изобретения представлены на фиг. 4. Конъюгаты huC242 с DM1 с использованием перекрестно сшивающего реагента SMCC обладают большой активностью в разрушении антиген-положительных клетокSKBR3 со значением IC50 в 3,510-12 М. Напротив, антиген-отрицательные клетки А 375 примерно в 800 раз менее чувствительны, свидетельствуя, что конъюгаты майтансиноидов обладают большой активностью и высокой специфичностью. Конъюгат huC242-SMCC-DM1 обладал равной или большей активностью по сравнению с конъюгатами, полученными с помощью дисульфидсодержащих линкеров, при определении клоногенным методом (фиг. 6 А-С) и методом непрямой цитотоксичности (фиг. 7). Эти результаты были неожиданны в связи с опубликованными ранее данными, показывающими, что антитело против Her2, конъюгированное с майтансиноидами через SMCC, не проявляет специфической активности (Chari et al., 52 Cancer Res. 127133 (1992. Активность конъюгатов, полученных с помощью нерасщепляемого линкера SMCC, не ограничивается конъюгатами huC242. Специфическая активность in vitro также наблюдалась с конъюгатами SMCCDM1 и трастузумаба, антитела против Her2; Му 9-6, антитела против CD33; KS77, антитела противin vitro, не ограничиваются линкером SMCC. Конъюгат из DM1 и huC242, синтезированный с помощью нерасщепляемого линкера SIAB, проявлял сильную и антигенспецифичную цитотоксичность при определении клоногенным методом in vitro (фиг. 9). Также и конъюгат из DM1 и трастузумаба, синтезированный с помощью SIAB, оказался цитотоксичным при определении клоногенным методом (фиг. 28). К тому же и конъюгат huC242-не содержащий S нерасщепляемый линкер-DM1 проявлял сильную и антиген-специфичную цитотоксичность при определении клоногенным методом in vitro (фиг. 22). Конъюгаты антител и DM1 с линкером SMCC проявляют противораковую активность против ксенотрансплантатов опухолей человека у мышей (фиг. 10 А-С). Во-первых, как показано на фиг. 10 А, наблюдалось заметное ингибирование роста опухолей при обработке ксенотрансплантатов опухоли толстой кишки COLO205 конъюгатом huC242-SMCC-DM1. В этом эксперименте одну группу из 5 животных, несущих устоявшиеся подкожные опухоли, обрабатывали huC242-SMCC-DM1 в дозе 150 мкг/кг конъюгированного DM1. Размеры опухолей периодичеки измеряли и откладывали на графике как функцию времени после инокуляции опухоли. Все пять обработанных животных имели полную ремиссию,хотя трое животных дали рецидив в различные моменты времени, тогда как двое животных оставались свободными от опухоли до окнчания эксперимента (фиг. 10 А). Кроме того, как показано на фиг. 10 В, эта противораковая активность наблюдалась при таких дозах конъюгата, которые не влияют на вес тела мышей как критерий токсичности препарата. В этом эксперименте три группы по 5 животных, каждое из которых несло устоявшуюся подкожную опухоль SNU, обрабатывали huC242-SMCC-DM1 в дозах 15, 30 и 60 мкг/кг конъюгированного DM1, соответственно. Размеры опухолей периодичеки измеряли и откладывали на графике как функцию времени после инокуляции опухоли. huC242-SMCC-DM1 показал дозозависимый противоопухолевый эффект. Результаты показывают, что обработка мышей, несущих ксенотрансплантаты опухоли карциномы толстой кишки COLO205, конъюгатом huC242-SMCC-DM1 вела к полной регрессии опухолей, причем одна мышь оставалась свободной от заметных опухолей свыше 2 месяцев после обработки (фиг. 10 А). Опять же такая активность была получена при такой концентрации- 13010508 конъюгата, которая не влияла на вес тела мышей. Конъюгат трастузумаб-SMCC-DM1 также проявлял заметную регрессию опухолей у мышей на модели ксенотрансплантата с клетками линии карциномы молочной железы MCF-7 (фиг. 10 С). Плазменный клиренс конъюгата антитело-майтансиноид, синтезированного с помощью нерасщепляемого линкера SMCC, очень медленный и сравним с клиренсом самого антитела. Это резко отличается от плазменного клиренса конъюгатов типа huC242-SPP-DM1, полученных с относительно лабильными дисульфидными связями. Например, время полужизни для клиренса конъюгата SMCC составляет около 320 ч, тогда как время полужизни у конъюгата SPP находится в пределах 40-50 ч (фиг. 11). Однако клиренс антител, входящих в состав каждого типа конъюгатов, одинаков, свидетельствуя, что отличия по измеренному показателю клиренса конъюгатов обусловлены потерей майтансиноида из конъюгата с антителом в случае конъюгата SPP-DM1. Следовательно, нерасщепляемый линкер SMCC значительно более устойчив к процессам расщепления связи майтансиноид-линкер in vivo, чем конъюгат SPP-DM1. Кроме того, снижение показателя клиренса у конъюгатов SMCC по сравнению с конъюгатами SPP-DM1 ведет к возрастанию почти в 5 раз общей экспозиции животного майтансиноидом, судя по площади под кривой (AUC). Такая увеличенная экспозиция может иметь существенное влияние на эффективность препарата в некоторых случаях. Конъюгаты майтансиноидов, полученные с помощью нерасщепляемых линкеров типа SMCC, проявляют неожиданно высокую толерантность на мышах по сравнению с конъюгатами, полученными с помощью расщепляемых дисульфидных линкеров. Проводился тест на острую токсичность при однократном внутривенном введении на самках мышей CD-1. Проводили сравнение переносимости конъюгата huC242-SMCC-DM1 (нерасщепляемого) с конъюгатами huC242, полученными с помощью линкеров,содержащих расщепляемые дисульфидные связи, учитывая смертность мышей (фиг. 12 А и В) и признаки токсичности (фиг. 12 С и D) на серии из четырех возрастающих доз каждого конъюгата. Максимальная переносимая доза (MTD) для конъюгата SMCC-DM1 превышала наибольшую тестированную дозу (150 мг/кг), тогда как MTD для соединенного через дисульфид конъюгата SPP-DM1 находилась в пределах 45-90 мг/кг. При 150 мг/кг выжили все мыши в группе, получавшей SMCC-DM1, тогда как у всех мышей в группе, получавшей SPP-DM1, наблюдалась летальная токсичность к 96 часам после обработки. Конъюгаты майтансиноидов, как полагают, реализуют свою активность по разрушению клеток через ингибирование полимеризации микротрубочек. Ингибирование полимеризации микротрубочек ведет к остановке клеточного цикла на стадии G2/M. Антиген-зависимую остановку клеток на стадии G2/M под действием конъюгатов антитело-майтансиноид можно наблюдать методами проточной цитометрии (фиг. 13). Обработка клеток COLO205 конъюгатом huC242-SPP-DM1 или huC242SMCC-DM1 приводит к полной остановке на стадии G2/M через 6-10 ч. Однако через 30 ч после обработки некоторые из клеток, остановленных при обработке соединенным через дисульфид конъюгатом huC242-SPP-DM1, выходили из блокировки клеточного цикла и возобновляли клеточное деление. Вне ожидания клетки, обработанные нерасщепляемым конъюгатом, не выходили из блокировки клеточного цикла в этот поздний момент времени. Различия в продолжительности действия этих двух конъюгатов также отражаются в процентном содержании мертвых клеток по прошествии 30 ч,судя по определению методом исключения красителя трипанового синего. Эти результаты свидетельствуют о неожиданной продолжительности молекулярных событий, вызванных обработкой конъюгатами с нерасщепляемым линкером SMCC. Дополнительный аспект конъюгатов, полученных с помощью нерасщепляемых линкеров, по сравнению с конъюгатами, содержащими расщепляемые дисульфидные линкеры, заключается в отсутствии активности по отношению к антиген-отрицательным клеткам, когда они находятся поблизости от антиген-положительных клеток, который мы назвали посторонним действием. При этом конъюгаты, полученные с помощью нерасщепляемых линкеров, обладают минимальной неспецифической активностью. Конъюгаты huC242-SPP-DM1 (расщепляемый) и huC242-SMCC-DM1 (нерасщепляемый) оба проявляют сильную активность по разрушению клеток в отношении антиген-положительных клеток линииCOLO205 и не обладают активностью в отношении антиген-отрицательных клеток линии Namalwa при раздельном культивировании (фиг. 14 А-С). Однако при обработке совместных культур клеток COLO205 и Namalwa конъюгатом huC242-SPP-DM1 открывается впечатляющая активность конъюгата по разрушению клеток даже в отношении антиген-отрицательных клеток Namalwa. Напротив, конъюгат huC242SMCC-DM1 не проявляет никакой неспецифической активности в этих условиях. У конъюгата huC242SMCC-DM1 не наблюдается какой-либо активности по разрушению клеток в отношении клеток Namalwa даже при совместном культивировании с антиген-положительными клетками COLO205. Такая минимальная неспецифическая активность у нерасщепляемого конъюгата, судя по этому определению in vitro,может способствовать повышенной переносимости конъюгата с нерасщепляемым линкером, наблюдавшейся в опытах по острой токсичности. Результаты вышеприведенных экспериментов свидетельствуют, что конъюгаты майтансиноидов с нерасщепляемыми линкерами по настоящему изобретению обладают сильно улучшенной противоопухолевой активностью по сравнению с ранее описанными конъюгатами из агентов клеточного связывания и майтансиноидов.- 14010508 Способы применения Вышеописанные конъюгаты могут применяться в способе прицельной доставки майтансиноидов к выбранной популяции клеток, который включает контактирование популяции клеток или ткани, предположительно содержащей выбранную популяцию клеток, с конъюгатом из майтансиноида и агента клеточного связывания, в котором один или несколько майтансиноидов ковалентно соединено с агентом клеточного связывания через нерасщепляемый линкер, а агент клеточного связывания связывается с клетками выбранной популяции клеток. Вышеописанные конъюгаты также могут применяться в способе разрушения клеток, который включает контактирование клеток с конъюгатом из майтансиноида и агента клеточного связывания, в котором один или несколько майтансиноидов ковалентно соединено с агентом клеточного связывания через нерасщепляемый линкер, а агент клеточного связывания связывается с клетками. Вышеописанные конъюгаты также могут применяться в способе лечения заболеваний, включая (но не ограничиваясь этим) злокачественные опухоли, аутоиммунные заболевания, отторжение трансплантатов, реакции "трансплантат против хозяина", вирусные инфекции, микробные инфекции и паразитарные инфекции, причем способ включает введение нуждающемуся в лечении субъекту эффективного количества конъюгата из майтансиноида и агента клеточного связывания, в котором один или несколько майтансиноидов ковалентно соединено с агентом клеточного связывания через нерасщепляемый линкер, а агент клеточного связывания связывается с больными или инфицированными клетками при данном заболевании. Примеры медицинских заболеваний, которые можно лечить в соответствии со способами настоящего изобретения, включают (не ограничиваясь этим) злокачественные образования любого типа, в том числе, к примеру, рак легких, молочной железы, толстой кишки, простаты, почек, поджелудочной железы, яичников и лимфатических органов; аутоиммунные заболевания, такие как системная волчанка, ревматоидный артрит и множественный склероз; отторжение трансплантатов типа отторжения почечных трансплантатов, отторжения печеночных трансплантатов, отторжения легочных трансплантатов, отторжения сердечных трансплантатов и отторжения трансплантатов костного мозга; реакции "трансплантат против хозяина"; вирусные инфекции типа инфекции CMV, инфекции ВИЧ, СПИД и др.; и паразитарные инфекции, такие как лямблиоз, амебиоз, шистосомоз и др., что определяется средним специалистом в этой области. Способы могут осуществляться in vitro или in vivo. Вышеописанные конъюгаты могут применяться в способе применения in vitro для обработки, к примеру, аутологичных клеток костного мозга перед их пересадкой тому же самому пациенту для того,чтобы разрушить больные или злокачественные клетки; клеток костного мозга или другой ткани перед их пересадкой для того, чтобы разрушить Т-клетки и другие лимфоидные клетки и предотвратить реакцию "трансплантат против хозяина"; клеточных культур для того, чтобы разрушить все клетки, кроме желательных вариантов, не экспрессирующих целевой антиген, либо клеточных культур для того, чтобы разрушить те клетки, которые экспрессируют нежелательный антиген, причем способ включает обработку клеток эффективным количеством конъюгата из майтансиноида и агента клеточного связывания, в котором один или несколько майтансиноидов ковалентно соединено с агентом клеточного связывания через нерасщепляемый линкер, а агент клеточного связывания связывается с клетками, подлежащими разрушению. Условия клинического и неклинического применения in vitro легко определяются средним специалистом в этой области. Например, обработка может проводиться следующим образом. Костный мозг можно взять у пациента или иного индивидуума, а затем инкубировать в среде, содержащей сыворотку, в которую добавлено цитотоксическое вещество изобретения, причем концентрация составляет от 10 пМ до 1 нМ, в течение времени от 30 мин до 48 ч при 37 С. Точные условия концентрации и времени инкубации, например доза, легко определяются средним специалистом в этой области. После инкубации клетки костного мозга можно промыть средой, содержащей сыворотку, и ввести обратно пациенту внутривенно в соответствии с известными методами. В обстоятельствах, когда пациент подвергается другому лечению, скажем, курсу деструктивной химиотерапии или облучению всего тела в период между взятием костного мозга и реинфузией обработанных клеток, обработанные клетки костного мозга могут храниться замороженными в жидком азоте с применением стандартного медицинского оборудования. Для клинического применения in vivo цитотоксическое вещество может быть подано в виде раствора или лиофилизованного порошка, который протестирован на стерильность и на содержание эндотоксинов. Примеры подходящих методик введения конъюгата заключаются в следующем. Конъюгаты можно вводить еженедельно на протяжении 4 недель внутривенно болюсом каждую неделю. Болюсные дозы можно вводить в 50-500 мл обычного физраствора, в который можно добавить 5-10 мл сывороточного альбумина человека. Дозировка составляет от 10 до 2000 мг на введение, внутривенно (от 100 нг до 20 мг/кг в день). После 4 недель лечения пациент может продолжать лечение по еженедельной схеме. Конкретные клинические методики in vitro в отношении способа применения, наполнителей, разбавителей, дозировки, времени и т.д. могут быть определены средним специалистом в этой области, как- 15010508 того потребует клиническая ситуация. При желании вместе с конъюгатом можно вводить и другие активные вещества, к примеру, другие противоопухолевые средства. Новые конъюгаты, композиции и способы получения конъюгатов В то время как некоторые конъюгаты из антител и майтансиноидов, соединенных через нерасщепляемый линкер, уже известны, другие являются новыми. Поэтому представлен конъюгат из майтансиноида и агента клеточного связывания, в котором по меньшей мере один майтансиноид соединен с агентом клеточного связывания через нерасщепляемый линкер, при условии, что линкер не содержит группы, происходящей из перекрестно сшивающего реагента, выбранного из группы, состоящей из сукцинимидил-4-(N-малеимидометил)циклогексан-1-карбоксилата (SMCC), сульфо-SMCC, m-малеимидобензоил-N-гидроксисукцинимидного эфира (MBS), сульфо-MBS и сукцинимидил-иодацетата, если агентом клеточного связывания является антитело. Новые конъюгаты могут быть получены и применены, как описано выше. Композиция включает конъюгат из майтансиноида и агента клеточного связывания и носитель. Носителем может быть фармацевтически приемлемый носитель, разбавитель или наполнитель. Подходящие фармацевтически приемлемые носители, разбавители и наполнители хорошо известны и могут быть определены средними специалистами в этой области, как того потребует клиническая ситуация. Примеры подходящих фармацевтически приемлемых носителей, разбавителей и/или наполнителей включают: (1) фосфатно-солевой буфер Дюльбекко, рН около 7,4, содержащий или не содержащий от 1 до 25 мг/мл сывороточного альбумина человека; (2) 0,9% физраствор (0,9% NaCl) и (3) 5 мас.% декстроза; они могут также содержать антиоксидант типа триптамина и стабилизирующее вещество типа Tween 20. Для этих новых конъюгатов также представлены способы синтеза. Один из способов получения конъюгата из майтансиноида и агента клеточного связывания включает:(a) обеспечение агента клеточного связывания,(b) модифицирование агента клеточного связывания с помощью перекрестно сшивающего реагента, и(c) конъюгирование модифицированного агента клеточного связывания с майтансиноидом или тиолсодержащим майтансиноидом, обеспечивая при этом нерасщепляемый линкер между агентом клеточного связывания и майтансиноидом или тиолсодержащим майтансиноидом для образования конъюгата. Другой способ получения конъюгата из майтансиноида и агента клеточного связывания включает:(a) обеспечение майтансиноида или тиолсодержащего майтансиноида,(b) модифицирование майтансиноида или тиолсодержащего майтансиноида с помощью перекрестно сшивающего реагента для образования нерасщепляемого линкера, и(c) конъюгирование модифицированного майтансиноида или тиолсодержащего майтансиноида с агентом клеточного связывания, обеспечивая при этом нерасщепляемый линкер между агентом клеточного связывания и майтансиноидом или тиолсодержащим майтансиноидом для образования конъюгата. Дополнительный способ получения конъюгата из майтансиноида и агента клеточного связывания включает:(a) обеспечение майтансиноида,(b) модифицирование майтансиноида для получения не содержащего серы майтансинола, содержащего активный эфир, и(c) конъюгирование модифицированного майтансиноида с агентом клеточного связывания, обеспечивая при этом не содержащий S нерасщепляемый линкер между агентом клеточного связывания и майтансинолом для образования конъюгата. Эти способы подробно описаны выше и в цитировавшихся патентах США и явным образом включены в настоящее изобретение путем отсылки. ПРИМЕРЫ Далее изобретение будет раскрыто на следующих неограничивающих примерах. Если не указано иначе, все проценты, отношения, весовые доли и т.п. выражены по массе. В нижеследующих экспериментах использовали такие буферы: 50 мМ фосфат (KPi)/50 мМ NaCl/2 мМ этилендиаминтетрауксусная кислота (ЭДТА), рН 6,5 (буфер А); фосфатно-солевой буфер (PBS), рН 6,5 (буфер В); и 0,1 М KPi-буфер/2 мМ ЭДТА, рН 7,5 (буфер для определения).SMCC ( продукта 22360, м.в. 334,33 г/моль) и SIAB ( продукта 22329, м.в. 402,15 г/моль) приобретали у фирмы Pierce. Антитело huC242 представляет собой гуманизированную форму моноклонального антитела С 242, описанного в U.S. Patent No. 5,552,293, гибридома которого депонирована в ЕСАСС под номером 90012601. Антитело трастузумаб получали от Genentech. DM1 (форма со свободным тиолом, м.в. 737,5 г/моль) получали, как описано ранее в U.S. Patent Nos. 5,208,020 и 6,333,410 B1. Хроматографию проводили на хроматографических колонках, приобретенных у фирмы AmershamBiosciences (готовые колонки NAP-25, заполненные Sephadex G25 (Amersham, 17-0852-02); колонки для обессоливания HiPrep 26/10 со смолой Sephadex G25 fine, 3 колонки, соединенные последовательно (Amersham, 17-5087-01. Также использовали хроматографические колонки TSK-GEL G3000SWXL (TOSOHBioscience, 08541) вместе с защитной колонкой TSK SWx1 (TOSOH Bioscience, 08543). В нижеследующих экспериментах использовали такие растворители: диметилсульфоксид (DMSO),диметилацетамид (DMA), этанол (EtOH) и 100 мМ реагент Эллмана (DTNB, фирмы Cayman Chemical) вa) Получение и измерение антител huC242 Концентрацию антител измеряли, используя коэффициент экстинкции 1,48 (мг/мл)-1 при 280 нм и молекулярный вес 147000 г/моль.b) Приготовление и измерение маточного раствора SMCC Готовили 20 мМ раствор SMCC (6,69 мг/мл) в диметилсульфоксиде (DMSO). Раствор разводили 1:40 буфером для определения и измеряли поглощение образцов при 302 нм. Концентрацию маточного раствора рассчитывали, используя коэффициент экстинкции 602 М-1 см-1.c) Приготовление и измерение маточного раствора DM1 Готовили 10 мМ раствор DM1 (форма со свободным тиолом) в диметилацетамиде (DMA) (7,37 мг/мл) (фиг. 2). Измеряли поглощение разведений маточного раствора в этаноле (EtOH) при 280 нм. Концентрацию маточного раствора DM1 рассчитывали, используя коэффициент экстинкции 5700 М-1 при 280 нм. Концентрацию свободных сульфгидрильных или тиоловых групп (SH-групп) в маточном препарате DM1 измеряли с помощью реактива Эллмана (DTNB). Готовили разведения маточного раствора в буфере для определения, доведенном до 3% об. DMA, а затем добавляли 100 мМ DTNB в DMSO(1/100 объема). Измеряли возрастание поглощения при 412 нм против холостой пробы и рассчитывали концентрацию, используя коэффициент экстинкции 14150 М-1 см-1. Полученную методом Эллмана концентрацию SH-групп использовали для представления концентрации маточного раствора DM1 при расчетах условий конъюгирования.d) Модификация huC242 сшивающим реагентом SMCC Антитела разделяли на два образца; один подвергали модификации, используя 7,5-кратный молярный избыток перекрестно сшивающего реагента SMCC, а другой - при 8,5-кратном молярном избытке перекрестно сшивающего реагента SMCC. Образцы подвергали реакции при концентрации антител 8 мг/мл. Реакции проводили в буфере А (95% об.) с DMSO (5% об.) в течение 2 ч при комнатной температуре с перемешиванием.e) Хроматография на G25 для удаления избытка SMCC Реакционные смеси huC242-SMCC подвергали гель-фильтрации через готовые колонки 1,54,9 см со смолой Sephadex G25, уравновешенной буфером А. Объемы нанесения и элюции соответствовали инструкциям изготовителя. Элюаты с модифицированными антителами подвергали анализу для определения концентрации антител, используя приведенный выше коэффициент экстинкции. Выход модифицированных антител составил 74,6% при реакции с 7,5-кратным молярным избытком SMCC и 81,6% при реакции с 8,5-кратным молярным избытком SMCC.f) Конъюгирование huC242-SMCC с DM1 Образцы модифицированных антител подвергали реакции при 1,7-кратном избытке DM1 относительно линкера (из расчета 5 линкеров на антитело). Реакции проводили при концентрации антител 2,5 мг/мл в буфере А (97% об.) с DMA (3% об.). После добавления DM1 реакции инкубировали при комнатной температуре в течение примерно 20 ч с перемешиванием.g) Очистка конъюгатов хроматографией на G25 Смеси для реакции конъюгирования подвергали гель-фильтрации через готовые колонки 1,54,9 см со смолой Sephadex G25, уравновешенной буфером В. Объемы нанесения и элюции соответствовали инструкциям изготовителя. Число молекул DM1 на моль huC242 определяли по измерению поглощения элюатов при 252 нм и 280 нм. Отношение DM1/антитело при 7,5-кратном молярном избытке SMCC в образце оказалось равным 3,54, а при 8,5-кратном молярном избытке SMCC - 3,65. На стадии конъюгации выход составил 83,7% и 75,4%, соответственно. Оба конъюгата объединяли, стерилизовали фильтрованием и повторяли определение концентраций препарата и антител. Объединенному образцу присвоилипрепарата 1713-146 С и подвергли анализу на связывание, цитотоксичность, специфичность,степень агрегации и содержание свободного препарата. Таблица I. Характеристики huC242-SMCC-DM1a) Связывание Сродство связывания антитела huC242 и huC242-SMCC-DM1 сравнивали, используя непрямой метод на клетках COLO 205, в котором использовали 5103 клеток на лунку при первичной инкубации на льду в течение 3 часов. Результаты представлены на фиг. 3. Немодифицированное антитело связывалось со значением KD в 5,5210-10 М, а его конъюгированный вариант связывался со значением KD в 5,110-10- 17010508 М. Таким образом, конъюгация с DM1, очевидно, не изменяет сродство связывания huC242.b) Цитотоксичность и специфичность Цитотоксичность и специфичность конъюгата huC242-SMCC-DM1 in vitro оценивали клоногенным методом при непрерывном воздействии. Результаты представлены на фиг. 4. Конъюгат huC242-SMCCDM1 эффективно разрушал антиген-положительные клетки SKBR3 (IC50 = 3,510-12 М). Специфичность проявлялась при сравнении значений IC50 на целевых клетках SKBR3 и на клетках антигенотрицательной линии А 375, на которых значение IC50 конъюгата превышало 3,010-9 М.c) Анализ методом эксклюзионной хроматографии Конъюгат подвергали анализу на эксклюзионной колонке TSK300 (фиг. 5). Пик 4 пердставляет собой мономерную фракцию конъюгата, тогда как ранее сходящие пики представляют собой мультимер, а позднее сходящие пики представляют собой фрагмент. Площадь под каждой кривой, деленная на общую площадь пиков, представляет собой вклад пиков в образец. Было найдено, что образец конъюгата на 96,0% состоит из мономера.d) Свободное лекарственное средство Содержание свободного лекарственного средства измеряли методом ELISA, и оно составило 4,4%. Пример 2 А. Получение конъюгата трастузумаб-SMCC-DM1. Антитела трастузумаб получали от Genentech для конъюгации с DM1 с помощью нерасщепляемого гетеробифункционального перекрестно сшивающего реагента SMCC. Антитела подвергали замене буфера из 50 мМ фосфата калия/2 мМ ЭДТА, рН 6,0, на 50 мМ фосфата калия/20 мМ NaC1/2 мМ ЭДТА, рН 6,5 (буфер А). Затем антитела подвергали реакции при 7,5 кратном молярном избытке линкера SMCC и очищали на смоле Sephadex G25 перед конъюгированием сDM1. Конечный конъюгат снова очищали на смоле Sephadex G25. Полученный конъюгат содержал 3,1 моль DM1 на моль антитела.a) Получение и измерение антител трастузумаб Антитела трастузумаб в буфере из 50 мМ фосфата калия/2 мМ ЭДТА, рН 6,0, пропускали через колонку Sephadex G25, уравновешенную буфером А, и элюировали буфером А. Все буфера, используемые в этом эксперименте, тестировали на отсутствие эндотоксина методом с хромогенным лизатом амебоцитов Lymulus (LAL) (Cambrex). Концентрацию антител измеряли, используя коэффициент экстинкции 1,45 млмг-1 см-1 при 280 нм и молекулярный вес 145423 г.b) Приготовление и измерение маточного раствора SMCC Готовили 20 мМ раствор SMCC (6,69 мг/мл) в диметилсульфоксиде (DMSO). Раствор разводили 1:40 буфером для определения и измеряли поглощение образцов при 302 нм. Концентрацию маточного раствора рассчитывали, используя молярный коэффициент экстинкции 602 М-1 см-1.c) Приготовление и измерение маточного раствора DM1 Готовили 10 мМ раствор DM1 (форма со свободным тиолом) в диметилацетамиде (DMA) (7,37 мг/мл) (фиг. 2). Измеряли поглощение разведений маточного раствора в EtOH при 280 нм. Концентрацию маточного раствора DM1 рассчитывали, используя молярный коэффициент экстинкции 5700 М-1 см-1 при 280 нм. Концентрацию свободных SH-групп в маточном препарате DM1 измеряли с помощью реактива Эллмана (DTNB). Готовили разведения маточного раствора в буфере для определения, доведенном до 3% об. DMA, а затем добавляли 100 мМ DTNB в DMSO (1/100 объема). Измеряли возрастание поглощения при 412 нм против холостой пробы и рассчитывали концентрацию, используя коэффициент экстинкции 14150 М-1 см-1. Полученную методом Эллмана концентрацию SH-групп использовали для представления концентрации маточного раствора DM1 при расчетах условий конъюгирования.d) Модификация трастузумаб перекрестно сшивающим реагентом SMCC Антитела подвергали модификации, используя 7,5-кратный молярный избыток SMCC при концентрации антител 20 мг/мл. Реакцию проводили в буфере А (95 об.%) с DMSO (5 об.%) в течение 2 ч при комнатной температуре с перемешиванием.e) Хроматография на G25 для удаления избытка SMCC Реакционную смесь трастузумаб-SMCC подвергали гель-фильтрации через готовую колонку 1,54,9 см со смолой Sephadex G25, уравновешенной буфером А. Объемы нанесения и элюции соответствовали инструкциям изготовителя (Amersham Biosciences). Концентрацию модифицированных антител в растворе определяли спектрофотометрически, используя приведенный выше коэффициент экстинкции. Выход модифицированных антител составил 88% на основе концентрации белка.f) Конъюгирование трастузумаб-SMCC с DM1 Модифицированные антитела подвергали реакции при 1,7-кратном избытке DM1 относительно линкера (из расчета 5 линкеров на антитело). Реакцию проводили при концентрации антител 10 мг/мл в буфере А (94 об.%) с DMA (6 об.%). После добавления DM1 реакцию инкубировали при комнатной температуре в течение 16,5 ч с перемешиванием.g) Очистка конъюгатов хроматографией на G25 Смеси для реакции конъюгирования подвергали гель-фильтрации через готовые колонки 1,54,9 см со смолой Sephadex G25, уравновешенной буфером В. Объемы нанесения и элюции соответствовали ин- 18010508 струкциям изготовителя (Amersham Biosciences). Число молекул DM1 на моль трастузумаба определяли по измерению поглощения элюатов при 252 и 280 нм. Отношение DM1/антитело оказалось равным 3,13,а выход на стадии конъюгации составил 95,7%. Общий выход конъюгированного трастузумаба составил 84% в пересчете на исходные антитела. Полученный конъюгат подвергали анализу на связывание, цитотоксичность, специфичность, степень агрегации и содержание свободного препарата. Таблица II. Характеристики трастузумаб-SMCC-DM1 Пример 2 В. Тестирование трастузумаб-SMCC-DM1 in vitro. Опыты по связыванию показали, что конъюгация антител с DM1 не влияет на кажущееся значениеKD: как немодифицированные антитела трастузумаб, так и конъюгат трастузумаб-SMCC-DM1 обладали одинаковым сродством связывания на чашках ECD (5,510-11 М). Оценка цитотоксичности образца invitro показала, что конъюгат трастузумаб-SMCC-DM1 сильно токсичен (IC50 = 3,510-12 M на клетках антиген-положительной линии) и специфичен (IC50 конъюгата превышает 3,010-9 М на клетках антигенотрицательной линии). а) Связывание Сродства связывания антитела трастузумаб и трастузумаб-SMCC-DM1 сравнивали, используя метод связывания на чашках HER2-ECD фирмы Genentech. Результаты представлены на фиг. 24. И немодифицированное антитело, и его конъюгированный вариант связывались со значением кажущейся KD в 5,510-11 М. Таким образом, конъюгация с DM1 не меняет сродство связывания трастузумаба.b) Цитотоксичность и специфичность Цитотоксичность и специфичность конъюгата трастузумаб-SMCC-DM1 in vitro оценивали клоногенным методом при непрерывном воздействии. Результаты представлены на фиг. 25. Конъюгат трастузумаб-SMCC-DM1 эффективно разрушал антиген-положительные клетки SKBR3 (IC50 = 3,610-12 М). Специфичность проявлялась при сравнении значений IC50 на клетках-мишенях SKBR3 и на клетках антиген-отрицательной линии A375, на которых значение IC50 конъюгата превышало 3,010-9 М.c) Анализ методом эксклюзионной хроматографии Конъюгат подвергали анализу на эксклюзионной колонке TSK300 (фиг. 26). Пик 1 пердставляет собой мультимер, пик 2 представляет собой димер, а пик 3 представляет собой мономер. Площадь под каждой кривой, деленная на общую площадь пиков, представляет собой вклад пиков в образец. Было найдено, что образец конъюгата на 95,3% состоит из мономера (фиг. 5).d) Анализ свободного лекарственного средства Содержание свободного лекарственного средства измеряли методом ELISA, и оно составило 3,4%.e) Содержание эндотоксина Конъюгат проверяли хроматографическим методом LAL и получили, что он содержит 0,03 ед./мг. Пример 3 А. Получение конъюгата трастузумаб-SIAB-DM1. Антитела трастузумаб получали от Genentech для конъюгации с DM1 с помощью нерасщепляемого гетеробифункционального перекрестно сшивающего реагента SIAB. Антитела подвергали реакции при 7,0-кратном молярном избытке линкера SIAB при рН 6,5 и очищали на смоле Sephadex G25F. Содержащие антитела фракции объединяли и обрабатывали DM1 в течение ночи в стандартных условиях конъюгирования при рН 6,5 и комнатной температуре, но в темноте. Отбирали аликвоту из реакционного сосуда и анализировали для определения включения DM1. При измерении после фильтрования через NAP-5 в ней содержалось только 1,4 молекулы препарата/антитело. В реакцию дополнительно вносили 8-кратный избыток SIAB на 2 ч, а затем повышали рН до 8 перед самым добавлением дополнительного 1,5-кратного избытка DM1/SIAB. Реакцию оставляли для продолжения и очищали с помощью смолы Sephadex G25F. Полученный конъюгат содержал 3,42 моль DM1 на моль антитела.a) Измерение антител трастузумаб Концентрацию антител измеряли, используя коэффициент экстинкции 1,45 млмг-1 см-1 при 280 нм и молекулярный вес 145423 г.b) Приготовление и измерение маточного раствора SIAB Готовили 18 мМ раствор SIAB (7,2 мг/мл) в DMSO. Раствор, разведенный буфером рН 4, сканировали по шкале длин волн и регистрировали только для сведения.c) Приготовление и измерение маточного раствора DM1 Готовили приблизительно 30 мМ раствор DM1 (форма со свободньм тиолом) в DMA. Концентрацию свободных SH-групп в маточном препарате DM1 измеряли с помощью реактива Эллмана (DTNB). Готовили разведения маточного раствора в буфере для определения, доведенном до 3 об.%. DMA, а затем добавляли 100 мМ DTNB в DMSO (1/100 объема). Измеряли возрастание поглощения при 412 нм против холостой пробы и рассчитывали концентрацию, используя молярный коэффициент экстинкции 14150 М-1 см-1. Полученную методом Эллмана концентрацию SH-групп использовали для представления концентрации маточного раствора DM1 при расчетах условий конъюгирования.d) Модификация трастузумаб перекрестно сшивающим реагентом SIAB Антитела подвергали модификации, используя 7,0-кратный молярный избыток SIAB при концентрации антител 20 мг/мл. Реакцию проводили в буфере А (95 об.%) с DMSO (5 об.%) в течение 2 ч при комнатной температуре с перемешиванием в темноте.e) Хроматография на G25 для удаления избытка SIAB Реакционную смесь трастузумаб-SIAB подвергали гель-фильтрации через колонку для обессоливания HiPrep 26/10, уравновешенную буфером А. Наблюдались помехи при 280 нм от реагента SIAB, поэтому выход модифицированных антител принимали равным 100% и степень модификации принимали за 5 линкеров на антитело при определении количества DM1 в реакции конъюгирования.f) Конъюгирование трастузумаб-SIAB с DM1 Модифицированные антитела подвергали реакции при 1,7-кратном избытке DM1 относительно линкера из расчета 100% выхода и 5 линкеров на антитело, как указано выше. Концентрация антител при реакции составляла 12,5 мг/мл, а реакция проводилась в буфере А (97 об.%) с DMA (3 об.%). После добавления DM1 реакцию инкубировали при комнатной температуре в темноте в течение 16,5 ч с перемешиванием.g) Анализ реакции конъюгации Отбирали аликвоту в 0,25 мл реакционной смеси и подвергали гель-фильтрации через готовую колонку Sephadex G25, уравновешенную буфером В. Число молекул DM1 на моль трастузумаба определяли по измерению поглощения элюатов при 252 и 280 нм. Отношение DM 1/антитело составило лишь 1,4.h) Дополнительная реакция модификации/конъюгации Дополнительно вносили 8-кратный молярный избыток SIAB и инкубировали 2 ч при комнатной температуре. Добавляли 1,5-кратный молярный избыток DM1 относительно SIAB и повышали рН реакции до 8 добавлением 1 N NaOH. Реакцию инкубировали при комнатной температуре в темноте и подвергали гель-фильтрации через колонку со смолой G25F, уравновешенную буфером В.i) Объединение фракций и характеристика конъюгата Белковые фракции объединяли, фильтровали и измеряли поглощение при 252 и 280 нм. Образцы конъюгата тестировали на содержание эндотоксина, связывание, специфическую и неспецифическую цитотоксичность, % мономера и содержание свободного лекарственного средства. Таблица III. Характеристики трастузумаб-SIAB-DM1 Пример 3 В. Тестирование трастузумаб-SIAB-DM1 in vitro. Опыты по связыванию показали, что конъюгация антител с DM1 не влияет на кажущееся значениеKD: как немодифицированные антитела трастузумаб, так и конъюгат трастузумаб-SIAB-DM1 обладали близким сродством связывания (кажущиеся значения KD: антитело 1,210-10 М, конъюгат 1,910-10 M). Оценка цитотоксичности образца in vitro показала, что конъюгат трастузумаб-SIAB-DM1 сильно токсичен (IC50 = 510-12 М на клетках антиген-положительной линии SKBR3) и специфичен (IC50 превышает 3,010-9 М на клетках антиген-отрицательной линии A375).a) Связывание Сродство связывания антитела трастузумаб и трастузумаб-SIAB-DM1 сравнивали, используя метод связывания на чашках HER2-ECD фирмы Genentech. Результаты представлены на фиг. 27. Немодифицированное антитело и трастузумаб-SIAB-DM1 обладали близким сродством связывания (кажущиеся значения KD: 1,210-10 М для антитела, 1,910-10 М для конъюгата).b) Цитотоксичность и специфичность Оценка цитотоксичности образца in vitro показала, что конъюгат трастузумаб-SIAB-DM1 сильно токсичен (IC50=510-12 М на клетках антиген-положительной линии SKBR3) и специфичен (IC50 превышает 3,010-9 М на клетках антиген-отрицательной линии А 375). См. фиг. 28.c) Анализ методом эксклюзионной хроматографии Конъюгат подвергали анализу на эксклюзионной колонке TSK300 (фиг. 29). Пик 1 пердставляет собой димер, а пик 2 представляет собой мономер. Площадь под каждой кривой, деленная на общую площадь пиков, представляет собой вклад пиков в образец. Было найдено, что образец конъюгата на 96,4% состоит из мономера.d) Свободное лекарственное средство Содержание свободного лекарственного средства измеряли методом ELISA, и оно составило 0,35%.e) Содержание эндотоксина Конъюгат проверяли хроматографическим методом LAL и получили, что он содержит 0,04 ед./мг. Пример 4. Конъюгация huC242 с перекрестно сшивающим реагентом, образующим не содержащийS нерасщепляемый линкер. а) Синтез Готовили маточный раствор перекрестно сшивающего реагента (см. структуру на фиг. 21) в DMA,- 20010508 удаляли нерастворимый осадок центрифугированием и определяли концентрацию оставшегося раствора,используя коэффициент экстинкции 280=5700 М-1 см-1, который дает экстинкцию DM1 на этой волне. Поскольку действительный коэффициент экстинкции для этого материала не был определен, то это дает лишь оценку концентрации. Следует отметить, что отношение 252/280 для DM1 равно 4,7 (в EtOH), тогда как 252/280 для данного раствора перекрестно сшивающего реагента (в буфере рН 7,5) составило 1,42,что свидетельствует либо о разных экстинкциях, либо о примесях. Реакцию конъюгирования проводили в масштабе 2 мг, используя 2,8 мг/мл антител huC242 в 16%DMA в буфере Е, рН 7,5 (буфер Е = 50 мМ фосфат натрия, 150 мМ NaCl, 10 мМ ЭДТА). На основании оценки концентрации сшивающего реагента в маточном растворе использовали 30 эквивалентов сшивающего линкера на антитело (в более раннем эксперименте с использованием 10 экв. Перекрестно сшивающего линкера на антитело получили конъюгат, содержащий только 0,9 DM1/антитело). Реакцию проводили в течение 3 ч, после чего конъюгат очищали пропусканием через колонку Nap 10 (G25). После фильтрования (фильтр Millex GV, размер пор 0,2 мкм) конъюгат содержал 2,56 DM1/антитело (препарат 1749-119 А, выход антител = 78%). Аликвоту конъюгата исследовали методом ВЭЖХ (колонка HiPrep) на свободный DM1 и наблюдали измеряемый пик DM1 на 12,09'. Образец поэтому подвергали диализу в буфере В, чтобы избавиться от этого пика, а затем повторяли определение. Конечный образец конъюгата(препарат 1749-124 А) не содержал свободного DM1 по данным ВЭЖХ и содержал 1,84DM1/антитело. Методом SEC-ВЭЖХ получили, что конъюгат на 97% состоит из мономерного антитела.b) Цитотоксичность и связывание Авторы изобретения провели исследования связывания и цитотоксичности конъюгата huC242-несодержащий-S-нерасщепляемый линкер-DM1. Сперва сравнивали сродство связывания антитела huC242,huC242-SMNP-DM3 и huC242-не-содержащий-S-нерасщепляемый линкер-DM1, используя непрямой метод на клетках COLO 205. Использовали 510 клеток на лунку при первичной инкубации во льду в течение 3 ч. Результаты представлены на фиг. 23, которая показывает, что конъюгат huC242-несодержащий-S-нерасщепляемый линкер-DM1 проявлял примерно в два раза более высокую кажущуюся константу диссоциации, чем свободное антитело (см. фиг. 23). Дополнительно конъюгат huC242-несодержащий-S-нерасщепляемый линкер-DM1 имел цитотоксичность in vitro, которая была сравнима сhuC242-SMNP-DM3 (IC50 конъюгата с не содержащим S нерасщепляемым линкером = 7,010-12 М) (см. фиг. 22). Поскольку изобретение уже описано подробно и со ссылкой на его конкретные воплощения, то специалисту в этой области должно быть ясно, что в нем можно производить различные изменения и модификации, не отходящие от духа и не выходящие за рамки изобретения. Все патенты, публикации и прочие ссылки, приведенные в настоящем изобретении, явным образом включены путем отсылки во всей полноте. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Конъюгат из майтансиноида и агента клеточного связывания следующей формулы: 2. Конъюгат из майтансиноида и агента клеточного связывания следующей формулы: 3. Конъюгат из майтансиноида и агента клеточного связывания следующей формулы: 4. Конъюгат из майтансиноида и агента клеточного связывания следующей формулы: 5. Способ прицельной доставки майтансиноидов к выбранной популяции клеток in vitro, включающий контактирование популяции клеток или ткани, предположительно содержащей выбранную популяцию клеток, с конъюгатом из майтансиноида и агента клеточного связывания, в котором один или несколько майтансиноидов ковалентно соединено с агентом клеточного связывания через нерасщепляемый линкер, а агент клеточного связывания связывается с клетками выбранной популяции клеток. 6. Способ устранения клеток in vitro, включающий контактирование клеток с конъюгатом из майтансиноида и агента клеточного связывания, в котором один или несколько майтансиноидов ковалентно соединено с агентом клеточного связывания через нерасщепляемый линкер, а агент клеточного связывания связывается с клетками. 7. Способ применения in vitro для обработки аутологичных клеток костного мозга перед их пересадкой тому же самому субъекту для того, чтобы устранить больные или раковые клетки; клеток костного мозга перед их пересадкой для того, чтобы устранить компетентные Т-клетки и предотвратить реакцию "трансплантат против хозяина"; клеточных культур для того, чтобы устранить все клетки за исключением желательных вариантов, не экспрессирующих целевой антиген; либо клеточных культур для то- 21010508 го, чтобы устранить варианты клеток, экспрессирующие нежелательный антиген; причем способ включает обработку клеток эффективным количеством конъюгата из майтансиноида и агента клеточного связывания, в котором один или несколько майтансиноидов ковалентно соединено с агентом клеточного связывания через нерасщепляемый линкер, а агент клеточного связывания связывается с клетками, подлежащими устранению. 8. Способ по п.5 или 6, в котором агент клеточного связывания представляет собой антитело трастузумаб. 9. Способ по п.6, в котором агент клеточного связывания представляет собой перестроенное (resurfaced) антитело С 242. 10. Способ по п.5 или 6, в котором агент клеточного связывания представляет собой антитело против CanAg, антитело против CD19, антитело против CD33, антитело против CALLA, антитело противEGFR, антитело против CD56, антитело против IGF-IR или антитело против Her2. 11. Способ по п.5 или 6, в котором агент клеточного связывания представляет собой перестроенное(resurfaced) антитело Му 9-6, KS77 или N901. 12. Способ по п.5 или 6, в котором агент клеточного связывания представляет собой антитело трастузумаб, антитело В 4 или антитело huC242. 13. Способ по п.5 или 6, в котором агент клеточного связывания представляет собой антителоhuC242. 14. Способ по любому из пп.5-13, где нерасщепляемый линкер, по существу, устойчив к расщеплению под действием кислоты, расщеплению под действием света, расщеплению пептидазами, расщеплению эстеразами или расщеплению дисульфидной связи. 15. Способ по любому из пп.5-13, где нерасщепляемый линкер не содержит атома серы. 16. Способ по п.15, где линкер происходит из молекулы на основе дикарбоновой кислоты. 17. Способ по п.16, где линкер происходит из молекулы на основе ,-дикарбоновой кислоты, причем ,-дикарбоновая кислота соответствует общей формуле HOOC-X1-Yn-Zm-COOH, где X означает линейный или разветвленный алкил, алкенил или алкинил, содержащий от 2 до 20 атомов углерода, Y означает циклоалкил или циклоалкенил, содержащий от 3 до 10 атомов углерода, Z означает замещенную или незамещенную ароматическую группу, содержащую от 6 до 10 атомов углерода, либо замещенную или незамещенную гетероциклическую группу, в которой гетероатом выбран из N, О или S, причемl, m и n поодиночке равны 0 или 1 при условии, что все вместе они не равны 0 одновременно. 18. Способ по п.17, где ,-дикарбоновая кислота представляет собой адипиновую кислоту, глутаровую кислоту, пимелиновую кислоту, гексен-1,6-диовую кислоту, пентен-1,5-диовую кислоту, циклогександиовую кислоту или циклогексендиовую кислоту. 19. Способ по любому из пп.5-13, где нерасщепляемый линкер содержит атом серы. 20. Способ по п.19, где нерасщепляемый линкер происходит из молекулы на основе малеимида. 21. Способ по п.20, где нерасщепляемый линкер происходит из молекулы на основе малеимида, выбранной из группы, состоящей из N-сукцинимидил-4-(малеимидометил)циклогексанкарбоксилата(PMPI). 22. Способ по п.21, где нерасщепляемый линкер происходит из SMCC. 23. Способ по п.19, где нерасщепляемый линкер происходит из молекулы на основе галоидацетила. 24. Способ по п.23, где нерасщепляемый линкер происходит из молекулы на основе галоидацетила,выбранной из группы, состоящей из N-сукцинимидил-4-(иодацетил)аминобензоата (SIAB), Nсукцинимидилиодацетата (SIA), N-сукцинимидилбромацетата(SBA) и N-сукцинимидил-3(бромацетамидо)пропионата (SBAP). 25. Способ по п.24, где нерасщепляемый линкер происходит из SIAB. 26. Способ по любому из пп.5-13, где линкер находится на одной из групп: гидроксиле С-3, гидроксиметиле С-14, гидроксиле С-15 или десметиле С-20 по меньшей мере одного майтансиноида. 27. Способ по любому из пп.5-13, где по меньшей мере один майтансиноид представляет собой сложный эфир майтансинола, содержащий N-метилаланин. 28. Способ по любому из пп.5-13, где по меньшей мере один майтансиноид представляет собой сложный эфир майтансинола, содержащий N-метилцистеин. 29. Способ по любому из пп.5-13, в котором по меньшей мере один майтансиноид представлен формулой II'-L, II'-D или II'-D,L: где Yl' означает (CR7R8)l(CR9=CR10)p(CC)qAo(CR5R6)mDu(CR11=CR12)r(CC)sBt(CR3R4)nCR1R2S-,причем R1-R12 независимо друг от друга означают линейный алкил или алкенил, содержащий от 1 до 10 атомов углерода, разветвленный или циклический алкил или алкенил, содержащий от 3 до 10 атомов углерода, фенил, замещенный фенил, либо гетероциклический ароматический или гетероциклоалкильный радикал, и, кроме того, R2-R12 могут означать Н; А, В и D независимо друг от друга означают циклический алкил или циклический алкенил, содержащий от 3 до 10 атомов углерода, простой или замещенный арил, либо гетероциклический ароматический или гетероциклоалкильный радикал;l, m, n, о, р, q, r, s, t и u независимо друг от друга означают 0 или целое число от 1 до 5, при условии,что по меньшей мере два из l, m, n, о, р, q, r, s, t и u не равны 0; иMay означает майтансиноид, несущий боковую цепь на гидроксиле С-3, гидроксиметиле С-14, гидроксиле С-15 или десметиле С-20. 30. Способ по любому из пп.5-13, в котором по меньшей мере один майтансиноид представлен формулой II-L, II-D или II-D,L где Y1 означает (CR7R8)l(CR5R6)m(CR3R4)nCR1R2S-, причем R1-R8 независимо друг от друга означают линейный алкил или алкенил, содержащий от 1 до 10 атомов углерода, разветвленный или циклический алкил или алкенил, содержащий от 3 до 10 атомов углерода, фенил, замещенный фенил, либо гетероциклический ароматический или гетероциклоалкильный радикал, и, кроме того, R2-R8 могут означать Н;l, m и n независимо друг от друга означают целое число от 1 до 5, и, кроме того, n может быть равно 0 иMay означает майтансиноид, несущий боковую цепь на гидроксиле С-3, гидроксиметиле С-14, гидроксиле С-15 или десметиле С-20. 31. Способ по любому из пп.5-13, в котором по меньшей мере один майтансиноид представлен формулой 41' где Yl' означает (CR7R8)l(CR9=CR10)p(CC)qAo(CR5R6)mDu(CR11=CR12)r(CC)sBt(CR3R4)nCR1R2S-,причем R1-R12 независимо друг от друга означают линейный алкил или алкенил, содержащий от 1 до 10 атомов углерода, разветвленный или циклический алкил или алкенил, содержащий от 3 до 10 атомов углерода, фенил, замещенный фенил, либо гетероциклический ароматический или гетероциклоалкильный радикал, и, кроме того, R2-R12 могут означать Н; А, В и D независимо друг от друга означают циклический алкил или циклический алкенил, содержащий от 3 до 10 атомов углерода, простой или замещенный арил, либо гетероциклический ароматиче- 23010508 ский или гетероциклоалкильный радикал; иl, m, n, о, р, q, r, s, t и u независимо друг от друга означают 0 или целое число от 1 до 5 при условии,что по меньшей мере два из l, m, n, о, р, q, r, s, t и u не равны 0. 32. Способ по любому из пп.5-13, в котором по меньшей мере один майтансиноид представлен формулой 41 где Y1 означает (CR7R8)l(CR5R6)m(CR3R4)nCR1R2S-, причем R1-R8 независимо друг от друга означают линейный алкил или алкенил, содержащий от 1 до 10 атомов углерода, разветвленный или циклический алкил или алкенил, содержащий от 3 до 10 атомов углерода, фенил, замещенный фенил, либо гетероциклический ароматический или гетероциклоалкильный радикал, и кроме того, R2-R8 могут означать Н; иl, m и n независимо друг от друга означают целое число от 1 до 5 и, кроме того, n может быть равно 0. 33. Способ по любому из пп.29-32, где R1 означает метил и R2 означает Н, либо R1 и R2 означают метил. 34. Способ по любому из пп.29-32, где R1 означает метил, R2 означает Н, R5, R6, R7 и R8 означают Н,l и m равны 1 и n равно 0; либо в котором R1 и R2 означают метил, R5, R6, R7 и R8 означают Н, l и m равны 1 и n равно 0. 35. Способ по любому из пп.5-13, в котором по меньшей мере один майтансиноид представляет собой DM1. 36. Способ по любому из п.п.5-13, в котором по меньшей мере один майтансиноид представляет собой DM3. 37. Способ по любому из пп.5-13, в котором по меньшей мере один майтансиноид представляет собой DM4. 38. Способ по любому из пп.5-13, в котором майтансиноид модифицирован не содержащим серы перекрестно сшивающим реагентом, образуя соединение формулы 5 где X означает линейный или разветвленный алкил, алкенил или алкинил, содержащий от 2 до 20 атомов углерода, Y означает циклоалкил или циклоалкенил, содержащий от 3 до 10 атомов углерода, Z означает замещенную или незамещенную ароматическую группу, содержащую от 6 до 10 атомов углерода, либо замещенную или незамещенную гетероциклическую группу, в которой гетероатом выбран из N,О или S, причем l, m и n поодиночке равны 0 или 1 при условии, что все вместе они не равны 0 одновременно, и Е вместе с карбонильной группой образует активный эфир, такой как Nгидроксисукцинимидиловый и сульфосукцинимидиловый эфиры, N-гидроксифталимидиловый эфир, Nгидроксисульфофталимидиловый эфир, ортонитрофениловый эфир, паранитрофениловый эфир, 2,4 динитрофениловый эфир, 3-сульфонил-4-нитрофениловый эфир, 3-карбокси-4-нитрофениловый эфир,пентафторфениловый эфир и сульфонилтетрафторфениловый эфир. 39. Способ по любому из пп.5-13, в котором майтансиноид модифицирован не содержащим серы- 24010508 перекрестно сшивающим реагентом, образуя соединение формулы 6 где n означает целое число от 3 до 24, а Е вместе с карбонильной группой образует активный эфир,такой как N-гидроксисукцинимидиловый и сульфосукцинимидиловый эфиры, N-гидроксифталимидиловый эфир, N-гидроксисульфофталимидиловый эфир, ортонитрофениловый эфир, паранитрофениловый эфир, 2,4-динитрофениловый эфир, 3-сульфонил-4-нитрофениловый эфир, 3-карбокси-4 нитрофениловый эфир, пентафторфениловый эфир и сульфонилтетрафторфениловый эфир. 40. Способ по любому из пп.5-13, в котором майтансиноид модифицирован не содержащим серы перекрестно сшивающим реагентом, образуя соединение формулы 7 где R означает Н или SO3-Na+. 41. Способ по любому из пп.5-7, в котором агент клеточного связывания представляет собой антитело, одноцепочечное антитело или фрагмент антитела, который специфически связывается с клеткоймишенью. 42. Способ по любому из пп.5-7, в котором агент клеточного связывания представляет собой перестроенное (resurfaced) антитело, перестроенное одноцепочечное антитело или фрагмент перестроенного антитела, который специфически связывается с клеткой-мишенью. 43. Способ по любому из пп.5-7, в котором агент клеточного связывания представляет собой гуманизированное антитело, гуманизированное одноцепочечное антитело или фрагмент гуманизированного антитела, который специфически связывается с клеткой-мишенью. 44. Способ по любому из пп.5-7, в котором агент клеточного связывания представляет собой моноклональное антитело, одноцепочечное моноклональное антитело или фрагмент моноклонального антитела, который специфически связывается с клеткой-мишенью. 45. Способ по любому из пп.5-7, в котором агент клеточного связывания представляет собой перестроенное (resurfaced) моноклональное антитело, перестроенное одноцепочечное моноклональное антитело или фрагмент перестроенного моноклонального антитела, который специфически связывается с клеткой-мишенью. 46. Способ по любому из пп.5-7, в котором агент клеточного связывания представляет собой гуманизированное моноклональное антитело, гуманизированное одноцепочечное моноклональное антитело или фрагмент гуманизированного моноклонального антитела, который специфически связывается с клеткой-мишенью. 47. Способ по любому из пп.5-7, в котором конъюгат из майтансиноида и агента клеточного связывания, включающий нерасщепляемый линкер, менее токсичен, чем конъюгат из майтансиноида и агента клеточного связывания, включающий по меньшей мере один майтансиноид, соединенный с агентом клеточного связывания через расщепляемый линкер. 48. Способ по любому из пп.5-7, в котором конъюгат из майтансиноида и агента клеточного связывания обладает почти таким же плазменным клиренсом, как и само антитело. 49. Способ по любому из пп.5-7, в котором максимальная переносимая доза у конъюгата из майтансиноида и агента клеточного связывания, включающего нерасщепляемый линкер, больше, чем у конъюгата из майтансиноида и агента клеточного связывания, включающего по меньшей мере один майтансиноид, соединенный с агентом клеточного связывания через расщепляемый линкер.- 25010508 50. Способ по любому из пп.5-7, в котором продолжительность биологической активности у конъюгата из майтансиноида и агента клеточного связывания, включающего нерасщепляемый линкер, больше, чем у конъюгата из майтансиноида и агента клеточного связывания, включающего по меньшей мере один майтансиноид, соединенный с агентом клеточного связывания через расщепляемый линкер. 51. Способ по любому из пп.5-7, в котором активность в отношении антиген-отрицательных клеток у конъюгата из майтансиноида и агента клеточного связывания, включающего нерасщепляемый линкер,меньше, чем у конъюгата из майтансиноида и агента клеточного связывания, включающего по меньшей мере один майтансиноид, соединенный с агентом клеточного связывания через расщепляемый линкер. 52. Способ по любому из пп.5-7, в котором конъюгат из майтансиноида и агента клеточного связывания проявляет минимальную неспецифическую активность (bystander activity). 53. Способ по п.5 или 6, в котором агент клеточного связывания связывается с раковыми клетками; зараженными вирусами клетками, зараженными микроорганизмами клетками, зараженными паразитами клетками, аутоиммунными клетками, активированными клетками, миелоидными клетками, активированными Т-клетками, В-клетками или меланоцитами; клетками, экспрессирующими антигены CD33,CD19, CanAg, CALLA или Her2; либо клетками, экспрессирующими рецептор инсулиноподобного фактора роста, рецептор эпидермального фактора роста или рецептор фолата. 54. Способ по п.5 или 6, в котором агент клеточного связывания связывается с клетками, выбранными из группы, состоящей из клеток рака молочной железы, клеток рака простаты, клеток рака яичников, клеток рака толстой и прямой кишки, клеток рака желудка, клеток плоскоклеточного рака, клеток мелкоклеточного рака легких, клеток рака яичек и клеток нейробластомы. 55. Способ по п.5 или 6, в котором агент клеточного связывания представляет собой антитело, одноцепочечное антитело, фрагмент антитела, который специфически связывается с клеткой-мишенью,моноклональное антитело, одноцепочечное моноклональное антитело или фрагмент моноклонального антитела, который специфически связывается с клеткой-мишенью, химерное антитело, фрагмент химерного антитела, который специфически связывается с клеткой-мишенью, доменное антитело, фрагмент доменного антитела, который специфически связывается с клеткой-мишенью, лимфокин, гормон, витамин, фактор роста, колониестимулирующий фактор или молекулу переносчика питательного вещества. 56. Способ по п.5 или 6, в котором агент клеточного связывания представляет собой интерферон,IL-2, IL-3, IL-4, IL-6, инсулин, рилизинг-фактор тиреотропина, меланоцитстимулирующий гормон, стероидный гормон, соматостатин, EGF, TGF-, FGF, G-CSF, VEGF, MCSF, GM-CSF, фолиевую кислоту,трансферрин, эстроген, аналог эстрогена, андроген или аналог андрогена. 57. Способ по п.5 или 6, в котором агент клеточного связывания представляет собой химерное антитело, фрагмент химерного антитела, доменное антитело или фрагмент доменного антитела, который специфически связывается с клеткой-мишенью. 58. Способ по п.5 или 6, в котором агент клеточного связывания представляет собой моноклональное антитело, одноцепочечное моноклональное антитело или фрагмент моноклонального антитела, который специфически связывается с раковыми клетками. 59. Способ по п.5 или 6, в котором агент клеточного связывания представляет собой перестроенное(resurfaced) моноклональное антитело, перестроенное одноцепочечное моноклональное антитело или фрагмент перестроенного моноклонального антитела, который специфически связывается с раковыми клетками. 60. Способ по п.5 или 6, в котором агент клеточного связывания представляет собой гуманизированное моноклональное антитело, гуманизированное одноцепочечное моноклональное антитело или фрагмент гуманизированного моноклонального антитела, который специфически связывается с раковыми клетками. 61. Способ по п.5 или 6, в котором агент клеточного связывания представляет собой химерное антитело, фрагмент химерного антитела, доменное антитело или фрагмент доменного антитела, который специфически связывается с раковыми клетками. 62. Способ по п.5 или 6, в котором агент клеточного связывания представляет собой моноклональное антитело, одноцепочечное моноклональное антитело или фрагмент моноклонального антитела, который специфически связывается с клетками рака толстой и прямой кишки или клетками рака молочной железы. 63. Способ по п.5 или 6, в котором агент клеточного связывания представляет собой перестроенное(resurfaced) моноклональное антитело, перестроенное одноцепочечное моноклональное антитело или фрагмент перестроенного моноклонального антитела, который специфически связывается с клетками рака толстой и прямой кишки или клетками рака молочной железы. 64. Способ по п.5 или 6, в котором агент клеточного связывания представляет собой гуманизированное моноклональное антитело, гуманизированное одноцепочечное моноклональное антитело или фрагмент гуманизированного моноклонального антитела, который специфически связывается с клетками рака толстой и прямой кишки или клетками рака молочной железы. 65. Способ по п.5 или 6, в котором агент клеточного связывания представляет собой перестроенное(resurfaced) моноклональное антитело, перестроенное одноцепочечное моноклональное антитело или- 26010508 фрагмент перестроенного моноклонального антитела, который специфически связывается с клетками рака молочной железы. 66. Способ по п.5 или 6, в котором агент клеточного связывания представляет собой гуманизированное моноклональное антитело, гуманизированное одноцепочечное моноклональное антитело или фрагмент гуманизированного моноклонального антитела, который специфически связывается с клетками рака молочной железы. 67. Конъюгат из майтансиноида и агента клеточного связывания, в котором один или несколько майтансиноидов соединено с агентом клеточного связывания через нерасщепляемый линкер, а агент клеточного связывания связывается с клетками-мишенями, представляющими собой больные или инфицированные клетки при заболевании, для применения в способе лечения заболеваний, выбранных из группы, состоящей из опухолей, аутоиммунных заболеваний, отторжения трансплантатов, реакции "трансплантат против хозяина", вирусных инфекций и паразитарных инфекций, причем способ включает введение нуждающемуся в лечении субъекту эффективного количества данного конъюгата. 68. Конъюгат по п.67, где опухоли выбраны из группы, состоящей из рака легких, молочной железы, толстой кишки, простаты, почек, поджелудочной железы, яичников и лимфатических органов. 69. Конъюгат по п.67, где аутоиммунные заболевания выбраны из группы, состоящей из системной волчанки, ревматоидного артрита и множественного склероза. 70. Конъюгат по п.67, где отторжения трансплантатов выбраны из группы, состоящей из отторжения почечных трансплантатов, отторжения сердечных трансплантатов и отторжения трансплантатов костного мозга. 71. Конъюгат по п.67, где вирусные инфекции выбраны из группы, состоящей из CMV, ВИЧ и СПИД. 72. Конъюгат по п.67, в котором паразитарные инфекции выбраны из группы, состоящей из лямблиоза, амебиоза и шистосомоза. 73. Конъюгат по любому из пп.67-72, в котором конъюгат является конъюгатом, охарактеризованным в любом из пп.14-40. 74. Конъюгат по п.67, в котором агент клеточного связывания является конъюгатом, охарактеризованным в любом из пп.9-13. 75. Конъюгат из майтансиноида и агента клеточного связывания, в котором по меньшей мере один майтансиноид соединен с агентом клеточного связывания через нерасщепляемый линкер, при условии,что если агентом клеточного связывания является антитело, то линкер не происходит из перекрестно сшивающего реагента, выбранного из группы, состоящей из сукцинимидил-4-(N-малеимидометил)циклогексан-1-карбоксилата (SMCC), сульфо-SMCC, m-малеимидобензоил-N-гидроксисукцинимидного эфира (MBS), сульфо-MBS и N-сукцинимидил-иодацетата (SIA). 76. Конъюгат из майтансиноида и агента клеточного связывания по п.75, при условии, что агентом клеточного связывания не является антитело. 77. Конъюгат из майтансиноида и агента клеточного связывания по п.75 или 76, в котором конъюгат является конъюгатом, охарактеризованным в любом из пп.14-40. 78. Конъюгат из майтансиноида и агента клеточного связывания по п.75 или 76, в котором агент клеточного связывания связывается с раковыми клетками; зараженными вирусами клетками, зараженными микроорганизмами клетками, зараженными паразитами клетками, аутоиммунными клетками, активированными клетками, миелоидными клетками, активированными Т-клетками, В-клетками или меланоцитами; клетками, экспрессирующими антигены CD33, CD19, CanAg, CALLA или Her2; либо клетками, экспрессирующими рецептор инсулино-подобного фактора роста, рецептор эпидермального фактора роста или рецептор фолата. 79. Конъюгат из майтансиноида и агента клеточного связывания по п.78, в котором агент клеточного связывания связывается с клетками, выбранными из группы, состоящей из клеток рака молочной железы, клеток рака простаты, клеток рака яичников, клеток рака толстой и прямой кишки, клеток рака желудка, клеток плоскоклеточного рака, клеток мелкоклеточного рака легких, клеток рака яичек и клеток нейробластомы. 80. Конъюгат из майтансиноида и агента клеточного связывания по п.75, в котором агент клеточного связывания является агентом, охарактеризованным в любом из пп.9, 13, 41-44, 55, 57-64 и 66. 81. Конъюгат из майтансиноида и агента клеточного связывания по п.75 или 76, в котором агент клеточного связывания представляет собой лимфокин, гормон, витамин, фактор роста, колониестимулирующий фактор или молекулу переносчика питательного вещества. 82. Конъюгат из майтансиноида и агента клеточного связывания по п.75 или 76, в котором агент клеточного связывания является агентом, охарактеризованным в любом из пп.47-52 и 56. 83. Конъюгат из майтансиноида и агента клеточного связывания по п.75, в котором агент клеточного связывания является агентом, охарактеризованным в любом из пп.10-12. 84 Конъюгат из майтансиноида и агента клеточного связывания по п.83, в котором майтансиноид представляет собой DM1, DM2 или DM3. 85. Композиция, включающая конъюгат из майтансиноида и агента клеточного связывания по лю- 27010508 бому из пп.75-84, а также носитель. 86. Способ получения конъюгата из майтансиноида и агента клеточного связывания по п.75 или 76,включающий:(a) обеспечение агента клеточного связывания,(b) модифицирование агента клеточного связывания с помощью перекрестно сшивающего реагента и(c) конъюгирование модифицированного агента клеточного связывания с майтансиноидом или тиолсодержащим майтансиноидом, обеспечивая при этом нерасщепляемый линкер между агентом клеточного связывания и майтансиноидом или тиолсодержащим майтансиноидом для образования конъюгата. 87. Способ получения конъюгата из майтансиноида и агента клеточного связывания по п.75 или 76,включающий:(а) обеспечение майтансиноида или тиолсодержащего майтансиноида,(b) модифицирование майтансиноида или тиолсодержащего майтансиноида с помощью перекрестно сшивающего реагента для образования нерасщепляемого линкера и(c) конъюгирование модифицированного майтансиноида или тиолсодержащего майтансиноида с агентом клеточного связывания, обеспечивая при этом нерасщепляемый линкер между агентом клеточного связывания и майтансиноидом или тиолсодержащим майтансиноидом для образования конъюгата. 88. Способ получения конъюгата из майтансиноида и агента клеточного связывания по п.75 или 76,включающий:(a) обеспечение майтансиноида,(b) модифицирование майтансиноида с помощью не содержащего серы перекрестно сшивающего реагента для получения сложного эфира майтансиноида, и(c) конъюгирование сложного эфира майтансиноида с агентом клеточного связывания, обеспечивая при этом нерасщепляемый линкер между агентом клеточного связывания и майтансиноидом для образования конъюгата. 89. Соединение формулы 5 где X означает линейный или разветвленный алкил, алкенил или алкинил, содержащий от 2 до 20 атомов углерода, Y означает циклоалкил или циклоалкенил, содержащий от 3 до 10 атомов углерода, Z означает замещенную или незамещенную ароматическую группу, содержащую от 6 до 10 атомов углерода, либо замещенную или незамещенную гетероциклическую группу, в которой гетероатом выбран из N,О или S, причем l, m и n поодиночке равны 0 или 1 при условии, что все вместе они не равны 0 одновременно, и Е вместе с карбонильной группой образует активный эфир, такой как Nгидроксисукцинимидиловый и сульфосукцинимидиловый эфиры, N-гидроксифталимидиловый эфир, Nгидроксисульфофталимидиловый эфир, ортонитрофениловый эфир, паранитрофениловый эфир, 2,4 динитрофениловый эфир, 3-сульфонил-4-нитрофениловый эфир, 3-карбокси-4-нитрофениловый эфир,пентафторфениловый эфир и сульфонилтетрафторфениловый эфир. 90. Соединение формулы 6 где n означает целое число от 3 до 24, а Е вместе с карбонильной группой образует активный эфир,такой как N-гидроксисукцинимидиловый и сульфосукцинимидиловый эфиры, N-гидроксифталимидиловый эфир, N-гидроксисульфофталимидиловый эфир, ортонитрофениловый эфир, паранитрофениловый эфир, 2,4-динитрофениловый эфир, 3-сульфонил-4-нитрофениловый эфир, 3-карбокси-4 нитрофениловый эфир, пентафторфениловый эфир и сульфонилтетрафторфениловый эфир. 91. Соединение формулы 7
МПК / Метки
МПК: C07D 491/12
Метки: помощью, получения, клеточного, определенные, воздействия, клеток, популяции, способы, майтансиноида, соединенных, прицельного, конюгатов, таких, конъюгаты, линкер, нерасщепляемый, агента, способ, связывания
Код ссылки
<a href="https://eas.patents.su/30-10508-sposob-pricelnogo-vozdejjstviya-na-opredelennye-populyacii-kletok-s-pomoshhyu-konyugatov-iz-majjtansinoida-i-agenta-kletochnogo-svyazyvaniya-soedinennyh-cherez-nerasshheplyaemyjj-l.html" rel="bookmark" title="База патентов Евразийского Союза">Способ прицельного воздействия на определенные популяции клеток с помощью конъюгатов из майтансиноида и агента клеточного связывания, соединенных через нерасщепляемый линкер, конъюгаты и способы получения таких конъюгатов</a>
Предыдущий патент: Композиция, содержащая частицы меламина
Следующий патент: Способ внесения удобрений
Случайный патент: Макроциклические ингибиторы сериновых протеаз гепатита с