Насыщенные 1-аминоалкилциклогексановые антагонисты nmda, 5-ht3 и нейронных никотиновых рецепторов
Номер патента: 10177
Опубликовано: 30.06.2008
Авторы: Гольд Маркус, Хенрих Маркус, Каусс Валерьянс, Парсонс Кристофер Грахам Рафаэль, Калвиньш Иварс, Йиргенсонс Айгарс, Даныш Войцех
Формула / Реферат
1. Соединение, выбранное из соединений формулы I
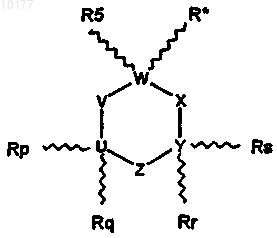
где
R* обозначает -(A)n-(CR1R2)m-NR3R4;
n+m=0, 1 или 2;
А выбран из группы, содержащей линейный или разветвленный низший алкил(C1-C6), линейный или разветвленный низший алкенил(C2-C6) и линейный или разветвленный низший алкинил(C2-С6);
R1 и R2 независимо выбраны из группы, содержащей водород, линейный или разветвленный низший алкил(C1-C6), линейный или разветвленный низший алкенил(C2-C6) и линейный или разветвленный низший алкинил(C2-C6);
R3 и R4 независимо выбраны из группы, содержащей водород, линейный или разветвленный низший алкил(C1-C6), линейный или разветвленный низший алкенил(C2-C6) и линейный или разветвленный низший алкинил(C2-C6), или вместе образуют алкилен(C2-C10) или алкенилен(С2-C10), или вместе с N образуют необязательно (C1-C6)алкил- и/или (C2-С6)алкенилзамещенный 3-7-членный азациклоалкан или азациклоалкен;
R5 независимо выбран из группы, содержащей линейный или разветвленный низший алкил(C1-C6), линейный или разветвленный низший алкенил(C2-C6) и линейный или разветвленный низший алкинил(C2-C6), или R5 объединяется с углеродом, к которому он присоединен, и соседним углеродом, образуя двойную связь;
Rp, Rq, Rr и Rs независимо выбраны из группы, содержащей водород, линейный или разветвленный низший алкил(C1-C6), линейный или разветвленный низший алкенил(C2-C6) и линейный или разветвленный низший алкинил(C2-C6), или Rp, Rq, Rr и Rs независимо могут объединяться с углеродом, к которому они присоединены, и соседним углеродом, образуя двойную связь, или Rp, Rq, Rr и Rs независимо могут образовывать двойную связь с U или Y, к которому они присоединены; при условии, что U-V-W-X-Y-Z выбран из
циклогексана,
циклогекс-2-ена,
циклогекс-3-ена,
циклогекса-1,4-диена,
циклогекса-1,5-диена,
циклогекса-2,4-диена и
циклогекса-2,5-диена,
и при условии, что по меньшей мере один из Rp и Rq не является водородом и по меньшей мере один из Rr и Rs не является водородом,
и при условии, что U-Z представляет собой циклогексан, если по меньшей мере один из -(A)n-(CR1R2)m-, R3, R4, R5, Rp, Rq, Rr и Rs представляет собой линейный или разветвленный низший алкенил(C2-C6) или линейный или разветвленный низший алкинил(C2-C6);
и его оптические изомеры и фармацевтически приемлемые аддитивные соли кислот или оснований.
2. Соединение по п.1, выбранное из группы, включающей
1-этенил-3,3,5,5-тетраметилциклогексиламин,
2-(3,3,5,5-тетраметилциклогексилиден)этанамин,
1-амино-3,3,5-триметил-2-циклогексен,
1,3,5,5-тетраметил-2-циклогексен-1-амин
1-аллил-3,3,5,5-тетраметилциклогексанамин,
1-(3,3,5,5-тетраметилциклогексилиден)-2-пропанамин,
1-(3,3-диэтил-5,5-диметилциклогексилиден)-2-пропанамин,
цис-3-винил-1,3,транс-5-триметилциклогексиламин,
2-метил-1-(3,3,5,5-тетраметил-1-циклогексен-1-ил)-2-пропанамин,
1-(1-аллил-3,3,5,5-тетраметилциклогексил)пиперидин,
2-(1-винил-3,3,5,5-тетраметилциклогексил-1)этиламин,
1-[3,3,5,5-тетраметил-1-(3-метил-2-бутенил)циклогексил]пиперидин,
1-[3,3,5,5-тетраметил-1-(2-пропинил)циклогексил]пиперидин,
2-(1,3,3,5,5-пентаметилциклогексил)-4-пентениламин,
3-(3,3,5,5-тетраметилциклогексилиден)пропанамин,
2-метил-1-(3,3,5,5-тетраметилциклогексилиден)-2-пропанамин,
2-(3,3,5,5-тетраметилциклогексилиден)пропанамин,
N-метил-1-этенил-3,3,5,5-тетраметилциклогексиламин,
N-аллил-1,3,3,5,5-пентаметилциклогексанамин
и их оптические изомеры и фармацевтически приемлемые аддитивные соли кислот или оснований.
3. Фармацевтическая композиция для лечения животного с целью ингибирования развития или облегчения выбранных недомоганий или состояний, в частности недомоганий или состояний, восприимчивых к лечению антагонистом рецепторов 5-HT3, NMDA или антагонистом нейронных никотиновых рецепторов, содержащая соединение по п.1 или 2 в комбинации с одним или более фармацевтически приемлемыми разбавителями, наполнителями и/или носителями.
4. Способ лечения животных с целью облегчения состояния, излечиваемого антагонистом NMDA, включающий стадию введения животному некоторого количества соединения, выбранного из соединений формулы I
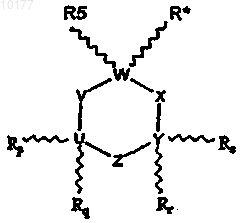
где
R* обозначает -(A)n-(CR1R2)m-NR3R4;
n+m=0, 1 или 2;
А выбран из группы, содержащей линейный или разветвленный низший алкил(C1-C6), линейный или разветвленный низший алкенил(C2-C6) и линейный или разветвленный низший алкинил(C2-C6);
R1 и R2 независимо выбраны из группы, содержащей водород, линейный или разветвленный низший алкил(C1-C6), линейный или разветвленный низший алкенил(C2-C6) и линейный или разветвленный низший алкинил(C2-C6);
R3 и R4 независимо выбраны из группы, содержащей водород, линейный или разветвленный низший алкил(C1-C6), линейный или разветвленный низший алкенил(C2-C6) и линейный или разветвленный низший алкинил(C2-C6), или вместе образуют алкилен(C2-C10) или алкенилен(C2-C10), или вместе с N образуют необязательно (C1-C6)алкил- и/или (C2-C6)алкенилзамещенный 3-7-членный азациклоалкан или азациклоалкен;
R5, Rp, Rq, Rr и Rs независимо выбраны из группы, содержащей водород, линейный или разветвленный низший алкил(C1-C6), линейный или разветвленный низший алкенил(C2-C6) и линейный или разветвленный низший алкинил(C2-C6), или R5, Rp, Rq, Rr и Rs независимо могут объединяться с углеродом, к которому они присоединены, и соседним углеродом, образуя двойную связь, или Rp, Rq, Rr и Rs независимо могут образовывать двойную связь с U или Y, к которому они присоединены;
при условии, что U-V-W-X-Y-Z выбран из
циклогексана,
циклогекс-1-ена,
циклогекс-2-ена,
циклогекс-3-ена,
циклогекса-1,3-диена,
циклогекса-1,4-диена,
циклогекса-1,5-диена,
циклогекса-2,4-диена и
циклогекса-2,5-диена,
и при условии, что U-Z представляет собой циклогексан, если по меньшей мере один из -(A)n-(CR1R2)m-, R3, R4, R5, Rp, Rq, Rr представляет собой линейный или разветвленный низший алкенил(С2-C6) или линейный или разветвленный низший алкинил(C2-C6);
его оптических изомеров и фармацевтически приемлемых аддитивных солей кислот или оснований, которые эффективны для облегчения указанного состояния.
5. Способ лечения животных с целью облегчения состояния, излечиваемого антагонистом NMDA, выбранного из группы, включающей эксцитотоксичность, выбранную из ишемии при ударе, травмы, гипоксии, гипогликемии, глаукомы и печеночной энцефалопатии,
хронические нейродегенеративные заболевания, выбранные из болезни Альцгеймера, сосудистой деменции, болезни Паркинсона, болезни Хантингтона, множественного склероза, бокового амиотрофического склероза, СПИД-нейродегенерации, оливопонтоцеребеллярной атрофии, синдрома Туретта, двигательного нейронного заболевания, митохондриальной дисфункции, синдрома Корсакова и болезни Крейтцфельдта-Якоба,
другие нарушения, относящиеся к длительным пластичным изменениям в центральной нервной системе, выбранные из хронической боли, лекарственной переносимости, зависимости и аддикции (например, опиоидной, кокаиновой, бензодиазепиновой, никотиновой и алкогольной), и
эпилепсию, позднюю дискинезию, L-DOPA-индуцированную дискинезию, шизофрению, состояние тревоги, депрессию, острую боль, спастичность и ощущение шума в ушах,
включающий стадию введения животному некоторого количества соединения, выбранного из соединений формулы I
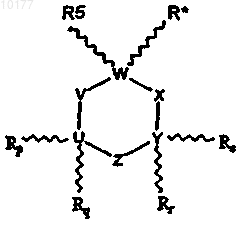
где
R* обозначает - (A)n-(CR1R2)m-NR3R4;
n+m=0, 1 или 2;
А выбран из группы, содержащей линейный или разветвленный низший алкил(C1-C6), линейный или разветвленный низший алкенил(C2-C6) и линейный или разветвленный низший алкинил(C2-C6);
R1 и R2 независимо выбраны из группы, содержащей водород, линейный или разветвленный низший алкил(C1-C6), линейный или разветвленный низший алкенил(C2-C6) и линейный или разветвленный низший алкинил(C2-C6);
R3 и R4 независимо выбраны из группы, содержащей водород, линейный или разветвленный низший алкил(C1-C6), линейный или разветвленный низший алкенил(C2-C6) и линейный или разветвленный низший алкинил (C2-C6), или вместе образуют алкилен(C2-C10) или алкенилен(C2-C10), или вместе с N образуют необязательно (C1-C6)алкил- и/или (C2-C6)алкенилзамещенный 3-7-членный азациклоалкан или азациклоалкен;
R5, Rp, Rq, Rr и Rs независимо выбраны из группы, содержащей водород, линейный или разветвленный низший алкил(C1-C6), линейный или разветвленный низший алкенил(C2-C6) и линейный или разветвленный низший алкинил(C2-C6), или R5, Rp, Rq, Rr и Rs независимо могут объединяться с углеродом, к которому они присоединены, и соседним углеродом, образуя двойную связь, или Rp, Rq, Rr и Rs независимо могут образовывать двойную связь с U или Y, к которому они присоединены;
при условии, что U-V-W-X-Y-Z выбран из
циклогексана,
циклогекс-1-ена,
циклогекс-2-ена,
циклогекс-3-ена,
циклогекса-1,3-диена,
циклогекса-1,4-диена,
циклогекса-1,5-диена,
циклогекса-2,4-диена и
циклогекса-2,5-диена,
и при условии, что U-Z представляет собой циклогексан, если по меньшей мере один из -(A)n-(CR1R2)m-,
R3, R4, R5, Rp, Rq, Rr представляет собой линейный или разветвленный низший алкенил(C2-C6) или линейный или разветвленный низший алкинил(C2-C6);
его оптических изомеров и фармацевтически приемлемых аддитивных солей кислот или оснований, которые эффективны для облегчения указанного состояния.
6. Способ лечения животных с целью облегчения состояния, излечиваемого антагонистом рецептора 5-HT3, включающий стадию введения животному некоторого количества соединения, выбранного из соединений формулы I
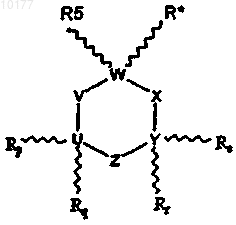
где
R* обозначает -(A)n-(CR1R2)m-NR3R4;
n+m=0, 1 или 2;
А выбран из группы, содержащей линейный или разветвленный низший алкил(C1-C6), линейный или разветвленный низший алкенил(C2-C6) и линейный или разветвленный низший алкинил(C2-C6);
R1 и R2 независимо выбраны из группы, содержащей водород, линейный или разветвленный низший алкил(C1-C6), линейный или разветвленный низший алкенил(C2-C6) и линейный или разветвленный низший алкинил(C2-C6);
R3 и R4 независимо выбраны из группы, содержащей водород, линейный или разветвленный низший алкил(C1-C6), линейный или разветвленный низший алкенил(C2-C6) и линейный или разветвленный низший алкинил(C2-C6), или вместе образуют алкилен(С2-C10) или алкенилен(С2-C10), или вместе с N образуют необязательно (C1-C6)алкил- и/или (С2-C6)алкенилзамещенный 3-7-членный азациклоалкан или азациклоалкен;
R5, Rp, Rq, Rr и Rs независимо выбраны из группы, содержащей водород, линейный или разветвленный низший алкил(С1-C6), линейный или разветвленный низший алкенил(С2-C6) и линейный или разветвленный низший алкинил(С2-C6), или R5, Rp, Rq, Rr и Rs независимо могут объединяться с углеродом, к которому они присоединены, и соседним углеродом, образуя двойную связь, или Rp, Rq, Rr и Rs независимо могут образовывать двойную связь с U или Y, к которому они присоединены;
при условии, что U-V-W-X-Y-Z выбран из
циклогексана,
циклогекс-1-ена,
циклогекс-2-ена,
циклогекс-3-ена,
циклогекса-1,3-диена,
циклогекса-1,4-диена,
циклогекса-1,5-диена,
циклогекса-2,4-диена и
циклогекса-2,5-диена, и при условии, что U-Z представляет собой циклогексан, если по меньшей мере один из -(A)n-(CR1R2)m-, R3, R4, R5, Rp, Rq, Rr представляет собой линейный или разветвленный низший алкенил(С2-C6) или линейный или разветвленный низший алкинил(С2-C6);
его оптических изомеров и фармацевтически приемлемых аддитивных солей кислот или оснований, которые эффективны для облегчения указанного состояния.
7. Способ лечения животных с целью облегчения состояния, излечиваемого антагонистом нейронных никотиновых рецепторов, включающий стадию введения животному некоторого количества соединения, выбранного из соединений формулы I
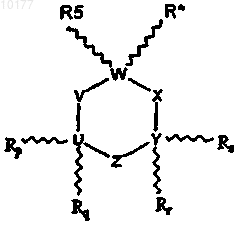
где
R* обозначает -(А)n-(CR1R2)m-NR3R4;
n+m=0, 1 или 2;
А выбран из группы, содержащей линейный или разветвленный низший алкил(C1-C6), линейный или разветвленный низший алкенил(С2-С6) и линейный или разветвленный низший алкинил (C2-C6);
R1 и R2 независимо выбраны из группы, содержащей водород, линейный или разветвленный низший алкил(C1-C6), линейный или разветвленный низший алкенил(С2-С6) и линейный или разветвленный низшшщ алкинил(C2-C6);
R3 и R4 независимо выбраны из группы, содержащей водород, линейный или разветвленный низший алкил(C1-C6), линейный или разветвленный низший алкенил(C2-C6) и линейный или разветвленный низший алкинил(C2-C6), или вместе образуют алкилен(C2-C10) или алкенилен(C2-C10), или вместе с N образуют необязательно (C1-C6)алкил- и/или (C2-C6)алкенилзамещенный 3-7-членный азациклоалкан или азациклоалкен;
R5, Rp, Rq, Rr и Rs независимо выбраны из группы, содержащей водород, линейный или разветвленный низший алкил(C1-C6), линейный или разветвленный низший алкенил(C2-C6) и линейный или разветвленный низший алкинил(C2-C6), или R5, Rp, Rq, Rr и Rs независимо могут объединяться с углеродом, к которому они присоединены, и соседним углеродом, образуя двойную связь, или Rp, Rq, Rr и Rs независимо могут образовывать двойную связь с U или Y, к которому они присоединены;
при условии, что U-V-W-X-Y-Z выбран из
циклогексана,
циклогекс-1-ена,
циклогекс-2-ена,
циклогекс-3-ена,
циклогекса-1,3-диена,
циклогекса-1,4-диена,
циклогекса-1,5-диена,
циклогекса-2,4-диена и
циклогекса-2,5-диена,
и при условии, что U-Z представляет собой циклогексан, если по меньшей мере один из -(А)n-(CR1R2)m-, R3, R4, R5, Rp, Rq, Rr представляет собой линейный или разветвленный низший алкенил(С2-С6) или линейный или разветвленный низший алкинил(C2-C6);
его оптических изомеров и фармацевтически приемлемых аддитивных солей кислот или оснований, которые эффективны для облегчения указанного состояния.
8. Способ лечения животных с целью облегчения состояния, излечиваемого антагонистом 5-НТ3, выбранного из группы, включающей нарушения, связанные с состоянием тревоги, депрессивные нарушения, шизофрению, и лечения связанных с этим психозов, нарушений, связанных со злоупотреблением лекарствами и алкоголем, когнитивных нарушений, болезни Альцгеймера, болезни Паркинсона, мозжечкового тремора, мигрени, нарушений аппетита, слизистого колита (IBS) и рвоты, включающий стадию введения животному некоторого количества соединения, выбранного из соединений формулы I

где
R* обозначает -(A)n-(CR1R2)m-NR3R4;
n+m=0, 1 или 2;
А выбран из группы, содержащей линейный или разветвленный низший алкил(C1-C6), линейный или разветвленный низший алкенил(С2-С6) и линейный или разветвленный низший алкинил(C2-C6);
R1 и R2 независимо выбраны из группы, содержащей водород, линейный или разветвленный низший алкил(C1-C6), линейный или разветвленный низший алкенил(C2-C6) и линейный или разветвленный низший алкинил(C2-C6);
R3 и R4 независимо выбраны из группы, содержащей водород, линейный или разветвленный низший алкил(C1-C6), линейный или разветвленный низший алкенил(C2-C6) и линейный или разветвленный низший алкинил(С2-C6), или вместе образуют алкилен(С2-C10) или алкенилен(С2-C10), или вместе с N образуют необязательно (C1-C6)алкил- и/или (С2-С6)алкенилзамещенный 3-7-членный азациклоалкан или азациклоалкен;
R5, Rp, Rq, Rr и Rs независимо выбраны из группы, содержащей водород, линейный или разветвленный низший алкил(C1-C6), линейный или разветвленный низший алкенил(С2-C6) и линейный или разветвленный низший алкинил(C2-C6), или R5, Rp, Rq, Rr и Rs независимо могут объединяться с углеродом, к которому они присоединены, и соседним углеродом, образуя двойную связь, или Rp, Rq, Rr и Rs независимо могут образовывать двойную связь с U или Y, к которому они присоединены; при условии, что U-V-W-X-Y-Z выбран из
циклогексана,
циклогекс-1-ена,
циклогекс-2-ена,
циклогекс-3-ена,
циклогекса-1,3-диена,
циклогекса-1,4-диена,
циклогекса-1,5-диена,
циклогекса-2,4-диена и
циклогекса-2,5-диена,
и при условии, что U-Z представляет собой циклогексан, если по меньшей мере один из -(A)n-(CR1R2)m-, R3, R4, R5, Rp, Rq, Rr представляет собой линейный или разветвленный низший алкенил(C2-C6) или линейный или разветвленный низший алкинил(C2-C6);
его оптических изомеров и фармацевтически приемлемых аддитивных солей кислот или оснований, которые эффективны для облегчения указанного состояния.
9. Способ лечения животных с целью облегчения состояния, излечиваемого антагонистом нейронных никотиновых рецепторов, выбранного из группы, включающей синдром Туретта, нарушения, связанные с состоянием тревоги, шизофрению, злоупотребление лекарствами, злоупотребление никотином, злоупотребление кокаином, дискинезию (Morbus Huntington, L-DOPA-индуцированную), нарушения, связянные с гиперактивностью при дефиците внимания (ADHD), болезнь Альцгеймера, болезнь Паркинсона и боль, включающий стадию введения животному некоторого количества соединения, выбранного из соединений формулы I

где
R* обозначает -(A)n-(CR1R2)m-N3R4;
n+m=0, 1 или 2;
А выбран из группы, содержащей линейный или разветвленный низший алкил(C1-C6), линейный или разветвленный низший алкенил(С2-C6) и линейный или разветвленный низший алкинил(C2-C6);
R1 и R2 независимо выбраны из группы, содержащей водород, линейный или разветвленный низший алкил(C1-C6), линейный или разветвленный низший алкенил(С2-С6) и линейный или разветвленный низший алкинил(C2-C6);
R3 и R4 независимо выбраны из группы, содержащей водород, линейный или разветвленный низший алкил(C1-C6), линейный или разветвленный низший алкенил(C2-C6) и линейный или разветвленный низший алкинил(С2-С6), или вместе образуют алкилен(С2-C10) или алкенилен(C2-C10), или вместе с N образуют необязательно(C1-C6)алкил- и/или (C2-С6)алкенилзамещенный 3-7-членный азациклоалкан или азациклоалкен;
R5, Rp, Rq, Rr и Rs независимо выбраны из группы, содержащей водород, линейный или разветвленный низший алкил(C1-C6), линейный или разветвленный низший алкенил(С2-C6) и линейный или разветвленный низший алкинил(C2-C6), или R5, Rp, Rq, Rr и Rs независимо могут объединяться с углеродом, к которому они присоединены, и соседним углеродом, образуя двойную связь, или Rp, Rq, Rr и Rs независимо могут образовыврть двойную связь с U или Y, к которому они присоединены;
при условии, что U-V-W-X-Y-Z выбран из
циклогексана,
циклогекс-1-ена,
циклогекс-2-ена,
циклогекс-3-ена,
циклогекса-1,3-диена,
циклогекса-1,4-диена,
циклогекса-1,5-диена,
циклогекса-2,4-диена и
циклогекса-2,5-диена,
и при условии, что U-Z представляет собой циклогексан, если по меньшей мере один из -(A)n-(CR1R2)m-, R3, R4, R5, Rp, Rq, Rr представляет собой линейный или разветвленный низший алкенил(C2-C6) или линейный или разветвленный низший алкинил(C2-C6);
его оптических изомеров и фармацевтически приемлемых аддитивных солей кислот или оснований, которые эффективны для облегчения указанного состояния.
10. Применение соединения формулы I по любому из пп.1-2 и его оптических изомеров и фармацевтически приемлемых аддитивных солей кислот или оснований в производстве лекарственного средства для использования в способе по любому из пп.5-9.
Текст
010177 Предпосылки изобретения 1. Область изобретения. Ненасыщенные 1-аминоалкилциклогексановые соединения, которые являются системно активными в качестве антагонистов NMDA, 5-HT3 и никотиновых рецепторов, включающие их фармацевтические композиции, способ их получения и способ лечения с их помощью нарушений ЦНС, которые включают расстройства глутаматергической, серотонинергической и никотиновой передачи, для лечения иммуномодуляторных нарушений и для лечения инфекционных заболеваний. 2. Известный уровень техники. Антагонисты NMDA Антагонизм глутаматных рецепторов типа N-метил-D-аспартата (NMDA) потенциально имеет широкий диапазон терапевтических применений [19]. Функционального ингибирования NMDA-рецепторов можно достичь путем воздействия по различным сайтам рестрикции, таким как первичный медиаторный сайт, стрихниннечувствительный глициновый сайт (глицинв), полиаминный сайт и фенциклидиновый сайт, расположенный внутри катионного канала. Блокаторы каналов NMDA-рецепторов действуют неконкурентным "зависящим от применения" образом; это подразумевает, что они обычно только блокируют канал в открытом состоянии. Как интерпретируют многие, эта зависимость от применения означает, что более сильная активация рецептора должна приводить к большей степени антагонизма. Кроме того, полагают, что такой способ действия подразумевает, что данный класс антагониста может быть особо полезен, когда ожидается чрезмерная активация NMDA-рецепторов, как при эпилепсии, ишемии и травме. Однако предварительная клиническая практика с применением селективного, имеющего высокое сродство, сильно зависящего от применения неконкурентного агониста NMDA-рецепторов (+)-5-метил 10,11-дигидро-5 Н-дибензоциклогептен-5,10-иминмалеата +)-МК-801) является неутешительной. А именно, терапевтическая эффективность при эпилепсии низкая, тогда как при терапевтических дозах обнаруживают некоторые психотропные побочные эффекты. Данные наблюдения вместе с тем фактом,что злоупотребляющие фенциклидином испытывают аналогичные психотропные симптомы, приводят к выводу, что неконкурентный антагонизм NMDA-рецепторов не может быть многообещающим терапевтическим подходом. Однако применение более сложных электрофизиологических методов показывает, что не существует равенства между различными неконкурентными антагонистами, так как такие факторы, как скорость блокады рецептора (кинетики включения-выключения) и зависимость от напряжения данного эффекта,могут определять фармакодинамические отличительные признаки in vivo, наряду, например, с терапевтической безопасностью. Парадоксально, что подходящими могут быть скорее агенты со сродством от низкого до умеренного, чем агенты с высоким сродством. Такие открытия инициировали пересмотр концепции неконкурентного антагонизма NMDA-рецепторов при разработке лекарственных средств [19, 22]. Неконкурентные антагонисты NMDA-рецепторов, такие как амантадин и мемантин, которые удовлетворяют указанным выше критериям, применяются клинически в течение нескольких лет при лечении болезни Паркинсона и слабоумия, соответственно, и на самом деле редко дают побочные эффекты при терапевтических дозах,используемых при их соответствующих показаниях. С точки зрения упомянутого выше обоснования заявители разработали серии новых неконкурентных антагонистов NMDA-рецепторов на основе ненасыщенной 1-аминоалкилциклогексановой структуры. Настоящее исследование разработано для сравнения антагонистических свойств NMDA-рецепторов данных ненасыщенных 1-аминоалкилциклогексановых производных в исследованиях по связыванию рецепторов, электрофизиологических экспериментах, на одной конвульсионной модели и двух моделях двигательной недостаточности. Замещения для данных ненасыщенных 1-аминоалкилциклогексанов подробно указаны в табл. 6. Антагонисты рецепторов 5-HT3 Рецепторы 5-НТ 3 представляют собой закрытые лигандами ионотропные рецепторы, проницаемые для катионов. Рецепторы 5-НТ 3 человека имеют наивысшую плотность на энтерохромафинных клетках в желудочно-кишечной слизистой оболочке, которые раздражаются вагусными афферентами, и areapostrema ствола головного мозга, которая образует хеморецепторную триггерную зону. Так как рецепторы 5-HT3 имеют высокую плотность не только в area postrema, но также в области гиппокампа и миндалевидного тела лимбической системы, предполагают, что 5-HT3-селективные антагонисты могут оказывать психотропные действия (GreenshawSilverstone, 1997). Действительно, ранние исследования на животных предполагают, что антагонисты рецепторов 5HT3, кроме их широко признанного противорвотного применения, могут быть клинически полезны в ряде областей. Данные области включают болезненное состояние тревоги, шизофрению, злоупотребления лекарствами и алкоголем, депрессивные нарушения, когнитивные нарушения, болезнь Альцгеймера,мозжечковый тремор, психоз, связанный с лечением болезни Паркинсона, боль (мигрень и слизистый колит) и нарушения аппетита. Антагонисты нейронных никотиновых рецепторов В настоящее время известно десять альфа-подъединиц (альфа 1-10) и четыре бета-подъединицы(бета 1-4) для никотиновых рецепторов. Рецепторы 42, вероятно, являются наиболее общими в ЦНС, в особенности в гиппокампе и полосатом теле. Они образуют неселективные катионные каналы с медленно не полностью десенсибилизирующими токами (тип II). Гомомерные рецепторы 7 являются пред- и постсинаптическими и обнаружены в гиппокампе, двигательной области головного мозга и лимбической системе, а также в периферической автономной нервной системе. Данные рецепторы характеризуются своей высокой Са 2+-проницаемостью и быстрыми сильно десенсибилизирующими реакциями (тип 1 А). Изменения в никотиновых рецепторах причастны к ряду заболеваний. Данные заболевания включают болезнь Альцгеймера, болезнь Паркинсона, синдром Туретта,шизофрению, злоупотребление лекарствами, злоупотребление никотином и боль. На основании наблюдения, что никотиновый агонист никотин, по-видимому, сам по себе оказывает полезные действия, разработка лекарственного средства до сих пор подразумевала открытие селективных никотиновых агонистов. С другой стороны, неясно, обусловлены ли эффекты никотиновых агонистов, например при синдроме Туретта и шизофрении, активацией или дезактивацией/десенсибилизацией нейронных никотиновых рецепторов. Эффекты агонистов на нейронные никотиновые рецепторы сильно зависят от периода воздействия. Быстрая обратимая десенсибилизация происходит за миллисекунды, уменьшение происходит за секунды, необратимая дезактивация рецепторов, содержащих 42 и 7, происходит за часы, и их позитивная регуляция происходит за дни. Другими словами: эффекты никотиновых "агонистов" в действительности могут быть обусловлены частичным агонизмом, дезактивацией и/или десенсибилизацией нейронных никотиновых рецепторов. В свою очередь умеренные концентрации блокаторов каналов нейронных никотиновых рецепторов могут производить такие же эффекты, как эффекты, сообщаемые для никотиновых агонистов в упомянутых выше показаниях. Настоящее изобретение В настоящее время обнаружено, что ряд ненасыщенных 1-аминоалкилциклогексанов обладает резко выраженной и неожиданной антагонистической активностью относительно NMDA, 5-НТ 3 и никотиновых рецепторов. Благодаря указанному выше свойству данные вещества подходят для лечения широкого диапазона нарушений ЦНС, которые включают расстройства глутаматергической, серотонинергической и никотиновой передачи, обладают иммуномодуляторным эффектом и свойствами против инфекционных заболеваний. Данные соединения предпочтительно находятся в виде фармацевтических композиций, в которых они присутствуют вместе с одним или большим количеством фармацевтически приемлемых разбавителей, носителей или наполнителей. Цели изобретения Целью настоящего изобретения являются новые фармацевтические соединения, которые представляют собой ненасыщенные 1-аминоалкилциклогексановые антагонисты NMDA, 5-НТ 3 и никотиновых рецепторов, и их фармацевтические композиции. Кроме того, предметом данного изобретения является новый способ лечения, прекращения, облегчения, ослабления или уменьшения интенсивности нежелательных нарушений ЦНС, которые включают расстройства глутаматергической, серотонинергической,никотиновой передачи, лечение иммуномодуляторных нарушений и лечения инфекционных заболеваний посредством применения соединения данного изобретения или содержащей его фармацевтической композиции. Дополнительным предметом данного изобретения является способ получения ненасыщенных 1-аминоалкилциклогексановых активных элементов. Дополнительные цели изобретения будут ясны далее, и еще другие цели будут ясны специалисту в данной области. Краткое описание изобретения Таким образом, как полагают авторы, содержание данного изобретения можно суммировать среди прочего следующими словами: соединение, выбранное из соединений формулы In+m=0, 1 или 2; А выбран из группы, содержащей линейный или разветвленный низший алкил(C1-C6), линейный или разветвленный низший алкенил(C2-C6) и линейный или разветвленный низший алкинил(C2-C6);R1 и R2 независимо выбраны из группы, содержащей водород, линейный или разветвленный низший алкил(C1-C6), линейный или разветвленный низший алкенил(С 2-С 6) и линейный или разветвленный низший алкинил(С 2-C6);R3 и R4 независимо выбраны из группы, содержащей водород, линейный или разветвленный низший алкил(C1-C6), линейный или разветвленный низший алкенил(C2-C6) и линейный или разветвленный низший алкинил(C2-C6), или вместе образуют алкилен(C2-C10) или алкенилен(С 2-C10), или вместе с N образуют необязательно(C1-C6) алкил- и/или (С 2-C6)алкенилзамещенный 3-7-членный азациклоалкан или азациклоалкен;R5 независимо выбран из группы, содержащей линейный или разветвленный низший алкил(C1-C6),линейный или разветвленный низший алкенил(С 2-C6) и линейный или разветвленный низший алкинилRp, Rq, Rr и Rs независимо выбраны из группы, содержащей водород, линейный или разветвленный низший алкил(C1-C6), линейный или разветвленный низший алкенил(C2-C6) и линейный или разветвленный низший алкинил(С 2-C6), или Rp, Rq, Rr и Rs независимо могут объединяться с углеродом, к которому они присоединены, и соседним углеродом, образуя двойную связь, или Rp, Rq, Rr и Rs независимо могут образовывать двойную связь с U или Y, к которому они присоединены; при условии, что U-V-W-X-Y-Z выбран из циклогексана,циклогекс-2-ена,циклогекс-3-ена,циклогекса-1,4-диена,циклогекса-1,5-диена,циклогекса-2,4-диена и циклогекса-2,5-диена,и при условии, что по меньшей мере один из Rp и Rq не является водородом и по меньшей мере один из Rr и Rs не является водородом,и при условии, что U-Z представляет собой циклогексан, если по меньшей мере один из -(A)n(CR1R2)m-, R3, R4, R5, Rp, Rq, Rr и Rs представляет собой линейный или разветвленный низший алкенил(С 2-C6) или линейный или разветвленный низший алкинил (С 2-С 6); и его оптические изомеры и фармацевтически приемлемые аддитивные соли кислот или оснований; способ лечения животных с целью облегчения состояния, излечиваемого антагонистом NMDA,включающий стадию введения животному некоторого количества соединения, выбранного из соединений формулы In+m=0, 1 или 2; А выбран из группы, содержащей линейный или разветвленный низший алкил(C1-C6), линейный или разветвленный низший алкенил(C2-C6) и линейный или разветвленный низший алкинил (C2-C6);R1 и R2 независимо выбраны из группы, содержащей водород, линейный или разветвленный низший алкил(C1-C6), линейный или разветвленный низший алкенил(C2-C6) и линейный или разветвленный низший алкинил(C2-C6);R3 и R4 независимо выбраны из группы, содержащей водород, линейный или разветвленный низший алкил(C1-C6), линейный или разветвленный низший алкенил(С 2-С 6) и линейный или разветвленный низший алкинил(С 2-C6), или вместе образуют алкилен(C2-C10) или алкенилен(С 2-C10), или вместе с N образуют необязательно (C1-C6)алкил- и/или (С 2-C6)алкенилзамещенный 3-7-членный азациклоалкан или азациклоалкен;R5, Rp, Rq, Rr и Rs независимо выбраны из группы, содержащей водород, линейный или разветвленный низший алкил(C1-C6), линейный или разветвленный низший алкенил(C2-C6) и линейный или разветвленный низший алкинил (С 2-С 6), или R5, Rp, Rq, Rr и Rs независимо могут объединяться с углеродом,к которому они присоединены, и соседним углеродом, образуя двойную связь, или Rp, Rq, Rr и Rs независимо могут образовывать двойную связь с U или Y, к которому они присоединены; при условии, что U-V-W-X-Y-Z выбран из циклогексана,циклогекс-1-ена,циклогекс-2-ена,циклогекс-3-ена,циклогекса-1,3-диена,циклогекса-1,4-диена,-3 010177 циклогекса-1,5-диена,циклогекса-2,4-диена и циклогекса-2,5-диена,и при условии, что U-Z представляет собой циклогексан, если по меньшей мере один из -(A)n(CR1R2)m-, R3, R4, R5, Rp Rq, Rr представляет собой линейный или разветвленный низший алкенил(С 2-C6) или линейный или разветвленный низший алкинил(C2-C6); его оптических изомеров и фармацевтически приемлемых аддитивных солей кислот или оснований,которые эффективны для облегчения указанного состояния; способ лечения животных с целью облегчения состояния, где соединение выбрано вследствие его иммуномодуляторной, антималярийной эффективности, эффективности против вируса Borna или против вируса гепатита С, антитрипаносомальной эффективности и против вируса герпеса, включающий стадию введения животному некоторого количества соединения, выбранного из соединений формулы In+m=0, 1 или 2; А выбран из группы, содержащей линейный или разветвленный низший алкил(C1-C6), линейный или разветвленный низший алкенил (С 2-C6) и линейный или разветвленный низший алкинил (С 2-C6);R1 и R2 независимо выбраны из группы, содержащей водород, линейный или разветвленный низший алкил(C1-C6), линейный или разветвленный низший алкенил(С 2-C6) и линейный или разветвленный низший алкинил(С 2-C6);R3 и R4 независимо выбраны из группы, содержащей водород, линейный или разветвленный низший алкил(C1-C6), линейный или разветвленный низший алкенил(С 2-C6) и линейный или разветвленный низший алкинил(C2-C6), или вместе образуют алкилен(C2-C10) или алкенилен (C2-C10), или вместе с N образуют необязательно (C1-C6)алкил- и/или (С 2-C6)алкенилзамещенный 3-7-членный азациклоалкан или азациклоалкен;R5, Rp, Rq, Rr и Rs независимо выбраны из группы, содержащей водород, линейный или разветвленный низший алкил(C1-C6), линейный или разветвленный низший алкенил(С 2-C6) и линейный или разветвленный низший алкинил(С 2-C6), или R5, Rp, Rq, Rr и Rs независимо могут объединяться с углеродом,к которому они присоединены, и соседним углеродом, образуя двойную связь, или Rp, Rq, Rr и Rs независимо могут образовывать двойную связь с U или Y, к которому они присоединены; при условии, что U-V-W-X-Y-Z выбран из циклогексана,циклогекс-1-ена,циклогекс-2-ена,циклогекс-3-ена,циклогекса-1,3-диена,циклогекса-1,4-диена,циклогекса-1,5-диена,циклогекса-2,4-диена и циклогекса-2,5-диена,и при условии, что U-Z представляет собой циклогексан, если по меньшей мере один из -(A)n(CR1R2)m-, R3, R4, R5, Rp, Rq, Rr представляют собой линейный или разветвленный низший алкенил(C2-C6) или линейный или разветвленный низший алкинил (C2-C6); его оптических изомеров и фармацевтически приемлемых аддитивных солей кислот или оснований,которые эффективны для облегчения указанного состояния; способ лечения животных с целью облегчения состояния, излечиваемого антагонистом NMDA, выбранного из группы, включающей эксцитотоксичность, выбранную из ишемии при ударе, травме, гипоксии, гипогликемии, глаукомы и печеночной энцефалопатии,хронические нейродегенеративные заболевания, выбранные из болезни Альцгеймера, сосудистой деменции, болезни Паркинсона, болезни Хантингтона, множественного склероза, бокового амиотрофического склероза, СПИД-нейродегенерации, оливопонтоцеребеллярной атрофии, синдрома Туретта, двигательного нейронного заболевания, митохондриальной дисфункции, синдрома Корсакова и болезни Крейтцфельдта-Якоба, другие нарушения, относящиеся к длительным пластичным изменениям в центральной нервной системе, выбранные из хронической боли, лекарственной переносимости, зависимости и аддикции (например, опиоидной, кокаиновой, бензодиазепиновой, никотиновой и алкогольной) и эпилепсию, позднюю дискинезию, L-DOPA-индуцированную дискинезию, шизофрению, состояние-4 010177 тревоги, депрессию, острую боль, спастичность и ощущение шума в ушах,включающий стадию введения животному некоторого количества соединения, выбранного из соединений формулы In+m=0, 1 или 2; А выбран из группы, содержащей линейный или разветвленный низший алкил(C1-C6), линейный или разветвленный низший алкенил(C2-С 6) и линейный или разветвленный низший алкинил(С 2-С 6);R1 и R2 независимо выбраны из группы, содержащей водород, линейный или разветвленный низший алкил(C1-C6), линейный или разветвленный низший алкенил(C2-C6) и линейный или разветвленный низший алкинил(C2-С 6);R3 и R4 независимо выбраны из группы, содержащей водород, линейный или разветвленный низший алкил(C1-C6), линейный или разветвленный низший алкенил(C2-C6) и линейный или разветвленный низший алкинил(C2-C6), или вместе образуют алкилен(С 2-C10) или алкенилен(С 2-C10), или вместе с N образуют необязательно (C1-C6)алкил- и/или (С 2-С 6)алкенилзамещенный 3-7-членный азациклоалкан или азациклоалкен;R5, Rp, Rq, Rr и Rs независимо выбраны из группы, содержащей водород, линейный или разветвленный низший алкил(C1-C6), линейный или разветвленный низший алкенил(С 2-С 6) и линейный или разветвленный низший алкини(C2-C6), или R5, Rp, Rq, Rr и Rs независимо могут объединяться с углеродом, к которому они присоединены, и соседним углеродом, образуя двойную связь, или Rp, Rq, Rr и Rs независимо могут образовывать двойную связь с U или Y, к которому они присоединены; при условии, что UV-W-X-Y-Z выбран из циклогексана,циклогекс-1-ена,циклогекс-2-ена,циклогекс-3-ена,циклогекса-1,3-диена,циклогекса-1,4-диена,циклогекса-1,5-диена,циклогекса-2,4-диена и циклогекса-2,5-диена,и при условии, что U-Z представляет собой циклогексан, если по меньшей мере один из -(A)n(CR1R2)m-, R3, R4, R5, Rp, Rq, Rr представляет собой линейный или разветвленный низший алкенил(C2-C6) или линейный или разветвленный низший алкинил(C2-C6); его оптических изомеров и фармацевтически приемлемых аддитивных солей кислот или оснований,которые эффективны для облегчения указанного состояния; способ лечения животных с целью облегчения состояния, излечиваемого антагонистом рецептора 5HT3, включающий стадию введения животному некоторого количества соединения, выбранного из соединений формулы In+m=0, 1 или 2; А выбран из группы, содержащей линейный или разветвленный низший алкил(C1-C6), линейный или разветвленный низший алкенил(С 2-С 6) и линейный или разветвленный низший алкинил(С 2-С 6);R1 и R2 независимо выбраны из группы, содержащей водород, линейный или разветвленный низший алкил(C1-C6), линейный или разветвленный низший алкенил(C2-C6) и линейный или разветвленный низший алкинил(С 2-C6);R3 и R4 независимо выбраны из группы, содержащей водород, линейный или разветвленный низший алкил(C1-C6), линейный или разветвленный низший алкенил(C2-C6) и линейный или разветвленный-5 010177 низший алкинил(C2-C6), или вместе образуют алкилен(C2-C10) или алкенилен(С 2-C10), или вместе с N образуют необязательно(C1-C6)алкил- и/или (С 2-C6)алкенилзамещенный 3-7-членный азациклоалкан или азациклоалкен;R5, Rp, Rq, Rr и Rs независимо выбраны из группы, содержащей водород, линейный или разветвленный низший алкил(C1-C6), линейный или разветвленный низший алкенил(С 2-С 6) и линейный или разветвленный низший алкинил(С 2-С 6), или R5, Rp, Rq, Rr и Rs независимо могут объединяться с углеродом,к которому они присоединены, и соседним углеродом, образуя двойную связь, или Rp, Rq, Rr и Rs независимо могут образовывать двойную связь с U или Y, к которому они присоединены; при условии, что U-V-W-X-Y-Z выбран из циклогексана,циклогекс-1-ена,циклогекс-2-ена,циклогекс-3-ена,циклогекса-1,3-диена,циклогекса-1,4-диена,циклогекса-1,5-диена,циклогекса-2,4-диена и циклогекса-2,5-диена, и при условии, что U-Z представляет собой циклогексан, если по меньшей мере один из -(A)n-(CR1R2)m-, R3, R4, R5, Rp, Rq, Rr представляет собой линейный или разветвленный низший алкенил(С 2-C6) или линейный или разветвленный низший алкинил(С 2-C6); его оптических изомеров и фармацевтически приемлемых аддитивных солей кислот или оснований,которые эффективны для облегчения указанного состояния; способ лечения животных с целью облегчения состояния, излечиваемого антагонистом нейронных никотиновых рецепторов, включающий стадию введения животному некоторого количества соединения,выбранного из соединений формулы In+m=0, 1 или 2; А выбран из группы, содержащей линейный или разветвленный низший алкил(C1-C6), линейный или разветвленный низший алкенил(С 2-C6) и линейный или разветвленный низший алкинил(С 2-C6);R1 и R2 независимо выбраны из группы, содержащей водород, линейный или разветвленный низший алкил(C1-C6), линейный или разветвленный низший алкенил(С 2-С 6) и линейный или разветвленный низший алкинил(С 2-C6);R3 и R4 независимо выбраны из группы, содержащей водород, линейный или разветвленный низший алкил(C1-C6), линейный или разветвленный низший алкени(С 2-С 6) и линейный или разветвленный низший алкинил(C2-C6), или вместе образуют алкилен(С 2-C10) или алкенилен(С 2-C10), или вместе с N образуют необязательно (C1-C6)алкил- и/или (С 2-C6)алкенилзамещенный 3-7-членный азациклоалкан или азациклоалкен;R5, Rp, Rq, Rr и Rs независимо выбраны из группы, содержащей водород, линейный или разветвленный низший алкил(C1-C6), линейный или разветвленный низший алкенил(C2-C6) и линейный или разветвленный низший алкинил(C2-C6), или R5, Rp, Rq, Rr и Rs независимо могут объединяться с углеродом,к которому они присоединены, и соседним углеродом, образуя двойную связь, или Rp, Rq, Rr и Rs независимо могут образовывать двойную связь с U или Y, к которому они присоединены; при условии, что U-V-W-X-Y-Z выбран из циклогексана,циклогекс-1-ена,циклогекс-2-ена,циклогекс-3-ена,циклогекса-1,3-диена,циклогекса-1,4-диена,циклогекса-1,5-диена,циклогекса-2,4-диена и циклогекса-2,5-диена,и при условии, что U-Z представляет собой циклогексан, если по меньшей мере один из -(A)n(CR1R2)m-, R3, R4, R5, Rp, Rq, Rr представляет собой линейный или разветвленный низший алкенил(С 2-C6) или линейный или разветвленный низший алкинил (С 2-C6);-6 010177 его оптических изомеров и фармацевтически приемлемых аддитивных солей кислот или оснований,которые эффективны для облегчения указанного состояния; способ лечения животных с целью облегчения состояния, излечиваемого антагонистом 5-HT3, выбранного из группы, включающей нарушения, связанные с состоянием тревоги, депрессивные нарушения, шизофрению, и лечения связанных с этим психозов, нарушений, связанных со злоупотреблением лекарствами и алкоголем, когнитивных нарушений, болезни Альцгеймера, болезни Паркинсона, мозжечкового тремора, мигрени, нарушений аппетита, слизистого колита (IBS) и рвоты, включающий стадию введения животному некоторого количества соединения, выбранного из соединений формулы I:n+m=0, 1 или 2; А выбран из группы, содержащей линейный или разветвленный низший алкил(C1-C6), линейный или разветвленный низший алкенил(С 2-C6) и линейный или разветвленный низший алкинил(C2-C6);R1 и R2 независимо выбраны из группы, содержащей водород, линейный или разветвленный низший алкил(C1-C6), линейный или разветвленный низший алкенил(C2-С 6) и линейный или разветвленный низший алкинил(C2-C6);R3 и R4 независимо выбраны из группы, содержащей водород, линейный или разветвленный низший алкил(C1-C6), линейный или разветвленный низший алкенил(C2-C6) и линейный или разветвленный низший алкинил(С 2-C6), или вместе образуют алкилен(C2-C10) или алкенилен(C2-C10), или вместе с N образуют необязательно (C1-C6)алкил- и/или (C2-C6)алкенилзамещенный 3-7-членный азациклоалкан или азациклоалкен;R5, Rp, Rq, Rr и Rs независимо выбраны из группы, содержащей водород, линейный или разветвленный низший алкил(C1-C6), линейный или разветвленный низший алкенил(C2-C6) и линейный или разветвленный низший алкинил(C2-С 6), или R5, Rp, Rq, Rr и Rs независимо могут объединяться с углеродом,к которому они присоединены, и соседним углеродом, образуя двойную связь, или Rp, Rq, Rr и Rs независимо могут образовывать двойную связь с U или Y, к которому они присоединены; при условии, что U-V-W-X-Y-Z выбран из циклогексана,циклогекс-1-ена,циклогекс-2-ена,циклогекс-3-ена,циклогекса-1,3-диена,циклогекса-1,4-диена,циклогекса-1,5-диена,циклогекса-2,4-диена и циклогекса-2,5-диена,и при условии, что U-Z представляет собой циклогексан, если по меньшей мере один из -(A)n(CR1R2)m-, R3, R4, R5, Rp, Rq, Rr представляет собой линейный или разветвленный низший алкенил(C2-C6) или линейный или разветвленный низший алкинил(C2-C6); его оптических изомеров и фармацевтически приемлемых аддитивных солей кислот или оснований,которые эффективны для облегчения указанного состояния; способ лечения животных с целью облегчения состояния, излечиваемого антагонистом нейронных никотиновых рецепторов, выбранного из группы, включающей синдром Туретта, нарушения, связанные с состоянием тревоги, шизофрению, злоупотребление лекарствами, злоупотребление никотином, злоупотребление кокаином, дискинезию (Morbus Huntington, L-DOPA-индуцированную), нарушения, связянные с гиперактивностью при дефиците внимания (ADHD), болезнь Альцгеймера, болезнь Паркинсона и боль, включающий стадию введения животному некоторого количества соединения, выбранного из соединений формулы I:n+m=0, 1 или 2; А выбран из группы, содержащей линейный или разветвленный низший алкил(C1-C6), линейный или разветвленный низший алкенил(С 2-С 6) и линейный или разветвленный низший алкинил(С 2-С 6);R1 и R2 независимо выбраны из группы, содержащей водород, линейный или разветвленный низший алкил(C1-C6), линейный или разветвленный низший алкенил(С 2-C6) и линейный или разветвленный низший алкинил(С 2-С 6);R3 и R4 независимо выбраны из группы, содержащей водород, линейный или разветвленный низший алкил(C1-C6), линейный или разветвленный низший алкенил(C2-C6) и линейный или разветвленный низший алкинил(C2-C6), или вместе образуют алкилен(C2-C10) или алкенилен(C2-C10), или вместе с N образуют необязательно (C1-C6)алкил- и/или (C2-С 6)алкенилзамещенный 3-7-членный азациклоалкан или азациклоалкен;R5, Rp, Rq, Rr и Rs независимо выбраны из группы, содержащей водород, линейный или разветвленный низший алкил(C1-C6), линейный или разветвленный низший алкенил(C2-C6) и линейный или разветвленный низший алкинил(С 2-С 6), или R5, Rp, Rq, Rr и Rs независимо могут объединяться с углеродом,к которому они присоединены, и соседним углеродом, образуя двойную связь, или Rp, Rq, Rr и Rs независимо могут образовывать двойную связь с U или Y, к которому они присоединены; при условии, что U-V-W-X-Y-Z выбран из циклогексана,циклогекс-1-ена,циклогекс-2-ена,циклогекс-3-ена,циклогекса-1,3-диена,циклогекса-1,4-диена,циклогекса-1,5-диена,циклогекса-2,4-диена и циклогекса-2,5-диена,и при условии, что U-Z представляет собой циклогексан, если по меньшей мере один из -(A)n(CR1R2)m-, R3, R4, R5, Rp, Rq, Rr представляет собой линейный или разветвленный низший алкенил(С 2-C6) или линейный или разветвленный низший алкинил(C2-C6); его оптических изомеров и фармацевтически приемлемых аддитивных солей кислот или оснований,которые эффективны для облегчения указанного состояния; применение соединения формулы I, которое определено в связи с предыдущими способами, и его оптических изомеров и фармацевтически приемлемых аддитивных солей кислот или оснований в производстве лекарственного средства для использования в любом таком способе; и фармацевтическая композиция, содержащая соединение, выбранное из соединений формулы In+m=0, 1 или 2; А выбран из группы, содержащей линейный или разветвленный низший алкил(C1-C6), линейный или разветвленный низший алкенил(C2-C6) и линейный или разветвленный низший алкинил(C2-C6);R1 и R2 независимо выбраны из группы, содержащей водород, линейный или разветвленный низший алкил(C1-C6), линейный или разветвленный низший алкенил(C2-C6) и линейный или разветвленный низший алкинил(C2-C6);R3 и R4 независимо выбраны из группы, содержащей водород, линейный или разветвленный низший алкил(C1-C6), линейный или разветвленный низший алкенил(С 2-С 6) и линейный или разветвленный низший алкинил(С 2-C6), или вместе образуют алкилен(C2-C10) или алкенилен(C2-C10), или вместе с N образуют необязательно (C1-C6)алкил- и/или (С 2-C6)алкенилзамещенный 3-7-членный азациклоалкан или азациклоалкен;R5 независимо выбран из группы, содержащей линейный или разветвленный низший алкил(C1-C6),линейный или разветвленный низший алкенил(С 2-C6) и линейный или разветвленный низший алкинил(С 2-C6), или R5 объединяется с углеродом, к которому он присоединен, и соседним углеродом, образуя двойную связь; Rp, Rq, Rr и Rs независимо выбраны из группы, содержащей водород, линейный или разветвленный низший алкил(С 1-C6), линейный или разветвленный низший алкенил(C2-C6) и линейный или разветвленный низший алкинил(С 2-C6), или Rp, Rq, Rr и Rs независимо могут объединяться с углеродом, к которому они присоединены, и соседним углеродом, образуя двойную связь, или Rp, Rq, Rr и Rs незави-8 010177 симо могут образовывать двойную связь с U или Y, к которому они присоединены; при условии, что U-V-W-X-Y-Z выбран из циклогексана, циклогекс-2-ена, циклогекс-3-ена, циклогекса-1,4-диена, циклогекса-1,5-диена, циклогекса-2,4-диена и циклогекса-2,5-диена, и при условии, что по меньшей мере один из Rp и Rq не является водородом, и по меньшей мере один из Rr и Rs не является водородом,и при условии, что U-Z представляет собой циклогексан, если по меньшей мере один из -(A)n(CR1R2)m-, Rp, Rq, Rr и Rs представляет собой линейный или разветвленный низший алкенил(C2-C6) и линейный или разветвленный низший алкинил(С 2-C6); и его оптические изомеры и фармацевтически приемлемые аддитивные соли кислот или оснований,в комбинации с одним или большим количеством фармацевтически приемлемых разбавителей, наполнителей и/или носителей. Подробное описание изобретения Дальнейшие детали и подробные примеры приведены только для иллюстрации и не являются ограничительными. Схема: примеры 1 и 2 Пример 1. Гидрохлорид 3,3,5,5-тетраметил-1-винилциклогексанамина (5). а) Этил 2-(3,3,5,5-тетраметилциклогексилиден)ацетат (2). К перемешиваемому раствору триэтилфосфоноацетата (49,32 г, 222 ммоль) в безводном ТГФ (180 мл) в атмосфере аргона добавляют NaH (8,8 г, 222 ммоль, 60% суспензия в минеральном масле) небольшими порциями при охлаждении ледяной водой. Перемешивание продолжают в течение 1 ч при комнатной температуре, затем добавляют раствор 3,3,5,5-тетраметилциклогексанона (30,85 г, 200 ммоль) в течение 10 мин и полученную смесь кипятят с обратным холодильником в течение 22 ч. Затем ее выливают на лед (400 г) и продукт экстрагируют диэтиловым эфиром (4150 мл), экстракты сушат над MgSO4. После выпаривания растворителя в вакууме маслянистый остаток перегоняют при 145 С (11 мм рт.ст.), получая 36,8 г (86%) 2 в виде масла. 1 Н-ЯМР (CDCl3, TMS), м.д.: 0,96 и 0,98 (всего 12 Н, оба с, 3,5-CH3); 1,27 (3H, т, СН 3-этил); 1,33 (2 Н, м, 4-СН 2); 1,95 и 2,65 (всего 4 Н, оба с, 2,6-СН 2); 4,14 (2 Н, кв, СН 2-этил) и 5,69 (1 Н, с, =С-Н).b) 2-(3,3,5,5-тетраметилциклогексилиден)этанол (3). К перемешиваемому раствору LiAlH4 (1,7 г, 4 5 ммоль) в безводном эфире (60 мл) добавляют по капле раствор ацетата 2 (3,2 г, 15 ммоль) в эфире (20 мл) при охлаждении ледяной водой. Перемешивание продолжают в течение 1 ч и оставшийся LiAlH4 разлагают водой. Водный слой отделяют и дважды экстрагируют эфиром (30 мл). Объединенные экстракты промывают насыщенным раствором соли (50 мл) и сушат над MgSO4. После концентрирования в вакууме маслянистый остаток очищают перегонкой в аппарате Kugelrohr с короткой насадкой (150-170 С, 11 мм рт.ст.), получая 3 (2,3 г, 89%) в виде масла. 1 НЯМР (CDCl3, TMS), м.д.: 0,92 (6 Н, с, 3,5-СН 3); 1,10 (1 Н, шир.с, ОН); 1,28 (2 Н, с, 4-СН 2); 1,87 и 1,94 (всего 4 Н, оба с, 2,6-СН 2); 4,16 (2 Н, д, 7 Гц, CH2O) и 5,50 (1H, т, 7 Гц, =С-Н).c) 2,2,2-Трихлор-N-(3,3,5,5-тетраметил-1-винилциклогексил)ацетамид (4). К раствору спирта 3 (0,8 г, 4,7 ммоль) в диэтиловом эфире (5 мл) добавляют NaH (0,22 г 55% дисперсии в минеральном масле (0,22 ммоль. Реакционную смесь охлаждают до -10 С и добавляют по капле раствор трихлорацетонитрила (0,68 г, 4,7 ммоль) в диэтиловом эфире (3 мл). Раствору дают нагреться до комнатной температуры и выпаривают растворитель. Добавляют к остатку пентан (8 мл), содержащий метанол (0,018 мл). Полученную смесь фильтруют через слой целита и выпаривают. Оставшееся масло растворяют в ксилоле (10 мл) и кипятят с обратным холодильником в течение 10 ч. Основное ко-9 010177 личество ксилола отгоняют при пониженном давлении (11 мм рт.ст.) и остаток очищают методом флэшхроматографии на силикагеле (гексан, гексан-этилацетат, 10:1), получая 4 (0,98 г, 66%) в виде масла. 1d) Гидрохлорид 3,3,5,5-тетраметил-1-винилциклогексанамина (5). Смесь амида 4 (0,32 г, 1 ммоль) с порошком NaOH (0,4 г, 10 ммоль) в ДМСО (3 мл) перемешивают в течение 7 дней при комнатной температуре. Реакционную смесь разбавляют H2O (20 мл) и перемешивают в течение ночи при комнатной температуре. Продукт экстрагируют гексаном (310 мл). Объединенные экстракты промывают насыщенным раствором соли (20 мл), сушат над NaOH и фильтруют через слой целита. К полученному раствору добавляют 4 М HCl в безводном диэтиловом эфире (0,5 мл) и растворитель выпаривают. Остаток обрабатывают ацетонитрилом (10 мл), а осадок отфильтровывают и сушат над P2O5 в вакууме, получая 5 (0,12 г, 53%) в виде бесцветного твердого вещества. 1 Н-ЯМР (CDCl3, TMS), м.д.: 0,98 и 1,01 (всего 12 Н, оба с, 3,5-СН 3); 1,19 и 1,29 (всего 2 Н, оба д, 14 Гц, 4-СН 2); 1,62 (2 Н, д, 13,5 Гц, 2,6-СН 2); 1,72 (2 Н, шир.с, H2O); 2,16 (2 Н, д, 13,5 Гц, 2,6-СН 2); 5,46 и 5,73(2 Н, оба д, 18 и 11 Гц, =СН 2); 6,16 (1 Н, дд, 18 и 11 Гц, =СН) и 8,24 (3H, шир.с, NH3+). Пример 2. Гидрохлорид N,3,3,5,5-пентаметил-1-винилциклогексиламина (7). а) Метил 3,3,5,5-тетраметил-1-винилциклогексилкарбамат (6). Смесь гидрохлорида амина 5 (0,25 г, 1,2 ммоль) и Na2CO3 (0,73 г, 6,9 ммоль) в ТГФ (6 мл) перемешивают при комнатной температуре 1 ч. Добавляют метилхлорформиат (0,27 г, 3,4 5 ммоль) и реакционную смесь перемешивают при комнатной температуре в течение 15 ч. Смесь разбавляют диэтиловым эфиром (20 мл), фильтруют и выпаривают досуха. Неочищенный продукт очищают методом флэшхроматографии на силикагеле (легкий петролейный эфир-этилацетат, 10:1), получая 6 (0,24 г, 87%) в виде бесцветного твердого вещества с т.пл. 61-63 С. 1 Н-ЯМР (CDCl3, TMS), м.д.: 0,92 и 1,15 (всего 12 Н, оба с, 3,5-СН 3); 1,00-1,40 (4 Н, м, 4-СН 2 и 2,6 СН); 2,00 (2 Н, д, 14 Гц, 2,6-СН); 3,62 (3H, с, CH3N); 4,72 (1 Н, шир.с, NH); 5,00 и 5,06 (всего 2 Н, оба д,10,5 и 17 Гц, =СН 2) и 5,83 (1 Н, дд, 10,5 и 17 Гц, =СН).b) Гидрохлорид N,3,3,5,5-пентаметил-1-винилциклогексиламина (7). Смесь LiAlH4 (0,28 г, 7,4 ммоль) и карбамата 6 (0,22 г, 0,92 ммоль) в ТГФ (22 мл) кипятят с обратным холодильником в течение 12 ч. Затем ее охлаждают на бане со льдом и добавляют по капле воду (20 мл). Полученную суспензию экстрагируют гексаном (32 0 мл) и объединенные экстракты промывают насыщенным раствором соли (20 мл). Экстракт сушат над NaOH, фильтруют и обрабатывают 2,4 М раствором HCl в диэтиловом эфире (1 мл). Полученную суспензию выпаривают досуха. Остаток обрабатывают диэтиловым эфиром (10 мл) и ацетонитрилом (1 мл). Осадок отфильтровывают и сушат в вакууме над P2O5, получая 7 (0,11 г, 52%) в виде бесцветного твердого вещества. 1 Н-ЯМР (CDCl3, TMS), м.д.: 1,00 и 1,02 (всего 12 Н, оба с, 3,5-СН 3); 1,23 и 1,32 (всего 2 Н, оба д, 15 Гц, 4-СН 2); 1,72 (2 Н, д, 13 Гц, 2,6-СН); 2,15 (2 Н, д, 13 Гц, 2,6-СН); 2,45 (3H, т, 5 Гц, CH3N); 5,64 и 5,69 Пример 3. Гидрохлорид 1-аллил-3,3,5,5-тетраметилциклогексанамина (11). а) 1-Аллил-3,3,5,5-тетраметилциклогексанол (8). К перемешиваемому 1 М эфирному раствору аллилмагнийбромида (60 мл, 60 ммоль) добавляют по капле раствор 3,3,5,5-тетраметилциклогексанона (3,86 г, 25 ммоль) в безводном эфире (20 мл). Смесь перемешивают 1 ч при температуре окружающей среды и кипятят с обратным холодильником в течение- 10010177 10 мин. Затем ее охлаждают ледяной водой и осторожно растирают в насыщенном водном NH4Cl (40 мл). Органический слой отделяют и промывают водой и насыщенным раствором соли. После сушки над безводным MgSO4 раствор концентрируют в вакууме. Выполняют фракционную перегонку остатка при пониженном давлении, получая 3,5 г (72%) 8 с т.кип.98-100 С/12 мм рт.ст. 1 Н-ЯМР (CDCl3, TMS), м.д.: 0,88 (6 Н, с, 3,5-CH3eq); 1,20 (6 Н, с, 3,5-CH3ax); 0,95-1,60 (6 Н, м, 2,4,6 СН 2); 2,15 (2 Н, д, 7,5 Гц, СН 2 С=); 4,95-5,30 (2 Н, м, =СН 2) и 5,65-6,20 (1 Н, м, =СН).b) 1-Аллил-1-азидо-3,3,5,5-тетраметилциклогексан (9) и 1-метил-2-(3,3,5,5-тетраметилциклогексилиден)этилазид (10). К раствору циклогексанола 8 (1,96 г, 10 ммоль) в безводном бензоле (20 мл) в атмосфере аргона добавляют азидотриметилсилан (12 ммоль). К данному охлажденному (5 С) раствору медленно добавляютBF3OEt2 (12 ммоль) при помощи шприца за 20 мин. Смесь перемешивают в течение 6 ч, затем медленно добавляют воду. Органический слой отделяют и промывают насыщенным водным NaHCO3 и насыщенным раствором соли и сушат над MgSO4. Фильтрация и выпаривание растворителя при поддерживании температуры ниже 25 С дают масло, которое выделяют методом колоночной хроматографии на силикагеле (легкий петролейный эфир). Фракцию с Rf 0,85 (гексан) собирают. Выпаривание растворителя дает 9 в виде бесцветного масла (0,26 г, 11,7%). 1 Н-ЯМР (CDCl3, TMS), м.д.: 0,89 (6 Н, с, 3,5-CH3eq); 0,90 (1 Н, д, 14 Гц, 4-СНах); 1,05 (2 Н, д, 14 Гц,2,6-СНах); 1,18- (6 Н, с, 3,5-СН 3 ах); 1,37 (1 Н, д, 14 Гц, 4-CHeq); 1,60 (2 Н, д, 14 Гц, 2,6-CHeq), 2,29 (2 Н, д, 7 Гц, СН 2 С=); 4,95-5,25 (2 Н, м, =СН 2) и 5,65-6,15 (1 Н, м, =СН). Выпаривание дополнительной фракции (Rf 0,65 (гексан дает 0,425 г (20,3%) азида 10 в виде бесцветного масла. 1 Н-ЯМР (CDCl3, TMS), м.д.: 0,91 (6 Н, с), 0,94 (3H, с) и 0,96 (3H, с, 3',5'-СН 3); 1,23 (3H, д, 6,5 Гц, 1 СН 3); 1,26 (2 Н, с, 4'-СН 2); 1,89 (2 Н, с) и 1,96 (2 Н, с, 2',6'-СН 2); 4,31 (1 Н, дкв, 6,5 и 9,5 Гц, 1-СН) и 5,21c) Гидрохлорид 1-аллил-3,3,5,5-тетраметилциклогексанамина (11). Раствор азида 9 (0,221 г, 1,0 ммоль) в безводном эфире (4 мл) добавляют по капле к перемешиваемой суспензии литийалюминийгидрида (0,152 г, 4 ммоль) в эфире (10 мл) за 10 мин. Смесь перемешивают в течение 4 ч, затем обрабатывают 20% водным NaOH (8 мл). Водный слой отделяют и экстрагируют диэтиловым эфиром (215 мл). Объединенные органические экстракты промывают насыщенным раствором соли и сушат над NaOH. Профильтрованный раствор обрабатывают безводным раствором HCl в диэтиловом эфире и выпаривают. К твердому остатку добавляют безводный диэтиловый эфир, отфильтровывают и промывают безводным эфиром, получая 11 (0,105 г, 47%) в виде бесцветного твердого вещества. 1 Н-ЯМР (CDCl3, TMS), м.д.: 1,03 (6 Н, с, 3,5-CH3eq); 1,06 (6 Н, с, 3,5-CH3ax); 1,29 (2 Н, с, 4-СН 2); 1,63(2 Н, д, 13 Гц, 2,6-CHax); 1,80 (2 Н, д, 13 Гц, 2,6-CHeq), 2,71 (2 Н, д, 7 Гц, СН 2 С=); 5,10-5,40 (2 Н, м, =СН 2); 5,75-6,25 (1 Н, м, =СН) и 8,25 (3H, шир.с, NH3+). Пример 4. Гидрохлорид 1-(3,3,5,5-тетраметилциклогексилиден)-2-пропанамина (24). Раствор 1-метил-2-(3,3,5,5-тетраметилциклогексилиден)этилазида (10) (0,33 г, 1,5 ммоль) в безводном диэтиловом эфире (4 мл) добавляют по капле к перемешиваемой суспензии литийалюминийгидрида(0,152 г, 4 ммоль) в эфире (15 мл) за 10 мин. Данную смесь перемешивают в течение 4 ч, затем обрабатывают ее 20% водным NaOH (8 мл). Водный слой экстрагируют эфиром (215 мл). Органические экстракты объединяют, промывают насыщенным раствором соли и сушат над NaOH. Профильтрованный раствор обрабатывают безводным раствором HCl в эфире и выпаривают в вакууме. Добавляют безводный эфир к твердому остатку, отфильтровывают и промывают безводным эфиром, получая 24 (0,18 г, 54%) в виде бесцветного твердого вещества. 1- 11010177 Получают конденсацией пиперидина (1,2 эквивалента) и 3,3,5,5-тетраметилциклогексанона при нагревании в бензоле с азеотропным удалением воды. Неочищенный продукт получают удалением исходных веществ в условиях вакуумной перегонки (100 С/10 мм рт.ст.). Янтарное масло. 1b) Гидрохлорид 1-(1-аллил-3,3,5,5-тетраметилциклогексил)пиперидина (13). К раствору енамина 12 (2,1 г, 9 ммоль) в ТГФ (20 мл) добавляют уксусную кислоту (0,675 г, 11,25 ммоль). Смесь перемешивают в течение 5 мин и добавляют цинковый порошок (0,74 г, 11,25 мгА). Затем добавляют по капле раствор аллилбромида (1,63 г, 13,5 ммоль) в ТГФ (5 мл) и смесь перемешивают при температуре окружающей среды в течение 6 ч. Добавляют водный Na2CO3 и полученную смесь экстрагируют эфиром. Экстракт промывают насыщенным раствором соли, сушат над безводным MgSO4 и концентрируют в вакууме. Остаток выделяют методом колоночной хроматографии на силикагеле (гексан,5% EtOAc в гексане). Фракцию с Rf 0,85 (гексан-EtOAc, 13:2) собирают, выпаривают и обрабатывают безводным раствором HCl в эфире. Осадок отфильтровывают и промывают смесью гексан-EtOAc, получая 13 (0,79 г, 29%) в виде бесцветного твердого вещества. 1 Н-ЯМР (CDCl3, TMS), м.д.: 1,07 (6 Н, с, 3',5'-CH3eq), 1,10 (6 Н, с, 3'5'-CH3ax); 1,34 (1 Н, д, 12,2 Гц) и 1,45 (1 Н, д, 12,2 Гц, 4'-СН 2); 1,70-1,95 (6 Н, м, 2',6'-СНах и пиперидин 3,5-СН, 4-СН 2); 2,37 (2 Н, д, 13,4 Гц,2',6'-CHeq); 2,40-2,70 (2 Н, м, пиперидин 3,5-СН); 2,76 (2 Н, д, 7,2 Гц, СН 2 С=); 2,75-3,00 (2 Н, м, пиперидин 2,6-СН); 3,64 (2 Н, д, 11,6 Гц, пиперидин 2,6-СН); 5,13 (1 Н, д, 9,6 Гц) и 5,24 (1 Н, д, 17,8 Гц, =СН 2); 5,856,15 (1 Н, м, =СН) и 10,72 (1 Н, шир.с, NH). Пример 6. Гидрохлорид 1-[3,3,5,5-тетраметил-1-(3-метил-2-бутенил)циклогексил]пиперидина (14). Получают из пиперидина 12 согласно методике для соединения 13 (пример 5, b), используя 4-бром 2-метил-2-бутен вместо аллилбромида. Выход: 20%. 1 Н-ЯМР (CDCl3, TMS), м.д.: 1,07 и 1,08 (всего 12 Н, оба с, 3',5'-СН 3), 1,32 и 1,44 (2 Н, оба д, 14,2 Гц,4'-СН 2); 1,69 и 1,76 (6 Н, оба с, =С(СН 3)2); 1,68-1,96 (4 Н, м, 3,5-СН и 4-СН 2.); 1,84 (2 Н, д, 13,4 Гц, 2',6'-СНах); 2,31 (2 Н, д, 13,4 Гц, 2',6'-CHeq); 2,40-2,80 (4 Н, м, N(СН)2, 3,5-СН); 2,60 (2 Н, д, 7,2 Гц, СН 2 С=); 3,63(2 Н, д, 10,4 Гц, N(CH)2); 5,31 (1 Н, т, 6,8 Гц, =СН) и 10,55 (1 Н, шир.с, NH). Пример 7. Гидрохлорид 1-[3,3,5,5,5-тетраметил-1-(2-пропинил)циклогексил]пиперидина (15). Получают из пиперидина 12 согласно методике для соединения 13 (пример 5, b), используя 3 бромпропин вместо аллилбромида. Выход: 6%. 1 Н-ЯМР (CDCl3, TMS), м.д.: 1,07 (6 Н, с, 3',5'-CH3eq), 1,11(4,63 г, 25,4 ммоль) и пропионовой кислоты (0,19 мл, 2,5 ммоль) нагревают при 145 С в течение 10 ч. В ходе реакции из смеси отгоняют этанол. Реакционную смесь охлаждают и выливают в воду (100 мл). Водную фазу экстрагируют гексаном (250 мл) и объединенные органические фазы промывают 5% водным KHSO4 (50 мл) и насыщенным раствором соли (50 мл). Экстракт сушат над MgSO4, фильтруют и выпаривают. Остаток очищают методом флэш-хроматографии на силикагеле (легкий петролейный эфир и легкий петролейный эфир-этилацетат, 100:2), получая 16 (4,64 г, 73%) в виде масла. 1 Н-ЯМР (CDCl3,TMS), м.д.: 0,91 (6 Н, с, 3,5-СН 3); 1,01 (6 Н, с, 3,5-CH3); 1,23 (3H, т, 7 Гц, этил СН 3) 1,00-1,30 (4 Н, м, 4-СН 2 и 2,6-СН); 1,86 (2 Н, д, 13 Гц, 2,6-СН); 2,22 (2 Н, с, СН 2 С=O); 4,08 (2H, кв, 7 Гц, этил СН 2); 5,06 и 5,07b) 2-(3,3,5,5-тетраметил-1-винилциклогексил)уксусная кислота (17). Раствор NaOH (1,03 г, 25,8 ммоль) и ацетата 16 (1,3 г, 5,15 ммоль) в метаноле (26 мл) кипятят с обратным холодильником в течение 3 ч. Смесь охлаждают до комнатной температуры и выливают в воду(100 мл). Водную фазу подкисляют концентрированной водной HCl и экстрагируют гексаном (330 мл). Объединенные органические фазы промывают насыщенным раствором соли, сушат над СаС 12, фильтруют и выпаривают. Остаток очищают методом флэш-хроматографии на силикагеле (легкий петролейный эфир-этилацетат, 10:1), получая 17 (0,7 г, 71%) в виде бесцветного твердого вещества с т.пл. 9294 С. 1 Н-ЯМР (CDCl3, TMS), м.д.: 0,92 (6 Н, с, 3,5-СН 3); 1,02 (6 Н, с, 3,5-СН 3); 1,00-1,30 (4 Н, м, 4-СН 2 и 2,6 СН); 1,90 (2 Н, д, 14 Гц, 2,6-СН); 2,27 (2 Н, с, СН 2 С=O); 5,11 и 5,13 (всего 2H, оба д, 11 и 18 Гц, =СН 2); 5,99 (1 Н, дд, 18 и 11 Гц, =СН) и 10,80 (1 Н, шир.с, СООН).c) 2-(3,3,5,5-Тетраметил-1-винилциклогексил)ацетамид (18) N-гидроксисукцинимид (0,25 г, 2,2 ммоль) и N,N'-дициклогексилкарбодиимид (0,45 г, 2,2 ммоль) добавляют к раствору циклогексилуксусной кислоты 17 (0,45 г, 2 ммоль) в ТГФ (5 мл). Смесь перемешивают в течение 18 ч при комнатной температуре и охлаждают на бане со льдом. Добавляют одной порцией 25% водный NH4OH (2 мл) и смесь перемешивают при комнатной температуре в течение 2 ч. Осадок отфильтровывают и промывают диэтиловым эфиром (30 мл). Органическую фазу фильтрата отделяют и промывают 5% водной KHSO4 (10 мл) и насыщенным раствором соли. Экстракт сушат над MgSO4, фильтруют и выпаривают. Остаток очищают методом флэш-хроматографии на силикагеле (легкий петролейный эфир-этилацетат, от 4:1 до 1:1), получая 18 (0,34 г, 76%) в виде бесцветного твердого вещества с т.пл. 44-46 С. 1 Н-ЯМР (CDCl3, TMS), м.д.: 0,91 (6 Н, с, 3,5-СН 3); 1,02 (6 Н, с, 3,5-CH3); 1,00-1,30 (4 Н, м, 4-СН 2 иd) Гидрохлорид 2-(3,3,5,5-тетраметил-1-винилциклогексил)этанамина (19). Смесь LiAlH4 (0,41 г, 11 ммоль) и амида 18 (0,30 г, 1,4 ммоль) в ТГФ (18 мл) кипятят с обратным холодильником в течение 17 ч. Затем ее охлаждают на бане со льдом и добавляют по капле воду (30 мл). Полученную суспензию экстрагируют гексаном (330 мл) и объединенные органические фазы промывают насыщенным раствором соли. Экстракт сушат над NaOH, фильтруют и концентрируют до объема 10 мл. Добавляют 4,8 М раствор HCl в диэтиловом эфире (1 мл) и полученную суспензию выпаривают досуха. Остаток обрабатывают ацетонитрилом (5 мл), осадок отфильтровывают и сушат в вакууме надNaOH, получая 19 (0,16 г, 50%) в виде бесцветного твердого вещества. 1 Н-ЯМР (CDCl3, TMS), м.д.: 0,89 (6 Н, с, 3,5-СН 3); 1,02 (6 Н, с, 3,5-СН 3); 0,90-1,80 (8 Н, м, кольцевые протоны и этанамин-2-СН 2); 2,92 (2 Н, шир.с, CH2N); 5,05 и 5,15 (2 Н, оба д, 18 и 11 Гц, =СН 2); 5,77 (1 Н,дд, 18 и 11 Гц, =СН) и 8,10 (3H, шир.с, NH3+). Пример 9. Гидрохлорид 3-(3,3,5,5-тетраметилциклогексилиден)пропанамина (32). Триэтиламин (0,25 мл, 1,76 ммоль) и дифенилфосфорилазид (0,38 мл, 1,76 ммоль) добавляют к раствору кислоты 17 (0,36 г, 1,6 ммоль) в бензоле (6 мл). Смесь кипятят с обратным холодильником в течение 2 ч, охлаждают до комнатной температуры и выпаривают досуха. Добавляют к остатку холодную(5 С) концентрированную водную HCl (3 мл). Полученную смесь перемешивают при комнатной температуре в течение 18 ч. и делают сильнощелочной, добавляя 10% водный NaOH. К смеси добавляют гексан (20 мл) и обе фазы фильтруют. Осадок промывают гексаном (25 мл) и водой (25 мл). Органическую фазу фильтрата отделяют. Водную фазу промывают гексаном (210 мл). Объединенные органические фазы промывают насыщенным раствором соли (10 мл), сушат над NaOH и фильтруют. Добавляют 4,8 М раствор HCl в диэтиловом эфире (1 мл) и полученную суспензию выпаривают. Остаток перекристаллизовывают из ацетонитрила и сушат в вакууме над P2O5, получая 32 (0,1 г, 43%) в виде бесцветного твердого вещества. 1 Н-ЯМР (CDCl3, TMS), м.д.: 0,90 и 0,92 (всего 12 Н, оба с, циклогексан-3,5-СН 3); 1,23 (2 Н, с, циклогексан-4-СН 2); 1,86 и 1,92 (всего 4 Н, оба с, циклогексан-2,6-СН 2); 2,49 (2 Н, кв, 7 Гц, пропанамин-2-СН 2); 2,98 (2 Н, т, 7 Гц, пропанамин-1-СН 2); 5,15 (1 Н, т, 7 Гц, =СН-) и 8,30 (3H, шир. с, NH3+). Схема: примеры 10 и 11- 13010177 60% дисперсию NaH в минеральном масле (0,96 г, 24 ммоль) добавляют к раствору диэтилцианометилфосфоната (4,25 г, 24 ммоль) в ТГФ (30 мл) при охлаждении водой со льдом. Смесь перемешивают 30 мин и добавляют по капле раствор 3,3,5,5-тетраметилциклогексанона (3,08 г, 20 ммоль) в ТГФ (10 мл). Охлаждающую баню убирают и перемешивают смесь при комнатной температуре в течение 72 ч. Выливают ее в ледяную воду (100 мл) и экстрагируют диэтиловым эфиром (350 мл). Объединенные органические фазы промывают насыщенным раствором соли, сушат над MgSO4,фильтруют и выпаривают. Неочищенный продукт очищают методом флэш-хроматографии на силикагелеb) Гидрохлорид 2-(3,3,5,5-тетраметилциклогексилиден)этанамина (22). Суспензию LiAlH4 (0,68 г, 18 ммоль) в диэтиловом эфире (30 мл) охлаждают на бане со льдом и добавляют 1 М раствор ZnCl2 в диэтиловом эфире (9 мл, 9 ммоль). Полученную смесь перемешивают в течение 15 мин и добавляют по капле раствор нитрила 20 (1 г, 6 ммоль) в диэтиловом эфире (30 мл), поддерживая температуру 0-5 С. Затем баню со льдом убирают и смесь перемешивают при комнатной температуре в течение 24 ч. Добавляют воду (30 мл) и 20% водный NaOH (20 мл) при охлаждении на бане со льдом. Водную фазу экстрагируют диэтиловым эфиром (450 мл). Объединенные органические фазы промывают насыщенным раствором соли (50 мл), сушат над NaOH, фильтруют и выпаривают. Остаток очищают перегонкой в аппарате Kugelrohr с короткой насадкой при 160 С/20 мм рт.ст. Дистиллят разбавляют диэтиловым эфиром и добавляют 4,8 М раствор HCl в диэтиловом эфире (3 мл). Полученный осадок отфильтровывают, промывают диэтиловым эфиром (35 мл) и сушат в вакууме над NaOH, получая 22 в виде бесцветного твердого вещества. 1 Н-ЯМР (CDCl3, TMS), м.д.: 0,91 и 0,92 (всего 12 Н, оба с, 3',5'-СН 3); 1,28 (2 Н, с, 4'-СН 2); 1,89 и 1,93(всего 4 Н, оба с, 2',6'-CH2); 3,62 (2 Н, д, 7 Гц, CH2N); 5,41 (1 Н, т, 7 Гц, -С=СН) и 8,3 (3H, шир.с, NH3+). Пример 11. Гидрохлорид 2-(3,3,5,5-тетраметилциклогексилиден)пропанамина (23). а) 2-(3,3,5,5-тетраметилциклогексилиден)пропионитрил (21). Получают согласно методике для соединения 20 (пример 10, а), используя диэтил(1-цианоэтил) фосфонат. Нитрил 21 получают в виде бесцветного масла с выходом 41%. 1 Н-ЯМР (CDCl3, TMS), м.д.: 0,96 и 1,00 (всего 12 Н, оба с, циклогексан-3,5-СН 3); 1,34 (12 Н, с, циклогексан-4-СН 2); 1,91 (3H, с, пропионитрил-3-СН 3); 2,04 и 2,28 (всего 4 Н, оба с, циклогексан-2,6-CHr).b) Гидрохлорид 2-(3,3,5,5-тетраметилциклогексилиден)пропанамина (23). Получают из нитрила 21 согласно методике для соединения 22 (пример 10, b). Гидрохлорид амина 23 получают в виде бесцветного твердого вещества. 1 Н-ЯМР (CDCl3, TMS), м.д.: 0,92 и 0,93 (всего 12 Н, оба с, циклогексан-3, 5-СН 3); 1,27 (2 Н, с, циклогексан-4-СН 2); 1,89 (3H, с, пропанамин-3-СН 3); 1,99 и 2,01 (всего 4 Н, оба с, циклогексан-2,6-СН 2); 3,64 Пример 12. Гидрохлорид (E,Z)-1-(3,3-диэтил-5,5-диметилциклогексилиден)-2-пропанамина (28). а) 1-Аллил-3,3-диэтил-5,5-диметилциклогексанол (26). К перемешиваемому 1 М эфирному раствору аллилмагнийбромида (20 мл, 20 ммоль) добавляют по капле раствор 3,3-диэтил-5,5-диметилциклогексанона (25) (1,47 г, 8,06 ммоль) в безводном эфире (5 мл). Данную смесь перемешивают в течение 1 ч при температуре окружающей среды и кипятят с обратным холодильником 10 мин. Затем ее охлаждают ледяной водой и обрабатывают насыщенным водным NH4Cl(40 мл). Органический слой отделяют и промывают водой и насыщенным раствором соли. После сушки над безводным MgSO4, раствор концентрируют в вакууме. Остаток очищают методом колоночной хроматографии на силикагеле (легкий петролейный эфир). Фракцию с Rf 0,7 (гексан:EtOAc, 13:2) собирают. Выпаривание растворителя дает 26 (1,35 г, 74%) в виде бесцветного масла. 1 Н-ЯМР (CDCl3, TMS), м.д.: 0,74 (6 Н, т, 7 Гц, 2 СН 3 этил); 0,88 (3H, с, 5-CH3eq); 1,19 (3H, с, 5-СН 3 ах); 0,80-2,05 (10 Н, м, 2,4,6-СН 2 и 2 СН 2 этил); 2,14 (2 Н, д, 7 Гц, СН 2 С=); 4,95-5,30 (2 Н, м, =СН 2) и 5,65-6,20b) (E,Z) -1-метил-2-(3,3-диэтил-5,5-диметилциклогексилиден)этилазид (27). Получают из циклогексанола 26 согласно методике для соединений 9 и 10 (пример 3, b). Азид 27 получают в виде бесцветного масла с выходом 15%. 1 Н-ЯМР (CDCl3, TMS), м.д.: 0,73 и 0,74 (всего 6 Н, оба т, 7 Гц, 2 СН 3 этил); 0,91, 0,94 и 0,97 (всего 6 Н, все с, 5',5'-СН 3); 1,10-1,45 (4 Н, м, 2 СН 2 этил); 1,22 (3H, д, 6,5 Гц, 1-CH3); 1,26 (2 Н, с, 4'-СН 2); 1,89 (2 Н,с) и 1,97 (2 Н, м, 2',6'-СН 2); 4,08-4,48 (1 Н, м, 1-СН) и 5,18 (1 Н, дм, 9,5 Гц, =СН).c) Гидрохлорид (E,Z)-1-(3,3-диэтил-5,5-диметилциклогексилиден)-2-пропанамина (28). Получают из азида 27 согласно методике для соединения 24 (пример 4). Гидрохлорид амина 28 получают в виде бесцветного твердого вещества с выходом 16%. 1 Н-ЯМР (CDCl3, TMS), м.д.: 0,72 (6 Н, шир.т, 7 Гц, 2 СН 3 этил), 0,90, 0,92 и 0,98 (всего 6 Н, все с, 5',5'СН 3); 1,25 (6 Н, м, 4 '-СН 2 и 2 СН 2 этил); 1,47 (3H, д, 6,5 Гц, 2-CH3); 1,70-2,25 (2 Н, шир. АВ кв, 13 Гц, 2'СН 2); 1,87 (2 Н, с, 6'-СН 2), 4,18 (1 Н, м, 2-СН); 5,34 (1 Н, шир.д, 9,5 Гц, =СН) и 8,38 (3H, шир.с, NH3+). Схема: пример 13a) 2-метил-1-(3,3,5,5-тетраметилциклогексилиден)-2-пропанол (29). Раствор ацетата 2 (2,14 г, 10 ммоль) в диэтиловом эфире (20 мл) добавляют к 1,6 М раствору MeLi в диэтиловом эфире (26 мл, 40 ммоль) при охлаждении на бане со льдом. Реакционную смесь перемешивают при комнатной температуре в течение 1 ч. Затем ее охлаждают на бане со льдом и добавляют по капле насыщенный водный NH4Cl (20 мл). Водную фазу экстрагируют диэтиловым эфиром (230 мл). Объединенные органические фазы промывают насыщенным раствором соли (30 мл), сушат над MgSO4,фильтруют и выпаривают. Остаток очищают перегонкой в аппарате Kugelrohr с короткой насадкойBF3Et2O (0,3 мл, 2,4 ммоль) добавляют к раствору спирта 29 (0,42 г, 2 ммоль) и TMSN3 (0,31 мл, 2,4 ммоль) в бензоле (4,5 мл) в течение 3 мин при охлаждении на бане со льдом. Реакционную смесь перемешивают при 5-10 С в течение 1 ч и фильтруют через короткую колонку с силикагелем. Раствор выпаривают и остаток очищают методом флэш-хроматографии на силикагеле (легкий петролейный эфир),получая 30 (0,30 г, 64%) в виде бесцветного масла. 1 Н-ЯМР (CDCl3, TMS), м.д.: 0,92 и 0,98 (всего 12 Н, оба с, циклогексан-3,5-CH3); 1,27 (2 Н, с, циклогексан-4-СН 2); 1,40 (6 Н, с, -C(CH3)2N3); 1,85 и 2,23 (оба 2 Н, оба с, циклогексан-2,6-СН 2) и 5,27 (1 Н, с,=СН-). с) Гидрохлорид 2-метил-1-(3,3,5,5-тетраметилциклогексилиден)-2-пропанамина (31). Получают из азида 30 по такой же методике, как для амина 24 (пример 4). Гидрохлорид амина 31 получают в виде бесцветного твердого вещества с выходом 69%. 1 Н-ЯМР (CDCl3, TMS), м.д.: 0,91 и 0,98 (всего 12 Н, оба с, циклогексан-3,5-СН 3); 1,26 (2 Н, с, циклогексан-4-СН 2); 1,68 (6 Н, с, -C(CH3)2N); 1,84 и 2,10 (оба 2 Н, оба с, циклогексан-2,6-СН 2); 5,15 (1 Н, с,=СН-) и 8,5 (3H, шир.с, NH3+). Схема: примеры 14 и 15- 15010177 К охлажденной (0 С) суспензии азида натрия (0,81 г, 12,5 ммоль) в CH2Cl2 (5 мл) добавляют по капле 53% водную H2SO4 (8 мл). Смесь перемешивают в течение 10 мин, затем добавляют раствор 3,5,5 триметил-2-циклогексанола (33) (0,70 г, 5 ммоль) в CH2Cl2 (8 мл). Смесь перемешивают в течение 20 ч,выливают в ледяную воду, нейтрализуют водным NH4OH и экстрагируют CH2Cl2. Экстракт промывают насыщенным раствором соли и сушат над MgSO4. Фильтрация и выпаривание растворителя при поддержании температуры ниже 25 С дают масло, которое выделяют методом колоночной хроматографии на силикагеле (легкий петролейный эфир). Фракцию с Rf 0,8 (гексан) собирают. Выпаривание растворителя дает 34 в виде бесцветного масла (0,365 г, 44%). 1 Н-ЯМР (CDCl3, TMS), м.д.: 0,89 и 1,01 (всего 6 Н, оба с, 5,5-CH3); 1,34 (1 Н, м, цикло-4-СН); 1,551,95 (3H, м, 4-СН, 6-СН 2); 1.71 (3H, с, 1-CH3); 3,90 (1 Н, м, 3-СН) и 5,39 (1 Н, с, С=СН).b) Гидрохлорид 3,5,5-триметил-2-циклогексен-1-амина (35). Получают из азида 34 согласно методике для соединения 11 (пример 3, с). Гидрохлорид амина 35 получают в виде бесцветного твердого вещества с выходом 57%. 1 Н-ЯМР (CDCl3, TMS), м.д.: 0,89 и 1,03 (всего 6 Н, оба с, 5,5-СН 3); 1,25-2,15 (4 Н, м, 4,6-СН 2); 1,72(38). К перемешиваемому 2 М эфирному раствору метилмагниййодида (15 мл, 30 ммоль) добавляют по капле раствор 3,5,5-триметил-2-циклогексен-1-она (36) (1,38 г, 10 ммоль) в безводном эфире (15 мл). Смесь перемешивают в течение 1 ч, охлаждают ледяной водой и осторожно обрабатывают 15% водной СН 3 СООН (15 мл). Смесь перемешивают еще один час. Органический слой отделяют и промывают водой и насыщенным водным NaHCO3. После сушки над MgSO4 раствор концентрируют в вакууме. Остаток очищают методом флэш-хроматографии (легкий петролейный эфир, Rf 0,95 (гексан), получая смесь 37 и 38 (0,955 г, 70%) (7:10, на основании ГХ) в виде масла. 1 Н-ЯМР (CDCl3, TMS), м.д.: 0,89, 0,98 и 1,03b) 3-Азидо-1,5,5,5-театраметил-1-циклогексен (39). Получают из смеси 37 и 38 согласно методике для соединения 34 (пример 14, а). Азид 39 получают в виде бесцветного масла с выходом 43%. 1 Н-ЯМР (CDCl3, TMS), м.д.: 0,93 и 0,99 (всего 6 Н, оба с, 5,5-СН 3); 1,31 (3H; с, 1-СН 3); 1,36 и 1,62c) Гидрохлорид 1,3,5,5-тетраметил-2-циклогексен-1-амина (40). Получают из азида 39 согласно методике для соединения 11 (пример 3, с). Гидрохлорид амина 40 получают в виде бесцветного твердого вещества с выходом 60%. 1 Н-ЯМР (CDCl3, TMS), м.д.: 0,96 и 1,07 (всего 6 Н, оба с, 5,5-СН 3); 1,56 (3H, с, 1-СН 3); 1,73 (3H, с, 3 СН 3); 1,60-2,05 (4 Н, м, 4,6-СН 2); 5,49 (1 Н, с, С=СН) и 8,27 (3H, шир.с, NH3+). Схема: пример 16 Пример 16. Гидрохлорид 1,3-транс-5-приметил-цис-3-винилциклогексанамина (45). а) 3,5-Диметил-3-винилциклогексанон (42). 1 М раствор винилмагнийбромида в ТГФ (90 мл, 90 ммоль) охлаждают на бане безводный ледацетон до -20 С в инертной атмосфере и добавляют CuCl (4,45 г, 45 ммоль) одной порцией. Смесь перемешивают в течение 30 мин и добавляют по капле раствор 3,5-диметил-2-циклогексен-1-она (41) (3,73 г,30 ммоль) в ТГФ (40 мл), поддерживая температуру реакции при -20 С. Охлаждающую баню убирают и дают температуре реакционной смеси подняться до комнатной в течение 2 ч. Добавляют полностью насыщенный водный NH4Cl (50 мл) при охлаждении на бане со льдом. Затем добавляют гексан (150 мл) и водный слой отделяют и экстрагируют гексаном (2100 мл). Объединенные органические экстракты промывают 20% водной уксусной кислотой (100 мл) и насыщенным водным NaHCO3 (3200 мл). Экстракт сушат над MgSO4, фильтруют и выпаривают. Неочищенный продукт очищают методом флэшхроматографии на силикагеле (легкий петролейный эфир-этилацетат, 20:1), получая 42 (2,4 г, 52%) в ви- 16010177 де бесцветного масла. 1 Н-ЯМР (CDCl3, TMS), м.д.: 0,99 (3H, д, 6 Гц, 5-СН 3); 1,11 (3H, с, 3-CH3); 1,2-2,6 (7 Н, м, кольцевые протоны); 4,94 и 5,01 (всего 2 Н, оба д, 17 и 10,5 Гц, СН 2=) и 5,64 (1 Н, дд, 17 и 11 Гц, =СН).b) 1,3-транс-5-триметил-цис-3-винилциклогексанол (43). Раствор кетона 42 (1 г, 6,6 ммоль) в диэтиловом эфире (10 мл) добавляют к 1,6 М раствору метиллития в диэтиловом эфире (12 мл, 19,6 ммоль) при охлаждении на бане со льдом. Полученную смесь перемешивают в течение 1 ч при 0-5 С и добавляют полностью насыщенный водный NH4Cl (10 мл). Водный слой отделяют и экстрагируют диэтиловым эфиром (215 мл). Объединенные органические фазы промывают насыщенным раствором соли (20 мл) и сушат над MgSO4. Экстракт фильтруют и выпаривают. Неочищенный продукт очищают методом флэш-хроматографии на силикагеле (3% этилацетат в легком петролейном эфире). Циклогексанол 43 (0,82 г, 74%) получают в виде бесцветного масла, которое используют на следующей стадии без характеризации.c) 1-Азидо-1,3-транс-5-триметил-цис-3-винилциклогексан (44). Получают из циклогексанола 43 согласно методике для соединения 9 (пример 3, b). Азид 44 получают в виде бесцветного масла с выходом 17%. 1 Н-ЯМР (CDCl3, TMS), м.д.: 0,94 (3H, д, 6,5 Гц, 5-CH3); 0,97 (3H, с, 3-СН 3); 1,27 (3H, с, 1-СН 3); 0,7-2,0 (7 Н, м, кольцевые протоны); 4,95 и 4,97 (всего 2 Н, оба д,18 и 11 Гц, =СН 2) и 5,77 (1 Н, дд, 18 и 11 Гц, =СН).d) Гидрохлорид 1,3-транс-5-триметил-цис-3-винилциклогексанамина (45). Получают из азида 44 согласно методике для соединения 11 (пример 3, с). Гидрохлорид амина 45 получают в виде бесцветного твердого вещества с выходом 32%. 1 Н-ЯМР (CDCl3, TMS), м.д.: 0,92 (3H, д,6,5 Гц, 5-CH3); 0,96 (3H, с, 3-СН 3); 1,45 (3H, с, 1-СН 3); 0,8-2,1 (9 Н, м, 2,4,6-СН 2, 5-СН и H2O); 4,94 и 4,97 Пример 17. Гидрохлорид 2-(1,3,3,5,5-пентаметилциклогексил)-4-пентениламина (49). а) Этил 2-циано-2-(1,3,3,5,5-пентаметилциклогексил) ацетат (47). Хлорид меди(I) (0,05 г, 0,5 ммоль) добавляют к охлажденному (-10 С) в атмосфере аргона 1 М метилмагниййодиду в этиловом эфире (15 мл, 15 ммоль) и перемешивают в течение 5 мин. Затем добавляют по капле раствор ацетата 46 (2,5 г, 10 ммоль) в ТГФ (25 мл) за 20 мин, поддерживая температуру ниже 0 С. Смесь перемешивают в течение 1 ч, гасят насыщенным водным NH4Cl и экстрагируют диэтиловым эфиром. Экстракт промывают насыщенным раствором соли, сушат над безводным MgSO4, фильтруют и выпаривают. Остаток очищают методом флэш-хроматографии на силикагеле (легкий петролейный эфир-этилацетат, 20:1), получая 47 (1,5 г, 56,5%) в виде бесцветного масла. 1 Н-ЯМР (CDCl3, TMS), м.д.: 1,01, 1,07 и 1,09 (всего 12 Н, с, 3',5'-СН 3); 1,00-1,85 (6 Н, м, кольцо СН); 1,30 (3H, с, 1'-CH3); 1,33 (3H, т, 7 Гц, CH3-этил); 3,44 (1 Н, с, 2-СН) и 4,27 (2 Н, кв, 7 Гц, ОСН 2).b) Этил 2-циано-2-(1,3,3,5,5-пентаметилциклогексил)-4-пентеноат (48). К раствору цианоацетата 47 (1,25 г, 4,71 ммоль) в безводном ДМСО (10 мл) добавляют гидрид натрия (0,284 г, 7,09 ммоль; 60% дисперсия в минеральном масле). Смесь перемешивают в течение 30 мин при 50 С и охлаждают до 20 С. К данной смеси добавляют аллилбромид (0,86 г, 7,1 ммоль) и смесь перемешивают в течение 3 ч при комнатной температуре, затем 30 мин при 50 С. Смесь охлаждают, обрабатывают водой и экстрагируют диэтиловым эфиром. Экстракт промывают водой и насыщенным раствором соли, сушат над безводным MgSO4, фильтруют и выпаривают. Остаток очищают методом флэшхроматографии на силикагеле (легкий петролейный эфир-этилацетат, 20:1), получая 48 (0,92 г, 63,7%) в виде бесцветного масла. 1 Н-ЯМР (CDCl3, TMS), м.д.: 0,98 (6 Н, с, 3',5'-CH3eq); 1,11 (6 Н, с, 3',5'-СН 3 ах); 1,00-1,85 (6 Н, м, кольцо СН); 1,31 (3H, т, 7 Гц, СН 3-этил); 1,33 (3H, с, 1'-СН 3); 2,42 и 2,86 (всего 2 Н, оба дд, 13 и 7 Гц, 3-СН 2); 4,02c) Гидрохлорид 2-(1,3,3,5,5-пентаметилциклогексил)-4-пентениламина (49). К раствору сложного эфира 48 (0,9 г, 2,95 ммоль) в ДМСО (10 мл) добавляют воду (0,53 мл, 2,95 ммоль) и хлорид лития (0,25 г, 5,9 ммоль). Смесь перемешивают в течение 3 ч при 175-180 С, затем охлаждают и добавляют воду (30 мл). Смесь экстрагируют диэтиловым эфиром. Экстракт промывают водой и насыщенным раствором соли, сушат над безводным MgSO4, фильтруют и концентрируют до объе- 17010177 ма 10 мл. Полученный раствор добавляют по капле к суспензии литийалюминийгидрида (0,25 г, 6,6 ммоль) в диэтиловом эфире (15 мл) и кипятят с обратным холодильником в течение 3 ч. Смесь охлаждают, обрабатывают 20% водным NaOH и экстрагируют диэтиловым эфиром. Экстракт промывают насыщенным раствором соли, сушат над NaOH, фильтруют и обрабатывают безводным раствором HCl в диэтиловом эфире. После выпаривания растворителя остаток очищают методом хроматографии на силикагеле (хлороформ-метанол, 20:1), получая 49 (0,245 г, 31%) в виде бесцветного твердого вещества. 1 Н-ЯМР (ДМСО-D6, TMS), м.д.: 0,92, 0,96 и 1,04 (всего 15 Н, все с, 3',5'-СН 3 и 1'-СН 3), 1,00-1,65 (всего 6 Н, м, кольцо-СН 2); 1,85-2,40 (3H, м, 3-СН 2, 4-СН); 2,60-3,10 (2 Н, м, CH2N); 4,90-5,25 (2 Н, м, =СН 2); 5,62-6,10 (1 Н, м, =СН) и 7,92 (3H, шир.с, NH3+). Фармацевтические композиции Активные ингредиенты данного изобретения вместе с одним или большим количеством обычных адъювантов, носителей или разбавителей можно приготовить в виде фармацевтических композиций и их единичных дозированных форм и в таком виде можно применять их как твердые композиции, такие как таблетки с покрытием или без покрытия или заполненные капсулы, или жидкости, такие как растворы,суспензии, эмульсии, эликсиры или капсулы, заполненные ими, все для перорального применения; в виде суппозиториев или капсул для ректального применения или в виде стерильных растворов для инъекций для парентерального (включая внутривенное или подкожное) применения. Такие фармацевтические композиции и их единичные дозированные формы могут содержать общеизвестные или новые ингредиенты в обычных или специальных пропорциях, с дополнительными активными соединениями или без оных, и такие единичные дозированные формы могут содержать любое подходящее эффективное количество активного ингредиента, соответствующее предполагаемому для приема диапазону дневных доз. Таким образом, подходящими типичными единичными дозированными формами являются таблетки,содержащие от двадцати (20) до ста (100) миллиграммов активного ингредиента, или, более широко, от десяти (10) до двухсот пятидесяти (250) миллиграммов в таблетке. Способ лечения Благодаря высокой степени своей активности и низкой токсичности, представляющими вместе наиболее благоприятный терапевтический показатель, активные вещества данного изобретения можно вводить субъекту, например, в организм нуждающегося в этом животного (включая человека), для лечения,облегчения или снижения интенсивности, временного облегчения или ликвидации показания или состояния, восприимчивого к ним, или типичного показания или состояния, указанного где-либо дальше в данной заявке, предпочтительно конкурентно, одновременно или вместе с одним или большим количеством фармацевтически приемлемых наполнителей, носителей или разбавителей, особенно и предпочтительно в виде их фармацевтической композиции перорально, ректально или парентерально (включая внутривенный и подкожный способы), или в некоторых случаях даже местно при эффективном количестве. Подходящие диапазоны доз составляют 1-1000 мг в день, предпочтительно 10-500 мг в день, и в особенности 50-500 мг в день в зависимости, как правило, от точного способа введения, формы введения,показания, на которое направлено введение, участвующего субъекта, массы тела участвующего субъекта и предпочтений и опыта лечащего врача или ветеринара. Примеры типичных фармацевтических композиций При помощи обычно используемых растворителей, вспомогательных агентов и носителей продукты реакций можно переработать в таблетки, таблетки с покрытием, капсулы, растворы для капельниц, суппозитории, препараты для инъекций и вливаний и подобное и можно применять терапевтически пероральным, ректальным, парентеральным и другими способами. Типичные фармацевтические композиции приведены далее.(a) Таблетки, подходящие для перорального введения, которые содержат активный ингредиент,можно получить обычными методиками таблетирования.(b) Для суппозиториев можно использовать любую обычную основу суппозиториев для включения в нее активного ингредиента по обычной методике, такую как полиэтиленгликоль, который является твердым при нормальной комнатной температуре, но плавится при температуре тела или около нее.(с) Для растворов для парентерального (включая внутривенное и подкожное) введения применяют активный ингредиент вместе с обычными ингредиентами в обычных количествах, такими как, например,хлорид натрия и дважды дистиллированная вода, сколько требуется, согласно обычной методике, такой как фильтрование, асептическое заполнение ампул или бутылок для внутривенных капельниц, и обработка в автоклаве для стерильности. Другие подходящие фармацевтические композиции будут непосредственно ясны для специалистов в данной области. Следующие примеры также даны только для иллюстрации и не являются ограничительными. Пример 18. Препарат для таблеток. Подходящим препаратом для таблетки, содержащей 10 мг активного ингредиента, является следующий: Пример 19. Препарат для таблеток. Другим подходящим препаратом для таблетки, содержащей 100 мг активного ингредиента, является следующий: Пример 20. Препарат для капсул. Подходящим препаратом для капсулы, содержащей 50 мг активного ингредиента, является следующий: Заполняют желатиновую капсулу. Пример 21. Раствор для инъекций. Подходящим препаратом для раствора для инъекций, содержащего один процент активного ингредиента, является следующий: Пример 22. Жидкий препарат для перорального приема. Подходящим препаратом для 1 л жидкой смеси, содержащей 2 мг активного ингредиента в одном мл смеси, является следующий:- 19010177 Пример 23. Жидкий препарат для перорального приема. Другим подходящим препаратом для 1 л жидкой смеси, содержащей 20 мг активного ингредиента в одном мл смеси, является следующий: Пример 24. Жидкий препарат для перорального приема. Другим подходящим препаратом для 1 л жидкой смеси, содержащей 2 мг активного ингредиента в одном мл смеси, является следующий: Алюминиевые баллончики для аэрозоля заполняют 15 мл данного раствора, закрывают дозировочным клапаном, создают давление 3,0 бар. Пример 26. TDS-препарат 100 г раствора содержат: 1,8 мл данного раствора помещают на ткань, покрытую липкой подкладкой из фольги. Систему закрывают защитной прокладкой, которую удаляют перед применением. Пример 27. Препарат в виде наночастиц 10 г полибутилцианоакрилатных наночастиц содержат: Полибутилцианоакрилатные наночастицы получают полимеризацией эмульсии в смеси вода/0,1 н.HCl/этанол как полимеризационной среде. В заключение наночастицы в суспензии лиофилизуют в ва- 20010177 кууме. Фармакология - краткое изложение Активные вещества настоящего изобретения, их фармацевтические композиции и способы лечения с их помощью отличаются уникальными преимуществами и неочевидными свойствами, делая заявленный в данном описании "рассматриваемый материал в целом" неочевидным. Данные соединения и их фармацевтические композиции демонстрируют в стандартных общепринятых заслуживающих доверия методиках исследования следующие оцениваемые свойства и характеристики. Они являются системно-активными, неконкурентными антагонистами рецепторов NMDA с быстрыми кинетиками блокирования/разблокирования и сильной зависимостью от напряжения и, следовательно, применимы при лечении, прекращении, облегчении, ослаблении или уменьшении интенсивности восприимчивых состояний путем применения или введения животному-носителю с целью лечения широкого диапазона нарушений ЦНС, которые включают расстройства глутаматергической предачи. Данные соединения также являются системноактивными, неконкурентными антагонистами рецепторов 5-НТ 3 и нейронных никотиновых рецепторов и, следовательно, применимы при лечении, прекращении, облегчении, ослаблении или уменьшении интенсивности восприимчивых состояний путем нанесения: или введения животному-носителю с целью лечения широкого диапазона нарушений ЦНС, которые включают расстройства серотонинергической или никотиновой передачи. Методы Исследования связывания рецепторов Самцов крыс Sprague-Dawlew (200-250 г) обезглавливают и быстро удаляют мозг. Кору иссекают и гомогенизируют в 20 объемах охлажденной на льду 0,32 М сахарозы, используя стеклянно-тефлоновый гомогенизатор. Гомогенат центрифугируют при 1000g в течение 10 мин. Осадок отбрасывают и супернатант центрифугируют при 20000g в течение 20 мин. Полученный осадок повторно суспендируют в 20 объемах дистиллированной воды и центрифугируют в течение 20 мин при 8000g. Затем супернатант и лейкоцитную пленку центрифугируют при 48000g в течение 20 мин в присутствии 50 мМ Трис-HCl, рН 8,0. Затем осадок повторно суспендируют и центрифугируют два-три раза при 48000g в течение 20 мин. в присутствии 50 мМ Трис-HCl, рН 8,0. Все стадии центрифугирования проводят при 4 С. После повторного суспендирования в 5 объемах 50 мМ Трис-HCl, рН 8,0 мембранную суспензию быстро замораживают при -80 С. В день исследования мембраны размораживают и пребывают четыре раза при повторном суспендировании в 50 мМ Трис-HCl, рН 8,0 и центрифугировании при 48000g в течение 20 мин и окончательно снова суспендируют в 50 мМ Трис-HCl, рН 7,4. Определяют количество белка в конечном мембранном препарате (250-500 мкг/мл) согласно способу Лоури и др. (1951). Инкубацию начинают при добавлении[3 Н]-(+)-МК-801 (23,9 Ки/ммоль, 5 нМ, Dupont NEN) в пробирки с глицином (10 мкМ), глутаматом (10 мкМ) и 125-250 мкг белка (общий объем 0,5 мл) и различными концентрациями исследуемых агентов (10 концентраций, каждая дублирована). Инкубацию проводят при комнатной температуре в течение 120 мин (достигают равновесия при используемых условиях). Неспецифическое связывание определяют путем добавления немеченого (+)-МК-801 (10 мкМ). Инкубацию завершают, применяя фильтровальную систему Millipore. Образцы дважды ополаскивают 4 мл исследовательского буфера, охлажденного на льду, на фильтрах из стекловолокна (SchleicherSchuell) в постоянном вакууме. После отделения и споласкивания фильтры помещают в сцинтилляционную жидкость (5 мл, Ultima Gold) и определяют радиоактивность, задержанную на фильтрах, при помощи обычного жидкостного сцинтилляционного счетчика(Hewlett Packard, Liquid Scintillation Analyser). Kd [3H]-(+)-МК-801 для 4,6 нМ определяют анализом по Скретчарду и используют согласно соотношению Чена-Прусова для расчета сродства замещающих веществ как величины Kd. Большинство антагонистов тестируют в 3-7 отдельных экспериментах. Экспрессия подтипа рецепторов NMDA и нейронных никотиновых рецепторов в овоцитах Xenopus Зрелым женским особям Xenopus laevis проводят анестезию в 0,2% трикаине на льду в течение 15 мин до оперативного вмешательства. Овоциты удаляют и инкубируют в 2 мг/мл коллагеназе (тип II) в овоцитном растворе Рингера, не содержащем Са 2+ (82,5 мМ, NaCl, 2 мМ KCl, 2 мМ MgCl2, 5 мМ HEPES,рН 7,5), в течение 30 мин при комнатной температуре и тщательно промывают OR-2 (100 мМ NaCl, 2 мМKCl, 1 мМ MgCl2, 2 мМ CaCl2, 5 мМ HEPES, рН 7,5). Оставшийся слой фолликулярных клеток удаляют вручную при помощи остроконечного пинцета и хранят овоциты в OR-2. РНК растворяют в DEPCобрабстанной стерильной дистиллированной воде. РНК для подъединицы NMDA NR1a смешивают в соотношении 1:1 с РНК для подъединицы NMDA NR2A. Аналогично РНК нейронного никотинового 4 смешивают в соотношении 1:1 с РНК для подъединицы 2. От пятидесяти до ста нанолитров каждой смеси РНК вводят в цитоплазму овоцитов, применяя нанолитровый инжектор (World Precision Instruments). Овоциты инкубируют при 19 С в OR-2 в течение следующих 3-6 дней. Получают электрофизиологические отклики, применяя стандартный двухэлектродный метод напряжение-блокировка (усилитель GeneClamp 500), в течение 2-6 дней после инъекции. Электроды имеют сопротивление между 0,2 и 0,4 МОм и заполнены 3 М KCl. Регистрацию производят в изготовленной на- 21010177 заказ камере с 2-3-секундными временами обмена. Раствор для бани готовят без Са 2+, избегая Са 2+индуцированных Clтоков (100 мМ NaCl, 2 мМ KCl, 5 мМ HEPES, 2 мМ BaCl2, рН 7,35). РецепторыNMDA активируют вручную, применяя совместно 1 мМ глутамат и 10 мкМ глицин в течение 30-40 с каждые 2-3 мин в овоциты, блокированные при -70 мВ. Нейронные никотиновые рецепторы активируют,применяя 100 мкМ ацетилхолин в течение 20-30 с каждые 2-3 мин на овоцитах, блокированных при -70 мВ. После получения стабильных контрольных откликов получают полные кривые концентрация-отклик с антагонистами путем предварительной инкубации 6-7 различных концентраций с интервалами log 3. Только результаты от стабильных клеток приемлемы для включения в финальное исследование, а именно, показывающие по меньшей мере 50% восстановление реакций на NMDA после удаления исследуемого антагониста. Несмотря на это, восстановление от действия лекарств не всегда составляет 100% из-за незначительного затухания или разбега в некоторых клетках. Данный эффект, если таковой присутствует, всегда компенсируют, закладывая в исходный % антагонизма при каждой концентрации для контроля и восстановления и допуская линейное временное течение для данного затухания. Все антагонисты оценивают в устойчивом состоянии блокады при 6-7 концентрациях по меньшей мере на 4 клетках. Равновесной блокады достигают в пределах применения 1-3 агонистов в зависимости от концентрации антагонистов. Кинетические эксперименты проводят, применяя различные концентрации ненасыщенных аминоалкилциклогексанов (обычно 5 концентраций по схеме дозирования log 3) в течение 10-20 с при постоянном присутствии глутамата (100 мкМ) и глицина (10 мкМ) в течение 90-180 с в овоцитах Xenopus, экспрессирующих рецепторы NR1a/2A. Перфузионная система, применяемая для данных экспериментов,представляет собой модифицированную овоцитную карусельную систему, которая позволяет быстрое вливание и вымывание агониста и антагониста с периодами замены менее одной секунды. Экспоненциальные зависимости получают, используя программу TIDA для Windows, и большинство откликов хорошо описываются простой экспоненциальной зависимостью. Такую же систему применяют для получения зависимости блокады от напряжения, но раствор в бане содержит флуфенамовую кислоту (100 мкМ) для блокировки эндогенных активированных напряжением и Са 2+-активированных Clтоков. Также Ва 2+(2 мМ) заменяют низкими концентрациями Са 2+ (0,2 мМ). После равновесной блокады при высоких концентрациях антагониста (обычно 10-кратных величинах IC50) получают пять наклонов от -70 мВ до +30 мВ за две с. Аналогичные наклоны получают для растворов в бане и для глутамата без антагониста, до применения антагониста и после восстановления откликов. Утечки в отсутствие глутамата вычитают из кривых для глутамата и глутамата плюс антагонист. Затем определяют зависимость от напряжения,сравнивая кривые для глутамата и глутамата плюс антагонист. Блокировка рецепторов для NMDA и никотина Гиппокампы получают из эмбрионов крыс (Е 20 и Е 21) и переносят в раствор соли с буфером Хэнка,не содержащий кальция и магния (Gibco), на льду. Клетки разъединяют механически в смеси 0,05% ДНКаза/0,3% овомукоид (Sigma) после 8-минутной предварительной инкубации со смесью 0,66% трипсин/0,1% ДНКаза (Sigma). Затем разъединенные клетки центрифугируют при 18g в течение 10 мин, повторно суспендируют в минимальной поддерживающей среде (Gibco) и высевают с плотностью 150000 клетоксм-2 в пластиковые чашки Петри (Falcon) с предварительно нанесенным поли-L-лизином (Sigma). Клетки снабжают минимальной поддерживающей средой с буфером NaHCO3/HEPES с добавлением 5% плодной телячьей сыворотки и 5% лошадиной сыворотки (Gibco) и инкубируют при 37 С, 5% CO2 и 95% влажности. Среду полностью меняют после ингибирования продолжающегося глиального митоза при помощи цитозин-D-арабинофуранозида (20 М Sigma) примерно через 7 дней in vitro. После этого среду заменяют частично дважды в неделю. Регистрацию блокировки рецепторов производят от данных нейронов посредством полированных стеклянных электродов (4-6 МОм) по способу модели целой клетки при комнатной температуре (2022 С) при помощи усилителя ЕРС-7 (List). Исследуемые вещества применяют переключением каналов сделанной на заказ быстрой суперфузионной системы с обычным выходом (время обмена 10-20 мс.). Составные части внутриклеточного раствора следующие (мМ): CsCl (120), ТЕАС 1 (20), EGTA (10), MgCl2(1), CaCl2 (0,2), глюкоза (10), АТФ (2), цАМФ (0,25); рН доводят до 7,3 при помощи CsOH или HCl. Внеклеточные растворы имеют следующий основной состав (мМ): NaCl (140), KCl (3), CaCl2 (0,2), глюкоза(10), HEPES (10), сахароза (4,5), тетродотоксин (ТТХ 310-4). Во всех растворах присутствует глицин (1 М) с концентрацией, достаточной, чтобы вызвать примерно 80-85% активацию рецепторов глицинав. Только результаты от стабильных клеток приемлемы для включения в финальное исследование, а именно, соответствующие восстановлению откликов на NMDA, при их по меньшей мере 75% депрессии исследуемыми антагонистами. Блокировка рецепторов для 5-НТ 3 Клетки N1E-115 приобретают из Европейской коллекции клеточных культур (ЕСАСС, Salisbury,UK) и хранят при -80 С до дальнейшего использования. Клетки высевают с плотностью 100000 клетоксм-2 в пластиковые чашки Петри (Falcon) и снабжают минимальной поддерживающей средой (MEM) с буфером NaHCO3/HEPES с добавлением 15% плодной телячьей сыворотки (Gibco) и инкубируют при- 22010177 37 С, 5% CO2 и 95% влажности. Среду полностью меняют ежедневно. Раз в три дня клетки пересевают в свежие чашки Петри после обработки смесью трипсин-ЭДТА (1% в PBS), повторного суспендирования вMEM и центрифугирования при 1000 об./мин в течение 4 мин. Производят регистрацию блокировки рецепторов при -70 мВ от собранных клеток, через 2-3 дня после посева, посредством полированных стеклянных электродов (2-6 МОм) по способу целой клетки при комнатной температуре (20-22 С) при помощи усилителя ЕРС-7 (List). Составные части внутриклеточного раствора следующие (мМ): CsCl (130), HEPES (10), EGTA (10), MgCl2 (2), CaCl2 (2), К-АТФ (2),Трис-ГТФ (0,2), D-глюкоза (10); рН доводят до 7,3 при помощи CsOH или HCl. Внеклеточные растворы имеют следующий основной состав (мМ): NaCl (124), KCl (2,8), HEPES (10), рН 7,3 регулируют при помощи NaOH или HCl. После установления конфигурации целой клетки собирают клетки со стеклянной подложки и вносят серотонин (10 мкМ), мемантин и ненасыщенные аминоалкилциклогексановые производные с различными концентрациями, применяя устройство для быстрой суперфузии. Для воздействия на собранные клетки раствором, не содержащим или содержащим серотонин, применяют управляемую пьезопреобразователем двухцилиндровую пипетку. Двухсекундный импульс серотонина поступает каждые 60 с. Предполагаемые антагонисты растворяют в дважды дистиллированной воде и разбавляют раствором из бани до требуемой концентрации. Только результаты от стабильных клеток приемлемы для включения в финальное исследование, а именно, демонстрирующие по меньшей мере 50% восстановление откликов на серотонин после удаления соединений. Несмотря на это, восстановление от действия других лекарств не всегда составляет 100% из-за затухания в некоторых клетках (10% за 10 мин). Данный эффект, если таковой присутствует, всегда компенсируют, закладывая в исходный % антагонизма при каждой концентрации для контроля и восстановления и допуская линейное временное течение для данного затухания. Все антагонисты оценивают в устойчивом состоянии блокады при 3-6 концентрациях по меньшей мере на пяти клетках. Равновесной блокады достигают в рамках применения 2-5 агонистов в зависимости от концентрации антагониста.In vivo Антиконвульсивное действие Для исследований максимального электрошока (MES) и двигательной недостаточности используют самок мышей NMP (18-28 г), помещенных по 5 в клетку. Всех животных содержат без ограничения воды и пищи с 12-часовым циклом свет-темнота (свет после 6 ч утра) и регулируемой температуре (200,5 С). Все эксперименты проводят между 10 ч утра и 5 ч вечера. Исследуемые агенты вводят внутрибрюшинно за 30 мин до индукции конвульсий, если не указано по-другому (см. ниже). Все соединения растворяют в 0,9% физиологическом растворе.MES-тест проводят вместе с исследованиями миорелаксантного действия (рефлекс вытяжения) и двигательной координации (вращающийся стержень). Для исследования рефлекса вытяжения мышей помещают вместе с передними лапами на горизонтальный стержень и требуют поместить все 4 лапы на проволоку за 10 с. Для исследования атаксии (двигательной координации) мышей помещают на ускоряющийся вращающийся стержень и требуют оставаться на стержне в течение 1 мин. Только мыши, не достигшие критериев во всех трех повторениях каждого исследования, считаются продемонстрировавшими миорелаксацию или атаксию соответственно. После данных исследований проводят MES (100 Гц,продолжительность шока 0,5 с, интенсивность шока 50 мА, продолжительность импульса 0,9 мс, UgoBasil), осуществляемый при помощи роговичных электродов. Отмечают наличие тонических судорог(тоническое вытягивание задних лап с минимальным углом относительно тела 90). Целью является получение ЭД 50 для всех отмечаемых параметров (антиконвульсивное действие и двигательные побочные эффекты) при применении теста Литифилда-Вилкоксона для количественных величин откликов на дозу. Результат деления ЭД 50 для побочных эффектов (атаксия или миорелаксация) на ЭД 50 для антагонизма электрошоковых конвульсий используют в качестве терапевтического индекса (TI). Статистический анализIC50 в исследованиях блокировки рецепторов и связывания рассчитывают согласно четырехпараметровому логистическому уравнению, используя компьютерную программу Grafit (Erithacus Software,England). Затем определяют значение Ki для исследований связывания по Чену-Прусову. Представленные величины связывания являются средними значениямисреднеквадратичное отклонение из 3-5 определений (каждое проводят дважды). В каждом из in vivo тестов исследуют 4-7 доз антагонистов (5-8 животных на дозу), допуская расчет оцениваемых ЭД 50 согласно прямому анализу (Litchfield и Wilcoxon) с коррекцией для 0-100% эффектов. ЭД 50 представлены с 95% доверительным интервалом (CL). Для сравнения in vitro эффективности и invivo антиконвульсивного действия применяют корреляционный анализ по Пирсону (Pearson product moment correlation analysis) (Sigma Stat, Jandel Scientific).MRZ-номера используют для представления химических названий. MRZ-номера и соответствующие химические названия представлены в "списке MRZ". Список MRZ Связывание МК-80 Все соединения замещают [3 Н]-(+)-МК-801 со значениями Ki от 1 до 83 мкМ (смотри табл. 1). Таблица 1 Результаты для типичных соединений приведены на фиг. 1. Экспрессия подтипа рецепторов NMDA в овоцитах XENOPUS Блокаду рецепторов NMDA посредством MRZ 2/759 определяют, применяя различные концентрации (от 0,1 до 100 мкМ при схеме дозирования log 3) в течение 10 с, при постоянном присутствии глутамата (100 мкМ) и глицина (10 мкМ), при -70 мВ в течение 100 с в овоцитах Xenopus, экспрессирующих рецепторы NR1a/2A (фиг. 2, левая). Эффективность MRZ 2/759 (IC50=1,99 мкМ, Hill 0,75) определяют,составляя график процента блокады относительно концентрации антагониста и затем оптимизируя кривую в соответствии с логистическим уравнением (фиг. 2, правая). Фиксация бляшек Отклики внутренних токов свежеразъединенных нейронов гиппокампа в устойчивом состоянии наNMDA (200 М с глицином 1 М при -70 мВ) подвергают антагонистическому воздействию MRZ 2/759. Пики и токи в устойчивом состоянии подвержены воздействию в одинаковой степени, что делает маловероятным опосредование их эффектов на сайте глицинав. Сильную поддержку неконкурентной природы данного антагонизма обеспечивает ясная зависимость его блокады от применения и напряжения. См. фиг. 3.In vivo Антиконвульсивное действие Результаты MES и миорелаксационного действия представлены в табл. 2. Таблица 2 В заключение, из предыдущего ясно, что настоящее изобретение касается новых, полезных и неожиданных применений и использований соединений настоящего изобретения, которые согласно настоящему изобретению содержат активный агент, а также их новых фармацевтических композиций и способов их получения и лечения с их использованием, все они обладают характеристиками и преимуществами, подробнее перечисленными выше. Как очевидно из приведенного текста, высокая степень активности активного агента настоящего изобретения и его композиций является показателем применимости для людей, а также низших животных на основе его полезной активности. Однако клиническая оценка для людей не завершена. Несомненно, понятно, что распределение или продажа любого соединения или композиции, подпадающей под область настоящего изобретения, для применения людьми конечно будет основана на предварительном одобрении правительственных органов, таких как U.S. Federal Food and Drug Administration, которые отвечают за это и уполномочены принимать решения по таким вопросам. Выводы Данные ненасыщенные 1-аминоалкилциклогексаны представляют новый класс системноактивных неконкурентных антагонистов рецепторов NMDA с быстрыми кинетиками блокировки/разблокирования и сильной зависимостью от напряжения. С точки зрения их умеренной эффективности и связанных с этим быстрых кинетик они будут полезными терапевтическими агентами в широком диапазоне нарушений ЦНС, которые включают расстройства глутаматергической передачи. Таким образом, данные соединения находят применение при лечении следующих нарушений организма животного, в особенности человека. 1. Эксцитотоксичность, такая как ишемия при ударе, травма, гипоксия, гипогликемия, глаукома и печеночная энцефалопатия. 2. Хронические нейродегенеративные заболевания, такие как болезнь Альцгеймера, сосудистая деменция, болезнь Паркинсона, болезнь Хантингтона, множественный склероз, боковой амиотрофический склероз, СПИД-нейродегенерация, оливопонтоцеребеллярная атрофия, синдром Туретта, двигательное нейронное заболевание, митохондриальная дисфункция, синдром Корсакова и болезнь КрейтцфельдтаЯкоба. 3. Другие нарушения, относящиеся к длительным пластичным изменениям в центральной нервной системе, выбранные из хронической боли, лекарственной переносимости, зависимости и аддикции (например, опиоидной, кокаиновой, бензодиазепиновой, никотиновой и алкогольной). 4. Эпилепсия, поздняя дискинезия, шизофрения, состояние тревоги, депрессия, острая боль, спастичность и ощущение шума в ушах. Кроме того, обнаружено, что данные соединения являются также антагонистами нейронных никотиновых рецепторов и рецепторов 5-HT3. Таким образом, соединения данного изобретения находят применение при лечении нарушений в организме животного, в особенности человека, при опосредованных никотиновыми и 5-НТ 3 рецепторами показаниях для симптоматических и нейрозащитных целей (например, для лечения рвоты, злоупотребления никотином, шизофрении, мозжечкового тремора, слизистого колита, мигрени, депрессивных нарушений, когнитивных нарушений, психоза, связанного с лечением болезни Паркинсона, и нарушений аппетита). Кроме того, как уже установлено, благодаря своему аминному заместителю, по меньшей мере, частично соединения настоящего изобретения также эффективны при показаниях, не связанных с указанным выше механизмом действия, демонстрируя иммуномодуляторную активность, антималярийную и антитрипаносомальную эффективность, активность против вируса Borna, против вируса герпеса и против вируса гепатита С. Способ лечения организма животного соединением данного изобретения с целью ингибирования развития или облегчения выбранного в нем недомогания представляет, как установлено ранее, любой обычно приемлемый фармацевтический способ, применяющий выбранную дозировку, которая является эффективной при облегчении конкретного недомогания, которое требуется облегчить. Применение соединений настоящего изобретения в производстве лекарственного препарата для лечения животного с целью ингибирования развития или облегчения выбранных недомоганий или состояний, в частности недомоганий или состояний, восприимчивых к лечению антагонистом рецепторовNMDA, антагонистом нейронных никотиновых рецепторов, антагонистом 5-HT3 или соединением, де- 26010177 монстрирующим иммуномодуляторную активность, антималярийную и антитрипаносомальную эффективность, активность против вируса Borna, против вируса герпеса и против вируса гепатита С, осуществляют обычным способом, включающим стадию смешивания эффективного количества соединения данного изобретения с фармацевтически приемлемым разбавителем, наполнителем или носителем, и способ лечения, фармацевтические композиции и применение соединения настоящего изобретения в производстве лекарственного препарата. Типичные фармацевтические композиции, полученные смешиванием активного ингредиента с подходящим фармацевтически приемлемым наполнителем, разбавителем или носителем, включают таблетки, капсулы, растворы для инъекций, жидкие препараты для перорального применения, аэрозольные препараты, TDS-препараты и препараты в виде наночастиц, обеспечивая, таким образом, лекарственные препараты для перорального приема, введения путем инъекции или кожного применения в соответствии со сказанным выше. Понятно, что данное изобретение не ограничено показанными и описанными точными подробностями операций или точными композициями, способами, методиками или вариантами, так как специалисту в данной области ясны очевидные модификации и эквиваленты, и, следовательно, данное изобретение ограничено только всей областью, которую можно юридически привести в соответствие с приложенной формулой изобретения. Ссылки 1. R.L. Frank, H.K. Hall (1950) J. Am. Chem. Soc. 22:1645-1648. 2. G.A. Hiegel, P. Burk. (1973) J. Org. Chem. 38:3637-3639. 3. N.F. Firrell, P.W. Hickmott. (1970) J. Chem. Soc. Q716-719. 4. G.H. Posner, L.L Frye. (1984) Isr. J. Chem. 24:88-92. 5. G.L. Lemiere, T.A. van Osselaer, F.C. Anderweireldt. (1978) Bull. Soc. Chim. Belg. 87:771-782. 6. H.O. House, J.M. Wilkins. (1976) J. Org. Chem. 41:(25) 4031-4033. 7. A.R. Greenaway, W.B. Whalley. (1976) J. Chem. Soc. P.T. 1.:1385-1389. 8. S. Matsuzawa, Y. Horiguchi, E. Nakamura, I. Kuwajima. (1989) Tetrahedron 45.:(2) 349-362. 9. H.O. House, W.F. Fischer. (1968) J. Org. Chem. 33:(3) 949-956. 10. Chiurdoglu, G., Maquestlau, A. (1954) Bull. Soc. Chim. Belg. 63: 357-378. 11. Zaidlewicz, M., Uzarewicz A., Zacharewicz, W. (1964) Roczniki Chem. 38: 591-597. 12. Crossley, A.W., Gilling, С. (1910) J. Chem. Soc. 2218. 13. Zaidlewicz, M., Uzarewicz, A. (1971) Roczniki Chem. 45: 1187-1194. 14. Lutz, E.T., van der Maas, J.H. (1981) Spectrochim. Acta, A. 38A: 283. 15. Lutz, E.T., van der Maas, J.H. (1981) Spectrochim. Acta, A. 37A: 129-134. 16. Ramalingam K., Balasubramanian, M., Baliah, V. (1972) Indian J. Chem. 10: 366-369. 17. Hamlin, K.E., Freifelder, M. (1953) J. Am. Chem. Soc. 75: 369-373. 18. Hassner, A., Fibinger, R., Andisik, D. (1984) J. Org. Chem. 49: 4237-4244. 19. W. Danysz, C.G. Parsons, I. Bresink, G. Quack (1995) Drug News Perspect. 8:261-277. 20. J.D. Leander, R.R. Lawson, P.L., Ornstein, D.M. Zimmerman (1988) Brain Res. 448:115-120. 21. C.G. Parsons, G. Quack, I. Bresink, L. Baran, E. Przegafinski, W. Kostowski, P. Krzascik, S. Hartmann, W. Danysz (1995). Neuropharmacology 34:1239-1258. 22. M.A. Rogawski (1993) Trends Pharmacol. Sci. 14:325-331. 23. Booher J. and Sensenbrenner M. (1972). Neurobiology 2:97-105. 24. Dichter, M. (1987) Brain Research 149:279. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение, выбранное из соединений формулы In+m=0, 1 или 2; А выбран из группы, содержащей линейный или разветвленный низший алкил(C1-C6), линейный или разветвленный низший алкенил(C2-C6) и линейный или разветвленный низший алкинил(C2-С 6);R1 и R2 независимо выбраны из группы, содержащей водород, линейный или разветвленный низший алкил(C1-C6), линейный или разветвленный низший алкенил(C2-C6) и линейный или разветвленный низший алкинил(C2-C6);R3 и R4 независимо выбраны из группы, содержащей водород, линейный или разветвленный низший алкил(C1-C6), линейный или разветвленный низший алкенил(C2-C6) и линейный или разветвленный низший алкинил(C2-C6), или вместе образуют алкилен(C2-C10) или алкенилен(С 2-C10), или вместе с N образуют необязательно (C1-C6)алкил- и/или (C2-С 6)алкенилзамещенный 3-7-членный азациклоалкан или азациклоалкен;R5 независимо выбран из группы, содержащей линейный или разветвленный низший алкил(C1-C6),линейный или разветвленный низший алкенил(C2-C6) и линейный или разветвленный низший алкинил(C2-C6), или R5 объединяется с углеродом, к которому он присоединен, и соседним углеродом, образуя двойную связь;Rp, Rq, Rr и Rs независимо выбраны из группы, содержащей водород, линейный или разветвленный низший алкил(C1-C6), линейный или разветвленный низший алкенил(C2-C6) и линейный или разветвленный низший алкинил(C2-C6), или Rp, Rq, Rr и Rs независимо могут объединяться с углеродом, к которому они присоединены, и соседним углеродом, образуя двойную связь, или Rp, Rq, Rr и Rs независимо могут образовывать двойную связь с U или Y, к которому они присоединены; при условии, что U-V-W-X-Y-Z выбран из циклогексана,циклогекс-2-ена,циклогекс-3-ена,циклогекса-1,4-диена,циклогекса-1,5-диена,циклогекса-2,4-диена и циклогекса-2,5-диена,и при условии, что по меньшей мере один из Rp и Rq не является водородом и по меньшей мере один из Rr и Rs не является водородом,и при условии, что U-Z представляет собой циклогексан, если по меньшей мере один из -(A)n(CR1R2)m-, R3, R4, R5, Rp, Rq, Rr и Rs представляет собой линейный или разветвленный низший алкенил(C2-C6) или линейный или разветвленный низший алкинил(C2-C6); и его оптические изомеры и фармацевтически приемлемые аддитивные соли кислот или оснований. 2. Соединение по п.1, выбранное из группы, включающей 1-этенил-3,3,5,5-тетраметилциклогексиламин,2-(3,3,5,5-тетраметилциклогексилиден)этанамин,1-амино-3,3,5-триметил-2-циклогексен,1,3,5,5-тетраметил-2-циклогексен-1-амин 1-аллил-3,3,5,5-тетраметилциклогексанамин,1-(3,3,5,5-тетраметилциклогексилиден)-2-пропанамин,1-(3,3-диэтил-5,5-диметилциклогексилиден)-2-пропанамин,цис-3-винил-1,3,транс-5-триметилциклогексиламин,2-метил-1-(3,3,5,5-тетраметил-1-циклогексен-1-ил)-2-пропанамин,1-(1-аллил-3,3,5,5-тетраметилциклогексил)пиперидин,2-(1-винил-3,3,5,5-тетраметилциклогексил-1)этиламин,1-[3,3,5,5-тетраметил-1-(3-метил-2-бутенил)циклогексил]пиперидин,1-[3,3,5,5-тетраметил-1-(2-пропинил)циклогексил]пиперидин,2-(1,3,3,5,5-пентаметилциклогексил)-4-пентениламин,3-(3,3,5,5-тетраметилциклогексилиден)пропанамин,2-метил-1-(3,3,5,5-тетраметилциклогексилиден)-2-пропанамин,2-(3,3,5,5-тетраметилциклогексилиден)пропанамин,N-метил-1-этенил-3,3,5,5-тетраметилциклогексиламин,N-аллил-1,3,3,5,5-пентаметилциклогексанамин и их оптические изомеры и фармацевтически приемлемые аддитивные соли кислот или оснований. 3. Фармацевтическая композиция для лечения животного с целью ингибирования развития или облегчения выбранных недомоганий или состояний, в частности недомоганий или состояний, восприимчивых к лечению антагонистом рецепторов 5-HT3, NMDA или антагонистом нейронных никотиновых рецепторов, содержащая соединение по п.1 или 2 в комбинации с одним или более фармацевтически приемлемыми разбавителями, наполнителями и/или носителями. 4. Способ лечения животных с целью облегчения состояния, излечиваемого антагонистом NMDA,включающий стадию введения животному некоторого количества соединения, выбранного из соединений формулы In+m=0, 1 или 2; А выбран из группы, содержащей линейный или разветвленный низший алкил(C1-C6), линейный или разветвленный низший алкенил(C2-C6) и линейный или разветвленный низший алкинил(C2-C6);R1 и R2 независимо выбраны из группы, содержащей водород, линейный или разветвленный низший алкил(C1-C6), линейный или разветвленный низший алкенил(C2-C6) и линейный или разветвленный низший алкинил(C2-C6);R3 и R4 независимо выбраны из группы, содержащей водород, линейный или разветвленный низший алкил(C1-C6), линейный или разветвленный низший алкенил(C2-C6) и линейный или разветвленный низший алкинил(C2-C6), или вместе образуют алкилен(C2-C10) или алкенилен(C2-C10), или вместе с N образуют необязательно (C1-C6)алкил- и/или (C2-C6)алкенилзамещенный 3-7-членный азациклоалкан или азациклоалкен;R5, Rp, Rq, Rr и Rs независимо выбраны из группы, содержащей водород, линейный или разветвленный низший алкил(C1-C6), линейный или разветвленный низший алкенил(C2-C6) и линейный или разветвленный низший алкинил(C2-C6), или R5, Rp, Rq, Rr и Rs независимо могут объединяться с углеродом,к которому они присоединены, и соседним углеродом, образуя двойную связь, или Rp, Rq, Rr и Rs независимо могут образовывать двойную связь с U или Y, к которому они присоединены; при условии, что U-V-W-X-Y-Z выбран из циклогексана,циклогекс-1-ена,циклогекс-2-ена,циклогекс-3-ена,циклогекса-1,3-диена,циклогекса-1,4-диена,циклогекса-1,5-диена,циклогекса-2,4-диена и циклогекса-2,5-диена,и при условии, что U-Z представляет собой циклогексан, если по меньшей мере один из -(A)n(CR1R2)m-, R3, R4, R5, Rp, Rq, Rr представляет собой линейный или разветвленный низший алкенил(С 2-C6) или линейный или разветвленный низший алкинил(C2-C6); его оптических изомеров и фармацевтически приемлемых аддитивных солей кислот или оснований,которые эффективны для облегчения указанного состояния. 5. Способ лечения животных с целью облегчения состояния, излечиваемого антагонистом NMDA,выбранного из группы, включающей эксцитотоксичность, выбранную из ишемии при ударе, травмы,гипоксии, гипогликемии, глаукомы и печеночной энцефалопатии,хронические нейродегенеративные заболевания, выбранные из болезни Альцгеймера, сосудистой деменции, болезни Паркинсона, болезни Хантингтона, множественного склероза, бокового амиотрофического склероза, СПИД-нейродегенерации, оливопонтоцеребеллярной атрофии, синдрома Туретта, двигательного нейронного заболевания, митохондриальной дисфункции, синдрома Корсакова и болезни Крейтцфельдта-Якоба,другие нарушения, относящиеся к длительным пластичным изменениям в центральной нервной системе, выбранные из хронической боли, лекарственной переносимости, зависимости и аддикции (например, опиоидной, кокаиновой, бензодиазепиновой, никотиновой и алкогольной), и эпилепсию, позднюю дискинезию, L-DOPA-индуцированную дискинезию, шизофрению, состояние тревоги, депрессию, острую боль, спастичность и ощущение шума в ушах,включающий стадию введения животному некоторого количества соединения, выбранного из соединений формулы In+m=0, 1 или 2; А выбран из группы, содержащей линейный или разветвленный низший алкил(C1-C6), линейный или разветвленный низший алкенил(C2-C6) и линейный или разветвленный низший алкинил(C2-C6);R1 и R2 независимо выбраны из группы, содержащей водород, линейный или разветвленный низший алкил(C1-C6), линейный или разветвленный низший алкенил(C2-C6) и линейный или разветвленныйR3 и R4 независимо выбраны из группы, содержащей водород, линейный или разветвленный низший алкил(C1-C6), линейный или разветвленный низший алкенил(C2-C6) и линейный или разветвленный низший алкинил (C2-C6), или вместе образуют алкилен(C2-C10) или алкенилен(C2-C10), или вместе с N образуют необязательно (C1-C6)алкил- и/или (C2-C6)алкенилзамещенный 3-7-членный азациклоалкан или азациклоалкен;R5, Rp, Rq, Rr и Rs независимо выбраны из группы, содержащей водород, линейный или разветвленный низший алкил(C1-C6), линейный или разветвленный низший алкенил(C2-C6) и линейный или разветвленный низший алкинил(C2-C6), или R5, Rp, Rq, Rr и Rs независимо могут объединяться с углеродом,к которому они присоединены, и соседним углеродом, образуя двойную связь, или Rp, Rq, Rr и Rs независимо могут образовывать двойную связь с U или Y, к которому они присоединены; при условии, что U-V-W-X-Y-Z выбран из циклогексана,циклогекс-1-ена,циклогекс-2-ена,циклогекс-3-ена,циклогекса-1,3-диена,циклогекса-1,4-диена,циклогекса-1,5-диена,циклогекса-2,4-диена и циклогекса-2,5-диена,и при условии, что U-Z представляет собой циклогексан, если по меньшей мере один из -(A)n(CR1R2)m-,R3, R4, R5, Rp, Rq, Rr представляет собой линейный или разветвленный низший алкенил(C2-C6) или линейный или разветвленный низший алкинил(C2-C6); его оптических изомеров и фармацевтически приемлемых аддитивных солей кислот или оснований,которые эффективны для облегчения указанного состояния. 6. Способ лечения животных с целью облегчения состояния, излечиваемого антагонистом рецептора 5-HT3, включающий стадию введения животному некоторого количества соединения, выбранного из соединений формулы In+m=0, 1 или 2; А выбран из группы, содержащей линейный или разветвленный низший алкил(C1-C6), линейный или разветвленный низший алкенил(C2-C6) и линейный или разветвленный низший алкинил(C2-C6);R1 и R2 независимо выбраны из группы, содержащей водород, линейный или разветвленный низший алкил(C1-C6), линейный или разветвленный низший алкенил(C2-C6) и линейный или разветвленный низший алкинил(C2-C6);R3 и R4 независимо выбраны из группы, содержащей водород, линейный или разветвленный низший алкил(C1-C6), линейный или разветвленный низший алкенил(C2-C6) и линейный или разветвленный низший алкинил(C2-C6), или вместе образуют алкилен(С 2-C10) или алкенилен(С 2-C10), или вместе с N образуют необязательно (C1-C6)алкил- и/или (С 2-C6)алкенилзамещенный 3-7-членный азациклоалкан или азациклоалкен;R5, Rp, Rq, Rr и Rs независимо выбраны из группы, содержащей водород, линейный или разветвленный низший алкил(С 1-C6), линейный или разветвленный низший алкенил(С 2-C6) и линейный или разветвленный низший алкинил(С 2-C6), или R5, Rp, Rq, Rr и Rs независимо могут объединяться с углеродом,к которому они присоединены, и соседним углеродом, образуя двойную связь, или Rp, Rq, Rr и Rs независимо могут образовывать двойную связь с U или Y, к которому они присоединены; при условии, что U-V-W-X-Y-Z выбран из циклогексана,циклогекс-1-ена,циклогекс-2-ена,циклогекс-3-ена,циклогекса-1,3-диена,циклогекса-1,4-диена,- 30
МПК / Метки
МПК: A61K 31/13, C07C 211/40, A61P 25/28, C07C 211/35, C07D 211/06
Метки: никотиновых, nmda, 5-ht3, насыщенные, нейронных, 1-аминоалкилциклогексановые, рецепторов, антагонисты
Код ссылки
<a href="https://eas.patents.su/30-10177-nasyshhennye-1-aminoalkilciklogeksanovye-antagonisty-nmda-5-ht3-i-nejjronnyh-nikotinovyh-receptorov.html" rel="bookmark" title="База патентов Евразийского Союза">Насыщенные 1-аминоалкилциклогексановые антагонисты nmda, 5-ht3 и нейронных никотиновых рецепторов</a>
Предыдущий патент: Соль фосфорной кислоты и 5-[4-[2-(n-метил-n-(2-пиридил)амино)этокси] бензил]тиазолидин-2, 4-диона и способ её получения
Следующий патент: Разрыхляющаяся при пероральном приёме фармацевтическая композиция, содержащая рисперидон
Случайный патент: Ингибиторы агрегации амилоидных белков, их применение (варианты), композиция на их основе и способ визуализации амилоидных отложений