Фармацевтические препараты, способы и схемы приёма для лечения и предупреждения острых коронарных синдромов
Номер патента: 10134
Опубликовано: 30.06.2008
Авторы: Хартман Дэниел, Бисгайер Чарльз Л., Родригеса Венди В., Йоханссон Ян, Лалвани Нарендра Д.
Формула / Реферат
1. Способ лечения острых коронарных синдромов у субъекта, нуждающегося в этом, включающий введение комплекса аполипопротеин A-I Milano:1-пальмитоил-2-олеоил-sn-глицеро-3-фосфохолин (комплекс Apo А-IМ:РОРС) в дозе от примерно 1 до примерно 100 мг белка/кг, причем указанный способ облегчает расстройства, связанные с острым коронарным тромбозом.
2. Способ по п.1, где комплекс Apo А-IМ:РОРС вводят субъекту в дозе примерно 15 мг/кг.
3. Способ по п.1, где комплекс Apo А-IМ:РОРС вводят субъекту в дозе примерно 45 мг/кг.
4. Способ по п.1, где комплекс Apo А-IМ:РОРС вводят субъекту в дозе от примерно 15 до примерно 45 мг/кг.
5. Способ по п.1, где Apo A-I Milano представляет собой рекомбинантный Apo A-I Milano.
6. Способ по п.1, где комплекс Apo А-IМ:РОРС состоит из аполипопротеина A-I Milano и 1-пальмитоил-2-олеоил-sn-глицеро-3-фосфохолина в соотношении масса белка/масса липида примерно 1:1.
7. Способ по п.1, где комплекс Apo А-IМ:РОРС представляет собой стерильный жидкий фармацевтический препарат.
8. Способ по п.7, где фармацевтический препарат вводят субъекту в дозе примерно 15 мг/кг.
9. Способ по п.7, где фармацевтический препарат вводят субъекту в дозе примерно 45 мг/кг.
10. Способ по п.7, где фармацевтический препарат вводят субъекту 1 раз в неделю в течение примерно 6, примерно 5, примерно 4, примерно 3, примерно 2 месяцев или примерно 1 месяца.
11. Способ по п.7, где фармацевтический препарат вводят субъекту примерно каждые сутки в течение примерно 1 месяца.
12. Способ по п.7, где фармацевтический препарат вводят субъекту примерно каждые 3 суток в течение периода времени от примерно 1 месяца до примерно 6 месяцев.
13. Способ по п.7, где фармацевтический препарат вводят примерно каждые 10 суток в течение периода времени от примерно 1 месяца до примерно 6 месяцев.
14. Способ по п.7, где фармацевтический препарат вводят примерно каждые 14 суток в течение периода времени от примерно 1 месяца до примерно 6 месяцев.
15. Способ по п.1, дополнительно включающий хирургическое вмешательство.
16. Способ по п.15, где хирургическое вмешательство включает в себя чрескожную транслюминальную коронарную ангиопластику или аортокоронарное шунтирование.
17. Способ по п.1, дополнительно включающий введение другого лекарства для лечения, предупреждения или облегчения заболеваний, расстройств, симптомов или боли, ассоциированных с острыми коронарными синдромами.
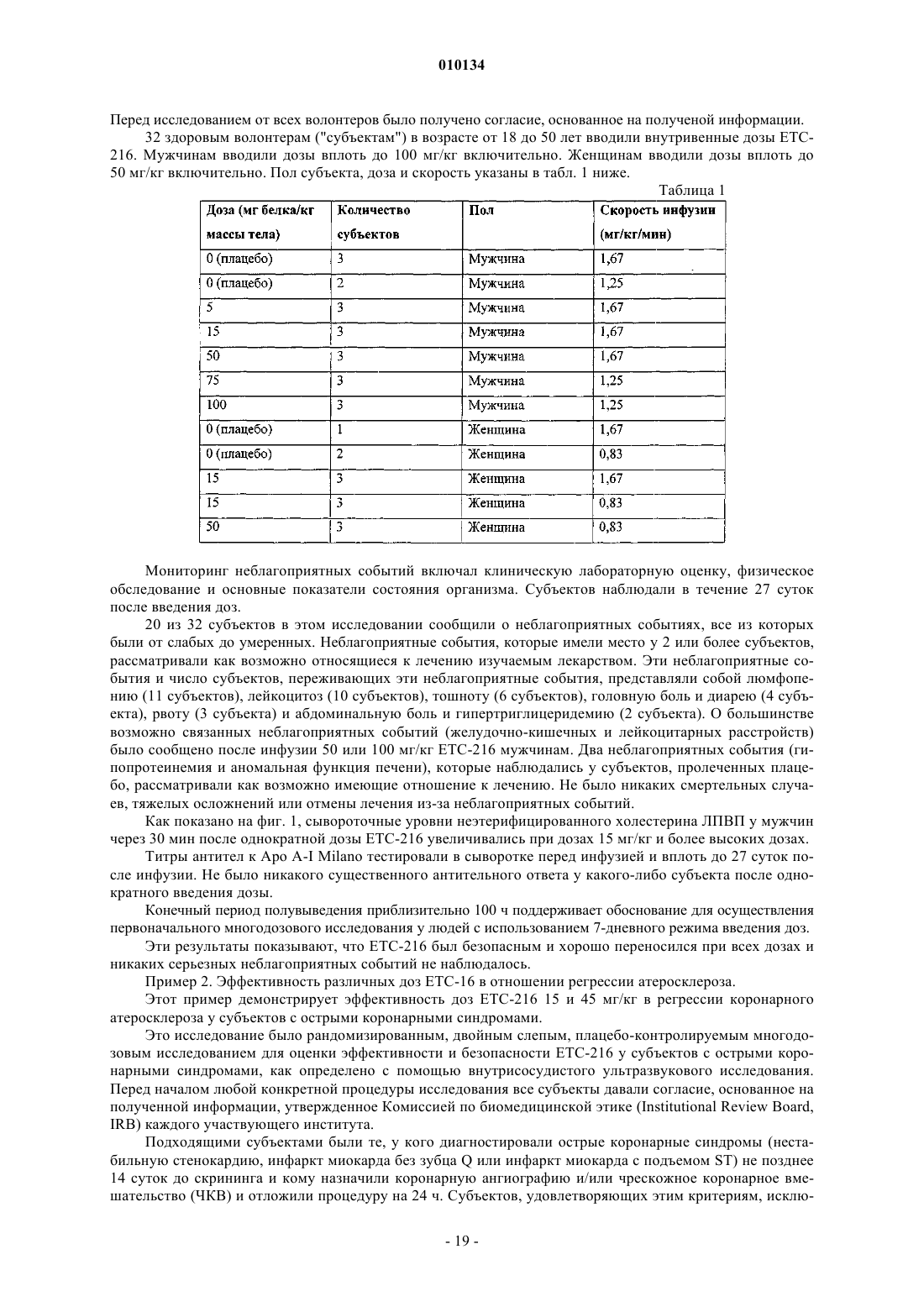
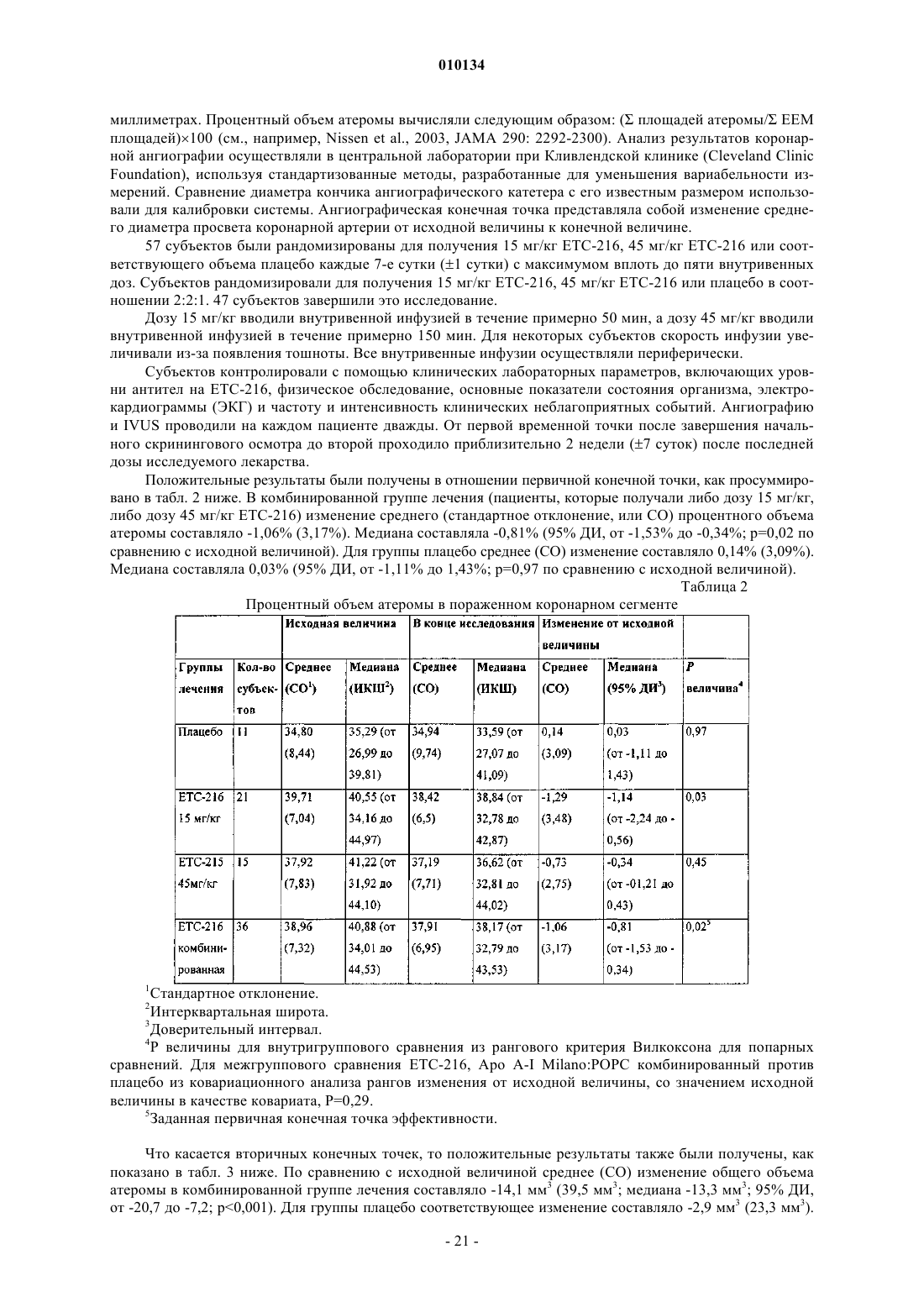
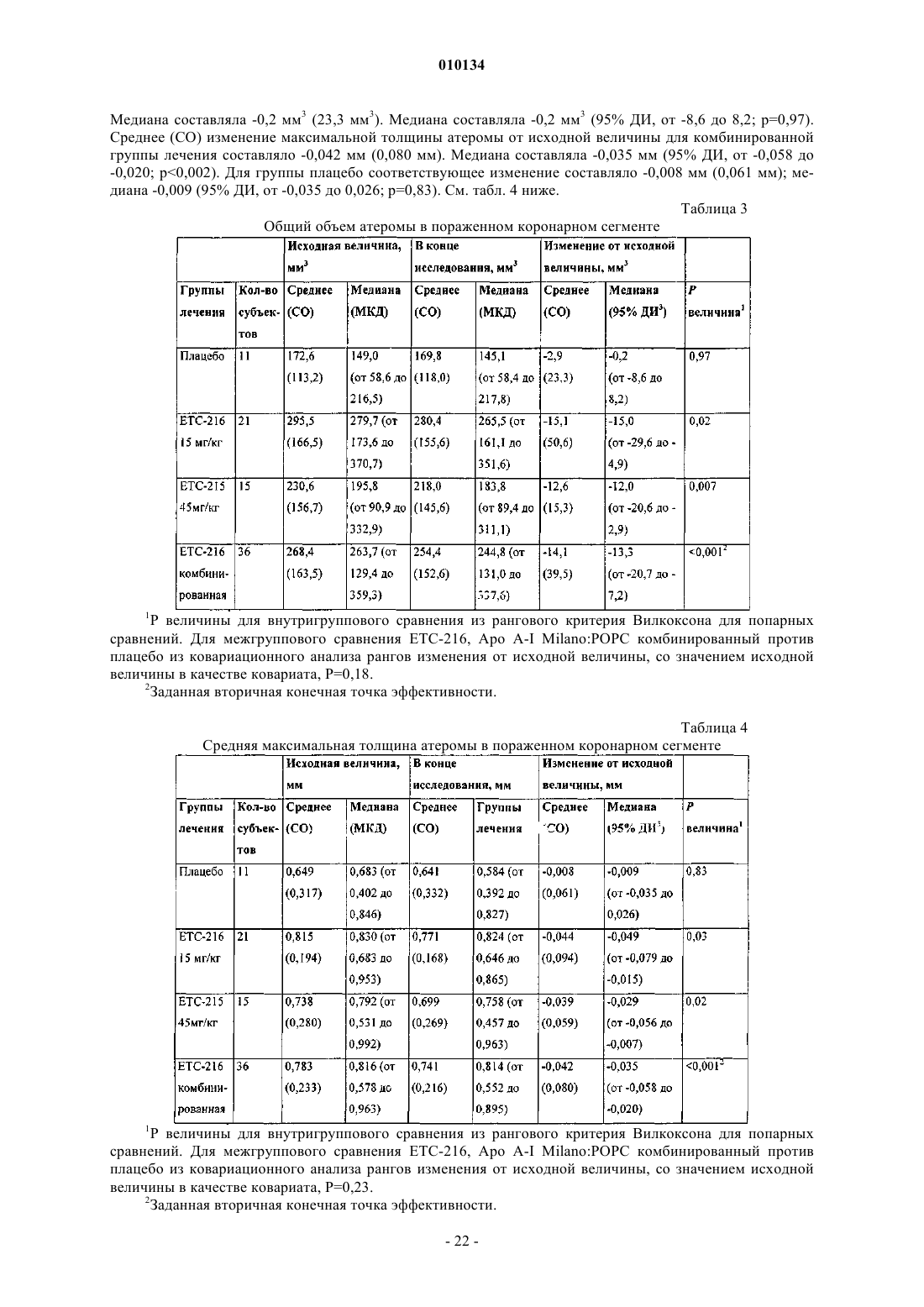
18. Способ по п.1, где процентный объем атеромы в пораженном сосуде субъекта уменьшается на величину от примерно -0,73 до примерно -1,29%.
19. Способ по п.1, где общий объем атеромы в пораженном сосуде субъекта уменьшается на величину от примерно -15,1 до примерно -12,6 мм3.
20. Способ по п.1, где средняя максимальная толщина атеромы в пораженном коронарном сегменте субъекта уменьшается на величину от примерно -0,039 до -0,044 мм.
21. Способ по п.7, где фармацевтический препарат вводят внутривенно.
22. Способ по п.21, где фармацевтический препарат вводят в течение примерно 1 ч.
23. Способ по п.21, где фармацевтический препарат вводят в течение примерно 3 ч.
24. Способ по п.7, где фармацевтический препарат содержит Apo A-I Milano, РОРС, сахарозоманнитный носитель и фосфатный буфер.
25. Способ по п.24, где сахарозоманнитный носитель состоит из сахарозы в количестве от примерно 6,0 до примерно 6,4% и маннита в количестве от примерно 0,8 до примерно 1%.
26. Способ по п.25, где сахарозоманнитный носитель состоит из примерно 6,2% сахарозы и примерно 0,9% маннита.
27. Способ по п.7, где фармацевтический препарат имеет рН от примерно 7,0 до примерно 7,8.
28. Способ по п.27, где рН составляет примерно 7,5.
29. Способ по п.7, где фармацевтический препарат содержит от примерно 12 до примерно 18 мг/мл Apo A-I Milano.
30. Способ по п.7, где фармацевтический препарат содержит от примерно 11 до примерно 17 мг/мл РОРС.
31. Способ по п.7, где фармацевтический препарат содержит менее 6000 частиц размером более 10 мкм на 50 мл.
32 Способ по п.7, где фармацевтический препарат содержит менее 600 частиц размером более 25 мкм на 50 мл.
33. Способ по п.7, где фармацевтический препарат имеет осмоляльность от примерно 280 до примерно 320 мОсм.
34. Способ по п.33, где фармацевтический препарат имеет осмоляльность примерно 290 мОсм.
35. Способ уменьшения атеросклеротической бляшки у субъекта, нуждающегося в этом, включающий, по меньшей мере, однократное введение субъекту 45 мг/кг комплекса рекомбинантный Apo A-I Milano:POPC.
36. Способ по п.35, где комплекс рекомбинантный Apo A-I Milano:POPC вводят 1 раз в неделю, 1 раз в месяц или 1 раз в год.
37. Способ по п.35, где комплекс рекомбинантный Apo A-I Milano:POPCвводят 1 раз в неделю в течение примерно 3-5 недель.
38. Способ по п.35, дополнительно включающий, по меньшей мере, однократное введение субъекту дозы 15 мг/кг комплекса рекомбинантный Apo A-I Milano:POPC.
39. Способ по п.38, где комплекс вводят 1 раз в неделю, 1 раз в месяц или 1 раз в год.
40. Способ по п.35, где субъекта также лечат другим лекарством для лечения, предупреждения или облегчения заболеваний, расстройств, симптомов или боли, ассоциированных с острыми коронарными синдромами.
41. Способ по п.40, где лекарство представляет собой статин, b-блокатор, ингибитор АПФ (ангиотензин-превращающего фермента), антитромботическое средство, вазодилататор или их комбинацию.
42. Жидкий фармацевтический препарат, содержащий комплекс рекомбинантный Apo A-I Milano или его вариант:1-пальмитоил-2-олеоил-sn-глицеро-3-фосфохолин в буфере, содержащем от примерно 6,0 до примерно 6,4% сахарозы, дополнительно содержащем от примерно 0,8 до примерно 1% маннита, имеющем рН от примерно 7,0 до примерно 7,8.
43. Фармацевтический препарат по п.42, содержащий примерно 6,2% сахарозы.
44. Фармацевтический препарат по п.42, содержащий примерно 0,9% маннита.
45. Фармацевтический препарат по п.42, где рН составляет примерно 7,5.
46. Фармацевтический препарат по п.42, где концентрация rApo A-I Milano составляет от примерно 12 до примерно 18 мг на мл указанного буфера.
47. Фармацевтический препарат, содержащий рекомбинантный Apo A-I Milano или его вариант в виде комплекса с 1-пальмитоил-2-олеоил-sn-глицеро-3-фосфохолином и фосфатный буфер, имеющий рН от примерно 7,0 до примерно 7,8, содержащий 2% глюкозы и 4 мМ фосфата натрия.
48. Фармацевтический препарат по п.47, содержащий фосфатный буфер для достижения рН примерно 7,5.
49. Фармацевтический препарат по п.42 или 47, где рекомбинантный Apo A-I Milano представляет собой Apo A-I Milano с консервативными заменами.
50. Фармацевтический препарат по п.42 или 47, где рекомбинантный Apo A-I Milano и РОРС образуют комплекс рекомбинантный Apo A-I Milano:POPC в соотношении 1:0,95 (масса белка/масса липида).
51. Фармацевтический препарат по п.42 или 47, содержащий менее 6000 частиц размером более 10 мкм на 50 мл.
52. Фармацевтический препарат по п.42 или 47, содержащий менее 600 частиц размером более 25 мкм на 50 мл.
53. Фармацевтический препарат по п.42 или 47, где осмоляльность составляет от примерно 280 до примерно 320 мОсм.
54. Фармацевтический препарат по п.53, где осмоляльность составляет примерно 290 мОсм.
55. Фармацевтический препарат по п.42 или 47, который является стерильным.
56. Фармацевтический препарат по п.42 или 47, который является замороженным.
57. Фармацевтический препарат по п.42 или 47, который находится в стерильном флаконе, стерильном предварительно заполненном мешке или предварительно заполненном шприце.
58. Лиофилизированный фармацевтический препарат, содержащий:
а) рекомбинантный Apo A-I Milano или его вариант в виде комплекса с 1-пальмитоил-2-олеоил-sn-глицеро-3-фосфохолином;
б) от примерно 6,0 до примерно 6,4% сахарозы и
в) от примерно 0,8 до примерно 1% маннита.
59. Фармацевтический препарат по п.58, содержащий примеЁэю 6,2% сахарозы.
60. Фармацевтический препарат по п.58, содержащий примерно 0,9% маннита.
61. Фармацевтический препарат по п.58, дополнительно содержащий буфер, который имеет рН примерно 7,5.
62. Фармацевтический препарат по п.58, где рекомбинантный Apo A-I Milano представляет собой Apo A-I Milano с консервативными заменами.
63. Фармацевтический препарат по п.58, где концентрация РОРС составляет от примерно 11 до примерно 17 мг/мл.
64. Фармацевтический препарат по п.58, где рекомбинантный Apo A-I Milano и РОРС образуют комплекс рекомбинантный Apo A-I Milano:РОРС в соотношении 1:0,95 (масса белка/масса липида).
65. Фармацевтический препарат по п.58, содержащий менее 6000 частиц размером более 10 мкм на 50 мл.
66. Фармацевтический препарат по п.58, содержащий менее 600 частиц размером более 25 мкм на 50 мл.
67. Фармацевтический препарат по п.58, где осмоляльность составляет от примерно 280 до примерно 320 мОсм.
68. Фармацевтический препарат по п.67, где осмоляльность составляет примерно 290 мОсм.
69. Фармацевтический препарат по п.58, который является стерильным.
70. Фармацевтический препарат по п.58, который находится в стерильном флаконе, стерильном предварительно заполненном мешке или предварительно заполненном шприце.
71. Способ лечения ишемической реперфузии у субъекта, нуждающегося в этом, включающий введение комплекса аполипопротеин A-I Milano:1-пальмитоил-2-олеоил-sn-глицеро-3-фосфохолин (комплекс Apo А-IМ:РОРС) в дозе примерно 15 мг белка/кг.
72. Способ лечения ишемической реперфузии у субъекта, нуждающегося в этом, включающий введение комплекса аполипопротеин A-I Milano:1-пальмитоил-2-олеоил-sn-глицеро-3-фосфохолин (комплекс Apo А-IМ:РОРС) в дозе примерно 45 мг белка/кг.
73. Способ по пп.2, 8 или 71, дополнительно включающий введение 45 мг белка/кг.
74. Способ по пп.3, 9 или 72, дополнительно включающий введение 15 мг белка/кг.
Текст
010134 Область изобретения В изобретении предложены новые препараты и способы лечения или предупреждения острых коронарных синдромов. В предпочтительном воплощении эти препараты представляют собой однократные дозы, которые имеют специфические значения рН, осмотического давления и чистоты. В предпочтительном способе препарат вводят раз в неделю, раз в месяц или раз в год в дозовом диапазоне от примерно 1 до примерно 100 мг/кг на введение. Кроме того, описаны дозы и схемы приема, а также конкретные заболевания, для которых предусмотрено использование этих доз или схем приема. В препаратах и способах используют комплекс аполипопротеин A-I Milano:фосфолипид. Предшествующий уровень техники Начиная с первой половины 20-го столетия, ведение и лечение инфаркта миокарда резко изменилось, перейдя от эры постельного режима и наблюдения к технологии, включающей гемодинамический мониторинг и баллонные катетеры, с повышенным вниманием к тромболитической терапии (Antman andedition, vol. 2, Braunwald et al., eds, 2001, W.B. Saunders Company, Philadelphia). Терапевтические подходы к лечению сердечно-сосудистых заболеваний чрезвычайно развились за последние 100 лет, что сопровождалось большим пониманием лежащей в их основе патологии. Почти все инфаркты миокарда являются следствием коронарного атеросклероза, обычно с наложением коронарного тромбоза. Медленно образующиеся бляшки могут быть бессимптомными благодаря развитию коллатеральных сосудов. Однако атеросклеротические бляшки, особенно обогащенные липидами, склонны к внезапному разрыву. Разрыв бляшки и связанное с этим повреждение эндотелия приводят к высвобождению медиаторов, таких как тромбоксан A2, серотонин, аденозиндифосфат, тромбин,тромбоцит-активирующий фактор, тканевой фактор и свободные радикалы, происходящие из кислорода. Эти медиаторы стимулируют агрегацию тромбоцитов и механическую обструкцию, часто приводящие к тромбообразованию, которое препятствует кровотоку и кислородному снабжению. Постоянные и серьезные препятствия к поступлению кислорода в миокард могут привести к острому инфаркту миокарда(см. Rioufol et al., 2002, Circulation 106:804, Timmis, 2003, Heart 89: 1268-72). Основой атеросклеротической фармакотерапии являлась длительная терапия с целью предупреждения или замедления развития атеросклероткческих бляшек, главным образом, путем сосредоточения на снижении ЛПНП (липопротеинов низкой плотности), или "плохого холестерина", в качестве терапевтической конечной точки. Например, статиновая терапия в значительной степени способствовала улучшению состояния сердечно-сосудистой системы; однако, препятствием остаются такие неблагоприятные эффекты, как рабдомиолиз. Кроме того, статины мало подходят для острой ситуации, например для уменьшения уязвимой, нестабильной атеросклеротической бляшки во время ишемического эпизода. Лечение острого состояния преимущественно базировалось на тромболитических средствах (таких, как tPA(тканевой активатор плазминогена и хирургическом вмешательстве, таком как чрескожная транслюминальная коронарная ангиопластика (ЧТКА) и аортокоронарное шунтирование (АКШ). Несмотря на то,что тромболитические средства обспечивают облегчение благодаря уменьшению или элиминации закупоривающего тромба, они не изменяют лежащую в основе патологию. Вмешательства, такие как ЧТКА,также сопровождаются риском и часто не годятся для пациентов, находящихся в острых состояниях. Поэтому современные фармакологические терапии мало помогают пациентам в том случае, если существует риск присутствия нестабильной бляшки (см. Newton and Krause 2002, Atherosclerosis S3: 31-38). ЛПВП терапия возникла как новый принцип лечения дислипидемии и атеросклероза (там же). Аполипопротеин A-I Milano (Apo A-I Milano) стал представлять интерес благодаря парадоксальному открытию того, что носители вариантной формы этого аполипопротеина имеют низкие уровни ЛПВП (липопротеинов высокой плотности) ("хорошего холестерина") и сниженный риск сердечно-сосудистого заболевания (см. Franceschini et al., 1980, J. Clin. Invest. 66: 892-900, Weisgraber et al., 1983, J. Biol. Chem. 258: 2508-2513, Franceschini et al., 1985, Atherosclerosis 58: 159-174, Franceschini et al., 1987, Arteriosclerosis 7: 426-435). Было обнаружено, что гомодимеры Аро A-I Milano уменьшают утолщение интимы у кроликов,которых кормили холестерином (Ameli et al., 1994, Circulation, 90: 1935-41 и Soma et al., 1995, Cir. Res. 76: 405-11). У мышей с дефицитом АроЕ атеросклеротические повреждения уменьшались как многократной низкой дозой, так и однократной высокой дозой комплексов Аро A-I Milano:липид (Shah et al.,1998, Circulation 97: 780-85 и Shah et al., 2001, Circulation 103: 3047-50). Регрессия бляшек у кроликов была также продемонстрирована с помощью однократных местных инфузий комплексов Аро A-IMilano:фосфолипид в дозах 500 и 1000 мг белка на кролика (Chiesa et al., 2002, Cir. Res. 90: 974-80). Повреждения, индуцированные в модели кроликов, включают в себя, в основном, макрофаги и не характеризуют более сложные повреждения у людей. Поэтому неясно, будут ли аналогичные схемы лечения эффективными для осложненных бляшек, обнаруженных при атеросклерозе у человека (Li et al., 1999,Arterioscler. Thromb Vasc. Biol. 19: 378-383 и Shah et al., 2001, Circulation 103: 3047-50). Однако, несмотря на лучшее понимание патофизиологии инфаркта миокарда и развитие ЛПВП терапии, все же желательны безопасные и эффективные дозы, режимы дозирования и фармацевтические препараты для профилактического и терапевтического применени Аро A-I Milano или комплексов Аро-1 010134 Краткое описание сущности изобретения В изобретении предложены способы и фармацевтические препараты для лечения и предупреждения сердечно-сосудистого заболевания или родственных расстройств, включающих атеросклероз, острые коронарные синдромы, ишемию, ишемическое реперфузионное повреждение, стенокардию и инфаркт миокарда, и уменьшения или стабилизации атеросклеротической бляшки, уменьшения бляшки в закупоренных сосудах и активации оттока холестерина. Таким образом, изобретение охватывает дозы и схемы приема для применения комплекса Аро A-I Milano:фосфолипид и фармацевтических препаратов комплекса Аро A-IMilano:фосфолипид для лечения или предупреждения сердечно-сосудистого заболевания или родственных расстройств, включающих атеросклероз, острые коронарные синдромы, ишемическое реперфузионное повреждение, стенокардию и инфаркт миокарда, и уменьшения или стабилизации атеросклеротической бляшки, уменьшения бляшки в закупоренных сосудах и активации оттока холестерина. Описанные в данном изобретении способ и препараты вызывают быстрое уменьшение или стабилизацию нестабильных атеросклеротических бляшек, которые в случае отсутствия лечения или лечения традиционными способами могут разрываться и приводить к ишемическим событиям, включающим острые коронарные синдромы. Заявители определили, что экзогенно образующийся миметик ЛПВП, такой как Аро A-I Milano,предпочтительно такой как комплекс Аро A-I Milano:фосфолипид, предлагает уникальный подход к лечению и предупреждению сердечно-сосудистого заболевания или родственных расстройств, такие расстройства включают, но не ограничиваются ими, атеросклероз, острые коронарные синдромы, ишемию,ишемическое реперфузионное повреждение, стенокардию и инфаркт миокарда, или уменьшению или стабилизации атеросклеротической бляшки в суженных или закупоренных сосудах. Эти способы, включающие дозы и схемы приема, и фармацевтические препараты по изобретению составляют безопасное,эффективное и нехирургическое лечение, которое быстро активирует отток холестерина и мобилизацию из атеросклеротических бляшек. Активация быстрого оттока холестерина уменьшает объем атеромы в одном или более пораженных сосудах. Уменьшенные атеромы (масса бляшки дегенерированной утолщенной артериальной интимы, встречающейся в атеросклеротических сосудах) делают возможным увеличение кровотока и уменьшение риска ишемии, включая нестабильную стенокардию, инфаркты миокарда и острые коронарные синдромы. До этого изобретения, которое предлагает фармацевтические препараты Аро A-I М и конкретные дозы для лечения и предупреждения сердечно-сосудистого заболевания, включая острые коронарные синдромы, атеросклероз, стенокардию, инфаркт миокарда и ишемическое реперфузионное повреждение,традиционная атеросклеротическая терапия была сосредоточена на снижении ЛПНП, или "плохого холестерина", в качестве терапевтической конечной точки. Эти традиционные ЛПНП терапии, например лечение статинами, могут потребовать нескольких месяцев лечения, прежде чем у субъекта снизятся уровни ЛПНП в сыворотке крови. При острых или прогрессирующих сердечно-сосудистых расстройствах традиционная терапия, в основном, базировалась на хирургическом вмешательстве, таком как чрескожная транслюминальная коронарная ангиопластика (ЧТКА) и аортокоронарное шунтирование (АКШ). Однако в экстренной ситуации хирургическое вмешательство часто противопоказано некоторым пациентам, в частности пациентам с общим плохим состоянием здоровья. Кроме того, в этих традиционных способах не предлагается нехирургического фармакологического лечения, эффективного в острой ситуации. Более того, традиционные терапии сосредоточены на лечении симптомов сердечно-сосудистого заболевания и острых коронарных синдромов, особенно в системе кровообращения. Традиционные терапии, как описано выше и более подробно ниже, были сосредоточены на снижении холестерина ЛПНП,уменьшении образования кровяных сгустков и снижении кровяного давления, что не лечит или не предупреждает лежащую в основе причину сердечно-сосудистого заболевания и острых коронарных синдромов, стабилизации, уменьшении и модификации бляшки в сосудистой стенке. Предложенные в данном изобретении фармацевтические препараты и способы, включая дозы и схемы приема, являются безопасными, эффективными и быстро действуют, уменьшая или стабилизируя атеросклеротическую бляшку. Описанные в данном изобретении дозы являются быстродействующими,что обеспечивает уменьшение атеросклеротической бляшки уже через несколько недель благодаря активации мобилизации холестерина. В некоторых воплощениях дозы, описанные в данном изобретении,могут быть использованы для лечения субъекта, страдающего острыми коронарными синдромами или расстройствами, связанными с ишемией или закупоркой сосудов. В некоторых воплощениях дозы, описанные в данном изобретении, могут быть использованы для предупреждения прогрессирования заболевания в том случае, если атеросклеротические бляшки представляют риск для субъекта. Прогрессирование заболевания, которое предупреждают, может подразумевать дополнительную закупорку сосуда или разрыв нестабильной атеросклеротической бляшки, который может привести к ишемическим состояниям, включающим острые коронарные синдромы и ишемическое реперфузионное повреждение. Способы и фармацевтические препараты, предложенные в данном изобретении, являются настолько эффективными, что однократная доза 45 мг/кг может стимулировать мобилизацию холестерина из атеросклеротической бляшки. В некоторых воплощениях субъекту можно вводить однократную высокую дозу, например примерно 45 мг/кг, комплекса Аро A-I Milano:фосфолипид или его фармацевтического препарата. В некоторых воплощениях одну или более высоких доз комплекса Аро A-IMilano:фосфолипид или его фармацевтического препарата можно вводить субъекту с последующим введением одной или более таких же доз (45 мг/кг) или меньших доз, например примерно 1, примерно 3,примерно 5, примерно 10 или примерно 15 мг/кг. Например, субъекту можно вводить две дозы 45 мг/кг,а затем дополнительные дозы 10 мг/кг. Кроме того, может быть использован альтернативный режим низкой дозы с последующей высокой дозой. Конечно, для острого болезненного состояния предпочтительно сначала использовать более высокие дозы. В некоторых воплощениях субъекта можно лечить с помощью комплекса Аро A-I Milano:фосфолипид или его фармацевтического препарата 1 раз в неделю в течение нескольких недель, а затем периодически, например 2 раза в год, раз в год или каждые 2 года, как требуется для поддержания пациента и незакупоренных сосудов и для уменьшения риска разрыва бляшки и неблагоприятных сосудистых событий. В некоторых воплощениях способы лечения или предупреждения острых коронарных синдромов включают введение субъекту, нуждающемуся в этом, комплексов Аро A-I Milano:фосфолипид или их фармацевтических препаратов примерно каждые сутки, примерно через сутки, примерно каждые 3 суток,примерно каждые 4 суток, примерно каждые 5 суток, примерно каждые 6 суток, примерно каждые 7 суток, примерно каждые 8-10 суток или примерно каждые 11-14 суток. В предпочтительном воплощении комплексы Аро A-I Milano:фосфолипид или их фармацевтические препараты можно вводить примерно каждые 7 суток. В некоторых воплощениях введение комплексов Аро A-I Milano:фосфолипид или их фармацевтических препаратов может представлять собой одноразовое введение. В некоторых воплощениях введение можно продолжать в течение примерно 1 недели, примерно 2, примерно 3, примерно 4,примерно 5, примерно 6, примерно 7-12, примерно 13-24 или примерно 25-52 недель. В некоторых предпочтительных воплощениях введение комплексов Аро A-I Milano:фосфолипид или их фармацевтических препаратов осуществляется примерно каждые 7 суток в течение примерно 5 недель. В некоторых воплощениях введение может быть прервано по прошествии, например, примерно 5 недель. Например, субъекта можно лечить 1 раз в неделю в течение примерно 5 недель, а затем лечить примерно 3-4 раза в течение следующего года. В некоторых воплощениях фармацевтические препараты, описанные в данном изобретении, можно вводить субъекту прерывистым образом для поддержания проходимости сосуда. Например,дозу примерно 15 мг/кг можно вводить при введении фармацевтического препарата примерно каждые 10 суток в течение примерно 7 недель, а затем проводить лечение, например, спустя примерно 26 недель или спустя примерно 52 недели. Другие воплощения, включая схемы приема и применение способов в комбинации с традиционной лекарственной терапией и хирургическими вмешательствами, описаны в данном изобретении ниже. В изобретении предложены фармацевтические препараты для введения аполипопротеина A-I Milano(Apo A-I Milano) для лечения или предупреждения острых коронарных синдромов и ишемического реперфузионного повреждения. В предпочтительном воплощении Apo A-I Milano образует комплекс с липидом для способов, описанных в данном изобретении. Например, липид может представлять собой фосфолипид, предпочтительно 1-пальмитоил-2-олеоил-sn-глицеро-3-фосфохолин (также именуемый как 1-пальмитоил-2-олеоил-фосфатидилхолин или РОРС). В наиболее предпочтительном воплощении комплекс Apo A-I Milano:POPC может представлять собой фармацевтический препарат. В другом предпочтительном воплощении комплекс Apo A-I Milano:фосфолипид или его фармацевтический препарат можно вводить субъекту, нуждающемуся в этом, в дозе от примерно 1 до примерно 100 мг белка/кг. В некоторых воплощениях способы могут включать введение доз комплексов Apo A-I Milano:фосфолипид или их инъецируемых или жидких фармацевтических препаратов для лечения острых коронарных синдромов. В предпочтительном воплощении комплексы Apo А-I M:фосфолипид или их фармацевтические препараты можно вводить субъекту, нуждающемуся в этом, в дозе от примерно 1 до примерно 100 мг белка/кг. В некоторых воплощениях способ может включать лечение или предупреждение острых коронарных синдромов путем введения комплексов Аро A-I Milano:фосфолипид или их фармацевтических препаратов посредством внутривенной инфузии. В некоторых воплощениях способы могут включать введение посредством внутривенной струйной инфузии (push infusion). Под внутривенной струйной инфузией подразумевают, что Apo A-I Milano:фосфолипид или его фармацевтические препараты вводят внутривенно в течение короткого промежутка времени, например вплоть до 5 мин, например 2-5 мин. В некоторых воплощениях введение комплексов Apo A-I Milano:фосфолипид или их фармацевтических препаратов может включать в себя длительную внутривенную инфузию. Под длительной внутривенной инфузией подразумевают, что комплексы Apo A-I Milano:фосфолипид или их фармацевтические препараты вводят непрерывно в течение более длительного, чем 2-5 мин, периода времени, например от примерно 30 мин до примерно 3 ч. Длительные внутривенные инфузии можно осуществлять с помощью инфузионого насоса или устройства. В некоторых воплощениях введение Apo A-I Milano:фосфолипида или его фармацевтических препаратов может представлять собой комбинацию длительных внутривенных инфузий и внутривенных струйных инфузий ("болюсные дозы") комплексов Apo A-I Milano:фосфолипид комплексов или их фармацевтических препаратов. Болюсные дозы можно вводить до, после или во время длительной инфузий. В некоторых воплощениях введение комплексов Apo A-I Milano или липидных комплексов или их фармацевтических препаратов может осуществляться в комбинации с другими лекарствами, которые лечат или предупреждают сердечно-сосудистое заболевание, сопутствующие или соче-3 010134 танные заболевания или обеспечивают облегчение симптомов. Введение других лекарств может быть совместным или последовательным. В способах предложена внутривенная инфузия фармацевтических препаратов, описанных в данном изобретении. Для инфузии может быть использован любой подходящий сосуд, включая периферические сосуды, такие как сосуды локтевой ямки руки или центральной линии грудной клетки. В предпочтительных воплощениях осуществляют инфузию фармацевтического препарата в подкожный латеральный или срединный сосуд локтевой ямки на руке субъекта. В некоторых воплощениях способы могут включать введение фармацевтического препарата комплекса Apo A-I Milano:фосфолипид в высоких или низких дозах или их комбинацию. Как описано в данном изобретении ниже, высокая доза фармацевтического препарата в течение короткого интервала дозирования может безопасно и эффективно уменьшать объем атеромы у субъектов с частично или полностью закупоренными сосудами. В некоторых воплощениях фармацевтический препарат можно вводить до, во время или после хирургического вмешательства, такого как ЧТКА, чтобы разблокировать закупоренный сосуд. В некоторых воплощениях субъекту можно вводить одну или более прерывистых доз для поддержания проходимости ранее закупоренного сосуда ("поддерживающая доза"). В этом изобретении предложен новый подход к лечению или предупреждению ишемического реперфузионного повреждения, а именно применение фармацевтических препаратов или доз комплексаApo A-I Milano, описанного в данном изобретении, для лечения ишемической реперфузии. Дозы, полезные для этого лечения, включают дозы вплоть до 100 мг/кг комплекса Apo A-I Milano:фосфолипид, вводимого субъекту, нуждающемуся в этом. В некоторых воплощениях способы могут включать введение фармацевтической композиции комплекса Apo A-I Milano:фосфолипид в дозе от примерно 1 до примерно 100 мг/кг массы тела субъекта. В конкретных воплощениях способы могут включать введение фармацевтической композиции комплекса Apo A-I Milano:фосфолипид в дозе от примерно 10 до примерно 50 мг/кг. В предпочтительном воплощении способы могут включать введение фармацевтической композиции комплекса Apo A-I Milano:фосфолипид в конкретной дозе примерно 15 мг/кг. В другом предпочтительном воплощении способы могут включать введение фармацевтической композиции комплекса Apo A-IMilano:фосфолипид в конкретной дозе примерно 45 мг/кг. Изобретение также предпочтительно включает применение дозы 15 мг/кг отдельно или в комбинации с дозой 45 мг/кг. Аналогично, доза 45 мг/кг может быть использована отдельно или в комбинации с дозой 15 мг/кг для лечения или предупреждения ишемического реперфузионного повреждения. Фармацевтический препарат, предложенный в данном изобретении, содержит комплекс Apo A-IMilano:фосфолипид с подходящими значениями рН, осмоляльности, тоничности, чистоты и стерильности для безопасного введения субъекту. Фармацевтические препараты могут быть приготовлены для однократного, одноразового использования или могут быть приготовлены так, чтобы содержать противомикробные эксципиенты, как описано ниже, делающие фармацевтические препараты подходящими для многократных доз. В некоторых воплощениях фармацевтический препарат может находиться в стерильных предварительно заполненных шприцах или стерильных предварительно заполненных мешках, которые можно замораживать или охлаждать. В предпочтительных воплощениях комплекс Apo A-I Milano: липид представляет собой комплекс Apo A-I Milano:фосфолипид. В более предпочтительных воплощениях комплекс Apo A-I Milano:фосфолипид представляет собой Apo A-I Milano:POPC. В некоторых воплощениях фармацевтический препарат может находиться в порционных или дозированных упаковках. Как известно специалистам в данной области, порционная упаковка обеспечивает доставку субъекту однократной дозы лекарства. В способах по изобретению предложена порционная упаковка фармацевтического препарата, содержащая, например, 1050 мг Apo A-I Milano белка на упаковку. Например, 1050 мг Apo A-I Milano белка представляет собой количество, посредством которого субъекту массой 70 кг вводят 15 мг/кг Apo A-I Milano. Порция может представлять собой, например, стерильный флакон для одноразового применения, стерильный предварительно заполненный шприц, стерильные предварительно заполненные мешки (т.е. piggybacks) и т.п. В некоторых воплощениях фармацевтический препарат может представлять собой дозированную упаковку. Как известно специалистам в данной области, дозированная упаковка представляет собой удобную установленного размера, готовую для использования пациентом порцию, снабженную этикеткой для адресного распределения учреждениями и специалистами, обеспечивающими медицинское обслуживание. Дозированная упаковка содержит фармацевтический препарат в количестве, необходимом для типичного периода лечения и продолжительности для данного показания. В способах по изобретению предложена дозированная упаковка фармацевтического препарата, содержащего, например, комплекс Apo A-I Milano:фосфолипид в количестве, достаточном для лечения взрослых мужчины или женщины среднего роста дозой 15 мг/кг Apo A-I Milano белка внутривенно 1 раз в неделю в течение 5 недель. Таким образом, дозированная упаковка, как она описана выше, будет иметь пять доз комплексаApo A-I Milano:фосфолипид (доступных во флаконе или предварительно заполненных шприцах). В одном воплощении дозированная упаковка может включать фармацевтический препарат, содержащий комплекс Apo A-I Milano:фосфолипид в количестве, достаточном для лечения взрослых мужчины или женщины среднего роста дозой 15 или 45 мг/кг 1 раз в неделю в течение 6 недель. Специалистам в данной-4 010134 области будет понятно, что описанные в данном изобретении дозы основаны на массе тела субъекта. Фармацевтические препараты могут снабжаться этикеткой и иметь сопровождающую аннотацию для идентификации препарата, содержащегося в упаковке, и другие сведения, полезные для учреждений и специалистов, обеспечивающих медицинское обслуживание, и субъектов при лечении острых коронарных синдромов, включая, но не ограничиваясь этим, инструкции по применению, дозу, интервал между приемами доз, продолжительность лечения, показания к применению, противопоказания, предупреждающие указания, меры предосторожности, инструкции по обороту и хранению и т.п. Краткое описание графических материалов На фиг. 1 показан сильный эффект однократной дозы ЕТС-216 на ЛПВП сыворотки крови у нормальных мужчин; на фиг. 2(А) показан электромеханический оттягивающий механизм IVUS визуализирующего катетера, начинающийся в дистальной фидуциарной ветви (участок С) и заканчивающийся в проксимальной ветви (участок А). Путь катетера показан на ангиограмме; на фиг. 2(В) показан типичный поперечный срез сосуда, который получают через каждые 0,5 мм до тех пор, пока не будет достигнута проксимальная ветвь; на фиг. 2(С) показан промежуточный поперечный срез сосуда; на фиг. 2(D) показана дистальная ветвь в IVUS изображении; на фиг. 3(А) показан поперечный срез для анализа; на фиг. 3(В) показана наружная эластическая мембрана (ЕЕМ); на фиг. 3(С) показана площадь просвета сосуда; на фиг. 3(D) показан расчет максимальной толщины атеромы, измеренной путем вычитания площади поперечного сечения просвета сосуда из площади ЕЕМ; на фиг. 4(А) представлено исходное изображение сосуда пациента перед приемом ЕТС-216; на фиг. 4(В) представлено изображение сосуда пациента в конце исследования после приема ЕТС 216. Площадь атеромы уменьшилась с 8,1 до 5,35 мм 3 практически без изменения площади просвета; на фиг. 5 представлен пример протокола, где изолированные сердца кроликов обрабатывали наполнителем или комплексом белок/липид по изобретению (ЕТС-216) до начала ишемии; на фиг. 6 представлена креатинкиназная активность в коронарном венозном оттоке; на фиг. 7 представлен мониторинг в реальном масштабе времени сердечной функции, полученной на изолированном сердце кролика, обработанном наполнителем и ЕТС-216, в аппарате Лангердорфа (Langendorff); на фиг. 8 показаны временные изменения диастолического давления в левом желудочке (LVDP) в изолированных сердцах кроликов до, во время и после 30 мин глобальной ишемии и 60 мин реперфузии; на фиг. 9 показаны временные изменения конечного диастолического давления в левом желудочке (LVEDP) в изолированных сердцах кроликов до, во время и после 30 мин глобальной ишемии и 60 мин реперфузии; на фиг. 10 показаны временные изменения коронарного перфузионного давления (СРР) в изолированных сердцах кроликов до, во время и после 30 мин глобальной ишемии и 60 мин реперфузии; на фиг. 11 представлено содержание липидных гидропероксидов в тканевых гомогенатах из обработанных наполнителем и ЕТС-216 сердец кроликов, подвергнутых глобальной ишемии в течение 30 мин, а затем 60 мин реперфузии; на фиг. 12 представлены электронно-микроскопические изображения образцов сердечной мышцы из сердец кроликов, обработанных наполнителем и ЕТС-216; на фиг. 13 представлен дополнительный протокол настоящего изобретения, где одну предварительную обработку осуществляли до начала ишемии в группе срочного введения и две предварительные обработки осуществляли до начала ишемии в группе длительного введения; на фиг. 14 представлен протокол определения размера инфаркта; на фиг. 15 представлен процент инфаркта от площади риска, процент инфаркта левого желудочка и процент площади риска левого желудочка у кроликов, обработанных 1 раз (т.е. срочное лечение) или обработанных 2 раза (т.е. длительное лечение) ЕТС-216 (100 мг/кг) или эквивалентным объемом наполнителя; на фиг. 16 представлен дополнительный протокол настоящего изобретения, где кроликов предварительно обрабатывали до начала ишемии либо наполнителем (группа 1), либо 10, 3 или 1 мг/кг ЕТС-216 (группа 2); на фиг. 17 представлены процент инфаркта от площади риска, процент инфаркта левого желудочка и процент площади риска левого желудочка, которые определяли у кроликов, обработанных 1 раз (т.е. срочное лечение) 10, 3 или 1 мг/кг ЕТС-216 или эквивалентным объемом сахарозоманнитного наполнителя для каждой группы; на фиг. 18 представлены временные изменения уровня неэтерифицированного холестерина липопротеинов; на фиг. 19 представлен дополнительный протокол настоящего изобретения, где однократное введение наполнителя и ЕТС-216 осуществляли в течение последних 5 мин 30-минутного периода ишемии; и на фиг. 20 представлены процент инфаркта от площади риска, процент инфаркта левого желудочка и процент площади риска левого желудочка, определенные у кроликов. Подробное описание изобретения Определения Используемые в данном описании следующие термины должны иметь следующее значение.-5 010134 Термины "лечить", "лечение" или "терапия" относятся к способу облегчения или устранения заболевания, расстройства и/или его симптомов. Термин "терапевтически эффективное количество" относится к такому количеству комплекса ApoA-I Milano или липидного комплекса или его фармацевтического препарата, которое достаточно для облегчения до некоторой степени одного или более симптомов состояния или расстройства, которое лечат. Термины "предупреждать", "предупреждение" или "профилактика" относятся к способу исключения приобретения субъектом заболевания, расстройства и/или его симптомов. В некоторых воплощениях термины "предупреждать", "предупреждение" или "профилактика" относятся к способу уменьшения риска приобретения заболевания, расстройства и/или его симптомов. Термин "профилактически эффективное количество" относится к такому количеству комплекса Apo A-IMilano или липидного комплекса или его фармацевтического препарата, которое достаточно для того, чтобы предупредить начало или рецидив одного или более симптомов состояния или расстройства, которое лечат. Термин "острые коронарные синдромы" относится к ишемическим расстройствам, таким как нестабильная стенокардия, инфаркт миокарда с зубцом Q и без зубца Q, или как предложено в 9-м издании Международной классификации болезней (International Classification of Disease, ICD-9), замененном 10-м изданием (ICD-10). Инфаркт миокарда может быть представлен на электрокардиограмме с подъемом или без подъема сегмента ST. Термин "ишемия" относится к местной анемии в результате механически или биологически индуцированной, например посредством спазма, тромбоза, стеноза, обструкции (главным образом, артериального сужения или нарушения) кровоснабжения. Термин "ишемия миокарда" относится к недостаточному кровообращению в миокарде, обычно в результате заболевания коронарной артерии. Термин "ишемическая реперфузия" относится к восстановлению в ткани повышенного количества крови, насыщенной кислородом. Термин "сердечно-сосудистые заболевания" относится к заболеваниям сердца, кровеносных сосудов и кровообращения, таким как инфаркт миокарда, острый коронарный синдром, атеросклероз, стенокардия, ишемическое реперфузионное повреждение и родственные расстройства. Используемый в данном описании термин "хирургическое вмешательство" относится к мануальным, нефармакологическим или оперативным способам. Хирургическое вмешательство может осуществляться для диагностических, радиологических, профилактических или лечебных целей. Термин "нестабильная стенокардия" относится к изменению частоты, тяжести или длительности симптомов хронической стабильной стенокардии, таких как боль в груди, которая может распространяться в челюсти и руки, или эпигастральная боль. Хроническая стабильная стенокардия представляет собой боль в груди, которая может распространяться в челюсти и руки субъекта и которая индуцируется физической нагрузкой, приемом пищи и/или стрессом и ослабляется в состоянии покоя без нового изменения частоты или силы активности, необходимой для продуцирования симптомов. Термин "фармацевтический препарат" относится либо к композиции, содержащей Apo A-I Milano или комплекс Apo A-I Milano:липид и подходящий разбавитель, носитель, наполнитель или эксципиенты, подходящие для введения субъекту. Этот термин включает, но не ограничивается этим, пероральные,парентеральные композиции и композиции для местного применения, как описано ниже. Термин "примерно" относится к сравнительному термину, обозначающему приближение плюс или минус 20% от номинальной величины, к которой оно относится. Для области этого описания этот уровень приближения является подходящим, если эта величина не указана специально как требующая более узкого диапазона. Термин "этикетка" относится к изображению написанных, напечатанных или графических сведений непосредственно на контейнере для продукта, например написанных сведений, изображенных на флаконе, содержащем фармацевтически активный агент. Термин "этикетирование" относится ко всем этикеткам и другим написанным, напечатанным или графическим сведениям на любом продукте или любом контейнере для него или обертке или, например,на вкладыше в упаковку, сопровождающем такой продукт, на видеолентах с инструкциями или цифровых видеодисках (DVD) с инструкциями, сопровождающих или связанных с контейнером для фармацевтически активного агента. Способы лечения В изобретении предложены способы и препараты для лечения или предупреждения острых коронарных синдромов, включая нестабильную стенокардию, инфаркт миокарда с подъемом сегмента ST и инфаркт миокарда без зубца Q. Для лечения и предупреждения острых коронарных синдромов заявителями были определены безопасные и эффективные дозы для фармацевтических препаратов, описанных в данном изобретении. На основе современного понимания возникла система взглядов, которая изменила клинические картины, называемые теперь острыми коронарными синдромами ("ОКС") (там же). Острые коронарные синдромы включают нестабильную стенокардию, инфаркт миокарда с зубцом Q и без подъема сегмента ST и являются основной причиной заболеваемости и смертности, особенно в течение первых 24 ч после возникновения (Schoenhagen et al., 2000, Circulation 101: 598-603). ОКС представляет собой ишемический дискомфорт, который представлен на электрокардиографе подъемом без сегмента ST. Ишемия часто развивается в нестабильную стенокардию, инфаркт миокарда с зубцом Q и без зубца Q (Antman and Braunwald,-6 010134"Acute Myocardial Infarction" in Heart Disease, A Textbook of Cardiovascular Medicine, 6th edition, vol. 2,Braunwald et al., eds, 2001, W.B. Saunders Company, Philadelphia). В способах и препаратах по изобретению предложен уникальный и эффективный подход к лечению атеросклероза и острых коронарных синдромов. В способах по изобретению комплексы Apo A-I Milano: фосфолипид или их фармацевтические препараты обеспечивают не облегчение симптомов, а нехирургическое лечение, которое отменяет патофизиологическую основу этого заболевания. В способах по изобретению предложено введение Apo A-I Milano, комплекса Apo A-I Milano:фосфолипид или их фармацевтических препаратов, обеспечивающих ЛПВП терапию, которая стимулирует отток холестерина, обратный транспорт холестерина и уменьшает атеросклеротическую бляшку. Не ограничиваясь какой-либо теорией, полагают, что Apo A-I Milano, комплекс Apo A-I Milano:фосфолипид или их фармацевтические препараты имитируют функциональный ЛПВП, который стимулирует отток холестерина и обратный транспорт холестерина, уменьшает объем атеромы и может стабилизировать атеросклеротическую бляшку. В изобретении предложены способы лечения острых коронарных синдромов. В предпочтительных воплощениях комплексы Apo А-I Milano:фосфолипид или их фармацевтические препараты, как описано ниже, можно вводить в дозе от примерно 1 до примерно 100 мг белка/кг, предпочтительно в дозе от 1 до 50 мг белка/кг; наиболее предпочтительно 15 или 45 мг/кг. Заявители показали, что эти дозы являются безопасными, эффективными и хорошо переносятся субъектами, страдающими острыми коронарными синдромами, или с риском острых коронарных синдромов, как подробно описано в данном изобретении. В изобретении предложены способы лечения или предупреждения острых коронарных синдромов,включая облегчение или улучшение признаков или симптомов острых коронарных синдромов. В некоторых воплощениях предложены способы лечения или уменьшения коронарного атеросклероза. В некоторых воплощениях предложены способы активации оттока холестерина из пораженных сосудов. В некоторых воплощениях предложены способы активации обратного транспорта холестерина. В одном воплощении предложены способы уменьшения объема атеромы в пораженном сосуде. В некоторых воплощениях пораженный сосуд представляет собой коронарную артерию. Как описано в данном изобретении, объем атеромы может быть определен с помощью внутрисосудистого ультразвука (IVUS). В некоторых воплощениях предложены способы уменьшения общего объема бляшки в пораженном сосуде. В некоторых воплощениях предложены способы уменьшения средней максимальной толщины бляшки в пораженном сосуде. В некоторых воплощениях предложены способы уменьшения средней максимальной толщины атеромы. В некоторых воплощениях предложены способы уменьшения объема бляшки, по меньшей мере, площади бляшки, выраженной в процентах. В некоторых воплощениях предложены способы уменьшения наибольшей площади бляшки, выраженной в процентах. В некоторых воплощениях предложены способы увеличения среднего диаметра просвета артерии в пораженном коронарном сосуде. В некоторых воплощениях субъект, в отношении которого применяют способы и препараты по изобретению, может иметь уменьшенные ангиографические повреждения по сравнению с субъектами, в отношении которых не применяют способы и препараты по изобретению. В некоторых воплощениях предложены способы регрессии уже существующих повреждений. В некоторых воплощениях способы и фармацевтический препарат предложены для достижения проходимости закупоренного сосуда или поддержания проходимости закупоренного сосуда. В некоторых воплощениях дозы комплекса Apo A-I Milano:фосфолипид от примерно 15 до примерно 45 мг/кг предложены для уменьшения среднего процентного объема атеромы на примерно 2, примерно 1 или примерно 0,05%. В некоторых воплощениях дозы комплекса Apo A-I Milano:фосфолипид от примерно 15 до примерно 45 мг/кг предложены для уменьшения объема атеромы, составляющего примерно 20, примерно 15, примерно 10 или примерно 5 мм 3. В некоторых воплощениях дозы комплексаApo A-I Milano:фосфолипид от примерно 15 до примерно 45 мг/кг предложены для уменьшения средней максимальной толщины атеромы на величину от примерно -0,039 до -0,044 мм. В одном воплощении предложены способы лечения острых коронарных синдромов у субъектов с признаками или симптомами острых коронарных синдромов. В одном воплощении субъекты могут иметь признаки и/или симптомы ишемии миокарда, например боль в груди, челюсти, руках или эпигастральной области, учащенное сердцебиение, одышку, потоотделение, тошноту и/или рвоту. В другом воплощении предложены способы лечения острых коронарных синдромов у субъектов, демонстрирующих признаки и симптомы острых коронарных синдромов в сочетании с изменениями в электрокардиограме("ЭКГ"), такими как подъемы сегмента ST, изменения зубца Т, такие как инверсии, увеличениями креатинкиназной фракции, тропонина I или С-реактивного белка. В одном воплощении предложены способы предупреждения острых коронарных синдромов у субъектов с риском развития острых коронарных синдромов. Такие субъекты могут включать в себя субъектов разных возрастов (например, 18-24, примерно 25, примерно 30, примерно 40, примерно 50, примерно 60, примерно 70, примерно 80 или примерно 90 лет), субъектов с семейным анамнезом сердечно-сосудистого заболевания или генетической предрасположенностью к сердечно-сосудистому заболеванию,субъектов, у которых имеется диабет, гипертензия, множественное сосудистое заболевание или заболевание главных сосудов левой половины тела или у которых ранее имел место инфаркт миокарда. Специалистам в данной области понятно, что фактическая доза препаратов по изобретению может-7 010134 варьировать в зависимости от роста, массы, возраста, тяжести заболевания субъекта, наличия сопутствующих медицинских состояний и т.п. Например, пожилого субъекта с нарушенной почечной или печеночной функцией можно лечить дозой комплекса Apo A-I Milano:липид, которая находится в нижнем диапазоне доз около 1 мг/кг (например, 0,8 или 0,9 мг/кг). Субъекта с тяжелыми острыми коронарными синдромами, страдающего ожирением, с хорошей почечной и печеночной функцией можно лечить дозой комплекса Apo A-I Milano:липид, которая находится, например, в верхнем диапазоне доз около 100 мг/кг(например, 120, 119, 118, 115 мг/кг и т.п.). Было показано, что дозировка препаратов, описанных в данном изобретении, является эффективной для достижения намеченной цели. Эти дозы достигают диапазона циркулирующих концентраций, которые включают эффективную дозу с приемлемым профилем риск/польза. В изобретении предложены способы лечения или предупреждения острых коронарных синдромов с режимом введения доз, достаточным для лечения острых коронарных синдромов у субъекта, нуждающегося в таком лечении. В некоторых воплощениях комплекс Apo A-I Milano:фосфолипид или его фармацевтический препарат, как описано ниже, можно вводить примерно каждые сутки, примерно через сутки,примерно каждые 3 суток, примерно каждые 4 суток, примерно каждые 5 суток, примерно каждые 6 суток, примерно каждые 7 суток, примерно каждые 8-10 суток или примерно каждые 11-14 суток. Этот период времени также упоминается как интервал между введением доз или интервал. В некоторых воплощениях интервал между введением доз может составлять каждый месяц, каждые 6, каждые 12, каждые 18 месяцев или каждые 24 месяца. В предпочтительных воплощениях Apo A-I Milano, липидный комплекс или его фармацевтический препарат можно вводить примерно каждые 7 суток. В некоторых воплощениях введение комплексов Apo A-I Milano:фосфолипид или их фармацевтических препаратов может представлять собой однократное введение. В некоторых воплощениях введение можно продолжать в течение примерно 1 недели, примерно 2, примерно 3, примерно 4, примерно 5, примерно 6, примерно 7-12, примерно 13-24, примерно 52 недель или продолжать в течение жизни субъекта. Этот период времени также обозначается как продолжительность введения доз, продолжительность лечения или продолжительность. Таким образом, режим введения доз может представлять собой, например, фармацевтический препарат комплекса Apo A-I Milano:фосфолипид, вводимый примерно каждые 7 суток в течение примерно 6 недель. В некоторых воплощениях введение доз может продолжаться с перерывами после примерно 52 недель. Например, субъекта можно лечить 1 раз в неделю в течение примерно 52 недель и затем лечить от примерно 3 до примерно 4 раз в течение следующего года. В некоторых предпочтительных воплощениях введение фармацевтического препарата, содержащего комплекс Apo A-I Milano:фосфолипид, происходит примерно каждые 7 суток в течение примерно 5 недель. Другие режимы введения доз, в которых используют различные интервалы между введением доз и продолжительности, также входят в объем изобретения, как описано в данном изобретении. Доза комплекса Apo A-I Milano:фосфолипид или его фармацевтических препаратов может варьировать в течение периода лечения. Например, субъекта можно лечить дозой 45 мг/кг фармацевтического препарата комплекса Apo A-I Milano:фосфолипид 1 раз в неделю в течение 3 недель, а затем лечить дозой 15 мг/кг фармацевтического препарата комплекса Apo A-I Milano:фосфолипид 1 раз каждые 4 месяца или 1 раз в год на протяжении жизни субъекта. Такие периодические дозы можно вводить для поддержания проходимости сосуда. Периодические дозы на протяжении жизни субъекта для поддержания уменьшенного объема атеромы и увеличенного просвета сосуда входят в объем изобретения. Способы и препараты по настоящему изобретению могут быть использованы в сочетании с хирургическим вмешательством, т.е. до, во время или после операции. Хирургическое вмешательство может включать в себя ангиопластику, внутрисосудистое ультразвуковое исследование, аортокоронарное шунтирование (АКШ), коронарную ангиографию, имплантацию сосудистых эндопротезов, чрескожное коронарное вмешательство (ЧКВ) и/или стабилизацию бляшек. В некоторых воплощениях предложены способы введения доз комплекса Apo A-I Milano:фосфолипид или его фармацевтических препаратов до или после хирургического вмешательства для того, чтобы раскрыть закупоренный сосуд или уменьшить атеросклеротическую бляшку в сосуде. Хирургическое вмешательство относится к мануальным, нефармакологическим или оперативным способам, используемым для диагностики, визуализации (радиология),предупреждения или лечения заболевания или состояния. Например, внутрисосудистое ультразвуковое исследование (IVUS) и коронарная ангиография представляют собой процедуры, которые могут обеспечить количественную оценку массы бляшки (диагностическая цель), ангиография может обеспечить изображения сосудов (радиологическая цель), а ангиопластика может раскрыть закупоренный сосуд (лечебная цель). Все они включены в качестве хирургических вмешательств, используемых в данном изобретении. Аполипопротеин A-I Milano В одном аспекте настоящего изобретения предложены способы и препараты для лечения, уменьшения или предупреждения повреждения от острых коронарных синдромов путем введения препарата, содержащего Apo A-I Milano. В некоторых воплощениях Apo A-I Milano может образовывать комплекс с липидом.Apo A-I Milano человека представляет собой природный вариант Apo A-I (Weisgraber et al., 1980, J.Clin. Invest. 66: 901-907). В Apo A-I Milano аминокислота аргинин (Arg173) заменена аминокислотой цистеин (Cys173). Поскольку Apo A-I Milano содержит один остаток цистеина на полипептидную цепь, то он может существовать в мономерной, гомодимерной или гетеродимерной форме (см. патент США 5876968,-8 010134 включенный в данное описание путем ссылки во всей его полноте). Эти формы являются химически взаимозаменяемыми, и термин Apo A-I Milano не делает различий между этими формами. На уровне ДНК вариантная форма является результатом замены С на Т в генной последовательности, т.е. кодон CGC меняется на TGC, разрешая трансляцию цистеина (Cys) вместо аргинина (Arg) в аминокислотном положении 173. В некоторых воплощениях Apo A-I Milano может представлять собой вариант Apo A-I Milano или ApoA-I Milano с консервативной заменой. Под консервативной заменой подразумевают, что некоторые аминокислотные остатки Apo A-I Milano могут быть заменены другими аминокислотными остатками без существенного неблагоприятного воздействия на активность белка. Таким образом, в настоящем изобретении также рассматриваются измененные формы Apo A-I Milano или формы с заменами, где по меньшей мере один определенный аминокислотный остаток в структуре заменен другим аминокислотным остатком. С целью определения консервативных аминокислотных замен аминокислоты могут быть удобно классифицированы на две основные категории - гидрофильную и гидрофобную - в зависимости, главным образом,от физико-химических характеристик аминокислотной боковой цепи. Эти две основные категории могут быть дополнительно классифицированы на подкатегории, которые более четко определяют характеристики аминокислотных боковых цепей. Например, класс гидрофильных аминокислот может быть дополнительно подразделен на кислые, основные и полярные аминокислоты. Класс гидрофобных аминокислот может быть дополнительно подразделен на неполярные и ароматические аминокислоты. Определения различных категорий аминокислот, которые определяют структуру (I), представляют собой следующее."Гидрофильная аминокислота" относится к аминокислоте, проявляющей гидрофобность меньше нуля согласно стандартизованной согласованной шкале гидрофобности Айзенберга (Eisenberg et al.,1984, J. Mol. Biol. 179: 125-142). Генетически кодируемые гидрофильные аминокислоты включают в себя"Кислая аминокислота" относится к гидрофильной аминокислоте, имеющей величину pK для боковой цепи меньше 7. Кислые аминокислоты типично имеют отрицательно заряженные боковые цепи при физиологическом значении рН в результате потери иона водорода. Генетически кодируемые кислые аминокислоты включают в себя Glu (E) и Asp (D)."Основная аминокислота" относится к гидрофильной аминокислоте, имеющей величину pK для боковой цепи больше 7. Основные аминокислоты типично имеют положительно заряженные боковые цепи при физиологическом значении рН в результате ассоциации с ионом гидрония. Генетически кодируемые основные аминокислоты включают в себя His (H), Arg (R) и Lys (K)."Полярная аминокислота" относится к гидрофильной аминокислоте, имеющий боковую цепь, которая при физиологическом значении рН является незаряженной, но которая имеет по меньшей мере одну связь, в которой пара электронов, общая для 2 атомов, удерживается ближе к одному из атомов. Генетически кодируемые полярные аминокислоты включают в себя Asn (N), Gln (Q), Ser (S) и Thr (T)."Гидрофобная аминокислота" относится к аминокислоте, проявляющей гидрофобность больше нуля согласно стандартизованной согласованной шкале гидрофобности Айзенберга (Eisenberg, 1984, J. Mol.Biol. 179: 125-142). Генетически кодируемые гидрофобные аминокислоты включают в себя Pro (P), Ile (I),Phe (F), Val (V), Leu (L), Trp (W), Met (M), Ala (A), Gly (G) и Tyr (Y)."Ароматическая аминокислота" относится к гидрофобной аминокислоте с боковой цепью, имеющей по меньшей мере одно ароматическое или гетероароматическое кольцо. Ароматическое или гетероароматическое кольцо может содержать один или более чем один заместитель, такой как -ОН, -SH, -CN, -F,-Cl, -Br, -I, -NO2, -NO, -NH2, -NHR, -NRR, -С(О)R, -C(O)OH, -C(O)OR, -C(O)NH2, -C(O)NHR, -C(O)NRR и т.п., где каждый R независимо представляет собой (С 1-С 6)алкил, замещенный (С 1-С 6)алкил, (С 1-С 6)алкенил, замещенный (С 1-С 6)алкенил, (С 1-С 6)алкинил, замещенный (С 1-С 6)алкинил, (С 5-С 20)арил, замещенный (С 5-С 20)арил, (С 6-С 26)алкарил, замещенный (С 6-С 26)алкарил, 5-20-членный гетероарил, замещенный 5-20-членный гетероарил, 6-26-членный алкгетероарил или замещенный 6-26-членный алкгетероарил. Генетически кодируемые ароматические аминокислоты включают в себя Phe (F), Tyr (Y) и Trp (W)."Неполярная аминокислота" относится к гидрофобной аминокислоте, имеющей боковую цепь, которая является незаряженной при физиологическом значении рН и которая имеет связи, в которых пара электронов, общая для 2 атомов, обычно удерживается в равной степени каждым из 2 атомов (т.е. боковая цепь является неполярной). Генетически кодируемые неполярные аминокислоты включают в себя"Алифатическая аминокислота" относится к гидрофобной аминокислоте, имеющей алифатическую углеводородную боковую цепь. Генетически кодируемые алифатические аминокислоты включают в себяAla (A), Val (V), Leu (L) и Ile (I). Аминокислотный остаток Cys (С) является необычным в том смысле, что он может образовывать дисульфидные мостики с другими Cys (С) остатками или другими сульфанилсодержащими аминокислотами. Способность Cys (С) остатков (и других аминокислот с боковыми цепями, содержащими -SH) существовать в пептиде либо в восстановленной свободной -SH, либо окисленной, образующей дисульфидный мостик форме оказывает влияние на то, будут ли Cys (С) остатки иметь общий гидрофобный или гидрофильный характер в пептиде. Хотя Cys (С) проявляет гидрофобность 0,29 согласно стандартизованной согласованной шкале Айзенберга (Eisenberg, 1984, выше), следует понимать, что для целей на-9 010134 стоящего изобретения Cys (С) классифицирована как полярная гидрофильная аминокислота, несмотря на общие классификации, приведенные выше. Как будет понятно специалистам в данной области, определенные выше категории не являются взаимоисключающими. Так, аминокислоты, имеющие боковые цепи, проявляющие два или более физико-химических свойств, могут быть включены в различные категории. Например, аминокислотные боковые цепи, имеющие ароматические группировки, которые дополнительно замещены полярными заместителями, такие как Tyr (Y), могут проявлять как ароматические гидрофобные свойства, так и полярные или гидрофильные свойства, и поэтому могут быть включены как в ароматическую, так и в полярную категорию. Подходящая классификация любой аминокислоты будет очевидна специалистам в данной области, особенно в свете подробного описания, предложенного в данном изобретении. В некоторых воплощениях замещенная или измененная форма Apo A-I Milano не является Apo A-I.Apo A-I Milano, используемый в изобретении, может быть получен из любого доступного источника. Например, Apo A-I Milano может быть рекомбинантным, синтетическим, полусинтетическим или очищенным Apo A-I Milano. В предпочтительном воплощении Apo A-I Milano может быть рекомбинантным белком (rApo A-I Milano), экспрессирующимся в дрожжах или Е. coli, как описано в патенте США 5721114 и в европейских патентах ЕР 0469017 и ЕР 0267703, включенных в данное описание путем ссылки во всей их полноте. Способы получения Apo A-I Milano, используемые в изобретении, хорошо известны в данной области. Например, Apo A-I Milano может быть выделен из плазмы, например, путем центрифугирования в градиенте плотности с последующим осуществлением делипидизации липопротеина, восстановления, денатурации и гель-фильтрационной хроматографии, ионообменной хроматографии, гидрофобной, например фенилсефарозной, хроматографии с взаимодействием или иммуноаффинной хроматографии или получен синтетически, полусинтетически или с использованием методов рекомбинантных ДНК, известных специалистам в данной области, и последующей очистки, также хорошо известной специалистам в данной области (см., например, патенты США 6107467, 6559284, 6423830,6090921, 5834596, 5990081, 6506879, Mulugeta et al., 1998, J. Chromatogr. 798 (1-2): 83-90; Chung et al.,1980, J. Lipid Res. 21 (3): 284-91; Cheung et al., 1987, J. Lipid Res. 28 (8): 913-29; Persson, et al., 1998, J.WO 86/04920 и WO 87/02062). Если Apo A-I Milano получают из природных источников, то он может быть получен из любого животного любого вида. В некоторых воплощениях Apo A-I Milano может иметь происхождение от млекопитающего. В некоторых воплощениях Apo A-I Milano может иметь происхождение от человека. В предпочтительных воплощениях изобретения Apo A-I Milano происходит от того же вида, что и субъект,которому вводят Apo A-I Milano. В предпочтительном воплощении Apo A-I Milano является рекомбинантным белком Apo A-I Milano (rApo A-I Milano). Способы введения Комплексы Apo A-I Milano:фосфолипид или их фармацевтические препараты можно вводить любым подходящим путем, известным специалистам в данной области, который обеспечивает биодоступность в кровоток. Может быть использован любой путь введения, который обеспечивает терапевтически эффективное количество препаратов по изобретению. Путь введения может быть определен типом фармацевтического препарата. Например, инъецируемые препараты можно вводить парентерально, включая,но не ограничиваясь этим, внутривенные (в/в), внутримышечные (в/м), интрадермальные, подкожныеApproach, Ch.2, pp. 15-34, включенный в данное описание путем ссылки во всей его полноте). В предпочтительном воплощении комплексы Apo A-I Milano:фосфолипид или их фармацевтические препараты можно вводить парентерально. В более предпочтительном воплощении парентеральное введение является внутривенным. Внутривенное введение может осуществляться в виде болюса, вводимого, например, в течение примерно 2-3 мин или путем длительной инфузии, например посредством насоса, в течение примерно 1 ч или непрерывного введения в течение примерно 24 ч. В предпочтительном воплощении инфузию можно осуществлять в течение от примерно 1 до примерно 3 ч. В способах предложена внутривенная инфузия фармацевтических препаратов, описанных в данном изобретении. В качестве места для инфузии может быть выбран любой подходящий сосуд, включая периферические сосуды, такие как сосуды локтевой ямки руки или центральной линии грудной клетки. В предпочтительных воплощениях осуществляют инфузию фармацевтического препарата в подкожный латеральный или срединный сосуд в локтевой ямке на руке субъекта. В некоторых воплощениях введение может осуществляться посредством механического насоса или устройства для доставки, например устройства для доставки в перикард (PerDUCER) или аппарата искусственного кровобращения. Липидные комплексы В некоторых воплощениях способы по изобретению включают введение липидных комплексов ApoA-I Milano. В некоторых воплощениях изобретения предложены фармацевтические препараты комплексов Apo A-I Milano:фосфолипид. Эффективность может быть увеличена путем образования комплекcов- 10010134 липидов с Apo А-I Milano. В типичном случае липид смешивают с Apo A-I Milano перед введением. ApoA-I Milano и липиды могут быть смешаны в водном растворе в подходящих соотношениях и могут быть подвергнуты комплексообразованию способами, известными в данной области, включая лиофилизацию,солюбилизацию с помощью детергента с последующим диализом, микрофлуидизацию, обработку ультразвуком и гомогенизацию. Выход комплексов можно оптимизировать, например, путем изменения давления, частоты ультразвука или концентрации детергента. Примером детергента, обычно используемого для получения комплексов Apo A-I Milano:фосфолипид, является холат натрия. В некоторых случаях для лечения или предупреждения острых коронарных синдромов предпочтительней вводить только Apo A-I Milano, по существу, не содержащий липидов. В предпочтительных воплощениях комплекс Apo A-I Milano:липид вводят субъекту, нуждающемуся в этом. В одном воплощении комплекс Apo A-I Milano:фосфолипид комплекс может находиться в растворе с подходящим фармацевтическим разбавителем. В другом воплощении высушенные сублимацией или лиофилизированные препараты комплексов Apo A-I Milano:фосфолипид могут быть гидратированы или разведены подходящим фармацевтическим разбавителем перед введением. В другом воплощении комплексы Apo A-I Milano:липид могут представлять собой замороженные препараты, которые оттаивают до получения однородного раствора перед тем, как вводить субъекту, нуждающемуся в этом. Липид может представлять собой любой подходящий липид, известный специалистам в данной области. Могут быть использованы липиды, не содержащие фосфор, включая стеариламин, додециламин,ацетилпальмитат, (1,3)-D-маннозил-(1,3)диглицерид, аминофенилгликозид, 3-холестерил-6'-(гликозилтио) гексилэфирные гликолипиды, N-(2,3-ди(9-(Z)-октадеценилокси-проп-1-ил-N,N,N-триметиламмония хлорид и амиды жирных кислот. В предпочтительных воплощениях липид представляет собой фосфолипид. Фосфолипид может быть получен из любого источника, известного специалистам в данной области. Например, фосфолипид может быть получен из коммерческих источников, природных источников или синтетическими или полусинтетическими способами, известными специалистам в данной областиet al., 2002, Nippon Yakurigaku Zasshi 120 (1): 67P-69P). В предпочтительных воплощениях липид может представлять собой фосфолипид. Фосфолипид может представлять собой любой фосфолипид, известный специалистам в данной области. Например, фосфолипид может представлять собой фосфолипид с небольшой алкильной цепью, фосфатидилхолин, яичный фосфатидилхолин, соевый фосфатидилхолин, дипальмитоилфосфатидилхолин, соевый фосфатидилглицерин, яичный фосфатидилглицерин, дистеароилфосфатидилглицерин, димиристоилфосфатидилхолин, дистеароилфосфатидилхолин, дилаурилфосфатидилхолин, 1-миристоил-2-пальмитоилфосфатидилхолин, 1-пальмитоил-2-миристоилфосфатидилхолин, 1-пальмитоил-2-стеароилфосфатидилхолин, 1-стеароил-2-пальмитоилфосфатидилхолин, диолеоилфосфатидилхолин, 1-пальмитоил-2-олеоилфосфатидилхолин, 1-олеоил-2-пальмитилфосфатидилхолин, диолеоилфосфатидилэтаноламин, дилауроилфосфатидилглицерин, фосфатидилсерин, фосфатидилэтаноламин, фосфатидилинозит, фосфатидилглицерин, дифосфатидилглицерин, димиристоилфосфатидилглицерин, дипальмитоилфосфатидилглицерин, дистеароилфосфатидилглицерин, диолеоилфосфатидилглицерин, фосфатидную кислоту, димиристоилфосфатидную кислоту, дипальмитоилфосфатидную кислоту, димиристоилфосфатидилэтаноламин, дипальмитоилфосфатидилэтаноламин, димиристоилфосфатидилсерин, дипальмитоилфосфатидилсерин, фосфатидилсерин мозга, сфингомиелин, сфинголипиды, сфингомиелин мозга, дипальмитоилсфингомиелин, дистеароилсфингомиелин, галактоцереброзид, ганглиозиды, цереброзиды, фосфатидилглицерин, фосфатидную кислоту, лизолецитин, лизофосфатидилэтаноламин, цефалин, кардиолипин, дицетилфосфат, дистеароилфосфатидилэтаноламин и холестерин и его производные. Фосфолипид может представлять собой также производное или аналог любого из вышеуказанных фосфолипидов. В некоторых воплощениях комплекс Apo A-I Milano:фосфолипид может содержать комбинации двух или более фосфолипидов. В предпочтительных воплощениях в способах по изобретению предложено введение комплексаApo A-I Milano:фосфолипид. В более предпочтительном воплощении липид представляет собой фосфолипид, предпочтительно 1-пальмитоил-2-олеоилфосфатидилхолин ("РОРС") или ("1-пальмитоил-2-олеоил-sn-глицеро-3-фосфохолин"). В еще более предпочтительном воплощении комплекс Apo A-I Milano:POPC содержит соотношение Apo A-I Milano:POPC примерно 1:1 по массе. В наиболее предпочтительном воплощении комплекс Apo A-I Milano:POPC представляет собой фармацевтический препарат. Комплекс Apo A-I Milano:POPC обозначается как ЕТС-216. Комплекс, содержащий Apo A-I Milano и липид, может содержать любое количество липида, предпочтительно фосфолипида, и любое количество Apo A-I Milano, эффективное для лечения или предупреждения острых коронарных синдромов. В некоторых воплощениях Apo A-I Milano может содержать комплекс Apo A-I Milano и фосфолипида в соотношении примерно 1:1 по массе. Однако Apo A-I Milano может содержать комплексы с другими соотношениями фосфолипида к Apo A-I Milano, такими как примерно 100:1, примерно 10:1, примерно 5:1, примерно 3:1, примерно 2:1, примерно 1:1, примерно 1:2,- 11010134 примерно 1:3, примерно 1:5, примерно 1:10 и примерно 1:100 (масса белка/масса липида). Соотношение от примерно 1:0,5 до примерно 1:3 по массе (масса белка/масса липида), более предпочтительно соотношение от примерно 1:0,8 до примерно 1:1,2 (масса белка/масса липида) является предпочтительным для получения наиболее гомогенной популяции и для целей производства стабильных и воспроизводимых партий. В еще более предпочтительном воплощении соотношение Apo A-I Milano к фосфолипиду составляет 1:0,95 (масса белка/масса липида). Дополнительные липиды, подходящие для применения в способах по изобретению, хорошо известны специалистам в данной области и указаны в многочисленных общеизвестных источниках, напримерMcCutcheon's Detergents and Emulsifiers и McCutcheon's Functional Materials, Allured Publishing Co.,Ridgewood, N.J., которые оба включены в данное описание путем ссылки. Обычно желательно, чтобы липиды были жидкокристаллическими при 37, 35 или 32 С. Липиды в жидкокристаллическом состоянии типично связывают холестерин более эффективно, чем липиды в гелеобразном состоянии. Поскольку субъекты типично имеют температуру тела примерно 37 С, то липиды, которые являются жидкокристаллическими при 37 С, обычно находятся в жидкокристаллическом состоянии во время лечения. Получение липидных комплексов Комплексы Apo A-I Milano:липид могут быть получены любым способом, известным специалисту в данной области. В некоторых случаях желательно смешивать липид и Apo A-I Milano перед введением. Липиды могут находиться в растворе или в форме липосом или эмульсий, образованных с использованием стандартных методик, таких как гомогенизация, обработка ультразвуком или экструзия. Обработку ультразвуком обычно осуществляют с помощью ультразвукового дезинтегратора, такого как ультразвуковой дезинтегратор Брансона (Branson), в ледяной бане. Типично суспензию подвергают нескольким циклам обработки ультразвуком. Экструзию можно осуществлять с помощью биомембраннх экструдеров, таких как Lipex Biomembrane Extruder (Lipex Biomembrane Extruder, Inc. Vancouver, Канада). Определенный размер пор в экструзионных фильтрах может приводить к образованию однослойных липосомных везикул определенных размеров. Липосомы могут быть также образованы путем экструзии через асимметричный керамический фильтр, такой как Ceraflow Microfilter, коммерчески доступный от NortonCompany, Worcester Mass, или через поликарбонатный фильтр или другие типы полимеризованных материалов (т.е. пластмасс), известных специалистам в данной области. Комплекс Apo A-I Milano:липид может быть получен в различных формах, включая, но не ограничиваясь этим, везикулы, липосомы или протеолипосомы. Для получения комплексов Apo A-I Milano:липид могут быть использованы различные способы, хорошо известные специалистам в данной области. Для приготовления липосом или протеолипосом можно использовать целый ряд доступных методов. Например, Apo A-I Milano можно обрабатывать ультразвуком (с использованием бани или ультразвукового аппарата с зондами) вместе с подходящим липидом с образованием липидных комплексов. В некоторых воплощениях Apo A-I Milano можно объединять с предварительно образованными липидными везикулами, полученными при спонтанном образовании комплекса аполипопротеина с липидом. В другом воплощении Apo A-I Milano можно получать также способом диализа с детергентом; например,смесь Apo A-I Milano, липида и детергента, такого как холат, может быть подвергнута диализу для того,чтобы удалить детергент, и восстановлена с образованием липидных комплексов (см., например, Jonas etal., 1986, Methods Enzymol. 128, 553-82). В другом воплощении липидные комплексы могут быть получены путем совместной лиофилизации,как описано в патентах США 6287590 и 6455088, содержания которых, таким образом, включены путем ссылки во всей их полноте. Другие способы раскрыты, например, в патентах США 6004925,6037323 и 6046166, включенных в данное описание путем ссылки во всей их полноте. Другие способы получения комплексов Apo A-I Milano:липид будут очевидны специалистам в данной области. В предпочтительном воплощении липидные комплексы могут быть получены путем гомогенизации. В предпочтительных воплощениях производство комплексов Apo A-I Milano:липид начинается, когда рекомбинантный Apo A-I Milano разбавляют водой для инъекции до концентрации 15 мг/мл в растворе. Фосфат натрия добавляют до конечной концентрации 9-15 мМ фосфата и для доведения рН до величины от примерно 7,0 до примерно 7,8. Маннит добавляют для достижения концентрации от примерно 0,8 до примерно 1% маннита (мас./об.). Затем добавляют РОРС для получения смеси димера ApoA-I Milano и РОРС в соотношении примерно 1:0,95 (масса белка/масса липида). Смесь перемешивают при 5000 об./мин в течение примерно 20 мин, используя подвесную пропеллерную мешалку и Ultra Turrax и поддерживая температуру от 37 до 43 С. Питающий сосуд перемешивают непрерывно при 300 об./мин,поддерживая температуру от 32 до 43 С с помощью последовательно расположенных теплообменников(Avestin, Inc.). Гомогенизацию в течение первых 30 мин осуществляют при 50 МПа (7250 фунт-сила на кв.дюйм) и после этого давление поддерживают при 80-120 МПа (11600-17400 фунт-сила на кв.дюйм) до тех пор, пока промежуточное тестирование с помощью гель-фильтрации не продемонстрирует % AUC(площадь под кривой) более 70% между белковыми стандартами. Комплексы могут быть также получены в виде препаратов 10, 11, 12, 13 и 14 мг/мл, где масса представляет собой массу белка. Комбинированная терапияApo A-I Milano или липидные комплексы или их фармацевтические препараты могут быть исполь- 12010134 зованы в способах по настоящему изобретению раздельно или в комбинированной терапии с другими вмешательствами. Такие терапии включают, но не ограничиваются этим, одновременное или последовательное введение других лекарств. В некоторых воплощениях способы и препараты по изобретению могут быть использованы в комбинации с другими лекарствами для достижения способов, предложенных в данном изобретении. Совместное введение другого лекарства может осуществляться для лечения, предупреждения или облегчения сопровождающих заболеваний, состояний, расстройств или симптомов, например вводимые противоаритмические лекарства лечат одновременно имеющуюся аритмию. В некоторых воплощениях предложены способы совместного введения лекарств для лечения или предупреждения боли, сопровождающей острые коронарные синдромы. Как описано выше, традиционная терапия ишемических событий, включая инфаркт миокарда, стенокардию и острые коронарные синдромы, не нацелена на лежащую в основе патологию разорванных или нестабильных атеросклеротических бляшек. Например, субъект, имеющий сердечный дискомфорт в груди или другие ишемические симптомы, может быть подготовлен для срочного чрескожного коронарного вмешательства (ЧКВ) с помощью антикоагулянтов или антитромботических лекарств, таких как аспирин, клопидогрел, гепарин, эптифибатид или абциксимаб. Бета-адренергические блокаторы (-блокаторы) можно вводить для уменьшения частоты сердечных сокращений. Введение ингибиторов ангиотензин-превращающего фермента (ингибиторы АПФ) рекомендовано для субъектов, страдающих сопутствующей застойной сердечной недостаточностью (ЗСН) или дисфункцией левого желудочка (ЛЖ). Для субъектов, которые были реанимированы после внезапной сердечной смерти, рекомендуется введение амиодарона. Субъекта часто обеспечивают кислородом, обычно с помощью маски или назального катетера, и жизненные признаки тщательно контролируют, включая насыщение кислородом с помощью пульсовой оксиметрии. Для длительного лечения субъекту часто вводят статины (ингибиторы ГМГ-КоАредуктазы) для того, чтобы уменьшить уровни LDC. Например, Apo A-I Milano или липидный комплекс или его фармацевтический препарат можно вводить вместе с другими фармацевтически активными лекарствами, включающими, но не ограничивающимися этим, альфа/бета-адренергические антагонисты, антиадренергические агенты, альфа-1-адренергические антагонисты, бета-адренергические антагонисты, активаторы АМФ-киназы, ингибиторы ангиотензин-превращающего фермента (АПФ), антагонисты рецепторов ангиотензина II, блокаторы кальциевых каналов, противоаритмические агенты, вазодилататоры, нитраты, сосудосуживающие агенты,инотропные агенты, диуретики, антикоагулянты, антитромбоцитарные агенты, тромболитические агенты, противодиабетические агенты, антиоксиданты, противовоспалительные агенты, секвестранты желчных кислот, статины, ингибиторы белка-переносчика эфиров холестерина (СЕТР), агенты, снижающие уровень холестерина/регуляторы уровня липидов, лекарства, которые блокируют превращение арахидоновой кислоты, эстрогензамещающую терапию, аналоги жирных кислот, ингибиторы синтеза жирных кислот, фибраты, гистидин, производные никотиновой кислоты, агонисты или антагонисты рецептора,активируемого пероксисомальным пролифератором, ингибиторы окисления жирных кислот, талидомид или тиазолидиндионы (Drugs Facts and Comparisons, обновляемые ежемесячно, January 2003, WoltersKluwer Company, St. Louis, MO; Physicians Desk Reference (56-е издание, 2002) Medical Economics). Другие лекарства отдельно или в комбинации, которые могут дополнять или усиливать полезные свойства Apo A-I Milano, липидных комплексов или их фармацевтических препаратов, включают, но не ограничиваются этим, альфа/бета-адренергические антагонисты ("-блокаторы"), такие как карведиол(Coreg); лабеталол HCl (Normodyne); антиадренергические агенты, такие как гуанадрел (Hylorel); гуанетидин (Ismelin); резерпин, клонидин (Catapres и Catapres-TTS); гуанфацин (Tenex); гуанабенз(Wytensin); метилдопу и метилдопат (Aldomet); альфа-1-адренергический антагонист, такой как доксазозин (Cardura); празозин (Minipress); теразозин (Hytrin) и фентоламин (Regitine); бета-адренергические антагонисты, такие как соталол (Betapace AF и Betapace); тимолол (Blocadren); пропранололMEDICA 16; ингибиторы ангиотензинпревращающего фермента (АПФ), такие как хинаприл (Accupril); беназеприл (Lotensin); каптоприл (Capoten); эналаприл (Vasotec); рамиприл (Altace); фозиноприл(Monopril); моэксиприл (Univasc); лизиноприл (Prinivil и Zestril); трандолаприл (Mavik), периндоприл (Aceon); и антагонисты рецепторов ангиотензина II, такие как кандесартан (Atacand); ирбесартан(Avapro); лозартан (Cozaar); валсартан (Diovan); телмисартан (Micardis); эпросартан (Tevetan) и олмесартан (Benicar); блокаторы кальциевых каналов, такие как нифедипин (Adalat, Adalat CC, Procardia и Procardia XL); верапамил (Calan, CalanSR, Covera-HS, IsoptinSR, Verelan и VerelanPM); дилтиазем (Cardizem, CardizemCD и Tiazac); нимодипин (Nimotop); амлодипин (Norvasc); фелодипин (Plendil); низолдипин (Sular); бепридил (Vascor); исрадипин (DynaCirc) и никардипин(Cardene); противоаритмические агенты, такие как различные хинидины; прокаинамид (Pronestyl и(Lanoxin); вазодилататоры, такие как диазоксид (Hyperstat IV); гидралазин (Apresoline); фенолдопам(Corolpam); миноксидил (Loniten) и нитропруссид (Nipride); нитраты, такие как изосорбида динитрат(Nitrol); различные нитроглицериновые пластыри; нитроглицерин SL (Nitrostat), нитролингвальный спрей и нитроглицерин IV (Tridil); сосудосуживающие агенты, такие как норэпинефрин (Levophed) и фенилэфрин (Neo-Synephrine); инотропные агенты, такие как амринон (Inocor); дофамин (Intropine); добутамин (Dobutrex); эпинефрин (Adrenalin); изопротеренол (Isuprel), милринон (Primacor); диуретики, такие как спиронолактон (Aldactone); торсемид (Demadex); гидрофлуметиазид (Diucardin); хлортиазид (Diuril); этакриновую кислоту (Edecrin); гидрохлортиазид (hydroDIURIL и Microzide); амилорид (Midamor); хлорталидон (Thalitone и Hygroton); буметанид (Bumex); фуросемид (Lasix); индапамид (Lozol); метолазон (Zaroxolyn); триамтерен (Dyrenium) и комбинации триамтерена и гидрохлортиазида (Dyazide и Maxzide); антитромботические средства/антикоагулянты/антитромбоцитарные средства, такие как бивалирудин (Angiomax); лепирудин (Refludan); различные гепарины; данапароид(Orgaran); различные низкомолекулярные гепарины; далтепарин (Fragmin); энокзапарин (Lovenox); тинзапарин (Innohep); варфарин (Coumadin); дикумарол (Dicoumarol); анизиндион (Miradone); аспирин; аргатробан (Argatroban); абциксимаб (Reopro); эптифибатид (Integrilin); тирофибан (Aggrastat); клопидогрел (Plavix); тиклопидин (Ticlid); и дипиридамол (Persantine); тромболитики, такие как альтеплаза (Activase); активатор тканевого плазминогена (ТРА) (Activase); анистреплазу, APSAC (Eminase); ретеплазу, rPA (Retavasae); стрептокиназу, SK (Streptase); урокиназу (Abbokinase); противодиабетические агенты, такие как метформин (Glucophage); глипизид (Glucotrol); хлорпропамид (Diabinese); ацетогексамид (Dymelor); толазамид (Tolinase); глимеприд (Amaryl); глибурид (DiaBeta и Micronase); акарбозу (Precose); миглитол (Glyset); репафлинид (Prandin); натеглинид (Starlix); розиглитазон(Avandia) и пиоглитазон (Actos); антиоксиданты и противовоспалительные агенты; секвестранты желчных кислот, такие как холестирамин (LoCholest, Prevalite и Questran); колестипол (Colestid) и колесевелам (Welchol); статины (лекарства, которые ингибируют ГМК-КоА-редуктазу), такие как ровастатин (Crestor); флувастатин (Lescol); аторвастатин (Lipitor); ловастатин (Mevacor); правастатин(Pravachol) и симвастатин (Zocor); ингибиторы СЕТР; лекарства, которые блокируют превращение арахидоновой кислоты; эстрогензамещающую терапию; аналоги жирных кислот, такие как PD 72953,MEDICA 16, ESP 24232, и ESP 31015; ингибиторы синтеза жирных кислот; ингибиторы синтеза жирных кислот; ингибиторы окисления жирных кислот, ранолазин (Ranexa); фибраты, такие как клофибрат(Atromid-S); гемфиброзил (Lopid); капсулы микронизированного фенофибрата (Tricor); безафибрат и ципрофибрат; гистидин; производные никотиновой кислоты, такие как таблетки ниацина длительного высвобождения (Niaspan); агонисты или антагонисты рецептора, активируемого пероксисомальным пролифератором; талидомид (Thalomid) и соединения, описанные в патентах США 6459003, 6506799 и публикациях заявок США 20030022865, 20030018013, 20020077316 и 20030078239, содержания которых включены в данное описание путем ссылки во всей их полноте. Другие лекарства отдельно или в комбинации, которые могут дополнять или усиливать полезные свойства Apo A-I Milano или липидных комплексов или их фармацевтических препаратов, включают,например, антипролиферативные лекарства, подобные паклитакселу и топотекану (Brehm et al., 2001,Biochemical Pharmacology, 61 (1): 119-127), и противовоспалительные лекарства, такие как стероидные и нестероидные противовоспалительные агенты (включающие ингибиторы циклооксигеназы-2 (СОХ-2. Фармацевтические препараты В одном аспекте настоящего изобретения предложены препараты для лечения, уменьшения или предупреждения повреждения от острых коронарных синдромов путем введения фармацевтического препарата,содержащего Apo A-I Milano. В предпочтительных воплощениях Apo A-I Milano может находится в виде комплекса с липидом. В более предпочтительном воплощении Apo A-I Milano образует комплекс с POPC.Apo A-I Milano или его липидные комплексы можно вводить в форме фармацевтического препарата. Фармацевтический препарат, как описано в данном изобретении, включает добавление, например,приемлемого разбавителя, эксципиента, наполнителя или носителя. Как известно в данной области, добавление одного или более чем одного разбавителя, эксципиента, наполнителя или носителя делает препарат подходящим для введения субъекту и может обеспечивать другие предпочтительные свойства,такие как длительный срок хранения. Фармацевтические препараты типично содержат фармацевтически приемлемый носитель или наполнитель. Могут быть использованы многие фармацевтически приемлемые носители или наполнители. В примере, описанном в данном изобретении, используют сахарозоманнит. В качестве фармацевтическо- 14010134 го носителя или наполнителя часто используют нормальный физиологический раствор. Другие подходящие носители или наполнители включают глюкозу, трегалозу, сахарозу, стерильную воду, забуференную воду, 0,45%-ный физиологический раствор (половина нормального физиологического раствора) и 0,3%ный глицин и могут дополнительно включать гликопротеины для улучшения стабильности, такие как альбумин. Эти препараты можно стерилизовать с помощью традиционных, хорошо известных методов стерилизации. Полученные водные растворы могут быть упакованы для применения или профильтрованы в асептических условиях и лиофилизированы (высушены сублимацией). Лиофилизированный препарат можно затем объединить со стерильным водным раствором перед введением. Фармацевтические препараты могут также содержать фармацевтически приемлемые эксципиенты,которые требуется для того, чтобы приблизиться к физиологическим условиям, такие как агенты, регулирующие рН, и забуферивающие агенты, и агенты, регулирующие тоничность, например ацетат натрия,лактат натрия, хлорид натрия, хлорид калия и хлорид кальция. Для поддержания стерильности продукта,особенно фармацевтических препаратов, предназначенных для многодозового парентерального применения, могут быть добавлены противобактериальные агенты, например фенол, бензалкония хлорид или бензетония хлорид. В препаратах по изобретению также могут быть использованы суспендирующие,стабилизирующие и/или диспергирующие агенты. Фармацевтические препараты могут содержать аполипопротеин (Apo A-I Milano) в форме соли. Например, поскольку белки могут содержать кислотные и/или основные концы и/или боковые цепи, ApoA-I Milano может находиться в фармацевтических препаратах либо в виде свободных кислот или оснований, либо в виде фармацевтически приемлемых солей. Фармацевтически приемлемые соли могут включать подходящие кислоты, способные образовывать соли с Apo A-I Milano, включая, например, неорганические кислоты, такие как соляная кислота, бромисто-водородная кислота, хлорная кислота, азотная кислота, тиоциановая кислота, серная кислота, фосфорная кислота и т.п.; и органические кислоты, такие как муравьиная кислота, уксусная кислота, пропионовая кислота, гликолевая кислота, молочная кислота,пировиноградная кислота, щавелевая кислота, малоновая кислота, янтарная кислота, малеиновая кислота, фумаровая кислота, антраниловая кислота, коричная кислота, нафталинсульфоновая кислота, сульфаниловая кислота и т.п. Подходящие основания, способные образовывать соли с Apo A-I Milano, могут включать, например, неорганические основания, такие как гидроксид натрия, гидроксид аммония, гидроксид калия и т.п.; и органические основания, такие как моно-, ди- и триалкиламины (например, триэтиламин, диизопропиламин, метиламин, диметиламин и т.п.) и возможно замещенные этаноламины (например, этаноламин, диэтаноламин и т.п.). Фармацевтический препарат может находиться в различных формах, подходящих для любого пути введения, включая, но не ограничиваясь этим, парентеральный, энтеральный, местный путь или ингаляцию. Парентеральное введение относится к любому пути введения, который осуществляется не через пищеварительный тракт, включая, но не ограничиваясь этим, введение путем инъекции (т.е. внутривенное, внутримышечное и т.п., как описано в данном изобретении). Энтеральное введение относится к любому пути введения с использованием пищеварительного тракта, пероральному или ректальному, включая, но не ограничиваясь этим, таблетки, капсулы, пероральные растворы, суспензии, спреи и т.п., как описано в данном изобретении. Для целей этой заявки энтеральное введение также относится к вагинальному пути введения. Местное введение относится к любому пути введения через кожу, включая, но не ограничиваясь этим, кремы, мази, гели и трансдермальные пластыри, как описано в данном изобретении (см. также Remington's Pharmaceutical Sciences, 18th edition, Gennaro et al., eds., Mack PrintingCompany, Easton, Pennsylvania, 1990). Парентеральные фармацевтические препараты по настоящему изобретению можно вводить путем инъекции, например в вену (внутривенно), артерию (внутриартериально), мышцу (внутримышечно), под кожу (подкожно или в депо препарате), в перикард, в коронарные артерии. Инъецируемые фармацевтические препараты могут представлять собой фармацевтически подходящий препарат для введения непосредственно в сердце, перикард или коронарные артерии. В предпочтительных воплощениях фармацевтические препараты вводят путем инфузии в периферический сосуд субъекта, например, на руке или в локтевой ямке. Инъецируемые фармацевтические препараты могут представлять собой стерильные суспензии, растворы или эмульсии в водных или масляных наполнителях. Препараты для инъекции могут быть представлены в стандартной лекарственной форме, например в ампулах или многодозовых контейнерах, и могут содержать добавленные консерванты. Предпочтительными буферами для парентеральных фармацевтических препаратов являются фосфат, цитрат и ацетат. В другом воплощении фармацевтический препарат может быть предложен в порошковой форме для разведения перед применением подходящим носителем, включая, но не ограничиваясь этим, стерильную апирогенную воду, физиологический раствор или декстрозу. Для этой цели Apo A-I Milano может быть лиофилизирован или совместно лиофилизирован с липидом, как описано выше, когда это целесообразно. В другом воплощении фармацевтические препараты могут доставляться в стандартных лекарственных формах и разводиться перед применением. Для пролонгированной доставки фармацевтический препарат может быть предложен в виде депо препарата для введения путем имплантации, например подкожной, интрадермальной или внутримышеч- 15010134 ной инъекции. Так, например, фармацевтический препарат может быть приготовлен вместе с подходящими полимерными или гидрофобными материалами (например, в виде эмульсии в подходящем масле) или ионообменными смолами или в виде труднорастворимых производных; например в виде труднорастворимой солевой формы Apo A-I Milano или комплекса Apo A-I Milano:липид. В другом воплощении фармацевтический препарат представляет собой чрескожную систему доставки,изготовленную в виде липкого диска или пластыря, который медленно высвобождает активный ингредиент в процессе чрескожной абсорбции. В этом воплощении могут быть использованы усилители проницаемости для облегчения проникания Apo A-I Milano через кожу. В другом воплощении чрескожный фармацевтический препарат может дополнительно содержать нитроглицерин для применения у пациентов со стенокардией. Для введения путем ингаляции фармацевтический препарат может доставляться с помощью аэрозольного спрея из упаковок, находящихся под давлением, или через небулайзер с использованием подходящего пропеллента, например дихлордифторметана, трихлордифторметана, дихлортетрафторэтана, диоксида углерода или другого подходящего газа. В случае аэрозоля, находящегося под давлением, единица дозирования может быть обеспечена путем снабжения клапаном для доставки дозированного количества, например в виде дозирующего ингалятора. Капсулы и картриджи, например, из желатина для применения в ингаляторе или инсуффляторе могут быть приготовлены таким образом, чтобы содержать порошковую смесь Apo A-I Milano и подходящего порошкового основания, такого как лактоза или крахмал. Препараты, при желании, могут быть представлены в упаковке или раздаточном устройстве, которое может содержать одну или более чем одну стандартную лекарственную форму, содержащую фармацевтические препараты Apo A-I Milano. Упаковка, например блистерная упаковка, может содержать, например, металлическую или полимерную пленку. Упаковка или раздаточное устройство может иметь этикетку или инструкции для введения. В некоторых воплощениях фармацевтический препарат Apo A-I М или комплекса Apo A-IMilano:липид может содержать концентрацию Apo A-I Milano, достаточную для лечения субъекта, нуждающегося в этом. В некоторых воплощениях фармацевтический препарат Apo A-I Milano или комплексаApo A-I Milano:липид может содержать концентрацию Apo A-I Milano от примерно 5 до примерно 50 мг/мл. В предпочтительных воплощениях препараты могут содержать Apo A-I Milano в концентрации от примерно 10 до примерно 20 мг/мл. В более предпочтительном воплощении препараты могут содержать ApoA-I Milano в концентрации от примерно 13 до примерно 16 мг/мл. Концентрация Apo A-I Milano может быть определена любым подходящим методом, известным специалистам в данной области. В некоторых воплощениях концентрацию Apo A-I Milano определяют с помощью эксклюзионной высокоэффективной жидкостной хроматографии (SE-HPLC). В некоторых воплощениях фармацевтический препарат Apo A-I М или комплекса Apo A-I Milano:липид может содержать концентрацию липида, достаточную для образования комплексов с Apo A-I Milano. В некоторых воплощениях липид представляет собой фосфолипид. В предпочтительных воплощениях липид представляет собой РОРС. В некоторых воплощениях фармацевтический препарат Apo A-I Milano или комплекса Apo A-I Milano:липид может содержать концентрацию РОРС от примерно 1 до примерно 50 мг/мл. В предпочтительных воплощениях препараты могут содержать РОРС в концентрации от примерно 5 до примерно 25 мг/мл. В более предпочтительном воплощении препараты могут содержать РОРС в концентрации от примерно 10 до примерно 20 мг/мл. В еще более предпочтительном воплощении препараты могут содержать РОРС в концентрации от примерно 11 до примерно 17 мг/мл. Концентрация РОРС может быть определена любым подходящим методом, известным специалистам в данной области. В некоторых воплощениях концентрацию РОРС определяют с помощью высокоэффективной жидкостной хроматографии. В предпочтительных воплощениях фармацевтический препарат комплекса Apo A-I Milano:липид может содержать сахарозу в количестве, достаточном для изготовления фармацевтически подходящего препарата Apo A-I Milano или комплекса Apo A-I Milano:липид. В некоторых воплощениях фармацевтические препараты могут содержать от примерно 0,5 до примерно 20% сахарозы. В некоторых воплощениях фармацевтические препараты могут содержать от примерно 3 до примерно 12% сахарозы. В некоторых воплощениях фармацевтические препараты могут содержать от примерно 5 до примерно 7% сахарозы. В предпочтительных воплощениях фармацевтические препараты могут содержать от примерно 6,0 до примерно 6,4% сахарозы. В наиболее предпочтительном воплощении фармацевтический препарат может содержать 6,2% сахарозы. В предпочтительных воплощениях фармацевтический препарат комплекса Apo A-I Milano:липид может содержать маннит в количестве, достаточном для изготовления фармацевтически подходящего препарата Apo A-I Milano или комплекса Apo A-I Milano:липид. В некоторых воплощениях фармацевтические препараты могут содержать от примерно 0,01 до примерно 5% маннита. В некоторых воплощениях фармацевтические препараты могут содержать от примерно 0,1 до примерно 3% маннита. В некоторых воплощениях фармацевтические препараты могут содержать от примерно 0,5 до примерно 2% сахарозы. В предпочтительных воплощениях фармацевтические препараты могут содержать от примерно 0,8 до примерно 1% маннита. В наиболее предпочтительном воплощении фармацевтический препарат может содержать 0,9% маннита. В некоторых воплощениях фармацевтический препарат комплекса Apo A-I Milano:липид может со- 16010134 держать буфер в количестве, достаточном для изготовления фармацевтически подходящего препаратаApo A-I Milano или комплекса Apo A-I Milano:липид. В некоторых воплощениях фармацевтические препараты могут содержать фосфатный буфер. В некоторых воплощениях концентрация буфера может составлять от примерно 3 до примерно 25 мМ. В некоторых воплощениях концентрация буфера может составлять от примерно 5 до примерно 20 мМ. В предпочтительных воплощениях концентрация буфера может составлять от примерно 8 до примерно 15 мМ. В некоторых воплощениях добавляют подходящий буфер для доведения рН фармацевтического препарата до диапазона, подходящего для введения субъекту. В некоторых воплощениях фармацевтический препарат может иметь рН от примерно 6,8 до примерно 7,8. В некоторых воплощениях фармацевтический препарат может иметь рН от примерно 7,0 до примерно 7,8. В некоторых воплощениях фармацевтические препараты могут иметь рН от примерно 7,2 до примерно 7,5. В предпочтительных воплощениях фармацевтический препарат может иметь рН примерно 7,5. В некоторых воплощениях фармацевтический препарат комплекса Apo A-I Milano:липид имеет осмоляльность, которая является подходящей для введения субъекту. В некоторых воплощениях осмоляльность препарата может составлять от примерно 200 до примерно 400 мОсм. В некоторых воплощениях фармацевтический препарат может иметь осмоляльность от примерно 220 до примерно 380 мОсм. В некоторых воплощениях фармацевтический препарат может иметь осмоляльность от примерно 260 до примерно 340 мОсм. В предпочтительных воплощениях фармацевтический препарат может иметь осмоляльность от примерно 280 до примерно 320 мОсм. В наиболее предпочтительном воплощении фармацевтический препарат может иметь осмоляльность примерно 290 мОсм. Препараты по изобретению обеспечивают комплекс Apo A-I Milano:липид, имеющий чистоту, достаточную для введения субъекту. В некоторых воплощениях фармацевтический препарат может содержать Apo A-I Milano с чистотой примерно 98% или более, примерно 96% или более, примерно 95% или более, примерно 93% или более, примерно 91% или более или примерно 90% или более. В предпочтительном воплощении чистота Apo A-I Milano составляет примерно 90% или более. Чистота Apo A-I Milano может быть определена любым подходящим методом, известным специалистам в данной области. В некоторых воплощениях чистота Apo A-I Milano может быть определена с помощью эксклюзионной HPLC. Препараты по изобретению обеспечивают комплекс Apo A-I Milano:липид с РОРС, имеющим чистоту, достаточную для введения субъекту. В некоторых воплощениях фармацевтический препарат может содержать РОРС с чистотой примерно 98% или более, примерно 96% или более, примерно 95% или более, примерно 93% или более, примерно 91% или более или примерно 90% или более. В предпочтительном воплощении чистота РОРС составляет более примерно 90%. Чистота РОРС может быть определена любым подходящим методом, известным специалистам в данной области. В некоторых воплощениях чистота РОРС может быть определена с помощью HPLC. В некоторых предпочтительных воплощениях комплекс Apo A-I Milano:липид содержит количества липидного гидропероксида примерно 10% или ниже, примерно 8% или ниже, примерно 6% или ниже,примерно 4% или ниже, примерно 2% или ниже, примерно 1% или ниже детектируемых пределов, как определено с помощью анализа окисление двухвалентного железа/ксиленол оранжевый (Jiang, et al.,1992, Anal. Biochem. 202: 384-389). В некоторых воплощениях комплекс Apo А-I М:РОРС имеет чистоту более 85% (измеренную как % от общей площади пика), как определено гель-проникающей хроматографией. В некоторых воплощениях препарат почти не содержит или вовсе не содержит эндотоксины. В предпочтительных воплощениях препарат имеет содержание эндотоксинов менее 0,04 ЭЕ (эндотоксиновая едница)/мг Apo A-I Milano. В некоторых воплощениях в препарате количество частиц размером более 10 мкм может составлять менее примерно 6000 на флакон емкостью 50 мл, как определено с помощью обскурации света. В некоторых воплощениях количество частиц с размером более 25 мкм составляет менее примерно 600 на флакон емкостью 50 мл, как определено с помощью обскурации света. В предпочтительном воплощении фармацевтический препарат комплекса Apo A-I Milano:липид получают путем разведения rApo A-I Milano водой для инъекции до концентрации 15 мг/мл в растворе. Добавляют фосфат натрия до конечной концентрации 9-15 мМ фосфата и для того, чтобы довести рН до величины от примерно 7,0 до примерно 7,8. Добавляют маннит для достижения концентрации от примерно 0,8 до примерно 1% маннит (мас./об.). Затем добавляют РОРС для достижения соотношения димера Apo A-I Milano к РОРС 1:0,95 (масса белка/масса липида). Смесь перемешивают при 5000 об./мин в течение примерно 20мин, используя подвесную пропеллерную мешалку и Ultra Turrax и поддерживая температуру от 37 до 43 С. В сосуде с сырьем осуществляют непрерывное перемешивание при 300 об./мин,поддерживая температуру от 32 до 43 С с помощью расположенных линейно теплообменников (Avestin,Inc.). Гомогенизацию в течение первых 30 мин осуществляют при 50 МПа (7250 фунт-сила на кв.дюйм) и после этого поддерживают давление при 80-120 МПа (11600-17400 фунт-сила на кв.дюйм) до тех пор,пока промежуточное тестирование посредством гель-проникающей хроматографии не продемонстрирует% AUC более примерно 70% между белковыми стандартами. Осмоляльность комплекса затем доводят путем добавления от 6,0 до 6,4% сахарозы. Фармацевтический препарат комплекса Apo A-I Milano:POPC затем стерилизуют путем фильтрации через фильтры 0,22 мкм. В другом предпочтительном воплощении фармацевтический препарат содержит от примерно 12 до- 17010134 примерно 18 мг/мл рекомбинантного Apo A-I Milano, от примерно 11 до примерно 17 мг/мл 1-пальмитоил-2-олеоил-sn-глицеро-3-фосфохолина при рН 7,4, 6,2% сахарозы и 0,9% маннита, имеет осмоляльность от примерно 280 до примерно 320 мОсм. Фармацевтический препарат может содержать rApo A-I M с чистотой примерно 90%, РОРС с чистотой примерно 97%. В одном воплощении ни одной примеси не может содержаться более примерно 2%. Фармацевтический препарат можно хранить замороженным (от примерно -15 до примерно -25 С). В некоторых воплощениях препараты могут представлять собой холодные растворы, замороженные растворы или лиофилизированные растворы. Предпочтительно, чтобы такие препараты были оттаяны и нагреты до комнатной температуры перед введением субъекту. Для того, чтобы избежать денатурации белка, рекомендуется осторожное оттаивание и нагревание. В другом предпочтительном воплощении препараты могут находиться в стерильных стеклянных флаконах объемом от примерно 2 до примерно 250 мл, предпочтительно от примерно 10 до примерно 100 мл, наиболее предпочтительно примерно 50 мл, содержащих фармацевтический препарат, содержащий комплекс Apo A-I Milano:фосфолипид. В некоторых воплощениях фармацевтические препараты могут содержать от примерно 10 до примерно 15 мг/мл комплекса Apo A-I Milano:фосфолипид в конечном заполненном объеме от примерно 39 до 41 мл на флакон. Количество комплекса Apo A-I Milano:фосфолипид может составлять от примерно 500 до 750 мг во флаконе объемом 50 мл. Фармацевтические препараты могут быть предназначены для однократного, одноразового применения или могут содержать противомикробные эксципиенты, как описано выше, что делает фармацевтические препараты подходящими для многократного применения, например флакон для многократного применения. В некоторых воплощениях фармацевтические препараты могут находиться в дозированных упаковках. Как известно специалистам в данной области, дозированная упаковка представляет собой удобную, установленного размера, готовую для использования пациентом порцию, снабженную этикеткой для адресного распределения учреждениями и специалистами, обеспечивающими медицинское обслуживание. Дозированная упаковка содержит фармацевтический препарат в количестве, необходимом для типичного интервала лечения и продолжительности для данного показания. В способах и препаратах по изобретению предложена дозированная упаковка фармацевтического препарата, содержащая, например, комплекс Apo A-I Milano:фосфолипид в количестве, достаточном для лечения взрослых мужчины или женщины среднего роста дозой 15 мг/кг 1 раз в неделю в течение 5 недель. В одном воплощении дозированная упаковка может содержать фармацевтический препарат, содержащий комплекс Apo A-IMilano:фосфолипид в количестве, достаточном для лечения взрослого субъекта среднего роста дозой 45 мг/кг 1 раз в неделю в течение 6 недель. Специалистам в данной области будет очевидно, что дозы,описанные в данном изобретении, основаны на массе субъекта. Фармацевтические препараты могут быть снабжены этикетками и имеют сопровождающую аннотацию для идентификации препарата, содержащегося в упаковке, и другие сведения, полезные для учреждений и специалистов, обеспечивающих медицинское обслуживание, и субъектов для лечения и предупреждения сердечно-сосудистых и сосудистых расстройств, острых коронарных синдромов, ишемических расстройств и для стабилизации бляшек, включая, но не ограничиваясь этим, инструкции по применению,дозу, интервал между приемом доз, продолжительность лечения, показания для применения, противопоказания, предостерегающие указания, меры предосторожности, инструкции по обороту и хранению и т.п. В других воплощениях настоящего изобретения предложены наборы для лечения или предупреждения сердечно-сосудистых и сосудистых расстройств, острых коронарных синдромов, ишемических расстройств и для стабилизации бляшек. Эти наборы содержат одну или более чем одну эффективную дозу Apo A-I Milano или комплекса Apo A-I Milano:липид или их фармацевтических препаратов вместе с этикеткой или инструкциями по применению Apo A-I Milano или комплекса Apo A-I Milano:липид или их фармацевтических препаратов для лечения или предупреждения острых коронарных синдромов в соответствии со способами по изобретению. В некоторых воплощениях наборы могут содержать компоненты, полезные для осуществления способов, такие как устройства для доставки Apo A-I Milano или комплекса Apo A-I Milano:липид или их фармацевтических препаратов, и компоненты для безопасного размещения этих устройств, например определенный контейнер. В некоторых воплощениях наборы могут содержать Apo A-I Milano или комплекс Apo А-I Milano:липид или их фармацевтические препараты в предварительно заполненных шприцах, порционных или дозированных упаковках. Примеры Настоящее изобретение будет дополнительно объяснено путем ссылки на следующие неограничивающие примеры. Пример 1. Переносимость ЕТС-216. Этот пример демонстрирует безопасность и переносимость ЕТС-216 здоровыми волонтерами. Двойное слепое плацебо-контролируемое исследование проводили для того, чтобы определить безопасность и переносимость Apo A-I Milano и фосфолипида. Apo A-I Milano был подвергнут комплексообразованию с фосфолипидом (РОРС) в соотношении 1:1 по массе и обозначен как ЕТС-216. Исследование оценивало безопасность и переносимость пяти повышающихся доз для однократной внутривенной инфузии ЕТС-216 у здоровых мужчин-волонтеров и двух различных доз у здоровых женщин-волонтеров.- 18010134 Перед исследованием от всех волонтеров было получено согласие, основанное на полученой информации. 32 здоровым волонтерам ("субъектам") в возрасте от 18 до 50 лет вводили внутривенные дозы ЕТС 216. Мужчинам вводили дозы вплоть до 100 мг/кг включительно. Женщинам вводили дозы вплоть до 50 мг/кг включительно. Пол субъекта, доза и скорость указаны в табл. 1 ниже. Таблица 1 Мониторинг неблагоприятных событий включал клиническую лабораторную оценку, физическое обследование и основные показатели состояния организма. Субъектов наблюдали в течение 27 суток после введения доз. 20 из 32 субъектов в этом исследовании сообщили о неблагоприятных событиях, все из которых были от слабых до умеренных. Неблагоприятные события, которые имели место у 2 или более субъектов,рассматривали как возможно относящиеся к лечению изучаемым лекарством. Эти неблагоприятные события и число субъектов, переживающих эти неблагоприятные события, представляли собой люмфопению (11 субъектов), лейкоцитоз (10 субъектов), тошноту (6 субъектов), головную боль и диарею (4 субъекта), рвоту (3 субъекта) и абдоминальную боль и гипертриглицеридемию (2 субъекта). О большинстве возможно связанных неблагоприятных событий (желудочно-кишечных и лейкоцитарных расстройств) было сообщено после инфузии 50 или 100 мг/кг ЕТС-216 мужчинам. Два неблагоприятных события (гипопротеинемия и аномальная функция печени), которые наблюдались у субъектов, пролеченных плацебо, рассматривали как возможно имеющие отношение к лечению. Не было никаких смертельных случаев, тяжелых осложнений или отмены лечения из-за неблагоприятных событий. Как показано на фиг. 1, сывороточные уровни неэтерифицированного холестерина ЛПВП у мужчин через 30 мин после однократной дозы ЕТС-216 увеличивались при дозах 15 мг/кг и более высоких дозах. Титры антител к Apo A-I Milano тестировали в сыворотке перед инфузией и вплоть до 27 суток после инфузии. Не было никакого существенного антительного ответа у какого-либо субъекта после однократного введения дозы. Конечный период полувыведения приблизительно 100 ч поддерживает обоснование для осуществления первоначального многодозового исследования у людей с использованием 7-дневного режима введения доз. Эти результаты показывают, что ЕТС-216 был безопасным и хорошо переносился при всех дозах и никаких серьезных неблагоприятных событий не наблюдалось. Пример 2. Эффективность различных доз ЕТС-16 в отношении регрессии атеросклероза. Этот пример демонстрирует эффективность доз ЕТС-216 15 и 45 мг/кг в регрессии коронарного атеросклероза у субъектов с острыми коронарными синдромами. Это исследование было рандомизированным, двойным слепым, плацебо-контролируемым многодозовым исследованием для оценки эффективности и безопасности ЕТС-216 у субъектов с острыми коронарными синдромами, как определено с помощью внутрисосудистого ультразвукового исследования. Перед началом любой конкретной процедуры исследования все субъекты давали согласие, основанное на полученной информации, утвержденное Комиссией по биомедицинской этике (Institutional Review Board,IRB) каждого участвующего института. Подходящими субъектами были те, у кого диагностировали острые коронарные синдромы (нестабильную стенокардию, инфаркт миокарда без зубца Q или инфаркт миокарда с подъемом ST) не позднее 14 суток до скрининга и кому назначили коронарную ангиографию и/или чрескожное коронарное вмешательство (ЧКВ) и отложили процедуру на 24 ч. Субъектов, удовлетворяющих этим критериям, исклю- 19010134 чали из исследования в случае, если их процедуру считали срочной и/или считали, что она несет высокий риск сильных осложнений, что определялось лечащим врачом. Первичная конечная точка эффективности представляла собой изменение (конец лечения минус предварительное лечение) процентного объема атеромы в 30-80 мм сегменте одной пораженной (визуализированной) коронарной артерии, определяемое с помощью внутрисосудистого ультразвукового исследования (IVUS). Положительный результат определяли как отрицательное изменение процентного объема атеромы с доверительными интервалами (ДИ), не включающими ноль. Вторичные конечные точки эффективности представляли собой среднее изменение общего объема атеромы и средней максимальной толщины атеромы. Вторичные конечные точки эффективности устанавливали для IVUS и ангиографии. Что касается IVUS, то вторичные конечные точки эффективности представляли собой: 1) номинальное изменение (конец лечения минус предварительное лечение) общего "объема" бляшки, измеренного путем усреднения площадей бляшек для всех срезов анатомически сравнимых сегментов пораженной коронарной артерии; 2) номинальное изменение (конец лечения минус предварительное лечение) средней максимальной толщины бляшек для всех срезов анатомически сравнимых сегментов пораженной коронарной артерии; 3) "объем" наименее и наиболее пораженного сегмента: а) номинальное изменение (конец лечения минус предварительное лечение) "объема" сегмента бляшки для 10 мм последовательных срезов от исходной величины, содержащей минимальную процентную площадь бляшки (определенную как наименее пораженный сегмент); б) номинальное изменение (конец лечения минус предварительное лечение) "объема" сегмента бляшки для 10 мм последовательных срезов от исходной величины, содержащей наибольшую процентную площадь бляшки (определенную как наиболее пораженный сегмент). Вторичные конечные точки эффективности для ангиографии представляли собой: 1) средний диаметр коронарного просвета во всех измеренных коронарных сегментах; 2) количество новых ангиографических повреждений в каждой подгруппе лечения; 3) долю субъектов с одним или более новыми ангиографическими коронарными повреждениями в конце лечения; 4) количество участков с уже имеющимся повреждением, демонстрирующим регрессию; 5) количество участков с уже имеющимся повреждением, демонстрирующим прогрессию; 6) долю субъектов, демонстрирующих "регрессию" в любом из уже имеющихся повреждений; 7) долю субъектов, демонстрирующих "прогрессию или никакого изменения" во всех уже имеющихся повреждениях; 8) долю субъектов, демонстрирующих "регрессию или никакого изменения" во всех уже имеющихся повреждениях. Способы для IVUS анализировали, как описано Nissen в Am. J. Cardiol. 87: 15 А-20 А, 2001, включенном в данное описание путем ссылки во всей его полноте. Кратко, оператор, отцифровавший IVUS видеоленту, просматривал в замедленном темпе и выбирал начало наиболее дистальной боковой ветви в качестве начальной точки для анализа, как показано на фиг. 2(А). Затем для анализа выбирали каждое 30-е изображение, представляя ряд поперечных сечений, расположенных на расстоянии точно 0,5 мм друг от друга. Конечное анализируемое поперечное сечение представляло собой наиболее проксимальное изображение в последовательности до появления левой основной коронарной артерии или устья правой коронарной артерии (проксимального фидуциарного участка), как показано на фиг. 2(B)-2(D). Процедуру повторяли для дополнительной проверки с использованием идентичных опознавательных точек для гарантии того, что в обеих временных точках анализировали идентичный сегмент. Осуществляли как прямые, так и производные IVUS измерения. Прямые IVUS измерения осуществляли в соответствии со стандартами Американского Колледжа Кардиологии и Европейского Общества Кардиологии (Mintz et al., 2001, J. Am. Coll. Cardiol. 37: 1478-92, включенный в данное описание путем ссылки во всей его полноте). Используя изображение 1,62 Национального института здоровья США(NIH) (общедоступные программы NIH), оператор осуществлял процедуру калибровки путем измерения 1 мм знаков координатной сетки, кодируемых в IVUS изображении, с помощью сканера. Для каждого поперечного сечения оператор вручную выполнял планиметрию для выявления передних кромок просвета и границ наружной эластичной мембраны (фиг. 3(A)-3(D. Также непосредственно измеряли максимальную толщину атеромы. Точность и воспроизводимость этих способов ранее уже были описаны,демонстрируя, что после калибровки средние значения IVUS измерений площади поперечного сечения находились в пределах 0,5% реальных размеров точно нацеленных (precision-drilled) люцитных фантомов, вариьрующих по площади от 3,24 до 27,99 мм 2 (Schoenhagen et al., 2003, J. Am. Soc. Echocardiogr. 16: 277-84, включенный в данное описание путем ссылки во всей его полноте). Вариабельность результатов измерений между разными исследователями показала стандартное отклонение 2,9%. Производные IVUS измерения включали расчет площади атеромы, определяемой как площадь наружной эластичной мембраны (ЕЕМ) минус площадь просвета сосуда. Поскольку изображения поперечных сечений были получены с 0,5 мм интервалами, общий объем атеромы можно было рассчитать, используя правило Симпсона, как среднюю площадь атеромы, умноженную на длину обратного образа в- 20010134 миллиметрах. Процентный объем атеромы вычисляли следующим образом: ( площадей атеромы/ ЕЕМ площадей)100 (см., например, Nissen et al., 2003, JAMA 290: 2292-2300). Анализ результатов коронарной ангиографии осуществляли в центральной лаборатории при Кливлендской клинике (Cleveland ClinicFoundation), используя стандартизованные методы, разработанные для уменьшения вариабельности измерений. Сравнение диаметра кончика ангиографического катетера с его известным размером использовали для калибровки системы. Ангиографическая конечная точка представляла собой изменение среднего диаметра просвета коронарной артерии от исходной величины к конечной величине. 57 субъектов были рандомизированы для получения 15 мг/кг ЕТС-216, 45 мг/кг ЕТС-216 или соответствующего объема плацебо каждые 7-е сутки (1 сутки) с максимумом вплоть до пяти внутривенных доз. Субъектов рандомизировали для получения 15 мг/кг ЕТС-216, 45 мг/кг ЕТС-216 или плацебо в соотношении 2:2:1. 47 субъектов завершили это исследование. Дозу 15 мг/кг вводили внутривенной инфузией в течение примерно 50 мин, а дозу 45 мг/кг вводили внутривенной инфузией в течение примерно 150 мин. Для некоторых субъектов скорость инфузии увеличивали из-за появления тошноты. Все внутривенные инфузии осуществляли периферически. Субъектов контролировали с помощью клинических лабораторных параметров, включающих уровни антител на ЕТС-216, физическое обследование, основные показатели состояния организма, электрокардиограммы (ЭКГ) и частоту и интенсивность клинических неблагоприятных событий. Ангиографию и IVUS проводили на каждом пациенте дважды. От первой временной точки после завершения начального скринингового осмотра до второй проходило приблизительно 2 недели (7 суток) после последней дозы исследуемого лекарства. Положительные результаты были получены в отношении первичной конечной точки, как просуммировано в табл. 2 ниже. В комбинированной группе лечения (пациенты, которые получали либо дозу 15 мг/кг,либо дозу 45 мг/кг ЕТС-216) изменение среднего (стандартное отклонение, или СО) процентного объема атеромы составляло -1,06% (3,17%). Медиана составляла -0,81% (95% ДИ, от -1,53% до -0,34%; р=0,02 по сравнению с исходной величиной). Для группы плацебо среднее (СО) изменение составляло 0,14% (3,09%). Медиана составляла 0,03% (95% ДИ, от -1,11% до 1,43%; р=0,97 по сравнению с исходной величиной). Таблица 2 Процентный объем атеромы в пораженном коронарном сегменте Стандартное отклонение. Интерквартальная широта. 3 Доверительный интервал. 4 Р величины для внутригруппового сравнения из рангового критерия Вилкоксона для попарных сравнений. Для межгруппового сравнения ЕТС-216, Apo A-I Milano:POPC комбинированный против плацебо из ковариационного анализа рангов изменения от исходной величины, со значением исходной величины в качестве ковариата, Р=0,29. 5 Заданная первичная конечная точка эффективности. 2 Что касается вторичных конечных точек, то положительные результаты также были получены, как показано в табл. 3 ниже. По сравнению с исходной величиной среднее (СО) изменение общего объема атеромы в комбинированной группе лечения составляло -14,1 мм 3 (39,5 мм 3; медиана -13,3 мм 3; 95% ДИ,от -20,7 до -7,2; р 0,001). Для группы плацебо соответствующее изменение составляло -2,9 мм 3 (23,3 мм 3).- 21010134 Медиана составляла -0,2 мм 3 (23,3 мм 3). Медиана составляла -0,2 мм 3 (95% ДИ, от -8,6 до 8,2; р=0,97). Среднее (СО) изменение максимальной толщины атеромы от исходной величины для комбинированной группы лечения составляло -0,042 мм (0,080 мм). Медиана составляла -0,035 мм (95% ДИ, от -0,058 до-0,020; р 0,002). Для группы плацебо соответствующее изменение составляло -0,008 мм (0,061 мм); медиана -0,009 (95% ДИ, от -0,035 до 0,026; р=0,83). См. табл. 4 ниже. Таблица 3 Общий объем атеромы в пораженном коронарном сегменте Р величины для внутригруппового сравнения из рангового критерия Вилкоксона для попарных сравнений. Для межгруппового сравнения ЕТС-216, Apo A-I Milano:POPC комбинированный против плацебо из ковариационного анализа рангов изменения от исходной величины, со значением исходной величины в качестве ковариата, Р=0,18. 2 Заданная вторичная конечная точка эффективности. Таблица 4 Средняя максимальная толщина атеромы в пораженном коронарном сегменте Р величины для внутригруппового сравнения из рангового критерия Вилкоксона для попарных сравнений. Для межгруппового сравнения ЕТС-216, Apo A-I Milano:POPC комбинированный против плацебо из ковариационного анализа рангов изменения от исходной величины, со значением исходной величины в качестве ковариата, Р=0,23. 2 Заданная вторичная конечная точка эффективности.- 22010134 Результаты показали, что ЕТС-216 эффективно уменьшает размер бляшки. Статистически значимая регрессия атеросклероза была продемонстрирована в обеих группах лечения. Пример 3. Ex vivo Лангендорф (Langendorff). Этот пример демонстрирует кардиопротективный эффект профилактического ЕТС-216 в подвергнутом реперфузии изолированном ишемизированном сердце кролика. В исследовании использовали самцов белых новозеландских кроликов, полученных из Charles River, массой приблизительно 2-3 кг. Самец белого новозеландского кролика был выбран в качестве подходящей тест-системы для целей этого исследования. Изолированное ишемизированное, а затем подвергнутое реперфузии сердце кролика является моделью инфаркта миокарда у человека. После прибытия животным присваивали уникальные идентификационные номера. Животных размещали в клетках из нержавеющей стали в соответствии с рекомендациями комиссии университета Мичигана по использованию и содержанию животных. Ветеринарная служба находится при Лаборатории медицины животных университета Мичигана. Университет Мичигана получил сертификат Американской ассоциации лиц по уходу за лабораторными животными, а программа использования животных соответствует стандартам, изложенным в Инструкции по содержанию и использованию лабораторных животных, DHEW (NIH) Publ. No. 86-23. ЕТС-216 представляет собой комплекс рекомбинантного аполипопротеина A-I Milano и 1-пальмитоил-2-олеоил-фосфатидилхолина в соотношении 1:1 по массе. Исходные растворы ЕТС-216 содержали 14 мг белка/мл в буфере с сахарозой и маннитом. Поскольку сахарозоманнитный буфер был несовместим с буфером Кребса-Хензелейта, а также для того, чтобы контролировать любые независимые эффекты только маннита, ЕТС-216 диализовали, чтобы получить фоновый буфер, состоящий из 2% глюкозы в 4 мМ фосфате натрия, рН 7,4. ЕТС-216 разбавляли буфером Кребса-Хензелейта с получением концентрации лекарства 0,45 мг/мл. Аналогично разбавляли наполнитель. Выбор дозы был основан на известных данных относительно доз, использованных в фазе I клинических испытаний на людях (Esperion) относительно безопасности однократных доз, где людям вводили дозы вплоть до 100 мг/кг ЕТС-216. Что касается исследований, описанных в этом протоколе, то концентрация 0,5 мг/мл приблизительно эквивалентна внутривенной дозе 25 мг/кг, вводимой человеку. Эксперименты проводили, используя аппарат Лангендорфа для перфузии кроличьих сердец. Кроликов умерщвляли путем цервикальной дислокации и сердца быстро выделяли и соединяли с канюлей для перфузии через аорту. Перфузионная среда состояла из циркулирующего буфера Кребса-Хензелейта(рН 7,4, 37 С; "KH"), который подвергали непрерывному воздействию смеси 95% О 2/5% CO2, и вводилась с постоянной скоростью 20-25 мл/мин. Сердца стимулировали на протяжении всего протокола посредством электродов, присоединенных к правому предсердию. Кардиостимулы передавались из лабораторного генератора прямоугольных волн (на 10% выше физиологической стимуляции, продолжительность 1 мс, Grass 588, Quincy, MA). Легочную артерию снабжали канюлей с системой трубок SilasticTM для облегчения сбора вытекающей из легочной артерии жидкости, представляющей собой коронарный венозный возврат в коронарный синус. На верхнюю и нижнюю полые вены и легочные вены накладывали лигатуру для того, чтобы предотвратить потерю перфузата из других перерезанных сосудов. Дренаж левого желудочка, термисторный зонд и латексный баллончик вводили через левое предсердие и размещали в левом желудочке. Наполненный жидкостью латексный баллончик соединяли жесткой трубочкой с катетерным датчиком давления Миллера, позволяющим измерять давление, развивающееся в левом желудочке. Внутрижелудочковый баллончик расширяли с помощью дистиллированной воды для того,чтобы достичь в левом желудочке первоначальной исходной величины конечного диастолического давления приблизительно 10 мм рт.ст. (1,33 кПа). Коронарное перфузионное давление измеряли с помощью датчика давления, соединенного с боковой ветвью аортальной канюли. Поскольку скорость перфузии коронарной артерии поддерживали постоянной, то изменения перфузионного давления в коронарной артерии служили индикатором изменений сопротивления в коронарной артерии. Все гемодинамические параметры контролировали непрерывно, используя многоканальный самописец, такой как Grass Polygraph 79D (Quincy, MA), подключенный к системе сбора данных Polyview Software Data Acquisition System. Сердца поддерживали при 37 С в течение всего эксперимента путем помещения сердца в двойную стеклянную камеру с регулируемой температурой и пропускания перфузионной среды через нагретый резервуар и систему доставки. Для экспериментальных процедур использовали две группы обработки, как показано ниже. Группа 1 2 Тестируемое вещество Наполнитель ЕТС-216 Сердца подвергали экспериментальной обработке, как показано на фиг. 5. Изолированные сердца стабилизировали в нормоксических (нормальный уровень кислорода) условиях в течение 20 мин перед тем, как индуцировать глобальную ишемию. В течение первых 10 мин этого периода сердца подвергали воздействию только буфера KH, а затем в течение еще 10 мин - буфера KH, содержащего либо наполни- 23010134 тель (группа 1), либо ЕТС-216 (группа 2). Затем сердца подвергали воздействию 30-минутного периода ишемии, а затем 60-минутного периода реперфузии буфером KH, содержащим наполнитель (группа 1) или ЕТС-216 (группа 2). Индукцию тотальной глобальной ишемии осуществляли путем прекращения потока перфузата в сердце, а реперфузию сердца осуществляли путем включения насоса с восстановлением первоначальной скорости потока. Аликвоты вытекающей из легочной артерии жидкости собирали из сердец во всех группах при исходном уровне (перед ишемией), и сначала каждую минуту вплоть до 5 мин, и каждые 5 мин после этого в течение периода реперфузии. Вытекающие жидкости анализировали на концентрацию креатинкиназы(фиг. 6), являющуюся признаком тканевого повреждения. Креатинкиназа представляет собой цитозольный фермент, высвобождающийся из необратимо поврежденных клеток. Сердечные функции постоянно контролировали (фиг. 7). Были определены конечные точки для сердца: 1 - электрокардиограма - скорость сердечных сокращений (электростимулированная) для того, чтобы определить наличие или отсутствие аритмий; 2 - давление, развивающееся в левом желудочке (фиг. 8) (данные представлены как среднеестандартная ошибка среднего для указанного количества сердец в каждой группе); 3 - dP/dt для левого желудочка; 4 - конечное диастолическое давление в левом желудочке (фиг. 9) (данные представлены как среднеестандартная ошибка среднего для указанного количества сердец в каждой группе); 5 - коронарное перфузионное давление (фиг. 10) (данные представлены как среднеестандартная ошибка среднего для указанного количества сердец в каждой группе); 6 - сбор лимфатической дренажной жидкости для определения высвобождения тканевой креатинкиназы до и после реперфузии (фиг. 6). После завершения экспериментального протокола биопсии из пяти сердец из каждой группы обработки сразу погружали в жидкий азот и хранили при -80 С для последующего анализа липидных гидропероксидов. Перед проведением анализа липидных пероксидов образцы гомогенатов нормализировали по содержанию белка (фиг. 11). В этом примере ЕТС-216 снижал сердечные липидные гидропероксиды на 46%. После завершения указанного протокола два сердца из каждой группы подвергали перфузии в течение 3 мин 2,5%-ным глутаральдегидом и 1%-ным LaCl3 в 0,1 М натрий-калкодилатном буфере (рН 7,4). Осмофильный LaCl3 в нормальных условиях удерживается в сосудистом компартменте, связанном с сосудистой стенкой, и служит индикатором целостности кровеносного сосуда. Просачивание LaCl3 во внесосудистое пространство использовали для того, чтобы показать наличие сосудистого повреждения. Образцы ткани из миокарда левого желудочка выделяли и разрезали на сегменты со стороной приблизительно 1 мм. Эти образцы фиксировали в течение еще 2 ч при 4 С в вышеуказанном буфере. После этого образцы обезвоживали последовательно в этаноле и погружали в ЕМ bed-812 (Electron Microscopy Sciences,Ft, Washington, PA). Тканевые блоки разрезали с помощью ультрамикротома Reichert и помещали на медные сетки с формваровым покрытием для последующего окрашивания 4%-ным уранилацетатом. Срезы изучали с помощью электронного микроскопа Phillips CM-10. Трансмиссионную электронную микроскопию использовали для анализа образцов миокарда из каждой исследуемой группы. Изображения показывают, что структурные признаки саркомеров из сердец,обработанных наполнителем, выражены слабо и полосы сокращения присутствуют. Митохондрии являются заметно набухшими с разрушенными кристаллическими и осмофильными тельцами включений. В сердцах, обработанных ЕТС-216, саркомерная структура является относительно нормальной и митохондрии кажутся не поврежденными лишь с минимальным набуханием. Фактическое отсутствие полос сокращения заметно контрастирует с полосами сокращения, наблюдамыми в контрольных сердцах. Способность ЕТС-216 предупреждать некроз полос сокращения согласуется с наблюдением, что сердца,предварительно обработанные ЕТС-216, не демонстрировали увеличение LVEDP после реперфузии. Как некроз полос сокращения, так и постоянное увеличение LVEDP связаны с увеличением перегрузки внутриклеточным кальцием и необратимым повреждением клеток. Наличие миофибриллярного размыванияZ-полос и разрушение миофибриллярной архитектуры указывают на значительное повреждение. Другое ожидаемое морфологическое повреждение включало разрушенные кристы и матрикс митохондрий, а также большие электронноплотные тельца в митохондриях. Кратность увеличения составляла 7900 х на обеих микрофотографиях (фиг. 12). Анализ концентраций креатинкиназы (фиг. 6) показал, что во время реперфузии имеет место быстрая фаза высвобождения фермента в венозный отток. Контрольные сердца (обработанные наполнителем) продемонстрировали заметное высвобождение креатинкиназы по сравнению с сердцами, обработанными ЕТС-216. Кроме того, сердца, обработанные ЕТС-216, продемонстрировали уменьшенное конечное диастолическое давление в левом желудочке (LVEDP) (фиг. 7 и 9), повышенное развивающееся давление в левом желудочке (фиг. 8), уменьшенное перфузионное давление в коронарной артерии (фиг. 10) и уменьшенное количество липидных гидропероксидов (LHP) по сравнению с контрольными сердцами(фиг. 11). Кроме того, ЕТС-216 защищал против морфологических изменений в миокарде (фиг. 12). Эти результаты демонстрируют кардиопротективные эффекты ЕТС-216 при введении перед ишемическим событием. Пример 4. Срочное и длительное введение в LAD (левая передняя нисходящая артерия) окклюдированное-реперфузированное сердце кролика в дозе 100 мг/кг. Этот пример демонстрирует кардиопротективные эффекты ЕТС-216 в модели региональной ишемии миокарда и реперфузии in vivo. Самец белого новозеландского кролика был выбран в качестве подходящей тест-системы для целей этого исследования из-за отсутствия коллатерального кровоснабжения в его сердце, что, соответственно, делает излишним использование определений миокардиального кровотока. В этом исследовании использовали различные режимы введения доз в отдельных группах кроликов, которых подвергали 30-минутной региональной ишемии миокарда путем наложения лигатуры на коронарную артерию и реперфузии. Использовали две схемы введения доз. В первом протоколе ЕТС-216 тестировали при однократной предварительной обработке, при которой сердце подвергают воздействию 100 мг/кг агента непосредственно перед началом региональной ишемии, тогда как во втором протоколе применяли две предварительные обработки дозой 100 мг/кг (за 1 сутки и непосредственно) до начала региональной ишемии. Эти протоколы представлены на фиг. 13. Это исследование было сконцентрировано на эффектах ЕТС-216 как кардиопротективного агента в исследовании in vivo, в котором сердце кролика подвергали региональной ишемии миокарда в течение 30 мин, а затем реперфузии в течение,минимум, 4 ч. Этот пример демонстрирует, что ЕТС-216 является кардиопротективным агентом при введении после ишемического события. Процедуры, используемые в этом исследовании, согласуются с рекомендациями комиссии университета Мичигана по использованию и содержанию животных. Ветеринарная служба находится при Лаборатории медицины животных университета Мичигана. Университет Мичигана получил сертификат Американской ассоциации лиц по уходу за лабораторными животными, а программа использования животных соответствует стандартам, изложенным в Инструкции по содержанию и использованию лабораторных животных, DHEW (NIH) Publ. No. 86-23. В исследовании использовали самцов белых новозеландских кроликов, полученных из CharlesRiver, массой приблизительно 2-3 кг. После прибытия животным присваивали уникальные идентификационные номера. Кроликов подвергали анестезии смесью ксилазина (3,0 мг/кг) и кетамина (35 мг/кг) внутримышечно, а затем внутривенной инъекции пентобарбитала натрия (30 мг/кг). Анестезию поддерживали внутривенными инъекциями раствора пентобарбитала (30 мг/мл). Вставляли эндотрахеальную трубку с манжетой и животных подвергали искусственной вентиляци легких комнатным воздухом под положительным давлением. Правую яремную вену изолировали и вставляли канюлю для введения ЕТС 216 или соответствующего объема наполнителя. Правую сонную артерию изолировали и оснащали датчиком давления в виде микронаконечника катетера MillarTM, расположенного непосредственно выше аортальных клапанов для того, чтобы контролировать кровяное давление в аорте и получать первую производную пульсовых колебаний давления (dP/dt). Электрокардиограму в отведении II контролировали в течение всего эксперимента. Осуществляли левую торакотомию и перикардиотомию с последующей идентификацией левой передней нисходящей (LAD) коронарной артерии. Шелковую хирургическую нить (3,0; Deknatel, Fall River, MA) пропускали сзади артерии и оба конца нити вставляли в короткую полиэтиленовую трубку. Понижение давления на полиэтиленовую трубку при распространении развивающегося напряжения на свободных концах нити сдавливает подстилающую коронарную артерию, что приводит к окклюзии сосуда и региональной ишемии миокарда. Окклюзию поддерживали в течение 30 мин,после чего напряжение на нити снимали и полиэтиленовую трубку извлекали, что делало возможным проведение реперфузии. Региональную ишемию миокарда подтверждали наличием участка в площади распределения окклюдированного сосуда и изменениями в электрокардиограмме, которые согласуются с наличием трансмуральной регионарной ишемии миокарда (подъем сегмента ST). Определение основной конечной точки состояло из измерений размера инфаркта в виде процента от левого желудочка и в виде процента от площади риска (фиг. 14 и 15). В конце исследования кроликам,находящимся в состоянии анестезии, давали гепарин (1000 ед. внутривенно), после чего их подвергали эвтаназии. Сердце иссекали и затем подготавливали для перфузии через аорту в аппарате Лангендорфа буфером Кребса-Хензелейта при постоянном потоке 22-24 мл/мин. Сердца промывали буфером в течение 10 мин для того, чтобы гарантировать, что ткань была чистой. 45 мл 1%-ного раствора трифенилтетразолия хлорида (ТТС) в фосфатном буфере (рН 7,4) перфузировали через сердце. ТТС разграничивает неинфаркный миокард в зоне риска с помощью красно-коричневого цвета, который указывает на присутствие формазанового осадка, являющегося результатом восстановления ТТС коферментами, присутствующими в жизнеспособной ткани миокарда. Необратимо поврежденная ткань, испытывающая недостаток цитозольных дегидрогеназ, не способна образовывать формазановый осадок и выглядит бледножелтой. На левую переднюю нисходящую (LAD) артерию накладывали лигатуру на участке, идентичном области, лигированной во время индукции региональной ишемии миокарда. Перфузионный насос останавливали и 2 мл 0,25%-ного раствора Эванса голубого медленно инъецировали через отверстие боковой ветви, соединенное с аортальной канюлей. Краситель пропускали через сердце в течение 10 с, чтобы- 25010134 обеспечить одинаковое распределение красителя. Присутствие Эванса голубого использовали для разграничения ткани левого желудочка, которая не была подвергнута региональной ишемии, от зоны риска. Сердце извлекали из перфузионного аппарата и разрезали на поперечные срезы под правыми углами к вертикальной оси. Правый желудочек, верхушку и предсердную ткань отбрасывали. Обе поверхности каждого поперечного среза копировали на чистые ацетатные листы. Изображения фотокопировали и увеличивали. Фотокопии сканировали и загружали в Adobe PhotoShop (Adobe Systems Inc., Seattle, WA). Площади нормального левого желудочка (NLV), участки без риска, площадь риска и инфаркта определяют путем вычисления количества пикселей, занимающих каждую площадь, с использованием программы Adobe PhotoShop. Общая площадь риска выражается в виде процента от левого желудочка. Размер инфаркта выражается в виде процента от площади риска (ARR) (фиг. 14 и 15). Показаны процент инфаркта от площади риска, процент инфаркта левого желудочка и процент площади риска левого желудочка у кроликов, обработанных 1 раз (т.е. срочная обработка) или обработанных 2 раза (т.е. длительная обработка) ЕТС-216 (100 мг/кг) или эквивалентным объемом наполнителя. Данные представляют собой среднеестандартная ошибка среднего для n=6 животных на группу. Звездочки на фиг. 14 указывают на значительное отличие от соответствующего контроля. Были сделаны и другие определения конечной точки. На предельный размер инфаркта могут оказывать влияние увеличения или уменьшения в утилизации миокардиального кислорода. Две важные детерминанты компенсации миокардиального кислорода представляют собой частоту сердечных сокращений и нагрузку давлением. Произведение частоты на давление (частота сердечных сокращенийсреднее артериальное кровяное давление) дает аппроксимацию изменения потребности сердца в миокардиальном кислороде. Поэтому произведение частота-давление вычисляли для того, чтобы определить, коррелировало ли наблюдаемое уменьшение размера инфаркта с изменением произведения частота-давление. Частоту сердечных сокращений и среднее аортальное давление контролировали постоянно на протяжении всего экспериментального протокола и данные использовали в исследовании каждой экспериментальной группы для расчета произведения частота-давление в конкретных временных точках. Процент площади риска левого желудочка уменьшался в сердцах, обработанных ЕТС-216, по сравнению с контролями как в случае срочного, так и длительного введения, однако, результаты не были статистически значимыми. Процент инфаркта площади риска и процент инфаркта левого желудочка существенно уменьшались в сердцах, обработанных ЕТС-216, по сравнению с контролями как для срочного,так и для длительного введения. Эти результаты показывают, что ЕТС-216 является кардиопротективным и при срочном введении, и при длительном введении. Можно сравнить креатинкиназную активность миокардиальной ткани в участках с риском и без риска. Принцип анализа основан на увеличении поглощения реакционной смеси при 340 нм в результате эквимолярного восстановления NAD до NADH. Скорость изменения поглощения прямо пропорциональна креатинкиназной активности. 1 единица определяется как количество фермента, которое продуцирует 1 мкмоль NADPH в минуту в условиях аналитической процедуры. Миокардиальная ткань, подвергнутая продолжительному периоду лишения кровотока (ишемии) без реперфузии, будет подвергаться морфологическим изменениям, характеризующим некроз наряду с присутствием воспалительных клеток. Морфологическая картина клеточной гибели, индуцированной ишемией, отличается от картины, наблюдающейся в результате реперфузии. Последняя характеризуется полосами сокращения и обозначается как некроз полос сокращения. Сердечную ткань из каждой группы фиксировали и препарировали для исследования путем электронной микроскопии. Ишемическое реперфузионное повреждение связано с накоплением воспалительных клеток, преимущественно нейтрофилов, в зоне риска. Миелопероксидаза (МРО) представляет собой фермент, присутствующий почти исключительно в нейтрофилах (Liu et al., J. Pharmacol. Exp. Ther. 287: 527-537, 1998). Поэтому ожидают, что ткань из соответствующих участков сердца можно анализировать на активность МРО в качестве индикатора повреждения. Также ожидают, что вмешательство, способное уменьшить воспалительный ответ, будет связано с уменьшением активности МРО в реперфузированной зоне риска по сравнению с сердечной тканью из зоны риска у необработанных животных. Таким образом, процентное изменение активности МРО (зона риска/зона без риска) будет уменьшаться в сердцах, обработанных лекарствами, по сравнению с контрольными сердцами, обработанными наполнителем. В конце эксперимента определяли активность тканевой миелопероксидазы (МРО) в предварительном,неконтролируемом, неутвержденном анализе. Образцы сердечной ткани получали из зоны риска и зоны без риска, и гомогенизировали в 0,5%-ном гексадецилтриметиламмония бромиде, и разводили в 50 мМ калий-фосфатном буфере, рН 6,0 (см. также Liu et al., 1998, J. Pharmacol. Exp. Ther. 287: 527-537). Гомогенаты центрифугировали при 12500 g при 4 С в течение 30 мин. Супернатанты собирали и подвергали взаимодействию с 0,167 мг/мл ортодианизидина дигидрохлорида (Sigma) и 0,0005% Н 2 О 2 в 50 мМ калийфосфатном буфере, рН 6,0. Изменение поглощения измеряли спектрофотометрически при 460 нм. 1 единицу МРО определяли как количество фермента, гидролизующего 1 ммоль Н 2 О 2/мин при 25 С. Результаты этого предварительного эксперимента, не представленные в данном описании, по-видимому, указывают на то, что не существуют никаких различий между сердцами, обработанными ЕТС-216 и наполнителем в- 26010134 плане ишемического реперфузионного повреждения, однако, эти результаты должны быть еще подтверждены, например, путем сравнения уровней МРО до ишемического реперфузионного повреждения. Как показывает уменьшение процента инфаркта от площади риска и процента инфаркта левого желудочка, сердца, обработанные ЕТС-216, были защищены от ишемического реперфузионного повреждения. Кардиопротекция предоставлялась обоими дозовыми протоколами, а именно ЕТС-216, введенным в виде однократной дозы 100 мг/кг перед началом ишемии, или ЕТС-216, введенным двумя дозами 100 мг/кг,при этом одну дозу дают за сутки до ишемии, а вторую дозу дают непосредственно до ишемии. Пример 5. Определение минимальной эффективной дозы для срочного введения в LAD окклюдированное-реперфузированное сердце кролика. Этот пример демонстрирует профилактическую эффективность различных доз ЕТС-216, вводимых в качестве однократной предварительной обработки непосредственно перед началом региональной ишемии. Исследование в примере 2 было направлено на эффекты ЕТС-216 в качестве кардиопротективного агента в исследовании in vivo, в котором сердце кролика подвергали региональной ишемии миокарда в течение 30 мин, а затем реперфузии в течение, минимум, 4 ч. Использовали две схемы приема. В первом протоколе тестировали ЕТС-216 в виде однократной преварительной обработки, при которой системное кровообращение подвергали воздействию 100 мг/кг агента непосредственно перед началом региональной ишемии, тогда как во втором протоколе две преварительные обработки дозой 100 мг/кг осуществляли до начала региональной ишемии (за 1 сутки и непосредственно перед ишемией). Обе схемы показали, что и одна, и две обработки дозой 100 мг/кг ЕТС-216 являются кардиопротективными. Поэтому ЕТС-216 тестировали в виде однократной преварительной обработки, при которой сердце подвергали воздействию однократных доз агента или эквивалентного объема наполнителя непосредственно перед началом региональной ишемии для того, чтобы определить эффекты в плане кардиопротекции. Сердца анализировали теми же способами, которые использовали в примере 2. Кроме того, этот протокол был разработан для того, чтобы найти минимальную эффективную дозу ЕТС-216 для обработки сердца кролика с целью защиты от ишемии. Чтобы найти минимальную эффективную дозу ЕТС-216, использовали тот же протокол для срочной обработки (см. фиг. 13), при котором животные получали однократные обработки либо 10, 3 или 1 мг/кг ЕТС-216, либо эквивалентным объемом наполнителя, как показано на фиг. 16. Площадь риска (AAR) или ишемизированная зона, выраженная в виде процента от всего левого желудочка, для группы обработки дозой 10 мг/кг была аналогичной в контрольной группе и в группе обработки (фиг. 17). У кроликов, обработанных 10 мг/кг ЕТС-216, развивались меньшие инфаркты (р 0,0005), выраженные в виде процента от AAR, по сравнению с кроликами, обработанными наполнителем (фиг. 18). Наблюдалось также уменьшение размера инфаркта миокарда (р 0,0001), когда данные выражали в виде процента от всего левого желудочка (фиг. 17). Аналогичные результаты наблюдались с дозой 3 мг/кг. AAR, выраженная в виде процента от всего левого желудочка, была аналогичной в группах, обработанных ЕТС-216 и наполнителем (фиг. 17). У кроликов, обработанных 3 мг/кг ЕТС-216, развивались меньшие инфаркты (р 0,05), выраженные в виде процента от площади риска, по сравнению с кроликами, обработанными наполнителем (фиг. 17). Наблюдалось уменьшение размера инфаркта миокарда (р 0,05), когда данные выражали в виде процента от всего левого желудочка (фиг. 17). Никаких значительных различий не было отмечено для дозы 1 мг/кг между ЕТС-216 и наполнителем в размере AAR, выраженном в виде процента от левого желудочка (фиг. 17). При 1 мг/кг никаких значительных различий не было отмечено между группами в виде процента от AAR (фиг. 17) и в размере инфаркта миокарда, выраженном в виде процента от всего левого желудочка (фиг. 17). Обобщение данных из каждой из четырех групп срочной обработки (т.е. 100, 10, 3 и 1 мг/кг) и их соответствующих контролей представлены на фиг. 17. AAR инфаркта была аналогичной в каждой из четырех групп. Из четырех схем приема размер инфаркта, выраженный или в виде процента от площади риска, или в виде процента от левого желудочка, по сравнению с соответствующими контролями уменьшался дозами ЕТС-216 100, 10 и 3 мг/кг. В противоположность этому, размер инфаркта в группе животных, принимающих 1 мг/кг, не отличался от размера, наблюдаемого в соответствующей группе, обработанной наполнителем. На фиг. 18 показаны примеры временных изменений уровня неэтерифицированного холестерина липопротеинов. Образцы крови получали от кроликов непосредственно перед и периодически после введения 1, 3, 10 или 100 мг/кг ЕТС-216 или наполнителя. Показаны профили неэтерифицированного холестерина, полученные в репрезентативных временных образцах сыворотки крови, где липопротеины сыворотки выделяли по размеру с помощью гель-фильтрационной хроматографии с постоянным анализом неэтерифицированного холестерина. Заметно повышение неэтерифицированного холестерина в холестерине высокой плотности через 45 мин после введения ЕТС-216, особенно при 100 мг/кг и в меньшей степени при 10 мг/кг, несмотря на фактическое отсутствие неэтерифицированного холестерина во внутривенно вводимом ЕТС-216 тест-агенте. Заметно также замедленное явное увеличение неэтерифицированного холестерина липопротеинов очень низкой плотности через 210 и 270 мин после введения либо 10,либо 100 мг/кг ЕТС-216. Заметно также, что изменения уровня неэтерифицированного холестерина ли- 27010134 попротеинов были не очевидными при лечебной дозе 3 мг/кг ЕТС-216 в анализируемых временных точках, однако, эта доза была кардиопротективной, как показано на фиг. 17. Результаты показывают, что дозы 100, 10 и 3 мг/кг являются эффективными профилактическими дозами ЕТС-216. Пример 6. ЕТС-216 предупреждает повреждение при ишемии-реперфузии при введении после начала LAD окклюзии в окклюдированном-реперфузированном сердце кролика. Этот пример демонстрирует эффективность ЕТС-216 в предупреждении или уменьшении ишемического реперфузионного повреждения при введении после ишемического или окклюзионного события. Исследования в примерах 2 и 3 иллюстрируют профилактическую пользу обработки сердечной мышцы перед началом ишемии. Следовательно, для того, чтобы определить, может ли защитить ЕТС-216 сердечную мышцу после начала ишемии, LAD окклюдировали перед введением тест-агента или наполнителя. В этом протоколе тестировали ЕТС-216 при однократной обработке, при которой сердце подвергали воздействию 10 мг/кг агента или эквивалентного объема наполнителя, вводимого в течение последних 5 мин региональной ишемии и продолжающегося в течение первых 55 мин реперфузии (фиг. 19). AAR или ишемизированная зона, выраженная в виде процента от всего левого желудочка, для группы обработки дозой 10 мг/кг была аналогична в контрольной группе (фиг. 20). У кроликов, обработанных ЕТС-216,развивались меньшие инфаркты (р 0,001), выраженные в виде процента от AAR, по сравнению с кроликами, обработанными наполнителем (фиг. 20). Уменьшение размера инфаркта миокарда (р 0,0005) также наблюдали, когда эти данные были выражены в виде процента от всего левого желудочка (фиг. 20). Этот пример демонстрирует, что однократная обработка, осуществляемая после ишемического события, смягчала или уменьшала ишемическое реперфузионное поврежедение. Были описаны различные воплощения изобретения. Описание и примеры предназначены для иллюстрации изобретения, а не для его ограничения. Действительно, специалистам в данной области будет очевидно, что могут быть получены модификации для различных воплощений изобретения, описанных без отклонения от сущности изобретения или объема прилагаемой формулы изобретения, представленной ниже. Все ссылки, приведенные в данном изобретении, включены таким образом путем ссылки во всей их полноте. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ лечения острых коронарных синдромов у субъекта, нуждающегося в этом, включающий введение комплекса аполипопротеин A-I Milano:1-пальмитоил-2-олеоил-sn-глицеро-3-фосфохолин (комплекс Apo А-IM:РОРС) в дозе от примерно 1 до примерно 100 мг белка/кг, причем указанный способ облегчает расстройства, связанные с острым коронарным тромбозом. 2. Способ по п.1, где комплекс Apo А-IM:РОРС вводят субъекту в дозе примерно 15 мг/кг. 3. Способ по п.1, где комплекс Apo А-IM:РОРС вводят субъекту в дозе примерно 45 мг/кг. 4. Способ по п.1, где комплекс Apo А-IM:РОРС вводят субъекту в дозе от примерно 15 до примерно 45 мг/кг. 5. Способ по п.1, где Apo A-I Milano представляет собой рекомбинантный Apo A-I Milano. 6. Способ по п.1, где комплекс Apo А-IM:РОРС состоит из аполипопротеина A-I Milano и 1 пальмитоил-2-олеоил-sn-глицеро-3-фосфохолина в соотношении масса белка/масса липида примерно 1:1. 7. Способ по п.1, где комплекс Apo А-IM:РОРС представляет собой стерильный жидкий фармацевтический препарат. 8. Способ по п.7, где фармацевтический препарат вводят субъекту в дозе примерно 15 мг/кг. 9. Способ по п.7, где фармацевтический препарат вводят субъекту в дозе примерно 45 мг/кг. 10. Способ по п.7, где фармацевтический препарат вводят субъекту 1 раз в неделю в течение примерно 6, примерно 5, примерно 4, примерно 3, примерно 2 месяцев или примерно 1 месяца. 11. Способ по п.7, где фармацевтический препарат вводят субъекту примерно каждые сутки в течение примерно 1 месяца. 12. Способ по п.7, где фармацевтический препарат вводят субъекту примерно каждые 3 суток в течение периода времени от примерно 1 месяца до примерно 6 месяцев. 13. Способ по п.7, где фармацевтический препарат вводят примерно каждые 10 суток в течение периода времени от примерно 1 месяца до примерно 6 месяцев. 14. Способ по п.7, где фармацевтический препарат вводят примерно каждые 14 суток в течение периода времени от примерно 1 месяца до примерно 6 месяцев. 15. Способ по п.1, дополнительно включающий хирургическое вмешательство. 16. Способ по п.15, где хирургическое вмешательство включает в себя чрескожную транслюминальную коронарную ангиопластику или аортокоронарное шунтирование. 17. Способ по п.1, дополнительно включающий введение другого лекарства для лечения, предупреждения или облегчения заболеваний, расстройств, симптомов или боли, ассоциированных с острыми коронарными синдромами.- 28010134 18. Способ по п.1, где процентный объем атеромы в пораженном сосуде субъекта уменьшается на величину от примерно -0,73 до примерно -1,29%. 19. Способ по п.1, где общий объем атеромы в пораженном сосуде субъекта уменьшается на величину от примерно -15,1 до примерно -12,6 мм 3. 20. Способ по п.1, где средняя максимальная толщина атеромы в пораженном коронарном сегменте субъекта уменьшается на величину от примерно -0,039 до -0,044 мм. 21. Способ по п.7, где фармацевтический препарат вводят внутривенно. 22. Способ по п.21, где фармацевтический препарат вводят в течение примерно 1 ч. 23. Способ по п.21, где фармацевтический препарат вводят в течение примерно 3 ч. 24. Способ по п.7, где фармацевтический препарат содержит Apo A-I Milano, РОРС, сахарозоманнитный носитель и фосфатный буфер. 25. Способ по п.24, где сахарозоманнитный носитель состоит из сахарозы в количестве от примерно 6,0 до примерно 6,4% и маннита в количестве от примерно 0,8 до примерно 1%. 26. Способ по п.25, где сахарозоманнитный носитель состоит из примерно 6,2% сахарозы и примерно 0,9% маннита. 27. Способ по п.7, где фармацевтический препарат имеет рН от примерно 7,0 до примерно 7,8. 28. Способ по п.27, где рН составляет примерно 7,5. 29. Способ по п.7, где фармацевтический препарат содержит от примерно 12 до примерно 18 мг/млApo A-I Milano. 30. Способ по п.7, где фармацевтический препарат содержит от примерно 11 до примерно 17 мг/мл РОРС. 31. Способ по п.7, где фармацевтический препарат содержит менее 6000 частиц размером более 10 мкм на 50 мл. 32 Способ по п.7, где фармацевтический препарат содержит менее 600 частиц размером более 25 мкм на 50 мл. 33. Способ по п.7, где фармацевтический препарат имеет осмоляльность от примерно 280 до примерно 320 мОсм. 34. Способ по п.33, где фармацевтический препарат имеет осмоляльность примерно 290 мОсм. 35. Способ уменьшения атеросклеротической бляшки у субъекта, нуждающегося в этом, включающий, по меньшей мере, однократное введение субъекту 45 мг/кг комплекса рекомбинантный Apo A-IMilano:POPC. 36. Способ по п.35, где комплекс рекомбинантный Apo A-I Milano:POPC вводят 1 раз в неделю, 1 раз в месяц или 1 раз в год. 37. Способ по п.35, где комплекс рекомбинантный Apo A-I Milano:POPC вводят 1 раз в неделю в течение примерно 3-5 недель. 38. Способ по п.35, дополнительно включающий, по меньшей мере, однократное введение субъекту дозы 15 мг/кг комплекса рекомбинантный Apo A-I Milano:POPC. 39. Способ по п.38, где комплекс вводят 1 раз в неделю, 1 раз в месяц или 1 раз в год. 40. Способ по п.35, где субъекта также лечат другим лекарством для лечения, предупреждения или облегчения заболеваний, расстройств, симптомов или боли, ассоциированных с острыми коронарными синдромами. 41. Способ по п.40, где лекарство представляет собой статин, -блокатор, ингибитор АПФ (ангиотензин-превращающего фермента), антитромботическое средство, вазодилататор или их комбинацию. 42. Жидкий фармацевтический препарат, содержащий комплекс рекомбинантный Apo A-I Milano или его вариант:1-пальмитоил-2-олеоил-sn-глицеро-3-фосфохолин в буфере, содержащем от примерно 6,0 до примерно 6,4% сахарозы, дополнительно содержащем от примерно 0,8 до примерно 1% маннита,имеющем рН от примерно 7,0 до примерно 7,8. 43. Фармацевтический препарат по п.42, содержащий примерно 6,2% сахарозы. 44. Фармацевтический препарат по п.42, содержащий примерно 0,9% маннита. 45. Фармацевтический препарат по п.42, где рН составляет примерно 7,5. 46. Фармацевтический препарат по п.42, где концентрация rApo A-I Milano составляет от примерно 12 до примерно 18 мг на мл указанного буфера. 47. Фармацевтический препарат, содержащий рекомбинантный Apo A-I Milano или его вариант в виде комплекса с 1-пальмитоил-2-олеоил-sn-глицеро-3-фосфохолином и фосфатный буфер, имеющий рН от примерно 7,0 до примерно 7,8, содержащий 2% глюкозы и 4 мМ фосфата натрия. 48. Фармацевтический препарат по п.47, содержащий фосфатный буфер для достижения рН примерно 7,5. 49. Фармацевтический препарат по п.42 или 47, где рекомбинантный Apo A-I Milano представляет собой Apo A-I Milano с консервативными заменами. 50. Фармацевтический препарат по п.42 или 47, где рекомбинантный Apo A-I Milano и РОРС образуют комплекс рекомбинантный Apo A-I Milano:POPC в соотношении 1:0,95 (масса белка/масса липида). 51. Фармацевтический препарат по п.42 или 47, содержащий менее 6000 частиц размером более 10- 29010134 мкм на 50 мл. 52. Фармацевтический препарат по п.42 или 47, содержащий менее 600 частиц размером более 25 мкм на 50 мл. 53. Фармацевтический препарат по п.42 или 47, где осмоляльность составляет от примерно 280 до примерно 320 мОсм. 54. Фармацевтический препарат по п.53, где осмоляльность составляет примерно 290 мОсм. 55. Фармацевтический препарат по п.42 или 47, который является стерильным. 56. Фармацевтический препарат по п.42 или 47, который является замороженным. 57. Фармацевтический препарат по п.42 или 47, который находится в стерильном флаконе, стерильном предварительно заполненном мешке или предварительно заполненном шприце. 58. Лиофилизированный фармацевтический препарат, содержащий: а) рекомбинантный Apo A-I Milano или его вариант в виде комплекса с 1-пальмитоил-2-олеоил-snглицеро-3-фосфохолином; б) от примерно 6,0 до примерно 6,4% сахарозы и в) от примерно 0,8 до примерно 1% маннита. 59. Фармацевтический препарат по п.58, содержащий примерно 6,2% сахарозы. 60. Фармацевтический препарат по п.58, содержащий примерно 0,9% маннита. 61. Фармацевтический препарат по п.58, дополнительно содержащий буфер, который имеет рН примерно 7,5. 62. Фармацевтический препарат по п.58, где рекомбинантный Apo A-I Milano представляет собойApo A-I Milano с консервативными заменами. 63. Фармацевтический препарат по п.58, где концентрация РОРС составляет от примерно 11 до примерно 17 мг/мл. 64. Фармацевтический препарат по п.58, где рекомбинантный Apo A-I Milano и РОРС образуют комплекс рекомбинантный Apo A-I Milano:РОРС в соотношении 1:0,95 (масса белка/масса липида). 65. Фармацевтический препарат по п.58, содержащий менее 6000 частиц размером более 10 мкм на 50 мл. 66. Фармацевтический препарат по п.58, содержащий менее 600 частиц размером более 25 мкм на 50 мл. 67. Фармацевтический препарат по п.58, где осмоляльность составляет от примерно 280 до примерно 320 мОсм. 68. Фармацевтический препарат по п.67, где осмоляльность составляет примерно 290 мОсм. 69. Фармацевтический препарат по п.58, который является стерильным. 70. Фармацевтический препарат по п.58, который находится в стерильном флаконе, стерильном предварительно заполненном мешке или предварительно заполненном шприце. 71. Способ лечения ишемической реперфузии у субъекта, нуждающегося в этом, включающий введение комплекса аполипопротеин A-I Milano:1-пальмитоил-2-олеоил-sn-глицеро-3-фосфохолин (комплекс Apo А-IM:РОРС) в дозе примерно 15 мг белка/кг. 72. Способ лечения ишемической реперфузии у субъекта, нуждающегося в этом, включающий введение комплекса аполипопротеин A-I Milano:1-пальмитоил-2-олеоил-sn-глицеро-3-фосфохолин (комплекс Apo А-IM:РОРС) в дозе примерно 45 мг белка/кг. 73. Способ по пп.2, 8 или 71, дополнительно включающий введение 45 мг белка/кг. 74. Способ по пп.3, 9 или 72, дополнительно включающий введение 15 мг белка/кг.
МПК / Метки
МПК: A01N 37/18, A61K 38/00
Метки: фармацевтические, схемы, лечения, коронарных, острых, способы, приёма, препараты, предупреждения, синдромов
Код ссылки
<a href="https://eas.patents.su/30-10134-farmacevticheskie-preparaty-sposoby-i-shemy-priyoma-dlya-lecheniya-i-preduprezhdeniya-ostryh-koronarnyh-sindromov.html" rel="bookmark" title="База патентов Евразийского Союза">Фармацевтические препараты, способы и схемы приёма для лечения и предупреждения острых коронарных синдромов</a>
Предыдущий патент: Производные формамида, пригодные в качестве адренорецептора
Следующий патент: Фунгицидная смесь на основе дитианона и способ борьбы с фитопатогенными грибами
Случайный патент: Станция групповой катодной защиты