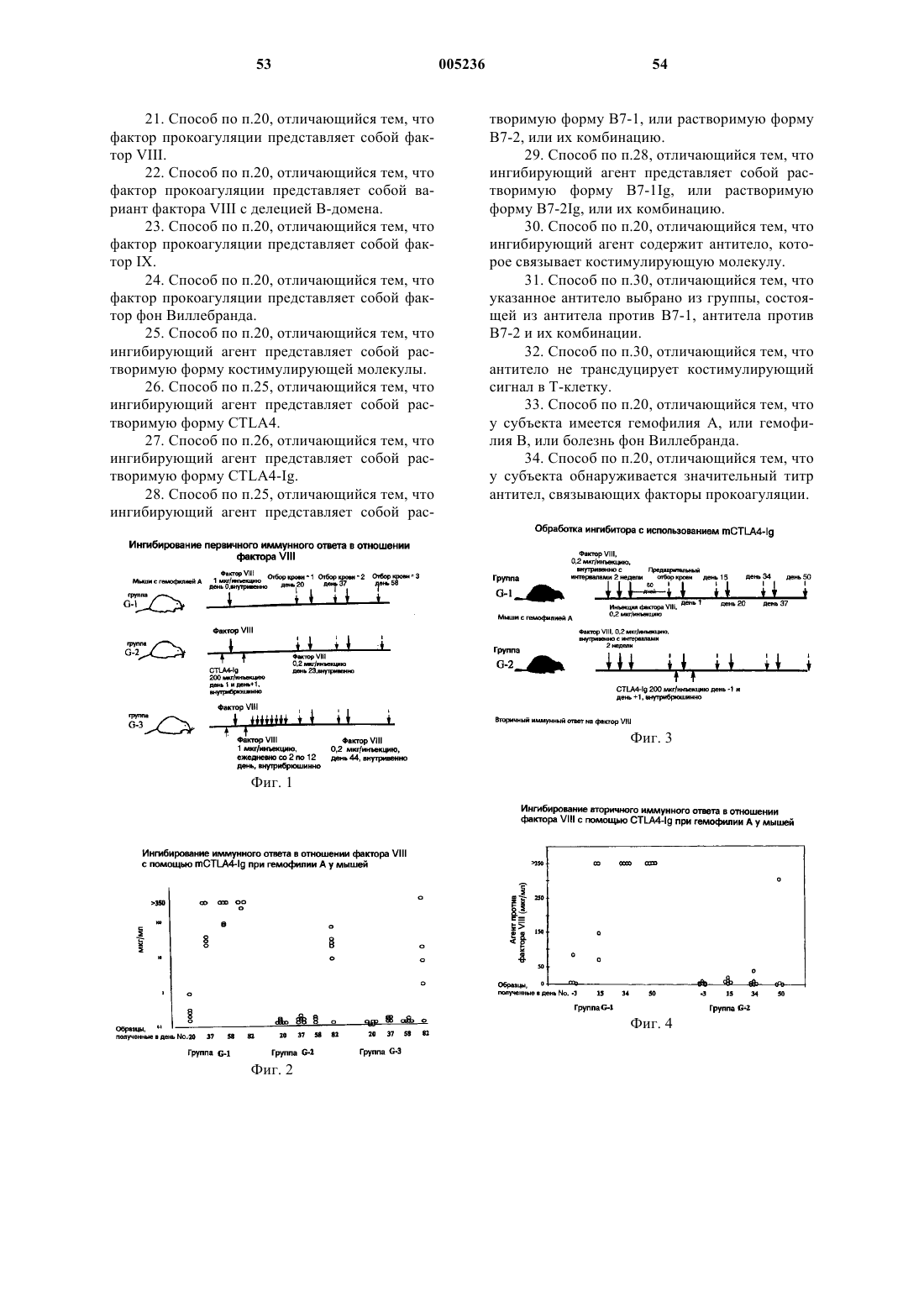
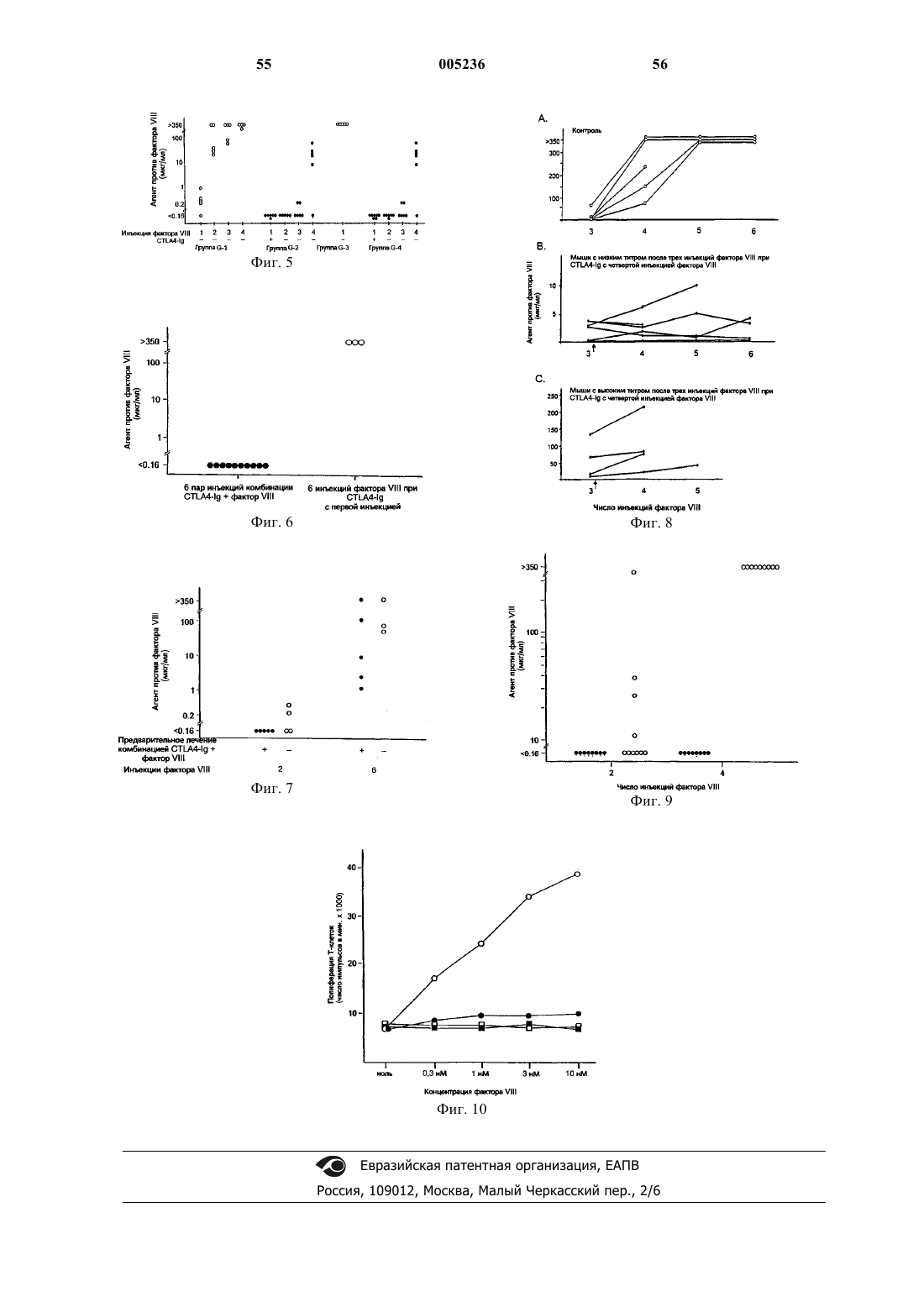
Композиция для лечения и/или предупреждения нарушений, приводящих к аномальному кровотечению, и способ лечения таких нарушений (варианты)
Номер патента: 5236
Опубликовано: 30.12.2004
Авторы: Грэй Гэри С., Коллинс Мэри, Хойэр Леон У., Киан Джиахуа
Формула / Реферат
1. Композиция для лечения и/или предупреждения нарушений, приводящих к аномальному кровотечению, содержащая по меньшей мере один фактор прокоагуляции и по меньшей мере один агент, ингибирующий взаимодействие костимулирующей молекулы на поверхности антиген-презентирующей клетки и соответствующего ей рецептора на Т-клетке, приводящее к генерации иммунного ответа на указанный фактор.
2. Композиция по п.1, отличающаяся тем, что она дополнительно содержит фармацевтически приемлемый носитель.
3. Композиция по п.1, отличающаяся тем, что фактор прокоагуляции представляет собой фактор VIII.
4. Композиция по п.1, отличающаяся тем, что фактор прокоагуляции представляет собой вариант фактора VIII с делецией B-домена.
5. Композиция по п.1, отличающаяся тем, что фактор прокоагуляции представляет собой фактор IX.
6. Композиция по п.1, отличающаяся тем, что фактор прокоагуляции представляет собой фактор фон Виллебранда.
7. Композиция по п.1, отличающаяся тем, что ингибирующий агент представляет собой растворимую форму костимулирующей молекулы.
8. Композиция по п.7, отличающаяся тем, что ингибирующий агент представляет собой растворимую форму CTLA4.
9. Композиция по п.7, отличающаяся тем, что ингибирующий агент представляет собой растворимую форму B7-1, или растворимую форму B7-2, или их комбинацию.
10. Композиция по п.8, отличающаяся тем, что ингибирующий агент содержит CTLA4-Ig.
11. Композиция по п.9, отличающаяся тем, что ингибирующий агент содержит B7-1Ig или B7-2lg.
12. Композиция по п.1, отличающаяся тем, что ингибирующий агент представляет собой антитело, связывающее костимулирующую молекулу.
13. Композиция по п.12, отличающаяся тем, что указанное антитело выбрано из группы, состоящей из антитела против B7-1, антитела против B7-2 и их комбинации.
14. Композиция по п.12, отличающаяся тем, что антитело не трансдуцирует костимулирующий сигнал в Т-клетку.
15. Способ лечения нарушений, приводящих к аномальному кровотечению у субъекта, путем введения субъекту композиции по любому из пп.1-14 с достижением терапевтического эффекта.
16. Способ по п.15, отличающийся тем, что у субъекта обнаруживается иммунный ответ в отношении факторов прокоагуляции.
17. Способ по п.15, отличающийся тем, что у субъекта не обнаруживается иммунный ответ в отношении факторов прокоагуляции.
18. Способ по п.15, отличающийся тем, что далее субъекту вводят композицию, содержащую дополнительный иммуносупрессивный агент.
19. Способ по п.15, отличающийся тем, что у субъекта имеется гемофилия A, или гемофилия B, или болезнь фон Виллебранда.
20. Способ лечения нарушений, приводящих к аномальному кровотечению у субъекта, отличающийся тем, что субъекту вводят по меньшей мере один фактор прокоагуляции и по меньшей мере один агент, ингибирующий взаимодействие костимулирующей молекулы на поверхности антиген-презентирующей клетки и соответствующего ей рецептора на Т-клетке, приводящее к генерации иммунного ответа на указанный фактор, с достижением терапевтического эффекта.
21. Способ по п.20, отличающийся тем, что фактор прокоагуляции представляет собой фактор VIII.
22. Способ по п.20, отличающийся тем, что фактор прокоагуляции представляет собой вариант фактора VIII с делецией В-домена.
23. Способ по п.20, отличающийся тем, что фактор прокоагуляции представляет собой фактор IX.
24. Способ по п.20, отличающийся тем, что фактор прокоагуляции представляет собой фактор фон Виллебранда.
25. Способ по п.20, отличающийся тем, что ингибирующий агент представляет собой растворимую форму костимулирующей молекулы.
26. Способ по п.25, отличающийся тем, что ингибирующий агент представляет собой растворимую форму CTLA4.
27. Способ по п.26, отличающийся тем, что ингибирующий агент представляет собой растворимую форму CTLA4-Ig.
28. Способ по п.25, отличающийся тем, что ингибирующий агент представляет собой растворимую форму B7-1, или растворимую форму B7-2, или их комбинацию.
29. Способ по п.28, отличающийся тем, что ингибирующий агент представляет собой растворимую форму B7-1Ig, или растворимую форму B7-2Ig, или их комбинацию.
30. Способ по п.20, отличающийся тем, что ингибирующий агент содержит антитело, которое связывает костимулирующую молекулу.
31. Способ по п.30, отличающийся тем, что указанное антитело выбрано из группы, состоящей из антитела против B7-1, антитела против B7-2 и их комбинации.
32. Способ по п.30, отличающийся тем, что антитело не трансдуцирует костимулирующий сигнал в Т-клетку.
33. Способ по п.20, отличающийся тем, что у субъекта имеется гемофилия A, или гемофилия B, или болезнь фон Виллебранда.
34. Способ по п.20, отличающийся тем, что у субъекта обнаруживается значительный титр антител, связывающих факторы прокоагуляции.
Текст
1 Область техники, к которой относится изобретение Изобретение относится к области иммунологии и медицины и касается лечения нарушения гемостаза путем введения субъекту чужеродных терапевтических белков при отрицательной модуляции иммунных ответов на них у субъекта. Уровень техники Одним из первичных ограничений терапевтического лечения с использованием биологических белков является иммунный ответ, который вырабатывает организм в ответ на присутствие в нем чужеродных субстанций. Данный иммунный ответ представляет собой особенную проблему, когда чужеродные субстанции должны повторно вводиться с целью получения их оптимальной эффективности. Одним примером такой ситуации является повторное введение агентов для лечения нарушений гемостаза, таких как заболевания, связанные с дефицитом фактора VIII (например,классическая гемофилия А и болезнь фон Виллебранда) или дефицитом фактора IX, известным также, как гемофилия В. Классическая гемофилия, гемофилия А, представляет собой Хсцепленное нарушение, которое поражает одного из 10000 мужчин. Болезнь фон Виллебранда является наиболее распространенной наследственной болезнью, связанной с кровотечением,которая встречается у одного из 800-1000 субъектов. Гемофилия В, известная также как болезнь Кристмаса, встречается примерно у 1 из 100000 мужчин (см. монографию Принципы терапии Харрисона (Harrison's Principles of Internal Medicine) под ред. Isselbacher и соавт., 13-е изд., 1994. McGraw-Hill N.Y., N.Y.). Фактор VIII представляет собой одноцепочечный белок молекулярной массы 265 кД, который циркулирует в крови в комплексе с фактором фон Виллебранда (VWF). Фактор VIII является важным регуляторным белком в каскаде свертывания крови. После активации тромбина он повышает скорость активации фактора Х активированным фактором IX (фактор IXa), в конечном итоге приводя к образованию фибринового сгустка. Молекула VWF представляет собой адгезионный гликопротеин, который играет главную роль в агглютинации тромбоцитов. Он служит носителем для фактора VIII в плазме и облегчает взаимодействия тромбоцита со стенкой сосуда, VWF состоит из множества,возможно, идентичных субъединиц, каждая из которых имеет молекулярную массу приблизительно 230 кД. VWF синтезируется в эндотелиальных клетках и мегакариоцитах. Фактор IX представляет собой одноцепочечный профермент молекулярной массы 55 кД, который конвертируется в активную протеазу (IXa) фактором XIa или комплексом тканевый фактор-VIIa. Активированный фактор IX и активированный фактор VIII затем активируют фактор X. 2 Повторное введение чужеродных белков может привести к иммунному ответу на данные белки в организме реципиента. При Тклеточном ответе на чужеродные белки антиген-презентирующие клетки (АРС) должны доставить два сигнала к покоящимся Тлимфоцитам (см. статьи Jenkins M. и SchwartzD.L. и соавт., J. Immunol., 144, 3701-3709,(1990. Первый сигнал, который определяет специфичность иммунного ответа, трансдуцируется через Т-клеточный рецептор (TCR) после распознавания чужеродного антигенного пептида, презентируемого в контексте главного комплекса гистосовместимости (МНС). Второй сигнал, называемый костимуляцией, индуцирует пролиферацию и появление функциональности Т-клеток (см. статью Lenschow и соавт., Annu.Rev. Immunol., 14:233, (1996. Костимуляция не является ни антиген-специфической, ни МНСограниченной и, как полагают, обеспечивается одной или несколькими различными молекулами клеточной поверхности, экспрессируемых посредством АРС (см. статьи Jenkins M.K. и соавт., J. Immunol., 140, 3324-3330, (1988);USA, 89, 271-275, (1992); van-Seventer G.A. и соавт., J. Immunol., 144, 4579-4586, (1990); LaSalle J.M. и соавт., J. Immunol., 147, 774-80,(1991); Dustin M.I. и соавт., J. Exp. Med 169,503, (1989); Armitage R.J. и соавт., Nature, 357,80-82, (1992); Liu Y. и соавт., J. Exp. Med., 175,437-445, (1992. Белки CD80 (В 7-1) и CD86 (В 7-2), экспрессированные на АРС, представляют собой критические костимулирующие молекулы (см. статьи Freeman и соавт., J. Exp. Med., 174:625,(1991); Freeman и соавт., J. Immunol., 143:2714,(1989); Azuma и соавт., Nature, 366:76, (1993);Freeman и соавт., Science, 262:909, (1993. В 7-2, как полагают, является более важным при первичных иммунных ответах, тогда как В 7-1, положительная регуляция которого происходит на более поздних стадиях иммунного ответа, может быть важным для пролонгирования первичных Т-клеточных ответов или костимулирующих вторичных Т-клеточных ответов(см. статью Bluestone, Immunity, 2:555, (1995. В 7-1 и В 7-2 представляют собой противорецепторы для двух лигандов, экспрессированных на Т-лимфоцитах. Один лиганд, с которым связываются В 7-1 и В 7-2, CD28, конститутивно экспрессируется на покоящихся Т-клетках, и его экспрессия повышается после активации. После сигнала через Т-клеточный рецептор лигирование CD28 и трансдукция костимулирующего сигнала индуцируют пролиферацию Т-клеток и(CD152), является гомологичным CD28, но не экспрессируется на покоящихся Т-клетках и появляется после активации Т-клеток (см. статью Brunet J.F. и соавт., Nature, 328, 267-270,(1987. CTLA4, по-видимому, является критическим в плане негативной регуляции Тклеточных ответов (см. статью Waterhouse и соавт., Science, 270:985, (1995. Было обнаружено, что блокада CTLA4 устраняет ингибирующие сигналы, тогда как агрегация CTLA4,как было обнаружено, обеспечивает ингибирующие сигналы, которые отрицательно регулируют (супрессируют) Т-клеточные ответы(Allison и Krummel, Science, 270:932, (1995. Молекулы В 7 обладают более высокой аффинностью в отношении CTLA4, чем в отношенииMed 174, 561-569, (1991, а В 7-1 и В 7-2, как было показано, связывают отдельные участки молекулы CTLA4 и имеют различную кинетику связывания с CTLA4 (см. статью Unsley и соавт., Immunity, 1:793, (1994. У 10-25% пациентов с гемофилией развивается иммунный ответ на фактор VIII. У данных пациентов образуются ингибиторы, как правило, антитела IgG, которые нейтрализуют активность фактора VIII, что таким образом препятствует эффективной терапии. Было идентифицировано два типа ингибиторов. Пациенты с высоким уровнем ответа, имеющие ингибиторы типа I, проявляют анамнестический ответ на фактор VIII, что приводит к повышенному титру антител против фактора VIII. Пациенты с низким уровнем ответа, имеющие ингибитор типа II, показывают низкий титр антител, который не повышается при введении фактора VIII. Современные стратегии, направленные на сглаживание ответа антител у данных пациентов,являются успешными только в самой малой степени. Более того, усовершенствование антител против замещающих белков представляет собой насущную проблему, которая должна быть решена, если генотерапия все-таки будет эффективной при лечении гемофилии и других болезней, связанных пороками (см. статьи Connelly S. и соавт., Blood, 88:3846, (1996); Кunа S.H. и соавт., Blood, 91:784, (1998. Сущность изобретения В данном изобретении среди прочего представлены композиции и способы, которые позволяют вводить терапевтический белок для лечения нарушения при снижении выработки и/или развития иммунного ответа на терапевтический белок. 4 В одном аспекте изобретение касается композиций для лечения и/или предупреждения нарушений, приводящих к аномальному кровотечению, содержащих по меньшей мере один фактор прокоагуляции и по меньшей мере один агент, ингибирующий взаимодействие костимулирующей молекулы на поверхности антигенпрезентирующей клетки и соответствующего ей рецептора на Т-клетке, приводящее к генерации иммунного ответа на указанный фактор. В одном варианте осуществления изобретения данные композиции содержат, кроме того,фармацевтически приемлемый носитель. В одном из предпочтительных вариантов осуществления фактор прокоагуляции представляет собой фактор VIII. В другом варианте осуществления он представляет собой вариант фактора VIII с делецией В-домена. В следующем варианте осуществления фактор прокоагуляции является фактором IX. В другом варианте осуществления он представляет собой фактор фон Виллебранда. В предпочтительном варианте осуществления изобретения ингибирующий агент является растворимой формой костимулирующей молекулы. В предпочтительном варианте осуществления ингибирующий агент является растворимой формой CTLA4. В другом предпочтительном варианте осуществления ингибирующий агент является растворимой формой В 7-1,или растворимой формой В 7-2, или комбинацией растворимой формы В 7-1 и растворимой формы В 7-2. В более предпочтительном варианте осуществления ингибирующий агент представляет собой (или содержит) CTLA4-Ig. В другом более предпочтительном варианте осуществления он представляет собой (или содержит) В 7-11g или В 7-21g. В следующем варианте осуществления ингибирующий агент представляет собой антитело, которое связывает костимулирующую молекулу. В предпочтительном варианте осуществления ингибирующий агент выбран из группы,состоящей из антитела против В 7-1, антитела против В 7-2 и комбинации антител против В 7-1 и В 7-2. В одном из вариантов осуществления антитело не трансдуцирует костимулирующий сигнал в Т-клетку. Кроме того, изобретение касается способов лечения нарушений, приводящих к аномальному кровотечению у субъекта, предусматривающих введение субъекту данных композиций так,что возникает терапевтический эффект в отношении указанных нарушений, приводящих к аномальному кровотечению. В одном из вариантов осуществления изобретения субъект имеет высокий титр антител,которые связывают фактор прокоагуляции. В другом варианте осуществления у субъекта отсутствует высокий титр антител, которые связывают фактор прокоагуляции. 5 В одном из вариантов осуществления нарушение гемостаза, имеющееся у субъекта,представляет собой гемофилию А или гемофилию В, или болезнь фон Виллебранда. В другом аспекте изобретение касается способов лечения нарушения гемостаза у субъекта, предусматривающих введение субъекту по меньшей мере одного фактора прокоагуляции и по меньшей мере одного агента, ингибирующего взаимодействие молекулы на поверхности антиген-презентирующей клетки и соответствующего ей рецептора на Т-клетке, приводящее к генерации иммунного ответа на указанный фактор. В одном извариантов осуществления фактор прокоагуляции представлен фактором VIII. В другом варианте осуществления фактор прокоагуляции представляет собой вариант фактораVIII с делецией В-домена. В другом варианте осуществления фактор прокоагуляции является фактором IX. В другом варианте осуществления он представляет собой фактор фон Виллебранда. В следующем варианте осуществления ингибирующий агент является растворимой формой костимулирующей молекулы. В предпочтительном варианте осуществления он является растворимой формой CTLA4. В более предпочтительном варианте осуществления данный агент представлен CTLA4-1g. В другом предпочтительном варианте осуществления он является растворимой формой В 7-1, растворимой формой В 7-2 или комбинацией обоих В 7-1 и В 7-2. В другом более предпочтительном варианте осуществления ингибирующий агент представляет собой В 7-11g, В 7-21g или комбинацию обоих В 7-11g и В 7-21g. В еще одном варианте осуществления ингибирующий агент представляет собой антитело, которое связывает костимулирующую молекулу. В другом варианте осуществления данный агент выбран из группы, состоящей из антитела против В 7-1, антитела против В 7-2 и комбинации антител против В 7-1 и В 7-2. В еще одном варианте осуществления антитело не трансдуцирует костимулирующий сигнал в Т-клетку. В одном из вариантов осуществления нарушение гемостаза, имеющееся у субъекта,представляет собой гемофилию А, или гемофилию В, или болезнь фон Виллебранда. В другом варианте осуществления у субъекта имеется высокий титр антител, которые связывают факторы прокоагуляции. Перечень чертежей и иных материалов На фиг. 1 представлена схема эксперимента, использованная в примере 1, для тестирования ингибирования первичных ответов антител на фактор VIII. На фиг. 2 показано, что хотя мыши, которые не получали CTLA4-Ig, имели высокие титры антител, начиная с такого раннего срока, как день 20 (G-1), у мышей, которые получалиCTLA4-Ig, не вырабатывались антитела до дня 82 (G-2 и G-3). На фиг. 3 представлена схема эксперимента, использованная в примере 2, для тестирования ингибирования вторичных ответов антител на фактор VIII. На фиг. 4 показано, что животные, которые не получали CTLA4-Ig, имели высокие титры антител против фактора VIII (G-1), тогда как у мышей, которые получали CTLA4-Ig (G-2) (за исключением 1 мыши), не развивался вторичный иммунный ответ на фактор VIII. На фиг. 5 представлен эффект mCTLA4-Ig на образование антител против фактора VIII. На фиг. 6 представлен эффект повторного введения mCTLA4-Ig на образование антител против фактора VIII. На фиг. 7 представлен эффект одновременного введения mCTLA4-Ig и фактора VIII. На фиг. 8 представлен эффект mCTLA4-Ig на вторичный иммунный ответ в отношении фактора VIII. На фиг. 9 показана роль В 7-1 и В 7-2 в ответе антител против фактора VIII. На фиг. 10 представлен ответ Т-клеток на фактор VIII для мышей с гемофилией А/В 7-1-/- и гемофилией А/В 2-/-. Сведения, подтверждающие возможность осуществления изобретения Данное изобретение представляет значительное продвижение в лечении нарушений гемостаза, посредством предложения композиций и способов, которые позволяют вводить терапевтический белок для лечения заболевания при снижении выработки и/или развития иммунного ответа на терапевтический белок. Перед дальнейшим описанием изобретения ряд терминов, использованных в описании,примерах и прилагаемой формуле изобретения,для удобства собран в данном разделе.I. Определения. Как используют в данном контексте, выражение "нарушение гемостаза" включает нарушения, которые приводят к аномальному кровотечению и/или тромбозу. Нормальный гемостаз ограничивает потерю крови посредством серии взаимодействий между компонентами стенок кровеносных сосудов, тромбоцитов и белков плазмы. Нарушения гемостаза происходят, например, вследствие неспособности тромбоцитов к агрегации и/или образованию фибринового сгустка, что может обусловить несоответствующие реакции на болезнь или травму,например, неконтролируемое кровотечение. Данные нарушения могут быть установлены,например, по определению времени кровотечения, частичного тромбопластинового времени(РТТ), протромбинового времени (РТ), тромбинового времени (ТТ) или с помощью количественного определения фибриногена с использованием способов, хорошо известных в данной области. Примеры нарушений гемостаза вклю 7 чают гемофилию А, гемофилию В и болезнь фон Виллебранда. Как используют в данном контексте, выражение "агент, который стимулирует гемостаз", включает белок или полипептид, который имеется в недостаточном количестве или отсутствует у субъекта и который при введении субъекту облегчает или излечивает нарушение гемостаза. Предпочтительные агенты, которые способствуют гемостазу, включают факторы свертывания, такие как фактор VIII, фактор IX, VWF и их аналоги. Термин "семейство В 7" или "молекулы В 7", как используют в данном контексте, включает костимулирующие молекулы, которые имеют последовательность аминокислот, идентичную полипептидам В 7, например, В 7-1, В 7-2 или В 7-3 (распознаваемым антителом ВВ-1). Кроме того, семейство молекул В 7 характеризуется общей функцией, например, способностью связывать лиганд семейства В 7 (например, один или несколько из CD28, CTLA4 или ICOS) и способностью костимулировать активацию Тклеток. Полипептиды В 7 обладают способностью обеспечивать костимуляцию активированных Тклеток, индуцируя таким образом пролиферацию Т-клеток и/или секрецию цитокинов, или ингибировать костимуляцию Т-клеток, например, когда они находятся в растворимой форме. Представители семейства В 7 включают В 7-1,В 7-2 и их растворимые фрагменты или производные. В одном из вариантов осуществления члены семейства В 7 связывают CTLA4, CD28,ICOS и/или другие лиганды на иммунных клетках и обладают способностью ингибировать или индуцировать костимуляцию иммунных клеток. Используемое в контексте данной заявки выражение "агент, который ингибирует костимулирующий сигнал в Т-клетке" включает агенты, которые ингибируют сигнал, производимый при взаимодействии костимулирующей молекулы на антиген-презентирующей клетке (АРС),например, молекулы семейства В 7, и ее противорецептора на Т-клетке. Костимулирующие молекулы на АРС (например, молекулы семейства В 7) и родственные им лиганды на Тклетках (например, CTLA4, CD28 и ICOS) в данном контексте совместно называют костимулирующими молекулами. Агент, который ингибирует костимулирующий сигнал, может действовать либо экстрацеллюларно, чтобы ингибировать взаимодействие между костимулирующими молекулами, блокируя таким образом образование внутриклеточных сигналов, либо может действовать интрацеллюларно, чтобы ингибировать костимулирующие сигналы в пути сигнальной трансдукции. Примеры агентов более подробно описаны в данном контексте и включают, например, растворимые формы костимулирующих молекул и антитела, которые связывают костимулирующие молекулы. 8 Как используют в данном контексте, выражение "отрицательная модуляция иммунного ответа" включает снижение иммунного ответа(например, супрессию, ослабление или ингибирование) у пациента, у которого в данный момент отсутствует иммунный ответ, или уменьшение продолжительности и количественного значения существующего иммунного ответа. Термин "иммунный ответ" включает любой тип иммунного ответа, который инициируется или зависит от костимулирующих сигналов, например, клеточного или гуморального ответа, который может появляться у субъекта в ответ на чужеродный антиген. В одном варианте осуществления иммунный ответ представляет собой ответ антител на агент, который стимулирует гемостаз (например, фактор VII, VWF или фактор IX). Термин "иммунотолеризация" включает индукцию антиген-специфической толерантности, которая может быть измерена с использованием технологий, известных в уровне техники, например, путем измерения вторичных иммунных ответов (например, клеточных или гуморальных ответов) на антиген.II. Агенты,которые стимулируют гемостаз. В одном варианте осуществления агент,который стимулирует гемостаз, представлен фактором VIII. Термин "фактор VIII", как используют в данном контексте, включает белки,проявляющие активность прокоагулянта, характерную для фактора VIII. В одном варианте осуществления, соответствующем изобретению,белки фактора VIII представляют собой белки природного фактора VIII. Данные белки могут быть очищены из крови или могут быть введены в виде продукта крови или обогащенного продукта крови. В одном из вариантов осуществления высокоочищенный фактор VIII может быть получен путем адсорбции и элюции фактора из продукта крови на колонке с моноклональным антителом. Альтернативно данные природные белки можно получить рекомбинантным путем,используя молекулы нуклеиновой кислоты,предпочтительно природные молекулы нуклеиновой кислоты. Например, в одном из вариантов осуществления белки фактора VIII получают посредством экспрессии молекулы нуклеиновой кислоты, кодирующей фактор VIII, в клетке,используя известные в области техники способы, с образованием белка фактора VIII. Нуклеотидная последовательность (и соответствующая аминокислотная последовательность) человеческого фактора VIII известна в области техники(см., например, статью Toole и соавт., Nature,312:5992 (1984) или GenBank регистрационныеX01179; K01740). В другом варианте осуществления агент,стимулирующий гемостаз, представляет собой не существующий в природных условиях фактор VIII, например, мутантную форму фактораVIII, которая сохраняет терапевтическую функ 9 цию, например, активность стимуляции гемостаза фактора VIII. Например, последовательности ДНК, способные к гибридизации с ДНК,кодирующей человеческий фактор VIII, в условиях, которые позволяют избежать гибридизации с генами нефактора VIII (например, в условиях, эквивалентных 65 С в 5 Х SSC (1 Х SSC = 150 мМ NaCl/0,15 M цитрата Na, или с гомологичными последовательностями ДНК, которые сохраняют идентичность последовательности относительно участков молекулы нуклеиновой кислоты, кодирующей белковые домены,которые являются важными для функции фактора VIII, могут быть использованы для получения белков фактора VIII, которые входят в объем притязаний изобретения. В качестве примеров содержание патентов США 5744446,5663060, 5583209, 5661008, 5422260 и 5707832 специально включено в данный контекст в виде ссылки. В другом варианте осуществления агент,который стимулирует гемостаз, представляет собой белок фактора VIII, в котором имеется делеция по меньшей мере одного домена (например, неосновного домена) белка. Например,в одном из вариантов осуществления белок фактора VIII представляет собой модифицированный белок фактора VIII, в котором имеется делеция или замена одной или более аминокислот между сайтами расщепления 90 и 69 кД относительно нативного фактора VIII, как описано более подробно в патенте США 4868112, содержание которого введено в данный контекст в виде ссылки. В другом варианте осуществления агент,который стимулирует гемостаз, представляет собой аналог фактора VIII, содержащий делецию(и) между сайтом расщепления 50/40 и сайтом расщепления 73 кД, которую можно получить способами, аналогичными способам, описанным в патенте США 4868112, содержание которого введено в данный контекст в виде ссылки. В предпочтительном варианте осуществления аналог фактора VIII сохраняет частично или полностью участок кислых аминокислот между сайтами расщепления 80 и 73 кД. В другом варианте осуществления данный участок частично или полностью замещен соответствующим кислым участком, непосредственно прилежащим к сайту расщепления 50/40. В ряде других вариантов осуществления белки фактораVIII являются аналогами (имеющими или не имеющими делеции), такими как аналоги, описанные в международной заявке PCT/US 87/01299 (содержание которой введено в данный контекст в виде ссылки), например, такими,в которых один или несколько сайтов расщепления, находящихся между остатками аргинина в положениях 226, 336, 562, 740, 776, 1313, 1648 или 1721, были сделаны устойчивыми к протеолитическому расщеплению, например, путем замены одной или несколькими аминокислот 10 другими аминокислотами посредством мутагенеза кДНК с использованием технологий, известных в области техники, например, с помощью стандартного сайт-направленного мутагенеза. Агенты, которые стимулируют гемостаз,включают также белки гибридного фактораVIII, которые содержат фрагмент человеческого белка фактора VIII и фрагмент белка фактораVIII нечеловека, выделенный у животного другого вида (например, свиного фактора VIII). Данные гибридные белки могут быть получены с использованием технологий, которые известны в области техники, например, таких, которые представлены в патентах США 5744446,5663060 и 5583209. Содержание патентов США 5693499,5681746, 5663060, 5583209, 5563045, 5460951 и 5455031 также специально введено в данный контекст в виде ссылки. В другом варианте осуществления агент,который стимулирует гемостаз, представлен фактором IX. Как используют в данном контексте, термин "фактор IX" включает без ограничения перечисленным фактор IX, выделенный из плазмы, линии трансформированных клеток и полученный рекомбинантным путем фактор IX,выделенный из культуральной среды клеткихозяина. Фактор IX может быть очищен из крови или может быть введен в виде продукта крови или обогащенного продукта крови. В одном из вариантов осуществления высокоочищенный фактор IX может быть получен путем адсорбции и элюции фактора из продукта крови на колонке с моноклональным антителом. Примеры способов очистки описаны также в патентах США 5639857, 5457181 и 5286849. Альтернативно данные природные белки можно получить рекомбинантным путем, используя молекулы нуклеиновой кислоты, предпочтительно природные молекулы нуклеиновой кислоты. Например, в ряде вариантов осуществления белки фактора IX получают посредством экспрессии молекулы нуклеиновой кислоты,кодирующей фактор IX, в клетке, используя известные в области техники способы, приводящие к образованию белка фактора IX. Примеры генетических конструкций для экспрессии фактора IX можно найти в патентах США 5650503 и 4994371. Нуклеотидная последовательность и последовательность аминокислот фактора IX известна в области техники (см., например, статьюYoshitake и соавт., Biochemistry, 24:3726, (1985) или GenBank регистрационныеК 02402,А 07407, А 01819 или Х 54500). В других вариантах осуществления факторIX включает, например, белки, описанные в патентах США 4994371, 5171569, 5679639,5621039 и 5714583, полные описания которых включены в данный контекст в виде ссылки. 11 Кроме природных форм фактора IX, термин фактор IX также включает неприродные формы, например мутантные формы фактораIX, которые сохраняют терапевтические свойства, например, свойства стимуляции гемостаза,фактора IX. Например, включает последовательности ДНК, способные к гибридизации с ДНК, кодирующей человеческий фактор IX, в условиях, которые позволяют избежать гибридизации с генами нефактора IX (например, в условиях, эквивалентных 65 С в 5 Х SSC (1 ХSSC = 150 мМ NaCl/0,15 М цитрата Na). Кроме того, последовательности ДНК, сохраняющие идентичность последовательности относительно участков молекулы нуклеиновой кислоты, кодирующей белковые домены, которые являются важными для функции фактора IX, могут быть использованы для получения белков фактора IX,которые входят в объем притязаний изобретения. Белки фактора VIII или фактора IX можно также приобрести коммерческим путем. Например, имеются концентрированные формы фактора VIII, например, Immunate, (Immuno), Beriate (Behring); имеются очищенные с помощью моноклонального антитела формы фактораVIII, например, Octanativ-M (Pharmacia), Hemofil M (Baxter) и Monoclate-P (Armour), а также имеются рекомбинантные формы фактораVIII, например, Recombinate (Baxter) и Kogenate (Bayer). Имеется также форма фактора VIII с делецией В-домена - r-VIII SQ (Pharmacia иUpjohn, Stockholm). Фактор IX можно приобрести как Nanotiv (Kabi Pharmacia) или Immunine (Immuno); очищенный с помощью моноклонального антитела фактор IX также имеется в продаже под названием Mononine (Armour). Имеется также рекомбинантный фактор IX, например, под названием BeneFIX (Genetics Institute).VWF представляет собой большой мультимерный белок плазмы, состоящий только из гликопротеиновых субъединиц. СубъединицыVWF связаны дисульфидными связями. В плазме VWF циркулирует в виде мультимеров, среди которых встречаются мультимеры от димеров до мультимеров из более чем 50 субъединиц. Димеры состоят из двух субъединиц, связанных, возможно, по С-концам гибкими доменами, имеющими "форму стержня", и, как полагают, являются протомерами при мультимеризации. Протомеры связаны посредством больших, возможно, N-концевых глобулярных доменов с образованием мультимеров. VWF, повидимому, образуется в виде гликозилированного предшественника молекулярной массы 269 кД, который последовательно процессируется и сульфатируется. После димеризации и мультимеризации и протеолитического расщепления зрелый белок имеет молекулярную массу приблизительно 225 кД. VWF получен рекомбинантным путем. Нуклеотидная и аминокислот 005236 12 ная последовательности VWF известны в области техники (cм., например, работу Sadler и соавт., Cold Spring Harbor Symposium in Qunatitative Biology 51:515, (1986) или GenBank регистрационныеL15333 или K03028). Содержание патента ЕР 0197592 В 1 введено в данный контекст в виде ссылки. Кроме природных форм фактора VWF термин "фактор VWF" также включает неприродные формы, например, мутантные формы фактора VWF, которые сохраняют терапевтические свойства, например, свойства стимуляции гемостаза фактора VWF. Например, включает последовательности ДНК, способные к гибридизации с ДНК, кодирующей человеческий фактор VWF, в условиях, которые позволяют избежать гибридизации с генами нефактора VWFNa). Кроме того, последовательности ДНК, которые сохраняют идентичность последовательности относительно участков молекулы нуклеиновой кислоты, кодирующей белковые домены,которые являются важными для функции фактора VWF, могут быть использованы для получения белков фактора VWF, которые входят в объем изобретения. В одном из вариантов осуществления агенты, которые стимулируют гемостаз, являются по своему происхождению агентами, выделенными у млекопитающих. В предпочтительном варианте осуществления агенты, которые стимулируют гемостаз, являются по своему происхождению свиными. В еще одном варианте осуществления агенты, которые стимулируют гемостаз, являются по своему происхождению человеческими. В другом варианте осуществления агенты, которые стимулируют гемостаз, являются гибридными молекулами.III. Иммуномодулирующие агенты. В одном из вариантов осуществления агент, который ингибирует костимулирующий сигнал в Т-клетке, представляет собой природную форму костимулирующей молекулы. Природные формы костимулирующих молекул могут быть очищены из клеток или получены рекомбинантным путем с использованием технологий, известных в области техники. Например,костимулирующие белки могут быть получены путем экспрессии молекулы нуклеиновой кислоты, кодирующей костимулирующую молекулу, в клетке с образованием костимулирующей молекулы. Нуклеотидные последовательности костимулирующих молекул известны в области техники и могут быть найдены в литературе или в базе данных, такой как GenBank. См., например, относительно В 7-2 статью Freeman и соавт., Science, 262:909, (1993) или GenBank регистрационныеP42081 или А 48754; относительно В 7-1 статью Freeman и соавт., J.Exp. Med., 174:625, (1991) или GenBank регистрационныеP33681 или А 45803; относи 13 тельно CTLA4 см., например, статью Ginsberg и соавт., Science, 228:1401, (1985) или GenBankP16410 или 291929 и относительно CD28 статьи Aruffo и Seed, Proc. Natl. Acad. Sci.,84:8573 или GenBank регистрационный 180091, относительно ICOS статью Hutloff и соавт., Nature, 397:263, (1999); WO 98/38216 и близкие последовательности. Кроме природных форм костимулирующих молекул термин "костимулирующая молекула" также включает неприродные формы, например, мутантные формы костимулирующих молекул, которые сохраняют функцию костимулирующей молекулы, например, способность связывать родственный противорецептор. Например, последовательности ДНК, способные к гибридизации с ДНК, кодирующей молекулу В 7, молекулу CTLA4, CD28 или молекулу ICOS,в условиях, которые позволяют избежать гибридизации с генами некостимулирующих молекулNa) являются костимулирующими молекулами,входящими в объем изобретения. Альтернативно последовательности ДНК, которые сохраняют идентичность последовательности относительно участков молекулы нуклеиновой кислоты, кодирующей белковые домены, являющиеся важными для функции костимулирующей молекулы, например, функции связывания с другими костимулирующими молекулами, могут быть использованы для получения костимулирующих белков, которые могут быть использованы в качестве агентов, ингибирующих костимулирующий сигнал в Т-клетке. Предпочтительно когда неприродные костимулирующие молекулы обладают значительной (например, превышающей 70%, предпочтительно превышающей 80% и более предпочтительно превышающей 90-95%) идентичностью аминокислот с природной аминокислотной последовательностью экстрацеллюларного домена костимулирующей молекулы. Для определения остатков аминокислот костимулирующей молекулы, которые, вероятно, являются важными для связывания костимулирующей молекулы с ее противорецептором,можно сравнить последовательности аминокислот, содержащие экстрацеллюларные домены костимулирующих молекул различных видов животных, например, мыши и человека, и отметить консервативные (например, идентичные) остатки. Это может быть выполнено, например,с использованием любой стандартной программы сравнения, такой как MegAlign (DNASTAR). Данные консервативные или идентичные остатки, по-видимому, необходимы для правильного связывания костимулирующих молекул со своими рецепторами и таким образом, вероятно, не являются подверженными изменениям. 14 Специфические остатки костимулирующих молекул, которые являются важными для связывания, также были установлены. Например, фрагмент CD28, который является критическим для взаимодействия с В 7-1 и В 7-2, был определен с использованием сайт-направленного мутагенеза, картирования эпитопов с помощью моноклонального антитела противCD28, анализов адгезии на основе рецепторов и прямого связывания Ig-слитых белков с клеточными поверхностными рецепторами. Участок богатой пролином последовательности в CD28MYPPPY, как было показано, является необходимым для функции данного белка (см. статьюTruneh и соавт., Моl. Immunol., 33:321, (1996. Аналогичным образом участки молекулы В 7-1,важные для опосредования функционального взаимодействия с CD28 и CTLA4, были идентифицированы с помощью мутации. Было обнаружено, что два гидрофобных остатка в Vподобном домене В 7-1, включая остаток Y87,который является консервативным во всех молекулах В 7-1 и В 7-2, клонированных из организмов различных видов, являются необходимыми (см. статью Fargeas и соавт., J. Exp. Med.,182:667, (1995. Используя данные или аналогичные способы, можно определить остатки аминокислот экстрацеллюларных доменов костимулирующих молекул, которые являются необходимыми и вследствие этого не должны быть подвергнуты изменениям. Костимулирующие молекулы могут быть экспрессированы в растворимой форме или использованы как иммуногены для получения антител. Данные растворимые костимулирующие молекулы или антитела используют в качестве агентов, которые ингибируют костимулирующий сигнал в Т-клетке, как более подробно описано в данном контексте. А. Агенты с экстрацеллюларным действием, ингибирующие костимулирующий сигнал в Т-клетке. 1. Растворимые формы костимулирующих молекул. В одном из вариантов осуществления агент, блокирующий костимулирующий сигнал в Т-клетке, представляет собой растворимую форму Т-клеточной костимулирующей молекулы (например, CTLA4, CD28 и/или ICOS), которая способна блокировать трансдукцию костимулирующего сигнала в Т-клетке. В одном из вариантов осуществления агент, блокирующий костимулирующий сигнал в Т-клетке, представляет собой растворимую форму CTLA4. Последовательности ДНК, кодирующие человеческий или мышиный белок 15 вариантов осуществления растворимый белокCTLA4 содержит полный белок CTLA4. В предпочтительном варианте осуществления растворимый белок CTLA4 содержит экстрацеллюларный домен белка CTLA4. Например, растворимая рекомбинантная форма экстрацеллюларного домена CTLA4 была экспрессирована в дрожжах (см. статью Gerstmayer и соавт., FEBSLett., 407:63, (1997. В других вариантах осуществления растворимые белки CTLA4 содержат, по меньшей мере, фрагмент экстрацеллюларного домена белка CTLA4, который сохраняет способность связывать В 7-1 и/или В 7-2. В одном из вариантов осуществления растворимый белок CTLA4 или его фрагмент представляют собой слитый белок, содержащий по меньшей мере часть CTLA4, которая связывает В 7-1 и/или В 7-2, и по меньшей мере часть второго белка, отличного от CTLA4. В предпочтительных вариантах осуществления слитый белокCTLA4, который слит по аминоконцу с сигнальным пептидом, например, из онкостатина М(см., например, заявку WO 93/00431). В особенно предпочтительном варианте осуществления растворимая форма CTLA4 представляет собой слитый белок, содержащий экстрацеллюларный домен CTLA4, слитый с фрагментом молекулы иммуноглобулина. Данный слитый белок CTLA4-Ig может быть получен с использованием способов, известных в области техники (см., например, статью linsleyDesign), 2:221, (1994); Linsley, заявка WO 93/00431 и патент США 5770197). В одном из вариантов осуществления агент, блокирующий костимулирующий сигнал в Т-клетке, представлен растворимой формой костимулирующей молекулы антиген-презентирующей клетки (например, молекула семейства В 7, такая как В 7-1, В 7-2 и/или лигандICOS). Например, в одном из вариантов осуществления растворимая форма костимулирующей молекулы включает растворимую форму В 7-1 или растворимую форму В 7-2 или комбинацию растворимой формы В 7-1 и растворимой формы В 7-2. Последовательности ДНК, кодирующие белки В 7, известны в области техники, см., например, относительно В 7-2 статью Freeman и соавт., Science, 262:909, (1993) или GenBank регистрационныеP42081 или А 48754, относительно В 7-1 статью Freeman и соавт., J.Exp. Med., 174:625, (1991) или GenBank регистрационныеP33681 или А 45803. В ряде вариантов осуществления растворимый белок В 7 содержит полный белок В 7. В предпочтительных вариантах осуществления растворимый белок В 7 содержит экстрацеллюларный домен белка В 7. Например, растворимая рекомбинантная форма экстрацеллюларного домена CTLA4 была экспрессирована в дрожжах (см. статьюGerstmayer и соавт., FEBS Lett., 407:63, (1997. В других вариантах осуществления растворимые белки В 7 содержат по меньшей мере фрагмент экстрацеллюларного домена белка В 7, который сохраняет способность связывать CTLA4 и/или CD28. В одном из вариантов осуществления растворимый белок В 7 или его фрагмент представлены слитым белком, содержащим по меньшей мере часть В 7, которая связывает CD28 и/илиCTLA4, и по меньшей мере часть второго белка,отличного от В 7. В предпочтительных вариантах осуществления слитый белок В 7 содержит экстрацеллюларный домен В 7, который слит по аминоконцу с сигнальным пептидом, например,из онкостатина М (см., например, заявку WO 93/00431). В наиболее предпочтительном варианте осуществления растворимая форма В 7 представлена слитым белком, содержащим экстрацеллюларный домен В 7, слитый с фрагментом молекулы иммуноглобулина. Данный слитый белок В 7Ig можно получить, используя способы, известные в области техники (см., например, статью Linsley "Перспективы в области обнаружения и создания лекарств" (PerspectivesLinsley, Заявка WO 93/00431, Патент США 5770197 и Патент США 5580756). 2. Антитела, которые связывают костимулирующие молекулы. В ряде вариантов осуществления агент,блокирующий костимулирующий сигнал в Тклетке, представлен антителом, которое связывает костимулирующую молекулу. При получении антител, которые связывают костимулирующие молекулы, возможно использование костимулирующего белка, фрагмента костимулирующего белка (например, пептида, выделенного из костимулирующего белка) или слитого белка, который включает полностью или частично аминокислотную последовательность костимулирующей молекулы, для создания поликлональной антисыворотки или моноклональных антител против белка и/или против пептида с использованием стандартных способов. Термин "антитело", как используют в данном контексте, предназначен для включения целых антител, а также их фрагментов. Фрагменты антител (например, фрагменты Fab',фрагменты F(ab')2 или одноцепочечные антитела) могут быть получены с использованием способов, хорошо известных в области техники. Термин антитело включает также химерные и гуманизированные антитела. Например, млекопитающие (в частности,мышь, хомячок или кролик) могут быть иммунизированы с помощью иммуногенной формы костимулирующего белка или пептида, которые вызывают ответ антител у млекопитающего. Иммуноген может быть представлен, например,рекомбинантным белком костимулирующей 17 молекулы или его фрагментом, синтетическим пептидным фрагментом или клеткой, которая экспрессирует костимулирующую молекулу на своей поверхности. Клетка может быть, например, антиген-презентирующей клеткой или Тклеткой или клеткой, трансфицированной нуклеиновой кислотой, кодирующей костимулирующую молекулу, при этом костимулирующая молекула экспрессируется на клеточной поверхности. Клетки-хозяева, трансфицированные таким образом, чтобы получить экспрессию пептидов, могут быть представлены любой прокариотической или эукариотической клеткой. Например, пептид, обладающий активностью костимулирующей молекулы, может быть экспрессирован в бактериальных клетках, таких как Е. соli, клетках насекомых (бакуловирус), в дрожжах или клетках млекопитающих, таких как клетки яичников китайского хомячка (СНО) и клетки NSO. Другие подходящие клеткихозяева и экспрессионные векторы можно найти в работе Goeddel (1990) supra или они известны компетентным специалистам в данной области техники. Примеры векторов для экспрессии в дрожжах S. cerivisae включают pYepSec1 (см. статью Baldari и соавт., Embo J., 6:229-234,(1987, pMFa (см. статью Kurjan и Herskowitz,Cell, 30:933-943, (1982, pJRY88 (см. статьюpYES2 (Invitrogen Corporation, San Diego, CA). Имеющиеся бакуловирусные векторы для экспрессии белков в культивируемых клетках насекомых (клетки SF 9) включают серию рАс (см. статью Smith и соавт., Mol. Cell Biol., 3:21562165, (1983 и серию pVL (см. статью LucklowV.A. и Summers M.D., Virology, 170:31-39,(1989. В основном для временной амплификации/экспрессии в клетках млекопитающих используют клетки COS (см. статью Gluzman Y.,Cell, 23:175-182, (1981 в сочетании с такими векторами, как pCDM8 (см. статью Seed В., Nature, 329:840, (1987, тогда как клетки СНО(клетки dhfr- яичников китайского хомячка) используют с такими векторами, как рМТ 2 РС (см. статью Kaufrnan и соавт., EMBO J., 6:187-195,(1987,для стабильной амплификации/ экспрессии в клетках млекопитающих. Предпочтительной клеточной линией для продукции рекомбинантного белка является линия клеток миеломы NSO, имеющаяся в ЕСАСС (каталожный 85110503) и описанная в работе Galfre G. и Milstein С. 1981) Methods in Enzymology,73(13):3-46 и монографии "Стратегия и способы получения моноклональных антител" (Preparation of Monoclonal Antibodies: Strategies and Procedures), Academic Press, N.Y., N.Y). Вектор ДНК может быть интродуцирован в клетки млекопитающего посредством принятых технологий, таких как соосаждение фосфатом кальция или хлоридом кальция, DEAE-декстранопосредованная трансфекция, липофекция или электропорация. Пригодные способы трансфор 005236 18 мации клеток-хозяев можно найти в монографии Sambrook и соавт. "Лабораторное руководство по молекулярному клонированию (Molecular Cloning: A Laboratory Manual), 2-е изд.,Cold Spring Harbor Laboratory press (1989 и других лабораторных руководствах. При использовании в клетках млекопитающих функции контроля экспрессионых векторов часто обеспечиваются вирусным материалом. Например, обычно используемые промоторы выделены из полиомы, аденовируса 2, цитомегаловируса и, что наиболее часто, вируса 40 обезьян. Пептиды, обладающие активностью костимулирующей молекулы, экпрессировали в клетках млекопитающих, или в ином случае они могут быть очищены в соответствии со стандартными процедурами, соответствующими области техники, включая осаждение сульфатом аммония, фракционирование на хроматографических колонках (например, ионообменная хроматография, гель-фильтрация, электрофорез,аффинная хроматография и т.п.) с окончательной очисткой кристаллизацией (см. в целом работу "Очистка ферментов и подобные технологии" ("Enzyme Purification and Related Techniques"), Methods in Enzymology, 22:233-577(1971. Специалистам в данной области будет понятно, что в объем их компетенции входит получение антител против человеческих костимулирующих молекул с помощью стандартных технологий. Антитела могут быть представлены либо поликлональными, либо моноклональными антителами, либо антиген-связывающими фрагментами данных антител. Особенное значение в плане терапевтического применения имеют антитела, которые ингибируют связывание костимулирующей молекулы с ее природным лигандом(ами) на поверхности иммунных клеток, ингибирующее таким образом костимуляцию иммунной клетки. Предпочтительными антителами против костимулирующих молекул являются антитела, способные к ингибированию или отрицательной регуляциии опосредованных Т-клетками иммунных ответов путем связывания В 7-1 или В 7-2 на поверхности Влимфоцитов и предотвращения взаимодействия с CTLA4 и/или CD28. Другими предпочтительными антителами против костимулирующих молекул являются антитела, которые в комбинации со вторым антителом, которое связывает другую костимулирующую молекулу, приводят к повышению уровня ингибирования костимуляции Т-клеток по сравнению с действием только первого антитела, например, комбинация антител против В 7-1 и против В 7-2. А. Иммуноген. Термин "иммуноген" используют в данном контексте для описания композиции, содержащей пептид, обладающий активностью костимулирующей молекулы, в качестве активного ингредиента, который используют для получе 19 ния антител против костимулирующей молекулы. Когда пептид, обладающий активностью костимулирующей молекулы, используют для индукции антител, следует понимать, что может быть использован один пептид или пептид, связанный с носителем в виде конъюгата или в виде пептидного полимера. Для получения пригодных антител против костимулирующей молекулы иммуноген должен содержать эффективное иммуногенное количество пептида, обладающего активностью костимулирующей молекулы, как правило, в виде конъюгата, связанного с носителем. Эффективное количество пептида/унифицированная доза зависит среди прочего от вида инокулируемого животного, массы тела животного и выбранной схемы иммунизации, как это хорошо известно в области техники. Иммуногенный препарат обычно будет содержать пептид в концентрации от приблизительно 10 мкг до приблизительно 500 мг/иммунизационную дозу,предпочтительно от приблизительно 50 мкг до приблизительно 50 мг/дозу. Препарат для иммунизации может также включать адъювант в качестве части разбавителя. Адъюванты, такие как полный адъювант Фрейнда (CFA), неполный адъювант Фрейнда (IFA) и квасцы, представляют собой материалы, хорошо известные в области техники и имеющиеся в продаже от различных источников. Компетентные специалисты в данной области оценят, что вместо использования для иммунизации природных форм костимулирующей молекулы альтернативно могут быть использованы синтетические пептиды, против которых могут образовываться антитела для применения данного изобретения. Как растворимые, так и связанные с мембраной костимулирующая молекула или пептидные фрагменты являются пригодными для использования в качестве иммуногена и могут быть также выделены иммуноаффинной очисткой. Таким образом очищенная форма белка костимулирующей молекулы, такая, которая может быть выделена,как описано выше или как известно в области техники, может быть как таковая использована в качестве иммуногена или, альтернативно, может быть связана с подходящим белком-носителем традиционными способами, включая способы химического связывания, а также способами генной инженерии с использованием клонированного гена костимулирующей молекулы. Пептид или белок, выбранный для иммунизации, может быть модифицирован с целью повышения его иммуногенности. Например,технологии придания пептиду иммуногенности включают конъюгирование с носителями или другие способы, хорошо известные в области техники. Любой пептид, выбранный для иммунизации, может быть также синтезирован. В ряде вариантов осуществления данные пептиды могут быть синтезированы в виде разветвлен 005236 20 ных пептидов для повышения иммунных ответов, как известно в области техники (см., например, монографию "Пептиды" ("Peptides") под ред. Bernd Gutte, Academic Press, с. 456-493,(1995. Очищенный белок костимулирующей молекулы может также быть ковалентно или нековалентно модифицирован небелковыми материалами, такими как липиды или углеводы с целью повышения иммуногенности или растворимости. Альтернативно очищенный белок костимулирующей молекулы может быть связан с вирусной частицей, реплицирующимся вирусом или другим микроорганизмом или инкорпорирован в них для повышения иммуногенности. Белок костимулирующей молекулы может быть,например, химически присоединен к вирусной частице или микроорганизму или их иммуногенной части. В иллюстративном варианте осуществления очищенный белок костимулирующей молекулы или пептидный фрагмент, обладающий активностью костимулирующей молекулы (например, полученный путем ограниченного протеолиза или технологиями с использованием рекомбинантной ДНК), конъюгируют с носителем, который является иммуногенным для животных. Предпочтительные носители включают такие, как альбумин, белки сыворотки (например, глобулины и липопротеины) и полиаминокислоты. Примеры используемых белков включают бычий сывороточный альбумин, кроличий сывороточный альбумин, тироглобулин, гемоцианин блюдечка, яичный овальбумин и коровьи гамма-глобулины. Синтетические полиаминокислоты, такие как полилизин или полиаргинин, также представляют собой эффективные носители. Что касается ковалентного присоединения белка костимулирующей молекулы или пептидного фрагмента к подходящему иммуногенному носителю, то существует ряд химических перекрестно-сшивающих агентов, которые известны компетентным специалистам в данной области. Предпочтительными перекрестносшивающими агентами являются гетерофункциональные перекрестно-сшивающие линкеры,которые могут быть использованы для постадийного связывания белков. В области техники известен широкий круг гетеробифункциональных перекрестно-сшивающих линкеров, включая сукцинимидил 4-(N-малеимидометил)циклогексан-1-карбоксилат (SMCC), сложный эфир 21 Может быть также желательным просто иммунизировать целыми клетками, которые экспрессируют на своей поверхности белок костимулирующей молекулы. В качестве иммуногенов можно использовать различные клеточные линии для выработки моноклональных антител против антигена костимулирующей молекулы, включая, но не для ограничения, активированные В-клетки. Например, В-клетки поджелудочной железы можно получить от субъекта и активировать антииммуноглобулином. Альтернативно можно использовать линию В-клеток при условии, что костимулирующая молекула экспрессируется на клеточной поверхности,такую как линия клеток Raji (В-клеточной лимфомы Burkett, см., например, статью FreemanG.J. и соавт., Science, 262:909-911, (1993 или линию лимфобластоидных клеток JY В (см.,например, статью Azuma M. и соавт., Nature,366:76-79, (1993. Целые клетки, которые могут быть использованы в качестве иммуногенов для получения антител со специфичностью в отношении костимулирующей молекулы, включают также рекомбинантные трансфектанты. Например, клетки COS и СНО реконструированы путем трансфекции кДНК костимулирующей молекулы так, как описано в работах Knudson и соавт. (PNAS, 90:4003-4007, (1993; Travernor и соавт. (Immunogenitics, 37:474-477, (1993;Dougherty и соавт. (J. Exp. Med., 174:1-5, (1991 и Aruffo и соавт. (Cell, 61:1303-1313, (1990, с целью получения интактной костимулирующей молекулы на клеточной поверхности. Данные клетки-трансфектанты могут быть затем использованы в качестве иммуногена для получения антител против костимулирующей молекулы с заданной специфичностью. Известны другие примеры клеток-трансфектантов, в частности, эукариотные клетки, способные гликозилировать белок костимулирующей молекулы, но любой способ, пригодный для экспрессии трансфицированных генов костимулирующей молекулы на клеточной поверхности, можно было бы использовать для получения иммуногена в виде целой клетки. В. Поликлональные антитела против костимулирующей молекулы. Поликлональные антитела против очищенного белка костимулирующей молекулы или пептида, обладающего активностью костимулирующей молекулы, в основном могут быть получены у животных с помощью множества подкожных (sc) или внутрибрюшинных (ip) инъекций иммуногена в виде костимулирующей молекулы, такой как экстрацеллюларный домен белка костимулирующей молекулы, и адъюванта. Например, как описано выше, может быть эффективным конъюгирование костимулирующей молекулы (включая фрагменты, содержащие определенный эпитоп(ы), представляющий интерес) с белком, который является иммуногенным для иммунизируемого вида, например, с 22 гемоцианином блюдечка, сывороточным альбумином. В способе и схеме иммунизации животного-хозяина или выделенных из него культивируемых продуцирующих антитело клеток могут в целом быть использованы разработанные и принятые технологии стимуляции и продукции антител. В иллюстративном варианте осуществления животных, как правило, иммунизируют в отношении иммуногенных конъюгатов костимулирующей молекулы или производных путем смешивания 1 мкг - 1 мг конъюгата с полным адъювантом Фрейнда и внутрикожной инъекции раствора в различные участки тела. Через один месяц животным проводят повторную иммунизацию 1/5-1/10 исходного количества конъюгата в полном адъюванте Фрейнда (или другого подходящего адъюванта) путем подкожной инъекции в множество участков тела. Через 7-14 дней у животных берут кровь и оценивают сыворотку на титр молекул против костимулирующей молекулы. Животных повторно иммунизируют,пока значение титра не выходит на плато. Предпочтительно, когда животное повторно иммунизируют конъюгатом одного и того же белка костимулирующей молекулы, но конъюгированной с другим белком и/или с помощью другого перекрестно-сшивающего агента. Конъюгаты могут быть также получены в культуре рекомбинантных клеток в виде слитых белков. Кроме того, для усиления иммунного ответа могут быть использованы агрегирующие агенты, такие как квасцы. Данные, образуемые млекопитающими популяции молекул антител, называют "поликлональными", поскольку популяция содержит антитела с различной иммуноспецичностью и аффинностью в отношении костимулирующей молекулы. Затем молекулы антитела собирают из организма млекопитающего и выделяют хорошо известными способами, такими как, например, с использованием DEAE Sephadex для получения фракции IgG. Для повышения специфичности антитела данные антитела могут быть очищены с помощью иммуноаффинной хроматографии с использованием иммуногена,связанного с твердой фазой. Антитело контактирует с иммуногеном, связанным с твердой фазой, в течение времени, которое является достаточным для иммунореакции иммуногена с молекулами антитела с образованием связанного с твердой фазой иммунокомплекса. Связанные антитела отделяют от комплекса стандартными способами. С. Моноклональные антитела против костимулирующей молекулы. Термин "моноклональные антитела" или"композиция моноклональных антител", как используют в данном контексте, относится к популяции молекул антител, которая содержит только один вид антигенсвязывающего центра,который способен к иммунореакции с опреде 23 ленным эпитопом костимулирующей молекулы. Таким образом композиция моноклональных антител обычно проявляет одну аффинность связывания в отношении определенного белка костимулирующей молекулы, с которой оно вступает в иммунореакцию. Предпочтительно,когда моноклональное антитело, используемое в данном способе, далее характеризуется, как вступающее в иммунореакцию с костимулирующей молекулой, выделенной у человека. Моноклональные антитела, используемые в композициях и способах, соответствующих изобретению, направлены на эпитоп антигена костимулирующей молекулы, так что образование комплекса между антителом и костимулирующей молекулой ингибирует взаимодействие костимулирующей молекулы с ее природным лигандом(ами) на поверхности иммунных клеток, ингибируя таким образом костимуляцию Тклетки посредством взаимодействия костимулирующей молекулы и лиганда. Моноклональное антитело против эпитопа костимулирующей молекулы можно получить с использованием технологии, которая обеспечивает образование молекул антител в культуре стабильных клеточных линий. Данные технологии включают без ограничения перечисленным гибридомные технологии, изначально описанные в статье Kohler и Milstein (Nature, 256:495-497, (1975, более раннюю технологию с использованием гибридомы В-клеток человека (см. статью Kozbor и соавт., Immunol. Today, 4:72, (1983, технологию с использованием EBV-гибридомы (см. работу Cole и соавт., "Моноклональные антитела и терапия рака" (Monoclonal Antibodies and CancerTherapy), Alan R. Liss, Inc., c. 77-96, (1985, а также технологии с использованием триомы. Другие способы, которые могут обеспечивать эффективное получение моноклональных антител, используемых в данном изобретении,включают технологии с представлением на фагах (см. статью Marks и соавт., J. Biol. Chem., с. 16007-16010, (1992. В одном из вариантов осуществления препарат антител, используемый в данном способе,представляет собой моноклональное антитело,образуемое линией гибридомных клеток. Способы слияния с образованием гибридомы впервые представлены Kohler и Milstein (см. статьиKohler и соавт., Nature, 256:495-97 (1975); Brown и соавт., J. Immunol, 127:539-46, (1981); Brown и соавт., J. Biol. Chem., 255:4980-83, (1980); Yeh и соавт., PNAS, 76:2927-31, (1976) и Yeh и соавт.,Int. J. Cancer, 29:269-75, (1982. Таким образом композиции моноклональных антител, соответствующие данному изобретению, можно получить следующим способом, который предусматривает стадии(а) иммунизации животного костимулирующей молекулой. Иммунизацию, как правило, осуществляют путем введения иммуногена костимулирующей молекулы иммунокомпе 005236 24 тентному млекопитающему в иммунологически эффективном количестве, т.е. в количестве, достаточном для получения иммунного ответа. Предпочтительно, когда млекопитающее является грызуном, таким как кролик, крыса или мышь. Затем млекопитающее поддерживают в течение времени, которое достаточно для образования у млекопитающего клеток, секретирующих молекулы антител, иммунореактивных с иммуногеном костимулирующей молекулы. Данную иммунореакцию определяют путем скрининга полученных таким образом молекул антител на иммунореактивность с использованием препарата белка иммуногена. Необязательно, но может быть желательным проведение скрининга молекул антител с использованием препарата белка в той форме, в которой его должны определять с помощью молекул антител при анализе, например, в связанной с мембраной форме костимулирующей молекулы. Данные способы скрининга хорошо известны компетентным в данной области специалистам;(b) затем готовят суспензию продуцирующих антитело клеток, взятых у каждого иммунизированного млекопитающего. Через достаточный период времени мышь умерщвляют и получают соматические лимфоциты, продуцирующие антитело. Продуцирующие антитело клетки могут быть выделены из лимфатических узлов, селезенок и периферической крови нагруженных животных. Клетки селезенки являются предпочтительными, и они могут быть механически разделены на отдельные клетки в физиологически переносимой среде с использованием способов, известных в области техники. Лимфоциты мыши дают более высокий процент стабильных слияний с клетками мышиных миелом, описанными ниже. Возможно также использование соматических клеток кролика, крысы и лягушки. Хромосомы клеток селезенки,кодирующие желательные иммуноглобулины,иммортализуют путем слияния клеток селезенки с клетками миеломы, в основном, в присутствии способствующего слиянию агента, такого как полиэтиленгликоль (PEG). В качестве партнера для слияния может быть использована любая из числа линий клеток миеломы в соответствии со стандартными методиками, например, линии миеломы P3-NS1/1-Ag4-1, P3-x63-Ag8.653 илиSp2/0-Agl4. Данные линии миеломы имеются в Американской коллекции типовых культур(American Type Culture Collection) (ATCC),Rockville, Md. Полученные клетки, которые включают желательные гибридомы, затем выращивают в селективной среде, такой как среда HAT, в которой неслитая родительская миелома или клетки лимфоцитов в конечном счете погибают. Только гибридомные клетки выживают и могут выращиваться в условиях ограничивающего разведения с целью получения изолированных клонов. Скрининг супернатантов гибридом на 25 присутствие антитела желаемой специфичности проводят, например, способами иммуноанализа с помощью антигена, который был использован для иммунизации. Положительные клоны затем могут быть субклонированы в условиях ограничивающего разведения и образованные моноклональные антитела могут быть выделены. Существуют различные традиционные способы выделения и очистки моноклональных антител,направленные на освобождение их от других белков и иных примесей. Обычно используемые способы очистки моноклональных антител включают осаждение сульфатом аммония, ионообменную хроматографию и аффинную хроматографию (см., например, раздел, написанныйZola и соавт. в монографии "Методы получения и применения моноклональных гибридомных антител" (Monoclonal Hybridoma Antibodies:Techniques And Applications) под ред. Hurell, с. 51-52 (CRC Press (1982. Гибридомы, очищенные согласно данным способам, могут быть размножены in vitro или in vivo (в асцитной жидкости) с использованием известных в области техники методик. Вообще отдельную клеточную линию можно размножить in vitro, например, в лабораторных сосудах для культивирования, а питательная среда, содержащая высокие концентрации моноспецифического моноклонального антитела, может быть получена с помощью декантации, фильтрации или центрифугирования. Альтернативно выход моноклонального антитела можно повысить путем инъекции образца гибридомы гистосовместимому животному того типа, который был использован для получения соматических клеток и клеток миеломы для исходного слияния. Опухоли, секретирующие специфическое моноклональное антитело, получали при развитии гибридной слитой клетки в организме инъецированного животного. Жидкости тела животного, такие как асцитная жидкость или сыворотка, обеспечивают моноклональные антитела в высоких концентрациях. При использовании человеческих гибридом илиEBV-гибридом необходимо избегать отторжения ксенотрансплантата, инъецированного животным, таким как мыши. Возможно использование иммунодефицитных или голых мышей или можно пассировать гибридому сначала на облученных голых мышах в виде солидной подкожной опухоли, культивировать in vitro, а затем внутрибрюшинно инъецировать нагруженным пристаном облученным голым мышам, у которых развиваются асцитные опухоли, секретирующие большие количества специфических человеческих моноклональных антител. Среды и животные, используемые для приготовления данных композиций, хорошо известны в уровне техники, производятся в промышленных масштабах и включают синтетические среды для культивирования, инбредных мышей и т.п. Примером синтетической среды 26 является минимальная основная среда Дульбекко (Dulbecco) (см. DMEM; статью Dulbecco и соавт., Virol., 8:396, (1959 сдобавлением 4,5 г/л глюкозы, 20 мМ глутамина и 20% эмбриональной кошачьей сыворотки. Примером инбредной линии мышей является Balb/c.D. Гуманизированные антитела против костимулирующей молекулы. Когда антитела, продуцируемые субъектами, отличными от человека, применяют для терапии человека, они распознаются в различной степени как чужеродные, и у пациента может вырабатываться иммунный ответ. Один из подходов к минимизации или устранению данной проблемы, который является предпочтительным для общей иммуносупрессии, является получение химерных производных антител, т.е. молекул антител, которые сочетают вариабельный участок животного и константный участок человека. Данные антитела эквивалентны вышеописанным моноклональным и поликлональным антителам, но могут быть менее иммуногенными при введении человеку и вследствие этого более вероятно, что они будут переноситься пациентом. Химерные моноклональные антитела типа мышь-человек (т.е. химерные антитела), которые реактивны в отношении костимулирующей молекулы, могут быть получены, например, недавно разработанными способами получения химерных антител. Гуманизированные антитела можно получить, например, путем замены иммуногенной части антитела соответствующей,но неиммуногенной частью. Соответственно гены, кодирующие константные участки мышиного (или другого вида животного) антитела против костимулирующей молекулы, заменяют генами, кодирующими человеческие константные участки. (См. Robinson и соавт., международная патентная публикация PCT/US 86/02269;Akira и соавт. Европейская патентная заявка 184187; Taniguchi M. Европейская патентная заявка 171496; Morrison и соавт. Европейская патентная заявка 173494; Neuberger и соавт.,заявка РСТ WO 86/01533; Саbily и соавт. Европейская патентная заявка 125023; статьи Better и соавт., Science, 240:1041-1043, (1988); Liu и соавт. PNAS, 84:3439-3443, (1987); Liu и соавт. J.PNAS, 84:214-218, (1987); Nishimura и соавт.,Саnc. Res., 47:999-1005, (1987); Wood и соавт.,Nature, 314:446-449 и Shaw и соавт., J. Natl. Cancer Inst., 80:1553-1559, (1988. Общие обзоры по "гуманизированным" химерным антителам представлены Morrison S.L, Science, 229:12021207, (1985) и Oi и соавт., BioTechniques, 4:214,(1986). Данные способы включают выделение,манипуляции и экспрессию последовательностей нуклеиновых кислот, которые кодируют полностью или частично вариабельный участок иммуноглобулина по меньшей мере из одной тяжелой или легкой цепи. Источники данной 27 нуклеиновой кислоты хорошо известны компетентным специалистам в данной области и, например, могут быть получены из гибридомы,продуцирующей антитело против костимулирующей молекулы. Химерная кДНК затем может быть клонирована в подходящий экспрессирующий вектор. Подходящие "гуманизированные" антитела могут быть альтернативно получены заменойCDR или СЕА (см. Winter, Патент США 5225539; статьи Jones и соавт., Nature, 321:552525, (1986); Verhoeyan и соавт., Science,239:1534, (1988) и Beidler и соавт., J. Immunol.,141:4053-4060, (1988. Е. Комбинаторные антитела против костимулирующей молекулы. Композиции как моноклональных, так и поликлональных антител, соответствующих изобретению, могут быть также получены другими способами, хорошо известными компетентным специалистам в области технологии рекомбинантной ДНК. Альтернативный способ,называемый "представлением комбинаторных антител", был разработан для идентификации и выделения фрагментов антител, обладающих определенной специфичностью в отношении антигенов, и может быть использован для получения моноклональных антител против костимулирующей молекулы, а также поликлональной популяции против костимулирующей молекулы (см. статьи Sastry и соавт., PNAS, 86:5728,(1989); Huse и соавт., Science, 246:1275, (1989) иOrlandi и соавт., PNAS, 86:3833, (1989. После иммунизации животного иммуногеном в виде костимулирующей молекулы, как описано выше, клонируют спектр антител из полученного набора В-клеток. В основном известны способы прямого получения последовательности ДНК вариабельных участков гетерогенной популяции молекул иммуноглобулина с использованием смеси олигомерных праймеров и ПЦР (полимеразной цепной реакции). Например, смешанные олигонуклеотидные праймеры, соответствующие 5'-лидерным последовательностям (последовательностям сигнального пептида) и/или скелетным последовательностям 1 (FR1), а также праймер консервативного 3'-константного участка могут быть использованы для ПЦРамплификации вариабельных участков тяжелой и легкой цепей ряда мышиных антител (см. статью Larrick и соавт., Biotechniques, 11:152-156,(1991. Аналогичная стратегия может быть также использована для амплификации вариабельных участков тяжелой и легкой цепей человеческих антител (см. работу Larrick и соавт.(Methods: Companion to Methods in Enzymology),2:106-110, (1991. Возможность клонировать гены человеческого иммуноглобулина V приобретает особую важность в свете успехов в создании наборов человеческих антител в трансгенных животных (см., например, статьи Brug 005236Bruggeman и соавт., Eur. J. Immunol, 21:13231326, (1991), а также Wood и соавт., публикация заявки РСТ WO 91/00906). В иллюстративном варианте осуществления РНК выделяют из активированных Вклеток, например, из препаратов периферической крови, костного мозга или селезенки, используя стандартные протоколы (например, патент США 4683202; статьи Orlandi и соавт.,PNAS, 86:3833-3837 (1989); Sastry и соавт.,PNAS, 86:5728-5732 (1989) и Huse и соавт. Science, 246:1275-1281 (1989. кДНК первой нити синтезируют с использованием праймеров, специфических в отношении константного участка тяжелой цепи(ей) и каждой из - и -легких цепей, а также праймеров для сигнальной последовательности. Используя ПЦР-праймеры для вариабельного участка, амплифицируют вариабельные участки как тяжелой, так и легкой цепей (каждую из них как отдельно, так и в комбинации) и лигируют в соответствующие векторы для дальнейших манипуляций по созданию упаковок для представления. Олигонуклеотидные праймеры, используемые в протоколах амплификации, могут быть уникальными или дегенерированными или включать инозин в дегенерированных положениях. Последовательности узнавания рестриктазами также могут быть включены в праймеры, чтобы обеспечить клонирование амплифицированного фрагмента в вектор в заданную рамку считывания для экспрессии. Библиотека V-генов, клонированная из спектра антител, выделенных при иммунизации,может быть экспрессирована популяцией представляющих фагов, предпочтительно выделенных из нитчатого фага, с целью образования библиотеки, представляющей антитела. В идеале упаковка для представления содержит систему, которая позволяет получать образцы библиотек представления очень сильно различающихся антител, проводить быстрый сортинг после каждого этапа аффинного разделения и быстрое выделение гена антитела из очищенных упаковок для представления. В дополнение к производимым в промышленности наборам для создания библиотек представления фагов (например, Pharmacia Recombinant Phage AntibodySystem, каталожный 27-9400-01 и набор для представления фагов Stratagene SurfZAP каталожный 240612), примеры способов и реагентов, особенно подходящих для применения при создании библиотеки представления широкого круга антител против костимулирующей молекулы можно найти, например, в патенте США 5223409, выданном Ladner и соавт.; международной публикации Kang и соавт. WO 92/18619; международной публикации Dower и соавт. WO 91/17271; международной публикации Winter и соавт. WO 92/20791; международ 29 ной публикации Markland и соавт. WO 92/15679; международной публикации Breitling и соавт.Res., 19:4133-4137, (1991) и Barbas и соавт.,PNAS, 88:7978-7982, (1991). В ряде вариантов осуществления доменыV-участка тяжелой и легкой цепей могут быть экспрессированы на одном и том же полипептиде, связанные гибким линкером, для образования одноцепочечного фрагмента Fv, а ген scFV затем клонирован в желаемый экспрессионный вектор или геном фага. Как в основном описано в статье McCafferty и соавт. (Nature, 348:552554, (1990, полные домены антитела VН и VL,связанные гибким ликером (Gly4-Ser)3, могут быть использованы для получения одноцепочечного антитела, которое может обеспечить разделение представляющей упаковки по аффинности в отношении антигена. Из выделенных антител scFV, иммунореактивных с костимулирующей молекулой, может быть приготовлен фармацевтический препарат для применения в данном способе.F. Гибридомы и способы получения. Гибридомы, используемые в данном изобретении, представляют собой гибридомы, характеризующиеся способностью образовывать моноклональное антитело, которое является специфически иммунореактивным с костимулирующей молекулой. Как описано ниже, гибридомная клетка, продуцирующая антитело против костимулирующей молекулы, может быть непосредственно имплантирована животномуреципиенту с целью получения постоянного источника антитела. Использование иммуноизолирующих устройств для инкапсуляции культуры гибридомы может предупредить иммуногенный ответ в отношении имплантированных клеток, а также препятствовать неконтролируемой пролиферации клеток гибридомы в организме иммунокомпромиссного хозяина. Предпочтительная гибридома, соответствующая данному изобретению, характеризуется продукцией молекул антитела, которое является специфически иммунореактивным с костимулирующей молекулой, экспрессирующейся на клеточных поверхностях активированных В-клеток человека. 30 Способы создания гибридом, которые продуцируют, например секретируют, молекулы антитела, обладающие желательной иммуноспецифичностью, т.е. имеющие способность связывать определенную костимулирующую молекулу и/или идентифицируемый эпитоп костимулирующей молекулы, хорошо известны в области техники. Особенно пригодной для применения является гибридомная технология, описанная в работах Niman и соавт., PNAS, 80:49494953, (1983) и Galfre и соавт., Meth. Enzymol.,73:3-46, (1981). В другом примере способа трансгенные мыши, несущие спектры человеческих антител,могут быть иммунизированы человеческой костимулирующей молекулой. Спленоциты данных иммунизированных трансгенных мышей могут быть использованы для создания гибридом, которые секретируют человеческие моноклональные антитела, специфически реактивные с человеческой костимулирующей молекулой (см.,например, публикацию заявки РСТ Wood и соавт. WO 91/00906, публикацию заявки РСТKucherlapati и соавт. WO 91/10741; публикацию заявки РСТ Lonberg и соавт. WO 92/03918 ; публикацию заявки РСТ Кау и соавт. 92/03917; статьи Lonberg N. и соавт., Nature, 368:856-859,(1994); Green L.L и соавт., Nature Genet., 7:1321, (1994); Morrison S.L и соавт., Ргос. Natl.Acad. Sci. USA, 81:6851-6855, (1994); Bruggeman и соавт., Year Immunol., 7:33-40, (1993); Tuaillon и соавт., PNAS, 90:3720-3724, (1993) и Bruggeman и соавт., Eur J. Immunol., 21:1323-1326,(1991. Термин "антитело", как используют в данном контексте, предусматривает включение фрагментов антитела, которые также являются специфически реактивными с костимулирующей молекулой, как описано в данном контексте. Фрагменты антител могут быть получены с использованием принятых способов, а скрининг фрагментов на применение проводят таким же образом, как описано выше для целых антител. Например, фрагменты F(ab)2 можно получить при обработке антитела пепсином. Полученный фрагмент F(ab')2 может быть обработан с целью восстановления дисульфидных мостиков для получения фрагментов Fab'. Антитела, полученные с использованием тех или иных способов, могут быть протестированы для определения, ингибируют ли они костимулирующий сигнал в Т-клетке, с помощью нижеописанных способов. В одном из вариантов осуществления агент, который ингибирует костимулирующий сигнал в Т-клетке, представляет собой антитело,которое связывает как В 7-1, так и В 7-2. При создании такого антитела, например, фрагменты экстрацеллюларного домена, которые являются консервативными у двух костимулирующих молекул, могут быть использованы в качестве 31 иммуногена. См., например, статью Metzler и соавт., Nat. Struct. Biol., 4:527, (1997. В одном из вариантов осуществления агент, который ингибирует костимулирующий сигнал в Т-клетке, представляет собой антитело,которое связывает В 7-1. Данные антитела известны в области техники или могут быть получены, как представлено выше, с использованием молекулы В 7-1 или ее фрагмента в качестве иммуногена с проведением скрининга с помощью представленных выше способов или других стандартных способов. Примеры антител против В 7-1 включают антитела, представленные в патенте США 5747034 и статьях McHugh и соавт., Clin. Immunol. Immunopathol., 87:50,(1998) или Rugtveit и соавт., Clin. Exp. Immunol.,110:104, (1997). В другом варианте осуществления агент,который ингибирует костимулирующий сигнал в Т-клетке, представляет собой антитело, которое связывает В 7-2. Данные антитела известны в области техники или могут быть получены,как представлено выше, с использованием молекулы В 7-2 или ее фрагмента в качестве иммуногена с проведением скрининга с помощью представленных выше способов или других стандартных способов. Примеры антител против В 7-2 включают антитела, представленные в статье Rugtveit и соавт., Clin. Exp. Immunol.,110:104, (1997). В одном из вариантов осуществления агент, который блокирует костимулирующий сигнал в Т-клетке, представляет собой комбинацию антитела, которое связывает В 7-1 и антитела, которое связывает В 7-2. В ряде других вариантов осуществления агент, который ингибирует костимулирующий сигнал в Т-клетке, представляет собой антитело,которое связывает CD28, но не трансдуцирует костимулирующий сигнал в Т-клетку (например, фрагмент Fab или антитело против CD28). Данные антитела известны в области техники или могут быть получены, как представлено выше, с использованием молекулы CD28 или ее фрагмента в качестве иммуногена с проведением скрининга с помощью представленных выше способов или других стандартных способов. Примеры известных антител против CD28 включают антитела, представленные в статьеDarling и соавт., Gene Ther., 4:1350, (1997). В предпочтительных вариантах осуществления могут быть использованы фрагменты Fab антитела, которое связывает CD28. Было обнаружено, что данные фрагменты антитела, которые не способны перекрестно сшивать CD28 на поверхности Т-клетки, блокируют костимуляцию Т-клетки (см. статью Walunas и соавт., Immunity, 1:405, (1994. В ряде других вариантов осуществления агент, который ингибирует костимулирующий сигнал в Т-клетке, представляет собой антитело,которое связывает CTLA4, блокирующее кос 005236 32 тимулирующий сигнал в Т-клетке посредством доставки отрицательного сигнала в Т-клетку(т.е. то, которое является агонистом CTLA4). Например, перекрестное сшивание CTLA4 на поверхности Т-клетки, как было показано, ингибирует пролиферацию и продукцию ИЛ-2(интерлейкина-2) (см. статью Krummel и Allison,J. Exp. Med., 183:2533, (1996. Данные антитела могут быть получены, как представлено выше, с использованием молекулы CTLA4 или ее фрагмента в качестве иммуногена с проведением скрининга с помощью представленных выше способов или других стандартных методов. Примеры антител описаны также в статье Vandenborre и соавт., Am. J. Pathol., 152:963, (1998). В еще одном варианте осуществления агент, который ингибирует костимулирующий сигнал в Т-клетке, представляет собой антитело,которое связывает ICOS, блокирующее костимулирующий сигнал в Т-клетке. Данные антитела могут быть получены, как представлено выше, с использованием молекулы ICOS или ее фрагмента в качестве иммуногена с проведением скрининга с помощью представленных выше способов или других стандартных методов.IV. Агенты, которые регулируют экспрессию костимулирующих молекул. В другом варианте осуществления агент,который ингибирует костимулирующий сигнал в Т-клетке, представляет собой агент, который нарушает экспрессию костимулирующей молекулы. Например, было обнаружено, что взаимодействия между CD40 на антиген-презентирующих клетках и лиганда CD40 (CD40L) на Т-клетках являются важными для поддержания,усиления или пролонгирования экспрессии В 7-1 или В 7-2 на антиген-презентирующих клетках и приводят к повышенной костимуляции (см. статьи Van Gool, и соавт., Immunol. Rev., 153:47,(1996); Klaus и соавт., J. Immunol., 152:5643,(1994. В одном варианте осуществления агент,который блокирует экспрессию костимулирующей молекулы, блокируя таким образом костимулирующий сигнал в Т-клетке, представляет собой растворимую форму CD40 или CD40L. Последовательности ДНК, кодирующие данныеCD40L. В одном из вариантов осуществления агент, который блокирует экспрессию костимулирующей молекулы, блокируя таким образом костимулирующий сигнал в Т-клетке, представляет собой растворимую форму CD40 илиCD40L. В одном варианте осуществления растворимый белок CD40 или CD40L содержит полный белок. В предпочтительных вариантах осуществления растворимый белок CD40 илиCD40L содержит экстрацеллюларный домен белка. Например, растворимая рекомбинантная форма экстрацеллюларного домена белка CD40,или CD40L, или его фрагмента может быть получена в виде слитого белка, содержащего по меньшей мере часть CD40 или CD40L, при этом взаимодействие между CD40 на АРС и CD40L на Т-клетке нарушается и доставка костимулирующего сигнала в Т-клетку ингибируется. Данная растворимая рекомбинантная форма белка CD40 или CD40L содержит, по меньшей мере, фрагмент молекулы, достаточный для связывания со своим противорецептором, и, по меньшей мере, фрагмент второго белка, отличного от CD40 или CD40L. В предпочтительных вариантах осуществления слитый белок CD40 или CD40L содержит экстрацеллюларный доменCD40 или CD40L, который слит по аминоконцу с сигнальным пептидом, например, из онкостатина М (см., например, публикацию WO 93/00431). В особенно предпочтительном варианте осуществления слитая форма CD40 или CD40L представляет собой слитый белок, содержащий экстрацеллюларный домен CD40 или CD40L,который слит с фрагментом молекулы иммуноглобулина (см., например, Chen и соавт., J. Immunol., 155:2833, (1995. Такой слитый белокCD40-Ig или CD40L-Ig можно получить известными в области техники методами (см., например, Unsley "Перспективы в области обнаружения и создания лекарств" (Perspectives in DrugDiscovery and Design), 2:221, (1994); Unsley, международная заявка WO 93/00431, патент США 5770197 и патент США 5580756). Кроме того, было показано, что антитела против лиганда CD40 обладают синергетическим действием с агентами, которые ингибируют костимулирующий сигнал в Т-клетке, способствуя развитию толерантности в отношении трансплантата (см. статьи Kirk и соавт., Proc.Natl. Acad. Sci. USA, 94:8789, (1997); Larsen и соавт., Nature, 381:434, (1996. Вследствие этого, в одном из вариантов осуществления антитела против CD40 илиCD40L, которые связывают данные молекулы,но не индуцируют экспрессию костимулирующих молекул, могут быть использованы в качестве агента, который блокирует костимулирующий сигнал в Т-клетке.V. Агенты, которые действуют внутриклеточно для ингибирования костимулирующего сигнала. В одном из вариантов осуществления агент, который ингибирует костимулирующий сигнал в Т-клетке, представляет собой агент,который действует внутриклеточно для ингибирования данного сигнала. Стимуляция Т-клетки 34 через поверхностный рецептор CD28 (т.е. костимулирующий сигнал) приводит к образованию D-3 фосфоинозитидов в Т-клетке. Вследствие этого в одном варианте осуществления образование D-3 фосфоинозитидов может быть ингибировано в Т-клетке с целью ингибирования костимулирующего сигнала, чтобы ингибировать таким образом Т-клеточный ответ, который измеряют, например, по пролиферации и/или продукции цитокинов в Т-клетке. Термин"D-3 фосфоинозитиды" предусматривает включение производных фосфатидилинозита, фосфорилированных по положению D-3 цикла инозита, и охватывает соединения фосфатидилинозит(3)-монофосфат (Ptdlns(3)P), фосфатидилинозит(3,4)-бисфосфат (Ptdlns(3,4)P2) и фосфатидилинозит(3,4,5)-трифосфат (Рtdlns(3,4,5)Р 3).D-3 фосфоинозитиды образуются внутриклеточно при действии фосфатидилинозит 3 киназы (Рl3K). РI3K представляет собой гетеродимер, образованный субъединицей молекулярной массы 85 кД, которая связывает тирозилфосфорилированные белки посредством своихSH2-доменов, и каталитической субъединицей молекулярной массы 110 кД. PI3K впервые была идентифицирована каклипидкиназа, которая фосфорилируетположение D-3 цикла инозита фосфатидилинозита, Ptdlns (4)P и Ptdlns(4,5)P2. В двух последних исследованиях было показано, что PI3K на самом деле является киназой с двойной специфичностью, которая обладает активностями как липид-, так и серинкиназыCarpenter С.L. и соавт. Mol. Cell Biol., 13:1657,(1993. Соответственно в одном из вариантов осуществления агент, который ингибирует костимулирующий сигнал в Т-клетке, представляет собой агент, который ингибирует активностьPI3K. Предпочтительный агент, который ингибирует активность PI3K в Т-клетке, представлен грибным метаболитом вортманнином или его производными или аналогами. Вортманнин является сильным ингибитором PI3K, выделенным из Т. wortmannii (Kyowa Hakko Kohyo Co.Ltd.) или из Р. fumiculosum (Sigma). Производные или аналоги вортаманнина включают соединения, близкие по структуре вортманнину,которые сохраняют способность ингибироватьPI3K и ответы Т-клеток. Примеры производных и аналогов вортманнина описаны в статьях Wiesinger D. и соавт., Experientia, 30:135-136,(1974); Closse А. и соавт., J. Med. Chem.,24:1465-1471, (1981) и Baggiolini М. и соавт.,Exp. Cell Res., 169:408-418, (1987). Другой ингибитор активности PI3K, который может быть использован, представляет собой биофлавоноид кверцетин или его производные или аналоги. Производные и аналоги кверцетина включают соединения, близкие по структуре кверцетину,которые сохраняют способность ингибировать 35 производных и аналогов кверцетина описаны в статье Vlahos C.J. и соавт., J. Biol. Chem.,269:5241-5284, (1994). Предпочтительным производным кверцетина, которое ингибирует активность PI3K, является LY294002 (2-(4 морфолинил)-8-фенил-4 Н-1-бензопиран-4-он,Lilly Indianapolis, IN) (описанный в работе Vlahos и соавт., приведенной supra). Было также показано, что стимуляцияCD28 приводит к протеин-тирозинфосфорилированию в Т-клетке (см., например, статьи Vandenberghe P. и соавт., J. Exp. Med., 175:951-960,(1992); Lu Y. и соавт., J. Immunol., 149:24-29,(1992. Соответственно в одном варианте осуществления агент, который ингибирует костимулирующий сигнал в Т-клетке, ингибирует фосфорилирование тирозина в Т-клетке. Предпочтительным ингибитором протеин-тирозинкиназы является ингибитор, который ингибирует протеин-тирозинкиназы src. В одном варианте осуществления ингибитором протеинтирозинкиназы src является гербимицин А или его производное или аналог. Производные и аналоги гербимицина А включают соединения,которые близки по структуре гербимицину А и сохраняют способность ингибировать активность протеин-тирозинкиназ. В другом варианте осуществления агент, который ингибирует протеин-тирозинфосфорилирование, представляет собой протеин-тирозинфосфатазу или активатор протеин-тирозинфосфатазы. При повышении активности тирозинфосфатазы в Т-клетке абсолютное количество протеин-тирозинфосфорилирования снижается. Протеин-тирозинфосфатаза может быть клеточной протеин-тирозинфосфатазой Т-клетки, такой как CD45 или Hcph. Действие клеточной поверхностной тирозинфосфатазы на Т-клетке можно активировать путем контактирования Т-клетки с молекулой,которая связывает фосфатазу и стимулирует ее активность. Например, антитело, направленное против CD45, может быть использовано для стимуляции активности тирозинфосфатазы в Тклетке, экспрессирующей на своей поверхностиCD45. В соответствии с этим, в одном из вариантов осуществления агент, который ингибирует протеин-тирозин-фосфорилирование в Тклетке, представлен антителом против CD45 или его фрагментом, который сохраняет способность стимулировать активность CD45. Примеры фрагментов антитела включают фрагменты Fab и F(ab)2. Антитела или их фрагменты могут быть получены в стимулирующей форме,например, мультимеризованными или иммобилизованными и т.п. Кроме того, лигирование CD28 было ассоциировано с повышенной активностью фосфолипазы С (см., например, статью Nunes J. и соавт., Biochem. J., 293:835-842, (1993 и повышенными внутриклеточными уровнями кальция 36 В соответствии с этим, агент, который действует внутриклеточно, чтобы ингибировать костимулирующий сигнал в Т-клетке, может действовать путем ингибирования активности фосфолипазы С и/или ингибирования повышения внутриклеточных уровней кальция. Например,ингибитор тирозинкиназы гербимицин А ингибирует также СD28-индуцированный поток кальция в Т-клетки. Было также показано, что протеин-серин и серин-треонинкиназы участвуют в путях сигнальной трансдукции, связанных с CD28 (см. статьи Siegel J.N. и соавт., J. Immunol., 151:41164127, (1993); Pai S.V. и соавт., J. Immunol.,24:2364, (1994); Parry и соавт., Eur. J. Immunol.,27:2495, (1997. Таким образом, в другом варианте осуществления изобретения агент, который действует внутриклеточно для ингибирования костимулирующего сигнала в Т-клетке, ингибирует активность серин- или серин-треонинкиназы.VI. Другие агенты, которые блокируют костимуляцию Т-клеток. Другие агенты, которые блокируют костимулирующий сигнал в Т-клетке, могут быть идентифицированы с использованием стандартных способов. Например, данные агенты можно идентифицировать по их способности ингибировать пролиферацию и/или продукцию цитокинов в Т-клетках. В частности, может быть использована система анализа костимуляции. В данной системе человеческие Т-клетки CD28+ выделяют, например, путем истощения с помощью иммуномагнитных частиц, используя моноклональные антитела, направленные против В-клеток, естественных клеток-киллеров и макрофагов, как описано ранее (см. статью GimmiC.D. и соавт., Proc. Natl. Acad. Sci. USA, 90,6586-6590, (1993. Антиген-презентирующие клетки, например, целые клетки селезенки или очищенные В-клетки или клетки COS, трансфицированные В 7-1 или В 7-2, можно облучить или обработать митомицином С (например, в концентрации 25 мкг/мл) в течение 1 ч, а затем тщательно промыть для ингибирования пролиферации. 105 Т-клеток CD28+ можно инкубировать, например, с 105-104 АРС (например, клетками COS, трансфицированными молекулой В 7). В примере данного анализа одна популяция Т-клеток получает только первичный сигнал активации (например, сигнал Т-клеточного рецептора); другая популяция Т-клеток получает только костимулирующий сигнал, еще одна популяция Т-клеток получает как первичный сигнал активации, так и костимулирующий сигнал в присутствии агента, который тестируют на способность блокировать костимулирующий сигнал в Т-клетке. Первичный сигнал активации может быть доставлен, например, с помощью субмитогенной дозы РМА (например, 1 нг/мл),субмитогенной дозы митогена, субоптимальной дозы антигена или субмитогенной дозы антите 37 ла против Т-клеточного рецептора. Сигнал 2 доставляют с помощью антиген-презентирующих клеток, несущих молекулу В 7. Потенциальные блокирующие агенты можно тестировать в диапазоне концентраций. Например, потенциальные блокирующие антитела могут быть использованы в качестве супернатантов гибридомы или в качестве очищенного антитела (например, в концентрации приблизительно 10 мкг/мл). Пролиферация Т-клеток может быть измерена по включению 3H-тимидина (1 мкКи) в течение последних 12-18 ч 72-часового периода инкубирования. Доставка первичного сигнала активации должна приводить к некоторой пролиферации, но в Т-клетках, получивших как первичный сигнал активации, так и костимулирующий сигнал 2, должна проходить пролиферация на максимальном уровне. Блокирующие агенты идентифицируют по способности снижать максимальную индуцированную костимулирующим сигналом пролиферацию. В дополнение или в качестве альтернативы измерению пролиферации Т-клеток может быть измерена продукция цитокинов Т-клетками с использованием способов, хорошо известных в области техники. Например, ИЛ-2 и ИЛ-4, продуцируемые культурами Т-клеток, могут быть проанализированы в супернатантах культур,собранных через 24-72 ч после начала культивирования с использованием производимого в промышленности ELISA(RD Systems, Minneapolis, MN и BioSource, Camarillo, CA). Как указано выше, блокирующие агенты можно идентифицировать по способности снижать максимальную индуцированную костимулирующим сигналом продукцию цитокинов. В случае антител любые "блокирующие антитела", идентифицированные с помощью данного или иного способа анализа, могут тестироваться далее для определения костимулирующей молекулы, которую они связывают, с использованием способов, известных в области техники. Например, можно измерить способность блокирующих антител снижать уровень связывания меченого антитела с известным лигандом.VII. Дополнительные агенты для отрицательной модуляции имунных ответов. В некоторых вариантах осуществления композиции и способы, соответствующие изобретению, могут включать дополнительные агенты или применение дополнительных агентов для повышения иммунотолерантности в отношении агента, который стимулирует гемостаз. В одном из вариантов осуществления агент,который стимулирует иммунотолерантность, но не действует путем ингибирования костимулирующего сигнала в Т-клетке, может быть добавлен в данные композиции или введен в данные способы. Например, в композицию может быть включен лиганд против CD40 (например, моноклональное антитело против человеческого ли 005236Natl. Acad. Sci. USA, 94:8789, (1997. CD40 и его Т-клеточный лиганд CD40L (CD154) играют важную роль в положительной регуляции (стимуляции) В 7 и стабилизации активности Вклеток (см. патент США 5683693; статьи Yang и соавт., Science, 273:1862, (1996); Grewal и соавт., Science, 273:1864, (1996); Leterman и соавт.,J. Exp. Med., 175:1091, (1992); Lederman и соавт., J. Immunol., 149:3817, (1992. Было обнаружено, что антитела против лиганда CD40 обладают синергетическим действием с агентами,которые ингибируют костимулирующий сигнал в Т-клетке, способствуя развитию толерантности в отношении трансплантата (см. статьи Kirk и соавт., Proc. Natl. Acad. Sci. USA, 94:8789,(1997); Larsen и соавт., Nature, 381:434, (1996. В другом варианте осуществления в данных композициях может быть использован агент,который действует внутриклеточно, стимулируя иммунотолерантность, но не ингибирует костимулирующий сигнал в Т-клетке. Например, в одном из вариантов осуществления циклоспорин A (CSA), FK506, рапамицин или другой агент, который ингибирует иммунные ответы,может быть включен в данные композиции или введен как часть данных способов. (См., например, Sigal и соавт., Annv. Rev. Immunol., 10:519,(1992); Ruhlmann и соавт., Immunobiology,198:192, (1997) или Shaw и соавт., Clin. Chem.,42:1316, (1996.VIII. Способы применения композиций,которые содержат терапевтический белок и иммунотолеризирующий агент. В одном из вариантов осуществления данные композиции и/или агенты, описанные в данном контексте, вводят субъектам, у которых имеются нарушения гемостаза и которых ранее лечили агентом, стимулирующим гемостаз. В другом варианте осуществления данные композиции и/или агенты, описанные в данном контексте, вводят субъектам, которых еще не лечили агентом, который стимулирует гемостаз. В еще одном варианте осуществления данные композиции и/или агенты, описанные в данном контексте, вводят субъектам, у которых еще не развился иммунный ответ на агент, который стимулирует гемостаз. Имеет ли субъект"предварительно существующий иммунный ответ", можно установить измерением у субъекта титра антител, которые реагируют с агентом,который стимулирует гемостаз, используя методы, хорошо известные в уровне техники. Если у данного субъекта имеется измеряемый титр таких антител (например, статистически значимый титр) сравнительно с титрами контрольных субъектов, то можно сказать, что у субъекта имеется предварительно существующий иммунный ответ на агент, который стимулирует гемостаз. Альтернативно клеточный иммунный ответ на агент, который стимулирует гемостаз,можно измерить с целью определения, имеется 39 ли у субъекта развивающийся иммунный ответ в отношении агента, который стимулирует гемостаз. Данные способы хорошо известны в уровне техники. В одном из вариантов осуществления первый агент, который стимулирует гемостаз, и второй агент, который ингибирует или блокирует костимулирующий сигнал в Т-клетке, используют для лечения нарушений гемостаза. В другом варианте осуществления для лечения нарушения гемостаза могут быть использованы композиции, содержащие комбинацию первого агента, который стимулирует гемостаз, и второго агента, который ингибирует костимулирующий сигнал в Т-клетке. Введение композиций и/или агентов, описанных в данном контексте, может осуществляться в любой фармакологической форме, которая включает терапевтически активное количество агента и фармацевтически приемлемый носитель. Введение терапевтически активного количества данных агентов и/или композиций определяют, как количество, эффективное в дозировках и в периоды времени, которые необходимы для лечения нарушения гемостаза в случае применения агента, который стимулирует гемостаз, и достижения иммунотолерантности в отношении агента, который стимулирует гемостаз, в случае применения агента, который ингибирует костимулирующий сигнал в Т-клетке. Терапевтически активное количество агента или композиции может изменяться в соответствии с такими факторами, как состояние заболевания,возраст, пол и масса тела субъекта, а также от того, развился ли уже у субъекта иммунный ответ в отношении агента, который стимулирует гемостаз. Данное количество может быть легко установлено обычным специалистом в данной области. Оптимальная схема введения агентов и/или композиций может также изменяться в зависимости от субъекта, который проходит лечение. В некоторых вариантах осуществления субъекту может требоваться лечение обоими агентами в одно и то же время. В таком случае будет желательным одновременное введение агента, который стимулирует гемостаз, и агента,который ингибирует костимулирующий сигнал Т-клетки, например, в форме композиции, содержащей оба агента. В других вариантах осуществления будет желательным раздельное введение агентов, например, с целью обеспечения стабильности агентов или облегчения поэтапного введения агентов. В одном из вариантов осуществления поэтапное введение может быть желательным для достижения оптимального терапевтического эффекта агента, который стимулирует гемостаз,при оптимальном ингибировании иммунного ответа, предпочтительно иммунного ответа в отношении агента. Например, агент, который ингибирует костимулирующий сигнал, может 40 быть введен в виде монотерапии перед введением агента, который стимулирует гемостаз, или может быть введен в виде монотерапии через несколько дней после введения агента, который стимулирует гемостаз. В одном из вариантов осуществления агент, который блокирует костимулирующий сигнал в Т-клетке, может вводиться постоянно,например, каждый раз, когда вводят агент, который стимулирует гемостаз. В другом варианте осуществления агент, который блокирует костимулирующий сигнал в Т-клетке, вводят нерегулярно. Например, субъекту может требоваться регулярное лечение агентом, который стимулирует гемостаз, но может требоваться только периодическое лечение агентом, который ингибирует костимулирующий сигнал в Т-клетке. Например, лечение агентом, который стимулирует гемостаз, может быть постоянным, тогда как всего лишь одно или два введения агента, который блокирует костимулирующий сигнал в Тклетке, может быть достаточным для субъекта; дальнейшее введение агента, который блокирует костимулирующий сигнал в Т-клетке, может не требоваться. В предпочтительном варианте осуществления агент, который блокирует костимулирующий сигнал в Т-клетке, вводят с соответствующими интервалами в течение по меньшей мере приблизительно 6 месяцев. В одном из вариантов осуществления данные агенты или композиции вводят пациентам,если обнаружено, что у пациентов имеются предварительно существующие антитела. В другом варианте осуществления данные агенты или композиции вводят пациентам, которых ранее не лечили, т.е. не имеющим предварительно существующих антител. В еще одном варианте осуществления данные агенты или композиции вводят пациентам, которых ранее лечили, но у которых отсутствуют титры антител против агента, который стимулирует гемостаз. Схема дозировки может быть подобрана для каждого пациента для получения оптимального терапевтического ответа без проведения излишних экспериментов. Например, титры антител против агента, который стимулирует гемостаз, можно измерить с целью определения,развивается или не развивается у субъекта иммунный ответ на агент, и соответственно подобрать схему дозировки. Например, если титры антител в отношении агента, который стимулирует гемостаз, возрастают, можно ввести более высокие дозы агента, который блокирует костимулирующий сигнал в Т-клетке. Для введения данных агентов или композиций отличным от парентерального способом может быть необходимо покрытие их материалом, препятствующим инактивации, или совместное введение с данным материалом. Агент или композиция, соответствующие данному изобретению, могут вводиться субъекту в под 41 ходящем носителе или разбавителе, вводиться совместно с ингибиторами ферментов или в соответствующем носителе, таком как липосомы. Фармацевтически приемлемые разбавители включают физиологический раствор и водные буферные растворы. Ингибиторы ферментов включают ингибитор трипсина поджелудочной железы, диизопропилфторфосфат (DEP) и трасилол. Липосомы включают эмульсии типа вода-масло-вода, а также традиционные липосомы(Strejan и соавт., J. Neuroimmunol. 7:27, (1984. Активный агент или композиция могут быть также введены парентерально или внутрибрюшинно. Дисперсии могут быть также приготовлены в глицерине, жидких полиэтиленгликолях и их смесях и в маслах. При обычных условиях хранения и применения данные препараты могут содержать консервант для предотвращения роста микроорганизмов. Фармацевтические композиции, пригодные для инъекционного применения, включают стерильные водные растворы (в случае растворимости в воде) или дисперсии и стерильные порошки для приготовления непосредственно перед использованием стерильных инъекционных растворов или дисперсий. Во всех случаях агент или композиция должны быть стерильными и должны быть текучими до той степени,которая обеспечивает введение с помощью шприца. Они должны быть стабильными в условиях приготовления и хранения и должны быть защищены от загрязняющего действия микроорганизмов, таких как бактерии и грибы. Носитель может быть представлен растворителем или дисперсной средой, содержащей, например, воду, этанол, многоатомный спирт (например, глицерин, пропиленгликоль и жидкий полиэтиленгликоль и т.п.) и их подходящие смеси. Надлежащая текучесть может обеспечиваться, например, путем использовании покрытия, такого как лецитин, поддержания требующегося размера частиц в случае дисперсии и применения поверхностно-активных веществ. Предупреждение активности микроорганизмов может достигаться с помощью различных антибактериальных и антигрибных агентов, например, парабенов, хлорбутанола, фенола, аскорбиновой кислоты, тимеросала и т.п. Во многих случаях будет предпочтительным включение в композицию изотонических агентов, например,сахаров, многоатомных спиртов, таких как маннит и сорбит, хлорида натрия. Пролонгированное всасывание инъекционных композиций может быть получено за счет включения в композицию агента, который задерживает всасывание,например, моностеарата алюминия и желатина. Стерильные инъекционные растворы можно приготовить путем введения активной композиции или агента в требующемся количестве в подходящий раствор вместе с одним из вышеперечисленных ингредиентов или их комбинацией с последующей стерилизацией путем 42 фильтрования. В основном дисперсии готовят посредством введения активного соединения в стерильный носитель, который содержит основную дисперсную среду и другие необходимые ингредиенты из вышеперечисленных. В случае стерильных порошков для получения стерильных инъекционных растворов предпочтительными способами их приготовления являются вакуумная сушка и лиофилизация, при которых получают порошок активного ингредиента из предварительно простерилизованного фильтрованием раствора ингредиента. Когда активный агент или композиция защищены надлежащим образом, как описано выше, белок может быть введен перорально,например, с инертным разбавителем или ассимилируемым съедобным носителем. Как используют в данном контексте, выражение "фармацевтически приемлемый носитель" включает любой и все растворители, дисперсные среды,покрытия, антибактериальные и антигрибные агенты, изотонические и задерживающие всасывание агенты и т.п. Применение данных сред и агентов для фармацевтически активных субстанций хорошо известно в области техники. За исключением случаев несовместимости какихлибо известных сред или агента с активным соединением, предполагается применение любых из них в терапевтических композициях. В композиции могут быть также введены дополнительные активные соединения. Особенно перспективным является приготовление парентеральных композиций в виде унифицированной лекарственной формы для простоты введения и унификации дозировки. Термин "унифицированная лекарственная форма", как используют в данном контексте, относится к физически отдельным единицам, служащим одноразовыми дозами для млекопитающих субъектов, которые проходят лечение; при этом каждая единица содержит предварительно обусловленное количество активного соединения, рассчитанное таким образом, чтобы получить желательный терапевтический эффект, в сочетании с необходимым фармацевтическим носителем. Описание унифицированных лекарственных форм, соответствующих изобретению,диктуется и непосредственно зависит от (а) уникальных характеристик активного соединения и определенного терапевтического эффекта,который предполагают достигнуть, и (b) ограничений, свойственных для области приготовления данного активного агента и композиции для лечения субъектов. Какиспользуют в данном контексте, термин "фармацевтически приемлемый носитель" включает любой и все растворители, дисперсные среды, покрытия, антибактериальные и антигрибные агенты, изотонические и задерживающие всасывание агенты и т.п. Применение данных сред и агентов для фармацевтически активных субстанций хорошо известно в облас 43 ти техники. В композиции могут быть также введены дополнительные активные соединения. При практической реализации данного изобретения будут использованы, пока не указано иначе, традиционные технологии биологии клетки, культивирования клеток, молекулярной биологии, микробиологии, рекомбинантной ДНК и иммунологии, входящие в сферу компетенции данной области техники. Данные технологии полностью объясняются в литературе. См., например, монографии "Лабораторное руководство по генетике и молекулярному клонированию" (Genetics; Molecular Cloning A Laboratory Manual), под ред. Sambrook J. и соавт., 2-е изд. (Cold Spring Harbor Laboratory Press (1989;"Краткое описание методик молекулярной биологии" ("Short Protocols in Molecular Biology"),под ред. Ausubel F. и соавт., 3-е изд. (Wiley, NYWeir и С.С. Blackwell, (1986) и Miller J. "Эксперименты в молекулярной генетике" ("Experiments in Molecular Genetics"), (Cold Spring Harbor Press, Cold Spring Harbor, N.Y. (1972. Содержание всех ссылок, находящихся на рассмотрении патентных заявок и опубликованных патентов, приведенных в данной заявке,специально введено таким образом в виде ссылки. Изобретение далее иллюстрируется следующими примерами, которые не должны быть истолкованы, как дальнейшее ограничение. Примеры В примерах используют модель гемофилии А на мышах для оценки новых способов профилактики и лечения образования ингибитора. У мышей с гемофилией А, полученных путем направленного разрушения экзона 16 гена фактораVIII, отсутствует определяемая активность фактора VIII в плазме (см. статью Bi L, Nature Genetics, 10:119 (1995, и в этом плане они близки пациентам с тяжелой формой гемофилии А. В соответствии с ожиданиями, у мышей с гемофилией А имеются in vivo признаки дефекта пути коагуляции, проявляющиеся в летальном кровотечении при отрезании хвоста без применения гемостатических средств и в развитии у них подкожного и внутримышечного кровотечения 44 после того, как их держат в руках или временно иммобилизуют (см. статьи Qian J., Borovok M.,Bi L, Kazazian H.H., Hoyer L.ThrombHaemost.,81:940 (1999); Evans G.L и соавт., Ргос. Natl.Acad. Sci. USA, 95:5734 (1998. Внутривенные вливания 0,2 мкг человеческого фактора VIII, дозы, эквивалентной относительно массы тела дозе, вводимой пациентам с гемофилией А, приводят к минимальному ответу антител у данных мышей с гемофилией А после однократной инъекции или ответ отсутствует, но повторные вливания приводят к появлению высокого титра ингибирующей молекулы против фактора VIII (см. статью Qian J. и соавт.,Thromb. Haemost., 81:940 (1999. Кроме того,специфический в отношении фактора VIII пролиферативный ответ Т-клеток обнаруживают через три дня после первого введения человеческого фактора VIII до детекции антител. Пример 1. Ингибирование первичного иммунного ответа в отношении фактора VIII. Схема эксперимента для данного примера представлена на фиг. 1. Трем группам мышей внутривенно вводят фактор VIII в день 0. Одной группе мышей вводят также CTLA4-Ig за один день до и через одни день после введения фактора VIII. Второй группе мышей проводят введение такого же CTLA4-Ig (внутрибрюшинно) с последующими ежедневными инъекциями фактора VIII с 2-го дня по 12-й день. Третьей группе не вводят CTLA4-Ig ни в каком виде. Все мыши получают две дополнительные инъекции фактора VIII на 23-й и 24-й день. У животных берут кровь в день 20, 37, 58 и 82. В то время как у мышей, которые не получают CTLA4-Ig,имеются высокие титры антител, начиная с такого раннего срока, как 20-й день, у мышей,которые получают CTLA4-Ig, антитела не появляются до 82-го дня (см. фиг. 2). Пример 2. Ингибирование вторичного ответа на фактор VIII. Схема эксперимента для данного примера представлена на фиг. 3. В данном примере мышам делают множество внутривенных инъекций фактора VIII с интервалами две недели, а затем делят на две группы. Мышам делают повторную инъекцию фактора VIII в день 1, 20 и 37. Одной группе мышей вводят CTLA4-Ig в день -1 и день+1 относительно инъекций фактора VIII в день 1, 20 и 37. У животных, которые не получаютCTLA4-Ig, имеется высокий титр антител против фактора VIII, тогда как у мышей, которые получают CTLA4-Ig (за исключением 1 мыши) не развивается вторичный иммунный ответ на фактор VIII (см. фиг. 4). В примерах 3-6 используют следующие способы и материалы. Животные. Характеристики экзона 16 (Е 16) линии мышей с гемофилией представлены в статьях Bi L. и соавт., Nature Genetics, 10:119(1995); Bi L. и соавт., Blood, 88:3446 (1996). В данных исследованиях используют взрослых 45 самцов и гомозиготных по Е-16 самок мышей в возрасте 10-20 недель. Образцы крови получают при кровотечении из глазничного венозного сплетения и отделяют сыворотку центрифугированием при 600 g в течение 3 мин. Образцы сыворотки хранят при -20 С до проведения анализа. Чтобы избежать сильного кровотечения и гибели животных, ушные метки не используют для идентификации мышей в ряде экспериментов. По этой причине на фиг. 5 не указывают последовательные данные для отдельных мышей. Поколение дважды "нокаутированных"(имеющих два выбитых (инактивированных) гена) мышей Е-16/В 7-1 и В 7-2 осуществляют перекрестным скрещиванием линии Е-16 с мышами, нокаутированными по В 7-1 и В 7-2 (см. статью Borriello F. и соавт Immunity, 6:303(1997. Гомозиготных мышей с двойным нокаутом Е-16/В 7-1 и Е-16/В 7-2 идентифицируют по определению генотипа (см. статьи Bi L. и соавт., Nature Genetics, 10:119 (1995); BorrielloF. и соавт., Immunity, 6:303 (1997. Пониженную активность фактора VIII проверяют с использованием хромогенного биоанализа CoatestL. и соавт., Blood, 88:3446 (1996. Активность фактора VIII составляет меньше 1% у мышей с дефицитом как Е-16/В 7-1, так и Е-16/В 7-2. Антигены. Рекомбинантный человеческий фактор VIII получают от компании Hyland Division of Baxter Healthcare Corp. (Glendale, CA).mCTLA-4Ig. Плазмиду для экспрессии кДНК мышиного CTLA4-Ig готовят путем лигирования лидерного и экстрацеллюларного доменов мышиного CTLA4 с шарнирным, СН 2 и СН 3 доменами IgHg2a, в которые вводят мутацию для удаления эффекторных функций, как описано Streurer и соавт. (см. статью Streurer, J.Immunol, 155:1165 (1995. Инсерцию клонируют в экспрессионный вектор pED и стабильно трансфицируют им клетки СНО, как описано ранее (см. статью Lollar Р. и соавт., J. Clin. Invest. 93:2497 (1994. Концентрированную кондиционированную среду вносят в хроматографическую колонку rProtein A Sepharose FastFlow (Amersham Pharmacia Biotech, Piscataway,NJ). Колонку промывают PBS (забуференным фосфатом физиологическим раствором) с рН 7,1 и элюируют mCTLA4-Ig 20 мМ цитратом с рН 3,0. Объединенные пики нейтрализуют 1 М раствором Трис при рН 8,0 до конечного рН 7,5 и получают препарат в PBS рН 7,1, используя камеру для перемешивания Amicon с мембранойPoros PI (Perceptive Biosystems) и элюируют продукт с колонки линейным градиентом NaCl от 0 до 1 М NaCl в 25 мМ Трис с рН 7,5. ЗатемmCTLA4-Ig готовят в PBS рН 7,1, используя камеру для перемешивания Amicon с мембраной 46 Измерения антител. Титр антител против фактора VIII определяют с помощью ELISA(см. статью Qian J. и соавт. "Появление ингибирующих антител и клеточный ответ на человеческий фактор VIII при гемофилии А у мышей"ELISA осуществляют с использованием лунок для микротитрования, покрытых рекомбинантным человеческим фактором VIII в концентрации 0,8 мкг/мл в 0,05 мол/мл карбонатабикарбоната, рН 9. После инкубирования образцов плазмы в лунках при 4 С в течение ночи с последующим промыванием, добавляют конъюгированный с щелочной фосфатазой козий IgG против мыши (Southern Biotechnology AssociatesInc., Birmingham. AL) в течение 2 ч при комнатной температуре. Затем после промывания добавляют р-нитрофенилфосфат (Sigma, St. Louis,МО) в концентрации 2 мг/мл в 100 ммоль/л глицина, 1 ммоль/л MgCl2, 2 ммоль/л ZnCl2, рН 10,4 и измеряют поглощение при 410 нм, используя автоматизированный ридер для ELISA на платах для микротитрования. Концентрацию антител против фактора VIII определяют по стандартной кривой, полученной с помощью моноклонального мышиного антитела IgG против человеческого фактора VIII, которое связывает домен А 2 (Mab 413) (см. статью Lollar P. и соавт., J. Clin. Invest., 93:9497 (1994. Титр вычисляют по точкам, которые находятся на линейном участке стандартной кривой для анализа. Титры ингибитора антител против фактораVIII в единицах Bethesda (BU) измеряют с помощью анализа Bethesda (см. статью Kasper С.К., Thromb. et Diath. Haem., 30:263 (1973. Анализы пролиферации Т-клеток. В качестве источника Т-клеток для анализов пролиферации используют селезенку. Затем клетки селезенки культивируют (5105/лунку) в 96 луночных планшетах с плоским дном. Рекомбинантный фактор VIII добавляют в различных количествах в среду для культивирования, которая содержит полную среду RPMI-1640, содержащую 0,5% сыворотки мышей с гемофилией. Через 72 ч культивирования при 37 С добавляют 37 kBp 3H-тимидина/лунку (6,7 Ки/ммоль,ICN Pharmaceuticals Irvine, CA). Культуры собирают через 16 ч, используя Matrix 9600 (Packard,Meriden, CT). Результаты выражают, как среднее по трем повторностям лунки число импульсов в минуту (срm), инкорпорированное в нерастворимую ДНК. Пример 3. mCTLA4-Iq блокирует индукцию ответа против фактора VIII. Ингибирующие антитела против фактораVIII индуцируют у контрольных мышей путем повторных внутривенных инъекций 1 мкг рекомбинантного человеческого фактора VIII с интервалами три недели. В данном примере че 47 тырем группам мышей с гемофилией А инъецируют рекомбинантный человеческий фактор в день 0, 23, 44 и 66 (исходно 1 мкг внутривенно,а затем по 0,2 мкг в 2-й, 3-й и 4-й инъекциях). Мышам в группах G-3 и G-4 также вводят внутрибрюшинно 0,2 мкг фактора VIII на 2-12 дни. Образцы крови для анализа анитител против фактора VIII получают на 20, 37, 58 и 82 день. Животным контрольных групп G-1 и G-3 (белые круги) инъецируют только фактор VIII. Животным групп G-2 и G-4, черные круги, инъецируют также mCTLA4-Ig (250 мкг, внутрибрюшинно) в день перед и день после первого введения фактора VIII. Концентрацию антитела против фактора VIII определяют с помощью ELISA. Точки, полученные при анализе антител против фактора VIII, указанные как 0,16 мкг/мл, являются близкими точкам, полученным для образцов плазмы, выделенных у неиммунизированных мышей с гемофилией А. Результаты данного эксперимента представлены на фиг. 5(заметим, что на фиг. 5 повторяются некоторые данные, представленные на фиг. 2, но введены дополнительные данные). Антитело против фактора VIII определяют у четырех из пяти мышей через 20 дней после первой инъекции, а у всех контрольных мышей появляется высокий титр антител против фактора VIII после двух-четырех инъекций. Средний уровень ингибитора через четыре инъекции составляет 1860 единиц Bethesda (BU). Образование антител против фактора VIII в значительной степени супрессируется у мышей, которым внутрибрюшинно вводят 250 мкг мышиногоCTLA4-Ig в день перед и день после первой инъекции фактора VIII (группа G-2, фиг. 5) даже при отсутствии дальнейших введений mCTLA4Ig вместе с тремя последовательными инъекциями фактора VIII в дни 23, 44 и 66. Антитела против фактора VIII не определяются ни у одной из мышей группы G-2 после первой или второй инъекции фактора VIII. Через три недели после третьей инъекции фактора VIII определяют слабый иммунный ответ у двух из трех мышей в группе G-2. Для исследования, является ли ограниченная продолжительность иммунологической толерантности результатом короткого периода полусуществования человеческого фактора VIII в организмах данных мышей (4-5 ч при гемофилии А у мышей (см. статью Evans G.L и соавт.,Рrос. Natl. Acad. Sci. USA, 95:5734, (1998, контрольным и леченым mCTLA4-Ig мышам (группы G-3 и G-4, фиг. 5) внутривенно вводят 1 мкг фактора VIII в день 0 с последующими ежедневными внутрибрюшинными инъекциями 1 мкг фактора VIII в дни 2-12. Высокий титр антител против фактора VIII отмечают у контрольных мышей (группа G-3) в день 20 - более 350 мкг/мл по данным ELISA при среднем титре ингибитора 694 BU. Напротив, у мышей группы 48 перед и в день после первого воздействия фактора VIII, отсутствует определяемая активность против фактора VIII в день 20. Задержанный ответ антител против фактора VIII после трех дополнительных инъекций фактора VIII является у данных мышей таким же, как ответ у животных группы G-2. Таким образом, ограниченная персистенция фактора VIII в плазме после инъекции CTLA4-Ig не является причиной ограниченной продолжительности иммунологической толерантности у леченных CTLA4-Ig мышей. Пример 4. Эффекты повторного введенияCTLA4-Ig. Поскольку задержанный ответ антител против фактора VIII обнаруживают после повторных вливаний фактора VIII, когда mCTLA4Ig вводят только во время первого воздействия фактора VIII, установлено, что mCTLA4-Ig может препятствовать появлению антител против фактора VIII при введении с каждым вливанием фактора VIII. В данном эксперименте (фиг. 6) мышам с гемофилией А одновременно вливают как фактор VIII, так и mCTLA4-Ig шесть раз с интервалами три недели. Мышам с гемофилией А внутривенно вводят как 1 мкг фактора VIII,так и 250 мкг mCTLA4-Ig с интервалами 3 недели (черные круги) или фактор VIII в виде монотерапии после первой инъекции, которая содержит как фактор VIII, так и mCTLA4-Ig (белые круги). Образцы сыворотки для анализа антител против фактора VIII получают через 4 недели после 6-й инъекции фактора VIII. Определяемые антитела против фактора VIII не обнаруживают ни у одной из десяти мышей, которых лечат указанным образом, при их тестировании через четыре недели после шестой инъекции фактораVIII. Напротив, высокий титр антител против фактора VIII присутствует в сыворотке мышей,которым делают только одну инъекциюrrCTLA4-Ig (во время первого воздействия фактора VIII) с последующими пятью инъекциями фактора VIII в виде монотерапии. Данных леченных mCTLA4-Ig мышей затем тестируют, чтобы установить, имеется ли у них иммунный ответ после дополнительных инъекций фактора VIII в отсутствие mCTLA4Ig. После двух внутривенных инъекций с интервалами три недели ни у одной из пяти мышей не вырабатываются антитела против фактора VIII,тогда как у двух из четырех контрольных мышей, которых ранее не подвергали воздействию ни фактора VIII, ни mCTLA4-Ig, обнаружен низкий уровень антител против фактора VIII(фиг. 7). В данном эксперименте мышам с гемофилией А, леченным, как описано для фиг. 6,с помощью шести инъекций как фактора VIII,так и mCTLA4-Ig, затем делают шесть внутривенных инъекций 0,2 мкг фактора VIII с трехнедельными интервалами без дополнительного введения mCTLA4-Ig (черные круги). Контрольных мышей, не подвергавшихся предвари 49 тельному воздействию фактора VIII, иммунизируют параллельно (белые круги). Образцы сыворотки для анализа антител против фактораVIII получают через 3 недели после 2-й и 6-й инъекций. После шести инъекций фактора VIII в виде монотерапии средний титр фактора VIII составляет 93 мкг/мл для мышей, которые предварительно получали как фактор VIII, так иmCTLA4-Ig, тогда как для контрольных мышей средний титр составляет 155 мкг/мл. Данные результаты документально подтверждают ограничения антиген-специфической иммуносупрессии, которая обусловлена повторным совместным введением mCTLA4-Ig с факторомVIII. Пример 5. mCTLA4-Ig супрессирует вторичный иммунный ответ в отношении фактораmCTLA4-Ig вторичный иммунный ответ в отношении фактора VIII, mCTLA4-Ig инъецируют в то же самое время, когда фактор VIII вводят мышам с гемофилией А, у которых уже появились антитела против фактора VIII. Мышам делают инъекции три раза по 0,2 мкг фактора VIII и определяют уровень антител против фактораVIII с помощью ELISA. Контрольным мышам затем делают три дополнительные инъекции фактора VIII, тогда как оставшимся мышам вводят mCTLA4-Ig в то же самое время, когда им делают первую и третью дополнительные инъекции фактора VIII. Хотя многие мыши погибают вследствие осложнений, связанных с кровотечением, во время эксперимента из-за повторных инъекций и отбора образцов крови,результаты в двух группах ясно различаются. В данном примере всем мышам исходно делают 3 внутривенных инъекции по 0,2 мкг фактора VIII с интервалами 2 недели. Затем контрольным мышам (белые круги) делают инъекции фактора VIII еще три раза и получают образцы крови для анализа (верхняя панель). Другим мышам (черные круги) вводятmCTLA4-Ig (250 мкг, внутрибрюшинно) за день до и через день после 4-й инъекции фактора VIII(как указано стрелкой) с последующими двумя введениями фактора VIII в виде монотерапии с интервалами 3 недели. Число инъекций фактораVIII перед тестированием образцов крови на антитела против фактора VIII указано по горизонтальной оси. Повышение титра антител против фактораVIII отмечают после 4-й инъекции фактора VIII для контрольных мышей при среднем значении титра от 16 до 230 мкг/мл (см. фиг. 8 А). После 5-й инъекции фактора VIII все титры антител против фактора VIII составляют более 350 мкг/мл у четырех оставшихся контрольных мышей. Напротив, у мышей, леченных mCTLA4-Ig,при 4-й инъекции фактора VIII имеется минимальное количество или не имеется антител против фактора VIII (см. фиг. 8 В и С). ВведениеmCTLA4-lg ингибирует данный вторичный иммунный ответ в отношении фактора VIII у мышей, у которых уже появились относительно высокие уровни антител против фактора VIII,соответствующие ингибирующим титрам 5-90BU (см. статью Qian J. и соавт., Thromb. Haemost., 81:940 (1999 (см. фиг. 8 С), а также у мышей с минимальным уровнем антитела против фактора VIII после трех исходных инъекций меньше, чем 5 BU (см. фиг. 8 В). Пример 6. Установление роли В 7-1 и В 7-2 в первичном иммунном ответе в отношении фактора VIII. Далее определяют роли костимулирующих лигандов В 7-1 и В 7-2 на антиген-презентирующих клетках, поскольку именно их взаимодействие с CD28, как предполагают, следует предотвратить в экспериментах с использованиемmCTLA4-Ig. Для выполнения задачи скрещивают мышей с гемофилией А с мышами В 7-1-/- и В 7-2-/- (см. статьи Borriello F. и соавт., Immunity,6:303 (1997); Freeman G.J. и соавт., Science,262:907 (1993 и селектируют мышей с дефицитом как по фактору VIII, так и либо по В 7-1,либо по В 7-2 на основе анализа генотипа. Затем мышам типа гемофилия A/B7-1-/- и гемофилия А/В 7-2-/- внутривенно вводят 0,2 мкг человеческого фактора VIII с интервалами две недели. Образцы сыворотки для анализа антител против фактора VIII получают через 12 дней после 2-й и 6-й инъекций фактора VIII. После четырех инъекций у всех девяти мышей типа гемофилия А/В 7-1-/- (белые круги) вырабатываются антитела против фактора VIII с титрами более 350 мкг/мл и среднем значении уровня ингибитора 712 BU (см. фиг. 9), значения близки результатам, полученным для нормальных в других отношениях мышей с гемофилией А, которым вводят фактор VIII (см. статью Qian J. и соавт.,Thromb Haemost, 81:940 (1999. Напротив, ни у одной из восьми мышей типа гемофилия А/В 72-/- (черные круги) нет определяемых антител против фактора VIII. Аналогичные результаты получают для мышей с гемофилией А, которых лечат антителами против В 7-1 и против В 7-2. Для оценки Т-клеточного ответа данных мышей с гемофилией А и дефицитом по В 7-1 и В 7-2 через три дня после пятой внутривенной инъекции фактора VIII получают клетки селезенки. Объединенные клетки селезенки 3 мышей используют для получения данных по пролиферации. Белые и черные квадраты на фиг. 10 означают клетки, полученные от нелеченых мышей типов гемофилия A/B7-1-/- и гемофилияA/B7-2-/- соответственно. Белыми кругами обозначают клетки мышей типа гемофилия А/В 7-1-/-,которым делают 5 внутривенных инъекций фактора VIII, а черными кругами обозначают мышей типа гемофилия A/B7-2-/-, которым делают 5 внутривенных инъекций фактора VIII. Концентрация фактора VIII в культурах указана по горизонтальной оси. Пролиферативная актив 51 ность Т-клеток, определенная по включению 3Hтимидина, показывает зависимый от дозы фактора VIII ответ у клеток, полученных от мышей типа A/B7-1-/- (см. фиг. 10). Напротив, не определяют никакого Т-клеточного ответа при любом уровне фактора VIII в клетках селезенки,полученных от мышей типа A/B7-2-/-. Таким образом, В 7-2 играет главную роль в поддержке иммунного ответа в отношении фактора VIII,введенного внутривенно, и при его отсутствии происходит предупреждение образования ответа в отношении фактора VIII. Эквивалентные решения. Компетентные в данной области специалисты определят или способны установить с помощью не более чем рутинных экспериментов множество эквивалентных решений, касающихся специфических композиций и способов, описанных в данном контексте. Предусматривается,что данные эквивалентные решения входят в объем изобретения и охватываются следующей формулой изобретения. Список последовательностей ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Композиция для лечения и/или предупреждения нарушений, приводящих к аномальному кровотечению, содержащая по меньшей мере один фактор прокоагуляции и по меньшей мере один агент, ингибирующий взаимодействие костимулирующей молекулы на поверхности антиген-презентирующей клетки и соответствующего ей рецептора на Т-клетке, приводящее к генерации иммунного ответа на указанный фактор. 2. Композиция по п.1, отличающаяся тем,что она дополнительно содержит фармацевтически приемлемый носитель. 3. Композиция по п.1, отличающаяся тем,что фактор прокоагуляции представляет собой фактор VIII. 4. Композиция по п.1, отличающаяся тем,что фактор прокоагуляции представляет собой вариант фактора VIII с делецией В-домена. 52 5. Композиция по п.1, отличающаяся тем,что фактор прокоагуляции представляет собой фактор IX. 6. Композиция по п.1, отличающаяся тем,что фактор прокоагуляции представляет собой фактор фон Виллебранда. 7. Композиция по п.1, отличающаяся тем,что ингибирующий агент представляет собой растворимую форму костимулирующей молекулы. 8. Композиция по п.7, отличающаяся тем,что ингибирующий агент представляет собой растворимую форму CTLA4. 9. Композиция по п.7, отличающаяся тем,что ингибирующий агент представляет собой растворимую форму В 7-1, или растворимую форму В 7-2, или их комбинацию. 10. Композиция по п.8, отличающаяся тем,что ингибирующий агент содержит CTLA4-Ig. 11. Композиция по п.9, отличающаяся тем,что ингибирующий агент содержит В 7-1Ig или В 7-2Ig. 12. Композиция по п.1, отличающаяся тем,что ингибирующий агент представляет собой антитело, связывающее костимулирующую молекулу. 13. Композиция по п.12, отличающаяся тем, что указанное антитело выбрано из группы,состоящей из антитела против В 7-1, антитела против В 7-2 и их комбинации. 14. Композиция по п.12, отличающаяся тем, что антитело не трансдуцирует костимулирующий сигнал в Т-клетку. 15. Способ лечения нарушений, приводящих к аномальному кровотечению у субъекта,путем введения субъекту композиции по любому из пп.1-14 с достижением терапевтического эффекта. 16. Способ по п.15, отличающийся тем, что у субъекта обнаруживается иммунный ответ в отношении факторов прокоагуляции. 17. Способ по п.15, отличающийся тем, что у субъекта не обнаруживается иммунный ответ в отношении факторов прокоагуляции. 18. Способ по п.15, отличающийся тем, что далее субъекту вводят композицию, содержащую дополнительный иммуносупрессивный агент. 19. Способ по п.15, отличающийся тем, что у субъекта имеется гемофилия А, или гемофилия В, или болезнь фон Виллебранда. 20. Способ лечения нарушений, приводящих к аномальному кровотечению у субъекта,отличающийся тем, что субъекту вводят по меньшей мере один фактор прокоагуляции и по меньшей мере один агент, ингибирующий взаимодействие костимулирующей молекулы на поверхности антиген-презентирующей клетки и соответствующего ей рецептора на Т-клетке,приводящее к генерации иммунного ответа на указанный фактор, с достижением терапевтического эффекта. 53 21. Способ по п.20, отличающийся тем, что фактор прокоагуляции представляет собой фактор VIII. 22. Способ по п.20, отличающийся тем, что фактор прокоагуляции представляет собой вариант фактора VIII с делецией В-домена. 23. Способ по п.20, отличающийся тем, что фактор прокоагуляции представляет собой фактор IX. 24. Способ по п.20, отличающийся тем, что фактор прокоагуляции представляет собой фактор фон Виллебранда. 25. Способ по п.20, отличающийся тем, что ингибирующий агент представляет собой растворимую форму костимулирующей молекулы. 26. Способ по п.25, отличающийся тем, что ингибирующий агент представляет собой растворимую форму CTLA4. 27. Способ по п.26, отличающийся тем, что ингибирующий агент представляет собой растворимую форму CTLA4-Ig. 28. Способ по п.25, отличающийся тем, что ингибирующий агент представляет собой рас 005236 54 творимую форму В 7-1, или растворимую форму В 7-2, или их комбинацию. 29. Способ по п.28, отличающийся тем, что ингибирующий агент представляет собой растворимую форму В 7-1Ig, или растворимую форму В 7-2Ig, или их комбинацию. 30. Способ по п.20, отличающийся тем, что ингибирующий агент содержит антитело, которое связывает костимулирующую молекулу. 31. Способ по п.30, отличающийся тем, что указанное антитело выбрано из группы, состоящей из антитела против В 7-1, антитела против В 7-2 и их комбинации. 32. Способ по п.30, отличающийся тем, что антитело не трансдуцирует костимулирующий сигнал в Т-клетку. 33. Способ по п.20, отличающийся тем, что у субъекта имеется гемофилия А, или гемофилия В, или болезнь фон Виллебранда. 34. Способ по п.20, отличающийся тем, что у субъекта обнаруживается значительный титр антител, связывающих факторы прокоагуляции.
МПК / Метки
МПК: A61K 38/37, A61K 39/395, A61P 7/04
Метки: лечения, варианты, аномальному, способ, таких, композиция, предупреждения, кровотечению, приводящих, нарушений
Код ссылки
<a href="https://eas.patents.su/29-5236-kompoziciya-dlya-lecheniya-i-ili-preduprezhdeniya-narushenijj-privodyashhih-k-anomalnomu-krovotecheniyu-i-sposob-lecheniya-takih-narushenijj-varianty.html" rel="bookmark" title="База патентов Евразийского Союза">Композиция для лечения и/или предупреждения нарушений, приводящих к аномальному кровотечению, и способ лечения таких нарушений (варианты)</a>
Предыдущий патент: Биологически активная добавка
Следующий патент: Способ гидролитического осаждения железа
Случайный патент: Способ выемки твердого полезного ископаемого