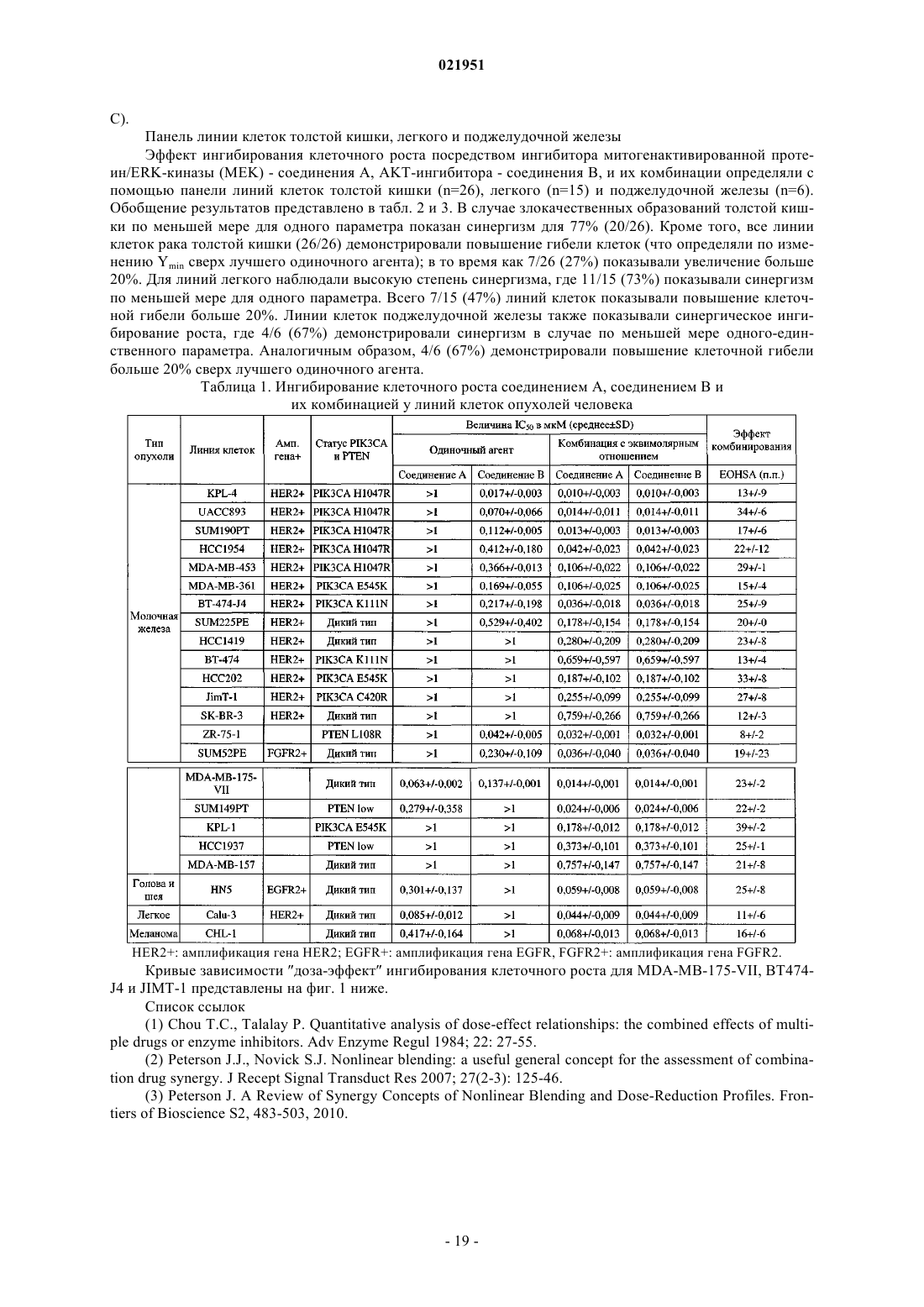
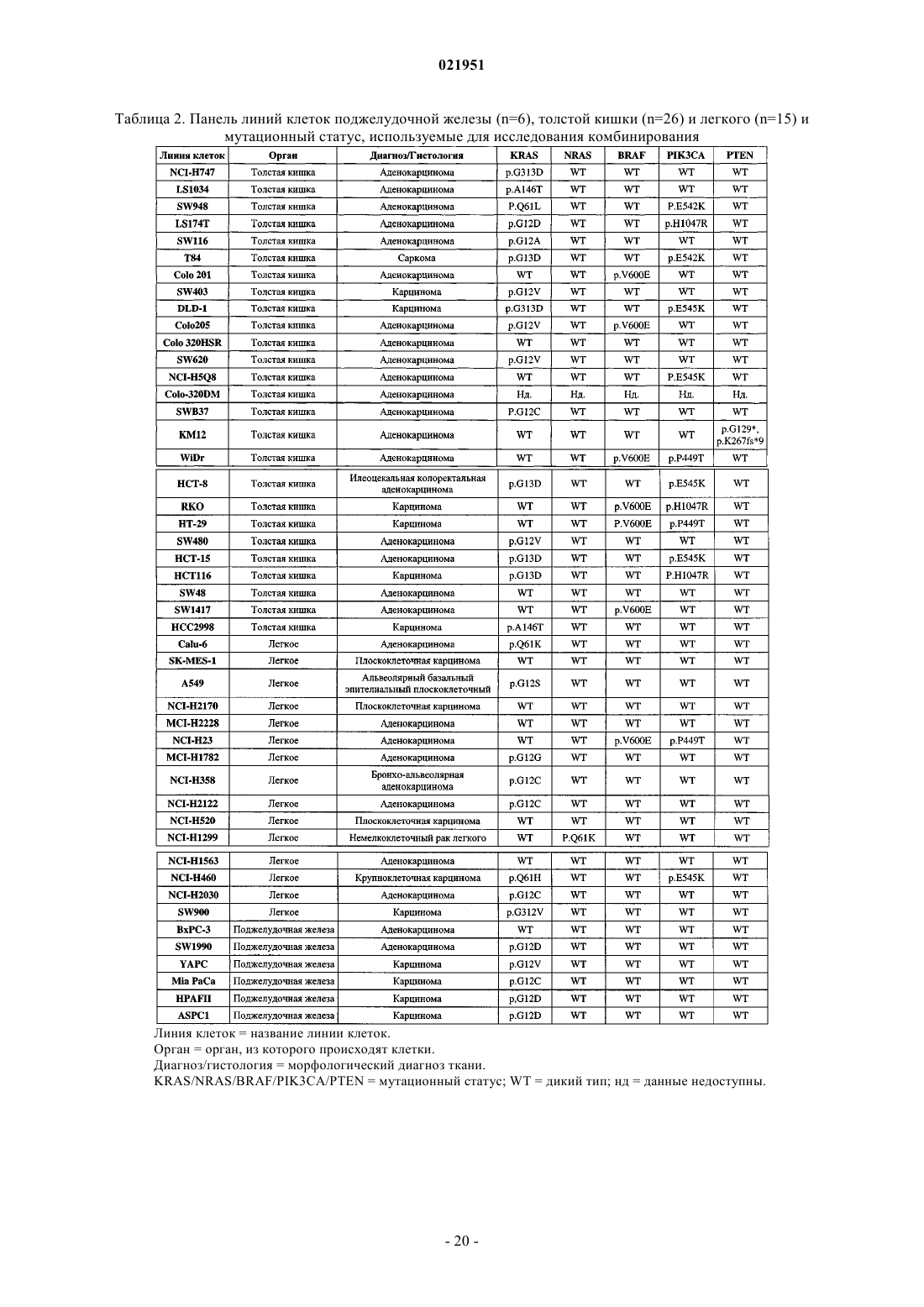
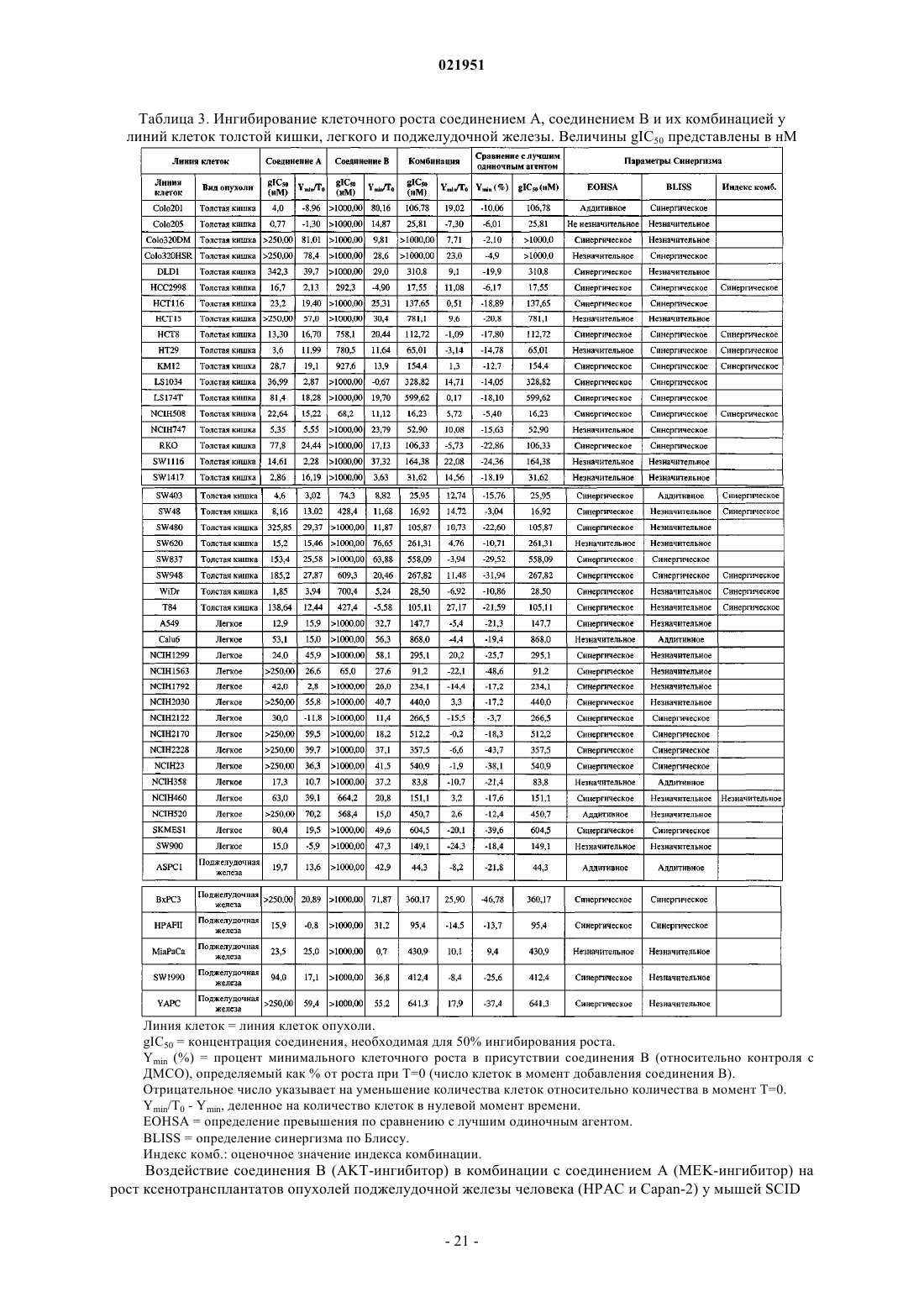
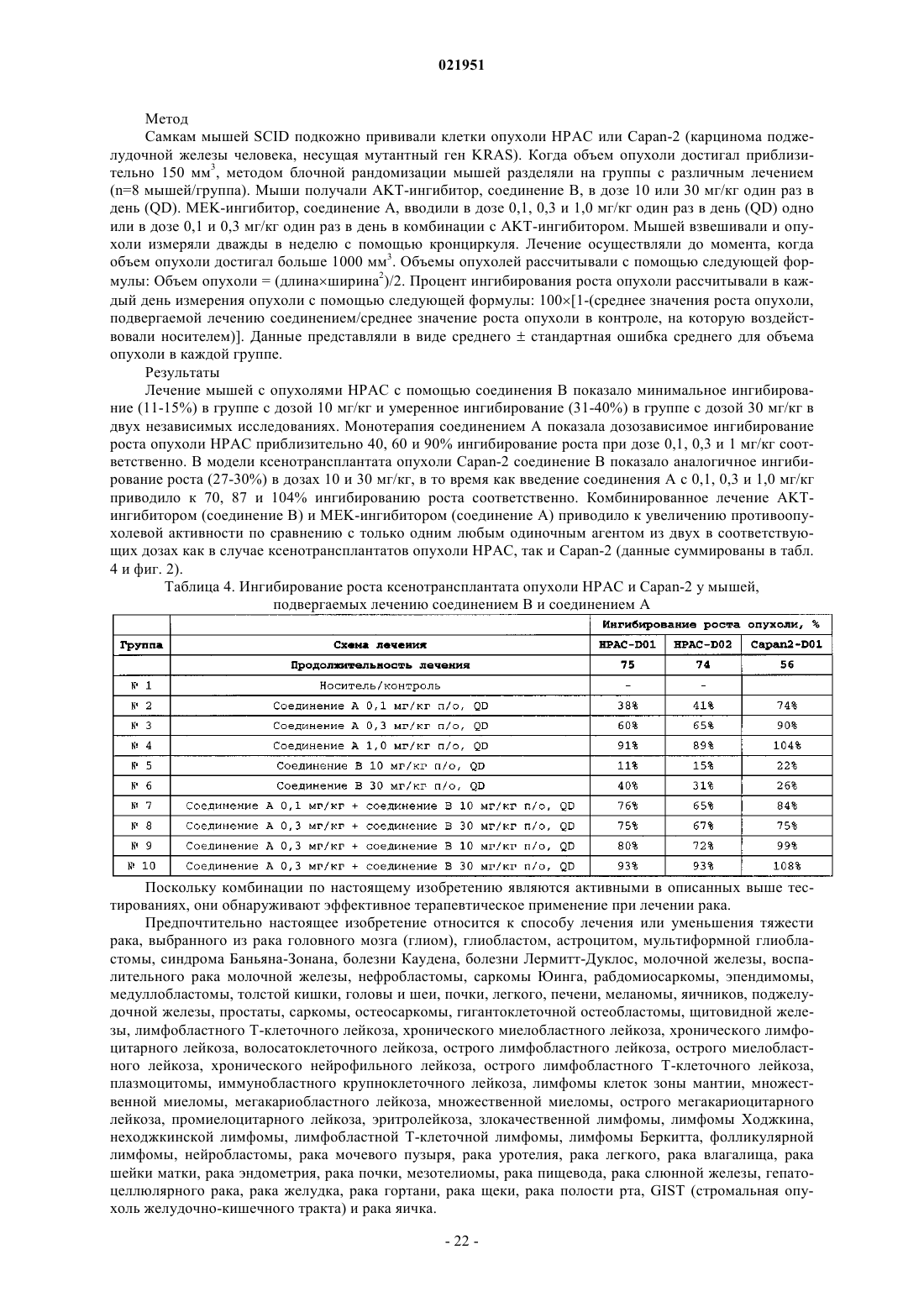
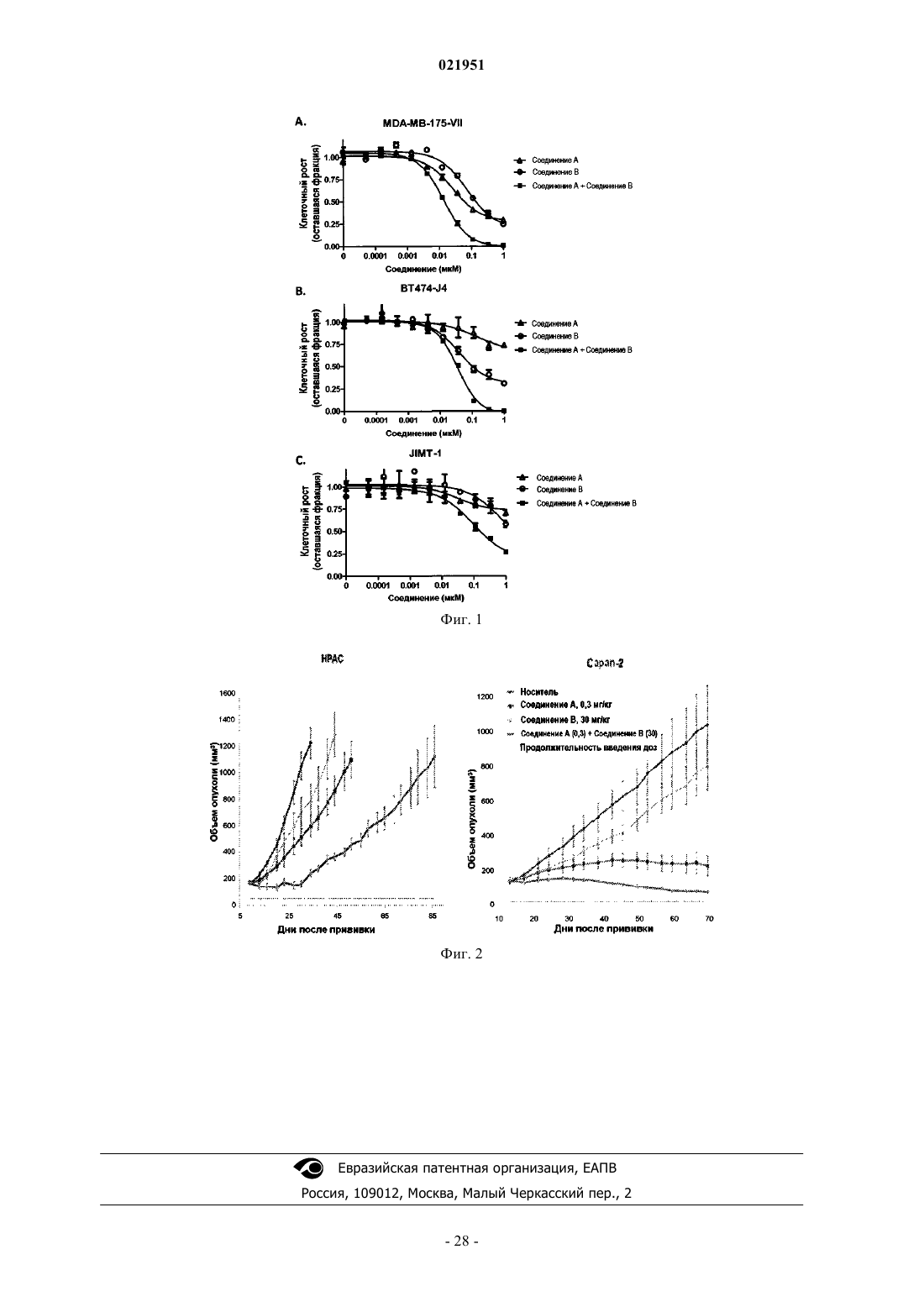
Противораковая комбинация
Номер патента: 21951
Опубликовано: 30.10.2015
Авторы: Кумар Ракеш, Лебовиц Питер Ф., Моррис Шэннон Рене, Лакерр Сильви, Джилмер Тона, Дамбл Мелисса
Формула / Реферат
1. Комбинация, включающая:
(i) соединение структуры (I)
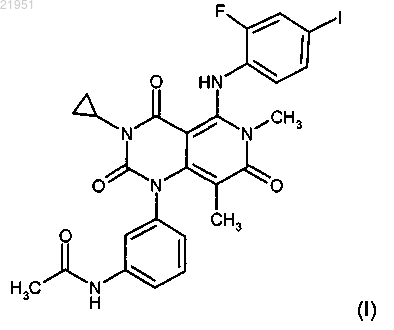
или его фармацевтически приемлемую соль, или сольват и
(ii) соединение структуры (II)
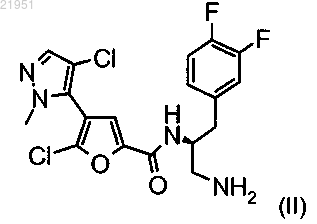
или его фармацевтически приемлемую соль.
2. Комбинация по п.1, где соединение структуры (I) находится в форме сольвата с диметилсульфоксидом.
3. Комбинированный набор, включающий комбинацию по п.1 или 2 вместе с фармацевтически приемлемым носителем или носителями.
4. Применение комбинации по п.1 или 2 или комбинированного набора по п.3 для получения лекарственного средства или лекарственных средств для лечения рака или предопухолевых состояний.
5. Применение комбинации или комбинированного набора по любому из пп.1-3 для лечения рака или предопухолевых состояний.
6. Способ лечения рака или предопухолевых состояний, включающий введение терапевтически эффективного количества комбинации по п.1 или комбинированного набора по п.3, где оба соединения комбинации или комбинированного набора вводят в интервале приблизительно 24 ч между ними и где комбинацию или комбинированный набор вводят в течение по меньшей мере одного дня.
7. Способ по п.6, где количество N-{3-[3-циклопропил-5-(2-фтор-4-йодфениламино)-6,8-диметил-2,4,7-триоксо-3,4,6,7-тетрагидро-2Н-пиридо[4,3-d]пиримидин-1-ил]фенил}ацетамид-диметилсульфоксида выбирают из количества от приблизительно 0,25 до приблизительно 9 мг, и это количество вводится один раз в день, и количество N-{(1S)-2-амино-1-[(3,4-дифторфенил)метил]этил}-5-хлор-4-(4-хлор-1-метил-1Н-пиразол-5-ил)-2-фуранкарбоксамида выбирают из количества от приблизительно 10 до приблизительно 300 мг, и это количество вводится один раз в день.
8. Способ по п.6, где N-{3-[3-циклопропил-5-(2-фтор-4-йодфениламино)-6,8-диметил-2,4,7-триоксо-3,4,6,7-тетрагидро-2Н-пиридо[4,3-d]пиримидин-1-ил]фенил}ацетамид-диметилсульфоксид и N-{(1S)-2-амино-1-[(3,4-дифторфенил)метил]этил}-5-хлор-4-(4-хлор-1-метил-1Н-пиразол-5-ил)-2-фуранкарбоксамид вводят с интервалом 12 ч между ними в течение от 1 до 3 последовательных дней с последующим введением N-{3-[3-циклопропил-5-(2-фтор-4-йодфениламино)-6,8-диметил-2,4,7-триоксо-3,4,6,7-тетрагидро-2Н-пиридо[4,3-d]пиримидин-1-ил]фенил}ацетамид-диметилсульфоксида в течение от 3 до 7 последовательных дней необязательно с последующими одним или более циклами повторного дозированного введения.
9. Способ по п.6, где N-{3-[3-циклопропил-5-(2-фтор-4-йодфениламино)-6,8-диметил-2,4,7-триоксо-3,4,6,7-тетрагидро-2Н-пиридо[4,3-d]пиримидин-1-ил]фенил}ацетамид-диметилсульфоксид и N-{(1S)-2-амино-1-[(3,4-дифторфенил)метил]этил}-5-хлор-4-(4-хлор-1-метил-1Н-пиразол-5-ил)-2-фуранкарбоксамид вводят с интервалом 12 ч между ними в течение 2 последовательных дней с последующим введением N-{3-[3-циклопропил-5-(2-фтор-4-йодфениламино)-6,8-диметил-2,4,7-триоксо-3,4,6,7-тетрагидро-2Н-пиридо[4,3-d]пиримидин-1-ил]фенил}ацетамид-диметилсульфоксида в течение от 4 до 6 последовательных дней необязательно с последующими одним или более циклами повторного дозированного введения.
10. Способ по п.6, где N-{3-[3-циклопропил-5-(2-фтор-4-йодфениламино)-6,8-диметил-2,4,7-триоксо-3,4,6,7-тетрагидро-2Н-пиридо[4,3-d]пиримидин-1-ил]фенил}ацетамид-диметилсульфоксид и N-{(1S)-2-амино-1-[(3,4-дифторфенил)метил]этил}-5-хлор-4-(4-хлор-1-метил-1Н-пиразол-5-ил)-2-фуранкарбоксамид вводят с интервалом 12 ч между ними течение 2 дней из 7-дневного периода времени, а в другие дни 7-дневного периода времени вводят либо только один N-{3-[3-циклопропил-5-(2-фтор-4-йодфениламино)-6,8-диметил-2,4,7-триоксо-3,4,6,7-тетрагидро-2Н-пиридо[4,3-d]пиримидин-1-ил]фенил}ацетамид-диметилсульфоксид необязательно с последующими одним или более циклами повторного дозированного введения, либо только один N-{(1S)-2-амино-1-[(3,4-дифторфенил)метил]этил}-5-хлор-4-(4-хлор-1-метил-1Н-пиразол-5-ил)-2-фуранкарбоксамид необязательно с последующими одним или более циклами повторного дозированного введения.
11. Способ по п.6, где N-{3-[3-циклопропил-5-(2-фтор-4-йодфениламино)-6,8-диметил-2,4,7-триоксо-3,4,6,7-тетрагидро-2Н-пиридо[4,3-d]пиримидин-1-ил]фенил}ацетамид-диметилсульфоксид и N-{(1S)-2-амино-1-[(3,4-дифторфенил)метил]этил}-5-хлор-4-(4-хлор-1-метил-1Н-пиразол-5-ил)-2-фуранкарбоксамид вводят с интервалом 12 ч между ними в течение 5 последовательных дней.
12. Способ по п.6, где N-{3-[3-циклопропил-5-(2-фтор-4-йодфениламино)-6,8-диметил-2,4,7-триоксо-3,4,6,7-тетрагидро-2Н-пиридо[4,3-d]пиримидин-1-ил]фенил}ацетамид-диметилсульфоксид и N-{(1S)-2-амино-1-[(3,4-дифторфенил)метил]этил}-5-хлор-4-(4-хлор-1-метил-1Н-пиразол-5-ил)-2-фуранкарбоксамид вводят с интервалом 12 ч между ними в течение 5 дней из 14-дневного периода времени, а в другие дни 14-дневного периода времени вводят либо только один N-{3-[3-циклопропил-5-(2-фтор-4-йодфениламино)-6,8-диметил-2,4,7-триоксо-3,4,6,7-тетрагидро-2Н-пиридо[4,3-d]пиримидин-1-ил]фенил}ацетамид-диметилсульфоксид необязательно с последующими одним или более циклами повторного дозированного введения, либо только один N-{(1S)-2-амино-1-[(3,4-дифторфенил)метил]этил}-5-хлор-4-(4-хлор-1-метил-1Н-пиразол-5-ил)-2-фуранкарбоксамид необязательно с последующими одним или более циклами повторного дозированного введения.
13. Способ по п.6 или 7, где соединение, представляющее собой N-{3-[3-циклопропил-5-(2-фтор-4-йодфениламино)-6,8-диметил-2,4,7-триоксо-3,4,6,7-тетрагидро-2Н-пиридо[4,3-d]пиримидин-1-ил]фенил}ацетамид-диметилсульфоксид, вводят сначала в виде нагрузочной дозы в течение от 1 до 3 дней с последующим введением поддерживающей дозы соединения; и/или соединение, представляющее собой N-{(1S)-2-амино-1-[(3,4-дифторфенил)метил]этил}-5-хлор-4-(4-хлор-1-метил-1Н-пиразол-5-ил)-2-фуранкарбоксамид или его фармацевтически приемлемую соль, вводят сначала в виде нагрузочной дозы в течение от 1 до 3 дней с последующим введением поддерживающей дозы соединения.
14. Применение по п.4, где рак содержит либо Ras/Raf дикого типа или мутантный, либо PI3K/PTEN дикого типа или мутантный.
15. Применение по п.4, где рак выбирают из рака яичников, молочной железы, поджелудочной железы и простаты.
Текст
Настоящее изобретение относится к способу лечения рака у человека и фармацевтической комбинации,полезной для такого лечения. В частности,способ относится к способу лечения рака,который включает введение N-3-[3-циклопропил-5-(2-фтор-4-йодфениламино)-6,8-диметил-2,4,7-триоксо-3,4,6,7 тетрагидро-2 Н-пиридо[4,3-d]пиримидин-1-ил]фенилацетамида или его фармацевтически приемлемой соли или сольвата и N-(1S)-2-амино-1-[(3,4-дифторфенил)метил]этил-5-хлор-4-(4 хлор-1-метил-1 Н-пиразол-5-ил)-2-фуранкарбоксамида или его фармацевтически приемлемой соли нуждающемуся в этом человеку. Область техники, к которой относится изобретение Настоящее изобретение относится к способу лечения рака у млекопитающего и к комбинациям, полезным для такого лечения. В частности, способ относится к новой комбинации, включающей ингибиторMEK N-3-[3-циклопропил-5-(2-фтор-4-йодфениламино)-6,8-диметил-2,4,7-триоксо-3,4,6,7-тетрагидро 2 Н-пиридо[4,3-d]пиримидин-1-ил]фенилацетамид или его фармацевтически приемлемую соль или сольват и ингибитор Akt N-(1S)-2-амино-1-[(3,4-дифторфенил)метил]этил-5-хлор-4-(4-хлор-1-метил 1 Н-пиразол-5-ил)-2-фуранкарбоксамид или его фармацевтически приемлемую соль, содержащим их фармацевтическим композициям и способам применения таких комбинаций для лечения рака. Уровень техники Целью, преследуемой в области онкологии, является эффективное лечение гиперпролиферативных расстройств, включая рак. Обычно рак возникает вследствие нарушения регуляции нормальных процессов, управляющих клеточным делением, дифференцировкой и гибелью клеток при апоптозе. Апоптоз(запрограммированная гибель клеток) играет существенную роль в эмбриональном развитии и патогенезе различных заболеваний, таких как дегенеративные нейронные заболевания, сердечно-сосудистые заболевания и рак. Одним из наиболее широко исследованных путей, который включает киназное регулирование апоптоза, является клеточный сигнал от рецепторов факторов роста на поверхности клетки к ядру (Crews и Erikson, Cell, 74: 215-17, 1993). Рецепторные тирозинкиназы (RTK), активированные внеклеточными факторами роста, рекрутируют внутриклеточные белки к клеточной мембране, активируя таким образом ключевые компоненты передачи сигнала, которые, обычно, гиперактивированы в случаях злокачественного новообразования. Они включают фосфоинозитид-3-киназу (далее именуемую PI3K) и гуанозинтрифосфат(ГТФ)-связывающий белок RAS. Семейство белков PI3K состоит из 15 членов с общей гомологией последовательности, в частности в их киназных доменах, однако они имеют различные субстратную специфичность и тип регулирования(VivancoSawyers. Nat. Rev. Cancer, 2002, 2: 489-501). PI3-киназы класса I фосфорилируют инозитсодержащие липиды, известные как фосфатидилинозиты (Ptdlns) по положению 3. Этими киназами первичные субстраты членов семейства класса I Ptdlns-4,5-P2 (PIP2) превращаются в Ptdlns-3,4,5-Р 3 (PIP3).PIP3 является ключевым вторичным мессенджером, который рекрутирует к клеточной мембране белки,содержащие плекстриновые гомологические домены, где они активируются. Среди этих белков наиболее изучены AKT, которые способствуют выживанию, росту и пролиферации клеток. Сигнальный путь AKT может регулироваться активацией PI3K. Три члена семейства генов AKT - AKT1, AKT2 и AKT3 кодируют серин/треонин-специфичные протеинкиназы, которые при активации перемещаются в цитоплазму и ядро, где фосфорилируют многочисленные субстраты, включая mTOR (TORC1). Путь PI3K-AKT принадлежит к наиболее часто активируемым путям при злокачественном новообразовании у человека. Функция и значение этого пути в возникновении и прогрессировании опухоли хорошо известны (SamuelsEricson. Curr. Opp in Oncology, 2006. 18: 77-82). Таким образом, нарушение регулирования сигнала PI3K/AKT при опухолях вносит вклад в клеточный фенотип, который демонстрирует многочисленные признаки злокачественности, включая неограниченный репродуктивный потенциал и способность избегать апоптоз (HanahanWeinberg, Cell, 2000, 100: 57-70). Эти пути могут быть активированы в результате многочисленных изменений генетического материала половых клеток и соматических клеток. Соматическая активация сигнального пути PI3K/AKT чаще всего происходит или путем активации мутаций в PI3KCA (который кодирует каталитическую киназную субъединицу p110),или путем инактивирующих мутаций, делеций или выключения подавляющего рост опухолевых клеток гена PTEN путем метилирования промотора (отрицательное регулирование PI3K) (VivancoSawyers.Nat. Rev. Cancer, 2002, 2: 489-501). Реже, при раке груди, яичников и колоректальном раке также обнаруживается активирующая мутация AKT1, приводящая к независимому мембранному рекрутингу PI3K(Carpten et al., Nature, 2007, 448: 439-44). Известно, что киназа митогенактивированной протеинкиназы (MAP)/внеклеточной сигнальнорегулируемой киназы (ERK) (далее именуемая MEK) вовлечена в регулирование различных клеточных процессов. Семейство Raf (B-Raf, C-Raf и т.д.) активирует семейство MEK (MEK-1, MEK-2 и т.д.), а семейство MEK активирует семейство ERK (ERK-1 и ERK-2). В широком смысле, сигнальная активность пути RAF/MEK/ERK управляет трансляцией мРНК. Это включает гены, относящиеся к клеточному циклу. Следовательно, гиперактивация этого пути приводит к неконтролируемой пролиферации клеток. Нарушение регуляции пути RAF/MEK/ERK гиперактивацией ERK наблюдается примерно в случае 30% всех злокачественных новообразований у человека (Allen L.F. et al., Semin. Oncol., 2003, 30(5 Suppl 16): 105-16). RAS, который может передавать сигнал как через PI3K/AKT, так и RAF/MEK/ERK, имеет мутированный онкогенный белок в 15% всех случаев злокачественных новообразований (Davies H. et al. Nature. 2002. 417: 949-54). Также, в случае определенных типов опухолей (например, меланомы) с высокой частотой обнаружены активирующие мутации BRAF (Davies H. et al., Nature, 2002, 417: 949-54). Несмотря на то что активирующие мутации MEK сами по себе, по-видимому, нечасто встречаются при злокачественном новообразовании у человека, полагают, что MEK является важной мишенью для лекарственных веществ при лечении злокачественного новообразования у человека из-за ее центральной роли вERK-пути. Кроме того, MEK-ингибирующая активность приводит к эффективному ингибированию активности ERK1/2 и подавлению клеточной пролиферации (The Journal of Biological Chemistry. Vol. 276, 4, pp. 2686-2692, 2001), и ожидается, что соединение будет эффективно при заболеваниях, вызываемых нежелательной клеточной пролиферацией, таких как развитие опухоли и/или рак. Эти наблюдения показывают, что PI3K/Akt-путь играет важную роль в регулировании выживания клеток или апоптоза при развитии опухоли и/или рака. Эти наблюдения показывают, что RAF/MEK/ERK-путь играет важную роль в регулировании выживания клеток или апоптоза при развитии опухоли и/или рака. Может быть полезным создание нового лекарственного средства, которое обеспечивает белее эффективное и/или улучшенное лечение субъекта, страдающего от проявлений рака. Краткое описание изобретения Один вариант изобретения обеспечивает комбинацию, включающую: или его фармацевтически приемлемую соль или сольват и или его фармацевтически приемлемую соль. Один из вариантов данного изобретения обеспечивает способ лечения рака у нуждающегося в этом человека, включающий введение такому человеку in vivo терапевтически эффективного количества комбинации N-3-[3-циклопропил-5-(2-фтор-4-йодфениламино)-6,8-диметил-2,4,7-триоксо-3,4,6,7-тетрагидро-2 Н-пиридо[4,3-d]пиримидин-1-ил]фенилацетамида или его фармацевтически приемлемой соли или сольвата, предпочтительно сольвата с диметилсульфоксидом, и N-(1S)-2-амино-1-[(3,4-дифторфенил)метил]этил-5-хлор-4-(4-хлор-1-метил-1 Н-пиразол-5-ил)-2-фуранкарбоксамида или его фармацевтически приемлемой соли. Один из вариантов данного изобретения обеспечивает способ лечения рака у нуждающегося в этом человека, включающий введение такому человеку in vivo терапевтически эффективного количества комбинации N-3-[3-циклопропил-5-(2-фтор-4-йодфениламино)-6,8-диметил-2,4,7-триоксо-3,4,6,7-тетрагидро-2 Н-пиридо[4,3-d]пиримидин-1-ил]фенилацетамида или его фармацевтически приемлемой соли или сольвата, предпочтительно сольвата с диметилсульфоксидом, и N-(1S)-2-амино-1-[(3,4-дифторфенил)метил]этил-5-хлор-4-(4-хлор-1-метил-1 Н-пиразол-5-ил)-2-фуранкарбоксамида или его фармацевтически приемлемой соли, где комбинацию вводят в пределах указанного периода и где комбинацию вводят в течение отрезка времени. Один из вариантов данного изобретения обеспечивает способ лечения рака у нуждающегося в этом человека, включающий введение такому человеку in vivo терапевтически эффективного количества комбинации N-3-[3-циклопропил-5-(2-фтор-4-йодфениламино)-6,8-диметил-2,4,7-триоксо-3,4,6,7-тетрагидро-2 Н-пиридо[4,3-d]пиримидин-1-ил]фенилацетамида или его фармацевтически приемлемой соли или сольвата, предпочтительно сольвата с диметилсульфоксидом, и N-(1S)-2-амино-1-[(3,4-дифторфенил)метил]этил-5-хлор-4-(4-хлор-1-метил-1 Н-пиразол-5-ил)-2-фуранкарбоксамида или его фармацевтически приемлемой соли, где соединения комбинации вводят последовательно. Краткое описание фигур На фиг. 1 представлены кривые зависимости доза-эффект ингибирования клеточного роста дляMDA-MB-175-VII, BT474-J4 и JIMT-1. На фиг. 2 показано действие комбинаций соединений А и В и монотерапии в отношении ксенотрансплантатов опухолей с мутантным KRAS, развивающихся у мышей SCID. Подробное описание изобретения Настоящее изобретение относится к комбинации, которая проявляет антипролиферативную активность. Предпочтительно способ относится к способам лечения рака путем совместного введения N-3-[3-2 021951 циклопропил-5-(2-фтор-4-йодфениламино)-6,8-диметил-2,4,7-триоксо-3,4,6,7-тетрагидро-2H-пиридо[4,3-d] пиримидин-1-ил]фенилацетамида или его фармацевтически приемлемой соли или сольвата, предпочтительно сольвата с диметилсульфоксидом (далее соединение А или его фармацевтически приемлемая соль или сольват, предпочтительно сольват с диметилсульфоксидом),где указанное соединение представлено структурой I и N-(1S)-2-амино-1-[(3,4-дифторфенил)метил]этил-5-хлор-4-(4-хлор-1-метил-1 Н-пиразол-5-ил)-2 фуранкарбоксамида или его фармацевтически приемлемой соли (далее соединение В или его фармацевтически приемлемая соль),где указанное соединение представлено структурой II Соединение А описано и заявлено наряду с его фармацевтически приемлемыми солями и сольватами как полезное в качестве ингибитора активности MEK, в частности для лечения рака, в международной заявке PCT/JP 2005/011082 с датой международной подачи 10 июня 2005 г., номер международной опубликованной заявки WO 2005/121142 и дата международной публикации 22 декабря 2005 г., полное описание которой включено посредством ссылки, соединение А является соединением примера 4-1. Соединение А может быть получено, как описано в международной заявке PCT/JP 2005/011082. Соединение А может быть получено, как описано в опубликованной патентной заявке США 2006/0014768, опубликованной 19 января 2006 г., полное описание которой включено посредством ссылки. Предпочтительно соединение А находится в форме сольвата с диметилсульфоксидом. Предпочтительно соединение А находится в форме натриевой соли. Предпочтительно соединение А находится в форме сольвата, выбранного из гидрата, сольвата с уксусной кислотой, этанолом, нитрометаном, хлорбензолом, 1-пентанолом, изопропиловым спиртом, этиленгликолем и 3-метил-1-бутанолом. Эти сольваты и солевые формы могут быть получены специалистом в данной области, исходя из описания международной заявки PCT/JP 2005/011082 или опубликованной патентной заявки США 2006/0014768. Соединение В описано и заявлено наряду с его фармацевтически приемлемыми солями как полезное в качестве ингибитора активности AKT, в частности для лечения злокачественного новообразования,в международной заявке PCT/US 2008/053269 с датой международной подачи 7 февраля 2008 г., номер международной опубликованной заявки WO 2008/098104 и дата международной публикации 14 августа 2008 г., полное описание которой включено посредством ссылки, соединение В является соединением примера 224. Соединение В может быть получено, как описано в международной заявке PCT/US 2008/053269. Введение терапевтически эффективного количества комбинаций в соответствии с изобретением имеет преимущества по сравнению с составляющими индивидуальными соединениями, заключающиеся в том, что комбинации будут обеспечивать одно или более из следующих улучшенных свойств, по сравнению с отдельным введением терапевтически эффективного количества составляющих соединений: i) более высокий противораковый эффект по сравнению с активным одиночным средством, ii) синергическую или высокосинергическую противораковую активность, iii) протокол дозирования, который обеспечивает улучшенный противораковый эффект со сниженным профилем побочных эффектов, iv) уменьшение профиля токсического эффекта, v) увеличение терапевтического окна или vi) повышение биодоступности одного или обоих составляющих соединений. Соединения изобретения могут содержать один или более хиральных атомов, или иначе, могут быть способны к существованию в виде двух энантиомеров. Соответственно, соединения данного изобретения включают смеси энантиомеров, равно как и очищенные энантиомеры и энантиомерно обогащенные смеси. Также понятно, что все таутомеры и смеси таутомеров включены в объем соединения А и его фармацевтически приемлемых солей и сольватов и соединения В и его фармацевтически приемлемых солей. Соединения в соответствии с изобретением могут образовывать сольваты, под которыми понимают комплексы с различной стехиометрией, образованные растворенным веществом (в данном изобретении соединением А или его солью и/или соединением В или его солью) и растворителем. Для целей изобретения такие растворители могут не влиять на биологическую активность растворенного вещества. Примеры подходящих растворителей включают, но без ограничения, воду, метанол, диметилсульфоксид,этанол и уксусную кислоту. Подходящим применяемым растворителем является фармацевтически приемлемый растворитель. Примеры подходящих фармацевтически приемлемых растворителей включают,но без ограничения, воду, диметилсульфоксид, этанол и уксусную кислоту. Подходящим применяемым растворителем является вода. Фармацевтически приемлемые соли соединений в соответствии с изобретение легко могут быть получены специалистом в данной области. Также рассматривается способ лечения рака с применением комбинации в соответствии с изобретением, в котором соединение А или его фармацевтически приемлемую соль или сольват и/или соединение В или его фармацевтически приемлемую соль вводят в виде пролекарств. Фармацевтически приемлемые пролекарства соединений в соответствии с изобретением легко могут быть получены специалистом в данной области. В отношении протокола дозирования термин день, в день и тому подобное относится ко времени в пределах одного календарного дня, который начинается в полночь и заканчивается в следующую полночь. Под термином лечение и его производными, используемыми в заявке, понимают терапевтическое лечение. Со ссылкой на конкретное состояние лечение означает: (1) улучшение или предотвращение состояния или одного или более биологических проявлений состояния, (2) вмешательство в (а) одно или более звеньев биологического каскада, который приводит к состоянию или ответственен за него, или (b) в одно или более биологических проявлений состояния, (3) облегчение одного или более симптомов, эффектов или побочных эффектов, связанных с состоянием или его лечением, или (4) замедление прогрессирования состояния или одного или более биологических проявлений состояния. Профилактическая терапия также рассматривается в заявке. Специалист в данной области должен осознавать, что предотвращение не является абсолютным термином. В медицине понимают предотвращение как относящееся к профилактическому введению лекарства для существенного снижения вероятности или тяжести состояния или его биологического проявления или как отсрочку момента начала такого состояния или его биологического проявления. Профилактическая терапия подходит, например, когда субъект рассматривается с позиции высокого риска развития злокачественного новообразования, такого как весомая история заболеваемости раком в семье или когда субъект был подвержен воздействию канцерогена. Используемый в заявке термин эффективное количество означает, что количество лекарства или фармацевтического средства будет вызывать биологический или медицинский ответ ткани, системы, животного или человека, искомый, например, исследователем или клиницистом. Далее, термин терапевтически эффективное количество означает любое количество, которое по сравнению с соответствующим субъектом, не получавшим такого количества, приводит к улучшенному лечению, исцелению,предотвращению или улучшению течения заболевания, расстройства или побочного эффекта или снижению скорости развития заболевания или расстройства. Термин также включает в свой объем количество,эффективное для улучшения нормальной физиологической функции. Термин комбинация и его производные, используемый в заявке, означает одновременное введение или иной способ раздельного последовательного введения терапевтически эффективного количества соединения А или его фармацевтически приемлемой соли или сольвата и соединения В или его фармацевтически приемлемой соли. Предпочтительно введение не является одновременным, соединения вводят через короткий промежуток времени между ними. Кроме того, не имеет значения, вводят ли соединения в одинаковых дозированных формах, например одно соединение можно вводить местно, а другое соединение можно вводить перорально. Предпочтительно оба соединения вводят перорально. Под термином комбинированный набор, используемым в заявке, понимают фармацевтическую композицию или композиции, которые применяют для введения соединения А или его фармацевтически приемлемой соли или сольвата и соединения В или его фармацевтически приемлемой соли в соответствии с изобретением. Когда оба соединения вводят одновременно, комбинированный набор может содержать соединение А или его фармацевтически приемлемую соль или сольват и соединение В или его фармацевтически приемлемую соль в единственной фармацевтической композиции, такой как таблетка, или в раздельных фармацевтических композициях. Когда соединения не вводят одновременно, комбинированный набор будет содержать соединение А или его фармацевтически приемлемую соль или сольват и соединение В или его фармацевтически приемлемую соль в раздельных фармацевтических композициях. Комбинированный набор может включать соединение А или его фармацевтически приемлемую соль или сольват и соединение В или его фармацевтически приемлемую соль в раздельных фармацевтических композициях в единой упаковке или раздельные фармацевтические композиции в раздельных упаковках. В одном аспекте обеспечивается комбинированный набор, включающий компоненты соединение А или его фармацевтически приемлемую соль или сольват в сочетании с фармацевтически приемлемым носителем и соединение В или его фармацевтически приемлемую соль в сочетании с фармацевтически приемлемым носителем. В одном варианте изобретения комбинированный набор включает следующие компоненты соединение А или его фармацевтически приемлемую соль или сольват в сочетании с фармацевтически приемлемым носителем и соединение В или его фармацевтически приемлемую соль в сочетании с фармацевтически приемлемым носителем,где компоненты представлены в форме, подходящей для последовательного, раздельного и/или одновременного введения. В одном варианте комбинированный набор включает первый контейнер, содержащий соединение А или его фармацевтически приемлемую соль или сольват в сочетании с фармацевтически приемлемым носителем; и второй контейнер, содержащий соединение В или его фармацевтически приемлемую соль в сочетании с фармацевтически приемлемым носителем, и емкостное устройство, содержащее указанные первый и второй контейнеры. Комбинированный набор может также быть снабжен инструкцией, такой как инструкция по дозированию и введению. Такие инструкции по дозированию и введению могут относиться к типу инструкций, адресованных врачу, например этикетка фармацевтического продукта, или они могут относиться к типу инструкций, предоставляемых врачом, таких как инструкции для пациента. Если не указано иное, во всех протоколах дозирования, раскрытых в описании, режим введения соединений не должен начинаться в начале лечения и завершаться в конце лечения, единственно требуется,чтобы число последовательных дней, в течение которых вводят оба соединения, и необязательное число последовательных дней, в течение которых вводят только одно из составляющих соединений, или указанный протокол дозирования, включающий количество вводимого соединения, приходились на какойто момент в течение курса лечения. Используемый в описании термин соединение А 2 означает соединение А или его фармацевтически приемлемую соль или сольват. Используемый в описании термин соединение В 2 означает соединение В или его фармацевтически приемлемую соль. Термин нагрузочная доза, используемый в описании, следует понимать как относящийся к однократной дозе или кратковременному режиму введения соединения А или соединения В, имеющему дозу,превышающую поддерживающую дозу, вводимую субъекту для быстрого увеличения уровня концентрации лекарства в крови. Предпочтительно кратковременный режим введения, применяемый в описании, составляет от 1 до 14 дней, предпочтительно от 1 до 7 дней, предпочтительно от 1 до 3 дней, предпочтительно в течение трех дней, предпочтительно в течение двух дней, предпочтительно в течение одного дня. В некоторых вариантах нагрузочная доза может увеличивать уровень концентрации лекарства в крови до терапевтически эффективного уровня. В некоторых вариантах нагрузочная доза может увеличивать уровень концентрации лекарства в крови до терапевтически эффективного уровня в сочетании с поддерживающей дозой лекарственного средства. Нагрузочная доза может быть введена один раз в день или более одного раза в день (например, до 4 раз в день). Предпочтительно нагрузочная доза может быть введена один раз в день. Предпочтительно нагрузочная доза может превосходить поддерживающую дозу в число раз от 2 до 100, предпочтительно от 2 до 10 раз, предпочтительно от 2 до 5 раз,предпочтительно в 2 раза, предпочтительно в 3 раза, предпочтительно в 4 раза, предпочтительно в 5 раз. Предпочтительно нагрузочную дозу вводят в течение от 1 до 7 дней, предпочтительно от 1 до 5 дней,предпочтительно от 1 до 3 дней, предпочтительно в течение 1 дня, предпочтительно в течение 2 дней,предпочтительно в течение 3 дней с последующим введением в соответствии с протоколом поддерживающего дозирования. Термин поддерживающая доза, используемый в описании, следует понимать как относящийся к дозе, которую вводят последовательно (например, по меньшей мере дважды) и которая предназначена для постепенного увеличения уровней концентрации соединения в крови до терапевтически эффективного уровня или для поддержания такого терапевтически эффективного уровня. Поддерживающую дозу обычно вводят один раз в день, а дневная доза поддерживающей дозы ниже, чем общая дневная нагрузочная доза. Предпочтительно комбинации в соответствии с изобретением вводят в течение указанного периода. Под термином указанный период и его производными, используемыми в описании, понимают интервал времени между введением одного из соединения А 2 и соединения В 2 и другого из соединения А 2 и соединения В 2. Если не указано иное, указанный период может включать одновременное введение. Если оба соединения в соответствии с изобретением вводят один раз в день, то указанный период относится ко времени введения соединения А 2 и соединения В 2 в течение одного дня. Если одно или оба соединения в соответствии с изобретением вводят более одного раза в день, то указанный период вычисляют на осно-5 021951 вании первого введения каждого соединения в конкретный день. Все введения соединения в соответствии с изобретением, следующие за первым в течение конкретного дня, не учитывают при расчете указанного периода. Предпочтительно, если соединения вводят в течение указанного периода, но не вводят одновременно, оба соединения вводят в интервале приблизительно 24 ч между ними, в этом случае указанный период составит приблизительно 24 ч; предпочтительно оба соединения вводят в интервале приблизительно 12 ч между ними, в этом случае указанный период составит приблизительно 12 ч; предпочтительно оба соединения вводят в интервале приблизительно 11 ч между ними, в этом случае указанный период составит приблизительно 11 ч; предпочтительно оба соединения вводят в интервале приблизительно 10 ч между ними, в этом случае указанный период составит приблизительно 10 ч; предпочтительно оба соединения вводят в интервале приблизительно 9 ч между ними, в этом случае указанный период составит приблизительно 9 ч; предпочтительно оба соединения вводят в интервале приблизительно 8 ч между ними, в этом случае указанный период составит приблизительно 8 ч; предпочтительно оба соединения вводят в интервале приблизительно 7 ч между ними, в этом случае указанный период составит приблизительно 7 ч; предпочтительно оба соединения вводят в интервале приблизительно 6 ч между ними, в этом случае указанный период составит приблизительно 6 ч; предпочтительно оба соединения вводят в интервале приблизительно 5 ч между ними, в этом случае указанный период составит приблизительно 5 ч; предпочтительно оба соединения вводят в интервале приблизительно 4 ч между ними, в этом случае указанный период составит приблизительно 4 ч; предпочтительно оба соединения вводят в интервале приблизительно 3 ч между ними, в этом случае указанный период составит приблизительно 3 ч; предпочтительно оба соединения вводят в интервале приблизительно 2 ч между ними, в этом случае указанный период составит приблизительно 2 ч; предпочтительно оба соединения вводят в интервале приблизительно 1 ч между ними, в этом случае указанный период составит приблизительно 1 ч. Как указано в описании, раздельное введение соединения А 2 и соединения В 2 в интервале менее 45 мин рассматривается как одновременное введение. Предпочтительно, если комбинацию в соответствии с изобретением вводят в пределах указанного периода, то соединения совместно вводят в течение отрезка времени. Под термином отрезок времени и его производными, используемыми в описании, понимают то,что оба соединения в соответствии с изобретением вводят в пределах указанного периода определенное число последовательных дней, за которыми необязательно следует число последовательных дней, в течение которых вводят только одно из составляющих соединений. В отношении указанного периода введения предпочтительно, если оба соединения вводят в пределах указанного периода по меньшей мере один день, то в этом случае отрезок времени будет составлять по меньшей мере один день; предпочтительно во время курса лечения, если оба соединения вводят в пределах указанного периода по меньшей мере 3 последовательных дня, то в этом случае отрезок времени будет составлять по меньшей мере 3 дня; предпочтительно, если оба соединения вводят в пределах указанного периода по меньшей мере 5 последовательных дней, то в этом случае отрезок времени будет составлять по меньшей мере 5 дней; предпочтительно, если оба соединения вводят в пределах указанного периода по меньшей мере 7 последовательных дней, то в этом случае отрезок времени будет составлять по меньшей мере 7 дней; предпочтительно, если оба соединения вводят в пределах указанного периода по меньшей мере 14 последовательных дней, то в этом случае отрезок времени будет составлять по меньшей мере 14 дней; предпочтительно, если оба соединения вводят в пределах указанного периода по меньшей мере 30 последовательных дней, то в этом случае отрезок времени будет составлять по меньшей мере 30 дней. Предпочтительно, если в течение курса лечения оба соединения вводят в пределах указанного периода по меньшей мере 1 день, то в этом случае отрезок времени будет составлять по меньшей мере 1 день; предпочтительно, если в течение курса лечения оба соединения вводят в пределах указанного периода по меньшей мере 2 последовательных дня, то в этом случае отрезок времени будет составлять по меньшей мере 2 дня; предпочтительно, если в течение курса лечения оба соединения вводят в пределах указанного периода по меньшей мере 3 последовательных дня, то в этом случае отрезок времени будет составлять по меньшей мере 3 дня; предпочтительно, если в течение курса лечения оба соединения вводят в пределах указанного периода по меньшей мере 5 последовательных дней, то в этом случае отрезок времени будет составлять по меньшей мере 5 дней; предпочтительно, если в течение курса лечения оба соединения вводят в пределах указанного периода по меньшей мере 7 последовательных дней, то в этом случае отрезок времени будет составлять по меньшей мере 7 дней; предпочтительно, если в течение курса лечения оба соединения вводят в пределах указанного периода по меньшей мере 14 последовательных дней, то в этом случае отрезок времени будет составлять по меньшей мере 14 дней; предпочтительно,если в течение курса лечения оба соединения вводят в пределах указанного периода по меньшей мере 30 последовательных дней, то в этом случае отрезок времени будет составлять по меньшей мере 30 дней. Если в течение курса лечения оба соединения вводят в пределах указанного периода в течение более 30 дней, то лечение рассматривается как лечение хронического заболевания, и оно будет продолжаться до тех пор, пока вносящее изменение событие, такое как переоценка картины злокачественного новообразования или изменение состояния пациента, не потребует изменения протокола дозирования. Дополнительно в отношении указанного периода введения предпочтительно, если в течение курса лечения оба соединения вводят в пределах указанного периода по меньшей мере 1 день с последующим введением только одного соединения А 2 в течение по меньшей мере 1 дня, то в этом случае отрезок времени будет составлять по меньшей мере 2 дня; предпочтительно, если в течение курса лечения оба соединения вводят в пределах указанного периода по меньшей мере 1 день с последующим введением только одного соединения А 2 в течение по меньшей мере 2 дней, то в этом случае отрезок времени будет составлять по меньшей мере 3 дня; предпочтительно, если в течение курса лечения оба соединения вводят в пределах указанного периода по меньшей мере 1 день с последующим введением только одного соединения А 2 в течение по меньшей мере 3 дней, то в этом случае отрезок времени будет составлять по меньшей мере 4 дня; предпочтительно, если в течение курса лечения оба соединения вводят в пределах указанного периода по меньшей мере 1 день с последующим введением только одного соединения А 2 в течение по меньшей мере 4 дней, то в этом случае отрезок времени будет составлять по меньшей мере 5 дней; предпочтительно, если в течение курса лечения оба соединения вводят в пределах указанного периода по меньшей мере 1 день с последующим введением только одного соединения А 2 в течение по меньшей мере 5 дней, то в этом случае отрезок времени будет составлять по меньшей мере 6 дней; предпочтительно, если в течение курса лечения оба соединения вводят в пределах указанного периода по меньшей мере 1 день с последующим введением только одного соединения А 2 в течение по меньшей мере 6 дней, то в этом случае отрезок времени будет составлять по меньшей мере 7 дней; предпочтительно,если в течение курса лечения оба соединения вводят в пределах указанного периода по меньшей мере 1 день с последующим введением только одного соединения А 2 в течение по меньшей мере 7 дней, то в этом случае отрезок времени будет составлять по меньшей мере 8 дней; предпочтительно, если в течение курса лечения оба соединения вводят в пределах указанного периода по меньшей мере 2 последовательных дня с последующим введением только одного соединения А 2 в течение по меньшей мере 1 дня, то в этом случае отрезок времени будет составлять по меньшей мере 3 дня; предпочтительно, если в течение курса лечения оба соединения вводят в пределах указанного периода по меньшей мере 2 последовательных дня с последующим введением только одного соединения А 2 в течение по меньшей мере 2 дней, то в этом случае отрезок времени будет составлять по меньшей мере 4 дня; предпочтительно, если в течение курса лечения оба соединения вводят в пределах указанного периода по меньшей мере 2 последовательных дня с последующим введением только одного соединения А 2 в течение по меньшей мере 3 дней, то в этом случае отрезок времени будет составлять по меньшей мере 5 дней; предпочтительно, если в течение курса лечения оба соединения вводят в пределах указанного периода по меньшей мере 2 последовательных дня с последующим введением только одного соединения А 2 в течение по меньшей мере 4 дней, то в этом случае отрезок времени будет составлять по меньшей мере 6 дней; предпочтительно, если в течение курса лечения оба соединения вводят в пределах указанного периода по меньшей мере 2 последовательных дня с последующим введением только одного соединения А 2 в течение по меньшей мере 5 дней, то в этом случае отрезок времени будет составлять по меньшей мере 7 дней; предпочтительно, если в течение курса лечения оба соединения вводят в пределах указанного периода по меньшей мере 2 последовательных дня с последующим введением только одного соединения А 2 в течение по меньшей мере 6 дней, то в этом случае отрезок времени будет составлять по меньшей мере 8 дней; предпочтительно, если в течение курса лечения оба соединения вводят в пределах указанного периода по меньшей мере 2 последовательных дня с последующим введением только одного соединения А 2 в течение по меньшей мере 7 дней, то в этом случае отрезок времени будет составлять по меньшей мере 9 дней; предпочтительно, если в течение курса лечения оба соединения вводят в пределах указанного периода по меньшей мере 3 последовательных дня с последующим введением только одного соединения А 2 в течение по меньшей мере 1 дня, то в этом случае отрезок времени будет составлять по меньшей мере 4 дня; предпочтительно, если в течение курса лечения оба соединения вводят в пределах указанного периода по меньшей мере 3 последовательных дня с последующим введением только одного соединения А 2 в течение по меньшей мере 2 дней, то в этом случае отрезок времени будет составлять по меньшей мере 5 дней; предпочтительно, если в течение курса лечения оба соединения вводят в пределах указанного периода по меньшей мере 3 последовательных дня с последующим введением только одного соединения А 2 в течение по меньшей мере 3 дней, то в этом случае отрезок времени будет составлять по меньшей мере 6 дней; предпочтительно, если в течение курса лечения оба соединения вводят в пределах указанного периода по меньшей мере 3 последовательных дня с последующим введением только одного соединения А 2 в течение по меньшей мере 4 дней, то в этом случае отрезок времени будет составлять по меньшей мере 7 дней; предпочтительно, если в течение курса лечения оба соединения вводят в пределах указанного периода по меньшей мере 3 последовательных дня с последующим введением только одного соединения А 2 в течение по меньшей мере 5 дней, то в этом случае отрезок времени будет составлять по меньшей мере 8 дней; предпочтительно, если в течение курса лечения оба соединения вводят в пределах указанного периода по меньшей мере 3 последовательных дня с последующим введением только одного соединения А 2 в течение по меньшей мере 6 дней, то в этом случае отрезок времени будет составлять по меньшей мере 9 дней; предпочтительно, если в течение курса лечения оба соединения вводят в пределах указанного периода по меньшей мере 3 последовательных дня с последующим введением только одного соединения А 2 в течение по меньшей мере 7 дней, то в этом случае отрезок времени будет составлять по меньшей мере 10 дней; предпочтительно, если в течение курса лечения оба соединения вводят в пределах указанного периода по меньшей мере 4 последовательных дня с последующим введением только одного соединения А 2 в течение по меньшей мере 1 дня,то в этом случае отрезок времени будет составлять по меньшей мере 5 последовательных дней; предпочтительно, если в течение курса лечения оба соединения вводят в пределах указанного периода по меньшей мере 4 последовательных дня с последующим введением только одного соединения А 2 в течение по меньшей мере 2 последовательных дней, то в этом случае отрезок времени будет составлять по меньшей мере 6 последовательных дней; предпочтительно, если в течение курса лечения оба соединения вводят в пределах указанного периода по меньшей мере 4 последовательных дня с последующим введением только одного соединения А 2 в течение по меньшей мере 3 последовательных дней, то в этом случае отрезок времени будет составлять по меньшей мере 7 последовательных дней; предпочтительно, если в течение курса лечения оба соединения вводят в пределах указанного периода по меньшей мере 4 последовательных дня с последующим введением только одного соединения А 2 в течение по меньшей мере 4 последовательных дней, то в этом случае отрезок времени будет составлять по меньшей мере 8 последовательных дней; предпочтительно, если в течение курса лечения оба соединения вводят в пределах указанного периода по меньшей мере 4 последовательных дня с последующим введением только одного соединения А 2 в течение по меньшей мере 7 последовательных дней, то в этом случае отрезок времени будет составлять по меньшей мере 11 последовательных дней; предпочтительно, если в течение курса лечения оба соединения вводят в пределах указанного периода по меньшей мере 5 последовательных дней с последующим введением только одного соединения А 2 в течение по меньшей мере 1 дня, то в этом случае отрезок времени будет составлять по меньшей мере 6 последовательных дней; предпочтительно, если в течение курса лечения оба соединения вводят в пределах указанного периода по меньшей мере 5 последовательных дней с последующим введением только одного соединения А 2 в течение по меньшей мере 2 последовательных дней, то в этом случае отрезок времени будет составлять по меньшей мере 7 последовательных дней; предпочтительно, если в течение курса лечения оба соединения вводят в пределах указанного периода по меньшей мере 5 последовательных дней с последующим введением только одного соединения А 2 в течение по меньшей мере 3 последовательных дней, то в этом случае отрезок времени будет составлять по меньшей мере 8 последовательных дней; предпочтительно, если в течение курса лечения оба соединения вводят в пределах указанного периода по меньшей мере 5 последовательных дней с последующим введением только одного соединения А 2 в течение по меньшей мере 4 последовательных дней, то в этом случае отрезок времени будет составлять по меньшей мере 9 последовательных дней; предпочтительно, если в течение курса лечения оба соединения вводят в пределах указанного периода по меньшей мере 5 последовательных дней с последующим введением только одного соединения А 2 в течение по меньшей мере 5 последовательных дней, то в этом случае отрезок времени будет составлять по меньшей мере 10 последовательных дней; предпочтительно, если в течение курса лечения оба соединения вводят в пределах указанного периода по меньшей мере 7 последовательных дней с последующим введением только одного соединения А 2 в течение по меньшей мере 2 последовательных дней, то в этом случае отрезок времени будет составлять по меньшей мере 9 последовательных дней; предпочтительно,если в течение курса лечения оба соединения вводят в пределах указанного периода по меньшей мере 14 последовательных дней с последующим введением только одного соединения А 2 в течение по меньшей мере 7 последовательных дней, то в этом случае отрезок времени будет составлять по меньшей мере 21 последовательный день; предпочтительно, если в течение курса лечения оба соединения вводят в пределах указанного периода по меньшей мере 30 последовательных дней с последующим введением только одного соединения А 2 в течение по меньшей мере 7 последовательных дней, то в этом случае отрезок времени будет составлять по меньшей мере 37 последовательных дней. Предпочтительно в течение курса лечения оба соединения вводят в пределах указанного периода от 1 до 3 последовательных дней с последующим введением только одного соединения А 2 в течение от 3 до 7 последовательных дней. Предпочтительно в течение курса лечения оба соединения вводят в пределах указанного периода от 3 до 6 последовательных дней с последующим введением только одного соединения А 2 в течение от 1 до 4 последовательных дней. Предпочтительно в течение курса лечения оба соединения вводят в пределах указанного периода 5 последовательных дней с последующим введением только одного соединения А 2 в течение 2 последовательных дней. Предпочтительно в течение курса лечения оба соединения вводят в пределах указанного периода 2 последовательных дня с последующим введением только одного соединения А 2 в течение от 3 до 7 последовательных дней. Дополнительно в отношении указанного периода введения предпочтительно, если в течение курса лечения оба соединения вводят в пределах указанного периода по меньшей мере 1 день с последующим введением только одного соединения В 2 в течение по меньшей мере 1 дня, то в этом случае отрезок времени будет составлять по меньшей мере 2 дня; предпочтительно, если в течение курса лечения оба соединения вводят в пределах указанного периода по меньшей мере 1 день с последующим введением только одного соединения В 2 в течение по меньшей мере 2 дней, то в этом случае отрезок времени будет составлять по меньшей мере 3 дня; предпочтительно, если в течение курса лечения оба соединения вводят в пределах указанного периода по меньшей мере 1 день с последующим введением только одного соединения В 2 в течение по меньшей мере 3 дней, то в этом случае отрезок времени будет составлять по меньшей мере 4 дня; предпочтительно, если в течение курса лечения оба соединения вводят в пределах указанного периода по меньшей мере 1 день с последующим введением только одного соединения В 2 в течение по меньшей мере 4 дней, то в этом случае отрезок времени будет составлять по меньшей мере 5 дней; предпочтительно, если в течение курса лечения оба соединения вводят в пределах указанного периода по меньшей мере 1 день с последующим введением только одного соединения В 2 в течение по меньшей мере 5 дней, то в этом случае отрезок времени будет составлять по меньшей мере 6 дней; предпочтительно, если в течение курса лечения оба соединения вводят в пределах указанного периода по меньшей мере 1 день с последующим введением только одного соединения В 2 в течение по меньшей мере 6 дней, то в этом случае отрезок времени будет составлять по меньшей мере 7 дней; предпочтительно,если в течение курса лечения оба соединения вводят в пределах указанного периода по меньшей мере 1 день с последующим введением только одного соединения В 2 в течение по меньшей мере 7 дней, то в этом случае отрезок времени будет составлять по меньшей мере 8 дней; предпочтительно, если в течение курса лечения оба соединения вводят в пределах указанного периода по меньшей мере 2 последовательных дня с последующим введением только одного соединения В 2 в течение по меньшей мере 1 дня, то в этом случае отрезок времени будет составлять по меньшей мере 3 дня; предпочтительно, если в течение курса лечения оба соединения вводят в пределах указанного периода по меньшей мере 2 последовательных дня с последующим введением только одного соединения В 2 в течение по меньшей мере 2 дней, то в этом случае отрезок времени будет составлять по меньшей мере 4 дня; предпочтительно, если в течение курса лечения оба соединения вводят в пределах указанного периода по меньшей мере 2 последовательных дня с последующим введением только одного соединения В 2 в течение по меньшей мере 3 дней, то в этом случае отрезок времени будет составлять по меньшей мере 5 дней; предпочтительно, если в течение курса лечения оба соединения вводят в пределах указанного периода по меньшей мере 2 последовательных дня с последующим введением только одного соединения В 2 в течение по меньшей мере 4 дней, то в этом случае отрезок времени будет составлять по меньшей мере 6 дней; предпочтительно, если в течение курса лечения оба соединения вводят в пределах указанного периода по меньшей мере 2 последовательных дня с последующим введением только одного соединения В 2 в течение по меньшей мере 5 дней, то в этом случае отрезок времени будет составлять по меньшей мере 7 дней; предпочтительно, если в течение курса лечения оба соединения вводят в пределах указанного периода по меньшей мере 2 последовательных дня с последующим введением только одного соединения В 2 в течение по меньшей мере 6 дней, то в этом случае отрезок времени будет составлять по меньшей мере 8 дней; предпочтительно, если в течение курса лечения оба соединения вводят в пределах указанного периода по меньшей мере 2 последовательных дня с последующим введением только одного соединения В 2 в течение по меньшей мере 7 дней, то в этом случае отрезок времени будет составлять поменьшей мере 9 дней; предпочтительно, если в течение курса лечения оба соединения вводят в пределах указанного периода по меньшей мере 3 последовательных дня с последующим введением только одного соединения В 2 в течение по меньшей мере 1 дня, то в этом случае отрезок времени будет составлять по меньшей мере 4 дня; предпочтительно, если в течение курса лечения оба соединения вводят в пределах указанного периода по меньшей мере 3 последовательных дня с последующим введением только одного соединения В 2 в течение по меньшей мере 2 дней, то в этом случае отрезок времени будет составлять по меньшей мере 5 дней; предпочтительно, если в течение курса лечения оба соединения вводят в пределах указанного периода по меньшей мере 3 последовательных дня с последующим введением только одного соединения В 2 в течение по меньшей мере 3 дней, то в этом случае отрезок времени будет составлять по меньшей мере 6 дней; предпочтительно, если в течение курса лечения оба соединения вводят в пределах указанного периода по меньшей мере 3 последовательных дня с последующим введением только одного соединения В 2 в течение по меньшей мере 4 дней, то в этом случае отрезок времени будет составлять по меньшей мере 7 дней; предпочтительно, если в течение курса лечения оба соединения вводят в пределах указанного периода по меньшей мере 3 последовательных дня с последующим введением только одного соединения В 2 в течение по меньшей мере 5 дней, то в этом случае отрезок времени будет составлять по меньшей мере 8 дней; предпочтительно, если в течение курса лечения оба соединения вводят в пределах указанного периода по меньшей мере 3 последовательных дня с последующим введением только одного соединения В 2 в течение по меньшей мере 6 дней, то в этом случае отрезок времени будет составлять по меньшей мере 9 дней; предпочтительно, если в течение курса лечения оба соединения вводят в пределах указанного периода по меньшей мере 3 последовательных дня с последующим введением только одного соединения В 2 в течение по меньшей мере 7 дней, то в этом случае отрезок времени будет составлять по меньшей мере 10 дней; предпочтительно, если в течение курса лечения оба соединения вводят в пределах указанного периода по меньшей мере 4 последовательных дня с последующим введением только одного соединения В 2 в течение по меньшей мере 1 дня,то в этом случае отрезок времени будет составлять по меньшей мере 5 последовательных дней; предпочтительно, если в течение курса лечения оба соединения вводят в пределах указанного периода по меньшей мере 4 последовательных дня с последующим введением только одного соединения В 2 в течение по меньшей мере 2 последовательных дней, то в этом случае отрезок времени будет составлять по меньшей мере 6 последовательных дней; предпочтительно, если в течение курса лечения оба соединения вводят в пределах указанного периода по меньшей мере 4 последовательных дня с последующим введением только одного соединения В 2 в течение по меньшей мере 3 последовательных дней, то в этом случае отрезок времени будет составлять по меньшей мере 7 последовательных дней; предпочтительно, если в течение курса лечения оба соединения вводят в пределах указанного периода по меньшей мере 4 последовательных дня с последующим введением только одного соединения В 2 в течение по меньшей мере 4 последовательных дней, то в этом случае отрезок времени будет составлять по меньшей мере 8 последовательных дней; предпочтительно, если в течение курса лечения оба соединения вводят в пределах указанного периода по меньшей мере 4 последовательных дня с последующим введением только одного соединения В 2 в течение по меньшей мере 7 последовательных дней, то в этом случае отрезок времени будет составлять по меньшей мере 11 последовательных дней; предпочтительно, если в течение курса лечения оба соединения вводят в пределах указанного периода по меньшей мере 5 последовательных дней с последующим введением только одного соединения В 2 в течение по меньшей мере 1 дня, то в этом случае отрезок времени будет составлять по меньшей мере 6 последовательных дней; предпочтительно, если в течение курса лечения оба соединения вводят в пределах указанного периода по меньшей мере 5 последовательных дней с последующим введением только одного соединения В 2 в течение по меньшей мере 2 последовательных дней, то в этом случае отрезок времени будет составлять по меньшей мере 7 последовательных дней; предпочтительно, если в течение курса лечения оба соединения вводят в пределах указанного периода по меньшей мере 5 последовательных дней с последующим введением только одного соединения В 2 в течение по меньшей мере 3 последовательных дней, то в этом случае отрезок времени будет составлять по меньшей мере 8 последовательных дней; предпочтительно, если в течение курса лечения оба соединения вводят в пределах указанного периода по меньшей мере 5 последовательных дней с последующим введением только одного соединения В 2 в течение по меньшей мере 4 последовательных дней, то в этом случае отрезок времени будет составлять по меньшей мере 9 последовательных дней; предпочтительно, если в течение курса лечения оба соединения вводят в пределах указанного периода по меньшей мере 5 последовательных дней с последующим введением только одного соединения В 2 в течение по меньшей мере 5 последовательных дней, то в этом случае отрезок времени будет составлять по меньшей мере 10 последовательных дней; предпочтительно, если в течение курса лечения оба соединения вводят в пределах указанного периода по меньшей мере 7 последовательных дней с последующим введением только одного соединения В 2 в течение по меньшей мере 2 последовательных дней, то в этом случае отрезок времени будет составлять по меньшей мере 9 последовательных дней; предпочтительно,если в течение курса лечения оба соединения вводят в пределах указанного периода по меньшей мере 14 последовательных дней с последующим введением только одного соединения В 2 в течение по меньшей мере 7 последовательных дней, то в этом случае отрезок времени будет составлять по меньшей мере 21 последовательный день; предпочтительно, если в течение курса лечения оба соединения вводят в пределах указанного периода по меньшей мере 30 последовательных дней с последующим введением только одного соединения В 2 в течение по меньшей мере 7 последовательных дней, то в этом случае отрезок времени будет составлять по меньшей мере 37 последовательных дней. Предпочтительно в течение курса лечения оба соединения вводят в пределах указанного периода от 1 до 3 последовательных дней с последующим введением только одного соединения В 2 в течение от 3 до 7 последовательных дней. Предпочтительно в течение курса лечения оба соединения вводят в пределах указанного периода от 3 до 6 последовательных дней с последующим введением только одного соединения В 2 в течение от 1 до 4 последовательных дней. Предпочтительно в течение курса лечения оба соединения вводят в пределах указанного периода 5 последовательных дней с последующим введением только одного соединения В 2 в течение 2 последовательных дней. Предпочтительно в течение курса лечения оба соединения вводят в пределах указанного периода 2 последовательных дня с последующим введением только одного соединения В 2 в течение от 3 до 7 последовательных дней. Дополнительно в отношении указанного периода введения предпочтительно в течение курса лечения соединение А 2 и соединение В 2 будут вводиться в пределах указанного периода в течение от 1 до 3 дней из 7-дневного промежутка времени, а в другие дни 7-дневного промежутка времени вводят только одно соединение А 2. Предпочтительно данный 7-дневный протокол повторяется в течение 2 циклов или в течение 14 дней, предпочтительно в течение 4 циклов или 28 дней, предпочтительно на протяжении постоянного введения. Предпочтительно в течение курса лечения соединение А 2 и соединение В 2 будут вводиться в пределах указанного периода в течение от 1 до 3 дней из 7-дневного промежутка времени, а в другие дни 7 дневного промежутка времени вводят только одно соединение В 2. Предпочтительно данный 7-дневный протокол повторяется в течение 2 циклов или в течение 14 дней, предпочтительно в течение 4 циклов или 28 дней, предпочтительно на протяжении постоянного введения. Предпочтительно в течение курса лечения соединение А 2 и соединение В 2 будут вводиться в пределах указанного периода в течение 3 дней из 7-дневного промежутка времени, а в другие дни 7-дневного промежутка времени вводят только одно соединение А 2. Предпочтительно данный 7-дневный протокол повторяется в течение 2 циклов или в течение 14 дней, предпочтительно в течение 4 циклов или 28 дней,предпочтительно на протяжении постоянного введения. Предпочтительно в течение курса лечения соединение А 2 и соединение В 2 будут вводиться в пределах указанного периода в течение 3 дней из 7-дневного промежутка времени, а в другие дни 7-дневного промежутка времени вводят только одно соединение В 2. Предпочтительно данный 7-дневный протокол повторяется в течение 2 циклов или в течение 14 дней, предпочтительно в течение 4 циклов или 28 дней,предпочтительно на протяжении постоянного введения. Предпочтительно в течение курса лечения соединение А 2 и соединение В 2 будут вводиться в пределах указанного периода в течение 2 дней из 7-дневного промежутка времени, а в другие дни 7-дневного промежутка времени вводят только одно соединение А 2. Предпочтительно данный 7-дневный протокол повторяется в течение 2 циклов или в течение 14 дней, предпочтительно в течение 4 циклов или 28 дней,предпочтительно на протяжении постоянного введения. Предпочтительно в течение курса лечения соединение А 2 и соединение В 2 будут вводиться в пределах указанного периода в течение 2 дней из 7-дневного промежутка времени, а в другие дни 7-дневного промежутка времени вводят только одно соединение В 2. Предпочтительно данный 7-дневный протокол повторяется в течение 2 циклов или в течение 14 дней, предпочтительно в течение 4 циклов или 28 дней,предпочтительно на протяжении постоянного введения. Предпочтительно в течение курса лечения соединение А 2 и соединение В 2 будут вводиться в пределах указанного периода в течение 1 дня из 7-дневного промежутка времени, а в другие дни 7-дневного промежутка времени вводят только одно соединение А 2. Предпочтительно данный 7-дневный протокол повторяется в течение 2 циклов или в течение 14 дней, предпочтительно в течение 4 циклов или 28 дней,предпочтительно на протяжении постоянного введения. Предпочтительно в течение курса лечения соединение А 2 и соединение В 2 будут вводиться в пределах указанного периода в течение 1 дня из 7-дневного промежутка времени, а в другие дни 7-дневного промежутка времени вводят только одно соединение В 2. Предпочтительно данный 7-дневный протокол повторяется в течение 2 циклов или в течение 14 дней, предпочтительно в течение 4 циклов или 28 дней,предпочтительно на протяжении постоянного введения. Предпочтительно в течение курса лечения соединение А 2 и соединение В 2 будут вводиться в пределах указанного периода в течение от 1 до 5 дней из 14-дневного промежутка времени, а в другие дни 14 дневного промежутка времени будет вводиться только одно соединение А 2. Предпочтительно данный 14 дневный протокол повторяется в течение 2 циклов или в течение 28 дней, предпочтительно на протяжении постоянного введения. Предпочтительно в течение курса лечения соединение А и соединение В будут вводиться в пределах указанного периода в течение от 1 до 5 дней из 14-дневного промежутка времени, а в другие дни 14 дневного промежутка времени будет вводиться только одно соединение В 2. Предпочтительно данный 14 дневный протокол повторяется в течение 2 циклов или в течение 28 дней, предпочтительно на протяжении постоянного введения. Предпочтительно, если соединения не вводятся в течение указанного периода, они вводятся последовательно. Под термином последовательное введение и его производными, используемыми в данном описании, понимают то, что одно из соединения А 2 и соединения В 2 вводится один раз в день в течение двух или более последовательных дней и затем вводится один раз в день другое из соединения А 2 и соединения В 2 в течение двух и более последовательных дней. Также рассматривается перерыв в приеме лекарственного средства, осуществляемый между последовательным введением одного из соединения А 2 и соединения В 2 и другого из соединения А 2 и соединения В 2. Под термином перерыв в приеме лекарственного средства, используемым в описании, понимают интервал времени в несколько дней после последовательного введения одного из соединения А 2 и соединения В 2 и перед введением другого из соединения А 2 и соединения В 2, когда не вводится ни соединение А 2, ни соединения В 2. Предпочтительно перерыв в приеме лекарственного средства будет составлять интервал времени в несколько дней, выбираемый из следующих: 1 день, 2 дня, 3 дня, 4 дня, 5 дней, 6 дней, 7 дней, 8 дней, 9 дней, 10 дней, 11 дней,12 дней, 13 дней и 14 дней. Предпочтительно, если соединения не вводятся в течение указанного периода, они вводятся последовательно. Под термином последовательное введение и его производными, используемыми в описании, понимают, что одно из соединения А 2 и соединения В 2 вводят в течение одного или более последовательных дней и затем вводят в течение одного или более последовательных дней другое из соединения А 2 и соединения В 2. Также рассматривается перерыв в приеме лекарственного средства, осуществляемый между последовательным введением одного из соединения А 2 и соединения В 2 и другого из соединения А 2 и соединения В 2. Под термином перерыв в приеме лекарственного средства, используемым в описании, понимают интервал времени в несколько дней после последовательного введения одного из соединения А 2 и соединения В и перед введением другого из соединения А 2 и соединения В 2, когда не вводится ни соединение А 2, ни соединения В 2. Предпочтительно перерыв в приеме лекарственного средства будет состав- 11021951 лять интервал времени в несколько дней, выбираемый из следующих: 1 день, 2 дня, 3 дня, 4 дня, 5 дней,6 дней, 7 дней, 8 дней, 9 дней, 10 дней, 11 дней, 12 дней, 13 дней и 14 дней. Что касается последовательного введения, предпочтительно одно из соединения А 2 и соединения В 2 вводится в течение от 2 до 30 последовательных дней с последующим необязательным перерывом в приеме лекарственного средства, за которым следует введение другого из соединения А 2 и соединения В 2 в течение от 2 до 30 последовательных дней. Предпочтительно одно из соединения А 2 и соединения В 2 вводится в течение от 2 до 21 последовательного дня с последующим необязательным перерывом в приеме лекарственного средства, за которым следует введение другого из соединения А 2 и соединения В 2 в течение от 2 до 21 последовательного дня. Предпочтительно одно из соединения А 2 и соединения В 2 вводится в течение от 2 до 14 последовательных дней с последующим перерывом в приеме лекарственного средства от 1 до 14 дней, за которым следует введение другого из соединения А 2 и соединения В 2 в течение от 2 до 14 последовательных дней. Предпочтительно одно из соединения А 2 и соединения В 2 вводится в течение от 3 до 7 последовательных дней с последующим перерывом в приеме лекарственного средства от 3 до 10 дней, за которым следует введение другого из соединения А 2 и соединения В 2 в течение от 3 до 7 последовательных дней. Предпочтительно одно из соединения А 2 и соединения В 2 вводится в течение от 1 до 30 последовательных дней с последующим необязательным перерывом в приеме лекарственного средства, за которым следует введение другого из соединения А 2 и соединения В 2 в течение от 1 до 30 последовательных дней. Предпочтительно одно из соединения А 2 и соединения В 2 вводится в течение от 1 до 21 последовательного дня с последующим необязательным перерывом в приеме лекарственного средства, за которым следует введение другого из соединения А 2 и соединения В 2 в течение от 1 до 21 последовательного дня. Предпочтительно одно из соединения А 2 и соединения В 2 вводится в течение от 1 до 14 последовательных дней с последующим перерывом в приеме лекарственного средства от 1 до 14 дней, за которым следует введение другого из соединения А 2 и соединения В 2 в течение от 1 до 14 последовательных дней. Предпочтительно одно из соединения А 2 и соединения В 2 вводится в течение от 2 до 7 последовательных дней с последующим перерывом в приеме лекарственного средства от 2 до 10 дней, за которым следует введение другого из соединения А 2 и соединения В 2 в течение от 2 до 7 последовательных дней. Предпочтительно соединение В 2 вводится первым в последовательности с последующим необязательным перерывом в приеме лекарственного средства, за которым следует введение соединения А 2. Предпочтительно соединение В 2 вводится в течение от 3 до 21 последовательного дня с последующим необязательным перерывом в приеме лекарственного средства, за которым следует введение соединения А 2 в течение от 3 до 21 последовательного дня. Предпочтительно соединение В 2 вводится в течение от 3 до 21 последовательного дня с последующим перерывом в приеме лекарственного средства от 1 до 14 дней, за которым следует введение соединения А 2 в течение от 3 до 21 последовательного дня. Предпочтительно соединение В 2 вводится в течение от 3 до 21 последовательного дня с последующим перерывом в приеме лекарственного средства от 3 до 14 дней, за которым следует введение соединения А 2 в течение от 3 до 21 последовательного дня. Предпочтительно соединение В 2 вводится в течение 21 последовательного дня с последующим необязательным перерывом в приеме лекарственного средства, за которым следует введение соединения А 2 в течение 14 последовательных дней. Предпочтительно соединение В 2 вводится в течение 14 последовательных дней с последующим перерывом в приеме лекарственного средства от 1 до 14 дней, за которым следует введение соединения А 2 в течение 14 последовательных дней. Предпочтительно соединение В 2 вводится в течение 7 последовательных дней с последующим перерывом в приеме лекарственного средства от 3 до 10 дней, за которым следует введение соединения А 2 в течение 7 последовательных дней. Предпочтительно соединение В 2 вводится в течение 3 последовательных дней с последующим перерывом в приеме лекарственного средства от 3 до 14 дней, за которым следует введение соединения А 2 в течение 7 последовательных дней. Предпочтительно соединение В 2 вводится в течение 3 последовательных дней с последующим перерывом в приеме лекарственного средства от 3 до 10 дней, за которым следует введение соединения А 2 в течение 3 последовательных дней. Предпочтительно соединение В 2 вводится первым в последовательности с последующим необязательным перерывом в приеме лекарственного средства, за которым следует введение соединения А 2. Предпочтительно соединение В 2 вводится в течение от 1 до 21 последовательного дня с последующим необязательным перерывом в приеме лекарственного средства, за которым следует введение соединения А 2 в течение от 1 до 21 последовательного дня. Предпочтительно соединение В 2 вводится в течение от 3 до 21 последовательного дня с последующим перерывом в приеме лекарственного средства от 1 до 14 дней, за которым следует введение соединения А 2 в течение от 3 до 21 последовательного дня. Предпочтительно соединение В 2 вводится в течение от 3 до 21 последовательного дня с последующим перерывом в приеме лекарственного средства от 3 до 14 дней, за которым следует введение соединения А 2 в течение от 3 до 21 последовательного дня. Предпочтительно соединение В 2 вводится в течение 21 последовательного дня с последующим необязательным перерывом в приеме лекарственного средства, за которым следует введение соединения А 2 в течение 14 последовательных дней. Предпочтительно соединение В 2 вводится в течение 14 последовательных дней с последующим перерывом в приеме лекарственного средства от 1 до 14 дней, за которым следует введение соединения А 2- 12021951 в течение 14 последовательных дней. Предпочтительно соединение В 2 вводится в течение 7 последовательных дней с последующим перерывом в приеме лекарственного средства от 3 до 10 дней, за которым следует введение соединения А 2 в течение 7 последовательных дней. Предпочтительно соединение В 2 вводится в течение 3 последовательных дней с последующим перерывом в приеме лекарственного средства от 3 до 14 дней, за которым следует введение соединения А 2 в течение 7 последовательных дней. Предпочтительно соединение В 2 вводится в течение 3 последовательных дней с последующим перерывом в приеме лекарственного средства от 3 до 10 дней, за которым следует введение соединения А 2 в течение 3 последовательных дней. Предпочтительно соединение А 2 вводится первым в последовательности с последующим необязательным перерывом в приеме лекарственного средства, за которым следует введение соединения В 2. Предпочтительно соединение А 2 вводится в течение от 1 до 21 последовательного дня с последующим необязательным перерывом в приеме лекарственного средства, за которым следует введение соединения В 2 в течение от 1 до 21 последовательного дня. Предпочтительно соединение А 2 вводится в течение от 3 до 21 последовательного дня с последующим перерывом в приеме лекарственного средства от 1 до 14 дней, за которым следует введение соединения В 2 в течение от 3 до 21 последовательного дня. Предпочтительно соединение А 2 вводится в течение от 3 до 21 последовательного дня с последующим перерывом в приеме лекарственного средства от 3 до 14 дней, за которым следует введение соединения В 2 в течение от 3 до 21 последовательного дня. Предпочтительно соединение А 2 вводится в течение 21 последовательного дня с последующим необязательным перерывом в приеме лекарственного средства, за которым следует введение соединения В 2 в течение 14 последовательных дней. Предпочтительно соединение А 2 вводится в течение 14 последовательных дней с последующим перерывом в приеме лекарственного средства от 1 до 14 дней, за которым следует введение соединения В 2 в течение 14 последовательных дней. Предпочтительно соединение А 2 вводится в течение 7 последовательных дней с последующим перерывом в приеме лекарственного средства от 3 до 10 дней, за которым следует введение соединения В 2 в течение 7 последовательных дней. Предпочтительно соединение А 2 вводится в течение 3 последовательных дней с последующим перерывом в приеме лекарственного средства от 3 до 14 дней, за которым следует введение соединения В 2 в течение 7 последовательных дней. Предпочтительно соединение А 2 вводится в течение 3 последовательных дней с последующим перерывом в приеме лекарственного средства от 3 до 10 дней, за которым следует введение соединения В 2 в течение 3 последовательных дней. Предпочтительно соединение А 2 вводится в течение 7 последовательных дней, за которым следует введение соединения В 2 в течение 1 дня. Предпочтительно соединение А 2 вводится в течение 6 последовательных дней, за которым следует введение соединения В 2 в течение 1 дня. Предпочтительно соединение В 2 вводится в течение 1 дня, за которым следует введение соединения А 2 в течение 7 последовательных дней. Предпочтительно соединение В 2 вводится в течение 1 дня, за которым следует введение соединения А 2 в течение 6 последовательных дней. Следует понимать, что после введения с указанным периодом и последовательного введения может следовать повторное дозированное введение или может применяться другой протокол дозирования и повторному дозированному введению или другому протоколу дозирования может предшествовать перерыв в приеме лекарственного средства. Предпочтительно количество соединения А 2, вводимое как часть комбинации в соответствии с настоящим изобретением, выбирают из количества от приблизительно 0,125 до приблизительно 10 мг; предпочтительно количество выбирают из количества от приблизительно 0,25 до приблизительно 9 мг; предпочтительно количество выбирают из количества от приблизительно 0,25 до приблизительно 8 мг; предпочтительно количество выбирают из количества от приблизительно 0,5 до приблизительно 8 мг; предпочтительно количество выбирают из количества от приблизительно 0,5 до приблизительно 7 мг; предпочтительно количество выбирают из количества от приблизительно 1 до приблизительно 7 мг; предпочтительно количество составляет приблизительно 5 мг. Таким образом, количество соединения А,вводимое как часть комбинации в соответствии с настоящим изобретением, выбирают из количества от приблизительно 0,125 до приблизительно 10 мг. Например, количество соединения А 2, вводимое как часть комбинации в соответствии с настоящим изобретением, может составлять 0,125, 0,25, 0,5, 0,75, 1,1,5, 2, 2,5, 3, 3,5, 4, 4,5, 5, 5,5, 6, 6,5, 7, 7,5, 8, 8,5, 9, 9,5, 10 мг. Предпочтительно выбранное количество соединения А 2 вводится дважды в день. Предпочтительно выбранное количество соединения А 2 вводится один раз в день. Предпочтительно введение соединения А 2 начинают с нагрузочной дозы. Предпочтительно нагрузочная доза превосходит поддерживающую дозу в число раз от 2 до 100, предпочтительно в число раз от 2 до 10, предпочтительно от 2 до 5 раз, предпочтительно в 2 раза, предпочтительно в 3 раза,предпочтительно в 4 раза, предпочтительно в 5 раз. Предпочтительно нагрузочная доза вводится от 1 до 7 дней, предпочтительно от 1 до 5 дней, предпочтительно от 1 до 3 дней, предпочтительно в течение 1 дня, предпочтительно в течение 2 дней, предпочтительно в течение 3 дней, после чего применяют протокол поддерживающего дозирования. Предпочтительно количество соединения В 2, вводимое как часть комбинации в соответствии с настоящим изобретением, выбирают из количества от приблизительно 5 до приблизительно 500 мг; предпочтительно количество выбирают из количества от приблизительно 25 до приблизительно 400 мг; пред- 13021951 почтительно количество выбирают из количества от приблизительно 30 до приблизительно 375 мг; предпочтительно количество выбирают из количества от приблизительно 35 до приблизительно 350 мг; предпочтительно количество выбирают из количества от приблизительно 40 до приблизительно 300 мг; предпочтительно количество выбирают из количества от приблизительно 45 до приблизительно 275 мг; предпочтительно количество выбирают из количества от приблизительно 50 до приблизительно 250 мг; предпочтительно количество выбирают из количества от приблизительно 55 до приблизительно 225 мг; предпочтительно количество выбирают из количества от приблизительно 60 до приблизительно 200 мг; предпочтительно количество выбирают из количества от приблизительно 65 до приблизительно 175 мг; предпочтительно количество выбирают из количества от приблизительно 70 до приблизительно 150 мг; предпочтительно количество выбирают из количества от приблизительно 50 до приблизительно 300 мг; предпочтительно количество выбирают из количества от приблизительно 75 до приблизительно 150 мг; предпочтительно количество составляет приблизительно 100 мг. Таким образом, количество соединения В 2,вводимое как часть комбинации в соответствии с настоящим изобретением, выбирают из количества от приблизительно 5 до приблизительно 500 мг. Например, количество соединения В 2, вводимое как часть комбинации в соответствии с настоящим изобретением, может составлять 5, 10, 15, 20, 25, 30, 35, 40, 45,50, 55, 60, 65, 70, 75, 80, 85, 90, 95, 100, 105, 1 10, 1 15, 120, 125, 130, 135, 140, 145, 150, 175, 200, 225, 250,275, 300, 325, 350, 375, 400, 425, 450, 475 или 500 мг. Предпочтительно выбранное количество соединения В 2 вводится дважды в день. Предпочтительно выбранное количество соединения В 2 вводится один раз в день. Предпочтительно введение соединения А 2 начинают с нагрузочной дозы. Предпочтительно нагрузочная доза превосходит поддерживающую дозу в число раз от 2 до 100, предпочтительно в число раз от 2 до 10, предпочтительно от 2 до 5 раз, предпочтительно в 2 раза, предпочтительно в 3 раза, предпочтительно в 4 раза, предпочтительно в 5 раз. Предпочтительно нагрузочная доза вводится от 1 до 7 дней, предпочтительно от 1 до 5 дней, предпочтительно от 1 до 3 дней, предпочтительно в течение 1 дня,предпочтительно в течение 2 дней, предпочтительно в течение 3 дней, после чего применяют протокол поддерживающего дозирования. Предпочтительно количество соединения В 2, вводимое как часть комбинации в соответствии с настоящим изобретением, выбирают из количества от приблизительно 75 до приблизительно 1000 мг; предпочтительно количество выбирают из количества от приблизительно 100 до приблизительно 900 мг; предпочтительно количество выбирают из количества от приблизительно 150 до приблизительно 850 мг; предпочтительно количество выбирают из количества от приблизительно 200 до приблизительно 800 мг; предпочтительно количество выбирают из количества от приблизительно 250 до приблизительно 750 мг; предпочтительно количество выбирают из количества от приблизительно 300 до приблизительно 6000 мг; предпочтительно количество составляет приблизительно 450 мг. Таким образом, количество соединения В 2, вводимое как часть комбинации в соответствии с настоящим изобретением, выбирают из количества от приблизительно 75 до приблизительно 1000 мг. Например, количество соединения В 2, вводимое как часть комбинации в соответствии с настоящим изобретением, может составлять 75, 100, 125, 150,175, 200, 225, 250, 275, 300, 325, 350, 375, 400, 425, 450, 475, 500, 525, 550, 575, 600, 625, 650, 675, 700,725, 750, 775, 800, 825, 850, 875, 900, 925, 950, 975 или 1000 мг. Все количества соединения А 2 и соединения В 2, указанные в описании, указываются как вводимое количество соединения в виде свободной, несолевой и несольватированной формы на дозу. Способ по изобретению может также применяться с другими способами лечения рака. В то время как возможно, что для применения в терапии терапевтически эффективные количества комбинаций по настоящему изобретению могут вводиться просто в виде активной субстанции, предпочтительно предоставлять комбинации в виде фармацевтической композиции или композиций. Таким образом, в изобретении дополнительно обеспечиваются фармацевтические композиции, которые включают соединение А 2 и/или соединение В 2 и один или несколько фармацевтически приемлемых носителей. Комбинации по настоящему изобретению являются такими, как описано выше. Носитель(и) должен быть приемлемым в том смысле, что совместим с другими компонентами состава, пригоден для осуществления процесса приготовления лекарственного состава и не наносить вред получающему его пациенту. В соответствии с другим аспектом изобретения также обеспечивается способ получения фармацевтического состава, включающий смешивание соединения А 2 и/или соединения В 2 с одним или несколькими фармацевтически приемлемыми носителями. Как указано ранее, такие компоненты используемой фармацевтической комбинации могут быть представлены в виде раздельных фармацевтических композиций или составлены вместе в один фармацевтический состав. Фармацевтические составы могут быть составлены в виде лекарственных форм для однократного введения, содержащих заданное количество активного ингредиента в разовой дозе. Как известно специалистам в данной области, количество активного компонента на дозу будет зависеть от условий проводимой терапии, пути введения и возраста, массы и состояния пациента. Предпочтительные дозированные составы для однократного введения представляют собой составы, содержащие суточную дозу или часть дозы или соответствующую ее часть активного компонента. Кроме того, такие фармацевтические составы могут быть получены любым способом, известным в фармацевтике. Соединение А 2 и соединение В 2 могут вводиться любым подходящим способом. Подходящие пути введения включают пероральное, ректальное, назальное, местное (включая буккальное и сублингвальное), вагинальное и парентеральное (включая подкожное, внутримышечное, внутривенное, внутрикожное, интратекальное и эпидуральное). Следует принимать во внимание, что предпочтительный путь введения может варьировать в зависимости, например, от состояния получающего комбинацию и подвергаемого лечению злокачественного новообразования. Следует также принимать во внимание, что каждый из вводимых агентов может вводиться одним и тем же или различными путями и что соединение А 2 и соединение В 2 могут быть смешаны вместе в фармацевтической композиции/составе. Предпочтительно соединение А 2 и соединение В 2 вводятся в раздельных пероральных фармацевтических композициях. Соединения или комбинации по настоящему изобретению включаются в удобные лекарственные формы, такие как капсулы, таблетки или препараты для инъекций. Применяются твердые или жидкие фармацевтические носители. Твердые носители включают крахмал, лактозу, дигидрат сульфата кальция,terra alba, сахарозу, тальк, желатин, агар, пектин, гуммиарабик, стеарат магния и стеариновую кислоту. Жидкие носители включают сироп, арахисовое масло, оливковое масло, солевой раствор и воду. Аналогичным образом, носитель может включать вещество для обеспечения пролонгированного высвобождения, такое как глицерилмоностеарат или глицерилдистеарат, один или вместе с воском. Количество твердого носителя варьирует широко, но предпочтительно составляет от приблизительно 25 мг до приблизительно 1 г на единицу дозирования. Когда используется жидкий носитель, препарат предпочтительно обеспечивается в виде сиропа, эликсира, эмульсии, мягких желатиновых капсул, стерильной жидкости для инъекций, как, например, в ампуле или водной и неводной жидкой суспензии. Например, для перорального введения в виде таблетки или капсулы активный лекарственный компонент может быть объединен с нетоксичным фармацевтически приемлемым инертным носителем для перорального введения, таким как этанол, глицерин, вода и тому подобное. Порошки получают путем измельчения соединения до подходящего мелкого размера и смешивания с аналогичным образом измельченным фармацевтическим носителем, таким как годный для употребления в пищу углевод, как,например, крахмал или маннит. Также может присутствовать ароматизатор, консервант, диспергирующий агент и краситель. Следует понимать, что кроме упомянутых ранее компонентов составы могут содержать другие агенты, традиционно применяемые в данной области для соответствующего типа лекарственной формы,например, агенты, подходящие для перорального введения, могут включать ароматизаторы. Как здесь указано, человеку вводятся терапевтически эффективные количества комбинаций по изобретению (соединение А 2 в комбинации с соединением В 2). Обычно терапевтически эффективное количество вводимых агентов по настоящему изобретению будет зависеть от ряда факторов, включая, например, возраст и массу субъекта, конкретного состояния, подвергаемого лечению, тяжести состояния, характера состава и пути введения. И наконец, терапевтически эффективное количество будет зависеть от осторожности лечащего врача. Комбинации по настоящему изобретению тестируются на эффективность, полезные и синергические свойства по известным методикам. Предпочтительно комбинации по изобретению тестируются на эффективность, полезные и синергические свойства в целом в соответствии со следующими объединенными анализами пролиферации клеток. Клетки высевают в 384-луночные планшеты при 500 клеток/лунку в культуральной среде, соответствующей каждому типу клеток, дополненной 10% FBS и 1% пенициллина/стрептомицина, и инкубируют в течение ночи при 37 С, 5% CO2. Клетки обрабатывают по сетке разбавленным раствором соединения А 2 (20 разведений, включая отсутствие соединения, путем двукратного разведения, начиная с 1-20 мкМ в зависимости от соединения) слева направо на 384-луночном планшете, а также обрабатывают соединением В 2 (20 разведений, включая отсутствие соединения, путем двукратного разведения, начиная с 1-20 мкМ в зависимости от соединения) сверху вниз на 384-луночном планшете и инкубируют, как описано выше, еще в течение 72 ч. В некоторых случаях соединения добавляют в шахматном порядке, и время инкубирования может быть увеличено до 7 дней. Рост клеток определяют с помощью реагентаCellTiter-Glo, следуя протоколу производителя, и сигнал измеряют с помощью аппарата для считывания планшетов PerkinElmer Envision для визуализации флуоресценции с интервалом 0,5 с. Данные анализируют, как описано далее. Результаты выражают как процентную величину от значения при t=0 и строят график зависимости от концентрации соединения(ий). Значение t=0 приводится к 100% и отражает количество клеток, присутствующее в момент добавления соединения. Клеточный ответ определяют для каждого соединения и/или комбинации соединений, используя 4- или 6-параметрический подбор кривой зависимости жизнеспособности клеток от концентрации с помощью пакета IDBS XLfit для программного обеспечения Microsoft Excel и определяют концентрацию, необходимую для 50% ингибирования роста клеток (gIC50). Корректировку сигнал/шум осуществляют путем вычитания значений, полученных в случае лунок, не содержащих клетки. Для каждой лекарственной комбинации вычисляют индекс комбинации (Combination Index, CI), превышение по сравнению с лучшим одиночным агентом (Excess Over Highest SingleAgent, EOHSA) и превышение над предсказанным значением в модели Блисса (Excess Over Bliss,- 15021951Regulation, 22, 37-55) и Berenbaum M.C. (1981, Adv. Cancer Research, 35, 269-335). Ингибирование in vitro соединением А, соединением В и их комбинацией клеточного роста на линиях опухолевых клеток Методы Исследования на линиях клеток рака молочной железы Линии клеток и условия роста Линии клеток опухоли молочной железы человека, ВТ-474, НСС 1419, НСС 1937, НСС 1954,НСС 202, KPL-1, MDA-MB-157, MDA-MB-175-VII, MDA-MB-361, MDA-MB-453, SK-BR-3, SUM225PE,UACC893 и ZR-75-1; линия клеток опухоли легкого, CALU-3 и линия клеток меланомы, CHL-1, были получены из Американской коллекции типовых культур (АТСС). Линия клеток опухоли молочной железы человека JIMT-1 была получена из Европейской коллекции клеточных культур (UK). Линии клеток опухоли молочной железы человека SUM149PT, SUM190PT и SUM52PE были получены от Asterand. Данные клеточные линии выращивали в среде RPMI 1640, содержащей 10% эмбриональной бычьей сыворотки (FBS). Линию клеток опухоли головы и шеи, LICR LON HN5 (HN5), подаренную Институтом исследований злокачественных опухолей (Institute of Cancer Research, Сюррей, Великобритания), выращивали в модифицированной по Дульбекко среде Игла (DMEM), содержащей 5% FBS; линия клеток опухоли молочной железы KPL-4 была любезно предоставлена доктором Юничи Куребаяши (Dr JunichiKurebayashi, Медицинская школа Кавасаки, Окаяма, Япония) и культивировалась в среде DMEM, содержащей 5% FBS. Линия клеток JIMT-1 была взята у пациента с клинической резистентностью к трастузумабу (Герцетин). BT-474-J4 представляет собой клон одной клетки, полученный из пула ВТ-474 клеток, которые выращивали с лапитинибом с концентрацией до 3 мкМ. Анализ ингибирования клеточного роста и анализ данных по комбинации Все клетки до посева культивировали не менее 72 ч. Клетки исследовали в 96-луночном планшете для тканевых культур (NUNC 136102) со средой RPMI, содержащей 10% FBS, для всех клеток при 2000 клеток/лунку, за исключением KPL-4 и HN5, которые высевали на среду DMEM, содержащую 5% FBS,при 500 клеток/лунку. Приблизительно через 24 ч после высевания клетки подвергали воздействию десяти двукратных или трехкратных серийных разведений соединения или комбинации двух агентов с постоянным мольным отношением соединения А к соединению В 1:1 в среде RPMI, содержащей 10% FBS,или DMEM, содержащей 5% FBS. Клетки инкубировали в присутствии соединений в течение 3 дней. Уровень АТФ определяли при добавлении Cell Titer Glo (Promega), следуя инструкции производителя. Вкратце, Cell Titer Glo вносили в каждую лунку, инкубировали в течение 20 мин, а затем измеряли интенсивность флуоресценции с помощью аппарата для считывания планшетов с временем интегрирования 0,5 с. Оценивали ингибирование клеточного роста в течение трех дней после обработки соединением или комбинацией соединений и сравнивали сигнал с сигналом от клеток, которые обрабатывали носителем(ДМСО). Клеточный рост рассчитывали относительно контрольных лунок, обработанных носителем(ДМСО). Концентрацию соединения, при которой подавляется 50% контролируемого клеточного роста(IC50), определяли интерполяцией с помощью метода нелинейной регрессии с использованием уравнения где А является минимальным ответом (ymin), В является максимальным ответом (ymax), С является точкой перегиба кривой (ЕС 50) и D - коэффициентом Хилла. Влияние комбинирования на активность оценивали с помощью индекса комбинации (CI), который вычисляли с помощью полученных обратной интерполяцией значений IC50 и уравнения по Chou и Talalay для случая взаимно не исключающих агентов (1) где IC50(а) равно IC50 для соединения A; IC50(b) равно IC50 для соединения В; Da равно концентрации соединения А в комбинации с соединением В, которая дает 50% ингибирование роста клеток; и Db равно концентрации соединения В в комбинации с соединением А, которая дает 50% ингибирование роста клеток. В общем, величина CI0,9, между 0,9 и 1,1 или 1,1 означает синергизм, аддитивный эффект и антагонизм соответственно. Обычно, чем меньше число CI, тем больше синергический эффект. Влияние комбинирования на величину ответа количественно определяли с помощью модели, позволяющей оценить превышение по сравнению с лучшим одиночным агентом (Excess Over Highest SingleAgent, EOHSA), основанной на концепции нелинейного смешивания, описанной детально у Peterson иNovick (2007) и Peterson (2010) [(2; 3) [Peterson and Novick, 2007; Peterson, 2010]. Величины EOHSA определяли как более значительное улучшение (здесь разница в процентных пунктах (п.п., вызванное комбинацией, по сравнению с лучшим одиночным агентом при его составляющей дозе для комбинации. В случае воздействия одиночным агентом и комбинацией клетки обрабатывали соединениями с фиксированным соотношением доз и для экспериментальных данных подбирали кривые доза-эффект и анализировали с помощью регрессионных моделей. Для получения статистических выводов по EOHSA по установленным уровням суммарных доз IC50 в соответствии с кривой доза-эффект определяли комбинацию доз (соответствующую IC50). Конкретно, в случае эксперимента с комбинацией лекарственных средств, содержащей лекарственное средство 1 в дозе d1 и лекарственное средство 2 в дозе d2 (то есть суммарная доза равна d1+d2), говорят о положительном EOHSA, если средний ответ в случае комбинации больше, чем средний ответ в случае лекарственного средства 1 в дозе d1 и лекарственного средства 2 в дозе d2. Результаты исследования линий клеток опухоли молочной железы представлены в табл. 1 и на фиг. 1 далее. Исследование пролиферации на линиях клеток толстой кишки, легкого и поджелудочной железы В отдельном исследовании с соединениями А и В проводили тестирование комбинированного лекарственного средства, используя панель клеточных линий рака толстой кишки человека (n=26), рака легкого (n=15) и рака поджелудочной железы (n=6). Линии клеток были получены от коммерческих поставщиков (АТСС и DSMZ). Линии клеток выращивали в среде RPMI-1640, содержащей 2 мМ глутамина, 1 мМ пирувата натрия и 10% эмбриональной бычьей сыворотки (за исключением Capan-1 и HuP-Т 4,которые растили в присутствии 20% эмбриональной бычьей сыворотки), и поддерживали в инкубаторе с влажным воздухом при 37 С и 5% СО 2. Анализы проводили в 384-луночном титрационном микропланшете с оптимальной для каждой линии клеток плотностью при посеве. Готовили 10 мМ базовые растворы тестируемых соединений в 100% ДМСО. Проводили дополнительные разведения соединений в ДМСО. В отдельном 96-луночном титрационном микропланшете разбавляли соединение А по горизонтали в рядах D-G, используя серию 3-кратных разведений, для 10 точек разведений. Соединение В аналогичным образом разбавляли по горизонтали в 96-луночном титрационном микропланшете в рядах В-Е, используя серию 3-кратных разведений для 10 точек разведений. Два соединения смешивали, используя равные объемы из каждого планшета с лекарственным веществом, в культуральной среде. В результате получали разведение лекарственных веществ 1:50. Соединение А и соединение В раститровывали каждое в отдельности по рядам В и С (для соединения В) и рядам F и G (для соединения А) объединенного планшета с лекарственными веществами. Разведение 1:10 лекарственных веществ проводили в культуральной среде до добавления к клеткам. Добавление лекарственного вещества к клеткам приводило к дополнительному разведению 1:2 лекарственных веществ с итоговым разведением 1:1000. Конечный концентрационный диапазон для тестируемых соединений составлял 250-0,013 нМ для соединения А и 1000-0,5 нМ для соединения В. Положительный контроль состоял из культуральной среды с ДМСО с концентрацией 0,1% и клеток. Отрицательный контроль состоял из культуральной среды с ДМСО с концентрацией 0,1%. Линии клеток инкубировали при 37 С, 5% СО 2 во влажной атмосфере в течение 72 ч. Пролиферацию клеток измеряли, используя реагент CellTiter Glo (Promega), следуя протоколу производителя. Планшеты обрабатывали раствором с CellTiter Glo и анализировали, измеряя ОСЕ(относительные световые единицы), с помощью аппарата для считывания планшетов SpectraMax M5 фирмы Molecular Devices. Анализ данных Для анализа сочетанного действия соединения В и соединения А в отношении ингибирования роста клеток было использовано три независимых параметра. Чтобы получить значения gIC50, были использованы значения интенсивности в процентах для расчета с помощью модели 205 пакета XLfit (IDBS, Inc.) для Microsoft Excel с использованием 4 параметрической подгонки логистической кривой. Средняя точка в полученном диапазоне роста клеток(gIC50) оказывается на половине пути между количеством клеток в момент добавления соединения (Т=0) и ростом клеток в контроле, обработанном только ДМСО, через 72 ч. Делят значение интенсивности нижней части кривой ответа (Ymin) на количество клеток в нулевой момент времени (Т 0), чтобы получить показатель гибели клеток (Ymin/T0). Величина меньше 1 для Ymin/T0 указывает на более высокую активность в индуцировании гибели клеток в результате обработки по сравнению с более высокими значениями. 1. Превышение по сравнению с лучшим одиночным агентом (EOHSA) - показатель рассчитывали,как описано выше (Borisy et al., 2003; FDA 21 CFR 300.50). 2. Синергизм по Блиссу (Bliss synergy) - второй критерий, часто используемый для определения синергизма при комбинировании, представляет собой оценку превышения показателя ингибирования над предсказанным в модели независимости Блисса или аддитивности (Bliss and Mexico, 1939). В модели исходят из предположения, что комбинированный эффект двух независимо действующих соединений описывается следующим образом: где Ea относится к эффекту (или ингибированию в процентах) соединения А и Eb относится к эффекту соединения В. Конечный эффект комбинации двух соединений сравнивают с их предсказанной аддитивностью по Блиссу и получают оценочное значение синергизма для каждой дозы вдоль кривой доза-эффект. 3. Индекс комбинации (CI) - третьим критерием, традиционно применяемым для оценки синергизма, является индекс комбинации (CI), определяемый по Chou и Talalay (1984). Следующее уравнение является моделью, используемой для соединений, которые имеют различные механизмы действия (формула для взаимно не исключающих агентов). Расчет осуществляли, как описано выше. В случае оценки с помощью модели EOHSA и Синергии по Блиссу получают оценочное значение для каждой дозы вдоль кривой зависимости эффекта. Данные оценочные значения отражают количество в процентах, на которое происходит превышение над лучшим агентом (EOHSA), или количество в процентах, превышающее аддитивность по Блиссу, на основании чего происходит интерпретация показателей. Устанавливают оценочные значения по всей дозовой кривой и все комбинации, которые показывают высокие оценочные значения (10) в диапазоне терапевтических концентраций в двух повторах, считают синергическими. Чем больше оценочное значение, тем больше эффект комбинирования двух соединений. В случае индекса комбинации, чем меньше значение CI, тем большую степень синергизма демонстрирует комбинация. Для всех линий клеток, у которых никогда не достигалась концентрация ингибирования 25% для 1 из соединений в комбинации, значение CI не может быть рассчитано, и в табл. 4, 7 и 10 значения для CI не указываются. Субпопуляцию линий клеток анализировали в двух повторах (толстой кишки: n=4; легкого: n=13; поджелудочной железы: n=3). Для всех последующих анализов данные для указанных клеток усредняли. Данные по мутациям линий клеток Данные по мутации сопоставляли для определения статуса генов, ответственных за развитие выбранного злокачественного новообразования. В качестве источника данных служили данные по скринингу мутаций линий раковых клеток, опубликованные как часть Каталога по соматическим мутациям в базе данных по злокачественным образованием (Catalog of Somatic Mutations in Cancer database, COSMIC,Bamford S. et al., Br. J. Cancer. 2004. 91: 355-58). Чтобы удостовериться, что идентичность линий клеток,применяемых в тесте на пролиферацию, соответствует представленной в базе данных COSMIC, было проведено сравнение генотипа между данными линиями клеток в тесте на чувствительность и представленными в COSMIC. Конкретно, это охватывает 1. Расчет генотипов для каждой линии клеток с помощью Affymetrix 500K SNP Chip (Affymetrix,Inc., Саннивейл, Калифорния) и алгоритма RLMM (RabbeeSpeed, Bioinformatics, 2006. 22: 7-12). 2. Идентификация сходства генотипа каждой линии клеток с предварительно рассчитанным генотипом для каждой линии на основе мутационных профилей в COSMIC. 3. Определение мутационного статуса для каждой линии клеток на основе сходства генотипа. Результаты Панель клеток рака молочной железы, меланомы, головы и шеи и легкого Эффект ингибирования клеточного роста посредством ингибитора митогенактивированной протеин/ERK-киназы (MEK) соединения А, AKT-ингибитора - соединения В и их комбинации определяли с помощью панели линий клеток опухолей человека. Средние значения IC50 (по меньшей мере из двух независимых экспериментов) и эффекты комбинирования IC50 суммированы в табл. 1. Репрезентативные кривые зависимости доза-эффект для линий клеток MDA-MB-175-VII, BT-474-J4 и JIMT-1 представлены на фиг. 1. Субпопуляция линий клеток рака молочной железы, включая линии с амплификацией генаPIK3CA, MDA-MB-361 с мутацией E545K в гене PIK3CA и SUM225PE с PIK3CA дикого типа; и линии без-HER2+ ZR-75-1, SUM52PE и MDA-MB-175-VII, была чувствительной к одиночному агенту соединению В с IC501 мкМ. С другой стороны, линии опухоли молочной железы MDA-MB-175-VII иSUM149PT, линия опухоли головы и шеи HN5, линия опухоли легкого Calu3 и линия меланомы CHL-1 обнаруживали чувствительность к одиночному агенту соединению А (IC501 мкМ). Однако все линии клеток, показанные в табл. 1, были более чувствительны к комбинации соединения А и соединения В, на что указывало снижение в их случае величины IC50, изменяющееся от 0,01 до 0,76 мкМ. Комбинация соединения А и соединения В показывала большее ингибирование клеточного роста, чем только один лучший одиночный агент, что демонстрировалось величинами EOHSA, равными 8-39 п.п. в случае всех линий (табл. 1), и синергизмом с величиной индекса комбинации (CI), равной 0,34 в случае MDA-MB175-VII - линии, чувствительной как к соединению А, так и соединению В (фиг. 1-А). BT-474-J4, полученная от родительской линии ВТ-474, которая демонстрировала повышенный уровень резистентности к лапатинибу, показала повышенную чувствительность к соединению В как одиночному агенту(IC50=0,271 мкМ) по сравнению с родительскими клетками ВТ-474 (IC501 мкМ). Для комбинации соединения А и соединения В было продемонстрировано преимущество повышения ингибирования клеточного роста в случае BT-474-J4 с величиной EOSHA, равной 25 п.п. (фиг. 1-В). Линия клеток JIMT-1,полученная у пациента с развившейся резистентностью к трастузумабу, была нечувствительной как к соединению А, так и соединению В, в качестве одиночных агентов. Комбинирование соединения А и соединения В было благоприятным в случае клеток JIMT-1 с величиной EOSHA, равной 27 п.п. (фиг. 1- 18021951 С). Панель линии клеток толстой кишки, легкого и поджелудочной железы Эффект ингибирования клеточного роста посредством ингибитора митогенактивированной протеин/ERK-киназы (MEK) - соединения А, AKT-ингибитора - соединения В, и их комбинации определяли с помощью панели линий клеток толстой кишки (n=26), легкого (n=15) и поджелудочной железы (n=6). Обобщение результатов представлено в табл. 2 и 3. В случае злокачественных образований толстой кишки по меньшей мере для одного параметра показан синергизм для 77% (20/26). Кроме того, все линии клеток рака толстой кишки (26/26) демонстрировали повышение гибели клеток (что определяли по изменению Ymin сверх лучшего одиночного агента); в то время как 7/26 (27%) показывали увеличение больше 20%. Для линий легкого наблюдали высокую степень синергизма, где 11/15 (73%) показывали синергизм по меньшей мере для одного параметра. Всего 7/15 (47%) линий клеток показывали повышение клеточной гибели больше 20%. Линии клеток поджелудочной железы также показывали синергическое ингибирование роста, где 4/6 (67%) демонстрировали синергизм в случае по меньшей мере одного-единственного параметра. Аналогичным образом, 4/6 (67%) демонстрировали повышение клеточной гибели больше 20% сверх лучшего одиночного агента. Таблица 1. Ингибирование клеточного роста соединением А, соединением В и их комбинацией у линий клеток опухолей человека Кривые зависимости доза-эффект ингибирования клеточного роста для MDA-MB-175-VII, BT474J4 и JIMT-1 представлены на фиг. 1 ниже. Список ссылок Таблица 2. Панель линий клеток поджелудочной железы (n=6), толстой кишки (n=26) и легкого (n=15) и мутационный статус, используемые для исследования комбинирования Линия клеток = название линии клеток. Орган = орган, из которого происходят клетки. Диагноз/гистология = морфологический диагноз ткани. Таблица 3. Ингибирование клеточного роста соединением А, соединением В и их комбинацией у линий клеток толстой кишки, легкого и поджелудочной железы. Величины gIC50 представлены в нМYmin (%) = процент минимального клеточного роста в присутствии соединения В (относительно контроля с ДМСО), определяемый как % от роста при Т=0 (число клеток в момент добавления соединения В). Отрицательное число указывает на уменьшение количества клеток относительно количества в момент Т=0.Ymin/T0 - Ymin, деленное на количество клеток в нулевой момент времени.EOHSA = определение превышения по сравнению с лучшим одиночным агентом.BLISS = определение синергизма по Блиссу. Индекс комб.: оценочное значение индекса комбинации. Воздействие соединения В (AKT-ингибитор) в комбинации с соединением А (MEK-ингибитор) на рост ксенотрансплантатов опухолей поджелудочной железы человека (НРАС и Capan-2) у мышей SCID Метод Самкам мышей SCID подкожно прививали клетки опухоли НРАС или Capan-2 (карцинома поджелудочной железы человека, несущая мутантный ген KRAS). Когда объем опухоли достигал приблизительно 150 мм 3, методом блочной рандомизации мышей разделяли на группы с различным лечением(n=8 мышей/группа). Мыши получали AKT-ингибитор, соединение В, в дозе 10 или 30 мг/кг один раз в день (QD). MEK-ингибитор, соединение А, вводили в дозе 0,1, 0,3 и 1,0 мг/кг один раз в день (QD) одно или в дозе 0,1 и 0,3 мг/кг один раз в день в комбинации с AKT-ингибитором. Мышей взвешивали и опухоли измеряли дважды в неделю с помощью кронциркуля. Лечение осуществляли до момента, когда объем опухоли достигал больше 1000 мм 3. Объемы опухолей рассчитывали с помощью следующей формулы: Объем опухоли = (длинаширина 2)/2. Процент ингибирования роста опухоли рассчитывали в каждый день измерения опухоли с помощью следующей формулы: 100[1-(среднее значения роста опухоли,подвергаемой лечению соединением/среднее значение роста опухоли в контроле, на которую воздействовали носителем)]. Данные представляли в виде среднегостандартная ошибка среднего для объема опухоли в каждой группе. Результаты Лечение мышей с опухолями НРАС с помощью соединения В показало минимальное ингибирование (11-15%) в группе с дозой 10 мг/кг и умеренное ингибирование (31-40%) в группе с дозой 30 мг/кг в двух независимых исследованиях. Монотерапия соединением А показала дозозависимое ингибирование роста опухоли НРАС приблизительно 40, 60 и 90% ингибирование роста при дозе 0,1, 0,3 и 1 мг/кг соответственно. В модели ксенотрансплантата опухоли Capan-2 соединение В показало аналогичное ингибирование роста (27-30%) в дозах 10 и 30 мг/кг, в то время как введение соединения А с 0,1, 0,3 и 1,0 мг/кг приводило к 70, 87 и 104% ингибированию роста соответственно. Комбинированное лечение AKTингибитором (соединение В) и MEK-ингибитором (соединение А) приводило к увеличению противоопухолевой активности по сравнению с только одним любым одиночным агентом из двух в соответствующих дозах как в случае ксенотрансплантатов опухоли НРАС, так и Capan-2 (данные суммированы в табл. 4 и фиг. 2). Таблица 4. Ингибирование роста ксенотрансплантата опухоли HPAC и Capan-2 у мышей,подвергаемых лечению соединением В и соединением А Поскольку комбинации по настоящему изобретению являются активными в описанных выше тестированиях, они обнаруживают эффективное терапевтическое применение при лечении рака. Предпочтительно настоящее изобретение относится к способу лечения или уменьшения тяжести рака, выбранного из рака головного мозга (глиом), глиобластом, астроцитом, мультиформной глиобластомы, синдрома Баньяна-Зонана, болезни Каудена, болезни Лермитт-Дуклос, молочной железы, воспалительного рака молочной железы, нефробластомы, саркомы Юинга, рабдомиосаркомы, эпендимомы,медуллобластомы, толстой кишки, головы и шеи, почки, легкого, печени, меланомы, яичников, поджелудочной железы, простаты, саркомы, остеосаркомы, гигантоклеточной остеобластомы, щитовидной железы, лимфобластного Т-клеточного лейкоза, хронического миелобластного лейкоза, хронического лимфоцитарного лейкоза, волосатоклеточного лейкоза, острого лимфобластного лейкоза, острого миелобластного лейкоза, хронического нейрофильного лейкоза, острого лимфобластного Т-клеточного лейкоза,плазмоцитомы, иммунобластного крупноклеточного лейкоза, лимфомы клеток зоны мантии, множественной миеломы, мегакариобластного лейкоза, множественной миеломы, острого мегакариоцитарного лейкоза, промиелоцитарного лейкоза, эритролейкоза, злокачественной лимфомы, лимфомы Ходжкина,неходжкинской лимфомы, лимфобластной Т-клеточной лимфомы, лимфомы Беркитта, фолликулярной лимфомы, нейробластомы, рака мочевого пузыря, рака уротелия, рака легкого, рака влагалища, рака шейки матки, рака эндометрия, рака почки, мезотелиомы, рака пищевода, рака слюнной железы, гепатоцеллюлярного рака, рака желудка, рака гортани, рака щеки, рака полости рта, GIST (стромальная опухоль желудочно-кишечного тракта) и рака яичка. Предпочтительно настоящее изобретение относится к способу лечения или уменьшения тяжести рака, выбранного из злокачественного новообразования головного мозга (глиом), глиобластом, астроцитом, мультиформной глиобластомы, синдрома Баньяна-Зонана, болезни Каудена, болезни ЛермиттДуклос, молочной железы, толстой кишки, головы и шеи, почки, легкого, печени, меланомы, яичников,поджелудочной железы, простаты, саркомы и щитовидной железы. Предпочтительно настоящее изобретение относится к способу лечения или уменьшения тяжести рака, выбранного из злокачественного новообразования яичников, молочной железы, поджелудочной железы и простаты. Предпочтительно настоящее изобретение относится к способу лечения или уменьшения тяжести предраковых состояний у млекопитающего, включая человека, где предраковые состояния выбирают из внутриэпителиальной неоплазии шейки матки, моноклональной гаммапатии неустановленной этиологии(MGUS), миелодиспластического синдрома, апластической анемии, болезней шейки матки, невусов (в стадии премеланомы), внутриэпителиальной (внутрипротоковой) неоплазии простаты (PIN), протоковой карциномы in situ (DCIS), полипов толстой кишки и тяжелого гепатита или цирроза. Предпочтительно настоящее изобретение относится к способу лечения или уменьшения тяжести рака, который является злокачественным новообразованием дикого типа или мутантным по Ras/Raf и дикого типа или мутантным по PI3K/Pten. Оно охватывает также пациентов как с Ras/Raf, так иPI3K/PTEN дикого типа, с мутантными как Ras/Raf, так и PI3K/PTEN, мутантными мутантными Ras/Raf и PI3K/PTEN дикого типа и Ras/Raf дикого типа и мутантными PI3K/PTEN. Термин дикий тип в данной области понимают как относящийся к полипептидной или полинуклеотидной последовательности, которая встречается у природной популяции, без генетической модификации. Как также понимают в данной области, термин мутант включает полипептидную или полинуклеотидную последовательность, имеющую изменение по меньшей мере в одной аминокислоте или нуклеиновой кислоте по сравнению с соответствующей аминокислотой или нуклеиновой кислотой, обнаруженной в полипептиде или полинуклеотиде дикого типа соответственно. Термин мутант также охватывает однонуклеотидный полиморфизм (SNP), когда существует отличие на одно основание в последовательности полинуклеотидной цепи по сравнению с преимущественно встречающейся цепью нуклеиновой кислоты (дикий тип). Злокачественные новообразования, которые являются по Ras/Raf дикого типа или мутантными и поPI3K/Pten дикого типа или мутантными, идентифицируются известными способами. Например, клетки опухоли дикого типа или мутантные по Ras/Raf или PI3K/PTEN могут быть легко идентифицированы с помощью методов ДНК-амплификации и секвенирования, методов детектирования ДНК и РНК, включая, в качестве неограничивающих примеров, Нозерн- и Саузерн-блоттинг, соответственно и/или различные технологии определения генетической информации и биочипы. Полипептиды дикого типа и мутантные могут быть детектированы различными методами, включая в качестве неограничивающих примеров, иммунологические методы исследования, такие как ELISA, вестерн-блоттинг или иммуноцитохимия. В настоящем изобретении обеспечивается комбинация N-3-[3-циклопропил-5-(2-фтор-4-йодфениламино)-6,8-диметил-2,4,7-триоксо-3,4,6,7-тетрагидро-2 Н-пиридо[4,3-d]пиримидин-1-ил]фенилацетамида или его фармацевтически приемлемой соли или сольвата и N-(1S)-2-амино-1-[(3,4-дифторфенил)метил]этил-5-хлор-4-(4-хлор-1-метил-1 Н-пиразол-5-ил)-2-фуранкарбоксамида или его фармацевтически приемлемой соли. В настоящем изобретении также обеспечивается комбинация, содержащая N-3-[3-циклопропил-5(2-фтор-4-йодфениламино)-6,8-диметил-2,4,7-триоксо-3,4,6,7-тетрагидро-2 Н-пиридо[4,3-d]пиримидин-1 ил]фенилацетамид или его фармацевтически приемлемую соль или сольват и N-(1S)-2-амино-1-[(3,4 дифторфенил)метил]этил-5-хлор-4-(4-хлор-1-метил-1 Н-пиразол-5-ил)-2-фуранкарбоксамид или его фармацевтически приемлемую соль, для применения в терапии. В настоящем изобретении также обеспечивается комбинация, содержащая N-3-[3-циклопропил-5(2-фтор-4-йодфениламино)-6,8-диметил-2,4,7-триоксо-3,4,6,7-тетрагидро-2 Н-пиридо[4,3-d]пиримидин-1 ил]фенилацетамид или его фармацевтически приемлемую соль или сольват и N-(1S)-2-амино-1-[(3,4 дифторфенил)метил]этил-5-хлор-4-(4-хлор-1-метил-1 Н-пиразол-5-ил)-2-фуранкарбоксамид или его фармацевтически приемлемую соль, для применения при лечении рака. В настоящем изобретении также обеспечивается фармацевтическая композиция, содержащая комбинацию N-3-[3-циклопропил-5-(2-фтор-4-йодфениламино)-6,8-диметил-2,4,7-триоксо-3,4,6,7-тетрагидро-2 Н-пиридо[4,3-d]пиримидин-1-ил]фенилацетамида или его фармацевтически приемлемой соли или сольвата и N-(1S)-2-амино-1-[(3,4-дифторфенил)метил]этил-5-хлор-4-(4-хлор-1-метил-1 Н-пиразол-5 ил)-2-фуранкарбоксамида или его фармацевтически приемлемой соли. В настоящем изобретении также обеспечивается комбинированный набор, содержащий N-3-[3-циклопропил-5-(2-фтор-4-йодфениламино)-6,8-диметил-2,4,7-триоксо-3,4,6,7-тетрагидро-2 Н-пиридо[4,3-d]пиримидин-1-ил]фенилацетамид или его фармацевтически приемлемую соль или сольват и N(1S)-2-амино-1-[(3,4-дифторфенил)метил]этил-5-хлор-4-(4-хлор-1-метил-1 Н-пиразол-5-ил)-2-фуран- 23021951 карбоксамид или его фармацевтически приемлемую соль. Данное изобретение также обеспечивает применение комбинации, содержащей N-3-[3 циклопропил-5-(2-фтор-4-йодфениламино)-6,8-диметил-2,4,7-триоксо-3,4,6,7-тетрагидро-2 Н-пиридо[4,3d]пиримидин-1-ил]фенилацетамид или его фармацевтически приемлемую соль или сольват и N-(1S)-2 амино-1-[(3,4-дифторфенил)метил]этил-5-хлор-4-(4-хлор-1-метил-1 Н-пиразол-5-ил)-2-фуранкарбоксамид или его фармацевтически приемлемую соль, для получения лекарственного средства. Данное изобретение также обеспечивает применение комбинации, содержащей N-3-[3-циклопропил-5-(2-фтор-4-йодфениламино)-6,8-диметил-2,4,7-триоксо-3,4,6,7-тетрагидро-2 Н-пиридо[4,3-d] пиримидин-1-ил]фенилацетамид или его фармацевтически приемлемую соль или сольват и N-(1S)-2 амино-1-[(3,4-дифторфенил)метил]этил-5-хлор-4-(4-хлор-1-метил-1 Н-пиразол-5-ил)-2-фуранкарбоксамид или его фармацевтически приемлемую соль, для получения лекарственного средства для лечения рака. Данное изобретение также обеспечивает способ лечения рака, который включает введение комбинации N-3-[3-циклопропил-5-(2-фтор-4-йодфениламино)-6,8-диметил-2,4,7-триоксо-3,4,6,7-тетрагидро 2 Н-пиридо[4,3-d]пиридин-1-ил]фенилацетамида или его фармацевтически приемлемой соли или сольвата и N-(1S)-2-амино-1-[(3,4-дифторфенил)метил]этил-5-хлор-4-(4-хлор-1-метил-1 Н-пиразол-5-ил)-2 фуранкарбоксамида или его фармацевтически приемлемой соли нуждающемуся в этом субъекту. Следующие далее примеры приведены с иллюстративной целью и не предназначены ограничивать объем изобретения каким-либо образом. Детали эксперимента Пример 1. Композиция для капсул Лекарственную форму для перорального введения комбинации по настоящему изобретению получают путем наполнения разъемной твердой желатиновой капсулы ингредиентами в пропорциях, представленных в табл. I ниже. Таблица I Пример 2. Композиция для капсул Лекарственную форму для перорального введения одного из соединений по настоящему изобретению получают путем наполнения разъемной твердой желатиновой капсулы ингредиентами в пропорциях, представленных в табл. II ниже. Таблица II Пример 3. Композиция для капсул Лекарственную форму для перорального введения одного из соединений по настоящему изобретению получают путем наполнения разъемной твердой желатиновой капсулы ингредиентами в пропорциях, представленных в табл. III ниже. Пример 4. Композиция для таблетирования Сахарозу, микрокристаллическую целлюлозу и соединения заявляемой в изобретении комбинации,как показано в табл. IV ниже, смешивают и гранулируют в представленных пропорциях с 10% раствором желатина. Влажные гранулы просеивают, сушат, смешивают с крахмалом, тальком и стеариновой кислотой, затем просеивают и прессуют в таблетки. Таблица IV Пример 5. Композиция для таблетирования Сахарозу, микрокристаллическую целлюлозу и одно из соединений заявляемой в изобретении комбинации, как показано в табл. V ниже, смешивают и гранулируют в представленных пропорциях с 10% раствором желатина. Влажные гранулы просеивают, сушат, смешивают с крахмалом, тальком и стеариновой кислотой, затем просеивают и прессуют в таблетки. Таблица V Пример 6. Композиция для таблетирования Сахарозу, микрокристаллическую целлюлозу и одно из соединений заявляемой в изобретении комбинации, как показано в табл. VI ниже, смешивают и гранулируют в представленных пропорциях с 10% раствором желатина. Влажные гранулы просеивают, сушат, смешивают с крахмалом, тальком и стеариновой кислотой, затем просеивают и прессуют в таблетки. Выше настоящее изобретение описано на предпочтительных примерах его осуществления, однако представленные здесь точные указания не ограничивают изобретение и могут быть внесены все изменения, которые находятся в пределах объема изобретения, определенного в прилагаемой формуле изобретения. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Комбинация, включающая: или его фармацевтически приемлемую соль, или сольват и или его фармацевтически приемлемую соль. 2. Комбинация по п.1, где соединение структуры (I) находится в форме сольвата с диметилсульфоксидом. 3. Комбинированный набор, включающий комбинацию по п.1 или 2 вместе с фармацевтически приемлемым носителем или носителями. 4. Применение комбинации по п.1 или 2 или комбинированного набора по п.3 для получения лекарственного средства или лекарственных средств для лечения рака или предопухолевых состояний. 5. Применение комбинации или комбинированного набора по любому из пп.1-3 для лечения рака или предопухолевых состояний. 6. Способ лечения рака или предопухолевых состояний, включающий введение терапевтически эффективного количества комбинации по п.1 или комбинированного набора по п.3, где оба соединения комбинации или комбинированного набора вводят в интервале приблизительно 24 ч между ними и где комбинацию или комбинированный набор вводят в течение по меньшей мере одного дня. 7. Способ по п.6, где количество N-3-[3-циклопропил-5-(2-фтор-4-йодфениламино)-6,8-диметил 2,4,7-триоксо-3,4,6,7-тетрагидро-2 Н-пиридо[4,3-d]пиримидин-1-ил]фенилацетамид-диметилсульфоксида выбирают из количества от приблизительно 0,25 до приблизительно 9 мг, и это количество вводится один раз в день, и количество N-(1S)-2-амино-1-[(3,4-дифторфенил)метил]этил-5-хлор-4-(4-хлор-1 метил-1 Н-пиразол-5-ил)-2-фуранкарбоксамида выбирают из количества от приблизительно 10 до приблизительно 300 мг, и это количество вводится один раз в день. 8. Способ по п.6, где N-3-[3-циклопропил-5-(2-фтор-4-йодфениламино)-6,8-диметил-2,4,7-триоксо 3,4,6,7-тетрагидро-2 Н-пиридо[4,3-d]пиримидин-1-ил]фенилацетамид-диметилсульфоксид и N-(1S)-2 амино-1-[(3,4-дифторфенил)метил]этил-5-хлор-4-(4-хлор-1-метил-1 Н-пиразол-5-ил)-2-фуранкарбокса- 26021951 мид вводят с интервалом 12 ч между ними в течение от 1 до 3 последовательных дней с последующим введением N-3-[3-циклопропил-5-(2-фтор-4-йодфениламино)-6,8-диметил-2,4,7-триоксо-3,4,6,7-тетрагидро-2 Н-пиридо[4,3-d]пиримидин-1-ил]фенилацетамид-диметилсульфоксида в течение от 3 до 7 последовательных дней необязательно с последующими одним или более циклами повторного дозированного введения. 9. Способ по п.6, где N-3-[3-циклопропил-5-(2-фтор-4-йодфениламино)-6,8-диметил-2,4,7-триоксо 3,4,6,7-тетрагидро-2 Н-пиридо[4,3-d]пиримидин-1-ил]фенилацетамид-диметилсульфоксид и N-(1S)-2 амино-1-[(3,4-дифторфенил)метил]этил-5-хлор-4-(4-хлор-1-метил-1 Н-пиразол-5-ил)-2-фуранкарбоксамид вводят с интервалом 12 ч между ними в течение 2 последовательных дней с последующим введением N-3-[3-циклопропил-5-(2-фтор-4-йодфениламино)-6,8-диметил-2,4,7-триоксо-3,4,6,7-тетрагидро-2 Нпиридо[4,3-d]пиримидин-1-ил]фенилацетамид-диметилсульфоксида в течение от 4 до 6 последовательных дней необязательно с последующими одним или более циклами повторного дозированного введения. 10. Способ по п.6, где N-3-[3-циклопропил-5-(2-фтор-4-йодфениламино)-6,8-диметил-2,4,7-триоксо-3,4,6,7-тетрагидро-2 Н-пиридо[4,3-d]пиримидин-1-ил]фенилацетамид-диметилсульфоксид и N-(1S)2-амино-1-[(3,4-дифторфенил)метил]этил-5-хлор-4-(4-хлор-1-метил-1 Н-пиразол-5-ил)-2-фуранкарбоксамид вводят с интервалом 12 ч между ними течение 2 дней из 7-дневного периода времени, а в другие дни 7-дневного периода времени вводят либо только один N-3-[3-циклопропил-5-(2-фтор-4-йодфениламино)-6,8-диметил-2,4,7-триоксо-3,4,6,7-тетрагидро-2 Н-пиридо[4,3-d]пиримидин-1-ил]фенилацетамиддиметилсульфоксид необязательно с последующими одним или более циклами повторного дозированного введения, либо только один N-(1S)-2-амино-1-[(3,4-дифторфенил)метил]этил-5-хлор-4-(4-хлор-1-метил-1 Н-пиразол-5-ил)-2-фуранкарбоксамид необязательно с последующими одним или более циклами повторного дозированного введения. 11. Способ по п.6, где N-3-[3-циклопропил-5-(2-фтор-4-йодфениламино)-6,8-диметил-2,4,7-триоксо-3,4,6,7-тетрагидро-2 Н-пиридо[4,3-d]пиримидин-1-ил]фенилацетамид-диметилсульфоксид и N(1S)-2-амино-1-[(3,4-дифторфенил)метил]этил-5-хлор-4-(4-хлор-1-метил-1 Н-пиразол-5-ил)-2-фуранкарбоксамид вводят с интервалом 12 ч между ними в течение 5 последовательных дней. 12. Способ по п.6, где N-3-[3-циклопропил-5-(2-фтор-4-йодфениламино)-6,8-диметил-2,4,7-триоксо-3,4,6,7-тетрагидро-2 Н-пиридо[4,3-d]пиримидин-1-ил]фенилацетамид-диметилсульфоксид и N(1S)-2-амино-1-[(3,4-дифторфенил)метил]этил-5-хлор-4-(4-хлор-1-метил-1 Н-пиразол-5-ил)-2-фуранкарбоксамид вводят с интервалом 12 ч между ними в течение 5 дней из 14-дневного периода времени, а в другие дни 14-дневного периода времени вводят либо только один N-3-[3-циклопропил-5-(2-фтор-4 йодфениламино)-6,8-диметил-2,4,7-триоксо-3,4,6,7-тетрагидро-2 Н-пиридо[4,3-d]пиримидин-1-ил]фенилацетамид-диметилсульфоксид необязательно с последующими одним или более циклами повторного дозированного введения, либо только один N-(1S)-2-амино-1-[(3,4-дифторфенил)метил]этил-5-хлор 4-(4-хлор-1-метил-1 Н-пиразол-5-ил)-2-фуранкарбоксамид необязательно с последующими одним или более циклами повторного дозированного введения. 13. Способ по п.6 или 7, где соединение, представляющее собой N-3-[3-циклопропил-5-(2-фтор-4 йодфениламино)-6,8-диметил-2,4,7-триоксо-3,4,6,7-тетрагидро-2 Н-пиридо[4,3-d]пиримидин-1-ил]фенилацетамид-диметилсульфоксид, вводят сначала в виде нагрузочной дозы в течение от 1 до 3 дней с последующим введением поддерживающей дозы соединения; и/или соединение, представляющее собойN-(1S)-2-амино-1-[(3,4-дифторфенил)метил]этил-5-хлор-4-(4-хлор-1-метил-1 Н-пиразол-5-ил)-2-фуранкарбоксамид или его фармацевтически приемлемую соль, вводят сначала в виде нагрузочной дозы в течение от 1 до 3 дней с последующим введением поддерживающей дозы соединения. 14. Применение по п.4, где рак содержит либо Ras/Raf дикого типа или мутантный, либоPI3K/PTEN дикого типа или мутантный. 15. Применение по п.4, где рак выбирают из рака яичников, молочной железы, поджелудочной железы и простаты.
МПК / Метки
МПК: A61K 31/415, A61K 31/505, A01N 43/54
Метки: комбинация, противораковая
Код ссылки
<a href="https://eas.patents.su/29-21951-protivorakovaya-kombinaciya.html" rel="bookmark" title="База патентов Евразийского Союза">Противораковая комбинация</a>
Предыдущий патент: Система и способ сбережения энергии для устройств с вращающимися или выполняющими возвратно-поступательное движение массами
Следующий патент: Система и способ создания кольцевой пробки в подземной скважине
Случайный патент: Сегментированное склеральное кольцо для лечения пресбиопии и других расстройств зрения