Гетероарилзамещенные производные 2-пиридинил- и 2-пиримидинил- 6, 7, 8, 9-тетрагидропиримидо[1, 2-а] пиримидин-4-она
Номер патента: 7737
Опубликовано: 29.12.2006
Авторы: Йеш Филипп, Локхид Алистер, Неделек Ален, Саади Мурад
Формула / Реферат
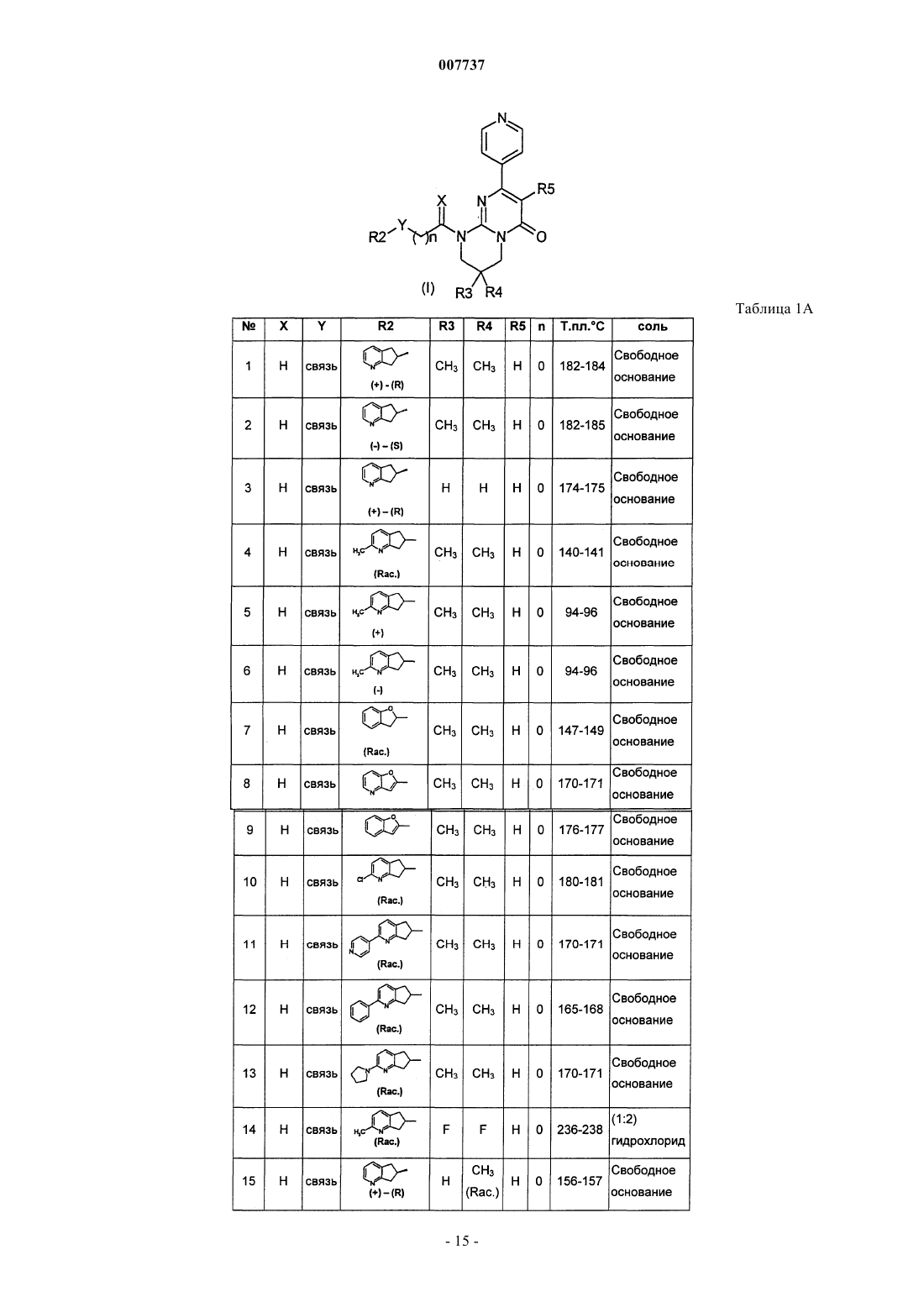
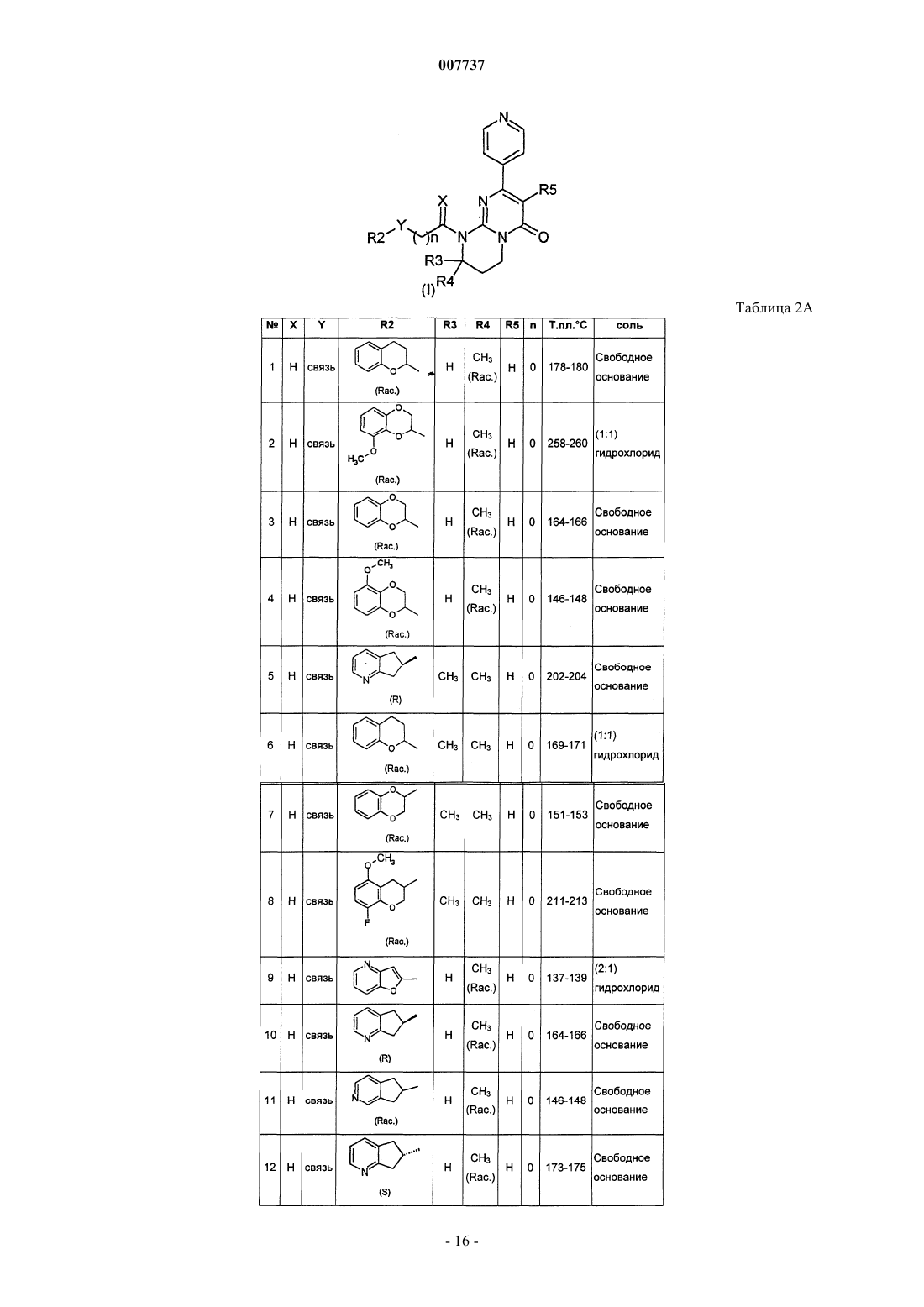
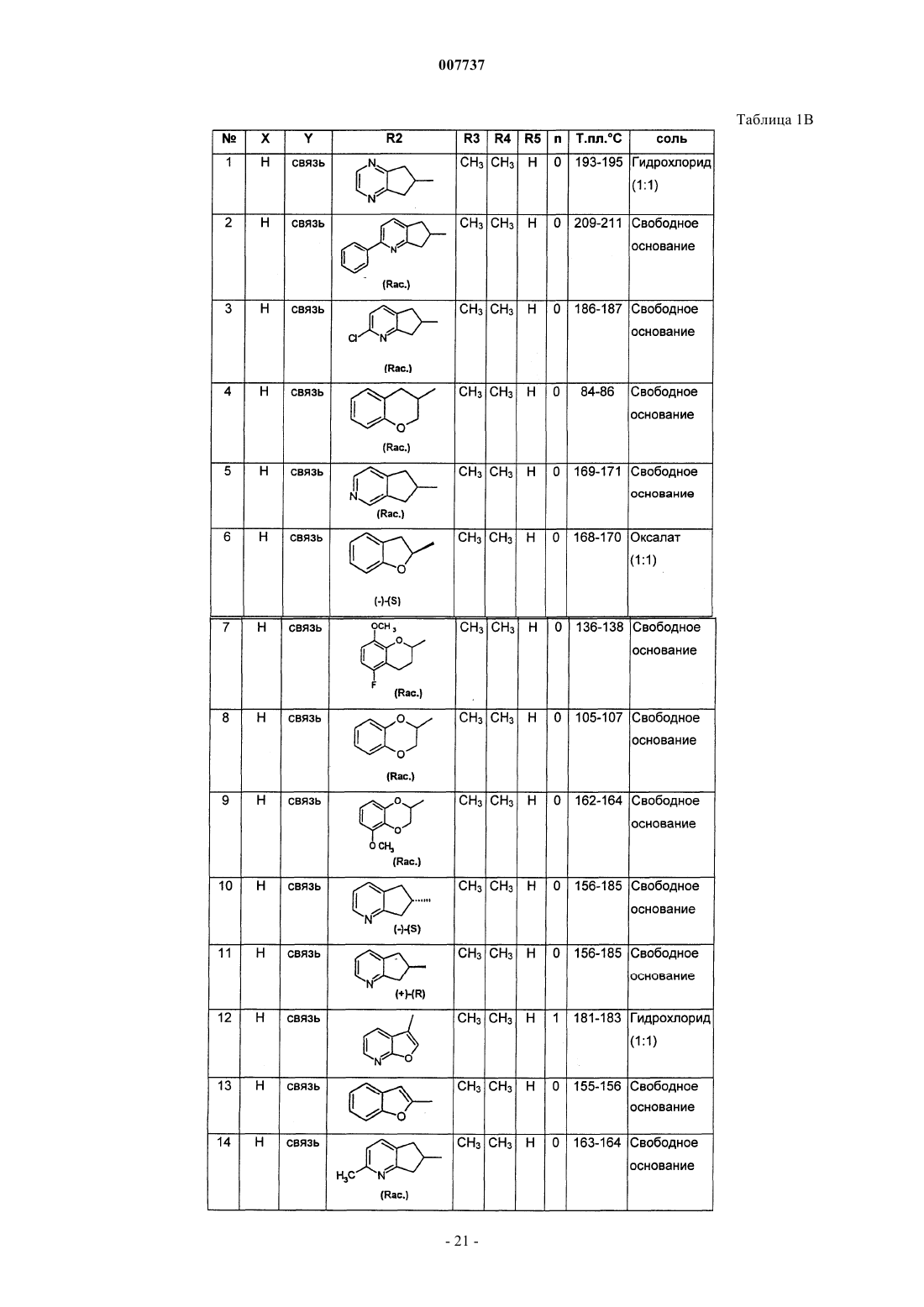
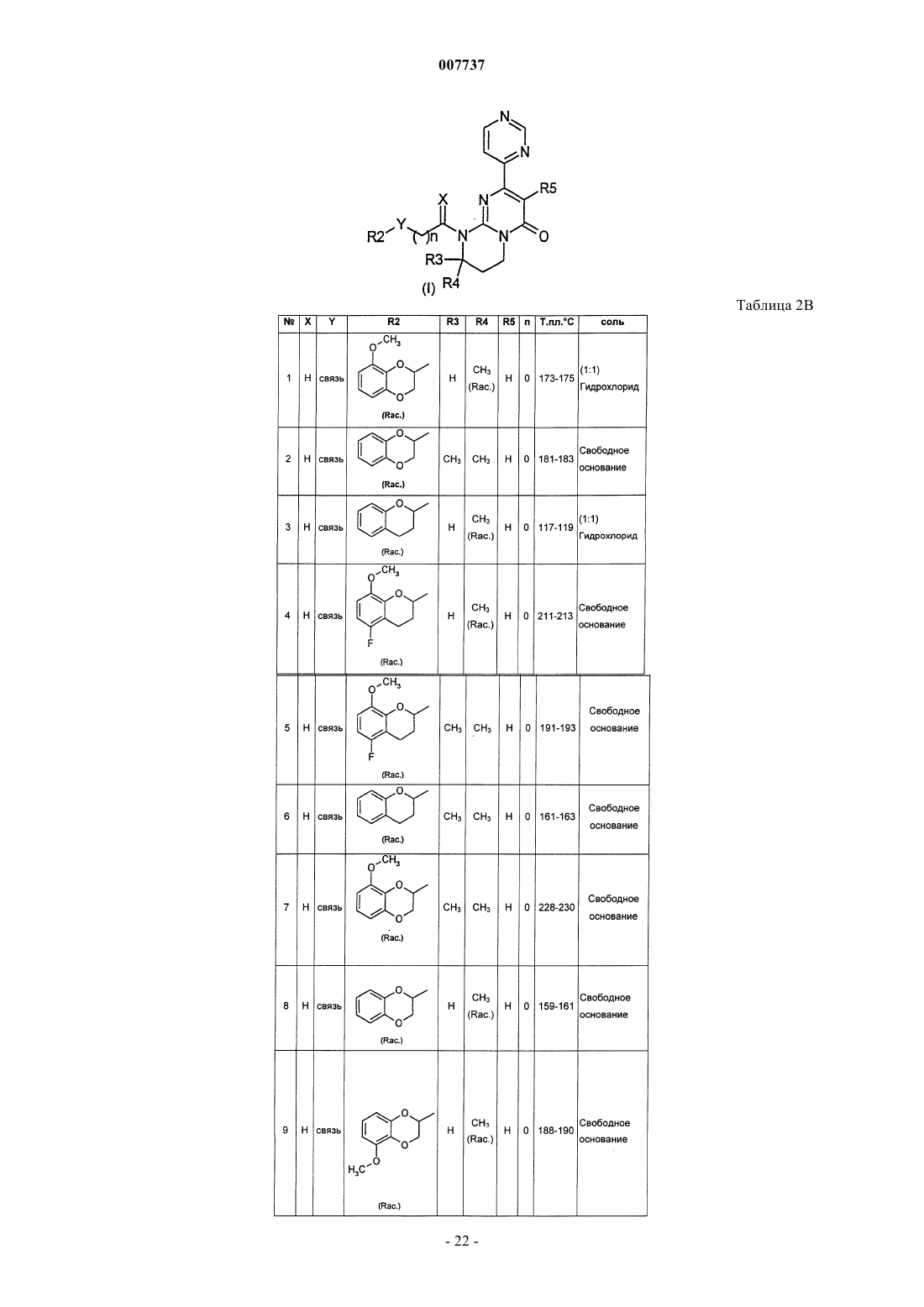
1. Производное пиримидона, представленное формулой (I), или его соль, или их сольват, или их гидрат

где X представляет собой два атома водорода или С1-2-алкильную группу и атом водорода;
Y представляет собой связь или метиленовую группу, возможно замещенную одной или двумя группами, выбранными из C1-6-алкильной группы, гидроксигруппы или C1-4-алкоксигруппы;
R1 представляет собой 2-, 3- или 4-пиридиновое кольцо или 2-, 4- или 5-пиримидиновое кольцо, которое может быть замещено С3-6-циклоалкильной группой, С1-4-алкильной группой, С1-4-алкоксигруппой или атомом галогена;
R2 представляет собой гетероциклическое бициклическое кольцо, имеющее 1-4 гетероатома, выбранных из атома кислорода, атома серы и атома азота, и имеющее 5-9 атомов углерода, формулы
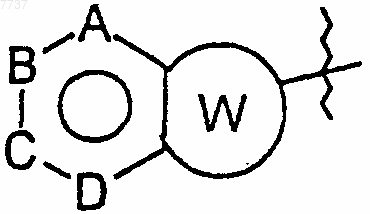
где А, В, С и D, каждый независимо, представляет собой атом углерода или атом азота и W представляет собой насыщенное или ненасыщенное 5- или 6-членное циклическое кольцо, включающее от 0 до 2 гетероатомов, таких как атом кислорода, атом серы или атом азота; причем группа R2 может быть замещена по атому углерода или, если возможно, по атому азота одним или двумя атомами или группами, выбранными из атома галогена, C1-6-алкильной группы, гидроксигруппы, С1-4-алкоксигруппы, бензольного кольца, пиридинового кольца или группы -NR6R7;
R3 представляет собой атом водорода, С1-6-алкильную группу, гидроксигруппу, C1-4-алкоксигруппу или атом галогена;
R4 представляет собой атом водорода, С1-6-алкильную группу, С1-4-алкоксигруппу или атом галогена;
R5 представляет собой атом водорода или атом галогена;
R6 и R7 вместе с атомом азота представляют собой пирролидиновое кольцо;
если m равно 0, р равно 1, 2 или 3,
если m равно 1, р равно 0, 1 или 2,
если m равно 2, р равно 0 или 1,
если m равно 3, р равно 0; и
n равно от 0 до 3;
при условии, что производное формулы (I) не представляет собой
9-[2-(1Н-индол-3-ил)этил]-2-пиридин-4-ил-6,7,8,9-тетрагидро-4H-пиримидо[1,2-а]пиримидин-4-он,
9-[3-(1Н-индол-3-ил)пропил]-2-пиридин-4-ил-6,7,8,9-тетрагидро-4Н-пиримидо[1,2-а]пиримидин-4-он,
1-[2-(1 Н-индол-3-ил)этил]-7-пиридин-4-ил-2,3-дигидроимидазо[1,2-а]пиримидин-5(1Н)-он или
1-[3-(1Н-индол-3-ил)пропил]-7-пиридин-4-ил-2,3-дигидроимидазо[1,2-а]пиримидин-5(1Н)-он.
2. Производное пиримидона, или его соль, или их сольват, или их гидрат по п.1, где R1 представляет собой незамещенную пиридинильную группу или незамещенное 4-пиримидиновое кольцо.
3. Производное пиримидона, выбранное из группы, состоящей из
(+)-(6R)-9-(6,7-дигидро-5H-[1]пириндин-6-илметил)-7,7-диметил-2-(пиридин-4-ил)-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-она,
(-)-(6S)-9-(6,7-дигидро-5H-[1]пириндин-6-илметил)-7,7-диметил-2-(пиридин-4-ил)-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-она,
(+)-(6R)-9-(6,7-дигидро-5Н-[1]пириндин-6-илметил)-2-(пиридин-4-ил)-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-она,
(+/-)-7,7-диметил-9-(2-метил-6,7-дигидро-5Н-[1]пириндин-6-илметил)-2-(пиридин-4-ил)-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-она,
(+)-7,7-диметил-9-(2-метил-6,7-дигидро-5Н-[1]пириндин-6-илметил)-2-(пиридин-4-ил)-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-она,
(-)-7,7-диметил-9-(2-метил-6,7-дигидро-5H-[1]пириндин-6-илметил)-2-(пиридин-4-ил)-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-она,
(+/-)-9-(2,3-дигидро-бензофуран-2-илметил)-7,7-диметил-2-(пиридин-4-ил)-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-она,
9-(фуро[3,2-b)]пиридин-2-илметил)-7,7-диметил-2-(пиридин-4-ил)-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-она,
9-(бензофуран-2-илметил)-7,7-диметил-2-(пиридин-4-ил)-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-она,
(+/-)-9-(2-хлор-6,7-дигидро-5H-[1]пириндин-6-илметил)-7,7-диметил-2-(пиридин-4-ил)-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-она,
(+/-)-7,7-диметил-2-(пиридин-4-ил)-9-[2-(пиридин-4-ил)-6,7-дигидро-5H-[1]пириндин-6-илметил]-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-она,
(+/-)-7,7-диметил-9-(2-фенил-6,7-дигидро-5Н-[1]пириндин-6-илметил)-2-(пиридин-4-ил)-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-она,
(+/-)-7,7-диметил-2-(пиридин-4-ил)-9-[2-(пирролидин-1-ил)-6,7-дигидро-5Н-[1]пириндин-6-илметил]-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-она,
(+/-)-7,7-дифтор-9-(2-метил-6,7-дигидро-5Н-[1]пириндин-6-илметил)-2-(пиридин-4-ил)-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-она,
9-((+)-(6-R)-6,7-дигидро-5Н-[1]пириндин-6-илметил)-(+/-)-7-метил-2-(пиридин-4-ил)-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-она,
или его соли, или их сольвата, или их гидрата.
4. Производное пиримидона, выбранное из группы, состоящей из
9-хроман-2-илметил-8-метил-2-пиридин-4-ил-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-она,
9-(8-метокси-2,3-дигидробензо[1,4]диоксин-2-илметил)-8-метил-2-пиридин-4-ил-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-она,
9-(2,3-дигидробензо[1,4]диоксин-2-илметил)-8-метил-2-пиридин-4-ил-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-она,
9-(5-метокси-2,3-дигидробензо[1,4]диоксин-2-илметил)-8-метил-2-пиридин-4-ил-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-она,
9-(6,7-дигидро-5Н-[1]пириндин-6-(R)-илметил)-8,8-диметил-2-пиридин-4-ил-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-она,
9-хроман-2-илметил-8,8-диметил-2-пиридин-4-ил-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-она,
9-(2,3-дигидробензо[1,4]диоксин-2-илметил)-8,8-диметил-2-пиридин-4-ил-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-она,
9-(8-фтор-5-метоксихроман-3-илметил)-8,8-диметил-2-пиридин-4-ил-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-она,
9-фуро[3,2-b]пиридин-2-илметил-8-метил-2-пиридин-4-ил-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-она,
9-(6,7-дигидро-5Н-[1]пириндин-6-(R)-илметил)-8-метил-2-пиридин-4-ил-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-она,
9-(6,7-дигидро-5H-[2]пириндин-6-илметил)-8-метил-2-пиридин-4-ил-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-она,
9-(6,7-дигидро-5Н-[1]пириндин-6-(S)-илметил)-8-метил-2-пиридин-4-ил-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-она,
или его соли, или их сольвата, или их гидрата.
5. Производное пиримидона, выбранное из группы, состоящей из
9-(6,7-дигидро-5Н-циклопентапиразин-6-илметил)-7,7-диметил-2-пиримидин-4-ил-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-она,
(+/-)-7,7-диметил-2-(пиримидин-4-ил)-9-(2-фенил-6,7-дигидро-5H-[1]пириндин-6-илметил)-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-она,
(+/-)-9-(2-хлор-6,7-дигидро-5H-[1]пириндин-6-илметил)-7,7-диметил-2-(пиримидин-4-ил)-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-она,
(+/-)-9-(хроман-3-илметил)-7,7-диметил-2-(пиримидин-4-ил)-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-она,
(+/-)-9-(6,7-дигидро-5H-[2]пириндин-6-илметил)-7,7-диметил-2-(пиримидин-4-ил)-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-она,
(-)-(S)-9-(2,3-дигидробензофуран-2-илметил)-7,7-диметил-2-(пиримидин-4-ил)-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-она,
(+/-)-9-(5-фтор-8-метоксихроман-2-илметил)-7,7-диметил-2-(пиримидин-4-ил)-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-она,
(+/-)-9(2,3-дигидробензо[1,4]диоксин-2-илметил)-7,7-диметил-2-(пиримидин-4-ил)-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-она,
(+/-)-9-(5-метокси-2,3-дигидробензо[1,4]диоксин-2-илметил)-7,7-диметил-2-(пиримидин-4-ил)-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-она,
(-)-(6S)-9-(6,7-дигидро-5Н-[1]пириндин-6-илметил)-7,7-диметил-2-(пиримидин-4-ил)-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-она,
(+)-(6R)-9-(6,7-дигидро-5Н-[1]пириндин-6-илметил)-7,7-диметил-2-(пиримидин-4-ил)-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-она,
9-(2-фуро[2,3-b]пиридин-3-ил-этил)-7,7-диметил-2-(пиримидин-4-ил)-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-она,
9-бензофуран-2-илметил-7,7-диметил-2-(пиримидин-4-ил)-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-она,
(+/-)-7,7-диметил-9-(2-метил-6,7-дигидро-5Н-[1]пириндин-6-илметил)-2-(пиримидин-4-ил)-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-она,
или его соли, или их сольвата, или их гидрата.
6. Производное пиримидона, выбранное из группы, состоящей из
9-(8-метокси-2,3-дигидробензо[1,4]диоксин-2-илметил)-8-метил-2-пиримидин-4-ил-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-она,
9-(2,3-дигидробензо[1,4]диоксин-2-илметил)-8,8-диметил-2-пиримидин-4-ил-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-она,
9-хроман-2-илметил-8-метил-2-пиримидин-4-ил-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-она,
9-(5-фтор-8-метоксихроман-2-илметил)-8-метил-2-пиримидин-4-ил-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-она,
9-(5-фтор-8-метоксихроман-2-илметил)-8,8-диметил-2-пиримидин-4-ил-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-она,
9-хроман-2-илметил-8,8-диметил-2-пиримидин-4-ил-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-она,
9-(8-метокси-2,3-дигидробензо[1,4]диоксин-2-илметил)-8,8-диметил-2-пиримидин-4-ил-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-она,
9-(2,3-дигидробензо[1,4]диоксин-2-илметил)-8-метил-2-пиримидин-4-ил-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-она,
9-(5-метокси-2,3-дигидробензо[1,4]диоксин-2-илметил)-8-метил-2-пиримидин-4-ил-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-она,
9-(5-метокси-2,3-дигидробензо[1,4]диоксин-2-илметил)-8,8-диметил-2-пиримидин-4-ил-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-она,
9-(6,7-дигидро-5Н-[1]пириндин-6-(R)-илметил)-8-метил-2-пиримидин-4-ил-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-она,
9-(6,7-дигидро-5H-[1]пириндин-6-(R)-илметил)-8,8-диметил-2-пиримидин-4-ил-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-она,
9-(6,7-дигидро-5Н-[1]пириндин-6-(S)-илметил)-8,8-диметил-2-пиримидин-4-ил-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-она,
9-фуро[3,2-b]пиридин-2-илметил-8-метил-2-пиримидин-4-ил-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-она,
9-(6,7-дигидро-5H-[1]пириндин-6-(S)-илметил)-8-метил-2-пиримидин-4-ил-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-она или
9-(6,7-дигидро-5Н-[2]пириндин-6-илметил)-8-метил-2-пиримидин-4-ил-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-она,
или его соли, или их сольвата, или их гидрата.
7. Лекарственное средство, содержащее в качестве активного ингредиента вещество, выбранное из группы, состоящей из производного пиримидона, представленного формулой (I), или его солей, или их сольвата, или их гидрата по пп.1-6.
8. Ингибитор GSK3b или GSK3b и cdk5/p25, выбранный из группы производного пиримидона, представленного формулой (I), или его солей, или их сольвата, или их гидрата по пп.1-6.
9. Применение соединения по пп.1-6 для изготовления лекарственного средства для профилактического и/или терапевтического лечения заболевания, вызванного аномальной активностью GSK3b или GSK3b и cdk5/p25.
10. Применение соединения по пп.1-6 для изготовления лекарственного средства для профилактического и/или терапевтического лечения нейродегенеративного заболевания.
11. Применение соединения по п.10, где нейродегенеративное заболевание выбрано из группы, состоящей из болезни Альцгеймера, болезни Паркинсона, тауопатий, сосудистой деменции; острого инсульта, травматических повреждений; инсультов, травмы головного мозга, травмы спинного мозга; периферических нейропатий; бокового амиотрофического склероза; ретинопатий или глаукомы.
12. Применение соединения по пп.1-6 для изготовления лекарственного средства для профилактического и/или терапевтического лечения инсулиннезависимого диабета, ожирения, маниакально-депрессивного психоза, шизофрении, алопеции, прекращения курения, эпилепсии или видов рака.
13. Применение по п.12, где рак представляет собой рак молочной железы, немелкоклеточную легочную карциному, рак щитовидной железы, Т- или В-клеточную лейкемию или вирус-индуцированную опухоль.
Текст
007737 Область изобретения Настоящее изобретение относится к соединениям, которые используют в качестве активного ингредиента лекарственного средства для профилактического и/или терапевтического лечения нейродегенеративных заболеваний, вызванных аномальными активностями только GSK3 или комбинированными эффектами GSK3 и cdk5/p25. Предшествующий уровень техникиGSK3 (гликогенсинтазакиназа 3) является пролиннаправленной серин/треонинкиназой, которая играет важную роль в регуляции метаболизма, дифференцировке и выживании. Она была впервые идентифицирована в качестве фермента, способного фосфорилировать и, следовательно, ингибировать гликогенсинтазу. Позже обнаружили, что GSK3 была идентична тау-протеинкиназе 1 (ТРК 1), ферменту, который фосфорилирует тау-белок в эпитопах, которые, как также было обнаружено, гиперфосфорилируются при болезни Альцгеймера и при некоторых тауопатиях. Интересно, что фосфорилирование протеинкиназой В (АКТ) киназы GSK3 приводит к потере ее киназной активности, и предположили, что это ингибирование может опосредовать некоторые эффекты нейротрофических факторов. Кроме того, фосфорилирование с помощью GSK3-катенина, белка, вовлеченного в клеточное выживание, приводит к его деградации убиквитинзависимым протеасомным путем. Таким образом, судя по всему, ингибирование активности GSK3 может привести к нейротрофической активности. Более того, существует доказательство, что литий - неконкурентный ингибитор GSK3 - усиливает нейритогенез в некоторых моделях, а также увеличивает выживание нейронов благодаря индукции факторов выживания, таких как Bcl-2, и ингибирование экспрессии проапоптотических факторов, таких как Р 53 и Вах. Недавние исследования показали, что -амилоид увеличивает активность GSK3 и фосфорилирование таубелка. Кроме того, это гиперфосфорилирование, а также нейротоксические эффекты -амилоида блокируются хлоридом лития и антисмысловой мРНК к GSK3. Эти наблюдения строго предполагают, что GSK3 может быть связующим звеном между двумя основными патологическими процессами в болезни Альцгеймера: процессингом аномального АРР (белка-предшественника амилоида) и гиперфосфорилированием тау-белка. Хотя гиперфосфорилирование тау приводит к дестабилизации нейронного цитоскелета, патологические последствия аномальной активности GSK3 обусловлены, по всей вероятности, не только патологическим фосфорилированием тау-белка, поскольку, как указано выше, избыточная активность этой киназы может влиять на выживание посредством модуляции экспрессии апоптотических и антиапоптотических факторов. Более того, было показано, что -амилоидиндуцированное увеличение активностиCdk5/p25, также известная как тау-протеинкиназа 2 (ТРK2), является пролиннаправленной, Ser/Thrкиназой, необходимой для развития центральной нервной системы, и в частности для нейронной миграции и роста нейритов. Cdk5 является гомологом циклинзависимых киназ и экспрессируется практически везде. Ее активатор р 35 (белок из 305 а.к.) или укороченная форма р 25 (208 а.к., отсутствующий N-концевой пролинбогатый домен не требуется для активности) избирательно экспрессируются в нейронах, ограничивая активность киназы cdk5 по существу ЦНС. Cdk5 полностью не активна в отсутствиe р 35 или р 25. Термин cdk5/p25 будет использоваться здесь для активного фермента, поскольку существует доказательство, которое дает возможность предположить, что р 25 и в меньшей степени р 35 могут быть вовлечены в патологические процессы. Физиологические субстраты для cdk5/p25 включают DARPP-32, Munc-18, РАК 1, синапсин 1 и, возможно, некоторые другие. Кроме того, теперь хорошо установлено, что cdk5/p25 фосфорилирует эпитопы тау-белка, которые гиперфосфорилированы при болезни Альцгеймера. Совсем недавно в мозге пациентов, страдающих от болезни Альцгеймера, была обнаружена повышенная активность cdk5/p25, неправильная локализация cdk5 и увеличение количества активатора р 25. Интересно, что предварительное фосфорилирование тау-белка с помощью cdk5/p25 существенно усиливает фосфорилирование тау-белка с помощью GSK3 по другим эпитопам, которые, как было обнаружено, также гиперфосфорилируются при болезни Альцгеймера. Кроме того, нейрофибриллярные пучки - признак болезни Альцгеймера - метятся антисывороткой к GSK3 и cdk5, но не к GSK3 и МАР-киназе; GSK3 и cdk5 также связаны с микротрубочками, и обе, более чем РКА и СК, вносят вклад в AD-подобное фосфорилирование тау-белка. Взятые вместе, эти результаты дают возможность предположить, что смешанные ингибиторы GSK3 иcdk5/p25 были бы эффективны в защите тау-белка от гиперфосфорилирования. Поэтому они могли бы использоваться для лечения любого патологического расстройства, связанного с аномальным фосфорилированием тау-белка, в частности болезни Альцгеймера, а также других тауопатий (например, лобно-височной деменции, кортикобазальной дегенерации, болезни Пика, прогрессирующего супрануклеарного паралича).Cdk5/p25 связана с апоптозом и нейродегенерацией в более общих чертах. Ее сверхэкспрессия индуцирует апоптоз в культивируемых нейронах, в мозговой ткани апоптотические клетки демонстрируют сильную иммунореактивность к cdk5. Нейротоксические агенты, включая А(1-42), повреждение нейронов, ишемия или удаление ростовых факторов приводят к активации и неправильной локализацииcdk5/p25, аномальному фосфорилированию субстратов cdk5, нарушению цитоскелета и клеточной смер-1 007737 ти. Кроме того, фосфорилирование с помощью cdk5/p25 превращает DARPP-32 в ингибитор протеинкиназы А, восстанавливающий трансдукцию сигнала в полосатом теле с очевидными последствиями в случае болезни Паркинсона. О роли cdk5 в ALS (боковой амиотрофический склероз) также предположили,основываясь на ее способности фосфорилировать нейрофиламенты. Совсем недавно в мышиной модели бокового амиотрофического склероза обнаружили отмену контроля cdk5. Взятые вместе, эти экспериментальные наблюдения указывают, что ингибиторы GSK3 могут найти применение в лечении нейропатологических последствий и дефицитов внимания и когнитивных функций, связанных с болезнью Альцгеймера, а также других острых и хронических нейродегенеративных заболеваний. Они включают, но не ограничиваются, болезнь Паркинсона, тауопатии (например,лобно-височную деменцию, кортикобазальную дегенерацию, болезнь Пика, прогрессирующий супрануклеарный паралич) и другие деменции, включая сосудистую деменцию; острый инсульт и другие травматические повреждения; инсульты (например, старческую дегенерацию желтого пятна); травму спинного или головного мозга; периферические нейропатии; ретинопатии и глаукому. Кроме того, ингибирование GSK3 может найти применение в лечении других заболеваний, таких как инсулиннезависимый сахарный диабет (такой как диабет II типа) и ожирение; маниакально-депрессивный психоз; шизофрения; алопеция; виды рака, такие как рак молочной железы, немелкоклеточная легочная карцинома, рак щитовидной железы, Т- или В-клеточная лейкемия и некоторые вирус-индуцированные опухоли. Следовательно, как GSK3, так и cdk5/p25 играют главную роль в индукции апоптоза в нервных клетках; комбинированное ингибирование этих двух ферментов может найти применение в лечении не только болезни Альцгеймера и других вышеупомянутых тауопатий, но также множества других нейродегенеративных заболеваний, в частности болезни Паркинсона и бокового амиотрофического склероза; других деменций, включая сосудистую деменцию; острого инсульта и других травматических повреждений; инсультов (например, старческой дегенерации желтого пятна); травмы спинного или головного мозга; периферических нейропатий; ретинопатий и глаукомы. Кроме того, смешанные ингибиторы ТРК 1/ТРК 2 могут найти свое применение в лечении других расстройств, таких как прекращение курения и другие абстинентные синдромы, эпилепсия. И более подробно следующие соединения: 9-[2-(1 Н-индол-3-ил)этил]-2-пиридин-4-ил-6,7,8,9-тетрагидро-4 Н-пиримидо[1,2-а]пиримидин-4-он; 9-[3-(1 Н-индол-3-ил)пропил]-2-пиридин-4-ил-6,7,8,9-тетрагидро-4 Н-пиримидо[1,2-а]пиримидин-4-он; 1-[2-(1 Н-индол-3-ил)этил]-7-пиридин-4-ил-2,3-дигидроимидазо[1,2-а]пиримидин-5(1 Н)-он или 1-[3-(1 Н-индол-3-ил)пропил]-7-пиридин-4-ил-2,3-дигидроимидазо[1,2-а]пиримидин-5(1 Н)-он. Подробное описание изобретения Цель настоящего изобретения состоит в том, чтобы предложить соединения, полезные в качестве активного ингредиента лекарственного средства для профилактического и/или терапевтического лечения заболевания, вызванного аномальной активностью GSK3 или GSK3 и cdk5/p25, особенно нейродегенеративных заболеваний. Более конкретно, цель состоит в том, чтобы предложить новые соединения,полезные в качестве активного ингредиента лекарственного средства, которое позволяет осуществлять профилактику и/или лечение нейродегенеративного заболевания, такого как болезнь Альцгеймера. Итак, изобретатели настоящего изобретения идентифицировали соединения, обладающие ингибирующей активностью против GSK3. В результате этого они обнаружили, что соединения, представленные следующей формулой (I), имели желаемую активность и были полезны в качестве активного ингредиента лекарственного средства для профилактического и/или терапевтического лечения вышеупомянутых заболеваний. Таким образом, в настоящем изобретении предложены производные пиримидона, представленные формулой (I), или их соли, их сольваты, или их гидраты:-2 007737 где X представляет собой два атома водорода или C1-2-алкильную группу и атом водорода;Y представляет собой связь или метиленовую группу, возможно замещенную одной или двумя группами, выбранными из C1-6-алкильной группы, гидроксигруппы или С 1-4-алкоксигруппы;R1 представляет собой 2-, 3- или 4-пиридиновое кольцо или 2-, 4- или 5-пиримидиновое кольцо, которое может быть замещено С 3-6-циклоалкильной группой, C1-4-алкильной группой, С 1-4-алкоксигруппой или атомом галогена;R2 представляет собой гетероциклическое бициклическое кольцо, имеющее 1-4 гетероатома, выбранных из атома кислорода, атома серы и атома азота, и имеющее 5-9 атомов углерода, формулы где А, В, С и D, каждый независимо, представляет собой атом углерода или атом азота, и W представляет собой насыщенное или ненасыщенное 5- или 6-членное циклическое кольцо, включающее от 0 до 2 гетероатомов, таких как атом кислорода, атом серы или атом азота; причем группа R2 может быть замещена по атому углерода или, если возможно, по атому азота одним или двумя атомами или группами, выбранными из атома галогена, C1-6-алкильной группы, гидроксигруппы, C1-4-алкоксигруппы, бензольного кольца, пиридинового кольца или группы -NR6R7;R3 представляет собой атом водорода, C1-6-алкильную группу, гидроксигруппу, C1-4-алкоксигруппу или атом галогена;R4 представляет собой атом водорода, C1-6-алкильную группу, С 1-4-алкоксигруппу или атом галогена;R5 представляет собой атом водорода или атом галогена;R6 и R7 вместе с атомом азота представляют собой пирролидиновое кольцо; если m равно 0, то р равно 1, 2 или 3,если m равно 1, то р равно 0, 1 или 2,если m равно 2, то р равно 0 или 1; если m равно 3, то р равно 0; иn равно от 0 до 3; при условии, что производное формулы (I) не представляет собой: 9-[2-(1H-индол-3-ил)этил]-2-пиридин-4-ил-6,7,8,9-тетрагидро-4H-пиримидо[1,2-а]пиримидин-4-он; 9-[3-(1 Н-индол-3-ил)пропил]-2-пиридин-4-ил-6,7,8,9-тетрагидро-4H-пиримидо[1,2-а]пиримидин-4-он; 1-[2-(1 Н-индол-3-ил)этил]-7-пиридин-4-ил-2,3-дигидроимидазо[1,2-а]пиримидин-5(1 Н)-он или 1-[3-(1 Н-индол-3-ил)пропил]-7-пиридин-4-ил-2,3-дигидроимидазо[1,2-а]пиримидин-5(1H)-он. В частности, настоящее изобретение относится к производным пиримидона, или его солям, или их сольватам, или их гидратам, где R1 представляет собой незамещенную пиридинильную группу или незамещенное 4-пиримидиновое кольцо. Настоящее изобретение относится также к производным пиримидона, представленным формулой (I),где R1 представляет собой пиридиновое кольцо, выбранным из группы, включающей соединения из табл. 1 А:1 (+)-(6R)-9-(6,7-дигидро-5 Н-[1]пириндин-6-илметил)-7,7-диметил-2-(пиридин-4-ил)-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-он, 2 (-)-(6S)-9-(6,7-дигидро-5 Н-[1]пириндин-6-илметил)-7,7-диметил-2-(пиридин-4-ил)-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-он, 3 (+)-(6R)-9-(6,7-дигидро-5 Н-[1]пириндин-6-илметил)-2-(пиридин-4-ил)-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-он, 4 (+/-)-7,7-диметил-9-(2-метил-6,7-дигидро-5 Н-[1]пириндин-6-илметил)-2-(пиридин-4-ил)-6,7,8,9 тетрагидропиримидо[1,2-а]пиримидин-4-он, 5 (+)-7,7-диметил-9-(2-метил-6,7-дигидро-5H-[1]пириндин-6-илметил)-2-(пиридин-4-ил)-6,7,8,9 тетрагидропиримидо[1,2-а]пиримидин-4-он, 6 (-)-7,7-диметил-9-(2-метил-6,7-дигидро-5 Н-[1]-пириндин-6-илметил)-2-(пиридин-4-ил)-6,7,8,9 тетрагидропиримидо[1,2-а]пиримидин-4-он, 7 (+/-)-9-(2,3-дигидробензофуран-2-илметил)-7,7-диметил-2-(пиридин-4-ил)-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-он, 8 9-(фуро[3,2-b]пиридин-2-илметил)-7,7-диметил-2-(пиридин-4-ил)-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-он, 9 9-(бензофуран-2-илметил)-7,7-диметил-2-(пиридин-4-ил)-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-он, 10 (+/-)-9-(2-хлор-6,7-дигидро-5 Н-[1]пириндин-6-илметил)-7,7-диметил-2-(пиридин-4-ил)-6,7,8,9 тетрагидропиримидо[1,2-а]пиримидин-4-он, 11 (+/-)-7,7-диметил-2-(пиридин-4-ил)-9-[2-(пиридин-4-ил)-6,7-дигидро-5 Н-[1]пириндин-6-илметил]-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-он, 12 (+/-)-7,7-диметил-9-(2-фенил-6,7-дигидро-5H-[1]пириндин-6-илметил)-2-(пиридин-4-ил)-6,7,8,9 тетрагидропиримидо[1,2-а]пиримидин-4-он,-3 00773713 (+/-)-7,7-диметил-2-(пиридин-4-ил)-9-[2-(пирролидин-1-ил)-6,7-дигидро-5H-[1]пириндин-6 илметил]-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-он, 14 (+/-)-7,7-дифтор-9-(2-метил-6,7-дигидро-5H-[1]пириндин-6-илметил)-2-(пиридин-4-ил)-6,7,8,9 тетрагидропиримидо[1,2-а]пиримидин-4-он, 15 9-+)-(6R)-6,7-дигидро-5 Н-[1]пириндин-6-илметил)-(+/-)-7-метил-2-(пиридин-4-ил)-6,7,8,9 тетрагидропиримидо[1,2-а]пиримидин-4-он,или их соли, или их сольваты, или их гидраты. Настоящее изобретение относится также к производным пиримидона, представленным формулой (I),где R1 представляет собой пиридиновое кольцо, выбранным из группы, включающей соединения из табл. 2 А:1 9-хроман-2-илметил-8-метил-2-пиридин-4-ил-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-он, 2 9-(8-метокси-2,3-дигидробензо[1,4]диоксин-2-илметил)-8-метил-2-пиридин-4-ил-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-он, 3 9-(2,3-дигидробензо[1,4]диоксин-2-илметил)-8-метил-2-пиридин-4-ил-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-он, 4 9-(5-метокси-2,3-дигидробензо[1,4]диоксин-2-илметил)-8-метил-2-пиридин-4-ил-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-он, 5 9-(6,7-дигидро-5 Н-[1]пириндин-6-(R)-илметил)-8,8-диметил-2-пиридин-4-ил-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-он, 6. 9-хроман-2-илметил-8,8-диметил-2-пиридин-2-ил-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-он, 7. 9-(2,3-дигидробензо[1,4]диоксин-2-илметил)-8,8-диметил-2-пиридин-4-ил-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-он, 8. 9-(8-фтор-5-метоксихроман-3-илметил)-8,8-диметил-2-пиридин-4-ил-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-он, 9 9-фуро[3,2-b]пиридин-2-илметил-8-метил-2-пиридин-4-ил-6,7,8,9-тетрагидропиримидо[1,2-а] пиримидин-4-он, 10 9-(6,7-дигидро-5 Н-[1]пириндин-6-(R)-илметил)-8-метил-2-пиридин-4-ил-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-он, 11 9-(6,7-дигидро-5 Н-[2]пириндин-6-илметил)-8-метил-2-пиридин-4-ил-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-он, 12 9-(6,7-дигидро-5 Н-[1]пириндин-6-(S)-илметил)-8-метил-2-пиридин-4-ил-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-он,или их соли, или их сольваты, или их гидраты. Настоящее изобретение относится также к производным пиримидона, представленным формулой (I), гдеR1 представляет собой пиримидиновое кольцо, выбранным из группы, включающей соединения из табл. 1 В:1 9-(6,7-дигидро-5 Н-циклопентапиразин-6-илметил)-7,7-диметил-2-пиримидин-4-ил-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-он, 2 (+/-)-7,7-диметил-2-(пиримидин-4-ил)-9-(2-фенил-6,7-дигидро-5H-[1]пириндин-6-илметил)-6,7,8,9 тетрагидропиримидо[1,2-а]пиримидин-4-он, 3 (+/-)-9-(2-хлор-6,7-дигидро-5 Н-[1]пириндин-6-илметил)-7,7-диметил-2-(пиримидин-4-ил)-6,7,8,9 тетрагидропиримидо[1,2-а]пиримидин-4-он, 4 (+/-)-9-(хроман-3-илметил)-7,7-диметил-2-(пиримидин-4-ил)-6,7,8,9-тетрагидропиримидо[1,2-а] пиримидин-4-он, 5 (+/-)-9-(6,7-дигидро-5H-[2]пириндин-6-илметил)-7,7-диметил-2-(пиримидин-4-ил)-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-он, 6 (-)-(S)-9-(2,3-дигидробензофуран-2-илметил)-7,7-диметил-2-(пиримидин-4-ил)-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-он, 7 (+/-)-9-(8-фтор-5-метоксихроман-3-илметил)-7,7-диметил-2-(пиримидин-4-ил)-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-он, 8 (+/-)-9-(2,3-дигидробензо[1,4]диоксин-2-илметил)-7,7-диметил-2-(пиримидин-4-ил)-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-он, 9 (+/-)-9-(5-метокси-2,3-дигидробензо[1,4]диоксин-2-илметил)-7,7-диметил-2-(пиримидин-4-ил)6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-он, 10 (-)-(6S)-9-(6,7-дигидро-5 Н-[1]пириндин-6-илметил)-7,7-диметил-2-(пиримидин-4-ил)-6,7,8,9 тетрагидропиримидо[1,2-а]пиримидин-4-он, 11 (+)-(6R)-9-(6,7-дигидро-5 Н-[1]пириндин-6-илметил)-7,7-диметил-2-(пиримидин-4-ил)-6,7,8,9 тетрагидропиримидо[1,2-а]пиримидин-4-он, 12 9-(2-фуро[2,3-b]пиридин-3-ил-этил)-7,7-диметил-2-(пиримидин-4-ил)-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-он, 13 9-бензофуран-2-илметил-7,7-диметил-2-(пиримидин-4-ил)-6,7,8,9-тетрагидропиримидо[1,2-а] пиримидин-4-он, 14 (+/-)-7,7-диметил-9-(2-метил-6,7-дигидро-5H-[1]пириндин-6-илметил)-2-(пиримидин-4-ил)-6,7,8,9 тетрагидропиримидо[1,2-а]пиримидин-4-он,-4 007737 или их соли, или их сольваты, или их гидраты. Настоящее изобретение относится также к производным пиримидона, представленным формулой(I), где R1 представляет собой пиримидин, включающим соединения из табл. 2 В:1 9-(8-метокси-2,3-дигидробензо[1,4]диоксин-2-илметил)-8-метил-2-пиримидин-4-ил-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-он, 2 9-(2,3-дигидробензо[1,4]диоксин-2-илметил)-8,8-диметил-2-пиримидин-4-ил-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-он, 3 9-хроман-2-илметил-8-метил-2-пиримидин-4-ил-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-он, 4 9-(5-фтор-8-метоксихроман-2-илметил)-8-метил-2-пиримидин-4-ил-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-он, 5 9-(5-фтор-8-метоксихроман-2-илметил)-8,8-диметил-2-пиримидин-4-ил-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-он, 6 9-хроман-2-илметил-8,8-диметил-2-пиримидин-4-ил-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин 4-он, 7 9-(8-метокси-2,3-дигидробензо[1,4]диоксин-2-илметил)-8,8-диметил-2-пиримидин-4-ил-6,7,8,9 тетрагидропиримидо[1,2-а]пиримидин-4-он, 8 9-(2,3-дигидробензо[1,4]диоксин-2-илметил)-8-метил-2-пиримидин-4-ил-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-он, 9 9-(5-метокси-2,3-дигидробензо[1,4]диоксин-2-илметил)-8-метил-2-пиримидин-4-ил-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-он, 10 9-(5-метокси-2,3-дигидробензо[1,4]диоксин-2-илметил)-8,8-диметил-2-пиримидин-4-ил-6,7,8,9 тетрагидропиримидо[1,2-а]пиримидин-4-он, 11 9-(6,7-дигидро-5 Н-[1]пириндин-6-(R)-илметил)-8-метил-2-пиримидин-4-ил-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-он, 12 9-(6,7-дигидро-5H-[1]пириндин-6-(R)-илметил)-8,8-диметил-2-пиримидин-4-ил-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-он, 13 9-(6,7-дигидро-5H-[1]пириндин-6-(S)-илметил)-8,8-диметил-2-пиримидин-4-ил-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-он, 14 9-фуро[3,2-b]пиридин-2-илметил-8-метил-2-пиримидин-4-ил-6,7,8,9-тетрагидропиримидо[1,2 а]пиримидин-4-он, 15 9-(6,7-дигидро-5 Н-[1]пириндин-6-(S)-илметил)-8-метил-2-пиримидин-4-ил-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-он, 16 9-(6,7-дигидро-5 Н-[2]пириндин-6-илметил)-8-метил-2-пиримидин-4-ил-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-он,или их соли, или их сольваты, или их гидраты. Согласно другому аспекту в настоящем изобретении предложено лекарственное средство, содержащее в качестве активного ингредиента вещество, выбранное из группы, состоящей из производных пиримидона, представленных формулой (I), и их физиологически приемлемых солей, их сольватов и их гидратов. В качестве предпочтительных воплощений лекарственного средства предложено вышеупомянутое лекарственное средство, которое используют для профилактического и/или терапевтического лечения заболеваний, вызванных аномальной активностью GSK3 или GSK3 и cdk5/p25, и вышеупомянутое лекарственное средство, которое используют для профилактического и/или терапевтического лечения нейродегенеративных заболеваний, а также других заболеваний, таких как инсулиннезависимый сахарный диабет (такой как диабет II типа) и ожирение; маниакально-депрессивный психоз; шизофрения; алопеция; прекращение курения и другие абстинентные синдромы, эпилепсия; виды рака, такие как рак молочной железы, немелкоклеточная легочная карцинома, рак щитовидной железы, Т-или В-клеточная лейкемия и некоторые вирус-индуцированные опухоли. В качестве дополнительных предпочтительных воплощений в настоящем изобретении предложены вышеупомянутое лекарственное средство, где заболевания представляют собой нейродегенеративные заболевания и выбраны из группы, состоящей из болезни Альцгеймера, болезни Паркинсона, бокового амиотрофического склероза, тауопатий (например, лобно-височной деменции, кортикобазальной дегенерации, болезни Пика, прогрессирующего супрануклеарного паралича) и других деменций, включая сосудистую деменцию; острого инсульта и других травматических повреждений; инсультов (например, старческой дегенерации желтого пятна); травмы спинного или головного мозга; периферических нейропатий; ретинопатий и глаукомы, и вышеупомянутое лекарственное средство в форме фармацевтической композиции, содержащей указанное выше вещество в качестве активного ингредиента вместе с одной или более чем одной фармацевтической добавкой. В настоящем изобретении дополнительно предложен ингибитор активности GSK3 или GSK3 иcdk5/p25, содержащий в качестве активного ингредиента вещество, выбранное из группы, состоящей из производных пиримидона формулы (I) и их солей, их сольватов и их гидратов. Согласно другим аспектам в настоящем изобретении предложено применение производных пиримидона формулы (I) и их физиологически приемлемых солей, их сольватов и их гидратов для изготовле-5 007737 ния лекарственного средства для профилактического и/или терапевтического лечения заболеваний, вызванных аномальной активностью GSK3 или GSK3 и cdk5/p25; применение производных пиримидона формулы (I) и их физиологически приемлемых солей, их сольватов и их гидратов для изготовления лекарственного средства для профилактического и/или терапевтического лечения нейродегенеративных заболеваний, например таких, как упомянуто выше; а также применение производных пиримидона формулы (I) и их физиологически приемлемых солей, их сольватов и их гидратов для изготовления лекарственного средства для профилактического и/или терапевтического лечения инсулиннезависимого диабета,ожирения, маниакально-депрессивного психоза, шизофрении, алопеции, прекращения курения, эпилепсии или видов рака, таких как рак молочной железы, немелкоклеточная легочная карцинома, рак щитовидной железы, Т- или В-клеточная лейкемия или вирус-индуцированная опухоль. При использовании здесь,C1-6-алкильная группа представляет собой прямую или разветвленную алкильную группу, имеющую от 1 до 6 атомов углерода, например метильную группу, этильную группу, н-пропильную группу,изопропильную группу, н-бутильную группу, изобутильную группу, втор-бутильную группу, тpeтбутильную группу, н-пентильную группу, изопентильную группу, неопентильную группу, 1,1 диметилпропильную группу, н-гексильную группу, изогексильную группу и тому подобное;C1-4-алкоксигруппа представляет собой алкилоксигруппу, имеющую от 1 до 4 атомов углерода, например метоксигруппу, этоксигруппу, пропоксигруппу, изопропоксигруппу, бутоксигруппу, изобутоксигруппу, втop-бутоксигруппу, тpeт-бутоксигруппу и тому подобное; атом галогена представляет собой атом фтора, хлора, брома или йода. Уходящая группа представляет собой группу, которая может быть легко отщеплена и замещена, такой группой может быть, например, тозилокси, мезилокси, бромид и тому подобное. Соединения, представленные вышеуказанной формулой (I), могут образовывать соль. При наличии кислой группы, примеры солей включают соли щелочных металлов и щелочно-земельных металлов, таких как литий, натрий, калий, магний и кальций; соли аммиака и амины, такие как метиламин, диметиламин,триметиламин, дициклогексиламин, трис(гидроксиметил)аминометан, N,N-бис(гидроксиэтил)пиперазин,2-амино-2-метил-1-пропанол, этаноламин, N-метилглюкамин и L-глюкамин; или соли с основными аминокислотами, такими как лизин, -гидроксилизин и аргинин. Соли присоединения оснований для кислых соединений получают стандартными способами, хорошо известными в данной области. При наличии основной группы, примеры включают соли с минеральными кислотами, такими как соляная кислота, бромисто-водородная кислота, серная кислота, азотная кислота, фосфорная кислота; соли с органическими кислотами, такими как метансульфокислота, бензолсульфокислота, паратолуолсульфокислота, уксусная кислота, пропионовая кислота, винная кислота, фумаровая кислота, малеиновая кислота, яблочная кислота, щавелевая кислота, янтарная кислота, лимонная кислота, бензойная кислота,миндальная кислота, коричная кислота, молочная кислота, гликолевая кислота, глюкуроновая кислота,аскорбиновая кислота, никотиновая кислота и салициловая кислота; или соли с кислыми аминокислотами, такими как аспарагиновая кислота и глутаминовая кислота. Соли добавления кислот для основных соединений получают стандартными способами, хорошо известными в данной области, которые включают, но не ограничиваются этим, растворение свободного основания в водном спиртовом растворе, содержащем подходящую кислоту, и выделение соли путем выпаривания раствора или путем взаимодействия свободного основания и кислоты в органическом растворителе, и в этом случае соль выделяют непосредственно, или осаждают вторым органическим растворителем, или она может быть получена путем концентрирования раствора. Кислоты, которые могут быть использованы для получения солей добавления кислот, включают предпочтительно кислоты, которые дают в сочетании со свободным основанием фармацевтически приемлемые соли, то есть соли, чьи анионы являются относительно безвредными для животного организма в фармацевтических дозах солей, так что полезные свойства, присущие свободному основанию, не дискредитируются побочными эффектами, приписываемыми анионам. Хотя приемлемые с медицинской точки зрения соли основных соединений являются предпочтительными, все соли добавления кислот также находятся в рамках настоящего изобретения. Кроме производных пиримидона, представленных вышеуказанной формулой (I), и их солей, их сольваты и гидраты также находятся в рамках настоящего изобретения. Производные пиримидона, представленные вышеуказанной формулой (I), могут иметь один или более асимметричных атомов углерода. Что касается стереохимии таких асимметричных атомов углерода, то они независимо могут находиться как в (R)-, так и в (S)-конфигурации, и производное пиримидона может существовать в виде стереоизомеров, таких как оптические изомеры или диастереоизомеры. Любые стереоизомеры в чистом виде, любые смеси стереоизомеров, рацематов и тому подобное находятся в рамках настоящего изобретения. Примеры предпочтительных соединений по настоящему изобретению представлены в табл. 1 А, 2 А,1 В и 2 В ниже. Однако объем настоящего изобретения не ограничивается этими соединениями. Предпочтительные соединения по настоящему изобретению, представленные формулой (I), включают также соединения, где:-6 007737 кольцо, или 4- или 5-пиримидиновое кольцо, и более предпочтительно 4-пиримидиновое кольцо, которое может быть замещено C1-2-алкильной группой, C1-2-алкоксигруппой или атомом галогена; и/или(2) X представляет собой два атома водорода или C1-2-алкильную группу и атом водорода;(3) Y представляет собой связь или метиленовую группу, возможно замещенную одной или двумя группами, выбранными из C1-3-алкильной группы или гидроксигруппы; и/или(4) R2 представляет собой гетероциклическое бициклическое кольцо, имеющее 1-4 гетероатома,выбранных из атома кислорода, атома серы и атома азота, и 5-9 атомов углерода, формулы где каждый А, В, С и D независимо представляет собой атом углерода или атом азота, и W представляет собой насыщенное или ненасыщенное 5- или 6-членное циклическое кольцо, включающее от 0 до 2 гетероатомов, таких как атом кислорода, атом серы или атом азота; группа R2 может быть замещена по атому углерода или, если возможно, по атому азота одним или двумя атомами или группами, выбранными из атома галогена, C1-6-алкильной группы, гидроксигруппы, С 1-4-алкоксигруппы, бензольного кольца, пиридинового кольца или группы -NR6R7; при условии, что, если R1 представляет собой пиридиновое кольцо и R2 представляет собой индольное кольцо, R3, R4 и R5 не являются атомами водорода и (m+р) отличается от 1 или 2. Более предпочтительные соединения по настоящему изобретению, представленные формулой (I),включают также соединения, где:(1) R1 представляет собой незамещенное 4-пиридиновое кольцо или 4-пиримидиновое кольцо; и/или(2) X представляет собой два атома водорода; и/или(4) R3 и R4, каждый независимо, представляет собой атом водорода, атом галогена или C1-2-алкильную группу; и/или(5) R2 представляет собой гетероциклическое бициклическое кольцо формулы где каждый А, В, С и D независимо представляет собой атом углерода или атом азота, и каждый Т иU независимо представляет собой атом углерода или гетероатом, такой как атом кислорода, атом серы или атом азота, и s равно 0 или 1; илиR2 представляет собой гетероциклическое бициклическое кольцо формулы где каждый А, В, С и D независимо представляет собой атом углерода или атом азота, и каждый Т и U независимо представляет собой атом углерода или гетероатом, такой как атом кислорода или атом серы; или гетероциклическое кольцо, представленное R2, представляет собой гетероциклическое бициклическое кольцо формулы где каждый А, В, С и D независимо представляет собой атом углерода или атом азота, и каждый Т иU независимо представляет собой атом углерода или гетероатом, такой как атом азота,при условии, что, если R1 представляет собой пиридиновое кольцо и R2 представляет собой индольное кольцо, R3, R4 и R5 не являются атомами водорода и (m+ р) отличается от 1 или 2; предпочтительно R2 представляет собой группу циклопентапиразин; 6,7-дигидроциклопентапиразин; бензофуран, 2,3-дигидробензофуран; 1,4-бензодиоксан; 2,3-дигидробензо[1,4]диоксин; хроман; изохроман; хиноксалин; хиназолин; фуропиридин; пириндин или 6,7-дигидропириндин; предпочтительно группу 6,7-дигидроциклопентапиразин, 6,7-дигидропириндин, бензофуран, 2,3-дигидробензофуран, хроман, 2,3 дигидробензо[1,4]диоксин или фуропиридин; и более предпочтительно соединения, где R1 и X, и Y, иR3, и R4, и R2 такие, как они определены выше. В качестве дополнительного объекта настоящее изобретение относится также к способам получения соединений, представленных вышеуказанной формулой (I). Эти соединения могут быть получены,например, согласно способам, описанным ниже. Способ получения Соединения пиримидона, представленные вышеуказанной формулой (I), могут быть получены согласно схеме 1.(На указанной выше схеме определения R1, R2, R3, R4, R5, X, Y, р, m и n такие же, как те, которые уже описаны для соединения формулы (I).) Производное пиримидинона, представленное вышеуказанной формулой (III), где R1 такой, как определено для соединения формулы (I), подвергают взаимодействию с основанием, таким как гидрид натрия, карбонат натрия или карбонат калия, в растворителе, таком как N,N-диметилформамид, N-метилпирролидин, N,N-диметилацетамид или хлороформ, при подходящей температуре в диапазоне от 0 до 130 С, в токе воздуха, затем с соединением формулы (II), где R2, X, Y и n такие, как определено для соединения формулы (I), и L представляет собой уходящую группу, предпочтительно бромид или мезилоксигруппу, добавляют для получения соединения вышеуказанной формулы (I). Соединение формулы (II) имеется в продаже или может быть синтезировано в соответствии с хорошо известными специалистам в данной области способами. Например, соединения формулы (II) могут быть получены аналогично способу, описанному в US 5559256. В качестве другого примера, соединения формулы (II), гдеX представляет собой два атома водорода,L представляет собой уходящую группу,n равно 1,Y представляет собой связь, иR2 представляет собой гетероциклическое бициклическое кольцо формулы могут быть получены аналогично способу, описанному в US 4957928 или US 5137901; или гдеR2 представляет собой гетероциклическое бициклическое кольцо формулы где А, В, С и D такие, как определено выше,каждый Т и U представляет собой атом углерода иs равно 0; могут быть получены аналогично способу, описанному в WO 99/02517 или представленному на схеме 2. Схема 2 Согласно способу, представленному на схеме 2, дикислоту формулы (XI) сначала этерифицируют,-8 007737 например, под действием тионилхлорида в спиртовом растворителе, таком как этанол, и затем сразу же восстанавливают под действием боргидрида натрия в присутствии карбоната кальция с получением соединения формулы (X). Соединение (X) подвергают взаимодействию с тионилхлоридом с получением соответствующего дихлоридного соединения формулы (IX), которое затем превращают в диэфир формулы (VIII) путем взаимодействия с натрийдианионным производным диэтилмалоната в растворителе, таком как этанол. Соединение (VIII) затем омыляют под действием концентрированного гидроксида калия в спиртовом растворителе, таком как этанол, нейтрализуют путем добавления концентрированной соляной кислоты, декарбоксилируют путем нагревания и затем этерифицируют путем обработки раствором соляной кислоты в этаноле с получением соединения (VII). Эфир (VII) может быть разделен на его энантиомеры с помощью способов, хорошо известных специалистам в данной области, таких как, например,ферментативный путь или химическое разделение. Эфир формулы (VII) затем может быть восстановлен до спирта формулы (VI) с помощью, например, алюмогидрида лития в растворителе, таком как тетрагидрофуран. Гидроксигруппу превращают в уходящую группу. Например, спирт подвергают взаимодействию с трифенилфосфина дибромидом в растворителе, таком как диоксан, с получением соединения (II), как определено выше, где L представляет собой бромид. Соединение формулы (III) может быть получено согласно способу, представленному на схеме 3. Схема 3(В указанной выше схеме определения R1, R3, R4, R5, р и m такие же, как уже описано выше.) Согласно этому способу 3-кетоэфир формулы (IV), где R1 и R5 такие, как определено для соединения формулы (I), и R представляет собой алкильную группу, такую как, например, метил или этил, подвергают взаимодействию с соединением формулы (V). Реакцию можно выполнять в присутствии карбоната калия в спиртовом растворителе, таком как метанол, этанол и тому подобное, или без него, при соответствующей температуре в диапазоне от 25 до 140 С, в токе воздуха. Альтернативно, соединения формулы (III), где R5 представляет собой атом водорода, могут быть галогенированы для получения соединений формулы (III), где R5 представляет собой атома галогена,такой как атом брома или атом хлора. Реакцию можно выполнять в кислой среде, такой как уксусная кислота или пропионовая кислота, в присутствии бромсукцинимида, или хлорсукцимида, или брома. Кроме того, соединения формулы (III), где R5 представляет собой атом фтора, могут быть получены аналогично способу, описанному в Tetrahedron Letters, vol. 30, No. 45, pp. 6113-6116, 1989. Соединения формулы (V) или (IV) имеются в продаже или могут быть синтезированы в соответствии с хорошо известными способами специалистами в данной области. Например, соединения формулы (IV), где R1 представляет собой пиридиновое кольцо или пиримидиновое кольцо, возможно замещенное С 1-4-алкильной группой, С 1-4-алкоксигруппой или атомом галогена, могут быть получены путем взаимодействия соответственно изоникотиновой кислоты или пиримидинкарбоновой кислоты, возможно замещенной C1-4-алкильной группой, С 1-4-алкоксигруппой или галогеном, с соответствующим моноэфиром малоновой кислоты. Реакция может быть выполнена с помощью способов, хорошо известных специалистам в данной области, например в присутствии связывающего агента, такого как 1,1'-карбонилбис-1H-имидазол, в растворителе, таком как тетрагидрофуран, при температуре в диапазоне от 20 до 70 С. Соединения формулы (I) также могут быть получены, исходя из другого соединения формулы (I),специалистом в данной области с помощью хорошо известных способов. В упомянутых выше реакциях иногда может быть необходима защита или удаление защиты функциональной группы. Подходящая защитная группа Рg может быть выбрана в зависимости от типа функциональной группы, и может использоваться способ, описанный в литературе. Примеры защитных групп, способов защиты и удаления защиты даны, например, в Protective Groups in Organic Synthesis,Greene et al., 2nd Ed. (John WileySons, Inc., New York). Соединения по настоящему изобретению обладают ингибирующей активностью в отношенииGSK3. Следовательно, соединения по настоящему изобретению полезны в качестве активного ингредиента для приготовления лекарственного средства, которое дает возможность осуществлять профилактическое и/или терапевтическое лечение заболевания, вызванного аномальной активностью GSK3 илиGSK3 и cdk5/p25, и особенно нейродегенеративных заболеваний, таких как болезнь Альцгеймера. Кро-9 007737 ме того, соединения по настоящему изобретению также полезны в качестве активного ингредиента для приготовления лекарственного средства для профилактического и/или терапевтического лечения нейродегенеративных заболеваний, таких как болезнь Паркинсона, боковой амиотрофический склероз, тауопатии (например, лобно-височная деменция, кортикобазальная дегенерация, болезнь Пика, прогрессирующий супрануклеарный паралич) и другие деменции, включая сосудистую деменцию; острый инсульт и другие травматические повреждения; острые нарушения мозгового кровообращения (например, старческая дегенерация желтого пятна); травма спинного или головного мозга; периферические нейропатии; ретинопатии и глаукома; и другие заболевания, такие как инсулиннезависимый сахарный диабет (такой как диабет II типа) и ожирение; маниакально-депрессивный психоз; шизофрения; алопеция; прекращение курения и другие абстинентные синдромы, эпилепсия; виды рака, такие как рак молочной железы, немелкоклеточная легочная карцинома, рак щитовидной железы, Т- или В-клеточная лейкемия и некоторые вирус-индуцированные опухоли. Кроме того, настоящее изобретение относится к способу лечения нейродегенеративных заболеваний, вызванных аномальной активностью GSK3 или GSK3 и cdk5/p25, и вышеупомянутых заболеваний, при котором в организм животного, нуждающегося в таком лечении, вводят эффективное количество соединения формулы (I). В качестве активного ингредиента лекарственного средства по настоящему изобретению может быть использовано вещество, которое выбрано из группы, состоящей из соединения, представленного вышеуказанной формулой (I), и его фармакологически приемлемых солей, их сольватов и их гидратов. Вещество, per se, может быть введено в качестве лекарственного средства по настоящему изобретению,однако, желательно вводить это лекарственное средство в форме фармацевтической композиции, содержащей вышеупомянутое вещество в качестве активного ингредиента и одну или более чем одну фармацевтическую добавку. В качестве активного ингредиента лекарственного средства по настоящему изобретению может быть использована комбинация двух или более вышеупомянутых веществ. Вышеуказанная фармацевтическая композиция может быть дополнена активным ингредиентом другого лекарственного средства для лечения вышеупомянутых заболеваний. Тип фармацевтической композиции конкретно не ограничивается, и композиция может быть предложена в виде любой лекарственной формы для перорального или парентерального введения. Например, фармацевтическая композиция может быть приготовлена в форме фармацевтических композиций для перорального введения, таких как гранулы,мелкие гранулы, порошки, твердые капсулы, мягкие капсулы, сиропы, эмульсии, суспензии, растворы и тому подобное, или в форме фармацевтических композиций для парентерального введения, таких как инъекции для внутривенного, внутримышечного или подкожного введения, капельные инфузии, препараты для трансдермального введения, препараты для введения через слизистую, капли в нос, ингаляции,суппозитории и тому подобное. Инъекции или капельные инфузии могут быть приготовлены в форме порошкообразных препаратов, например в форме лиофилизированных препаратов, и могут использоваться непосредственно перед применением путем растворения в подходящей водной среде, такой как физиологический солевой раствор. Препараты с замедленным высвобождением, такие как препараты,покрытые полимером, могут непосредственно вводиться интрацеребрально. Типы фармацевтических добавок, использующихся для производства фармацевтической композиции, соотношения содержания фармацевтических добавок относительно содержания активного ингредиента и способы приготовления фармацевтической композиции могут быть соответственно выбраны специалистами в данной области. В качестве фармацевтических добавок могут быть использованы неорганические или органические вещества, твердые или жидкие вещества. В основном, фармацевтические добавки можно включать в соотношении, варьирующем от 1 до 90 вес.% на основе веса активного ингредиента. Примеры эксципиентов, использованных для приготовления твердых фармацевтических композиций, включают, например, лактозу, сахарозу, крахмал, тальк, целлюлозу, декстрин, каолин, карбонат кальция и тому подобное. Для приготовления жидких композиций для перорального введения могут быть использованы стандартные инертные растворители, такие как вода или растительное масло. Жидкая композиция может содержать, кроме инертного растворителя, вспомогательные вещества, такие как увлажняющие агенты, суспензирующие агенты, подсластители, ароматизаторы, красители и консерванты. Жидкую композицию можно вводить в капсулы, сделанные из абсорбируемого вещества, такого как желатин. Примеры растворителей или суспензионных сред, использующихся для приготовления композиций для парентерального введения, например инъекций, суппозиториев, включают воду, пропиленгликоль, полиэтиленгликоль, бензиловый спирт, этилолеат, лецитин и тому подобное. Примеры основных веществ, использующихся для суппозиториев, включают, например, масло какао, эмульгированное масло какао, лауриновый жир, витепсол. Доза и частота введения лекарственного средства по настоящему изобретению конкретно не ограничены, и они соответственно могут быть выбраны в зависимости от условий, таких как цель профилактического и/или терапевтического лечения, вид заболевания, вес тела или возраст пациента, тяжесть заболевания и тому подобное. Обычно суточная доза для перорального введения взрослому может составлять от 0,01 до 1000 мг (вес активного ингредиента), и эта доза может вводиться 1 раз в день, или не- 10007737 сколько раз в день в виде раздельных порций, или 1 раз в несколько дней. Если лекарственное средство используют в виде инъекции, введения предпочтительно осуществляют непрерывно или периодически в суточной дозе от 0,001 до 100 мг (вес активного ингредиента) для взрослого. Химические примеры Настоящее изобретение будет объяснено более подробно со ссылкой на следующие основные примеры, однако, объем настоящего изобретения не ограничивается этими примерами. Часть А. R1=пиридиновое кольцо (табл. 1 А и 2 А). Пример 1 (соединение 1 из табл. 1 А). (+)-(6R)-9-(6,7-Дигидро-5 Н-[1]пириндин-6-илметил)-7,7 диметил-2-(пиридин-4-ил)-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-он. 1.1 7,7-Диметил-2-(пиридин-4-ил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-а]пиримидин-4-он. Смесь 5,9 г (30,55 ммоль) этил-3-(4-пиридил)-3-оксопропионата, 5,0 г (30,55 ммоль) 5,5-диметил 1,4,5,6-тетрагидро-2-пиримидинамина моногидрохлорида (полученного аналогично патенту US 4262122) и 6,33 г (45,82 ммоль) карбоната калия в 60 мл этанола кипятили с обратным холодильником в течение 12 ч. Охлажденную суспензию фильтровали и растворитель удаляли выпариванием. Полученный остаток растворяли в дихлорметане и промывали водой. Органическую фазу сушили и упаривали с получением 6,30 г (80%) продукта в виде бежевого твердого вещества. Т.пл.: 152-154 С. 1.2 (-)-(6R,5R)-(6,7-Дигидро-5 Н-[1]пириндин-6-ил)-(10,10-диметил-3,3-диокса-3-тиа-4-аза-трицикло[5.2.1.01,5]дец-4-ил]метанон. Суспензию 12 г (73,56 ммоль) (+/-)-6,7-дигидро-5 Н-[1]пириндин-6-карбоновой кислоты (полученной аналогично WO 99/02517) в 85 мл безводного диметилформамида обрабатывали 13,36 г (82,39 ммоль) 1,1'-карбонилдиимидазола и полученную смесь нагревали при 45 С в течение 1 ч. Добавляли 15,84 г(73,56 ммоль) (-)-10,2-камфосультама (Fluka) и 11,2 г (73,56 ммоль) 1,8-диазабицикло[5,4,0]ундец-7-ена и реакционную смесь перемешивали при 40 С в течение 18 ч. Выпавшее в осадок твердое вещество собирали фильтрацией, промывали этилацетатом, диэтиловым эфиром и сушили, получая 20,8 г (79%) продукта в виде белого твердого вещества. Т.пл.: 270-272 С.[]D20=-151 (с=1, СНСl3). 1.3 (+)-(6R)-6,7-Дигидро-5H-[1]пириндин-6-кapбoновая кислота. К раствору 20,6 г (57,15 ммоль) (-)-(6R,5R)-(6,7-дигидро-5 Н-[1]пириндин-6-ил)-(10,10-диметил-3,3 диокса-3-тиа-4-аза-трицикло[5.2.1.01,5]дец-4-ил]метанона в 300 мл смеси тетрагидрофуран/вода в соотношении 2:1 добавляли 2,88 г (68,6 ммоль) гидроксида лития. Смесь перемешивали при комнатной температуре в течение 5 ч. Добавляли воду и реакционную смесь экстрагировали этилацетатом. Водную фазу подкисляли уксусной кислотой до рН 6. Полученный осадок фильтровали и сушили с получением 7,5 г (81%) белого твердого вещества. Т.пл.: 236-237 С. []D20=+5,4 (с=0,5, диметилформамид). 1.4 (+)-(6R)-(6,7-Дигидро-5H-[1]пириндин-6-ил)метанол. К раствору 3,26 г (20 ммоль) (+)-6,7-дигидро-5 Н-[1]пириндин-6-карбоновой кислоты в 100 мл безводного тетрагидрофурана в атмосфере аргона добавляли 1,14 г (30 ммоль) алюмогидрида лития. Полученную смесь перемешивали при комнатной температуре в течение 1 ч. Избыток алюмогидрида лития гидролизовали 4,56 мл воды и 1,14 мл гидроксида натрия (15%). Осадок фильтровали и промывали диэтиловым эфиром, фильтрат упаривали с получением 2,88 г (97%) продукта в виде масла. []D20=+6,2(с=0,75, CH2Cl2). 1.5 6,7-Дигидро-5H-[1]пириндин-6-илметиловый эфир метансульфокислоты. К раствору 895 мг (6 ммоль) (+)-(6R)-(6,7-дигидро-5 Н-[1]пириндин-6-ил)метанола в 50 мл безводного дихлорметана при -15 С добавляли 0,918 мл (6,6 ммоль) триэтиламина и 0,465 мл (6 ммоль) метансульфонилхлорида. Полученную смесь перемешивали при 0 С в течение 45 мин. Затем смесь разбавляли водой и дихлорметаном и экстрагировали дихлорметаном. Органический слой сушили и упаривали с получением 1,4 г (100%) 6,7-дигидро-5H-[1]пириндин-6-илметилового эфира метансульфокислоты. 1.6 (+)-(6R)-9-(6,7-Дигидро-5 Н-[1]пириндин-6-илметил)-7,7-диметил-2-(пиридин-4-ил)-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-он. Суспензию 0,51 г (2 ммоль) 7,7-диметил-2-(пиридин-4-ил)-6,7,8,9-тетрагидро-4 Н-пиримидо[1,2-а] пиримидин-4-она в 10 мл безводного диметилформамида обрабатывали 96 мг (2 ммоль) гидрида натрия(50%-ная суспензия в минеральном масле) и полученную смесь перемешивали в течение 40 мин. Добавляли 0,455 г (2 ммоль) 6,7-дигидро-5 Н-[1]пириндин-6-илметилового эфира метансульфокислоты в 2 мл безводного диметилформамида и реакционную смесь перемешивали при комнатной температуре в течение 18 ч. Раствор обрабатывали водой и экстрагировали этилацетатом. Органическую фазу сушили и упаривали с получением грубого продукта, который очищали с помощью хроматографии на силикагеле, элюируя смесью этилацетат/метанол/диэтиламин в соотношении 98/2/0,2 с получением 0,383 г чистого продукта в форме свободного основания. Т.пл.: 182-184 С. []D20=+9,15 (с=0,5, CH2Cl2). Пример 2 (соединение 2 из табл. 1 А). (-)-(6S)-9-(6,7-Дигидро-5H-[1]пириндин-6-илметил)-7,7 диметил-2-(пиридин-4-ил)-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-он.(-)-10,2-камфосультама на стадии 1.2, получали соединение в виде свободного основания. Т.пл.: 182185 С. []D20=-6,6 (с=0,5, CH2Cl2). Пример 3 (соединение 3 из табл. 1 А). (+)-(6R)-9-(6,7-Дигидро-5H-[1]пириндин-6-илметил)-2-(пиридин-4-ил)-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-он. 3.1 2-(Пиридин-4-ил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-а]пиримидин-4-он. Смесь 8,98 г (46,5 ммоль) этил-3-(4-пиридил)-3-оксопропионата и 8,0 г (46,5 ммоль) 2-амино 3,4,5,6-тетрагидропиримидина дигидрохлорида (полученного согласно J. Org. Chem. 1955, 20, 829), и 19,3 г (139,5 ммоль) карбоната калия в 60 мл этанола кипятили с обратным холодильником в течение 18 ч. Раствор охлаждали и упаривали для удаления растворителя. Остаток обрабатывали водой и экстрагировали дихлорметаном. Экстракты сушили и упаривали с получением 8,0 г (75%) продукта в виде белого порошка. Т.пл.: 219 С. 3.2 (+)-(6R)-9-(6,7-Дигидро-5 Н-[1]пириндин-6-илметил)-2-(пиридин-4-ил)-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-он. Суспензию 0,46 г (2 ммоль) 2-(пиридин-4-ил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-а]пиримидин-4 она в 10 мл безводного диметилформамида обрабатывали 96 мг (2 ммоль) гидрида натрия (50%-ная суспензия в минеральном масле) и полученную смесь перемешивали в течение 40 мин. Добавляли 0,455 г(2 ммоль) 6,7-дигидро-5 Н-[1]пириндин-6-илметилового эфира метансульфокислоты в 2 мл безводного диметилформамида и реакционную смесь перемешивали при 45 С в течение 18 ч. Раствор обрабатывали водой и экстрагировали этилацетатом. Органическую фазу сушили и упаривали с получением грубого продукта, который очищали с помощью хроматографии на силикагеле, элюируя смесью этилацетат/метанол/аммиак в соотношении 90/10/1 с получением 0,373 г чистого продукта в форме свободного основания. Т.пл.: 174-175 С. []D20=+10,5 (c=1, CH2Cl2). Пример 4 (соединение 4 из табл. 1 А). (+/-)-7,7-Диметил-9-(2-метил-6,7-дигидро-5 Н-[1]пириндин 6-илметил)-2-(пиридин-4-ил)-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-он. Аналогично способу, описанному в примере 1, используя (+/-)2-метил-6,7-дигидро-5 Н-[1]пириндин-6-карбоновую кислоту вместо (+/-)-6,7-дигидро-5H-[1]пириндин-6-карбоновой кислоты, получали соединение в виде свободного основания. Т.пл.: 140-141 С. Пример 5 (соединение 5 из табл. 1 А). (+)-7,7-Диметил-9-(2-метил-6,7-дигидро-5 Н-[1]пириндин-6 илметил)-2-(пиридин-4-ил)-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-он. 180 мг (0,45 ммоль) (+/-)-7,7-диметил-9-(2-метил-6,7-дигидро-5 Н-[1]пириндин-6-илметил)-2-(пиридин-4-ил)-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-она (соединение 4) выделяли с помощью хиральной препаративной ВЭЖХ (CHIRALCEL OD 250x20), элюируя смесью гептан/этанол/диэтиламин в соотношении 85/15/0,1 с получением 0,071 г чистого продукта в форме свободного основания. tR: 12,48 мин. Т.пл.: 94-96 С. []D20=+6,79 (с=0,5, CH2Cl2). Пример 6 (соединение 6 из табл. 1 А). (-)-7,7-Диметил-9-(2-метил-6,7-дигидро-5H-[1]пириндин-6 илметил)-2-(пиридин-4-ил)-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-он. 180 мг (0,45 ммоль) (+/-)-7,7-диметил-9-(2-метил-6,7-дигидро-5 Н-[1]пириндин-6-илметил)-2-(пиридин-4-ил)-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-она (соединение 4) выделяли с помощью хиральной препаративной ВЭЖХ (CHIRALCEL OD 250x20), элюируя смесью гептан/этанол/диэтиламин в соотношении 85/15/0,1 с получением 0,075 г чистого продукта в форме свободного основания. tR: 17,25 мин. Т.пл.: 94-96 С. []D20=-5,61 (с=0,5, CH2Cl2). Пример 7 (соединение 7 из табл. 1 А). (+/-)-9-(2,3-Дигидробензофуран-2-илметил)-7,7-диметил-2(пиридин-4-ил)-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-он. Суспензию 0,51 г (2 ммоль) 7,7-диметил-2-(пиридин-4-ил)-6,7,8,9-тетрагидро-4 Н-пиримидо[1,2 а]пиримидин-4-она в 10 мл безводного диметилформамида обрабатывали 96 мг (2 ммоль) гидрида натрия(50%-ная суспензия в минеральном масле) и полученную смесь перемешивали при 40 С в течение 40 мин. Добавляли 0,52 г (2 ммоль) (+/-)-2-йодметил-2,3-дигидробензофурана (полученного согласно Synthesis 1997, (1), 23-25) в 2 мл безводного диметилформамида и реакционную смесь перемешивали при 60 С в течение 20 мин. Раствор обрабатывали водой и экстрагировали этилацетатом. Органическую фазу сушили и упаривали с получением грубого продукта, который очищали с помощью хроматографии на силикагеле, элюируя смесью дихлорметан/метанол/аммиак в соотношении 99/1/0,1-98/2/0,2 с получением 0,171 г чистого продукта в форме свободного основания. Т.пл.: 147-149 С. Пример 8 (соединение 8 из табл. 1 А). 9-(Фуро[3,2-b]пиридин-2-илметил)-7,7-диметил-2-(пиридин-4-ил)-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-он. 8.1 Фуро[3,2-b]пиридин-2-илметиловый эфир метансульфокислоты. Продукт получали аналогично способу, описанному на стадии 1.5, используя фуро[3,2-b]пиридин 2-ил-метанол (US 5559256 или ЕР 580402), и использовали как таковой на следующей стадии. 8.2 9-Фуро[3,2-b]пиридин-2-илметил-7,7-диметил-2-(пиридин-4-ил)-6,7,8,9-тетрагидропиримидо[1,2-а] пиримидин-4-он.- 12007737 Аналогично способу, описанному на стадии 1.6, используя фуро[3,2-b]пиридин-2-илметиловый эфир метансульфокислоты, получали соединение в форме свободного основания. Т.пл.: 170-171 С. Пример 9 (соединение 10 из табл. 1 А). (+/-)-9-(2-Хлор-6,7-дигидро-5 Н-[1]пириндин-6-илметил)7,7-диметил-2-(пиридин-4-ил)-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-он. 9.1 (+/-)-(2-Хлор-6,7-дигидро-5H-[1]пириндин-6-ил)метанол. К раствору 1,83 г (9,26 ммоль) (+/-)-2-хлор-6,7-дигидро-5H-[1]пириндин-6-карбоновой кислоты (полученной аналогично способу, описанному в WO 99/02517) в 50 мл безводного тетрагидрофурана в атмосфере аргона добавляли 0,52 г (13,89 ммоль) алюмогидрида лития. Полученную смесь перемешивали при комнатной температуре в течение 2 ч. Избыток алюмогидрида лития гидролизовали 2,13 мл воды и 0,53 мл гидроксида натрия (15%). Осадок фильтровали и промывали диэтиловым эфиром, фильтрат упаривали с получением 1,61 г (95%) продукта в виде масла. 9.2 (+/-)-2-Хлор-6,7-дигидро-5 Н-[1]пириндин-6-ил-метиловый эфир метансульфокислоты. Продукт получали аналогично способу, описанному на стадии 1.5, используя (+/-)-(2-хлор-6,7-дигидро-5H-[1]пириндин-6-ил)метанол. Продукт использовали как таковой на следующей стадии. 9.3 (+/-)-9-(2-Хлор-6,7-дигидро-5 Н-[1]пириндин-6-илметил)-7,7-диметил-2-(пиридин-4-ил)-6,7,8,9 тетрагидропиримидо[1,2-а]пиримидин-4-он. Продукт получали аналогично способу, описанному на стадии 1.6, используя (+/-)-2-хлор-6,7 дигидро-5H-[1]пириндин-6-ил-метиловый эфир метансульфокислоты. Соединение получали в форме свободного основания. Т.пл.: 180-181 С. Пример 10 (соединение 11 из табл. 1 А). (+/-)-7,7-Диметил-2-(пиридин-4-ил)-9-[2-(пиридин-4-ил)6,7-дигидро-5 Н-[1]пириндин-6-илметил]-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-он. Раствор 0,22 г (0,521 ммоль) (+/-)-9-(2-хлор-6,7-дигидро-5H-[1]пириндин-6-илметил)-7,7-диметил-2(пиридин-4-ил)-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-она в 3 мл безводного толуола и 0,5 мл этанола обрабатывали 0,625 мл (2 М раствор в воде) карбоната натрия, 36 мг (0,03 ммоль) тетракис(трифенилфосфин)палладия и 0,096 г (0,781 ммоль) пиридин-4-бороновой кислоты. После перемешивания в течение 24 ч при 140 С добавляли воду, смесь экстрагировали дихлорметаном. Органическую фазу сушили и упаривали с получением грубого продукта, который очищали с помощью хроматографии на силикагеле, элюируя смесью дихлорметан/метанол/аммиак в соотношении 99/1/0,1 с получением 0,049 г чистого продукта в форме свободного основания. Т.пл.: 170-171 С. Пример 11 (соединение 13 из табл. 1 А). (+/-)-7,7-Диметил-2-(пиридин-4-ил)-9-[(2-пирролидин-1 ил-6,7-дигидро-5 Н-[1]пириндин-6-илметил)]-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-он. Раствор 0,2 г (0,474 ммоль) (+/-)-9-(2-хлор-6,7-дигидро-5 Н-[1]пириндин-6-илметил)-7,7-диметил-2(пиридин-4-ил)-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-она в 20 мл безводного пирролидина обрабатывали 0,216 г (0,664 ммоль) карбоната цезия, 8,85 мг (0,142 ммоль) (S)-(-)-2,2'бис(дифенилфосфино)-1,1'-динафтила и 6,5 мг (0,07 ммоль) трис(дибензилиденацетон)дипалладия(0). После перемешивания при температуре кипения в течение 24 ч добавляли воду, смесь экстрагировали дихлорметаном. Органическую фазу сушили и упаривали с получением сырого продукта, который очищали с помощью хроматографии на силикагеле, элюируя смесью дихлорметан/метанол/аммиак в соотношении 99/1/0,1 с получением 0,184 г чистого продукта в форме свободного основания. Т.пл.: 170171 С. Пример 12 (соединение 14 из табл. 1 А). (+/-)-7,7-Дифтор-9-(2-метил-6,7-дигидро-5H-[1]пириндин-6-илметил)-2-(пиридин-4-ил)-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-она гидрохлорид (1:2). 12.1 5,5-Дифтор-1,4,5,6-тетрагидро-2-пиримидинамин. Продукт получали аналогично способу, описанному в патенте US 4262122, используя 2,2-дифтор 1,3-пропандиамин (Tetrahedron (1994) 50(29), 8617-8632), и использовали как таковой на следующей стадии. 12.2 7,7-Дифтор-2-(пиридин-4-ил)-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-он. Продукт получали аналогично стадии 3.1, используя 5,5-дифтор-1,4,5,6-тетрагидро-2-пиримидинамин, полученный на стадии 12.1. Т.пл.: 239-240 С. 12.3 (+/-)-7,7-Дифтор-9-(2-метил-6,7-дигидро-5 Н-[1]пириндин-6-илметил)-2-(пиридин-4-ил)-6,7,8,9 тетрагидропиримидо[1,2-а]пиримидин-4-она гидрохлорид (1:2). Продукт получали аналогично способу, описанному на стадии 1.6, получали соединение в форме свободного основания, которое превращали в гидрохлоридную соль. Т.пл.: 236-238 С. Пример 13 (соединение 15 из табл. 1 А). 9-+)-(6-R)-6,7-Дигидро-5 Н-[1]пириндин-6-илметил)-7 метил-2-(пиридин-4-ил)-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-он. 13.1 5-Метил-1,4,5,6-тетрагидро-2-пиримидинамина гидрохлорид. К раствору, содержащему 6,7 г (41,6 ммоль) 2-метил-1,3-пропандиамина гидрохлорид (Tetrahedron(1994) 50(29), 8617-8632) в 50 мл метанола, добавляли 83 мл раствора метилата натрия в метаноле(1 ммоль/мл) и полученную смесь обрабатывали 3,97 г (41,6 ммоль) гуанидин гидрохлорида. Реакционную смесь нагревали при 140 С в течение 3 ч. Раствор фильтровали, растворитель упаривали и полученный остаток использовали непосредственно на следующей стадии. 13.2 (+/-)-7-Метил-2-(пиридин-4-ил)-6,7,8,9-тетрагидро-4 Н-пиримидо[1,2-а]пиримидин-4-он. Продукт получали аналогично стадии 3.1, используя промежуточное соединение, полученное на- 13007737 стадии 13.1. 13.3 9-+)-(6-R)-6,7-Дигидро-5H-[1]пириндин-6-илметил)-7-метил-2-пиридин-4-ил-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-он. Продукт получали аналогично способу, описанному на стадии 1.6, используя (+/-)-7-метил-2(пиридин-4-ил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-а]пиримидин-4-он. Соединение получали в форме свободного основания. Т.пл.: 156-157 С. Пример 14 (соединение 10 из табл. 2 А). 9-(6,7-Дигидро-5 Н-[1]пириндин-6-(R)-илметил)-8-метил 2-пиридин-4-ил-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-он. 14.1 8-Метил-2-(пиридин-4-ил)-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-он. Смесь 6 г (31,0 ммоль) этил 3-(пиридин-4-ил)-3-оксопропионата, 4,6 г (31,0 ммоль) 6-метил-1,4,5,6 тетрагидропиримидин-2-иламина гидрохлорида (полученного согласно J. Org. Сhеm., 20, 1955, 829-838) и 6,44 г (46,0 ммоль) карбоната калия в 50 мл этанола кипятили с обратным холодильником в течение 18 ч. Реакционную смесь охлаждали и растворитель удаляли выпариванием. Полученный остаток обрабатывали водой и осадок собирали фильтрацией с получением 3,85 г (51%) продукта. Т.пл.: 245-247 С. 14.2 9-(6,7-Дигидро-5 Н-[1]пириндин-6-(R)-илметил)-8-метил-2-пиридин-4-ил-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-он. К раствору 0,15 г (0,62 ммоль) 8-метил-2-(пиридин-4-ил)-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-она в 3 мл безводного диметилформамида добавляли 0,032 г (0,81 ммоль) гидрида натрия (60%-ная суспензия в минеральном масле). Смесь перемешивали при 50 С в течение 30 мин. Добавляли 0,184 г(0,81 ммоль) 6,7-дигидро-5 Н-[1]пириндин-6-(R)-илметилового эфира метансульфокислоты и продолжали перемешивание при 85 С в течение 18 ч. Добавляли воду и смесь экстрагировали смесью трихлорметан/метанол, 90/10. Экстракты промывали насыщенным водным раствором хлорида натрия, сушили и упаривали с получением грубого продукта. Очистка с помощью хроматографии на силикагеле, элюция смесью этилацетат/этанол в соотношении 100/0-74/26 дает 0,14 г (60%) соединения в форме свободного основания. Т.пл.: 164-166 С. Пример 15 (соединение 5 в табл. 2 А). 9-(6,7-Дигидро-5H-[1]пириндин-6-(R)-илметил)-8,8-диметил-2-пиридин-4-ил-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-он. 15.1 8,8-Диметил-2-(пиридин-4-ил)-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-он. Смесь 7,68 г (39,8 ммоль) этил-3-(пиридин-4-ил)-3-оксопропионата, 7,9 г (37,9 ммоль) 6,6-диметил 1,4,5,6-тетрагидропиримидин-2-иламина гидробромида (полученного согласно Bull. Soc. Chim. Belg.,1950, 59, 573-587) и 11 г (79,5 ммоль) карбоната калия в 80 мл этанола кипятили с обратным холодильником в течение 18 ч. Реакционную смесь охлаждали и растворитель удаляли выпариванием. Полученный остаток обрабатывали водой и осадок собирали фильтрацией с получением 3,21 г (33%) продукта. 15.2 9-(6,7-Дигидро-5 Н-[1]пириндин-6-(R)-илметил)-8,8-диметил-2-пиридин-4-ил-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-он. К раствору 0,226 г (0,88 ммоль) 8,8-диметил-2-(пиридин-4-ил)-6,7,8,9-тетрагидропиримидо[1,2-а] пиримидин-4-она в 5 мл безводного диметилформамида добавляли 0,040 г (0,97 ммоль) гидрида натрия(60%-ная суспензия в минеральном масле), и смесь перемешивали при 45 С в течение 3 ч. Добавляли 0,20 г(0,88 ммоль) 6,7-дигидро-5 Н-[1]пириндин-6-(R)-илметилового эфира метансульфокислоты и продолжали перемешивание при 80 С в течение 18 ч. Смесь охлаждали и добавляли насыщенный раствор хлорида аммония. Эту смесь экстрагировали смесью трихлорметан/метанол, 90/10. Экстракты промывали насыщенным водным раствором хлорида натрия, сушили и упаривали с получением грубого продукта. Очистка с помощью хроматографии на силикагеле, элюция смесью этилацетат/этанол в соотношении 100/070/20 дает 0,197 г (58%) соединения в форме свободного основания. Т.пл.: 202-204 С. Перечень химических структур и физических данных для соединений указанной выше формулы (I),где R1 представляет собой пиридиновое кольцо, иллюстрирующий настоящее изобретение, приведен в табл. 1 А и 2 А. Соединения получены согласно способам, описанным в примерах. В таблицах:(S) означает абсолютную S-конфигурацию В табл. 1 А и 2 А R1 представляет собой незамещенное 4-пиридиновое кольцо (4-ру); в колонке "X",если X представляет собой два атома водорода, указывается один "Н", и для соединений формулы (I) "m" и "р" равно 1.- 16007737 Часть В. R1=пиримидиновое кольцо (табл. 1 В и 2 В). Пример 1 (соединение 1 из табл. 1 В). 9-(6,7-Дигидро-5 Н-циклопентапиразин-6-илметил)-7,7 диметил-2-(пиримидин-4-ил)-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-он. 1.1 7,7-Диметил-2-(пиримидин-4-ил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2-а]пиримидин-4-он. Смесь, содержащую 5,15 г (26,52 ммоль) этил-3-(4-пиримидинил)-3-оксопропионата (полученной аналогично способу, описанному в патенте DE 2705582), 4,34 г (26,52 ммоль) 5,5-диметил-1,4,5,6 тетрагидро-2-пиримидинамина моногидрохлорида (полученного аналогично способу, описанному в патенте US 4262122) и 3,66 г (26,5 ммоль) карбоната калия в 60 мл метанола, кипятили с обратным холодильником в течение 18 ч. Охлажденную реакционную смесь упаривали и добавляли воду. Полученный осадок собирали фильтрацией и сушили с получением 4,86 г (71%) продукта. Т.пл.: 194-196 С. 1.2 (6,7-Дигидро-5H-циклопентапиразин-6-ил)метанол. К раствору 4,5 г (23,4 ммоль) 6,7-дигидро-5 Н-циклопентапиразин-6 карбоновой кислоты этилового эфира (полученного аналогично способу, описанному в WO 99/02517) в 90 мл безводного тетрагидрофурана в атмосфере аргона добавляли 1,33 г (35,1 ммоль) алюмогидрида лития. Полученную смесь перемешивали при комнатной температуре в течение 2 ч. Реакционную смесь разбавляли 100 мл диэтилового эфира при 0 С и обрабатывали избытком насыщенного водного раствора сульфата натрия. Затем добавляли твердый сульфат натрия и органическую фазу фильтровали для удаления солей. Растворитель упаривали досуха с получением 3,3 г (94%) продукта в виде масла. 1.3 6,7-Дигидро-5 Н-циклопентапиразин-6-илметиловый эфир метансульфокислоты. К раствору 1,3 г (8,7 ммоль) (6,7-дигидро-5H-циклопентапиразин-6-ил)метанола в 15 мл безводного дихлорметана при -15 С добавляли 1,33 мл (9,52 ммоль) триэтиламина и 0,74 мл (9,52 ммоль) метансульфонилхлорида. Полученную смесь перемешивали при 0 С в течение 1 ч. Затем смесь разбавляли водой и дихлорметаном и экстрагировали дихлорметаном. Органический слой сушили и упаривали с получением 1,73 г (88%) 6,7-дигидро-5 Н-циклопентапиразин-6-илметилового эфира метансульфокислоты. 1.4 9-(6,7-Дигидро-5H-циклопентапиразин-6-илметил)-7,7-диметил-2-(пиримидин-4-ил)-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-он. Суспензию 0,5 г (1,94 ммоль) 7,7-диметил-2-(пиримидин-4-ил)-6,7,8,9-тетрагидро-4 Н-пиримидо[1,2-а]пиримидин-4-она в 10 мл безводного диметилформамида обрабатывали 155 мг (3,89 ммоль) гидрида натрия (50%-ная суспензия в минеральном масле) и полученную смесь перемешивали в течение 40 мин при 50 С. Добавляли 0,888 г (3,89 ммоль) 6,7-дигидро-5 Н-циклопентапиразин-6-илметилового эфира метансульфокислоты в 2 мл безводного диметилформамида и реакционную смесь перемешивали при комнатной температуре в течение 18 ч. Раствор обрабатывали водой и экстрагировали этилацетатом. Органическую фазу сушили и упаривали с получением грубого продукта, который очищали с помощью хроматографии на силикагеле, элюируя смесью дихлорметан/метанол в соотношении 100/1-95/5 с получением 80 мг чистого продукта в форме свободного основания, которое превращали в гидрохлоридную соль. Т.пл.: 193-195 С. Пример 2 (соединение 11 из табл. 1 В). (+)-(6R)-9-(6,7-Дигидро-5 Н-[1]пириндин-6-илметил)-7,7 диметил-2-(пиримидин-4-ил)-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-он. 2.1 (-)-(6R,5R)-(6,7-Дигидро-5 Н-[1]пириндин-6-ил)-(10,10-диметил-3,3-диокса-3-тиа-4-аза-трицикло[5.2.1.01,5]дец-4-ил]метанон. Суспензию 12 г (73,56 ммоль) (+/-) 6,7-дигидро-5 Н-[1]пириндин-6-карбоновой кислоты (полученной аналогично способу, описанному в WO 99/02517) в 85 мл безводного диметилформамида обрабатывали 13,36 г (82,39 ммоль) 1,1'-карбонилдиимидазола и полученную смесь нагревали при 45 С в течение 1 ч. Добавляли 15,84 г (73,56 ммоль) (-)-10,2-камфосультама (Fluka) и 11,2 г (73,56 ммоль) 1,8-диазабицикло[5,4,0]ундец-7-ена и реакционную смесь перемешивали при 40 С в течение 18 ч. Выпавшее в осадок твердое вещество собирали фильтрацией, промывали этилацетатом, диэтиловым эфиром и сушили, получая 20,8 г (79%) продукта в виде белого твердого вещества. Т.пл.: 270-272 С.[]D20=-151 (с=1, СНСl3). 2.2 (+)-(6R)-6,7-Дигидро-5H-[1]пириндин-6-карбоновая кислота. К раствору 20,6 г (57,15 ммоль) (-)-(6R,5R)-(6,7-дигидро-5H-[1]пириндин-6-ил)-(10,10-диметил-3,3 диокса-3-тиа-4-аза-трицикло[5.2.1.01,5]дец-4-ил]метанона в 300 мл смеси тетрагидрофуран/вода в соотношении 2:1 добавляли 2,88 г (68,6 ммоль) гидроксида лития. Смесь перемешивали при комнатной температуре в течение 5 ч. Добавляли воду и эту реакционную смесь экстрагировали этилацетатом. Водную фазу подкисляли уксусной кислотой до рН 6. Полученный осадок фильтровали и сушили с получением 7,5 г (81%) белого твердого вещества. Т.пл.: 236-237 []D20=+5,4 (с=0,5, диметилформамид). 2.3 (+)-(6R)-(6,7-Дигидро-5 Н-[1]пириндин-6-ил)метанол. К раствору 3,26 г (20 ммоль) (+)-6,7-дигидро-5 Н-[1]пириндин-6-карбоновой кислоты в 100 мл безводного тетрагидрофурана в атмосфере аргона добавляли 1,14 г (30 ммоль) алюмогидрида лития. Полученную смесь перемешивали при комнатной температуре в течение 1 ч. Избыток алюмогидрида лития гидролизовали 4,56 мл воды и 1,14 мл гидроксида натрия (15%). Осадок фильтровали и промывали диэтиловым эфиром, фильтрат упаривали с получением 2,88 г (97%) продукта в виде масла. []D20=+6,2(с=0,75, CH2Cl2). 2.4 6,7-Дигидро-5H-[1]пириндин-6-илметиловый эфир метансульфокислоты. К раствору 895 мг (6 ммоль) (+)-(6R)-(6,7-дигидро-5 Н-[1]пириндин-6-ил)метанола в 50 мл безводного дихлорметана при -15 С добавляли 0,918 мл (6,6 ммоль) триэтиламина и 0,465 мл (6 ммоль) метансульфонилхлорида. Полученную смесь перемешивали при 0 С в течение 45 мин. Затем эту смесь разбавляли водой и дихлорметаном и экстрагировали дихлорметаном. Органический слой сушили и упаривали с получением 1,4 г (100%) метансульфокислоты 6,7-дигидро-5 Н-[1]пириндин-6-илметилового эфира. 2.5 (+)-(6R)-9-(6,7-Дигидро-5 Н-[1]пириндин-6-илметил)-7,7-диметил-2-(пиримидин-4-ил)-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-он. Суспензию 0,514 г (2 ммоль) 7,7-диметил-2-(пиримидин-4-ил)-6,7,8,9-тетрагидро-4H-пиримидо[1,2 а]пиримидин-4-она в 10 мл безводного диметилформамида обрабатывали 96 мг (2 ммоль) гидрида натрия(50%-ная суспензия в минеральном масле) и полученную смесь перемешивали в течение 40 мин. Добавляли 0,455 г (2 ммоль) 6,7-дигидро-5 Н-[1]пириндин-6-илметилового эфира метансульфокислоты в 2 мл безводного диметилформамида и реакционную смесь перемешивали при комнатной температуре в течение 18 ч. Раствор обрабатывали водой и экстрагировали этилацетатом. Органическую фазу сушили и упаривали с получением сырого продукта, который очищали с помощью хроматографии на силикагеле, элюируя смесью этилацетат/метанол/диэтиламин в соотношении 98/2/0,2 с получением 0,338 г чистого продукта, полученного в форме свободного основания. Т.пл.: 156-185C. []D20=+13,6 (с=0,5, CH2Cl2). Пример 3 (cоединение 10 из табл. 1 В). (-)-(6S)-9-(6,7-Дигидро-5H-[1]пириндин-6-илметил)-7,7 диметил-2-(пиримидин-4-ил)-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-он. Аналогично способу, описанному в примере 2, но заменяя (-)-10,2-камфосультам (+)-10,2-камфосультамом (Fluka), получали соединение в виде свободного основания. Т.пл.: 156-185 С. []D20=-14,1(с=0,5, CH2Cl2). Пример 4 (соединение 3 из табл. 1 В). (+/-)-9-(2-Хлор-6,7-дигидро-5 Н-[1]пириндин-6-илметил)7,7-диметил-2-(пиримидин-4-ил)-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-он. 4.1 (+/-)-(2-Хлор-6,7-дигидро-5 Н-[1]пириндин-6-ил)метанол. К раствору 1,83 г (9,26 ммоль) (+/-)-2-хлор-6,7-дигидро-5H-[1]пириндин-6-карбоновой кислоты (полученной аналогично способу, описанному в WO99/02517) в 50 мл безводного тетрагидрофурана в атмосфере аргона добавляли 0,52 г (13,89 ммоль) алюмогидрида лития. Полученную смесь перемешивали при комнатной температуре в течение 2 ч. Избыток алюмогидрида лития гидролизовали 2,13 мл воды и 0,53 мл гидроксида натрия (15%). Осадок фильтровали и промывали диэтиловым эфиром, фильтрат упаривали с получением 1,61 г (95%) продукта в виде масла. 4.2 (+/-)-2-Хлор-6,7-дигидро-5H-[1]пириндин-6-ил-метиловый эфир метансульфокислоты. Продукт получали аналогично способу, описанному на стадии 2.4, используя (+/-)-(2-хлор-6,7 дигидро-5H-[1]пириндин-6-ил)метанол. Продукт использовали как таковой на следующей стадии. 4.3 (+/-)-9-(2-Хлор-6,7-дигидро-5 Н-[1]пириндин-6-илметил)-7,7-диметил-2-(пиримидин-4-ил)-6,7,8,9 тетрагидропиримидо[1,2-а]пиримидин-4-он. Продукт получали аналогично способу, описанному на стадии 2.5, используя (+/-)-2-хлор-6,7-дигидро-5H-[1]пириндин-6-ил-метиловый эфир метансульфокислоты вместо 6,7-дигидро-5H-[1]пириндин 6-илметилового эфира метансульфокислоты. Соединение получали в форме свободного основания. Т.пл.: 186-187 С. Пример 5 (cоединение 2 из табл. 1 В). (+/-)-7,7-Диметил-2-(пиримидин-4-ил)-9-(2-фенил-6,7 дигидро-5 Н-[1]пириндин-6-илметил)-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-он. Раствор 0,22 г (0,52 ммоль) (+/-)-9-(2-хлор-6,7-дигидро-5 Н-[1]пириндин-6-илметил)-7,7-диметил-2(пиримидин-4-ил)-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-она в 3 мл безводного толуола и 0,5 мл этанола обрабатывали 0,625 мл (2 М раствор в воде) карбоната натрия, 36 мг (0,03 ммоль) тетракис(трифенилфосфин)палладия и 0,095 г (0,780 ммоль) фенилбороновой кислоты. После перемешивания в течение 24 ч при 140 С добавляли воду, смесь экстрагировали дихлорметаном. Органическую фазу сушили и упаривали с получением сырого продукта, который очищали с помощью хроматографии на силикагеле, элюируя смесью дихлорметан/метанол/аммиак в соотношении 99/1/0,1 с получением 0,133 г чистого продукта в форме свободного основания. Т.пл.: 209-211 С. Пример 6 (соединение 4 из табл. 1 В). (+/-)-9-(Хроман-3-илметил)-7,7-диметил-2-(пиримидин-4 ил)-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-он. 6.1 (+/-)-Хроман-3-илметиловый эфир метансульфокислоты. Продукт получали аналогично способу, описанному на стадии 1.3, используя (+/-)-хроман-3-илметанол (US 4957928, Eur. J. Med. Chem., 1987, 22(6), 539-544). Соединение использовали как таковое на следующей стадии. 6.2 (+/-)-9-Хроман-3-илметил-7,7-диметил-2-(пиримидин-4-ил)-6,7,8,9-тетрагидропиримидо[1,2-а] пиримидин-4-он. Аналогично способу, описанному на стадии 1.4, используя (+/-)хроман-3-илметиловый эфир ме- 18007737 тансульфокислоты, получали соединение в форме свободного основания. Т.пл.: 84-86 С. Пример 7 (соединение 5 из табл. 1 В). (+/-)-9-(6,7-Дигидро-5 Н-[2]пириндин-6-илметил)-7,7-диметил-2-(пиримидин-4-ил)-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-он. 7.1 (+/-)-(6,7-Дигидро-5 Н-[2]пириндин-6-ил)метанол. Продукт получали аналогично способу, описанному на стадии 1.2, используя этиловый эфир (+/-)6,7-дигидро-5 Н-[2]пириндин-6-карбоновой кислоты (полученный аналогично способу, описанному вWO99/02517), и использовали как таковой на следующей стадии. 7.2 (+/-)-6,7-Дигидро-5 Н-[2]пириндин-6-илметиловый эфир метансульфокислоты. Продукт получали аналогично способу, описанному на стадии 1.3, используя (+/-)-(6,7-дигидро 5 Н-[2]пириндин-6-ил)метанол, полученный на стадии 3.1. Соединение использовали как таковое на следующей стадии. 7.3 (+/-)-9-(6,7-Дигидро-5 Н-[2]пириндин-6-илметил)-7,7-диметил-2-(пиримидин-4-ил)-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-он. Аналогично способу, описанному на стадии 1.4, используя (+/-)-6,7-дигидро-5H-[2]пириндин-6 илметиловый эфир метансульфокислоты, получали соединение в форме свободного основания. Т.пл.: 169-171 С. Пример 8 (соединение 6 из табл. 1 В). (-)-(5)-9-(2,3-Дигидробензофуран-2-илметил)-7,7-диметил 2-(пиримидин-4-ил)-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-он оксалат (1:1). 8.1 (-)-(S)-(2,3-Дигидробензофуран-2-ил)метанол. Продукт получали аналогично способу, описанному на стадии 1.2, и используя (-)-(S)-2,3 дигидробензофуран-2-карбоновую кислоту (полученную аналогично способу, описанному в J. Med.Chem., 1983, 26(3), 328-334), и использовали как таковой на следующей стадии. 8.2 2,3-Дигидробензофуран-2-илметиловый эфир метансульфокислоты. Продукт получали аналогично способу, описанному на стадии 1.3, используя (-)-(S)-(2,3 дигидробензофуран-2-ил)метанол, полученный на стадии 8.1, и использовали как таковой на следующей стадии. 8.3 (-)-(5)-9(2,3-Дигидробензофуран-2-илметил)-7,7-диметил-2-(пиримидин-4-ил)-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-она оксалат (1:1). Аналогично способу, описанному на стадии 1.4, используя 2,3-дигидробензофуран-2 илметиловый эфир метансульфокислоты, получали соединение в форме свободного основания, которое превращали в оксалатную соль. Т.пл.: 168-170 С. []D20=-1,4 (с=0,5, СН 3 ОН). Пример 9 (соединение 7 из табл. 1 В). (+/-)-9-(5-Фтор-8-метоксихроман-2-илметил)-7,7-диметил 2-(пиримидин-4-ил)-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-он. 9.1 (+/-)-(5-Фтор-8-метокси-3,4,4 а,8 а-тетрагидро-2 Н-хромен-2-ил)метанол. Продукт получали аналогично способу, описанному на стадии 1.2, и используя эфир (+/-)-5 фтор-8-метокси-3,4,4 а,8 а-тетрагидро-2 Н-хромен-2-карбоновой кислоты (полученный аналогично способу, описанному в US 5137901). Продукт использовали как таковой на следующей стадии. 9.2 (+/-)-5-Фтор-8-метокси-3,4,4 а,8 а-тетрагидро-2H-хромен-2-илметиловый эфир метансульфокислоты. Продукт получали аналогично способу, описанному на стадии 1.3, и используя (+/-)-(5-фтор-8 метокси-3,4,4 а,8 а-тетрагидро-2 Н-хромен-2-ил)метанол, полученный на стадии 9.1. Продукт использовали как таковой на следующей стадии. 9.3 (+/-)-9-(5-Фтор-8-метоксихроман-2-илметил)-7,7-диметил-2-(пиримидин-4-ил)-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-он. Аналогично способу, описанному на стадии 1.4, используя (+/-)-5-фтор-8-метокси-3,4,4 а,8 атетрагидро-2H-хромен-2-илметиловый эфир метансульфокислоты, получали соединение в форме свободного основания. Т.пл.: 136-138 С. Пример 10 (соединение 8 из табл. 1 В). (+/-)-9-(2,3-Дигидробензо[1,4]диоксин-2-илметил)-7,7 диметил-2-(пиримидин-4-ил)-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-он. 10.1 (+/-)-2,3-Дигидробензо[1,4]диоксин-2-илметиловый эфир метансульфокислоты. Продукт получали аналогично способу, описанному на стадии 1.3, и используя (+/-)-(2,3 дигидробензо[1,4]диоксин-2-ил)метанол от Aldrich. Продукт использовали как таковой на следующей стадии. 10.2 (+/-)-9-(2,3-Дигидробензо[1,4]диоксин-2-илметил)-7,7-диметил-2-(пиримидин-4-ил)-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-он. Аналогично способу, описанному на стадии 1.4, используя (+/-)2,3-дигидробензодиоксан-2 илметиловый эфир метансульфокислоты, получали соединение в форме свободного основания. Т.пл.: 105-107 С. Пример 11 (соединение 12 из табл. 1 В). 9-(2-Фуро[2,3-b]пиридин-3-ил-этил)-7,7-диметил-2(пиримидин-4-ил)-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-она гидрохлорид (1:1). 11.1 Этиловый эфир фуро[2,3-b]пиридин-3-ил-уксусной кислоты. К суспензии 0,325 г (8,14 ммоль) гидрида натрия (50%-ная суспензия в минеральном масле) в 8 мл безводного тетрагидрофурана добавляли 0,1 мл 1,1,1,3,3,3-гексаметилдисилазина и 1,81 г (8,14 ммоль)- 19007737 триэтилфосфоноацетат (Aldrich) в 4 мл безводного тетрагидрофурана. Полученную смесь перемешивали при комнатной температуре в течение 1 ч, охлаждали при 0 С и добавляли 1 г (7,4 ммоль) фуро[2,3b]пиридин-3-она (полученного согласно J. Met. Chem. 1986, 23, 1465-1469). После перемешивания при комнатной температуре в течение 24 ч добавляли воду, смесь экстрагировали дихлорметаном. Органическую фазу сушили и упаривали с получением грубого продукта, который очищали с помощью хроматографии на силикагеле, элюируя смесью этилацетат/циклогексан в соотношении 40/60 с получением 0,73 г чистого продукта. 11.2 2-Фуро[2,3-b]пиридин-3-ил-этанол. Продукт получали аналогично способу, описанному на стадии 1.2, и используя этиловый эфир фуро[2,3-b]пиридин-3-ил-уксусной кислоты, полученный на стадии 11.1. Продукт использовали как таковой на следующей стадии. 11.3 2-Фуро[2,3-b]пиридин-3-ил-этиловый эфир метансульфокислоты. Продукт получали аналогично способу, описанному на стадии 1.3, и используя 2-фуро[2,3b]пиридин-3-ил-этанол, полученный на стадии 11.2. Продукт использовали как таковой на следующей стадии. 11.4 9-(2-Фуро[2,3-b]пиридин-3-ил-этил)-7,7-диметил-2-(пиримидин-4-ил)-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-она гидрохлорид (1:1). Аналогично способу, описанному на стадии 1.4, используя 2-фуро[2,3-b]пиридин-3-ил-этиловый эфир метансульфокислоты, получали соединение в форме свободного основания, которое превращали в гидрохлоридную соль. Т.пл.: 181-183 С. Пример 12 (соединение 14 из табл. 1 В). (+/-)-7,7-Диметил-9-(2-метил-6,7-дигидро-5 Н-[1]пириндин-6-ил метил)-2-(пиримидин-4-ил)-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-он. Аналогично способу, описанному в примере 1, используя (+/-)-(2-метил-6,7-дигидро-5 Н-[1]пириндин-6-ил)метанол вместо (+/-)-(2-хлор-6,7-дигидро-5 Н-[1]пириндин-6-ил)метанола, получали соединение в виде свободного основания. Т.пл.: 163-164 С. Перечень химических структур и физических данных для соединений вышеуказанной формулы (I),где R1 представляет собой пиримидиновое кольцо, иллюстрирующий настоящее изобретение, представлен в табл. 1 В и 2 В. Соединения были получены согласно способам, описанным в примерах. В таблицах:(S) означает абсолютную S-конфигурацию. В табл. 1 В и 2 В R1 представляет собой незамещенное 4-пиримидиновое кольцо; в колонке "X", еслиX представляет собой два атома водорода, указывается один "Н"; "m" и "р" равно 1. Тест-пример. Ингибирующая активность лекарственного средства по настоящему изобретению против GSK3. Могут быть использованы два разных протокола. В первом протоколе: 7,5 мкМ предварительно фосфорилированного GS1 пептида и 10 мкМ АТФ(содержащего 300000 cpm (импульсов в минуту) 33 Р-АТФ) инкубировали в буфере, содержащем 25 мМ Трис-HCl, рН 7,5, 0,6 мМ ДТТ, 6 мМ МgСl2, 0,6 мМ ЭГТА, 0,05 мг/мл БСА, в течение 1 ч при комнатной температуре в присутствии GSK3 (общий объем реакции: 100 мкл). Во втором протоколе: 4,1 мкМ предварительно фосфорилированного GS1 пептида и 42 мкМ АТФ(содержащего 260000 cpm 33 Р-АТФ) инкубировали в буфере, содержащем 80 мМ Mes-NaOH, рН 6,5, 1 мМ Мg ацетата, 0,5 мМ ЭГТА, 5 мМ 2-меркаптоэтанола, 0,02% Tween 20, 10% глицерина, в течение 2 ч при комнатной температуре в присутствии GSK3. Ингибиторы растворяли в ДМСО (конечная концентрация растворителя в реакционной среде 1%). Реакцию останавливали с помощью 100 мкл раствора, содержащего 25 г полифосфорной кислоты(85% Р 2 О 5), 126 мл 85%-ной Н 3 РO4, Н 2 О до 500 мл, и затем разбавляли до 1:100 перед использованием. Затем аликвоту реакционной смеси переносили на катионообменные фильтры Whatman P81 и промывали раствором, описанным выше. Включенную 33 Р-радиоактивность определяли с помощью жидкостной сцинтилляционной спектрометрии. Фосфорилированный GS-1 пептид имел следующую последовательность:NH2-YRRAAVPPSPSLSRHSSPHQS(P)EDEE-COOH. СSК 3-ингибирующая активность соединений по настоящему изобретению выражена в IC50, и в качестве иллюстрации диапазона значений IC50 соединений: в табл. 1 А - от 5 наномолярных до 2 микромолярных концентраций; в табл. 2 А - от 70 наномолярных до 2 микромолярных концентраций; в табл. 1 В - от 5 наномолярных до 2 микромолярных концентраций; в табл. 2 В - от 15 наномолярных до 2 микромолярных концентраций. В качестве примера, соединение 4 из табл. 1 А демонстрирует IC50 8 нМ и соединение 8 из табл. 2 В IС 50 15 нМ. Тест-пример 2. Ингибирующая активность лекарственного средства по настоящему изобретению против cdk5/p25. Может быть использован следующий протокол. 0,4 мг/мл гистона Н 1 и 10 мкМ АТФ (содержащего 300000 срm 33 Р-АТФ) инкубировали в буфере,- 23007737 содержащем 50 мМ Hepes, pH 7,2, 1 мМ ДТТ, 1 мМ MgCl2, 1 мМ ЭГТА, 0,02% Tween 20, в течение 1 ч при комнатной температуре в присутствии cdk5/p25 (общий объем реакции: 100 мкл). Ингибиторы растворяли в ДМСО (конечная концентрация растворителя в реакционной среде 1%). Реакцию останавливали с помощью 100 мкл раствора, содержащего 25 г полифосфорной кислоты(85% Р 2 О 5), 126 мл 85%-ной Н 3 РO4, Н 2 О до 500 мл (разбавляли до 1:100 перед использованием). Затем аликвоту реакционной смеси переносили на катионообменные фильтры Whatman P81 и промывали раствором, описанным выше. Включенную 33 Р-радиоактивность определяли с помощью жидкостной сцинтилляционной спектрометрии. сdk5/р 25-ингибирующая активность соединений по настоящему изобретению выражена в виде значений IC50. Обычно используют 3-кратные последовательные разведения ингибитора в пределах по меньшей мере 1000-кратного диапазона концентраций. В качестве иллюстрации диапазона значений IC50 соединений: в табл. 1 А - от 50 наномолярных до 2 микромолярных концентраций; в табл. 2 А -1 микромолярной концентрации; в табл. 1 В - от 200 наномолярных до 5 микромолярных концентраций; в табл. 2 В - 1 микромолярной концентрации. Пример лекарственных форм (1).(1) Таблетки. Ингредиенты, указанные ниже, смешивали обычным способом и прессовали с помощью стандартного аппарата. Соединение из примера 1 30 мг Кристаллическая целлюлоза 60 мг Кукурузный крахмал 100 мг Лактоза 200 мг Стеарат магния 4 мг(2) Мягкие капсулы. Ингредиенты, указанные ниже, смешивали обычным способом и вводили в мягкие капсулы. Соединение из примера 1 30 мг Оливковое масло 300 мг Лецитин 20 мг(3) Парентеральные препараты. Ингредиенты, указанные ниже, смешивали обычным способом для приготовления инъекций, содержащихся в ампуле на 1 мл. Соединение из примера 1 3 мг Хлорид натрия 4 мг Дистиллированная вода для инъекций 1 мл Промышленная применимость Соединения по настоящему изобретению обладают GSK3- или GSK3- и сdk5/р 25-ингибирующей активностью и полезны в качестве активного ингредиента лекарственного средства для профилактического и/или терапевтического лечения заболеваний, вызванных аномальной активностью GSK3 или где X представляет собой два атома водорода или С 1-2-алкильную группу и атом водорода;Y представляет собой связь или метиленовую группу, возможно замещенную одной или двумя группами, выбранными из C1-6-алкильной группы, гидроксигруппы или C1-4-алкоксигруппы;R1 представляет собой 2-, 3- или 4-пиридиновое кольцо или 2-, 4- или 5-пиримидиновое кольцо, которое может быть замещено С 3-6-циклоалкильной группой, С 1-4-алкильной группой, С 1-4-алкоксигруппойR2 представляет собой гетероциклическое бициклическое кольцо, имеющее 1-4 гетероатома, выбранных из атома кислорода, атома серы и атома азота, и имеющее 5-9 атомов углерода, формулы где А, В, С и D, каждый независимо, представляет собой атом углерода или атом азота и W представляет собой насыщенное или ненасыщенное 5- или 6-членное циклическое кольцо, включающее от 0 до 2 гетероатомов, таких как атом кислорода, атом серы или атом азота; причем группа R2 может быть замещена по атому углерода или, если возможно, по атому азота одним или двумя атомами или группами, выбранными из атома галогена, C1-6-алкильной группы, гидроксигруппы, С 1-4-алкоксигруппы, бензольного кольца, пиридинового кольца или группы -NR6R7;R3 представляет собой атом водорода, С 1-6-алкильную группу, гидроксигруппу, C1-4-алкоксигруппу или атом галогена;R4 представляет собой атом водорода, С 1-6-алкильную группу, С 1-4-алкоксигруппу или атом галогена;R5 представляет собой атом водорода или атом галогена;R6 и R7 вместе с атомом азота представляют собой пирролидиновое кольцо; если m равно 0, р равно 1, 2 или 3,если m равно 1, р равно 0, 1 или 2,если m равно 2, р равно 0 или 1,если m равно 3, р равно 0; иn равно от 0 до 3; при условии, что производное формулы (I) не представляет собой 9-[2-(1 Н-индол-3-ил)этил]-2-пиридин-4-ил-6,7,8,9-тетрагидро-4H-пиримидо[1,2-а]пиримидин-4-он,9-[3-(1 Н-индол-3-ил)пропил]-2-пиридин-4-ил-6,7,8,9-тетрагидро-4 Н-пиримидо[1,2-а]пиримидин-4 он,1-[2-(1 Н-индол-3-ил)этил]-7-пиридин-4-ил-2,3-дигидроимидазо[1,2-а]пиримидин-5(1 Н)-он или 1-[3-(1 Н-индол-3-ил)пропил]-7-пиридин-4-ил-2,3-дигидроимидазо[1,2-а]пиримидин-5(1 Н)-он. 2. Производное пиримидона, или его соль, или их сольват, или их гидрат по п.1, где R1 представляет собой незамещенную пиридинильную группу или незамещенное 4-пиримидиновое кольцо. 3. Производное пиримидона, выбранное из группы, состоящей из(+)-(6R)-9-(6,7-дигидро-5H-[1]пириндин-6-илметил)-7,7-диметил-2-(пиридин-4-ил)-6,7,8,9 тетрагидропиримидо[1,2-а]пиримидин-4-она,(-)-(6S)-9-(6,7-дигидро-5H-[1]пириндин-6-илметил)-7,7-диметил-2-(пиридин-4-ил)-6,7,8,9 тетрагидропиримидо[1,2-а]пиримидин-4-она,(+)-(6R)-9-(6,7-дигидро-5 Н-[1]пириндин-6-илметил)-2-(пиридин-4-ил)-6,7,8,9 тетрагидропиримидо[1,2-а]пиримидин-4-она,(+/-)-7,7-диметил-9-(2-метил-6,7-дигидро-5 Н-[1]пириндин-6-илметил)-2-(пиридин-4-ил)-6,7,8,9 тетрагидропиримидо[1,2-а]пиримидин-4-она,(+)-7,7-диметил-9-(2-метил-6,7-дигидро-5 Н-[1]пириндин-6-илметил)-2-(пиридин-4-ил)-6,7,8,9 тетрагидропиримидо[1,2-а]пиримидин-4-она,(-)-7,7-диметил-9-(2-метил-6,7-дигидро-5H-[1]пириндин-6-илметил)-2-(пиридин-4-ил)-6,7,8,9 тетрагидропиримидо[1,2-а]пиримидин-4-она,(+/-)-9-(2,3-дигидро-бензофуран-2-илметил)-7,7-диметил-2-(пиридин-4-ил)-6,7,8,9 тетрагидропиримидо[1,2-а]пиримидин-4-она,9-(фуро[3,2-b)]пиридин-2-илметил)-7,7-диметил-2-(пиридин-4-ил)-6,7,8,9-тетрагидропиримидо[1,2 а]пиримидин-4-она,9-(бензофуран-2-илметил)-7,7-диметил-2-(пиридин-4-ил)-6,7,8,9-тетрагидропиримидо[1,2 а]пиримидин-4-она,(+/-)-9-(2-хлор-6,7-дигидро-5H-[1]пириндин-6-илметил)-7,7-диметил-2-(пиридин-4-ил)-6,7,8,9 тетрагидропиримидо[1,2-а]пиримидин-4-она,(+/-)-7,7-диметил-2-(пиридин-4-ил)-9-[2-(пиридин-4-ил)-6,7-дигидро-5H-[1]пириндин-6-илметил]6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-она,(+/-)-7,7-диметил-9-(2-фенил-6,7-дигидро-5 Н-[1]пириндин-6-илметил)-2-(пиридин-4-ил)-6,7,8,9 тетрагидропиримидо[1,2-а]пиримидин-4-она,(+/-)-7,7-диметил-2-(пиридин-4-ил)-9-[2-(пирролидин-1-ил)-6,7-дигидро-5 Н-[1]пириндин-6 илметил]-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-она,(+/-)-7,7-дифтор-9-(2-метил-6,7-дигидро-5 Н-[1]пириндин-6-илметил)-2-(пиридин-4-ил)-6,7,8,9 тетрагидропиримидо[1,2-а]пиримидин-4-она,9-+)-(6-R)-6,7-дигидро-5 Н-[1]пириндин-6-илметил)-(+/-)-7-метил-2-(пиридин-4-ил)-6,7,8,9- 25007737 тетрагидропиримидо[1,2-а]пиримидин-4-она,или его соли, или их сольвата, или их гидрата. 4. Производное пиримидона, выбранное из группы, состоящей из 9-хроман-2-илметил-8-метил-2-пиридин-4-ил-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-она,9-(8-метокси-2,3-дигидробензо[1,4]диоксин-2-илметил)-8-метил-2-пиридин-4-ил-6,7,8,9 тетрагидропиримидо[1,2-а]пиримидин-4-она,9-(2,3-дигидробензо[1,4]диоксин-2-илметил)-8-метил-2-пиридин-4-ил-6,7,8,9 тетрагидропиримидо[1,2-а]пиримидин-4-она,9-(5-метокси-2,3-дигидробензо[1,4]диоксин-2-илметил)-8-метил-2-пиридин-4-ил-6,7,8,9 тетрагидропиримидо[1,2-а]пиримидин-4-она,9-(6,7-дигидро-5 Н-[1]пириндин-6-(R)-илметил)-8,8-диметил-2-пиридин-4-ил-6,7,8,9 тетрагидропиримидо[1,2-а]пиримидин-4-она,9-хроман-2-илметил-8,8-диметил-2-пиридин-4-ил-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4 она,9-(2,3-дигидробензо[1,4]диоксин-2-илметил)-8,8-диметил-2-пиридин-4-ил-6,7,8,9 тетрагидропиримидо[1,2-а]пиримидин-4-она,9-(8-фтор-5-метоксихроман-3-илметил)-8,8-диметил-2-пиридин-4-ил-6,7,8,9 тетрагидропиримидо[1,2-а]пиримидин-4-она,9-фуро[3,2-b]пиридин-2-илметил-8-метил-2-пиридин-4-ил-6,7,8,9-тетрагидропиримидо[1,2 а]пиримидин-4-она,9-(6,7-дигидро-5 Н-[1]пириндин-6-(R)-илметил)-8-метил-2-пиридин-4-ил-6,7,8,9 тетрагидропиримидо[1,2-а]пиримидин-4-она,9-(6,7-дигидро-5H-[2]пириндин-6-илметил)-8-метил-2-пиридин-4-ил-6,7,8,9 тетрагидропиримидо[1,2-а]пиримидин-4-она,9-(6,7-дигидро-5 Н-[1]пириндин-6-(S)-илметил)-8-метил-2-пиридин-4-ил-6,7,8,9 тетрагидропиримидо[1,2-а]пиримидин-4-она,или его соли, или их сольвата, или их гидрата. 5. Производное пиримидона, выбранное из группы, состоящей из 9-(6,7-дигидро-5 Н-циклопентапиразин-6-илметил)-7,7-диметил-2-пиримидин-4-ил-6,7,8,9 тетрагидропиримидо[1,2-а]пиримидин-4-она,(+/-)-7,7-диметил-2-(пиримидин-4-ил)-9-(2-фенил-6,7-дигидро-5H-[1]пириндин-6-илметил)-6,7,8,9 тетрагидропиримидо[1,2-а]пиримидин-4-она,(+/-)-9-(2-хлор-6,7-дигидро-5H-[1]пириндин-6-илметил)-7,7-диметил-2-(пиримидин-4-ил)-6,7,8,9 тетрагидропиримидо[1,2-а]пиримидин-4-она,(+/-)-9-(хроман-3-илметил)-7,7-диметил-2-(пиримидин-4-ил)-6,7,8,9-тетрагидропиримидо[1,2 а]пиримидин-4-она,(+/-)-9-(6,7-дигидро-5H-[2]пириндин-6-илметил)-7,7-диметил-2-(пиримидин-4-ил)-6,7,8,9 тетрагидропиримидо[1,2-а]пиримидин-4-она,(-)-(S)-9-(2,3-дигидробензофуран-2-илметил)-7,7-диметил-2-(пиримидин-4-ил)-6,7,8,9 тетрагидропиримидо[1,2-а]пиримидин-4-она,(+/-)-9-(5-фтор-8-метоксихроман-2-илметил)-7,7-диметил-2-(пиримидин-4-ил)-6,7,8,9 тетрагидропиримидо[1,2-а]пиримидин-4-она,(+/-)-9(2,3-дигидробензо[1,4]диоксин-2-илметил)-7,7-диметил-2-(пиримидин-4-ил)-6,7,8,9 тетрагидропиримидо[1,2-а]пиримидин-4-она,(+/-)-9-(5-метокси-2,3-дигидробензо[1,4]диоксин-2-илметил)-7,7-диметил-2-(пиримидин-4-ил)6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4-она,(-)-(6S)-9-(6,7-дигидро-5 Н-[1]пириндин-6-илметил)-7,7-диметил-2-(пиримидин-4-ил)-6,7,8,9 тетрагидропиримидо[1,2-а]пиримидин-4-она,(+)-(6R)-9-(6,7-дигидро-5 Н-[1]пириндин-6-илметил)-7,7-диметил-2-(пиримидин-4-ил)-6,7,8,9 тетрагидропиримидо[1,2-а]пиримидин-4-она,9-(2-фуро[2,3-b]пиридин-3-ил-этил)-7,7-диметил-2-(пиримидин-4-ил)-6,7,8,9 тетрагидропиримидо[1,2-а]пиримидин-4-она,9-бензофуран-2-илметил-7,7-диметил-2-(пиримидин-4-ил)-6,7,8,9-тетрагидропиримидо[1,2 а]пиримидин-4-она,(+/-)-7,7-диметил-9-(2-метил-6,7-дигидро-5 Н-[1]пириндин-6-илметил)-2-(пиримидин-4-ил)-6,7,8,9 тетрагидропиримидо[1,2-а]пиримидин-4-она,или его соли, или их сольвата, или их гидрата. 6. Производное пиримидона, выбранное из группы, состоящей из 9-(8-метокси-2,3-дигидробензо[1,4]диоксин-2-илметил)-8-метил-2-пиримидин-4-ил-6,7,8,9 тетрагидропиримидо[1,2-а]пиримидин-4-она,9-(2,3-дигидробензо[1,4]диоксин-2-илметил)-8,8-диметил-2-пиримидин-4-ил-6,7,8,9 тетрагидропиримидо[1,2-а]пиримидин-4-она,- 26007737 9-хроман-2-илметил-8-метил-2-пиримидин-4-ил-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин-4 она,9-(5-фтор-8-метоксихроман-2-илметил)-8-метил-2-пиримидин-4-ил-6,7,8,9 тетрагидропиримидо[1,2-а]пиримидин-4-она,9-(5-фтор-8-метоксихроман-2-илметил)-8,8-диметил-2-пиримидин-4-ил-6,7,8,9 тетрагидропиримидо[1,2-а]пиримидин-4-она,9-хроман-2-илметил-8,8-диметил-2-пиримидин-4-ил-6,7,8,9-тетрагидропиримидо[1,2-а]пиримидин 4-она,9-(8-метокси-2,3-дигидробензо[1,4]диоксин-2-илметил)-8,8-диметил-2-пиримидин-4-ил-6,7,8,9 тетрагидропиримидо[1,2-а]пиримидин-4-она,9-(2,3-дигидробензо[1,4]диоксин-2-илметил)-8-метил-2-пиримидин-4-ил-6,7,8,9 тетрагидропиримидо[1,2-а]пиримидин-4-она,9-(5-метокси-2,3-дигидробензо[1,4]диоксин-2-илметил)-8-метил-2-пиримидин-4-ил-6,7,8,9 тетрагидропиримидо[1,2-а]пиримидин-4-она,9-(5-метокси-2,3-дигидробензо[1,4]диоксин-2-илметил)-8,8-диметил-2-пиримидин-4-ил-6,7,8,9 тетрагидропиримидо[1,2-а]пиримидин-4-она,9-(6,7-дигидро-5 Н-[1]пириндин-6-(R)-илметил)-8-метил-2-пиримидин-4-ил-6,7,8,9 тетрагидропиримидо[1,2-а]пиримидин-4-она,9-(6,7-дигидро-5H-[1]пириндин-6-(R)-илметил)-8,8-диметил-2-пиримидин-4-ил-6,7,8,9 тетрагидропиримидо[1,2-а]пиримидин-4-она,9-(6,7-дигидро-5 Н-[1]пириндин-6-(S)-илметил)-8,8-диметил-2-пиримидин-4-ил-6,7,8,9 тетрагидропиримидо[1,2-а]пиримидин-4-она,9-фуро[3,2-b]пиридин-2-илметил-8-метил-2-пиримидин-4-ил-6,7,8,9-тетрагидропиримидо[1,2 а]пиримидин-4-она,9-(6,7-дигидро-5H-[1]пириндин-6-(S)-илметил)-8-метил-2-пиримидин-4-ил-6,7,8,9 тетрагидропиримидо[1,2-а]пиримидин-4-она или 9-(6,7-дигидро-5 Н-[2]пириндин-6-илметил)-8-метил-2-пиримидин-4-ил-6,7,8,9 тетрагидропиримидо[1,2-а]пиримидин-4-она,или его соли, или их сольвата, или их гидрата. 7. Лекарственное средство, содержащее в качестве активного ингредиента вещество, выбранное из группы, состоящей из производного пиримидона, представленного формулой (I), или его солей, или их сольвата, или их гидрата по пп.1-6. 8. Ингибитор GSK3 или GSK3 и cdk5/p25, выбранный из группы производного пиримидона,представленного формулой (I), или его солей, или их сольвата, или их гидрата по пп.1-6. 9. Применение соединения по пп.1-6 для изготовления лекарственного средства для профилактического и/или терапевтического лечения заболевания, вызванного аномальной активностью GSK3 илиGSK3 и cdk5/p25. 10. Применение соединения по пп.1-6 для изготовления лекарственного средства для профилактического и/или терапевтического лечения нейродегенеративного заболевания. 11. Применение соединения по п.10, где нейродегенеративное заболевание выбрано из группы, состоящей из болезни Альцгеймера, болезни Паркинсона, тауопатий, сосудистой деменции; острого инсульта, травматических повреждений; инсультов, травмы головного мозга, травмы спинного мозга; периферических нейропатий; бокового амиотрофического склероза; ретинопатий или глаукомы. 12. Применение соединения по пп.1-6 для изготовления лекарственного средства для профилактического и/или терапевтического лечения инсулиннезависимого диабета, ожирения, маниакальнодепрессивного психоза, шизофрении, алопеции, прекращения курения, эпилепсии или видов рака. 13. Применение по п.12, где рак представляет собой рак молочной железы, немелкоклеточную легочную карциному, рак щитовидной железы, Т- или В-клеточную лейкемию или вирус-индуцированную опухоль.
МПК / Метки
МПК: C07D 487/04, A61P 25/00, A61K 31/519, C07D 519/00
Метки: 2-пиридинил, 2-а, гетероарилзамещенные, пиримидин-4-она, производные, 2-пиримидинил, 9-тетрагидропиримидо[1
Код ссылки
<a href="https://eas.patents.su/28-7737-geteroarilzameshhennye-proizvodnye-2-piridinil-i-2-pirimidinil-6-7-8-9-tetragidropirimido1-2-a-pirimidin-4-ona.html" rel="bookmark" title="База патентов Евразийского Союза">Гетероарилзамещенные производные 2-пиридинил- и 2-пиримидинил- 6, 7, 8, 9-тетрагидропиримидо[1, 2-а] пиримидин-4-она</a>
Предыдущий патент: Комбинация ингибитора pde и антагониста лейкотриенового рецептора
Следующий патент: Макроциклические пептиды, обладающие активностью в отношении вируса гепатита с
Случайный патент: Способ увеличения молекулярной массы полимерного гранулята