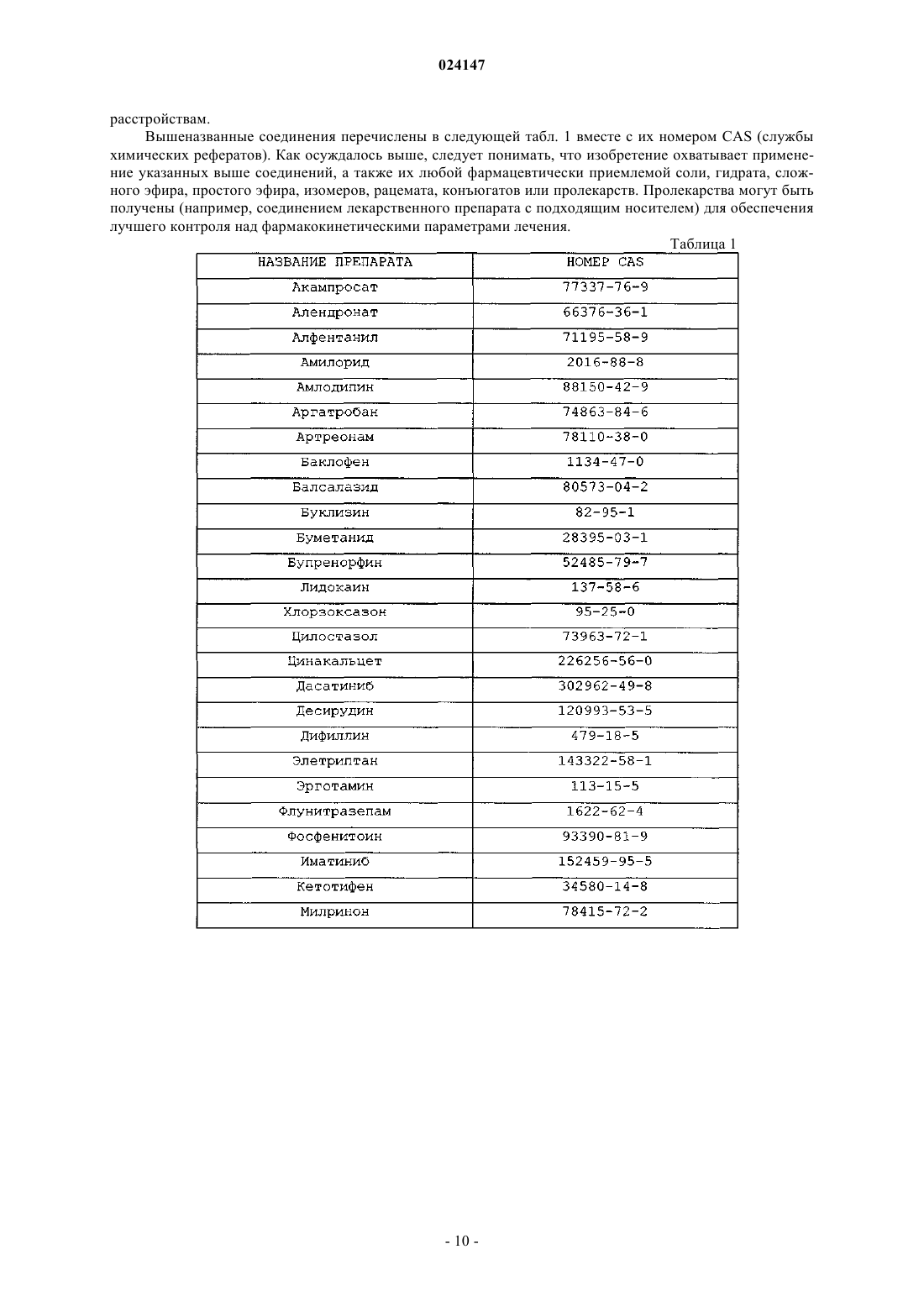
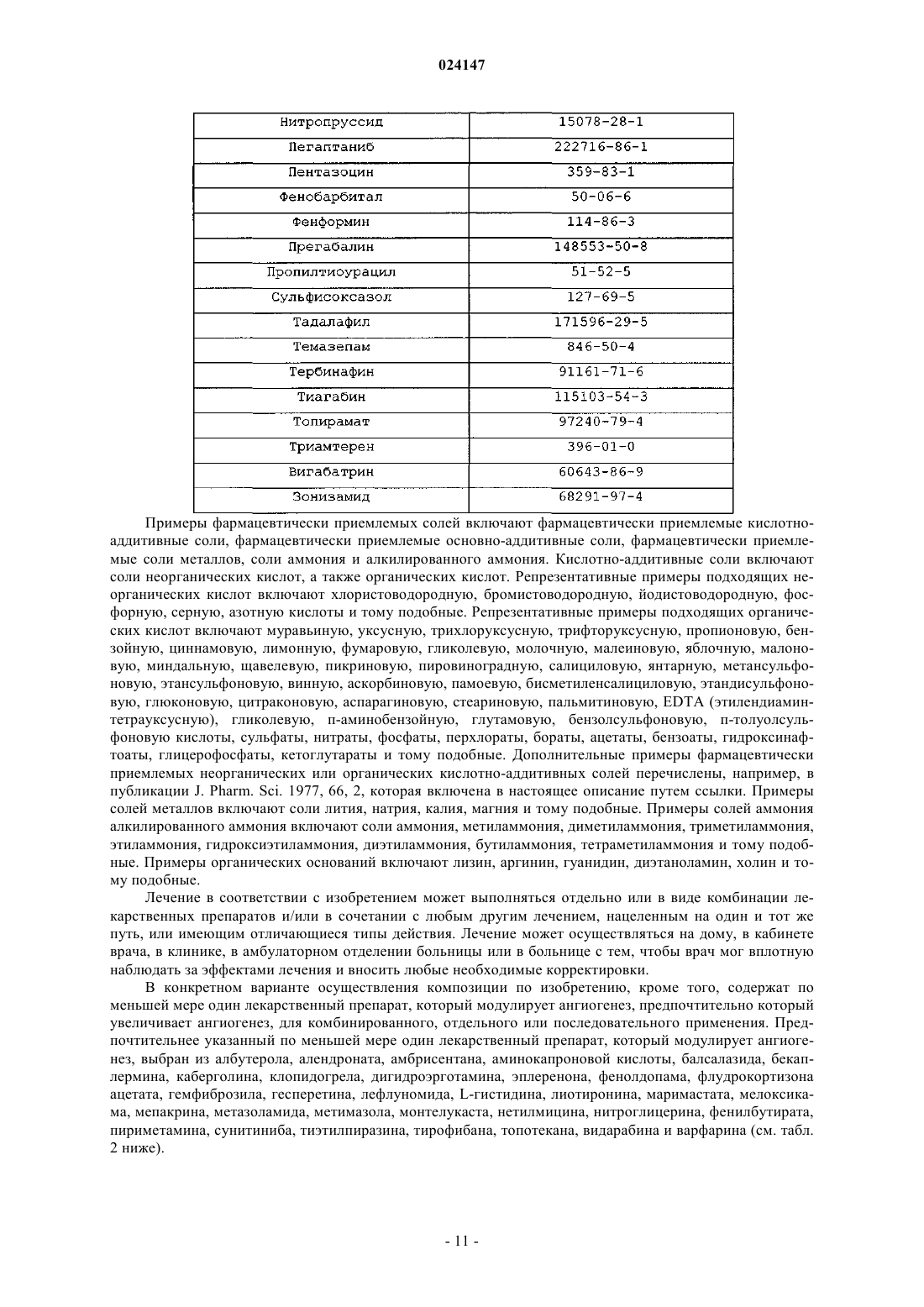
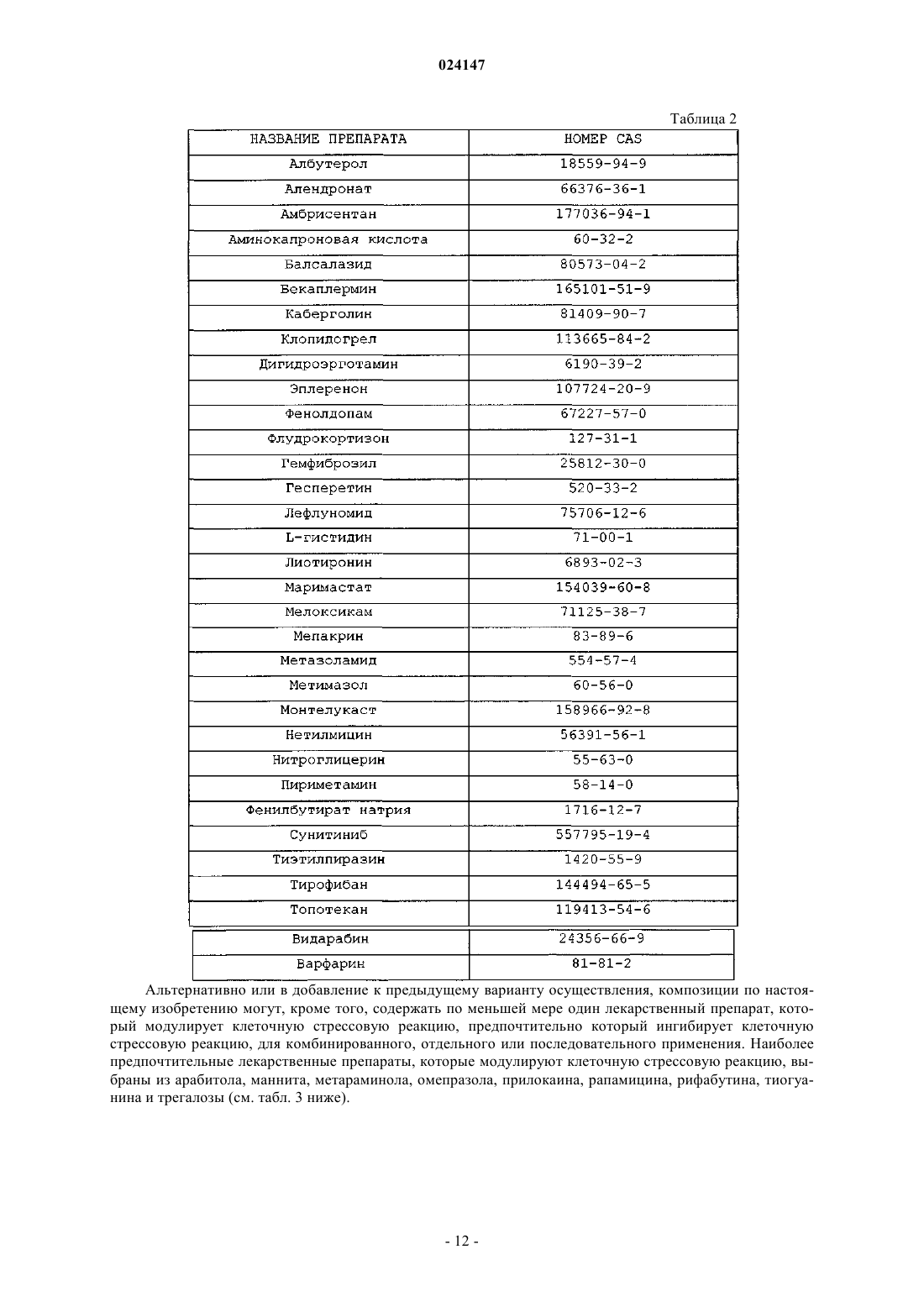
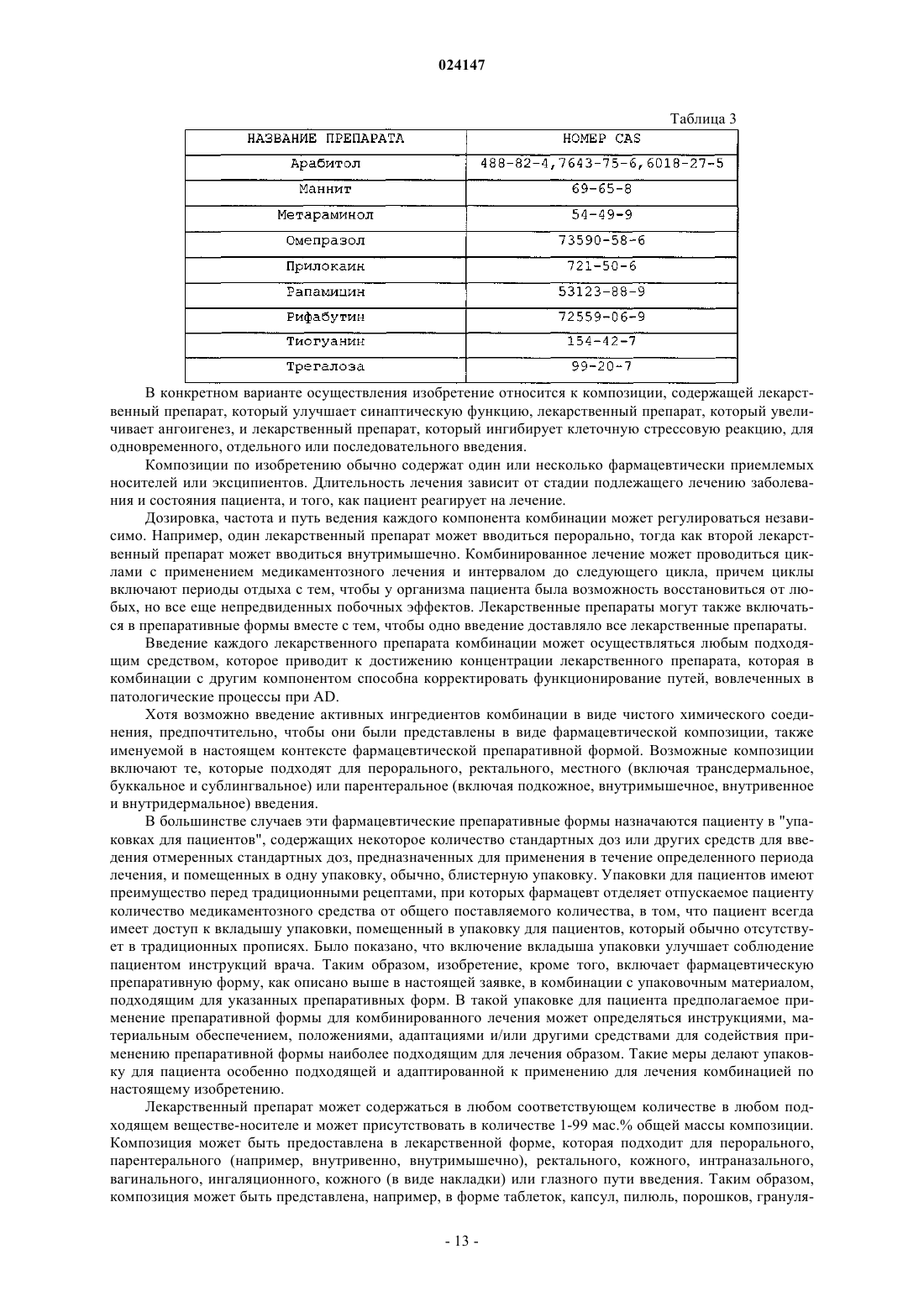
Комбинированные композиции для лечения болезни альцгеймера и родственных заболеваний зонизамидом и акампросатом
Номер патента: 24147
Опубликовано: 31.08.2016
Авторы: Набирошкин Сергей, Шумаков Илья, Шоле Натали, Герасименко Оксана, Коэн Даниель
Формула / Реферат
1. Применение комбинации, содержащей зонизамид и по меньшей мере одно соединение, выбранное из группы дифиллина, тадалафила, аргатробана, акампросата, цинакальцета, тербинафина, цилостазола, баклофена, фенформина, амлодипина и сульфисоксазола или их солей, для изготовления лекарственного средства для лечения болезни Альцгеймера.
2. Применение по п.1, где соединения или их соли предназначены для комбинированного, отдельного или последовательного введения с зонизамидом.
3. Применение по п.1 или 2, где указанная комбинация содержит, по меньшей мере, следующие соединения:
зонизамид и фенформин,
зонизамид и сульфисоксазол,
зонизамид и акампросат,
зонизамид и дифиллин,
зонизамид и баклофен,
зонизамид и тадалафил,
зонизамид и аргатробан или
зонизамид и цилостазол.
4. Применение по любому из предшествующих пунктов, где указанная комбинация содержит фармацевтически приемлемый носитель или эксципиент.
5. Применение по любому из предшествующих пунктов, где указанная комбинация вводится субъекту от одного до нескольких раз в день в течение от нескольких дней до нескольких лет.
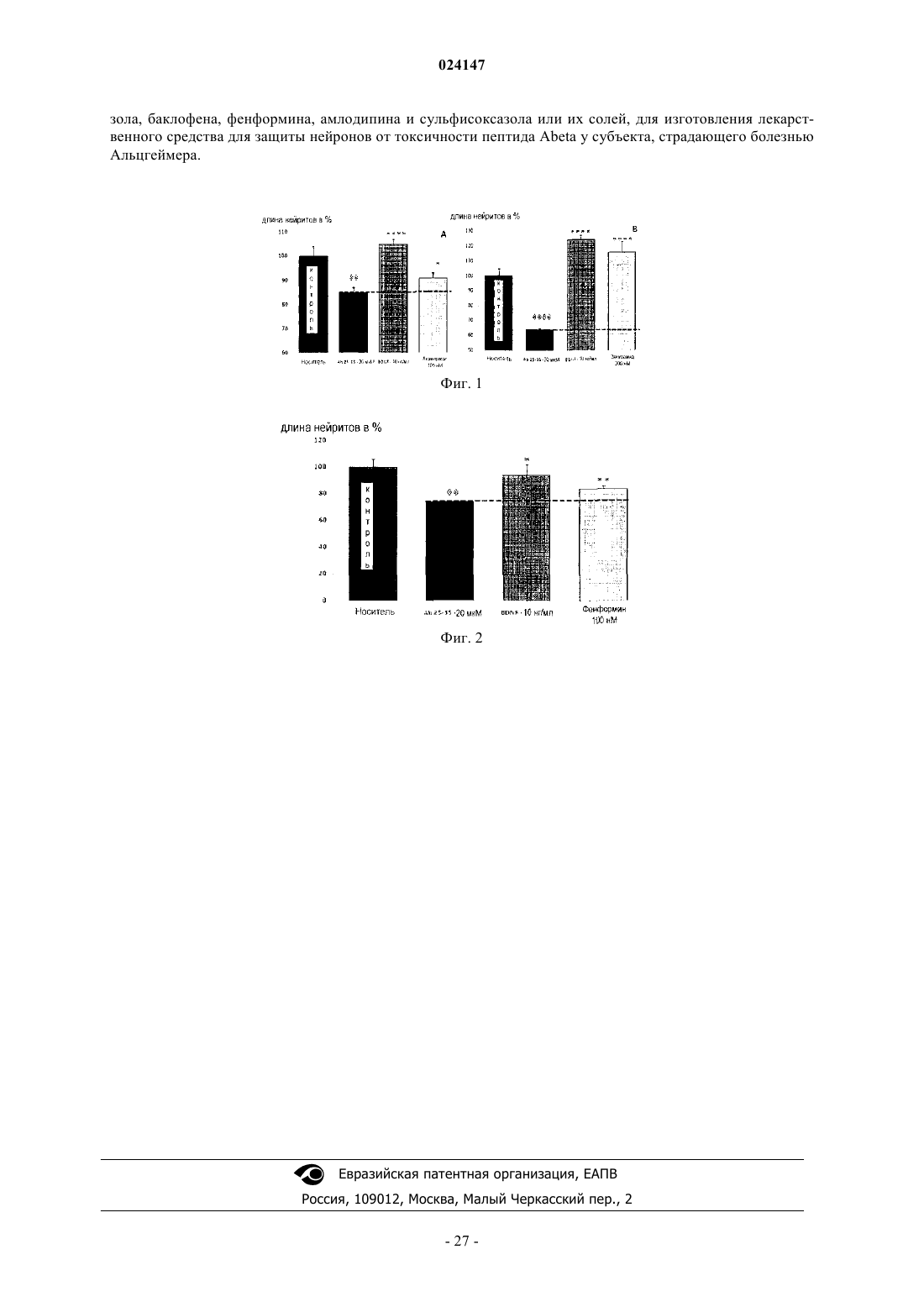
6. Применение комбинации, содержащей зонизамид и по меньшей мере одно соединение, выбранное из группы дифиллина, тадалафила, аргатробана, акампросата, цинакальцета, тербинафина, цилостазола, баклофена, фенформина, амлодипина и сульфисоксазола или их солей, для изготовления лекарственного средства для защиты нейронов от токсичности пептида Abeta у субъекта, страдающего болезнью Альцгеймера.
Текст
КОМБИНИРОВАННЫЕ КОМПОЗИЦИИ ДЛЯ ЛЕЧЕНИЯ БОЛЕЗНИ АЛЬЦГЕЙМЕРА И РОДСТВЕННЫХ ЗАБОЛЕВАНИЙ ЗОНИЗАМИДОМ И АКАМПРОСАТОМ Изобретение относится к применению комбинации, содержащей зонизамид и по меньшей мере одно соединение, выбранное из группы дифиллина, тадалафила, аргатробана, акампросата,цинакальцета, тербинафина, цилостазола, баклофена, фенформина, амлодипина и сульфисоксазола или их солей, для изготовления лекарственного средства для лечения болезни Альцгеймера. Изобретение также относится к применению комбинации, содержащей зонизамид и по меньшей мере одно соединение, выбранное из группы дифиллина, тадалафила, аргатробана, акампросата,цинакальцета, тербинафина, цилостазола, баклофена, фенформина, амлодипина и сульфисоксазола или их солей, для изготовления лекарственного средства для защиты нейронов от токсичности пептида Abeta у субъекта, страдающего болезнью Альцгеймера.RU-C2-2246295 ДАМУЛИН И.В. Применение церебролизина при сосудистой деменции и болезни Альцгеймера// Русский медецинский журнал, 2002,25, с. 1150-1155, [найдено 07.06.2011], Найдено из Интернет:URL:http://www.fesmu.ru/elib/Article.aspxid=86856, реферат и последний абзац ЯХНО Н.Н. и др. Болезнь Альцгеймера: клиника,патогенез,лечение// Русский медицинский журнал, 03.05.2006, т. 14,9,разделы Лечение БА, Препараты, оказывающие нейро-протективный эффект [он-лайн] [найдено 08.06.2011], Найдено из Интернет: URL:http:// Настоящее изобретение относится к композициям и способам лечения болезни Альцгеймера (AD) и родственных расстройств.AD представляет собой прототипическую кортикальную деменцию, характеризуемую нарушением памяти вместе с дисфазией (расстройством речи, при котором имеется нарушение разговорной речи и понимания разговорной речи), диспраксией (неспособности координировать и выполнять определенные прицельные движения и жесты в отсутствие двигательных или сенсорных нарушений) и агнозией (неспособностью узнавать объекты, лица, звуки, формы или запахи), которые могут быть связаны с вовлечением в патологический процесс кортикальных ассоциативных зон. Могут также наблюдаться особые симптомы, такие как спастический парапарез (нарушение в виде слабости в нижних конечностях) (1-4). Частота развития болезни Альцгеймера резко возрастает с возрастом. AD в настоящее время является самой частой причиной деменции. Она клинически характеризуется глобальным снижением когнитивной функции, которое медленно прогрессирует и оставляет пациентов в конечной стадии заболевания привязанными к постели, страдающими недержанием и зависимыми от ухода, осуществляемого опекунами. Смерть наступает в среднем через 9 лет после установления диагноза (5). Заболеваемость AD резко возрастает с возрастом. По оценкам популяционных исследований ООН к 2050 г количество людей в возрасте старше 80 лет приблизится к 370000000 человек. По оценкам в настоящее время 50% людей в возрасте старше 85 лет поражены AD. Поэтому через 50 лет более чем 100000000 людей во всем мире будут страдать деменцией. Огромное число людей, требующих постоянного ухода и других услуг, станет тяжелым бременем для медицинских, финансовых и человеческих ресурсов (6). Нарушение памяти является ранним признаком заболевания и включает эпизодическую память(память на события, произошедшие в пределах одного дня). Семантическая память (память словесного и зрительного значения) поражается на более поздних стадиях заболевания. Напротив, рабочая память(кратковременная память, вовлекающая структуры и процессы, используемые для временного хранения и манипулирования информацией) и процедурная память (подсознательная память, которая представляет собой долгосрочную память навыков и процедур) сохраняются до поздних стадий заболевания. По мере прогрессирования заболевания появляются дополнительные признаки нарушения речи, нарушений зрительного восприятия и пространственной ориентации, агнозии и апроксии. Классическая картина болезни Альцгеймера достаточно характерна для обеспечения возможности ее идентификации приблизительно у 80% случаев (7). Тем не менее, возникает клиническая неоднородность, и это важно не только для клинического ведения, но и обеспечивает дополнительную необходимость в специфических медикаментозных способах лечения по поводу функционально различных форм(8). Патологический критерий AD включает амилоидные бляшки, содержащие бета-амилоид (Abeta),сплетения нервных волокон (NFT), содержащие Tau, и дисфункцию и потерю нейронов и синапсов (911). В течение последнего десятилетия были предложены две основные гипотезы относительно причиныAD: "гипотеза амилоидного каскада", которая указывает, что нейродегенеративный процесс представляет собой серию явлений, запускаемых патологического процессинга амилоидного белкапредшественника (АРР) (12), и "гипотеза дегенерации цитоскелета нейронов" (13), которая предполагает,что запускающие явления представляют собой изменения цитоскелета нейронов. Наиболее широко принятой теорией, объясняющей прогрессирование AD, остается гипотеза амилоидного каскада (14-16), и исследователи AD главным образом сосредотачивались на определении механизмов, лежащих в основе токсичности, связанной с белками Abeta. Напротив, фармацевтическая промышленность уделяла белкуTau гораздо меньше внимания, чем амилоиду, из-за и фундаментальных, и практических причин. Кроме того, изменение синаптической плотности представляет собой патологическое поражение, которое наилучшим образом коррелируется с когнитивным нарушением, чем два другие. Исследования выявили,что, как представляется, амилоидная патология прогрессирует специфическим для нейромедиаторов образом, причем холинергические окончания представляются наиболее уязвимыми, за ними следуют глутаматергические окончания и, наконец, ГАМКергические окончания (11). Краткое описание сущности изобретения Целью настоящего изобретения является предоставление новых терапевтических подходов для лечения AD и родственных расстройств. Авторы идентифицировали молекулярный путь, который участвует в генезе AD и предоставляет новые мишени для разработки новых способов лечения или облегчения AD и родственных расстройств,в частности для разработки комбинированных способов лечения с использованием новых или существующих молекул, ранее использовавшихся по другим показаниям. Конкретнее, авторы идентифицировали несколько лекарственных средств, которые отдельно или в комбинации (комбинациях) могут эффективно воздействовать на такой путь и представляют новый и эффективный способ лечения AD и родственных расстройств. Поэтому изобретение предоставляет новые композиции и способы для лечения AD и родственных расстройств. Конкретнее, изобретение относится к композициям, подходящим для лечения болезни Альцгеймера или родственного расстройства у нуждающегося в лечении индивидуума, причем указанные композиции содержат лекарственное средство, которое улучшает функцию синапсов. Еще одна цель настоящего изобретения относится к композициям, подходящим для лечения болезни Альцгеймера или родственного расстройства у нуждающегося в лечении индивидуума, причем указанные композиции содержат комбинацию по меньшей мере двух лекарственных средств, которые улучшают функцию синапсов, для комбинированного, отдельного или последовательного введения. Предпочтительнее лекарственное средство или лекарственные средства, которые улучшают функцию синапсов, связываются или модулируют активность белка, кодируемого геном, выбранным из Конкретные и предпочтительные примеры таких лекарственных средств включают без ограничения соединения, выбранные из акампросата, алендроната, алфентанила, амилорида, амлодипина, аргатробана, азтреонама, баклофена, буклизина, буметанида, бупренорфина, лидокаина, хлорзоксазона, цилостазола, цинакалцета, дасатиниба, десирудина, дифиллина, элетриптана, эрготамина, флунитразепама, фосфенитоина, иматиниба, кетотифена, милринона, нитропрусеида, пегептаниба, пентазоцина, фенобарбитала,фенформина, прегабалина, пропилтиоурацила, сульфисоксазола, тадалафила, темпазепама, тербинафина,тиагабина, топирамата, триамтерена, вигабатрина и зонизамида, или их комбинации. В конкретном варианте осуществления композиции по настоящему изобретению, кроме того, содержат по меньшей мере одно лекарственное средство, которое модулирует ангиогенез, для комбинированного, отдельного или последовательного применения. Альтернативно или дополнительно, композиции по настоящему изобретению могут, кроме того,содержать по меньшей мере одно лекарственное средство, которое модулирует клеточную стрессовую реакцию, для комбинированного, отдельного или последовательного применения. Композиции по настоящему изобретению обычно, кроме того, содержат фармацевтически приемлемый носитель или эксципиент. Еще одна цель настоящего изобретения относится к способу получения лекарственного средства для лечения болезни Альцгеймера или родственного расстройства, причем способ включает стадию тестирования перспективного лекарственного средства на наличие активности в отношении функции синапсов и выбора лекарственных средств, которые улучшают функцию синапсов. Изобретение также относится к способу получения композиции для лечения болезни Альцгеймера или родственного расстройства, причем способ включает получение комбинации лекарственного средства, которое модулирует функцию синапсов, и лекарственного средства, которое модулирует ангиогенез или клеточную стрессовую реакцию, и составление указанной комбинации лекарственных средств для их одновременного, отдельного или последовательного введения нуждающемуся в лечении индивидууму. Изобретение, кроме того, относится к способу лечения болезни Альцгеймера или родственного расстройства, причем способ включает одновременное, отдельное или последовательное введение нуждающемуся в нем индивидууму лекарственного средства или комбинации лекарственных средств, которые улучшают функцию синапсов. Изобретение, кроме того, относится к способу лечения болезни Альцгеймера или родственного расстройства, причем способ включает одновременное, отдельное или последовательное введение нуждающемуся в нем индивидууму лекарственного средства, которое модулирует функцию синапсов, и лекарственного средства, которое модулирует ангиогенез, и/или лекарственного средства, которое модулирует клеточную стрессовую реакцию. Изобретение, кроме того, относится к применению лекарственного средства, которое улучшает функцию синапсов, для получения лекарственного препарата для лечения болезни Альцгеймера или родственного расстройства. Изобретение, кроме того, относится к применению комбинации по меньшей мере двух лекарственных средств, которые улучшают функцию синапсов, для получения лекарственного препарата для лечения болезни Альцгеймера или родственного расстройства, где по меньшей мере два лекарственных средства вводятся вместе, отдельно или последовательно. Как обсуждается в настоящем изобретении, указанные выше способы лечения и комбинированного лечения обеспечивают новые и эффективные подходы к лечению AD у людей. Краткое описание чертежей Фиг. 1 - воздействие выбранных лекарственных средств на разрастание нейритов в подвергнутой: интоксикации бета-амилоидом первичной культуре кортикальных нейронов крыс. р 0,00001: статистически значимое отличие от носителя. : р 0,05; : р 0,0001: статистически значимое отличие от Abeta25-35. Двусторонний критерий Стьюдента. Фиг. 2 - воздействие фенформиновых лекарственных средств на разрастание нейритов в подвергнутой интоксикации бета-амилоидом первичной культуре кортикальных нейронов крыс. : р 0,01: статистически значимое отличие от носителя. : р 0,05; : р 0,001: статистически значимое отличие отAbeta25-35. Двусторонний критерий Стьюдента. 20 мкМ Abeta25-35 вызывает значительную интоксикацию, выше 25%, по сравнению с нейронами,обработанными носителем (фиг. 1-A и В и 2, красные столбцы). Эта интоксикация эффективно предотвращается BDNF (мозговым нейротропным фактором) в концентрации 10 нг/мл, которая рассматривается как положительный нейропротективный контроль. Эта интоксикация также в значительной степени предотвращается такими лекарственными средствами как или акампросат (фиг. 1 А) или зонизамид (фиг. 1 В) и фенформин (фиг. 2). Подробное описание изобретения Настоящее изобретение относится к новым терапевтическим подходам к лечению AD или родственного расстройства. Изобретение обнаруживает новое применение лекарственных препаратов или комбинаций лекарственных препаратов, которые обеспечивают возможность эффективной коррекции таких заболеваний и могут применяться для лечения пациентов. Термин "родственное AD расстройство" обозначает болезнь Альцгеймера (АД), сенильную деменцию типа AD (SDAT), болезнь Паркинсона, деменцию, связанную с льюисовым телом, сосудистую деменцию, легкое когнитивное нарушение (MCI), возрастное нарушение памяти (AAMI) и проблему, связанную со старением, пост-энцефалическим паркинсонизмом, ALS и синдромом Дауна. Используемый в настоящем описании термин "лечение" расстройства включает терапию, предотвращение, профилактику, задержку или уменьшение симптомов, провоцируемых расстройством. Термин"лечение" включает, в частности, остановку прогрессирования заболевания и связанных с ним симптомов. Термин "улучшение", относящийся к функции синапсов, включает любое увеличение функции синапсов, по сравнению с существующей функцией, у индивидуума. Такое улучшение может включать восстановление, т.е., до нормальных уровней, или увеличение до уровня, более низкого чем нормальный,что, тем не менее, достаточно для улучшения состояния пациента. Такое улучшение может оцениваться или верифицироваться с использованием известных биологических тестов, таких как тесты, описанные в экспериментальном разделе. Также обозначение определенных соединений в контексте настоящего изобретения предназначено для включения не только конкретно названных молекул, но также его любая фармацевтически приемлемая соль, гидрат, сложный эфир, простой эфир, изомеры, рацемат, конъюгаты или пролекарства. Термин "комбинация" обозначает лечение, при котором по меньшей мере два или более лекарст-3 024147 венных средств вводятся индивидууму совместно для вызова биологического эффекта. При комбинированном лечении в соответствии с настоящим изобретением, два или более лекарственных средства могут вводиться вместе или отдельно, в одно и то же время или последовательно. Также по меньшей мере два лекарственных средства могут вводиться посредством различных путей и схем введения. В результате,хотя они могут совместно включаться в одну препаративную форму, лекарственные средства комбинации могут включаться в отдельные препаративные формы. Как обсуждается выше, изобретение относится к композициям и способом лечения болезни Альцгеймера и родственного расстройства у нуждающегося в лечении индивидуума с использованием лекарственного средства или комбинации лекарственных средств, которые улучшают функцию синапсов. Путем всестороннего объединения в одно целое экспериментальных данных, охватывающих результаты исследований клеточной биологии, экспериментов по профилированию экспрессии и исследований генетических связей, описывающих различные аспекты болезни Альцгеймера, и связей, существующих в клеточной передаче сигналов и функциональных путях, авторы обнаружили, что функция синапсов представляет важный механизм, который нарушается у индивидуумов, страдающих AD. Гены,локализующиеся в указанной функциональной сети, и вовлеченные в развитие болезни Альцгеймера,были выбраны по следующим критериям:(1) - прямое взаимодействие с генами, этиологически ответственными за семейные случаи болезни Альцгеймера (АРР, ApoE, пресенилины, белок tau),(2) - функциональные партнеры генов, выбранных критерием (1),(3) - ближайшие функциональные партнеры генов, выбранных критерием (2). Посредством этого процесса авторы смогли установить, что сеть, ответственная за дисфункцию синапсов, представляет собой основную функциональную сеть, пораженную при болезни Альцгеймера. Авторы установили, что синаптическая потеря представляет собой функционально релевантный критерий болезни Альцгеймера, которая в конечном счете приводит к прогрессирующему снижению когнитивной функции, потере памяти и деменции. Важно, что синаптическая потеря коррелируется лучше с недостаточностью когнитивной функции, характерной для патологии Альцгеймера, по сравнению с другими клеточными маркерами поражения, специфичными для AD, проявляющимися развитием сплетений нервных волокон или отложением амилоидных бляшек. Следовательно, организация синапсов и синаптическая пластичность представляют важную мишень для терапевтических вмешательств в контексте болезни Альцгеймера. Белок АРР переносится по аксонам и обрабатывается в пресинаптических окончаниях, приводя к высокому накоплению Abeta в синапсах. Сами олигомеры Abeta42, а также амилоидные бляшки важны для ингибирования длительного потенцирования и в первую очередь ответственны за нарушение памяти у пациентов с AD. Процедура объединения данных, разработанная авторами, выявила группу генов, которые вовлечены в синаптическое искажение при AD, и которые могут быть формально разделены на три основные функциональные группы: белки, участвующие в организации постсинаптической плотности ("PSD") и корригирующие передачу сигналов по нервам в постсинаптической мембране; белки, обеспечивающие высвобождение нейромедиаторов; и белки, участвующие в росте аксонов и связанной с развитием созревания синаптической механики. В конкретном варианте осуществления настоящее изобретение, таким образом, относится к композициям и способам применения лекарственных средств, которые повышают активность белков, участвующих в постсинаптической плотности. Афферентная часть возбуждающих синапсов постсинаптическая плотность - составлена из объединенной сети белков клеточного каркаса и рецепторов нейромедиаторов, которые служат широкому диапазону когнитивных функций, включая функции формирования памяти и обучения. Среди генов, идентифицированных анализом, разработанным авторами, ген DLG2 кодирует семейство белка MAGUK, который создает границу раздела между кластеризованными связанными с мембраной рецепторами, молекулами клеточной адгезии и цитоскелетом на основе актина. Авторы также идентифицировали большую группу рецепторов глутамата и ростовых факторов, которые взаимодействуют непосредственно с белком DLG2 или белковым комплексом DLG2/PSD95 в возбуждающих синапсах - а именно, рецепторы ErbB4 и TrkB, обработанные и функционально регулируемые пресенилином (17-18),ионотропные глутаматные рецепторы каината (GRIK2) и типы NMDA (GRIN3A, GRIN2B), типа дельт(GRID1, GRID2) глутаматные рецепторы, и соединенные с G-белком глутаматные рецепторы (GRM3,GRM7 и GRM8). Также авторы идентифицировали несколько эффекторных/модуляторных белков, которые участвуют в передаче сигналов вниз от синаптических рецепторов - цитрон, эффекторный белокRho/Rac, связывающие RASGRF2 АМРА рецепторы к активации RAS/ERK киназ, PARK2 и YES1 киназы. Другие релевантные AD функционально значимые гены, выявленные анализом, разработанным авторами, включают белки пресинаптический -нейрексин (NXR3) и постсинаптический нейролигин 1(NLGN1), которые образуют функциональный комплекс, участвующий в динамической совместной регуляции пре- и постсинаптических мембран на возбуждающих синапсах. В целом, популяция белков PSD, потенциально вовлеченных при болезни Альцгеймера, обогащена рецепторами, участвующими в организации возбуждающих глутаматергических синапсов; только несколько ингибиторных нейронных рецепторов - GABA(A) и GABA(B) были выявлены разработанным автором трафарета ввода полученных данных. В другом конкретном варианте осуществления настоящее изобретение относится к композициям и способом применения лекарственных средств, которые повышают активность белков, участвующих в регуляции высвобождения нейромедиаторов предпочтительно на пресинаптической мембране. Высвобождение нейромедиаторов в ограниченной и высоко специализированной активной зоне пресинаптической плазматической мембраны запускается потенциалом действия и регулируется комбинированными и противоположными действиями зависимых от напряжения, кальций-селективных Cav каналов (положительных модуляторов высвобождения нейромедиаторов) и MaxiK каналов, высоко проводимых, чувствительных к напряжению и кальцию калиевых каналов (отрицательных модуляторов высвобождения нейромедиаторов). Оба типа каналов были выбраны выполненным авторами анализом в качестве подходящих терапевтических мишеней для лечения болезни Альцгеймера. Кроме того, высвобождение нейромедиаторов в пресинаптической мембране могло модулироваться с одновременным применением лекарственных средств, влияющих на активность PRKG1 киназы и/или пресинаптические ГАМК(В) рецепторы. Проведенный авторами анализ выявил также группу белков, участвующих в структурной организации механики высвобождения нейромедиаторов, ответственной за созревание, докинг и слияние синаптических пузырьков с белками, составляющими активную зону белками STX2 и STXBP6, участвующими в слиянии синаптических пузырьков, белков BIN1, RAB3B, UNC13C, существенных для созревания и белков, составляющих каркас RIMS1/2. Белки, идентифицированные анализом, проведенным авторами,представляют и структурные белки, непосредственно участвующие в экзоцитозе/эндоцитозе и рециклировании синаптических пузырьков, и их зависимые от функциональной активности модуляторы. В другом конкретном варианте осуществления настоящее изобретение относится к композициям и способам, в которых используются лекарственные препараты, которые повышают активность белков,участвующих в регуляции роста и направления аксонов. Белки, участвующие в регуляции роста и направления аксонов, обеспечивают возможность миграции нейронных клеток-предшественников и аксонов в направлении должных участков назначения для обеспечения правильной локализации и соединения; они также участвуют в созревании в процессе развития вновь образованных синапсов, а также разрушении аксонов и синапсов при болезни Альцгеймера. Эти процессы играют фундаментальную роль в осуществлении когнитивных функций и представляются крайне уязвимыми для токсических воздействий бета-амилоидных отложений. Последовательные стадии роста и направления аксонов тщательно регулируются комбинированными действиями внеклеточных или связанных с мембранами молекул нетринов, семафоринов, эфринов,DLL и Slits и их соответствующих функциональных рецепторов, большинство из которых были выявлены подходом авторов к поиску данных. Функциональные исходы активации большинства из ростовых рецепторов аксонов тесно связаны с их способностью дифференциально модулировать активность малыхGTP-аз RhoA, Racl и Cdc42, причем RhoA GTP-аза, главным образом, ответственна за ретракцию невритов и коллапс ростового конуса (19). Среди выбранных генов рецептор Нейтрина направления аксона DCC участвует и в притяжении, и в отталкивании нейронов, тогда как рецептор нетрина UNC5C скорее обладает активностью отталкивания нейронов (20); семафорины и эфрины опосредуют коллапс ростового конуса и отталкивание в нервной системе во время развития и играют важную роль в синаптической пластичности в ЦНС взрослых индивидуумов (21-25). Белки Slits одновременно вовлечены в отталкивание и разветвление аксонов, два тесно связанных процесса, и модулируют активность рецепторов нитрина (26). Наконец, представляется,что рецептор Notch воздействует на направление аксона посредством и RBPJ-зависимого, и RBPJнезависимого пути ABL1/DAB1/TRIO, регулирующего организацию цитоскелета актина (27). В настоящем изобретении авторы предлагают новые композиции, которые могут применяться для улучшения функции синапсов, измененной при болезни Альцгеймера и других нейродегенеративных расстройствах. В конкретном варианте осуществления в композициях и способах по настоящему изобретению используются лекарственные препараты, которые улучшают функцию синапсов посредством их взаимодействия с одним геном или белком или их модуляции, как перечислено выше. Конкретнее, композиции по настоящему изобретению включают лекарственный препарат или препараты, которые улучшают функцию синапсов посредством связывания или модулирования активности белка, кодируемого геном, выбранным из Последовательности перечисленных выше генов и белков доступны из библиотек генов и могут быть выделены методиками, известными в уровне техники. Кроме того, активность этих генов и белков можно оценить методиками, известными в уровне техники, как обсуждается в экспериментальном разделе. В изобретении, кроме того, описаны лекарственные препараты, которые могут применяться для модуляции этих генов и белков-мишеней. В изобретении раскрывается идентификация и активность конкретных лекарственных препаратов, которые или отдельно, но предпочтительно в комбинации(ях) модулируют указанный выше путь и могут применяться для лечения указанных заболеваний. В частности,авторы идентифицировали малые молекулы, которые уже существуют в литературе, но применяются для лечения определенных заболеваний у людей. В этом отношении, в наиболее предпочтительном варианте осуществления композиции по настоящему изобретению содержат, по меньшей мере, ингибитор АВАТ (предпочтительно вигабатрин); и/или ингибитор ABL1 (предпочтительно иматиниб); и/или модулятор ADORA2B (предпочтительно дифиллин); и/или модулятор АМРК (предпочтительно фенформин) и/или ингибитор CACNA1C (предпочтительно амлодипин); и/или ингибитор CACNA2D3 (предпочтительно прегабалин); и/или модулятор CASRDHFR (предпочтительно триамтерен), и/или ингибитор ЕРНА 3 (предпочтительно дисатиниб), и/или антагонист EDNRA рецептора эндотелина (предпочтительно сульфизоксазол), и/или модулятор GABBR2 и глутаматергических рецепторов (предпочтительно выбранных из баклофена и акампросата), и/или модулятор GABRA2 (предпочтительно выбранный из фенобарбитала и азтреонама), и/или антагонист GRIK1(предпочтительно топирамате), и/или модулятор GRIN2B и GRIN3A (предпочтительно акампросат),и/или модулятор HTR1B и HTR1D (предпочтительно выбранный из эрготамина и элетриптана), и/или антагонист KCND2 (предпочтительно лидокаин), и/или модулятор KCNMA1 (предпочтительно хлорзоксазон), и/или модулятор NOS1 (предпочтительно выбранный из кетотифена и пропилтиоурацила), и/или ингибитор NRP2 (предпочтительно пегаптаниб), и/или модулятор OPCML (предпочтительно алфентанил), и/или модулятор OPRK1 (предпочтительно выбранный из бупренорфина и пентазоцина), и/или ингибитор рецептора PAR1 тромбина (предпочтительно аргатробан), и/или ингибитор фосфодиэстеразPDE4A/4B и активатор BK каналов (предпочтительно цилостазол), и/или ингибитор PDE4D (предпочтительно милринон), и/или активатор PRKG1 (предпочтительно выбранный из нитропруссида, тадалафила и цилостазола), и/или модулятор RHOA (предпочтительно выбранный из алендроната и тербинафина),и/или ингибитор натриевых каналов SCN1A и активатор BK каналов (предпочтительно зонизамид),и/или ингибитор SCN1A/B (предпочтительно фосфенитоин), и/или ингибитор SLC6A1 (предпочтительно тиагабин), и/или ингибитор SLC9A1 (предпочтительно буклизин), и/или ингибитор SLC12A1 (предпочтительно буметанид), и/или ингибитор тромбина (предпочтительно десирудин), и/или модулятор TSPO(предпочтительно выбранный из флунитразепама и темазепама), и/или ингибитор YES1 (предпочтительно дасатиниб). Как обсуждено выше, изобретение, в частности, предлагает схему комбинированных способов лечения для воздействия на механизмы AD и родственные расстройства. В этом отношении примеры наиболее предпочтительной мишени и лекарственной комбинации обсуждены ниже. Предпочтительнее композиция по изобретению содержит по меньшей мере одну из следующих комбинаций лекарственных препаратов для комбинированного, отдельного или последовательного введения: модулятор AMPK (предпочтительно фенформин) и ингибитор натриевых каналов SCN1A и активатора BK каналов (предпочтительно зонизамид),модулятор AMPK (предпочтительно фенформин) и модулятор ГАМКергических и глутаматергических рецепторов (предпочтительно акампросат),модулятор AMPK (предпочтительно фенформин) и антагонист EDNRA рецептора эндотелина(предпочтительно сульфисоксазол),модулятор ГАМКергических и глутаматергических рецепторов (предпочтительно акампросат) и антагонист EDNRA рецептора эндотелина (предпочтительно сульфисоксазол),ингибитор натриевых каналов SCN1A и активатор BK каналов (предпочтительно зонизамид) и антагонист EDNRA рецепторов эндотелина (предпочтительно сульфисоксазол),модулятор ГАМКергических и глутаматергических рецепторов (предпочтительно акампросат) и ингибитор фосфодиэстераз PDE3A/3B и PDE4A/4B и активатор BK каналов (предпочтительно цилостазол),ингибитор натриевых каналов SCN1A и активатор BK каналов (предпочтительно зонизамид) и модулятор рецепторов аденозина ADORA2B (предпочтительно дифиллин),ингибитор натриевых каналов SCN1A и активатор BK каналов (предпочтительно зонизамид) и ингибитор рецепторов тромбина PAR1 (предпочтительно аргатробан),модулятор AMPK (предпочтительно фенформин) и модулятор рецепторов аденозина ADORA2BPDE4A/4B и активатор BK каналов (предпочтительно цилостазол),ингибитор PDE11A и фосфодиэстераз PDE4A, PDE5A (предпочтительно тадалафил) и ингибитор фосфодиэстераз PDE3A/3B и PDE4A/4B и активатор BK каналов (предпочтительно цилостазол), или ингибитор натриевых каналов SCN1A и активатор BK каналов (предпочтительно зонизамид) и ингибитор фосфодиэстераз PDE3A/3B и PDE4A/4B и активатор BK каналов (предпочтительно цилостазол). Наиболее предпочтительные примеры композиций по настоящему изобретению содержат соединение, выбранное из акампросата, алендроната, алфентанила, амилорида, амлодипина, аргатробана, азтреонама, баклофена, буклизина, буметанида, бупренорфина, лидокаина, хлорзоксазона, цилостазола, цинакальцета, дасатиниба, дезируцина, дифиллина, элетриптана, эрготамина, флунитразепама, фосфенитоина,иматиниба, кетотифена, милринона, нитропруссида, пегаптаниба, пентазоцина, фенформина, фенобарбитала, прегабалина, пропилтиоурацила, сульфисоксазола, тадалафила, темазепама, тербинафина, тиагабина, топирамата, триамтерена, вигабатрина и зонизамида, или их комбинацию. Наиболее предпочтительные примеры комбинированных медикаментозных средств лечения по настоящему изобретению включают комбинированное применение, по меньшей мере, следующих соединений: фенформин и зонизамид,фенформин и акампросат,фенформин и сульфисоксазол,акампросат и сульфисоксазол,зонизамид и сульфисоксазол,акампросат и цилостазол,акампросат и зонизамид,акампросат и цилостазол,зонизамид и дифиллин,зонизамид и аргатробан,фенформин и дифиллин,фенформин и цилостазол,-7 024147 тадалафил и цилостазол или зонизамид и цилостазол. Наиболее предпочтительные композиции содержат по меньшей мере одно соединение, выбранное из группы, состоящей из зонизамида, дифиллина, тадалафила, аргатробана, акампросата, цинакальцета,тербинафина, цитостазола, баклофена, фенформина, амлодипина и сульфисоксазола, или их солей, или пролекарств, или производных или препаративных форм длительного высвобождения для одновременного, отдельного или последовательного введения. В более предпочтительном варианте осуществления композиции по изобретению содержат комбинацию по меньшей мере двух соединений, выбранных из группы, состоящей из зонизамида, дифиллина,тадалафила, аргатробана, акампросата, цинакальцета, тербинафина, цилостазола, баклофена, фенформина, амлодипина и сульфисоксазола, или их солей, или пролекарств, или производных или препаративных форм длительного высвобождения для одновременного, отдельного или последовательного введения. В другом варианте осуществления композиция в соответствии с изобретением содержит комбинацию по меньшей мере двух соединений, выбранных из группы, состоящей из зонизамида, дифиллина,тадалафила, аргатробана, акампросата, цинакальцета, тербинафина, цилостазола, баклофена, фенформина, амлодипина и сульфисоксазола, или их солей, или пролекарств, или производных или препаративных форм длительного высвобождения, где указанная композиция улучшает функцию синапса, измененную при нейродегенеративных расстройствах, выбранных из группы, состоящей из болезни Альцгеймера(AD), болезни Паркинсона (PD), бокового амиотрофического склероза (ALS) и рассеянного склероза(MS). В другом предпочтительном варианте осуществления композиция по изобретению содержит комбинацию по меньшей мере двух соединений, выбранных из группы, состоящей из зонизамида, дифиллина, тадалафила, аргатробана, акампросата, цинакальцета, тербинафина, цилостазола, баклофена, фенформина, амлодипина и сульфисоксазола, или их солей, или пролекарств, или производных или препаративных форм длительного высвобождения для лечения болезни Альцгеймера (AD). Предпочтительно композиция для лечения болезни Альцгеймера или родственного расстройства у нуждающегося в лечении субъекта содержит по меньшей мере одну из следующих лекарственных комбинаций для комбинированного, отдельного или последовательного введения: фенформин и зонизамид,фенформин и акампросат,фенформин и сульфисоксазол,акампросат и сульфисоксазол,зонизамид и сульфисоксазол,акампросат и цилостазол,акампросат и зонизамид,акампросат и цилостазол,зонизамид и дифиллин,зонизамид и аргатробан,фенформин и дифиллин,фенформин и цилостазол,тадалафил и цилостазол или зонизамид и цилостазол. В наиболее предпочтительном варианте осуществления композиция в соответствии с изобретением содержит, по меньшей мере, зонизамид и акампросат, или их соли, или пролекарства, или производные или препаративные формы длительного высвобождения для одновременного, отдельного или последовательного введения. В другом предпочтительном варианте осуществления композиция по изобретению содержит, по меньшей мере, зонизамид и/или акампросат, или их соли, или пролекарства, или производные или препаративные формы длительного высвобождения, для лечения болезни Альцгеймера или родственного расстройства. В другом варианте осуществления композиция, кроме того, содержит по меньшей мере один лекарственный препарат, который модулирует функцию синапсов для одновременного, отдельного или последовательного введения. Предпочтительно дополнительный лекарственный препарат, который модулирует функцию синапсов, выбран из ингибитора АВАТ (предпочтительно вигабатрина); и/или ингибитора ABL1, (предпочтительно иматиниба); и/или модулятора ADORA2B (предпочтительно дифиллина); и/или модулятора АМРК (предпочтительно фенформина) и/или ингибитора CACNA1C, (предпочтительно амлодипина); и/или ингибитора CACNA2D3, (предпочтительно прегабалина); и/или модулятора CASR (предпочтительно цинакальцета); и/или модулятора CNGB3 (предпочтительно амилорида), и/или ингибитора DHFR(предпочтительно триамтерена), и/или ингибитора ЕРНА 3 (предпочтительно дасатиниба), и/или антагониста EDNRA рецепторов эндотелина (предпочтительно сульфисоксазола), и/или модулятора GABBR2 и глутаматергических рецепторов (предпочтительно выбранного из баклофена и акампросата), и/или мо-8 024147 дулятора GABRA2 (предпочтительно выбранного из фенобарбитала и азтреонама), и/или антагонистаGRIK1 (предпочтительно топирамата), и/или модулятора GRIN2B и GRIN3A (предпочтительно акампросата), и/или модулятора HTR1B и HTR1D (предпочтительно выбранного из эрготамина и элетриптана),и/или антагониста KCND2 (предпочтительно лидокаина), и/или модулятора KCNMA1 (предпочтительно хлорзоксазона), и/или модулятора NOS1 (предпочтительно выбранного из кетотифена и пропилтиоурацила), и/или ингибитора NRP2 (предпочтительно пегаптаниба), и/или модулятора OPCML (предпочтительно алфентанила), и/или модулятора OPRK1 (предпочтительно выбранного из бупренорфина и пентазоцина), и/или ингибитора рецепторов тромбина PAR1 (предпочтительно аргатробана), и/или ингибитораPDE11A и фосфодиэстераз PDE4A, PDE5A (предпочтительно тадалафила), и/или ингибитора фосфодиэстераз PDE3A/3B и PDE4A/4B и активатора BK каналов (предпочтительно цилостазола), и/или ингибитора PDE4D (предпочтительно милринона), и/или активатора PRKG1 (предпочтительно выбранного из нитропруссида, тадалафила и цилостазола), и/или модулятора RHOA (предпочтительно выбранного из алендроната и тербинафина), и/или ингибитора натриевых каналов SCN1A и активатора BK каналов(предпочтительно зонизамида), и/или ингибитора SCN1A/B (предпочтительно фосфенитоина), и/или ингибитора SLC6A1 (предпочтительно тиагабина), и/или модулятора SLC9A1 (предпочтительно буклизина), и/или ингибитора SLC12A1 (предпочтительно буметадина), и/или ингибитора тромбина (предпочтительно десирудина), и/или модулятора TSPO (предпочтительно выбранного из флунитразепама и темазепама), и/или ингибитора YES1 (предпочтительно дасатиниба). В других вариантах осуществления указанный дополнительный лекарственный препарат, который модулирует функцию синапсов, выбран из лекарственного препарата или препаратов, которые связываются или модулируют активность белка, кодируемого геном, выбранным из: Авторы установили, что указанные выше лекарственные препараты и комбинации лекарственных препаратов обеспечивают улучшенный и синергический биологический эффект, ведущий к эффективной коррекции или нормализации функционального нарушения регуляции, ведущего к AD и родственным расстройствам. Вышеназванные соединения перечислены в следующей табл. 1 вместе с их номером CAS (службы химических рефератов). Как осуждалось выше, следует понимать, что изобретение охватывает применение указанных выше соединений, а также их любой фармацевтически приемлемой соли, гидрата, сложного эфира, простого эфира, изомеров, рацемата, конъюгатов или пролекарств. Пролекарства могут быть получены (например, соединением лекарственного препарата с подходящим носителем) для обеспечения лучшего контроля над фармакокинетическими параметрами лечения. Таблица 1 Примеры фармацевтически приемлемых солей включают фармацевтически приемлемые кислотноаддитивные соли, фармацевтически приемлемые основно-аддитивные соли, фармацевтически приемлемые соли металлов, соли аммония и алкилированного аммония. Кислотно-аддитивные соли включают соли неорганических кислот, а также органических кислот. Репрезентативные примеры подходящих неорганических кислот включают хлористоводородную, бромистоводородную, йодистоводородную, фосфорную, серную, азотную кислоты и тому подобные. Репрезентативные примеры подходящих органических кислот включают муравьиную, уксусную, трихлоруксусную, трифторуксусную, пропионовую, бензойную, циннамовую, лимонную, фумаровую, гликолевую, молочную, малеиновую, яблочную, малоновую, миндальную, щавелевую, пикриновую, пировиноградную, салициловую, янтарную, метансульфоновую, этансульфоновую, винную, аскорбиновую, памоевую, бисметиленсалициловую, этандисульфоновую, глюконовую, цитраконовую, аспарагиновую, стеариновую, пальмитиновую, EDTA (этилендиаминтетрауксусную), гликолевую, п-аминобензойную, глутамовую, бензолсульфоновую, п-толуолсульфоновую кислоты, сульфаты, нитраты, фосфаты, перхлораты, бораты, ацетаты, бензоаты, гидроксинафтоаты, глицерофосфаты, кетоглутараты и тому подобные. Дополнительные примеры фармацевтически приемлемых неорганических или органических кислотно-аддитивных солей перечислены, например, в публикации J. Pharm. Sci. 1977, 66, 2, которая включена в настоящее описание путем ссылки. Примеры солей металлов включают соли лития, натрия, калия, магния и тому подобные. Примеры солей аммония алкилированного аммония включают соли аммония, метиламмония, диметиламмония, триметиламмония,этиламмония, гидроксиэтиламмония, диэтиламмония, бутиламмония, тетраметиламмония и тому подобные. Примеры органических оснований включают лизин, аргинин, гуанидин, диэтаноламин, холин и тому подобные. Лечение в соответствии с изобретением может выполняться отдельно или в виде комбинации лекарственных препаратов и/или в сочетании с любым другим лечением, нацеленным на один и тот же путь, или имеющим отличающиеся типы действия. Лечение может осуществляться на дому, в кабинете врача, в клинике, в амбулаторном отделении больницы или в больнице с тем, чтобы врач мог вплотную наблюдать за эффектами лечения и вносить любые необходимые корректировки. В конкретном варианте осуществления композиции по изобретению, кроме того, содержат по меньшей мере один лекарственный препарат, который модулирует ангиогенез, предпочтительно который увеличивает ангиогенез, для комбинированного, отдельного или последовательного применения. Предпочтительнее указанный по меньшей мере один лекарственный препарат, который модулирует ангиогенез, выбран из албутерола, алендроната, амбрисентана, аминокапроновой кислоты, балсалазида, бекаплермина, каберголина, клопидогрела, дигидроэрготамина, эплеренона, фенолдопама, флудрокортизона ацетата, гемфиброзила, гесперетина, лефлуномида, L-гистидина, лиотиронина, маримастата, мелоксикама, мепакрина, метазоламида, метимазола, монтелукаста, нетилмицина, нитроглицерина, фенилбутирата,пириметамина, сунитиниба, тиэтилпиразина, тирофибана, топотекана, видарабина и варфарина (см. табл. 2 ниже). Альтернативно или в добавление к предыдущему варианту осуществления, композиции по настоящему изобретению могут, кроме того, содержать по меньшей мере один лекарственный препарат, который модулирует клеточную стрессовую реакцию, предпочтительно который ингибирует клеточную стрессовую реакцию, для комбинированного, отдельного или последовательного применения. Наиболее предпочтительные лекарственные препараты, которые модулируют клеточную стрессовую реакцию, выбраны из арабитола, маннита, метараминола, омепразола, прилокаина, рапамицина, рифабутина, тиогуанина и трегалозы (см. табл. 3 ниже). В конкретном варианте осуществления изобретение относится к композиции, содержащей лекарственный препарат, который улучшает синаптическую функцию, лекарственный препарат, который увеличивает ангоигенез, и лекарственный препарат, который ингибирует клеточную стрессовую реакцию, для одновременного, отдельного или последовательного введения. Композиции по изобретению обычно содержат один или несколько фармацевтически приемлемых носителей или эксципиентов. Длительность лечения зависит от стадии подлежащего лечению заболевания и состояния пациента, и того, как пациент реагирует на лечение. Дозировка, частота и путь ведения каждого компонента комбинации может регулироваться независимо. Например, один лекарственный препарат может вводиться перорально, тогда как второй лекарственный препарат может вводиться внутримышечно. Комбинированное лечение может проводиться циклами с применением медикаментозного лечения и интервалом до следующего цикла, причем циклы включают периоды отдыха с тем, чтобы у организма пациента была возможность восстановиться от любых, но все еще непредвиденных побочных эффектов. Лекарственные препараты могут также включаться в препаративные формы вместе с тем, чтобы одно введение доставляло все лекарственные препараты. Введение каждого лекарственного препарата комбинации может осуществляться любым подходящим средством, которое приводит к достижению концентрации лекарственного препарата, которая в комбинации с другим компонентом способна корректировать функционирование путей, вовлеченных в патологические процессы при AD. Хотя возможно введение активных ингредиентов комбинации в виде чистого химического соединения, предпочтительно, чтобы они были представлены в виде фармацевтической композиции, также именуемой в настоящем контексте фармацевтической препаративной формой. Возможные композиции включают те, которые подходят для перорального, ректального, местного (включая трансдермальное,буккальное и сублингвальное) или парентеральное (включая подкожное, внутримышечное, внутривенное и внутридермальное) введения. В большинстве случаев эти фармацевтические препаративные формы назначаются пациенту в "упаковках для пациентов", содержащих некоторое количество стандартных доз или других средств для введения отмеренных стандартных доз, предназначенных для применения в течение определенного периода лечения, и помещенных в одну упаковку, обычно, блистерную упаковку. Упаковки для пациентов имеют преимущество перед традиционными рецептами, при которых фармацевт отделяет отпускаемое пациенту количество медикаментозного средства от общего поставляемого количества, в том, что пациент всегда имеет доступ к вкладышу упаковки, помещенный в упаковку для пациентов, который обычно отсутствует в традиционных прописях. Было показано, что включение вкладыша упаковки улучшает соблюдение пациентом инструкций врача. Таким образом, изобретение, кроме того, включает фармацевтическую препаративную форму, как описано выше в настоящей заявке, в комбинации с упаковочным материалом,подходящим для указанных препаративных форм. В такой упаковке для пациента предполагаемое применение препаративной формы для комбинированного лечения может определяться инструкциями, материальным обеспечением, положениями, адаптациями и/или другими средствами для содействия применению препаративной формы наиболее подходящим для лечения образом. Такие меры делают упаковку для пациента особенно подходящей и адаптированной к применению для лечения комбинацией по настоящему изобретению. Лекарственный препарат может содержаться в любом соответствующем количестве в любом подходящем веществе-носителе и может присутствовать в количестве 1-99 мас.% общей массы композиции. Композиция может быть предоставлена в лекарственной форме, которая подходит для перорального,парентерального (например, внутривенно, внутримышечно), ректального, кожного, интраназального,вагинального, ингаляционного, кожного (в виде накладки) или глазного пути введения. Таким образом,композиция может быть представлена, например, в форме таблеток, капсул, пилюль, порошков, грануля- 13024147 тов, суспензий, эмульсий, растворов, гелей, включая гидрогели, паст, мазей, кремов, пластырей, примочек, устройств осмотической подачи, суппозиторий, клизм, растворов для инъекций, имплантатов, спреев или аэрозолей. Фармацевтические композиции могут составляться в соответствии с обычной фармацевтической практикой (см., например, документы Remington: The Science and Practice of Pharmacy (20th ed.), ed. A.R.and J.C. Boylan, 1988-1999, Marcel Dekker, New York). Фармацевтические композиции в соответствии с изобретением могут составляться для высвобождения активного лекарственного препарата, по существу, немедленно после введения или в любое заданное время или период времени после введения. Препаративные формы контролируемого высвобождения включают (i) препаративные формы, которые создают, по существу, постоянную концентрацию лекарственного препарата внутри организма в течение продолжительного периода времени; (ii) препаративные формы, которые после заданного промежутка времени создают, по существу, постоянную концентрацию лекарственного препарата внутри организма в течение продолжительного периода времени; (iii) препаративные формы, которые обеспечивают действие лекарственного препарата в течение заданного периода времени путем поддержания относительно постоянного, эффективного уровня лекарственного препарата в организме с одновременной минимизацией нежелательных побочных эффектов, связанных с колебаниями содержания в плазме активного лекарственного вещества; (iv) препаративные формы, которые локализуют действие лекарственного препарата, например, пространственным помещением композиции контролируемого высвобождения с примыканием к пораженной ткани органа; и (v) препаративные формы, которые нацеливают действие лекарственного препарата использованием носителей или химических производных для доставки лекарственного препарата к определенному целевому типу клеток. Введение лекарственных препаратов в форме препаративной формы контролируемого высвобождения особенно предпочтительно в случаях, в которых лекарственный препарат, отдельно или в комбинации, имеет (i) узкий терапевтический индекс (т.е. различие между концентрацией в плазме, ведущей к вредным побочным эффектам или токсическим реакциям, и концентрацией в плазме, ведущей к терапевтическому эффекту, является небольшим; в целом, терапевтический индекс, TI, определяется как отношение медианы летальной дозы (LD50) к медиане эффективной дозы (ED50; (ii) узкое окно абсорбции в желудочно-кишечном тракте или (iii) очень короткий биологический период полувыведения, так что требуется частое введение в течение дня для поддержания содержания в плазме на терапевтическом уровне. Для получения контролируемого высвобождения, при котором скорость высвобождения превышает скорость метаболизма рассматриваемого лекарственного препарата, может использоваться любая из ряда стратегий. Контролируемое высвобождение может быть получено соответствующим выбором различных параметров и ингредиентов препаративной формы, включая, например, различные типы композиций контролируемого высвобождения и покрытий. Таким образом, лекарственный препарат включается в состав с соответствующими эксципиентами в фармацевтическую композицию, которая, после введения,высвобождает лекарственный препарат контролируемым образом (композиции в виде стандартных доз,включенных в таблетки или капсулы, для однократного или множественного введения, масляные растворы, суспензии, эмульсии, микрокапсулы, микросферы, наночастицы, накладки и липосомы). Твердые лекарственные формы для перорального применения. Препаративные формы для перорального применения включают таблетки, содержащие активный ингредиент(ы) в смеси с нетоксичными фармацевтически приемлемыми эксципиентами. Эти эксципиенты могут, например, представлять собой инертные разбавители или наполнители (например, сахарозу,микрокристаллическую целлюлозу, крахмалы, включая картофельный крахмал, карбонат кальция, хлорид натрия, фосфат кальция, сульфат кальция или фосфат натрия); гранулирующие и разрыхляющие агенты (например, производные целлюлозы, включая микрокристаллическую целлюлозу, крахмалы,включая картофельный крахмал, кроскармеллозу натрия, альгинаты или альгиновую кислоту); связывающие агенты (например, акацию, альгиновую кислоту, альгинат натрия, желатин, крахмал, предварительно желатинированный крахмал, микрокристаллическую целлюлозу, карбоксиметилцеллюлозу натрия, метилцеллюлозу, гидроксипропилметилцеллюлозу, этилцеллюлозу, поливинилпирролидон или полиэтиленгликоль); и смазывающие агенты, глянцеватели и антиадгзионные агенты (например, стеариновую кислоту, диоксиды кремния, или тальк). Другие фармацевтически приемлемые эксципиенты могут представлять собой красящие агенты, ароматизирующие агенты, пластификаторы, увлажнители, забуферивающие агенты и тому подобное. Таблетки могут быть непокрытыми или они могут быть покрыты известными методиками, возможно для задержки разрушения и абсорбции в желудочно-кишечном тракте и, посредством этого, обеспечивая продолжительное действие в течение более длительного периода. Покрытие может быть приспособлено для высвобождения активного лекарственного вещества заданным образом (например, для получения препаративной формы контролируемого высвобождения) или оно может быть приспособлено не высвобождать активное лекарственное вещество до тех пор, пока препаративная форма не пройдет через желудок (энтеросолюбильное покрытие). Покрытие может представлять собой сахарное покрытие, пленочное покрытие (например, на основе гидроксипропилметилцеллюлозы, метилцеллюлозы, метилгидроксиэтилцеллюлозы, гидроксипропилцеллюлозы, карбоксиметилцеллюлозы, акрилатных сополимеров,полиэтиленгликолей и/или поливинилпирролидона), или энтеросолюбильное покрытие (например, на основе сополимера метакриловой кислоты, ацетатфталата целлюлозы, фталата гидроксипропилметилцеллюлозы, ацетатсукцината гидроксипропилметилцеллюлозы, поливинилацетатфталата, шеллака и/или этилцеллюлозы). Может использоваться материал, задерживающий время высвобождения, такой как,например, глицерилмоностеарат или глицерилдистеарат. Твердые таблетированные композиции могут включать покрытие, приспособленное для защиты композиции от нежелательных химических изменений (например, химического разрушения перед высвобождением активного лекарственного вещества). Покрытие может наноситься на твердую лекарственную форму таким же образом, как описано в Encyclopedia of Pharmaceutical Technology (Энциклопедии фармацевтической технологии). Несколько лекарственных препаратов могут смешиваться вместе в таблетке или могут быть разделены. Например, первый лекарственный препарат содержится на внутренней стороне таблетки, а второй лекарственный препарат находится на наружной стороне таблетки с тем, чтобы существенная часть второго лекарственного препарата высвобождалась перед высвобождением первого лекарственного препарата. Препаративные формы для перорального применения могут быть также представлены в виде жевательных таблеток, или в виде твердых желатиновых капсул, где активный ингредиент смешан с инертным твердым разбавителем (например, картофельным крахмалом, микрокристаллической целлюлозой,карбонатом кальция, фосфатом кальция или каолином), или в виде мягких желатиновых капсул, где активный ингредиент смешан с водой или масляной средой, например, жидким парафином или оливковым маслом. Порошки или грануляты могут быть получены обычным образом с использованием ингредиентов, указанных выше в составе таблеток и капсул. Композиции контролируемого высвобождения для перорального применения могут быть, например, составлены для высвобождения активного лекарственного препарата путем регулирования растворения и/или диффузии активного лекарственного вещества. Регулируемое растворением или диффузией высвобождение может быть достигнуто соответствующим покрытием готовой формы лекарственных препаратов в виде таблетки, капсулы, пилюли или гранулята или включением лекарственного препарата в соответствующую матрицу. Покрытие, обеспечивающее контролируемое высвобождение, может включать одно или более покрывающих веществ, указанных выше, и/или, например, шеллак, пчелиный воск, гликовоск, касторовый воск, карнаубский воск,стеариловый спирт, глицерилмоностеарат, глицерилдистеарат, глицеролпальмитостеарат, этилцеллюлозу, акриловые смолы, d1-полимолочную кислоту, ацетатбутират целлюлозы, поливинилхлорид, поливинилацетат, винилпирролидон, полиэтилен, полиметакрилат, метилметакрилат, 2-гидроксиметакрилат,метакрилатные гидрогели, 1,3-бутиленгликоль, метакрилат этиленгликоля и/или полиэтиленгликоли. В матричном составе контролируемого высвобождения, матричный материал может также включать, например, гидрированную метилцеллюлозу, карнаубский воск и стеариновый спирт, карбопол 934, силикон, глицерилтристеарат, метилакрилат-метилметакрилат, поливинилхлорид, полиэтилен и/или галоидированный фторуглерод. Композиция контролируемого высвобождения, содержащая один или более лекарственных препаратов заявленных комбинаций, может быть также представлена в форме плавающей таблетки или капсулы (т.е. таблетки или капсулы, которая после перорального введения, плавает поверх желудочного содержимого в течение определенного периода времени). Препаративная форма лекарственного препарата(ов) в виде плавающей таблетки можетбыть получена гранулированием смеси лекарственного препарата(ов) с эксципиентами и 20-75% мас./мас. гидроколлоидов, таких как гидроксиэтилцеллюлоза, гидроксипропилцеллюлоза или гидроксипропилметилцеллюлоза. Затем полученные гранулы могут прессоваться в таблетки. После контакта с желудочным соком таблетка образует, по существу, непроницаемый для воды барьер геля вокруг ее поверхности. Этот гелевый барьер принимает участие в поддержании плотности менее единицы, посредством этого обеспечивая возможность таблетке оставаться плавающей в желудочном соке. Жидкости для перорального введения. Порошки, диспергируемые порошки или гранулы, подходящие для получения водных суспензий добавлением воды, представляют собой удобные лекарственные формы для перорального введения. Препаративная форма в виде суспензии предоставляет активный ингредиент в смеси с диспергирующим или смачивающим агентом, суспендирующим агентом и одним или более консервантами. Подходящими суспендирующими агентами являются, например, карбоксиметилцеллюлоза натрия, метилцеллюлоза,альгинат натрия и тому подобное. Парентеральные композиции. Фармацевтическую композицию можно также вводить парентерально инъекцией, инфузией или имплантацией (внутривенной, внутримышечной, подкожной или тому подобной) в лекарственных фор- 15024147 мах, препаративных формах или посредством подходящих устройств доставки или имплантатов, содержащих обычные, нетоксичные фармацевтически приемлемые носители и адъюванты. Составление и получение таких композиций хорошо известны специалистам в области составления фармацевтических средств. Композиции для парентерального применения могут быть предоставлены в стандартных лекарственных формах (например, в однодозовых ампулах) или во флаконах, содержащих несколько доз, и в которые может добавляться подходящий консервант (см. ниже). Композиция может быть представлена в форме раствора, суспензии, эмульсии, инфузионного устройства или устройства доставки для имплантации, или она может быть представлена в виде сухого порошка, подлежащего восстановлению влагосодержания добавлением воды или другого подходящего носителя перед применением. Кроме активного лекарственного препарата(ов), композиция может включать подходящие парентерально приемлемые носители и/или эксципиенты. Активный лекарственный препарат(ы) может быть включен в микросферы,микрокапсулы, наночастицы, липосомы или тому подобные для контролируемого высвобождения. Композиция может включать суспендирующие, солюбилизирующие, стабилизирующие, регулирующие рН агенты и/или диспергирующие агенты. Фармацевтические композиции в соответствии с изобретением могут быть представлены в стерильной форме, подходящей для инъекции. Для получения такой композиции, подходящий активный лекарственный препарат(ы) растворяется или суспендируется в парентерально приемлемом жидком носителе. Среди приемлемых носителей и растворителей, которые могут использоваться, можно указать воду, воду с рН, доведенным до подходящего уровня добавлением соответствующего количества хлористоводородной кислоты, гидроксида натрия или подходящего буфера, 1,3-бутандиола, раствора Рингера и изотонического раствора хлорида натрия. Водная препаративная форма может также содержать один или более консервантов (например, метил, этил или н-пропил п-гидроксибензоат). В случаях, когда один из лекарственных препаратов лишь умеренно или незначительно растворим в воде, может добавляться усиливающий растворение или солюбилизирующий агент, или растворитель может включать 10-60% мас./мас., пропиленгликоля или тому подобного соединения. Парентеральные композиции контролируемого высвобождения могут быть представлены в форме водных суспензий, микросфер, микрокапсул, магнитных микросфер, масляных растров, масляных суспензий или эмульсий. Альтернативно, активный лекарственный препарат(ы) может быть включен в биологически совместимые носители, липосомы, наночастицы, имплантаты или инфузионные устройства. Материалами для применения при получении микросфер и/или микрокапсул являются, например, биологически разлагаемые/биологически эродируемые полимеры, такие как полигалактин, поли(изобутилцианоакрилат), поли(2-гидроксиэтил-L-глутамин). Биологически совместимые носители, которые могут применяться при составлении парентеральной препаративной формы контролируемого высвобождения, представляют собой углеводороды (например, декстраны), белки (например, альбумин),липопротеины или антитела. Материалы для использования в имплантатах могут быть не биологически разлагаемыми (например, представлять собой полидиметилсилоксан) или биологически разлагаемыми(например, представлять собой поли(капролактон), поли(гликолевую кислоту) или поли(ортоэфиры. Ректальные композиции. Для ректального применения, подходящие лекарственные формы для композиции включают суппозитории (эмульсионного или суспензионного типа) и ректальные желатиновые капсулы (растворы или суспензии). В типичной препаративной форме в виде суппозитория, активный лекарственный препарат(ы) комбинируется с соответствующей фармацевтически приемлемой основой суппозитория, такой как масло какао, эстерифицированные жирные кислоты, глицеринированный желатин и различные растворимые или диспергируемые в воде основы, подобные полиэтиленгликолям. Могут быть включены различные добавки, усилители или поверхностно-активные вещества. Чрескожные и местные композиции. Фармацевтические композиции могут также вводиться местно на кожу для чрескожного всасывания в лекарственных формах или препаративных формах, содержащих обычно нетоксичные фармацевтически приемлемые носители и эксципиенты, включая микросферы и липосомы. Препаративные формы включают кремы, мази, лосьоны, линименты, гели, гидрогели, растворы, суспензии, палочки, спреи, пасты, пластыри и другие виды систем для трансдермальной доставки лекарственных средств. Фармацевтически приемлемые носители или эксципиенты могут включать эмульгирующие агенты, антиоксиданты,забуферивающие агенты, консерванты, увлажнители, усилители проницаемости, хелатообразующие агенты, агенты, образующие гель, мазевые основы, отдушки и средства для защиты кожи. Эмульгирующие агенты могут представлять собой естественно встречающиеся смолы (например,смолу акации или смолу трагаканта). Консерванты, увлажнители, усилители проницаемости могут представлять собой парабены, такие как метил или пропил п-гидроксибензоат, и бензалкония хлорид, глицерин, пропиленгликоль, мочевина и т.д. Описанные выше фармацевтические композиции для местного нанесения на кожу могут также использоваться в связи с местным нанесением на подлежащие лечению части тела. Композиции могут быть приспособлены для непосредственного нанесения или для нанесения посредством специальных устройств для доставки лекарственных препаратов, таких как перевязочные материалы или, альтернативно,пластыри, накладки, губки, полоски или другие формы подходящего гибкого материала. Дозировки и длительность лечения. Следует понимать, что лекарственные препараты комбинации могут вводиться одновременно или в одной и той же, или в другой фармацевтической препаративной форме, или последовательно. Если имеет место последовательное введение, то задержка введения второго (или дополнительного) активного ингредиента не должна быть такой, чтобы был утрачен благоприятный эффект комбинации активных ингредиентов. Минимальным требованием для комбинации в соответствии с настоящим описанием является то, что комбинация должна быть предназначена для комбинированного применения с обеспечением благоприятного эффекта комбинацией активных ингредиентов. Предназначенное применение комбинации может осуществляться материальным обеспечением, положениями, адаптациями и/или другими средствами для содействия применению комбинации в соответствии с изобретением. Хотя активные лекарственные средства по настоящему изобретению могут вводиться дробными дозами, например два или три раза в день, предпочтительна однодневная доза каждого лекарственного препарата в комбинации, причем наиболее предпочтительна однодневная доза всех лекарственных препаратов в одной фармацевтической композиции (стандартной лекарственной форме). Термин "стандартная лекарственная форма" относится к физически дискретным единицам (таким как капсулы, таблетки или заправленные цилиндры шприцев), подходящие в качестве стандартных дозировок для людей, причем каждая единица содержит заданное количество активного материала или материалов, рассчитанное для получения желательного терапевтического эффекта, в сочетании с требуемым фармацевтическим носителем. Введение может осуществляться от одного до нескольких раз в день в течение периода от нескольких дней до нескольких лет, и может даже продолжаться в течение всей жизни пациента. В большинстве случаев будет показано постоянное или, по меньшей мере, периодически повторяющееся длительное введение. Кроме того, на используемую дозировку может воздействовать фармакогеномная информация(влияние генотипа на фармакокинетический, фармакодинамический профиль или профиль эффективности терапевтического средства) о конкретном пациенте. За исключением реагирования на особенно тяжелые случаи AD, при которых могут потребоваться более высокие дозировки, предпочтительная дозировка каждого препарата в комбинации обычно находится в пределах диапазона доз, не превышающих дозы, обычно назначаемые для длительного поддерживающего лечения, или безопасность которых доказана в крупных клинических исследованиях 3 фазы. Наиболее предпочтительная дозировка соответствует количествам от 1 до 10% тех количеств, которые обычно назначаются для длительного поддерживающего лечения. Например: дасатиниб перорально от примерно 1 до 10 мг в день и акампросат перорально от примерно 7 до 70 мг три раза в день,азтреонам перорально от примерно 20 до 1400 мг в день 4 дробными дозами и тиагабин перорально от примерно 0,3 до 3 мг в день,хлорзоксазон перорально от примерно 5 до 50 мг 3 или 4 раза в день и тадалафил перорально от примерно 0,05 до 0,5 мг в день,хлорзоксазон перорально от примерно 5 до 50 мг 3 или 4 раза в день и цилостазол перорально от примерно 1 до 10 мг в день,хлорзоксазон перорально от примерно 5 до 50 мг 3 или 4 раза в день и тербинафин перорально от примерно 2,5 до 25 мг один или два раза в день,хлорзоксазон перорально от примерно 5 до 50 мг 3 или 4 раза в день и дасатиниб перорально от примерно 1 до 10 мг в день,дасатиниб перорально от примерно 1 до 10 мг в день и тербинафин перорально от примерно 2,5 до 25 мг один или два раза в день,цинакальцет перорально от примерно 0,3 до 3 мг в день и акампросат перорально от примерно 7 до 70 мг три раза в день,азтреонам перорально от примерно 20 до 1400 мг в день 4-мя дробными дозами и вигабатрин перорально от примерно 20 до 200 мг один или два раза в день,топирамат перорально от примерно 2 до 60 мг в день и дифиллин перорально от примерно 6 до 60 мг в день двумя или тремя дробными дозами. Следует понимать, что действительно введенное количество лекарственного препарата определяется врачом с учетом релевантных обстоятельств, включая подлежащее лечению состояние или состояния,точную композицию, которую предстоит ввести, возраст, массу тела и реакцию данного пациента, тяжесть симптомов у пациента и выбранный путь введения. Поэтому, указанные выше диапазоны дозировки предназначены для предоставления общего руководства и подтверждения положений настоящего описания, но не предназначены для ограничения объема изобретения. Следующие примеры приведены в целях иллюстрации, а не в качестве ограничения. Примеры 1. Обоснование применения лекарственного препарата с использованием анализов in vitro. Анализы in vitro представляют собой высокоэффективный инструмент для усовершенствования лекарственных средств и их комбинаций, действующих на пути, вовлеченные в патогенез AD. Лекарственные препараты по настоящему изобретению и их комбинации оптимизируются действием на специфические анализы in vitro, адаптированные в соответствии с сетью AD, идентифицированной в настоящем изобретении. В последующем, эти молекулы или их комбинации тестируются на модели AD in vivo. Эти тесты in vitro начинаются с исследования уровня экспрессии гена АРР с последующими анализами нейропротективного потенциала лекарственных препаратов на клетках, подверженных токсическому воздействию белка Abeta. Лекарственные препараты по отдельности тестируются в плане их воздействия на патогенетические пути с последующими анализами их комбинированного действия. На последующей стадии, наиболее эффективные комбинации, действующие на мишени в отдельных путях, объединяются и тестируются в нейропротективных тестах. При AD белок образует агрегаты нерастворимых сложенных -листов фибриллярного белка Abeta(амилоида). Конформационное изменение из растворимых в фибриллярные формы представляется спонтанным явлением, которое увеличивается при более высоких концентрациях Abeta, и поэтому любая продукция больших количеств Abeta, чем нормальное (или продукция более крупных, менее растворимых форм Abeta), будет иметь тенденцию к увеличению образования бляшек. После того как начинается образование бляшки из белка Abeta, другие молекулы могут взаимодействовать с его связанными зонами гибели клеток нейронов. Учитывая это, авторы отдали предпочтение тестированию воздействий лекарственных препаратов на жизнеспособность клеток, подверженных воздействию белка амилоида . Клеточная культура. Первичные кортикальные нейроны крыс культивируют, как описано Singer et al., 1999. Вкратце, самок крыс с беременностью сроком 15 дней умерщвляют смещением шейных позвонков (крысы линииWistar; Janvier), и плоды удаляли из матки. Кору удаляют и помещают в ледяную среду Leibovitz (L 15;Invitrogen), содержащую 1% пенициллина-стрептомицина (PS; Invitrogen) и 1% бычьего сывороточного альбумина (BSA; Sigma). Диссоциацию коры вызывали трипсинизацией в течение 20 мин при 37 С(Trypsin EDTA IX; Invitrogen), разбавленным в PBS (солевом растворе с фосфатным буфером) без кальция и магния. Реакцию останавливают добавлением модифицированной Dulbecco среды Eagle (DMEM;Invitrogen), содержащей ДНКазу I степени II (0,1 мг/мл; Roche Diagnostic) и 10% фетальной ягнячьей сыворотки (FCS; Invitrogen). Затем клетки механически диссоциируют, трижды пропуская через пипетку объемом 10 мл, затем клетки центрифугируют при 180g в течение 10 мин при 10 С. Супернатант удаляют и клетки осадка после центрифугирования ресуспендируют в определенной культуральной среде,состоящей из Neurobasal (Invitrogen) с добавлением В 27 (2%; Invitrogen), L-глутамина (0,2 мМ;Invitrogen), 1% PS (фосфатно-солевого) раствора и 10 нг/мл полученного из мозга нейротрофического фактора (BDNF, Pan Biotech). Жизнеспособные клетки подсчитывают в цитометре Neubauer с использованием теста на исключение трипанового синего. Клетки высевают при плотности 30000 клеток/лунку в 96-луночные планшеты (лунки предварительно покрываются поли-L-лизином (10 мкг/мл; Sigma и культивируют при 37 С в увлажненной атмосфере воздуха (95%)/СО 2 (5%). Чрез 6 дней культивирования, клетки инкубируют с лекарственными препаратами (5 концентраций). Через 1 ч проводят интоксикацию клеток 20 мкМ бета-амилоида (25-35; Sigma) в определенной среде без BDNF, но вместе с лекарственными препаратами. Интоксикацию кортикальных нейронов проводят в течение 2 дней. BDNF (10 нг/мл) используют в качестве положительного (нейропротективного) контроля. Выполняют две независимые культуры при каждых условиях, по 6 лунок на условие. Количественное определение длины нейритов. Клетки фиксируют холодным раствором этанола (95%) и уксусной кислоты (5%) в течение 10 мин. После пермеабилизации 0,1% сапонина клетки блокируют в течение 2 ч PBS, содержащим 10% козью сыворотку. Затем клетки инкубируют с моноклональным антителом, направленным против микротрубочки, связанной с белком 2 (МАР-2; Sigma). Это антитело специфически выявляет клеточные тела и нейриты. Используемое вторичное антитело представляет собой козий анти-мышиный IgG Alexa Fluor 488 (молекулярный зонд). Ядра нейронов выявляют флюоресцентным красителем (раствором Hoechst,SIGMA). Делают 20 фотографий каждой лунки с использованием анализатора In Cell AnalyzerTM 1000(GE Healthcare) при увеличении 2 Ох. Все изображения получают в одинаковых условиях. Количественное определение длины нейритов с использованием программного обеспечения Developer (GEHealthcare). Результаты. Результаты, представленные на фиг. 1, получены по двум независимым культурам, 6 лунок на условие. Все величины выражены в виде средней величиныстандартная ошибка средней. Анализ с использованием двухстороннего критерия Стьюдента выполняют на необработанных данных. Результаты выражены в процентах длины нейритов, по сравнению с контролем (носителем). Лекарственные препараты инкубировали с первичными кортикальными нейронами за 1 ч до интоксикации 20 мкМ Abeta25-35, которая продолжается 2 дня (40). Через два дня после этой инкубации количественно определяли длину сети нейритов, отражающую рост аксонов клеток. Авторы наблюдали, что 3 лекарственных препарата отчетливо оказывают нейропротективный эффект против данной интоксикации Abeta25-35 (фиг. 1 и 2). Тесты in vivo. Соединения и их комбинации, проявляющие активность в тестах in vitro, тестировали на модели invivo болезни Альцгеймера. Избыточная экспрессия трансгенов связанного с болезнью Альцгеймера мутантного предшественника белка бета амилоида человека (АРР) была наиболее надежным средством содействия отложению Abeta в мозгах трансгенных мышей, которые служили в качестве модели болезни Альцгеймера в многочисленных исследованиях. По мере старения у этих мышей с мутантным АРР развивается выраженная амилоидная патология и другие признаки, подобные AD, включая сниженную плотность синапсов, реактивный глиоз и некоторые когнитивные дефициты. Многие мышиные модели с мутантным АРР проявляют немного доказательств выраженной потери нейронов и патологии в виде нейроволоконных сплетений (NFT). Мыши, гемизиготные в отношении этого трансгена BRI-Abeta42,жизнеспособны и фертильны при нормальной продолжительности жизни. мРНК трансгенного BRIAbeta42 экспрессирована по типу, характерному для промотера прионного белка мыши; самые высокие уровни экспрессии трансгена выявлены в гранулярных клетках мозжечка и гиппокампе с последующим выявлением в коре, мосту, таламусе и среднем мозге. В трансгенном слитом белке, Abeta1-42 слит с С концом белка BRI в подобном сайту расщепления фурина, так что расщепление приводит к эффективной секреции Abeta1-42 в просвет или внеклеточное пространство. Поэтому, эти мыши специфически экспрессируют изоформу Abeta1-42. У гемизиготных мышей BRI-Abeta42 с возрастом накапливается нерастворимый в детергенте амилоид-бета, и уже в возрасте 3 месяцев в мозжечке развиваются имеющие ядра бляшки. Развитие патологии переднего мозга происходит позднее, внеклеточные бляшки Abeta постоянно не присутствуют в гиппокампе и энторинальной/грушевидной коре до возраста 12 месяцев. Отложения бета-амилоида (имеющих ядро бляшек) может наблюдаться уже в возрасте 3 месяцев в молекулярном слое мозжечков трансгенных мышей, и с возрастом становиться более выраженным; единичные внеклеточные бляшки видны в энторинальной/грушевидной коре и гиппокампе в возрасте 6 месяцев, но они не постоянно обнаруживаются до возраста 12 месяцев. У самых старых мышей обнаруживается широко распространенная патология с имеющими ядро и диффузными бляшками в мозжечке, коре, гиппокампе и обонятельной луковице. Во внеклеточных амилоидных бляшках выявляются плотные амилоидные ядра с радиально отходящими волокнами; множество пучков дистрофических нейритов наблюдаются на периферии этих бляшек. Реактивный глиоз связан с бляшками. Медикаментозное лечение. Трансгенных мышей Tg (Prnp-ITM2B/APP69542) A12E (31) получали из лаборатории Jackson Laboratory (http://jaxmice.jax.org/strain/007002.html). Мышей с самыми высокими уровнями Abeta42 в плазме, линию BRI-Abeta42A (12e), поддерживали на смешанном фоне В 6 С 3. Взрослые самцы трансгенных мышей имели свободный доступ к корму и воде. В соответствии с утвержденным протоколом Institutional Animal Care and Use Committee (Учрежденческого Комитета по уходу за животными и их использованию), мышей взвешивали, и им внутрибрюшинно вводили или насильно скармливали один раз в день в течение 10-20 последовательных недель или контрольный раствор (плацебо), или лекарственные препараты РХТ, полученные в различных дозах. Анализ выживания. Показатели выживаемости анализировали, используя способ Каплана-Майера. Способы ХолмаСидака (ретроспективной оценки) использовали для всех парных тестов множественного сравнения. Проводили отсев случаев смерти от иных причин. Все сравнения проводили между особями одного помета для ограничения любых возможных дезориентирующих воздействий в результате фоновых различий между штаммами. Поведенческие тесты. Поведенческие тесты структурировали и проводили в соответствии со способами, опубликованными несколькими авторами (32-35). Пространственное обучение и память в водном лабиринте Морриса (Morris Water Maze (MWM. Этот эксперимент выполняли в круглом бассейне диаметром 90 см, изготовленном из белого пластика, и заполняли водой, окрашенной в молочный цвет. Платформу для спасения диаметром 8 см, изготовленную из прозрачного пластика, погружали на 0,5 см ниже уровня воды. Визуальные указатели предоставляли в виде различных геометрических форм, напечатанных буквами размером печатного листа А 4, и помещали на четырех окружающих стенках (расстояние от бассейна составляло от 50 до 70 см). Каждой мыши ежедневно предоставляли возможность пройти четыре испытания (от 5- до 7-минутного интервала между испытаниями, всего 16 испытаний) в течение 4 дней. Каждое испытание выполняли от одной из четырех исходных точек. Движение мышей контролировали с использованием программного обеспечения Videotrack Software (ViewPoint). Определяли время, затраченное на поиск спасительной платформы (латентность спасения; до 60 с). После определения положения платформы,- 19024147 мыши давали возможность сидеть на ней в течение 15 с. Мышей, которым не удавалось найти платформу в пределах 60 с, направляли на нее и давали возможность оставаться на ней в течение 15 с. В таком случае в протокол вносили латентность 60 с. Результаты всех четырех испытаний в день усредняли для статистического анализа, за исключением первого испытания в 1 день. На 9 день (через 5 дней после последней тренировки) мышей подвергали 6-секундному пробному испытанию, при котором платформу удаляли и мышам давали возможность искать ее. Регистрировали время, которое каждое животное проводило в каждом квадранте (время поиска в квадранте). Несколько групп самцов мышей использовали через 3, 7, 10 и 12 месяцев. Несколько мышей проявляли поведение в виде замирания (т.е. лежали неподвижно в воде и отказывались плавать), что в значительной степени мешало проведению теста, и этих животных исключали из анализа данных. Все поведенческие тесты проводили в спокойной обстановке при пониженной освещенности. Тест рабочей памяти в водном лабиринте с радиальным ответвлением. Этот основанный на когнитивной функции показатель рабочей памяти был получен с помощью устройства, состоящего из имеющего диаметр 100 см заполненного водой бассейна (также используемого для задач плавания в водном лабиринте Морриса и распознавания платформы), снабженного алюминиевым вкладышем для создания шести радиально распределенных плеч для плавания. Тестирование состояло из пяти 1-минутных испытаний на ежедневный сеанс в течение 9-12 последовательных дней. В начале каждого сеанса, прозрачную погруженную платформу располагали в конце одного из шести плеч для плавания (выбранных методом случайной выборки, ежедневно меняемых). Для каждого из первых четырех испытаний приобретения навыков, животное помещали в одно из не содержащих платформу плеч (в последовательности, определяемой методом случайной выборки) и давали возможность искать плечо. В течение 60-секундного испытания, каждый раз, когда животное направлялось в другое не содержащее платформу плечо, его осторожно возвращали в его исходное положение и регистрировали ошибку. После четвертого испытания, животному давали возможность отдохнуть в течение 30 мин, после чего следовало пятое (удерживающее) испытание, которое начиналось в последнем, не содержащем платформу плече для плавания. Для каждого испытания регистрировали число ошибок (неправильных выборов плеч) и латентность спасения (время, затраченное на достижение платформы, максимум 60 с). Обучение и память пространственных реперов в тесте круглой платформы. Этот основанный на когнитивной функции тест выполняется с помощью устройства, которое состоит из круглой платформы диаметром 69 см, имеющей 16 "спасательных" отверстий, расположенных через одинаковые промежутки по окружности. Спасательное убежище установлено под одним из отверстий, и черная занавеска, на которой помещены различные визуальные указатели, окружает платформу. Животное помещали в центр платформы в начале одного 5-минутного испытания и подавали раздражающие стимулы (яркий свет, поток воздуха от вентилятора). Регистрировали общее число ошибок(толчков головы в не спасательные отверстия) и латентность спасения (время, затраченное на достижение спасательного отверстия). Способность распознавания в тесте распознавания на платформе. Эта основанная на когнитивной функции задача оценивает идентификацию объекта и способность распознавания. Объект-мишень состоит из круглой платформы диаметром 9 см, снабженной черным значком размером 1040 см, который расположен на 0,8 см над поверхностью воды в круглом бассейне диаметром 100 см. Тестирование состоит из четырех 60-секундных испытаний в день в каждый из четырех последовательных дней. В каждый день объект-мишень помещается в другой квадрант бассейна для каждого испытания, и животное высвобождается в одном и том же участке вдоль окружности бассейна для всех четырех испытаний. Для каждого испытания регистрируется общая латентность (максимум 60 с). Модифицированное исследование Irwin. Всесторонний скрининг, модифицированный вариант метода по Irwin, используется для определения того, проявляла ли какая-либо из мышей физиологические, поведенческие или сенсорно-моторные нарушения, связанные с их генотипом. Для исследования двигательных навыков, координации и мышечной силы, мышей помещали на проволоку, которая была натянута между двумя столбиками высотой 30 см, и оценивали их способность балансировать на проволоке. Кроме того, определяли их способность схватывать проволоку всеми четырьмя лапами и висеть на ней в течение по меньшей мере 5 с и вскарабкиваться назад на проволоку. Количественное определение отложения амилоида в сосудах. Для количественного определения церебральной амилоидной ангиопатии (САА), залитые в парафин срезы толщиной 5 мкм через интервалы 30 мкм, произведенные через мягкую и паутинную оболочки париетальной или мозжечковой коры подвергали иммунному окрашиванию биотинилированным Ab9 антителом (анти-А 31-16, 1:500) в течение ночи при 4 С (n=5-7 мышей на генотип в каждой возрастной группе, n=6 срезов на мышь). Положительно окрашенные кровеносные сосуды визуально оценивали с использованием модифицированной системы балльной оценки Vonsattel (36). Балльную оценку тяжести САА рассчитывали умножением числа сосудов с САА на степень тяжести САА. Гистология: иммуногистохимия и иммунофлюоресценция. Мышей Tg и WT в возрасте от 3 до 12 месяцев наркотизировали и проводили транскардиальную перфузию последовательно 0,9% NaCl и 4% параформальдегиом в 0,1 моль/л солевом растворе с фосфатным буфером (PBS) (рН 7,4) или 10% формалином и 4% параформальдегидом в 0,1 моль/л PBS (рН 7,4). Мозг и спинной мозг животных удаляли и хранили в 4% параформальдегиде. Некоторые образцы заливали в парафин и разрезали на скользящем микротоме при толщине 10 мкм. Криосрезы (14 мкм) делали на криостате и устанавливали на покрытые хромовыми квасцами предметные стекла. Эндогенную пероксидазу гасили обработкой среза метанолом, содержащим 0,3% Н 2 О 2, в течение 30 мин. Срезы блокировали в 10% лошадиной сыворотке. Использовали первичные антитела и инкубировали в течение ночи при 4 С в присутствии 1% лошадиной сыворотки. Все вторичные биотинилированные или соединенные с флюоресцеином, техасским красным и АМСА антитела, фторохромы, ABC-набор и 3,3'диаминобензидин в качестве хромогена для определения активности пероксидазы были получены изVector Laboratories. Инкубацию со вторичным антителом проводили при комнатной температуре в течение 1 часа. Все стадии промывания (3-10 мин), и разведение антител выполняли с использованием солевого раствора с фосфатным буфером (0,1 моль/л PBS, рН 7,4) или солевого раствора, забуференного Tris(0,01 моль/л Tris, 0,15 моль/л NaCl, рН 7,4). Инкубацию с комплексом ABC и выявление 3,3'диаминобензидином проводили в соответствии с руководством изготовителя. Противоокрашивание гематоксилином выполняли в соответствии со стандартными процедурами. Минимум три мыши на генотип, возраст и пол использовали для каждого определения (37). Получение экстрактов мозга. Мозг животных быстро забирали на лед через 90-120 мин после последней инъекции и замораживали до -80 С. Правое полушарие мозга от каждой мыши взвешивали после замораживания. Анализ массы полушария по абсолютному отклонению медианы позволил авторам исключить образцы, которые находятся за пределами 4 абсолютных отклонения медианы от остальных величин набора. Полушария мозга гомогенизировали, и клеточные лизаты, содержащие цельный белок, получали в соответствии с инструкциями изготовителя, для наборов ферментного анализа (RD Systems, Inc.). Вкратце, кору мозга гомогенизировали в 800 мкл раствора с низким уровнем соли, содержащем 1 экстракционного буфера (наборRD) и инкубировали на льду в течение 10 мин. Затем гомогенаты центрифугировали при 13000 g в течение 15 мин при 4 С. Концентрацию белка в каждом образце оценивали в соответствии с анализом на основе реакции биурета (Pierce). Уровни АРР, А 40 и А 42 измеряли соответственно методиками Вестерн иммуноблоттинга и сэндвич твердофазного иммуноферментного анализа (ELISA), как описано в публикации (28). Кроме того, могла измеряться активность -, - и -секретаз из тех же экстрактов. Анализ уровней общего АРР в экстрактах коры головного мозга мышей. Равное количество экстрактов головного мозга загружали в каждый гель, 30 мкг на полосу на образец. Каждый гель содержал 8 видов обработки: контроль; доза 1 7,5 мг/кг; и препарат 2 в нескольких дозах. Для минимизации изменений внутри геля, каждый гель содержал три набора всех групп обработки. Каждый блот зондировали антителом 22 С 11. Каждый блот также зондировали антителом против актина для нормализации к эффективности переноса. Интенсивность полосы сигнала АРР нормализовали к таковой -актина. Два образца "контролей" загружали в каждый гель/блот для тестирования изменения от блота к блоту. Анализ блотов выполняли двумя путями: отдельных блотов (n=3), для тестирования изменения от геля к гелю; и анализ объединенных блотов (n=9 или 10), как описано в публикации(38-39). Анализ отдельных блотов при n=3 показал такую же тенденцию как конечный анализ с n=9 или 10 блотов. Представлены результаты комбинированного анализа. Сэндвич ELISA A. Для анализов ELISA A уровни A в переднем мозге и заднем мозге определяются независимо, и обонятельная луковица исключается из анализа. Для анализа A в плазме кровь собрали в покрытыеEDTA пробирки после сердечной пункции. Образцы крови центрифугировали при 3000 об/мин в течение 10 мин при 4 С и плазму делили на аликвотные количества и хранили при -80 С до использования. Уровни A определяли конечно-специфическими анализами сэндвич ELISA с использованием Ab9 (анти-А 1-16 Ab) в качестве захватывающего Ab для A40, 13.1.1-HRP (анти-А 35-40 Ab) в качестве Ab выявления для A40, 2.1.3 (анти-А 35-42 Ab) в качестве захватывающего Ab для A42, и Ab9-HRP в качестве Ab выявления для А 42 (n=5-7 мышей на генотип в каждой возрастной группе). Уровни A нормализовали к предыдущим результатам с использованием тех же групп мышей в качестве внутренних контролей для минимизации потенциальной вариабельности ELISA, как описано в публикации (28). Вестерн-блоттинг. Быстро замороженные образцы переднего мозга гомогенизировали в буфере для анализа радиоиммунопреципитации (RIPA) (Boston BioProducts, Worcester, MA) 1% смесью ингибитора протеазы (Roche). Гомогенат центрифугировали при 100000g в течение 1 ч при 4 С. Концентрацию белка в супернатантах определяли с использованием анализа белка ВСА (Pierce). Образцы белка (20 мкг) пропускали через гелиBis-Tris 12% XT или гели Bis-Tris 4-12% XT (Bio-Rad, Hercules, CA) и переносили на мембраны нитро- 21024147 целлюлозы толщиной 0,2 мкм. Блоты дважды обрабатывали в микроволной печи в течение 2 мин в 0,1 МPBS и зондировали Ab 82E1 (анти-А 1-16, 1:1000; IBL, Gunma, Japan) и антителами против 20 Сконцевых аминокислот АРР (1:1000), как описано в публикации (28). Блоты десорбировали и повторно зондировали анти -актином (1:1000; Sigma) в качестве контроля загрузки. Интенсивность реакционной полосы измеряли с использованием программного обеспечения ImageJ. Количественное определение паренхимного отложения амилоида. Полушария фиксировали погружением в 10% формалин и обрабатывали для заливки в парафин. Проводили иммуноокрашивание срезов ткани мозга (5 мкм) антителом против всего А (Ab). Противоокрашивание срезов проводили гематоксилином. Шесть срезов на мозг через гиппокамп, грушевидную кору (брегма -1,70 до -2,80 мм), или мозжечок (paraflocculus, crus ansiform, и простые доли; брегму, -5,40 до -6,36 мм) использовали для количественного определения (n=5-7 мышей на генотип в каждой возрастной группе). Нагрузку бляшками A определяли с использованием программного обеспечения MetaMorph (Molecular Devices, Palo Alto, CA). Для количественного определения бляшек, имеющих ядро, серийные срезы бляшек, анализировавшихся на нагрузку А, окрашивали тиофлавином S (ThioS) и подсчитывали число положительных по ThioS бляшек в гиппокампе, энторинальной/грушевидной коре или мозжечке. Все указанные выше анализы выполняли слепым методом. Статистический анализ данных in vivo. Результаты всех экспериментов анализировали с использованием программного обеспечения STATISTICA 8.0 (Statsoft). Уровни А, нагрузка амилоидными бляшками и тяжесть САА анализировали использованием дисперсионного анализа ANOVA ретроградным критерием множественного сравнения Холма-Сидака(Holm-Sidak) или двухстороннего критерия t Стьюдента (Student). Если набор данных не соответствовал допущениям параметрического критерия, выполняли или тест Крускала-Уоллиса (Kruskal-Wallis) с последующим ретроспективным множественным сравнением Данна (Dunn), или ранговый суммарный тест Манна-Уитни (Mann-Whitney). Для тестирования того, согласовывались ли уровни А у битрансгенных мышей с аддитивной суммой уровней A у трансгенных особей одного помета, использовали множественную линейную регрессию без критерия перехвата. Все сравнения проводили между особями одного помета. Моделирование реакции на лекарственные препараты проводили, исключая контрольные образцы(0 мг/кг). ED50 соответствует дозе (мг/кг), требуемой для вызова 50% максимальной реакции, вызванной лекарственным препаратом в экспериментах. Она рассчитывается с использованием модели уравнения Хилла (Hill) для логарифма ED50. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Применение комбинации, содержащей зонизамид и по меньшей мере одно соединение, выбранное из группы дифиллина, тадалафила, аргатробана, акампросата, цинакальцета, тербинафина, цилостазола, баклофена, фенформина, амлодипина и сульфисоксазола или их солей, для изготовления лекарственного средства для лечения болезни Альцгеймера. 2. Применение по п.1, где соединения или их соли предназначены для комбинированного, отдельного или последовательного введения с зонизамидом. 3. Применение по п.1 или 2, где указанная комбинация содержит, по меньшей мере, следующие соединения: зонизамид и фенформин,зонизамид и сульфисоксазол,зонизамид и акампросат,зонизамид и дифиллин,зонизамид и баклофен,зонизамид и тадалафил,зонизамид и аргатробан или зонизамид и цилостазол. 4. Применение по любому из предшествующих пунктов, где указанная комбинация содержит фармацевтически приемлемый носитель или эксципиент. 5. Применение по любому из предшествующих пунктов, где указанная комбинация вводится субъекту от одного до нескольких раз в день в течение от нескольких дней до нескольких лет. 6. Применение комбинации, содержащей зонизамид и по меньшей мере одно соединение, выбранное из группы дифиллина, тадалафила, аргатробана, акампросата, цинакальцета, тербинафина, цилоста- 26024147 зола, баклофена, фенформина, амлодипина и сульфисоксазола или их солей, для изготовления лекарственного средства для защиты нейронов от токсичности пептида Abeta у субъекта, страдающего болезнью Альцгеймера.
МПК / Метки
МПК: A61P 25/16, A61P 25/28, A61P 25/00, A61K 31/255, A61K 31/42
Метки: болезни, заболеваний, акампросатом, альцгеймера, лечения, композиции, зонизамидом, комбинированные, родственных
Код ссылки
<a href="https://eas.patents.su/28-24147-kombinirovannye-kompozicii-dlya-lecheniya-bolezni-alcgejjmera-i-rodstvennyh-zabolevanijj-zonizamidom-i-akamprosatom.html" rel="bookmark" title="База патентов Евразийского Союза">Комбинированные композиции для лечения болезни альцгеймера и родственных заболеваний зонизамидом и акампросатом</a>