Гетероарильные соединения в качестве бетамиметиков для лечения заболеваний дыхательных путей
Номер патента: 12727
Опубликовано: 30.12.2009
Авторы: Череда Энцо, Шнапп Андреас, Хёнке Кристоф, Буйсу Тьерри, Конетцки Инго, Лустенбергер Филипп
Формула / Реферат
1. Соединения формулы 1
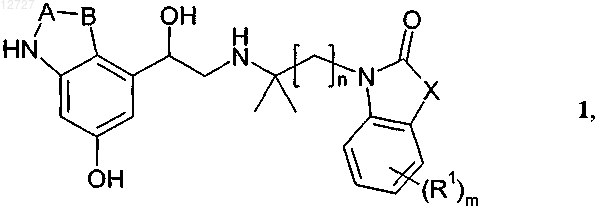
в которой n обозначает 2, 3,
m обозначает 1, 2 или 3,
X обозначает NR2 или О,
А обозначает СО,
В обозначает группу с двумя связями, выбранную из О, CR3R4-О, NR5, CR3R4-NR5, CH=CH или СН2-СН2,
R1 обозначает Н, C1-С6алкил, C1-С6галоалкил, С3-С6циклоалкил, галоген, ОН, CN, NO2, О-С1-С6алкил, СООН или СОО-С1-С4алкил,
R2 обозначает Н, С1-С4алкил, С1-2алкилен-С3-С6-циклоалкил, фенилэтил или бензил,
R3 обозначает Н или C1-С6алкил,
R4 обозначает Н или C1-С6алкил и
R5 обозначает Н или C1-С6алкил,
необязательно в виде отдельных энантиомеров, смесей отдельных энантиомеров или рацематов, необязательно в виде их кислотно-аддитивных солей с фармакологически безвредными кислотами, а также необязательно в виде сольватов и/или гидратов.
2. Соединения формулы 1 по п.1, в которой n обозначает 2 или 3, m обозначает 1, 2 или 3, X обозначает NR2 или О, А обозначает СО, В обозначает группу с двумя связями, выбранную из О, CR3R4-О, NR5, CR3R4-NR5, CH=CH или СН2-СН2, R1 обозначает Н, метил, этил, пропил, CF3, CH2F, CH2CF3, фтор, хлор, бром, ОН, метоксигруппу, этоксигруппу, СООН или СООМе, R2 обозначает Н, метил, этил или пропил, R3 обозначает Н, метил, этил или пропил, R4 обозначает Н, метил, этил или пропил и R5 обозначает Н, метил, этил или пропил, необязательно в виде отдельных энантиомеров, смесей отдельных энантиомеров или рацематов, необязательно в виде их кислотно-аддитивных солей с фармакологически безвредными кислотами, а также необязательно в виде сольватов и/или гидратов.
3. Соединения формулы 1 по любому из пп.1-2, в которой n обозначает 2 или 3, m обозначает 1, 2 или 3, X обозначает NR2 или О, А обозначает СО, В обозначает группу с двумя связями, выбранную из СН2-О, СН=СН или СН2-СН2, R1 обозначает Н, метил, этил, пропил, CF3, CH2F, CH2CF3, фтор, хлор, бром, ОН, метоксигруппу, этоксигруппу, СООН или СООМе и R2 обозначает Н, метил, этил или пропил, необязательно в виде отдельных энантиомеров, смесей отдельных энантиомеров или рацематов, необязательно в виде их кислотно-аддитивных солей с фармакологически безвредными кислотами, а также необязательно в виде сольватов и/или гидратов.
4. Соединения формулы 1 по любому из пп.1-3, в которой n обозначает 2 или 3, m обозначает 1 или 2, X обозначает NR2 или О, А обозначает СО, В обозначает группу с двумя связями, выбранную из СН2-О, СН=СН или СН2-СН2, R1 обозначает Н, метил, этил, пропил, CF3, CH2F или CH2CF3 и R2 обозначает Н, метил, этил или пропил, необязательно в виде отдельных энантиомеров, смесей отдельных энантиомеров или рацематов, необязательно в виде их кислотно-аддитивных солей с фармакологически безвредными кислотами, а также необязательно в виде сольватов и/или гидратов.
5. Соединения формулы 1 по одному из пп.1-4, в которой n обозначает 2 или 3, m обозначает 1, X обозначает NR2 или О, А обозначает СО, В обозначает группу с двумя связями, выбранную из СН2-О, СН=СН или СН2-СН2, R1 обозначает Н, метил или CF3 и R2 обозначает Н или метил, необязательно в виде отдельных энантиомеров, смесей отдельных энантиомеров или рацематов, необязательно в виде их кислотно-аддитивных солей с фармакологически безвредными кислотами, а также необязательно в виде сольватов и/или гидратов.
6. Соединения формулы 1 по любому из пп.1-5, в которой n обозначает 2 или 3, m обозначает 1, X обозначает NR2, О, А обозначает СО, В обозначает группу с двумя связями, выбранную из СН2-O или СН=СН, R1 обозначает Н, метил или CF3 и R2 обозначает Н или метил, необязательно в виде отдельных энантиомеров, смесей отдельных энантиомеров или рацематов, необязательно в виде их кислотно-аддитивных солей с фармакологически безвредными кислотами, а также необязательно в виде сольватов и/или гидратов.
7. Соединения формулы 1 по любому из пп.1-6, в которой n обозначает 2, m обозначает 1, X обозначает NH, А обозначает СО, В обозначает группу с двумя связями СН2-О, R1 обозначает Н, метил или CF3, необязательно в виде отдельных энантиомеров, смесей отдельных энантиомеров или рацематов, необязательно в виде их кислотно-аддитивных солей с фармакологически безвредными кислотами, а также необязательно в виде сольватов и/или гидратов.
8. Соединения формулы 1 по любому из пп.1-7, отличающиеся тем, что они представлены в виде одной из их кислотно-аддитивных солей с фармакологически безвредными кислотами, выбранной из группы, включающей гидрохлорид, гидробромид, гидроиодид, гидросульфат, гидрофосфат, гидрометансульфонат, гидронитрат, гидромалеат, гидроацетат, гидробензоат, гидроцитрат, гидрофумарат, гидротартрат, гидрооксалат, гидросукцинат, гидробензоат и гидро-n-толуолсульфонат.
9. Соединения формулы 1 по любому из пп.1-8, отличающиеся тем, что они представлены в виде R-энантиомеров формулы R-1
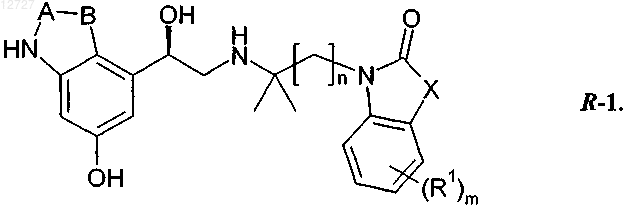
10. Применение соединения формулы 1 по любому из пп.1-9 в качестве лекарственных средств.
11. Применение соединений формулы 1 по любому из пп.1-9 для приготовления лекарственного средства, предназначенного для лечения заболеваний дыхательных путей.
12. Фармацевтическая композиция, отличающаяся тем, что она содержит соединение формулы 1 по любому из пп.1-9.
Текст
012727 Бетамиметики (-адренергические вещества) известны из уровня техники. В этом отношении можно сослаться, например, на патенты US 4460581 и 4154829, в которых предложены бетамиметики и их применение для терапии различных заболеваний. Для медикаментозной терапии различных заболеваний часто желательно располагать лекарственными средствами, обладающими продолжительным действием. За счет этого, как правило, удается обеспечить в течение длительного периода времени поддержание в организме необходимой для достижения терапевтического эффекта концентрации действующего вещества без необходимости излишне частого повторного введения лекарственного средства в организм. В остальном же введение действующего вещества в организм с меньшей периодичностью в значительной степени способствует хорошему самочувствию пациента. Наиболее желательно при этом располагать лекарственным средством, которое позволяло бы достигать требуемого терапевтического эффекта при его однократном введении в организм в день (т.е. лекарственным средством, рассчитанным на однократный прием в сутки). Преимущество, связанное с применением лекарственного средства только один раз в сутки, состоит в удобстве подобной схемы лечения для пациента благодаря сравнительно быстрому его привыканию к регулярному приему медикамента в определенное время суток. Исходя из вышеизложенного, в основу настоящего изобретения была положена задача предложить бетамиметики, которые, с одной стороны, проявляли бы терапевтический эффект при лечении заболеваний дыхательных путей, а с другой стороны, обладали бы более продолжительным действием и тем самым могли бы использоваться для приготовления лекарственных средств с более длительным действием. Задача настоящего изобретения состояла, прежде всего, в том, чтобы предложить бетамиметики, которые благодаря их длительному действию можно было бы использовать для приготовления лекарственного средства, которое для терапии заболеваний дыхательных путей требовалось бы вводить в организм один раз в сутки. Наряду с указанными выше задачами еще одна задача настоящего изобретения состояла в том, чтобы предложить бетамиметики, которые обладали бы не только особо высокой эффективностью(сильным действием), но и высокой степенью избирательности по отношению к 2-адренорецепторам. Описание изобретения При создании изобретения неожиданно было установлено, что указанные выше задачи позволяют решить соединения формулы 1. В соответствии с этим в настоящем изобретении предлагаются соединения формулы 1R5 обозначает Н или C1-С 6 алкил,необязательно в виде отдельных энантиомеров, смесей отдельных энантиомеров или рацематов, необязательно в виде их кислотно-аддитивных солей с фармакологически безвредными кислотами, а также необязательно в виде сольватов и/или гидратов. При наличии нескольких остатков R1 (т.е. когда m1) они могут иметь идентичные или различные указанные для R1 значения. Предпочтительны указанные выше соединения формулы 1, в которой А обозначает СО, необязательно в виде отдельных энантиомеров, смесей отдельных энантиомеров или рацематов, необязательно в виде их кислотно-аддитивных солей с фармакологически безвредными кислотами, а также необязательно в виде сольватов и/или гидратов. Предпочтительны далее указанные выше соединения формулы 1, в которойCR R -S, NR5, CR3R4-NR5, CH=CH и СН 2-СН 2,R1 обозначает Н, C1-С 6 алкил, С 2-С 6 алкенил, С 2-С 6 алкинил, С 3-С 6 циклоалкил, C1-С 6 галоалкил,О-С 1-С 6 галоалкил, галоген, ОН, CN, NO2, О-С 1-С 6 алкил, СООН или СОО-С 1-С 4 алкил, предпочтительно Н, C1-С 6 алкил, C1-С 6 галоалкил, С 3-С 6 циклоалкил, галоген, ОН, CN, NO2, O-C1-С 6 алкил, СООН или СООС 1-С 4 алкил,R2 обозначает Н, С 1-С 4 алкил, С 1-С 2 алкилен-С 3-С 6 циклоалкил, фенилэтил или бензил, предпочтительно Н, С 1-С 4 алкил или С 3-С 6 циклоалкилметил, наиболее предпочтительно Н, метил или циклопропилметил, R3 обозначает Н или С 1-С 4 алкил, предпочтительно Н или метил, R4 обозначает Н или С 1 С 4 алкил, предпочтительно Н или метил, иR5 обозначает Н или С 1-С 4 алкил, предпочтительно Н или метил, необязательно в виде отдельных энантиомеров, смесей отдельных энантиомеров или рацематов, необязательно в виде их кислотноаддитивных солей с фармакологически безвредными кислотами, а также необязательно в виде сольватов и/или гидратов. Предпочтительны также указанные выше соединения формулы 1, в которойR5 обозначает Н или С 1-С 4 алкил, предпочтительно Н или метил,необязательно в виде отдельных энантиомеров, смесей отдельных энантиомеров или рацематов, необязательно в виде их кислотно-аддитивных солей с фармакологически безвредными кислотами, а также необязательно в виде сольватов и/или гидратов. Предпочтительны, кроме того, указанные выше соединения формулы 1, в которойR5 обозначает Н, метил, этил или пропил, предпочтительно Н,необязательно в виде отдельных энантиомеров, смесей отдельных энантиомеров или рацематов, необязательно в виде их кислотно-аддитивных солей с фармакологически безвредными кислотами, а также необязательно в виде сольватов и/или гидратов. Предпочтительны, кроме того, указанные выше соединения формулы 1, в которойR5 обозначает Н или метил, предпочтительно Н,необязательно в виде отдельных энантиомеров, смесей отдельных энантиомеров или рацематов, не-2 012727 обязательно в виде их кислотно-аддитивных солей с фармакологически безвредными кислотами, а также необязательно в виде сольватов и/или гидратов. Предпочтительны далее указанные выше соединения формулы 1, в которойn обозначает 2 или 3,m обозначает 1, 2 или 3,X обозначает СН 2, СО, NR2, S или О,А обозначает СО,В обозначает группу с двумя связями, выбранную из группы, включающей СН 2-О, СН=СН и СН 2-СН 2,R1 обозначает Н, метил, этил, пропил, CF3, CH2F, CH2CF3, фтор, хлор, бром, ОН, метоксигруппу,этоксигруппу, СООН или СООМе иR2 обозначает Н, метил, этил или пропил,необязательно в виде отдельных энантиомеров, смесей отдельных энантиомеров или рацематов, необязательно в виде их кислотно-аддитивных солей с фармакологически безвредными кислотами, а также необязательно в виде сольватов и/или гидратов. Предпочтительны также указанные выше соединения формулы 1, в которойR2 обозначает H, метил, этил или пропил,необязательно в виде отдельных энантиомеров, смесей отдельных энантиомеров или рацематов, необязательно в виде их кислотно-аддитивных солей с фармакологически безвредными кислотами, а также необязательно в виде сольватов и/или гидратов. Предпочтительны, кроме того, указанные выше соединения формулы 1, в которойR2 обозначает Н или метил,необязательно в виде отдельных энантиомеров, смесей отдельных энантиомеров или рацематов, необязательно в виде их кислотно-аддитивных солей с фармакологически безвредными кислотами, а также необязательно в виде сольватов и/или гидратов. Предпочтительны также указанные выше соединения формулы 1, в которой X обозначает NR2 или О, где R2 имеет указанные выше значения, предпочтительно Н или С 1-С 4 алкил, более предпочтительно Н, метил, этил или пропил, наиболее предпочтительно Н или метил, необязательно в виде отдельных энантиомеров, смесей отдельных энантиомеров или рацематов, необязательно в виде их кислотноаддитивных солей с фармакологически безвредными кислотами, а также необязательно в виде сольватов и/или гидратов. Предпочтительны далее указанные выше соединения формулы 1, в которойR2 обозначает Н или метил,необязательно в виде отдельных энантиомеров, смесей отдельных энантиомеров или рацематов, необязательно в виде их кислотно-аддитивных солей с фармакологически безвредными кислотами, а также необязательно в виде сольватов и/или гидратов. Особенно предпочтительны указанные выше соединения формулы 1, в которойn обозначает 2,m обозначает 1,X обозначает NH,А обозначает СО,В обозначает группу с двумя связями СН 2-O иR1 обозначает Н, метил или CF3,необязательно в виде отдельных энантиомеров, смесей отдельных энантиомеров или рацематов, необязательно в виде их кислотно-аддитивных солей с фармакологически безвредными кислотами, а также необязательно в виде сольватов и/или гидратов. Особенно предпочтительны далее указанные выше соединения формулы 1, в которой X обозначаетNR2, где R2 обозначает циклопропилметил, циклопропилэтил, циклопентилметил, циклопентилэтил,циклогексилметил или циклогексилэтил, предпочтительно циклопропилметил, циклопентилметил или циклогексилметил, наиболее предпочтительно циклопропилметил, а индексы n и m и остатки А, В и R1 могут иметь указанные выше значения, необязательно в виде отдельных энантиомеров, смесей отдельных энантиомеров или рацематов, необязательно в виде их кислотно-аддитивных солей с фармакологически безвредными кислотами, а также необязательно в виде сольватов и/или гидратов. К предпочтительным относятся далее соединения формулы 1, в которой X обозначает СН 2, а индексы n и m и остатки А, В и R1 могут иметь указанные выше значения, необязательно в виде отдельных энантиомеров, смесей отдельных энантиомеров или рацематов, необязательно в виде их кислотноаддитивных солей с фармакологически безвредными кислотами, а также необязательно в виде сольватов и/или гидратов. К предпочтительным относятся далее соединения формулы 1, в которой X обозначает СО, а индексы n и m и остатки А, В и R1 могут иметь указанные выше значения, необязательно в виде отдельных энантиомеров, смесей отдельных энантиомеров или рацематов, необязательно в виде их кислотноаддитивных солей с фармакологически безвредными кислотами, а также необязательно в виде сольватов и/или гидратов. К предпочтительным относятся далее соединения формулы 1, в которой X обозначает О, а индексыn и m и остатки А, В и R1 могут иметь указанные выше значения, необязательно в виде отдельных энантиомеров, смесей отдельных энантиомеров или рацематов, необязательно в виде их кислотноаддитивных солей с фармакологически безвредными кислотами, а также необязательно в виде сольватов и/или гидратов. К предпочтительным относятся далее соединения формулы 1, в которой X обозначает S, а индексыn и m и остатки А, В и R1 могут иметь указанные выше значения, необязательно в виде отдельных энантиомеров, смесей отдельных энантиомеров или рацематов, необязательно в виде их кислотноаддитивных солей с фармакологически безвредными кислотами, а также необязательно в виде сольватов и/или гидратов. К предпочтительным относятся далее соединения формулы 1, в которой X обозначает NR2, а остатки n, m, А, В, R1 и R2 могут иметь указанные выше значения, необязательно в виде отдельных энантиомеров, смесей отдельных энантиомеров или рацематов, необязательно в виде их кислотно-аддитивных солей с фармакологически безвредными кислотами, а также необязательно в виде сольватов и/или гидратов. К предпочтительным относятся далее соединения формулы 1, в которой X обозначает NH, а индексы n и m и остатки А, В и R1 могут иметь указанные выше значения, необязательно в виде отдельных энантиомеров, смесей отдельных энантиомеров или рацематов, необязательно в виде их кислотноаддитивных солей с фармакологически безвредными кислотами, а также необязательно в виде сольватов и/или гидратов. Соединения формулы 1, в которой А обозначает СО, а В обозначает СН 2-О, отличаются тем, что они соответствуют общей формуле 1.1 В предпочтительном варианте осуществления настоящего изобретения в нем предлагаются соединения формулы 1.1, в которой n, m, X и R1 могут иметь заказанные выше значения, необязательно в виде отдельных энантиомеров, смесей отдельных энантиомеров или рацематов, необязательно в виде их кислотно-аддитивных солей с фармакологически безвредными кислотами, а также необязательно в виде сольватов и/или гидратов. Соединения формулы 1, в которой А обозначает СО, а В обозначает СН=СН, отличаются тем, что они соответствуют общей формуле 1.2 В предпочтительном варианте осуществления настоящего изобретения в нем предлагаются соединения формулы 1.2, в которой n, m, X и R1 могут иметь указанные выше значения, необязательно в виде-4 012727 отдельных энантиомеров, смесей отдельных энантиомеров или рацематов, необязательно в виде их кислотно-аддитивных солей с фармакологически безвредными кислотами, а также необязательно в виде сольватов и/или гидратов. Соединения формулы 1, в которой А обозначает СО, а В обозначает СН 2-СН 2, отличаются тем, что они соответствуют общей формуле 1.3 В предпочтительном варианте осуществления настоящего изобретения в нем предлагаются соединения формулы 1.3, в которой n, m, X и R1 могут иметь указанные выше значения, необязательно в виде отдельных энантиомеров, смесей отдельных энантиомеров или рацематов, необязательно в виде их кислотно-аддитивных солей с фармакологически безвредными кислотами, а также необязательно в виде сольватов и/или гидратов. Соединения формулы 1, в которой А обозначает СО, а В обозначает О, отличаются тем, что они соответствуют общей формуле 1.4 В предпочтительном варианте осуществления настоящего изобретения в нем предлагаются соединения формулы 1.4, в которой n, m, X и R1 могут иметь указанные выше значения, необязательно в виде отдельных энантиомеров, смесей отдельных энантиомеров или рацематов, необязательно в виде их кислотно-аддитивных солей с фармакологически безвредными кислотами, а также необязательно в виде сольватов и/или гидратов. Соединения формулы 1, в которой А обозначает СО, В обозначает CR3R4-О, a R3, соответственно 4R , обозначает метил, отличаются тем, что они соответствуют общей формуле 1.5 В предпочтительном варианте осуществления настоящего изобретения в нем предлагаются соединения формулы 1.5, в которой n, m, X и R1 могут иметь указанные выше значения, необязательно в виде отдельных энантиомеров, смесей отдельных энантиомеров или рацематов, необязательно в виде их кислотно-аддитивных солей с фармакологически безвредными кислотами, а также необязательно в виде сольватов и/или гидратов.-5 012727 К особенно предпочтительным относятся далее соединения формулы 1, выбранные из группы,включающей где в формуле 1a n обозначает 2 или 3, а в формулах 1b, 1c, 1d и 1e n обозначает 2, и представленные необязательно в виде отдельных энантиомеров, смесей отдельных энантиомеров или рацематов, необязательно в виде их кислотно-аддитивных солей с фармакологически безвредными кислотами, а также необязательно в виде сольватов и/или гидратов. В еще одном варианте осуществления настоящего изобретения в нем предлагаются указанные выше новые соединения формулы 1 в виде отдельных оптических изомеров, смесей отдельных энантиомеров или рацематов. Особенно предпочтительны при этом соединения формулы 1 в виде чистых энантиомеров, а особое значение согласно изобретению имеют R-энантиомеры соединений формулы 1.R-энантиомеры соединений формулы 1 можно представить общей формулой R-1 в которой индексы n и m и остатки А, В, X и R1 могут иметь указанные выше значения. Особенно предпочтительны при этом соединения формулы R-1, выбранные из группы, включающей где в формулах R-1 а и R-1c n обозначает 2 или 3, а в формулах R-1b, R-1d и R-1e n обозначает 2, и представленные необязательно в виде отдельных энантиомеров, смесей отдельных энантиомеров или рацематов, необязательно в виде их кислотно-аддитивных солей с фармакологически безвредными кислотами, а также необязательно в виде сольватов и/или гидратов. Методы разделения рацематов на индивидуальные энантиомеры известны из уровня техники и аналогичным образом могут использоваться для получения чистых R-, соответственно S-энантиомеров соединений формулы 1. Следующим объектом настоящего изобретения являются вышеуказанные новые соединения формулы 1 в качестве лекарственных средств. Настоящее изобретение относится далее к применению вышеуказанных соединений формулы 1 для приготовления лекарственного средства, предназначенного для лечения заболеваний дыхательных путей. В предпочтительном варианте настоящее изобретение относится к применению вышеуказанных соединений формулы 1 для приготовления лекарственного средства, предназначенного для лечения заболеваний дыхательных путей, выбранных из группы, включающей обструктивные заболевания легких различного генеза, эмфиземы легких различного генеза, рестриктивные заболевания легких, интерстициальные заболевания легких, кистозный фиброз, бронхиты различного генеза, бронхоэктазии, респираторный дистресс-синдром у взрослых (РДСВ) и все формы отека легких. Предпочтительно применение соединений формулы 1 для приготовления лекарственного средства,предназначенного для лечения обструктивных заболеваний легких, выбранных из группы, включающей хроническое обструктивное заболевание легких (ХОЗЛ), бронхиальную астму, детскую астму, тяжелую астму, острый приступ астмы и хронический бронхит, а особенно предпочтительно согласно изобретению применение для получения лекарственного средства, предназначенного для лечения бронхиальной астмы. Предпочтительно далее применение соединений формулы 1 для приготовления лекарственного средства, предназначенного для лечения эмфизем легких, причиной которых является ХОЗЛ или дефицит ингибиторов 1-протеиназы. Предпочтительно далее применение соединений формулы 1 для приготовления лекарственного средства, предназначенного для лечения рестриктивных заболеваний легких, выбранных из группы,включающей аллергический альвеолит, вызванные профессиональными вредностями рестриктивные заболевания легких, такие как асбестоз или силикоз, и рестрикцию вследствие опухолей легких, таких,например, как лимфангиоз (Lymphangiosis carcinomatosa), бронхоальвеолярный рак и лимфомы. Предпочтительно далее применение соединений формулы 1 для приготовления лекарственного средства, предназначенного для лечения интерстициальных заболеваний легких, выбранных из группы,включающей инфекционные пневмонии, например вследствие инфекции вирусами, бактериями, грибами, простейшими, гельминтами или иными возбудителями, пневмонит различного генеза, такой, например, как аспирация и недостаточность левых отделов сердца, лучевой пневмонит или фиброз, коллагенозы, такие, например, как красная волчанка, системная склеродермия или саркоидоз, гранулематозы, такие, например, как болезнь Бека, идиопатическая интерстициальная пневмония или идиопатический фиброз легких (ИФЛ). Предпочтительно далее применение соединений формулы 1 для приготовления лекарственного средства, предназначенного для лечения кистозного фиброза, соответственно муковисцидоза. Предпочтительно далее применение соединений формулы 1 для приготовления лекарственного средства, предназначенного для лечения бронхитов, таких, например, как бронхит вследствие бактериальной или вирусной инфекции, аллергический бронхит и токсический бронхит. Предпочтительно далее применение соединений формулы 1 для приготовления лекарственного средства, предназначенного для лечения бронхоэктазий. Предпочтительно далее применение соединений формулы 1 для приготовления лекарственного средства, предназначенного для лечения РДСВ. Предпочтительно далее применение соединений формулы 1 для приготовления лекарственного средства, предназначенного для лечения отеков легких, например токсического отека легких после аспи-7 012727 рации или вдыхания токсических веществ и чужеродных веществ. В особенно предпочтительном варианте настоящее изобретение относится к применению предлагаемых в нем соединений формулы 1 для получения лекарственного средства, предназначенного для лечения астмы или ХОЗЛ. Особое значение имеет далее указанное выше применение предлагаемых в изобретении соединений формулы 1 для получения лекарственного средства, предназначенного для однократного в сутки применения при лечении воспалительных и обструктивных заболеваний дыхательных путей, наиболее предпочтительно для однократного в сутки применения при лечении астмы или ХОЗЛ. Настоящее изобретение относится далее к способу лечения указанных выше заболеваний, отличающемуся тем, что в организм в терапевтически эффективных количествах вводят одно или несколько вышеуказанных соединений общей формулы 1. В предпочтительном варианте настоящее изобретение относится к способу лечения астмы или ХОЗЛ, отличающемуся тем, что в организм в терапевтически эффективных количествах один раз в сутки вводят одно или несколько вышеуказанных соединений общей формулы 1. Следующим объектом настоящего изобретения являются вышеуказанные соединения формулы 1 в виде их кислотно-аддитивных солей с фармакологически безвредными (приемлемыми) кислотами, а также необязательно в виде сольватов и/или гидратов. Под кислотно-аддитивными солями с фармакологически безвредными (приемлемыми) кислотами при этом подразумеваются, например, соли, выбранные из группы, включающей гидрохлорид, гидробромид, гидроиодид, гидросульфат, гидрофосфат, гидрометансульфонат, гидронитрат, гидромалеат, гидроацетат, гидробензоат, гидроцитрат, гидрофумарат, гидротартрат, гидрооксалат, гидросукцинат, гидробензоат и гидро-n-толуолсульфонат, предпочтительно гидрохлорид, гидробромид, гидросульфат, гидрофосфат, гидрофумарат и гидрометансульфонат. Под термином "C1-С 6 алкил" (в том числе и когда он является фрагментом других остатков) подразумеваются разветвленные и неразветвленные алкильные группы с 1-6 атомами углерода, а под термином "С 1-С 4 алкил" подразумеваются разветвленные и неразветвленные алкильные группы с 1-4 атомами углерода. Предпочтительны при этом алкильные группы с 1-4 атомами углерода. В качестве примера таких групп можно назвать метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил,н-пентил, изопентил, неопентил или гексил. Для обозначения подобных групп в некоторых случаях используются также соответствующие им сокращенные названия Me, Et, н-Pr, изо-Pr, н-Bu, изо-Bu, трет-Bu и т.д. Если не указано иное, то в понятия "пропил", "бутил", "пентил" и "гексил" включены также все возможные изомерные формы каждого из таких остатков. Так, например, в понятие "пропил" включены н-пропил и изопропил, в понятие "бутил" включены изобутил, втор-бутил и трет-бутил и т.д. Под алкиленовыми группами согласно настоящему изобретению подразумеваются мостиковые алкильные группы, т.е. алкильные группы, соединенные с двумя другими группами. Под термином "С 2-С 6 алкенил" (в том числе и когда он является фрагментом других остатков) подразумеваются разветвленные и неразветвленные алкенильные группы с 2-6 атомами углерода, а под термином "С 2-С 4 алкенил" подразумеваются разветвленные и неразветвленные алкенильные группы с 2-4 атомами углерода и с по меньшей мере одной двойной связью. Предпочтительны алкенильные группы с 2-4 атомами углерода. В качестве примера таких групп можно назвать этенил или винил, пропенил,бутенил, пентенил или гексенил. Если не указано иное, то в перечисленные выше понятия "пропенил","бутенил", "пентенил" и "гексенил" включены также все возможные изомерные формы каждого из этих остатков. Так, например, в понятие "пропенил" включены 1-пропенил и 2-пропенил, в понятие "бутенил" включены 1-, 2- и 3-бутенил, 1-метил-1-пропенил, 1-метил-2-пропенил и т.д. Под термином "С 2-С 6 алкинил" (в том числе и когда он является фрагментом других остатков) подразумеваются разветвленные и неразветвленные алкинильные группы с 2-6 атомами углерода, а под термином "С 2-С 4 алкинил" подразумеваются разветвленные и неразветвленные алкинильные группы с 2-4 атомами углерода и с по меньшей мере одной тройной связью. Предпочтительны алкинильные группы с 2-4 атомами углерода. В качестве примера таких групп можно назвать этинил, пропинил, бутинил, пентинил или гексинил. Если не указано иное, то в перечисленные выше понятия "пропинил", "бутинил","пентинил" и "гексинил" включены также все возможные изомерные формы каждого из этих остатков. Так, например, в понятие "пропинил" включены 1-пропинил и 2-пропинил, в понятие "бутинил" включены 1-, 2- и 3-бутинил, 1-метил-1-пропинил, 1-метил-2-пропинил и т.д. Под термином "С 3-С 6 циклоалкил" (в том числе и когда он является фрагментом других остатков) подразумеваются циклические алкильные группы с 3-6 атомами углерода. В качестве примера таких групп можно назвать циклопропил, циклопентил или циклогексил. Если не указано иное, то циклические алкильные группы могут быть замещены одним или несколькими остатками, выбранными из группы,включающей метил, этил, изопропил, трет-бутил, гидроксигруппу, фтор, хлор, бром и иод. Под алкиленциклоалкильными группами имеются в виду циклоалкильные группы, присоединенные через алкиленовый мостик. К таким группам относится, прежде всего, циклопропилметил. Под термином "C1-С 6 галоалкил" (в том числе и когда он является фрагментом других остатков) подразумеваются разветвленные и неразветвленные алкильные группы с 1-6 атомами углерода, замещенные одним или несколькими атомами галогена. Под термином "С 1-С 4 галоалкил" подразумеваются-8 012727 разветвленные и неразветвленные алкильные группы с 1-4 атомами углерода, замещенные одним или несколькими атомами галогена. Предпочтительны при этом галоалкильные группы с 1-4 атомами углерода. К предпочтительным атомам галогена относятся фтор и хлор, наиболее предпочтителен среди которых фтор. В качестве примера таких групп можно назвать CF3, CHF2, CH2F, CH2CF3. Под термином "С 6-С 10 арил" (в том числе и когда он является фрагментом других остатков) подразумеваются ароматические циклы, которые могут содержать от 6 до 10 атомов углерода. В качестве примера при этом можно назвать фенил или нафтил. Под алкиленарильными группами имеются в виду арильные группы, присоединенные через алкиленовый мостик. К таким группам относится, прежде всего, бензил. Под галогеном в контексте настоящего описания подразумевается фтор, хлор, бром или иод. Если не указано иное, то фтор, хлор и бром являются предпочтительными галогенами. Соединения общей формулы 1 могут содержать кислотные группы, преимущественно карбоксильные группы, и/или основные группы, такие, например, как функциональные аминогруппы. С учетом этого соединения общей формулы 1 могут быть представлены в виде внутренних солей, в виде солей с фармацевтически приемлемыми неорганическими кислотами, такими как соляная кислота, серная кислота,фосфорная кислота, сульфоновая кислота, или органическими кислотами (такими, например, как малеиновая кислота, фумаровая кислота, лимонная кислота, винная кислота или уксусная кислота), либо в виде солей с фармацевтически приемлемыми основаниями, такими как гидроксиды или карбонаты щелочных или щелочно-земельных металлов, гидроксиды цинка или аммония или органические амины, например диэтиламин, триэтиламин, триэтаноламин и другие. Соединения формулы 1 можно, как указывалось выше, переводить в их соли, прежде всего для фармацевтического применения в их физиологически совместимые и фармакологически приемлемые соли. Такие соли, с одной стороны, могут представлять собой физиологически совместимые и фармакологически приемлемые кислотно-аддитивные соли соединений формулы 1 с неорганическими или органическими кислотами. Для получения кислотно-аддитивных солей может использоваться, например, соляная кислота, бромисто-водородная кислота, серная кислота, фосфорная кислота, метансульфоновая кислота, уксусная кислота, фумаровая кислота, янтарная кислота, молочная кислота, лимонная кислота,винная кислота или малеиновая кислота. Помимо этого возможно также использование смесей вышеуказанных кислот. Для получения солей соединения формулы 1 с щелочными и щелочно-земельными металлами предпочтительно использовать гидроксиды и гидриды щелочных и щелочно-земельных металлов, особенно предпочтительно гидроксиды и гидриды щелочных металлов, прежде всего натрия и калия, наиболее предпочтительно гидроксид натрия и гидроксид калия. Соединения формулы 1 можно при необходимости переводить в их соли, прежде всего для фармацевтического применения в их фармакологически безвредные кислотно-аддитивные соли с неорганической или органической кислотой. Для получения таких кислотно-аддитивных солей может использоваться, например, янтарная кислота, бромисто-водородная кислота, уксусная кислота, фумаровая кислота,малеиновая кислота, метансульфоновая кислота, молочная кислота, фосфорная кислота, соляная кислота,серная кислота, винная кислота или лимонная кислота. Помимо этого возможно также использование смесей вышеуказанных кислот. Объектом изобретения являются соответствующие, предлагаемые в нем соединения, необязательно в виде отдельных оптических изомеров, смесей отдельных энантиомеров или рацематов, в виде таутомеров, а также в виде свободных оснований или соответствующих кислотно-аддитивных солей с фармакологически безвредными кислотами, таких, в частности, как кислотно-аддитивные соли с галогеноводородными кислотами, например хлористо- либо бромисто-водородной кислотой, или с органическими кислотами, такими, например, как щавелевая, фумаровая, дигликолевая или метансульфоновая кислота. Предлагаемые в изобретении соединения могут быть представлены в виде рацематов, однако их можно получать и в виде чистых энантиомеров, т.е. в (R)- или (S)-форме. Предпочтительны соединения,представленные в виде рацематов, соответственно в виде (R)-энантиомеров. Предлагаемые в изобретении соединения можно получать аналогично уже известным из уровня техники способам. Пригодные для получения предлагаемых в изобретении соединений способы известны, например, из патентов US 4460581 и 4154829, содержание которых в этом отношении в полном объеме включено в настоящее описание к качестве ссылки. Ниже настоящее изобретение более подробно рассмотрено на примерах, которые, однако, носят исключительно иллюстративный характер и не ограничивают его объем приведенными в них пояснениями. Примеры. Синтез промежуточных соединений. Промежуточное соединение 1: трет-Бутиловый эфир (3-амино-3-метилбутил)карбаминовой кислоты 23,6 г (117 ммоль) трет-бутилового эфира (1,1-диметил-3-оксопропил)карбаминовой кислоты в 700 мл раствора аммиака в этаноле обрабатывают в присутствии 3,5 г никеля Ренея при комнатной температуре и при давлении водорода 3 бар до полного по данным анализа тонкослойной хроматографией израсходования эдукта. Затем катализатор отфильтровывают и путем отгонки удаляют растворитель.-9 012727 Таким путем получают темно-зеленое масло. Выход: 22,7 г (96%). Масс-спектроскопия: [М+Н]+=203. Промежуточное соединение 2: 1-(3-амино-1,1-диметилпропил)-6-метил-1,3-дигидробензоимидазол 2-он а) трет-Бутиловый эфир [3-метил-3-(5-метил-2-нитрофениламино)бутил]карбаминовой кислоты 2,0 г (12,9 ммоль) 3-фтор-4-нитротолуола, 2,6 г (13,0 ммоль) трет-бутилового эфира (3-амино-3 метилбутил)карбаминовой кислоты и 2,3 г (16,8 ммоль) карбоната калия перемешивают в течение ночи при комнатной температуре в 20 мл ДМФ. Затем отгоняют растворитель и остаток смешивают с этилацетатом. После этого вновь промывают водой, сушат над сульфатом натрия и удаляют растворитель. Таким путем получают 4,8 г желтого масла. Масс-спектроскопия: [М+Н]+=338. б) трет-Бутиловый эфир [3-(2-амино-5-метилфениламино)-3-метилбутил]карбаминовой кислоты 4,71 г (14,0 ммоль) трет-бутилового эфира [3-метил-3-(5-метил-2-нитрофениламино)бутил]карбаминовой кислоты растворяют в 110 мл метанола и гидрируют в присутствии 340 мг палладия на угле(10%-ного) при комнатной температуре. После этого катализатор отделяют и отгоняют растворитель. Таким путем получают коричневое твердое вещество. Выход: 3,72 г (87%). Масс-спектроскопия: [М+Н]+=308. в) трет-Бутиловый эфир [3-метил-3-(6-метил-2-оксо-2,3-дигидробензоимидазол-1-ил)бутил]карбаминовой кислоты 1,76 г (5,7 ммоль) трет-бутилового эфира [3-(2-амино-5-метилфениламино)-3-метилбутил]карбаминовой кислоты растворяют в 35 мл ТГФ, смешивают с 2,1 г (12,7 ммоль) 1,1 карбонилди(1,2,4-триазола) и оставляют перемешиваться на ночь. Затем отгоняют растворитель, и остаток растворяют в этилацетате. Раствор последовательно промывают раствором гидросульфата калия и раствором хлорида натрия и сушат над сульфатом натрия. Остаток хроматографируют (силикагель, дихлорметан с 0-16% смеси метанол/аммиак в соотношении 9:1) и полученный таким путем сырой продукт размешивают с диэтиловым эфиром. Таким путем получают светло-желтое твердое вещество. Выход: 1,12 г (59%). Масс-спектроскопия: [М+Н]+=334. г) 1-(3-амино-1,1-диметилпропил)-6-метил-1,3-дигидробензоимидазол-2-он Раствор 1,50 г (4,5 ммоль) трет-бутилового эфира [3-метил-3-(6-метил-2-оксо-2,3 дигидробензоимидазол-1-ил)бутил]карбаминовой кислоты в 100 мл диоксана смешивают с 10 мл 4 молярной соляной кислоты в диоксане и затем нагревают до 90 С с выдержкой при этой температуре в течение 90 мин, что сопровождается выпадением белого осадка. После охлаждения до комнатной температуры отгоняют растворитель, и остаток размешивают в диэтиловом эфире. Таким путем получают белое твердое вещество. Выход: 1,04 г (86%, гидрохлорид). Масс-спектроскопия: [М+Н]+=234. Промежуточное соединение 3: 1-(3-амино-3-метилбутил)-5-трифторметил-1,3-дигидробензоимидазол-2-он а) трет-Бутиловый эфир [3-метил-3-(2-нитро-4-трифторметилфениламино)бутил]карбаминовой кислоты Указанное соединение получают аналогично стадии 2 а) получения промежуточного соединения 2 из в общей сложности 3,25 г (15,5 ммоль) 1-фтор-2-нитро-4-трифторметилбензола и 2,74 г (13,5 ммоль) трет-бутилового эфира (3-амино-3-метилбутил)карбаминовой кислоты. Выход: 6,1 г желтого масла. Масс-спектроскопия: [М+Н]+=392. б) трет-Бутиловый эфир [3-(2-амино-4-трифторметилфениламино)-1,1-диметилпропил]карбаминовой кислоты 6,10 г (15,6 ммоль) трет-бутилового эфира [3-метил-3-(2-нитро-4-трифторметилфениламино)бутил]карбаминовой кислоты гидрируют аналогично стадии 2 б) получения промежуточного соединения 2.- 10012727 Выход: 5,05 г (90%). Масс-спектроскопия: [М+Н]+=362. в) трет-Бутиловый эфир [1,1-диметил-3-(2-оксо-5-трифторметил-2,3-дигидробензоимидазол-1 ил)пропил]карбаминовой кислоты 5,00 г (13,8 ммоль) трет-бутилового эфира [3-(2-амино-4-трифторметилфениламино)-1,1 диметилпропил]карбаминовой кислоты и 6,73 г (41,5 ммоль) 1,1-карбонилдиимидазола подвергают взаимодействию между собой и последующей переработке аналогично стадии 2 в) получения промежуточного соединения 2. Таким путем получают белое твердое вещество. Выход: 4,18 г (78%). Масс-спектроскопия: [М-Н]+=386. г) 1-(3-амино-3-метилбутил)-5-трифторметил-1,3-дигидробензоимидазол-2-он Указанное соединение получают аналогично стадии 2 г) получения промежуточного соединения 2 из 2,89 г (7,5 ммоль) трет-бутилового эфира [1,1-диметил-3-(2-оксо-5-трифторметил-2,3 дигидробензоимидазол-1-ил)пропил]карбаминовой кислоты. Выход: 1,60 г (66%). Масс-спектроскопия: [М+Н]+=288. Промежуточное соединение 4: 3-(3-амино-3-метилбутил)-3 Н-бензооксазол-2-он а) 1-иод-4-метилнитропентан К 26,0 г (177 ммоль) 1-метил-4-нитропентан-1-ола и 52,8 г (352 ммоль) иодида натрия в 350 мл ацетонитрила по каплям добавляют раствор 44,7 мл (352 ммоль) хлортриметилсилана в 50 мл ацетонитрила. Затем нагревают до 50 С с выдержкой при этой температуре в течение 4 ч, после чего отгоняют растворитель и остаток смешивают с 500 мл диэтилового эфира. Далее последовательно промывают водой, раствором тиосульфата натрия и раствором хлорида натрия. Органическую фазу сушат над сульфатом натрия и концентрируют. Таким путем получают 34,2 г красного масла. б) 3-(3-метил-3-нитробутил)-3 Н-бензооксазол-2-он К раствору 4,50 г (33,3 ммоль) бензооксазол-2-она в 50 мл ДМФ порциями добавляют 1,70 г(42,5 ммоль) гидрида натрия (60%-ного), поддерживая при этом температуру путем охлаждения ниже 0 С. После перемешивания в течение часа по каплям добавляют раствор 9,61 г (37,4 ммоль) 1-иод-4 метил-4-нитропентана в 20 мл ДМФ таким образом, чтобы температура не поднималась выше 5 С. Затем смесь оставляют перемешиваться на ночь при комнатной температуре, после чего отгоняют растворитель. Остаток растворяют в этилацетате, последовательно промывают водой и раствором хлорида натрия,сушат над сульфатом натрия и концентрируют. Таким путем получают 11,0 г масла. Масс-спектроскопия: [М+Н]+=265. в) 3-(3-амино-3-метилбутил)-3 Н-бензооксазол-2-он 11,0 г 3-(3-метил-3-нитробутил)-3 Н-бензооксазол-2-она, полученного на предыдущей стадии, растворяют в 130 мл этанола и гидрируют в течение 20 ч при давлении 5 бар в присутствии никеля Ренея в качестве катализатора. Затем катализатор отфильтровывают и из фильтрата удаляют растворитель. После этого смешивают с 10%-ным раствором соляной кислоты в этаноле, отгоняют растворитель и остаток размешивают в смеси ацетон/диэтиловый эфир. Таким путем получают белое твердое вещество. Выход: 6,0 г (77% по двум стадиям, гидрохлорид). Интервал температур плавления: 145-147 С. Промежуточное соединение 5: 3-(3-амино-3-метилбутил)-3 Н-бензооксазол-2-он а) трет-Бутиловый эфир [1,1-диметил-3-(2-оксобензооксазол-3-ил)пропил]карбаминовой кислоты 4,0 г (29,6 ммоль) бензооксазол-2-она растворяют в 40 мл N,N'-диметилпропиленмочевины и охлаждают с помощью ледяной бани. К этому раствору в атмосфере защитного газа порциями добавляют 897 мг (35,5 ммоль) гидрида натрия (95%-ного). Затем реакционную смесь нагревают до комнатной температуры и после этого перемешивают еще в течение часа. Далее добавляют 9,85 г (44,4 ммоль) третбутилового эфира (3-амино-1,1-диметилпропил)карбаминовой кислоты и 1,97 г (5,3 ммоль) тетрабутиламмонийиодида и оставляют перемешиваться на ночь. Затем реакцию прекращают осторожным добавлением раствора гидрокарбоната натрия. После этого смешивают с этилацетатом, водную фазу отделяют и вновь экстрагируют ее этилацетатом. Объединенные органические фазы промывают раствором хлорида натрия, сушат над сульфатом натрия и концентрируют. Остаток очищают колоночной хроматографией (силикагель, петролейный эфир/этилацетат в соотношении 7:3), получая требуемый продукт в виде масла.- 11012727 Выход 4,1 г (43%). Масс-спектроскопия: [М+Н]+=321. б) 3-(3-амино-3-метилбутил)-3 Н-бензооксазол-2-он К раствору 4,0 г (12,5 ммоль) трет-бутилового эфира [1,1-диметил-3-(2-оксобензооксазол-3 ил)пропил]карбаминовой кислоты в 110 мл дихлорметана при комнатной температуре по каплям добавляют 18 мл трифторуксусной кислоты. Смесь оставляют перемешиваться на ночь, после чего отгоняют растворитель. Оставшееся масло размешивают в диэтиловом эфире, что сопровождается выпадением в осадок твердого вещества, которое отфильтровывают. После повторного размешивания с диэтиловым эфиром и фильтрации получают твердое вещество бежевого цвета. Выход: 3,63 г (65%, трифторацетат). Масс-спектроскопия: [М+Н]+=221. Промежуточное соединение 6: 5-бензилокси-7-(2-этокси-2-гидроксиацетил)-3 Н-бензооксазол-2-он а) 1-(5-бензилокси-2-гидрокси-3-нитрофенил)этанон К раствору 81,5 г (0,34 моль) 1-(5-бензилокси-2-гидроксифенил)этанона (известного из US 4460581) в 700 мл уксусной кислоты при охлаждении с помощью ледяной бани по каплям добавляют 18 мл дымящей азотной кислоты таким образом, чтобы температура не поднималась выше 20 С. После этого реакционную смесь в течение двух часов перемешивают при комнатной температуре, сливают в смесь воды со льдом и фильтруют. Продукт перекристаллизовывают в изопропаноле, отделяют вакуум-фильтрацией и промывают изопропанолом и диизопропиловым эфиром. Выход: 69,6 г (72%). Масс-спектроскопия [М+Н]+=288. б) 1-(3-амино-5-бензилокси-2-гидроксифенил)этанон 69,5 г (242 ммоль) 1-(5-бензилокси-2-гидрокси-3-нитрофенил)этанона растворяют в 1,4 л метанола и гидрируют при давлении 3 бар и комнатной температуре в присутствии 14 г родия на угле (10%-ного) в качестве катализатора. После этого катализатор отфильтровывают и фильтрат концентрируют. Остаток без дополнительной очистки используют в последующей реакции. Выход: 60,0 г (96%). Значение Rf=0,45 (дихлорметан на силикагеле). в) 7-ацетил-5-бензилокси-3 Н-бензооксазол-2-он В раствор 121 г (0,47 моль) 1-(3-амино-5-бензилокси-2-гидроксифенил)этанона в 800 мл пиридина при 20-40 С вводят 52 г (0,53 моль) фосгена. Затем реакционную смесь нагревают до 50 С с выдержкой при этой температуре в течение 2 ч, после чего сливают на лед и подкисляют концентрированной соляной кислотой. Таким путем получают красно-коричневое твердое вещество, которое повторно перекристаллизовывают в этаноле с добавлением активированного угля. Выход: 67,5 г (50,6%). Интервал температур плавления: 163-166 С. г) 5-бензилокси-7-(2-этокси-2-гидроксиацетил)-3 Н-бензооксазол-2-он 20 г (71 ммоль) 7-ацетил-5 бензилокси-3 Н-бензооксазол-2-она и 8 г (72 ммоль) диоксида селена в течение 8 ч перемешивают при кипячении с обратным холодильником в присутствии активированного угля в 100 мл диоксана и 3,1 мл воды. Твердое вещество отфильтровывают, отгоняют растворитель, и остаток смешивают с 50 мл этанола. После этого смесь в течение 15 мин кипятят с обратным холодильником и затем фильтруют через активированный уголь. Выпавшее в осадок при охлаждении твердое вещество через 3 ч отделяют вакуум-фильтрацией и промывают этанолом и диэтиловым эфиром. Выход: 7 г (29%). Интервал температур плавления: 140-143 С. Промежуточное соединение 7: 6-бензилокси-8-(2-этокси-2-гидроксиацетил)-2,2-диметил-4 Нбензо[1,4]оксазин-3-он а) N-(3-ацетил-5-бензилокси-2-гидроксифенил)-2-бром-2-метилпропионамид К раствору 5,15 г (20 ммоль) 1-(3-амино-5-бензилокси-2-гидроксифенил)этанона в 20 мл пиридина при 5-20 С по каплям добавляют 4,64 г (25 ммоль) 2-бром-2-метилпропионилхлорида. По завершении- 12012727 добавления этого соединения смесь перемешивают в течение 15 мин, смешивают со смесью воды со льдом и 100 мл этилацетата и подкисляют концентрированной соляной кислотой. Органическую фазу отделяют, промывают водой и сушат над сульфатом натрия. После отгонки растворителя полученный остаток выкристаллизовывают в смеси диэтиловый эфир/петролейный эфир. Выход: 6,8 г (84%). Интервал температур плавления: 88-90 С. б) 8-ацетил-6-бензилокси-2,2-диметил-4 Н-бензо[1,4]оксазин-3-он 6,60 г (16,2 ммоль) N-(3-ацетил-5-бензилокси-2-гидроксифенил)-2-бром-2-метилпропионамида и 2,76 г (20 ммоль) карбоната калия в течение 1 ч перемешивают в 70 мл ацетонитрила при кипячении с обратным холодильником. Твердое вещество отделяют вакуум-фильтрацией, фильтрат концентрируют и остаток смешивают с 30 мл этилацетата. После повторной фильтрации и отгонки растворителя сырой продукт выкристаллизовывают в небольшом количестве метанола. Выход: 1,00 г (19%). Масс-спектроскопия [М+Н]+=326. Интервал температур плавления: 148-150 С. в) 6-бензилокси-8-(2-этокси-2-гидроксиацетил)-2,2-диметил-4 Н-бензо[1,4]оксазин-3-он Указанное соединение получают из 8-ацетил-6-бензилокси-2,2-диметил-4 Н-бензо[1,4]оксазин-3-она аналогично промежуточному соединению 6 описанным в примере 6 г) способом. Промежуточное соединение 8: 7-бензилокси-5-оксиранил-1 Н-хинолин-2-он а) 2-ацетил-4-бензилокси-6-нитрофениловый эфир трифторметансульфоновой кислоты 92,7 мл (660 ммоль) триэтиламина при -10 С добавляют к 90 г (313 ммоль) 1-(5-бензилокси-2 гидрокси-3-нитрофенил)этанона в 940 мл дихлорметана. Затем медленно по каплям добавляют раствор 65 мл (394 ммоль) трифторметансульфонового ангидрида в 40 мл дихлорметана. После 15-минутного перемешивания при -5 С реакцию прекращают путем осторожного добавления 400 мл раствора хлорида аммония и 400 мл раствора гидрокарбоната натрия. Органическую фазу отделяют, сушат над сульфатом натрия и концентрируют. Остаток растворяют в 150 мл диэтилового эфира и затем осаждают добавлением 800 мл гексана. Твердое вещество отфильтровывают, суспендируют в смеси диэтиловый эфир/гексан и вновь отделяют вакуум-фильтрацией. Выход: 118 г (90%). Масс-спектроскопия: [М+Н]+=420. б) Метиловый эфир 3-(2-ацетил-4-бензилокси-6-нитрофенил)акриловой кислоты К раствору 100 г (238 ммоль) 2-ацетил-4-бензилокси-6-нитрофенилового эфира трифторметансульфоновой кислоты в 360 мл диоксана добавляют 5,88 г (6,42 ммоль) трис-(дибензилиденацетон)дипалладия, 3,50 г (12,01 ммоль) тетрафторбората три-трет-бутилфосфония, 81,2 мл (371 ммоль) дициклогексилметиламина, 105,8 г (286 ммоль) тетрабутиламмонийиодида и 32,6 мл (362 ммоль) метилакрилата. Затем реакционную смесь в течение 2 ч перемешивают при 80 С в атмосфере азота в присутствии 100 г молекулярного сита (4 ) и после этого смешивают с 2 л диэтилового эфира и 500 г силикагеля. Через 10 мин силикагель отделяют вакуум-фильтрацией, после чего вновь промывают диэтиловым эфиром. Объединенные органические фазы последовательно промывают 1 н. соляной кислотой, раствором карбоната натрия и раствором хлорида натрия. Затем отгоняют растворитель, остаток выкристаллизовывают в этаноле и отфильтровывают твердое вещество, которое промывают этанолом. Выход: 32,2 г (38%). Масс-спектроскопия: [М+Н]+=356. в) 5-ацетил-7-бензилокси-3,4-дигидро-1H-хинолин-2-он 5,0 г (14,07 ммоль) метилового эфира 3-(2-ацетил-4-бензилокси-6-нитрофенил)акриловой кислоты смешивают с 100 мл этанола и гидрируют в присутствии никеля Ренея в качестве катализатора при давлении 4 бар. Затем катализатор отделяют и фильтрат подкисляют 15 мл 2 н. соляной кислоты. Выкристаллизовавшийся продукт отделяют вакуум-фильтрацией и сушат. Выход: 1,0 г (24%). Масс-спектроскопия: [М+Н]+=296. г) 5-ацетил-7-бензилокси-1H-хинолин-2-он 13,0 г (44 ммоль) 5-ацетил-7-бензилокси-3,4-дигидро-1H-хинолин-2-она суспендируют в 130 мл диоксана и смешивают с 15,0 г (66 ммоль) 2,3-дихлор-5,6-дицианобензохинона. Затем смесь в течение 30 мин кипятят с обратным холодильником, после чего охлаждают до комнатной температуры и перемешивают еще в течение 2 ч. Твердое вещество отфильтровывают, промывают диоксаном и растворяют в 600 мл смеси дихлорметан/метанол (в соотношении 9:1). Полученный раствор промывают раствором- 13012727 гидрокарбоната натрия, сушат над сульфатом натрия и концентрируют. После этого остаток суспендируют в метаноле, суспензию фильтруют и осадок на фильтре сушат. Выход: 8,3 г (64%). Масс-спектроскопия: [М+Н]+=294. д) 7-бензилокси-5-(2-хлорацетил)-1 Н-хинолин-2-он 7,0 г (23,9 ммоль) 5-ацетил-7-бензилокси-1 Н-хинолин-2-она и 19,0 г (54,6 ммоль) бензилтриметиламмонийдихлориодата при 65 С перемешивают в 43 мл уксусной кислоты, 7 мл воды и 147 мл дихлорэтана. Через 4,5 ч реакцию прекращают добавлением 400 мл раствора карбоната натрия и 50 мл 5%-ного раствора сульфита натрия. Нерастворившиеся компоненты отделяют вакуум-фильтрацией, промывают водой и сушат. Выход: 6,0 г (77%). Масс-спектроскопия: [М+Н]+=328. е) 7-бензилокси-5-оксиранил-1 Н-хинолин-2-он 6,0 г (18,3 ммоль) 7-бензилокси-5-(2-хлорацетил)-1 Н-хинолин-2-она добавляют к 150 мл тетрагидрофурана и при 0-5 С смешивают с 434 мг (19,9 ммоль) боргидрида лития. Затем смесь перемешивают в течение 30 мин, после чего добавляют 43 мл 2,5-молярного раствора гидроксида натрия и продолжают перемешивать еще в течение 4 ч при нагреве до комнатной температуры. Далее смесь смешивают с раствором хлорида натрия, фильтруют и вновь экстрагируют смесью этилацетат/тетрагидрофуран (в соотношении 1:1). Отфильтрованное твердое вещество и органические фазы объединяют и удаляют растворитель. Остаток суспендируют в метаноле, суспензию подвергают вакуум-фильтрации и осадок на фильтре сушат. Выход 4,8 г (89%). Масс-спектроскопия: [М+Н]+=294. Промежуточное соединение 9: 1-(3-амино-3-метилбутил)-4-метокси-1,3-дигидробензоимидазол-2 он а) 4-метил-4-нитропентан-1-ол 50 г (0,285 моль) метилового эфира 4-метил-4-нитропентановой кислоты растворяют в смеси ТГФ/этанол, взятых в соотношении 6:4 (1000 мл). Полученный раствор охлаждают до -10 С и смешивают с 24,2 г (0,571 моль) хлорида лития. Затем порциями добавляют 21,6 г (0,571 моль) боргидрида лития. После этого смесь перемешивают в течение 30 мин при -10 С и затем оставляют на ночь нагреваться до комнатной температуры. Далее реакционную смесь перемешивают в течение 6 ч при 60 С, после чего оставляют перемешиваться на ночь при комнатной температуре. Затем смешивают с водой и добавлением разбавленной соляной кислоты значение рН устанавливают на 6. После этого отгоняют растворитель и остаток смешивают с водой. Далее экстрагируют дихлорметаном, объединенные органические фазы промывают водой и раствором хлорида аммония и сушат над сульфатом натрия. После удаления растворителя получают продукт в виде желтого масла. Выход: 40,0 г (95%). Масс-спектроскопия: [М+Н]+=148. б) 1-иод-4-метил-4-нитропентан К 40 г (0,272 моль) 4-метил-4-нитропентан-1-ола и 81,5 г (0,544 моль) иодида натрия в 350 мл ацетонитрила при комнатной температуре по каплям добавляют 70 мл (0,544 моль) триметилхлорсилана. Затем реакционную смесь фильтруют, концентрируют и смешивают с диэтиловым эфиром. Органическую фазу промывают раствором бисульфита натрия и водой, сушат и удаляют растворитель. Полученный таким путем продукт представляет собой желтое масло. Выход: 56,0 г (80%). Масс-спектроскопия: [M-NO2]+=211. в) 2-метокси-6-нитрофениламин К раствору 25 г (0,162 моль) 2-амино-3-нитрофенола в 200 мл ДМФ добавляют 85%-ный раствор гидроксида калия (11,7 г, 0,179 моль). После этого по каплям добавляют 11,1 мл (0,178 моль) подметана и оставляют перемешиваться на ночь при комнатной температуре. Затем реакционную смесь сливают на лед и перемешивают в течение часа. Выпавший в осадок продукт отфильтровывают, промывают водой и сушат. Выход: 23,8 г (87%). Масс-спектроскопия: [М+Н]+=169. г) Этиловый эфир (2-метокси-6-нитрофенил)карбаминовой кислоты К раствору 23,8 г (0,142 моль) 2-метокси-6-нитрофениламина в 300 мл ТГФ при кипячении с обрат- 14012727 ным холодильником по каплям добавляют 17,1 мл (0,141 моль) трихлорметилхлорформиата, после чего перемешивают в течение 4 ч при этой же температуре. Затем отгоняют растворитель и остаток размешивают с изопропанолом, что сопровождается выпадением в осадок желтого твердого вещества. Выход: 25,0 г (73%). Масс-спектроскопия: [М+Н]+=241. д) Этиловый эфир (2-амино-6-метоксифенил)карбаминовой кислоты 25,0 г (0,104 моль) этилового эфира (2-метокси-6-нитрофенил)карбаминовой кислоты растворяют в 400 мл метанола. Затем добавляют 116,4 г (0,516 моль) SnCl22H2O и в течение 3 ч кипятят с обратным холодильником. Далее реакционную смесь концентрируют, смешивают с раствором карбоната натрия и фильтруют. Водную фазу вновь экстрагируют дихлорметаном и объединенные органические фазы промывают раствором хлорида натрия,сушат и концентрируют. Выкристаллизовавшийся при стоянии остаток размешивают с изопропанолом. Выход: 13,0 г (59%). Масс-спектроскопия: [М+Н]+=211. е) Этиловый эфир 7-метокси-2-оксо-2,3-дигидробензоимидазол-1-карбоновой кислоты 13,0 г (0,062 моль) этилового эфира (2-амино-6-метоксифенил)карбаминовой кислоты и 10,3 мл(0,074 моль) триэтиламина в 100 мл дихлорметана при охлаждении льдом добавляют к раствору 8,20 мл(0,068 моль) трихлорметилхлорформиата в 50 мл дихлорметана. После 4-часового перемешивания при комнатной температуре реакционную смесь сливают на лед и экстрагируют дихлорметаном. Объединенные органические фазы промывают водой, сушат и удаляют растворитель. Остаток размешивают в диэтиловом эфире. Выход: 9,0 г (62%). Масс-спектроскопия: [М+Н]+=237. ж) 4-метокси-1-(3-метил-3-нитробутил)-1,3-дигидробензоимидазол-2-он 4,0 г (17 ммоль) этилового эфира 7-метокси-2-оксо-2,3-дигидробензоимидазол-1-карбоновой кислоты в ДМФ при охлаждении с помощью ледяной бани смешивают с 85%-ным раствором гидроксида калия (3,3 г, 51 ммоль). Через 30 мин добавляют раствор 5,2 г (21 ммоль) 1-иод-4-метил-4-нитропентана в ДМФ и оставляют перемешиваться на ночь при комнатной температуре. Затем реакционную смесь разбавляют водой и экстрагируют этилацетатом. Объединенные органические фазы промывают водой, сушат и удаляют растворитель. Оставшееся масло очищают хроматографией на силикагелевой колонке (градиентное элюирование смесью циклогексан/этилацетат). Выход: 0,5 г (8%). Масс-спектроскопия: [М+Н]+=366. з) 1-(3-амино-3-метилбутил)-4-метокси-1,3-дигидробензоимидазол-2-он 1,4 г (4,8 ммоль) 4-метокси 1-(3-метил-3-нитробутил)-1,3-дигидробензоимидазол-2-она растворяют в метаноле и гидрируют в присутствии никеля Ренея при давлении 3 бар. Затем катализатор отделяют, отгоняют растворитель и остаток растворяют в растворе соляной кислоты в этаноле. После этого отгоняют растворитель и оставшееся твердое вещество размешивают с изопропанолом. Выход: 0,6 г (42%, гидрохлорид). Масс-спектроскопия: [М+Н]+=300. Промежуточное соединение 10: 1-(3-амино-3-метилбутил)-5-метокси-3-метил-1,3-дигидробензоимидазол-2-он а) (5-метокси-2-нитрофенил)метиламин К 14,3 г (83,56 ммоль) 3-фтор-4-нитроанизола и 12,71 г (92,02 ммоль) карбоната калия в 200 мл дихлорметана по каплям добавляют 83,5 мл (167,0 ммоль) 2-молярного раствора метиламина в ТГФ. Затем смесь оставляют перемешиваться на ночь, после чего смешивают с водой. Органическую фазу последовательно промывают водой и раствором хлорида аммония, сушат и концентрируют. Оставшееся желтое твердое вещество размешивают с гексаном. Выход: 12,7 г (84%). Масс-спектроскопия: [М+Н]+=183. б) 4-метокси-N-2-метилбензол-1,2-диамин 12,5 г (68,6 ммоль) (5-метокси-2-нитрофенил)метиламина и 77,39 г (343,0 ммоль) SnCl22H2O в 200 мл этанола в течение 6 ч кипятят с обратным холодильником. Затем реакционную смесь промывают раствором карбоната натрия, фильтруют и концентрируют. Остаток смешивают с водой и экстрагируют этилацетатом. Объединенные органические фазы промывают водой, сушат и удаляют растворитель. Таким путем получают продукт в виде масла. Выход: 8,0 г (77%). Масс-спектроскопия: [М+Н]+=153.- 15012727 в) 5-метокси-1-метил-1,3-дигидробензоимидазол-2-он 8,0 г (52,56 ммоль) 4-метокси-N-2-метилбензол-1,2-диамина и 8,7 мл (63,00 ммоль) триэтиламина растворяют в 100 мл дихлорметана и по каплям добавляют к 7 мл (58,00 ммоль) трихлорметилхлорформиата в 50 мл дихлорметана. Затем реакционную смесь оставляют перемешиваться на ночь при комнатной температуре, после чего сливают в смесь воды со льдом и экстрагируют дихлорметаном. Объединенные органические фазы промывают водой, сушат и концентрируют. Оставшееся твердое вещество размешивают с диэтиловым эфиром. Выход: 4,2 г (45%). Масс-спектроскопия: [М+Н]+=179. г) 5-метокси-3-метил-1-(3-метил-3-нитробутил)-1,3-дигидробензоимидазол-2-он К 2,5 г (14 ммоль) 5-метокси-1-метил-1,3-дигидробензоимидазол-2-она в 30 мл ДМФ при охлаждении с помощью ледяной бани добавляют 1,1 г (28 ммоль) 60%-ного гидрида натрия. Через 30 мин добавляют раствор 1-иод-4-метил-4-нитропентана в 20 мл ДМФ и оставляют перемешиваться на ночь. Затем разбавляют водой и экстрагируют этилацетатом. Объединенные органические фазы промывают водой,сушат и концентрируют. Оставшееся твердое вещество размешивают с диэтиловым эфиром. Выход: 2,7 г (63%). Масс-спектроскопия: [М+Н]+=308. д) 1 -(3-амино-3-метилбутил)-5-метокси-3-метил-1,3-дигидробензоимидазол-2-он 2,7 г (8,7 ммоль) 5-метокси-3-метил-1-(3-метил-3-нитробутил)-1,3-дигидробензоимидазол-2-она и 9,93 г (44,0 ммоль) SnCl22H2O в 200 мл этанола в течение 3 ч кипятят с обратным холодильником. Затем реакционную смесь концентрируют, смешивают с раствором карбоната натрия и фильтруют. Фильтрат экстрагируют этилацетатом, объединенные органические фазы промывают водой, сушат и удаляют растворитель. Остаток растворяют в этаноле и полученный раствор смешивают с раствором соляной кислоты в диэтиловом эфире. Оставшееся после отгонки растворителя твердое вещество размешивают с диизопропиловым эфиром. Выход: 0,7 г (29%). Масс-спектроскопия: [М+Н]+=278. Промежуточное соединение 11: 3-(4-амино-4-метилпентил)-5-фтор-1-метил-1,3-дигидробензоимидазол-2-он а) (4-фтор-2-нитрофенил)метиламин К 25 г (157 ммоль) 2,4-дифторнитробензола и 23,9 г (173 ммоль) карбоната калия в 300 мл дихлорметана при охлаждении по каплям добавляют 157 мл (314 ммоль) 2-молярного раствора метиламина в ТГФ. Далее смесь оставляют перемешиваться на ночь при комнатной температуре, после чего смешивают с водой. Органическую фазу промывают водой, сушат и концентрируют. Остаток размешивают с диэтиловым эфиром. Выход: 18 г (69%). Масс-спектроскопия [М+Н]+=171. б) 4-фтор-N-1-метилбензол-1,2-диамин 22 г (0,12 моль) (4-фтор-2-нитрофенил)метиламина в 250 мл этанола гидрируют в присутствии палладия на угле в качестве катализатора при давлении водорода 4 бар. Затем катализатор отделяют и отгоняют растворитель. Оставшееся масло очищают хроматографией (силикагель, градиентное элюирование смесью гексан/этилацетат). Таким путем получают продукт в виде масла. Выход: 9 г (50%). Масс-спектроскопия [М+Н]+=141. в) 5-фтор-1-метил-1,3-дигидробензоимидазол-2-он 13,0 г (92,1 ммоль) 4-фтор-N-1-метилбензол-1,2-диамина подвергают взаимодействию с трихлорметилхлорформиатом аналогично стадии 10 в) получения промежуточного соединения 10. После размешивания в диэтиловом эфире выделяют продукт в виде твердого вещества. Выход: 6,0 г (39%). Масс-спектроскопия: [М+Н]+=167. г) 5-фтор-1-метил-3-(4-метил-4-нитропентил)-1,3-дигидробензоимидазол-2-он К раствору 2,1 г (12,6 ммоль) 5-фтор-1-метил-1,3-дигидробензоимидазол-2-она в ДМФ сначала добавляют 0,624 г (13,9 ммоль) 60%-ного гидрида натрия, а затем при охлаждении добавляют 4,6 г(17,8 ммоль) 1-иод-4-метил-4-нитропентана в 10 мл ДМФ. Далее реакционную смесь оставляют перемешиваться на ночь при комнатной температуре, после чего сливают в воду и экстрагируют диэтиловым эфиром. Органические фазы концентрируют и остаток перекристаллизовывают в изопропиловом эфире.- 16012727 Выход: 1,8 г (48%). Масс-спектроскопия [М+Н]+=296. д) 3-(4-амино-4-метилпентил)-5-фтор-1-метил-1,3-дигидробензоимидазол-2-он 1,8 г (6,09 ммоль) 5-фтор-1-метил-3-(4-метил-4-нитропентил)-1,3-дигидробензоимидазол-2-она в 50 мл метанола гидрируют в присутствии никеля Ренея в качестве катализатора при давлении водорода 3 бар. Затем катализатор отделяют и отгоняют растворитель. Для получения гидрохлорида остаток смешивают с этанолом и соляной кислотой в диэтиловом эфире. Выход: 1,5 г (83%, гидрохлорид). Интервал температур плавления: 225-228 С. Масс-спектроскопия [М+Н]+=303. Промежуточное соединение 12: 3-(4-амино-4-метилпентил)-4-фтор-1-метил-1,3-дигидробензоимидазол-2-он а) (3-фтор-2-нитрофенил)метиламин Указанное соединение получают аналогично стадии 10 а) получения промежуточного соединения 10 взаимодействием 2,0 г (2,6 ммоль) 2,6-дифторнитробензола с 2-молярным раствором метиламина в ТГФ. Полученный таким путем продукт представляет собой красное твердое вещество. Выход: 1,8 г (86%). Масс-спектроскопия: [М+Н]+=171. б) 3-фтор-N-1-метилбензол-1,2-диамин Указанное соединение получают аналогично стадии 10 б) получения промежуточного соединения 10 восстановлением 8,0 г (47,0 ммоль) (3-фтор-2-нитрофенил)метиламина с помощью SnCl22H2O. Полученный таким путем продукт представляет собой красное масло. Выход: 4,5 г (68%). Масс-спектроскопия: [М+Н]+=141. в) 4-фтор-1-метил-1,3-дигидробензоимидазол-2-он Указанное соединение получают аналогично стадии 10 в) получения промежуточного соединения 10 из 4,5 г (32,1 ммоль) 3-фтор-N-1-метилбензол-1,2-диамина. Полученный таким путем продукт представляет собой коричневое твердое вещество. Выход: 1,4 г (26%). Масс-спектроскопия: [М+Н]+=167. г) 4-фтор-1-метил-3-(4-метил-4-нитропентил)-1,3-дигидробензоимидазол-2-он Указанное соединение получают аналогично стадии 10 г) получения промежуточного соединения 10 из 1,4 г (8,42 ммоль) 4-фтор-1-метил-1,3-дигидробензоимидазол-2-она. Полученный таким путем продукт представляет собой желтое масло. Выход: 1,7 г (68%). Масс-спектроскопия: [М+Н]+=296. д) 3-(4-амино-4-метилпентил)-4-фтор-1-метил-1,3-дигидробензоимидазол-2-он Раствор 2 г (6,7 ммоль) 4-фтор-1-метил-3-(4-метил-4-нитропентил)-1,3-дигидробензоимидазол-2 она в метаноле гидрируют в присутствии никеля Ренея при давлении водорода 3 бар. После отделения катализатора добавляют соляную кислоту в диэтиловом эфире. Выпавший в осадок гидрохлорид отфильтровывают и сушат. Выход: 1,5 г (83%, гидрохлорид). Интервал температур плавления: 230-232 С. Масс-спектроскопия: [М+Н]+=303. Синтез конечных соединений. Общая методика 1. 1 ммоль глиоксальальдегида или -ацеталя и 1 ммоль амина в течение 30 мин перемешивают при 50 С в 5 мл тетрагидрофурана. Затем охлаждают до 0 С и в атмосфере аргона по каплям добавляют 1,5 мл 2-молярного раствора боргидрида лития в тетрагидрофуране. Далее перемешивают в течение 30 мин при 0 С, смешивают с 10 мл дихлорметана и 3 мл воды, перемешивают еще в течение часа при комнатной температуре и затем фильтруют через кизельгур, элюируя при этом дихлорметаном. Из элюата удаляют растворитель и остаток при необходимости очищают хроматографией. Полученный таким путем бензиловый эфир растворяют в метаноле и гидрируют в присутствии палладия на угле (10%-ного) в качестве катализатора при давлении 2,5 бар и комнатной температуре. После этого катализатор отделяют и сырой продукт очищают хроматографией (обращенная фаза, градиентное элюирование смесью ацетонитрил/вода с 0,1% трифторуксусной кислоты) либо выкристаллизовывают в ацетонитриле.- 17012727 Общая методика 2. 1 ммоль глиоксальальдегида или -ацеталя и 1 ммоль амина суспендируют в 5 мл этанола и нагревают до 70 С. Полученный раствор в течение часа перемешивают при 70 С, после чего охлаждают до комнатной температуры. После добавления 113 мг (3 ммоль) боргидрида натрия перемешивают в течение 3 ч при комнатной температуре, смешивают с 0,7 мл насыщенного раствора карбоната калия и перемешивают еще в течение 30 мин. Далее фильтруют через оксид алюминия (основный), вновь промывают смесью дихлорметан/метанол в соотношении 15:1, концентрируют и хроматографируют (силикагель, дихлорметан с 0-10% смеси метанол/аммиак в соотношении 9:1). Полученное таким путем бензильное соединение растворяют в 10 мл метанола и гидрируют в присутствии палладия на угле в качестве катализатора при давлении водорода 1 бар. После этого катализатор отфильтровывают и фильтрат концентрируют. Пример 1: 8-2-[1,1-диметил-3-(6-метил-2-оксо-2,3-дигидробензоимидазол-1-ил)пропиламино]-1 гидроксиэтил)-6-гидрокси-4 Н-бензох[1,4]оксазин-3-он Указанное в заголовке соединение получают в соответствии с общей методикой 1 из 357 мг Указанное в заголовке соединение получают в соответствии с общей методикой 1 из 357 мг 357 мг (1 ммоль) 6-бензилокси-8-(2-этокси-1,2-дигидроксиэтил)-4 Н-бензо[1,4]оксазин-3-она и 287 мг (1 ммоль) 3-(4-амино-4-метилпентил)-3 Н-бензооксазол-2-она подвергают взаимодействию между собой в соответствии с общей методикой 1. После гидрогенолитического отщепления бензильной защитной группы получают масло, из которого размешиванием в смеси ацетон/диэтиловый эфир получают требуемый продукт. Выход: 161 мг (29%, трифторацетат). Масс-спектроскопия: [М+Н]+=442. Пример 4: 8-2-[1,1-диметил-3-(3-метил-2-оксо-2,3-дигидробензоимидазол-1-ил)пропиламино]-1 гидроксиэтил-6-гидрокси-4 Н-бензо[1,4]оксазин-3-он Указанное в заголовке соединение получают в соответствии с общей методикой 2 из 357 мг Требуемое указанное в заголовке соединение получают в соответствии с общей методикой 2 из 357 мг (1 ммоль) 6-бензилокси-8-(2-этокси-1,2-дигидроксиэтил)-4 Н-бензо[1,4]оксазин-3-она и 219 мг Указанное в заголовке соединение получают в соответствии с общей методикой 2 из 357 мг Указанное в заголовке соединение получают в соответствии с общей методикой 1 из 357 мг(1 ммоль) 1-(3-амино-3-метилбутил)-1,3-дигидробензоимидазол-2-она в течение 1,5 ч перемешивают при 80 С в 15 мл этанола. После охлаждения до комнатной температуры добавляют 80 мг (2 ммоль) боргидрида натрия и перемешивают в течение 2 ч. Затем реакционную смесь подкисляют 3 мл 1-молярного раствора соляной кислоты, перемешивают в течение 10 мин и подщелачивают раствором карбоната калия. Далее экстрагируют этилацетатом, органические фазы сушат над сульфатом натрия и отгоняют растворитель. Остаток очищают хроматографией на силикагелевой колонке (градиентное элюирование смесью дихлорметан/метанол). Таким путем получают бежевое твердое вещество. Выход: 340 мг (68%). Масс-спектроскопия [М+Н]+=503. б) 7-2-[1,1-диметил-3-(2-оксо-2,3-дигидробензоимидазол-1-ил)пропиламино]-1-гидроксиэтил-5 гидрокси-3 Н-бензооксазол-2-он 320 мг (0,64 ммоль) 5-бензилокси-7-2-[1,1-диметил-3-(2-оксо-2,3-дигидробензоимидазол-1 ил)пропиламино]-1-гидроксиэтил-3 Н-бензооксазол-2-она растворяют в 12 мл метанола и гидрируют в присутствии палладия на угле в качестве катализатора при комнатной температуре. Затем катализатор отделяют и из фильтрата удаляют растворитель. Таким путем получают бежевое твердое вещество. Выход: 150 мг (57%). Масс-спектроскопия [М-Н]+=411. а) 1-(3-амино-3-метилбутил)-3-бензил-1,3-дигидробензоимидазол-2-он трет-Бутиловый эфир [1,1-диметил-3-(2-оксо-2,3-дигидробензоимидазол-1-ил)пропил]карбаминовой кислоты, бензилхлорид и трет-бутилат калия оставляют перемешиваться на ночь при комнатной температуре в диметилсульфоксиде. Полученный в результате этого взаимодействия в качестве продукта алкилирования третбутиловый эфир [3-(3-бензил-2-оксо-2,3-дигидробензоимидазол-1-ил)-1,1-диметилпропил]карбаминовой кислоты для удаления защитной группы обрабатывают затем трифторуксусной кислотой в дихлорметане. Масс-спектроскопия [М+Н]+=310. б) 8-(2-[3-(3-бензил-2-оксо-2,3-дигидробензоимидазол-1-ил)-1,1-диметилпропиламино]-1-гидроксиэтил-6-гидрокси-2,2-диметил-4 Н-бензо[1,4]оксазин-3-он 385 мг (1 ммоль) 6-бензилокси-8-(2-этокси-2-гидроксиацетил)-2,2-диметил-4 Н-бензо[1,4]оксазин-3 она и 423 мг (1 ммоль) 1-(3-амино-3-метилбутил)-3-бензил-1,3-дигидробензоимидазол-2-она подвергают взаимодействию между собой и переработке в соответствии с общей методикой 1. Выход: 39 мг (6%, трифторацетат). Масс-спектроскопия [М+Н]+=545. Пример 10: 8-2-[3-(3-циклопропилметил-2-оксо-2,3-дигидробензоимидазол-1-ил)-1,1-диметилпропиламино]-1-гидроксиэтил-6-гидрокси-4 Н-бензо[1,4]оксазин-3-он а) 1-(3-амино-3-метилбутил)-3-циклопропилметил-1,3-дигидробензоимидазол-2-он Взаимодействием трет-бутилового эфира [1,1-диметил-3-(2-оксо-2,3-дигидробензоимидазол-1 ил)пропил]карбаминовой кислоты с (хлорметил)циклопропаном и трет-бутилатом калия в диметилсульфоксиде при комнатной температуре получают трет-бутиловый эфир [3-(3-циклопропилметил-2-оксо 2,3-дигидробензоимидазол-1-ил)-1,1-диметилпропил]карбаминовой кислоты. Затем от полученного продукта алкилирования обработкой трифторуксусной кислотой в дихлорметане отщепляют защитную группу. Масс-спектроскопия [М+Н]+=274. б) 8-2-[3-(3-циклопропилметил-2-оксо-2,3-дигидробензоимидазол-1-ил)-1,1-диметилпропиламино]-1-гидроксиэтил-6-гидрокси-4 Н-бензо[1,4]оксазин-3-он 165 мг (0,5 ммоль) 6-бензилокси-8-(2-этокси-2-гидроксиацетил)-4 Н-бензо[1,4]оксазин-3-она и 194 мг (0,5 ммоль) 1-(3-амино-3-метилбутил)-3-циклопропилметил-1,3-дигидробензоимидазол-2-она растворяют в 8 мл этанола и в течение 1,5 ч перемешивают при 80 С. Затем смеси дают охладиться до комнатной температуры, после чего смешивают с 19 мг (0,5 ммоль) боргидрида натрия и перемешивают еще в течение 2 ч. Далее реакционную смесь подкисляют 1-молярной соляной кислотой, перемешивают в течение 10 мин и подщелачивают раствором карбоната калия. После этого добавляют этилацетат и фильтрацией через кизельгур отделяют водную фазу. Из органической фазы удаляют растворитель и остаток суспендируют в смеси ацетонитрил/вода. Последующее дебензилирование осуществляют аналогично общей методике 1. Выход: 77 мг (26%, трифторацетат). Масс-спектроскопия [М+Н]+=481. Пример 11: 5-2-[1,1-диметил-3-(2-оксо-2,3-дигидробензоимидазол-1-ил)пропиламино]-1-гидроксиэтил-7-гидрокси-1 Н-хинолин-2-он- 20012727 1-(3-амино-3-метилбутил)-1,3-дигидробензоимидазол-2-она и 0,4 мл изопропанола и в течение 30 мин подвергают при 135 С воздействию СВЧ-излучения. Затем реакционную смесь смешивают с этилацетатом и 0,5-молярной винной кислотой, что сопровождается выпадением в осадок твердого вещества. Это твердое вещество и водную фазу отделяют и добавляют воду, дихлорметан и небольшое количество метанола. Водную фазу экстрагируют дихлорметаном, объединенные дихлорметановые фазы сушат и удаляют растворитель. Остаток смешивают с соляной кислотой в этилацетате, отгоняют растворитель и остаток размешивают в этилацетате. Таким путем получают белое твердое вещество. Выход: 87 мг (38%, гидрохлорид). Масс-спектроскопия: [М+Н]+=513. б) 5-2-[1,1-диметил-3-(2-оксо-2,3-дигидробензоимидазол-1-ил)пропиламино]-1-гидроксиэтил-7 гидрокси-1 Н-хинолин-2-он 71 мг (0,129 ммоль) гидрохлорида 7-бензилокси-5-2-[1,1-диметил-3-(2-оксо-2,3-дигидробензоимидазол-1-ил)пропиламино]-1-гидроксиэтил-1 Н-хинолин-2-она растворяют в метаноле и гидрируют в присутствии палладия на угле в качестве катализатора при нормальном давлении. Затем катализатор отделяют путем фильтрации через целит и из фильтрата удаляют растворитель. Размешиванием остатка с этилацетатом получают продукт в виде твердого вещества. Выход: 31 мг (52%, гидрохлорид). Масс-спектроскопия: [М+Н]+=423. Пример 12: 6-гидрокси-8-1-гидрокси-2-[4-(4-метокси-2-оксо-2,3-дигидробензоимидазол-1-ил)-1,1 диметилбутиламино]этил-4 Н-бензо[1,4]оксазин-3-он а) 6-бензилокси-8-1-гидрокси-2-[4-(4-метокси-2-оксо-2,3-дигидробензоимидазол-1-ил)-1,1 диметилбутиламино]этил-4 Н-бензо[1,4]оксазин-3-он 200 мг (0,667 ммоль) гидрохлорида 1-(3-амино-3-метилбутил)-4-метокси-1,3-дигидробензоимидазол-2 она и 120 мкл (0,733 ммоль) триэтиламина в 5 мл ТГФ перемешивают в течение 30 мин, после чего смешивают с 200 мг (0,666 ммоль) 6-бензилокси-8-(2-этокси-2-гидроксиацетил)-4 Н-бензо[1,4]оксазин-3-она. Через 2 ч реакционную смесь охлаждают до 10 С и добавляют 60 мг (2,76 ммоль) боргидрида лития. Затем смесь перемешивают в течение часа при комнатной температуре, после чего охлаждают до 10 С и смешивают с 15 мл воды. Органическую фазу экстрагируют дихлорметаном, объединенные органические экстракты сушат и удаляют растворитель. Оставшееся масло растворяют в этилацетате и добавлением соляной кислоты в этилацетате значение рН устанавливают на 2. Затем отгоняют растворитель и остаток размешивают со смесью дихлорметан/диэтиловый эфир. Выход: 130 мг (35%, гидрохлорид). Масс-спектроскопия: [М+Н]+=561. б) 6-гидрокси-8-1-гидрокси-2-[4-(4-метокси-2-оксо-2,3-дигидробензоимидазол-1-ил)-1,1-диметилбутиламино]этил-4 Н-бензо[1,4]оксазин-3-он 130 мг (0,213 ммоль) гидрохлорида 6-бензилокси-8-1-гидрокси-2-[4-(4-метокси-2-оксо-2,3 дигидробензоимидазол-1-ил)-1,1-диметилбутиламино]этил-4 Н-бензо[1,4]оксазин-3-она растворяют в метаноле и гидрируют в присутствии палладия на угле в качестве катализатора при нормальном давлении. После этого катализатор отделяют фильтрацией через целит, из фильтрата удаляют растворитель и остаток размешивают с этилацетатом. Таким путем получают продукт в виде твердого вещества. Выход: 50 мг (45%, гидрохлорид). Масс-спектроскопия: [М+Н]=471. Пример 13: 6-гидрокси-8-1-гидрокси-2-[4-(5-метокси-3-метил-2-оксо-2,3-дигидробензоимидазол-1 ил)-1,1-диметилбутиламино]этил-4 Н-бензо[1,4]оксазин-3-он Указанное в заголовке соединение получают аналогично примеру 13 из 1-(3-амино-3-метилбутил)5-метокси-3-метил-1,3-дигидробензоимидазол-2-она и 6-бензилокси-8-(2-этокси-2-гидроксиацетил)-4 Нбензо[1,4]оксазин-3-она. Масс-спектроскопия: [М+Н]+=485.(0,754 ммоль) гидрохлорида 3-(4-амино-4-метилпентил)-5-фтор-1-метил-1,3 дигидробензоимидазол-2-она и 237 мг (0,663 ммоль) 6-бензилокси-8-(2-этокси-2-гидроксиацетил)-4 Нбензо[1,4]оксазин-3-она подвергают взаимодействию между собой аналогично примеру 13 а. Продукт очищают затем хроматографией на силикагелевой колонке. Выход: 164 мг (44%). Масс-спектроскопия: [М+Н]+=563. б) 8-2-[4-(6-фтор-3-метил-2-оксо-2,3-дигидробензоимидазол-1-ил)-1,1-диметилбутиламино]-1 гидроксиэтил-6-гидрокси-4 Н-бензо[1,4]оксазин-3-он 164 мг (0,274 ммоль) 6-бензилокси-8-2-[4-(6-фтор-3-метил-2-оксо-2,3-дигидробензоимидазол-1 ил)-1,1-диметилбутиламино]-1-гидроксиэтил-4 Н-бензо[1,4]оксазин-3-она дебензилируют аналогично примеру 13 б). Для очистки сырой продукт размешивают с этилацетатом. Масс-спектроскопия: [М+Н]+=473. Пример 15: 8-2-[4-(7-фтор-3-метил-2-оксо-2,3-дигидробензоимидазол-1-ил)-1,1-диметилбутиламино]-1-гидроксиэтил-6-гидрокси-4 Н-бензо[1,4]оксазин-3-он(0,663 ммоль) гидрохлорида 3-(4-амино-4-метилпентил)-4-фтор-1-метил-1,3 дигидробензоимидазол-2-она и 237 мг (0,663 ммоль) 6-бензилокси-8-(2-этокси-2-гидроксиацетил)-4 Нбензо[1,4]оксазин-3-она подвергают взаимодействию между собой аналогично примеру 13 а). Продукт очищают затем хроматографией на силикагелевой колонке. Выход: 68 мг (17%). Масс-спектроскопия: [М+Н]+=563. б) 8-2-[4-(7-фтор-3-метил-2-оксо-2,3-дигидробензоимидазол-1-ил)-1,1-диметилбутиламино]-1 гидроксиэтил-6-гидрокси-4 Н-бензо[1,4]оксазин-3-он 68 мг (0,121 ммоль) 6-бензилокси-8-2-[4-(7-фтор-3-метил-2-оксо-2,3-дигидробензоимидазол-1-ил)1,1-диметилбутиламино]-1-гидроксиэтил-4 Н-бензо[1,4]оксазин-3-она дебензилируют аналогично примеру 13 б). Для очистки сырой продукт размешивают в этилацетате. Выход: 60 мг. Масс-спектроскопия: [М+Н]+=474. В качестве примера лекарственных форм, пригодных для введения в организм в их составе соединений формулы 1, можно назвать таблетки, капсулы, суппозитории, растворы, порошки и т.д. На долю фармацевтически активного(-ых) соединения(-ий) в таких лекарственных формах должно приходиться в каждом случае от 0,05 до 90 мас.%, предпочтительно от 0,1 до 50 мас.%, от общей массы препарата. Соответствующие таблетки можно изготавливать, например, смешением действующего вещества или действующих веществ с известными вспомогательными веществами, например инертными разбавителями, такими как карбонат кальция, фосфат кальция или лактоза, разрыхлителями, такими как кукурузный крахмал или альгиновая кислота, связующими, такими как крахмал или желатин, смазывающими веществами, такими как стеарат магния или тальк, и/или средствами для обеспечения депо-эффекта, такими как карбоксиметилцеллюлоза, ацетофталат целлюлозы или поливинилацетат. Таблетки могут также состоять из нескольких слоев. Соответствующим образом можно изготавливать драже нанесением на полученные аналогично таблеткам ядра покрытий из обычно применяемых в этих целях материалов, например коллидона или шеллака, гуммиарабика, талька, диоксида титана или сахара. Ядра драже для обеспечения депо-эффекта или во избежание несовместимости также можно изготавливать многослойными. Равным образом и оболочка драже также может состоять для обеспечения депо-эффекта из нескольких слоев, при этом можно использовать вспомогательные вещества, указанные выше для таблеток.- 22012727 В состав микстур с предлагаемыми в изобретении действующими веществами, соответственно комбинациями действующих веществ, дополнительно могут входить также подслащивающее вещество, такое как сахарин, цикламат, глицерин или сахар, а также улучшитель вкуса, например ароматизатор, такой как ванилин или апельсиновый экстракт. Помимо этого, микстуры могут содержать суспендирующие вспомогательные вещества или загустители, такие как натрийкарбоксиметилцеллюлоза, смачиватели, например продукты конденсации жирных спиртов с этиленоксидом, или защитные вещества (консерванты), такие как n-гидроксибензоаты. Растворы приготавливают по известной технологии, например, с добавлением придающих изотоничность агентов, консервантов, таких как n-гидроксибензоаты, или стабилизаторов, таких как соли этилендиаминтетрауксусной кислоты с щелочными металлами, и при необходимости с применением эмульгаторов и/или диспергаторов, при этом, например, при применении воды в качестве разбавителя при необходимости можно использовать органические растворители в качестве гидротропных солюбилизаторов, соответственно вспомогательных растворителей, и затем разливают по бутылкам для инъекций, ампулам или бутылкам для инфузии. Капсулы, содержащие одно или несколько действующих веществ, соответственно комбинации действующих веществ, можно изготавливать, например, смешением действующих веществ с инертными носителями, такими как лактоза или сорбит, и расфасовыванием полученной смеси в желатиновые капсулы. Соответствующие суппозитории можно изготавливать, например, смешением действующего вещества или действующих веществ с предусмотренными для этой цели носителями, такими как нейтральные жиры или полиэтиленгликоль, соответственно его производные. В качестве примера вспомогательных веществ, которые можно использовать при изготовлении лекарственных форм, можно назвать воду, фармацевтически приемлемые (безвредные) органические растворители, такие как парафины (например, фракции минерального масла), масла растительного происхождения (например, арахисовое или кунжутное масло), моно- или полифункциональные спирты (например, этанол или глицерин), носители, такие как природная мука горных пород (например, каолин,глиноземы, тальк, мел), синтетическая мука горных пород (например, высокодисперсная кремниевая кислота и силикаты), сахара (например, тростниковый, молочный и виноградный сахар), эмульгаторы (например, лигнин, сульфитный щелок, метилцеллюлоза, крахмал и поливинилпирролидон) и скользящие вещества (например, стеарат магния, тальк, стеариновая кислота и лаурилсульфат натрия). В состав предназначенных для приема внутрь таблеток помимо вышеуказанных носителей можно,как очевидно, включать также такие добавки, как, например, цитрат натрия, карбонат кальция и дикальцийфосфат, совместно с различного рода наполнителями, такими как крахмал, предпочтительно картофельный крахмал, желатин и т.п. Помимо этого, при производстве таблеток могут использоваться также скользящие вещества, такие как стеарат магния, лаурилсульфат натрия и тальк. В случае водных суспензий действующие вещества помимо вышеописанных вспомогательных веществ можно также смешивать с различного рода улучшителями вкуса или красителями. При предусмотренном согласно изобретению применении соединений формулы 1 для терапии заболеваний дыхательных путей наиболее предпочтительно использовать вводимые в организм путем ингаляции лекарственные формы, соответственно фармацевтические композиции. В качестве примера ингалируемых лекарственных форм можно назвать ингаляционные порошки, дозированные аэрозоли с пропеллентом или ингаляционные растворы без пропеллента. В соответствии с настоящим изобретением под выражением "ингаляционные растворы без пропеллента" подразумеваются также концентраты или стерильные, готовые к применению ингаляционные растворы. Подобные используемые согласно настоящему изобретению лекарственные формы более подробно рассмотрены в последующей части описания. В применяемых согласно изобретению ингаляционных порошках соединения формулы 1 могут содержаться либо индивидуально, либо в смеси с приемлемыми физиологически безвредными вспомогательными веществами. Если действующие вещества формулы 1 содержатся в предлагаемых в изобретении ингаляционных порошках в смеси с физиологически безвредными вспомогательными веществами,то для получения таких ингаляционных порошков могут использоваться следующие физиологически безвредные вспомогательные вещества: моносахариды (например, глюкоза или арабиноза), дисахариды(например, лактоза, сахароза, мальтоза), олиго- и полисахариды (например, декстраны), полиспирты (например, сорбит, маннит, ксилит), соли (например, хлорид натрия, карбонат кальция) либо смеси этих вспомогательных веществ между собой. Предпочтительно использовать моно- или дисахариды, при этом особенно предпочтительно применение лактозы или глюкозы, прежде всего, но не исключительно, в виде их гидратов. Особенно предпочтительным согласно изобретению является применение в качестве вспомогательного вещества лактозы, наиболее предпочтительно моногидрата лактозы. Максимальный средний размер частиц вспомогательных веществ, применяемых в составе предлагаемых в изобретении ингаляционных порошков, составляет вплоть до 250 мкм, предпочтительно от 10 до 150 мкм, наиболее предпочтительно от 15 до 80 мкм. При определенных условиях может оказаться целесообразным примешивать к указанным выше вспомогательным веществам их же фракции с мень- 23012727 шим средним размером частиц, составляющим от 1 до 9 мкм. Подобные вспомогательные вещества с меньшим размером частиц также выбирают из описанной выше группы вспомогательных веществ, применяемых в ингаляционных порошках. Помимо этого, при получении предлагаемых в изобретении ингаляционных порошков предлагается примешивать к смеси вспомогательных веществ микронизированное действующее вещество формулы 1, средний размер частиц которого предпочтительно составляет от 0,5 до 10 мкм, наиболее предпочтительно от 1 до 5 мкм. Способы получения предлагаемых в изобретении ингаляционных порошков путем размола и микронизации компонентов с последующим их смешением известны из уровня техники. Для введения предлагаемых в изобретении ингаляционных порошков в организм могут использоваться известные из уровня техники ингаляторы. В предлагаемых в изобретении препаратах с пропеллентом для аэрозольной ингаляции действующие вещества формулы 1 могут присутствовать в растворенном или в диспергированном в пропелленте виде. Используемые для получения препаратов для аэрозольной ингаляции пропелленты известны из уровня техники. Пригодные для этой цели пропелленты выбирают из группы, включающей углеводороды, такие как н-пропан, н-бутан или изобутан, и галогенированные углеводороды, такие как фторированные производные метана, этана, пропана, бутана, циклопропана или циклобутана. Указанные выше пропелленты могут при этом использоваться индивидуально либо в виде их смесей. Наиболее предпочтительными пропеллентами являются галогенированные производные алкана, выбранные из группы,включающей TG134a и TG227, а также их смеси. В состав препаратов с пропеллентом для аэрозольной ингаляции могут входить также другие компоненты, такие как сорастворители, стабилизаторы, поверхностно-активные вещества (ПАВ), антиокислители, смазывающие вещества, а также средства для регулирования значения рН. Все такие компоненты известны из уровня техники. Для введения описанных выше препаратов с пропеллентом в организм путем аэрозольной ингаляции могут использоваться известные из уровня техники ингаляторы (ингаляторы с дозировочной шкалой). Предлагаемые в изобретении действующие вещества формулы 1 можно также вводить в организм в составе ингаляционных растворов и ингаляционных суспензий без пропеллента. В качестве таких растворов могут использоваться водные или спиртовые, предпочтительно этанольные, растворы. Растворителем при этом может служить только вода либо смесь воды с этанолом. Относительное содержание этанола в пересчете на количество воды не ограничено какими-либо конкретными пределами, предпочтительно, однако, чтобы максимальное содержание этанола составляло до 70 об.%, прежде всего до 60 об.%, наиболее предпочтительно до 30 об.%. Остальное количество, недостающее до 100 об.%, приходится на воду. Значение рН растворов или суспензий, содержащих действующие вещества формулы 1,устанавливают с помощью пригодных для этой цели кислот на 2-7, предпочтительно на 2-5. Для регулирования значения рН с целью его установки на указанные выше значения могут использоваться кислоты из числа неорганических или органических кислот. В качестве примера предпочтительных в этом отношении неорганических кислот можно назвать соляную кислоту, бромисто-водородную кислоту, азотную кислоту, серную кислоту и/или фосфорную кислоту. В качестве примера наиболее пригодных для применения в указанных целях органических кислот можно назвать аскорбиновую кислоту, лимонную кислоту, яблочную кислоту, винную кислоту, малеиновую кислоту, янтарную кислоту, фумаровую кислоту, уксусную кислоту, муравьиную кислоту и/или пропионовую кислоту, а также другие кислоты. Предпочтительными неорганическими кислотами являются соляная кислота и серная кислота. Возможно также использование кислот, которые с одним из действующих веществ уже образуют кислотноаддитивную соль. Среди органических кислот предпочтительны аскорбиновая кислота, фумаровая кислота и лимонная кислота. При определенных условиях допустимо использование и смесей указанных кислот, прежде всего в случае тех кислот, которые наряду с их повышающими кислотность свойствами обладают и иными свойствами, например могут использоваться в качестве вкусовых веществ, антиокислителей или комплексообразователей, как, например, лимонная кислота или аскорбиновая кислота. Для регулирования значения рН наиболее предпочтительно согласно изобретению использовать соляную кислоту. Согласно изобретению можно отказаться от включения в состав таких препаратов эдитиновой кислоты (ЭДТК) или одной из ее известных солей, в частности эдетата натрия, в качестве стабилизатора или комплексообразователя. Однако в других вариантах предусматривается использование этого(-их) соединения(-ий). В одном из таких предпочтительных вариантов, в котором предусмотрено применение эдетата натрия, его концентрация в растворе составляет менее 100 мг на 100 мл, предпочтительно менее 50 мг на 100 мл, наиболее предпочтительно менее 20 мг на 100 мл. В целом же предпочтительны такие ингаляционные растворы, содержание в которых эдетата натрия составляет от 0 до 10 мг на 100 мл. К не содержащим пропеллент ингаляционным растворам можно добавлять сорастворители и/или другие вспомогательные вещества. В качестве таких сорастворителей предпочтительно использовать такие, которые содержат гидроксильные группы или иные полярные группы, например спирты, прежде всего изопропиловый спирт, гликоли, прежде всего пропиленгликоль, полиэтиленгликоль, полипропи- 24012727 ленгликоль, гликолевый эфир, глицерин, полиоксиэтиленовые спирты и эфиры полиоксиэтилена и жирных кислот. Под вспомогательными веществами и добавками в данном контексте подразумевается любое фармакологически приемлемое вещество, которое не является действующим веществом, но которое можно включать в состав препарата совместно с действующим(-и) веществом(-ами) в фармакологически приемлемом растворителе для улучшения качественных характеристик такого препарата. Эти вещества не должны проявлять никакого или с учетом целевого терапевтического эффекта никакого скольконибудь значительного или, по меньшей мере, никакого нежелательного фармакологического действия. К подобным вспомогательным веществам и добавкам относятся, например, поверхностно-активные вещества, такие как соевый лецитин, олеиновая кислота, сорбитановый эфир, в частности полисорбаты, поливинилпирролидон, прочие стабилизаторы, комплексообразователи, антиокислители и/или консерванты,обеспечивающие сохранность готового лекарственного препарата или позволяющие продлить срок его годности, вкусовые вещества, витамины и/или иные известные из уровня техники добавки. К таким добавкам относятся также фармакологически безвредные соли, такие, например, как хлорид натрия, в качестве придающих изотоничность агентов. К числу предпочтительных вспомогательных веществ относятся антиокислители, такие, например,как аскорбиновая кислота, если только она уже не используется для регулирования значения рН, витамин А, витамин Е, токоферолы и аналогичные встречающиеся в организме человека витамины и провитамины. Консерванты могут использоваться для защиты лекарственного препарата от заражения патогенными микроорганизмами. В качестве подобных консервантов могут использоваться известные из уровня техники вещества, прежде всего цетилпиридинийхлорид, бензалконийхлорид или бензойная кислота,соответственно бензоаты, такие как бензоат натрия, в известных из уровня техники концентрациях. Концентрация указанных выше консервантов предпочтительно должна составлять до 50 мг на 100 мл раствора, наиболее предпочтительно от 5 до 20 мг на 100 мл раствора. Предпочтительные лекарственные препараты помимо растворителя, которым является вода, и действующего вещества формулы 1 содержат также только бензалконийхлорид и эдетат натрия. В другом предпочтительном варианте предлагается полностью отказаться от применения эдетата натрия. Назначаемая доза предлагаемых в изобретении соединений в существенной степени зависит, как очевидно, от метода их введения в организм и подлежащего лечению заболевания. При введении соединений формулы 1 в организм путем ингаляции выраженный эффект от их применения проявляется уже при их введении в организм в дозах, лежащих в микрограммовом диапазоне. Однако соединения формулы 1 целесообразно применять и в дозах, превышающих микрограммовый диапазон. При этом соответствующая доза может, например, лежать в миллиграммовом диапазоне. Еще одним объектом настоящего изобретения являются описанные выше фармацевтические композиции (лекарственные препараты), отличающиеся тем, что они содержат соединение формулы 1 как таковое, наиболее предпочтительно описанные выше фармацевтические композиции для введения в организм путем ингаляции. Ниже изобретение проиллюстрировано на примерах, в которых представлены составы некоторых лекарственных форм и которые не ограничивают его объем. А) Раствор в ампулах Действующее вещество при собственном значении рН или при определенных условиях при рН от 5,5 до 6,5 растворяют в воде и смешивают с хлоридом натрия в качестве придающего изотоничность агента. От полученного раствора отфильтровывают пирогенные продукты и фильтрат в асептических условиях разливают по ампулам, которые затем стерилизуют и запаивают. Такие ампулы могут содержать 5, 25 и 50 мг действующего вещества. Б) Дозированный аэрозоль (суспензия) Суспензию заливают в обычный аэрозольный баллончик, снабженный дозирующим клапаном. Выдаваемая за однократное нажатие на такой клапан порция суспензии предпочтительно составляет 50 мкл. При необходимости действующее вещество можно вводить в организм и в более высоких дозах. В) Дозированный аэрозоль (раствор)- 25012727 Раствор такого состава приготавливают по обычной технологии смешением отдельных компонентов. Г) Ингаляционный порошок Ингаляционный порошок указанного состава получают по обычной технологии смешением отдельных компонентов. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединения формулы 1R5 обозначает Н или C1-С 6 алкил,необязательно в виде отдельных энантиомеров, смесей отдельных энантиомеров или рацематов, необязательно в виде их кислотно-аддитивных солей с фармакологически безвредными кислотами, а также необязательно в виде сольватов и/или гидратов. 2. Соединения формулы 1 по п.1, в которой n обозначает 2 или 3, m обозначает 1, 2 или 3, X обозначает NR2 или О, А обозначает СО, В обозначает группу с двумя связями, выбранную из О, CR3R4-О, NR5,CR3R4-NR5, CH=CH или СН 2-СН 2, R1 обозначает Н, метил, этил, пропил, CF3, CH2F, CH2CF3, фтор, хлор,бром, ОН, метоксигруппу, этоксигруппу, СООН или СООМе, R2 обозначает Н, метил, этил или пропил,R3 обозначает Н, метил, этил или пропил, R4 обозначает Н, метил, этил или пропил и R5 обозначает Н,метил, этил или пропил, необязательно в виде отдельных энантиомеров, смесей отдельных энантиомеров или рацематов, необязательно в виде их кислотно-аддитивных солей с фармакологически безвредными кислотами, а также необязательно в виде сольватов и/или гидратов. 3. Соединения формулы 1 по любому из пп.1-2, в которой n обозначает 2 или 3, m обозначает 1, 2 или 3, X обозначает NR2 или О, А обозначает СО, В обозначает группу с двумя связями, выбранную из СН 2-О, СН=СН или СН 2-СН 2, R1 обозначает Н, метил, этил, пропил, CF3, CH2F, CH2CF3, фтор, хлор,бром, ОН, метоксигруппу, этоксигруппу, СООН или СООМе и R2 обозначает Н, метил, этил или пропил,необязательно в виде отдельных энантиомеров, смесей отдельных энантиомеров или рацематов, необязательно в виде их кислотно-аддитивных солей с фармакологически безвредными кислотами, а также необязательно в виде сольватов и/или гидратов. 4. Соединения формулы 1 по любому из пп.1-3, в которой n обозначает 2 или 3, m обозначает 1 или 2, X обозначает NR2 или О, А обозначает СО, В обозначает группу с двумя связями, выбранную из СН 2 О, СН=СН или СН 2-СН 2, R1 обозначает Н, метил, этил, пропил, CF3, CH2F или CH2CF3 и R2 обозначает Н,метил, этил или пропил, необязательно в виде отдельных энантиомеров, смесей отдельных энантиомеров или рацематов, необязательно в виде их кислотно-аддитивных солей с фармакологически безвредными кислотами, а также необязательно в виде сольватов и/или гидратов. 5. Соединения формулы 1 по одному из пп.1-4, в которой n обозначает 2 или 3, m обозначает 1, X обозначает NR2 или О, А обозначает СО, В обозначает группу с двумя связями, выбранную из СН 2-О,СН=СН или СН 2-СН 2, R1 обозначает Н, метил или CF3 и R2 обозначает Н или метил, необязательно в виде отдельных энантиомеров, смесей отдельных энантиомеров или рацематов, необязательно в виде их кислотно-аддитивных солей с фармакологически безвредными кислотами, а также необязательно в виде сольватов и/или гидратов. 6. Соединения формулы 1 по любому из пп.1-5, в которой n обозначает 2 или 3, m обозначает 1, X обозначает NR2, О, А обозначает СО, В обозначает группу с двумя связями, выбранную из СН 2-O или СН=СН, R1 обозначает Н, метил или CF3 и R2 обозначает Н или метил, необязательно в виде отдельных- 26012727 энантиомеров, смесей отдельных энантиомеров или рацематов, необязательно в виде их кислотноаддитивных солей с фармакологически безвредными кислотами, а также необязательно в виде сольватов и/или гидратов. 7. Соединения формулы 1 по любому из пп.1-6, в которой n обозначает 2, m обозначает 1, X обозначает NH, А обозначает СО, В обозначает группу с двумя связями СН 2-О, R1 обозначает Н, метил илиCF3, необязательно в виде отдельных энантиомеров, смесей отдельных энантиомеров или рацематов,необязательно в виде их кислотно-аддитивных солей с фармакологически безвредными кислотами, а также необязательно в виде сольватов и/или гидратов. 8. Соединения формулы 1 по любому из пп.1-7, отличающиеся тем, что они представлены в виде одной из их кислотно-аддитивных солей с фармакологически безвредными кислотами, выбранной из группы, включающей гидрохлорид, гидробромид, гидроиодид, гидросульфат, гидрофосфат, гидрометансульфонат, гидронитрат, гидромалеат, гидроацетат, гидробензоат, гидроцитрат, гидрофумарат, гидротартрат, гидрооксалат, гидросукцинат, гидробензоат и гидро-n-толуолсульфонат. 9. Соединения формулы 1 по любому из пп.1-8, отличающиеся тем, что они представлены в виде Rэнантиомеров формулы R-1 10. Применение соединения формулы 1 по любому из пп.1-9 в качестве лекарственных средств. 11. Применение соединений формулы 1 по любому из пп.1-9 для приготовления лекарственного средства, предназначенного для лечения заболеваний дыхательных путей. 12. Фармацевтическая композиция, отличающаяся тем, что она содержит соединение формулы 1 по любому из пп.1-9.
МПК / Метки
МПК: C07D 401/12, C07D 413/12, A61P 11/00, A61K 31/538
Метки: качестве, заболеваний, соединения, дыхательных, бетамиметиков, путей, гетероарильные, лечения
Код ссылки
<a href="https://eas.patents.su/28-12727-geteroarilnye-soedineniya-v-kachestve-betamimetikov-dlya-lecheniya-zabolevanijj-dyhatelnyh-putejj.html" rel="bookmark" title="База патентов Евразийского Союза">Гетероарильные соединения в качестве бетамиметиков для лечения заболеваний дыхательных путей</a>
Предыдущий патент: Производные пиррола, их получение и их применение в терапии
Следующий патент: Способ получения искусственной пищевой зернистой икры
Случайный патент: Стиральная машина
































