Способ лечения рака
Номер патента: 3326
Опубликовано: 24.04.2003
Авторы: Растинеджад Фарзан, Коффи Хитер Энн, Коннелл Ричард Дамиан, Фостер Барбара Энн
Формула / Реферат
1. Способ лечения рака у человека, включающий стадии:
a) введения указанному субъекту органического непептидного соединения, которое способно связываться с одним или более доменами человеческого белка семейства p53 в физиологических условиях и стабилизировать его функциональную конформацию, и
b) взаимодействия указанного стабилизированного белка с одной или более макромолекулами, которые принимают участие в обеспечении активности дикого типа указанного белка.
2. Способ по п.1, где указанный белок выбран из группы, состоящей из p53, p63 и p73.
3. Способ по п.1, где указанный белок является р53.
4. Способ по п.1, где указанное органическое непептидное соединение связывается с ДНК-связывающим доменом, остатками 94-312 человеческого белка p53.
5. Способ по п.1, где белок семейства p53, на который целенаправленно воздействует указанное органическое непептидное соединение, является белком дикого типа.
6. Способ по п.1, где белок семейства p53, на который целенаправленно воздействует указанное органическое непептидное соединение, является мутантом, кодируемым аллельным вариантом.
7. Способ по п.1, где ДНК-связывающий домен указанного белка включает миссенс-мутацию по положению аминокислоты, выбранной из группы, состоящей из остатков 143, 173, 175, 241 и 249 белка р53.
8. Способ по п.1, где стадии a) и b) осуществляют последовательно.
9. Способ по п.1, где стадии a) и b) осуществляют одновременно.
10. Способ по п.1, где указанное раковое заболевание связано с наличием мутантного белка семейства p53, имеющего одну или более пониженных активностей дикого типа.

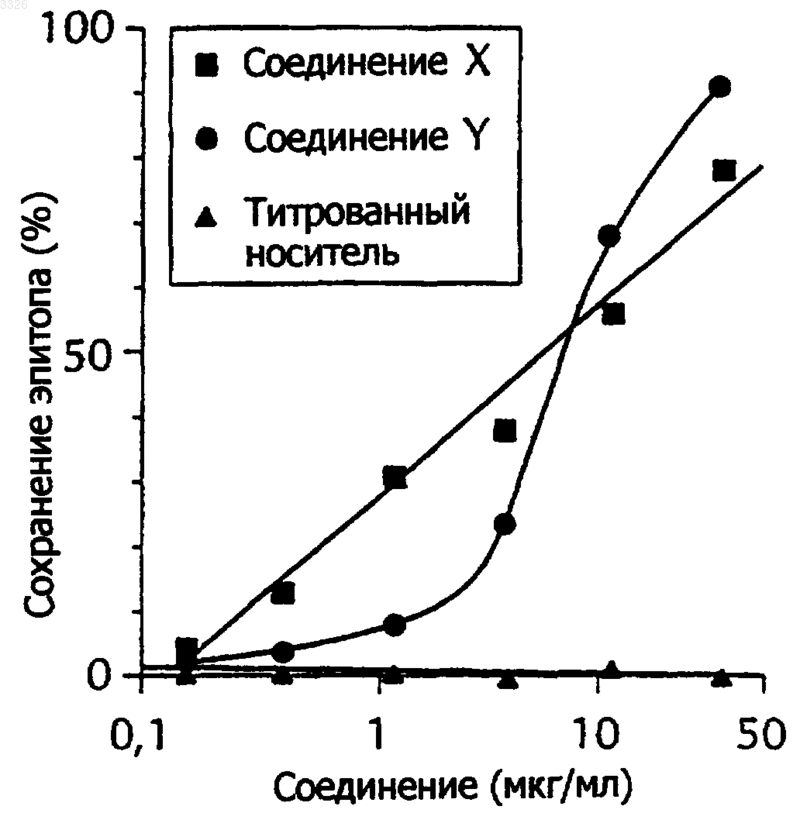
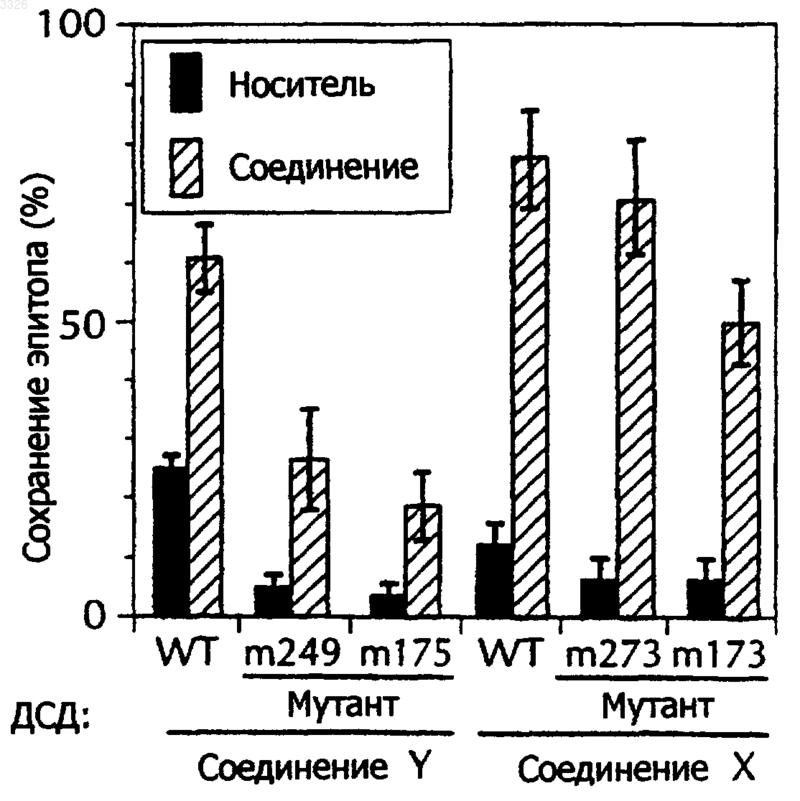
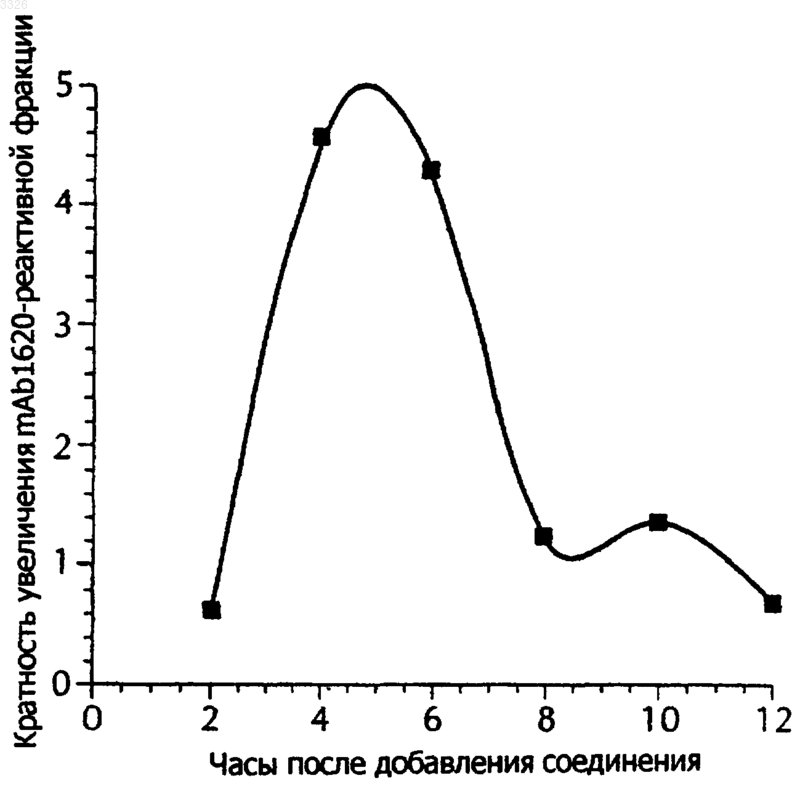
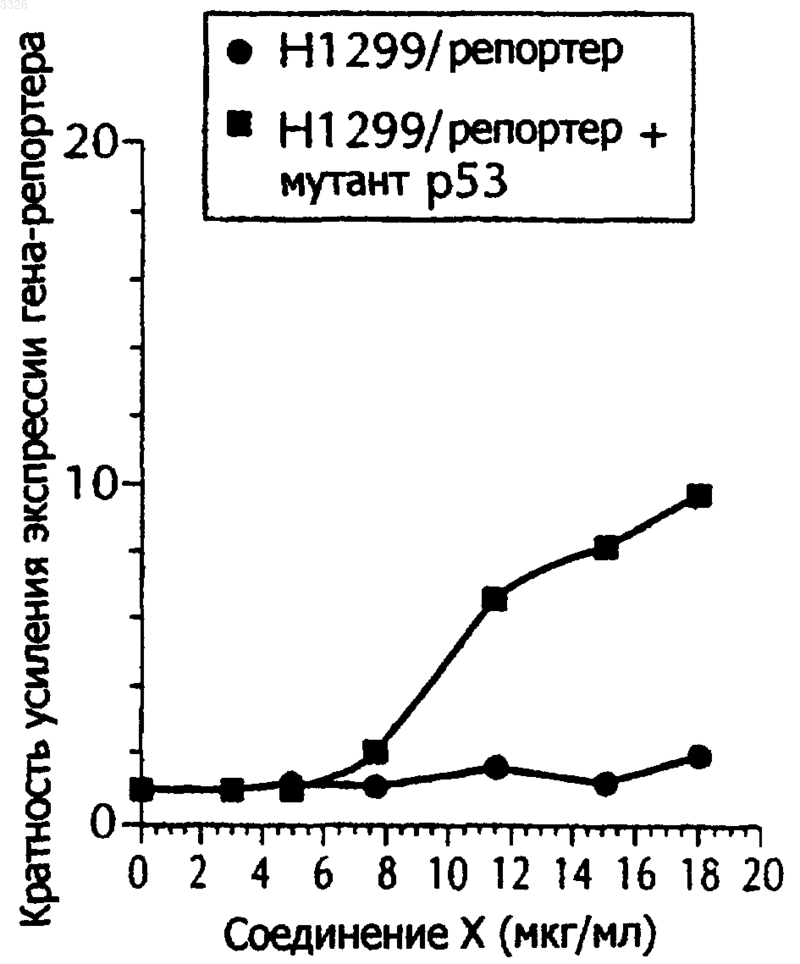
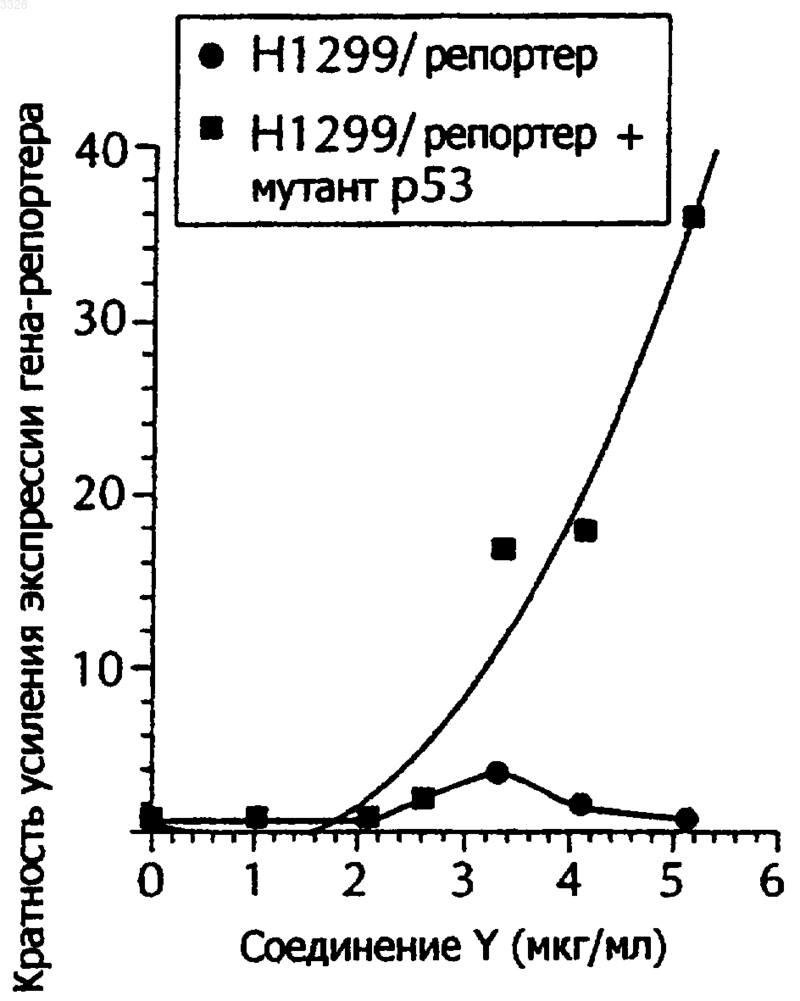
Текст
I. Область, к которой относится изобретение Настоящее изобретение относится к области лечения рака. Настоящее изобретение относится к органическим непептидным соединениям, способным взаимодействовать с белком-супрессором опухоли, относящимся к семейству р 53, и стабилизировать его функциональную конформацию. Настоящее изобретение, в частности, может быть использовано для стабилизации мутантных форм белков-супрессоров опухоли у пациентов, у которых коррекция функциональных свойств указанных белков может облегчать лечение рака. Рассматриваются также способы скрининга в целях выявления указанных соединений.II. Предпосылки создания изобретения Первичная структура белка представляет собой конкретную последовательность аминокислотных структурных элементов, которые,будучи связаны друг с другом, образуют полипептидную цепь(и) белка. Эти полипептидные цепи, в свою очередь, уложены в трехмерную структуру. В настоящее время считается, что ряд серьезных заболеваний обусловлен конформационным нарушением трехмерной структуры клеточного белка (см. обзор Thomas et al., 1995,TIBS 20: 456-459; Carrell et al., 1997, Lancet 350:134-138). Так, например, болезнь Альцгеймера вызывается неправильной укладкой и последующей агрегацией бета-амилоидного белка,что приводит к нарушению клеточной функции. Аналогично считается, что этиологические факторы болезни Крейтцфельда-Якоба, а именно прионы, вызывают указанное заболевание посредством инициации цепной реакции превращения нормальных белков прионов в белки прионы с неправильной укладкой. Белки, которые приобретают аномальные конформации, могут принимать их либо вследствие присущей им восприимчивости к неправильной укладке, либо вследствие имеющихся у них мутаций, которые термодинамически дестабилизируют мутантный белок, что не свойственно белку дикого типа. Главным примером миссенс-мутаций, приводящих к заболеванию,является белок-супрессор опухоли р 53. Белок дикого типа р 53 действует как регулятор транскрипции, в результате чего осуществляется координированный контроль за множеством процессов в циклизирующих клетках, за апоптозом и ангиогенезом. Очевидно, что все клеточные механизмы, которые осуществляют мониторинг клеточных стрессов, таких как разрушение ДНК, неправильная сборка митотического веретена и гипоксия, сводятся к действию р 53. Потеря активности р 53 может приводить к неконтролируемой пролиферации пораженных клеток и к росту опухоли. Хотя потеря активности р 53 сама по себе может быть, а может и не быть, стимулятором трансформации клетки в раковую клетку, однако, обнаруживаемые раковые заболевания чаще всего встречаются и, в 2 основном, развиваются у индивидуумов с мутациями в р 53. Фактически, мутанты р 53 являются наиболее распространенной генетической аберрацией при раке. Недавно были идентифицированы два дополнительных белка р 73 и р 63, которые имеют гомологию с р 53 (см., например, обзор Kaelin,1999, J. Natl. Cancer. Inst. 91:594-598; см. такжеp51 также называют р 40, р 51, КЕТ или p73L. Эти белки не только имеют общую аминокислотную последовательность, гомологичную р 53,но они также могут активировать реактивные промоторы р 53 и индуцировать апоптоз. Кроме того, гены, кодирующие эти белки, очевидно,являются эволюционно родственными белку р 53. Таким образом, существует известное семейство белков, родственных р 53, которые обладают аналогичными функциями и имеют родственные аминокислотные последовательности. р 53 представляет собой сложную макромолекулу, имеющую три независимых функциональных домена: N-конец, который включает домен активации транскрипции (приблизительно, аминокислоты 1-43); центральную часть, которая кодирует ДНК-связывающий домен (ДСД)(приблизительно, аминокислоты 100-300); и С-концевую часть, которая служит в качестве домена олигомеризации (приблизительно, аминокислоты 319-360). Кристаллическая структура ДСД р 53 представляет почти сферический глобулярный домен с высоким содержанием бета-складок. Активность р 53 в высокой степени зависит от способности этого белка поддерживать свою функциональную конформацию. Анализ опухолей множества различных раковых заболеваний выявил,что ДСД часто является мутированным. Friedlanderet аl., 1996, J. Biol. Chem. 271: 25468-25478. Хотя существует широкий ряд точечных мутаций, которые происходят в ДНК-связывающем домене р 53 в большинстве раковых опухолей (Pavletich et al.,1993, GenesDevelopment 7, 2556-2564), однако,существуют конкретные положения остатков в ДСД р 53, известные как "горячие точки", которые особенно часто подвергаются мутациям. Мутации в"горячих точках", обычно обнаруживаемые в опухолях человека, до некоторой степени произвольно распределяются по всему ДСД. При обработке мочевиной, ДСД р 53 всех часто мутируемых форм р 53 становятся менее стабильными, чем ДСД дикого типа (Bullock et al., см. выше). Кроме того, мутанты р 53 часто ассоциируются с белками теплового шока в клетках, что дает основание предполагать, что они менее способны к сохранению нативной конформации (Finlay et al., 1988, Molecular and 3 С-концевому р 53, в циклирующие клетки может приводить к остановке клеточного цикла (Mercer et al., 1982, Proc. Natl. Acad. Sci.: USA, 79,6309-6312). Более тщательные исследования показали, что С-концевой домен регулирует ДНК-связывающую активность домена ДСД. Так, например, Нuрр и др. обнаружили, что моноклональное антитело Pab 421, которое взаимодействует с остатками 373-381 С-концевого домена р 53, способно усиливать ДНКсвязывающую активность некоторых мутантных форм р 53 (Нuрр et al., 1993, Nucleic. Acids Research 21; 3167-3174). Так, например, в попытке восстановить функцию р 53, Нuрр и сотрудники обратили внимание на антитела и пептиды, которые нейтрализуют независимый негативный регуляторный домен у С-конца (Selivanova et al.,1997, Nature Med. 3, 632-638). Однако мутанты положения 273, которые восстанавливаются таким способом, отличаются от других распространенных мутантов тем, что они сохраняют высокую базальную ДНК-связывающую активность и обнаруживают признаки термодинамической стабильности, аналогично белку дикого типа (Bullocr et al., 1997, Proc. Natl. Acad. Sci.:USA 94, 14338-14342). Другие исследователи в этой области высказали соображения, что наиболее эффективным средством для спасения активности р 53 дикого типа является получение соединения,которое связывает N-концевой домен мутантного р 53. Так, например, Friedlander и др. протестировали ряд различных моноклональных антител, которые связываются с определенными эпитопами на р 53, на их способность стимулировать ДНК-связывающую активность термочувствительных мутантов р 53. Friedlander et al.,1996, J. Biol. Chem. 271: 25468-25478. Хотя антитело Pab 421, специфичное к С-концу, восстанавливает ДНК-связывающую функцию мутанта р 53 при более низких температурах, однако,антитела р 53, специфичные к N-концу, а в частности моноклональное антитело Pab 1801, являются более эффективными в стимуляции ДНК-связывающей активности термочувствительных мутантов р 53 при повышенных температурах. На основе этих исследований, Friedlander и др. высказали предположение, что получение небольшой молекулы, которая имитирует область распознавания эпитопа 1801 путем связывания с N-концом, должна способствовать ДНК-связывающей активности дикого типа у мутантного р 53. Интересно отметить, что Friedlander и др. продемонстрировали, что антитело,специфичное к эпитопу в центральной части(домен ДСД) белка р 53, не влияет на ДНКсвязывающую активность. В качестве одного из объяснений этих результатов, Friedlander и др. высказали предположение, что конформация одного домена в белке стабилизируется с использованием дистального домена. Bullock и др. продемонстрировали, что изменение термоди 003326 4 намической стабильности у обычно встречающихся мутантов ДНК-связывающего домена р 53 довольно незначительно, и высказали предположение, что разработка метода терапии с использованием небольших молекул для р 53, таких, которые были предложены Friedlander и др.(то есть, молекулы, которые связываются с Nконцом) может оказаться целесообразной. Bullock и др., 1997, см. выше. Другие, более глобальные подходы по идентификации противораковых соединений были направлены на тестирование прямой противоопухолевой активности небольших молекул в анализе с использованием клеток (например, опухолевых клеточных линий) или животных. Был описан ряд небольших молекул с возможной противоопухолевой активностью. Mazerska et al., 1990, Anti-CancerDrug Design 5, 169-187; Su et al., 1995, J. Med. Chem. 38, 3226-3235; Nagy et al., 1996, Anticancer Research 16, 1915-1918; Wuonola et al., 1997, Anticancer Research 17, 3409-23. Mazerska и др. описали ряд нитро-9-аминоакридинов с нитро-группой, связанной с акридиновой группой, противоопухолевые свойства которых приписывают их способности связываться с ДНК и образовывать ковалентные межцепочечные перекрестные связи. Su и др. описывают ряд 9-анилиноакридиновых производных с различными положениями анилиновых и акридиновых замещенных кольцевых систем, которые были получены как ингибиторы топоизомеразы II. Nagy и др. описывают ряд фенотиазинподобных соединений, присоединенных посредством короткого углеродного линкера к группе мочевины или фталимидной основной группе. Nagy и др. высказали предположение, что противоопухолевая активность соединений этого класса обусловлена их способностью реагировать с кальциевыми каналами и кальмодулином. Wuonola и др., см. выше, описывают фенотиазиновые соединения, аналогичные соединениям, описанным Nagy и др., см. выше. До настоящего времени ничего не сообщалось о небольших органических непептидных молекулах, которые взаимодействуют с белком семейства р 53 с сохранением или стабилизацией активности дикого типа, такой как опухольингибирующая активность. Кроме того, обнаружению таких соединений препятствовало отсутствие высокоэффективного скрининга или анализа.III. Краткое описание изобретения Понимая важность идентификации соединений, которые могут конформационно стабилизировать термодинамически нестабильные белки или белки с неправильной укладкой, ассоциируемые с заболеваниями человека, и осознавая отсутствие высокоэффективных аналитических систем, с помощью которых такие соединения могут быть быстро идентифицированы, авторы настоящего изобретения исследовали возможность использования выделенного ДНК-связывающего домена (ДСД) мутантного р 53 в in vitro и in vivo анализах в качестве мо 5 дельной системы, позволяющей быстро идентифицировать агенты, которые конформационно стабилизируют мутантный р 53. Настоящее изобретение относится к быстрому, надежному и точному способу реальной идентификации соединений, включая фармацевтические средства,используемые человеком, которые стимулируют активность белка дикого типа, принадлежащего к семейству р 53. В соответствии с этим настоящее изобретение предоставляет предварительную иллюстрацию того факта, что непептидные органические соединения могут взаимодействовать с белком семейства р 53 и стимулировать его активность дикого типа. При физиологических или близких к ним температурах,эти активные соединения стимулируют активность р 53 дикого типа не только в ряде мутантных белков р 53, но также и в белках р 53 дикого типа. Указанные соединения имеют важное значение как противораковые фармацевтические агенты. Таким образом, настоящее изобретение относится к новому способу и к соединениям, которые полезны для противоопухолевой терапии раковых заболеваний с активностью мутантного белка или белка дикого типа, принадлежащего семейству к р 53. В одном из своих аспектов настоящее изобретение относится к способу стимуляции активности дикого типа мутантной формы человеческого белка семейства р 53, где одна или несколько функциональных активностей указанного белка, по крайней мере, частично нарушена неспособностью этого белка поддерживать свою функциональную конформацию в физиологических условиях, причем, указанный способ предусматривает проведение стадий контактирования мутантного белка с органическим непептидным соединением, способным связываться с одним или несколькими доменами мутантного белка в физиологических условиях и стабилизировать функциональную конформацию данного белка; и взаимодействия стабилизированного белка с одним или несколькими макромолекулами, участвующими в активности дикого типа. Указанным человеческим белком семейства р 53 может быть, например, р 53, р 63 или р 73. В своих предпочтительных вариантах органическое непептидное соединение взаимодействует с р 53, а более предпочтительно с ДНК-связывающим доменом белка р 53. В другом своем варианте настоящее изобретение также относится к способу лечения болезненного состояния человека, связанного с экспрессией мутантного белка семейства р 53,который обладает одной или несколькими пониженными активностями дикого типа, где указанный способ включает стадии введения индивидууму органического непептидного соединения, способного к связыванию с одним или несколькими доменами мутантного белка в физиологических условиях и к стабилизации его функциональной конформации; и взаимодейст 003326 6 вия указанного стабилизированного белка пациента с одной или несколькими макромолекулами, участвующими в активности дикого типа. В еще одном своем варианте, настоящее изобретение относится к способу лечения человека от рака, включающему стадии введения данному индивидууму органического непептидного соединения, способного к связыванию с одним или несколькими доменами человеческого белка семейства р 53 в физиологических условиях и к стабилизации его функциональной конформации; и взаимодействия указанного стабилизированного белка с одной или несколькими макромолекулами, участвующими в активности дикого типа данного белка. В одном из своих аспектов органическими непептидными соединениями для использования в настоящем изобретении могут быть соединения, содержащие как гидрофобную группу(например, планарную полициклическую группу), так и катионную группу (предпочтительно,амин), соединенные друг с другом посредством линкера определенной длины. В предпочтительном аспекте органические непептидные соединения для использования в настоящем изобретении выбраны из группы,состоящей из где для группы IR5 представляет -NR18R19, где R18 представляет Н, (С 1-С 6)алкил или фенил и R19 представляет Н, (C1-С 6)алкил, (С 3-С 10)циклоалкил или фенил, где указанная алкильная, циклоалкильная или фенильная группа необязательно замещена гидрокси, (С 3-С 8)циклогетероалкилом,-CONR18(CH2)pNR20R21 или -(CH2)p-(CHR22)m(CH2)n-NR20R21, где р равно 0-5, m равно 0-5, n равно 0-5, R22 представляет гидрокси или (C1 С 6)алкил и каждый из R20 и R21 независимо выбран из:(a) Н, (C1-C12)алкила, (С 3-C12)циклоалкила,(С 3-С 10)гетероциклоалкила, (С 6-С 10)арила, (C5C9)гетероарила, (C1-C6)алкил(С 6-С 12)арила, где указанные группы необязательно замещены одной или более гидрокси, галогеном, амино,трифторметилом, (C1-С 6)алкилом, (C1-C6)алкокси, (C1-C6)алкил (С 3-С 10)гетероциклоалкилом или (C1-C6)алкил (С 6-С 10)арилом; или(a) (C1-C6)алкил или (C2-C8)алкенил, каждый из которых необязательно замещен одной или более фенильными группами, илиR7 и R8 являются одинаковыми или различными и выбраны из Н, нитро, (C1-C6) алкокси или галогена, выбранного из фтора, хлора и брома; где для группы IIR9 представляет (C1-C6)алкил, (С 3-С 10) циклоалкил или фенил, где указанная алкильная, циклоалкильная или фенильная группа необязательно замещена гидрокси, (С 3-С 8)циклогетероалкилом, -CONR18(CH2)pNR20R21 или-(СН 2)p-(CHR22)m-(CH2)n-NR20R21, где р равно 05, m равно 0-5, n равно 0-5, R22 представляет гидрокси или (C1-C6)алкил, и каждый из R20 иR21 независимо выбран из Н, (C1-C12)алкила,(С 3-C12)циклоалкила, (С 3-С 10)гетероциклоалкила, (С 6-С 10)арила, (C5-С 9)гетероарила, (C1-C6)алкил(C6-C12)арила, где указанные группы необязательно замещены одной или более гидрокси,галогеном, амино, трифторметилом, (C1-C6)алкилом, (C1-C6)алкокси, (C1-С 6)алкил(С 3-С 10)гетероциклоалкилом, (C1-C6)алкил(C5-C9)гетероарилом или (C1-С 6)алкил(С 6-С 10)арилом; где для группы IIIR10 представляет -NR18R19, где R18 представляет Н, (C1-С 6)алкил или фенил, и R19 представляет Н, (C1-C6)алкил, (С 3-С 10)циклоалкил или фенил, где указанная алкильная, циклоалкильная или фенильная группа необязательно замещена гидрокси, (С 3-С 8)циклогетероалкилом,-CONR18(CH2)pNR20R21 или -(СН 2)p-(CHR22)m(СН 2)n-NR20R21, где р равно 0-5, m равно 0-5, n равно 0-5, R22 представляет гидрокси или (C1 С 6)алкил, и каждый из R20 и R21 независимо выбран из:(a) Н, (С 1-С 12)алкила, (С 3-С 12)циклоалкила,(С 3-С 10)гетероциклоалкила, (С 6-С 10)арила, (C5C9)гетероарила, (C1-С 6)алкил(C6-C12)арила, где указанные группы необязательно замещены одной или более гидрокси, галогеном, амино, трифторметилом, (C1-С 6)алкилом, (C1-С 6)алкокси,(C1-C6)алкил(С 3-С 10)гетероциклоалкилом, (C1 С 6)алкил(С 5-С 9)гетероарилом или (C1-С 6)алкил(С 6-С 10)арилом; или 8 А и В являются одинаковыми или различными, и каждый из них представляет углерод или азот;R11 и R12 являются одинаковыми или различными и выбраны из Н, нитро, (C1-С 6)алкокси или галогена, выбранного из фтора, хлора и брома; где для группы IVR13 представляет -NR18R19, где R18 представляет Н, (С 1-С 6)алкил или фенил, и R19 представляет Н, (C1-C6)алкил, (С 3-С 10)циклоалкил или фенил, где указанная алкильная, циклоалкильная или фенильная группа необязательно замещена гидрокси, (С 3-С 8)циклогетероалкилом,-CONR18(CH2)pNR20R21 или -(СН 2)p-(CHR22)m(CH2)n-NR20R21, где р равно 0-5, m равно 0-5, n равно 0-5, R22 представляет гидрокси или (С 1 С 6)алкил, и каждый из R20 и R21 независимо выбран из:(C1-C6)алкил(С 6-С 12)арила, где указанные группы необязательно замещены одной или более гидрокси, галогеном, амино, трифторметилом,(C1-C6)алкилом, (C1-C6)алкокси, (C1-С 6) ал(C1-C6)алкил(С 3-С 10)гетероциклоалкилом,кил(C5-C9)гетероарилом или (C1-C6)алкил(С 6 С 10)арилом; или(b) NR20R21, взятые вместе, представляют водород, морфолин или 4-(C1-C6)алкилпиперизин; А и В являются одинаковыми или различными, и каждый из них представляет углерод или азот; иR14 и R15 являются одинаковыми или различными и выбраны из Н, нитро, (C1-C6)алкокси или галогена, выбранного из фтора, хлора и брома; где для группы V А представляет углерод или азот;R16 представляет -NR18R19,где R18 представляет Н, (С 1-С 6)алкил или фенил, и R19 представляет Н, (C1-С 6)алкил, (С 3 С 10)циклоалкил или фенил, где указанная алкильная, циклоалкильная или фенильная группа необязательно замещена гидрокси, (С 3-C8)циклогетероалкилом, -CONR18(CH2)pNR20R21 или-(СН 2)p-(CHR22)m-(CH2)n-NR20R21, где р равно 05, m равно 0-5, n равно 0-5, R22 представляет гидрокси или (C1-С 6)алкил, и каждый из R20 и(a) Н, (C1-C12)алкила, (С 3-C12)циклоалкила,(С 3-С 10)гетероциклоалкила, (С 6-С 10)арила, (С 5 С 9)гетероарила, (C1-C6)алкил(С 5-С 10)арила и (C1 С 6)алкил(С 5-С 9)гетероарила, или где указанные группы необязательно замещены одной или более гидрокси, галогеном, амино, трифторметилом, (C1-C6)алкилом, (C1-C6)-алкокси, (C1-C6) алкил(С 3-С 10)гетероциклоалкилом, (C1-C6)алкилR17 выбран из Н, нитро, (C1-C6)алкокси или галогена, выбранного из фтора, хлора и брома. Кроме того, многие из соединений, полезные на практике настоящего изобретения, сами по себе являются новыми, и описание указанных соединений составляет другой аспект настоящего изобретения. В другом своем аспекте настоящее изобретение также относится к способу разработки дополнительных соединений, стимулирующих активность дикого типа белка семейства р 53. Данный способ предусматривает использование одного из активных соединений настоящего изобретения для генерирования гипотезы, идентификацию соединения-кандидата, соответствующего данной гипотезе, и установление факта стимуляции соединением-кандидатом активности дикого типа белка семейства р 53. В другом своем аспекте настоящее изобретение относится к композиции, содержащей комплекс белка семейства р 53 и непептидного соединения, которое взаимодействует с указанным белком и стимулирует активность дикого типа данного белка. В еще одном своем аспекте настоящее изобретение относится к способу скрининга соединений, стимулирующих активность дикого типа белка семейства р 53. В предпочтительном аспекте указанный способ предусматривает анализ на выявление соединений, которые взаимодействуют с ДНК-связывающим доменом(ДСД) белка р 53, и определение конформации указанного ДСД р 53 в присутствии данного соединения. Однако в настоящем изобретении также рассматривается использование полноразмерных и неполных белков семейства р 53 в указанных способах скрининга. В конкретном варианте осуществления изобретения, указанные стадии анализа и определения конформации осуществляют одновременно. Соединения, которые, как было установлено, стимулируют активность дикого типа в мутантной форме белка семейства р 53, необязательно скринируют invivo на их способность прекращать или подавлять рост опухоли. В другом своем аспекте, настоящее изобретение относится к способу выявления лекарственного средства путем скрининга органических непептидных соединений на их 10 способность специфически взаимодействовать с ДСД р 53. Успех настоящего изобретения в идентификации соединений, стимулирующих активность дикого типа в мутантной форме белка семейства р 53, продемонстрировал, что способы настоящего изобретения могут быть широко использованы в целях обнаружения лекарственного средства для лечения заболеваний определенного класса, индуцируемых конформационно дефектными или нестабильными белками. Примерами таких белков-мишеней являются рр 60src, убихитинактивирующий фермент Е 1,ассоциированный с кистозным фиброзом регулятор трансмембранной проводимости, гемоглобин, белки прионы, серпины и бетаамилоидный белок.IV. Краткое описание графического материала Фиг. 1 - модуляция конформационнозависимых эпитопов на ДСД р 53. ДСД р 53 иммобилизовывали на микротитрационных лунках и инкубировали при повышенных температурах. С помощью анализа ELISA был определен процент эпитопа для mAb1620, остающегося в нагретых лунках, по сравнению с контрольными лунками,которые выдерживали на льду; фиг. 1 А: 0,5 нг ДСД белка р 53 дикого типа инкубировали и количество оставшегося эпитопа для mАb1620 представляли как процент от ненагретого контроля. Стандартные отклонения составляли 10%; фиг. 1 В: 1,25 нг FLAG-меченного ДСД р 53 иммобилизовали, нагревали при 45 С, и количество оставшегося эпитопа для FLAG-меченного mАb1620 представляли как процент от ненагретого контроля; фиг. 1 С: 1,0 нг ДСД белка дикого типа и ДСД р 53 с мутацией в положении 143, которые обнаруживали приблизительно равные уровни эпитопа для mАb1620, нагревали при 37 С, и проводили мониторинг стабильности эпитопа как процент от ненагретого контроля. Величины ошибок представляют собой стандартные отклонения для 4 повторностей. Фиг. 2 - стабилизация эпитопа для 1620 на мутантном ДСД р 53; фиг. 2 А: представители соединений, обозначенные как соединение X, соединение Y и соединение Z, которые стимулируют конформационную стабильность р 53; фиг. 2 В: 1 нг ДСД р 53 дикого типа иммобилизовали и нагревали при 45 С в течение 30 мин в присутствии соединений настоящего изобретения или эквивалентной концентрации носителя ДМСО. Количество оставшегося эпитопа для mAb1620 представлено как процент от ненагретого контроля; фиг. 2 С: ДСДпрепараты белка дикого типа и мутантного ДСД р 53 с приблизительно равными уровнями эпитопа для mАb1620 (в пределах 10%) иммобилизовали и нагревали при 37 С в течение 30 мин в присутствии соединения настоящего изобретения или носителя. Количество оставшегося эпитопа для mAb1620 представлено как процент от ненагретого контроля. 11 Величины ошибок представляют собой стандартные отклонения для 4 повторностей. Фиг. 3 - модуляция конформации р 53 и транскрипционной активности в клетках, содержащих мутант р 53; фиг. 3 А: трансфектанты Н 1299, которые экспрессировали р 53 с мутацией в положении 173, обрабатывали 16,5 мкг/мл соединения Х в культуре. Клеточные лизаты нормализовали на незначительные изменения в полном белке р 53 с помощью Вестерн-блотанализа с использованием пан-антитела против р 53, mAbDO-1, и количество белка р 53, который обнаруживал эпитоп для mAb1620, определяли с помощью анализа ELISA. Увеличение 1620 положительной фракции р 53 корректировали на фракцию 1620-положительного р 53 в необработанных клетках; фиг. 3 В: соответствующие трансфектанты Н 1299, имеющие ген-репортер люциферазы (Н 1299/репортер) или ген-репортер и мутант р 53 по положению 173(Н 1299/репортер + мутант р 53), обрабатывали в микротитрационных лунках в течение 16 ч. Индуцированную экспрессию гена-репортера люциферазы, которая указывает на функцию р 53 дикого типа, корректировали на базальный уровень экспрессии в отсутствии соединения. Результаты представлены как средние величины для 4 повторностей. Фиг. 4 - индуцирование WAF1 экспрессии в клетках, содержащих мутант р 53. Клетки Saos2, экспрессирующие трансфецированные мутантные белки р 53 (по положению 173 или по положению 249), обрабатывали в культуре 16,5 мкг/мл соединения Х в течение 16 ч. Клеточные лизаты нормализовали на полный белок и анализировали на Вестерн-блотах. Верхнюю часть блота зондировали антителом mAbDO-1 на полный белок р 53, а нижнюю часть того же самого блота зондировали антителом против WAF1. Фиг. 5 - стимуляция конформационной стабильности р 53 и его функции в опухолях. Мышам, имеющим подкожные опухоли, происходящие из клеток Н 1299/репортер + мутант р 53, вводили внутрибрюшинно одну дозу 100 мг/кг соединения X, и опухолевые лизаты в дубликате нормализовали на содержание полного белка р 53, исходя из денситометрических сканов Вестерн-блотов с использованием антитела mAbDO-1. Количество р 53, который обнаруживал эпитоп для mAb1620, определяли с помощью анализа ELISA и увеличение 1620 положительной фракции р 53 было скорректировано на фракцию 1620-положительного р 53 в лизатах от необработанных опухолей. Опухолевые лизаты были также проанализированы на экспрессию люциферазы в целях оценки увеличения транскрипционной активности р 53. Экспрессии люциферазы нормализовали на концентрацию белка и сравнивали с лизатами от необработанных опухолей. Фиг. 6 - суппрессия опухолевого ксенотрансплантата, экспрессирующего мутиро 003326 12 ванный р 53. Мышей инокулировали опухолевыми клетками и внутрибрюшинно инъецировали соединение Х или носитель, как указано на фигуре. Указанное соединение вводили в течение семи дней один раз в день (q.d.) или с 12 часовыми интервалами (b.i.d.). Обработанные носителем мыши получали инъекции через 12 часовые интервалы. Объем опухолей определяли путем измерения диаметра опухоли в двух осевых плоскостях и усредняли для 5-7 мышей в каждой группе. Пунктирными линиями представлен первоначальный объем опухоли в начале обработки.V. Подробное описание изобретения Потеря функции суппрессора опухоли генным продуктом р 53 может приводить к неконтролируемой пролиферации и/или к отсутствию апоптоза, наблюдаемых во многих раковых опухолях различного типа. Даже если р 53 не является мутированным в раковых клетках, то стимулирование р 53-активности дикого типа в таких клетках может ингибировать фенотип раковых клеток. Настоящее изобретение, впервые продемонстрировало, что органические непептидные соединения могут взаимодействовать с белком семейства р 53, что приводит к стабилизации его функциональной конформации. В соответствии с этим, такие соединения могут быть использованы в качестве ценных фармацевтических агентов для лечения всех видов рака. Таким образом, в одном из своих аспектов настоящее изобретение относится к способу стимуляции активности дикого типа мутантной формы человеческого белка семейства р 53, где одна или несколько функциональных активностей указанного белка, по крайней мере, частично, нарушена неспособностью этого белка поддерживать свою функциональную конформацию в физиологических условия; причем,указанный способ включает стадии контактирования мутантного белка с органическим непептидным соединением, способным связываться с одним или несколькими доменами мутантного белка в физиологических условиях и стабилизировать его функциональную конформацию, и взаимодействия указанного стабилизированного белка с одной или несколькими макромолекулами, участвующими в активности дикого типа. Указанным мутантным человеческим белком семейства р 53 может быть, например, мутантный белок р 53, р 63 или р 73. В своих предпочтительных вариантах, органическое непептидное соединение взаимодействует с р 53, а более предпочтительно, с ДНК-связывающим доменом белка р 53. В другом своем варианте настоящее изобретение также относится к способу лечения болезненного состояния человека, связанного с экспрессией мутантного белка семейства р 53,который обладает одной или несколькими пониженными активностями дикого типа, где ука 13 занный способ включает стадии введения данному индивидууму органического непептидного соединения, способного связываться с одним или несколькими доменами мутантного белка в физиологических условиях и стабилизировать его функциональную конформацию, и взаимодействия указанного стабилизированного белка с одной или несколькими макромолекулами,участвующими в активности дикого типа. В еще одном своем варианте настоящее изобретение относится к способу лечения человека от рака, включающему стадии введения индивидууму органического непептидного соединения, способного связываться с одним или несколькими доменами человеческого белка р 53 в физиологических условиях и стабилизировать его функциональную конформацию, и взаимодействия указанного стабилизированного белка с одной или несколькими макромолекулами,участвующими в активности дикого типа данного белка. Указанным человеческим белком семейства р 53, который стабилизируется способами настоящего изобретения, может быть белок дикого типа или мутантный белок, например р 53, р 63 или р 73. Хотя белки семейства р 53 являются мутантными в ряде раковых опухолей, но тем не менее, в некоторых типах рака или раковых клеток структура или функция белка семейства р 53(в большинстве исследований получали сам р 53) является модифицированной, даже если включенные в опухоль клетки сохраняют аллель, кодирующий белок дикого типа. См., например, Klein, 1999 (см. выше), где обсуждается вирус-ассоциированный рак, при котором вирусный белок разрушает белок р 53, либо р 53 инактивируется или разрушается, например продуктами экспрессии онкогенов. Принимая во внимание ту важную роль, которую белки семейства р 53 играют в клеточных регуляторных процессах, очевидно, что соединения настоящего изобретения могут быть также использованы для стабилизации функциональных конформаций немутантных членов семейства р 53 в физиологических условиях в клетках, в которых время жизни, и/или структура, и/или активность таких белков является нормальной. Таким образом, соединения настоящего изобретения могут быть использованы для лечения рака, при котором функция белка р 53 и т.п., в основном, не подвержена неблагоприятному воздействию,обусловленному раковым статусом, а также для лечения тканей, экспрессирующих предраковые клетки, патология которых еще заметно не распространяется на функцию, время жизни или структуру р 53 (или члена семейства р 53). Кроме того, благодаря дополнительной стабилизации(например, обеспечению более продолжительного времени полужизни) белков семейства р 53 в здоровых клетках, которые соседствуют со злокачественным участками или которые так или иначе контактируют со злокачественными 14 клетками в организме, можно контролировать распространение раковой опухоли. Для этих целей также могут быть использованы соединения настоящего изобретения. В соответствии с осуществлением настоящего изобретения белок семейства р 53 определяют как белок р 53, р 63 или р 73 млекопитающего; и/или белок, который содержит домен, все аминокислотные последовательности которого,по крайней мере, на 50%, а более предпочтительно на 80% гомологичны одному или нескольким (1) N-концевым доменам, необходимым для транскрипционной активации, (2) ДНК-связывающему домену, или (3) домену олигомеризации, происходящему от р 53, р 63 или р 73 млекопитающих, где указанную гомологию измеряют с использованием любого из известных алгоритмовWashington University, St. Louis, МО, USA), и где указанный белок обнаруживает, по крайней мере, одну функцию, которая идентифицируется специалистами в данной области как функция, характерная также и для белков р 53, р 63 или р 73 (например, способность активировать реактивные промоторы р 53 и индуцировать апопотоз; обсуждение известных свойств см.Kaelin, 199; Yang et al., 1998; и Yoshikawa et al.,1999, см. выше). Общее обсуждение процедур и эффективности алгоритмов BLAST, SmithWaterman и FASTA см. работу Nicolas et al.,1998, "A Tutorial on Searching Sequence Databases(www.psc.edu.) и цитируемые в ней работы. Соединениями, которые стабилизируют конформацию дикого типа белка семейства р 53,являются соединения, которые при их контактировании с белком семейства р 53, стимулируют или восстанавливают активность дикого типа данного белка, такую как аффинность связывания с ДНК или способность к взаимодействию с любой макромолекулой для осуществления нормальной функции белка семейства р 53. Другими активностями дикого типа р 53 являются, но не ограничиваются ими, способность к активации транскрипции (например, индуцирование WAF1), прекращение клеточного цикла и стимуляция апоптоза. В еще одном своем аспекте настоящее изобретение относится к использованию соединений настоящего изобретения для ингибирования роста опухоли и/или для лечения рака. Основное преимущество настоящего изобретения заключается в том, что, как было показано, соединения, идентифицированные описанными здесь методами, стабилизируют активную конформацию не только ДСД р 53 дикого типа и ДСД мутантного р 53, используемого в скрининге, но также и других мутантных р 53 и ДСД р 53. 15 Поэтому, идентифицированные таким образом соединения могут иметь широкое применение для лечения различных раковых заболеваний. Настоящее изобретение также относится к новому способу скрининга соединений, которые стимулируют конформацию дикого типа белка семейства р 53 и могут восстанавливать активность дикого типа у мутантных белков семейства р 53. Соединения, идентифицированные способами настоящего изобретения, могут быть использованы для лечения заболеваний, таких как рак, которые ассоциируются с дефицитом активности белков семейства р 53. Способы настоящего изобретения предусматривают проведение скрининга соединений,которые непосредственно взаимодействуют с белком семейства р 53. Указанные способы могут предусматривать использование полноразмерного белка семейства р 53 (мутантного или дикого типа) в целях скрининга, или использование производного, измененного путем делеции, содержащего, по крайней мере, ДСД и необязательно N-концевой и/или С-концевой домены. Однако в предпочтительном аспекте настоящего изобретения указанный скрининг предусматривает использование полипептидного фрагмента белка семейства р 53, содержащего только ДСД без интактных N- или С-концевых доменов. В соответствии с этим в описании настоящей заявки термин "ДНК-связывающий домен" или "ДСД" следует понимать только как ДСД белка семейства р 53 без интактных N- или С-концов (если это не оговорено особо). Однако такие домены ДСД могут быть присоединены к гетерологичным полипептидам в зависимости от формата анализа (например, к эпитопу FLAG или белку глутатион-S-трансферазы). Кроме того, вместо того, чтобы просто исключить негативное регуляторное действие на связывание с ДНК, способы и соединения настоящего изобретения стимулируют повышение конформационной стабильности как белка дикого типа,так и мутантных белков семейства р 53. В соответствии с этим в одном из своих аспектов, проиллюстрированных ниже в неограничивающем рабочем примере, настоящее изобретение относится к способу скрининга в целях поиска соединений, которые специфически взаимодействуют с ДСД р 53, и определения конформации ДСД р 53 в присутствии тестируемого соединения. ДСД р 53 является, но необязательно, мутантным ДСД р 53. Однако, ДСД р 53 дикого типа легче поддается сверхпродуцированию в больших количествах. Хотя указанный скринирующий анализ может быть осуществлен в формате на основе клеток, однако, для высокоэффективного скринига, специфичного для соединений, которые направлены на ДСД р 53, прямым и наиболее желательным анализом является анализ in vitro. Соединения, идентифицированные при первоначальном скрининге на ДСД р 53, могут быть, кроме того, протестиро 003326 16 ваны на их воздействие на функцию интактного р 53 (включая миссенс-мутанты р 53). Соединения, идентифицированные указанными способами, также входят в объем настоящего изобретения. В целях настоящего изобретения анализы на соединения, которые взаимодействуют с ДНК-связывающим доменом белка семейства р 53, были разработаны так, чтобы обнаруженные соединения были такими соединениями,которые специфически направлены на ДСД, а не на другие домены данного белка. Так, например, соединение, которое специфически "взаимодействует с" или "действует на" ДСД необязательно должно (хотя и может) стабильно связываться с ДСД; при этом, достаточно, чтобы данное соединение, если оно присутствует, оказывало определенное влияние на конформацию белка семейства р 53. В соответствии с этим соединения могут быть сначала скринированы на взаимодействие с ДСД, а затем проанализированы на их влияние на конформацию, либо для детекции также взаимодействия с ДСД эти две стадии скрининга могут быть осуществлены одновременно с использованием конформационного изменения в присутствии данного соединения. Термин "специфическое взаимодействие",используемый в настоящей заявке, исключает неспецифические формы связывания, включая типы связывания, которые, как известно, происходят между гидрофобными соединениями и белками посредством неселективных гидрофобных взаимодействий. Термин "специфическое взаимодействие", используется, кроме того, для отличения свойств соединений настоящего изобретения от свойств соединений, которые воздействуют на термостабильность белка путем изменения химических свойств среды окружения. Такие молекулы, не входящие в объем данного аспекта изобретения, следовательно, включают термостабилизирующие агенты, такие как глицерин, оксид триметиламина и дейтерированная вода. Было показано, что соединения,которые специфически взаимодействуют с белком семейства р 53, проявляют действие при гораздо меньших концентрациях, чем указанная среда окружения белка или неспецифичные гидрофобные взаимодействия. Так, например,глицерин является эффективным при 600 мМ. Однако эффект соединений, которые специфически взаимодействуют с белком семейства р 53,наблюдается при концентрациях соединения менее чем 1 мМ, предпочтительно менее 100 микромоль, а более предпочтительно менее чем 10 микромоль в in vitro анализах или в анализах на клетках. При описании осуществления настоящего изобретения будут использованы, в основном,следующие определения. Если это не оговорено особо, то используемый здесь термин "алкил" включает насыщенные одновалентные углево 17 дородные радикалы, имеющие прямую, разветвленную или циклическую части или их комбинации. Аналогично, термины "алкенил" и"алкинил" означают углеводородные радикалы,имеющие прямую, разветвленную или циклическую части, где присутствует, по крайней мере,одна двойная связь или, по крайней мере, одна тройная связь, соответственно. Указанные определения также применяются в том случае, если алкильная, алкенильная или алкинильная группа присутствует в другой группе, такой как алкокси или алкиламин. Используемый здесь термин"алкокси" означает O-алкильные группы, где термин "алкил" определен выше. Если это не оговорено особо, то используемый здесь термин галоген означает фтор, хлор, бром или йод. Для удобства описания, используемый здесь термин "(С 3-C10)циклоалкил" означает как циклоалкильную, так и циклоалкенильную группы, не имеющие или имеющие, но необязательно, одну или несколько двойных связей,такие как циклопропил, циклобутил, циклопентил, циклопентенил, циклогексил, циклогексенил, 1,3-циклогексадиен, циклогептил, циклогептенил, бицикло[3.2.1]октан, норборнанил и т.п. Используемый здесь термин "(С 3 С 10)гетероциклоалкил" означает пирролидинил,тетрагидрофуранил, дигидрофуранил, тетрагидропиранил, пиранил, тиопиранил, азиридинил,оксиранил, метилендиоксил, хроменил, изоксазолидинил, 1,3-оксазолидин-3-ил, изотиазолидинил, 1,3-тиазолидин-3-ил, 1,2-пиразолидин-2 ил, 1,3-пиразолидин-1-ил, пиперидинил, тиоморфолинил, 1,2-тетрагидротиазин-2-ил, 1,3 тетрагидротиазин-3-ил, тетрагидротиадиазинил,морфолинил, 1,2-тетрагидродиазин-2-ил, 1,3 тетрагидродиазин-1-ил,тетрагидроазепинил,пиперазинил, хроманил и т.п. Каждому специалисту в данной области известно, что связь указанных (С 3-С 10)гетероциклоалкильных колец осуществляется через углерод или sр 3 гибридизованный гетероатом азота. Используемый здесь термин "(С 5-С 9)гетероарил" означает фурил, тиенил, тиазолил, пиразолил, изотиазолил, оксазолил, изоксазолил, пирролил, триазолил, тетразолил, имидазолил, 1,3,5 оксадиазолил, 1,2,4-оксадиазолил, 1,2,3-оксадиазолил, 1,3,5-тиадиазолил, 1,2,3-тиадиазолил, 1,2,4 тиадиазолил, пиридил, пиримидил, пиразинил,пиридазинил, 1,2,4-триазинил, 1,2,3-триазинил,1,3,5-триазинил, пиразоло[3,4-b]пиридинил, циннолинил, птеридинил, пуринил, 6,7-дигидро-5 Н[1]пиридинил, бензо[b]тиофенил, 5,6,7,8-тетрагидрохинолин-3-ил, бензоксазолил, бензотиазолил,бензизотиазолил, бензизоксазолил, бензимидазолил, тианафтенил, изотианафтенил, бензофуранил, изобензофуранил, изоиндолил, индолил, индолизинил, индазолил, изохинолил, хинолил, фталазинил, хиноксалинил, хиназолинил, бензоксазинил и т.п. Для каждого специалиста в данной области очевидно, что присоединение (С 5-С 9)гетеро 003326 18 арильной группы к остальной структуре обычно происходит без ограничений, то есть, через атом углерода или sp2-гибридизованный гетероатом. Аналогично, фенил и нафтил являются представителями (С 6-С 10)арила. Если на рисунке обозначена связь, но не указано, какая именно группа расположена на ее отдаленном конце, то обычно подразумевается,что этой группой является метильная группа. При отсутствии какой-либо связи, указанное положение занято водородом, если это позволяет валентность, что совершенно очевидно для каждого специалиста в данной области. Таким образом, обозначение R-O- означает R-O-СН 3. А. Соединения настоящего изобретения,которые стимулируют активность дикого типа в белке А семейства р 53. Органическими непептидными соединениями настоящего изобретения могут быть соединения любого типа, которые при контактировании с белком дикого типа или мутантным белком семейства р 53, стимулируют активность дикого типа данного белка. Предпочтительными соединениями являются относительно небольшие (по сравнению с обычными белками 50-150 кДа) органические соединения. Настоящее изобретение относится, прежде всего, к соединениям, которые не являются пептидами, а более конкретно, не являются антителами, и которые специфически взаимодействуют с р 53, и тем самым стабилизируют конформацию дикого типа ДСД р 53 или белка р 53. Органические соединения, которые не являются пептидами, являются особенно полезными в качестве фармацевтических средств для различных целей. Так, например, непептидные соединения являются гораздо менее иммуногенными, чем пептиды, и более легко абсорбируются в организме через слизистую оболочку или через другой барьер из клеточного слоя, и могут быть менее лабильными. В одном из аспектов настоящего изобретения активные соединения, обнаруженные способами настоящего изобретения, могут быть определены как соединения, содержащие как гидрофобную группу (например, планарную полициклическую группу), так и катионную группу (предпочтительно, амин), соединенные друг с другом посредством линкера определенной длины. Предпочтительными в гидрофобном положении являются бензимидазол, бензохинолин, фенотиазин и стирилхиназолин. Активными катионными группами являются как вторичные, так и третичные амины, включая,но не ограничиваясь ими, диметиламин, диэтиламин, диэтаноламин, метиламин, метил-пиперазин и морфолин. При тестировании в серии фенотиазиновых гидрофобных соединений, некоторые более крупные амины были, соответственно, более активными; в соответствии с этим в данной ситуации предпочтительным является более крупный амин. Положительно заряженные группы в катионном положении являются активными, а 19 поэтому, они являются предпочтительными (см. ниже, табл. 1). В соответствии с данным аспектом настоящего изобретения расстояние между гидрофобными и катионными группами должно иметь, по крайней мере, длину пропильной группы; в конкретных условиях анализа, линкеры, имеющие длину короче, чем длина пропильной группы являются, в основном, менее эффективными (см. ниже табл. 2). Следовательно, хотя соединения, содержащие линкеры, имеющие длину пропильного линкера (около 6,5 ангстрем), являются наиболее активными, однако, предпочтительными являются линкеры, имеющие длину приблизительно от 3 до 5 углеродных связей (от 5 до 9 ангстрем, а более предпочтительно, от 6 до 8 ангстрем). В конкретных условиях анализа, линкеры, имеющие длину, превышающую длину бутильного линкера, дают соединения, которые являются менее эффективными, чем соответствующие соединения с линкерами, имеющими длину бутильного линкера (табл. 2). Еще более предпочтительными являются разветвленные линкеры,которые сохраняют нужное расстояние; в данном анализе указанные линкеры являются, в основном,более активными, чем соответствующий линейный линкер, до тех пор, пока они сохраняют примерно требуемую длину от 5 до 9 ангстрем (а оптимально,около 6,5 ангстрем). В соответствии с этим в одном из своих аспектов соединения настоящего изобретения имеют формулу: где R1, R2, R3 являются одинаковыми или различными и независимо выбраны из группы, состоящей из водорода, галогена, метокси и нитро; L представляет прямой или разветвленный алкил,имеющий длину от 5 до 9 ангстрем; а F2 представляет вторичный или третичный амин. В другом аспекте настоящего изобретения F2 представляет диметиламин, диэтиламин, диэтаноламин, метилпиперазин или морфолин. Так, например, F2 может представлять амин, выбранный из группы,состоящей из: где R4 представляет -О-СН 2-СН 3 или Н. Ниже приводятся химические структуры различных соединений настоящего изобретения. Было обнаружено, что каждое из этих соединений значительно увеличивает стабильность конформационно-чувствительного эпитопа для р 53, по крайней мере, в одном ДСД мутантного р 53 при температурах, близких к физиологическим. 1. Акридины 22 В соответствии с описанной здесь общей концепцией, разработанной для осуществления настоящего изобретения, предпочтительными являются следующие группы соединений: где для группы IR5 представляет -NR18R19, где R18 представляет Н, (C1-C6)алкил или фенил, и R19 представляет Н, (C1-C6)алкил, (С 3-С 10)циклоалкил или фенил, где указанная алкильная, циклоалкильная или фенильная группа необязательно замещена гидрокси, (С 3-С 8)циклогетероалкилом,-CONR18(CH2)pNR20R21 или -(CH2)p-(CHR22)m(СН 2)n-NR20R21, где р равно 0-5, m равно 0-5, n равно 0-5, R22 представляет гидрокси или (C1 С 6)алкил, и каждый из R20 и R21 независимо выбран из:(a) Н, (С 1-С 12)алкила, (C3-C12)циклоалкила,(С 3-С 10)гетероциклоалкила, (С 6-С 10)арила, (С 5 С 9)гетероарила, (C1-C6)алкил (С 6-С 12)арила, где указанные группы необязательно замещены одной или более гидрокси, галогеном, амино,трифторметилом, (C1-С 6)алкилом, (С 1-С 6) алкокси,(C1-С 6)алкил(С 3-С 10)гетероциклоалкилом или (C1-C6)алкил(С 6-С 10)арилом; или(a) (C1-С 6)алкил или (С 2-С 8)алкенил, каждый из которых необязательно замещен одной или более фенильными группами, илиR7 и R8 являются одинаковыми или различными и выбраны из Н, нитро, (C1-С 6)алкокси или галогена, выбранного из фтора, хлора и брома; где для группы IIR9 представляет (C1-C6)алкил, (С 3-С 10)циклоалкил или фенил, где указанная алкильная,циклоалкильная или фенильная группа необязательно замещена гидрокси, (С 3-С 8)циклогетероалкилом, -CONR18(CH2)pNR20R21 или -(СН 2)p(CHR22)m-(CH2)n-NR20R21, где р равно 0-5, m равно 0-5, n равно 0-5, R22 представляет гидрокси или (C1-C6)алкил, и каждый из R20 и R21 не 23 зависимо выбран из Н, (C1-C12)алкила, (С 3(С 3-С 10)гетероциклоалкила,C12)циклоалкила,(С 5-С 9)гетероарила,(C1-C6)(С 6-С 10)арила,алкил(C6-C12)арила, где указанные группы необязательно замещены одной или более гидрокси, галогеном, амино, трифторметилом, (C1-C6) алкилом, (C1-C6)алкокси, (C1-С 6)алкил(С 3-С 10) гетероциклоалкилом, (C1-С 6)алкил(C5-C9)гетероарилом или (C1-С 6)алкил(С 6-С 10)арилом; где для группы IIIR10 представляет -NR18R19, где R18 представляет Н, (С 1-С 6)алкил или фенил и R19 представляет Н, (C1-С 6)алкил, (С 3-С 10)циклоалкил или фенил, где указанная алкильная, циклоалкильная или фенильная группа необязательно замещена гидрокси, (С 3-С 8)циклогетероалкилом,-CONR18(CH2)pNR20R21 или -(СН 2)p-(CHR22)m(CH2)n-NR20R21, где р равно 0-5, m равно 0-5, n равно 0-5, R22 представляет гидрокси или (C1C6)алкил и каждый из R20 и R21 независимо выбран из:(a) Н, (C1-C12)алкила, (С 3-С 12)циклоалкила,(С 3-С 10)гетероциклоалкила, (С 6-С 10)арила, (С 5 С 9)гетероарила, (C1-C6)алкил(С 6-С 12)арила, где указанные группы необязательно замещены одной или более гидрокси, галогеном, амино,трифторметилом, (C1-С 6)алкилом, (C1-C6)алкокси,(C1-C6)алкил(С 3-С 10)гетероциклоалкилом,(C1-C6)алкил(С 5-С 9)гетероарилом или (C1-C6)алкил(С 6-С 10)арилом; или(b) NR20R21, взятые вместе, представляют водород, морфолин или 4-(C1-C6)алкилпиперизин; А и В являются одинаковыми или различными, и каждый из них представляет углерод или азот;R11 и R12 являются одинаковыми или различными и выбраны из Н, нитро, (C1-C6)алкокси или галогена, выбранного из фтора, хлора и брома; где для группы IVR13 представляет -NR18R19, где R18 представляет Н, (C1-C6)алкил или фенил и R19 представляет H, (C1-С 6)алкил, (С 3-С 10)циклоалкил или фенил, где указанная алкильная, циклоалкильная или фенильная группа необязательно замещена гидрокси,(С 3-С 8)циклогетероалкилом, -CONR18(CH2)pNR20R21 или-(СН 2)p-(CHR22)m-(CH2)n-NR20R21, где р равно 05, m равно 0-5, n равно 0-5, R22 представляет гидрокси или (C1-C6)алкил, и каждый из R20 и(C1-C6)алкил(С 6-С 12)арила, где указанные группы необязательно замещены одной или более гидрокси, галогеном, амино, трифторметилом,(C1-С 6)алкилом, (C1-C6)алкокси, (C1-С 6)алкил(b) NR20R21, взятые вместе, представляют водород, морфолин или 4-(C1-C6)алкилпиперизин; А и В являются одинаковыми или различными и каждый из них представляет углерод или азот; иR14 и R15 являются одинаковыми или различными и выбраны из Н, нитро, (C1-C6)алкокси или галогена, выбранного из фтора, хлора и брома; где для группы V А представляет углерод или азот;R16 представляет -NR18R19, где R18 представляет Н, (C1-С 6)алкил или фенил и R19 представляет Н, (C1-С 6)алкил, (С 3-С 10)циклоалкил или фенил, где указанная алкильная, циклоалкильная или фенильная группа необязательно замещена гидрокси, (С 3-С 8)циклогетероалкилом,-CONR18(CH2)pNR20R21 или -(СН 2)p-(CHR22)m(CH2)n-NR20R21, где р равно 0-5, m равно 0-5, n равно 0-5, R22 представляет гидрокси или (C1C6)алкил и каждый из R20 и R21 независимо выбран из:(a) Н, (C1-C12)алкила, (С 3-С 12)циклоалкила,(С 3-С 10)гетероциклоалкила, (С 6-С 10)арила, (C5C9)гетероарила, (C1-C6)алкил(C5-С 10)арила и (C1C6)алкил(С 5-С 9)гетероарила или где указанные группы необязательно замещены одной или более гидрокси, галогеном, амино, трифторметилом, (C1-С 6)алкилом, (C1-С 6)-алкокси, (C1-С 6)алкил(С 3-С 10)гетероциклоалкилом, (C1-C6)алкил(С 5-С 9)гетероарилом или (C1-C6)алкил(С 6-С 10) арилом; илиR17 выбран из Н, нитро, (C1-C6)алкокси или галогена, выбранного из фтора, хлора и брома. Особенно предпочтительными соединениями настоящего изобретения являются следующие одиннадцать соединений:N4-2-[2-(4-бромфенил)винил]-7-хлорхиназолин-4-ил-N1,N1-диэтилпентан-1,4-диамин, 2-[(2-гидроксиэтил)-(3-2-[2-(4-метоксифенил)винил]хиназолин-4-иламинопропил)амино]этанол. Органические непептидные соединения настоящего изобретения могут быть синтезированы стандартными методами. Соединениями настоящего изобретения и соединениями, используемыми в способах настоящего изобретения, также являются пролекарства соединений, которые стимулируют активность дикого типа белка семейства р 53. Пролекарствами являются соединения, которые, при их введении конкретному млекопитающему (а в частности, человеку), превращаются в значительных и эффективных количествах в активную молекулу. Соединения настоящего изобретения могут быть использованы в форме свободных кислот, свободных оснований или их фармацевтически эффективных солей. Указанные соли могут быть легко получены путем обработки соединения соответствующей кислотой. Примерами таких кислот являются, но не ограничиваются ими, неорганические кислоты, такие как галогеноводородные кислоты(хлористоводородная, бромисто-водородная и др.), серная кислота, азотная кислота, фосфорная кислота и т.п.; и органические кислоты, такие как уксусная кислота, пропановая кислота, 2-оксопропионовая кислота, пропандионовая кислота, бутандионовая кислота и т.п. И наоборот, указанная соль может быть превращена в свободное основание путем обработки щелочью. В. Терапевтические препараты и дозы Соединения, идентифицированные способами настоящего изобретения, могут быть использованы для лечения заболеваний, связанных с конформационно нестабильными белками или белками с неправильной укладкой. Заболевания, связанные с конформационно нестабильными белками или белками с неправильной укладкой, хорошо известны, и такими заболеваниями являются кистозный фиброз (CFTR),синдром Марфана (фибриллин), боковой амиотрофический склероз (супероксид-дисмутаза),цинга (коллаген), болезнь "кленового сиропа"(прион), болезнь Альцгеймера (бета-амилоид),наследственный амилоидоз (лизоцим), катаракта (кристаллины), наследственная гиперхолистеринемия (рецептор LDL), заболевание, связанное с дефицитом 1-антитрипсина, болезнь Тея-Сакса (бета-гексозаминидаза), пигментный ретинит (родопсин) и лепречаунизм (инсулиновый рецептор). Само собой разумеется, что описанные здесь способы и соединения особенно полезны для лечения раковых заболеваний, а в частности, для лечения раковых заболеваний,связанных с генами мутантного р 53. Следует отметить, что, исходя из медицинских возможностей лечащего врача или пациента, желательно фактически любое облегчение или предотвращение нежелательного симптома,связанного со степенью тяжести заболевания, а в частности, степенью тяжести ракового заболевания (например боли, повышенной чувствительности, потери веса и т.п.). Кроме того, что касается тяжести ракового заболевания, то желательно любое снижение массы опухоли или замедление ее роста, а также улучшение гистопатологической картины данной опухоли. Таким образом, используемые в настоящей заявке термины "лечение", "терапевтическое применение" или "использование в медицине" относятся к использованию любой и всех заявленных композиций, предназначенных для лечения болезненного состояния или симптомов, либо, для предотвращения, подавления, замедления или реверсии прогрессирования заболевания или других нежелательных симптомов каким-либо иным способом. Эффективная доза и схема лечения могут быть определены стандартными методами, с первоначальным введением низкой дозы лабораторным животным, и последующим увеличением дозы с проведением мониторинга эффектов и систематическим варьированием схемы введения доз также. Для определения максимальной толерантной дозы (или МТД) биоактивного агента на килограмм массы тела, обычно проводят эксперименты на животных, а предпочтительно, на млекопитающих. Для определения эффективности доз и во избежание их токсического действия на другие виды животных, включая человека, каждый специалист в данной области может соответствующим образом экстраполировать эти дозы. Перед исследованием, проводимым с участием человека, установить безопасные дозы для нормальных индивидуумов помогают клинические исследования на Фазе I. При определении оптимальной дозы для данного индивидуума, врачом должны учитываться многие факторы. Главным среди этих факторов является токсичность и время полужизни выбранного гетерологичного генного продукта. Другими 28 факторами являются вес, возраст и общее состояние здоровья пациента, конкретное раковое заболевание, подвергаемое лечению, тяжесть заболевания, использование пациентом других лекарственных средств, in vivo-активность данного генного продукта и т.п. Испытуемые дозы должны быть выбраны после ознакомления с результатами исследований на животных и с медицинской литературой. Как показано ниже в конкретном рабочем варианте осуществления изобретения, доза 200 мг/кг/день является дозой, наиболее эффективной для ингибирования и/или подавления роста опухоли у животной модели с имплантированной раковой опухолью человека. На основании этих результатов, можно сделать вывод, что обычная доза соединения X, которая может быть использована для лечения рака у человека,составляет от 0,1 до 10 г/день и может быть введена внутривенно (i.v.) или непосредственно в опухоль, либо она может быть введена перорально, в зависимости от состояния индивидуума. Само собой разумеется, что для соединений с различными уровнями эффективности и/или токсичности, эти величины должны быть соответственно скорректированы. Кроме того, дозы могут вводиться с двукратным или многократным увеличением дозы в день. Соединения, используемые в способах настоящего изобретения, могут быть также изготовлены в виде имплантируемого приспособления с медленным высвобождением для пролонгированного и замедленного введения лекарственного средства. Примерами таких препаратов пролонгированного высвобождения являются композиции из биологически разлагаемых полимеров, таких как поли(молочная кислота),поли(молочная-и-гликолевая кислота), метилцеллюлоза, гиалуроновая кислота, коллаген и т.п. Структура, выбор и использование разлагаемых полимеров в носителях для доставки лекарственного средства описаны в нескольких публикациях, включая, A. Domb et al., Polymersfor Advanced Technologies 3:279-292 (1992). Дополнительные сведения по выбору и использованию полимеров в фармацевтических композициях можно найти в работе М. ChasinR,Langer (eds.), "Biodegradable Polymers as Drugal. (выданном 12 ноября 1996). В частности, если рассматривается использование in vivo, то различными биохимическими компонентами настоящего изобретения являются предпочтительно компоненты высокой степени чистоты и, в основном, не содержащие потенциально вредных примесей (например, по крайней мере, относящихся к категории натурального пищевого продукта (NF), а в основном, имеющих, по крайней мере, аналитическую чистоту, а предпочтительно, по крайней 29 мере, фармацевтическую чистоту). Учитывая то,что данное соединение должно быть синтезировано до его использования, такой синтез или последующая очистка, должна предпочтительно приводить к получению продукта, в основном,не содержащего каких-либо потенциально токсичных агентов, которые могут быть использованы в процессе синтеза или очистки. В целях использования для лечения раковых заболеваний у индивидуума в одном из своих аспектов настоящее изобретение также относится к набору или к упаковке в форме стерильного сосуда или ампулы, которая, как очевидно, содержит соединения, эффективные для осуществления способов настоящего изобретения. В одном варианте осуществления изобретения, указанный набор содержит соединение настоящего изобретения, такое как соединениеY, соединение Х или соединение Z, в виде готовой для введения композиции, либо в виде разовой лекарственной формы, либо в виде многократных доз, где указанная упаковка имеет этикетку с инструкцией по использованию ее содержимого для лечения рака. Альтернативно и в соответствии с другим вариантом осуществления изобретения данная упаковка включает в себя стерильный сосуд или ампулу, содержащую указанное соединение. С. Методы доставки лекарственного средства Каждая или все указанные стадии скрининга соединений, которые взаимодействуют с белком семейства р 53, а в частности, с ДСД р 53,и/или влияют на его активность дикого типа,могут быть скорректированы для высокоэффективного анализа в целях выявления соединенийкандидатов. Высокоэффективный скрининг хорошо известен специалистам в данной области и может быть осуществлен в любом формате. Так,например, могут быть использованы анализыELISA, техника сцинтилляционной аппроксимации, анализы на конкурентное связывание и анализы на заместительное связывание. Лабораторная автоматизация, включая роботизированную технологию, может в значительной степени снизить время, необходимое для скрининга большого числа соединений, и является коммерчески доступной, например поставляемой компаниями Tecan, Scitec, Rosys, Mitsubishi,CRS Robotics, Fanuk и Beckman-Coulter Sagian,не говоря уже о других компаниях. После идентификации соединений-кандидатов (или одновременно с их идентификацией), может быть осуществлен второй скрининг для определения клеточного и/или in vivo-действия данных соединений на активность белка семейства р 53. 1. Белки семейства р 53, на которые направлены способы и композиции настоящего изобретения Белок р 53 присутствует во всех эукариотических организмах. В соответствии с этим,белки р 53 и ДСД р 53, используемые в способах и композициях настоящего изобретения, могут 30 быть получены или могут происходить от любой эукариотической клетки, включая грибы(например, Drosophila) и млекопитающие (например, мышь и/или человек), хотя предпочтительными являются белки р 53 человека. Были идентифицированы и другие гомологии р 53 млекопитающих с родственными структурами и функциями, а именно р 63 и р 73; и такие белки семейства р 53, и например, их соответствующие ДСД, могут быть также использованы в способах и композициях настоящего изобретения. Кроме того, в способах и композициях настоящего изобретения могут быть использованы белки семейства р 53 (определенные в настоящем описании), которые еще предстоит обнаружить. Как указывалось выше, белок р 53 содержит, по крайней мере, три различных домена: домен активации транскрипции, локализованный у амино-конца; центральный ДСД; и домен олигомеризации у карбоксильного конца. Кроме того, у карбоксильного конца данного белка присутствует домен негативной регуляции. Большинство миссенс-мутаций р 53, связанных с раком человека, встречается в ДСД. Способы и соединения настоящего изобретения направлены на стабилизацию конформации любой из указанных миссенс-мутаций. Особенно предпочтительными мишенями являются мутантные р 53, содержащие одну или несколько так называемых "горячих точек" для образования мутаций в положениях остатков 175, 245, 248, 249,273 и 282 (все положения остатков даны для последовательности р 53 человека; аналогичные положения остатков в белках р 53 других организмов могут быть легко определены путем сопоставительного анализа гомологии с последовательностью человека). Другие наиболее распространенные мутации в р 53 встречаются в положениях 132, 135, 138, 141, 143, 146, 151,152, 154, 157, 158, 159, 163, 173, 176, 179, 186,194, 196, 213, 220, 237, 238, 241, 242, 258, 266,272, 278, 280, 281, 285 и 286; эти мутанты также являются объектом настоящего изобретения. Кроме того, настоящее изобретение проиллюстрировано нижеприведенными рабочими примерами, где показана конформационная стабилизация следующих мутантных белков р 53: 143 А,173 А, 175S, 241D, 249S и 273 Н. Раковыми заболеваниями, связанными с миссенс-мутациями в белках р 53, а в частности,в ДСД белка р 53, являются, но не ограничиваются ими, карцинома толстого кишечника, карцинома мочевого пузыря, гепатоцеллюлярная карцинома, карцинома яичника, карцинома легких, карцинома молочной железы, плоскоклеточная карцинома головы и шеи, карцинома пищевода, карцинома щитовидной железы и нейрогенные опухоли, такие как астроцитома,ганглиобластома и нейробластома. Вышеуказанные раковые заболевания и другие заболева 31 ния могут быть подвергнуты лечению способами и соединениями настоящего изобретения. ДСД р 53 находится приблизительно в области аминокислотных остатков 100-300. Было показано, что резистентные к протеолизу центральные остатки 102-292 являются достаточными для связывания ДНК, и кристаллическая структура ДСД р 53 была выявлена для остатков 94-312 (Cho et al., 1994, Science 265, 246; Friend,1994, Science 265, 334). В соответствии с этим,для использования в способах настоящего изобретения, N-конец домена ДСД р 53 может начинаться с остатков 50-110, а предпочтительно он может начинаться в каком-либо месте между остатками 94-102. С-конец ДСД р 53 может заканчиваться у остатков 286-340, а предпочтительно он может заканчиваться между остатками 292-312."Термодинамически дестабилизированные мутанты р 53" представляют собой мутанты,которые не сохраняют одно или несколько функциональных свойств р 53, таких как связывание с ДНК при физиологических температурах (то есть, около 37 С), но которые, при этом,восстанавливают эту(эти) функцию(ии) при пониженных температурах или в других условиях. Так, например, все наиболее распространенные мутанты сохраняют свою способность связываться с ДНК in vitro при низкой температуре(Friedlander et al., см. выше). 2. Форматы анализов а. Форматы анализов на связывание В основе анализов, используемых для идентификации соединения, которые просто связываются с ДСД белка семейства р 53, лежит получение реакционной смеси белка ДСД и тестируемого соединения в условиях и в течение периода времени, достаточных для взаимодействия и связывания указанных двух компонентов с образованием комплекса, который может быть выделен и/или детектирован в реакционной смеси. Вид используемого ДСД может варьироваться в зависимости от цели скринирующего анализа. Так, например, в случае поиска соединений, которые взаимодействуют с конкретным связывающим доменом, может быть использован полноразмерный белок семейства р 53, содержащий указанный связывающий домен; сам ДСД; или гибридный белок,содержащий ДСД, присоединенный к белку или полипептиду, который является наиболее подходящим для данной аналитической системы(например, для мечения, выделения полученного комплекса и т.п.). Пептиды, полученные от ДСД для использования в данном методе, должны содержать, по крайней мере, 6, предпочтительно 10, более предпочтительно 20, а еще более предпочтительно 30 или даже 50 или более следующих друг за другом аминокислот ДСД. Анализы в целях скрининга могут быть проведены различными способами. Так, например, один из способов проведения такого анали 003326 32 за предусматривает заякоривание ДСД-белка,полипептида, пептида или гибридного белка,либо тестируемого вещества на твердой фазе, и детекцию комплексов ДСД/тестируемого соединения, заякоренных на твердой фазе после завершения реакции. В одном из вариантов такого способа, ДСД-реагент может быть заякорен на твердой поверхности, а тестируемое соединение, которое не является заякоренным, может быть помечено прямым или непрямым методом. При этом, могут быть использованы любые подходящие системы мечения, включая, но не ограничиваясь ими, радиоактивные изотопы,такие как 125I и 32P, системы мечения ферментами, которые продуцируют детектируемый колориметический сигнал или излучение при экспонирование субстратом, и флуоресцентные метки. В другом предпочтительном варианте данного способа, ДСД-белок, заякоренный на твердой фазе, представляет собой комплекс с меченным антителом. Затем, тестируемое соединение может быть проанализировано на его способность к разрушению ассоциации комплекса ДСД/антитело. На практике в качестве твердой фазы обычно используют микротитрационные планшеты. Заякоренный компонент может быть иммобилизован путем нековалентного или ковалентного связывания. Нековалентное связывание может быть осуществлено путем простого покрытия твердой поверхности раствором белка и сушки. Альтернативно, для заякоривания белка на твердой поверхности, может быть использовано иммобилизованное антитело, а предпочтительно, моноклональное антитело, специфичное для иммобилизуемого белка. Указанные поверхности могут быть приготовлены заранее и оставлены на хранение. Для проведения анализа, на покрытую поверхность, содержащую заякоренный компонент, добавляют неиммобилизованный компонент. После завершения реакции, непрореагировавшие компоненты удаляют (например, промывкой) в определенных условиях, так чтобы любой из образовавшихся комплексов оставался иммобилизованным на твердой поверхности. Детекция комплексов, заякоренных на твердой поверхности, может быть осуществлена различными способами. Если, пока еще неиммобилизованный компонент был предварительно помечен, то детекция метки, иммобилизованной на этой поверхности, указывает на образование комплексов. Если ранее неиммобилизованный компонент не был ранее помечен, то для детекции комплексов, заякоренных на этой поверхности, может быть использована непрямая метка,например меченное антитело, специфичное для данного неиммобилизованного компонента (антитело, в свою очередь, может быть подвергнуто прямому или непрямому мечению меченным антителом против Ig). 33 В других вариантах осуществления настоящего изобретения связывание может быть детектировано и без использования прямой или непрямой метки. Так, например, может быть проанализировано биофизическое свойство,изменяющееся в случае, когда происходит связывание. Системой твердых носителей, особенно подходящих для указанного скрининга, является система BIAcore 2000, поставляемая фирмой BIAcore, Inc. (Piscataway, NJ). УстройствоBIAcore (http:// www.biacore.com) предусматривает использование оптического феномена поверхностного плазменного резонанса (ППР) для мониторинга биоспецифических взаимодействий в реальном времени. ППР-эффект представляет собой, в основном, очень слабое электрическое поле, на которое влияют локальные изменения в показателе поглощения на границе раздела металл - жидкость. Сенсорную микросхему изготавливают по типу "сэндвича" из золотой пленки, находящейся между стеклом и карбоксиметилдекстрановой матрицей, с которой химически связан анализируемый лиганд или белок. Эту сенсорную микросхему монтируют на жидкостный картридж, создающий проточные кюветы, через которые могут быть инжектированы соединения-аналиты. Взаимодействие лиганд-аналит на сенсорной микросхеме детектируют как изменение угла луча поляризованного света, отраженного от поверхности микросхемы. Связывание любой массы с данной микросхемой влияет на ППР в слое золота/декстрана. Это изменение электрического поля в золотом слое влияет на отраженный луч света и изменяет угол отражения пропорционально количеству связанной массы. Отраженный свет детектируется на диодной матрице и преобразуется в сигнал связывания, выраженный в единицах ответа (ЕО). Поскольку ответ прямо пропорционально зависит от связанной массы, то могут быть измерены кинетические константы и константы равновесия для взаимодействия белок-белок. Альтернативно, реакция может быть проведена в жидкой фазе и могут быть детектированы продукты этой реакции, выделенные из непрореагировавших компонентов, и комплексы.b. Способы измерения конформации белка семейства р 53 Конформация белка р 53 может быть измерена любым из ряда различных способов. Так,например, для зондирования конформации ДСД р 53 могут быть использованы антитела. Предпочтительные способы настоящего изобретения предусматривают использование моноклональных антител, которые являются специфичными по отношению к активной (например, ДНКсвязывающей) или неактивной (термодинамически неустойчивой или неправильно уложенной или развернутой) конформациям р 53 и/или ДСД р 53. Так, например, mAb1620 распознает эпитоп 34 на ДСД р 53, который непосредственно связан с противоопухолевой активностью белка р 53. Ballet al., 1984, EMBO J.3:1485-1491; Gamble et al.,1988, Virology 162:452-458. Таким образом,mAb 1620 не связывается с ДСД р 53, если он имеет неактивную конформацию. И наоборот,эпитоп, распознаваемый mAb 240, подвергается воздействию в том случае, если р 53 является инактивированным вследствие мутации, либо в том случае, если р 53 дикого типа является денатурированным (Bartek et al, 1990, Oncogene 5,893-899; Stephen et al., 1992, J. Mol. Biol. 225,577-83). Другие моноклональные антитела, которые уже известны или которые еще предстоит обнаружить и которые являются конформационно-специфичными, также могут быть использованы в способах настоящего изобретения. Такие антитела полезны благодаря тому, что они могут легко адаптируются для высокоэффективного скрининга. Способы получения антител,включая моноклональные антитела, хорошо известны специалистам. Другими способами измерения конформации белка семейства р 53, такого как р 53 или ДСД р 53, являются, но не ограничиваются ими,абсорбция красителей, спектроскопия (например, круговой дихроизм, ЯМР), эксклюзионная хроматография, ультрацентрифугирование, анализ на специфическое связывание с ДНК (например, при физиологических температурах, но не при пониженных температурах) и анализ на специфическое связывание с белком (например,большой Т-антиген SV40 связывается только с активной конформацией дикого типа, но не с неактивной конформацией). Как указывалось выше, многие из наиболее часто встречающихся мутаций р 53 не могут связываться с ДНК при физиологических температурах, но могут связываться с ДНК при пониженных температурах. Следовательно, одним из аспектов способа измерения конформации белка семейства р 53 в присутствии тестируемых соединений является температурная зависимость. Конформацию измеряют, предпочтительно, при физиологических температурах(около 38 С); примерно в диапазоне 20-50 С, а более предпочтительно в диапазоне 35-42 С. Конформация белка-мишени может быть также измерена за период времени, составляющий от нескольких минут до нескольких часов или более. Если в скрининге используется белок р 53 дикого типа или ДСД р 53 дикого типа, то нагревание обычно проводят дольше и при более высоких температурах, чем при использовании мутантного ДСД р 53. Каждый специалист может легко определить соответствующую температуру на основании информации, представленной в настоящем описании. Кроме того, анализ на связывание соединения и анализ на любое изменение конформации белка семейства р 53 могут быть проведены одновременно. В указанном анализе, изменение 35 конформации белка семейства р 53 в присутствии тестируемого соединения можно оценивать как положительный результат. Анализы, проиллюстрированные ниже неограничивающими примерами, представляют собой высокоэффективный скрининг, позволяющий тестировать соединения, которые взаимодействуют с ДСД р 53, вызывая конформационные изменения. Указанный высокоэффективный скрининг позволяет идентифицировать класс соединений,пригодных для использования в способах настоящего изобретения. При температурах, близких к физиологическим, эти соединения усиливают стабильность конформационно-чувствительного эпитопа для mАb1620 на белке дикого типа и на различных мутантах белка р 53. Низкие микромолярные концентрации соединения дают кратковременное увеличение конформационной стабильности эпитопа в живых клетках и позволяют мутанту р 53 активировать транскрипцию. Как будет более подробно описано ниже, органическое непептидное соединение модулирует конформацию и функцию р 53 при его введении мышам, имеющим опухоли с мутантным р 53, и значительно ингибирует рост ксенотрансплантатов опухоли человека, имеющей природный мутированный р 53. с. Анализы, проводимые на клетках и на животных После идентификации соединенийкандидатов методами первичного скрининга,описанного выше, обычно проводят анализы на клетках или экспериментальных животных для определения эффекта соединений-кандидатов в данных системах. Предварительный анализ может предусматривать использование клеточных линий, происходящих от опухолей, имеющих мутантный ген, кодирующий белок семейства р 53, или клеточных линий, модифицированных так, чтобы они экспрессировали мутантный белок семейства р 53. Затем оценивают действие соединений-кандидатов на любую одну (или на все) из активностей дикого типа белка семейства р 53. Так, например, индуцирование WAF1 в присутствии соединения-кандидата указывает на то, что данное соединение способствует сохранению функции в мутантном р 53 путем стимуляции его специфических ДНК-связывающих свойств, а не просто каких-либо связывающих свойств без всякого различия. При этом, может быть рассмотрен любой ген, негативно или позитивно регулируемый белком р 53, или другими членами семейства р 53. Другими активностями белков семейства р 53 являются ингибирование роста и апоптоз. Ингибирование роста может быть легко оценено под микроскопом в клетках тканевой культуры или с помощью анализа на образование колоний. Апоптоз может быть визуализирован путем окрашивания TUNEL или путем окрашивания пропидийиодидом и проточной цитометрией. 36 Кроме того, для скрининга как на токсичность, так и на эффективность соединенийкандидатов могут быть использованы животные-модели. Так, например, у животногомодели могут быть индуцированы опухоли,имеющие мутантный р 53, и этому животному вводят соединения-кандидаты. Затем оценивают токсичность и рост опухоли. Рабочие примеры такого скрининга представлены ниже. 3. Источники соединений для скрининга Соединениями, которые могут быть скринированы в соответствии с настоящим изобретением, являются, но не ограничиваются ими,малые органические молекулы, которые способны проникать в клетку и воздействовать на активность белка семейства р 53. Имеются коммерчески доступные библиотеки соединений,поставляемые рядом компаний, такими какPharmacopeia, Arqule, Enzymed, Sigma, Aldrich,Maybridge, Trega и PanLabs, не говоря уже о других источниках. В целях выявления соединений, которые взаимодействуют с ДСД р 53,может быть также проведен скрининг библиотек известных соединений, включая натуральные продукты или синтетические химические соединения, и биологически активные материалы, включая белки. Однако предпочтительными соединениями являются небелковые или непептидные соединения (то есть, цепь из 3 или более аминокислот, связанных пептидными связями). Антитела представляют собой пептиды, которые являются иммуноглобулинами или антигенсвязывающими фрагментами иммуноглобулина; при этом, предпочтительные соединения также не являются антителами. Конкретные классы и примеры соединений, используемых в способах настоящего изобретения, описаны ниже. После идентификации соединения, которое стимулирует активность дикого типа белка семейства р 53, могут быть использованы методы молекулярного моделирования в целях конструирования вариантов соединения, которые являются более эффективными. Примерами систем для молекулярного моделирования являются CHARM (Polygen Corporation, Waltham, MA) и QUANTA (программы Molecular SimulationsInc., San Diego, CA). CHARM позволяет осуществлять минимизацию энергии и молекулярных динамических функций. QUANTA позволяет осуществлять конструирование, графическое моделирование и анализ молекулярной структуры. QUANTA позволяет осуществлять интерактивное конструирование, модификацию, визуализацию и анализ поведения молекул по отношению друг к другу. Так, например, после идентификации соединения, которое стимулирует активность дикого типа белка семейства р 53, данное соединение может быть использовано для построения гипотезы. Как будет более подробно описано ниже, предпочтительная гипотеза заключается в том, что планарная полициклическая гидрофоб 37 ная группа находится на расстоянии примерно 5(пять) -9 (девять) ангстрем, а более предпочтительно, 6 (шесть) - 8 (восемь) ангстрем от полярного амина. Данная гипотеза может быть построена на основе любого одного из соединений настоящего изобретения с использованием программы Catalyst (Molecular Simulations Inc.,San Diego, CA). Кроме того, программа Catalyst может использовать эту гипотезу для поиска патентованных баз данных, а именно базы данных малых молекул Cambridge (Cambridge,England), а также других баз данных, упомянутых выше, в целях идентификации дополнительных примеров соединений настоящего изобретения. Соединения настоящего изобретения могут быть, кроме того, использованы для конструирования более эффективных вариантов с использованием пакетов программ для моделирования, таких как Ludi, Insight II, C2-Minimiszerand Affinity (Molecular Simulations Inc., San Diego, CA). Особенно предпочтительным пакетом программ для моделирования является MacroModel (Columba University, NY, NY). Соединения настоящего изобретения могут быть также использованы в качестве базы для разработки рациональной комбинаторной библиотеки. Такая библиотека может быть также скринирована на более эффективные соединения. Хотя природа комбинаторной библиотеки зависит от таких факторов, как соединение,конкретно выбранное из предпочтительных соединений настоящего изобретения в целях создания базы для данной библиотеки, и от цели синтеза указанной библиотеки с использованием полимера; однако, при этом, следует отметить, что соединения настоящего изобретения дают возможность получить нужные данные,подходящие для программ комбинаторного конструирования, таких как C2-QSAR (MolecularSimulations Inc., San Diego, CA). Настоящее изобретение описано в нижеследующих примерах, которые приводятся лишь в иллюстративных целях и не ограничивают объема изобретения.VI. Пример 1. Анализ на термостабилизацию ДСД р 53. Был разработан высокоэффективный анализ с использованием ДСД р 53 дикого типа. С использованием данного анализа были скринированы фармакологические соединения, и те соединения, которые стабилизируют активную конформацию ДСД, рассматривались как положительный результат. А. Материалы и методы Анализ на термостабилизацию. Рекомбинантный ДСД (остатки 94-312),происходящий от белков р 53 дикого типа и мутантных белков р 53 и FLAG-меченный ДСД р 53 получали как описано в литературе (Pavletish et 38 ными белками являлись 143 А, 173 А, 175S, 249S и 273 Н. Был протестирован ряд низкомолекулярных органических соединений. Маточные растворы соединений растворяли в ДМСО при 10 мг/мл и разводили перед использованием. Белки (0,25-1,0 нг/лунку) разводили в буфере,содержащем 25 мМ HEPES, рН 6,8, 150 мМ KСl,10 мМ дитиотреитола, и связывали в 50 мкл с микротитрационными планшетами Reacti-Bind(Pierce) в течение 35 мин на льду. Лунки промывали 25 мМ HEPES, рН 6,8, 150 мМ КСl, добавляли соединение или разведенный ДМСО в качестве носителя и планшеты инкубировали при указанных температурах. Инкубирование прекращали путем помещения лунок на лед; осуществляли ELISA-анализы, однако, во избежание дополнительных альтераций эпитопов планшеты выдерживали на льду. Перед добавлением "первых" антител, лунки блокировали в течение 1 ч холодным 5% сепарированным молоком (Difco) в буфере HEPES/KCl. Моноклональные антитела mAb1620, mАb240 (Calbiochem) и антитело М 2 против FLAG (EastmanHEPES/KCl и добавляли в концентрации 100 мкл/лунку в течение 30 мин. Планшеты дважды промывали холодным буфером HEPES/KCl и инкубировали с антителом против мышиныхIgG (Boehringer, Mannheim), конъюгированным с пероксидазой хрена (ПХ) в течение еще 30 мин. ПХ-сигнал формировали с использованием проявителя ТМВ (Pierce) и оптическую плотность данного сигнала считывали на микропланшет-ридере BioRad при 450 нм. В. Результаты Конформация ДСД р 53 является термолабильной. Эпитоп, распознаваемый mAb 1620,зависит от конформации, и его присутствие на р 53 тесно связано с противоопухолевой активностью белка (Ball et al., 1984, см. выше; Gambleand Milner, 1988, см. выше). И наоборот, эпитоп,распознаваемый mAb240, представляет собой линейный эпитоп, который подвергается воздействию в том случае, когда р 53 инактивирован вследствие мутации, или в том случае, когда р 53 дикого типа денатурирован (Bartek et al.,1990, Oncogene 5, 853-899; Stephen and Lane,1992, J. Mol. Biol., 225, 577-583). Рекомбинантный ДСД р 53 (остатки 94-312), при переходе от активной конформации в неактивную конформацию in vitro, постепенно теряет эпитоп 1620,но при этом, аккумулирует эпитоп 240. Очищенный ДСД р 53, иммобилизованный на микротитрационных планшетах, нагревали до температуры, близкой к физиологической, и зондировали антителом mАb1620 в формате ELISA. Эпитоп 1620 теряется в зависимости от температуры и времени (фиг. 1 А). Потеря эпитопа 1620 специфически связывается с потерей конформации, поскольку эпитоп FLAG, который был связан с ДСД, оставался полностью стабильным (фиг.В). Кроме того, потеря эпитопа 39 1620, происходящая одновременно с увеличением частоты встречаемости эпитопа 240, позволяет предположить, что потеря эпитопа 1620 свидетельствует о конформационном изменении в ДСД р 53, а не о потери иммобилизованного белка. Время полужизни эпитопа 1620 на ДСД р 53 дикого типа составляло приблизительно 35 мин при 23 С и постепенно снижалось при более высоких температурах в течение менее чем 5 мин при 45 С (фиг. 1 А). Параллельно ДНКсвязывающая способность ДСД р 53 в анализе на подвижность в геле снижалась при нагревании в растворе (данные не приводятся). Время полужизни эпитопа 1620 на ДСД р 53 дикого типа примерно в два раза превышало время полужизни этого эпитопа на мутантном ДСД р 53 при 37 С (фиг. 1 С). Эти данные соответствуют полученным ранее сообщениям о снижении термодинамической стабильности для некоторых других мутантных белков р 53 и свидетельствуют о том, что эпитоп 1620 может быть использован для мониторинга конформации ДСД р 53(Bullock и др., 1997, см. выше). Соединения стабилизируют конформацию р 53. Для идентификации соединений, которые стабилизируют активную конформацию р 53 и способствуют лучшему сохранению функции дикого типа мутантными белками, использовали анализ ELISA. Некоторые соединения ингибировали потерю эпитопа для mАb1620 при физиологической температуре (например, см. фиг. 2 А). Относительную способность данных соединений определяли в экспериментах по титрованию путем измерения концентрации, необходимой для стабилизации 50% эпитопа дляmАb1620. Активные соединения стабилизировали данный эпитоп дозозависимым образом(фиг. 2 В). Растворитель ДМСО и некоторые аналоги активных соединений обнаруживали неспособность к такой стабилизации (фиг. 2 В,см. табл. 1 и 2). Полноразмерный белок р 53 дикого типа также стабилизировался соединениями, как и ДСД от нескольких мутантных белков р 53 (данные не приводятся, фиг. 2 С). В присутствии соединения эти мутантные белки были такими же стабильными, как и белок дикого типа в отсутствии соединения. Хотя данные соединения способствовали сохранению эпитопа для mАb1620, однако, они не спасают р 53, который уже потерял данный эпитоп. Так, например, при нагревании ДСД р 53 перед добавлением соединения Y какого-либо увеличения реактивности mAb1620 не наблюдалось. Несмотря на снижение скорости потери эпитопа в присутствии соединения, более длительное нагревание приводило к окончательной потери 1620-положительной конформации. Кроме того, данное соединение, очевидно, не 40 связывается необратимо с р 53, поскольку добавление и отмывка соединения Y перед инкубированием при 37 С не предотвращала потерю эпитопа (данные не приводятся). Эти результаты соответствуют модели, где взаимодействие ДСД р 53 с соединением позволяет данному белку более стабильно поддерживать функциональную конформацию,распознаваемуюmАb1620. Структура активных соединений Во всех идентифицированных активных соединениях гидрофобная группа (планарная полициклическая) и катионная группа (в большинстве случаев амин) связаны друг с другом посредством линкера конкретной длины. Бензимидазол, бензохинолин, фенотиазин и стирилхиназолин в гидрофобном (R1)-положении были активными, тогда как при незначительных изменениях эти группы и простые бициклические или моноциклические группы были неактивными в конкретных тестируемых условиях(табл. 1). Соединения называются "активными" в данном анализе, если имеется более, чем 10 кратное различие между двумя соответствующими парами (см. табл. 1) количеств соединения, необходимых для стабилизации 50% эпитопа для mАb1620. Таким образом, следует отметить, что соединения, считающиеся неактивными в данном анализе, не являются абсолютно неактивными, а являются лишь относительно неактивными. В соответствии с этим, активными катионными (R2) группами являются диметиламин, диэтиламин, диэтаноламин, метиламин, метилпиперазин и морфолин (табл. 1). Некоторые более крупные амины были соответственно более активными при их тестировании в фенотиазиновом ряду. Отрицательно заряженные или незаряженные группы, такие как карбоксильная или бензольная группы в положенииR2 являются неактивными, как было определено в данном анализе (табл. 1). Расстояние между группами R1 и R2 также имеет важное значение для активности соединения в данном анализе,поскольку линкеры, которые по своей длине короче, чем пропил, способствуют снижению относительной активности соединения (табл. 2). Бутильные линкеры немного менее эффективны, чем пропильные линкеры, однако, соединения, в которых присутствовали более длинные линкеры, обнаруживали меньшую активность в данном анализе (табл. 2 и данные не приводятся). Разветвленные линкеры, которые поддерживают правильное расстояние, давали, в основном, большую активность, чем соответствующие линейные линкеры. Эти общие наблюдения не ограничивают объема настоящего изобретения и могут быть использованы на практике настоящего изобретения для получения других молекул. 41 Таблица 1. Зависимость активности от структурных особенностей данных соединений"Активный" и "неактивный" означают 10 кратное различие в эффективности соответствующих пар соединений. Относительную эффективность определяли по количеству соединения, необходимого для стабилизации 50% эпитопа для mАb1620 в экспериментах по титрованию. Таблица 2. Зависимость активности от расстояния между группами R1 и R2 Концентрация соединения, необходимая для сохранения 50% эпитопа для mАb1620, присутствующего на 0,5 нг ДСД р 53, нагретого при 45 С в течение 30 мин. С. Обсуждение Эти результаты продемонстрировали истинность принципа, на основе которого была разработана новая стратегия восстановления функции мутанта р 53 и были получены противораковые терапевтические средства. В данном примере сообщается об обнаружении первого семейства соединений, способных воздействовать на выделенный ДСД, и тем самым, промотировать его конформационную стабильность.VII. Пример 2. Определение конформации р 53 в клетках и опухолях. В этом примере и в примерах, приведенных ниже, было показано, что соединенияпрототипы действуют при низких микромоляр 003326 42 ных концентрациях, модулируя функцию мутантного р 53 в живых клетках и в опухолях и подавляя рост опухолей, содержащих природный мутированный р 53. А. Материалы и методы Клеточная культура. Все клеточные линии были получены из АТСС и культивированы в рекомендованных средах в 10% фетальной телячьей сывороткой(Gibco BRL). Определение конформации р 53. клеток Приблизительно 1 х 107 Н 1299/репортер + мутантный р 53 обрабатывали в течение ночи, промывали три раза холодным забуференным трисом физиологическим раствором и лизировали в 1,5 мл гипотонического буфера для лизиса (20 мМ HEPES, рН 7,4, 10 мМ NaCl, 20% глицерин, 0,2 мМ EDTA, 0,1% Тритон-Х 100, 10 мМ дитиотреитол с ингибиторами протеазы). Клетки осаждали в микроцентрифужных пробирках при 2000 об/мин в течение 5 мин при 4 С и экстракты ядер получали ресуспендированием осадка в том же самом буфере с 0,5 М NaCl. Опухолевые образцы гомогенизировали в гомогенизаторе Даунса с использованием трех объемов вышеуказанного буфера с 0,5 М NaCl. Лизаты осветляли центрифугированием при 10000 об/мин в течение 10 мин при 4 С. Экстракты ядер нормализовали на содержание р 53, определенное количественным Вестерн-блот-анализом с использованием антитела mAbDO-1, и р 53 был иммобилизован на лунках планшетов MaxiSorp F96 (Nunc), которые были сенсибилизированы в течение ночи при 4 С антителом mAbDO-1 при 1 мкг/мл в 0,05 М карбонатном буфере, рН 9,6. Эти лунки промывали холодным PBS, блокировали в течение 3 ч при 4 С с использованием четырехпроцентного сепарированного молока в PBS и зондировали с использованием конъюгированного с пероксидазой хрена (ПХ) антитела mАb1620 в сепарированном молоке. Инкубирование антитела проводили в течение 1 ч на льду, после чего лунки три раза промывали в PBS 0,05%-ным твином 20 и использовали субстрат ТМВ для обнаружения сигнала. Стандартную кривую строили с использованием лизата от термоподвижных клеток Н 1299/репортер + мутантный р 53 (32 С), которые экспрессировали 1620 положительный р 53. Оценку образцов проводили по указанной стандартной кривой и полученное значение корректировали на количество полного р 53 в каждом образце, а также на фракцию 1620-положительного р 53 в необработанных лизатах. В. Результаты Стабилизация конформации в клетках. Способность соединений стабилизировать 1620-положительную конформацию клеточного р 53 тестировали в живых клетках, экспрессирующих исключительно мутантный р 53. Клетки Н 1299, которые не содержали р 53, трансфеци 43 ровали опухолевым мутантом р 53 (в положении 173) и для отбора клона, экспрессирующего избыточное количество мутантного белка, проводили Вестерн-блот-анализ с использованием антитела (mAbDO-1) против конформационно нечувствительного р 53. Низкие стационарные уровни белка р 53, который имел эпитоп дляmАb1620, детектировали в экстрактах от трансфектантов, что свидетельствовало о том, что малая фракция мутантного р 53 может сохранять активную конформацию (Chen et al., 1993, Oncogen 8, 2159-2166). Низкие микромолярные концентрации соединения Х способствовали примерно 5-кратному увеличению стационарной фракции 1620-положительного р 53 в клетках (фиг. 3 А). Через 4-6 ч после обработки достигались максимальные уровни обогащения эпитопом. Полное количество р 53 оставалось неизменным, как было определено по реактивности с антителом mAbDO-1, которое направлено против конформационно нечувствительного эпитопа, локализованного на амино-конце данного белка. С. Обсуждение Полученные результаты показали, что стабилизирующие конформацию соединения,идентифицированные методами настоящего изобретения, могут стабилизировать активную конформацию р 53 в живых клетках. Соединения, которые восстанавливают мутантный р 53 в опухолях, могут действовать либо на все нефункциональные пулы р 53, либо на субсерию р 53, которая имеет эпитоп для mАb1620. Главной мишенью для описанных здесь соединений,очевидно, является вновь синтезированный мутантный р 53, который еще сохраняет активную конформацию. Действительно, эти соединения повышали персистентность 1620-эпитопа, но они были неспособны восстанавливать 1620 эпитоп, который был уже потерян вследствие предварительного нагревания in vitro. Соединения, которые повышают стабильность активной конформации вновь синтезированного р 53,должны способствовать аккумуляции устойчивых уровней функционального р 53 в зависимости от времени. Наблюдаемое четырехчасовое запаздывание достижения максимального уровня 1620-эпитопа в клетках подтверждает данную гипотезу (фиг. 3 А).VIII. Пример 3. Восстановление функции р 53. А. Материалы и методы Анализы на трансактивацию. Клетки трансфецировали экспрессирующими плазмидами, кодирующими мутантные белки р 53 (173 А, 249S) и неомицинселективный маркер, с использованием катионного липидного реагента трансфекции DOTAP(Boehringer Mannhiem) или фосфата кальция. Клетки также трансфецировали плазмидой, кодирующей маркерный ген устойчивости к гигромицину и ген-репортер для р 53, состоящий из 44 четырех копий связывающей последовательности р 53, соответствующей связывающей последовательности р 53 в промоторной области гена тимидинкиназы вируса простого герпеса (основания 26-58 тимидинкиназы из Genbank под номером доступа S57428, которые начинаются с последовательности GCCTTGCCT и заканчиваются последовательностью TGCCTTTTC), расположенной выше от базального промотораSV40, под контролем которого находится ген люцифиразы. Соответствующую клеточную пару получали путем трансфекции клона клеток, содержащего репортерную конструкцию,дополнительной конструкцией для экспрессии мутантного р 53. Трансфецированные клоны отбирали для культивирования в средах, содержащих гигромицин или G418, если это необходимо. Монослои клеток в 96-луночных планшетах для культивирования тканей (Costar) обрабатывали соединением, и активность люциферазы определяли с использованием анализа на превращение субстрата (Promega) и количественно оценивали с помощью люминометра для микропланшетов Dinatech. Экспрессия WAF1 и р 53. Культивированные клетки обрабатывали в течение 21 ч, промывали 3 раза холодным забуференным трисом физиологическим раствором,соскабливали и осаждали при 10000 об/мин в течение 30 с, а затем их ресуспендировали в 50 мМ HEPES, рН 7,5, 0,1% NP-40, 250 мМ NaCl, 5 мМ EDTA, 50 мМ NaF, 1 мМ DTT, 50 мкг/мл апротинина, 1 мг/мл Pefabloc (Boehringer Mannhiem). Концентрации белка определяли с использованием реагента Брэдфорда (BioRad) и 5 или 10 мг клеточного лизата загружали на 8-16 процентные градиентные полиакриламидные гели с ДСН (Novex). Белки переносили на мембрану Immobilon P (Millipore) в буфере Тоубина(Towbin et al., 1979, Proc. Natl. Acad. Sci.: USA 76, 4350) с 20% метанолом. Мембраны рассекали пополам между маркерами молекулярной массы 32,5 и 47,5 кДа и блокировали в течение 1 ч при комнатной температуре в Superblock(Pierce) + 3% сепарированное молоко. Нижнюю половину блота зондировали на экспрессиюWAF1 с использованием клона моноклонального антитела ЕА 10 (Calbiochem WAF1-Ab-1), a верхнюю половину блота зондировали на экспрессию полного р 53 с использованиемmAbDO-1 (Calbiochem p53-Ab-1). Эти блоты промывали в течение одного часа в забуференном трисом физиологическом растворе с тремя заменами, содержащем 0,1-процентный твин 20,а затем добавляли "второе" конъюгированное с ПХ антитело против мышиных IgG. Полосы визуализировали методом электрохемилюминесценции с использованием Renaissance ECL 45 В. Результаты Восстановление функции р 53 в клетках. Для того, чтобы определить, может ли стабилизация конформации р 53 приводить к лучшему сохранению функции дикого типа, авторы настоящего изобретения провели оценку последовательность - специфическая транскрипционная активность р 53. Клетки Н 1299 трансфецировали р 53-индуцибельным геном-репортером люциферазы и стабильный клон (Н 1299/репортер) вторично трансфецировали мутантным р 53 с получением соответствующего клона, экспрессирующего как ген-репортер, так и р 53, мутантный по положению 173 (Н 1299/репортер + мутантный р 53). Соединения усиливали транскрипционную активность мутантного р 53, как было определено по индуцированию генарепортера (фиг. 3 В). Низкие уровни активации транскрипции наблюдались в клетках Н 1299/репортер, что может быть обусловлено присутствием гомолога р 53, р 73 (данные не приводятся). Хотя, авторами настоящего изобретения еще не было установлено, могут ли эти соединения усиливать активность р 73, однако, значительное р 53-зависимое усиление индуцирования гена-репортера дает основание предположить, что р 53 является главной мишенью в данных клетках. р 53-Зависимая активация генарепортера происходит при относительно небольшом диапазоне концентраций, поскольку эффективность данных соединений при более высоких дозах ограничена отслаиванием клеток. Усиление транскрипционной активности достигало пика через 12-16 ч после обработки (данные не приводятся). Это наблюдение соответствует экспрессии гена-репортера, происходящей как вторичное событие после стабилизации функциональной конформации р 53, которая имеет место через 4-6 ч после обработки. В анализах на индуцирование генарепортера соединение Y давало лучшие результаты, чем соединение X. Это может быть объяснено вторичным эффектом соединения Y, вызывающим повреждение ДНК и приводящим к повышению уровней белка р 53 (фиг. 3 В). Соединение Y, но не соединение X, увеличивает уровни полного белка р 53 при концентрациях,необходимых для клеточной активности. Для подтверждения того, что не только повреждение ДНК ответственно за индуцирование соединением Y гена-репортера для р 53, авторы настоящего изобретения проанализировали действие агента адриамицина, вызывающего повреждение ДНК. Адриамицин, несмотря на свою способность индуцировать аккумуляцию мутантного р 53 в клетках, не индуцирует ген-репортер в широком диапазоне концентраций (0,4-40 мкг/мл) (данные не приводятся). Эти результаты показали, что стимулировать специфическую транскрипционную активность может конформационная стабилизация, но не аккумуляция мутантного р 53. В частности, соединение X, 003326 46 которое не повышает устойчивые уровни полного белка р 53, очевидно, восстанавливает транскрипционную функцию р 53 только благодаря конформационной стабилизации. Соединение Х позитивно регулируетWAF1, р 53-чувствительный клеточный генный продукт в присутствии мутантного р 53. Клетки остеосаркомы Saos-2, которые не экспрессируют р 53, трансфецировали векторами экспрессии мутантного р 53 и выделяли клоны, экспрессирующие любой из двух мутантов (по положению 173 или по положению 249). Эти клоны экспрессировали более низкие базальные уровни WAF1 по сравнению с родительскими клетками Saos-2, что возможно позволило заявителям выбирать более быстро растущие клоны. Эти клетки обрабатывали соединением Х в течение 16 ч и лизаты, представляющие равные количества белка, подвергали Вестерн-блотанализу на присутствие р 53 и WAF1. Клетки,которые экспрессировали любой из двух мутантных белков р 53, но не родительские клеткиSaos-2, имели повышенные уровни экспрессииWAF1 после обработки (фиг. 4). Полное количество белка р 53 в данных лизатах оставалось, в основном, неизмененным. Хотя адриамицин повышает уровень экспрессии WAF1 в клетках(данные не приводятся), он не индуцирует экспрессию WAF1 в клетках Saos-2 с мутантным р 53. С. Обсуждение Способ действия описанных здесь агентов,стабилизирующих конформацию, явно отличается от наблюдаемого способа действия традиционных цитотоксических противоопухолевых агентов. Цитотоксические агенты, используемые в химиотерапии, являются, в основном,неэффективными в клетках с мутантным р 53et al., Cancer Res. 57, 4285-4300). Действительно,в анализах, проведенных заявителями, ДНКповреждающий агент адриамицин не восстанавливал транскрипционную активность мутанта р 53. Цитотоксические соединения были также идентифицированы по явному индуцированию полного белка р 53 в нормальных и опухолевых клетках. Соединение Х не индуцировало уровни полного белка в клетках или в опухолях. Поскольку индукция р 53 является чувствительной мерой повреждения клеточной ДНК, то маловероятно, что соединение Х может повреждать ДНК при эффективных концентрациях. В итоге можно сказать, что результаты, полученные заявителями, указывают на то, что стабилизация 1620-позитивной конформации и функциональное восстановление активности мутантного р 53 может происходить по механизму, не зависящему от повреждения ДНК. Некоторые факты свидетельствовали о предотвращении неспецифического действия на стабилизацию белка. Глицерин, неспецифиче 47 ский ингибитор денатурации белка, который действует путем вытеснения воды и создания более гидрофобного микроокружения вокруг молекул белка, может восстанавливать ядерную локализацию мутантного мышиного белка р 53 в клетках при концентрации 600 мМ (Broun et al.,1997, J. Clin. Invest., 99, 1432-1444). В данном анализе, соединение Х было активным при 0,03 мМ, что дает основание предположить о гораздо более явном взаимодействии, включающем контактирование данного соединения и р 53 (данные не приводятся). Кроме того, наблюдение того факта, что соединение Х может влиять на конформацию р 53 в присутствии большого избыточного количества других белков в культуре иin vivo (см. ниже), подтверждает селективное распознавание р 53. К тому же, механизм взаимодействия соединения с р 53 может не предусматривать тесное связывание со структурой нативного белка. Сильное взаимодействие с небольшой субсерией молекул белка, которые находятся в переходном состоянии, может приводить к блокированию последующего отклонения от активной конформации или облегчать восстановление указанной нативной конформации.IX. Пример 4. Анализ на рост опухоли. А. Материалы и методы Анализ на рост опухоли. Культивированные клетки промывали(BASF). Диаметр опухоли измеряли в двух осевых плоскостях с использованием штангенциркуля и вычисляли объем опухоли (Euhus et al.,1986, J. Surg. Oncol. 31, 229-234). В. Результаты Модуляция р 53 in vivo Соединение Х повышало устойчивые уровни р 53-фракции, которая имела эпитоп дляmАb1620 в опухолях с мутированным р 53. Данное соединение вводили внутрибрюшинно при концентрации 100 мг/кг мышам, имеющим подкожные опухоли, образованные путем инъекции клеток Н 1299/репортер + мутантный р 53. После введения одной дозы данного соединения мышей умерщвляли и опухолевые лизаты анализировали на экспрессию полного и 1620 позитивного р 53. Уровни полного р 53 оставались неизменными, как было измерено с помощью Вестерн-блот-анализа с использованиемmAbDO-1. Лизаты нормализовали на небольшие отклонения в содержании полного р 53 и тестировали с помощью ELISA на экспрессию эпитопа для mАb1620. Уровень данного эпитопа возрастал через 3-5 ч после обработки (фиг. 5). Время продуцирования ответа in vivo было ана 003326 48 логично времени продуцирования ответа культуральными клетками (фиг. 3 А). Для оценки функционального восстановления мутантного р 53 in vivo авторы настоящего изобретения оценивали экспрессию генарепортера люциферазы в опухолях от обработанных и необработанных животных. Максимальное 4,5-кратное увеличение индуцирования гена-репортера наблюдалось через 8 ч после введения дозы (фиг. 5). Промежуток времени между конформационным и функциональным ответами может указывать на время, необходимое для трансляции транскрипта люциферазы и аккумуляции белка. Максимальная концентрация соединения в плазме мыши составляла приблизительно 10 мг/мл, что ниже концентрации,требуемой для максимального индуцирования гена-репортера в клетках (данные не приводятся). Поэтому более низкие уровни индуцирования гена-репортера в опухолях по сравнению с культивированными клетками могут быть обусловлены субоптимальной обработкой. С. Обсуждение Полученные результаты показали, что соединения, стабилизирующие конформацию,могут функционально восстанавливать ряд произвольно выбранных мутантов. Таким образом,способы и соединения настоящего изобретения могут широко применяться для различных мутантов р 53. Так, например, мутация в положении 241 в клетках DLD-1, которая влияет на минорный сайт взаимодействия с ДНК, может быть функционально комплементирована посредством стабилизирующей активности соединения X. Поэтому, большое число мутантов р 53,включая некоторые мутанты по сайтам взаимодействия с ДНК, могут быть восстановлены после стабилизации активной конформации. Несмотря на стабилизацию конформации как р 53 дикого типа, так и мутантного р 53 invitro, соединение Х обнаружило терапевтическую селективность in vivo. Действительно,данное соединение является безопасным, и при его введении мышам в дозе 200 мг/кг/день (100 мг/кг два раза в день) в течение 14 дней подряд гибели мышей не наблюдалось (данные не приводятся). Такая селективность может быть обусловлена очень низкими устойчивыми уровнями р 53 в нормальных клетках по сравнению с гораздо более высокими уровнями р 53 в опухолевых клетках (Lassus et al., 1996, EMBO J. 15 б 4566-4573). Кроме того, опухоль-специфические стрессы, такие как повреждение ДНК и истощение кислорода и питательных веществ, могут способствовать апоптотическому действию р 53 преимущественно на опухолевые клетки (Chenet al., 1996, Genes and Dev. 10, 2438-2451). Если это имеет место, то могут быть достигнуты синергические противоопухолевые эффекты путем объединения терапии р 53-стабилизирующими соединениями с облучением или терапией генотоксическими средствами. 49 Каждому специалисту в данной области для осуществления настоящего изобретения достаточно ознакомиться с вышепривиденным описанием изобретения. Действительно, в объем нижеследующей формулы изобретения входят различные модификации вышеописанных способов настоящего изобретения, которые являются очевидными для каждого специалиста в области молекулярной биологии, медицины или в родственных областях. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ лечения рака у человека, включающий стадииa) введения указанному субъекту органического непептидного соединения, которое способно связываться с одним или более доменами человеческого белка семейства р 53 в физиологических условиях и стабилизировать его функциональную конформацию, иb) взаимодействия указанного стабилизированного белка с одной или более макромолекулами, которые принимают участие в обеспечении активности дикого типа указанного белка. 2. Способ по п.1, где указанный белок выбран из группы, состоящей из р 53, р 63 и р 73. 3. Способ по п.1, где указанный белок является р 53. 50 4. Способ по п.1, где указанное органическое непептидное соединение связывается с ДНК-связывающим доменом, остатками 94-312 человеческого белка р 53. 5. Способ по п.1, где белок семейства р 53,на который целенаправленно воздействует указанное органическое непептидное соединение,является белком дикого типа. 6. Способ по п.1, где белок семейства р 53,на который целенаправленно воздействует указанное органическое непептидное соединение,является мутантом, кодируемым аллельным вариантом. 7. Способ по п.1, где ДНК-связывающий домен указанного белка включает миссенсмутацию по положению аминокислоты, выбранной из группы, состоящей из остатков 143,173, 175, 241 и 249 белка р 53. 8. Способ по п.1, где стадии а) и b) осуществляют последовательно. 9. Способ по п.1, где стадии а) и b) осуществляют одновременно. 10. Способ по п.1, где указанное раковое заболевание связано с наличием мутантного белка семейства р 53, имеющего одну или более пониженных активностей дикого типа.
МПК / Метки
МПК: A61K 31/5415, G01N 33/50, A61P 35/00
Код ссылки
<a href="https://eas.patents.su/27-3326-sposob-lecheniya-raka.html" rel="bookmark" title="База патентов Евразийского Союза">Способ лечения рака</a>
Предыдущий патент: 19-норстероиды, галогенированные в положении 17, способы их получения и их применение, промежуточные продукты и фармацевтические композиции, их содержащие
Следующий патент: Антивирусные соединения
Случайный патент: Способ и устройство для контроля доступа к сосудам, а также устройство для экстракорпоральной обработки крови с устройством для контроля доступа к сосудам












