Способы и соединения, предназначенные для получения ингибиторов котранспортера натрий-глюкозы 2 типа
Номер патента: 17411
Опубликовано: 28.12.2012
Авторы: Чжао Мэттью Манчжу, Янь Цзе, Мейбон Росс, Иимура Синия, Гудвин Николь Кэтлин, Сонг Цюлин, Чжан Хаймин, У Вэньсюэ, Харрисон Брайс Олден
Формула / Реферат
1. Способ получения соединения формулы I
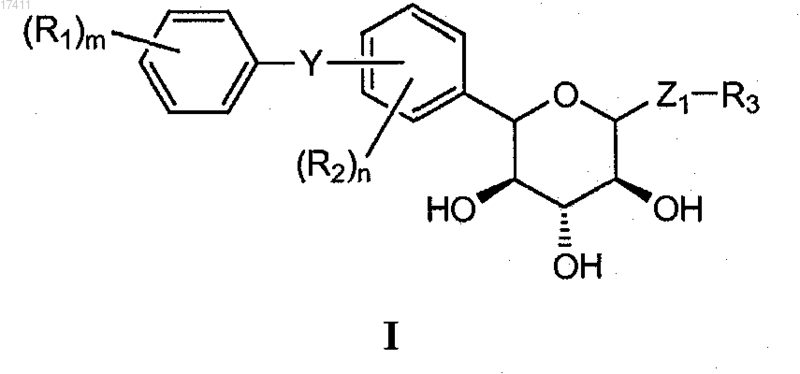
или его соли, который включает взаимодействие соединения формулы II
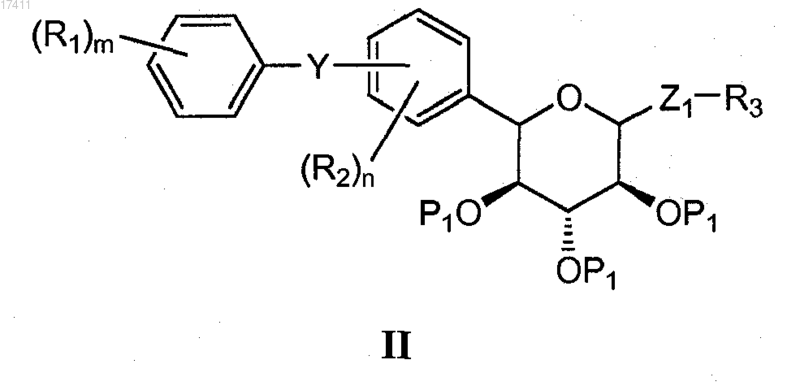
с основанием с получением соединения формулы I,
где Y представляет собой О, S, NR4 или C(R4)2;
Z1 представляет собой О, S, SO или SO2;
каждый Р1 независимо представляет собой гидроксизащитную группу, устойчивую в кислых условиях;
каждый R1 независимо представляет собой водород, галоген, циано, OR1A SR1A или C1-10алкил;
каждый R1A независимо представляет собой водород, или C1-10алкил, или С6-12арил;
каждый R2 независимо представляет собой водород, галоген, циано, OR2A, SR2A или C1-10алкил;
каждый R2A независимо представляет собой водород, или C1-10алкил, или С6-12арил;
R3 представляет собой C1-10алкил, С6-12арил или С5-12гетероциклил, представляющий собой ароматическое, частично ароматическое или неароматическое моноциклическое или полициклическое кольцо или систему колец, содержащий по меньшей мере один гетероатом, выбранный из N, О или S;
каждый R4 независимо представляет собой водород или C1-10алкил;
n равно 1-3;
m равно 1-3.
2. Способ по п.1, где соединение формулы I представляет собой соединение формулы

или
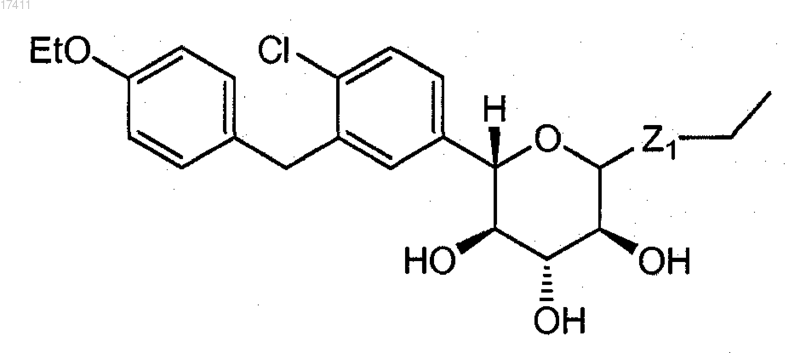
где Z1 представляет собой S или SO2,
3. Способ по п.1, где Z1 представляет собой SO2 и соединение формулы II получают окислением (например, с использованием пероксидного соединения, такого как м-хлорпербензойная кислота, перуксусная кислота, оксон или смесь пероксида водорода или комплекса пероксида водорода (например, мочевины с пероксидом водорода) и ангидрида кислоты (например, фталевый ангидрид)) соединения формулы II(а)
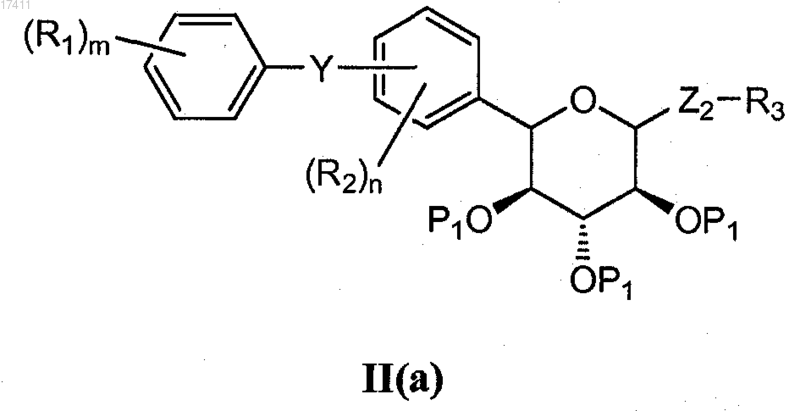
где Z2 представляет собой S или SO.
4. Способ по одному из пп.1-3, который дополнительно включает кристаллизацию соединения формулы I.
5. Способ получения соединения формулы II(b)
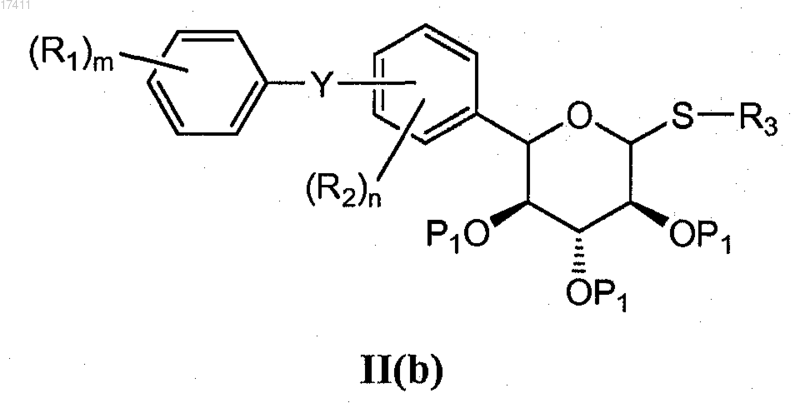
или его соли, который включает взаимодействие соединения формулы II(c)
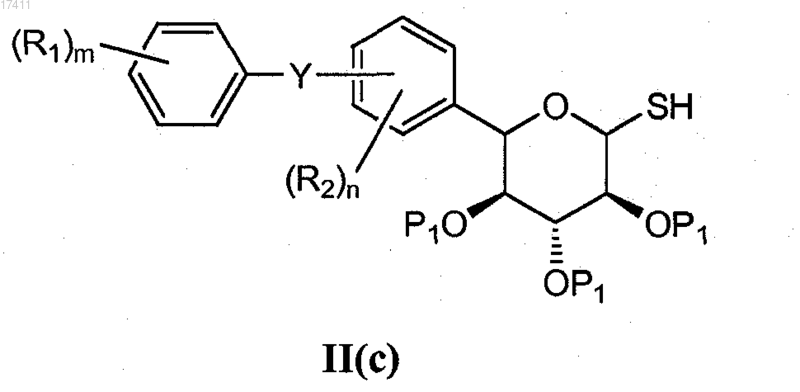
с соединением формулы R3X в основных условиях,
где X представляет собой бром, йод, C1-10алкансульфокси или C1-10алкоксисульфокси;
Y представляет собой О, S, NR4 или C(R4)2;
каждый P1 независимо представляет собой гидроксизащитную группу, устойчивую в кислых условиях;
каждый R1 независимо представляет собой водород, галоген, циано, OR4, SR4 или C1-10алкил;
каждый R2 независимо представляет собой водород, галоген, циано, OR4, SR4 или C1-10алкил;
R3 представляет собой C1-10алкил, С6-12арил или С5-12гетероциклил, представляющий собой ароматическое, частично ароматическое или неароматическое моноциклическое или полициклическое кольцо или систему колец, содержащий по меньшей мере один гетероатом, выбранный из N, О или S;
каждый R4 независимо представляет собой водород или C1-10 алкил;
n равно 1-2;
m равно 1-2.
6. Способ по п.5, где соединение формулы II(b) представляет собой соединение формулы
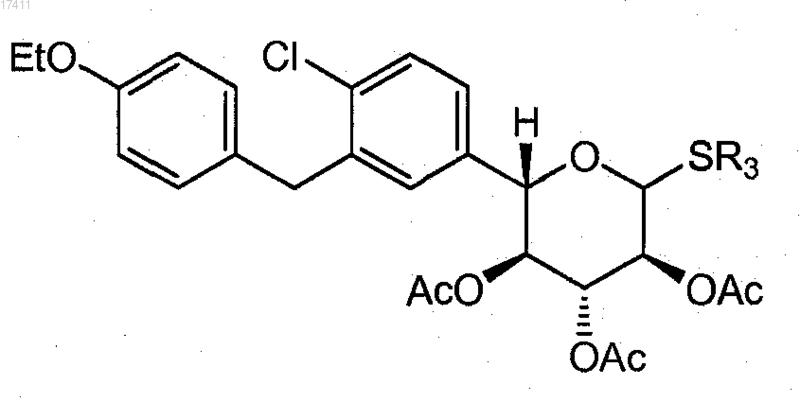
7. Способ по п.5, где соединение формулы II(c) получают взаимодействием соединения формулы II(d)
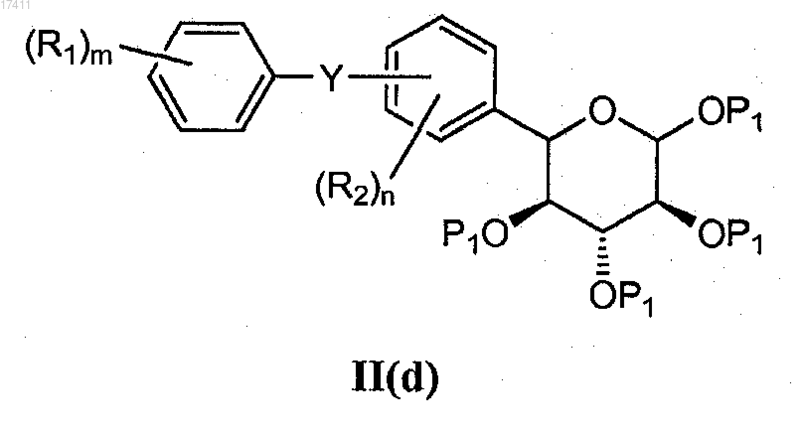
с кислотой Льюиса (например, такой как триметилсилилтрифторметансульфонат) и тиомочевиной.
8. Способ получения соединения формулы II(d)
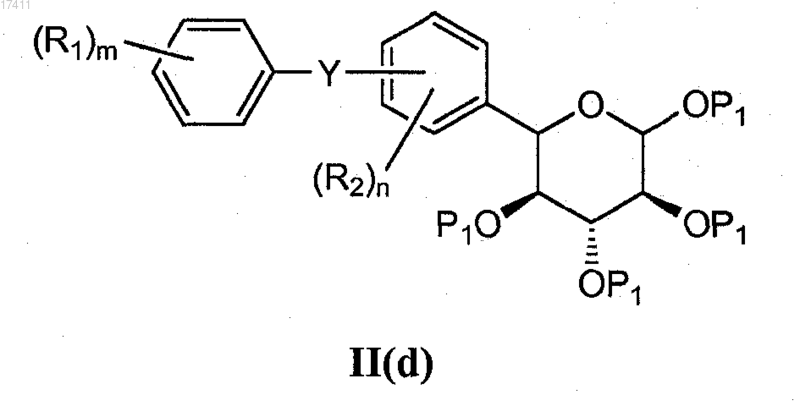
или его соли, который включает взаимодействие соединения формулы II(e)
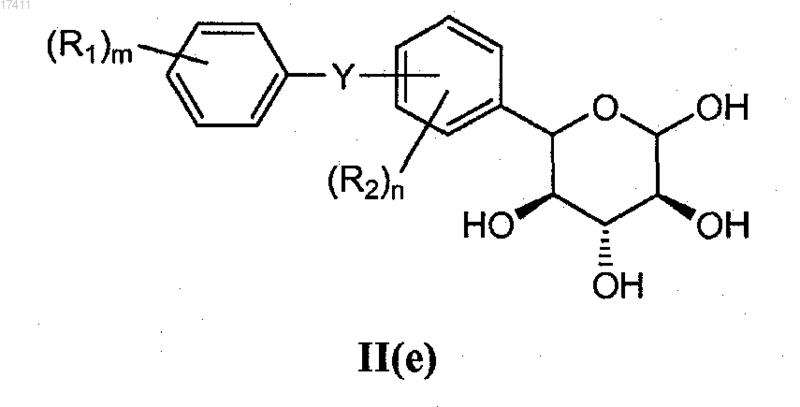
с солью P1X'" с получением соединения формулы (IId),
где X'" представляет собой хлор, бром, йод, C1-10алкилкарбокси, C1-10алкансульфокси или C1-10алкоксисульфокси;
Y представляет собой О, S, NR4 или C(R4)2;
каждый Р1 независимо представляет собой гидроксизащитную группу, устойчивую в кислых условиях;
каждый R1 независимо представляет собой водород, галоген, циано, OR4, SR4 или C1-10алкил;
каждый R2 независимо представляет собой водород, галоген, циано, OR4, SR4 или C1-10алкил;
каждый R4 независимо представляет собой водород или C1-10алкил;
n равно 1-2;
m равно 1-2.
9. Способ по п.8, где соединение формулы II(d) представляет собой соединение формулы
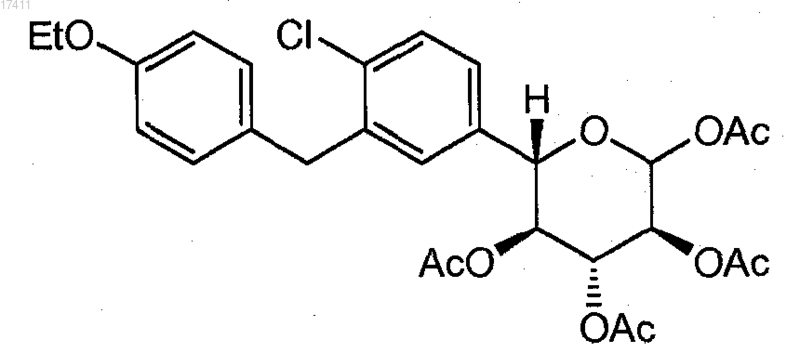
10. Способ по п.8, где соединение формулы II(e) получают взаимодействием соединения формулы III(a)
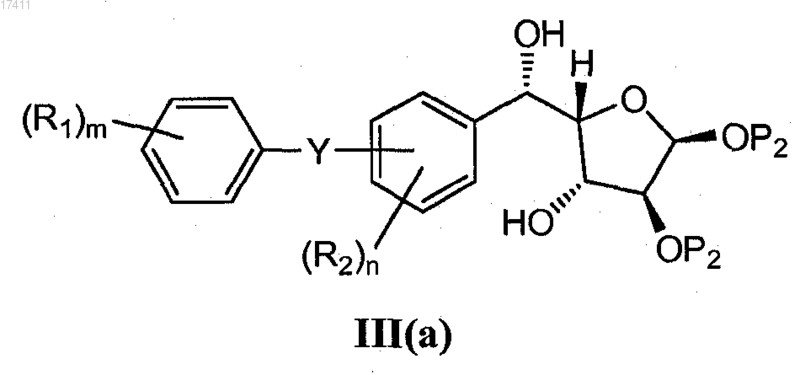
с кислотой с получением соединения II(e),
где каждый Р2 представляет собой независимо C(O)R6 или оба Р2 вместе образуют С(R6)2;
каждый R6 представляет собой независимо C1-10алкил.
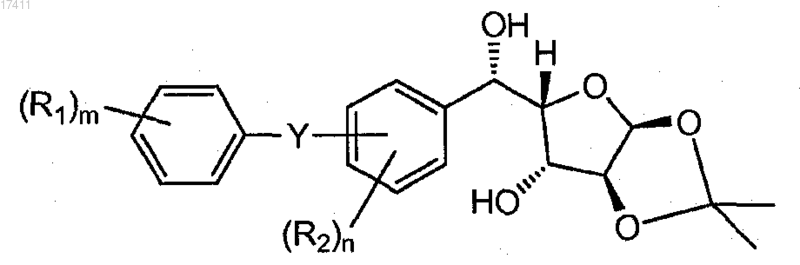
11. Способ по п.10, где соединение III(а) представляет собой соединение формулы
12. Способ по п.10, где соединение формулы III(а) получают восстановлением соединения формулы III(b)
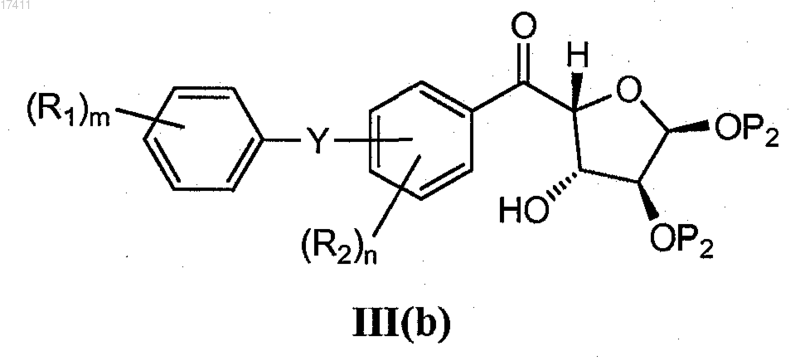
13. Способ по п.12, где соединение формулы III(b) представляет собой соединение формулы

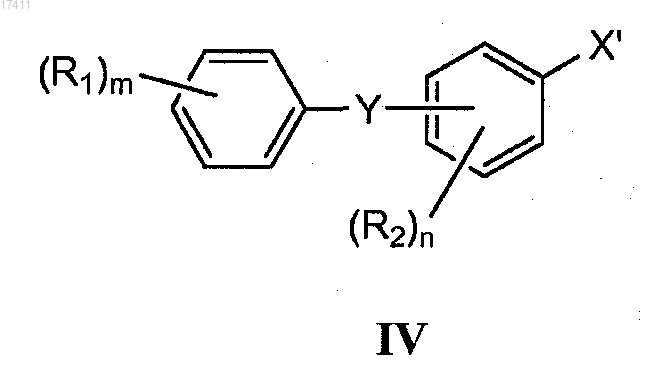
14. Способ по п.12, где соединение формулы III(b) получают путем проведения реакции сочетания соединения формулы IV
с соединением формулы V
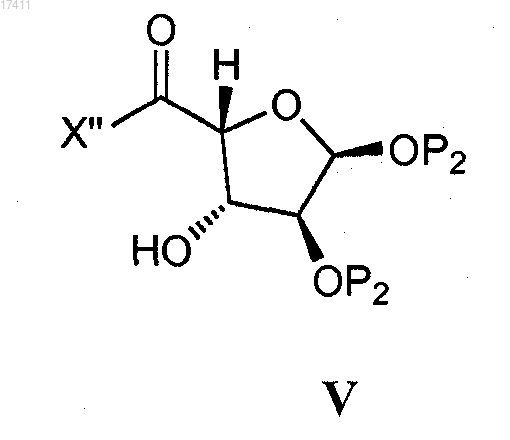
с получением соединения формулы III(b),
где X' представляет собой бром или йод;
X" представляет собой уходящую группу (например, амино, C1-10алкоксиамино, гидрокси, галоген, С1-10алкокси, фенокси, карбокси, сульфокси).
15. Способ по п.14, где соединение формулы IV представляет собой соединение формулы
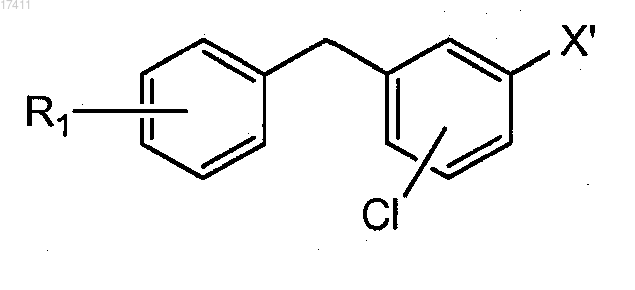
или соединение формулы IV представляет собой соединение формулы

16. Способ по п.14, где соединение формулы V представляет собой соединение формулы
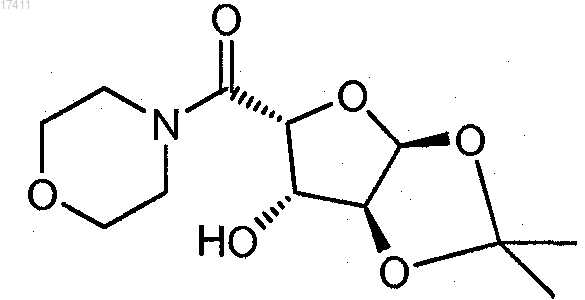
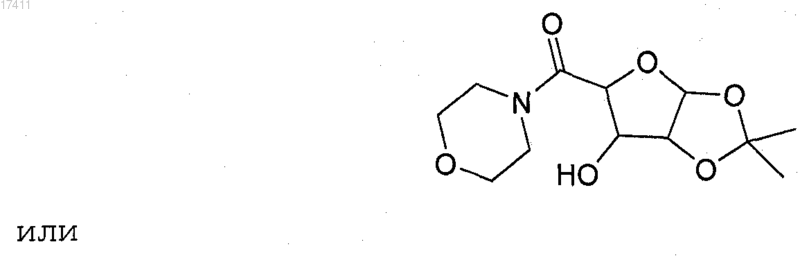
17. Способ получения ((3aS,5R,6S,6aS)-6-гидрокси-2,2-диметилтетрагидрофуро[2,3-d][1,3]диоксол-5-ил)(морфолино)метанона
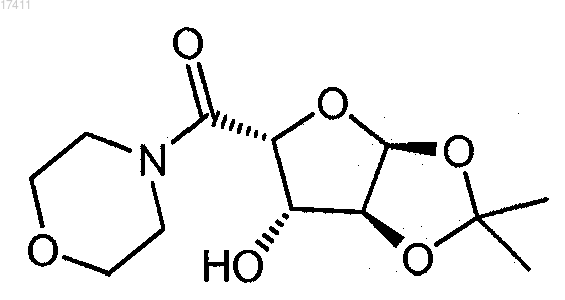
который включает взаимодействие (3aS,5R,6S,6aS)-6-гидрокси-2,2-диметилтетрагидрофуро[2,3-d][1,3]диоксол-5-карбоновой кислоты с морфолином с получением ((3aS,5R,6S,6aS)-6-гидрокси-2,2-диметилтетрагидрофуро[2,3-d][1,3]диоксол-5-ил)(морфолино)метанона.
18. Способ по п.17, где (3aS,5R,6S,6aS)-6-гидрокси-2,2-диметилтетрагидрофуро[2,3-d][1,3]диоксол-5-карбоновую кислоту получают окислением (3aS,5S,6R,6aS)-5-(гидроксиметил)-2,2-диметилтетрагидрофуро[2,3-d][1,3]диоксол-6-ола с получением (3aS,5R,6S,6aS)-6-гидрокси-2,2-диметилтетрагидрофуро[2,3-d][1,3]диоксол-5-карбоновой кислоты и где (3aS,5S,6R,6aS)-5-(гидроксиметил)-2,2-диметилтетрагидрофуро[2,3-d][1,3]диоксол-6-ол получают циклизацией L-(-)-ксилозы в присутствии ацетона с получением (3aS,5S,6R,6aS)-5-(гидроксиметил)-2,2-диметилтетрагидрофуро[2,3-d][1,3]диоксол-6-ола.
19. Соединение или его соль, где соединение представлено формулой
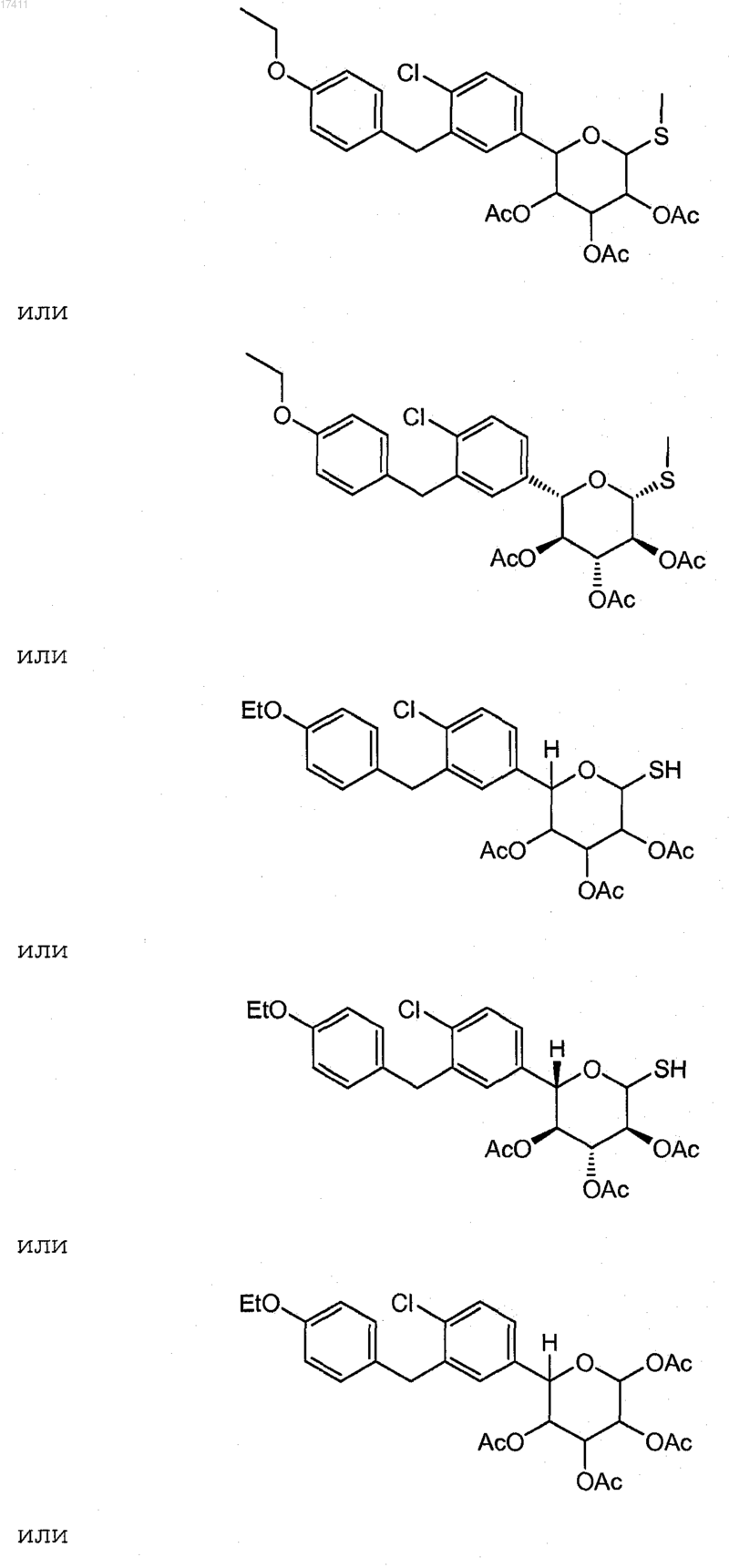
20. Соединение или его соль, где соединение представлено формулой
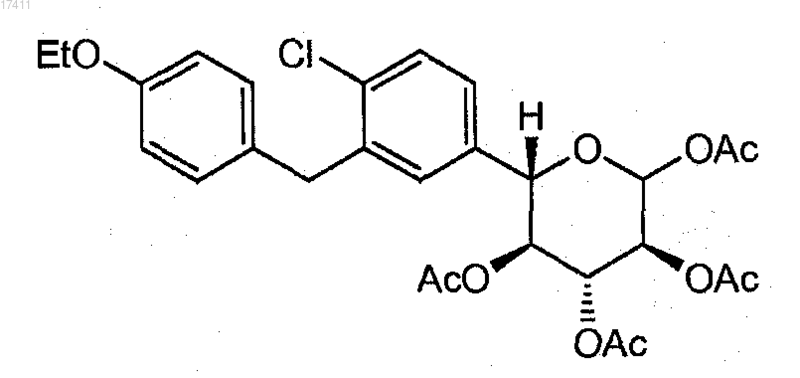
21. Соединение или его соль, где соединение представлено формулой
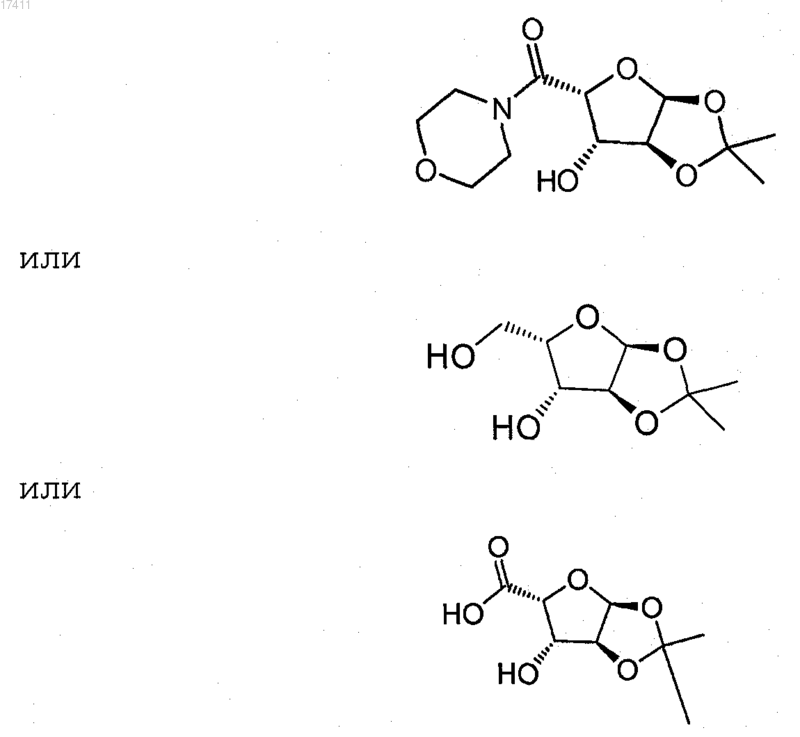
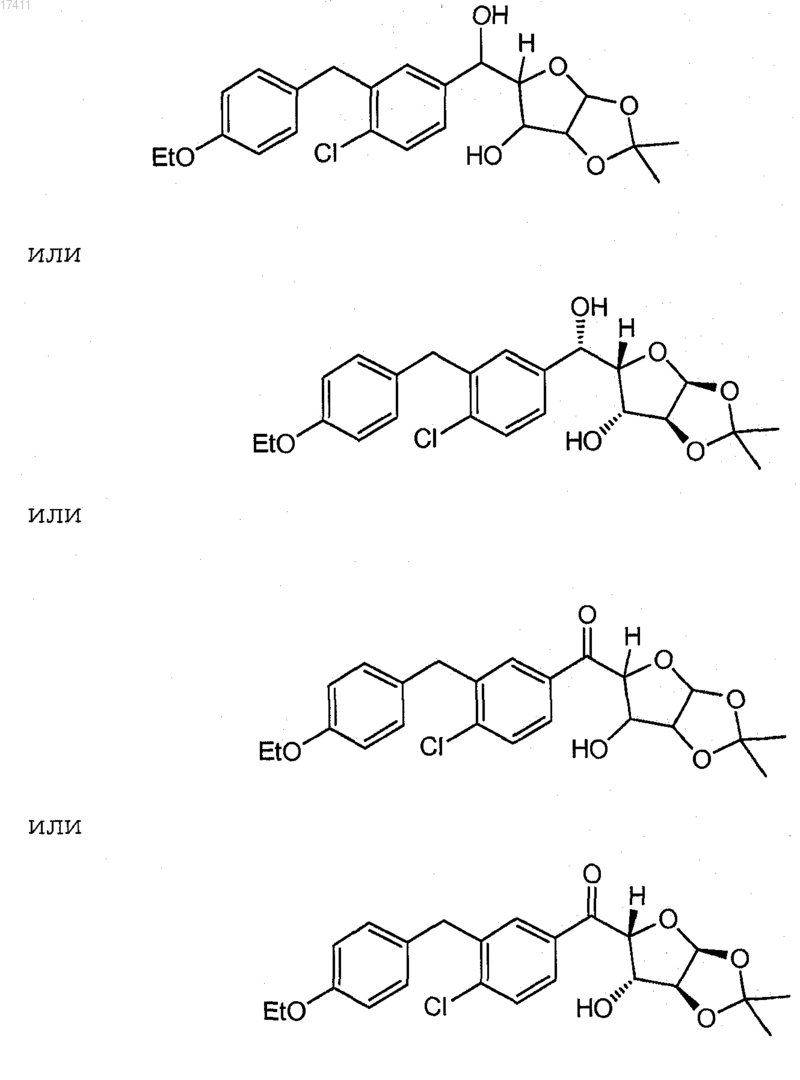
22. Соединение или его соль, где соединение представлено формулой
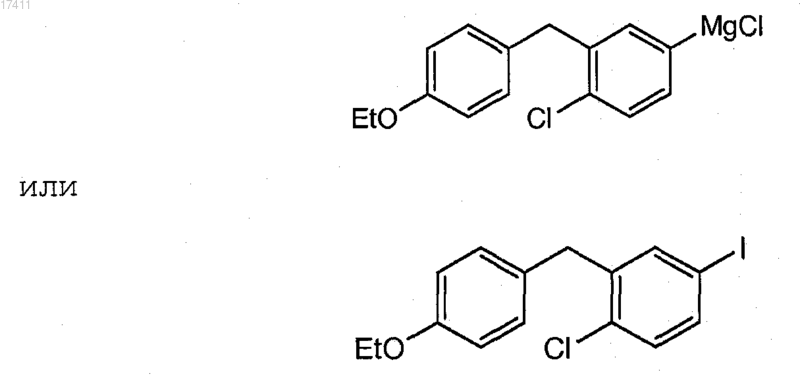
Текст
СПОСОБЫ И СОЕДИНЕНИЯ, ПРЕДНАЗНАЧЕННЫЕ ДЛЯ ПОЛУЧЕНИЯ ИНГИБИТОРОВ КОТРАНСПОРТЕРА НАТРИЙ-ГЛЮКОЗЫ 2 ТИПА Приведены описания способов синтеза ингибиторов котранспортеров натрий-глюкозы 2 типа, а также соединений, применимых здесь. Конкретными ингибиторами являются соединения формулы Гудвин Николь Кэтлин, Харрисон Брайс Олден, Иимура Синия, Мейбон Росс, Сонг Цюлин, У Вэньсюэ, Янь Цзе, Чжан Хаймин, Чжао Мэттью Манчжу (US) Медведев В.Н. (RU) 017411 По заявке на данное изобретение испрашивается приоритет на основании предварительной заявки на патент США 60/952122, поданной 26 июля 2008 г., которая во всей полноте включена в настоящее описание путем ссылки. 1. Область техники, к которой относится изобретение Настоящее изобретение относится к способам получения ингибиторов котранспортера натрийглюкозы 2 типа. 2. Уровень техники Котранспортер натрий-глюкозы 2 типа (SGLT2) представляет собой транспортер, который реабсорбирует глюкозу из почечного фильтрата и предотвращает потерю глюкозы с мочой. Так как конкурирующие ингибиторы SGLT2 вызывают почечное выведение глюкозы, они могут быть использованы для нормализации высоких уровней глюкозы в крови, связанных с такими заболеваниями, как диабет[Handlon, A.L., Expert Opin. Ther. Patents 15(11):1531-1540 (2005)]. При поиске новых лекарственных средств, которые могут использоваться для лечения диабета, был описан ряд ингибиторов SGLT2 [см., например, Handlon, выше; патент США 6515117; публикации заявок на патент США 2006/0035841 и 2004/0138439]. По меньшей мере один ингибитор является объектом клинических исследований как средство для лечения сахарного диабета типа 2, См., например,Komoroski, В., et al., "Dapagliflozin (BMS-512148), a Selective Inhibitor of the Sodium-Glucose Uptake Transporter 2 (SGLT2), Reduces Fasting Serum Glucose and Glucose Excursion in Type 2 Diabetes Mellitus PatientsOver 14 Days". American Diabetes Assn. 67th Scientific Sessions. Abstract 0188-OR (2007). 3. Сущность изобретения Настоящее изобретение относится к способу получения соединения формулы I или его соли, который включает взаимодействие соединения формулы II с основанием с получением соединения формулы I,где Y представляет собой О, S, NR4 или C(R4)2;Z1 представляет собой О, S, SO или SO2;. каждый P1 независимо представляет собой гидроксизащитную группу, устойчивую в кислых условиях; каждый R1 независимо представляет собой водород, галоген, циано, OR1A, SR1A или необязательно замещенный C1-10 алкил; каждый R1A независимо представляет собой водород, или C1-10 алкил, или С 6-12 арил; каждый R2 независимо представляет собой водород, галоген, циано, OR2A, SR2A или С 1-10 алкил; каждый R2A независимо представляет собой водород или C1-10 алкил или С 6-12 арил;R3 представляет собой C1-10 алкил, С 6-12 арил или С 5-12 гетероциклил, представляющий собой ароматическое, частично ароматическое или неароматическое моноциклическое или полициклическое кольцо или систему колец, содержащий по меньшей мере один гетероатом, выбранный из N, О или S; каждый R4 независимо представляет собой водород или C1-10 алкил;-1 017411 В предпочтительном варианте осуществления изобретения соединение формулы I представляет собой соединение формулы где Z1 представляет собой S или SO2. В другом предпочтительном варианте осуществления изобретения Z1 представляет собой SO2, и соединение формулы II получают окислением (например, с использованием пероксидного соединения, такого как м-хлорпербензойная кислота, перуксусная кислота, оксон или смесь пероксида водорода или комплекса пероксида водорода (например, мочевины с пероксидом водорода) и ангидрида кислоты (например, фталевый ангидрид соединения формулы II(а) где Z2 представляет собой S или SO. В наиболее предпочтительном варианте осуществления способ по изобретению дополнительно включает кристаллизацию соединения формулы I. Изобретение также охватывает различные промежуточные соединения, предназначенные для получения ингибиторов SGLT2, включая соединения формулы I, и способы их получения. Так, в одном из вариантов предложенное изобретение относится к способу получения соединения формулы II(b) или его соли, который включает взаимодействие соединения формулы II(c)Y представляет собой О, S, NR4 или C(R4)2; каждый P1 независимо представляет собой гидроксизащитную группу, устойчивую в кислых условиях; каждый R1 независимо представляет собой водород, галоген, циано, OR4, SR4 или C1-10 алкил; каждый R2 независимо представляет собой водород, галоген, циано, OR4, SR4 или C1-10 алкил;R3 представляет собой C1-10 алкил, С 6-12 арил или С 5-12 гетероциклил, представляющий собой ароматическое, частично ароматическое или неароматическое моноциклическое или полициклическое кольцо или систему колец, содержащий по меньшей мере один гетероатом, выбранный из N, О или S; каждый R4 независимо представляет собой водород или C1-10 алкил;-2 017411 В предпочтительном варианте осуществления соединение формулы II(b) представляет собой соединение формулы Согласно другому предпочтительному варианту соединение формулы II(c) получают взаимодействием соединения формулы II(d) с кислотой Льюиса (например, такой как триметилсилилтрифторметансульфонат) и тиомочевиной. В ещ одном варианте осуществления предложенное изобретение относится к способу получения соединения формулы II(d) или его соли, который включает взаимодействие соединения формулы II(е) с солью P1X'" с получением соединения формулы (IId),где X'" представляет собой хлор, бром, йод, C1-10 алкилкарбокси, C1-10 алкансульфокси илиY представляет собой О, S, NR4 или C(R4)2; каждый Р 1 независимо представляет собой гидроксизащитную группу, устойчивую в кислых условиях; каждый R1 независимо представляет собой водород, галоген, циано, OR4, SR4 или С 1-10 алкил; каждый R2 независимо представляет собой водород, галоген, циано, OR4, SR4 или С 1-10 алкил; каждый R4 независимо представляет собой водород или С 1-10 алкил;m равно 1-2. Предпочтительно, когда соединение формулы II(d) представляет собой соединение формулы В ещ одном предпочтительном варианте соединение формулы II(e) получают взаимодействием соединения формулы III(a) с кислотой с получением соединения II(e),где каждый Р 2 представляет собой независимо C(O)R6 или оба Р 2 вместе образуют C(R6)2, где каждый R6 представляет собой независимо С 1-10 алкил.-3 017411 При этом предпочтительно, если соединение III(а) представляет собой соединение формулы а также если соединение формулы III (а) получают восстановлением соединения формулы III(b) где в предпочтительном случае соединение формулы III(b) представляет собой соединение формулы В ещ одном предпочтительном варианте соединение формулы III(b) получают путем проведения реакции сочетания соединения формулы IV с получением соединения формулы III(b),где X' представляет собой бром или йод;X" представляет собой уходящую группу (например, амино, C1-10 алкоксиамино, гидрокси, галоген,C1-10 алкокси, фенокси, карбокси, сульфокси). Причем предпочтительно, если соединение формулы IV представляет собой соединение формулы или соединение формулы IV представляет собой соединение формулы Кроме того, предпочтительно, когда соединение формулы V представляет собой соединение формулы Ещ одним объектом настоящего изобретения является способ получения 3aS,5R,6S,6aS)-6 гидрокси-2,2-диметилтетрагидрофуро[2,3-d][1,3]диоксол-5-ил)(морфолино)метанона-4 017411 При этом предпочтительно, когда (3aS,5R,6S,6aS)-6-гидрокси-2,2-диметилтетрагидрофуро[2,3d][1,3]диоксол-5-карбоновую кислоту получают окислением (3aS,5S,6R,6aS)-5-(гидроксиметил)-2,2 диметилтетрагидрофуро[2,3-d][1,3]диоксол-6-ола с получением (3aS,5R,6S,6aS)-6-гидрокси-2,2-диметилтетрагидрофуро[2,3-d][1,3]диоксол-5-карбоновой кислоты и (3aS,5S,6R,6aS)-5-(гидроксиметил)-2,2 диметилтетрагидрофуро[2,3-d][1,3]диоксол-6-ол получают циклизацией L-(-)-ксилозы в присутствии ацетона с получением (3aS,5S,6R,6aS)-5-(гидроксиметил)-2,2-диметилтетрагидрофуро[2,3-d][1,3]диоксол-6 ола. Объектом настоящего изобретения являются также соединения или их соли, выбранные из-6 017411 4. Краткое описание чертежей Некоторые аспекты изобретения можно понять на основании прилагаемых фигур. На фиг. 1 представлена дифракционная рентгенограмма кристаллической твердой формы(2S,3S,4R,5S,6R)-2-(4-хлор-3-(4-этоксибензил)фенил)-6-(метилтио)тетрагидро-2 Н-пиран-3,4,5-триилтриацетата. Спектр был записан на дифрактометре Rigaku MiniFlex (Cu (1,54060 )излучение). На фиг. 2 представлена дифракционная рентгенограмма кристаллической твердой формы (4-хлор-3-(4-этоксибензил)фенил)3aS,5R,6S,6aS)-6-гидрокси-2,2-диметилтетрагидрофуро[2,3d][1,3]диоксол-5-ил)метанона. Спектр был записан на дифрактометре Rigaku MiniFlex (Cu(1,54060 )излучение). На фиг. 3 представлена дифракционная рентгенограмма кристаллической твердой формы 3aS,5R,6S,6aS)-6-гидрокси-2,2-диметилтетрагидрофуро[2,3-d][1,3]диоксол-5-ил)(морфолино)метанона. Спектр был получен на дифрактометре Rigaku MiniFlex (Cu (1,54060 ) излучение). На фиг. 4 представлена дифракционная рентгенограмма кристаллической твердой формы 1-хлор-2(4-этоксибензил)-4-йодбензола. Спектр был записан на дифрактометре Rigaku MiniFlex (Cu (1,54060 ) излучение). 5. Подробное описание Недавно были описаны новые соединения, которые ингибируют котранспортер натрий-глюкозы 2 типа (SGLT2). См. предварительные заявки на патент США 60/848156 (подана 29 сентября 2006 г.) и 60/905714 (подана 8 марта 2007 г.). Настоящее изобретение частично базируется на новых способах получения таких соединений. Конкретные способы по изобретению предусматривают крупномасштабное производство соединений. 5.1. Определения. Если не указано иное, термин "алкенил" обозначает неразветвленный, разветвленный и/или циклический углеводород, содержащий от 2 до 20 (например, 2-10 или 2-6) атомов углерода и включающий по меньшей мере одну углерод-углеродную двойную связь. Типичные алкенильные группы включают винил, аллил, 1-бутенил, 2-бутенил, изобутиленил, 1-пентенил, 2-пентенил, 3-метил-1-бутенил, 2-метил-2 бутенил, 2,3-диметил-2-бутенил, 1-гексенил, 2-гексенил, 3-гексенил, 1-гептенил, 2-гептенил, 3-гептенил,1-октенил, 2-октенил, 3-октенил, 1-ноненил, 2-ноненил, 3-ноненил, 1-деценил, 2-деценил и 3-деценил. Если не указано иное, термин "алкокси" обозначает -O-алкильную группу. Примеры алкоксигрупп включают (но не ограничиваются ими) -ОСН 3, -ОСН 2 СН 3, -O(СН 2)2 СН 3, -O(СН 2)3 СН 3, -O(СН 2)4 СН 3 и-O(СН 2)5 СН 3,Если не указано иное, термин "алкил" обозначает неразветвленный, разветвленный и/или циклический ("циклоалкильный") углеводород, содержащий от 1 до 20 (например, 1-10 или 1-4) атомов углерода. Алкильные группы, содержащие от 1 до 4 атомов углерода, называются "низший алкил". Примеры алкильных групп включают (но не ограничиваются ими) метил, этил, пропил, изопропил, н-бутил, третбутил, изобутил, пентил, гексил, изогексил, гептил, 4,4-диметилпентил, октил, 2,2,4-триметилпентил,нонил, децил, ундецил и додецил. Циклоалкильные группы могут быть моноциклическими или полициклическими, и примеры включают циклопропил, циклобутил, циклопентил, циклогексил и адамантил. Дополнительные примеры алкильных групп содержат неразветвленные, разветвленные и/или циклические части (например, 1-этил-4-метилциклогексил). Термин "алкил" включает насыщенные углеводороды, а также алкенильные и алкинильные группы. Если не указано иное, термин "алкиларил" обозначает алкильную группу, связанную с арильной группой. Если не указано иное, термин "алкилгетероарил" обозначает алкильную группу, связанную с гетероарильной группой. Если не указано иное, термин "алкилгетероцикл" обозначает алкильную группу, связанную с гетероциклической группой. Если не указано иное, термин "алкинил" обозначает неразветвленный, разветвленный и/или циклический углеводород, содержащий от 2 до 20 (например, 2-20 или 2-6) атомов углерода и включающий по меньшей мере одну тройную углерод-углеродную связь. Типичные алкинильные группы включают ацетиленил, пропинил, 1-бутинил, 2-бутинил, 1-пентинил, 2-пентинил, 3-метил-1-бутинил, 4-пентинил,1-гексинил, 2-гексинил, 5-гексинил, 1-гептинил, 2-гептинил, 6-гептинил, 1-октинил, 2-октинил, 7 октинил, 1-нонинил, 2-нонинил, 8-нонинил, 1-децинил, 2-децинил и 9-децинил. Если не указано иное, термин "арил" обозначает ароматическое кольцо или ароматическую или частично ароматическую циклическую систему, состоящую из атомов углерода и водорода. Арильная группа может содержать несколько колец, связанных или конденсированных вместе. Примеры арильных фрагментов включают (но не ограничиваются ими) антраценил, азуленил, бифенил, флуоренил, индан,инденил, нафтил, фенантренил, фенил, 1,2,3,4-тетрагидронафталин и толил. Если не указано иное, термин "арилалкил" обозначает арильную группу, связанную с алкильной группой. Если не указано иное, термин "галоген" охватывает фтор, хлор, бром и йод.-7 017411 Если не указано иное, термин "гетероалкил" относится к алкильной группе (например, линейной,разветвленной или циклической), в которой по меньшей мере один из атомов углерода заменен гетероатомом (например, N, О или S). Если не указано иное, термин "гетероарил" относится к арильной группе, в которой по меньшей мере один из ее атомов углерода заменен гетероатомом (например, N, О или S). Примеры включают (но не ограничиваются ими) акридинил, бензимидазолил, бензофуранил, бензоизотиазолил, бензоизоксазолил,бензохиназолинил, бензотиазолил, бензоксазолил, фурил, имидазолил, индолил, изотиазолил, изоксазолил, оксадиазолил, оксазолил, фталазинил, пиразинил, пиразолил, пиридазинил, пиридил, пиримидинил,пиримидил, пирролил, хиназолинил, хинолинил, тетразолил, тиазолил и триазинил. Если не указано иное, термин "гетероарилалкил" обозначает гетероарильную группу, связанную с алкильной группой. Если не указано иное, термин "гетероцикл" относится к ароматическому, частично ароматическому или неароматическому моноциклическому или полициклическому кольцу или системе колец, содержащим углерод, водород и по меньшей мере один гетероатом (например, N, О или S). Гетероцикл может содержать несколько (т.е. два или более) колец, конденсированных или связанных вместе. Гетероциклы включают гетероарилы. Примеры включают (но не ограничиваются ими) бензо[1,3]диоксолил,2,3-дигидробензо[1,4]диоксинил, циннолинил, фуранил, гидантоинил, морфолинил, оксетанил, оксиранил, пиперазинил, пиперидинил, пирролидинонил, пирролидинил, тетрагидрофуранил, тетрагидропиранил, тетрагидропиридинил, тетрагидропиримидинил, тетрагидротиофенил, тетрагидротиопиранил и валеролактамил. Если не указано иное, термин "гетероциклалкил" относится к гетероциклической группе, связанной с алкильной группой. Если не указано иное, термин "гетероциклоалкил" относится к неароматическому гетероциклу. Если не указано иное, термин "гетероциклоалкилалкил" относится к гетероциклоалкильной группе,связанной с алкильной группой. Если не указано иное, термин "фармацевтически приемлемые соли" относится к солям, полученным из фармацевтически приемлемых нетоксичных кислот или оснований, включающих неорганические кислоты и основания и органические кислоты и основания. Подходящие фармацевтически приемлемые аддитивные соли с основаниями включают (но не ограничиваются ими) соли металлов, полученные из алюминия, кальция, лития, магния, калия, натрия и цинка, или органические соли, полученные из лизина,N,N'-дибензилэтилендиамина, хлорпрокаина, холина, диэтаноламина, этилендиамина, меглумина(N-метилглюкамина) и прокаина. Подходящие нетоксичные кислоты включают (но не ограничиваются ими) неорганические и органические кислоты, такие как уксусная, альгиновая, антраниловая, бензолсульфоновая, бензойная, камфорсульфоновая, лимонная, этенсульфоновая, муравьиная, фумаровая, фуранкарбоновая, галактуроновая, глюконовая, глюкуроновая, глутаминовая, гликолевая, бромистоводородная, хлористо-водородная, изэтионовая, молочная, малеиновая, яблочная, миндальная, метансульфоновая, муциновая, азотная, памовая, пантотеновая, фенилуксусная, фосфорная, пропионовая, салициловая, стеариновая, янтарная, сульфаниловая, серная, винная кислоты и п-толуолсульфоновая кислота. Конкретные нетоксичные кислоты включают хлористо-водородную, бромисто-водородную, фосфорную, серную и метансульфоновую кислоты. Примеры конкретных солей включают, таким образом,гидрохлориды и мезилаты. Другие хорошо известны в данной области техники. См., например,Remington's Pharmaceutical Sciences, 18th ed. (Mack Publishing, Easton PA: 1990) and Remington: The Science and Practice of Pharmacy, 19th ed. (Mack Publishing, Easton PA: 1995). Если не указано иное, термин "стереоизомерная смесь" охватывает рацемические смеси, а также стереохимически обогащенные смеси (например, R/S=30/70, 35/65, 40/60, 45/55, 55/45, 60/40, 65/35 и 70/30). Если не указано иное, термин "стереохимически чистый" обозначает композицию, которая содержит один стереоизомер соединения и, по существу, не содержит других стереоизомеров соединения. Например, стереохимически чистая композиция соединения, содержащего один стереоцентр, по существу,не должна содержать противоположного по знаку стереоизомера этого соединения. Стереохимически чистая композиция соединения, содержащего два стереоцентра, по существу, не должна содержать других диастереомеров соединения. Типичное стереохимически чистое соединение содержит больше примерно 80 мас.% одного стереоизомера соединения и меньше примерно 20 мас.% других стереоизомеров соединения, больше примерно 90 мас.% одного стереоизомера соединения и меньше примерно 10 мас.% других стереоизомеров соединения, больше примерно 95 мас.% одного стереоизомера соединения и меньше примерно 5 мас.% других стереоизомеров соединения, больше примерно 97 мас.% одного стереоизомера соединения и меньше примерно 3 мас.% других стереоизомеров соединения или больше примерно 99 мас.% одного стереоизомера соединения и меньше примерно 1 мас.% других стереоизомеров соединения. Если не указано иное, термин "замещенный" при использовании для описания химической структуры или группы относится к производному такой структуры или к такой группе, где один или несколько атомов водорода замещены химическим фрагментом или функциональной группой, такими как (но не(-NHCONH-алкил-). Если не указано иное, термин "включают" имеет то же значение, что и "включают, но не ограничиваются". Аналогично, термин "такой как" имеет то же значение, что и "такой как, но не ограничен этим". Если не указано иное, одно или несколько прилагательных непосредственно перед рядом существительных следует рассматривать как относящиеся к каждому из существительных. Например, фраза "необязательно замещенный алкил, арил или гетероарил" имеет то же значение, что и "необязательно замещенный алкил, необязательно замещенный арил или необязательно замещенный гетероарил". Следует отметить, что химический фрагмент, который образует часть более крупной молекулы,может быть здесь описан с помощью названия, обычно соответствующего ему, когда он существует в виде отдельной молекулы, или названия, обычно соответствующего его радикалу. Например, термины"пиридин" и "пиридил" имеют одно и то же значение, когда используются для описания фрагмента, присоединенного к другим химическим фрагментам. Таким образом, две фразы "XOH, где X представляет собой пиридил", и "XOH, где X представляет собой пиридин", имеют одно и то же значение и включают пиридин-2-ол, пиридин-3-ол и пиридин-4-ол. Следует также отметить, что, если стереохимия структуры или части структуры не указана, например, "жирными" или пунктирными линиями, структуру или часть структуры следует рассматривать, как включающую все ее стереоизомеры. Кроме того, предполагается, что любой атом, показанный на чертеже с неудовлетворительными валентностями, соединен с достаточным числом атомов водорода для соблюдения валентности. Кроме того, химические связи, изображенные одной сплошной линией, параллельной одной пунктирной линии, включают как одинарные, так и двойные (например, ароматические) связи, если валентности это допускают. 5.2. Способы. Настоящее изобретение охватывает способы получения соединений формулы IZ1 представляет собой О, S, SO или SO2; каждый R1 независимо представляет собой водород, галоген, циано, OR1A, SR1A или необязательно замещенный алкил; каждый R1A независимо представляет собой водород или необязательно замещенный алкил или арил; каждый R2 независимо представляет собой водород, галоген, циано, OR2A, SR2A или необязательно замещенный алкил; каждый R2A независимо представляет собой водород или необязательно замещенный алкил или арил;R3 представляет собой необязательно замещенный алкил, арил или гетероцикл; каждый R4 независимо представляет собой водород или необязательно замещенный алкил или арил;m равно 1-3. Конкретный метод показан на схеме 1. где каждый P1 независимо представляет собой гидроксизащитную группу, устойчивую в кислых условиях. В данном методе соединение формулы II(a) окисляют и получают соединение формулы II, которое затем подвергают взаимодействию с основанием, получая соединение формулы I. Подходящие условия окисления хорошо известны в данной области техники и включают применение пероксидных соединений, таких как м-хлорпербензойная кислота, перуксусная кислота, оксон, смесь пероксида водорода или его комплекса (например, мочевина-пероксид водорода) и ангидрида кислоты (например, фталевого ангидрида). Подходящие основания также известны в данной области техники и включают алкоксиды,гидроксиды, карбонаты и амины. Разумеется, потенциально реакционноспособные фрагменты, охватываемые определениями различных фрагментов (например, R1-R3), приведенными здесь, могут быть защищены способами, известными в данной области техники. Кроме того, конечные продукты можно подвергать дальнейшим реакциям, известным в данной области техники, чтобы получить другие соединения, охватываемые формулой I. Конечные продукты также можно кристаллизовать. В одном способе продукт сокристаллизуют с аминокислотой (например, с L-фенилаланином, L-фенилглицином, L-аргинином). В отношении всех общих структур и реакций, описанных здесь (например, в схемах 1-3), в соответствующих случаях некоторые варианты осуществления изобретения таковы, что Y представляет собойC(R4)2. В других вариантах Z1 представляет собой S, SO или SO2. В некоторых других каждая P1 независимо представляет собой C(O)R5, где каждый R5 независимо представляет собой алкил, арил, алкиларил или арилалкил. Примеры Р 1 включают ацетил, бензоил и пивалоил. В других вариантах осуществления изобретения R1 представляет собой OR1A и R1A представляет собой, например, необязательно замещенный низший алкил. В других вариантах R2 представляет собой галоген. В других вариантах R3 представляет собой низший алкил (например, метил или этил). В других вариантах R4 представляет собой водород. В других вариантах m равно 1. В других вариантах n равно 1. В одном варианте осуществления изобретения Y представляет собой СН 2, Z1 представляет собой S или SO2, R1 представляет собой этокси, R2 представляет собой хлор, a R3 представляет собой метил. Например, в конкретном способе соединение формулы I является соединением формулы В еще одном варианте осуществления изобретения Y представляет собой СН 2, Z1 представляет собой S или SO2, R1 представляет собой этокси, R2 представляет собой хлор, a R3 представляет собой этил. Например, в конкретном способе соединение формулы I является соединением формулы В конкретном варианте осуществления изобретения соединение формулы II(a) является соединением формулы II(b), которое можно получить, как показано на схеме 2. где X представляет собой бром, йод, алкансульфокси или алкоксисульфокси. Подходящие условия реакции известны в данной области техники. Например, можно использовать основные условия (например, использование основания, такого как N,N-диизопропилэтиламин). В одном способе соединение формулы II(b) является соединением формулы Конкретное соединение формулы II(b) представляет собой (2S,3S,4R,5S,6R)-2-(4-хлор-3-(4 этоксибензил)фенил)-6-(метилтио)тетрагидро-2 Н-пиран-3,4,5-триилтриацетат Конкретная кристаллическая форма данного соединения имеет температуру плавления около 156 С, как измерено дифференциальной сканирующей калориметрией (DSC), (начальная температура). Эта форма дает порошковую рентгенограмму (XRPD) с пиками при одном или нескольких углах отражения около 7,7; 11,9; 12,4; 16,9; 19,5; 19,9; 21,9; 23,2; 24,1 и/или 27,72. Специалисты в данной области хорошо понимают, что относительные интенсивности пиков на рентгенограмме кристаллической формы могут варьироваться в зависимости от того, как был приготовлен образец и как были получены данные. Имея это в виду, авторами на фиг. 1 представлен пример порошковой рентгенограммы (XRPD) данной кристаллической формы. Вообще соединения формулы II(a) могут быть получены способом, показанным на схеме 3. Схема 3- 11017411 где каждая группа Р 2 независимо представляет собой гидроксизащитную группу, устойчивую в кислых условиях, или обе группы Р 2, взятые вместе, образуют одну защитную группу;X" представляет собой уходящую группу (например, амино, алкоксиамино, гидрокси, галоген, алкокси, фенокси, карбокси, сульфокси). В конкретных способах каждая группа Р 2 независимо представляет собой C(O)R6 или обе группы Р 2,взятые вместе, образуют С(R6)2, где каждый R6 независимо представляет собой алкил, арил, алкиларил или арилалкил. В рассматриваемом способе соединение формулы II(а) получают при взаимодействии соединения формулы II(d) с такими реагентами и в таких условиях реакции, которые будут зависеть от природы Z2. Например, соединение формулы II(d) можно вводить в реакцию с кислотой Льюиса (например, с триметилсилилтрифторметансульфонатом) и тиомочевиной для получения соединения, в котором Z2 представляет собой S (например, соединения формулы II(с), показанного выше на схеме 2). Соединение формулыII(d) можно вводить в реакцию с гидроксилсодержащим соединением в кислых условиях для получения соединения, в котором Z2 представляет собой О. Соединения формулы II(d) могут быть получены при взаимодействии соединения формулы II(e) сP1-X"' в подходящих условиях реакции, где X'" представляет собой хлор, бром, йод, алкилкарбокси, алкансульфокси или алкоксисульфокси. Подходящие условия реакции известны в данной области техники. Например, реакцию можно проводить при катализе основанием, таким как пиридин. В конкретном варианте осуществления изобретения соединение формулы II(d) представляет собой соединение формулы а соль P1 представляет собой, например, ацилхлорид или уксусный ангидрид. Соединения формулы II(е) могут быть получены взаимодействием соединения формулы III(а) с кислотой в условиях, подходящих для получения соединения формулы II(e). Приемлемые кислоты известны в данной области техники и включают уксусную, соляную, серную, фосфорную, метансульфоновую и толуолсульфоновую кислоты. Соединения формулы III(а) могут быть получены восстановлением соединения формулы III(b). Подходящие условия восстановления известны в данной области техники и включают применение хлорида церия и боргидрида натрия, комплекса борана, ферментативного восстановления и гидрогенизацию или трансферную гидрогенизацию. В конкретном варианте осуществления изобретения соединение формулы III(b) представляет собой соединение формулы Конкретное соединение формулы III(b) представляет собой (4-хлор-3-(4-этоксибензил)фенил)3aS,5R,6S,6aS)-6-гидрокси-2,2-диметилтетрагидрофуро[2,3-d][1,3]диоксол-5-ил)метанон Конкретная кристаллическая форма данного соединения имеет температуру плавления примерно 113 С, как измерено дифференциальной сканирующей калориметрией (DSC), (начальная температура). Эта форма дает порошковую рентгенограмму (XRPD) с пиками при одном или нескольких углах отражения около 7,6; 13,2; 17,0; 17,4; 18,6; 19,5; 20,5; 20,8 и/или 23,22. Пример порошковой рентгенограммы(XRPD) данной кристаллической формы представлен на фиг. 2. Соединения формулы III(b) могут быть получены реакцией сочетания соединения формулы IV с соединением формулы V. Подходящие условия сочетания известны в данной области техники и включают применение металлирующих агентов (например, магния или лития) или трансметаллирующих агентов,таких как магниевые реагенты (например, алкилмагнийгалогенид, диалкил магний, литийтриалкилмагнийгалогенид) и литийорганические реагенты (например, н-бутиллитий, втор-бутиллитий, третбутиллитий). Таким образом, соединения формулы III(b) могут быть получены при использовании соединений формулы IV(а) в подходящих условиях,- 12017411 где М представляет собой соответствующий металл, такой как Na, K, Li или Mg;X' представляет собой Cl, Br или I и р равно 0, 1 или 2 в зависимости от металла. В конкретном способе соединение формулы V представляет собой соединение, в котором X" является аминогруппой (например, морфолино). Конкретное соединение V представляет собой 3aS,5R,6S,6aS)-6-гидрокси-2,2-диметилтетрагидрофуро[2,3-d][1,3]диоксол-5-ил)(морфолино)метанон Конкретная кристаллическая форма данного соединения имеет температуру плавления примерно 136 С, как измерено методом DSC, (начальная температура). Эта форма дает порошковую рентгенограмму (XRPD) с пиками при одном или нескольких углах отражения около 9,0; 16,9; 17,6; 18,2; 18,4; 18,8 и/или 22,72. Пример порошковой рентгенограммы (XRPD) данной кристаллической формы представлен на фиг. 3. Конкретное соединение формулы V можно получать способами, подобными показанному на схеме 4. Схема 4 Подходящие условия реакции известны в данной области техники и включают условия, описанные ниже в примерах. Вообще L-(-)-ксилозу подвергают циклизации в условиях, пригодных для получения соединения 1, которое затем окисляют для получения соединения 2, которое затем вводят в реакцию с морфолином в условиях,пригодных для получения 3aS,5R,6S,6aS)-6-гидрокси-2,2 диметилтетрагидрофуро[2,3-d][1,3]диоксол-5-ил)(морфолино)метанона. Настоящее изобретение охватывает соединения формул 1 и 2, включая их кристаллические формы. Возвращаясь к схеме 3, в конкретном способе по изобретению соединение формулы IV представляет собой соединение формулы Конкретное соединение формулы IV представляет собой 1-хлор-2-(4-этоксибензил)-4-йодбензол Конкретная кристаллическая форма данного соединения имеет температуру плавления примерно 65 С, определенную на приборе для определения температуры плавления. Эта форма дает порошковую рентгенограмму (XRPD) с пиками при одном или нескольких углах отражения около 5,1; 13,5; 15,2; 20,3; 22,2 и/или 27,02. Пример порошковой рентгенограммы (XRPD) данной кристаллической формы представлен на фиг. 4. Конкретные соединения формулы IV(а) включают соединения формулы Более конкретные соединения представляют собой соединения формулы Конкретные соединения формулы IV(a) представляют собой (4-хлор-3-(4-этоксибензил)фенил)магниййодид и (4-хлор-3-(4-этоксибензил)фенил)магнийхлорид, показанный ниже Соединения формул IV и V могут быть получены способами, такими как описанные ниже, а также способами, известными в данной области техники. См., например, патент США 6515117; Davis N.J., et- 13017411 6. Примеры Объекты настоящего изобретения можно понять из следующих ниже примеров, которые не ограничивают его объем. 6.1. Синтез 3aS,5R,6S,6aS)-6-гидрокси-2,2-диметилтетрагидрофуро[2,3-d][1,3]диоксол-5 ил)(морфолино)метанона В трехгорлую круглодонную колбу объемом 12 л, снабженную механической мешалкой, резиновой прокладкой с датчиком температуры и барботером газа, загружают L-(-)-ксилозу (504,40 г, 3,360 моль),ацетон (5 л, химически чистый) и порошок безводного MgSO4 (811,23 г, 6,740 моль/2,0 экв.). Суспензию перемешивают при температуре окружающей среды и затем прибавляют концентрированную H2SO4(50 мл, 0,938 моль/0,28 экв.). Отмечают медленную слабоэкзотермическую реакцию (температура поднимается до 24 С в течение примерно 1 ч) и реакционную смесь оставляют перемешиваться на ночь при температуре окружающей среды. Через 16,25 ч ТСХ позволяет предположить, что вся L-ксилоза прореагировала, причем основным продуктом является бис-ацетонид, кроме того, образуется небольшое количество (3aS,5S,6R,6aS)-5-(гидроксиметил)-2,2-диметилтетрагидрофуро[2,3-d][1,3]диоксол-6-ола. Реакционную смесь фильтруют и собранные твердые вещества дважды промывают ацетоном (500 мл на каждую промывку). Перемешиваемый желтый фильтрат нейтрализуют концентрированным растворомNH4OH (39 мл) до рН 8,7. После перемешивания в течение 10 мин суспендированные твердые вещества удаляют отфильтровыванием. Фильтрат концентрируют и получают неочищенное промежуточное соединение - бис-ацетонид - в виде желтого масла (725,23 г). Желтое масло суспендируют в 2,5 л воды,перемешивая в трехгорлой круглодонной колбе объемом 5 л, снабженной механической мешалкой, резиновой прокладкой с датчиком температуры и барботером газа. Доводят рН с 9 до 2, прибавляя 1 н. водный раствор HCl (142 мл), и перемешивают при комнатной температуре в течение 6 ч до тех пор, пока ГХ не покажет достаточное превращение промежуточного соединения - бис-ацетонида - в(3aS,5S,6R,6aS)-5-(гидроксиметил)-2,2-диметилтетрагидрофуро[2,3-d][1,3]диоксол-6-ол. Реакционную смесь нейтрализуют, прибавляя 50% (мас./мас.) водный раствор K2HPO4, до рН 7. Затем растворитель выпаривают, прибавляют этилацетат (1,25 л) и получают белую суспензию, которую фильтруют. Фильтрат концентрируют в вакууме и получают оранжевое масло, которое растворяют 1 л метил-третбутилового эфира. Полученный раствор имел KF (содержание воды по Фишеру) 0,23 мас.%, раствор концентрируют,получая(3aS,5S,6R,6aS)-5-(гидроксиметил)-2,2-диметилтетрагидрофуро[2,3d][1,3]диоксол-6-ол в виде оранжевого масла (551,23 г, выход 86%, чистота 96,7% по ГХ (по площади. 1 Н ЯМР (400 МГц, ДМСО-d6):1,22 (с, 3 Н), 1,37 (с, 3 Н), 3,51 (дд, J=11,12; 5,81 Гц, 1 Н), 3,61 (дд,J=11,12; 5,05 Гц, 1 Н), 3,93-4,00 (м, 1 Н), 3,96 (с, 1 Н), 4,36 (д, J=3,79 Гц, 1 Н), 4,86 (уш.с, 2 Н), 5,79 (д,J=3,54 Гц, 1 Н). 13 С ЯМР (101 МГц, ДМСО-d6):26,48; 27,02; 59,30; 73,88; 81,71; 85,48; 104,69; 110,73. К раствору (3aS,5S,6R,6aS)-5-(гидроксиметил)-2,2-диметилтетрагидрофуро[2,3-d][1,3]диоксол-6-ола(25,0 г, 131 ммоль) в ацетоне (375 мл, 15 Х) и Н 2 О (125 мл, 5 Х) прибавляют NaHCO3 (33,0 г, 3,0 экв.),NaBr (2,8 г, 20 мол.%) и TEMPO (0,40 г, 2 мол.%) при 20 С. Смесь охлаждают до 0-5 С и затем порциями прибавляют твердую трихлоризоциануровую кислоту (ТССА, 30,5 г, 1,0 экв.). Суспензию перемешивают при 20 С в течение 24 ч. Прибавляют метанол (20 мл) и смесь перемешивают при 20 С в течение 1 ч. Белая суспензия образуется на данной стадии. Смесь фильтруют, промывают ацетоном (50 мл, 2 Х). Органический растворитель удаляют в вакууме, водный слой экстрагируют EtOAc (300 мл, 12 Х х 3) и объединенные органические слои концентрируют, получая маслообразную смесь с некоторым количеством твердого остатка. Прибавляют ацетон (125 мл, 5 Х) и смесь фильтруют. Затем ацетоновый раствор концентрируют и получают требуемую кислоту 3aS,5R,6S,6aS)-6-гидрокси-2,2 диметилтетрагидрофуро[2,3-d][1,3]диоксол-5-карбоновую кислоту) в виде твердого желтого вещества(3aS,5R,6S,6aS)-6-гидрокси-2,2-диметилтетрагидрофуро[2,3-d][1,3]диоксол-5 карбоновой кислоты (5,0 г, 24,5 ммоль) в ТГФ (100 мл, 20 Х) прибавляют TBTU (11,8 г, 1,5 экв.),N-метилморфолин (NMM, 4,1 мл, 1,5 экв.) и смесь перемешивают при 20 С в течение 30 мин. Затем прибавляют морфолин (3,2 мл, 1,5 экв.) и реакционную смесь перемешивают при 20 С в течение 6 ч допол- 14017411 нительно. Твердое вещество отфильтровывают и слой на фильтре промывают ТГФ (10 мл, 2 Х х 2). Органический раствор концентрируют в вакууме, остаток очищают колоночной хроматографией на силикагеле (гексаны:EtOAc, от 1:4 до 4:1) и получают 4,3 г требуемого морфолинамида (64%) в виде белого твердого вещества. 1 Н ЯМР (CDCl3):6,02 (д, J=3,2 Гц, 1 Н), 5,11 (уш.с, 1 Н), 4,62 (д, J=3,2 Гц, 1 Н), 4,58 (д, J=3,2 Гц,1 Н), 3,9-3,5 (м, 8 Н), 1,51 (с, 3 Н), 1,35 (с, 3 Н). 6.2. Альтернативный синтез 3aS,5R,6S,6aS)-6-гидрокси-2,2-диметилтетрагидрофуро[2,3-d][1,3]диоксол-5-ил)(морфолино)метанона. Раствор диола (3aS,5S,6R,6aS)-5-(гидроксиметил)-2,2-диметилтетрагидрофуро[2,3-d][1,3]диоксол-6 ола в ацетонитриле (5,38 кг, 65% мас./мас., 3,50 кг активного, 18,40 моль) ацетонитрила (10,5 л) иTEMPO (28,4 г, 1 мол.%) прибавляют к раствору K2HPO4 (0,32 кг, 1,84 моль) и KH2PO4 (1,25 кг,9,20 моль) в воде (10,5 л). Раствор NaClO2 (3,12 кг, 80% мас./мас., 27,6 моль, 1,50 экв.) в воде (7,0 л) и раствор K2HPO4 (2,89 кг, 0,90 экв.) в воде (3,0 л) готовят при охлаждении. Бытовой отбеливатель (3,0 л,приблизительно 6% раствор) смешивают с приготовленным раствором K2HPO4. Прибавляют приблизительно 20% приготовленного раствора NaClO2 (1,6 л) и раствор отбеливатель/K2HPO4 (400 мл, 1 мол.%). Остатки двух растворов прибавляют одновременно. Реакционная смесь приобретает темный краснокоричневый цвет и наблюдается медленная экзотермическая реакция. Скорость прибавления раствораNaClO2 составляет около 40 мл/мин (прибавление в течение 3-4 ч), а скорость прибавления раствора отбеливатель/K2HPO4 составляет около 10-12 мл/мин (прибавление в течение 10 ч) при поддерживании температуры бани 15-25 С. Каждые 5-6 ч осуществляют дополнительные загрузки TEMPO (14,3 г,0,5 мол.%) до тех пор, пока реакция не завершится (обычно достаточно выполнить две загрузки). Для того чтобы не допустить накапливания зелено-желтого газа в сосуде, осуществляют непрерывную продувку азотом газовой фазы в скруббер с водой. Реакционную смесь охлаждают до температуры ниже 10 С и гасят тремя порциями Na2SO3 (1,4 кг, 0,6 экв. ) в течение 1 ч. Затем реакционную смесь подкисляют Н 3 РО 4 (2,5-2,7 л) до рН 2,0-2,1 при 5-15 С. Слои разделяют и водный слой экстрагируют ацетонитрилом (310,5 л). Объединенный органический слой концентрируют в вакууме (100-120 торр) при температуре ниже 35 С (температура паров 28-32 С, температура бани 45-50 С) до меньшего объема(6-7 л) и затем промывают ацетонитрилом (40 л) до тех пор, пока KF (содержание воды по Фишеру) не станет менее 1% при разбавлении ацетонитрилом до объема примерно 12-15 л. Прибавляют морфолин(1,61 л, 18,4 моль, 1,0 экв.) в течение 4-6 ч и взвесь выдерживают в атмосфере азота в течение ночи. Смесь охлаждают до 0-5 С и выдерживают 3 ч, затем фильтруют. Осадок на фильтре промывают ацетонитрилом (10 л). Сушка в токе азота дает 4,13 кг морфолиновой соли (3aS,5R,6S,6aS)-6-гидрокси-2,2 диметилтетрагидрофуро[2,3-d][1,3]диоксол-5-карбоновой кислоты в виде белого твердого вещества(92-94% чистоты по данным 1 Н ЯМР с 1,4-диметоксибензолом в качестве внутреннего стандарта), выход 72-75% с поправкой на чистоту. 1 Н ЯМР (D2O):5,96 (д, J=3,6 Гц, 1 Н), 4,58 (д, J=3,6 Гц, 1 Н), 4,53 (д, J=3,2 Гц, 1 Н), 4,30 (д, J=3,2 Гц,1 Н), 3,84 (м, 2 Н), 3,18 (м, 2 Н), 1,40 (с, 1 Н), 1,25 (с, 1 Н). 13 Н ЯМР (D2O):174,5; 112,5; 104,6; 84,2; 81,7; 75,0; 63,6; 43,1; 25,6; 25,1. Морфолиновую соль (3aS,5R,6S,6aS)-6-гидрокси-2,2-диметилтетрагидрофуро[2,3-d][1,3]диоксол-5 карбоновой кислоты (7,85 кг, 26,9 моль), морфолин (2,40 л, 27,5 моль) и борную кислоту (340 г,5,49 моль, 0,2 экв.) прибавляют к толуолу (31 л). Полученную взвесь деаэрируют и нагревают с обратным холодильником с ловушкой Дина-Старка в атмосфере азота в течение 12 ч, а затем охлаждают до комнатной температуры. Смесь фильтруют для удаления нерастворимых веществ и осадок на фильтре промывают толуолом (5 л). Фильтрат концентрируют до объема приблизительно 14 л и промывают толуолом (80 л) для удаления избытка морфолина. После доведения конечного объема приблизительно до 12 л медленно прибавляют гептан (14 л) при 60-70 С. Полученную взвесь постепенно охлаждают до комнатной температуры и выдерживают 3 ч. Затем ее фильтруют, промывают гептаном (12 л) и сушат в атмосфере азота, получая розоватое твердое вещество (6,26 кг, чистота 97%, выход 98%). Т.пл.: 136 С (DSC). 1 Н ЯМР (CDCl3):6,02 (д, J=3,2 Гц, 1 Н), 5,11 (уш.с, 1 Н), 4,62 (д, J=3,2 Гц, 1 Н), 4,58 (д, J=3,2 Гц,1 Н), 3,9-3,5 (м, 8 Н), 1,51 (с, 3 Н), 1,35 (с, 3 Н). 13 С ЯМР (метанол-d4):26,84; 27,61; 44,24; 47,45; 68,16; 77,14; 81,14; 86,80; 106,87; 113,68; 169,05. 6.3. Синтез 1-хлор-2-(4-этоксибензил)-4-йодбензола В трехгорлую круглодонную колбу объемом 2 л, снабженную механической мешалкой, резиновой прокладкой, датчиком температуры и капельной воронкой с выравниванием давления и с барботером газа, загружают 2-хлор-5-йодбензойную кислоту (199,41 г, 0,706 моль), дихлорметан (1,2 л,KF=0,003 мас.%) и полученную суспензию начинают перемешивать при температуре окружающей сре- 15017411 ды. Прибавляют N,N-диметилформамид (0,6 мл, 1,1 мол.%), затем в течение 11 мин прибавляют оксалилхлорид (63 мл, 0,722 моль, 1,02 экв.). Реакционную смесь оставляют перемешиваться на ночь при температуре окружающей среды, и суспензия становится раствором. Через 18,75 ч прибавляют дополнительную порцию оксалилхлорида (6 мл, 0,069 моль, 0,10 экв.), чтобы израсходовать непрореагировавшее исходное вещество. Через 2 ч реакционную смесь концентрируют в вакууме и получают неочищенный 2-хлор-5-йодбензоилхлорид в виде светло-желтой пены, который используют на следующей стадии. В трехгорлую круглодонную колбу в рубашке объемом 2 л, снабженную механической мешалкой,резиновой прокладкой, датчиком температуры и капельной воронкой с выравниванием давления и с барботером газа, загружают хлорид алюминия (97,68 г, 0,733 моль, 1,04 экв.) и дихлорметан (0,65 л,KF=0,003 мас.%) и полученную суспензию перемешивают в атмосфере азота и охлаждают приблизительно до 6 С. Затем прибавляют этоксибензол (90 мл, 0,712 моль, 1,01 экв.) в течение 7 мин, поддерживая внутреннюю температуру ниже 9 С. Полученный оранжевый раствор разбавляют дихлорметаном(75 мл) и охлаждают до -7 С. Затем прибавляют раствор 2-хлор-5-йодбензоилхлорида (0,706 моль) в 350 мл дихлорметана за 13 мин, поддерживая внутреннюю температуру ниже 3 С. Реакционную смесь слегка нагревают и выдерживают при 5 С в течение 2 ч. ВЭЖХ-анализ позволяет предположить, что реакция завершена, и реакцию гасят предварительно охлажденным (5 С) 2 н. водным раствором HCl(450 мл) при перемешивании в круглодонной колбе с рубашкой. Гашение проводят порциями в течение 10 мин, при этом внутренняя температура остается ниже 28 С. Двухфазную смесь после гашения перемешивают при 20 С в течение 45 мин и нижний органический слой промывают 1 н. водным растворомHCl (200 мл), дважды насыщенным водным раствором бикарбоната натрия (200 мл на 1 промывку) и насыщенным водным раствором хлорида натрия (200 мл). Промытый экстракт концентрируют на роторном испарителе и получают неочищенный (2-хлор-5-йодфенил)(4-этоксифенил)метанон в виде не совсем белого твердого вещества (268,93 г, 99,0% по площади пика на ВЭЖХ при 220 нм, 1,0% региоизомера по площади пика на ВЭЖХ при 200 нм, выход 98,5% "как есть"). В трехгорлую круглодонную колбу объемом 1 л, снабженную механической мешалкой, резиновой прокладкой с датчиком температуры и барботером газа, загружают неочищенный (2-хлор-5-йодфенил)(4 этоксифенил)метанон (30,13 г, 77,93 ммоль) и ацетонитрил (300 мл, KF=0,004 мас.%) и полученную суспензию перемешивают в атмосфере азота и охлаждают примерно до 5 С. Прибавляют триэтилсилан(28 мл, 175,30 ммоль, 2,25 экв.), затем диэтилэфират трифторида бора (24 мл, 194,46 ммоль, 2,50 экв.),который прибавляют в течение примерно 30 с. Реакционную смесь нагревают до температуры окружающей среды в течение примерно 30 мин и перемешивают в течение 17 ч. Реакционную смесь разбавляют метил-трет-бутиловым эфиром (150 мл), затем насыщенным водным раствором бикарбоната натрия(150 мл), который прибавляют примерно за 1 мин. Отмечается умеренное выделение газа; двухфазный раствор перемешивают при температуре окружающей среды в течение 45 мин. Верхнюю органическую фазу промывают насыщенным водным раствором бикарбоната натрия (100 мл) и насыщенным водным раствором хлорида натрия (50 мл). Промытый экстракт концентрируют на роторном испарителе примерно до половины первоначального объема и разбавляют водой (70 мл). Проводят дальнейшее концентрирование в вакууме при 45 С до тех пор, пока не образуются белые гранулы, которым дают охладиться до температуры окружающей среды при перемешивании. Примерно через 30 мин при температуре окружающей среды суспендированные твердые вещества выделяют фильтрованием, промывают водой(30 мл) и сушат в вакууме при 45 С. Примерно через 2,5 ч получают 1-хлор-2-(4-этоксибензил)-4 йодбензол в виде белого гранулированного порошка, немного похожего на воск (28,28 г, 98,2% по площади пика на ВЭЖХ при 220 нм, выход 97,4% "как есть"). 6.4. Синтез (4-хлор-3-(4-этоксибензил)фенил)3aS,5R,6S,6aS)-6-гидрокси-2,2-диметилтетрагидрофуро[2,3-d][1,3]диоксол-5-ил)метанонаi-PrMgCl (2,0 М в ТГФ, 1,0 мл, 2,00 ммоль) при 0-5 С и смесь перемешивают в течение 1,5 ч при 0-5 С. Прибавляют по каплям раствор 3aS,5R,6S,6aS)-6-гидрокси-2,2-диметилтетрагидрофуро[2,3d][1,3]диоксол-5-ил)(морфолино)метанона (146,5 мг, 0,536 ммоль) в ТГФ (1,0 мл) при 0-5 С и смесь перемешивают в течение 1 ч, нагревают до 20 С и перемешивают при 20 С в течение 2 ч. Реакционную смесь гасят насыщенным водным раствором NH4Cl, экстрагируют МТВЕ, промывают насыщенным водным раствором хлорида натрия. Органический слой концентрируют, остаток очищают колоночной хроматографией на силикагеле и получают требуемый кетон (178 мг, 76%) в виде белого твердого вещества. 1 Н ЯМР (CDCl3):7,88 (дд, J=8,4; 2,0 Гц, 1 Н), 7,82 (д, J=2,0 Гц, 1 Н), 7,50 (д, J=8,4 Гц, 1 Н), 7,12 (д,J=8,4 Гц, 2 Н), 6,86 (д, J=8,4 Гц, 2 Н), 6,07 (д, J=3,2 Гц, 1 Н), 5,21 (д, J=3,2 Гц, 1 Н), 4,58 (д, J=3,2 Гц, 1 Н),4,56 (д, J=3,2 Гц, 1 Н), 4,16 (д, J=7,2 Гц, 2 Н), 4,03 (кв, J=7,2 Гц, 2 Н), 1,54 (с, 3 Н), 1,42 (т, J=7,2 Гц, 3 Н), 1,37- 16017411 6.5. Альтернативный синтез (4-хлор-3-(4-этоксибензил)фенил)3aS,5R,6S,6aS)-6-гидрокси-2,2 диметилтетрагидрофуро[2,3-d][1,3]диоксол-5-ил)метанона. В реактор объемом 20 л, снабженный механической мешалкой, регулятором температуры и устройством для подачи азота, загружают йодид (3,00 кг, 8,05 моль) и ТГФ (8 л, 4 Х по отношению к морфолинамиду) при комнатной температуре и охлаждают до -5 С. К полученному раствору прибавляют по каплям раствор i-PrMgCl в ТГФ (Aldrich, 2 М, 4,39 л, 8,82 моль) при -5 С в течение 3 ч. Полученный раствор Гриньяра используют в реакции образования кетона, описанной ниже. В реактор объемом 50 л, снабженный механической мешалкой, регулятором температуры и устройством для подачи азота, загружают морфолинамид (чистота по ВЭЖХ = 97 мас.%, 2,01 кг, 7,34 моль) и ТГФ (11 л, 5,5 Х) при комнатной температуре и перемешивают в течение 45 мин при комнатной температуре и в течение 15 мин при 30 С. Гомогенный раствор затем охлаждают до -25 С. К полученному раствору прибавляют раствор трет-BuMgCl в ТГФ (Aldrich, 1 М, 7,32 л, 7,91 моль) при -25 С в течение 3 ч. Затем к этому раствору прибавляют вышеупомянутый раствор Гриньяра при -20 С в течение 41 мин. Полученный раствор дополнительно перемешивают при -20 С перед гашением. Реакционную смесь прибавляют к 10 мас.% водному раствору NH4Cl (10 л, 5 Х) при 0 С при энергичном перемешивании и перемешивают в течение 30 мин при 0 С. К образовавшейся смеси медленно прибавляют 6 н. раствор HCl(4 л, 2 Х) при 0 С для получения прозрачного раствора и перемешивают в течение 30 мин при 10 С. После разделения фаз органический слой промывают 25 мас.% водным раствором NaCl (5 л, 2,5 Х). Затем органический слой концентрируют до 3 Х раствора в следующих условиях: 200 мбар, температура бани 50 С. Прибавляют EtOAc (24 л, 12 Х) и упаривают до 3 Х раствора в следующих условиях: 150 мбар, температура бани 50 С. После удаления твердых веществ с помощью "полировочной" фильтрации прибавляют EtOAc (4 л, 2 Х) и концентрируют досуха (150 мбар, температура бани 50 С). Влажный осадок с фильтра затем переносят в реактор объемом 50 л, снабженный механической мешалкой, регулятором температуры и устройством для подачи азота. После прибавления EtOAc суспензию нагревают при 70 С для получения 2,5 Х гомогенного раствора. К полученному гомогенному раствору медленно прибавляют гептан (5 л, 2,5 Х) при той же температуре. В гомогенный раствор помещают затравку и к мутноватому раствору медленно прибавляют гептан (15 л, 7,5 Х) при 70 С. После перемешивания в течение 0,5 ч при 70 С суспензию медленно охлаждают до 60 С и перемешивают в течение 1 ч при 60 С. Суспензию затем медленно охлаждают до комнатной температуры и перемешивают в течение 14 ч при той же температуре. Кристаллы выделяют и промывают гептаном (8 л, 4 Х), сушат в вакууме при 45 С и получают требуемый кетон в виде рыхлого твердого вещества (2,57 кг, 100 мас.% по ВЭЖХ, выход 81% с поправкой на чистоту). 6.6. Синтез(4-хлор-3-(4-этоксибензил)фенил)3aS,5R,6S,6aS)-6-гидрокси-2,2 диметилтетрагидрофуро[2,3-d][1,3]диоксол-5-ил)метанона (114,7 г, 0,265 моль) в МеОН (2 л, 17 Х) прибавляют CeCl37H2O (118,5 г, 1,2 экв.) и смесь перемешивают при 20 С до растворения всех твердых веществ. Затем смесь охлаждают до -78 С и порциями прибавляют NaBH4 (12,03 г, 1,2 экв.) таким образом,чтобы температура реакции не превышала -70 С. Смесь перемешивают при -78 С в течение 1 ч, медленно нагревают до 0 С и гасят насыщенным водным раствором NH4Cl (550 мл, 5 Х). Смесь концентрируют в вакууме для удаления МеОН, затем экстрагируют EtOAc (1,1 л, 10 Х х 2) и экстракт промывают насыщенным раствором хлорида натрия (550 мл, 5 Х). Объединенные органические экстракты концентрируют в вакууме и получают требуемый спирт в виде бесцветного масла (неочищенный продукт, 115 г). К полученному бесцветному маслу прибавляют AcOH (650 мл) и H2O (450 мл) и смесь нагревают до 100 С и перемешивают в течение 15 ч. Затем смесь охлаждают до комнатной температуры (20 С), концентрируют в вакууме, получая желтое масло (неочищенный продукт, 118 г). К полученному неочищенному маслу прибавляют пиридин (500 мл) и смесь охлаждают до 0 С. Затем прибавляют Ac2O (195 мл,8,0 экв.), смесь нагревают до 20 С и перемешивают при 20 С в течение 2 ч. Реакцию гасят H2O (500 мл) и разбавляют EtOAc (1000 мл). Органический слой отделяют и концентрируют в вакууме для удаленияEtOAc и пиридина. Остаток разбавляют EtOAc (1000 мл) и промывают водным раствором NaHSO4 (1 н.,- 17017411 500 мл, х 2) и насыщенным солевым раствором (300 мл). Органический слой концентрируют, получая требуемый промежуточный тетраацетат в виде желтой пены (133 г). К раствору тетраацетата (133 г, 0,237 моль предположительно чистого) и тиомочевины (36,1,2,0 экв.) в диоксане (530 мл, 4 Х) прибавляют триметилсилилтрифторметансульфонат (TMSOTf) (64,5 мл,1,5 экв.) и реакционную смесь нагревают при 80 С в течение 3,5 ч. Смесь охлаждают до 20 С, прибавляют MeI (37 мл, 2,5 экв.) и N,N-диизопропилэтиламин (DiPEA) (207 мл, 5,0 экв.) и смесь перемешивают при 20 С в течение 3 ч. Затем смесь разбавляют метил-трет-бутиловым эфиром (МТВЕ) (1,3 л, 10 Х) и промывают H2O (650 мл, 5 Х х 2). Органический слой отделяют, концентрируют в вакууме и получают желтое твердое вещество. К полученному желтому веществу прибавляют МеОН (650 мл, 5 Х) и смесь повторно суспендируют при 60 С в течение 2 ч, затем охлаждают до 0 С и перемешивают при 0 С в течение 1 ч. Смесь фильтруют и осадок на фильтре промывают MeOH (0 С, 70 мл, х 3). Осадок сушат в вакууме при 45 С в течение ночи и получают требуемый триацетат (2S,3S,4R,5S,6R)-2-(4-хлор-3-(4 этоксибензил)фенил)-6-(метилтио)тетрагидро-2 Н-пиран-3,4,5-триилтриацетат (88 г, 60% после 4 стадий) в виде светло-желтого твердого вещества. 1 Н ЯМР (CDCl3):7,37 (д, J=8,0 Гц, 1 Н), 7,20 (дд, J=8,0; 2,0 Гц, 1 Н), 7,07 (м, 2 Н), 6,85 (м, 2 Н), 5,32(2S,3S,4R,5S,6R)-2-(4-хлор-3-(4-этоксибензил)фенил)-6(метилтио)тетрагидро-2 Н-пиран-3,4,5-триилтриацетата. В реактор объемом 50 л в атмосфере азота загружают 40 л MeOH, затем кетон (2,50 кг, 5,78 моль) иCeCl37H2O (2,16 кг, 1,0 экв.). Прибавляют метанол (7,5 л) в качестве жидкости для промывки (всего 47,5 л, 19 Х). Медленно прибавляют свежеприготовленный раствор NaBH4 (87,5 г, 0,4 экв.) в 1 н. водном растворе NaOH (250 мл) при 15-25 С в течение 35 мин. Затем смесь перемешивают в течение 15 мин. ВЭЖХ-анализ реакционной смеси показал, что соотношение диастереомеров составляет приблизительно 90:10. Реакцию гасят 10 мас.% водным раствором NH4Cl (2,5 л, 1X) и смесь концентрируют в вакууме до 5 Х, разбавляют водой (10 л, 4 Х) и МТВЕ (12,5 л, 5 Х). Смесь охлаждают до 10 С и прибавляют 6 н. водный раствор HCl до достижения рН смеси 2,0. Перемешивание продолжают в течение 10 мин и слои разделяют. Органический слой промывают H2O (5 л, 2 Х). Объединенный водный слой экстрагируют MTBE(12,5 л, 5 Х). Объединенные органические слои промывают насыщенным водным раствором хлорида натрия (2,5 л, 1X) и концентрируют в вакууме до 3 Х. Прибавляют MeCN (15 л, 6 Х). Смесь опять концентрируют до 10 л (4 Х) и любой твердый остаток удаляют "полировочной" фильтрацией. Осадок на фильтре промывают минимальным количеством MeCN. Органический фильтрат переносят в реактор объемом 50 л и прибавляют предварительно приготовленный 20 мол.% водный раствор H2SO4 (61,8 мл 98% концентрированной H2SO4 и 5 л H2O). Смесь нагревают при 80 С в течение 2 ч, затем охлаждают до 20 С. Реакцию гасят насыщенным водным раствором K2CO3 (5 л, 2 Х) и разбавляют MTBE (15 л, 6 Х). Органический слой отделяют, промывают насыщенным водным раствором хлорида натрия (5 л, 2 Х) и концентрируют в вакууме до 5 л (2 Х). ПрибавляютMeCN (12,5 л, 5 Х) и смесь концентрируют до 7,5 л (3 Х). Полученный раствор(3S,4R,5R,6S)-6-(4-хлор-3-(4-этоксибензил)фенил)тетрагидро-2 Н-пиран 2,3,4,5-тетраола в MeCN охлаждают до 10 С, прибавляют диметиламинопиридин (17,53 г, 2,5 мол.%),затем медленно прибавляют уксусный ангидрид (3,23 л, 6,0 экв.) и триэтиламин (5 л, 2 Х, 6,0 экв.) таким образом, чтобы температура смеси сохранялась ниже 20 С. Затем реакционную смесь нагревают до 20 С,перемешивают в течение 1 ч и разбавляют МТВЕ (15 л, 6 Х). Смесь медленно гасят водой (7,5 л, 3 Х). Органический слой отделяют и промывают последовательно насыщенным водным раствором K2HCO3 (5 л,2 Х), 1 н. раствором NaHSO4 (5 л, 2X) и насыщенным водным раствором хлорида натрия (5 л, 2 Х). Органический слой затем концентрируют в вакууме до 5 л (2 Х). Прибавляют MeCN (12,5 л, 5 Х) и раствор концентрируют до объема 7,5 л (3 Х) (KF=0,08%). Прибавляют диоксан (12,5 л, 5 Х) и раствор концентрируют до объема 7,50 л (3 Х) (KF=0,02%). Любые остатки твердых веществ удаляют "полировочной" фильтрацией и слой осадка на фильтре промывают минимальным количеством диоксана(500 мл). К вышеупомянутому фильтрату прибавляют тиомочевину (880 г, 2,0 экв.) и TMSOTf (1,57 л,1,5 экв.). Реакционную смесь нагревают при 80 С в течение 3 ч (конверсия 97%). Смесь охлаждают до 20 С, прибавляют метилйодид (541 мл, 1,5 экв.) и диэтилизопропиламин (3,02 л, 3,0 экв.) и смесь перемешивают при 20 С в течение 18 ч. Прибавляют дополнительное количество метилйодида (90 мл,0,25 экв.) и смесь перемешивают при 20 С в течение 1 ч. Затем смесь разбавляют МТВЕ (25 л, 10 Х) и промывают водой (12,5 л, 5 Х х 2). Органический слой отделяют и концентрируют в вакууме до 5 л (2 Х). Прибавляют МеОН (12,5 л, 5 Х) и смесь концентрируют до 5 Х, получая взвесь. Затем смесь нагревают при 60 С в течение 1 ч, охлаждают до 0 С и перемешивают при 0 С в течение 1 ч. Смесь фильтруют и осадок на фильтре промывают МеОН (0 С, 2,5 л, 1X х 2, 1,0 л, 0,4 Х). Осадок сушат в вакууме при 45 С в течение ночи и получают требуемый триацетат (1,49 кг, 47% после 4 стадий) в виде светло-желтого/не совсем белого твердого вещества.(2S,3R,4R,5S,6R)-2-(4-хлор-3-(4-этоксибензил)фенил)-6-(метилтио)тетрагидро-2 Н К взвеси (2S,3S,4R,5S,6R)-2-(4-хлор-3-(4-этоксибензил)фенил)-6-(метилтио)тетрагидро-2 Н-пиран 3,4,5-триилтриацетата (90,0 г, 0,164 моль) в MeOH (900 мл, 10 Х) прибавляют NaOMe в MeOH (25 мас.%,18 мл, 0,2 Х) при 20 С и смесь перемешивают при 20 С в течение 2 ч до исчезновения всех твердых веществ. Затем смесь концентрируют до 300 мл, прибавляют к воде (1 л) и перемешивают в течение 1 ч. Твердое вещество отфильтровывают и промывают H2O (3100 мл), осадок на фильтре сушат в вакууме при 45 С в течение ночи и получают требуемый метилтиолят (67,0 г, 95%). 1 Н ЯМР (CDCl3):7,38 (д, J=8,4 Гц, 1 Н), 7,22 (м, 2 Н), 7,11 (д, J=8,8 Гц, 2 Н), 6,83 (д, J=8,8 Гц, 2 Н),4,35 (д, J=9,6 Гц, 1 Н), 4,15 (д, J=9,6 Гц, 1 Н), 4,10-3,95 (м, 3 Н), 3,64 (т, J=8,8 Гц, 1 Н), 3,50 (м, 2 Н), 2,73(уш.с, 3 Н), 2,17 (с, 3 Н), 1,40 (т, J=7,2 Гц, 3 Н). 6.9. Получение формы 1 кристаллического безводного (2S,3R,4R,5S,6R)-2-(4-хлор-3-(4 этоксибензил)фенил)-6-(метилтио)тетрагидро-2 Н-пиран-3,4,5-триола. В реактор объемом 50 л загружают МеОН (12 л) и триацетат (1,70 кг, 3,09 моль) при слабом положительном давлении азота. Прибавляют метанол (5 л) в качестве жидкости для промывки. Затем к взвеси прибавляют NaOMe в MeOH (25 мас.%, 340 мл, 0,2 Х) за 15 мин при 20 С и смесь перемешивают при 20 С в течение 2 ч до исчезновения всех твердых веществ. К смеси медленно (в течение 45 мин) прибавляют воду (25,5 л, 15 Х), содержащую 5 г затравки (DSC 123 С). Выпадает твердое вещество и смесь перемешивают при 20 С в течение 1 ч, охлаждают до 0 С и перемешивают в течение 30 мин. Твердое вещество отфильтровывают и промывают водой (1,7 л, 1X, х 2), осадок на фильтре сушат в вакууме при 45 С в течение ночи и получают указанное в заголовке соединение (т.пл.=123 С по пику DSC; 1,28 кг,выход 97,7%). 6.10. Получение формы 2 кристаллического безводного (2S,3R,4R,5S,6R)-2-(4-хлор-3-(4 этоксибензил)фенил)-6-(метилтио)тетрагидро-2 Н-пиран-3,4,5-триола. В реактор объемом 50 л загружают MEK (2-бутанон, 4 л) и форму 1 (2S,3R,4R,5S,6R)-2-(4-хлор-3(4-этоксибензил)фенил)-6-(метилтио)тетрагидро-2 Н-пиран-3,4,5-триола (1,49 кг) при слабом положительном давлении азота. Прибавляют MEK (3,45 л) в качестве жидкости для промывки. Смесь нагревают до 80 С и медленно прибавляют гептан (14,9 л, 10 Х) в течение 1,5 ч. Начинается выпадение твердых веществ и в смесь загружают гептан (14,9 л, 10 Х) в течение 6 ч. Смесь перемешивают при 80 С в течение 15 ч. Смесь охлаждают до 20 С за 3 ч и перемешивают при 20 С в течение 1 ч. Твердые вещества отфильтровывают, осадок на фильтре промывают смесью MEK/гептан (2,5:7,5, об./об., 1,49 л, IX х 2), сушат в атмосфере азота в течение 12 ч и в вакууме при 50 С в течение 24 ч и получают указанное в заголовке соединение в виде белого твердого вещества (т.пл.=134 С по пику DSC; 1,48 кг, возвращено 98%). 6.11. Альтернативное получение формы 2 кристаллического безводного (2S,3R,4R,5S,6R)-2-(4-хлор 3-(4-этоксибензил)фенил)-6-(метилтио)тетрагидро-2 Н-пиран-3,4,5-триола. В реактор объемом 250 л загружают триацетат (10 кг) и метанол (75 кг). Прибавляют метоксид натрия (1,6 кг, 30% раствор) с 5 кг метанола для промывки. Смесь перемешивают при комнатной температуре в течение по меньшей мере 2 ч или до завершения реакции. Прибавляют древесный уголь (DarcoG-60, 1 кг) с 5 кг метанола для промывки. Полученную смесь нагревают при 40 С в течение 1 ч, охлаждают до комнатной температуры и фильтруют через целит. Осадок на фильтре промывают метанолом(50 кг) и фазы разделяют. Органический слой промывают водой (100 кг) и концентрируют в вакууме. Прибавляют MEK (100 кг) и практически весь растворитель отгоняют в вакууме. Такое прибавлениеMEK и отгонку в вакууме повторяют, чтобы высушить раствор. Прибавляют MEK в количестве, достаточном для того, чтобы получить раствор (2S,3R,4R,5S,6R)-2-(4-хлор-3-(4-этоксибензил)фенил)-6(метилтио)тетрагидро-2 Н-пиран-3,4,5-триола в 50 л MEK. Полученный раствор подвергают "полировочной" фильтрации и прибавляют гептан (100 л) при температуре около 80 С. Прибавляют "затравку" формы 2 (0,1 кг) с последующим медленным прибавлением гептана (100 л) при 80 С. Продолжают нагревание более 8 ч при 80 С, охлаждают до 20 С по меньшей мере в течение 3 ч, выдерживают при этой температуре по меньшей мере 2 ч, фильтруют и промывают смесью MEK/гептан. Осадок на фильтре сушат при 50 С в вакууме и получают указанное в заголовке соединение в виде белого твердого вещества (6,6 кг, выход 86%). К смеси комплекса мочевины и пероксида водорода (UHP, 92,34 г, 6,0 экв. ) и фталевого ангидрида(72,70 г, 3,0 экв. ) прибавляют MeCN (720 мл) и МеОН (180 мл). Смесь перемешивают при 20 С до тех пор, пока не растворятся все твердые вещества. Затем прибавляют раствор (2S,3S,4R,5S,6R)-2-(4-хлор-3(4-этоксибензил)фенил)-6-(метилтио)тетрагидро-2 Н-пиран-3,4,5-триилтриацетата (90,00 г, 0,163 моль) вMeCN (540 мл, 6 Х) и смесь перемешивают при 20 С в течение 7 ч. Затем смесь разбавляют EtOAc(900 мл, 10 Х) и промывают насыщенным водным раствором NaHCO3 (900 мл, 450 мл) и Н 2 О (450 мл). Органический слой затем концентрируют в вакууме и получают белое твердое вещество (95 г). К полученному белому твердому веществу прибавляют МеОН (900 мл) и затем NaOMe в МеОН (25 мас.%,18 мл, 0,2 Х) и смесь перемешивают при 20 С в течение 3 ч до исчезновения всех твердых веществ. Смесь концентрируют до объема 300 мл и медленно прибавляют Н 2 О (1350 мл) при перемешивании. Перемешивание продолжают в течение 1 ч. Твердое вещество отфильтровывают и осадок на фильтре промывают H2O (290 мл) и сушат в вакууме при 45 С в течение ночи и получают требуемый сульфон (71,4 г,96%). 1 Н ЯМР (CDCl3):7,35 (д, J=8,4 Гц, 1 Н), 7,20 (м, 2 Н), 7,081 (д, J=8,8 Гц, 2 Н), 6,78 (д, J=8,8 Гц, 2 Н),4,58 (уш.с, 1 Н), 4,51 (уш.с, 1 Н), 4,42 (д, J=9,6 Гц, 1 Н), 4,24 (д, J=9,6 Гц, 1 Н), 4,10-3,90 (м, 4 Н), 3,74 (м,1 Н), 3,54 (м, 1 Н), 3,36 (уш.с, 1 Н), 2,81 (с, 3 Н), 1,37 (т, J=7,2 Гц, 3 Н). Все публикации (например, патенты и заявки на патент), цитируемые выше, включены в данный документ путем ссылки во всей полноте. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения соединения формулы I или его соли, который включает взаимодействие соединения формулы II с основанием с получением соединения формулы I,где Y представляет собой О, S, NR4 или C(R4)2;Z1 представляет собой О, S, SO или SO2; каждый Р 1 независимо представляет собой гидроксизащитную группу, устойчивую в кислых условиях; каждый R1 независимо представляет собой водород, галоген, циано, OR1A SR1A или C1-10 алкил; каждый R1A независимо представляет собой водород, или C1-10 алкил, или С 6-12 арил; каждый R2 независимо представляет собой водород, галоген, циано, OR2A, SR2A или C1-10 алкил; каждый R2A независимо представляет собой водород, или C1-10 алкил, или С 6-12 арил;R3 представляет собой C1-10 алкил, С 6-12 арил или С 5-12 гетероциклил, представляющий собой ароматическое, частично ароматическое или неароматическое моноциклическое или полициклическое кольцо или систему колец, содержащий по меньшей мере один гетероатом, выбранный из N, О или S; каждый R4 независимо представляет собой водород или C1-10 алкил;m равно 1-3. 2. Способ по п.1, где соединение формулы I представляет собой соединение формулы(например, с использованием пероксидного соединения, такого как м-хлорпербензойная кислота, перуксусная кислота, оксон или смесь пероксида водорода или комплекса пероксида водорода (например, мочевины с пероксидом водорода) и ангидрида кислоты (например, фталевый ангидрид соединения формулы II(а) где Z2 представляет собой S или SO. 4. Способ по одному из пп.1-3, который дополнительно включает кристаллизацию соединения формулы I. 5. Способ получения соединения формулы II(b) или его соли, который включает взаимодействие соединения формулы II(c)Y представляет собой О, S, NR4 или C(R4)2; каждый P1 независимо представляет собой гидроксизащитную группу, устойчивую в кислых условиях; каждый R1 независимо представляет собой водород, галоген, циано, OR4, SR4 или C1-10 алкил; каждый R2 независимо представляет собой водород, галоген, циано, OR4, SR4 или C1-10 алкил;R3 представляет собой C1-10 алкил, С 6-12 арил или С 5-12 гетероциклил, представляющий собой ароматическое, частично ароматическое или неароматическое моноциклическое или полициклическое кольцо или систему колец, содержащий по меньшей мере один гетероатом, выбранный из N, О или S; каждый R4 независимо представляет собой водород или C1-10 алкил;m равно 1-2. 6. Способ по п.5, где соединение формулы II(b) представляет собой соединение формулы 7. Способ по п.5, где соединение формулы II(c) получают взаимодействием соединения формулы с кислотой Льюиса (например, такой как триметилсилилтрифторметансульфонат) и тиомочевиной. 8. Способ получения соединения формулы II(d) или его соли, который включает взаимодействие соединения формулы II(e) с солью P1X'" с получением соединения формулы (IId),где X'" представляет собой хлор, бром, йод, C1-10 алкилкарбокси, C1-10 алкансульфокси илиY представляет собой О, S, NR4 или C(R4)2; каждый Р 1 независимо представляет собой гидроксизащитную группу, устойчивую в кислых условиях; каждый R1 независимо представляет собой водород, галоген, циано, OR4, SR4 или C1-10 алкил; каждый R2 независимо представляет собой водород, галоген, циано, OR4, SR4 или C1-10 алкил; каждый R4 независимо представляет собой водород или C1-10 алкил;m равно 1-2. 9. Способ по п.8, где соединение формулы II(d) представляет собой соединение формулы 10. Способ по п.8, где соединение формулы II(e) получают взаимодействием соединения формулы с кислотой с получением соединения II(e),где каждый Р 2 представляет собой независимо C(O)R6 или оба Р 2 вместе образуют С(R6)2; каждый R6 представляет собой независимо C1-10 алкил. 11. Способ по п.10, где соединение III(а) представляет собой соединение формулы 12. Способ по п.10, где соединение формулы III(а) получают восстановлением соединения формулы 13. Способ по п.12, где соединение формулы III(b) представляет собой соединение формулы 14. Способ по п.12, где соединение формулы III(b) получают путем проведения реакции сочетания соединения формулы IV с получением соединения формулы III(b),где X' представляет собой бром или йод;X" представляет собой уходящую группу (например, амино, C1-10 алкоксиамино, гидрокси, галоген,С 1-10 алкокси, фенокси, карбокси, сульфокси). 15. Способ по п.14, где соединение формулы IV представляет собой соединение формулы или соединение формулы IV представляет собой соединение формулы 16. Способ по п.14, где соединение формулы V представляет собой соединение формулы который включает взаимодействие (3aS,5R,6S,6aS)-6-гидрокси-2,2-диметилтетрагидрофуро[2,3d][1,3]диоксол-5-карбоновой кислоты с морфолином с получением 3aS,5R,6S,6aS)-6-гидрокси-2,2 диметилтетрагидрофуро[2,3-d][1,3]диоксол-5-ил)(морфолино)метанона. 18. Способ по п.17, где (3aS,5R,6S,6aS)-6-гидрокси-2,2-диметилтетрагидрофуро[2,3-d][1,3]диоксол 5-карбоновую кислоту получают окислением (3aS,5S,6R,6aS)-5-(гидроксиметил)-2,2-диметилтетрагидрофуро[2,3-d][1,3]диоксол-6-ола с получением (3aS,5R,6S,6aS)-6-гидрокси-2,2-диметилтетрагидрофуро[2,3d][1,3]диоксол-5-карбоновой кислоты и где (3aS,5S,6R,6aS)-5-(гидроксиметил)-2,2-диметилтетрагидрофуро[2,3-d][1,3]диоксол-6-ол получают циклизацией L-(-)-ксилозы в присутствии ацетона с получением(3aS,5S,6R,6aS)-5-(гидроксиметил)-2,2-диметилтетрагидрофуро[2,3-d][1,3]диоксол-6-ола. 19. Соединение или его соль, где соединение представлено формулой 20. Соединение или его соль, где соединение представлено формулой 21. Соединение или его соль, где соединение представлено формулой 22. Соединение или его соль, где соединение представлено формулой
МПК / Метки
МПК: C07H 5/04, C07H 15/04, C07H 9/04, C07H 7/04
Метки: предназначенные, способы, соединения, получения, натрий-глюкозы, котранспортера, типа, ингибиторов
Код ссылки
<a href="https://eas.patents.su/27-17411-sposoby-i-soedineniya-prednaznachennye-dlya-polucheniya-ingibitorov-kotransportera-natrijj-glyukozy-2-tipa.html" rel="bookmark" title="База патентов Евразийского Союза">Способы и соединения, предназначенные для получения ингибиторов котранспортера натрий-глюкозы 2 типа</a>
Предыдущий патент: Переключаемая оптическая система создания изображений и сопутствующее устройство с переключением трехмерного/двумерного изображений
Следующий патент: Фильтр, содержащий беспорядочно ориентированные волокна для уменьшения прорыва частиц
Случайный патент: Устройство и способ газожидкостного обмена