Соединения для лечения нарушенной фундальной релаксации
Номер патента: 5760
Опубликовано: 30.06.2005
Авторы: Фернандес-Гадеа Франсиско Хавьер, Ван Эмелен Кристоф, Бартоломе-Небреда Хосе Мануэль, Де Брюин Марсель Франс Леопольд, Андрес-Хиль Хосе Игнасио, Матесан-Баллестерос Мария Энкарнасьон, Алькасар-Вака Мануэль Хесус
Формула / Реферат
1. Соединение формулы (I)
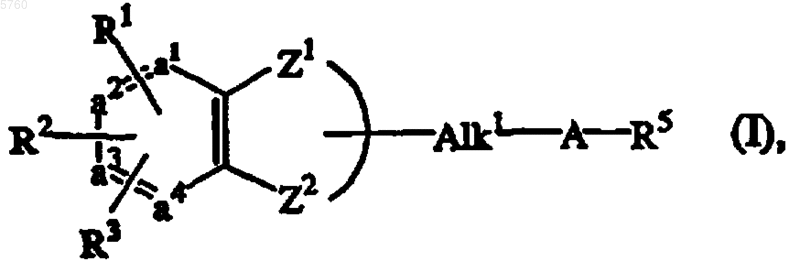
его стереохимически изомерные формы, N-оксидная форма, фармацевтически приемлемая аддитивная соль кислоты или четвертичная аммониевая соль, где -a1=a2-a3=a4- представляет бивалентный радикал формулы
-N=CH-CH=CH- (a-1),
-CH=N-CH=CH- (a-2),
-CH=CH-N=CH- (a-3),
-CH=CH-CH=N- (a-4),
-N=CH-N=CH- (a-6),
-Z1-Z2- представляет бивалентный радикал формулы
-Y1-CH(R4)-CH2- (b-1),
-Y1-CH(R4)-O- (b-2),
-Y1-CH(R4)-CH2-O- (b-3),
-Y1-CH(R4)-CH2-S- (b-4),
-Y1-CH(R4)-CH2-NH- (b-5) или
-Y1-CH(R4)-CH2-CH2- (b-6),
где, если возможно, необязательно один или два атома водорода на одном или разных атомах углерода или азота могут быть замещены C1-6алкилом;
Y1 представляет кислород или серу;
Alk1 представляет C1-6алкандиил;
R1, R2 и R3, каждый независимо, выбран из водорода, C1-6алкила или галогена;
R4 представляет водород;
-A- представляет бивалентный радикал формулы

где m равно 0 или 1;
Alk2 представляет C1-6алкил, необязательно замещенный одним или более гидрокси;
R6 представляет водород, гидрокси, гидроксиC1-4алкил, C1-4алкилокси, C1-4алкилоксикарбонил или гидроксикарбонил;
R5 представляет радикал формулы
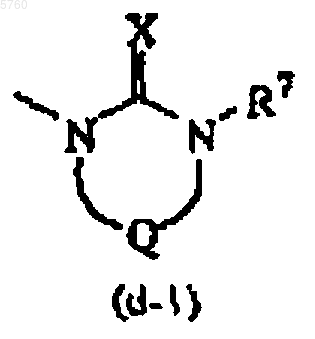
X представляет кислород;
R7 представляет водород, C1-6алкил, C3-6циклоалкил, фенил или фенилметил и
Q представляет бивалентный радикал формулы
-CH2-CH2- (e-1),
-CH2-CH2-CH2- (e-2),
-CH2-CO- (e-5),
-(CH2)2-CO- (e-7),
где необязательно один или два атома водорода на одном или разных атомах углерода могут быть заменены C1-4алкилом, гидрокси или фенилом.
2. Соединение по п.1, где Q представляет радикал формулы (e-2) или (e-5).
3. Соединение по п.1, где бивалентный радикал -a1=a2-a3=a4- имеет формулу (a-1), (a-2) или (a-4); бивалентный радикал -Z1-Z2-имеет формулу (b-1), (b-2) или (b-4); Alk1 представляет -CH2-; R7 представляет водород.
4. Соединение по п.1, где бивалентный радикал -a1=a2-a3=a4- имеет формулу (a-1), (a-2) или (a-4); бивалентный радикал -Z1-Z2-имеет формулу (b-1), (b-2) или (b-4); Alk1 представляет -CH2-; бивалентный радикал -A- имеет формулу (c-2), где R6 представляет гидроксиметил; R7 представляет водород.
5. Соединение по п.1, где бивалентный радикал -a1=a2-a3=a4- имеет формулу (a-1), (a-2) или (a-4); бивалентный радикал -Z1-Z2-имеет формулу (b-1), (b-2) или (b-4); Alk1 представляет -CH2-; бивалентный радикал -A- имеет формулу -CH2-CHOH-CH2-; R7 представляет водород.
6. Соединение по п.1, где данное соединение представляет
1-[1-[(2,3-дигидро[1,4]диоксино[2,3-b]пиридин-3-ил)метил]-4-пиперидинил]-2-имидазолидинон;
1-[1-[(2,3-дигидро[1,4]диоксино[2,3-b]пиридин-3-ил)метил]-4-пиперидинил]тетрагидро-2(1H)-пиримидинон;
1-[3-[[(2,3-дигидро[1,4]диоксино[2,3-b]пиридин-3-ил)метил]амино]пропил]дигидро-2,4(1H,3H)-пиримидиндион и
1-[3-[[(2,3-дигидро[1,4]диоксино[2,3-b]пиридин-3-ил)метил]амино]пропил]-2,
4-имидазолидиндион,
их фармацевтически приемлемые аддитивные соли кислот, стереохимически изомерные формы или N-оксидные формы.
7. Фармацевтическая композиция, содержащая фармацевтически приемлемый носитель и терапевтически активное количество соединения по любому из пп.1-6.
8. Способ получения фармацевтической композиции по п.7, где терапевтически активное количество соединения по любому из пп.1-6 тщательно смешивают с фармацевтически приемлемым носителем.
9. Применение соединения по любому из пп.1-6 для фундальной релаксации.
10. Способ получения соединения формулы (I), где промежуточный продукт формулы (II) алкилируют промежуточным продуктом формулы (III) в реакционно-инертном растворителе и необязательно в присутствии подходящего основания
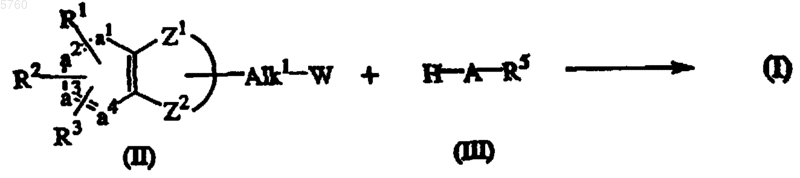
и соединения формулы (I), при необходимости, превращают друг в друга известными реакциями трансформации; или, если требуется, соединение формулы (I) превращают в аддитивную соль кислоты или, обратно, аддитивную соль кислоты соединения формулы (I) превращают в свободное основание щелочью; и, если требуется, получают их стереохимически изомерные формы.
Текст
005760 Настоящее изобретение касается новых соединений формулы (I), обладающих фундальными релаксационными свойствами. Кроме того, данное изобретение касается способов получения таких соединений, фармацевтических композиций, содержащих указанные соединения, а также применения указанных соединений в качестве лекарственного средства для восстановления нарушенной фундальной аккомодации.DE-2400094, опубликованный 18 июля 1974, раскрывает 1-[1-[2-(1,4-бензодиоксан-2-ил)-2 гидроксиэтил-4-пиперидил-2-бензимидазолиноны, обладающие активностью по снижению кровяного давления.WO-93/17017, опубликованная 2 сентября 1993, раскрывает [(бензодиоксан, бензофуран или бензопиран)алкиламино]алкилзамещенные гуанидины в качестве селективных сосудосуживающих агентов,полезных при лечении состояний, связанных с расширением кровеносных сосудов, таких как, например,мигрень, повторяющиеся головные боли и головная боль, связанная с сосудистыми нарушениями.WO-95/053837, опубликованная 23 февраля 1995, охватывает производные дигидробензопиранпиримидина, также обладающие сосудосуживающей активностью.WO-97/28157, опубликованная 7 августа 1997, раскрывает производные аминометилхромана в качестве антагонистов 2-адренергических рецепторов, полезных при лечении дегенеративных неврологических состояний. Соединения настоящего изобретения отличаются от перечисленных соединений, известных в данной области, структурно, природой бивалентного радикала -a1=a2-a3=a4-, заместителем R5 и фармакологически тем фактом, что данные соединения неожиданно обладают фундальными релаксационными свойствами. Кроме того, соединения настоящего изобретения обладают дополнительными полезными фармакологическими свойствами, благодаря которым они оказывают небольшое сосудосуживающее действие или не оказывают такового. Настоящее изобретение касается соединений формулы (I) их стереохимически изомерных форм, N-оксидной формы, фармацевтически приемлемых аддитивных солей кислот или четвертичных аммониевых солей, где -a1=a2-a3=a4- представляет бивалентный радикал формулы-N=CH-CH=CH- (а-1),-CH=N-CH=CH- (а-2),-CH=CH-N=CH- (а-3),-CH=CH-CH=N- (а-4),-N=CH-N=CH- (а-6),-Z1-Z2- представляет бивалентный радикал формулы-Y1-CH(R4)-CH2-CH2- (b-6),где, если возможно, необязательно один или два атома водорода на одном или разных атомах углерода или азота могут быть замещены C1-6 алкилом;Y1 представляет кислород или серу;R1, R2 и R3 каждый независимо выбран из водорода, C1-6 алкила или галогена;-А- представляет бивалентный радикал формулыAlk2 представляет C1-6 алкил, необязательно замещенный одним или более гидрокси;Q представляет бивалентный радикал формулы-СН 2-СН 2- (е-1),-СН 2-СН 2-СН 2- (е-2),-СН 2-СО- (е-5),-(СН 2)2-СО- (е-7),где необязательно один или два атома водорода на одном или разных атомах углерода могут быть заменены С 1-4 алкилом, гидрокси или фенилом. Используемый в предыдущих определениях термин галоген является общим для фтора, хлора,брома и иода; С 1-4 алкил определяет прямые и разветвленные насыщенные углеводородные радикалы,имеющие от 1 до 4 атомов углерода, такие как, например, метил, этил, пропил, бутил, 1-метилэтил, 2 метилпропил и подобные; имеется в виду, что C1-6 алкил включает С 1-4 алкил и более высокие гомологи,имеющие 5 или 6 атомов углерода, такие как, например, 2-метилбутил, пентил, гексил и подобные; С 3-6 циклоалкил является общим определением для циклопропила, циклобутила, циклопентила и циклогексила; С 3-6 алкенил определяет прямые и разветвленные ненасыщенные углеводородные радикалы,имеющие от 3 до 6 атомов углерода, такие как пропенил, бутенил, пентенил или гексенил; С 1-2 алкандиил определяет метилен или 1,2-этандиил; C1-3 алкандиил определяет бивалентные прямые или разветвленные углеводородные радикалы, содержащие от 1 до 3 атомов углерода, такие как, например, метилен, 1,2 этандиил, 1,3-пропандиил и их разветвленные изомеры; С 1-5 алкандиил определяет бивалентные прямые или разветвленные углеводородные радикалы,содержащие от 1 до 5 атомов углерода, такие как, например, метилен, 1,2-этандиил, 1,3-пропандиил, 1,4 бутандиил, 1,5-пентандиил и их разветвленные изомеры;C1-6 алкандиил включает С 1-5 алкандиил и более высокие гомологи, имеющие 6 атомов углерода,такие как, например, 1,6-гександиил и подобные. Обозначение СО относится к карбонильной группе. Используемый здесь выше термин стереохимически изомерные формы определяет все возможные изомерные формы, которые могут иметь соединения формулы (I). Если не упоминается или не указано иначе, химическое название соединений означает смесь всех возможных стереохимически изомерных форм, причем указанные смеси содержат все диастереомеры и энантиомеры основной молекулярной структуры. Более конкретно, стереогенные центры могут иметь R-или S-конфигурацию; заместители на бивалентных циклических (частично) насыщенных радикалах могут иметь цис- или трансконфигурацию. Соединения, включающие двойные связи, могут иметь Е- или Z-стереохимию по указанной двойной связи. Очевидно, подразумевается, что стереохимически изомерные формы соединений формулы (I) входят в объем данного изобретения. Как указано выше, имеется в виду, что фармацевтически приемлемые аддитивные соли кислот включают терапевтически активные нетоксические формы аддитивных солей кислот, которые способны образовывать соединения формулы (I). Обычно фармацевтически приемлемые аддитивные соли кислот можно получать, обрабатывая основную форму подходящей кислотой. Подходящие кислоты включают,например, неорганические кислоты, такие как галогенводородные кислоты, например, хлористоводородную или бромистоводородную, серную, азотную, фосфорную и подобные кислоты; или органические кислоты, такие как, например, уксусная, пропановая, гидроксиуксусная, молочная, пировиноградная,щавелевая (то есть этандиовая), малоновая, янтарная (то есть бутандиовая), малеиновая, фумаровая, яблочная, винная, лимонная, метансульфоновая, этансульфоновая, бензолсульфоновая, паратолуолсульфоновая, цикламовая, салициловая, пара-аминосалициловая, памовая и подобные кислоты.-2 005760 Указанные формы солей можно превратить обратно в свободные основания посредством обработки подходящим основанием. Используемое здесь выражение четвертичные аммониевые соли соединений формулы (I) определяет соединения формулы (I), которые могут образоваться при взаимодействии основного азота соединения формулы (I) и подходящего агента кватернизации, такого как, например, необязательно замещенный алкилгалогенид, арилгалогенид или арилалкилгалогенид, например, метилиодид или бензилиодид. Можно использовать также другие реагенты с хорошими уходящими группами, такие как алкилтрифторметансульфонаты, алкилметансульфонаты и алкил-пара-толуолсульфонаты. Четвертичная аммониевая соль имеет положительно заряженный азот. Фармацевтически приемлемые противоионы включают хлор,бром, иод, трифторацетат и ацетат. Выбрать противоион можно, используя колонки с ионообменными смолами. Используемый здесь выше термин аддитивная соль включает также сольваты, которые могут образовывать соединения формулы (I), а также их соли. Такими сольватами являются, например, гидраты,алкоголяты и подобные. Подразумевается, что N-оксидные формы соединений формулы (I), которые можно получить известными в данной области способами, включают соединения формулы (I), где атом азота окислен до Nоксида. Абсолютные стереохимические конфигурации некоторых соединений формулы (I) и используемых при их получении промежуточных продуктов экспериментально не определены. В таких случаях стереохимически изомерную форму, которую выделяют первой, обозначают как А и вторую как В, не указывая действительную стереохимическую конфигурацию. Однако указанные изомерные формы А и В можно недвусмысленно охарактеризовать, например, их оптическим вращением, если А и В имеют энантиомерное соотношение. Специалист в данной области способен определить абсолютную конфигурацию таких соединений, применяя известные способы, например, дифракцию рентгеновских лучей. Первую группу соединений представляют соединения формулы (I), где бивалентный радикал -Z12Z - имеет формулу (b-1), (b-2), (b-3), (b-4) или (b-5). Интересны соединения формулы (I), где применяется одно или более из следующих ограничений:f) R1, R2 и R3 каждый независимо выбран из водорода, C1-6 алкила или галогена;j) R6 представляет водород. Особыми соединениями формулы (I) являются те соединения формулы (I), в которых бивалентный радикал -Z1-Z2- имеет формулу -O-СН 2-СН 2-O-, а бивалентный радикал -a1=a2-a3=a4- имеет формулу (а-1). Другими особыми соединениями являются соединения формулы (I), в которых бивалентный радикал -Z1-Z2- имеет формулу -O-CH2-O-, а бивалентный радикал -a1=a2-a3=a4- имеет формулу (а-1). Предпочтительны соединения формулы (I), в которых R5 представляет радикал формулы (d-1), где Х представляет кислород, R7 представляет водород и Q представляет (е-2). Более предпочтительны соединения формулы (I), в которых бивалентный радикал -a1=a2-a3=a4- имеет формулу (а-1), (а-2) или (а-4); бивалентный радикал -Z1-Z2- имеет формулу (b-1), (b-2) или (b-4), где R4 представляет водород; Alk1 представляет -СН 2-; бивалентный радикал -А- имеет формулу (с-1) или (с-2); и R5 представляет радикал формулы (d-1),где Х представляет кислород, R7 представляет водород и Q имеет формулу (е-1), (е-2) или (е-7). Другими более предпочтительными соединениями являются соединения формулы (I), в которых бивалентный радикал -a1=a2-a3=a4- имеет формулу (а-1), (а-2) или (а-4); бивалентный радикал Z1-Z2 имеет формулу (b-1), (b-2) или (b-4), где R4 представляет водород; Alk1 представляет -СН 2-; бивалентный радикал -А- имеет формулу (с-2), где R6 представляет гидроксиметил; и R5 представляет радикал формулы (d-1), где Х представляет кислород, R7 представляет водород и Q имеет формулу (е-1), (е-2), (е-5) или(е-7). Другими более предпочтительными соединениями являются соединения формулы (I), в которых бивалентный радикал -a1=a2-a3=a4- имеет формулу (а-1), (а-2) или (а-4); бивалентный радикал -Z1-Z2 имеет формулу (b-1), (b-2) или (b-4), где R4 представляет водород; Alk1 представляет -СН 2-; бивалентный-3 005760 радикал -А- имеет формулу -СН 2-СНОН-СН 2-; и R5 представляет радикал формулы (d-1), где Х представляет кислород, R7 представляет водород и Q имеет формулу (е-1), (е-2), (е-5) или (е-7). Наиболее предпочтительными соединениями являются соединения формулы (I), в которых бивалентный радикал -a1=a2-a3=a4- имеет формулу (а-1); бивалентный радикал -Z1-Z2- имеет формулу (b-3),где Y1 представляет О и R4 представляет водород; бивалентный радикал Alk1 представляет -СН 2-; бивалентный радикал -А- имеет формулу (с-2), где m равно целому числу 0; и радикал R5 имеет формулу (d1), где бивалентный радикал Q имеет формулу (е-1) или (е-2). Другими наиболее предпочтительными соединениями являются соединения формулы (I), в которых бивалентный радикал -a1=a2-a3=a4- имеет формулу (а-1); бивалентный радикал -Z1-Z2-имеет формулу (b3), где Y1 представляет О и R4 представляет водород; бивалентный радикал Alk1 представляет -CH2-; бивалентный радикал -А- имеет формулу (с-1), где Alk2 представляет -(СН 2)3-; и радикал R5 имеет формулу(d-1), где бивалентный радикал Q имеет формулу (е-5) или (е-7). Предпочтительными соединениями являются 1-[1-[(2,3-дигидро[1,4]диоксино[2,3-b]пиридин-3-ил)метил]-4-пиперидинил]-2-имидазолидинон; 1-[1-[(2,3-дигидро[1,4]диоксино[2,3-b]пиридин-3-ил)метил]-4-пиперидинил]тетрагидро-2(1 Н)пиримидинон; 1-[3-(2,3-дигидро[1,4]диоксино[2,3-b]пиридин-3-ил)метил]амино]пропил]дигидро-2,4(1 Н,3 Н)пиримидиндион и 1-[3-(2,3-дигидро[1,4]диоксино[2,3-b]пиридин-3-ил)метил]амино]пропил]-2,4-имидазолидиндион,их фармацевтически приемлемые аддитивные соли кислот, стереохимически изомерные формы или Nоксидная форма. В частности, предпочтительны (S)-стереоизомеры четырех указанных выше соединений. Соединения настоящего изобретения обычно можно получить алкилированием промежуточного продукта формулы (III) промежуточным продуктом формулы (II), где W обозначает подходящую уходящую группу, такую как галоген, например, фтор, хлор, бром, иод, или в некоторых случаях W также может представлять сульфонилоксигруппу, например, метансульфонилокси, бензолсульфонилокси, трифторметансульфонилокси и подобные реакционноспособные уходящие группы. Взаимодействие можно проводить в реакционно-инертном растворителе, таком как, например, ацетонитрил или тетрагидрофуран, и необязательно в присутствии подходящего основания, такого как, например, карбонат натрия,карбонат калия, оксид кальция или триэтиламин. Перемешивание может повысить скорость взаимодействия. Взаимодействие можно удобно проводить в диапазоне температур от комнатной до температуры дефлегмации реакционной смеси и, если требуется, взаимодействие можно осуществлять в автоклаве при повышенном давлении. Соединения формулы (I) можно также получить восстановительным алкилированием промежуточного продукта формулы (IV), где Alk1 обозначает прямую связь или С 1-5 алкандиил, по методикам известного в данной области восстановительного алкилирования промежуточным продуктом формулы (III) Указанное восстановительное алкилирование можно проводить в реакционно-инертном растворителе, таком как, например, дихлорметан, этанол, толуол или их смесь, и в присутствии восстановительного агента, такого как боргидрид, например, боргидрид натрия, цианоборгидрид натрия или триацетоксиборгидрид. Также может быть удобно использовать в качестве восстановителя водород в комбинации с подходящим катализатором, таким как, например палладий на угле, родий на углероде или платина на угле. В случае использования водорода в качестве восстановителя может быть полезно добавить к реакционной смеси дегидратирующий агент, такой как, например, трет-бутоксид алюминия. Для предупреждения дальнейшего нежелательного гидрирования определенных функциональных групп в реагентах и реакционных продуктах может быть полезно добавить к реакционной смеси подходящий каталитический яд, например, тиофен или хинолин-серу. Для повышения скорости реакции можно повысить температуру в диапазоне от комнатной до температуры дефлегмации реакционной смеси и необязательно увеличить давление газообразного водорода. Альтернативно, соединения формулы (I) можно также получить взаимодействием хлорангидрида формулы (V), где Alk1' обозначает С 1-5 алкандиил или прямую связь, с промежуточным продуктом формулы (III) в подходящих условиях реакции. Указанное взаимодействие можно проводить в условиях гидрирования газообразным водородом в присутствии подходящего катализатора, такого как, например палладий на угле, родий на углероде или платина на угле, в подходящем растворителе, таком как, например, этилацетат, и в присутствии оксида магния. Для предупреждения дальнейшего нежелательного гидрирования определенных функциональных групп в реагентах и реакционных продуктах может быть полезно добавить к реакционной смеси подходящий каталитический яд, например, тиофен или хинолин-серу. Для повышения скорости реакции можно повысить температуру в диапазоне от комнатной до температуры дефлегмации реакционной смеси и необязательно увеличить давление газообразного водорода. Соединения формулы (I-а), определенные как соединения формулы (I), где бивалентный радикал А- представляет -NR6-CH2-CH(ОН)-СН 2-, можно получить взаимодействием промежуточных продуктов формулы (VI) с промежуточными продуктами формулы (VII) в реакционно-инертном растворителе, таком как метанол, и необязательно в присутствии неорганического основания, такого как карбонат натрия. Соединения формулы (I) можно получить превращением соединений формулы (I) друг в друга в соответствии с известными в данной области реакциями трансформации групп. Например, соединения формулы (I), где R6 представляет фенилметил, можно превратить в соответствующие соединения формулы (I), где R6 представляет водород, по известным методикам дебензилирования. Указанное дебензилирование можно проводить по известным в данной области методикам, таким как каталитическое гидрирование с применением подходящих катализаторов, например, платины на угле, палладия на угле, в подходящих растворителях, таких как метанол, этанол, 2-пропанол, диэтиловый эфир, тетрагидрофуран и подобные. Кроме того, соединения формулы (I), где R6 представляет водород, можно алкилировать, применяя известные методики, такие как, например, восстановительное N-алкилирование подходящим альдегидом или кетоном. Соединения формулы (I) можно также превращать в соответствующие N-оксидные формы, по известным в данной области методикам превращения трехвалентного азота в N-оксидную форму. Указанную реакцию N-окисления обычно можно проводить посредством взаимодействия исходного вещества формулы (I) с подходящим органическим или неорганическим пероксидом. Подходящие неорганические пероксиды включают, например, пероксид водорода, пероксиды щелочных металлов или щелочноземельных металлов, например, пероксид натрия, пероксид калия; подходящие органические пероксиды могут включать надкислоты, такие как бензолкарбопероксокислота или галогензамещенная бензолкарбопероксокислота, например, 3-хлорбензолкарбопероксокислота, пероксоалкановые кислоты, например,пероксоуксусная кислота, алкилгидропероксиды, например, трет-бутилгидропероксид. Подходящими растворителями являются, например, вода, низшие алканолы, например, этанол и подобные; углеводороды, например, толуол; кетоны, например, 2-бутанон; галогенированные углеводороды, например, дихлорметан; и смеси таких растворителей. Исходные материалы и некоторые промежуточные продукты представляют собой известные соединения и доступны коммерчески, или их можно получить по обычным методикам, известным в данной области. Например, некоторые промежуточные продукты формулы (III) можно получить, как описано в примерах А.4 и А.5 WO-99/29687. Соединения формулы (I) и некоторые промежуточные продукты могут иметь в своей структуре один или более стереогенных центров, находящихся в R- или S-конфигурации, таких как, например, атом углерода, несущий заместитель R4, и атом углерода, связанный с фрагментом -Alk1-A-R5. Соединения формулы (I), которые получены описанными здесь выше способами, можно синтезировать в виде рацемических смесей энантиомеров, которые можно отделить друг от друга известными спо-5 005760 собами разделения. Рацемические соединения формулы (I) можно превратить в соответствующие формы диастереомерных солей путем взаимодействия с подходящей хиральной кислотой. Затем указанные диастереомерные соли разделяют, например, путем селективной или фракционной кристаллизации и высвобождают из них энантиомеры действием щелочи. Альтернативный способ разделения энантиомерных форм соединений формулы (I) включает жидкостную хроматографию с использованием хиральной неподвижной фазы. Указанные чистые стереохимически изомерные формы можно также получить из соответствующих чистых стереохимически изомерных форм подходящих исходных материалов, при условии, что взаимодействие происходит стереоспецифически. Если требуется конкретный стереоизомер,предпочтительно синтезировать указанное соединение стереоспецифическими способами получения. В данных способах полезно использовать чистые исходные материалы. Соединения формулы (I), их N-оксидные формы, фармацевтически приемлемые соли и стереоизомерные формы обладают подходящими фундальными релаксационными свойствами, что очевидно из исследования фармакологического примера C.1 Желудочный тонус, измеренный при помощи электронного баростата у находящихся в сознании собак. Кроме того, соединения настоящего изобретения обладают дополнительными полезными фармакологическими свойствами, благодаря которым они оказывают небольшое сосудосуживающее действие или не оказывают такового, как может быть показано в фармакологическом примере С.2 Сосудосуживающее действие на базилярную артерию. Сосудосуживающее действие может быть причиной нежелательных побочных эффектов, таких как коронарные эффекты, которые могут вызывать боль в грудной клетке. Кроме того, соединения настоящего изобретения обладают другими полезными фармакологическими свойствами, так как они быстро воздействуют и имеют малую продолжительность действия при отсутствии какого-либо CYP4502D6- или 3 А 4-опосредованного метаболизма. Во время приема пищи дно желудка, то есть его проксимальная часть, релаксирует и обеспечивает функцию резервуара. Показано, что пациенты с нарушенной или ухудшенной адаптационной фундальной релаксацией при приеме пищи гиперчувствительны к растяжению желудка и демонстрируют диспептические симптомы. Таким образом, полагают, что соединения, которые способны нормализовать или восстановить нарушенную фундальную аккомодацию, полезны для облегчения страданий пациентов от указанных диспептических симптомов. Ввиду способности соединений настоящего изобретения обеспечивать фундальную релаксацию,данные соединения полезны для лечения нарушений или состояний, связанных с нарушенной, затрудненной или ухудшенной фундальной аккомодацией, таких как диспепсия, раннее пресыщение, вздутие и анорексия. Диспепсию описывают как нарушение перистальтики. Симптомы могут быть вызваны замедленным опорожнением желудка или ухудшенной фундальной релаксацией на прием пищи. Теплокровные животные, включая людей (обычно называемые пациентами), страдающие от симптомов диспепсии в результате замедленного опорожнения желудка, обычно имеют нормальную фундальную релаксацию и их диспептические симптомы могут быть облегчены путем введения прокинетического агента, такого как, например, цисаприд. Пациенты могут иметь диспептические симптомы, не имея нарушений опорожнения желудка. Их диспептические симптомы могут быть результатом гиперсокращенного дна или гиперчувствительности, результатом чего является уменьшенная пластичность и расстройство адаптационной фундальной релаксации. Гиперсокращенное дно дает уменьшенную пластичность желудка. Пластичность желудка можно выразить как отношение объема желудка к давлению, оказываемому стенками желудка. Пластичность желудка относится к желудочному тонусу, который является результатом тонического сокращения мышечных волокон проксимального желудка. Данная проксимальная часть желудка при осуществлении регулярных тонических сокращений (желудочный тонус) выполняет резервуарную функцию желудка. Пациенты, страдающие от ранней насыщаемости, не могут закончить нормальный прием пищи, так как они чувствуют насыщение до завершения указанного нормального приема пищи. Обычно, если пациент начинает есть, желудок будет проявлять адаптационную релаксацию, то есть желудок будет релаксировать, принимая проглоченную пищу. Данная адаптационная релаксация невозможна, если пластичность желудка затруднена, в результате чего происходит ухудшение релаксации дна. Вследствие полезности соединений формулы (I) настоящее изобретение предлагает также способ лечения теплокровных животных, включая людей (обычно называемых пациентами), страдающих от нарушенной, затрудненной или ухудшенной фундальной аккомодации к приему пищи. Следовательно,предложен способ лечения для облегчения страданий пациентов от таких состояний, как, например, диспепсия, раннее насыщение, вздутие и анорексия. Таким образом, предложено применение соединения формулы (I) в качестве лекарственного средства и, в частности, применение соединения формулы (I) с целью производства лекарственных средств для лечения состояний, включающих нарушенную, затрудненную или ухудшенную фундальную аккомодацию к приему пищи. Рассматриваются как профилактика, так и терапевтическое лечение.-6 005760 Симптомы ухудшенной фундальной релаксации могут также увеличиться вследствие приема химических веществ, например, селективных ингибиторов обратного поглощения серотонина (SSRI), таких как флуоксетин, пароксетин, флувоксамин, циталопрам и сертралин. Для получения композиций данного изобретения эффективное количество конкретного соединения в виде аддитивной соли основания или кислоты в качестве активного ингредиента объединяют в однородной смеси с фармацевтически приемлемым носителем, который может иметь разнообразные формы в зависимости от требующегося для введения вида препарата. Желательно, чтобы такие фармацевтические композиции находились в виде стандартных дозированных форм, предпочтительно подходящих для перорального, ректального введения или парентеральной инъекции. Например, при получении композиций в виде дозированной формы для перорального введения можно использовать любую обычную фармацевтическую среду, такую как, например, вода, гликоли, масла, спирты и подобное, в случае жидких препаратов для перорального введения, таких как суспензии, сиропы, эликсиры и растворы; или твердые носители, такие как крахмалы, сахара, каолин, смазывающие вещества, связующие, дезинтегрирующие агенты и подобное, в случае порошков, пилюль, капсул и таблеток. Из-за простоты введения таблетки и капсулы представляют наиболее полезные пероральные дозированные единичные формы, в которых, как ясно, применяют твердые фармацевтические носители. Носитель для парентеральных композиций обычно включает стерильную воду, по крайней мере, большую часть, хотя можно включать и другие ингредиенты, например, агенты, способствующие растворимости. Например, можно приготовить растворы для инъекций, носитель которых включает физиологический раствор, раствор глюкозы или смесь физиологического раствора и раствора глюкозы. Можно также приготовить суспензии для инъекций, в данном случае можно применять подходящие жидкие носители, суспендирующие агенты и подобное. В композициях, подходящих для чрескожного введения, носитель обычно включает агент для повышения проникновения и/или подходящий смачивающий агент, необязательно вместе с подходящими добавками любой природы в незначительных количествах, такие добавки не вызывают существенного вредного действия на кожу. Указанные добавки могут облегчать введение через кожу и/или могут быть полезны для получения требуемых композиций. Такие композиции можно применять различными способами,например, как трансдермальные пластыри, как наклейка, как мази. Ясно, что для получения водных композиций больше подходят аддитивные соли кислот (I), благодаря своей повышенной растворимости в воде по сравнению с основными формами. Особенно полезно готовить указанные выше фармацевтические композиции в виде единичных дозированных форм для простоты применения и единообразия дозировки. Используемое в описании и формуле изобретения выражение единичная дозированная форма относится к физически дискретным единицам, подходящим в качестве стандартных доз, причем каждая единица содержит предварительно определенное количество активного ингредиента, рассчитанное для произведения требуемого терапевтического эффекта, в сочетании с необходимым фармацевтическим носителем. Примерами таких единичных дозированных форм являются таблетки (включая таблетки с бороздкой или с покрытием), капсулы,пилюли, пакетики с порошками, облатки, растворы или суспензии для инъекций, чайная ложка, столовая ложка и подобные и их выделенные множества. Фармацевтические композиции для перорального введения могут иметь форму твердых дозированных препаратов, например, таблеток (для глотания и жевательных), капсул или желатиновых капсул,полученных обычными способами с фармацевтически приемлемыми эксципиентами, такими как связующие агенты (например, предварительно желатинированный кукурузный крахмал, поливинилпирролидон или гидроксипропилметилцеллюлоза); наполнители (например, лактоза, микрокристаллическая целлюлоза или фосфат кальция); смазывающие вещества (например, стеарат магния, тальк или диоксид кремния); дезинтегрирующие агенты (например, картофельный крахмал или натрийкрахмалгликолят) или смачивающие агенты (например, лаурилсульфат натрия). На таблетки можно нанести покрытие способами, хорошо известными в данной области. Жидкие препараты для перорального введения могут иметь вид, например, растворов, сиропов или суспензий, или они могут представлять сухой продукт для разбавления передиспользованием водой или другим подходящим носителем. Такие жидкие препараты можно получить обычными способами, необязательно с фармацевтически приемлемыми добавками, такими как суспендирующие агенты (например,сироп сорбита, метилцеллюлоза, гидроксипропилметилцеллюлоза или гидрированные пищевые жиры); эмульгаторы (например, лецитин или аравийская камедь); неводные носители (например, миндальное масло, маслянистые сложные эфиры или этиловый спирт) и консерванты (например, метил- или пропил пара-гидроксибензоаты или сорбиновая кислота). Фармацевтически приемлемые подслащающие агенты предпочтительно включают, по меньшей мере, один сильный подслащающий агент, такой как сахарин, натрий- или кальцийсахарин, аспартам, ацесульфамкалий, натрийцикламат, алитам, дигидрохальконовый подслащающий агент, монеллин, стевиозид или сукралозу (4,1',6'-трихлор-4,1',6'-тридезоксигалактосахарозу), предпочтительны сахарин, натрийили кальцийсахарин, и необязательно объемный подслащающий агент, такой как сорбит, маннит, фруктоза, сахароза, мальтоза, изомальт, глюкоза, сироп гидрированной глюкозы, ксилит, карамель или мед.-7 005760 Сильный подслащающий агент обычно применяют при низких концентрациях. Например, в случае натрийсахарина концентрация может составлять от 0,04 до 0,1% (мас./об.), как для карамельного шоколадного ароматизатора, мятного освежающего ароматизатора, фантазийного ароматизатора и подобных фармацевтически приемлемых сильных ароматизаторов. Каждый ароматизатор может присутствовать в конечной композиции при концентрации от 0,05 до 1% (мас./об.). Преимущественно используют комбинации указанных сильных ароматизаторов. Предпочтительно применяют ароматизатор, который не подвержен изменению или потере вкуса и цвета в кислых условиях композиции. Соединения данного изобретения можно получить в виде депо-препаратов. Такие композиции длительного действия можно вводить путем имплантации (например, подкожно или внутримышечно) или посредством внутримышечной инъекции. Таким образом, данные соединения можно составить в виде композиции, например, с подходящими полимерными или гидрофобными материалами (например, в виде эмульсии в подходящем масле), или ионообменными смолами, или в виде умеренно растворимых производных, например, умеренно растворимых солей. Соединения данного изобретения можно составить в виде композиций для парентерального введения посредством инъекции, обычно внутривенной, внутримышечной или подкожной инъекции, например, посредством инъекции болюса или продолжительной внутривенной инъекции. Композиции для инъекций можно представить в виде единичной дозированной формы, например, в ампулах или многодозовых контейнерах с добавленными консервантами. Композиции могут иметь такие формы, как суспензии, растворы или эмульсии в масляных или водных носителях, и могут содержать агенты для составления композиций, такие как изотонические, суспендирующие, стабилизирующие и/или диспергирующие агенты. Альтернативно, активный ингредиент может быть в виде порошка для получения состава в подходящем носителе перед применением, например, в стерильной воде, не содержащей пирогенов. Соединения данного изобретения можно также получить в виде композиций для ректального введения, таких как суппозитории или удерживающие клизмы, например, содержащие обычные основы для суппозиториев, такие как масло какао или другие глицериды. Соединения данного изобретения можно применять для интраназального введения, например, в виде жидкого спрея, порошка или капель. Композиции настоящего изобретения могут необязательно включать агенты против метеоризма, такие как симетикон, альфа-D-галактозидаза и подобные. Вообще предполагают, что терапевтически эффективное количество должно составлять примерно от 0,001 до 2 мг/кг массы тела, предпочтительно примерно от 0,02 до 0,5 мг/кг массы тела. Способ лечения может также включать введение активного ингредиента по схеме от двух до четырех введений в день. Экспериментальная часть В описанных здесь далее методиках использованы следующие сокращения: АЦН обозначает ацетонитрил и ДХМ обозначает дихлорметан. Для некоторых химических реагентов использованы химические формулы, например, CH2Cl2 для дихлорметана, СН 3 ОН для метанола, NН 3 для аммиака, НСl для соляной кислоты и NaOH для гидроксида натрия. В некоторых случаях стереохимически изомерную форму, которую выделяют первой, обозначают как А, вторую как В, третью как С и четвертую как D, не указывая действительную стереохимическую конфигурацию. А. Получение промежуточных продуктов Пример А.1 Метансульфонилхлорид (0,012 моль) в ДХМ (6 мл) добавляют по каплям к охлаждаемой на бане со льдом смеси 2,3-дигидро-1,4-диоксино[2,3-b]пиридин-3-метанола (0,008 моль) и триэтиламина (0,016 моль) в ДХМ (26 мл) и данную смесь перемешивают при 5 С в течение 1 ч. Смесь фильтруют, фильтрат промывают водой и экстрагируют. Органический слой сушат, фильтруют и выпаривают досуха. Продукт используют без дальнейшей очистки, получая 2,17 г -2,3-дигидро-1,4-диоксино[2,3-b]пиридин-3 метанолметансульфоната (сложный эфир) (промежуточный продукт 1). Пример А.2a) Смесь 2,3-дигидро-3-[(фенилметокси)метил]-1,4-диоксино[2,3-b]пиридина (0,0638 моль) в СН 3 ОН (250 мл) гидрируют, используя в качестве катализатора палладий на углероде (10%, 2 г). После поглощения водорода (1 эквивалент) катализатор отфильтровывают, а фильтрат выпаривают. Данную фракцию очищают ВЭЖХ (элюент: этанол/метанол = 60/40; колонка Chiralpak AD 20 мкм). Собирают две фракции и выпаривают растворитель, получая 4,06 г (S)-2,3-дигидро-1,4-диоксино[2,3-b]пиридин-3 метанола (промежуточный продукт 2-а) ([]D20=-34,33; с=25,34 мг/5 мл в метаноле) и 3,81 г (R)-2,3 дигидро-1,4-диоксино[2,3-b]пиридин-3-метанола (промежуточный продукт 2-b) ([]D20=+32,74; c=22,60 мг/5 мл в метаноле).b) Смесь промежуточного продукта (2-а) (0,023 моль) и триэтиламина (0,046 моль) в ДХМ (40 мл) перемешивают при 0 С. Добавляют по каплям смесь метансульфонилхлорида. (0,035 моль) в ДХМ (10-8 005760 мл). Данную смесь перемешивают на бане со льдом в течение 2 ч и затем промывают H2O/NaCl. Органический слой сушат, фильтруют и выпаривают растворитель. Остаток (масло) отверждают в диизопропиловом эфире (ДИПЭ, DIPE). Осадок отфильтровывают и сушат, получая 5 г (S)-2,3-дигидро-1,4 диоксино[2,3-b]пиридин-3-метанолметансульфоната (сложный эфир) (промежуточный продукт 3).(0,225 моль) и смесь перемешивают в течение 30 мин при комнатной температуре. Охлаждают реакционную смесь на бане с водой и льдом и добавляют по каплям 1,1-дихлор-2-метокси-2-оксоэтил (1,125 моль). Полученную реакционную смесь перемешивают 5 ч при 95 С, а затем в течение ночи при комнатной температуре. Охлажденную неочищенную реакционную смесь обрабатывают водой, фильтруют через целит и экстрагируют этилацетатом. Отделенный органический слой сушат, фильтруют и выпаривают растворитель. Остаток очищают хроматографически на короткой открытой колонке с силикагелем(элюент: ДХМ). Необходимые фракции собирают и выпаривают растворитель, получая 4,13 г -метил 1,3-диоксоло[4,5-b]пиридин-2-карбоксилата (промежуточный продукт 4).b) Реакция в атмосфере азота. Раствор промежуточного продукта (4) (0,042 моль) в ТГФ (48 мл) добавляют по каплям к LiAlH4(1 М в ТГФ) (0,0466 моль) и охлаждают на бане с водой и льдом. Реакционную смесь перемешивают в течение одного часа при комнатной температуре. Аккуратно обрабатывают данную реакционную смесь 10% раствором NH4Cl и разбавляют водой и этилацетатом. Реакционную смесь фильтруют через целит и фильтрат экстрагируют. Отделенный органический слой сушат, фильтруют и выпаривают растворитель. Остаток промывают ДХМ, фильтруют и сушат, получая 2,78 г -1,3-диоксоло[4,5-b]пиридин-2 метанола (промежуточный продукт 5).c) Раствор промежуточного продукта (5) (0,018 моль) и триэтиламина (0,036 моль) в ДХМ (80 мл) перемешивают и охлаждают на бане с водой и льдом. Добавляют по каплям метансульфонилхлорид(0,027 моль) и полученную реакционную смесь перемешивают в течение одного часа при охлаждении на бане со льдом. Неочищенную реакционную смесь промывают водой и насыщенным раствором соли, затем экстрагируют. Отделенный органический слой сушат, фильтруют и выпаривают растворитель, получая 4,2 г -1,3-диоксоло[4,5-b]пиридин-2-метанолметансульфоната (сложный эфир) (промежуточный продукт 6). Пример А.4a) В атмосфере азота. 2-Пропен-1-ол (0,002 моль) добавляют по каплям к перемешиваемой смеси NaH 60% (0,002 моль) в ДМЭ (5 мл). Смесь перемешивают при комнатной температуре в течение 15 мин. Добавляют по каплям раствор 3-(метоксиметокси)-4-хлорпиридина (0,0017 моль) в ДМЭ (5 мл). Полученную реакционную смесь перемешивают при кипячении с обратным холодильником в течение ночи. Данную смесь промывают водой и экстрагируют этилацетатом. Органический слой сушат, фильтруют и выпаривают досуха. Остаток очищают хроматографически на открытой колонке (элюент: гексан/этилацетат = 3/2; СН 2 С 12/2 пропанон = 90/10; CH2Cl2/MeOH = 96/4). Фракции продукта собирают и выпаривают растворитель, получая 0,18 г 3-(метоксиметокси)-4-(2-пропенилокси)пиридина (промежуточный продукт 7).b) К раствору промежуточного продукта (7) (0,00092 моль) в ДХМ (2 мл) добавляют по каплям бром (0,00092 моль). Реакционную смесь перемешивают при комнатной температуре в течение 15 мин. Смесь выливают в насыщенный раствор NаНСО 3 с несколькими каплями 10% раствора Na2SO4. Данную смесь экстрагируют. Органический слой сушат над Na2SO4, фильтруют и выпаривают досуха, получая 0,32 г -4-(2,3-дибромпропокси)-3-(метоксиметокси)пиридина (промежуточный продукт 8).c) Смесь промежуточного продукта (8) (0,0248 моль), НСl (35,42 мл) и этанола (40 мл) перемешивают при комнатной температуре в течение ночи. Реакционную смесь концентрируют в вакууме. Концентрат охлаждают на бане с водой и льдом. Смесь нейтрализуют насыщенным раствором NаНСО 3 и экстрагируют этилацетатом. Органический слой сушат, фильтруют и выпаривают досуха. Остаток очищают хроматографически на открытой колонке (элюент: СН 2 Сl2; СН 2 Сl2/МеОН = 98/2; 96/4 и 90/10). Чистые фракции собирают и выпаривают растворитель, получая 4,27 г -4-(2,3-дибромпропокси)-3 пиридинола (промежуточный продукт 9).d) Раствор промежуточного продукта (9) (0,0097 моль) в этаноле (50 мл) перемешивают и кипятят с обратным холодильником в течение ночи. Добавляют NaHCO3 (0,0097 моль) и полученную реакционную смесь перемешивают и кипятят с обратным холодильником в течение ночи. Растворитель выпаривают. Остаток промывают водой и экстрагируют ДХМ. Органический слой сушат, фильтруют и выпаривают растворитель. Остаток очищают хроматографически на открытой колонке (элюент: гексан/этилацетат = 3/2). Чистые фракции собирают и выпаривают растворитель, получая 1,51 г -3-(бромметил)-2,3 дигидро-1,4-диоксино[2,3-с]пиридина (промежуточный продукт 10).a) Смесь 2,2-диметил-1,3-пропандиамина (0,22 моль) и 2-пропеннитрила (0,22 моль) в этаноле (250 мл) перемешивают в течение ночи при комнатной температуре. Выпаривают растворитель. Смесь 2,2 диметил-1,3-пропандиамина (0,28 моль) и 2-пропеннитрила (0,28 моль) в этаноле (250 мл) перемешивают один час при комнатной температуре. Выпаривают растворитель. Остатки объединяют. Данную фракцию очищают перегонкой, получая 27,2 г 3-[(3-амино-2,2-диметилпропил)амино]пропаннитрила (промежуточный продукт 11).b) Смесь промежуточного продукта (11) (0,16 моль) и 1,1'-карбонилбис-1 Н-имидазола (0,16 моль) в ТГФ (500 мл) перемешивают и кипятят с обратным холодильником в течение ночи. Осадок отфильтровывают и сушат, получая 26,7 г гексагидро-5,5-диметил-2-оксо-1-пиримидинпропаннитрила (промежуточный продукт 12, т.пл. 190 С).c) Смесь промежуточного продукта (12) (0,12 моль) в СН 3 ОН/NН 3 (400 мл) гидрируют, используя в качестве катализатора никель Ренея (3,0 г). После поглощения водорода (2 эквивалента) катализатор отфильтровывают, а фильтрат выпаривают, получая 21,2 г 1-(3-аминопропил)тетрагидро-5,5-диметил 2(1 Н)-пиримидинона (промежуточный продукт 13). Пример А.6a) Смесь 4-амино-1-(фенилметил)-4-пиперидинметанола (0,0182 моль) и 2-пропеннитрила (0,0304 моль) в этаноле (80 мл) перемешивают и кипятят с обратным холодильником в течение двух дней. Добавляют 2-пропеннитрил (2 мл). Смесь перемешивают и кипятят с обратным холодильником в течение 5 ч. Снова добавляют 2-пропеннитрил (2 мл). Смесь перемешивают и кипятят с обратным холодильником в течение ночи. Выпаривают растворитель. Остаток очищают через силикагель на стеклянном фильтре(элюент: CH2Cl2/(СН 3 ОН/NН 3) = 95/5). Необходимые фракции собирают и выпаривают растворитель,получая 3-4-(гидроксиметил)-1-(фенилметил)-4-пиперидинил]амино]пропаннитрил (промежуточный продукт 14).b) Смесь промежуточного продукта (14) (0,0159 моль) в метаноле, насыщенном NН 3 (150 мл), гидрируют при 14 С, используя в качестве катализатора никель Ренея (1/2 ложки). После поглощения водорода (2 эквивалента) катализатор отфильтровывают, а фильтрат выпаривают, получая 3,8 г 4-[(3 аминопропил)амино]-1-(фенилметил)-4-пиперидинметанола (промежуточный продукт 15).c) 1,1'-Карбонилбис-1H-имидазол (0,0149 моль) добавляют к смеси промежуточного продукта (15)(0,0137 моль) в ТГФ (40 мл). Данную смесь перемешивают при комнатной температуре в течение ночи. Осадок отфильтровывают, кристаллизуют из АЦН, отфильтровывают, промывают АЦН и ДИПЭ и затем сушат, получая 2,05 г тетрагидро-1-[4-(гидроксиметил)-1-(фенилметил)-4-пиперидинил]-2(1 Н)пиримидинона (промежуточный продукт 16, т.пл. 210 С). а) Смесь промежуточного продукта (16) (0,0059 моль) в метаноле (100 мл) гидрируют, используя в качестве катализатора палладий на углероде (1 г). После поглощения водорода (1 эквивалент) катализатор отфильтровывают, фильтрат выпаривают и кристаллизуют из АЦН, получая 0,6 г тетрагидро-1-[4(гидроксиметил)-4-пиперидинил]-2(1 Н)-пиримидинона (промежуточный продукт 17, т.пл. 162 С). Пример А.7 Реакционный раствор 1-(2-пропенил)-2,4-имидазолидиндиона(0,036 моль) и 3 хлорбензолкарбопероксокислоты (0,043 моль, 70,75%) в ДХМ (25 мл) перемешивают 2 ч при комнатной температуре. Добавляют водный раствор бисульфита- и смесь перемешивают 10 мин. Добавляют Na2CO3 и экстрагируют данную смесь ДХМ. Отделенный органический слой сушат, фильтруют и выпаривают растворитель, получая 5 г -1-(оксиранилметил)-2,4-имидазолидиндиона (промежуточный продукт 18). Пример А.8a) Реакцию проводят в токе азота. Смесь 2-хлор-3-пиридинолгидрохлорида (1:1) (1,760 моль) в ДМФ (1000 мл) добавляют по каплям за 30 мин к смеси NaH 60% (1,934 моль) в ДМФ (1200 мл) (температура ниже 27 С). Реакционную смесь перемешивают в течение 30 мин. Добавляют по каплям (хлорметил)оксиран (3,530 моль) в ДМФ (1200 мл) за 30 минут. Реакционную смесь перемешивают 9 ч при 60 С. Смесь охлаждают. Добавляют по каплям воду на бане со льдом. Смесь экстрагируют ДХМ. Органический слой сушат, фильтруют и выпаривают растворитель. К остатку добавляют петролейный эфир, затем декантируют (3 раза). Данную фракцию объединяют с аналогично полученными фракциями, затем очищают ВЭЖХ на силикагеле (элюент:гексан/этилацетат = 50/50). Необходимые фракции собирают и выпаривают растворитель, получая 635 г 2-хлор-3-(оксиранилметокси)пиридина (промежуточный продукт 19).b) Смесь ТГФ (915 мл), бензолметанола (2,96 моль) и NaOH (2,36 моль) перемешивают при комнатной температуре в течение 30 мин (для поддержания температуры ниже 25 С требуется охлаждение). Добавляют промежуточный продукт (19) (1,97 моль). Реакционную смесь перемешивают при комнатной температуре в течение 4 дней. Добавляют по каплям воду (необходимо охлаждение) и экстрагируют смесь этилацетатом. Органический слой сушат, фильтруют и выпаривают растворитель. Остаток объединяют с аналогично полученной фракцией, затем очищают ВЭЖХ на силикагеле (элюент: гексан/этилацетат = 60/40). Необходимые фракции собирают и выпаривают растворитель, получая с выхо- 10005760 дом 38% 1-[(2-хлор-3-пиридинил)окси]-3-[(3Z)-3,5-гексадиенилокси]-2-пропанол (промежуточный продукт 20).c) Смесь промежуточного продукта (20) (0,034 моль) и реагента Лавессона (0,051 моль) в толуоле(750 мл) перемешивают и кипятят с обратным холодильником в течение 16 ч. Выпаривают растворитель и остаток очищают хроматографически на короткой открытой колонке с силикагелем (элюент: CH2Cl2/2 пропанон = 100/0; 90/10). Собирают необходимые фракции и выпаривают растворитель. Остаток очищают флэш-хроматографией на колонке с силикагелем (элюент: гексан/2-пропанон = 95/5; 90/10). Собирают необходимые фракции и выпаривают растворитель, получая 2,3 г 2,3-дигидро-3(фенилметокси)метил-[1,4]оксатиино[3,2-b]пиридина (промежуточный продукт 21).d) Смесь промежуточного продукта (21) (0,00732 моль) и FеСl3 (2,37 г) в ДХМ (100 мл) перемешивают при комнатной температуре в течение 16 ч. Добавляют FeCl3 (2,37 г) и перемешивают смесь еще 16 ч. Подщелачивают реакционную смесь NH4OH (насыщенный) и фильтруют через целит. Органический слой сушат, фильтруют и выпаривают растворитель. Остаток очищают хроматографически на короткой колонке с силикагелем (элюент: СН 2 Сl2/2-пропанон = 95/5). Собирают необходимые фракции и выпаривают растворитель, получая 0,93 г 2,3-дигидро[1,4]оксатиино[3,2-b]пиридин-3-метанола (промежуточный продукт 22).(22) (0,0051 моль) и триэтиламина (0,0102 моль) в ДХМ (50 мл) при 0 С. Смесь перемешивают при 0 С в течение 2 ч. Добавляют воду. Органический слой сушат, фильтруют и выпаривают растворитель, получая 1,16 г 2,3-дигидро[1,4]оксатиино[3,2-b]пиридин-3-метанолметансульфоната (сложный эфир) (промежуточный продукт 23). Пример А.9 а) Смесь NaH 60% (0,051 моль) в ТГФ (20 мл) перемешивают при 0 С. Добавляют по каплям при 0 С раствор 3-гидрокси-2-пиридинкарбоксальдегида (0,034 моль) в ТГФ (75 мл). Реакционную смесь перемешивают 1 ч при комнатной температуре. Добавляют по каплям при 0 С раствор этилового эфира 2-(диэтоксифосфинил)-2-акриловой кислоты (0,041 моль) в ТГФ (75 мл). Реакционную смесь перемешивают в течение 24 ч при комнатной температуре, затем перемешивают и кипятят с обратным холодильником в течение 4 ч, затем перемешивают в течение 24 ч при комнатной температуре. Добавляют 10% водный раствор NH4Cl и смесь экстрагируют ДХМ. Отделенный органический слой сушат, фильтруют и выпаривают растворитель. Остаток очищают хроматографически на короткой открытой колонке с силикагелем. Необходимые фракции собирают и выпаривают растворитель, получая 0,56 г этилового эфира 2 Н-пирано[3,2-b]пиридин-3-карбоновой кислоты (промежуточный продукт 24).b) Раствор промежуточного продукта (24) (0,0032 моль) в метаноле (сухом) (2 мл) и ТГФ (сухом)(16 мл) перемешивают при 0 С. Добавляют частями NaBH4 (0,0128 моль) при 0 С. Реакционную смесь перемешивают в течение 5 ч при комнатной температуре. Добавляют 10% раствор NH4Cl и данную смесь экстрагируют ДХМ. Отделенный органический слой сушат, фильтруют и выпаривают растворитель, получая 0,45 г 2 Н-пирано[3,2-b]пиридин-3-метанола (промежуточный продукт 25).c) Смесь промежуточного продукта (25) (0,0027 моль) в метаноле (20 мл) гидрируют в течение 24 ч при комнатной температуре, используя в качестве катализатора палладий на углероде (0,04 г). После поглощения водорода (1 эквивалент) катализатор отфильтровывают, а фильтрат выпаривают, получая 0,35 г 3,4-дигидро-2 Н-пирано[3,2-b]пиридин-3-метанола (промежуточный продукт 26).d) Раствор промежуточного продукта (26) (0,002 моль) в ДХМ (10 мл) перемешивают при 0 С. Добавляют при 0 С триэтиламин (0,0024 моль) и метансульфонилхлорид (0,0024 моль) и полученную смесь перемешивают в течение 3 ч при комнатной температуре. Добавляют насыщенный раствор NаНСО 3. Органический слой отделяют, сушат, фильтруют и выпаривают растворитель, получая 0,49 г 3,4-дигидро 2 Н-пирано[3,2-b]пиридин-3-метанолметансульфоната (сложный эфир) (промежуточный продукт 27). Пример А.10a) К раствору 2-хлор-3-пиридинамина (0,0465 моль) в ТГФ (45 мл) при -78 С в токе N2 добавляют по каплям литийдиизопропиламин (0,0513 моль, 2 М). Смеси дают нагреться до 0 С и перемешивают в течение 1 ч, а затем охлаждают до -78 С. Затем добавляют иодметан (0,0582 моль), дают реакционной смеси нагреться до комнатной температуры и перемешивают в течение 16 ч. Добавляют насыщенный раствор NH4Cl и экстрагируют смесь этилацетатом. Отделенный органический слой сушат, фильтруют и выпаривают растворитель. Остаток очищают хроматографически на короткой открытой колонке с силикагелем (элюент: гексан/этилацетат = 80/20). Фракции продукта собирают и выпаривают растворитель,получая 5,91 г 2-хлор-N-метил-3-пиридинамина (промежуточный продукт 28).b) К раствору промежуточного продукта (28) (0,031 моль) в ТГФ (50 мл) в токе азота при -78 С медленно добавляют литийдиизопропиламин (0,062 моль, 2 М). Реакционной смеси дают нагреться до 0 С и перемешивают в течение 1 ч. Затем снова охлаждают до -78 С, добавляют раствор [(фенилметокси)метил]оксирана (0,034 моль) в ТГФ (40 мл), дают смеси нагреться до комнатной температуры и перемешивают в течение 16 ч. Добавляют насыщенный раствор NH4Cl и экстрагируют смесь этилацетатом. Отделенный органический слой сушат, фильтруют и выпаривают растворитель. Остаток очищают хроматографически на короткой открытой колонке с силикагелем (элюент: гексан/этилацетат = 50/50).- 11005760 Фракции продукта собирают и выпаривают растворитель, получая 7,18 г 1-[(2-хлор-3 пиридинил)метиламино]-3-(фенилметокси)-2-пропанола (промежуточный продукт 29).c) К суспензии NaH 60% (0,081 моль) в ДМЭ (250 мл) добавляют по каплям промежуточный продукт (29) (0,023 моль) в ДМЭ (250 мл) . Реакционную смесь перемешивают и кипятят с обратным холодильником 16 ч. После охлаждения смесь переносят в Н 2 О/этилацетат. Отделенный органический слой сушат, фильтруют и выпаривают растворитель. Остаток очищают хроматографически на короткой открытой колонке с силикагелем (элюент:гексан/этилацетат = 95/5). Необходимые фракции собирают и выпаривают растворитель, получая 5,82 г 3-бензилоксиметил-1-метил-2,3-дигидро-1 Н-пиридо[2,3b][1,4]оксазина (промежуточный продукт 30).d) Смесь промежуточного продукта (30) (0,018 моль) и FeCl3(0,036 моль) в ДХМ (500 мл) перемешивают при комнатной температуре в течение 16 ч. Затем добавляют еще FеСl3 (0,018 моль) и перемешивают смесь еще 6 ч. Снова добавляют FеСl3 (0,018 моль) и перемешивают смесь 16 ч. Подщелачивают реакционную смесь насыщенным раствором NH4Cl и образовавшийся осадок отфильтровывают через дикалит. Отделенный органический слой экстрагируют насыщенным раствором NH4Cl, сушат, фильтруют и выпаривают растворитель. Остаток очищают хроматографически на короткой открытой колонке с силикагелем (элюент:СН 2 Сl2/(МеОН/NН 3) = 95/5). Фракции продукта собирают и выпаривают растворитель. Остаток снова очищают хроматографически на короткой открытой колонке с силикагелем (элюент:этилацетат/(МеОН/NН 3) = 98/2; 95/5). Необходимые фракции собирают и выпаривают растворитель, получая 2,1 г 2,3-дигидро-1-метил-1 Н-пиридо[2,3b][1,4]оксазин-3-метанола (промежуточный продукт 31).e) К раствору промежуточного продукта (31) (0,0111 моль) и триэтиламина (0,0222 моль) в ДХМ(200 мл) при 0 С добавляют по каплям метансульфонилхлорид (0,0166 моль). Реакционную смесь перемешивают при 0 С в течение 1 ч. Затем добавляют воду. Отделенный органический слой экстрагируют насыщенным раствором соли, сушат, фильтруют и выпаривают растворитель, получая 2,85 г 2,3 дигидро-1-метил-1 Н-пиридо[2,3-b][1,4]оксазин-3-метанолметансульфоната (сложный эфир) (промежуточный продукт 32). Пример А.11 а) Раствор 3-хлорбензолкарбопероксокислоты (0,087 моль) в трихлорметане (125 мл) добавляют по каплям к раствору сложного эфира 2,3-дигидро-1,4-диоксино[2,3-b]пиридин-3-метанолметансульфоната(0,0217 моль) в трихлорметане (125 мл) и перемешивают при комнатной температуре в течение ночи. Добавляют 50 мл метанола и 12,47 г К 2 СО 3 и смесь перемешивают 30 мин. Затем смесь фильтруют и твердое вещество промывают смесью ДХМ в метаноле (90/10). Фильтрат выпаривают досуха, а остаток очищают хроматографически на короткой открытой колонке с силикагелем (элюент: СН 2 Сl2/(МеОН/NН 3) = 96/4; 95/5 и 90/10). Фракции продукта собирают и выпаривают растворитель, получая 3,62 г 2,3-дигидро[1,4]диоксино[2,3-b]пиридин-3-метанолметансульфоната (сложный эфир) (промежуточный продукт 33).b) Смесь промежуточного продукта (33) (0,0138 моль) и оксихлорида фосфора (0,069 моль) перемешивают 3 ч при 100 С. Неочищенную реакционную смесь выпаривают досуха. Охлажденный остаток осторожно обрабатывают водой и затем нейтрализуют Nа 2 СО 3. Смесь экстрагируют ДХМ. Отделенный органический слой сушат, фильтруют и выпаривают досуха, получая 3,17 г 6-хлор-2,3 дигидро[1,4]диоксино[2,3-b]пиридин-3-метанолметансульфоната (сложный эфир) (промежуточный продукт 34). Пример А.12a) К раствору 2,3-дигидро-1,4-диоксино[2,3-b]пиридин-3-метанола (0,009 моль) в ДХМ (100 мл) и насыщенному раствору Nа 2 СО 3 (50 мл), перемешиваемым при комнатной температуре, добавляют бром(0,009 моль). Реакционную смесь перемешивают при комнатной температуре в течение 16 ч. Еще добавляют бром (0,009 моль) и реакционную смесь перемешивают еще 3 дня при комнатной температуре. Добавляют несколько капель Nа 2SО 3 и смесь перемешивают 15 мин. Отделенный органический слой сушат,фильтруют и выпаривают растворитель. Остаток очищают хроматографически на короткой открытой колонке с силикагелем (элюент: СН 2 Сl2/СН 3 ОН = 100/0; 98/2). Необходимые фракции собирают и выпаривают растворитель, получая 0,9 г 7-бром-2,3-дигидро[1,4]диоксино[2,3-b]пиридин-3-метанола (промежуточный продукт 35).b) Метансульфонилхлорид (0,0054 моль) добавляют по каплям к смеси промежуточного продукта(35) (0,0036 моль) и триэтиламина (0,0072 моль) в ДХМ (50 мл), перемешиваемой при 0 С. Реакционную смесь перемешивают 30 мин при 0 С и затем экстрагируют водой. Органический слой отделяют, сушат,фильтруют и выпаривают растворитель, получая 1,07 г 7-бром-2,3-дигидро[1,4]диоксино[2,3-b]пиридин 3-метанолметансульфоната (сложный эфир) (промежуточный продукт 36). Пример А.13a) Хлор(1,1-диметилэтил)диметилсилан (0,020 моль) добавляют по каплям к раствору промежуточного продукта (36) (0,010 моль) и 1H-имидазола (0,020 моль) в ДМФ (100 мл) и реакционную смесь перемешивают в течение 16 ч при комнатной температуре. Выпаривают растворитель. Остаток переносят в смесь вода/этилацетат. Органический слой отделяют, сушат, фильтруют и выпаривают растворитель.- 12005760 Остаток очищают хроматографически на короткой открытой колонке с силикагелем (элюент:гексан/этилацетат = 90/10). Необходимые фракции собирают и выпаривают растворитель, получая 2,4 г 7-бром-3-(1,1-диметилэтил)диметилсилил]окси]метил]-2,3-дигидро[1,4]диоксино[2,3-b]пиридинаb) Реакция в атмосфере азота. Раствор промежуточного продукта (37) (0,00194 моль) в ТГФ охлаждают до -78 С. Добавляют по каплям BuLi (0,00214 моль, 2,5 М) и смесь перемешивают 75 мин при -78 С. Затем добавляют иодметан(0,00214 моль) и реакционную смесь перемешивают 45 мин. Добавляют насыщенный водный растворNH4Cl и дают смеси нагреться до комнатной температуры. Данную смесь экстрагируют этилацетатом. Отделенный органический слой сушат, фильтруют и выпаривают растворитель. Остаток очищают флэшхроматографией на колонке с силикагелем (элюент: гексан/этилацетат = 80/20). Необходимые фракции собирают и выпаривают растворитель, получая 0,24 г 3-(1,1-диметилэтил)диметилсилил]окси]метил]2,3-дигидро-7-метил[1,4]диоксино[2,3-b]пиридина (промежуточный продукт 38).c) Реакция в атмосфере азота. TBAF, 1 М/ТГФ (0,00122 моль) добавляют к раствору промежуточного продукта (38) (0,00081 моль) в безводном ТГФ (5 мл), перемешивают при комнатной температуре. Реакционную смесь перемешивают в течение 16 ч. Добавляют воду. Данную смесь экстрагируют этилацетатом. Отделенный органический слой сушат, фильтруют и выпаривают растворитель, получая 0,147 г 2,3-дигидро-7-метил[1,4]диоксино[2,3-b]пиридин-3-метанола (промежуточный продукт 39).d) Метансульфонилхлорид (0,00103 моль) добавляют к смеси промежуточного продукта (39)(0,00081 моль) и триэтиламина (0,0019 моль) в ДХМ, перемешиваемой при 0 С. Реакционную смесь перемешивают 30 мин при 0 С. Добавляют воду. Органический слой отделяют, сушат, фильтруют и выпаривают растворитель,получая 0,208 г 2,3-дигидро-7-метил[1,4]диоксино[2,3-b]пиридин-3 метанолметансульфоната (сложный эфир) (промежуточный продукт 40). Пример А.14a) К раствору промежуточного продукта (2-а) (0,03 моль) в ДХМ (50 мл) и насыщенному растворуNa2CO3 (50 мл) добавляют по каплям бром (0,09 моль) и реакционную смесь перемешивают в течение 16 ч при комнатной температуре. Затем добавляют раствор Nа 2SО 3 (10%) и смесь перемешивают 5 мин при комнатной температуре, а затем нейтрализуют насыщенным раствором Na2CO3. Водный слой экстрагируют ДХМ и объединенные органические слои сушат, фильтруют и выпаривают растворитель. Остаток очищают хроматографически на короткой открытой колонке с силикагелем (элюент: СН 2 С 12/(МеОН/насыщенный NH3) = 95/5). Необходимые фракции собирают и выпаривают растворитель. Остаток очищают высокоэффективной жидкостной хроматографией на силикагеле (элюент: СН 2 Сl2/(МеОН/насыщенный NН 3) = 97/3). Фракции продукта собирают и выпаривают растворитель, получая 2,7 г (S)-7-бром-2,3-дигидро[1,4]диоксино[2,3-b]пиридин-3-метанола (промежуточный продукт 41) и 0,26 г 8-бром-2,3-дигидро[1,4]диоксино[2,3-b]пиридин-3-метанола (промежуточный продукт 42).b) К смеси промежуточного продукта (42) (0,0014 моль) и триэтиламина (0,0028 моль) в ДХМ (5 мл) медленно добавляют метансульфонилхлорид (0,0021 моль) при комнатной температуре. Реакционную смесь перемешивают в течение 16 ч и затем экстрагируют водой. Отделенный органический слой сушат, фильтруют и выпаривают растворитель, получая 0,42 г (S)-8-бром-2,3-дигидро[1,4]диоксино[2,3b]пиридин-3-метанолметансульфоната (сложный эфир) (промежуточный продукт 43). Пример.А.15a) Раствор диэтилового эфира диазендикарбоновой кислоты (0,1572 моль) в ТГФ (163 мл) добавляют по каплям в токе азота к смеси 4-хлор-3-пиридинола (0,1429 моль), 2-пропен-1-ола (0,1572 моль) и трифенилфосфина (0,1572 моль) в ТГФ (276 мл), которую охлаждают на бане с водой и льдом. Полученную смесь перемешивают на бане с водой и льдом 15 мин и при комнатной температуре в течение ночи. Смесь концентрируют в вакууме и остаток промывают насыщенным раствором Nа 2 СО 3. Смесь экстрагируют ДХМ, а отделенный органический слой сушат, фильтруют и выпаривают растворитель досуха. Остаток обрабатывают ДИПЭ и полученное твердое вещество отфильтровывают и отбрасывают. Фильтрат выпаривают досуха и остаток обрабатывают диэтиловым эфиром, полученное твердое вещество отфильтровывают и снова отбрасывают. Фильтрат выпаривают досуха, а остаток очищают хроматографически на открытой колонке с силикагелем (элюент:ДХМ/2-пропанон = 99/1; 98/2). Фракции продукта собирают и выпаривают растворитель, получая 7,9 г 4-хлор-3-(2-пропенилокси)пиридина (промежуточный продукт 44).b) К смеси NaH 60% (0,11 моль) в ДМЭ (170 мл) в токе азота добавляют по каплям бензолметанол(0,0698 моль) и смесь перемешивают при комнатной температуре 30 мин. Затем добавляют по каплям раствор промежуточного продукта (44) (0,046 моль) в ДМЭ (170 мл) и полученную смесь перемешивают и кипятят с обратным холодильником в течение ночи. Охлажденную реакционную смесь промывают водой и экстрагируют этилацетатом. Отделенный органический слой сушат, фильтруют и выпаривают растворитель досуха. Остаток очищают хроматографически на открытой колонке с силикагелем (элюент: ДХМ/2-пропанон/МеОН = 100/0/0; 96/4/0; 96/0/4; 90/0/10). Фракции продукта собирают и выпаривают растворитель, получая 6,2 г 4-(фенилметокси)-3-(2-пропенилокси)пиридина (промежуточный продукт 45).c) К раствору промежуточного продукта (45) (0,0256 моль) в ДХМ (64 мл) добавляют по каплям бром (0,0256 моль) и смесь перемешивают при комнатной температуре в течение 30 мин. Реакционную смесь промывают насыщенным раствором NaHCO3 с несколькими каплями 10% раствора Na2SO3 и экстрагируют. Отделенный органический слой сушат, фильтруют и выпаривают растворитель досуха. Остаток очищают хроматографически на открытой колонке (элюент: ДХМ/МеОН = 100/0; 99/1; 98/2). Фракции продукта собирают и выпаривают растворитель, получая 6,68 г 3-(2,3-дибромпропокси)-4(фенилметокси)пиридина (промежуточный продукт 46).d) К раствору промежуточного продукта (46) (0,0166 моль) в ДХМ (270 мл) добавляют порциямиFеС 13 (0,033 моль) и смесь перемешивают при комнатной температуре в течение ночи. Реакционную смесь обрабатывают насыщенным раствором NH4Cl и разбавленным раствором тартрата калия-натрия, а затем фильтруют через целит. Растворитель выпаривают досуха и остаток обрабатывают метанолом, а затем фильтруют. Фильтрат выпаривают досуха, а остаток обрабатывают монокалиевой-мононатриевой солью 2,3-дигидроксибутандиовой кислоты (1 г) в этаноле и кипятят с обратным холодильником 18 ч. Охлажденную реакционную смесь фильтруют через целит и фильтрат выпаривают досуха. Остаток промывают водой и экстрагируют ДХМ. Отделенный органический слой сушат, фильтруют и выпаривают растворитель досуха. Остаток очищают флэш-хроматографией на колонке с силикагелем (элюент:этилацетат/(МеОН/NН 3) = 96/4). Фракции продукта собирают и выпаривают растворитель, получая 0,52 г 2-(бромметил)-2,3-дигидро[1,4]диоксино[2,3-с]пиридина (промежуточный продукт 47). Пример А.16 а) 5-Бромпиридин (0,063 моль) медленно добавляют к 2-пропен-1-олу (4,03 моль) при 0 С и данную смесь перемешивают при комнатной температуре 1 ч. Затем добавляют NaH 60% (0,126 моль) и реакционную смесь перемешивают и кипятят с обратным холодильником в течение 48 ч. Добавляют воду и экстрагируют смесь этилацетатом. Отделенный органический слой сушат, фильтруют и выпаривают растворитель. Остаток очищают хроматографически на короткой открытой колонке с силикагелем (элюент: гексан/этилацетат = 50/50). Необходимые фракции собирают и выпаривают растворитель, получая 2,3 г 5-(2-пропенилокси)пиримидина (промежуточный продукт 48).b) К раствору промежуточного продукта (48) (0,0169 моль) в ДХМ (250 мл) медленно добавляют бром (0,0186 моль) и реакционную смесь перемешивают при комнатной температуре 1 ч. Экстрагируют растворитель насыщенным раствором Na2CO3 и добавляют несколько капель раствора Nа 2SО 3 (10%). Отделенный органический слой сушат, фильтруют и выпаривают растворитель. Остаток очищают хроматографически на короткой открытой колонке с силикагелем (элюент: гексан/этилацетат = 66/33; 50/50). Необходимые фракции собирают и выпаривают растворитель, получая 3,85 г 3-(2,3-дибромпропокси)пиридина (промежуточный продукт 49).c) К раствору промежуточного продукта (49) (0,0123 моль) и Н 2SO4 (0,0135 моль) в воде (5 мл) добавляют по каплям 35% СН 3 СО 2 Н (0,0246 моль) и реакционную смесь перемешивают при комнатной температуре в течение 16 ч. Смесь экстрагируют этилацетатом. Отделенный органический слой сушат,фильтруют и выпаривают растворитель. Остаток очищают хроматографически на короткой открытой колонке с силикагелем (элюент: этилацетат/(МеОН/NН 3) = 95/5). Необходимые фракции собирают и выпаривают растворитель, получая 2,83 г 5-(2,3-дибромпропокси)-4(3 Н)-пиримидинона (промежуточный продукт 50).d) Смесь промежуточного продукта (50) (0,0091 моль) и NаНСО 3 (0,0113 моль) в этаноле (100 мл) перемешивают и кипятят с обратным холодильником в течение 16 ч. Реакционной смеси дают охладиться до комнатной температуры и выпаривают растворитель. Остаток переносят в воду и этилацетат. Отделенный органический слой сушат, фильтруют и выпаривают растворитель. Остаток очищают хроматографически на короткой открытой колонке с силикагелем (элюент: гексан/этилацетат = 66/33; 50/50). Необходимые фракции собирают и выпаривают растворитель, получая 1,1 г 7-(бромметил)-6,7 дигидро[1,4]диоксино[2,3-d]пиримидина (промежуточный продукт 51). Пример А.17 а) Реакция в токе аргона. Смесь 1-амино-3-дибензиламинопропана (0,195 моль) в этаноле (225 мл) перемешивают при комнатной температуре. Выливают в данную смесь этилпропеноат (0,2 моль) и перемешивают реакционную смесь в течение ночи при комнатной температуре. Выпаривают растворитель. Остаток очищают колоночной хроматографией на силикагеле (элюент:СН 2 Сl2/гексан/СН 3 ОН = 50/45/5). Необходимые фракции собирают и выпаривают растворитель, получая 27 г этилового эфира N-[3-[бис(фенилметил)амино]пропил]аланина (промежуточный продукт 52).b) Промежуточный продукт (52) перемешивают в этаноле (150 мл). Данную смесь подкисляют смесью HCl/2-пропанол (60 мл) + вода (2 мл). Смесь перемешивают 15 мин. Выпаривают растворитель при 60 С. Добавляют к остатку этанол. Выпаривают растворитель. Добавляют к остатку смесь метанола в воде (70:30, 200 мл) и смесь перемешивают, затем слегка нагревают до полного растворения. Кислый раствор добавляют по каплям (за 30 мин в атмосфере аргона) к раствору KOCN (0,100 моль) в смеси метанола в воде (70:30, 100 мл), перемешивают при комнатной температуре, рН изменяется от 8 до 6.- 14005760 Реакционную смесь перемешивают в течение 19 ч при комнатной температуре. Добавляют еще KOCN(0,32 г) и реакционную смесь перемешивают 90 мин при комнатной температуре. Добавляют еще KOCN(0,9 г) и реакционную смесь перемешивают 75 мин при комнатной температуре, затем 6 дней при 95 С. Реакционную смесь охлаждают. Добавляют по каплям концентрированную НСl (20 мл). Реакционную смесь перемешивают в течение 2 ч при 95 С, затем оставляют на ночь при комнатной температуре. Осадок отфильтровывают, а фильтрат перемешивают и охлаждают в течение 3 ч на бане со льдом. Полученный осадок отфильтровывают и сушат, получая 19,6 г 1-[3-[бис(фенилметил)амино]пропил]дигидро 2,4(1 Н,3 Н)-пиримидиндиона (промежуточный продукт 53).c) Смесь промежуточного продукта (53) (0,010 моль) в метаноле (150 мл) гидрируют при 50 С, используя в качестве катализатора палладий на углероде (10%, 1 г). После поглощения водорода (2 эквивалента) катализатор отфильтровывают, а фильтрат выпаривают. Добавляют толуол и выпаривают азеотропную смесь на роторном испарителе. Остаток сушат в течение субботы-воскресенья в умеренном токе азота. Добавляют толуол и выпаривают азеотропную смесь на роторном испарителе. Остаток перемешивают с ДХМ (50 мл). Добавляют NaOCH3 (0,504 г) и реакционную смесь перемешивают один час в атмосфере азота. Еще добавляют метанол (25 мл) и смесь перемешивают 30 мин. Осадок отфильтровывают, а фильтрат выпаривают в вакууме, получая 1,54 г 1-(3-аминопропил)дигидро-2,4(1 Н,3 Н)пиримидиндиона (промежуточный продукт 54). В. Получение конечных соединений Пример В.1 Смесь промежуточного продукта (1) (0,00815 моль), 1-(3-аминопропил)тетрагидро-2(1 Н)пиримидинона (0,00815 моль) и СаО (0,022 моль) в растворителе (26,5 мл) перемешивают при 100 С в течение ночи в аппарате Парра. Избыток СаО отфильтровывают. Фильтрат выпаривают досуха. Остаток очищают хроматографически на открытой колонке с силикагелем (элюент 1: CH2Cl2/CH3OH = 90/10 и элюент 2: СН 2 Сl2/(СН 3 ОН/NH3) = 96/4). Чистые фракции собирают и выпаривают растворитель. Остаток снова очищают ВЭЖХ на силикагеле (элюент: СН 2 Сl2/(СН 3 ОН/NН 3) = 93/7). Чистые фракции собирают и растворитель выпаривают. Остаток кристаллизуют из ДИПЭ. Осадок отфильтровывают и сушат, получая 0,88 г -1-[3-(2,3-дигидро[1,4]диоксино[2,3-b]пиридин-3-ил)метил]амино]пропил]тетрагидро-2(1 Н)пиримидинона (соединение 1). Пример В.2 Смесь промежуточного продукта (6) (0,0092 моль) и промежуточного продукта (13) (0,0183 моль),перемешивают 2 ч при 100 С. Неочищенную реакционную смесь очищают хроматографически на открытой колонке с силикагелем (элюент:СН 2 Сl2/СН 3 ОН = 90/10). Необходимые фракции собирают и выпаривают растворитель. Остаток промывают ДИПЭ, затем сушат, получая 1,48 г -1-[3-[(1,3 диоксоло[4,5-b]пиридин-2-илметил)амино]пропил]тетрагидро-5,5-диметил-2(1 Н)-пиримидинона (соединение 10). Пример В.3 Смесь 2-(бромметил)-3,4-дигидро-2 Н-пирано[2,3-b]пиридина (0,007 моль) и 1-(3 аминопропил)тетрагидро-2(1 Н)-пиримидинона (0,014 моль) перемешивают 2 ч при 100 С. Неочищенную реакционную смесь обрабатывают ДХМ и полученное твердое вещество отфильтровывают и отбрасывают. Фильтрат выпаривают и остаток очищают хроматографически на открытой колонке с силикагелем(элюент: CH2Cl2/CH3OH = 84/16; CH2Cl2/(СН 3 ОН/NH3) = 90/10). Самые чистые фракции собирают и выпаривают растворитель. Остаток растворяют в этаноле и превращают в соль этандиовой кислоты (1:1),затем отфильтровывают и перекристаллизовывают из этанола, получая 0,45 г -1-[3-(3,4-дигидро-2 Нпирано[2,3-b]пиридин-2-ил)метил]амино]пропил]тетрагидро-2(1 Н)-пиримидинонэтандиоата (1:1) (соединение 9). Пример В.4 Смесь 2, 3-дигидро-N-(фенилметил)-1,4-диоксино[2,3-b]пиридин-3-метанамина (0,0059 моль) и промежуточного продукта (18) (0,00497 моль) в метаноле (30 мл) перемешивают и кипятят с обратным холодильником в течение ночи. Растворитель выпаривают. Остаток очищают хроматографически на короткой открытой колонке с силикагелем (элюент: СН 2 Сl2/2-пропанон = 96/4; 90/10 и 80/20; затемCH2Cl2/CH3OH = 96/4 и 90/10). Фракции продукта собирают и выпаривают растворитель, получая 1,29 г-1-[3-(2,3-дигидро-1,4-диоксино[2,3-b]пиридин-3-ил)метил](фенилметил)амино]-2-гидроксипропил]2,4-имидазолидиндиона (соединение 12). Пример В.5 Раствор соединения (12) (0,0031 моль) в метаноле (40 мл) гидрируют в аппарате Парра при 50 С,используя в качестве катализатора палладий на углероде (10%, 0,13 г). После поглощения водорода (1 эквивалент) катализатор отфильтровывают, а фильтрат выпаривают. Остаток очищают ВЭЖХ на силикагеле (элюент: СН 2 Сl2/(СН 3 ОН/NН 3) градиент от 90/10 до 92,5/7,5). Фракции продукта собирают и выпаривают растворитель, получая 0,3 г 1-[3-(2,3-дигидро-1,4-диоксино[2,3-b]пиридин-3- ил)метил]амино]2-гидроксипропил]-2,4-имидазолидиндиона (соединение 13).- 15005760 Пример В.6 Гидроксид калия (0,0022 моль) в этаноле добавляют к соединению (44) (0,0012 моль) в этаноле. Реакционную смесь перемешивают 4 ч при 50 С, затем в течение ночи при комнатной температуре. Растворитель выпаривают. Остаток очищают ВЭЖХ на RP BDS (Hyperprep С 18, 100 А, 8 мкм; элюент: Н 2O/СН 3 СN (0 мин) 100/0, (24 мин) 63/37, (24,01-32 мин) 0/100). Фракции продукта собирают и выпаривают растворитель, получая 0,050 г соединения (50). Пример В.7 Реакция в атмосфере азота. Соединение (R268652) (0,0037 моль) перемешивают в ТГФ (120 мл) и охлаждают на бане с водой и льдом. Добавляют литийборгидрид (0,0074 моль, 3,7 мл 2 М раствора в ТГФ) и реакционную смесь перемешивают один час при комнатной температуре. Смесь перемешивают и кипятят с обратным холодильником в течение 5 ч, затем в течение субботы-воскресенья при комнатной температуре, затем перемешивают и кипятят с обратным холодильником в течение ночи и, наконец, охлаждают до комнатной температуры. Еще добавляют литийборгидрид (0,0074 моль) и реакционную смесь перемешивают и кипятят с обратным холодильником в течение ночи, затем охлаждают до комнатной температуры. Добавляют воду. Смесь подщелачивают 50% NaOH и затем выпаривают органический растворитель (ТГФ). Остаток очищают колоночной хроматографией на силикагеле (элюент: СН 2 Сl2/СН 3 ОН = 95/5). Необходимые фракции собирают и выпаривают растворитель. Остаток переносят в небольшое количество АЦН, нагревают до полного растворения, охлаждают на бане со льдом и полученный осадок отфильтровывают, промывают и сушат, получая 0,7 г соединения (51). Пример В.8 Раствор мета-хлорпербензойной кислоты (0,0027 моль) в хлороформе (34 мл) добавляют по каплям к раствору соединения (14) (0,0024 моль) в хлороформе (8 мл), который охлажден до -50 С. Смесь перемешивают 1 ч при температуре от -50 до -20 С. Затем добавляют метанол и К 2 СО 3. Полученную смесь перемешивают при комнатной температуре 30 мин и затем фильтруют. Твердое вещество промывают смесью СН 2 Сl2/СН 3 ОН = 80/20, а фильтрат выпаривают досуха. Смесь очищают флэш-хроматографией на колонке (элюент: СН 2 Сl2/СН 3 ОН/(СН 3 ОН/NН 3) 80/20/0; 85/0/15; 80/0/20). Фракции продукта собирают и промывают ДХМ. Растворитель фильтруют и выпаривают, получая 0,44 г соединения (40). Пример В.9 Соединение (60) (0,0091 моль) очищают и выделяют высокоэффективной жидкостной хроматографией на Chiralpak AD (элюент: С 2 Н 5OН/СН 3 СN = 64/36). Собирают фракции продукта, выпаривают растворитель, а каждый остаток растворяют в этаноле и превращают в соль этандиовой кислоты (1:1). Выход 0,7 г соединения (27), []D20=-42,50 (с=25,06 мг/5 мл в СН 3 ОН), т.пл. 212 С; и 0,9 г соединения (28),[]D20=+42,77 (с=25,72 мг/5 мл в СН 3 ОН), т.пл. 216 С. Пример В.10 Смесь промежуточного продукта (3) (0,04 моль), 1-(4-пиперидинил)-2-имидазолидинона (0,05 моль) и NаНСО 3 (0,09 моль) в 1,4-диоксане (300 мл) перемешивают и кипятят с обратным холодильником в течение 60 ч. Выпаривают растворитель. Остаток распределяют между водой и ДХМ. Отделенный органический слой сушат, фильтруют и выпаривают растворитель. Остаток очищают колоночной хроматографией на силикагеле (элюент: СН 2 Сl2/СН 3 ОН = 95/5). Необходимые фракции собирают и выпаривают растворитель. Остаток отверждают в ДИПЭ, отфильтровывают и сушат, получая 6,13 г (48,3%) соединения (19) (т.пл. 132 С; []D20=-41,70 С, с=24,34 мг/5 мл в метаноле). Пример В.11 Смесь промежуточного продукта (54) (0,058 моль) в диоксане (400 мл) перемешивают. Добавляют смесь промежуточного продукта (3) (0,029 моль) и СаО (2,4 г). Реакционную смесь перемешивают при 140 С в течение 16 ч. Выпаривают растворитель. Добавляют к остатку ДХМ и воду. Отделенный органический слой сушат, фильтруют и выпаривают растворитель. Остаток очищают высокоэффективной жидкостной хроматографией на силикагеле (элюент: СН 2 Сl2/(СН 3 ОН/NН 3) = 90/10). Фракции продукта собирают и выпаривают растворитель. Остаток растворяют в этаноле и превращают в соль этандиовой кислоты (1:1). Полученный осадок отфильтровывают и сушат, получая 1,5 г (S)-1-[3-(2,3 дигидро[1,4]диоксино[2,3-b]пиридин-3-ил)метил]амино]пропил]дигидро-2,4(1 Н,3 Н)-пиримидиндионаa) Смесь промежуточного продукта (3) (0,041 моль), бензиламина (0,041 моль) и NаНСО 3 (0,11 моль) в диоксане (100 мл) перемешивают и кипятят с обратным холодильником в течение 48 ч. Выпаривают растворитель. Остаток переносят в воду и ДХМ. Отделенный органический слой сушат, фильтруют и выпаривают растворитель. Остаток очищают колоночной хроматографией на силикагеле (элюент:CH2Cl2/CH3OH = 95/5). Необходимые фракции собирают и выпаривают растворитель, получая (S)-2,3 дигидро-N-(фенилметил)[1,4] диоксино[2,3-b]пиридин-3-метанамин (промежуточный продукт 55).b) Промежуточный продукт (55) (0,0195 моль) растворяют в этаноле (50 мл). Добавляют 2 пропеннитрил (0,02 моль) и реакционную смесь перемешивают и кипятят с обратным холодильником в течение ночи. Добавляют еще 2-пропеннитрил (0,02 моль) и реакционную смесь перемешивают и кипя- 16005760 тят с обратным холодильником в течение 2 ч. Добавляют еще 2-пропеннитрил (0,02 моль) и реакционную смесь перемешивают и кипятят с обратным холодильником в течение 6 ч. Добавляют еще 2 пропеннитрил (0,02 моль) и реакционную смесь перемешивают и кипятят с обратным холодильником в течение ночи. Выпаривают растворитель. Остаток очищают колоночной хроматографией на силикагеле(элюент: CH2Cl2/CH3OH = 97/3). Фракции продукта собирают и выпаривают растворитель, получая 6,0 гc) Смесь промежуточного продукта (56) (0,0195 моль) в метаноле, насыщенном NН 3 (400 мл), гидрируют, используя в качестве катализатора никель Ренея (1 г). После поглощения водорода (2 эквивалента) катализатор отфильтровывают, а фильтрат выпаривают. Остаток очищают колоночной хроматографией на силикагеле (элюент: CH2Cl2/(СН 3 ОН/NН 3) = 90/10). Фракции продукта собирают и выпаривают растворитель, получая 2,7 г (S)-N1-[(2,3-дигидро[1,4]диоксино[2,3-b]пиридин-3-ил)метил]-N1-(фенилметил)-1,3-пропандиамина (промежуточный продукт 57).d) Этилмонобромацетат (0,0032 моль) растворяют в ТГФ (30 мл). Данный раствор добавляют по каплям и медленно к смеси промежуточного продукта (57) (0,0032 моль) и триэтиламина (0,0048 моль) в ТГФ (50 мл). Реакционную смесь перемешивают в течение ночи при комнатной температуре. Выпаривают растворитель. Остаток распределяют между водой и ДХМ. Органический слой отделяют, сушат,фильтруют и выпаривают растворитель. Остаток очищают колоночной хроматографией на силикагеле(элюент:CH2Cl2(СН 3 ОН/NН 3) = 99/1). Необходимые фракции собирают и выпаривают растворитель, получая 0,8 г этилового эфира (S)-3-(2,3-дигидро[1,4]диоксино[2,3-b]пиридин-3-ил)метил](фенилметил)амино]пропил]амино]уксусной кислоты (промежуточный продукт 58).e) Смесь промежуточного продукта (58) (0,002 моль) в диоксане (7,3 мл) и ТГФ (2,4 мл) перемешивают при комнатной температуре. Добавляют триметилсилилизоцианат (0,0023 моль) и реакционную смесь перемешивают и кипятят с обратным холодильником один час. Выпаривают растворитель. Остаток растворяют в НСl (6N, 6,2 мл), затем перемешивают и кипятят с обратным холодильником один час. Реакционную смесь охлаждают, выливают в смесь NН 4OН/лед и экстрагируют ДХМ. Отделенный органический слой сушат, фильтруют и выпаривают растворитель, получая 0,4 г (S)-1-[3-(2,3 дигидро[1,4]диоксино[2,3-b]пиридин-3-ил)метил](фенилметил)амино]пропил]-2,4-имидазолидиндионаf) Смесь промежуточного продукта (59) (0,001 моль) в метаноле (50 мл) гидрируют, используя в качестве катализатора палладий на углероде (0,2 г). После поглощения водорода (1 эквивалент) катализатор отфильтровывают, а фильтрат выпаривают. Остаток растворяют в этаноле и превращают в соль этандиовой кислоты (1:1), получая 0,3 г соединения (30), т.пл. 190 С; []D20=-35,99, (с=24,87 мг/5 мл в ДМФ). В табл. F-1-F-7 перечислены соединения, которые получают в соответствии с одним из перечисленных выше примеров. Использованы следующие сокращения: .C2H2O4 обозначает соль этандиовой кислоты. Таблица F-1C.1 Желудочный тонус, измеренный при помощи электронного баростата у собак, находящихся в сознании Желудочный тонус нельзя измерить манометрическими способами. Поэтому применяют электронный баростат. Он позволяет исследовать данную физиологическую модель, осуществлять регулирование желудочного тонуса у находящихся в сознании собак и исследовать влияние на данный тонус исследуемых соединений. Баростат состоит из системы подачи воздуха, которая связана поливиниловой трубкой с двойным просветом размером 14 со сверхтонким мягким полиэтиленовым мешком (максимальный объем 700 мл). Изменения желудочного тонуса измеряют, фиксируя изменения объема воздуха во внутрижелудочном мешке, поддерживаемом при постоянном давлении. Баростат поддерживает постоянное давление (предварительно выбранное) внутри заполняемого воздухом мягкого мешка, введенного в желудок, изменяя объем воздуха в мешке при помощи электронной системы обратной связи. Таким образом, баростат измеряет желудочную двигательную активность (сжатие или релаксацию) как изменения внутрижелудочного объема (уменьшение или увеличение, соответственно) при постоянном внутрижелудочном давлении. Баростат состоит из тензодатчика, соединенного через электронное реле с системой подачиаспирации воздуха. Тензодатчик и система подачи соединены посредством поливиниловой трубки с двойным просветом со сверхтонким полиэтиленовым мешком. Шкала баростата позволяет выбирать уровень давления, который будет поддерживаться во внутрижелудочном мешке. Самок гончих собак весом 7-17 кг тренируют стоять спокойно в решетках Павлова. Им имплантируют желудочную канюлю под общим наркозом и с асептическими мерами предосторожности. После серединной лапаротомии делают разрез стенки желудка в продольном направлении между большим и меньшим изгибом на 2 см выше нервов Латаржета. Канюлю закрепляют в стенке желудка при помощи двойного кисетного шва, выводят через рану в левом квадранте подреберной области. Собакам обеспечивают двухнедельный восстановительный период. В начале эксперимента канюлю открывают для удаления желудочного сока или остатков пищи. Если необходимо, чистят желудок при помощи 40-50 мл слегка теплой воды. Сверхтонкий мешок баростата помещают на дно желудка через желудочную канюлю. Для гарантии легкого развертывания внутрижелудочного мешка во время эксперимента в него дважды вводят объем 300-400 мл. Если в период стабилизации, максимально 90 мин, объем желудка является постоянным в течение 15 минут при постоянном давлении 6 мм рт.ст. (примерно 0,81 кПа), вводят исследуемое соединение подкожно (S.C.) или интрадуоденально (I.D.). Производят отбор исследуемых соединений, то есть измеряют изменения объема желудка, обычно при, дозе 0,63 мг/кг. Если при процедуре отбора показано, что- 22005760 исследуемое соединение является активным, то исследуют другие дозы и способы введения. В табл. С-1 суммированы средние максимальные изменения объема при фундальной релаксации в течение 1 ч наблюдения после S.C. или I.D. введения исследуемого соединения (0,63 мг/кг). Таблица С-1: максимальное изменение объема, определенное при концентрации исследуемого соединения 0,04 мг/кг С.2 Сосудосуживающее действие на базилярную артерию Сегменты базилярных артерий, взятых от свиней (анестезированных пентобарбиталом натрия), закрепляют для регистрации изометрического растяжения в бане для исследования органов. Препараты промывают в растворе Кребса-Хензелайта. Данный раствор хранят при 37 С и продувают смесью газов 95% O2-5% СO2. Препараты растягивают до получения стабильного натяжения 2 г. Получают препараты, которые сокращаются под действием серотонина (3 х 10-7M). Измеряют реакцию на добавление серотонина и затем серотонин отмывают. Данную процедуру повторяют до получения стабильных откликов. После этого вводят в баню исследуемое соединение и измеряют сокращение препарата. Данную сократительную реакцию выражают как процент от реакции на серотонин, которая измерена ранее. Определяют величину ЭД 50 (молярную концентрацию) как концентрацию, при которой исследуемое соединение вызывает 50% сократительной реакции, полученной с серотонином. Указанные величины ЭД 50 определяют из экспериментов на трех различных препаратах. его стереохимически изомерные формы, N-оксидная форма, фармацевтически приемлемая аддитивная соль кислоты или четвертичная аммониевая соль, где -a1=a2-a3=a4- представляет бивалентный радикал формулы-N=CH-CH=CH- (а-1),-CH=N-CH=CH- (а-2),-CH=CH-N=CH- (а-3),-CH=CH-CH=N- (а-4),-N=CH-N=CH- (a-6),-Z1-Z2- представляет бивалентный радикал формулы-Y1-CH(R4)-CH2-CH2- (b-6),где, если возможно, необязательно один или два атома водорода на одном или разных атомах углерода или азота могут быть замещены C1-6 алкилом;Y1 представляет кислород или серу;-А- представляет бивалентный радикал формулыAlk2 представляет C1-6 алкил, необязательно замещенный одним или более гидрокси;R7 представляет водород, C1-6 алкил, С 3-6 циклоалкил, фенил или фенилметил иQ представляет бивалентный радикал формулы-СН 2-СН 2- (е-1),-СН 2-СН 2-СН 2- (е-2),-СН 2-СО- (е-5),-(СН 2)2-СО- (е-7),где необязательно один или два атома водорода на одном или разных атомах углерода могут быть заменены С 1-4 алкилом, гидрокси или фенилом. 2. Соединение по п.1, где Q представляет радикал формулы (е-2) или (е-5). 3. Соединение по п.1, где бивалентный радикал -a1=a2-a3=a4- имеет формулу (а-1), (а-2) или (а-4); бивалентный радикал -Z1-Z2-имеет формулу (b-1), (b-2) или (b-4); Alk1 представляет -СН 2-;R7 представляет водород. 4. Соединение по п.1, где бивалентный радикал -a1=a2-a3=a4-имеет формулу (а-1), (а-2) или (а-4); бивалентный радикал -Z1-Z2-имеет формулу (b-1), (b-2) или (b-4);R7 представляет водород. 5. Соединение по п.1, где бивалентный радикал -a1=a2-a3=a4- имеет формулу (а-1), (а-2) или (а-4); бивалентный радикал -Z1-Z2-имеет формулу (b-1), (b-2) или (b-4);R7 представляет водород. 6. Соединение по п.1, где данное соединение представляет 1-[1-[(2,3-дигидро[1,4]диоксино[2,3-b]пиридин-3-ил)метил]-4-пиперидинил]-2-имидазолидинон; 1-[1-[(2,3-дигидро[1,4]диоксино[2,3-b]пиридин-3-ил)метил]-4-пиперидинил]тетрагидро-2(1 Н)пиримидинон; 1-[3-(2,3-дигидро[1,4]диоксино[2,3-b]пиридин-3-ил)метил]амино]пропил]дигидро-2,4(1 Н,3 Н)пиримидиндион и 1-[3-(2,3-дигидро[1,4]диоксино[2,3-b]пиридин-3-ил)метил]амино]пропил]-2,4-имидазолидиндион,их фармацевтически приемлемые аддитивные соли кислот, стереохимически изомерные формы или Nоксидные формы. 7. Фармацевтическая композиция, содержащая фармацевтически приемлемый носитель и терапевтически активное количество соединения по любому из пп.1-6. 8. Способ получения фармацевтической композиции по п.7, где терапевтически активное количество соединения по любому из пп.1-6 тщательно смешивают с фармацевтически приемлемым носителем. 9. Применение соединения по любому из пп.1-6 для фундальной релаксации. 10. Способ получения соединения формулы (I), где промежуточный продукт формулы (II) алкилируют промежуточным продуктом формулы (III) в реакционно-инертном растворителе и необязательно в присутствии подходящего основания и соединения формулы (I), при необходимости, превращают друг в друга известными реакциями трансформации; или, если требуется, соединение формулы (I) превращают в аддитивную соль кислоты или,обратно, аддитивную соль кислоты соединения формулы (I) превращают в свободное основание щелочью; и, если требуется, получают их стереохимически изомерные формы.
МПК / Метки
МПК: A61P 1/00, A61K 31/435, C07D 491/06
Метки: соединения, лечения, нарушенной, фундальной, релаксации
Код ссылки
<a href="https://eas.patents.su/26-5760-soedineniya-dlya-lecheniya-narushennojj-fundalnojj-relaksacii.html" rel="bookmark" title="База патентов Евразийского Союза">Соединения для лечения нарушенной фундальной релаксации</a>
Предыдущий патент: Устройство для непрерывного литья металлических полос
Следующий патент: 4-аминозамещенные-2-замещенные-1,2,3,4-тетрагидрохинолины в качестве ингибиторов сетр (хэпб)
Случайный патент: Способ фиксации информации о ходе следственных действий и система информационного обеспечения протоколирования в ходе следственных действий












