Нестероидные (гетеро)циклически замещенные ациланилиды, обладающие смешанным гестагенным и андрогенным действием
Номер патента: 4306
Опубликовано: 26.02.2004
Авторы: Мун Ханс-Петер, Штрельке Петер, Хайнрих Николаус, Шёллькопф Клаус, Фритцемайер Карл-Хайнрих, Краттенмахер Рольф, Леманн Манфред
Формула / Реферат
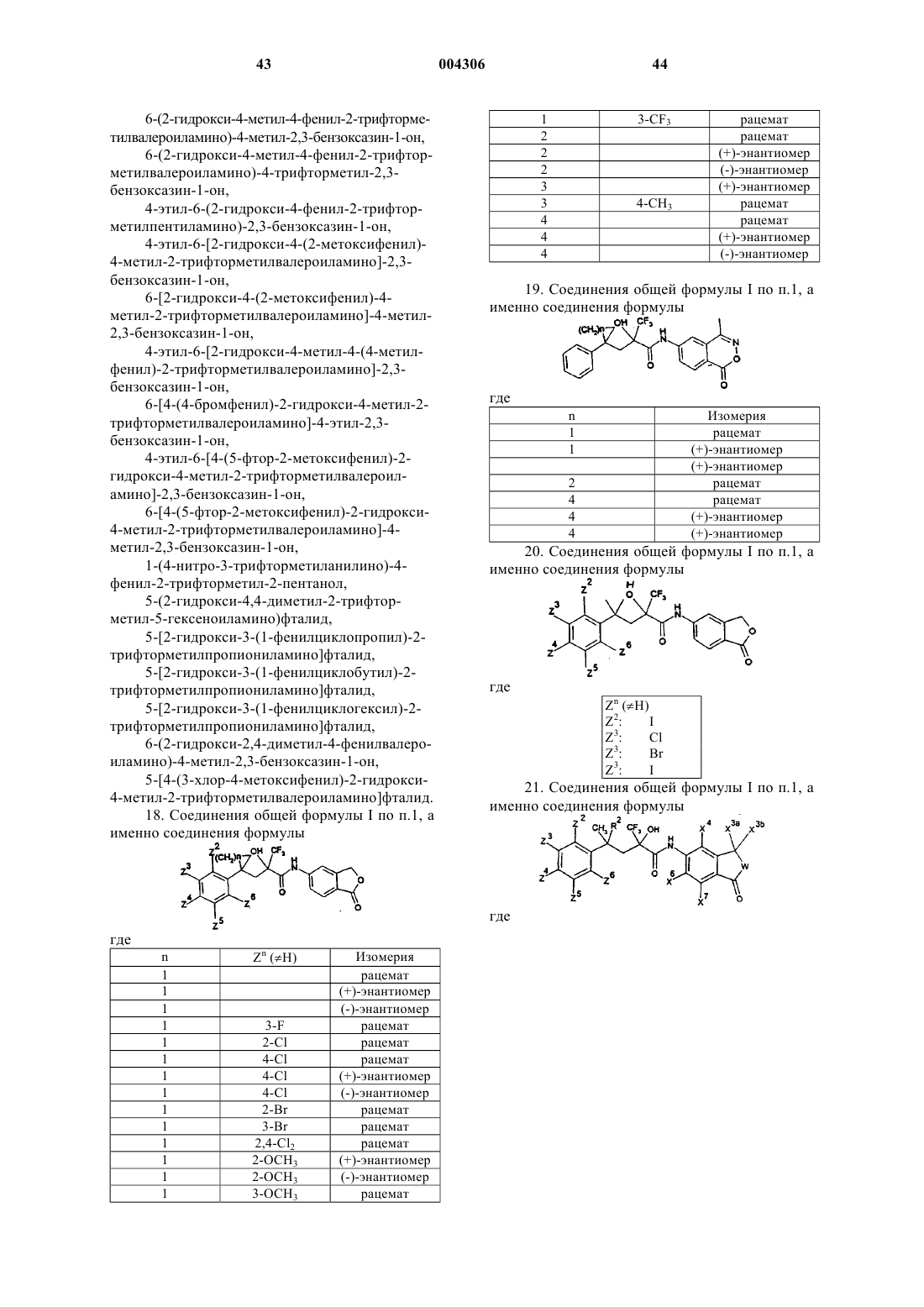
1. Соединения общей формулы I
в которой
R1 и R2 являются одинаковыми или различными и обозначают атом водорода, C1-C5алкильную группу или атом галогена, а также вместе с C-атомом цепи образуют кольцо, имеющее в общей сложности 3-7 членов,
R3 обозначает C1-C5алкильную группу или частично либо полностью фторированную C1-C5алкильную группу,
A обозначает моно- либо бициклическое карбоциклическое или гетероциклическое ароматическое кольцо, которое необязательно замещено одним или несколькими остатками, выбранными из атомов галогена, C1-C5алкильных групп, C2-C5алкенильных групп -CR5=CR6R7, где R5, R6 и R7 являются одинаковыми или различными и независимо друг от друга обозначают атомы водорода или C1-C5алкильные группы, гидроксигрупп, гидроксигрупп, которые несут C1-C10ацильную группу, C3-C10карбалкоксиалкильную группу, C2-C5цианалкильную группу, незамещенную либо замещенную C3-C10аллильную группу, незамещенную либо замещенную C3-C10пропаргильную группу, C2-C5алкоксиалкильную группу, частично либо полностью замещенную атомами фтора C1-C5алкильную группу, а также выбранными из циано- либо нитрогруппы, C1-C5алкоксигрупп, C1-C5алкилтиогрупп, моно- либо дизамещенных C1-C10аминогрупп или частично либо полностью фторированных C1-C5алкильных групп,
B обозначает карбонильную или CH2-группу и
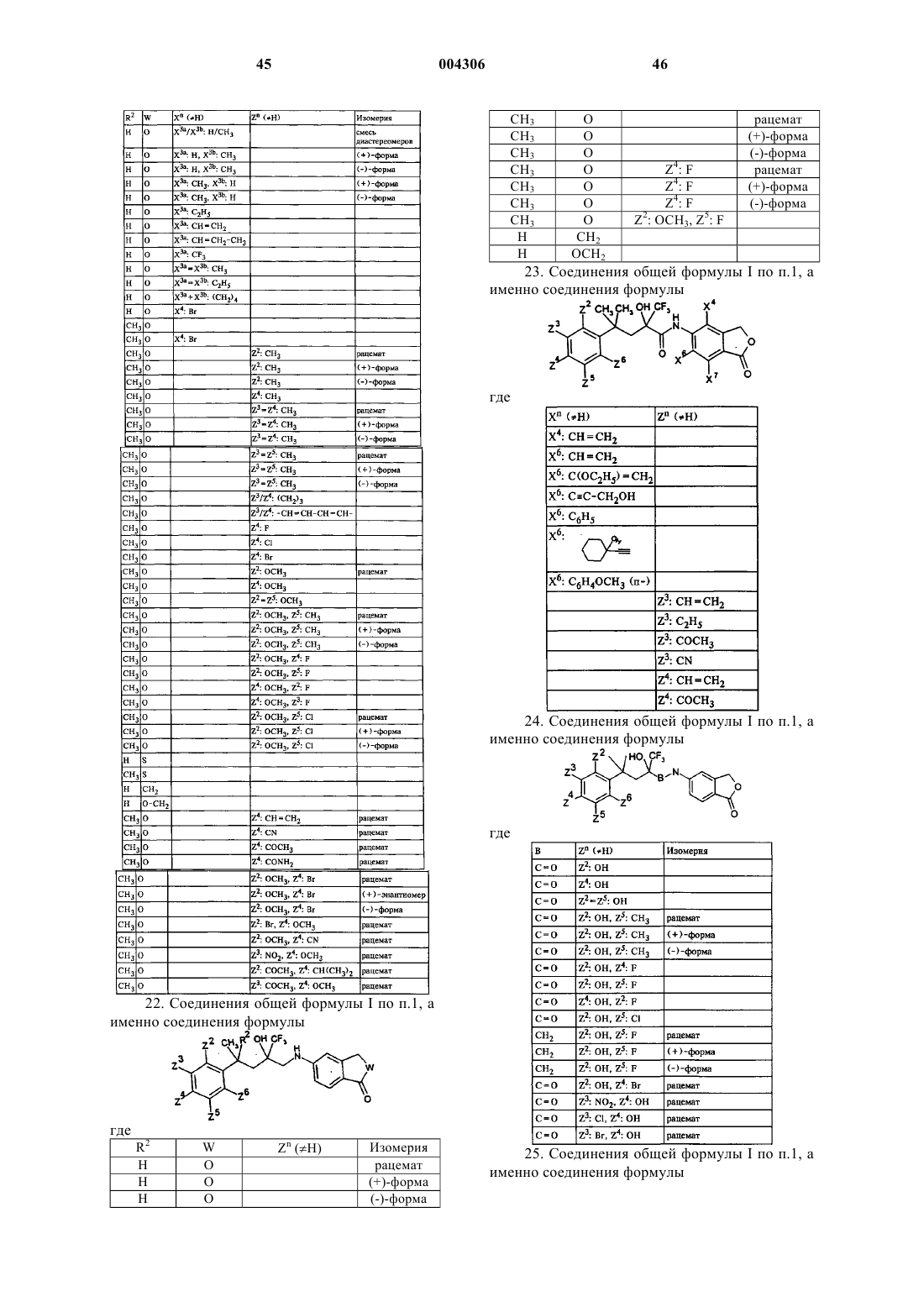
Ar обозначает кольцевую систему, выбранную из следующей группы общих субформул 2-11
где остатки X3a, X4, X6, X7 (в субформуле 2), X4, X6, X7 (в субформулах 3 и 4), X3a, X3b, X4, X6, X7 (в субформулах 5, 6 и 7) или Y4, Y5, Y7, Y8 (в субформулах 8, 9, 10 и 11) являются одинаковыми или различными и выбраны из атомов водорода, C1-C5алкильных групп, которые дополнительно также могут содержать гидроксигруппу, необязательно этерифицированную C1-C5алкильной группой до простого эфира или C1-C5алканоильной группой до сложного эфира, частично либо полностью фторированных C1-C5алкильных групп, C2-C5алкенильных групп -CR5=CR6R7, где R5, R6 и R7 имеют вышеуказанные значения, алкинильных групп -Cу CR5, где R5 имеет вышеуказанные значения,
остатки X3a и X3b далее вместе с C-атомом сконденсированной с бензольным ядром кольцевой системы 5, 6 или 7 могут образовывать кольцо, имеющее в общей сложности 3-7 членов, и, кроме того, значения остатков X4, X6, X7 (в субформулах 2, 3, 4, 5, 6 и 7) или Y4, Y5, Y7, Y8 (в субформулах 8, 9, 10 и 11) выбраны из атомов галогена, гидроксигрупп, C1-C5алкоксигрупп или C1-C5алканоильных групп,
а также в случае, когда B означает CH2-группу, физиологически приемлемые соли соединений общей формулы I с кислотами.
2. Соединения общей формулы I по п.1 в форме рацемата или смеси диастереомеров.
3. Соединения общей формулы I по п.1 в форме разделенных оптических изомеров.
4. Соединения общей формулы I по п.1, отличающиеся тем, что R1 и R2 являются одинаковыми или различными и обозначают атом водорода, метильную либо этильную группу или же вместе с C-атомом цепи образуют циклопропильное кольцо.
5. Соединения общей формулы I по п.1, отличающиеся тем, что R3 обозначает C1-C5перфторалкильную группу.
6. Соединения общей формулы I по п.1, отличающиеся тем, что A представляет собой бензольное, нафталиновое либо тиофеновое кольцо, которое необязательно замещено одним или несколькими остатками, выбранными из атомов фтора, атомов хлора, атомов брома, метильных групп, этильных групп, виниловых групп, гидроксигрупп, метоксигрупп и этоксигрупп.
7. Соединения общей формулы I по п.1, отличающиеся тем, что X3a обозначает атом водорода или C1-C5алкильную группу.
8. Соединения общей формулы I по п.1, отличающиеся тем, что X3a и X3b являются одинаковыми или различными и обозначают атом водорода или C1-C5алкильную группу.
9. Соединения общей формулы I по п.1, отличающиеся тем, что X4, X6 и X7 являются одинаковыми или различными и независимо друг от друга обозначают атом водорода или атом галогена.
10. Соединения общей формулы I по п.1, отличающиеся тем, что Y4 обозначает C1-C5алкильную группу или C1-C5перфторалкильную группу.
11. Соединения общей формулы I по п.1, отличающиеся тем, что Y5, Y7 и Y8 являются одинаковыми или различными и независимо друг от друга обозначают атом водорода или атом галогена.
12. Соединения общей формулы I по п.1, отличающиеся тем, что R1 и R2 являются одинаковыми или различными и обозначают атом водорода, метильную либо этильную группу или же вместе с C-атомом цепи образуют циклопропильное кольцо, R3 обозначает C1-C5перфторалкильную группу, A представляет собой бензольное, нафталиновое либо тиофеновое кольцо, которое необязательно замещено одним или несколькими остатками, выбранными из атомов фтора, атомов хлора, атомов брома, метильных групп, этильных групп, виниловых групп, гидроксигрупп, метоксигрупп и этоксигрупп, и либо X3a обозначает атом водорода или C1-C5алкильную группу, либо X3a и X3b являются одинаковыми или различными и обозначают атом водорода или C1-C5алкильную группу и X4, X6 и X7 являются одинаковыми или различными и независимо друг от друга обозначают атом водорода или атом галогена или Y4 обозначает C1-C5алкильную группу или C1-C5перфторалкильную группу и Y5, Y7 и Y8 являются одинаковыми или различными и независимо друг от друга обозначают атом водорода или атом галогена, а другие заместители имеют все указанные для формулы I значения.
13. Соединения общей формулы I по п.1, где Ar представляет собой кольцевую систему субформулы 6.
14. Соединения общей формулы I по п.1, где Ar представляет собой кольцевую систему субформулы 7.
15. Соединения общей формулы I по п.1, где Ar представляет собой кольцевую систему субформулы 10.
16. Соединения общей формулы I по п.1, где Ar представляет собой кольцевую систему субформулы 11.
17. Соединения общей формулы I по п.1, а именно
4-бром-5-(2-гидрокси-4-метил-4-фенил-2-трифторметилвалероиламино)фталид,
6-бром-5-(2-гидрокси-4-метил-4-фенил-2-трифторметилвалероиламино)фталид,
5-(2-гидрокси-4-метил-2-пентафторэтил-4-фенилвалероиламино)фталид,
5-[2-гидрокси-4-(3-метоксифенил)-4-метил-2-трифторметилвалероиламино]фталид,
5-[2-гидрокси-4-(4-метоксифенил)-4-метил-2-трифторметилвалероиламино]фталид,
5-[2-гидрокси-4-(2-гидроксифенил)-4-метил-2-трифторметилвалероиламино]фталид,
5-[4-(2-фторфенил)-2-гидрокси-4-метил-2-трифторметилвалероиламино]фталид,
5-[4-(4-фторфенил)-2-гидрокси-4-метил-2-трифторметилвалероиламино]фталид,
5-[4-(4-хлорфенил)-2-гидрокси-4-метил-2-трифторметилвалероиламино]фталид,
5-[4-(4-бромфенил)-2-гидрокси-4-метил-2-трифторметилвалероиламино]фталид,
5-[2-гидрокси-4-метил-4-(4-толил)-2-трифторметилвалероиламино]фталид,
5-[2-гидрокси-4-метил-4-(3-толил)-2-трифторметилвалероиламино]фталид,
5-[4-(4-цианфенил)-2-гидрокси-4-метил-2-трифторметилвалероиламино]фталид,
5-[4-(3,4-диметилфенил)-2-гидрокси-4-метил-2-трифторметилвалероиламино]фталид,
5-[4-(3,5-диметилфенил)-2-гидрокси-4-метил-2-трифторметилвалероиламино]фталид,
5-[2-гидрокси-4-(2-метокси-5-метилфенил)-4-метил-2-трифторметилвалероиламино]фталид,
5-[4-(5-хлор-2-гидроксифенил)-2-гидрокси-4-метил-2-трифторметилвалероиламино]фталид,
5-[4-(5-фтор-2-гидроксифенил)-2-гидрокси-4-метил-2-трифторметилвалероиламино]фталид,
5-[2-гидрокси-4-(2-гидрокси-5-метилфенил)-4-метил-2-трифторметилвалероиламино]фталид,
5-[4-(5-фтор-2-метоксифенил)-2-гидрокси-4-метил-2-трифторметилвалероиламино]фталид,
5-[4-(2-фтор-4-метоксифенил)-2-гидрокси-4-метил-2-трифторметилвалероиламино]фталид,
5-[4-(3-фтор-4-метоксифенил)-2-гидрокси-4-метил-2-трифторметилвалероиламино]фталид,
5-(2-гидрокси-4-фенил-2-трифторметилвалероиламино)фталид,
5-[2-гидрокси-4-(2-метоксифенил)-4-метил-2-трифторметилвалероиламино]фталид,
5-[4-(5-хлор-2-метоксифенил)-2-гидрокси-4-метил-2-трифторметилвалероиламино]фталид,
5-(2-гидрокси-4-фенил-2-трифторметилпентиламино)фталид,
5-(2-гидрокси-4-метил-4-фенил-2-трифторметилпентиламино)фталид,
5-[4-(4-фторфенил)-2-гидрокси-4-метил-2-трифторметилпентиламино]фталид,
5-[4-(5-фтор-2-гидроксифенил)-2-гидрокси-4-метил-2-трифторметилпентиламино]фталид,
6-ацетил-5-(2-гидрокси-4-метил-4-фенил-2-трифторметилвалероиламино)фталид,
5-[4-(3-фтор-4-гидроксифенил)-2-гидрокси-4-метил-2-трифторметилвалероиламино]фталид,
5-[4-(3-фторфенил)-2-гидрокси-4-метил-2-трифторметилвалероиламино]фталид,
6-(3-гидрокси-3-метил-1-бутинил)-5-(2-гидрокси-4-метил-4-фенил-2-трифторметилвалероиламино)фталид,
6-(2-гидрокси-4-метил-4-фенил-2-трифторметилвалероиламино)-4-метил-2,3-бензоксазин-1-он,
6-(2-гидрокси-4-метил-4-фенил-2-трифторметилвалероиламино)-4-трифторметил-2,3-бензоксазин-1-он,
4-этил-6-(2-гидрокси-4-фенил-2-трифторметилпентиламино)-2,3-бензоксазин-1-он,
4-этил-6-[2-гидрокси-4-(2-метоксифенил)-4-метил-2-трифторметилвалероиламино]-2,3-бензоксазин-1-он,
6-[2-гидрокси-4-(2-метоксифенил)-4-метил-2-трифторметилвалероиламино]-4-метил-2,3-бензоксазин-1-он,
4-этил-6-[2-гидрокси-4-метил-4-(4-метилфенил)-2-трифторметилвалероиламино]-2,3-бензоксазин-1-он,
6-[4-(4-бромфенил)-2-гидрокси-4-метил-2-трифторметилвалероиламино]-4-этил-2,3-бензоксазин-1-он,
4-этил-6-[4-(5-фтор-2-метоксифенил)-2-гидрокси-4-метил-2-трифторметилвалероиламино]-2,3-бензоксазин-1-он,
6-[4-(5-фтор-2-метоксифенил)-2-гидрокси-4-метил-2-трифторметилвалероиламино]-4-метил-2,3-бензоксазин-1-он,
1-(4-нитро-3-трифторметиланилино)-4-фенил-2-трифторметил-2-пентанол,
5-(2-гидрокси-4,4-диметил-2-трифторметил-5-гексеноиламино)фталид,
5-[2-гидрокси-3-(1-фенилциклопропил)-2-трифторметилпропиониламино]фталид,
5-[2-гидрокси-3-(1-фенилциклобутил)-2-трифторметилпропиониламино]фталид,
5-[2-гидрокси-3-(1-фенилциклогексил)-2-трифторметилпропиониламино]фталид,
6-(2-гидрокси-2,4-диметил-4-фенилвалероиламино)-4-метил-2,3-бензоксазин-1-он,
5-[4-(3-хлор-4-метоксифенил)-2-гидрокси-4-метил-2-трифторметилвалероиламино]фталид.
18. Соединения общей формулы I по п.1, а именно соединения формулы
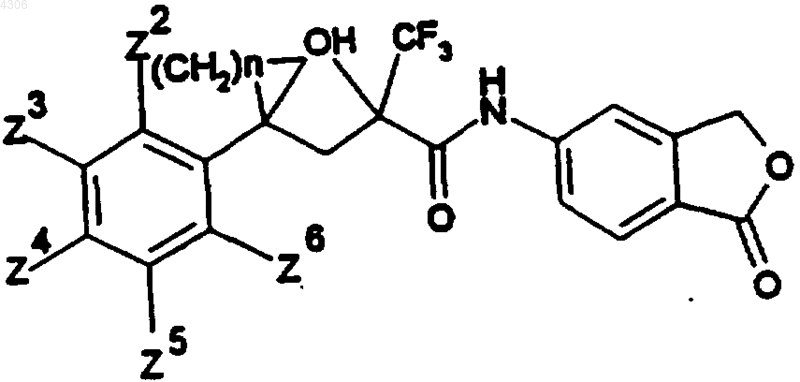
где
| N | Zn (ь H) | Изомерия |
| 1 | рацемат | |
| 1 | (+)-энантиомер | |
| 1 | (-)-энантиомер | |
| 1 | 3-F | рацемат |
| 1 | 2-Cl | рацемат |
| 1 | 4-Cl | рацемат |
| 1 | 4-Cl | (+)-энантиомер |
| 1 | 4-Cl | (-)-энантиомер |
| 1 | 2-Br | рацемат |
| 1 | 3-Br | рацемат |
| 1 | 2,4-Cl2 | рацемат |
| 1 | 2-OCH3 | (+)-энантиомер |
| 1 | 2-OCH3 | (-)-энантиомер |
| 1 | 3-OCH3 | рацемат |
| 1 | 3-CF3 | рацемат |
| 2 | рацемат | |
| 2 | (+)-энантиомер | |
| 2 | (-)-энантиомер | |
| 3 | (+)-энантиомер | |
| 3 | 4-CH3 | рацемат |
| 4 | рацемат | |
| 4 | (+)-энантиомер | |
| 4 | (-)-энантиомер |
19. Соединения общей формулы I по п.1, а именно соединения формулы
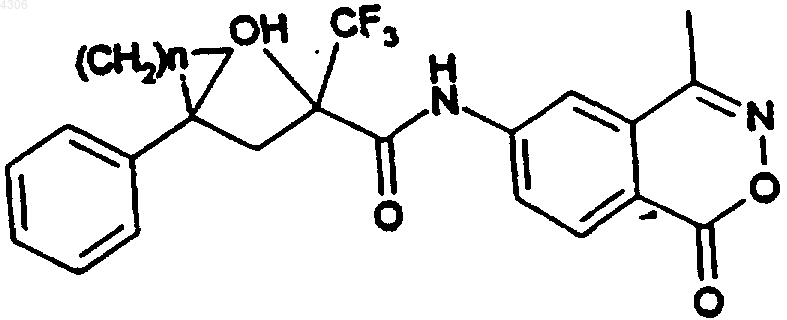
где
| N | Изомерия |
| 1 | рацемат |
| 1 | (+)-энантиомер |
| (+)-энантиомер | |
| 2 | рацемат |
| 4 | рацемат |
| 4 | (+)-энантиомер |
| 4 | (+)-энантиомер |
20. Соединения общей формулы I по п.1, а именно соединения формулы
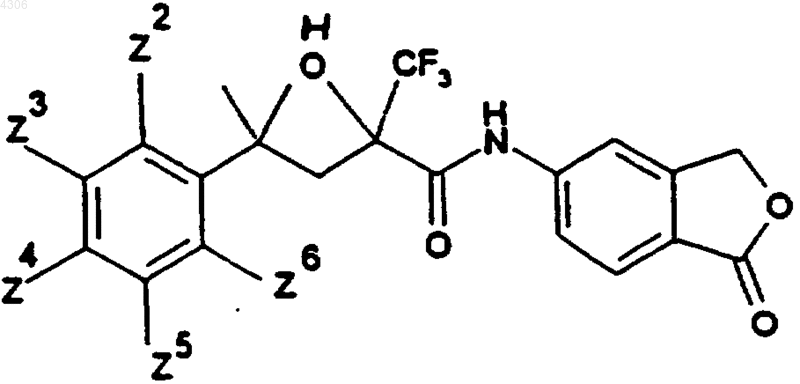
где
| Zn (ь H) | |
| Z2: | I |
| Z3: | Cl |
| Z3: | Br |
| Z3: | I |
21. Соединения общей формулы I по п.1, а именно соединения формулы
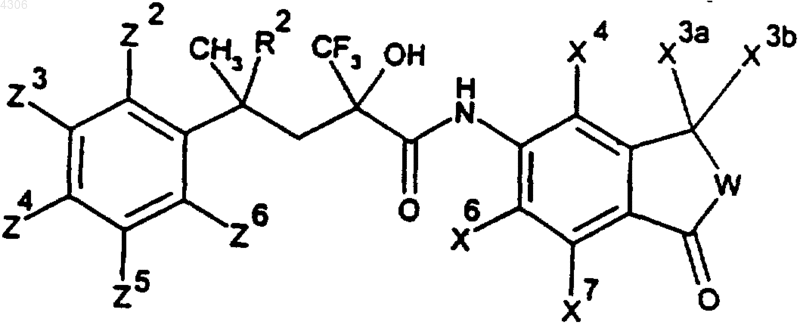
где
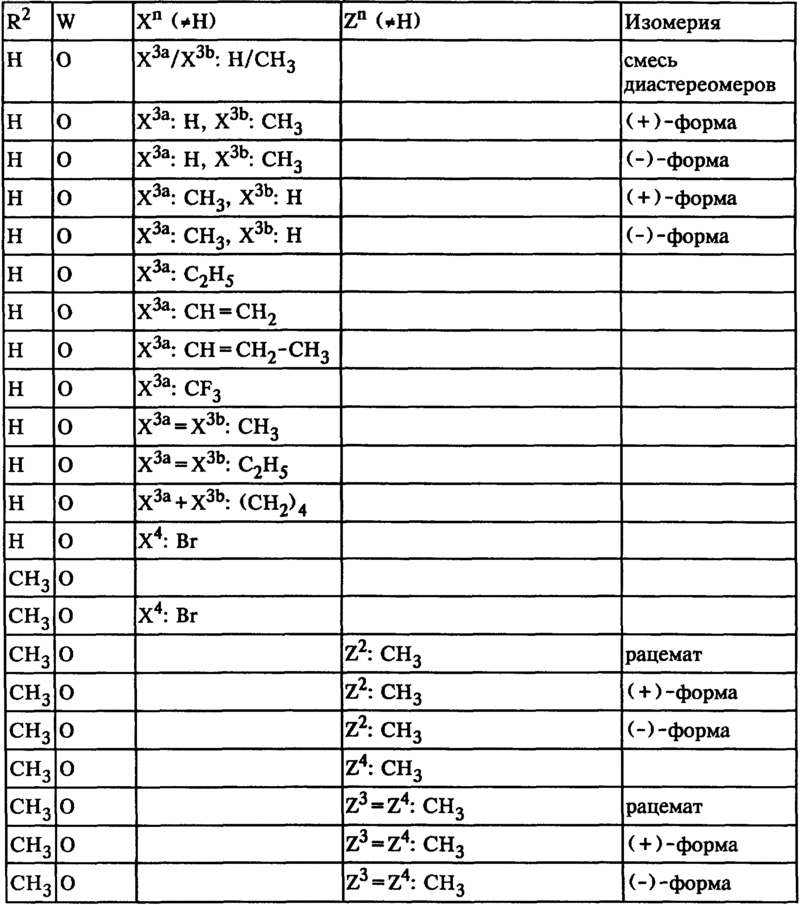
22. Соединения общей формулы I по п.1, а именно соединения формулы
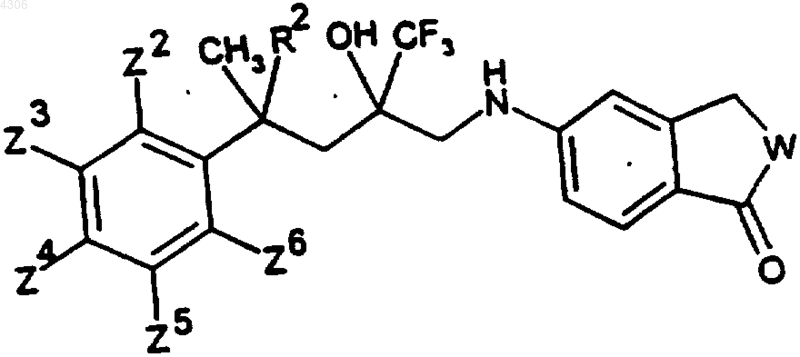
где
| R2 | W | Zn (ь H) | Изомерия |
| H | O | рацемат | |
| H | O | (+)-форма | |
| H | O | (-)-форма | |
| CH3 | O | рацемат | |
| CH3 | O | (+)-форма | |
| CH3 | O | (-)-форма | |
| CH3 | O | Z4: F | рацемат |
| CH3 | O | Z4: F | (+)-форма |
| CH3 | O | Z4: F | (-)-форма |
| CH3 | O | Z2: OCH3, Z5: F | |
| H | CH2 | ||
| H | OCH2 |
23. Соединения общей формулы I по п.1, а именно соединения формулы
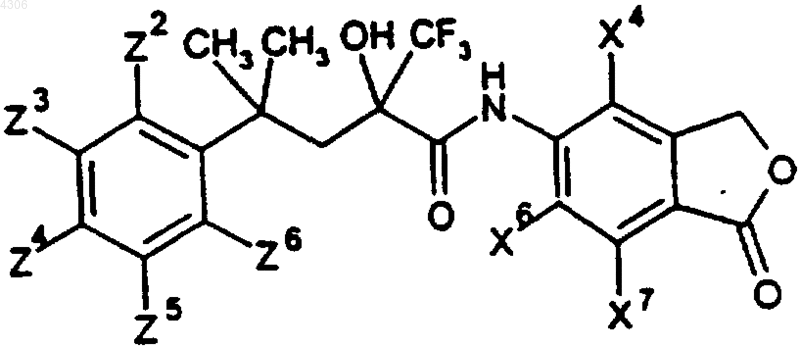
где
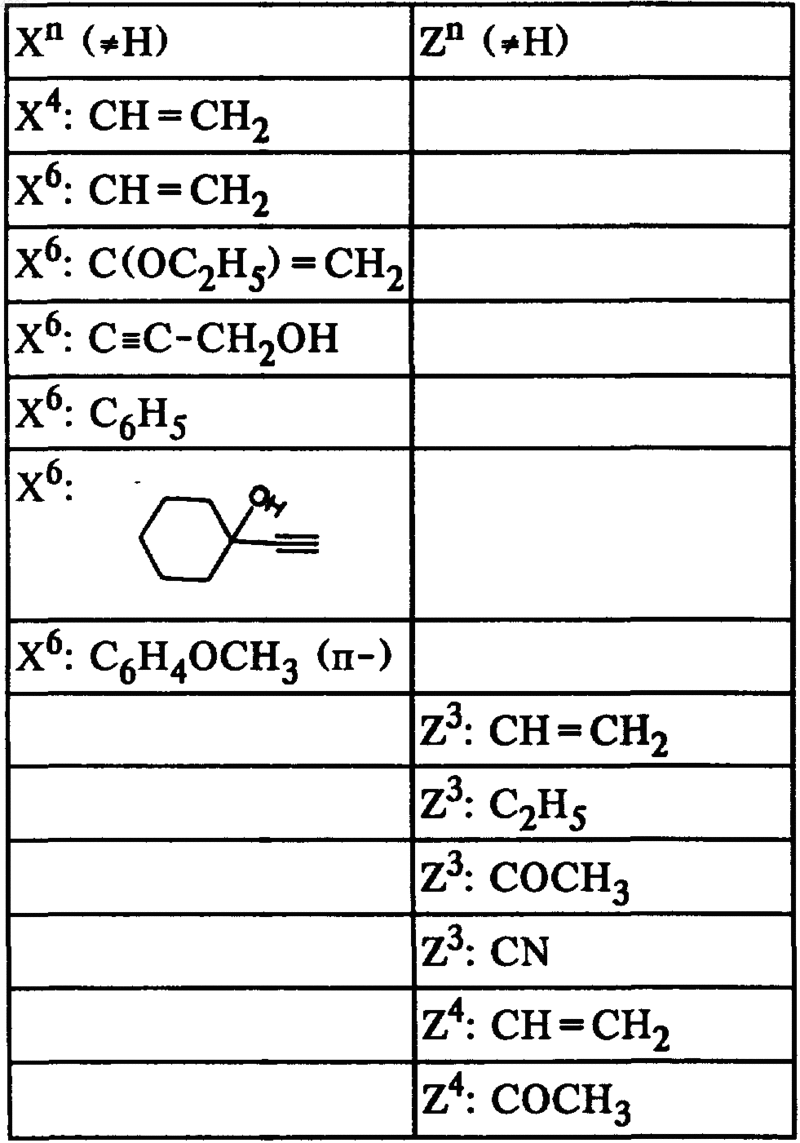
24. Соединения общей формулы I по п.1, а именно соединения формулы
где

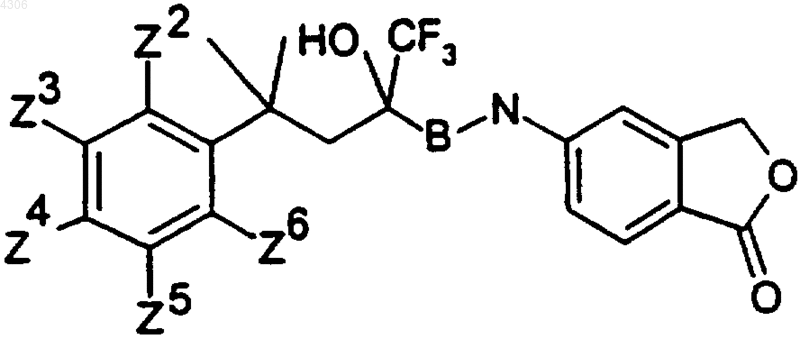
25. Соединения общей формулы I по п.1, а именно соединения формулы
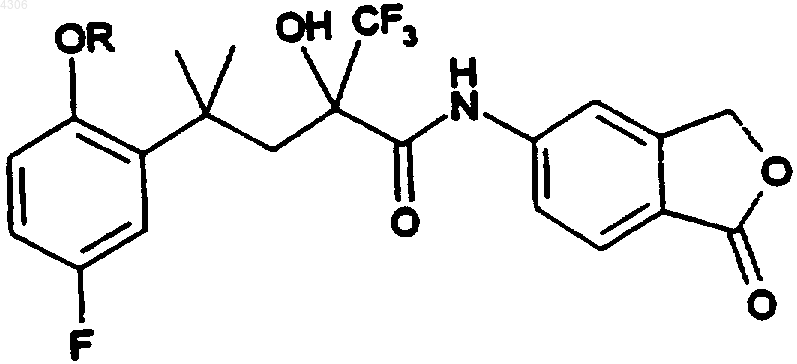
где
| R | Изомерия |
| CH(CH3)2 | рацемат |
| CH2CH=CH2 | рацемат |
| CH2CHу CH2 | рацемат |
| CH2CN | рацемат |
| CH2COOC(CH3)3 | рацемат |
| CH2COOC(CH3)3 | (-)-форма |
| CH2COOC(CH3)3 | (+)-форма |
26. Соединения общей формулы I по п.1, а именно соединения формулы
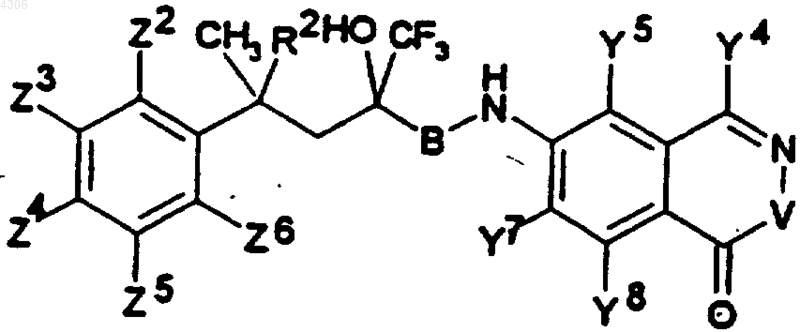
где
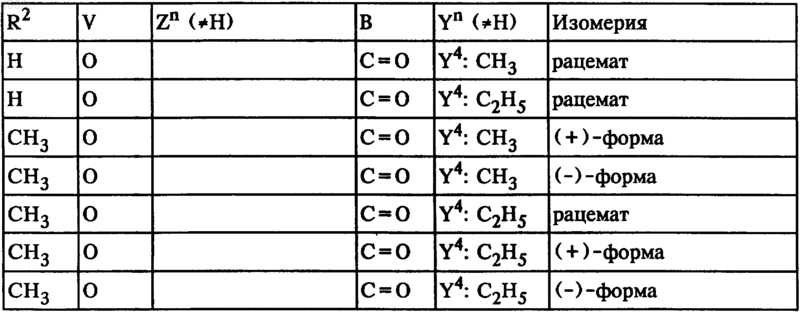
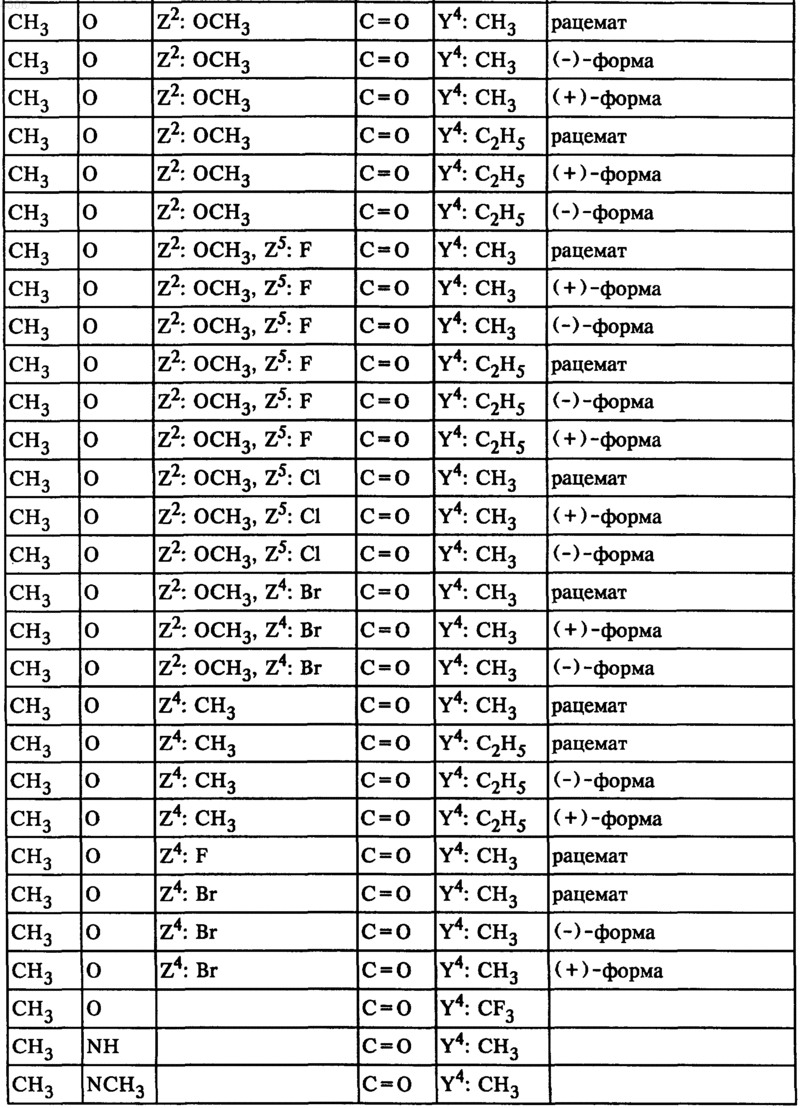
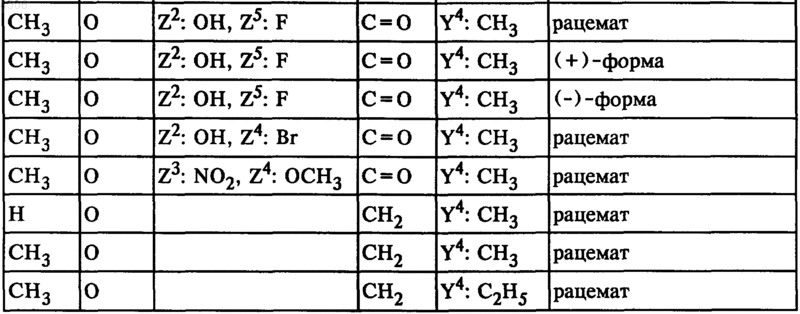
27. Фармацевтические препараты, содержащие по меньшей мере одно соединение общей формулы I по п.1, а также фармацевтически приемлемый носитель.
28. Применение соединений общей формулы I по п.1 для изготовления фармацевтических препаратов.
29. Способ получения соединений общей формулы I
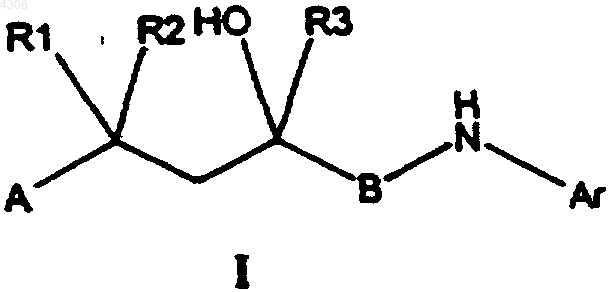
где A, B, Ar, R1, R2, а также R3 имеют указанные в п.1 значения, отличающийся тем, что карбонильное соединение общей формулы II
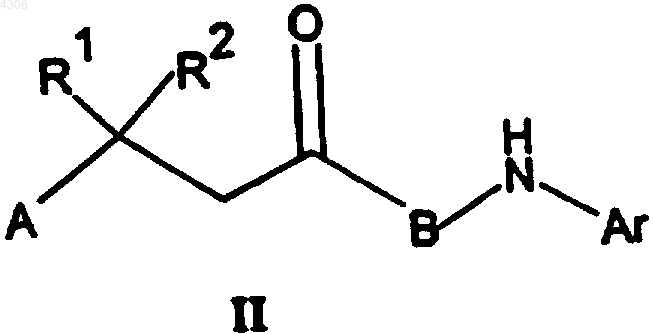
где A, B, Ar, R1 и R2 имеют указанные для формулы I значения, подвергают взаимодействию с соединением общей формулы R3-SiMe3, где R3 имеет указанные для общей формулы I значения, в присутствии катализатора или с алкилметаллическим соединением, например, реагентом Гриньяра или литийалкилом, с получением соединения общей формулы I.
30. Способ по п.29, отличающийся тем, что катализатором служит фторидная соль или карбонат щелочного металла.
31. Способ получения соединений общей формулы I
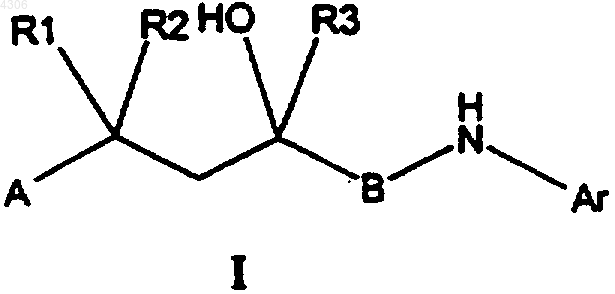
где A, B, Ar, R1, R2, а также R3 имеют указанные в п.1 значения, отличающийся тем, что соединение общей формулы III
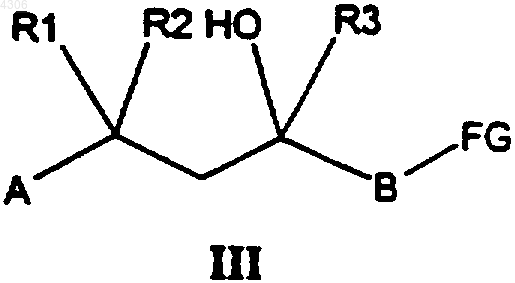
где A, B, R1, R2 и R3 имеют указанные для общей формулы I значения, a FG означает уходящую группу, подвергают взаимодействию с соединением формулы Ar-NH-R11, где R11 обозначает атом водорода или C1-C5алканоильную группу, а Ar имеет указанные для общей формулы I значения, и затем при необходимости отщепляют остаток R11.
32. Способ по п.31, отличающийся тем, что уходящая группа FG в соединении общей формулы III представляет собой атом хлора, брома либо иода, тозилатный либо мезилатный остаток или C1-C4перфторалкилсульфонилоксиостаток.
Текст
Настоящее изобретение относится к нестероидным соединениям, обладающим высокой гестагенной активностью. Наряду с большим числом стероидных соединений с гестагенным действием известны также гестагены, не являющиеся стероидамиJ. Med. Chem. 38 (1995), 4878). В частности, настоящее изобретение относится к соединениям общей формулы IR1 и R2 являются одинаковыми или различными и обозначают атом водорода, С 1 С 5 алкильную группу или атом галогена, а также вместе с С-атомом цепи образуют кольцо,имеющее в общей сложности 3-7 членов,R3 обозначает С 1-С 5 алкильную группу или частично либо полностью фторированную С 1 С 5 алкильную группу,А обозначает моно- либо бициклическое карбоциклическое или гетероциклическое ароматическое кольцо, которое необязательно замещено одним или несколькими остатками, выбранными из атомов галогена, С 1-С 5 алкильных групп, С 2-С 5 алкенильных групп -CR5=CR6R7,где R5, R6 и R7 являются одинаковыми или различными и независимо друг от друга обозначают атомы водорода или С 1-С 5 алкильные группы, гидроксигрупп, гидроксигрупп, которые несут С 1-С 10 ацильную группу, С 3-С 10 карбалкоксиалкильную группу, С 2-С 5 цианалкильную группу, незамещенную либо замещенную С 3 С 10 аллильную группу, незамещенную либо замещенную С 3-С 10 пропаргильную группу, С 2 С 5 алкоксиалкильную группу, частично либо полностью замещенную атомами фтора С 1 С 5 алкильную группу, а также выбранными из циано- либо нитрогруппы, С 1-С 5 алкоксигрупп,С 1-С 5 алкилтиогрупп, моно- либо дизамещенных С 1-С 10 аминогрупп или частично либо полностью фторированных С 1-С 5 алкильных групп,В обозначает карбонильную или СН 2 группу,Аr обозначает кольцевую систему, выбранную из следующей группы общих субформул 2-11(в субформулах 5, 6 и 7) или Y4, Y5, Y7, Y8 (в субформулах 8, 9, 10 и 11) являются одинаковыми или различными и выбраны из атомов водорода, С 1-С 5 алкильных групп, которые дополнительно могут содержать еще и гидроксигруппу, необязательно этерифицированную С 1 С 5 алкильной группой до простого эфира или С 1 С 5 алканоильной группой до сложного эфира,частично либо полностью фторированных С 1 С 5 алкильных групп, С 2-С 5 алкенильных группR5 имеет вышеуказанные значения, остатки X3a и Х 3b далее вместе с С-атомом сконденсированной с бензольным ядром кольцевой системы 5, 6 или 7 могут образовывать кольцо, имеющее в общей сложности 3-7 членов, и, кроме того,значения остатков X4, X6, X7 (в субформулах 2,3, 4, 5, 6 и 7) или Y4, Y5, Y7, Y8 (в субформулах 8, 9, 10 и 11) выбраны из атомов галогена, гидроксигрупп,С 1-С 5 алкоксигрупп или С 1 С 5 алканоильных групп, а также в случае, когда В означает СН 2-группу, физиологически приемлемые соли соединений общей формулы I с кислотами. Соединения по изобретению отличаются от известных нестероидных соединений с гестагенным действием образцом замещения по арильному остатку, расположенному справа в общей формуле I. В представленных в этом случае соединениях Ar обозначает сконденсированную с бензольным ядром бициклическую кольцевую систему, тогда как в структурах ациланилидных соединений, представленных в заявке ЕР 0253500 В 1 и рассматриваемых как относящиеся к ближайшему уровню техники, в указанном положении находится одно-, дву 3 либо трехкратно замещенный фенильный остаток. Описанные в ЕР 02523503 А 2, ЕР 0002892 и ЕР 0040932 ациламидные соединения все обладают антиандрогенной активностью, а в ЕР 0253503 А 2 предпочтительно дополнительно гистогенной активностью. Ациланилиды, описанные в ЕР 0173516 А 2, которые не имеют ОНгрупп и сравнимые с R3 заместители, имеют совершенно другую активность (антагонисты лейкотриена). Предлагаемые в изобретении соединения общей формулы I благодаря наличию асимметрических центров могут быть представлены в форме различных стереоизомеров. Как рацематы, так и представленные особо стереоизомеры являются объектом настоящего изобретения. Заместители в соединениях общей формулы I, указанные в виде групп, могут иметь соответственно следующие значения. С 1-С 5 алкильные группы могут представлять собой преимущественно метильную,этильную, н-пропильную, изопропильную, н-,изо-, трет-бутильную группу или н-пентильную,2,2-диметилпропильную либо 3-метилбутильную группу. Предпочтительны из них метильная или этильная группа. Атом галогена может представлять собой атом фтора, хлора, брома либо иода. Предпочтительными в данном случае являются фтор,хлор или бром. В случае, когда R1 и R2 вместе с С-атомом цепи образуют 3-7-членное кольцо, предпочтительно таковым является, например, циклопропильное,-бутильное,-пентильное либо-гексильное кольцо. Предпочтительно из них циклопропильное кольцо. В качестве частично либо полностью фторированной С 1-С 5 алкильной группы могут рассматриваться указанные выше перфторированные алкильные группы, а из них, в свою очередь, прежде всего трифторметильная либо пентафторэтильная группа; в качестве же частично фторированных алкильных групп приемлемы,например, 5,5,5,4,4-пентафторпентильная либо 5,5,5,4,4,3,3-гептафторпентильная группа. С 2-С 5 алкенильная группа может представлять собой, например, винильную, аллильную или 2,3-диметил-2-пропенильную группу; в том случае, когда ароматический радикал А замещен алкенильной группой, предпочтительной является винильная группа. С 2-С 5 карбалкоксиалкильная группа может представлять собой, например, карбоксиметильную, трет-бутоксиметильную либо этоксиметильную группу; предпочтительны из них две названных первыми. В качестве представителей С 2-С 5 цианалкильной группы можно назвать цианметил, а также 1- и 2-цианэтил; предпочтителен из них цианметил. 4 С 3-С 10 аллильная группа представляет собой предпочтительно незамещенную аллильную группу; в случае же замещенной аллильной группы можно назвать в качестве примеров 1 метилаллил, 1,1-диметилаллил, 2-метилаллил, 3 метилаллил, 2,3-диметилаллил, 3,3-диметилаллил, циннамил и 3-циклогексилаллил. В качестве представителей С 3-С 10 пропаргильной группы можно назвать среди прочих незамещенную пропаргильную, метилпропаргильную, 3-метилпропаргильную, 3-фенилпропаргильную или 3-циклогексилпропаргильную группу; предпочтительной является незамещенная пропаргильная группа. С 2-С 5 алкоксиалкил может представлять собой, например, метоксиметил, этоксиметил или 2-метоксиэтил. Представители С 1-С 5 алкоксигруппы выбраны из таких групп, как метокси, этокси, нпропокси, изопропокси, н-, изо-, трет-бутокси или н-пентокси, 2,2-диметилпропокси либо 3 метилбутокси. Предпочтительны из них метокси- или этоксигруппа. С 1-С 5 перфторалкоксигруппы представляют собой соответствующие перфторированные остатки вышеуказанных С 1-С 5 алкоксигрупп. Моно- или бициклическое ароматическое кольцо А, которое может быть замещенным,представляет собой карбоциклический либо гетероциклический арильный остаток. В первом случае речь идет, например, о фенильном или нафтильном остатке, предпочтительно о фенильном остатке. В качестве же гетероциклического остатка может рассматриваться, например, моноциклический гетероциклический остаток, в частности тиенил, фурил, пиранил, пирролил, имидазолил, пиразолил, пиридил, пиразинил, пиримидинил, пиридазинил, тиазолил,оксазолил, фуразанил, пирролинил, имидазолинил, пиразолинил, тиазолинил, триазолил, тетразолил, а именно, все возможные изомеры касательно положения гетероатомов. Предпочтительным в качестве гетероарильного остатка А является тиенильный остаток. В качестве С 1-С 5 алкильной группы, служащей для этерификации гидроксигрупп до простого эфира, могут рассматриваться названные выше алкильные группы, в первую очередь,метильная либо этильная группа. В качестве С 1-С 5 алканоильной группы,служащей для этерификации гидроксигрупп до сложного эфира, могут рассматриваться формильная, ацетильная, пропионильная, бутирильная, изобутирильная, валерильная либо изовалерильная или пивалоильная группа; предпочтительна из них ацетильная группа. В качестве С 1-С 10 ацильной группы, служащей для этерификации гидроксигрупп до сложного эфира, можно назвать, например, вышеуказанные алканоильные группы, предпочтительно, в свою очередь, ацетильную группу, или бензоильную, толуоильную, фенилацетильную, 5 акрилоильную, циннамоильную или циклогексилкарбонильную группу. В случае, когда Х 3a и X3b вместе с Сатомом сконденсированной с бензольным ядром кольцевой системы образуют 3-7-членное кольцо, последнее представляет собой, например,циклопропильное, -бутильное, -пентильное либо-гексильное кольцо. Предпочтительно из них циклопропильное кольцо. В качестве С 1-С 5 алканоилоксигруппы дляX4, X6, X7, Y4, Y5, Y7 или Y8 может рассматриваться формилокси-, ацетокси-, пропионилокси-, бутирилокси-, изобутирилокси-, валерилокси- или изовалерилоксигруппа; предпочтительна из них ацетоксигруппа. С 1-С 5 алкил в С 1-С 5 алкилтио-, С 1-С 5 алкилсульфинильной или С 1-С 5 алкилсульфонильной группе может включать указанные выше С 1 С 5 алкильные группы. В случае, когда соединения общей формулы I (В обозначает -СН 2-) представлены в виде солей, эти соли могут быть образованы в форме гидрохлорида, сульфата, нитрата, тартрата или бензоата. Если соединения по изобретению представлены в виде рацемических смесей, то специалист в данной области техники с помощью известных ему методов разделения рацематов может разделять их, получая в результате чистые, оптически активные формы. Так, например,рацемические смеси можно разделять посредством хроматографии на являющемся уже самим по себе активном носителе (CHIRALPAK AD) на чистые изомеры. Возможен и другой вариант, а именно: свободную гидроксигруппу в рацемическом соединении общей формулы I этерифицировать оптически активной кислотой до сложных эфиров и полученные диастереомерные эфиры разделять путем фракционной кристаллизации либо посредством хроматографии и разделенные эфиры омылять соответственно с получением в результате оптически чистых изомеров. В качестве оптически активной кислоты может использоваться, например,миндальная кислота, камфорсульфоновая кислота или винная кислота. Предпочтительными согласно настоящему изобретению являются такие соединения общей формулы I, в которых R1 и R2 являются одинаковыми или различными и обозначают атом водорода, метильную либо этильную группу или же вместе с С-атомом цепи образуют циклопропильное кольцо и/или R3 обозначает С 1 С 5 перфторалкильную группу и/или А представляет собой бензольное, нафталиновое либо тиофеновое кольцо, которое необязательно замещено одним или несколькими остатками, выбранными из атомов фтора, атомов хлора, атомов брома, метильных групп,этильных групп, виниловых групп, гидроксигрупп, метоксигрупп и этоксигрупп, и/или либо 6 Х 3 а обозначает атом водорода или С 1 С 5 алкильную группу, либоX3a и X3b являются одинаковыми или различными и обозначают атом водорода или С 1 С 5 алкильную группу и/или Х 4, Х 6 и Х 7 являются одинаковыми или различными и независимо друг от друга обозначают атом водорода или атом галогена и/или Y4 обозначает С 1-С 5 алкильную группу или С 1-С 5 перфторалкильную группу и/илиY5, Y7 и Y8 являются одинаковыми или различными и независимо друг от друга обозначают атом водорода или атом галогена, а другие заместители имеют все указанные для формулыI значения. Кроме того, предпочтительны те соединения общей формулы I, в которых Аr представляет собой кольцевую систему субформул 6, 7, 10 или 11. Особо предпочтительными согласно изобретению являются следующие конкретные соединения: 4-бром-5-(2-гидрокси-4-метил-4-фенил-2 трифторметилвалероиламино)фталид,6-бром-5-(2-гидрокси-4-метил-4-фенил-2 трифторметилвалероиламино)фталид,5-(2-гидрокси-4-метил-2-пентафторэтил-4 фенилвалероиламино)фталид,5-[2-гидрокси-4-(3-метоксифенил)-4 метил-2-трифторметилвалероиламино]фталид,5-[2-гидрокси-4-(4-метоксифенил)-4 метил-2-трифторметилвалероиламино]фталид,5-[2-гидрокси-4-(2-гидроксифенил)-4 метил-2-трифторметилвалероиламино]фталид,5-[4-(2-фторфенил)-2-гидрокси-4-метил-2 трифторметилвалероиламино]фталид,5-[4-(4-фторфенил)-2-гидрокси-4-метил-2 трифторметилвалероиламино]фталид,5-[4-(4-хлорфенил)-2-гидрокси-4-метил-2 трифторметилвалероиламино]фталид,5-[4-(4-бромфенил)-2-гидрокси-4-метил-2 трифторметилвалероиламино]фталид,5-[2-гидрокси-4-метил-4-(4-толил)-2 трифторметилвалероиламино]фталид,5-[2-гидрокси-4-метил-4-(3-толил)-2 трифторметилвалероиламино]фталид,5-[4-(4-цианфенил)-2-гидрокси-4-метил-2 трифторметилвалероиламино]фталид,5-[4-(3,4-диметилфенил)-2-гидрокси-4 метил-2-трифторметилвалероиламино]фталид,5-[4-(3,5-диметилфенил)-2-гидрокси-4 метил-2-трифторметилвалероиламино]фталид,5-[2-гидрокси-4-(2-метокси-5-метилфенил)-4-метил-2-трифторметилвалероиламино] фталид,5-[4-(5-хлор-2-гидроксифенил)-2-гидрокси-4-метил-2-трифторметилвалероиламино] фталид,5-[4-(5-фтор-2-гидроксифенил)-2-гидрокси-4-метил-2-трифторметилвалероиламино] фталид, 7 5-[2-гидрокси-4-(2-гидрокси-5-метилфенил)-4-метил-2-трифторметилвалероиламино] фталид,5-[4-(5-фтор-2-метоксифенил)-2-гидрокси 4-метил-2-трифторметилвалероиламино]фталид,5-[4-(2-фтор-4-метоксифенил)-2-гидрокси 4-метил-2-трифторметилвалероиламино]фталид,5-[4-(3-фтор-4-метоксифенил)-2-гидрокси 4-метил-2-трифторметилвалероиламино]фталид,5-(2-гидрокси-4-фенил-2-трифторметилвалероиламино)фталид,5-[2-гидрокси-4-(2-метоксифенил)-4 метил-2-трифторметилвалероиламино]фталид,5-[4-(5-хлор-2-метоксифенил)-2-гидрокси 4-метил-2-трифторметилвалероиламино]фталид,5-(2-гидрокси-4-фенил-2-трифторметилпентиламино)фталид,5-(2-гидрокси-4-метил-4-фенил-2-трифторметилпентиламино)фталид,5-[4-(4-фторфенил)-2-гидрокси-4-метил-2 трифторметилпентиламино]фталид,5-[4-(5-фтор-2-гидроксифенил)-2-гидрокси-4-метил-2-трифторметилпентиламино] фталид,6-ацетил-5-(2-гидрокси-4-метил-4-фенил 2-трифторметилвалероиламино)фталид,5-[4-(3-фтор-4-гидроксифенил)-2-гидрокси-4-метил-2-трифторметилвалероиламино] фталид,5-[4-(3-фторфенил)-2-гидрокси-4-метил-2 трифторметилвалероиламино]фталид,6-(3-гидрокси-3-метил-1-бутинил)-5-(2 гидрокси-4-метил-4-фенил-2-трифторметилвалероиламино)фталид,6-(2-гидрокси-4-метил-4-фенил-2-трифторметилвалероиламино)-4-метил-2,3-бензоксазин 1-он,6-(2-гидрокси-4-метил-4-фенил-2-трифторметилвалероиламино)-4-трифторметил-2,3 бензоксазин-1-он,4-этил-6-(2-гидрокси-4-фенил-2-трифторметилпентиламино)-2,3-бензоксазин-1-он,4-этил-6-[2-гидрокси-4-(2-метоксифенил)4-метил-2-трифторметилвалероиламино]-2,3 бензоксазин-1-он,6-[2-гидрокси-4-(2-метоксифенил)-4 метил-2-трифторметилвалероиламино]-4-метил 2,3-бензоксазин-1-он,4-этил-6-[2-гидрокси-4-метил-4-(4-метилфенил)-2-трифторметилвалероиламино]-2,3 бензоксазин-1-он,6-[4-(4-бромфенил)-2-гидрокси-4-метил-2 трифторметилвалероиламино]-4-этил-2,3 бензоксазин-1-он,4-этил-6-[4-(5-фтор-2-метоксифенил)-2 гидрокси-4-метил-2-трифторметилвалероиламино]-2,3-бензоксазин-1-он,6-[4-(5-фтор-2-метоксифенил)-2-гидрокси 4-метил-2-трифторметилвалероиламино]-4 метил-2,3-бензоксазин-1-он,1-(4-нитро-3-трифторметиланилино)-4 фенил-2-трифторметил-2-пентанол, 004306 8 5-(2-гидрокси-4,4-диметил-2-трифторметил-5-гексеноиламино)фталид,5-[2-гидрокси-3-(1-фенилциклопропил)-2 трифторметилпропиониламино]фталид,5-[2-гидрокси-3-(1-фенилциклобутил)-2 трифторметилпропиониламино]фталид,5-[2-гидрокси-3-(1-фенилциклогексил)-2 трифторметилпропиониламино]фталид,6-(2-гидрокси-2,4-диметил-4-фенилвалероиламино)-4-метил-2,3-бензоксазин-1-он,5-[4-(3-хлор-4-метоксифенил)-2-гидрокси 4-метил-2-трифторметилвалероиламино]фталид. К предпочтительным относятся далее соединения, представленные в табл. 7-15. Все указанные соединения особенно предпочтительны в форме оптических антиподов или разделенных диастереомеров. В тесте по связыванию с гестагенным рецептором, проводившемся на выявление гестагенной эффективности с использованием цитозола из гомогената матки кролика и 3 Нпрогестерона в качестве эталонной субстанции,новые соединения проявили высокую до очень высокой степень сродства к гестагенному рецептору (см. табл. 1). В дополнение к своей гестагенной эффективности, степень проявления которой, оставаясь во всех случаях на высоком уровне, была различной в зависимости от соответственно тестируемого соединения общей формулы I, новые соединения отличаются также более или менее ярко выраженным сродством и к андрогенному рецептору. Тест на связывание с андрогенным рецептором с целью выявить андрогенное действие проводили с использованием цитозола из гомогената простаты крысы и 3 Н-метилтриенолона в качестве эталонной субстанции. Таким образом, новые соединения по сравнению с гестагенными соединениями из заявки ЕР 0253500 В 1 представляют собой соединения совершенного иного комбинированного типа, поскольку обладают смешанным гестагенным и андрогенным действием (см. табл. 1). При этом для предлагаемых соединений общей формулы I рассматриваются все три приведенных ниже возможных случая, классифицируемые в контексте настоящего изобретения на основе конкурентных факторов по прогестеронному рецептору (KFProg) и андрогенному рецептору (КFAndro) следующим образом: 1) соединения с более выраженным гестагенным и менее выраженным андрогенным действием (KFProg1 и КFAndro5); 2) соединения с более выраженным андрогенным и менее выраженным гестагенным действием (КFAndro5 и KFProg1); 3) соединения с ярко выраженным гестагенным и ярко выраженным андрогенным действием (КFProg1 и КFAndro5). В зависимости от их классификации согласно 1), 2) или 3) новые соединения могут применяться согласно изобретению для различных медицинских или фармацевтических целей. Указанные в 1) соединения с более ярко выраженным гестагенным и менее выраженным андрогенным действием представляют собой высокоэффективные гестагены, которые подобно уже известным многочисленным гестагенным соединениям пригодны для применения с целью сохранения беременности как при их парентеральном, так и при оральном введении. В сочетании с эстрогеном из них можно изготавливать комбинированные препараты, которые могут применяться в качестве противозачаточных средств и для лечения болезненных состояний во время климакса. Благодаря их высокой гестагенной эффективности новые, указанные в 1) соединения общей формулы I могут использоваться, например, индивидуально или же в сочетании с эстрогенами в препаратах, предназначенных для контрацепции. В то же время для этих новых соединений не исключаются и все другие возможности применения, известные на сегодняшний день при использовании гестагенов (см., например, "Kontrazeption mit Hormonen", авторы Hans-Dieter Taubert и HerbertYork, 1995). Соответствующую дозировку можно определять обычным образом, выявляя, например,биоэквивалентность, в частности в тесте на сохранение беременности, в сравнении с какимлибо известным гестагеном при назначении с конкретной целью, например, в количестве, 10 биоэквивалентном 30-150 мкг левоноргестрела в случае контрацепции. Суточная дозировка указанных в 1) соединений по изобретению в контрацептивных препаратах должна составлять предпочтительно 0,01-2 мг. Гестагенные и эстрогенные активные компоненты, входящие в состав контрацептивных препаратов, предпочтительно назначать для совместного орального приема. Суточную дозу предпочтительно предусматривать для одноразового приема. В качестве эстрогенов приемлемы все природные и синтетические соединения, известные как обладающие эстрогенной эффективностью. В качестве природных эстрогенов пригодны для использования прежде всего эстрадиол, а также его сложные эфиры с пролонгированным действием, такие как валерат и ему подобные, или эстриол. Предпочтительны, однако, синтетические эстрогены, такие как этинилэстрадиол,14,17-этано-1,3,5(10)-эстратриен-3,17-диол(WO 88/01275), 14,17-этано-1,3,5(10)-эстратриен-3,16,17-триол (WO 91/08219) или 15,15-диалкильные производные эстрадиола и, в первую очередь, следует назвать из них 15,15 диметилэстрадиол (WO 95/04070). В качестве синтетического эстрогена предпочтителен этинилэстрадиол. В качестве эстрогенов для совместного использования с указанными в 1) соединениями общей формулы I приемлемы и ставшие сравнительно недавно известными эстратриен-3-амидосульфонаты (WO 96/05216 и WO 96/05217), являющиеся производными эстрадиола или этинилэстрадиола и отличающиеся низкой гапатической эстрогенностью. В завершение можно назвать еще и 14,15 метиленстероиды из ряда эстранов и прежде всего 14,15-метилен-17-эстрадиол, а также соответствующие производные 3-амидосульфоната. Эстроген рекомендуется назначать в количестве, соответствующем 0,01-0,05 мг этинилэстрадиола. Новые соединения общей формулы I, указанные в 1), могут использоваться также в препаратах, предназначенных для лечения гинекологических расстройств и для заместительной терапии. Благодаря своим положительным свойствам эти соединения согласно изобретению дают особенно хорошие результаты при лечении болезненных состояний в предменструальный период, таких как головные боли, депрессивная дисфория, задержка воды и мастодиния. Суточная доза при лечении таких предменструальных болезненных состояний составляет примерно 1-20 мг. Аналогично другим известным гестагенам новые соединения могут служить также эффективным средством для лечения эндометриоза. И, наконец, эти новые соединения могут найти применение также в качестве гестагенных компонентов в разработанных в последнее время составах для контроля женского бесплодия, 11 отличающихся тем, что в них используется дополнительно конкурентоспособный антагонист прогестерона (см. Н.В. Croxatto и А.М. Salvatierra "Female Contraception and Male FertilityKiesel, т. 2, Advances in Gynecological and Obstetric Research Series, изд-во Parthenon Publishing Group, 1991, стр. 245; заявки WO 93/17686,WO 93/21927, патент США 5521166). Дозировку следует выбирать в указанных выше пределах; состав можно приготавливать аналогично традиционным ОС-препаратам. Названный дополнительный конкурентный антагонист прогестерона можно вводить необязательно одновременно, а последовательно. Те соединения общей формулы I, которые можно отнести к указанным выше в 2) и 3), т.е.,следовательно, соединения, обладающие в любом случае сильным андрогенным действием(андрогенные гестагены), могут использоваться для изготовления фармацевтических препаратов для контроля мужской фертильности. В настоящее время по инициативе Всемирной организации здравоохранения проводятся многочисленные исследования контрацептивной эффективности на мужчинах при комбинированном использовании вводимого орально гестагена (медроксипрогестерона ацетат в депо-форме, левоноргестрела сложный эфир, ципротерона ацетат) и вводимого парентерально андрогена (тестестерона энантат). В отличие от этого контроль фертильности у мужчин можно осуществлять с помощью одной,содержащей предлагаемые соединения в соответствующей дозировке лекарственной формы,а именно, назначаемой для орального либо чрескожного введения. Кроме того, соединения по изобретению с андрогенным действием можно применять для мужчин старшего возраста в качестве средства гормон-заместительной терапии (ГЗТ). Те соединения общей формулы I, которые подпадают скорее под классификацию, указанную в 2), т.е. соединения с преимущественно андрогенным и более слабым гестагенным действием, могут использоваться для гормонотерапии мужчин. С помощью этих соединений можно выпускать препараты, предназначенные для лечения гипергонадизма (гипергенитализма) или для лечения мужского бесплодия и нарушений потенции. При использовании соединений по изобретению в целях контроля мужской фертильности и лечения вышеуказанных болезненных состояний и расстройств, связанных с действием андрогенов, предлагаемые соединения применяют в дозировках, эквивалентных по их действию количествам тестерона энантата согласно рекомендациям ВОЗ, соответственно в дозировке,уже практикуемой при использовании соединений в андрогенной терапии. Под эквивалентными по их действию количествами подразумева 004306 12 ются такие количества, которые обеспечивают эффект, сравнимый с достигнутым в тесте на андрогенное действие, проводившемся на семенных пузырьках и/или простате крысы (тест по Гершбергеру). Для ГЗТ мужчин заместительная доза тестостерона энантата составляет на сегодняшний день примерно 10 мг/сутки. В соответствии с данными ВОЗ, полученными при исследовании мужской фертильности,рекомендуется применять различные сложные эфиры тестостерона (энантат, буциклат, ундеканоат) в дозировках порядка 10-30 мг/сутки. Следует указать и на то, что классификация по трем группам согласно изобретению, как это представлено выше в 1), 2) и 3),в силу различных показаний не является строго определенной и возможны поэтому соответствующие варианты. Конкретно, соединения, которые по своим KFProg и/или КFAndro расположены ближе к границам каждой из указанных групп, могут быть по своим показаниям в равной степени отнесены и к смежной группе. Соединения общей формулы I проявляют частично свое действие и по отношению к глюкокортикоидному и/или минералокортикоидному рецептору. Фармацевтические препараты на основе новых соединений изготавливают по известной технологии, а именно, сначала активное вещество, необязательно совместно с эстрогеном, с обычно используемыми в галенике носителями,разбавителями, необязательно с вкусовыми добавками и т.п. подвергают переработке и затем переводят в требуемую лекарственную форму. Для предпочтительного орального введения препараты целесообразно выпускать, прежде всего, в виде таблеток, драже, капсул, пилюль,суспензий или растворов. Для парентерального введения пригодны, прежде всего, масляные растворы, как, например, растворы в кунжутном масле, касторовом масле и хлопковом масле. В целях повышения растворимости могут добавляться вещества, способствующие такой растворимости, такие, например, как бензилбензоат или бензиловый спирт. Соединения общей формулы I можно также непрерывно, в течение определенного промежутка времени вводить с помощью так называемой системы внутриматочного высвобождения активных веществ (ВМС; например, системы MIRENA); скорость высвобождения активного(ых) соединения(ий) выбирают при этом таким образом, чтобы обеспечить высвобождение предусмотренной суточной дозы в указанных выше пределах. Другая возможность состоит в том, что субстанции по изобретению включают в систему, предназначенную для трансдермального введения, и таким путем вводят их в организм. 13 Предлагаемые в изобретении соединения общей формулы I могут быть получены по описанной ниже технологии: Способ получения 1. Карбонильное соединение общей формулы II в которой А, В, Аr, R1 и R2 имеют значения, указанные в формуле I, подвергают взаимодействию с соединением общей формулы R3-SiMe3,где R3 имеет значения, указанные в общей формуле I, в присутствии катализатора или с алкилметаллическим соединением, например, реагентом Гриньяра либо литийалкилом, с получением в результате соединения формулы I. В качестве катализатора приемлемы фторидные соли или оснoвные соединения, такие как карбонаты щелочных металлов (см. Journ. Amer.Chem. Soc. 111, стр. 393 (1989. 2. Соединение общей формулы III в которой А, В, R1, R2 и R3 имеют значения, указанные в формуле I, a FG обозначает уходящую группу, подвергают взаимодействию с соединением Аr-NH-R11, где R11 обозначает атом водорода или С 1-С 5 ацильную группу, а Аr имеет значение, указанное в общей формуле I, при этом затем необязательно отщепляют остатокR1, получая в результате соединение формулы I. В ходе этой реакции соединение общей формулы III может быть необязательно образовано только в качестве промежуточного продукта,оно может представлять собой, например, образующийся на промежуточной стадии из соответствующей карбоновой кислоты хлорангидрид кислоты. В качестве уходящих групп можно назвать, например, атом хлора либо брома или тозилатный остаток. 3. Соединение общей формулы IV в которой A, R1, R2 и R3 имеют значения, указанные в формуле I, подвергают взаимодействию с соединением формулы Ar-NH-R11, где R11 и Аr имеют вышеуказанные значения, при этом затем необязательно отщепляют остаток R11,получая в результате соединение формулы I, где В представляет собой СН 2-группу. 4. Соединение формулы I, содержащее в остатке А или в остатке Аr группировку арил-Х, 004306 14 где арил представляет собой изоциклический либо гетероциклический ароматический радикал в соответствии со значениями, указанными при расшифровке формулы I, a X обозначает атом брома либо иода или группу -O-SO2R12, гдеR12 обозначает C1-С 5 перфторалкильную группу,по известным методам подвергают взаимодействию с соединением формулы R13-Y, где R13 обозначает необязательно замещенный арильный, этенильный либо этинильный остаток, а Y обозначает атом водорода (Journ. Org. Chem. 43,стр. 2947 (1978, или обозначает группу В(OR14)2 (Journ. Org. Chem. 58, стр. 2201 (1993 или группу Sn(R15)3 (Journ. Org. Chem. 52, стр. 422(1987 при R14 и R15, представляющими собой фенильный остаток или C1-С 5 алкил, а R14 может также представлять собой водород, Mg-галоген или атом щелочного металла, в присутствии катализатора на основе металла с получением в результате соединения арил-R13. 5. В соединении формулы I, содержащем в А либо Аr алкоксильный или ацилоксильный заместитель, высвобождают ОН-группу и необязательно проведением последующей реакции этерифицируют до простого либо сложного эфира, а затем, после превращения в простой 1 фенил-5-тетразолиловый эфир, путем гидрирования осуществляют процесс полного выделения (Journ. Amer. Chem. Soc. 88, стр. 4271(1966. Из описанных выше вариантов способа пригодными для получения всех соединений,подпадающих под общую формулу I, пригодны варианты 1 и 2. С помощью же варианта 3 способа можно получать соединения общей формулы I, в которой В представляет собой -СН 2 группу. С помощью вариантов 4 и 5 способа можно осуществлять функционализацию групп в уже имеющихся соединениях общей формулыI. При необходимости соединения, которые получают по одному из описанных выше способов и в которых А представляет собой необязательно замещенное ароматическое кольцо, могут селективно замещаться по этому ароматическому кольцу с помощью известных методов. В качестве примера можно назвать каталитическое гидрирование многократных связей, нитрование и галоидирование. Используемые в примерах исходные материалы получают следующим образом. Получение исходных соединений 4-Метил-4-фенил-2-оксовалериановая кислота. Раствор Гриньяра, полученный из 26,4 г магния и 162 мл 2-метил-2-фенил-1-хлорпропана в 150 мл диэтилового эфира, по каплям добавляют при -30 С к 600 мл диэтилового эфира щавелевой кислоты. По истечении 2 ч реакционную смесь добавляют к раствору хлорида аммония, экстрагируют диэтиловым эфиром,сушат (Na2SO4) и фракционируют перегонкой, 15 получая 84 г этилового эфира (tкип 115120 С/0,03 гПа), который растворяют в 1 мл метанола, смешивают с 500 мл 1 М гидроксида натрия и перемешивают в течение 1,5 ч при комнатной температуре. После выпаривания метанола в вакууме остаток распределяют между водой и диэтиловым эфиром, водную фазу подкисляют соляной кислотой и экстрагируют диэтиловым эфиром. После упаривания получают 57 г 4-метил-4-фенил-2-оксовалериановой кислоты в виде густого масла. 4,4-Диметил-2-оксо-5-гексеновая кислота. Из 50 г метилового эфира 3,3-диметил-4 пентеновой кислоты путем омыления 10%-ным едким кали получают 36 г 3,3-диметил-4 пентеновой кислоты в виде масла. Затем путем перемешивания с тионилхлоридом (20 ч, комнатная температура) получают хлорангидрид этой кислоты, tкип 59 С/30 гПа. 16 г полученного продукта перемешивают в течение 4 дней с 15 г триметилсилилцианида и 0,16 г иодида цинка. После перегонки получают 13 г нитрила 4,4 диметил-2-оксо-5-гексеновой кислоты, tкип 7585 С/30 гПа. 2 г этого продукта с 0,6 мл метанола в 13 мл гексана насыщают хлористым водородом при охлаждении льдом и по истечении 2 ч смешивают с водой. Из гексановой фазы после сушки (Nа 2SO4) и упаривания получают 0,558 г метилового эфира 4,4-диметил-2-оксо-5-гексеновой кислоты, tкип 48 С/0,003 гПа. 0,535 г этого эфира омыляют 1,3 мл 3 н. натрового щелока,получая 0,32 г 4,4-диметил-2-оксо-5-гексеновой кислоты в виде желтоватой жидкости. 3-(1-Фенилциклобутил)-2-оксопропионовая кислота. 10 г 1-фенилциклобутанкарбонитрила,растворенного в 70 мл толуола, смешивают при температуре в пределах от -72 до -69 С с 56 мл диизобутилалюмогидрида в толуоле (1,2 молярный раствор). После выдержки смеси в течение 4 ч при -75 С к ней по каплям добавляют 30 мл этилацетата. После нагревания до комнатной температуры к смеси еще раз добавляют этилацетат, а также воду. Затем фильтруют через кизельгур, органическую фазу отделяют, сушат (Nа 2SO4) и упаривают. После хроматографии на силикагеле (гексан с 0-10% этилацетата) получают 7,6 г 1-фенилциклобутанкарбальдегида. 3 г этого продукта растворяют в 10 мл тетрагидрофурана и при 0 С по каплям добавляют к раствору, который предварительно был получен смешением при 0 С 5 г триэтил-2 этоксифосфоноацетата в 70 мл тетрагидрофурана с 10,3 мл 2-молярного раствора диизопропиламида лития в тетрагидрофуране/гептане/ этилбензоле. После выдержки в течение 20 ч при комнатной температуре к реакционной смеси добавляют воду, экстрагируют этилацетатом,сушат (Na2SO4) и упаривают. 2 г этого сырого продукта омыляют 28 мл 1 н. натрового щелока. Таким путем получают 1,32 г кислоты, которую при интенсивном перемешивании с 25 мл 1 004306 16 молярной серной кислоты выдерживают с нагреванием в течение 20 ч при 90 С. После экстрагирования диэтиловым эфиром, сушкиJ. Org. Chem. 40, (1975), 3497, подвергают взаимодействию 16,7 г 2-метоксифенилацетонитрила, 158 мл триизопропиламида лития (2 молярный раствор) и 46,7 мл 1,2-дихлорэтана в 96 мл тетрагидрофурана с 58,6 мл триамида гексаметилфосфорной кислоты. В результате получают 5,6 г 1-(2-метоксифенил)циклопропилкарбонитрила, tкип 104-115 С/0,1 мбар, последующие превращения которого проводят аналогично методике, описанной для 3-(1-фенилциклобутил)-2-оксопропионовой кислоты. Таким путем получают 3-[1-(2-метоксифенил) циклопропил]-2-оксопропионовую кислоту в виде масла. Аналогично методике, описанной для 3-(1 фенилциклобутил)-2-оксопропионовой кислоты и 3-[1-(2-метоксифенил)циклопропил]-2-оксопропионовой кислоты, получают кислоты, представленные в табл. 2. Таблица 2tпл, С масло 60-63 масло 49-54 масло 185-190 масло масло масло 50-61 масло 17 4,2 мл 0,6-молярного раствора 3-метоксифенилмагнийбромида в тетрагидрофуране смешивают при -70 С с 257 мг комплекса бромида меди с диметилсульфидом, а затем перемешивают в течение 20 мин при -40 С. Реакционную смесь снова охлаждают до -70 С и медленно добавляют 0,33 мл 1,3-диметилтетрагидро-2-1 Нпиримидинона и смесь, состоящую из 400 мг метилового эфира 4-метил-2-оксо-3-пентеновой кислоты (Liebigs Annalen 1974, 477) и 0,71 мл триметилхлорсилана в 3,5 мл тетрагидрофурана. После этого перемешивают в течение 1 ч при-70 С и затем нагревают до комнатной температуры. Далее добавляют 2 н. соляную кислоту и этилацетат и этилацетатную фазу отделяют, а затем ее упаривают и остаток растворяют в 5 мл дихлорметана. После добавления 200 мг тетрабутиламмонийфторида реакционную смесь оставляют стоять на 1 ч при комнатной температуре, а затем промывают водой и дихлорметановую фазу сушат (Na2SO4) и упаривают. После хроматографии на силикагеле с использованием гексана/этилацетата (97:3) получают 63 мг метилового эфира 4-(3-метоксифенил)-4-метил-2 оксовалериановой кислоты, который смешивают с 1 мл раствора (10%-ного) гидроксида калия в метаноле. По истечении 45 мин реакционную смесь упаривают, остаток растворяют в воде и экстрагируют диэтиловым эфиром. Водную фазу затем подкисляют 6 н. соляной кислотой и экстрагируют диэтиловым эфиром. Диэтилэфирную фазу сушат (Na2SO4) и упаривают. Таким путем получают 50 мг 4-(3 метоксифенил)-4-метил-2-оксовалериановой кислоты. 2-Гидрокси-4-метил-4-фенил-2-трифторметилвалериановая кислота. Из 1,5 г магния и 10 г 2-метил-2 фенилпропилхлорида в 100 мл диэтилового эфира получают реагент Гриньяра, который вводят в реакцию с 10 г этилового эфира трифторпировиноградной кислоты, получая 9,5 г этилового эфира 2-гидрокси-4-метил-4-фенил-2 трифторметилвалериановой кислоты,tкип 90 С/0,045 гПа. 7,5 г этого этилового эфира в течение 18 ч кипятят с обратным холодильником с 100 мл раствора (10%-ного) гидроксида калия в метаноле. После концентрирования в вакууме остаток растворяют в воде и экстрагируют диэтиловым эфиром. Водную фазу подкисляют 2 н. соляной кислотой и экстрагируют диэтиловым эфиром. После выпаривания растворителя получают 3,2 г 2-гидрокси-4-метил-4 фенил-2-трифторметилвалериановой кислоты в виде бесцветных кристаллов, tпл 124-126 С. 4-(5-Фтор-2-метоксифенил)-2-гидрокси-4 метил-2-трифторметилвалериановая кислота. 1,3 г безводного хлорида цинка и 13,2 г зернистого марганца нагревают до кипения в 100 мл тетрагидрофурана и кипятят в течение 30 мин с 0,2 мл металлилбромида. Затем в течение 2 ч при кипении по каплям добавляют раствор 18 25 г металлилбромида и 17 г этилового эфира трифторпировиноградной кислоты в 80 мл тетрагидрофурана и кипятят еще в течение часа. Затем при охлаждении льдом добавляют насыщенный раствор хлорида аммония и 300 мл этилацетата, перемешивают в течение 30 мин при 0 С и отделенную этилацетатную фазу промывают насыщенным раствором хлорида аммония и трижды водой. Затем сушкой(Na2SO4) и упариванием удаляют растворитель и остаток перегоняют в вакууме. Таким путем получают 17,6 г этилового эфира 2-гидрокси-4 метилен-2-трифторметилвалериановой кислоты,tкип 48 С/1 гПа. К 5 мл 4-фторанизола и 0,9 г этилового эфира 2-гидрокси-4-метилен-2-трифторметилвалериановой кислоты добавляют 0,8 г безводного хлорида алюминия. После этого реакционную смесь перемешивают в течение 40 ч при комнатной температуре, а затем добавляют к ледяной 2 н. соляной кислоте и экстрагируют этилацетатом. Этилацетатную фазу промывают 1 н. соляной кислотой и водой, сушат (Na2SО 4) и упаривают. После хроматографии на силикагеле с использованием гексана/этилацетата (1:1) получают 1 г этилового эфира 4-(5-фтор-2 метоксифенил)-2-гидрокси-4-метил-2-трифторметилвалериановой кислоты, tпл 38-39 С. 1,9 г этого этилового эфира 4-(5-фтор-2 метоксифенил)-2-гидрокси-4-метил-2-трифторметилвалериановой кислоты в течение 2 ч кипятят с обратным холодильником с 40 мл раствора(10%-ного) гидроксида калия в метаноле. После выпаривания растворителя в вакууме добавляют воду, экстрагируют гексаном и отделенную водную фазу подкисляют 6 н. соляной кислотой. После экстракции этилацетатом этилацетатную фазу промывают водой, сушат (Na2SО 4) и упаривают. Остаток кристаллизуют из гексана. Таким путем получают 1,55 г 4-(5-фтор-2 метоксифенил)-2-гидрокси-4-метил-2-трифторметилвалериановой кислоты, tпл 102-104 С. 2-Гидрокси-4-метил-4-(2-тиенил)-2-трифторметилвалериановая кислота и 2-гидрокси 4-метил-4-(3-тиенил)-2-трифторметилвалериановая кислота. Аналогичным путем получают смесь (9:1) 2-гидрокси-4-метил-4-(2-тиенил)-2-трифторметилвалериановой кислоты и 2-гидрокси-4 метил-4-(3-тиенил)-2-трифторметилвалериановой кислоты, tпл 150-151 С. Указанные в следующей табл. 3 кислоты получают по аналогичной методике. Используя для соответствующих превращений стандартные методы, из вышепредставленных кислот или их предшественников получают также следующие кислоты. 2-Гидрокси-4-метил-2-трифторметил-4-(4 винилфенил)валериановая кислота. Нагреванием этилового эфира 4-(4 бромфенил)-2-гидрокси-4-метил-2-трифторметилвалериановой кислоты, трибутилвинилолова,три-о-толилфосфина и хлорида бис-три-отолилфосфинпалладия (II) в диметилформамиде до 120 С получают этиловый эфир 2-гидрокси 4-метил-2-трифторметил-4-(4-винилфенил)валериановой кислоты, из которого щелочным омылением получают указанное в заголовке соединение, tпл 73-74 С. 4-(4-Ацетилфенил)-2-гидрокси-4-метил-2 трифторметилвалериановая кислота. Получают аналогично предыдущему соединению нагреванием этилового эфира 4-(4 бромфенил)-2-гидрокси-4-метил-2-трифторметилвалериановой кислоты, трибутил-1-этоксивинилолова, три-о-толилфосфина и хлорида бис-три-о-толилфосфинпалладия (II) в диметилформамиде до 120 С с последующим кислым гидролизом енольного эфира и щелочным омылением, tпл 158-162 С. 4-(4-Ацетил-3-метоксифенил)-2-гидрокси 4-метил-2-трифторметилвалериановая кислота. Получают аналогично предыдущему соединению нагреванием этилового эфира 4-(4 бром-3-метоксифенил)-2-гидрокси-4-метил-2 20 трифторметилвалериановой кислоты, трибутил 1-этоксивинилолова, три-о-толилфосфина и хлорида бис-три-о-толилфосфинпалладия (II) в диметилформамиде до 120 С, масло. 4-(4-Цианфенил)-2-гидрокси-4-метил-2 трифторметилвалериановая кислота. Получают из этилового эфира 4-(4 бромфенил)-2-гидрокси-4-метил-2-трифторметилвалериановой кислоты, цианида цинка и тетракистрифенилфосфинпалладия в диметилформамиде при 140 С. Указанную в заголовке кислоту получают последующим омылением в виде пены. 4-(4-Карбамоилфенил)-2-гидрокси-4 метил-2-трифторметилвалериановая кислота. Получают обработкой этилового эфира предыдущей кислоты перекисью водорода и омылением, tпл 244-245 С. 4-(4-Циан-2-метоксифенил)-2-гидрокси-4 метил-2-трифторметилвалериановая кислота. Получают из этилового эфира 4-(4-бром-2 метоксифенил)-2-гидрокси-4-метил-2-трифторметилвалериановой кислоты, цианида цинка и тетракистрифенилфосфинпалладия в диметилформамиде при 140 С. Указанную в заголовке кислоту получают последующим омылением в виде аморфного порошка. 4-(3-Бром-4-метоксифенил)-2-гидрокси-4 метил-2-трифторметилвалериановая кислота. Получают из этилового эфира 2-гидрокси 4-(4-метоксифенил)-4-метил-2-трифторметилвалериановой кислоты путем бромирования Nбромсукцинимидом в диметилформамиде при 0 С с последующим омылением, tпл 94-96 С. 2-Гидрокси-4-метил-4-(3-нитро-4-метоксифенил)-2-трифторметилвалериановая кислота. Это соединение получают проводимым в течение часа при 0 С взаимодействием 2,5 г этилового эфира 2-гидрокси-4-(4-метоксифенил)-4-метил-2-трифторметилвалериановой кислоты с 4 мл 100%-ной азотной кислоты в 12 мл трифторуксусной кислоты, tпл 79-80 С. 4-(4-Иод-2-метоксифенил)-4-метил-2 оксовалериановая кислота. К 24,2 ммолям метилмагнийбромида в 23 мл диэтилового эфира добавляют 3,2 г метилового эфира 4-иод-2-метоксибензойной кислоты в 10 мл диэтилового эфира. Через 20 ч добавляют раствор хлорида аммония, эфирную фазу отделяют, сушат и упаривают. 2,4 г остатка растворяют в 10 мл дихлорметана, смешивают с 714 мг этилового эфира 2-триметилсилилоксиакриловой кислоты, охлаждают до -70 С и смешивают с 0,27 мл хлорида олова (IV). Через 15 мин этот раствор добавляют к раствору карбоната калия. После экстрации диэтиловым эфиром органическую фазу промывают водой, сушат и упаривают. 500 мг полученного таким путем этилового эфира 4-(4-иод-2-метоксифенил)-4-метил-2-оксовалериановой кислоты перемешивают в течение 3 ч с 8,6 мл 1 молярного раствора гидроксида натрия в смеси 21 этанола с водой (объемное соотношение 2:1). После добавления воды экстрагируют диэтиловым эфиром,водную фазу подкисляют 1 М соляной кислотой и экстрагируют диэтиловым эфиром. После сушки и упаривания получают 410 мг 4-(4-иодметоксифенил)-4-метил-2-оксовалериановой кислоты в виде желтоватого масла. 4-(3-Хлорфенил)-4-метил-2-оксовалериановая кислота. Получают аналогично предыдущему примеру в виде аморфного порошка. 4-(3-Бромфенил)-4-метил-2-оксовалериановая кислота. Получают аналогично предыдущему примеру в виде аморфного порошка. 4-(2-Иодфенил)-4-метил-2-оксовалериановая кислота. Получают аналогично предыдущему примеру в виде аморфного порошка. 4-(3-Иодфенил)-4-метил-2-оксовалериановая кислота. Получают аналогично предыдущему примеру в виде аморфного порошка. 4-(4-Иодфенил)-4-метил-2-оксовалериановая кислота. Получают аналогично предыдущему примеру в виде масла. 4-(5-Фтор-2-метоксифенил)-4-метил-2 оксовалериановая кислота. Получают аналогично предыдущему примеру, tпл 58-60 С. 4-(4-Бром-2-метоксифенил)-4-метил-2 оксовалериановая кислота. Получают аналогично предыдущему примеру в виде масла. 3-(1-Фенилциклопентил)пировиноградная кислота. Получают аналогично предыдущему примеру в виде масла из 1-фенилциклопентанола при взаимодействии с этиловым эфиром 2 триметилсилилоксиакриловой кислоты и хлорида олова (IV).(2-Гидрокси-4-фенил-2-трифторметилпентиловый)эфир 4-толуолсульфоновой кислоты. Из 2,6 г магниевой стружки и 15 мл 2 фенил-1-хлорпропана в диэтиловом эфире приготавливают раствор Гриньяра, к которому при-30 С добавляют в течение 30 мин 15 мл диэтилового эфира щавелевой кислоты. После этого перемешивают один час при -20 С и в течение 2 ч при 0 С, а затем смешивают с насыщенным раствором хлорида аммония. Диэтилэфирную фазу отделяют, сушат (Na2SО 4), упаривают и перегоняют в вакууме. Таким путем получают 17,7 г этилового эфира 2-оксо-4-фенилвалериановой кислоты, tкип 98-100 С/0,03 гПа. 4,4 г этилового эфира 2-оксо-4-фенилвалериановой кислоты растворяют в 40 мл тетрагидрофурана и смешивают при -78 С с 3,6 мл трифторметилтриметилсилана и 2 мл 1-молярного раствора тетрабутиламмонийфторида в 22 тетрагидрофуране. После выдержки в течение 24 ч при -78 С добавляют дополнительно 20 мл 1-молярного раствора тетрабутиламмонийфторида в тетрагидрофуране. Затем перемешивают в течение 1,5 ч при 0 С, добавляют этилацетат и насыщенный раствор поваренной соли и отделяют органическую фазу, которую промывают насыщенным раствором поваренной соли и водой. После этого сушат (Na2SО 4), упаривают и перегоняют на трубке с шаровым расширением. Таким путем получают 4,4 г этилового эфира 2 гидрокси-4-фенил-2-трифторметилвалериановой кислоты, tкип 95-100 С/0,04 гПа. 4,35 г этилового эфира 2-гидрокси-4 фенил-2-трифторметилвалериановой кислоты растворяют в 100 мл диэтилового эфира и перемешивают с 1,3 г алюмогидрида лития 1 ч при 0 С и в течение 16 ч при комнатной температуре. При охлаждении добавляют небольшое количество воды и перемешивают в течение 1 ч. Диэтилэфирную фазу отделяют, сушат (Na2SO4),упаривают и перегоняют на трубке с шаровым расширением. Таким путем получают 4,1 г 4 фенил-2-трифторметил-1,2-пентандиола, tкип 20 С/0,04 гПа. 4,25 г 4-фенил-2-трифторметил-1,2-пентандиола в 30 мл пиридина смешивают при 0 С с 3,8 г хлорангидрида 4-толуолсульфоновой кислоты. После выдержки в течение 16 ч при 0 С концентрируют в вакууме, смешивают с этилацетатом, промывают водой, сушат (Na2SО 4) и упаривают. Кристаллизацией из этилацетата/гексана получают 4,9 г (2-гидрокси-4-фенил 2-трифторметилпентилового)эфира 4-толуолсульфоновой кислоты, tпл 95-96 С. Аналогичным путем получают (2-гидрокси-4-метил-4-фенил-2-трифторметилпентиловый)эфир 4-толуолсульфоновой кислоты, tпл 78 С. Аналогичным путем получают также [4-(4 фторфенил)-2-гидрокси-4-метил-2-трифторметилпентиловый]эфир 4-толуолсульфоновой кислоты, tпл 80-81 С, и [2-гидрокси-4-(2-метокси 5-фторфенил)-4-метил-2-трифторметилпентиловый]эфир 4-толуолсульфоновой кислоты, tпл 9395 С. 2-(2-Фенилпропил)-2-трифторметилоксиран. 400 мг (2-гидрокси-4-фенил-2-трифторметилпентилового)эфира 4-толуолсульфоновой кислоты в 5 мл диметилформамида смешивают при 0 С с 35 мг гидрида натрия (80%-ного в минеральном масле). После выдержки при 0 С в течение 1 ч разбавляют водой и экстрагируют дихлорметаном. Дихлорметановую фазу промывают водой, сушат (Na2SО 4) и упаривают. Остаток перегоняют. Таким путем получают 200 мг 2-(2-фенилпропил)-2-трифторметилоксирана,tкип 110 С/1 гПа. 4-Бром-5-аминофталид. 23 г 3-бром-4-нитро-1,2-ксилола суспендируют в 200 мл пиридина и 600 мл воды и при 23 60 С смешивают, добавляя порциями, с 260 г перманганата калия, при этом температура повышается до 90 С. Реакционную смесь в течение еще 2 ч нагревают до 95 С, фильтруют,фильтрат подкисляют соляной кислотой и экстрагируют диэтиловым эфиром. После выпаривания растворителя получают 27 г 3-бром-4 нитрофталевой кислоты. 12 г этой кислоты в течение 15 мин нагревают до 220 С, а затем перегоняют на трубке с шаровым расширением. При давлении 0,03 гПа таким путем отгоняют 10 г ангидрида 3-бром-4-нитрофталевой кислоты. Полученный ангидрид растворяют в 120 мл диметилформамида и при 0 С медленно смешивают с 78,8 мл 0,5-молярного раствора борогидрида натрия в диметилформамиде. После выдержки в течение трех часов при 0 С осторожно добавляют 2 н. соляную кислоту и экстрагируют этилацетатом. После промывки раствором бикарбоната калия, сушки (Na2SО 4) и упаривания этилацетатной фазы получают 6,6 г 4-бром-5 нитрофталида. 6,6 г этого 4-бром-5 нитрофталида растворяют в 45 мл этанола и добавляют по каплям к нагретой до 60 С и тщательно перемешанной смеси, полученной из 65 г сульфата железа (II), 220 мл воды и 65 мл аммиака (33%-ного). После выдержки в течение 2 ч при 60 С смесь экстрагируют пятикратным смешением с 200 мл диэтилового эфира. Диэтилэфирные фазы упаривают, получая в виде остатка 4,1 г 4-бром-5-аминофталида, tпл 176180 С. 6-Бром-5-аминофталид. Ангидрид 4-бром-5-нитрофталевой кислоты получают аналогично описанной выше методике из 4-бром-5-нитро-1,2-ксилола. Кипячением с этанолом из этого ангидрида получают смесь 2-бром-6-этоксикарбонил-3-нитробензойной и 3-бром-2-этоксикарбонил-4-нитробензойной кислот. К 7,2 мл 0,66-молярного раствора диметилформамида в дихлорметане при 0 С по каплям острожно добавляют 1,2 мл оксалилхлорида. Полученный раствор перемешивают в течение 1 ч при 0 С и в течение 5 мин при комнатной температуре. Полученный после упаривания в вакууме остаток суспендируют в 7 мл ацетонитрила, охлаждают до -35 С и по каплям смешивают с 1,5 г смеси сложных эфиров. После выдержки в течение 1 ч при той же температуре реакционную смесь охлаждают до -70 С и по каплям добавляют 2,4 мл 2-молярного раствора борогидрида натрия в диметилформамиде. Полученную смесь перемешивают в течение 20 ч при комнатной температуре, добавляют воду,подщелачивают карбонатом калия и экстрагируют диэтиловым эфиром. Диэтилэфирную фазу сушат (Na2SО 4) и упаривают. Таким путем получают смесь 5-бром-6-нитрофталида и 6-бром 5-нитрофталида, которую разделяют на силикагеле с использованием гексана/этилацетата(95:5). Восстановление до аминофталида осуще 004306 24 ствляют по описанной выше методике, получая 6-бром-5-аминофталид, tпл 235-241 С. 5-Aмино-3-(1-пропенил)фталид. 5 г 2-бром-4-нитробензойной кислоты путем 2-часового кипячения с 30 мл тионилхлорида и отгонки избытка последнего переводят в хлорангидрид кислоты, который растворяют в 50 мл тетрагидрофурана и по каплям добавляют к раствору 3 мл аллиламина в 20 мл тетрагидрофурана. После выдержки в течение 20 ч при комнатной температуре распределяют между 1 н. соляной кислотой и этилацетатом, этилацетатную фазу промывают водой, сушат (Na2SO4) и упаривают. Остаток кристаллизуют с помощью гексана. Таким путем получают 5,6 г аллиламида 2-бром-4-нитробензойной кислоты, tпл 98-100 С. Этот материал растворяют в 35 мл этанола и добавляют по каплям к нагретой до 60 С и тщательно перемешанной смеси, полученной из 50 г сульфата железа (II), 170 мл воды и 50 мл аммиака (33%-ного). После выдержки в течение 2 ч при 60 С смесь экстрагируют пятикратным смешением с 200 мл диэтилового эфира, диэтилэфирные фазы упаривают и остаток кристаллизуют с помощью гексана. Таким путем получают 3,1 г аллиламида 4-амино-2-бромбензойной кислоты, tпл 115-117 С. 11 г этого аллиламида 4-амино-2 бромбензойной кислоты, 5,2 мл ацетонилацетона и 200 мг 4-толуолсульфоновой кислоты кипятят с обратным холодильником в течение 1,5 ч со средством для отделения воды (водоотделителем). После этого раствор разбавляют этилацетатом, промывают 1 н. соляной кислотой, а затем раствором карбоната калия, сушат(Na2SO4) и упаривают. Остаток кристаллизуют с помощью гексана. Таким путем получают 13,4 гN-аллил-2-бром-4-(2,5-диметилпиррол-1-ил) бензамида, tпл 136-138 С. 3 г N-аллил-2-бром-4-(2,5-диметилпиррол 1-ил)бензамида в 100 мл диметоксиэтана смешивают при -70 С с 14,2 мл 1,4-молярного раствора бутиллития в гексане. После выдержки в течение 30 мин при -70 С добавляют 1,63 мл крoтонового альдегида. Раствору дают нагреться до комнатной температуры, после чего перемешивают в течение 20 ч, добавляют 50 мл 50%-ной уксусной кислоты и в течение 6 ч нагревают до 60 С. После этого разбавляют водой,экстрагируют этилацетатом и этилацетатную фазу промывают раствором карбоната калия. Этилацетатную фазу сушат (Na2SO4) и упаривают. Остаток хроматографируют на силикагеле с использованием гексана/этилацетата (98:2),получая 1,1 г кристаллического 5-(2,5 диметилпиррол-1-ил)-3-(1-пропенил)фталида,tпл 91-95 С. 1,1 г 5-(2,5-диметилпиррол-1-ил)-3-(1-пропенил)фталида, 8,56 г гидрохлорида гидроксиламина и 4,58 г гидроксида калия в 75 мл смеси этанол/вода (в объемном соотношении 16:6,8) нагревают в течение 24 ч при 120 С. Растворитель отгоняют, остаток смешивают с водой и экстрагируют этилацетатом. Этилацетатную фазу сушат (Na2SО 4), упаривают и хроматографируют на силикагеле с использованием дихлорметана/метанола (99:1), получая 640 мг 5 амино-3-(1-пропенил)фталида, tпл 125-130 С. Аналогичным путем получают фталиды,указанные в табл. 4. Таблица 4 4-Бром-5-(4-метил-2-оксо-4-фенилвалероиламино)фталид. 412 мг 4-метил-4-фенил-2-оксовалериановой кислоты растворяют в 10 мл диметилацетамида и при -8 С смешивают в атмосфере аргона с 261 мг тионилхлорида. После перемешивания в течение 20 мин при температуре в интервале от -3 до +3 С добавляют 228 мг 4-бром 5-аминофталида. Затем перемешивают в течение 1,5 ч при комнатной температуре, после чего смешивают с водой, экстрагируют этилацетатом, органическую фазу промывают водой,сушат (Na2SО 4) и после выпаривания растворителя и обработки диэтиловым эфиром получают 360 мг 4-бром-5-(4-метил-2-оксо-4-фенилвалероиламино)фталида, tпл 150-152 С. Аналогично описанной выше методике получения 4-бром-5-(4-метил-2-оксо-4-фенилвалероиламино)фталида получают соединения,представленные в табл. 5 и 6. Таблица 5 5-[3-(1-Фенилциклопропил)-2-оксопропиониламино]фталид. Получают по аналогичной методике, описанной для получения 4-бром-5-(4-метил-2 оксо-4-фенилвалероиламино)фталида, из 5 26 аминофталида и 3-(1-фенилциклопропил)-2 оксопропионовой кислоты, tпл 132-138 С. 5-[3-(1-Фенилциклобутил)-2-оксопропиониламино]фталид. Получают по аналогичной методике, описанной для получения 4-бром-5-(4-метил-2 оксо-4-фенилвалероиламино)фталида, из 5 аминофталида и 3-(1-фенилциклобутил)-2 оксопропионовой кислоты, tпл 142-146 С. 5-[3-(1-Фенилциклогексил)-2-оксопропиониламино]фталид. Получают по аналогичной методике, описанной для получения 4-бром-5-(4-метил-2 оксо-4-фенилвалероиламино)фталида, из 5 аминофталида и 3-(1-фенилциклогексил)-2 оксопропионовой кислоты, tпл 120-123 С. Так же получают соединения, представленные в табл. 6. Таблица 6 6-[3-(1-Фенилциклопропил)-2-оксопропиониламино]-4-метил-2,3-бензоксазин-1-он. Получают по аналогичной методике, описанной для получения 4-бром-5-(4-метил-2 оксо-4-фенилвалероиламино)фталида, из 6 амино-4-метил-2,3-бензоксазин-1-она и 3-(1 фенилциклопропил)-2-оксопропионовой кислоты, tпл 197-200 С. 6-[3-(1-Фенилциклобутил)-2-оксопропиониламино]-4-метил-2,3-бензоксазин-1-он. Получают аналогично 6-[3-(1-фенилциклопропил)-2-оксопропиониламино]-4-метил-2,3 бензоксазин-1-ону с использованием 3-(1 фенилциклобутил)-2-оксопропионовой кислоты,tпл 155-156 С. 6-[3-(1-фенилциклогексил)-2-оксопропиониламино]-4-метил-2,3-бензоксазин-1-он. Получают аналогично 6-[3-(1-фенилциклопропил)-2-оксопропиониламино]-4-метил-2,3 бензоксазин-1-ону с использованием 3-(1 фенилциклогексил)-2-оксопропионовой кислоты, tпл 132-134C. 27 5-(4,4-Диметил-2-оксо-5-гексеноиламино) фталид. Получают по аналогичной методике, описанной для получения 4-бром-5-(4-метил-2 оксо-4-фенилвалероиламино)фталида, из 5 аминофталида и 4,4-диметил-2-оксо-5-гексеновой кислоты, tпл 103-104 С. 6-Бром-5-(4-метил-2-оксо-4-фенилвалероиламино)фталид. Аналогично предыдущему примеру из 2,0 г 4-метил-4-фенил-2-оксовалериановой кислоты и 1,11 г 6-бром-5-аминофталида с 1,27 г тионилхлорида в 60 мл диметилацетамида получают 1,7 г 6-бром-5-(4-метил-2-оксо-4-фенилвалероиламино)фталида, tпл 148-150 С. 5-[4-(4-Иод-2-метоксифенил)-4-метил-2 оксовалероиламино]фталид. Получают по аналогичной методике, описанной для получения 4-бром-5-(4-метил-2 оксо-4-фенилвалероиламино)фталида, из 5 аминофталида и 4-(4-иод-2-метоксифенил)-4 метил-2-оксовалериановой кислоты в виде пены. 5-[4-(4-Иодфенил)-4-метил-2-оксовалероиламино]фталид. Получают по аналогичной методике, описанной для получения 4-бром-5-(4-метил-2 оксо-4-фенилвалероиламино)фталида, из 5 аминофталида и 4-(4-иодфенил)-4-метил-2 оксовалериановой кислоты в виде масла. 5-[4-(3-Иодфенил)-4-метил-2-оксовалероиламино]фталид. Получают по аналогичной методике, описанной для получения 4-бром-5-(4-метил-2 оксо-4-фенилвалероиламино)фталида, из 5 аминофталида и 4-(3-иодфенил)-4-метил-2 оксовалериановой кислоты, tпл 160-161 С. 5-[4-(4-Бром-2-метоксифенил)-2-оксовалероиламино]фталид. Получают по аналогичной методике, описанной для получения 4-бром-5-(4-метил-2 оксо-4-фенилвалероиламино)фталида, из 5 аминофталида и 4-(4-бром-2-метоксифенил)-2 оксовалериановой кислоты, tпл 136-140 С. 5-[3-(1-Фенилциклопентил)-2-оксопропиониламино]фталид. Получают по аналогичной методике, описанной для получения 4-бром-5-(4-метил-2 оксо-4-фенилвалероиламино)фталида, из 5 аминофталида и 3-(1-фенилциклопентил)-2 оксопропионовой кислоты, tпл 140-144 С. 6-[4-(5-Фтор-2-метоксифенил)-4-метил-2 оксовалероиламино]-4-метил-2,3-бензоксазин-1 он. Получают по аналогичной методике, описанной для получения 4-бром-5-(4-метил-2 оксо-4-фенилвалероиламино)фталида, из 4 метил-2,3-бензоксазин-1-она и 4-(5-фтор-2 метоксифенил)-4-метил-2-оксовалериановой кислоты, tпл 171-173 С. 28 6-[4-(5-Фтор-2-метоксифенил)-4-метил-2 оксовалероиламино]-4-этил-2,3-бензоксазин-1 он. Получают по аналогичной методике, описанной для получения 4-бром-5-(4-метил-2 оксо-4-фенилвалероиламино)фталида, из 4-этил 2,3-бензоксазин-1-она и 4-(5-фтор-2-метоксифенил)-4-метил-2-оксовалериановой кислоты,tпл 157-158 С. 6-Aмино-4-метил-2,3-бензоксазин-1-он. 60 г 2-метил-5-нитроацетофенона, 38,5 г 2,2-диметил-1,3-пропандиола и 6 г п-толуолсульфоновой кислоты кипятят в 1 л толуола с водоотделителем до окончания образования воды. Раствор промывают бикарбонатом калия,сушат (Na2SO4) и упаривают. Из пентана получают 71,7 г кристаллического кеталя. Последний, как описано выше для получения 4-бром-5 аминофталида, окисляют в 1,5 л пиридина и 4,5 л воды с добавлением 350 г перманганата калия. В результате получают 56,4 г 4-нитро-2-(2,5,5 триметил-1,3-диоксан-2-ил)бензойной кислоты. 52 г этой кислоты гидрируют в 500 мл метанола и 500 мл этилацетата в присутствии 10 г палладия на угле (10%-ного). Таким путем из пентана получают 45,5 г кристаллического аминосоединения. 10 г этого амина в течение 2 ч кипятят с обратным холодильником с 100 мл концентрированной соляной кислоты. Растворитель выпаривают в вакууме и остаток в течение 12 ч кипятят с обратным холодильником с 15,7 г гидрохлорида гидроксиламина, 8,4 г гидроксида калия, 120 мл этанола и 50 мл воды. Разбавляют водой и кристаллы отфильтровывают вакуумфильтрацией. После сушки получают 3,5 г 6 амино-4-метил-2,3-бензоксазин-1-она, tпл 291296 С. 6-Амино-4-этил-2,3-бензоксазин-1-он. Получают аналогичным путем из 2-метил 5-нитропропиофенона, tпл 89-93 С. 6-Aмино-1-метил-1H-бензотриазол. Способ получения описан в Heterocycles 36, 259 (1993). 5-Aминобенз[1.2.5]оксадиазол. Способ получения описан в Boll. Sci. Fac.Chim. Ind. Bologna, 22, 33, 36, 37 (1964). 5-Aминобенз[1.2.5]тиадиазол. Способ получения описан в J. Heterocycl.Chem. 11, 777 (1974). 5-Aмино-1-инданон. Способ получения описан в J. Org. Chem. 27, 70 (1962). 6-Aмино-1,2,3,4-тетрагидро-1-нафталинон. Способ получения описан в J. Org. Chem. 27, 70 (1962). 6-Aмино-3,4-дигидро-1H-2-бензопиран-1 он. Получают каталитическим гидрированием(палладий на угле) в этаноле из соответствующего нитросоединения (Canad. J. Chem. 61, 2643 29 Приведенные ниже примеры более подробно поясняют настоящее изобретение. Другие соединения получают с использованием гомологичных/аналогичных реагентов. Необходимые исходные соединения описаны выше в разделе "Получение исходных соединений". Пример 1 (вариант 1 способа). 4-Бром-5-(2 гидрокси-4-метил-4-фенил-2-трифторметилвалероиламино)фталид. 350 мг 4-бром-5-(4-метил-2-оксо-4-фенилвалероиламино)фталида растворяют в атмосфере аргона в 15 мл диметилформамида и при охлаждении льдом смешивают с 0,77 мл трифторметилтриметилсилана и 350 мг карбоната цезия. После перемешивания в течение 3 ч при комнатной температуре добавляют 5 мл 1 молярного раствора тетрабутиламмонийфторида в тетрагидрофуране и несколько капель воды и один час перемешивают при комнатной температуре. После добавления 100 мл воды экстрагируют этилацетатом, органическую фазу сушат (Na2SО 4) и упаривают. Таким путем получают 250 мг 4-бром-5-(2-гидрокси-4-метил-4 фенил-2-трифторметилвалероиламино)фталида,tпл 187-194 С. Пример 2. 6-Бром-5-(2-гидрокси-4-метил 4-фенил-2-трифторметилвалероиламино) фталид. Получают аналогично примеру 1 из 1,6 г 6 бром-5-(4-метил-2-оксо-4-фенилвалероиламино) фталида, 3,5 мл трифторметилтриметилсилана и 1,6 г карбоната цезия, tпл 205-210 С. Пример 3. 5-(2-Гидрокси-4-метил-2-пентафторэтил-4-фенилвалероиламино)фталид. Получают аналогично примеру 1 из 20 мг 5-(4-метил-2-оксо-4-фенилвалероиламино) фталида, 0,1 мл триметилпентафторэтилсилана и 20 мг карбоната цезия, tпл 187-189 С. Пример 4. 5-[2-Гидрокси-4-(3-метоксифенил)-4-метил-2-трифторметилвалероиламино] фталид. Получают аналогично примеру 1 из 30 мг 5-[4-(3-метоксифенил)-4-метил-2-оксовалероиламино]фталида, 0,13 мл трифторметилтриметилсилана и 30 мг карбоната цезия, tпл 173178 С. Пример 5. 5-(2-Гидрокси-4,4-диметил-2 трифторметил-5-гексеноиламино)фталид. Получают аналогично примеру 1 из 200 мг 5-(4,4-диметил-2-оксо-5-гексеноиламино)фталида, 0,22 мл трифторметилтриметилсилана и 258 мг карбоната цезия, tпл 153-157 С. Аналогично примеру 1 получают соединения, представленные в табл. 7. Таблица 7 Пример 40. 6-(2-Гидрокси-2,4-диметил-4 фенилвалероиламино)-4-метил-2,3-бензоксазин 1-он. 72 мг 6-(4-метил-4-фенил-2-оксовалероиламино)-4-метил-2,3-бензоксазин-1-она в 4 мл тетрагидрофурана смешивают при 0 С с 3 мл метилмагнийбромида (3-молярного). По истечении 30 мин добавляют раствор хлорида аммония, органическую фазу отделяют, сушат и упаривают. После хроматографии на силикагелеImperial Chemical Industries в 10 мл диметилацетамида смешивают при -15 С с 0,14 мл тионилхлорида. После перемешивания в течение 3 ч при -15 С добавляют 600 мг 5-аминофталида(твердого). Раствор перемешивают в течение 2 ч при -15 С, а затем оставляют стоять на 18 ч при комнатной температуре, после чего смешивают с водой и экстрагируют этилацетатом. Этилацетатную фазу сушат (Na2SO4) и упаривают. Остаток размешивают с диэтиловым эфиром и фильтруют вакуум-фильтрацией. Таким путем получают 290 мг 5-(2-гидрокси-4-фенил-2 трифторметилвалероиламино)фталида, tпл 166168 С. Пример 42. 6-(2-Гидрокси-4-фенил-2 трифторметилвалероиламино)-4-метил-2,3 бензоксазин-1-он. Получают аналогично примеру 41 из 784 мг 2-гидрокси-4-фенил-2-трифторметилвалериановой кислоты в 17 мл диметилацетамида и 500 мг 6-амино-4-метил-2,3-бензоксазин-1-она, tпл 172-173 С. Аналогично примеру 41 получают соединения, представленные в табл. 10. Таблица 10(1) представленные в табл. 10 оптически активные соединения разделяют аналогично примеру 88; Пример 102. (+)- и (-)-5-[2-гидрокси-4 метил-4-(2-метоксифенил)-2-трифторметилвалероиламино]фталид. Смесь энантиомеров из примера 73 разделяют хроматографией на хиральном носителе(с=0,5 в хлороформе). Пример 103. 5-[2-Гидрокси-4-метил-4-(2 тиенил)-2-трифторметилвалероиламино]фталид и 5-[2-гидрокси-4-метил-4-(3-тиенил)-2-трифторметилвалероиламино]фталид. Смесь 2-гидрокси-4-метил-4-(2-тиенил)-2 трифторметилвалериановой кислоты и 2 гидрокси-4-метил-4-(3-тиенил)-2-трифторметилвалериановой кислоты (9:1) превращают аналогично примеру 41 с использованием 5 аминофталида. После хроматографического разделения изомеров по положению и разделения рацематов аналогично примеру 102 получают (+)-5-[2-гидрокси-4-метил-4-(2-тиенил)-2 трифторметилвалероиламино]фталид, tпл 166 С,[]D = +163,6 (с=0,5 в хлороформе), (-)-5-[2 гидрокси-4-метил-4-(2-тиенил)-2-трифторметил 33(с = 0,5 в хлороформе), (+)-5-[2-гидрокси-4 метил-4-(3-тиенил)-2-трифторметилвалероиламино]фталид, tпл 135 С, и (-)-5-[2-гидрокси-4 метил-4-(3-тиенил)-2-трифторметилвалероиламино]фталид, tпл 135 С. Пример 104 (вариант 3 способа). 5-(2 Гидрокси-4-фенил-2-трифторметилпентиламино)фталид. 760 мг 5-ацетамидофталида в 20 мл диметилформамида смешивают при 0 С с 144 мг гидрида натрия (80%-ного в минеральном масле) и по истечении 20 мин - с 800 мг (2 гидрокси-4-фенил-2-трифторметилпентилового) эфира 4-толуолсульфоновой кислоты. После выдержки в течение 16 ч при 60 С растворитель выпаривают в вакууме, остаток растворяют в этилацетате, промывают водой, сушат (Na2SO4) и упаривают. В результате хроматографии на силикагеле с использованием циклогексана/этилацетата (2:1) получают 266 мг 5-(2 гидрокси-4-фенил-2-трифторметилпентиламино)фталида, tпл 110 С. Аналогично примеру 104 получают соединения, представленные в табл. 11. Таблица 11(1) представленные в табл. 11 оптически активные соединения разделяют аналогично примеру 102; Пример 117. 4-Этил-6-(2-гидрокси-4 фенил-2-трифторметилпентиламино)-2,3-бензоксазин-1-он. Это соединение получают аналогично примеру 104 из 151 мг 6-ацетамидо-4-этил-2,3 бензоксазин-2-она, 208 мг (2-гидрокси-4-фенил 2-трифторметилпентилового)эфира 4-толуолсульфоновой кислоты и 36 мг гидрида натрия,tпл 161-163 С. Пример 118. 1-(4-Нитро-3-трифторметиланилино)-4-фенил-2-трифторметил-2-пентанол. 34 100 мг 4-нитро-3-трифторметилацетанилида в 2 мл диметилформамида смешивают при 0 С с 12 мг гидрида натрия (80%-ного в минеральном масле) и по истечении 20 мин - с 150 мг 2-(2-фенилпропил)-2-трифторметилоксирана. Перемешивают в течение 16 ч при 60 С, разбавляют водой и экстрагируют этилацетатом. После промывки водой этилацетатную фазу сушат(Na2SО 4) и упаривают. Таким путем получают 80 мгN-(2-гидрокси-4-метил-4-фенил-2 трифторметилвалероил)-4-нитро-3-трифторметиланилина, tпл 119-120 С. После разделения рацематов аналогично примеру 102 получают(+)-форму, []D = +48,8 (с = 0,5 в хлороформе). Пример 119 (вариант 4 способа). 6-(3 Гидрокси-3-метил-1-бутинил)-5-(2-гидрокси-4 метил-4-фенил-2-трифторметилвалероиламино) фталид. 150 мг бромзамещенного соединения из примера 2 вместе с 30 мг 2-метил-3-бутин-2-ола,0,24 мг иодида меди (I) и 0,9 мг трифенилфосфина растворяют в 1,5 мл пиридина и в атмосфере аргона смешивают с 0,25 мг хлорида бистрифенилфосфинпалладия (II). После 5 часового кипячения с обратным холодильником добавляют еще 30 мг 2-метил-3-бутин-2-ола и кипятят с обратным холодильником в течение 20 ч. Затем разбавляют водой и экстрагируют этилацетатом. Этилацетатную фазу сушат(Na2SО 4) и упаривают. Сырой продукт хроматографируют на силикагеле. С использованием циклогексана/этилацетата (1:1) получают 60 мг кристаллического 6-(3-гидрокси-3-метил-1 бутинил)-5-(2-гидрокси-4-метил-4-фенил-2 трифторметилвалероиламино)фталида, tпл 162168 С. Пример 120. 6-Ацетил-5-(2-гидрокси-4 метил-4-фенил-2-трифторметилвалероиламино) фталид. 100 мг бромзамещенного соединения из примера 2 вместе с 95 мг трибутил(1-этоксивинил)олова и 8 мг хлорида бис-трифенилфосфинпалладия (II) растворяют в атмосфере аргона в 4 мл толуола. После 5-часового кипячения с обратным холодильником добавляют еще 45 мг хлорида бис-трифенилфосфинпалладия (II) и кипятят с обратным холодильником в течение 20 ч. Затем добавляют 1 н. соляную кислоту и экстрагируют этилацетатом. Этилацетатную фазу сушат (Na2SO4) и упаривают. Сырой продукт перемешивают в течение 2 дней при комнатной температуре в 3 мл тетрагидрофурана и 3 мл 2 н. соляной кислоты. После этого смешивают с водой и экстрагируют этилацетатом. После промывки водой сушат(1) представленные в табл. 13 оптически активные соединения разделяют аналогично примеру 102; Получено каталитическим гидрированием из винилзамещенного соединения; получено мягким кислым гидролизом из простого енольного эфира. Пример 134 (вариант 5 способа). 5-[4-(3 Фтор-4-гидроксифенил)-2-гидрокси-4-метил-2 трифторметилвалероиламино]фталид. 132 мг 5-[4-(3-фтор-4-метоксифенил)-2 гидрокси-4-метил-2-трифторметилвалероиламино]фталида (пример 82) растворяют в 15 мл дихлорметана и при 0 С смешивают с 1,2 мл 1 молярного раствора трибромида бора в дихлорметане. После выдержки в течение 16 ч при 0 С в смесь добавляют лед, этилацетат и бикарбонат калия и этилацетатную фазу отделяют, сушат Пример 152. 5-[4-(3-Фторфенил)-2-гидрокси-4-метил-2-трифторметилвалероиламино] фталид. 66 мг (3-фтор-4-гидроксифенил)-2-гидрокси-4-метил-2-трифторметилвалероиламинофталида в течение 16 ч перемешивают с 126 мг карбоната калия и 108 мг 5-хлор-1-фенил-1Hтетразола в 3 мл диметилформамида. Затем диметилформамид отгоняют в вакууме и остаток распределяют между 1 н. соляной кислотой и этилацетатом. После промывки водой этилацетатную фазу сушат (Na2SО 4) и упаривают и остаток хроматографируют на силикагеле с использованием гексана/этилацетата (1:1). Полученный продукт гидрируют в 10 мл метанола в присутствии 30 мг палладия на угле (10%-ного). После удаления катализатора и выпаривания растворителя продукт хроматографируют на силикагеле с использованием гексана/ этилацетата (1:1). Таким путем получают 49 мг 5-[4-(3-фторфенил)-2-гидрокси-4-метил-2-трифторметилвалероиламино]фталида, tпл 157 С. Разделением рацематов аналогично примеру 102 получают (+)-форму с tпл 140-141 С и(-)-форму с tпл 141 С. Пример 153. 5-[2-Гидрокси-4-метил-4-(3 толил)-2-трифторметилвалероиламино]фталид. Это соединение получают аналогично предыдущему примеру из 57 мг 5-[2-гидрокси-4-(2 гидрокси-5-метилфенил)-4-метил-2-трифторметилвалероиламино]фталида, tпл 152-153 С. Разделением рацематов аналогично примеру 102 получают (+)-форму с tпл 148-149 С и при комнатной температуре в 1 мл диметилформамида с 28 мг карбоната калия и 50 мг этилиодида. Затем смешивают с водой, экстрагируют этилацетатом, органическую фазу промывают водой, сушат (Na2SO4) и после выпаривания растворителя получают 35 мг 5-[4-(5-фтор 2-этоксифенил)-2-гидрокси-4-метил-2-трифторметилвалероиламино]фталида, tпл 108 С. Аналогично примеру 154 получают соединения, представленные в табл. 14. Таблица 14 Пример 162. 5-[4-(3-Xлор-4-метоксифенил)-2-гидрокси-4-метил-2-трифторметилвалероиламино]фталид. 22 мг 5-[2-гидрокси-4-(4-метоксифенил)-4 метил-2-трифторметилвалероиламино]фталида перемешивают в течение 5 ч в 1,5 мл метанола с 20 мг N-хлорсукцинимида. Затем смесь распределяют в ледяной воде, растворе гидрокарбоната натрия и этилацетате, этилацетатную фазу сушат и упаривают. Таким путем получают 20 мг 5-[4-(3-бром-4-метоксифенил)-2-гидрокси-4 метил-2-трифторметилвалероиламино]фталида,температура плавления которого после перекристаллизации из изопропилового эфира составляет 189-191 С. 5-[4-(3-хлор-4-гидроксифенил)-2-гидрокси-4-метил-2-трифторметилвалероиламино] фталид. Получают аналогично примеру 134 из 5-[4(3-хлор-4-метоксифенил)-2-гидрокси-4-метил-2 трифторметилвалероиламино]фталида отщеплением группы простого эфира, tпл 105 С. По описанным выше методам получают 2,3-бензоксазиноновые и фталазиноновые производные, представленные в табл. 15. Таблица 15(1) представленные в табл. 15 оптически активные соединения разделяют аналогично примеру 102; Пример 207. 5-(2-Гидрокси-4-фенил-2-трифторметилвалероиламино)бенз[1.2.5]оксадиазол. Это соединение получают аналогично примеру 41 из 2-гидрокси-4-фенил-2-трифторметилвалериановой кислоты и 5-аминобенз[1.2.5]оксадиазола, tпл 192 С. Пример 208. 5-(2-Гидрокси-4-фенил-2 трифторметилвалероиламино)бензо[1.2.5]тиадиазол. Это соединение получают аналогично примеру 41 из 2-гидрокси-4-фенил-2 трифторметилвалериановой кислоты и 5 аминобензо[1.2.5]тиадиазола, tпл 166-167 С. Пример 209. 6-(2-Гидрокси-4-фенил-2 трифторметилвалероиламино)-1-метилбензотриазол. Это соединение получают аналогично примеру 41 из 2-гидрокси-4-фенил-2 трифторметилвалериановой кислоты и 6-амино 1-метилбензотриазола, tпл 194-196 С. 39 ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединения общей формулы I в которой R1 и R2 являются одинаковыми или различными и обозначают атом водорода, С 1 С 5 алкильную группу или атом галогена, а также вместе с С-атомом цепи образуют кольцо,имеющее в общей сложности 3-7 членов,R3 обозначает С 1-С 5 алкильную группу или частично либо полностью фторированную С 1 С 5 алкильную группу,А обозначает моно- либо бициклическое карбоциклическое или гетероциклическое ароматическое кольцо, которое необязательно замещено одним или несколькими остатками, выбранными из атомов галогена, С 1-С 5 алкильных групп, С 2-С 5 алкенильных групп -CR5=CR6R7,где R5, R6 и R7 являются одинаковыми или различными и независимо друг от друга обозначают атомы водорода или С 1-С 5 алкильные группы, гидроксигрупп, гидроксигрупп, которые несут С 1-С 10 ацильную группу, С 3-С 10 карбалкоксиалкильную группу, С 2-С 5 цианалкильную группу, незамещенную либо замещенную С 3 С 10 аллильную группу, незамещенную либо замещенную С 3-С 10 пропаргильную группу, С 2 С 5 алкоксиалкильную группу, частично либо полностью замещенную атомами фтора С 1 С 5 алкильную группу, а также выбранными из циано- либо нитрогруппы, С 1-С 5 алкоксигрупп,С 1-С 5 алкилтиогрупп, моно- либо дизамещенных С 1-С 10 аминогрупп или частично либо полностью фторированных С 1-С 5 алкильных групп,В обозначает карбонильную или СН 2 группу и Аr обозначает кольцевую систему, выбранную из следующей группы общих субформул 2-11(в субформулах 5, 6 и 7) или Y4, Y5, Y7, Y8 (в субформулах 8, 9, 10 и 11) являются одинаковыми или различными и выбраны из атомов водорода, С 1-С 5 алкильных групп, которые дополнительно также могут содержать гидроксигруппу, необязательно этерифицированную С 1 С 5 алкильной группой до простого эфира или С 1 С 5 алканоильной группой до сложного эфира,частично либо полностью фторированных С 1 С 5 алкильных групп, С 2-С 5 алкенильных группR5 имеет вышеуказанные значения,остатки Х 3a и Х 3b далее вместе с С-атомом сконденсированной с бензольным ядром кольцевой системы 5, 6 или 7 могут образовывать кольцо, имеющее в общей сложности 3-7 членов, и, кроме того, значения остатков Х 4, X6, X7(в субформулах 2, 3, 4, 5, 6 и 7) или Y4, Y5, Y7,Y8 (в субформулах 8, 9, 10 и 11) выбраны из атомов галогена, гидроксигрупп, С 1-С 5 алкоксигрупп или С 1-С 5 алканоильных групп,а также в случае, когда В означает СН 2 группу, физиологически приемлемые соли соединений общей формулы I с кислотами. 2. Соединения общей формулы I по п.1 в форме рацемата или смеси диастереомеров. 3. Соединения общей формулы I по п.1 в форме разделенных оптических изомеров. 4. Соединения общей формулы I по п.1,отличающиеся тем, что R1 и R2 являются одинаковыми или различными и обозначают атом водорода, метильную либо этильную группу или же вместе с С-атомом цепи образуют циклопропильное кольцо. 5. Соединения общей формулы I по п.1,отличающиеся тем, что R3 обозначает С 1 С 5 перфторалкильную группу. 6. Соединения общей формулы I по п.1,отличающиеся тем, что А представляет собой бензольное, нафталиновое либо тиофеновое кольцо, которое необязательно замещено одним или несколькими остатками, выбранными из атомов фтора, атомов хлора, атомов брома, метильных групп, этильных групп, виниловых групп, гидроксигрупп, метоксигрупп и этоксигрупп. 7. Соединения общей формулы I по п.1,отличающиеся тем, что X3a обозначает атом водорода или С 1-С 5 алкильную группу. 8. Соединения общей формулы I по п.1,отличающиеся тем, что X3a и X3b являются одинаковыми или различными и обозначают атом водорода или С 1-С 5 алкильную группу. 9. Соединения общей формулы I по п.1,отличающиеся тем, что X4, X6 и X7 являются одинаковыми или различными и независимо друг от друга обозначают атом водорода или атом галогена. 41 10. Соединения общей формулы I по п.1,отличающиеся тем, что Y4 обозначает С 1-С 5 алкильную группу или С 1-С 5 перфторалкильную группу. 11. Соединения общей формулы I по п.1,отличающиеся тем, что Y5, Y7 и Y8 являются одинаковыми или различными и независимо друг от друга обозначают атом водорода или атом галогена. 12. Соединения общей формулы I по п.1,отличающиеся тем, что R1 и R2 являются одинаковыми или различными и обозначают атом водорода, метильную либо этильную группу или же вместе с С-атомом цепи образуют циклопропильное кольцо, R3 обозначает С 1 С 5 перфторалкильную группу, А представляет собой бензольное, нафталиновое либо тиофеновое кольцо, которое необязательно замещено одним или несколькими остатками, выбранными из атомов фтора, атомов хлора, атомов брома, метильных групп, этильных групп, виниловых групп, гидроксигрупп, метоксигрупп и этоксигрупп, и либо X3a обозначает атом водорода или С 1-С 5 алкильную группу, либо X3a и X3b являются одинаковыми или различными и обозначают атом водорода или С 1-С 5 алкильную группу и X4, X6 и X7 являются одинаковыми или различными и независимо друг от друга обозначают атом водорода или атом галогена или Y4 обозначает С 1-С 5 алкильную группу или С 1 С 5 перфторалкильную группу и Y5, Y7 и Y8 являются одинаковыми или различными и независимо друг от друга обозначают атом водорода или атом галогена, а другие заместители имеют все указанные для формулы I значения. 13. Соединения общей формулы I по п.1,где Аr представляет собой кольцевую систему субформулы 6. 14. Соединения общей формулы I по п.1,где Аr представляет собой кольцевую систему субформулы 7. 15. Соединения общей формулы I по п.1,где Аr представляет собой кольцевую систему субформулы 10. 16. Соединения общей формулы I по п.1,гдe Аr представляет собой кольцевую систему субформулы 11. 17. Соединения общей формулы I по п.1, а именно 4-бром-5-(2-гидрокси-4-метил-4-фенил-2 трифторметилвалероиламино)фталид,6-бром-5-(2-гидрокси-4-метил-4-фенил-2 трифторметилвалероиламино)фталид,5-(2-гидрокси-4-метил-2-пентафторэтил-4 фенилвалероиламино)фталид,5-[2-гидрокси-4-(3-метоксифенил)-4 метил-2-трифторметилвалероиламино]фталид,5-[2-гидрокси-4-(4-метоксифенил)-4 метил-2-трифторметилвалероиламино]фталид,5-[2-гидрокси-4-(2-гидроксифенил)-4 метил-2-трифторметилвалероиламино]фталид, 004306 6-(2-гидрокси-4-метил-4-фенил-2-трифторметилвалероиламино)-4-метил-2,3-бензоксазин-1-он,6-(2-гидрокси-4-метил-4-фенил-2-трифторметилвалероиламино)-4-трифторметил-2,3 бензоксазин-1-он,4-этил-6-(2-гидрокси-4-фенил-2-трифторметилпентиламино)-2,3-бензоксазин-1-он,4-этил-6-[2-гидрокси-4-(2-метоксифенил)4-метил-2-трифторметилвалероиламино]-2,3 бензоксазин-1-он,6-[2-гидрокси-4-(2-метоксифенил)-4 метил-2-трифторметилвалероиламино]-4-метил 2,3-бензоксазин-1-он,4-этил-6-[2-гидрокси-4-метил-4-(4-метилфенил)-2-трифторметилвалероиламино]-2,3 бензоксазин-1-он,6-[4-(4-бромфенил)-2-гидрокси-4-метил-2 трифторметилвалероиламино]-4-этил-2,3 бензоксазин-1-он,4-этил-6-[4-(5-фтор-2-метоксифенил)-2 гидрокси-4-метил-2-трифторметилвалероиламино]-2,3-бензоксазин-1-он,6-[4-(5-фтор-2-метоксифенил)-2-гидрокси 4-метил-2-трифторметилвалероиламино]-4 метил-2,3-бензоксазин-1-он,1-(4-нитро-3-трифторметиланилино)-4 фенил-2-трифторметил-2-пентанол,5-(2-гидрокси-4,4-диметил-2-трифторметил-5-гексеноиламино)фталид,5-[2-гидрокси-3-(1-фенилциклопропил)-2 трифторметилпропиониламино]фталид,5-[2-гидрокси-3-(1-фенилциклобутил)-2 трифторметилпропиониламино]фталид,5-[2-гидрокси-3-(1-фенилциклогексил)-2 трифторметилпропиониламино]фталид,6-(2-гидрокси-2,4-диметил-4-фенилвалероиламино)-4-метил-2,3-бензоксазин-1-он,5-[4-(3-хлор-4-метоксифенил)-2-гидрокси 4-метил-2-трифторметилвалероиламино]фталид. 18. Соединения общей формулы I по п.1, а именно соединения формулы 19. Соединения общей формулы I по п.1, а именно соединения формулы 20. Соединения общей формулы I по п.1, а именно соединения формулы 21. Соединения общей формулы I по п.1, а именно соединения формулы 23. Соединения общей формулы I по п.1, а именно соединения формулы 24. Соединения общей формулы I по п.1, а именно соединения формулы 22. Соединения общей формулы I по п.1, а именно соединения формулы 25. Соединения общей формулы I по п.1, а именно соединения формулы Изомерия рацемат рацемат рацемат рацемат рацемат 26. Соединения общей формулы I по п.1, а именно соединения формулы 48 27. Фармацевтические препараты, содержащие по меньшей мере одно соединение общей формулы I по п.1, а также фармацевтически приемлемый носитель. 28. Применение соединений общей формулы I по п.1 для изготовления фармацевтических препаратов. 29. Способ получения соединений общей формулы I где А, В, Аr, R1, R2, а также R3 имеют указанные в п.1 значения, отличающийся тем, что карбонильное соединение общей формулы II где где А, В, Аr, R1 и R2 имеют указанные для формулы I значения, подвергают взаимодействию с соединением общей формулы R3-SiMe3, где R3 имеет указанные для общей формулы I значения, в присутствии катализатора или с алкилметаллическим соединением, например, реагентом Гриньяра или литийалкилом, с получением соединения общей формулы I. 30. Способ по п.29, отличающийся тем, что катализатором служит фторидная соль или карбонат щелочного металла. 31. Способ получения соединений общей формулы I где А, В, Аr, R1, R2, а также R3 имеют указанные в п.1 значения, отличающийся тем, что соединение общей формулы III где А, В, R1, R2 и R3 имеют указанные для общей формулы I значения, a FG означает уходящую группу, подвергают взаимодействию с соединением формулы Ar-NH-R11, где R11 обозначает атом водорода или С 1-С 5 алканоильную группу, а Аr имеет указанные для общей формулы I значения, и затем при необходимости отщепляют остаток R11. 32. Способ по п.31, отличающийся тем, что уходящая группа FG в соединении общей формулы III представляет собой атом хлора, брома либо иода, тозилатный либо мезилатный остаток или С 1-С 4 перфторалкилсульфонилоксиостаток. Евразийская патентная организация, ЕАПВ Россия, 109012, Москва, Малый Черкасский пер., 2/6
МПК / Метки
МПК: C07C 235/26, A61K 31/41, C07D 249/18, A61P 15/00
Метки: ациланилиды, действием, андрогенным, гетеро)циклически, обладающие, смешанным, гестагенным, нестероидные, замещенные
Код ссылки
<a href="https://eas.patents.su/26-4306-nesteroidnye-geterociklicheski-zameshhennye-acilanilidy-obladayushhie-smeshannym-gestagennym-i-androgennym-dejjstviem.html" rel="bookmark" title="База патентов Евразийского Союза">Нестероидные (гетеро)циклически замещенные ациланилиды, обладающие смешанным гестагенным и андрогенным действием</a>
Предыдущий патент: Применение регулятора роста растений на основе семикарбазона для раннего останавливания роста культурных растений
Следующий патент: Высокоэффективные композиции, содержащие дигидроэрготамин
Случайный патент: Способ приготовления композиции из лекарственных трав с маскированным горьким вкусом и композиция, полученная по этому способу