Соединение для лечения инфекционных заболеваний, соответствующий способ и фармацевтическая композиция, содержащая указанное соединение
Формула / Реферат
1. Соединение общей формулы (I)
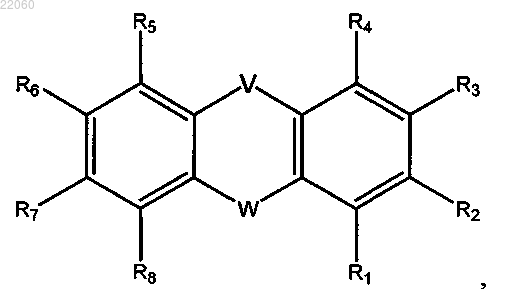
где V представляет собой S;
W представляет собой C=CH-(CHX)n-CX(R9)(R10) или W представляет собой C=CH-(CHX)n-1-CH=C(R9)(R10);
n представляет собой целое число в диапазоне от 1 до 5;
каждый X отдельно выбран из группы, включающей водород, галоген, гидрокси, амино, нитро, C1-6-алкил и C1-6-алкокси;
R1, R3, R4, R5, R6, R7 и R8 представляют собой водород;
R2 выбран из группы, включающей F, Cl, Br, I, CH2Y, CHY2 и CY3, где Y представляет собой атом галогена; и
R9 и R10 вместе с атомом углерода, к которому они присоединены, образуют С3-6-циклоалкил или С3-6-гетероциклил, выбранный из группы, включающей пиперидинил, пиперазинил, возможно замещенный галогеном, гидрокси, амино, нитро или С1-6алкилом, замещенным гидроксигруппой;
а также его соли.
2. Соединение по п.1, где n равно 2, 3 или 4.
3. Соединение общей формулы

где V представляет собой S;
W' представляет собой С=СН;
n представляет собой целое число в диапазоне от 1 до 6;
каждый X отдельно выбран из группы, включающей водород, галоген, гидрокси, амино, нитро, C1-6-алкил и C1-6-алкокси;
Z выбрано из С или N;
R1, R3, R4, R5, R6, R7, R8, R11, R12, R14 и R15 представляют собой водород;
R2 выбран из группы, включающей F, Cl, Br, I, CH2Y, CHY2 и CY3, где Y представляет собой атом галогена; и
R13 представляет собой водород, галоген, гидрокси, амино, нитро или C1-6-алкил, замещенный гидроксигруппой;
или его соль.
4. Применение соединения по любому из пп.1-3 в лечении инфекционной болезни.
5. Применение по п.4, где лечение инфекционной болезни осуществляют в комбинации с дополнительным противоинфекционным средством.
6. Применение по любому из пп.4, 5, где инфекционная болезнь вызывается устойчивым к лекарству инфекционным агентом.
7. Применение соединения по любому из пп.1-3 для получения лекарства для лечения или профилактики инфекционной болезни.
8. Способ лечения или предотвращения инфекционной болезни у субъекта, причем при указанном способе вводят указанному субъекту соединение по любому из пп.1-3 в клинически релевантном количестве.
9. Фармацевтическая композиция для лечения или предупреждения инфекционной болезни, включающая соединение по любому из пп.1-3 и по меньшей мере один фармацевтически приемлемый носитель или наполнитель.
10. Фармацевтическая композиция по п.9, содержащая клинически релевантное количество соединения по любому из пп.1-3.
Текст
СОЕДИНЕНИЕ ДЛЯ ЛЕЧЕНИЯ ИНФЕКЦИОННЫХ ЗАБОЛЕВАНИЙ,СООТВЕТСТВУЮЩИЙ СПОСОБ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ,СОДЕРЖАЩАЯ УКАЗАННОЕ СОЕДИНЕНИЕ Изобретение направлено на определенные тиоксантеновые производные формулы (I), где все заместители раскрыты в формуле изобретения, приемлемые для применения в качестве противоинфекционных средств, в частности, для лечения инфекционных болезней. Кроме того, данное изобретение касается композиций, включающих указанные противоинфекционные средства. Гиверкман Биргит Кджэлдгаард (DK) Носырева Е.Л. (RU)(71)(73) Заявитель и патентовладелец: БКГ ФАРМА АПС (DK) Область изобретения Данное изобретение относится к противоинфекционным средствам, в частности тиоксантеновым и фенотиазиновым производным, а также их применению для лечения инфекционных болезней. Кроме того, данное изобретение относится к применению соединений по данному изобретению в качестве хемосенсибилизирующих соединений. Предпосылки Лечение инфекционных болезней является основной клинической задачей во всем мире. Поскольку инфекционные агенты становятся устойчивыми к все большему количеству соединений антибиотиков, то основной задачей в данной области техники является разработка новых и более эффективных противоинфекционных средств. Устойчивость к химиотерапии является общей клинической проблемой у пациентов с инфекционными болезнями. Во время лечения инфекций мишени лекарственного средства клетки прокариотических или эукариотических микроорганизмов, как выяснили, часто являются нечувствительными к ряду лекарственных средств, которые имеют различное строение и функции. Это явление назвали множественной лекарственной устойчивостью (MDR). Частота устойчивости к нескольким противомикробным средствам у бактерий, которые вызывают инфекции в больницах/отделениях интенсивной терапии, повышается, и обычным становится обнаружение микроорганизмов, чувствительных к более чем 10 различным антибиотикам. Примеры таких устойчивых бактерий включают метициллин-устойчивые и метициллин-ванкомицин-устойчивые Staphylococcus aureus; ванкомицин-устойчивые энтерококки, такие как Enterococcus faecalis и Enterococcus faecium; пенициллин-устойчивые Streptococcus pneumoniae, и цефалоспорин- и хинолон-устойчивые грамотрицательные палочки (колиформы), такие как виды Е. coli, Salmonella, Klebsiella pneumoniae, виды Pseudomonas и виды Enterobacter. Совсем недавно появились устойчивые ко всем антибиотикам грамотрицательные и грамположительные бациллы. Скорость появления таких бактерий с устойчивостью к нескольким антибиотикам не соответствует скорости разработки новых антибиотиков, и поэтому возможно, что пациенты с серьезными инфекциями скоро не будут поддаваться лечению имеющимися в настоящее время противоинфекционными средствами. Некоторые международные сообщения осветили потенциальные проблемы, связанные с появлением противомикробной устойчивости во многих областях медицины, а также описали трудности лечения пациентов с инфекциями, вызванными этими микроорганизмами. Хотя большинство стойких микроорганизмов присутствуют в больницах, штаммы устойчивых к нескольким лекарственным средствам бактерий, таких как Streptococcus pneumoniae и Mycobacteriumtuberculosis, также вызывают тяжелые внебольничные инфекции. Распространенность устойчивой к лекарственному средству Streptococcus pneumoniae возросла в 60 раз с 1980 с 51% и 8% изолятов, демонстрирующих среднюю или высокую устойчивость к пенициллину или цефалоспоринам третьего поколения, соответственно. Таким образом, становится сложнее лечить пневмококковую пневмонию противоинфекционными средствами первой линии. Устойчивые бактерии из больниц могут быть переданы населению пациентами, пришедшими при продолжительном лечении домой, например, устойчивые к нескольким лекарственным средствам Staphylococcus aureus и ванкомицин-устойчивые энтерококки. Фенотиазины и тиоксантены применяются клинически как нейролептические и противорвотные средства. Фенотиазины и структурально родственные антипсихотические средства ингибируют некоторые клеточные ферменты и блокируют функцию важных клеточных рецепторов. Экстрапирамидные побочные эффекты, связанные с антипсихотической терапией, объясняются связыванием допаминового рецептора. В целом оказалось, что такие экстрапирамидные побочные эффекты были ограничены в клинических испытаниях с помощью фенотиазинов и тиоксантенов в непсихических областях, таких как лечение рака. Релевантные уровни в сыворотке фенотиазинов и тиоксантенов в основном находятся в диапазоне от примерно 0,3 мкг/л до 0,5 мг/л (от 0,3 нг/мл до 0,5 мкг/мл) с тем, чтобы избежать возможных побочных эффектов. Как показали, фенотиазины и тиоксантены обладают умеренной, но широкой, противомикробной активностью. MIC (минимальная концентрация соединения, при которой подавляются инфекционные агенты) обычно выше клинически релевантных концентраций, поскольку раскрытые минимальные эффективные концентрации in vitro составляют на уровне от примерно 20 мг/л до нескольких сотен мг/л. Хотя механизм, которым фенотиазины модулируют MDR, еще не ясен, предположили, что их фармакологические свойства могут быть опосредованы, по меньшей мере, частично, ингибированием выкачивающих насосов. Кроме того, прометазин был признан эффективным противоплазмидным средством в культурах, содержащих виды бактерий, таких как Escherichia coli, Yersinia enterocolitica, Staphylococcusaureus и Agrobacterium tumefaciens. Однако применяемые концентрации обычно много выше клинически релевантных концентраций. Недавно было показано, что определенные производные фенотиазина и тиоксантена, применяемые как противоинфекционные соединения, эффективны при уничтожении возбудителей инфекции, таких как устойчивые к нескольким лекарственным средствам возбудители инфекции, даже при клинически релевантных концентрациях, когда применяются в комбинации с противоинфекционным средством. Соответственно, WO2005/105145 А раскрывает применение конкретных производных тиоксантена и производных фенотиазина в качестве хемосенсибилизирующих соединений. Хемосенсибилизирующими соединениями являются противоинфекционные соединения для лечения инфекционной болезни в сочетании с противоинфекционным средством. Все раскрытые производные имеют азотсодержащий заместитель на тиоксантеновом или фенотиазиновом остове. Решаемая проблема по данному раскрытию касается комбинационного лечения инфекционных болезней и не раскрывает идею того, что раскрытые соединения приемлемы для введения как отдельные противобактериальные средства, а скорее раскрытые соединения приемлемы для комбинационного лечения, где другое антибиотическое средство применяется одновременно в комбинации с раскрытыми соединениями. Соединения по данному изобретению отличаются от соединений по WO2005/105145 А, например, в замене N на С в атоме, соединяющем заместители R9 и R10 согласно данному изобретению.WO2008/080408 А раскрывает неожиданное открытие того, что подгруппа соединений, раскрытых в WO2005/105145 А, может, на самом деле, быть пригодной в качестве одиночных противобактериальных средств. Данное открытие является неожиданным, поскольку полагалось, что функция соединений по WO2005/105145 А в качестве хемосенсибилизирующих соединений состояла в обращении устойчивости против одного или нескольких противоинфекционных средств. Патентный документ ЕР-А-0338532 раскрывает применение клопентиксола среди других соединений в качестве противопротозойного средства.Kolaczkowski M et al., International Journal of Antimicrobial Agents (2003) Vol. 2, No. 3 раскрывает транс-флупентиоксол среди ряда соединений в качестве модуляторов дрожжей с устойчивостью к нескольким лекарственным средствам (множественной лекарственной устойчивости у дрожжей).Kristensen et al., International Journal of Antimicrobial Agents (2000) Vol. 14, No. 3 раскрывает цис- и транс-флупентиксол как ингибиторы ВИЧ. Ясно, что повышение устойчивости к противоинфекционным средствам, таким как антибиотики,представляет главное препятствие в лечении инфекций. Таким образом, существует насущная потребность в новых противоинфекционных средствах. Также существует необходимость в соединениях, ингибирующих и обращающих лекарственную устойчивость и развитие лекарственной устойчивости у инфекционных агентов. Целью данного изобретения является обеспечение противоинфекционных средств, способных убить или ингибировать рост клинически релевантных микроорганизмов, особенно устойчивых, включая устойчивые к нескольким лекарственным средствам, клеток или микроорганизмов введением клинически релевантных количеств таких противоинфекционных средств субъекту, нуждающемуся в этом. Кроме того, целью данного изобретения было обеспечение хемосенсибилизирующих средств, способных в комбинации с дополнительным противоинфекционным средством убить или ингибировать рост клинически релевантных микроорганизмов, особенно устойчивых, включая устойчивые к нескольким лекарственным средствам, клеток или микроорганизмов введением клинически релевантных количеств таких противоинфекционных средств субъекту, нуждающемуся в этом. Описание изобретения Неожиданно было обнаружено, что определенные новые тиоксантеновые и фенотиазиновые соединения, альтернативные соединениям, раскрытым в WO2005/105145 А, также являются пригодными и даже более того для применения при лечении инфекционных болезней. Обнаружили, что с применением клинически релевантных количеств новых противоинфекционных средств, описанных здесь, достигается эффективное уничтожение микроорганизмов, включая устойчивые или устойчивые к нескольким лекарственным средствам клинически релевантные изоляты. Вопреки существующему мнению, это открытие делает возможной эффективную борьбу с микроорганизмами с помощью применения противоинфекционных средств, описанных здесь, в качестве одиночного противоинфекционного средства. Кроме того, было показано, что соединения по данному изобретению являются пригодными в качестве хемосенсибилизирующих соединений. Следовательно, в первом аспекте данное изобретение касается соединения общей формулы (I)n представляет собой целое число в диапазоне от 1 до 5; каждый X отдельно выбран из группы, включающей водород, галоген, гидрокси, амино, нитро, C1-6 алкил и C1-6-алкокси;R2 выбран из группы, включающей F, Cl, Br, I, CH2Y, CHY2 и CY3, где Y представляет собой атом галогена; и С 3-6-гетероциклил, выбранный из группы, включающей пиперидинил, пиперазинил, возможно замещенный галогеном, гидрокси, амино, нитро или C1-6 алкилом, замещенным гидроксигруппой; или его соли. В предпочтительном аспекте данное изобретение касается противоинфекционного средства общей формулы (II)n представляет собой целое число в диапазоне от 1 до 6; каждый X отдельно выбран из группы, включающей водород, галоген, гидрокси, амино, нитро, C1-6 алкил и C1-6-алкокси;R2 выбран из группы, включающей F, Cl, Br, I, CH2Y, CHY2 и CY3, где Y представляет собой атом галогена; иR13 представляет собой водород, галоген, гидрокси, амино, нитро или C1-6-алкил, замещенный гидроксигруппой; или его соль. Как будет сразу очевидно для специалиста, атомы углерода в (СНХ)n цепи, связывающей фенотиазиновый или тиоксантеновый остов с группой, включающей R9 и R10 или 6-членным гетероциклилом,показанным в формуле II, вместе с атомом углерода, к которому они присоединены, могут соединяться посредством двойных связей вместо одинарных связей (за счет 2 ХН) в соответствующем случае, без отступления, при этом, от изобретательского объема данного изобретения. Соединения по данному изобретению представляют собой противоинфекционные средства. Они пригодны для лечения или профилактики инфекционной болезни. Их также можно применять для получения лекарства для лечения или профилактики инфекционной болезни. Их можно применять в качестве одиночного активного ингредиента. Их также можно применять в качестве противовоспалительного активного ингредиента в комбинации с другим противовоспалительным средством. Их также можно применять в качестве хемосенсибилизирующих соединений в комбинации с другим противовоспалительным средством. В одном предпочтительном аспекте данное изобретение касается противоинфекционного средства формулы В другом предпочтительном аспекте данное изобретение касается противоинфекционного средства формулы Другой аспект данного изобретения будет очевиден из описания ниже и приложенной формулы изобретения. Детальное описание изобретения Определения В данном контексте выражение "C1-6-алкил" означает группу линейного или разветвленного насыщенного углеводорода, имеющую от одного до шести атомов углерода, такую как метил, этил, н-пропил,изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, н-пентил, изопентил, неопентил и н-гексил. В данном контексте выражение "С 3-6-циклоалкил" охватывает трех-, четырех-, пяти- и шестичленные кольца, включающие только атомы углерода, тогда как выражение "гетероциклил" означает трех-,четырех-, пяти- и шестичленные кольца, где атомы углерода вместе с 1-3 гетероатомами составляют указанное кольцо. Гетероатомы независимо выбраны из кислорода, серы и азота. Кольца С 3-6-циклоалкила и гетероциклила могут необязательно содержать одну или несколько ненасыщенных связей, расположенных таким образом, что не возникает ароматическая -электронная система. Иллюстративными примерами "C3-6-циклоалкила" являются карбоциклы циклопропан, циклобутан,циклопентан, циклопентен, циклопентадиен, никлогексан, циклогексен, 1,3-циклогексадиен и 1,4 циклогексадиен. Иллюстративными примерами "гетероциклилов" являются содержащие азот гетероциклы 2 пирролинил, 3-пирролинил, пирролидинил, 2-имидазолинил, имидазолидинил, 2-пиразолинил, 3 пиразолинил, пиразолидинил, пиперидинил, морфолинил, тиоморфолинил и пиперазинил. Связывание с гетероциклом может быть в положении гетероатома или через атом углерода гетероцикла. В данном контексте выражение "С 2-6-алкенил" означает линейную или разветвленную углеводородную группу, имеющую от двух до шести атомов углерода и содержащую одну или несколько двойных связей. Иллюстративные примеры С 2-6-алкенильных групп включают аллил, гомоаллил, винил, кротил,бутенил, пентенил и гексенил. Иллюстративные примеры С 2-6-алкенильных групп с более чем одной двойной связью включают бутадиенил, пентадиенил и гексадиенил. Положение двойной связи(ей) может быть любым положением вдоль углеродной цепи. В данном контексте выражение "С 2-6-алкинил" означает линейную или разветвленную углеводородную группу, содержащую от двух до шести атомов углерода и содержащую одну или несколько тройных связей. Иллюстративные примеры С 2-6-алкинильных групп включают ацетилен, пропинил, бутинил, пентинил и гексинил. Положение тройной связи(ей) может быть любым положением вдоль углеродной цепи. Более чем одна связь может быть ненасыщенной, так что "С 2-6-алкинил" является диин или энедиин, как известно специалисту в данной области. Применяемое здесь выражение "С 1-6-алкокси" означает C1-6-алкилокси, такие как метокси, этокси,н-пропокси, изопропокси, н-бутокси, изобутокси, втор-бутокси, трет-бутокси, н-пентокси, изопентокси,неопентокси и н-гексокси. Выражение "галоген" включает фтор, хлор, бром и йод. В данном контексте выражение "арил" означает карбоциклическое ароматическое кольцо или систему колец. Более того, выражение "арил" включает конденсированные кольцевые системы, где по меньшей мере два арильных кольца, или по меньшей мере один арил и по меньшей мере один С 3-6 циклоалкил, или по меньшей мере один арил и по меньшей мере один гетероциклил участвуют по меньшей мере в одной химической связи. Иллюстративные примеры "арильных" колец включают фенил,нафталенил, фенантренил, антраценил, аценафтиленил, тетралинил, фторенил, инденил, индолил, кумаранил, кумаринил, хроманил, изохроманил и азуленил. В данном контексте выражение "гетероарил" означает арильную группу, где один или несколько атомов углерода в ароматическом кольце замещены одним или несколькими гетероатомами, выбранными из группы, включающей азот, серу, фосфор и кислород. Кроме того, в данном контексте выражение"гетероарил" включает конденсированные кольцевые системы, где по меньшей мере одно арильное кольцо и по меньшей мере одно гетероарильное кольцо, по меньшей мере два гетероарила, по меньшей мере один гетероарил и по меньшей мере один гетероциклил, или по меньшей мере один гетероарил и по меньшей мере один С 3-6-циклоалкил участвуют по меньшей мере в одной химической связи. Иллюстративные примеры гетероарила включают фуранил, тиенил, пирролил, феноксазонил, осказолил, тиазолил, изотиазолил, имидазолил, пиразолил, изоксазолил, имидазолил, изотиазолил, оксадиазолил, фуразанил, тиазолил, тиадиазолил, пиперидинил, пиридинил, пиридазинил, пиримидинил, пиразинил, пиразолил, триазинил, изоиндолил, индолинил, бензофуранил, бензотиофенил, бензопиразолил,индазолил, бензимидазолил, бензтиазолил, пиринил, хинолизинил, хинолинил, изохинолинил, циннолинил, фталазинил, хиназолинил, хиноксалинил, нафтиридинил, птеридинилтиенофуранил, карбазолил,акридинил, феназинил, фенотиазинил, феноксазинил и тиантренил. В данном контексте выражение "необязательно замещенный" означает, что рассматриваемая группа может быть замещена один или несколько раз, например 1-5 раз, предпочтительно 1-3 раза, наиболее предпочтительно 1-2 раза, одной или несколькими группами, выбранными из группы, включающей С 1-6 алкил, С 1-6-алкокси, оксо (которая может быть представлена в таутомерной енольной форме), карбоксил,амино, гидрокси (которая, когда присутствует в енольной системе, может быть представлена в таутомерной кето форме), нитро, сульфоно, сульфанил, C1-6-карбоксил, С 1-6-алкоксикарбонил, С 1-6-алкилкарбонил,формил, арил, арилокси, арилоксикарбонил, арилкарбонил, гетероарил, амино, моно- и ди(С 1-6-4 022060 алкил)амино, карбамоил, моно- и ди(С 1-6-алкил)аминокарбонил, амино-С 1-6-алкиламинокарбонил, монои ди(С 1-6-алкил)амино-С 1-6-алкиламинокарбонил, С 1-6-алкилкарбониламино, циано, гуанидино, карбамидо, C1-6-алканоилокси, C1-6-алкилсульфонилокси, дигалоген-С 1-6-алкил, тригалоген-С 1-6-алкил и галоген,где арил и гетероарил заместители сами могут быть замещены 1-3 раза C1-6-алкилом, C1-6-алкокси, нитро,циано, гидрокси, амино или галогеном. Обычно, вышеуказанные заместители могут быть дополнительно необязательно замещены. Выражение "возбудитель инфекции" означает патогенные микроорганизмы, такие как бактерии,вирусы, грибы и внутри- или экстраклеточные паразиты. В предпочтительном аспекте данного изобретения выражение "возбудитель инфекции" означает патогенные микроорганизмы, такие как бактерии, грибы и вирусы. В более предпочтительном аспекте данного изобретения выражение "возбудитель инфекции" означает только патогенные бактерии, грибы и вирусы. В еще более предпочтительном аспекте данного изобретения выражение "возбудитель инфекции" означает только патогенные бактерии, грибы и вирусы. В одном аспекте данного изобретения выражение "возбудитель инфекции" означает только патогенные бактерии. В одном аспекте данного изобретения выражение "возбудитель инфекции" означает только патогенные грибы. В одном аспекте данного изобретения выражение "возбудитель инфекции" означает только патогенные вирусы. Аналогично, выражение "инфекционная болезнь" применяется к болезни, вызванной возбудителем инфекции. В данном контексте выражение "противоинфекционное средство" охватывает средства, способные убить, ингибировать или иным путем замедлить рост возбудителя инфекции. В предпочтительном аспекте данного изобретения выражение "противоинфекционное средство" охватывает средства, которые способны убивать, ингибировать или другим образом замедлять рост инфекционного агента при введении субъекту в количествах, которые не превышают 50 мг/л. Предпочтительно противоинфекционное средство вводят субъекту в количествах, которые не превышают 20 мг/л. Выражение "противоинфекционное средство", таким образом, охватывает средства, которые показывают значение MIC, равное или меньшее 20 мкг/мл, при определении, как описано здесь в примерах. Выражение "противоинфекционное средство" можно применять взаимозаменяемо с выражением "антибиотик", или "противовирусное средство",или "противогрибковое средство" в зависимости от природы возбудителя инфекции. Специфические примеры антибиотиков, обычно применяемых для лечения бактериальных и грибковых инфекций, включают, но не ограничиваются, аминогликозиды, такие как амикацин, гентамицин, канамицин, неомицин,нетилмицин, стрептомицин и тобрамицин; кабецефемы, такие как лоракарбеф; карбапенемы, такие как эртапенем, имипенем/циластатин и меропенем; цефалоспорины, такие как цефадроксил, цефазолин, цефалексин, цефаклор, цефамандол, цефалексин, цефокситин, цефпрозил, цефуроксим, цефиксим, цефдинир, цефдиторен, цефоперазон, цефотаксим, цефподоксим, цефтазидин, цефтибутен, цефтизоксим, цефтриаксон и цефепим; макролиды, такие как азитромицин, кларитромицин, диритромицин, эритромицин и тролеандомицин; монобактам; пенициллины, такие как амоксициллин, ампициллин, карбенициллин,клоксациллин, диклоксациллин, нафциллин, оксациллин, пенициллин G, пенициллин V, пиперациллин и тикарциллин; полипептиды, такие как бацитрацин, колистин и полимиксин В; хинолоны, такие как ципрофлоксацин, эноксацин, гатифлоксацин, левофлоксацин, ломефлоксацин, моксифлоксацин, норфлоксацин, офлоксацин и тровафлоксацин; сульфонамиды, такие как мафенид, сульфацетамид, сульфаметизол, сульфосалазин, сульфисоксазол и триметопримсульфаметоксазол; тетрациклины, такие как демеклоциклин, доксициклин, миноциклин, окситетрациклин и тетрациклин. В данном контексте выражение "хемосенсибилизирующее соединение" охватывает соединения, которые имеют синергический эффект при убийстве, ингибировании или замедлении другим образом роста инфекционного агента при применении вместе или в комбинации с противоинфекционным средством. При использовании в данном контексте выражения "вместе с" и "в комбинации с" не следует интерпретировать в узком смысле, что хемосенсибилизирующее соединение и противоинфекционное средство обязательно следует вводить одновременно, и/или что они образуют часть одной и той же фармацевтической композиции, хотя это является одним из вариантов осуществления данного изобретения. Синергический эффект по данному изобретению получают, если указатели фракционной ингибирующей концентрации (FIC) ниже 0,5. Показатель фракционной ингибирующей концентрации (FIC) рассчитывают для каждого соединения, как описано в WO2005/105145. Специфические примеры противовирусных средств, обычно применяемых для лечения вирусных инфекций, включают, но не ограничиваются, ацикловир, амантадин, цидофовир, фамцикловир, фомивирсен, фоскарнет, ганцикловир, интерферон альфа, осельтамивир, пенцикловир, рибавирин, римантадин, трифлуридин, валацикловир, валганцикловир, видарабин и занамивир. Специфические примеры противогрибковых средств, обычно применяемых для лечения тяжелых грибковых инфекций, включают, но не ограничиваются, амфотерицин В, каспофунгин, флуконазол, флуцитозин, итраконазол, кетоконазол и вориконазол. В данном контексте возбудитель инфекции является "устойчивым" или "устойчивым к лекарственному средству", если возбудитель инфекции претерпел изменение, которое снижает или элиминирует эффективность противоинфекционного средства, обычно применяемого для лечения инфекций, вызван-5 022060 ных возбудителем инфекции. Аналогично, выражение "лекарственная устойчивость" означает случай,когда болезнь, например инфекционная болезнь, не отвечает на терапевтическое средство, такое как противоинфекционное средство. Лекарственная устойчивость может быть свойственной, означающей, что болезнь никогда не отвечала на терапевтическое средство, или приобретенной, означающей, что болезнь прекращает отвечать на терапевтическое средство, на которое ранее она отвечала. В данном контексте возбудитель инфекции является "устойчивым к нескольким лекарственным средствам", если возбудитель инфекции претерпел изменение, которое снижает или элиминирует эффективность двух или нескольких противоинфекционных средств, которые обычно применяются для лечения инфекций, вызываемых возбудителем инфекции. Аналогично, "устойчивость к нескольким лекарственным средствам" является типом лекарственной устойчивости, где болезнь, например инфекционная болезнь, устойчива к ряду лекарственных средств, таком как ряд противоинфекционных средств. Выражение "клинически релевантное количество" означает, что противоинфекционное средство вводится пациенту в количестве, которое, с одной стороны, способно ослабить симптомы инфекционной болезни или лечить инфекционную болезнь пациента, но, с другой стороны, является нетоксичным для пациента и не приводит к неприемлемым побочным эффектам. Как определено выше, многие, если не все, из противоинфекционных средств, описанных здесь, как известно, вызывают тяжелые побочные эффекты у пациентов, когда вводятся в слишком высоких концентрациях, т.е. в количествах, которые не являются "клинически релевантными". В данном контексте выражение "натуральное происхождение", когда используется применительно к выражению "возбудитель инфекции", т.е. применительно к патогенным микроорганизмам, означает,что возбудитель инфекции, вызывающий инфекционную болезнь, является микроорганизмом, который можно обнаружить в природе, включая человека. Будет подразумеваться, что возбудители инфекции,такие как ген-манипулированные лабораторные штаммы, или возбудители инфекции, которые были изменены другими средствами и/или манипулированные человеческим вмешательством, не охвачены выражением "натуральное происхождение". Выражение "сыворотка" применяется в ее обычном значении, т. е. как плазма крови без фибриногена и других факторов свертывания крови. В данном документе выражение "стабильная концентрация в сыворотке" (противоинфекционного средства) подразумевает такие значения свободного несвязанного лекарственного средства, которые снова возникают с каждой дозой и находятся в состоянии равновесия между количеством вводимого противоинфекционного средства и количеством, выведенным в данный интервал времени. Выражение"стабильная концентрация в сыворотке", как подразумевают, таким образом означает концентрацию свободного, несвязанного соединения (противоинфекционного средства) в сыворотке. Это означает, что концентрацию определяют, исключая соединения, которые связаны с компонентами сыворотки (например, белками). В данном контексте выражение "лечение" касается введения лекарственного средства субъекту и включает i) предотвращение инфекционной болезни (т. е. причинные клинические симптомы инфекционной болезни не развиваются), ii) ингибирование инфекционной болезни (т. е. задержка развития клинических симптомов инфекционной болезни) и iii) облегчение болезни (т. е. обеспечение регрессии клинических симптомов инфекционной болезни), а также их комбинации. Выражения "профилактика" или "профилактическое лечение" касается лечения субъекта, который не инфицирован, но который может быть восприимчивым или подвергаться риску инфицирования. Выражение "субъект", как применяется здесь, означает живое позвоночное животное, например млекопитающее, такое как человек."Фармацевтически приемлемый" означает приемлемый для применения для млекопитающего, в частности приемлемый для применения для человека. Противоинфекционные средства В отношении общих формул, приведенных выше, заместители R1, R2, R3, R4, R5, R6, R7, R8, R11, R12,R14 и R15 каждый отдельно выбран из группы, включающей водород, галоген, гидрокси, амино, нитро,необязательно замещенный C1-6-алкил, необязательно замещенный С 2-6-алкенил, необязательно замещенный C2-6-алкинил и необязательно замещенный C1-6-алкокси, необязательно замещенный C2-6 алкенилокси, карбокси, необязательно замещенный C1-6-алкоксикарбонил, необязательно замещенныйR13 представляет собой водород, галоген, гидрокси, амино, нитро, необязательно замещенный C1-6 алкил или необязательно замещенный C1-6-алкокси. Предпочтительно R13 выбран из группы, включающей водород, галоген, гидрокси, амино, нитро и необязательно замещенный C1-6-алкил. Более предпочтительно R13 представляет собой водород, гидрокси, амино, нитро, галоген, CH2Y, CHY2 и CY3, где каждый Y отдельно выбран из водорода, гидрокси,амино, нитро или галогена. В предпочтительном варианте осуществления данного изобретения R13 выбран из группы, включающей водород, СН 3 и СН 2 ОН. В более предпочтительном варианте осуществления данного изобретения R13 выбран из группы,включающей водород и СН 3. В наиболее предпочтительном варианте осуществления R13 представляет собой водород. В предпочтительном варианте осуществления данного изобретения R2 заместитель представляет собой электроноакцепторную группу, такую как галоген, нитро или галогензамещенный C1-6-алкил. Более предпочтительно R2 выбран из группы, включающей F, Cl, Br, I, CH2Y, CHY2 и CY3 (где Y представляет атом галогена), такой как CH2Cl, CH2F, CHCl2, CHF2, CCl3 или CF3, в частности CCl3 или CF3. Наиболее предпочтительно R2 представляет собой Cl или CF3. Заместители R1, R3, R4, R5, R6, R7, R8, R11, R12, R14 и R15 каждый отдельно предпочтительно выбран из группы, включающей водород, необязательно замещенный C1-6-алкил и необязательно замещенныйC1-6-алкокси. Более предпочтительно все из R1, R3, R4, R5, R6, R7, R8, R11, R12, R14 и R15 представляют собой водород. Соответственно, в наиболее предпочтительном варианте осуществления данного изобретения R2 представляет собой Cl или CF3, и каждый из R1, R3, R4, R5, R6, R7, R8, R11, R12, R14 и R15 представляет собой водород. Как упомянуто выше, V выбран из группы, включающей S, SO2, SO, О и NH, такие как S или SO. В наиболее предпочтительном варианте осуществления данного изобретения V представляет собой S. Как будет понятно, в случае если W представляет собой N-(CHX)m-CX(R9)(R10) или W представляет собой N-(CHX)m-1-CH=C(R9)(R10), и V представляет собой S, то противоинфекционное средство общей формулы (I) представляет собой фенотиазиновое производное. Таким образом, соединение по данному изобретению в одном аспекте представляет собой фенотиазиновое производное общей формулы (III): где m - целое число в диапазоне от 2 до 6, такое как 2, 3, 4, 5 или 6, и каждый X отдельно выбран из группы, включающей водород, галоген, гидрокси, амино, нитро, необязательно замещенный C1-6-алкил и необязательно замещенный С 1-6-алкокси. В предпочтительном варианте осуществления данного изобретения n равно 2 или 3, X представляет собой водород или СН 3, a R12 представляет собой водород или СН 3. В частности, если п равен 2, каждыйX представляет собой водород, a R12 представляет собой водород или СН 3, то средства общей формулы(III) показывают сильную противоинфекционную активность. Таким образом, в предпочтительном варианте осуществления данного изобретения W вместе с функциональной группой, присоединенной к нему,формирует алкильную цепь (N-(CHX)n-) с необязательно замещенной гетероциклильной группой. Гетероциклильная группа предпочтительно не замещена или замещена в пара положении (R13). В предпочтительном варианте осуществления W вместе с функциональной группой, присоединенной к нему, представляет собой N-(СН 2)3-4-метилпиперидинил, N-СН 2-СН(СН 3)-4-метилпиперидинил, N-(CH2)3 пиперидинил или N-СН 2-СН(СН 3)-4-метилпиперидинил. В частности, структура, где W вместе с функциональной группой, присоединенной к нему, представляет собой N-(СН 2)3-пиперидинил, предпочтительна. Специфические примеры вышеупомянутых фенотиазиновых производных включают производные перфеназина и прохлорперазина. Как будет также понятно, в случае если W представляет собой С=СН-(CHX)n-CX(R9)(R10), или W представляет собой N-C=CH-(CHX)n-1-CH=C(R9)(R10), и V представляет собой S, то соединение общей формулы (I) становится тиоксантеном общей формулы (IV) Фенотиазин общей формулы (III) и тиоксантен общей формулы (IV) дает начало цис- и транс-изомеризму. В настоящем контексте считается, что соединения общей формулы (IVa) находятся в цис конфигурации, при этом считается, что соединения общей формулы (IVb) находятся в транс-конфигурации: где n - целое число в диапазоне от 1 до 5, такое как 1, 2, 3, 4 или 5, и каждый X отдельно выбран из группы, включающей водород, галоген, гидрокси, амино, нитро, необязательно замещенный C1-6-алкил и необязательно замещенный C1-6-алкокси. R9 и R10 каждый независимо выбраны из группы, включающей водород, необязательно замещенный C1-6-алкил, необязательно замещенный C2-6-алкенил, необязательно замещенный C2-6-алкинил, необязательно замещенный C1-6-алкоксикарбонил, необязательно замещенныйC1-6-алкилкарбонил, необязательно замещенный арил, необязательно замещенный арилоксикарбонил,необязательно замещенный арилкарбонил, необязательно замещенный гетероарил, необязательно замещенный гетероарилоксикарбонил, необязательно замещенный гетероарилкарбонил, аминокарбонил, моно- и ди(C1-6-алкил)аминокарбонил; или R9 и R10 вместе с атомом углерода, к которому они присоединены, образуют необязательно замещенную арильную группу, циклоалкильную группу или гетероциклильную группу, предпочтительно необязательно замещенный С 3-6-циклоалкил, или С 3-6-гетероциклил, предпочтительно азотсодержащий гетероарил или необязательно замещенный азотсодержащий гетероциклил; В целом предпочтительно, что соединения данного изобретения имеют транс-конфигурацию, т. е. структуру, проиллюстрированную общей формулой (IVb). В предпочтительном варианте осуществления X представляет собой водород, а n равно 3-5, в частности 3 или 4. В предпочтительном варианте осуществления данного изобретения W имеет структуру С=СН-(СН 2)2-CX(R10)(R11). В другом варианте осуществления данного изобретения W имеет структуруC=CH-(CH2)3-CX(R10)(R11). В другом варианте осуществления данного изобретения W имеет структуруC=CH-(CH2)4-CX(R10)(R11). В другом варианте осуществления данного изобретения W имеет структуру С=СН-СН 2-CH=C(R10)(R11). В другом варианте осуществления данного изобретения W имеет структуруC=CH-(CH2)2-CH=C(R10)(R11). В другом варианте осуществления данного изобретения W имеет структуру С=СН-(СН 2)3-CH=C(R10)(R11). В одном интересном варианте осуществления данного изобретения каждый из R9 и R10 отдельно выбраны из группы, включающей водород и необязательно замещенный С 1-6-алкил. Согласно данному варианту осуществления предпочтительно, чтобы как R9, так и R10 представляли собой необязательно замещенный C1-6-алкил. Наиболее предпочтительно как R9, так и R10 представляют собой СН 3. В другом интересном варианте осуществления данного изобретения R9 и R10 вместе с атомом углерода, к которому они присоединены, образуют необязательно замещенный арил, необязательно замещенный С 3-6-циклоалкил или гетероциклил, такой как необязательно замещенный 2-пирролинил, необя-8 022060 зательно замещенный 3-пирролинил, необязательно замещенный пирролидинил, необязательно замещенный 2-имидазолинил, необязательно замещенный имидазолинил, необязательно замещенный 2 пиразолинил, необязательно замещенный 3-пиразолинил, необязательно замещенный пиразолидинил,необязательно замещенный пиперидинил, необязательно замещенный морфолинил, необязательно замещенный тиоморфолинил или необязательно замещенный пиперидинил. Предпочтительно R9 и R10 вместе с атомом углерода, к которому они присоединены, образуют необязательно замещенный азотсодержащий гетероарил или необязательно замещенный азотсодержащий гетероциклил, при этом атом азота отделен двумя атомами углерода от атома углерода, к которому присоединены R9 и R10. Согласно данному варианту осуществления предпочтительно, чтобы R9 и R10 вместе с атомом углерода, к которому они присоединены, образовывали необязательно замещенный пиперидинил или необязательно замещенный пиперазинил, в частности необязательно замещенный пиперидинил. Пиперидиниловое кольцо может быть незамещенным, но предпочтительно является замещенным посредством необязательно замещеннойC1-6 алкильной группы, в частности в пара-положении, т.е. необязательно замещенная C1-6 алкильная группа ковалентно присоединена к атому азота пиперидинилового кольца. В высоко предпочтительном варианте осуществления данного изобретения необязательно замещенный C1-6-алкил выбран из группы,которая включает -СН 3, -СН 2 ОН, -СН 2-СН 3 и СН 2-СН 2 ОН, например -СН 3 или -СН 2-СН 2 ОН, в частности СН 2-СН 2 ОН. Как видно из формул, показанных здесь, и определений, связанных с ними, некоторые из соединений, описанных в данном документе, являются хиральными. Более того присутствие определенных ненасыщенных или циклических фрагментов или нескольких стереогенных атомов предусматривает существование диастереомерных форм некоторых из хемосенсибилизирующих соединений. Предполагается,что данное изобретение включает все стереоизомеры, включая оптические изомеры и их смеси, а также чистые, частично обогащенные или, где нужно, рацемические формы. В частности, многие из хемосенсибилизирующих средств, описанных в данном документе, могут быть в форме Е- или Z-стереоизомеров или смесей таких изомеров. В предпочтительном варианте осуществления данного изобретения W представляет собой C=CH(CHX)n-CX(R9)(R10) или W представляет собой С=СН-(CHX)n-1-CH=C(R9)(R10), и в данных вариантах осуществления предпочтительно, чтобы n было равно 2, или 3, или 4. Более того, предпочтительно, чтобы X представлял собой водород или СН 3. Также предпочтительно в данном варианте осуществления,чтобы R9 и R10 вместе с атомом углерода, к которому они присоединены, образовывали необязательно замещенный арил. В предпочтительном варианте осуществления R9 и R10 вместе с атомом углерода, к которому они присоединены, образуют необязательно замещенный С 3-6-циклоалкил или необязательно замещенный С 3-6-гетероциклил. Предпочтительно R9 и R10 вместе с атомом углерода, к которому они присоединены, образуют необязательно замещенный С 6-циклоалкил или необязательно замещенный С 6 гетероциклил. В предпочтительном варианте осуществления R13 представляет собой водород или СН 3. В частности показано, что, если n представляет собой 2, каждый X представляет собой водород, a R13 представляет собой водород или СН 3, то средства общей формулы (IVa) и (IVb) демонстрируют сильную противоинфекционную активность при клинически релевантных концентрациях. Таким образом, в предпочтительном варианте осуществления данного изобретения W вместе с функциональной группой, присоединенной к нему, формирует алкенильную цепь (С=С-(СНХ)n-) с необязательно замещенной пиперидинильной группой. Пиперидинильная группа предпочтительно не замещена или замещена в параположении (R13). Таким образом, в предпочтительном варианте осуществления W вместе с функциональной группой, присоединенной к нему, представляет собой ССН-(СН 2)2-4-метилпиперидинил, ССНСН 2-СН(СН 3)-4-метилпиперидинил, ССН-(СН 2)2-пиперидинил или ССН-(СН 2)2-пиперидинил. В частности, структура, где W вместе с функциональной группой, присоединенной к нему, представляет собой ССН-(СН 2)2-4-метилпиперидинил, предпочтительна. Как ни удивительно, тиоксантеновые противоинфекционные средства данного изобретения становятся все более эффективными как противоинфекционные средства с увеличением степени изомерной чистоты. Другими словами, показали, что в то время, как и средства общей формулы (IVa) (цисизомеры), и средства общей формулы (IVb) (транс-изомеры) проявляют сильные противоинфекционные свойства, изомерные смеси средств общей формулы (IVa) и (IVb) показывают сниженную противоинфекционную активность. В частности, присутствие транс-изомера ингибирует противоинфекционные свойства цис-изомера,а присутствие цис-изомера ингибирует противоинфекционные свойства транс-изомера. Даже небольшие количества изомерной примеси одного изомера может ингибировать противоинфекционные свойства других релевантных противоинфекционных изомеров. Следовательно, большей частью предпочтительно, что соединения общей формулы (III) применяются как чистые или в значительной степени чистые изомеры. Следовательно, соединения по данному варианту осуществления предпочтительно применяются при изомерной чистоте по меньшей мере 60%,например по меньшей мере 70%, например по меньшей мере 80%, например по меньшей мере 90% или даже по меньшей мере 95%, или даже по меньшей мере 98%. Во время серии экспериментов, проведенных для данного изобретения, показали, что транс-формы соединений по данному изобретению являются самыми сильными противоинфекционными средствами. Кроме того, видимое отсутствие антипсихотической активности или экстрапирамидных побочных эффектов транс-форм делает их в особенности привлекательными для применения в качестве противоинфекционных средств. Следовательно, в целом предпочтительно, что соединения общей формулы (IV) имеют транс-конфигурацию, т. е. структура представлена общей формулой (IVb). Кроме того, следует понимать, что противоинфекционные средства, описанные здесь, включают возможные их соли, из которых фармацевтически приемлемые соли, конечно, особенно релевантны для терапевтических применений. Соли включают кислотные аддитивные соли и основные соли. Примерами кислотных аддитивных солей являются гидрохлоридные соли, фумарат, оксалат и т. п. Примерами основных солей являются соли, где (оставшийся) противоион представляет собой выбранный из щелочных металлов, таких как натрий и калий, щелочно-земельных металлов, таких как кальциевые соли, калиевые соли, и аммонийных ионов (+N(R')4, где R' независимо обозначает необязательно замещенный C1-6 алкил, необязательно замещенный С 2-6-алкенил, необязательно замещенный арил или необязательно замещенный гетероарил). Фармацевтически приемлемые соли, например, описаны в Remington's - The Science and Practice of Pharmacy, 20th Ed. Alfonso R.Gennaro (Ed.), Lippincott, WilliamsWilkins; ISBN: 0683306472, 2000, и в Encyclopedia of Pharmaceutical Technology. Эффект противоинфекционных средств можно испытать, как описано здесь, и эффективность противоинфекционного средства против выбранных микроорганизмов можно выразить как значение MIC. Минимальная ингибирующая концентрация (MIC) согласно директивам NCCLS определяется как наименьшая ингибирующая концентрация, не показывающая видимого роста. Противоинфекционность противоинфекционных средств, описанных здесь, можно оценить любым из способов, доступных специалисту в данной области, включая in vitro испытания, описанные здесь в примерах. В предпочтительном варианте осуществления данного изобретения противоинфекционное средство и возбудитель инфекции (и, следовательно, инфекционная болезнь, которую лечат) показывают значение MIC, равное или меньшее 50 мкг/мл и предпочтительно меньшее 20 мкг/мл при определении,как описано здесь в примерах. Более предпочтительно противоинфекционное средство и возбудитель инфекции показывают значение MIC, равное или меньшее 16 мкг/мл, при определении, как описано здесь в примерах. Еще более предпочтительно значение MIC равно или меньше 8 мкг/мл, например, равно или меньше 4 мкг/мл, например максимум 4,0. Еще более предпочтительно значение MIC равно или меньше 2 мкг/мл, например максимум 2,0, максимум, 1,0 или даже максимум 0,5. Терапия, фармацевтические композиции и дозировки Как объясняется выше, противоинфекционные средства, описанные здесь, полезны для лечения инфекционных болезней. Таким образом, противоинфекционные средства, описанные здесь, можно применять для получения лекарства для лечения инфекционной болезни, где противоинфекционные средства являются одиночным противоинфекционным средством. Раскрытые соединения можно также применять в комбинации с другими противоинфекционными средствами. Таким образом, в одном варианте осуществления данное изобретение касается противоинфекционных средств, описанных здесь, для применения при лечении инфекционной болезни, где противоинфекционные средства являются одиночным противоинфекционным средством. Кроме того, противоинфекционные средства, описанные здесь, полезны для профилактического лечения инфекционных болезней. Они могут быть особенно релевантны в ситуациях, где субъект имеет высокий риск получения инфекций, например, пациенты с ослабленным иммунитетом или пациенты,перенесшие хирургическое вмешательство. Таким образом, противоинфекционные средства, описанные здесь, также можно применять для получения лекарства для профилактического лечения инфекционной болезни, где противоинфекционные средства являются одиночным противоинфекционным средством. Таким образом, в другом варианте осуществления данное изобретение касается противоинфекционных средств, описанных здесь, для применения в профилактическом лечении инфекционной болезни,где противоинфекционные средства являются одиночным противоинфекционным средством. В дополнительном аспекте данное изобретение направлено на противоинфекционные средства,описанные здесь, для применения в качестве лекарств для лечения инфекционной болезни. В дополнительном аспекте данное изобретение направлено на противоинфекционные средства,описанные здесь, для применения в качестве лекарств для лечения устойчивых к нескольким лекарственным средствам инфекций. В дополнительном аспекте данное изобретение направлено на противоинфекционные средства,описанные здесь, для применения (например, в качестве лекарств) для ингибирования развития устойчивости к антибиотикам у инфекционного агента. Дополнительный аспект данного изобретения касается способа лечения или предотвращения инфекционной болезни у субъекта, причем указанный способ включает введение указанному субъекту противоинфекционного средства, как описано здесь. Было показано, что соединения по данному изобретению обладают синергическим эффектом при применении в комбинации с другими противобактериальными средствами. Таким образом, соединения по данному изобретению можно также применять в качестве хемосенсибилизирующих соединений. Эффект хемосенсибилизирующих соединений (который, как полагают, вызван обращением лекарственной устойчивости или множественной лекарственной устойчивости) можно оценить как описано в данном документе, а эффективность хемосенсибилизирующего соединения в комбинации с выбранными противоинфекционными средствами против выбранных микроорганизмов можно выразить как DRсоотношение и/или FIC-показатель. Соотношение лекарственной устойчивости (DR) определяют как соотношение между величинойMIC для противоинфекционного средства самого по себе, деленное на MIC для противоинфекционного средства в присутствии хемосенсибилизирующего соединения. Данное соотношение представляет собой повышение явной активности противоинфекционного средства, обусловленное хемосенсибилизирующим соединением, и может выражаться в видеDR-соотношение = MIC противоинфекционное средство /MIC противоинфекционное средство + хемосенсибилизирующее соединение Показатель фракционной ингибирующей концентрации (FIC) можно рассчитать для каждого противоинфекционного средства отдельно и в комбинации с хемосенсибилизирующим согласно следующей формуле:FIC противоинфекционное средство = MIC противоинфекционное средство + хемосенсибилизирующее соединение/MIC противоинфекционное средство Синергические эффекты хемосенсибилизирующих соединений, описанные в данном документе, т.е. их способность обращать лекарственную устойчивость у микроорганизма, можно оценить любым из способов, доступных для специалиста в данной области, включая пробы in vitro, описанные в примерах в данном документе. В предпочтительном варианте осуществления данного изобретения хемосенсибилизирующее соединение, противоинфекционное средство и возбудитель инфекции (и, следовательно, инфекционная болезнь, которую лечат) показывают показатель FIC не более 0,5 мкг/мл при определении как описано здесь в примерах. Более предпочтительно показатель FIC составляет не более 0,4, например не более 0,3. Для хемосенсибилизирующих соединений, которые являются эффективными ингибиторами, это означает, что соотношениеMIC хемосенсибилизирующее соединение + противоинфекционное средство/MIC хемосенсибилизирующее соединение стремится к нулю, что, в свою очередь, означает, что FIC хемосенсибилизирующее соединение 0. Это также означает, чтоMIC противоинфекционное средство 1/DR. Соответственно, в предпочтительном варианте осуществления данного изобретения соединение по данному изобретению и инфекционный агент (и, таким образом, инфекционная болезнь, которую нужно лечить) показывает DR-соотношение по меньшей мере 2. Более предпочтительно DR-соотношение составляет по меньшей мере 5, такое как по меньшей мере 10, например по меньшей мере 20. Еще более предпочтительнее величина MIC составляет по меньшей мере 30, например по меньшей мере 50, по меньшей мере 75 или даже по меньшей мере 100. Терапия Как будет понятно из приведенного описания, инфекционная болезнь, подлежащая лечению, обычно вызывается возбудителем инфекции, таким как бактерия, вирус, гриб или внутри- или внеклеточный паразит, в частности бактерия. Возбудитель инфекции типично имеет природное происхождение, т. е. бактерия природного происхождения, вирус природного происхождения, гриб природного происхождения или внутри- или внеклеточный паразит природного происхождения, в частности бактерия природного происхождения. Конкретнее, возбудителем инфекции может быть грамотрицательная или грамположительная бактерия. Специфические примеры включают грамотрицательные бактерии рода, выбранного из группы,включающей Escherichia, Proteus, Salmonella, Klebsiella, Providencia, Enterobacter, Burkholderia, Pseudomonas, Acinetobacter, Aeromonas, Haemophilus, Yersinia, Neisseria, Erwinia, Rhodopseudomonas и Burkholderia. Специфические примеры грамположительных бактерий включают бактерии из рода, выбранного из группы, включающей Lactobacillus, Azorhizobium, Streptococcus, Pediococcus, Photobacterium, Bacillus,Enterococcus, Staphylococcus, Clostridium, Butyrivibrio, Sphingomonas, Rhodococcus и Streptomyces. В других вариантах осуществления возбудитель инфекции, например, из рода, выбранного из груп- 11022060 пы, включающей Methanobacterium, Sulfolobus, Archaeoglobu, Rhodobacter и Sinorhizobium. В других вариантах осуществления инфекционным агентом является, например, кислотоустойчивые бактерии видов Mycobacterium, такие как Mycobacterium tuberculosis, Mycobacterium bovis. Mycobacterium avium и Mycobacterium leprae вместе с членами родственного рода Nocardia, такими как Nocardiaasteroides, Nocardia brasiliensis и Nocardia caviae. В следующих вариантах осуществления возбудителем инфекции является гриб, такой как из родаneoformans; или из рода Aspergillus, например A. fumingatus. В других вариантах осуществления возбудителем инфекции являются протозоа, такие как малярийный или криптоспоридиевый паразит. Токсичность и терапевтическую эффективность противоинфекционных средств, описанных здесь,можно определить с помощью стандартных фармацевтических методик на клеточных культурах или экспериментальных животных, например, с помощью определения LD50 (доза, летальная для 50% популяции) и ED50 (доза, терапевтически эффективная в 50% популяции). Дозовое соотношение между токсическими и терапевтическими эффектами является терапевтическим индексом, и его можно выразить как соотношение между LD50 и ED50 (LD50/ED50). Предпочтительными являются противоинфекционные средства, которые показывают большие терапевтические индексы. Данные, полученные из испытаний этой клеточной культуры или исследований на животных, можно применять в формулировании диапазона дозировки для применения на людях. Дозировка таких противоинфекционных средств лежит предпочтительно в диапазоне циркулирующих концентраций, которые включают ED50 с небольшой токсичностью или ее отсутствием. Дозировка может варьировать в этом диапазоне в зависимости от используемой дозированной формы и используемого пути введения. Фармацевтические композиции Противоинфекционные средства, описанные здесь, типично сформулированы в фармацевтическую композицию перед применением в качестве лекарственного вещества. Следовательно, в дополнительном аспекте данное изобретение касается фармацевтической композиции, включающей противоинфекционное средство, как описано здесь, и по меньшей мере один фармацевтически приемлемый носитель или наполнитель. Путь введения противоинфекционных средств, описанных здесь, может быть любым приемлемым путем, который приводит к концентрации в крови или ткани, соответствующей клинически релевантной концентрации. Таким образом, например, следующие пути введения могут быть пригодными для применения, хотя данное изобретение ими не ограничивается: пероральный путь, парентеральный путь, кожный путь, назальный путь, ректальный путь, вагинальный путь и глазной путь. Специалисту в данной области будет ясно, что путь введения зависит от конкретного рассматриваемого противоинфекционного средства, в особенности, выбор пути введения зависит от физико-химических свойств противоинфекционного средства, а также возраста и веса пациента, от конкретной болезни или состояния и тяжести его. Однако обычно предпочтительными являются оральный и парентеральный пути. Противоинфекционные средства, описанные здесь, могут содержаться в любом соответствующем количестве в фармацевтической композиции и обычно содержатся в количестве около 0,1-95 вес.% общего веса композиции. Композиция может находиться в дозированной форме, такой как стандартная лекарственная форма, которая приемлема для орального, парентерального, ректального, кожного, назального, вагинального и/или окулярного пути введения. Таким образом, композиция может быть в форме, например, таблеток, капсул, пилюль, порошков, гранул, суспензий, эмульсий, растворов, гелей,включая гидрогели, паст, мазей, кремов, пластырей, примочек, доставляющих устройств, суппозиториев,клизм, инъекций, имплантатов, спреев, аэрозолей, и в другой приемлемой форме. Фармацевтические композиции можно составить согласно традиционной фармацевтической практике, см., например "Remington's Pharmaceutical Sciences" и "Encyclopedia of Pharmaceutical Technology",edited by Swarbrick, J.J. С. Boylan, Marcel Dekker, Inc., New York, 1988. Обычно, противоинфекционные средства, описанные в данном документе, составляют с (по меньшей мере) фармацевтически приемлемым носителем или наполнителем. Фармацевтически приемлемые носители или наполнители известны специалисту в данной области. Фармацевтические композиции для орального применения включают таблетки, содержащие противоинфекционное средство, как описано здесь, необязательно в комбинации по меньшей мере с одним дополнительным противоинфекционным средством, в смеси с нетоксичными фармацевтически приемлемыми наполнителями. Эти наполнители могут быть, например, инертными разбавителями или заполнителями, такими как сахароза, сорбитол, сахар, маннитол, микрокристаллическая целлюлоза, крахмалы,включая картофельный крахмал, кальция карбонат, натрия хлорид, лактоза, кальция фосфат, кальция сульфат или натрия фосфат; гранулирующие и дезинтегрирующие средства, например, производные целлюлозы, включая микрокристаллическую целлюлозу, крахмалы, включая картофельный крахмал,кроскармеллозу натрия, альгинаты или альгиновую кислоту; связывающие средства, например сахароза,глюкоза, сорбитол, аравийская камедь, альгиновая кислота, натрия альгинат, желатин, крахмал, пептизированный крахмал, микрокристаллическая целлюлоза, магния алюмосиликат, карбоксиметилцеллюлоза натрия, метилцеллюлоза, гидроксипропилметилцеллюлоза, этилцеллюлоза, поливинилпирролидон или полиэтиленгликоль; и смазывающие средства, включая глиданты и антиадгезивы, например, магния стеарат, цинка стеарат, стеариновую кислоту, диоксид кремния, гидрогенизированные растительные масла или тальк. Другими фармацевтически приемлемыми наполнителями могут быть красители, ароматизаторы,пластификаторы, увлажнители, буферные средства и т. п. Таблетки могут быть непокрытыми или их можно покрыть известными методами, необязательно для задержки распада и абсорбции в желудочно-кишечном тракте и, тем самым, для обеспечения длительного действия за более длительный период. Покрытие может применяться для высвобождения противоинфекционного средства по предопределенной модели, например, для достижения состава регулируемого высвобождения (см. ниже), или его можно применять, чтобы активное лекарственное вещество высвобождалось только после прохождения через желудок (энтеросолюбильное покрытие). Покрытие может быть сахарным покрытием, пленочным покрытием (например, на основе гидроксипропилметилцеллюлозы, метилцеллюлозы, метилгидроксиэтилцеллюлозы, гидроксипропилцеллюлозы, карбоксиметилцеллюлозы, акрилатных сополимеров (Eudragit E), полиэтиленгликолей и/или поливинилпирролидона) или энтеросолюбильным покрытием (например, на основе сополимера метакриловой кислоты (Eudragit L и S), целлюлозы ацетатфталата, гидроксипропилметилцеллюлозы фталата, гидроксипропилметилцеллюлозы ацетатсукцината, поливинилацетат фталата, шеллака и/или этилцеллюлозы). Кроме того, может использоваться материал задержки во времени, такой как, например, глицерил моностеарат или глицерил дистеарат. В дополнение, твердые таблетированные композиции, как упомянуто выше, могут быть обеспечены покрытием для защиты композиции от нежелательных химических изменений, например химической деградации, до высвобождения противоинфекционного средства. Покрытие может применяться на твердой дозированной форме подобно описанному в "AqueousSwarbrick, J.J. С. Boylan, Marcel Dekker, Inc., New York, 1988. Составы для орального применения также могут быть представлены как жевательные таблетки или как твердые желатиновые капсулы, где активный ингредиент смешивают с инертным твердым разбавителем, например картофельным крахмалом, лактозой, микрокристаллической целлюлозой, кальция карбонатом, кальция фосфатом или каолином, или как мягкие желатиновые капсулы, где активный ингредиент смешивают с водой или масляной средой, например арахисовым маслом, жидким парафином или оливковым маслом. Порошки и гранулы можно получить с помощью ингредиентов, упомянутых выше под таблетками и капсулами, традиционным способом с помощью, например, смесителя, аппарата псевдоожиженного слоя или оборудования сушки распылением. Композиции регулированного высвобождения для орального применения можно, например, сформировать для высвобождения активного лекарственного вещества с помощью регулирования растворения и/или диффузии активного лекарственного вещества. Регулированное высвобождение растворением или диффузией можно достичь с помощью соответствующего покрытия таблетированного, капсульного, пилюльного или гранулированного состава противоинфекционного средства или с помощью заключения рассматриваемого противоинфекционного средства, например, в соответствующую матрицу. Покрытие регулируемого высвобождения может включать одно или несколько из покрывающих веществ, упомянутых выше и/или, например шеллак, пчелиный воск, гликовоск, гидрированное касторовое масло, карнаубский воск, стеариловый спирт, глицерил моностеарат, глицерил дистеарат, глицерин пальмитостеарат, этилцеллюлоза, акриловые смолы, d1-полимолочная кислота, целлюлозы ацетат бутират, поливинилхлорид, поливинилацетат, винилпирролидон, полиэтилен, полиметакрилат, метилметакрилат, 2-гидроксиметакрилат, метакрилатные гидрогели, 1,3-бутиленгликоль, этиленгликольметакрилат и/или полиэтиленгликоли. В матричном составе регулируемого высвобождения противоинфекционного средства материал матрицы может включать, например, гидратированную метилцеллюлозу, карнаубский воск и стеариловый спирт, карбопол 934, силикон, глицерил тристеарат, метилакрилат-метилметакрилат, поливинилхлорид, полиэтилен и/или галогенированный фтороуглеводород. Композиция регулируемого высвобождения противоинфекционных средств, описанных здесь, также может находиться в форме плавучей таблетки или капсулы, т. е. таблетки или капсулы, которая после орального введения плавает сверху содержимого желудка в течение определенного периода времени. Состав плавучей таблетки рассматриваемого противоинфекционного средства можно получить гранулированием смеси противоинфекционного средства, наполнителей и 20-75% вес./вес. гидроколлоидов, таких как гидроксиэтилцеллюлоза, гидроксипропилцеллюлоза и гидроксипропилметилцеллюлоза. Затем полученные гранулы можно прессовать в таблетки. При контакте с желудочным соком таблетка может формировать в значительной степени водонепроницаемый гелевый барьер вокруг своей поверхности. Гелевый барьер участвует в поддержании плотности менее единицы, тем самым позволяя таблетке удерживаться на плаву в желудочном соке. Порошки, дисперсные порошки или гранулы, приемлемые для получения водной суспензии путем добавления воды, также являются приемлемыми дозированными формами. Состав в виде суспензии представляет противоинфекционное средство в смеси с диспергирующим или увлажняющим средством,суспендирующим средством и одним или несколькими консервантами. Приемлемыми диспергирующими или увлажняющими средствами являются, например, фосфатиды природного происхождения, например лецитин, или продукты конденсации этиленоксида с, например,жирной кислотой, длинноцепочечным алифатическим спиртом или неполным эфиром, происходящим от жирных кислот, и гексит или гексита ангидриды, например полиоксиэтилена стеарат, плиоксиэтилена сорбитолмоноолеат, полиоксиэтилена сорбитанмоноолеат и т. п. Приемлемыми суспендирующими средствами являются, например, натрия карбоксиметилцеллюлоза, метилцеллюлоза, натрия альгинат и т. п. Фармацевтическую композицию также можно вводить парентерально инъекцией, инфузией или имплантацией (внутривенно, внутримышечно, внутрисуставно, подкожно или т. д.) в дозированных формах, составах или, например, приемлемыми устройствами доставки или имплантатами, содержащими общепринятые, нетоксичные фармацевтически приемлемые носители и адъюванты. Состав и получение таких композиций хорошо известно специалисту в данной области фармацевтического состава. Специфические составы можно найти в пособии под названием "Remington's Pharmaceutical Sciences". Композиции для парентерального применения могут быть представлены в стандартных лекарственных формах, например в ампулах или во флаконах, содержащих несколько доз, и в которых может быть добавлен приемлемый консервант (см. ниже). Композиция может быть в форме раствора, суспензии, эмульсии, устройства для инфузии или устройства для доставки для имплантации или она может быть представлена в виде сухого порошка, подлежащего восстановлению водой или другой приемлемой средой перед применением. Кроме противоинфекционных средств, описанных здесь, композиции могут включать приемлемые парентерально допустимые носители и/или наполнители, или активное лекарственное вещество может быть заключено в микросферы, микрокапсулы, наночастицы, липосомы или подобное для регулируемого высвобождения. Кроме того, композиция может в дополнение удобно включать суспендирующие, растворяющие, стабилизирующие, регулирующие рН средства и/или диспергирующие средства. В другом рассматриваемом варианте осуществления данного изобретения фармацевтическая композиция является твердой дозированной формой, такой как таблетка, полученная из зернистого материала, описанного в WO 03/004001 и WO 2004/062643. Как показано выше, фармацевтические композиции могут содержать противоинфекционное средство в форме стерильной инъекции. Для приготовления такой композиции противоинфекционное средство растворяют или суспендируют в парентерально приемлемой жидкой среде для лекарств. Приемлемыми средами и растворителями, которые можно использовать, являются вода, вода для регулирования рН до приемлемого значения путем добавления соответствующего количества хлороводородной кислоты, гидроксида натрия или приемлемого буфера, 1,3-бутандиола, раствора Рингера и изотонического раствора хлорида натрия. Водный состав также может содержать один или несколько консервантов, например,метил, этил или н-пропил п-гидроксибензоат. В случаях, когда противоинфекционное средство слабо или плохо растворяется в воде, можно добавить улучшающее растворение или повышающее растворимость средство, или растворитель кроме воды может включать 10-60% вес/вес пропиленгликоля или подобного. Дозировки Как подробно обсуждалось ранее, важным аспектом данного изобретения является то, что противоинфекционные средства, описанные здесь, способны убить возбудителей инфекции, когда вводятся в клинически релевантных количествах, т. е. в количествах, достаточно небольших, чтобы избежать тяжелых побочных эффектов, обычно связанных с противоинфекционными средствами, описанными здесь. Будет понятно, что вводимая дозировка будет зависеть формы введения (см. ниже). Независимо от формы введения, противоинфекционное средство должно вводится в клинически релевантных количествах, т. е. в количествах, которые с одной стороны оказывают релевантный терапевтический эффект, а с другой стороны не дают тяжелых побочных эффектов. Противоинфекционные средства по данному изобретению могут связываться с несколькими компонентами сыворотки, таким образом делая необходимой повышенную дозировку средства. Однако слишком высокая дозировка может привести к нежелательным побочным эффектам. Таким образом, для того, чтобы достигнуть целей данного изобретения, подходящей является стабильная концентрация в сыворотке свободного несвязанного средства менее 200 мг/мл, такая как 150 мг/мл, или 100 мг/мл, или 50 мг/л, предпочтительно 20 мг/л. В целом, лечение инфекций от грамотрицательных бактерий нуждается в более высоких дозах, чем лечение инфекций грамположительными бактериями. Таким образом, в предпочтительном варианте осуществления данного изобретения противоинфекционное средство, кото- 14022060 рое описано в данном документе, вводят в клинически релевантном количестве, создавая стабильную концентрацию в сыворотке свободного несвязанного средства от 0,5 до 200 мг/мл, такую как от 0,5 до 150 мг/мл, или от 0,5 до 100 мг/мл, или от 1,0 до 50 мг/л, или от 1,5 до 20 мг/л. Более предпочтительно противоинфекционное средство вводят в релевантном количестве, создавая стабильную концентрацию в сыворотке менее 10 мг/л, такую как менее 8,0 мг/л. Более предпочтительно противоинфекционное средство вводят в клинически релевантном количестве, создавая стабильную концентрацию в сыворотке менее 7,0 мг/л, такую как менее 6,0 мг/л, например менее 5,0 мг/л. В некоторых случаях противоинфекционное средство вводят в клинически релевантном количестве, создавая стабильную концентрацию в сыворотке менее 4,0 мг/л, такую как менее 3,0 мг/л, например менее 2,0 мг/л. В некоторых случаях противоинфекционное средство вводят в клинически релевантном количестве, создавая стабильную концентрацию в сыворотке менее 1,5 мг/л, например, приблизительно 1,0 мг/л или приблизительно 0,5 мг/л. Другими словами, противоинфекционное средство предпочтительно вводят в клинически релевантном количестве, создавая стабильную концентрацию в сыворотке в интервале от 0,01 мкг/л до менее 200,0 мг/л, например от 0,01 мкг/л до менее 150,0 мг/л, например от 0,01 мкг/л до менее 100,0 мг/л, например от 0,01 мкг/л до менее 50,0 мг/л, например от 0,01 мкг/л до менее 20,0 мг/л, например от 0,01 мкг/л до менее 10,0 мг/л, например от 0,01 мкг/л до менее 8,0 мг/л, например, в интервале от 0,02 мкг/л до 7,0 мг/л, например в интервале от 0,04 мкг/л до 6,0 мг/л. Более предпочтительно стабильная концентрация в сыворотке противоинфекционного средства находится в интервале от 0,06 мкг/л до 5,0 мг/л, как например в интервале от 0,08 мкг/л до 4,0 мг/л, например в интервале от 0,1 мкг/л до 3,0 мг/л. Еще более предпочтительно стабильная концентрация в сыворотке противоинфекционного средства находится в интервале от 0,2 мкг/л до 2,0 мг/л, как например в интервале от 0,4 мкг/л до 2,0 мг/л, например, в интервале от 0,5 мкг/л до 2,0 мг/л. И еще более предпочтительно стабильная концентрация в сыворотке противоинфекционного средства находится в интервале от 0,6 мкг/л до 2,0 мг/л, как например в интервале от 0,8 мкг/л до 2,0 мг/л, например в интервале от 0,9 мкг/л до 2,0 мг/л. Наиболее предпочтительно стабильная концентрация в сыворотке противоинфекционного средства находится в интервале от 1,0 мкг/л до 2,0 мг/л, как например в интервале от 1,5 мкг/л до 2,0 мг/л, например в интервале от 1,5 мкг/л до 1,5 мг/л. Противоинфекционное средство предпочтительно вводят в количестве приблизительно 0,1-10000 мг в сутки, таком как приблизительно 0,5-5000 мг в сутки, или таком как приблизительно 1,0-2000 мг в сутки, или таком как приблизительно 2,0-1000 мг в сутки. Как будет понятно специалисту, фактическое вводимое количество будет inter alia зависеть от пути введения, т. е. вводится ли противоинфекционное средство перорально, внутривенно, внутримышечно и т. д. Для композиции, применяемой для орального введения систематического применения, дозировка обычно составляет от 1 мг до 3 г на дозу, вводимую 1-4 раза ежедневно в течение от 1 дня до 12 месяцев в зависимости от инфекционной болезни, которую лечат. Для парентерального введения, в частности внутривенного введения, подходящей является доза от около 0,1 до около 2000 мг в день. Для внутривенного введения подходящей является доза от около 0,1 до около 2000 мг в день, которую вводят в течение от 1 дня до 12 месяцев. Вышеупомянутые стабильные концентрации в сыворотке и дозировки будут вызывать желательные клинические эффекты и в то же время избегать тяжелых побочных эффектов, обычно связанных с противоинфекционными средствами, описанными здесь. Некоторые из противоинфекционных средств, описанных здесь, в частности противоинфекционные средства общей формулы IIIb, могут, однако, вводиться в более высоких количествах, тем самым вызывая стабильные концентрации в сыворотке выше уровней, определенных выше. Это потому, что данные противоинфекционные средства, как ожидают, не показывают тяжелых побочных эффектов, даже когда вводятся в более высоких количествах. Данное изобретение дополнительно проиллюстрировано ниже неограничивающими примерами. Материалы и способы Бактерии Клинические изоляты были получены из США, Канады, Европы и Среднего Востока, а стандартные контрольные штаммы были получены из АТСС (Коллекция американских типичных культур США) иCCUG (Университет контрольных культур Гетеборга, Швеция). Коллекция включает устойчивые к нескольким лекарственным средствам изоляты и представляет клинически важные бактерии и грибы. Устойчивые клетки были в приблизительно 10-1000 раз более устойчивы по сравнению с чувствительными клеточными линиями и поддерживали фенотип стабильной лекарственной устойчивости при росте на среде без лекарственного средства. Всех стафилококков типировали, чтобы гарантировать, что изоляты не представляют один и тот же клон/штамм. Лекарственные средства Лекарственные средства растворили в небольших количествах воды или 1% DMSO (диметилсульфоксид) (финальная концентрация DMSO в культуре менее 0,05%) перед растворением средой. Растворы готовили заново для каждого эксперимента. Чистота соединений составляла 95%. Эффект лекарственных средств на рост микробных клеток Клеточный рост тестировали с помощью тестов чувствительности к минимальной ингибирующей концентрации (MIC) с помощью метода микроразведения питательной среды согласно директивамAerobically; Approved Standard, Sixth Edition, Volume 23; Number 2). Минимальная ингибирующая концентрация (MIC) определена как самая низкая концентрация лекарственного средства, которая ингибирует рост тестируемого организма, в том смысле, что заметный рост не наблюдался (полное ингибирование роста). В примере 2 MIC соединений, применяемых на грибковых микроорганизмах, определили по измерениям IC90 согласно директивам NCCLS. Культуру бактерий в логарифмической фазе разбавили свежей предварительно нагретой средой Мюллера-Хинтона и отрегулировали до определенной OD при 600 нм, чтобы получить финальную концентрацию 1 х 104-5 бактерий/мл среды. Бактериальную культуру перенесли в микропланшеты, добавив культуру в каждую лунку. Лекарственное средство добавили в бактериальную культуру в лунки как серии двукратных разведений лекарственного средства для получения финальных концентраций, изменяющихся от 0,03 до 128 мкг/мл. Планшеты инкубировали при 37 С со встряхиванием в автоматическом анализаторе, PowerWavex, программное обеспечение KC4, Kebo.Lab, Копенгаген, в течение 16 ч, и измеряли оптическую плотность при 600 нм во время инкубации для составления кривых роста. Лунки, содержащие бактериальные культуры без лекарственного средства, использовали как контроли для обеспечения поправки размера инокулюма и бактериального роста во время инкубации. Культуры тестировали для выявления контаминации. Каждый эксперимент провели в трех повторностях. Значения MIC представляют средние значения двух отдельных экспериментов в трех повторностях. Отклонение между испытаниями и внутри испытаний было 5%. Определение ингибирующего рост эффекта противоинфекционных средств Рост бактерий в лунках описывается лагфазой, т.е. периодом до (перед) начала роста, лог-фазой, т.е. периодом с максимальной скоростью роста, стационарной фазой с последующей фазой отмирания. Эти параметры применяют при оценке ингибирующего эффекта лекарственного средства на рост бактерий путем сравнения кривых роста с лекарственным средством и без лекарственного средства. Полное ингибирование роста бактерий определяют как: OD (16 ч) = OD (0 ч) или отсутствие видимого роста, согласно директивам NCCLS. Ингибирование 90 (IC90) определяют как: OD, отвечающая 90% ингибированию роста. В приведенных ниже примерах тестируемыми соединениями являются показанные в табл. 1. Таблица 1. Тестовые соединения 1 (N-деалкил-транс-клопентиксол) и 2 (транс-клопентиксол) являются сравнительными соединениями). Пример 1 а. Эффект на клинически релевантные бактериальные изоляты. Заключение: противоинфекционный эффект соединения 3 выше по сравнению с соединениями 1 и 2. Штаммы: все используемые штаммы являются полирезистентными клиническими изолятами с устойчивостью к бета-лактамным антибиотикам, хинолонам и аминогликозидам (значения MIC16 мкг на мл). Десять штаммов в каждой тестовой группе. Таблица 1 а. Медианные значения MIC соединений (мкг/мл), десять штаммов в каждой тестовой группе. Как видно, соединение 3 проявляет сильную противоинфекционную активность и превосходит транс-клопентиксол и N-деалкил-транс-клопентиксол во всех тестовых группах. Пример 1b. Эффект на клинически релевантные человеческие изоляты полирезистентных и чувствительных видов Staphylococci, Streptococci, Micrococci и грамотрицательные виды. Клинически релевантные человеческие бактериальные изоляты Staphylococci, Streptococci, Micrococci и грамотрицательные виды культивировали и анализировали, как описано выше, на чувствительность к соединениям, приведенным в табл. 1b. Результаты показаны в табл. 1b. Таблица 1b. Противомикробный эффект соединений деалкилированного фенотиазина или тиоксантена на полирезистентные и чувствительные клинические изоляты Staphylococci, Micrococci, Streptococci и грамотрицательные виды. Каждая группа состояла из 8 полирезистентных изолятов и 8 чувствительных. Результаты в табл. 1b показывают, что тестируемые соединения показывают сильную противомикробную активность ко всем грамположительным и грамотрицательным клиническим изолятам, включая все полирезистентные изоляты. Эффекты соединений были приблизительно равносильные умеренные как у чувствительных, так и у устойчивых изолятов (данные не показаны). Пример 2. Эффект на устойчивые клинические изоляты Enterococcus faecalis и Enterococcus faecium. Клинически релевантные изоляты культивировали и испытывали, как описано выше. Результаты показаны в табл. 2. Таблица 2. Противомикробный эффект соединений деалкилированного фенотиазина или тиоксантена на полирезистентные и чувствительные клинические изоляты видов Enterococci Каждая группа состоит из 8 полирезистентных изолятов, представляющих следующие устойчивости VanB: изоляты (проявляют vanB-гликопептидную устойчивость, которая затрагивает в основном ванкомицин, а не тейкопланин); VanA (изоляты проявляют vanA-гликопептидную устойчивость, которая затрагивает как ванкомицин, так и тейкопланин); HLAR: (изоляты проявляют высокоуровневую аминогликозидную устойчивость); BLR,CR (изоляты проявляют бета-лактамную и карбапенемную устойчивость), и 8 чувствительных изолятов. Эксперимент демонстрирует, что протестированные соединения проявляют сильную антимикробную активность против устойчивых и полирезистентных изолятов, включая виды Enterococcus с ванкомициновой устойчивостью, тейкопланиновой устойчивостью и высокоуровневой амиерногликозидной устойчивостью. Эффекты соединений были приблизительно равносильные умеренные как у чувствительных, так и у устойчивых изолятов (данные не показаны). Пример 3. Противобактериальный эффект деалкилированных фенотиазиновых или тиоксантеновых соединений на клинические изоляты грибов. Противобактериальный эффект деметилированных/деалкилированных фенотиазиновых или тиоксантеновых соединений исследовали с помощью ингибирования роста клеток, подверженных 0-32 мкг/мл лекарственного средства. Каждый эксперимент провели в трех повторностях. Значения MIC представляют средние значения двух отдельных экспериментов в трех повторностях. 4 клинических изолята видов Candida (включая 3 устойчивых к флуконазолу изолята) перед тестированием чувствительности пересеяли в течение 24 ч на глюкозный агар Сабуро. Выполнили тесты микроразведения среды согласно документу NCCLS M27-A (Ref: National Commitee for Clinical LaboratoryStandard M27-A. NCCLS, Wayne, PA.). Микротитровальные планшеты считывали спектрофотометрически при 530 нм после перемешивания лунок путем пипетирования для ресуспендирования дрожжевых седиментов. В этом эксперименте MIC определили как самое низкое растворение лекарственного средства, приводящее к 90% ингибированию роста. Результаты показаны в табл. 3 ниже. Таблица 3. Противомикробный эффект соединений деалкилированного фенотиазина или тиоксантена на полирезистентные и чувствительные клинические изоляты видов Candida Каждая группа состоит из 8 полирезистентных изолятов, включая устойчивые к флуконазолу, и 8 чувствительных клинических изолятов видов Candida. Результаты показывают, что тестируемые соединения показывают сильную противогрибковую активность на клинические изоляты видов Candida, включая все полирезистентные изоляты. Эффекты соединений были приблизительно равносильные умеренные как у чувствительных, так и у устойчивых изолятов (данные не показаны). Пример 4 а. Синергические эффекты соединений деалкилированного фенотиазина или тиоксантена. Материалы и способы Эффект соединений тестировали по способам, описанным в WO2005/105145. Кратко, клеточный рост тестировали с помощью тестов чувствительности MIC с применением метода микроразведения питательной среды согласно директивам NCCLS (NCCLS Guidelines, Methods for Dilution Antimicrobial Susceptibility Tests for Bacteria That Grow Aerobically; Approved Standard, Sixth Edition, Volume 23; Number 2).FIC: показатель фракционной ингибирующей концентрации (FIC) рассчитывали для каждого соединения, как описано в WO2005/105145. Синергизм определяли по показателям фракционной ингибирующей концентрации (FIC) менее 0,5. Бактериальные изоляты: Enterococcus faecalis: 8 отобранных in vivo клинических изолятов, устойчивых к нескольким лекарственным средствам. Устойчивые к ампициллину, ципрофлоксацину, гентамицину и с пониженной или полной устойчивостью к ванкомицину. Изменение экспрессии целевого предшественника клеточной стенки в качестве основного механизма устойчивости (экспрессия гена VanA).Staphylococcus aureus: 8 отобранных in vivo клинических изолятов с MRSA. Устойчивые к метициллиновым и бета-лактамным антибиотикам. Чувствительные к тейкопланину, хлорамфениколу, фосфомицину, нетилмицину и ванкомицину. Е. coli: 8 отобранных in vivo клинических изолятов Е. coli с множественной лекарственной устойчивостью. Устойчивые к тетрациклину, бета-лактамам, фторхинолонам, хлорамфениколу и аминогликозиду Табл. 4 а показывает синергический эффект протестированных соединений 1, 2, 3 и 4 в комбинации с ципрофлоксацином, гентамицином, тетрациклином и диклоксациллином, соответственно, протестированных на устойчивых бактериальных изолятах. Синергизм определяли по показателям фракционной ингибирующей концентрации (FIC) менее 0,5 (средние значения). Показатели FIC для соединений показывают, что данные соединения являются синергическими при стимуляции противобактериальных эффектов противоинфекционных средств у устойчивых к лекарствам клеток. Все показатели FIC для хемосенсибилизирующих соединений, проанализированных на устойчивых к лекарствам клетках, составляли 0,5. Соединение 3 было наиболее сильным из всех протестированных хемосенсибилизирующих соединений, далее шли соединение 1, соединение 4 и соединение 2. Таким образом, клиническое применение соединений в комбинации с противоинфекционным средством,может, вероятно, сдвинуть MIC данного противоинфекционного средства для DR-клеток значительно ниже клинически достигаемой концентрации, демонстрируя эффективные концентрации при концентрациях до 0,06 мкг/мл. Эффект противо-DR был, как и ожидалось, наиболее сильным у устойчивых клеток. Однако, значительный усиливающий эффект для антибиотиков был также показан у чувствительных клеток, убедительно указывая на то, что эффект противо-DR этих хемосенсибилизирующих соединений не ограничен клетками, которые сверхэкспрессируют эффлюксные насосы или бета-лактамазу и противо-DR механизм не ограничен данными целями. Показатели FIC для чувствительных к антибиотикам клеток варьировали в диапазоне от 0,47 до 1,0. Пример 4b. Синергические эффекты соединений деалкилированного фенотиазина или тиоксантена. Максимальное получаемые обращение устойчивости и синергический эффект протестировали, как описано ранее. Штаммы: полирезистентные клинические изоляты S.aureus и S.epidermidis, десять штаммов в каждой группе. Таблица 4b. Максимальное обращение устойчивости и синергический эффект соединений 1-4. Медианные значения, мкг/мл Максимальное обращение устойчивости означает концентрацию, при которой дополнительное введение соединения более не понижает MIC. Как видно, соединение 3 превосходит что касается способности обращать устойчивость и синергического эффекта в комбинации с традиционными противомикробными средствами. При самой низкой концентрации, 0,30 мкг/мл, соединение 3 усиливало противомикробную активность составного противомикробного средства до наиболее высокой степени, получая наиболее высокую кратность усиления и наиболее низкие значения MIC. Все соединения 1, 2 и 4 демонстрировали синергический эффект, но до более низкой степени и при более высокой концентрации (0,75 или 0,98, или 0,60 мкг/мл). Однако соединение 4 превосходило соединение 2 в том, что максимальное обращение устойчивости достигалось при более низкой концентрации. Все значения были ниже 0,5 в соответствии с полученным синергическим эффектом. Пример 4 с. Синергические эффекты соединений деалкилированного фенотиазина или тиоксантена. Соединение 3 превосходит транс-клопентиксол и N-деалкил-транс-клопентиксол. Максимальное получаемые обращение устойчивости и синергический эффект протестировали, как описано ранее. Штаммы: полирезистентные клинические изоляты E.coli, десять штаммов в каждой группе. Таблица 4 с. Максимальное обращение устойчивости и синергический эффект соединений 1-3. Медианные значения, мкг/мл. Как видно, соединение 3 превосходит что касается способности обращать устойчивость и синергического эффекта в комбинации с традиционными противомикробными средствами. При самой низкой концентрации, 0,6 мкг/мл, соединение 3 усиливало противомикробную активность составного противомикробного средства до наиболее высокой степени, получая наиболее высокую кратность усиления и наиболее низкие значения MIC. Как соединение 1, так и соединение 2 демонстрировали синергический эффект, но до более низкой степени и при более высокой применяемой концентрации (2,0 или 1,0 мкг/мл). Все значения были ниже 0,5 в соответствии с полученным синергическим эффектом. Пример 5. Развитие нечувствительности к хемосенсибилизирующим соединениям. Одним возможным ограничением для комбинирования противоинфекционного средства с ингибиторами механизма(механизмов) устойчивости является вероятность обнаружений у микроорганизмов мутаций, которые делают их нечувствительными к ингибитору. Такая ситуация наблюдалась, например,для бактерий, вируса, грибов и дрожжей. Определили влияние ингибиторов на скорость возникновения отбираемой in vitro за один этап устойчивости к ципрофлоксацину на клиническом изоляте O11 S. aureus. Спонтанных мутантов получили через 24 ч после высевания клеток S. aureus на чашки с LB-агаром(агар Луриа-Бертани), содержащие ципрофлоксацин в концентрации 1 мкг/мл (двойная MIC) в отсутствие или в присутствии соединения 3 (смотри табл. 4) из расчета 1 мкг/мл. Частота отбора мутантов составляла 310-8, как определили посредством сравнения количества колоний, которые выросли на чашках, содержащих противоинфекционное средство, с количеством колоний, полученных после засевания соответствующих разведений при отсутствии противоинфекционных средств. Возможно наиболее частым аспектом при оценке применения ингибиторов в клинике является влияние этих ингибиторов на возникновение устойчивых мутантов. Что важно, и как показано в табл. 5,протестированный ингибитор понизил частоту спонтанного возникновения устойчивости к ципрофлоксацину в 100 раз и более. Это сильное влияние нельзя было объяснить за счет токсического эффекта ингибитора, поскольку такая же концентрация ингибитора, которая была, по меньшей мере, в 100 раз меньше, чем его MIC для S. aureus, на затрагивала ни способность образовывать колонии, ни размер колоний клеток S. aureus, высеянных в отсутствии ципрофлоксацина. В заключение необходимо отметить,что транс-клопентиксол ингибировал возникновение устойчивости к ципрофлоксацину у S. aureus. Таблица 5 Таблица 5. Частота возникновения отбираемых in vitro вариантов S. aureus, устойчивых к 1 мкг ципрофлоксацина на мл (двойная MIC для штамма S. aureus) либо в отсутствии, либо в присутствии ингибитора. Пример 6. Противомикробный эффект соединения 3 в мышиной модели перитонита. Мышиная модель перитонита/сепсиса. Бактерии. Использовали клинический изолят Enterococcus faecalis BG VSE-92 из мочи человека. Этот штамм является устойчивым к нескольким лекарственным средствам изолятом. Животные. Использовали самок мышей NMRI (возраст - приблизительно 6-8 недель; вес - 302 г) для модели пневмонии/перитонита мыши (как описано ниже). Бактериальные суспензии приготовили из свежих ночных культур (полученных из замороженных маточных культур) на планшетах с 5% кровяным агаром, как описано выше. Инокулюм для модели перитонита мыши приготовили непосредственно перед применением и отрегулировали при 540 нм для получения плотности приблизительно 107 KOE/мл. Размер инокулюма определили подсчетом выживаемости на 5% кровяном агаре. Мышей инъецировали внутриперитониально 0,5 мл энтерококковой суспензии, вызывающей бактериемию за 1 ч инокуляции. Антибиотическую терапию начали через 1 ч после инокуляции. N-деалкилтранс-клопентиксол ввели подкожно в область шеи в объеме 0,7 мл на дозу. В каждой опытной группе было пять мышей. Инокулированные контрольные мыши без лечения были включены во все опыты.(Ссылка метода: Erlandsdottir et al; Antimicrob Agents Chemother. 2001 Apr; 45(4): 1078-85.) Таблица 6. Режимы лечения инфицированных мышей Эффекты различных режимов лечения определяли в течение 5 ч лечения путем оценки подсчетов бактерий в перитонеальной жидкости. Бактерицидные эффективности режимов лечения на моделях мышей вычислили путем вычитания результатов каждый обработанной мыши из средних результатов для контрольной мыши в конце лечения (5 ч). Понижение в одну тысячу раз (3 ступени log 10) представляет собой максимальный эффект в данной модели и подтверждает сильный бактериальный поражающий эффект протестированного соединения. Результаты. Сильная противомикробная активность соединения 3 у инфицированной мыши. Бактерицидная активность соединения 3 в перитонеальной жидкости мыши показана в табл. 7. Как видно, при лечении мышей соединением количество бактерий на мл перитонеальной жидкости снижалось на 3 ступени log 10 и лишь 0,001% бактерий выживали через 5 ч (р 0,05). Таблица 7. Бактерий/мл в перитонеальной жидкости инфицированных мышей, получавших лечение и не получавших лечение, через 5 ч после инокуляции Использованный инокулят: 1,28108 KOE/мл Пример 7. Усиливающий эффект соединения 3 в мышиной модели перитонита. Бактерии. Использовали полирезистентный клинический изолят Enterococcus faecalis ENT 28 (VRE) из мочи человека. Животные. Использовали самок мышей NMRI (возраст - приблизительно 6-8 недель; вес - 302 г) для модели пневмонии/перитонита мыши (как описано ниже). Антибиотики. Линезолид получили от Sigma, Дания, в виде сухого порошка. Мышиная модель перитонита. Для определения какого-либо синергического эффекта, инфицированных мышей лечили субтерапевтическими дозами каждого тестового соединения отдельно или смеси из двух соединений. Бактериальные суспензии приготовили из свежих ночных культур (полученных из замороженных маточных культур) на планшетах с 5% кровяным агаром, как описано выше. Инокулюм для модели перитонита мыши приготовили непосредственно перед применением и отрегулировали при 540 нм для получения плотности приблизительно 107 KOE/мл. Размер инокулюма определили подсчетом выживаемости на 5% кровяном агаре. Нейтропению вызывали посредством предварительной обработки мышей циклофосфамидом (6 мг в сутки в течение трех суток). Мышей инъецировали внутриперитониально 0,5 мл энтерококковой суспензии, вызывающей бактериемию за 1 ч инокуляции. Антибиотическую терапию начали сразу после инокуляции. Линезолид и соединение 3 ввели подкожно в область шеи в объеме 0,5 мл на дозу. В каждой опытной группе было 3 мышей. Инокулированные контрольные мыши без лечения были включены во все опыты. (Ссылка метода: Erlandsdottir et al; Antimicrob Agents Chemother. 2001 Apr; 45(4): 1078-85.) Таблица 8. Режимы лечения инфицированных мышей Эффекты различных режимов лечения определяли в течение 5 ч лечения путем оценки подсчетов бактерий в перитонеальной жидкости. После убийства мышей осуществили промывание брюшины посредством инъекции 2 мл стерильного физиологического раствора внутрибрюшинно с последующим массированием брюшка и затем вскрытием брюшины для сбора жидкости. Перитонеальные жидкости немедленно разбавили в 10 раз соляным раствором, из которой 20 мкл высеяли на планшеты с 5% кровяным агаром пятнами с последующим подсчетом колоний после инкубации в течение ночи при 35 С. Самые низкие определяемые уровни для подсчета бактерий в крови и перитонеальной жидкости составляли 50 и 250 KOE/мл, соответственно. Бактерицидные эффективности режимов лечения на моделях мышей вычислили путем вычитания результатов каждой обработанной мыши из средних результатов для контрольной мыши в конце лечения (5 ч). Понижение в одну тысячу раз (3 log10 этапа) представляет собой максимальный эффект в данной модели и подтверждает сильный бактериальный поражающий эффект протестированных соединений. Результаты. Сильная усиливающая активность соединения 3 при мышином перитоните. Бактериальная активность линезолида и соединения 3 отдельно или в комбинации при мышином перитоните показана в табл. 9. Как видно, отдельно линезолид в субтерапевтической дозе не имел эффекта на инфекцию, а устойчивые бактерии не ликвидировались из брюшины мыши. Но при лечении мышей линезолидом и соединением 3 в комбинации бактерии были ликвидированы и выжило менее 0,001% (р 0,05). Соединение 3 отдельно не оказывало влияния на бактерии в соответствии с даваемой субтерапевтической дозой. Таблица 9. Усиливающий эффект соединения 3 в мышиной модели перитонита Пример 8. Синергические эффекты соединений деалкилированного фенотиазина или тиоксантена на грибах. Фунгицидное средство. Флуконазол (Pfizer, Баллеруп, Дания). Изоляты субкультивировали в течение 24 ч на глюкозном агаре Сабуро перед тестированием чувствительности. Выполнили тесты микроразведения среды согласно документу NCCLS М 27-А (Ref: National Commitee for Clinical Laboratory Standards. (1997). Reference Method for Broth Dilution Antifungal SusceptibilityTesting of Yeasts: Approved Standard M27-A. NCCLS, Уэйн, Пенсильвания). Микротитровальные планшеты считывали спектрофотометрически при 530 нм после перемешивания лунок путем пипетирования для ресуспендирования дрожжевых седиментов. MIC определяли как самое низкое растворение лекарственного средства, приводящее к 80% ингибированию роста, для фуконазола. Применяли следующие экспериментальные контрольные точки: чувствительные к флуконазолу(S), MIC8 мг/л; чувствительные дозозависимые (SSD), MIC 8-64 мг/л; и устойчивые (R), MIC64 мг/л. Фракционную ингибирующую концентрацию (FIC) рассчитывали для противоинфекционного средства отдельно и в комбинации с соединением 3 и 4 (смотри табл. 4), как описано выше. Синергизм определяли как показатель FIC 0,5. Рассчитанные показатели FIC показаны в табл. 10 ниже. Таблица 10 а. Синергические эффекты соединения 3 на Candida albicans Таблица 10b. Синергические эффекты соединения 4 на Candida albicans Показатель FIC для соединения 3 и 4 показывает, что данные соединения являются синергическими при стимуляции фунгицидного эффекта фунгицидных средств у устойчивых к лекарствам клеток. Как можно видеть, показатели FIC для хемосенсибилизирующих соединений, проанализированных на устойчивых к лекарствам клетках, составляли 0,5. Таким образом, клиническое применение, например, соединения 3 и 4 в комбинации с фунгицидным средством, может, вероятно, сдвинуть MIC данного фунгицидного средства для DR-клеток значительно ниже клинически достигаемой концентрации, демонстрируя эффективные концентрации при 0,5 мкг/мл. Пример 9. Усиливающие эффекты соединения 3 на противовирусные соединения. Усиливающий эффект соединения 3 на противовирусные соединения изучали исследованиям в шахматном порядке, воздействуя на ВИЧ-инфицированные клетки 0-3 мкМ противовирусным средством при отсутствии или в присутствии соединения 3 в концентрациях 0-6 мкМ. Каждый эксперимент выполнили в трех повторностях. Значения MIC представляли средние значения двух отдельных экспериментов. Способы. Вирусы и клетки. Штамм HTLV-IIIB ВИЧ-1 размножали в клетках Н 9 при 37 С, 5% СО 2 с использованием RPMI 1640 с 10% инактивированной нагреванием фетальной телячьей сыворотки (FCS) и антибиотиками (ростовая среда). Культуральный супернатант отфильтровали (0,45 нм), разделили на аликвоты и хранили при -80 С до применения. Штамм ВИЧ-1 получили по программе исследования и контроля СПИДА Национального института здоровья. Соединения. Противовирусное средство: AZT, (3'-азидо-3'-дезокситимидин), Glaxo Wellcome. Усиливающее соединение: транс-клопентиксол получили в виде порошкового вещества-эталона отBritish Pharmacopoeia Commission Laboratory, Мидлсекс, Соединенное Королевство. Ингибирование репликации ВИЧ-1. Соединения проверяли по возможной противовирусной активности против штамма IIIB ВИЧ-1 с использованием клеток МТ 4 в качестве мишеневых клеток. Клетки МТ 4 инкубировали с вирусом (0,005MOI) и ростовой средой, содержащей тестируемые растворения соединения(й) в течение шести дней параллельно с инфицированным вирусом и неинфицированными контрольными культурами без добавления соединения. Экспрессию ВИЧ в культурах определяли количественно косвенно с помощью анализа МТТ (на основе 3-4,5-диметилтиазол-2-ил-2,5-дифенилтетразолий бромида), как описано ранее. Соединения, обеспечивающие менее чем 30% снижение экспрессии ВИЧ, рассматривали как не имеющие биологической активности. Соединения тестировали параллельно по цитотоксическому эффекту в неинфицированных культурах МТ 4, содержащих тестируемые растворения соединения, как описано выше. Культуры для теста и противовирусной активности и цитотоксического эффекта проводили в трех повторностях по 200 мл на культуру в микротитровальных планшетах. 30% ингибирование клеточного роста относительно контрольных культур считали существенным. 50% ингибирующую концентрацию определили интерполяцией от наблюдений процентного ингибирования против концентрации соединения. ЕС 50 определяют как эффективную концентрацию, которая ингибирует 50% вирусного продуцирования, 50% вирусной инфекционности или 50% индуцированного вирусом цитопатического эффекта. СС 50 определяют как ингибирующую концентрацию, которая снижает клеточный рост или жизнеспособность неинфицированных клеток на 50%. Результаты. Как видно в табл. 11, комбинация соединения 3 (см. табл. 4) и AZT дала 5-кратное усиление противовирусного эффекта AZT, и, таким образом, может быть достаточной для ингибирования устойчивых вирусных штаммов. Соединение 3 отдельно не обладало противовирусным или цитотоксическим эффектом в использованных концентрациях. Таблица 11. Усиливающий эффект соединения 3 (С 3) на противовирусное соединение AZT (А). Концентрации в мкМ ЕС 50 определяют как эффективную концентрацию, которая ингибирует 50% вирусной продукции,50% вирусной инфекционности или 50% индуцированного вирусом цитопатического эффекта. СС 50 определяют как ингибирующую концентрацию, которая снижает клеточный рост или жизнеспособность неинфицированных клеток на 50%. Ссылка на метод вирусного теста: Petersen L, Jorgensen PT, Nielsen С, Hansen TH, Nielsen J, PedersenProdrug Approach. J. Med. Chem. 2005, 48, 1211-1220. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение общей формулы (I)n представляет собой целое число в диапазоне от 1 до 5; каждый X отдельно выбран из группы, включающей водород, галоген, гидрокси, амино, нитро, C1-6 алкил и C1-6-алкокси;R2 выбран из группы, включающей F, Cl, Br, I, CH2Y, CHY2 и CY3, где Y представляет собой атом галогена; иn представляет собой целое число в диапазоне от 1 до 6; каждый X отдельно выбран из группы, включающей водород, галоген, гидрокси, амино, нитро, C1-6 алкил и C1-6-алкокси;R2 выбран из группы, включающей F, Cl, Br, I, CH2Y, CHY2 и CY3, где Y представляет собой атом галогена; иR13 представляет собой водород, галоген, гидрокси, амино, нитро или C1-6-алкил, замещенный гидроксигруппой; или его соль. 4. Применение соединения по любому из пп.1-3 в лечении инфекционной болезни. 5. Применение по п.4, где лечение инфекционной болезни осуществляют в комбинации с дополнительным противоинфекционным средством. 6. Применение по любому из пп.4, 5, где инфекционная болезнь вызывается устойчивым к лекарству инфекционным агентом. 7. Применение соединения по любому из пп.1-3 для получения лекарства для лечения или профилактики инфекционной болезни. 8. Способ лечения или предотвращения инфекционной болезни у субъекта, причем при указанном способе вводят указанному субъекту соединение по любому из пп.1-3 в клинически релевантном количестве. 9. Фармацевтическая композиция для лечения или предупреждения инфекционной болезни, включающая соединение по любому из пп.1-3 и по меньшей мере один фармацевтически приемлемый носитель или наполнитель. 10. Фармацевтическая композиция по п.9, содержащая клинически релевантное количество соединения по любому из пп.1-3.
МПК / Метки
МПК: A61P 31/00, C07D 409/06, A61K 31/5415
Метки: заболеваний, фармацевтическая, соединение, соответствующий, содержащая, указанное, способ, лечения, композиция, инфекционных
Код ссылки
<a href="https://eas.patents.su/26-22060-soedinenie-dlya-lecheniya-infekcionnyh-zabolevanijj-sootvetstvuyushhijj-sposob-i-farmacevticheskaya-kompoziciya-soderzhashhaya-ukazannoe-soedinenie.html" rel="bookmark" title="База патентов Евразийского Союза">Соединение для лечения инфекционных заболеваний, соответствующий способ и фармацевтическая композиция, содержащая указанное соединение</a>
Предыдущий патент: Устройство и способ изготовления и шприцевания тонкоизмельченного колбасного фарша, в частности эмульсии
Следующий патент: Миметики белка smac
Случайный патент: Крутильный инструмент и способ затягивания или ослабления соединения с использованием этого инструмента