Миметики белка smac
Номер патента: 22061
Опубликовано: 30.10.2015
Авторы: Дэн Ицзюнь, Лапорте Мэтью Дж., Риппин Сьюзен Р., Кондон Стивен М.
Формула / Реферат
1. Соединение формулы
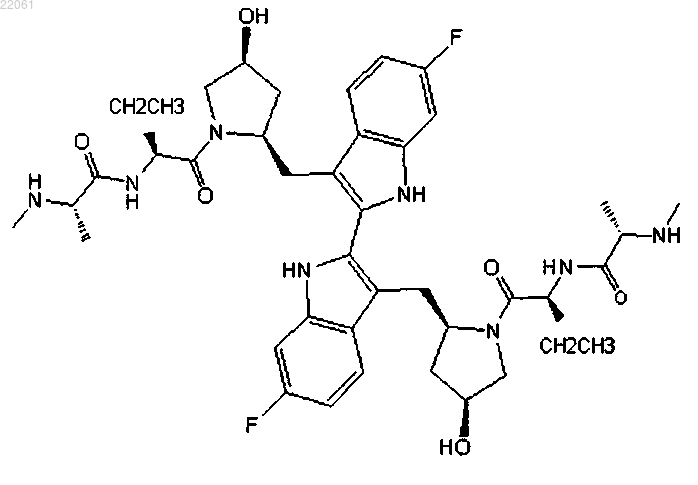
или его фармацевтически приемлемая соль.
2. Фармацевтическая композиция для лечения пролиферативного заболевания, содержащая соединение формулы
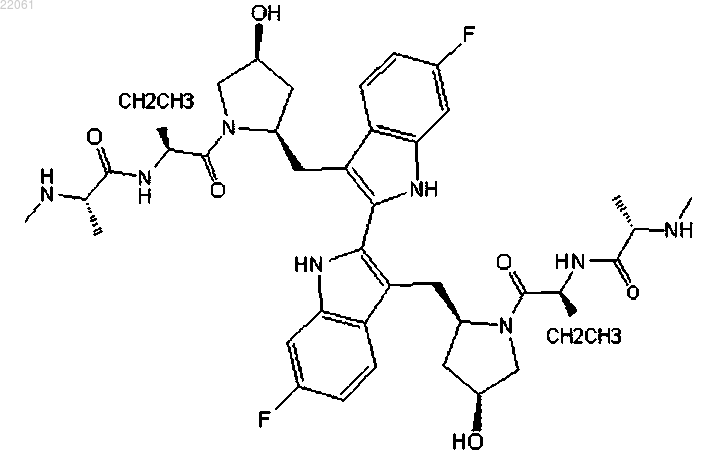
или его фармацевтически приемлемую соль и фармацевтически приемлемое вспомогательное вещество.
3. Фармацевтическая композиция по п.2 для лечения рака.
4. Фармацевтическая композиция по п.2 или 3, выполненная в виде стерильной жидкости для инъекций.
5. Фармацевтическая композиция по пп.2, 3 или 4, являющаяся единичной лекарственной формой.
6. Применение соединения или его фармацевтически приемлемой соли по п.1 для лечения пролиферативного заболевания у млекопитающих.
7. Применение по п.6, в котором пролиферативным заболеванием является рак, выбранный из группы, включающей следующие виды рака: рак поджелудочной железы, рак яичников, рак молочной железы, мезотелиому, периферическую нейрому, глиобластому, меланому, адренокортикальную карциному, СПИД-ассоциированную лимфому, рак анального канала, менингиому, глиому, астроцитому, рак шейки матки, хронические миелопролиферативные заболевания, рак толстой кишки, эндометриальный рак, эпендимому, рак пищевода, саркому Юинга, экстракраниальные герминогенные опухоли, внегонадные герминогенные опухоли, рак внепеченочных желчных путей, рак желчного пузыря, рак желудка, карциноидные опухоли желудочно-кишечного тракта, гестационные трофобластические опухоли, лейкоз ворсистых клеток, лимфому Ходжкина, неходжкиновскую лимфому, гипофарингеальный рак, интраокулярную меланому, рак островковых клеток, саркому Капоши, ларингеальный рак, лейкемию, рак губы, рак ротовой полости, рак печени, рак мужской груди, злокачественную мезотелиому, медуллобластому, карциному из клеток Меркеля, метастатический сквамозный рак шеи, множественную миелому и иные неоплазмы плазмацитов, фунгоидный микоз и синдром Сезари, миелодиспластический синдром, назофарингеальный рак, нейробластому, немелкоклеточный рак легкого, мелкоклеточный рак легкого, рак ротоглотки, рак костей, в том числе остеосаркому и злокачественную фиброзную гистиоцитоксантому костей, рак придаточных пазух носа, рак паращитовидной железы, рак полового члена, феохромоцитому, опухоли гипофиза, рак предстательной железы, рак прямой кишки, гипернефроидный рак, ретинобластому, рабдомиосаркому, рак слюнных желез, рак тонкого кишечника, саркому мягких тканей, супратенториальные примитивные нейроэктодермальные опухоли, пинеобластому, рак яичек, тимому, рак щитовидной железы, переходно-клеточный рак почечной лоханки и мочеточника, уретральный рак, саркому матки, влагалищный рак, вульварный рак, опухоль Уилма и иные опухоли почек у детей.
8. Применение по п.6, в котором пролиферативным заболеванием является рак, выбранный из группы, включающей саркомы, рак мочевого пузыря, рак яичников, рак молочной железы, рак мозга, рак поджелудочной железы, рак толстой кишки, рак крови, рак кожи, рак легких и рак костей.
9. Применение по п.6, в котором пролиферативным заболеванием является рак, выбранный из группы, включающей колоректальный рак, карциному почек, карциному яичника, карциному поджелудочной железы, карциному простаты, карциному молочных желез, меланому, глиобластому, острый миелолейкоз, мелкоклеточный рак легкого, немелкоклеточный рак легкого, рабдомиосаркому и базалиому.
10. Применение соединения или его фармацевтически приемлемой соли по п.1 для индуцирования апоптоза в клетке.
11. Применение по п.10, в котором клетка является раковой клеткой.
12. Применение по любому из пп.6-11, при котором соединение или его фармацевтическую соль по п.1 применяют (или назначают) в сочетании с другой противораковой терапией, выбранной из лучевой терапии, химиотерапии, иммунотерапии и(или) фотодинамической терапии или их сочетаний.
13. Применение соединения или его фармацевтически приемлемой соли по п.1 для лечения аутоиммунного заболевания, в котором аутоиммунное заболевание является заболеванием, при котором состояние вызвано или обусловлено аномальным регулированием апоптоза и выбрано из группы, включающей системную красную волчанку, псориаз и идиопатическую тромбоцитопеническую пурпуру (синдрома Верльгофа).
14. Соединение формулы
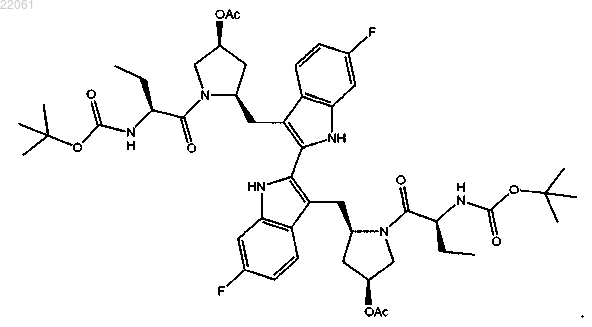
15. Соединение формулы
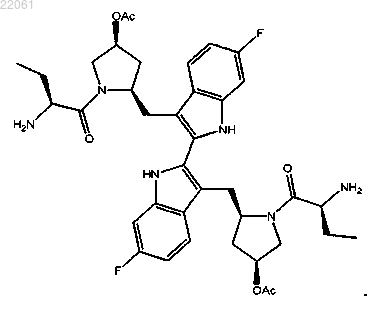
16. Соединение формулы
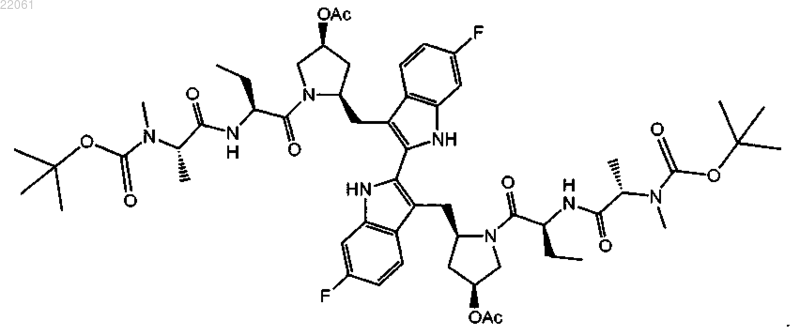
17. Соединение формулы
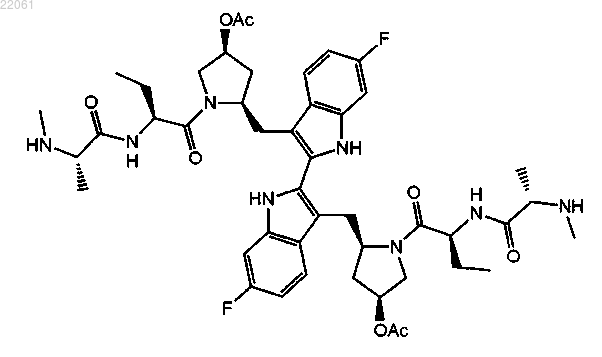
18. Способ получения соединения по п.1, включающий снятие защиты со следующего соединения:
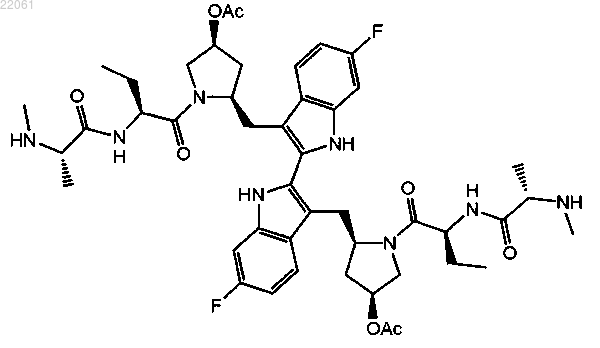
19. Соединение формулы
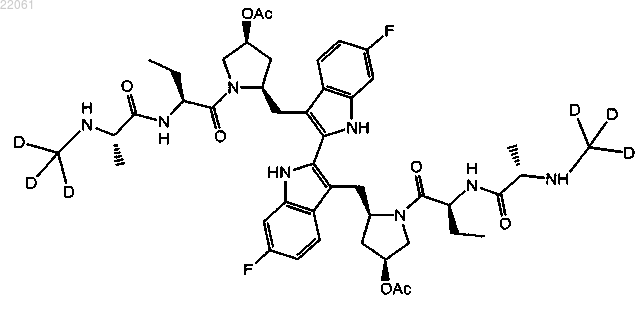
20. Соединение формулы
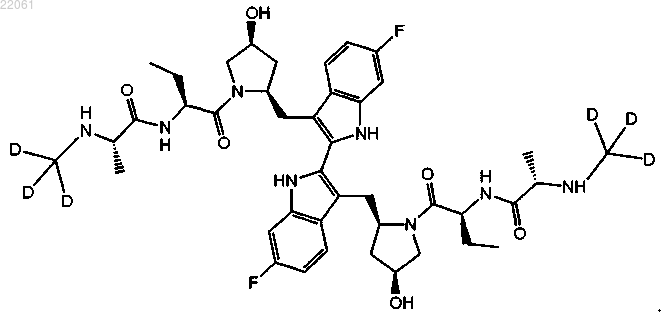
21. Соединение формулы
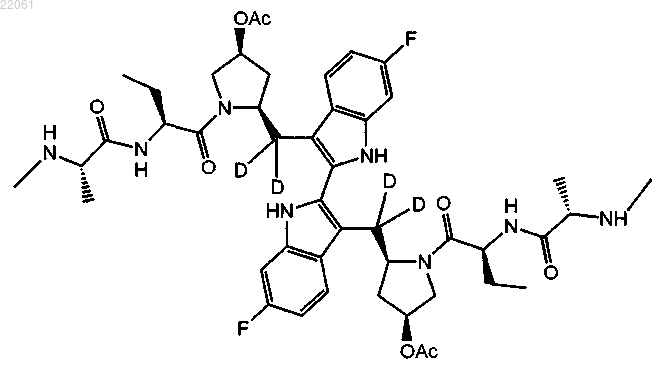
22. Соединение формулы

23. Соединение формулы
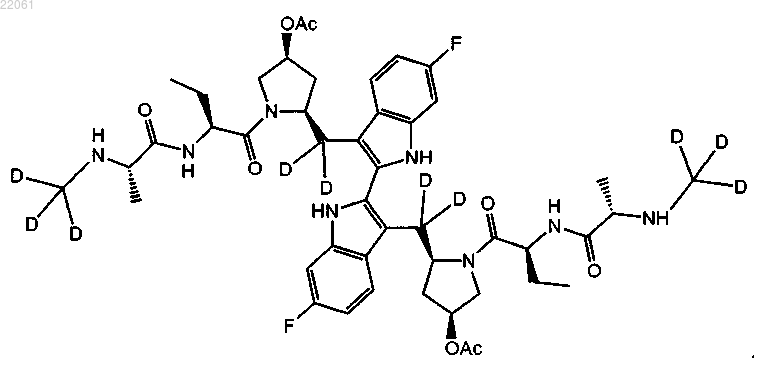
24. Соединение формулы

Текст
Настоящее изобретение касается соединения формулы или его фармацевтически приемлемой соли. Оно также относится к фармацевтической композиции для лечения пролиферативного заболевания, содержащей соединение согласно изобретению. Область техники, к которой относится изобретение Настоящее изобретение относится к миметикам белка SMAC, их композициям и их применению для лечения пролиферативных заболеваний, в том числе рака. Предпосылки создания изобретения Ингибиторы белков апоптоза (IAP) представляют собой внутриклеточные белки естественного происхождения, подавляющие каспаззависимый апоптоз. Белок SMAC, также известный как DIABLO,является еще одним внутриклеточным белком, антагонизирующим, т.е. ингибирующим активность IAP. В нормальных здоровых клетках белок SMAC и IAP функционируют вместе для поддержания здоровых клеток. Тем не менее, при определенном течении заболевания, например, при раке и других пролиферативных заболеваниях не удается в достаточной степени антагонизировать IAP, и, таким образом, они предотвращают апоптоз и вызывают или индуцируют аномальную пролиферацию и выживание. Миметики белка SMAC, также известные как IAP-антагонисты, являются синтетическими малыми молекулами, имитирующими структуру и активность IAP-антагониста четырех N-концевых аминокислот белка SMAC. (Миметики белка SMAC в ряде случаев называют IAP-антагонистами). При введении животным, страдающим от пролиферативных заболеваний, миметики белка SMAC антагонизируют IAP,тем самым вызывая усиление апоптоза среди аномально пролиферирующих клеток. Примеры пептидомиметиков белка SMAC раскрыты в патентах US 7517906; US 7309792; US 7419975; US 2005/0234042; US 2005/0261203; US 2006/0014700; US 2006/0025347; US 2006/0052311; US 2006/0128632; US 2006/0167066; US 2007/0042428; US 2007/032437; US 2008/0132485; WO 2005/069888;WO 2008/045905; WO 2008/016893; WO 2007/136921; WO 2007/021825; WO 2007/130626; WO 2007/106192 и WO 2007/101347. Краткое изложение существа изобретения В одном аспекте настоящее изобретение предусматривает создание N-1S-[2R-(6,6'-дифтор-3'-4Sгидрокси-1-[2S-(2S-метиламинопропиониламино)бутирил]пирролидин-2R-илметил-1 Н,1'Н-[2,2']бииндолил-3-илметил)-4S-гидроксипирролидин-1-карбонил]пропил-2S-метиламинопропионамид и его фармацевтически приемлемых солей, а также различных форм такого соединения и его солей в соответствии с описанием, изложенным ниже. Указанное соединение имеет нижеприведенную структуру: в которой R5 обозначает -СН 2 СН 3. Указанное соединение также называется в настоящем описании соединением 15. В соответствующих аспектах настоящее изобретение предусматривает создание фармацевтической композиции, включающей такое соединение, и способа лечения пролиферативных заболеваний у человека или у нечеловекоподобных млекопитающих, нуждающихся в таком лечении, предусматривающем введение в организм субъекта эффективного количества указанного соединения или его фармацевтически приемлемой соли. В других аспектах настоящее изобретение предусматривает создание способа лечения пролиферативных заболеваний у млекопитающих, нуждающихся в таком лечении, например у человека или домашних животных, мясомолочного скота или охотничьих животных, предусматривающего введение в организм животного эффективного количества соединения 15 или его фармацевтически приемлемой соли. В другом иллюстративном примере настоящее изобретение предусматривает создание способа индуцирования апоптоза в клетке, включающей создание контактного взаимодействия между клеткой и соединением 15 или его фармацевтически приемлемой солью. В данном примере осуществления настоящего изобретения клетка может представлять собой, например, раковую клетку. В дополнительных иллюстративных примерах осуществления настоящее изобретение предусматривает создание любого одного или нескольких из вышеуказанных способов, далее включающих проведение терапии вторичного рака, такой как, например, лучевой терапии, химиотерапии, иммунотерапии и(или) фотодинамической терапии и их сочетание. В дополнительном иллюстративном примере осуществления настоящее изобретение предусматривает создание способа лечения аутоиммунного заболевания, при котором состояние вызвано или индуцировано аномальным регулированием апоптоза в млекопитающем, нуждающемся в таком лечении, в том числе, например, системной красной волчанки, псориаза и идиопатической тромбоцитопенической пурпуры (синдрома Верльгофа), при этом способ предусматривает введение в организм животного эффективного количества соединения 15 или его фармацевтически приемлемой соли. Краткое описание чертежей Фиг. 1 - средняя потеря веса тела крыс в процентном выражении через 4 дня после внутривенного болюсного введения миметиков белка SMAC в соответствии с описанием в примере 4. Фиг. 2 - средний объем опухоли (2 А) и изменение веса тела (2 В) в результате лечения ксенотрансплантата от человека у безтимусных мышей с использованием миметиков белка SMAC в соответствии с описанием в примере 5. Подробное описание изобретения Соединение в соответствии с настоящим изобретением является миметиком белка SMAC, который может быть использован при лечении пролиферативных заболеваний, например различных доброкачественных или злокачественных опухолей (рака), доброкачественных пролиферативных заболеваний (например, псориаза, доброкачественной гиперплазии предстательной железы и рестеноза), либо аутоиммунных заболеваний (например, аутоиммунного пролиферативного гломерулонефрита, лимфопролиферативных аутоиммунных ответов). Виды рака, лечение которых потенциально можно проводить с использованием IAP-антагонистов, включают без ограничения следующие виды рака: легочную аденокарциному, рак поджелудочной железы, рак толстой кишки, рак яичников, рак молочной железы, мезотелиому, периферическую нейрому, рак мочевого пузыря, глиобластому, меланому, адренокортикальную карциному, СПИД-ассоциированную лимфому, рак анального канала, менигиому, глиому, астроцитому,рак шейки матки, хронические миелопролиферативные заболевания (например, хронический лимфоцитарный лейкоз, хроническая гранулоцитная лейкемия), рак толстой кишки, рак эндокринных желез, эндометриальный рак, эпендимому, рак пищевода, саркому Юинга, экстракраниальные герминогенные опухоли, внегонадные герминогенные опухоли, рак внепеченочных желчных путей, рак желчного пузыря, рак желудка, карциноидные опухоли желудочно-кишечного тракта, гестационные трофобластические опухоли, лейкоз ворсистых клеток, лимфому Ходжкина, неходжкиновскую лимфому, гипофарингеальный рак, интраокулярную меланому, рак островковых клеток, саркому Капоши, ларингеальный рак, лейкемию, острый лимфобластный лейкоз, острый миелолейкоз, рак губы, рак ротовой полости, рак печени,рак мужской груди, злокачественную мезотелиому, медуллобластому, меланому, карциному из клеток Меркеля, метастатический сквамозный рак шеи, множественную миелому и иные неоплазмы плазмацитов, фунгоидный микоз и синдром Сезари, миелодиспластический синдром, назофарингеальный рак,нейробластому, мелкоклеточный рак лгкого, немелкоклеточный рак лгкого, рак ротоглотки, рак костей, в том числе остеосаркому и злокачественную фиброзную гистиоцитоксантому костей, эпителиальный рак яичников, овариальные герминогенные опухоли, пограничную опухоль яичника, рак поджелудочной железы, рак придаточных пазух носа, рак паращитовидной железы, рак полового члена, феохромоцитому, опухоли гипофиза, рак предстательной железы, рак прямой кишки, гипернефроидный рак,ретинобластому, рабдомиосаркому, рак слюнных желез, рак кожи, рак тонкого кишечника, саркому мягких тканей, супратенториальные примитивные нейроэктодермальные опухоли, пинеобластому, рак яичек, тимому, рак вилочковой железы, рак щитовидной железы, переходно-клеточный рак почечной лоханки и мочеточника, уретральный рак, саркому матки, влагалищный рак, вульварный рак, опухоль Уилма и иные опухоли почек у детей. В ряде примеров осуществления настоящего изобретения предусматривается индуцирование апоптоза клеток, в частности патологически пролиферирующих клеток. Указанные способы могут быть осуществлены in vitro или in vivo. Способы в соответствии с настоящим изобретением могут предусматривать введение соединения в соответствии с настоящим изобретением отдельно, введение сочетания IAP-антагонистов или введение соединения в соответствии с настоящим изобретением с одним или несколькими дополнительными IAPантагонистами или без них и одного или нескольких дополнительных химиотерапевтических веществ. Введение нескольких веществ может осуществляться одновременно или последовательно. Эффективные химиотерапевтические вещества включают без ограничения алкилирующие вещества (например, циклофосфамид, мехлорэтамин, хлорамбуцил, мелфалан), антрациклины (например, даунорубицин, доксорубицин, эпирубицин, идарубицин, митоксантрон, валрубицин), цитоскелетные деструкторы (например,паклитаксел, доцетаксел), эпотилоны (например, эпотилон А, эпотилон В, эпотилон D), ингибиторы топоизомеразы II (например, этопозид, тенипозид, тафлупозид), аналоги нуклеотидов и аналоги прекурсоров (например, азацитидин, азатиоприн, капецитабин, ситарабин, доксифлюридин, фторурацил, гемцитабин, меркаптопурин, метотрексат, тиогуанин), пептидные антибиотики (например, блеомицин), вещества на основе платины (например, карбоплатин, цисплатин, оксалиплатин), ретиноиды (например, политрансретиноевая кислота) и алкалоиды и производные винка (например, винбластин, винкристин, виндезин,-2 022061 винорелбин). В ряде примеров осуществления настоящего изобретения химиотерапевтические вещества включают флударабин, доксорубицин, паклитаксел, доцетаксел, камптотецин, этопозид, топотекан, иринотекан, цисплатин, карбоплатин, оксалиплатин, амсакрин, митоксантрон, 5-фтор-урацил или гемцитабин. В ряде примеров осуществления настоящего изобретения фармацевтические композиции, содержащие соединение в соответствии с настоящим изобретением в отдельности или в сочетании с одним или несколькими другими активными фармацевтическими ингредиентами, вводят человеку или животному. Фармацевтические композиции обычно содержат по меньшей мере одно фармацевтически приемлемое вспомогательное вещество, например носитель или разбавитель, и они могут быть введены обычным способом, в том числе системно, топикально или перорально. Введение обычно осуществляется путем внутривенной инъекции либо в виде болюсного или инфузионного введения, однако не исключены иные способы введения. Составы для внутривенного введения могут представлять собой соединение 15(1 мг/мл) в стерильном 0,05 М фосфат-цитратном буферном растворе (PBS), рН 5. Конкретные способы введения зависят от показания и иных факторов, в том числе от конкретно вводимого соединения. Количество вводимого соединения является количеством, являющимся терапевтически эффективным. Вводимая доза зависит от характеристик субъекта, подвергаемого лечению, например от конкретного подвергаемого лечению пациента, возраста, веса, состояния здоровья, видов сопутствующего лечения, если таковое проводится. Частота лечения может быть легко определена специалистом в данной области техники (например, врачом-клиницистом). Обычно соединение в соответствии с настоящим изобретением вводят путем внутривенной инъекции, в том числе, например, путем инфузионного введения в течение от приблизительно 1 до приблизительно 120 мин, например в течение приблизительно 30 мин. Фармацевтическая композиция в соответствии с настоящим изобретением является композицией, в которой активный фармацевтический ингредиент, т.е. соединение в соответствии с настоящим изобретением, является достаточно чистым, и композиция в любом случае является приемлемой для введения в организм человека или иного млекопитающего. Фармацевтическая композиция может быть приготовлена в форме одноразовой дозы, т.е. в форме, приемлемой для одноразового введения субъекту. Таким образом, например, фармацевтическая композиция в форме внутривенной одноразовой дозы может включать ампулу или предварительно заполненный шприц, при этом каждое из устройств содержит эффективное количество или подходящую фракцию эффективного количества таким образом, чтобы обеспечивалось введение одного из содержимых одной ампулы или шприца за один прием. Такое введение может быть повторено до приблизительно 4 раз в день в течение определенного периода времени при необходимости достижения накопленной эффективной дозы, например, при необходимости достижения регрессии опухоли. Режим дозирования может представлять собой, например, ежедневные или проводимые два раза в неделю внутривенные инъекции, либо, например, еженедельные инъекции при трехнедельном цикле и недельном перерыве в том случае, если лечение является эффективным, например, до тех пор,пока болезнь прогрессирует или не разовьется непереносимость препарата. Эффективная доза, вводимая при каждой инъекции, представляет собой эффективное и переносимое количество; эффективная доза может составлять, например, 0,01-30 мг/м 2, например 0,2-10 мг/м 2 или, например, 0,5-5 мг/м 2. Соединение в соответствии с настоящим изобретением может быть применимо локально в виде изолированной перфузии конечностей. Соединение в соответствии с настоящим изобретением также может быть применено топикально в виде крема, геля, лосьона или мази, либо в виде резервуарного или матричного пластыря, либо в виде системы активной трансдермальной доставки. Эффективная доза является дозой, которая в течение курса терапии, который может, например, составлять 1 или несколько недель, например несколько курсов с 3-недельным циклом и недельном перерывом, и которая позволяет достичь положительного результата при лечении пролиферативного заболевания, т.е. позволяет снизить скорость прогрессии заболевания, прекратить прогрессию заболевания либо достичь регрессии или ремиссии. Используемые фармацевтические композиции содержат терапевтически эффективное количество соединения в соответствии с вышеприведенным описанием либо его фармацевтически приемлемую соль или его иную форму с одним или несколькими фармацевтически приемлемыми вспомогательными веществами. Фраза "фармацевтическая композиция" относится к композиции, приемлемой для введения при медицинском применении. Следует учесть, что определение надлежащей лекарственной формы, размеров дозировки и способов введения в отношении конкретного пациента находится в пределах компетенции средних специалистов в фармацевтической и медицинской областях. Композиции, приемлемые для парентерального введения, включают стерильный водный препарат соединения или композиции в соответствии с настоящим изобретением, который предпочтительно изотоничен крови реципиента. Рецептура указанного водного препарата может быть составлена в соответствии с известными методами с использованием приемлемых носителей или разбавителей, которые могут включать буферный раствор. При осуществлении совместной, или комбинированной терапии, описание которой более подробно приведено ниже, соединения и композиции в соответствиис настоящим изобретением могут вводиться одновременно с проведением химиотерапии или лучевой терапии, после или до их проведения в той степени, в какой химиотерапевтическое вещество или облучение сенсибилизирует систему к соединениям и композициям в соответствии с настоящим изобретением. Настоящее изобретение также предусматривает использование соединений и композиций в качестве вещества, потенциирующего эффект химиотерапии с другими методами лечения. Термин "химиопотенциирующее вещество" относится к веществу, действие которого направлено на повышение чувствительности организма, тканей или клеток к химическому соединению или относится к лечению, а именно"химиотерапевтическим веществам" или "химиопрепаратам" или к лучевой терапии. Таким образом, соединения и композиции в соответствии с настоящим изобретением могут быть использованы для ингибирования роста опухоли in vivo путем их введения в сочетании с биологическим или химиотерапевтическим веществом либо путем их использования в сочетании с химиолучевой терапией. При таком применении введение соединений и композиций в соответствии с настоящим изобретением может быть проведено до времени и в течение достаточного периода времени для того, чтобы вызвать сенсибилизацию участка, подвергаемого лечению. В другом случае соединения и композиции в соответствии с настоящим изобретением могут быть использованы одновременно с лучевой терапией и(или) дополнительными противораковыми химическими веществами (ниже). Такие системы позволяют избежать многократного введения соединений и композиций в соответствии с настоящим изобретением, тем самым повышая удобство для субъекта и врача и могут являться исключительно приемлемыми для определенных композиций в соответствии с настоящим изобретением. Биологические и химиотерапевтические/антинеопластические вещества и облучение вызывают апоптоз путем активирования внешнего или внутреннего апоптотического пути и ввиду того, что соединения и композиции в соответствии с настоящим изобретением высвобождают антагонисты апоптотических белков (IAPs) и, таким образом, устраняют блокирование апоптоза, сочетание химиотерапевтических/антинеопластических веществ и облучение с соединениями и композициями в соответствии с настоящим изобретением должно обеспечивать аддитивное действие или синергизм для ускорения апоптоза. Сочетание соединения в соответствии с настоящим изобретением и биологического/ химиотерапевтического/антинеопластического вещества и(или) лучевой терапии любого типа, активирующей внешний или внутренний путь, позволяет создать более эффективный способ разрушения опухолевых клеток. Соединение в соответствии с настоящим изобретением взаимодействует с IAP's, таким как XIAP, cIAP-1, cIAP-2, ML-IAP и т.д., и удаляет IAP-опосредованный блок апоптоза. Большинство химиотерапевтических/антинеопластических веществ и(или) лучевая терапия убивают активно делящиеся клетки путем активирования внутреннего апоптотического пути, что в результате приводит к апоптозу и гибели клеток. Биологические противоопухолевые вещества, такие как TRAIL (TNF-зависимый лиганд,индуцирующий апоптоз), активируют внешние апоптотические пути. Как описано более подробно ниже,примеры осуществления настоящего изобретения предусматривают создание сочетаний соединения в соответствии с настоящим изобретением и биологического или химиотерапевтического/ антинеопластического вещества и(или) облучения, что обеспечивает синергетическое действие против нежелательной клеточной пролиферации. Такое синергетическое действие между соединением в соответствии с настоящим изобретением и биологическим или химиотерапевтическим/антинеопластическим веществом и(или) лучевой терапией позволяет повысить эффективность биологического или химиотерапевтического/антинеопластического вещества и(или) лучевой терапии. Это позволяет повысить эффективность используемых в настоящее время биологических или химиотерапевтических/антинеопластических веществ или лучевой терапии, тем самым позволяя повысить процент опухолей, реагирующих на терапию, повысить ремиссию опухолей и потенциально снизить дозу биологического или химиотерапевтического/антинеопластического вещества, необходимого для лечения опухоли,тем самым при этом обеспечивая использование более переносимых доз биологического или химиотерапевтического/антинеопластического вещества и(или) облучения. В примере осуществления в соответствии с настоящим изобретением пациент проходит лечение путем введения соединения или фармацевтической композиции в соответствии с настоящим изобретением в период времени, когда пациент подвержен одновременному или предшествующему облучению или химиотерапии для лечения неопролиферативной патологии опухоли, такой как, без ограничения, рак мочевого пузыря, рак груди, рак простаты, рак легких, рак поджелудочной железы, рак желудка, рак толстой кишки, рак яичников, рак почек, гепатома, меланома, лимфома, саркома и их сочетаний. В другом примере осуществления настоящего изобретения соединение или композиция в соответствии с настоящим изобретением может быть введена в сочетании с биологической или химиотерапевтической терапией и(или) для использования в сочетании с лучевой терапией, иммунотерапией и(или) фотодинамической терапией, тем самым способствуя апоптозу и повышая эффективность химиотерапии,лучевой терапии, иммунотерапии и(или) фотодинамической терапии. Примеры осуществления настоящего изобретения также включают способ лечения пациента, пораженного раком, путем одновременного или совместного введения биологического или химиотерапевтического вещества. Такие биологические и химиотерапевтические вещества включают, без ограничения,-4 022061 химиотерапевтические вещества, описание которых приведено в работе "Modern Pharmacology with Clinical Applications", Sixth Edition, CraigStitzel, Chpt. 56, pg. 639-656 (2004), инкорпорированной в настоящее описание путем отсылки. Химиотерапевтическое вещество может представлять собой без ограничения алкилирующие вещества, антиметаболиты, противоопухолевые антибиотики, продукты растительного происхождения, такие как таксаны, энзимы, гормональные вещества, различные вещества, такие как цисплатин, моноклональные антитела, глюкокортикоиды, митотические ингибиторы, ингибиторы топоизомеразы I, ингибиторы топоизомеразы II, иммуномодулирующие вещества, такие как интерфероны, факторы клеточного роста, цитокины и нестероидные противовоспалительные соединения(INSAID), факторы клеточного роста и ингибиторы киназы. Другие приемлемые классификации для химиотерапевтических веществ включают митотические ингибиторы и антиэстрогенные вещества. Конкретные примеры приемлемых биологических и химиотерапевтических веществ включают без ограничения цисплатин, кармустин (BCNU), 5-фторурацил (5-FU), цитарабин (Ara-С), гемцитабин, метотрексат, даунорубицин, доксорубицин, дексаметазон, топотекан, этопозид, паклитаксел, винкристин,тамоксифен, TNF-, TRAIL и иные члены, т.е. кроме TRAIL и TNF-, суперсемейства молекул TNF, интерферон (в его как -, так и -формах), талидомид, производные талидомида, такие как леналидомид,мелфалан и ингибиторы PARP. Другие конкретные примеры приемлемых химиотерапевтических веществ включают хлорметины, такие как циклофосфамид, алкилсульфонаты, нитрозомочевина, этиленимины, триазены, фолатные антагонисты, пуриновые аналоги, пиримидиновые аналоги, антрациклины,блеомицины, митомицины, дактиномицины, пликамицин, алкалоиды винка, эпиподофиллотоксины, таксаны, глюкокортикоиды, L-аспарагиназа, эстрогены, эндрогены, прогестины, лютеинизирующие гормоны, ацетат октреотида, гидроксимочевина, прокарбазин, митотан, гексаметилмеламин, карбоплатин, митоксантрон, моноклональные антитела, левамизол, интерфероны, интерлейкины, филграстим и сарграмостим. Другой пример настоящего изобретения относится к использованию соединения или композиции в соответствии с настоящим изобретением в сочетании с ингибиторами топоизомеразы для потенциирования их индуцирующего апоптоз эффекта. Ингибиторы топоизомеразы ингибируют ДНК-репликацию и репарацию, тем самым способствуя апоптозу, и указанные ингибиторы используются в качестве химиотермотерапевтических веществ. Ингибиторы топоизомеразы вызывают повреждение ДНК путем ингибирования энзимов, которые необходимы в процессе ДНК репарации. Таким образом, экспорт белкаSmac из митохондриа в клеточный цитазол спровоцирован повреждением ДНК, вызванным ингибиторами топоизомеразы. Предусматривается, что ингибиторы топоизомеразы как типа I (камптотецин, топотекан, SN-38 (активный метаболит иринотекана, так и типа II (этопозид) продемонстрируют сильный синергизм с соединениями в соответствии с настоящим изобретением. Дополнительные примеры веществ,ингибирующих топоизомеразу, которые также могут быть использованы, включают без ограничения иринотекан, топотекан, этопозид, амсакрин, экзатекан, гиматекан и т.д. Другие ингибиторы топоизомеразы включают, например, аклациномицин А, камптотецин, даунорубицин, доксорубицин, эллиптицин,эпирубицин и митаксантрон. Другой пример осуществления настоящего изобретения относится к использованию соединения или композиции в соответствии с настоящим изобретением в сочетании с нестероидными противовоспалительными препаратами (NSAIDs). В другом примере осуществления настоящего изобретения химиотерапевтическое/ антинеопластическое вещество, предназначенное для использования в сочетании с соединениями и композициями в соответствии с настоящим изобретением, может представлять собой содержащее платину соединение. В одном примере настоящего изобретение содержащим платину соединением является цисплатин. Цисплатин способен синергировать с соединением в соответствии с настоящим изобретением и потенциировать ингибирование IAP, такого как без ограничения XIAP, cIAP-1, c-IAP-2, ML-IAP и т.д. В другом примере осуществления настоящего изобретения содержащим платину соединением является карбоплатин. Карбоплатин способен синергировать с соединением в соответствии с настоящим изобретением и потенциировать ингибирование IAP, включая без ограничения XIAP, cIAP-1, c-IAP-2, ML-IAP и т.д. В другом примере осуществления настоящего изобретения содержащим платину соединением является оксалиплатин. Оксалиплатин способен синергировать с соединением в соответствии с настоящим изобретением и потенциировать ингибирование IAP, включая без ограничения XIAP, cIAP-1, c-IAP-2,ML-IAP и т.д. Химиотерапевтические препараты на основе платины относятся к общей группе ДНКмодифицирующих веществ. ДНК-модифицирующие вещества могут представлять собой любое высокореактивное химическое соединение, связывающееся с различными нуклеофильными группами в нуклеиновых кислотах и белках, и вызывать мутагенные, канцерогенные или цитотоксические эффекты. ДНКмодифицирующие вещества действуют на основе различных механизмов - нарушение функции ДНК и гибель клеток; повреждение ДНК/формирование поперечных мостиков или связей между атомами в ДНК; и индуцирование ошибочного спаривания нуклеотидов, ведущее к мутациям для достижения одного и того же конечного результата. Три неограничивающих примера содержащих платину ДНК-5 022061 модицфицирующих веществ включают цисплатин, карбоплатин и оксалиплатин. Еще в одном примере осуществления настоящего изобретения предусматривается терапевтическая комбинация или терапевтическое использование соединения или композиции в соответствии с настоящим изобретением в комбинации с TRAIL, либо с антителами-агонистами TRAIL, либо иными химическими или биологическими веществами, связывающимися с рецептором(ами) TRAIL и активирующими их. Многие типы раковых клеток являются чувствительными к TRAIL-индуцированному апоптозу, в то время как большинство нормальных клеток, по-видимому, проявляют резистентность к указанному действию TRAIL. TRAIL-резистентные клетки могут возникнуть за счет широкого разнообразия различных механизмов, включающих потерю рецептора, присутствие рецепторов-ловушек или сверхэкспрессиюFLIP, которая конкурирует за связывание зимогенкаспазы-8 в процессе образования DISC и ингибирования активированной каспазы-3 и(или) каспазы-9 XIAP. При резистентности в отношении TRAIL соединение или композиция в соответствии с настоящим изобретением могут повысить чувствительность опухолевых клеток к TRAIL, вызывая повышенную гибель клеток, клинические корреляции которой, повидимому, заключаются в повышенной апоптотической активности в TRAIL-резистентных опухолях,улучшенном клиническом ответе, увеличенной длительности ответа и, в конечном счете, в повышенной выживаемости пациентов. В другом примере осуществления настоящего изобретения соединение 15 вводят в сочетании с цитокином, например TNF. Соединения и композиции в соответствии с настоящим изобретением также могут быть использованы для повышения эффективности лучевой терапии (или радиотерапии), т.е. медицинского использования ионизирующей радиации как части раковой терапии для борьбы с клетками злокачественных опухолей. Несмотря на то, что радиотерапию нередко используют как часть радикального лечения, в некоторых случаях ее используют для проведения паллиативного лечения, когда излечивание является невозможным, и цель заключается в облегчении симптомов. Радиотерапию обычно используют для лечения опухолей. Она может быть использована в качестве первичной терапии. Также общепринятой практикой является сочетание радиотерапии с хирургией и(или) химиотерапией. Наиболее распространенными опухолями, лечение которых проводится с использованием радиотерапии, являются рак молочной железы, рак простаты, рак прямой кишки, рак головы и шеи, гинекологические злокачественные опухоли, рак мочевого пузыря и лимфома. Лучевую терапию обычно применяют для воздействия исключительно на локализованный участок, пораженный злокачественной опухолью. Нередко поля облучения также включают дренирующие лимфатические узлы. Возможно проведение, однако в исключительно редких случаях, лучевой терапии всего тела или всей поверхности кожи. Лучевую терапию обычно проводят ежедневно до 35-38 фракций (суточная доза является фракцией). Облучение такими небольшими частыми дозами позволяет здоровым клеткам продолжить рост, устранить повреждение, нанесенное облучением. Три основные раздела радиотерапии включают дистанционную лучевую терапию, или телетерапию, брахитерапию, или радиотерапию с введением источника излучения в капсуле внутрь поражнного органа и радиотерапию с введением источника излучения внутрь поражнного органа путем инъецирования или приема вовнутрь, все из которых являются приемлемыми примерами протокола лечения в соответствии с настоящим изобретением. Различия заключаются в размещении источника излучения; внешний источник излучения располагают снаружи тела, в то время как закрытый и незакрытый источник радиотерапии содержит радиоактивный материал, доставляемый вовнутрь организма. Закрытые источники брахитерапии обычно извлекают после проведения курса лечения, в то время как незакрытые источники инъецируются в организм пациента. Соединение 15 способно образовывать фармацевтически приемлемые соли, в том числе без ограничения соли присоединения кислоты и(или) соли присоединения основания. Такие соли включены во все аспекты настоящего изобретения. Предусматривается, что настоящее изобретение охватывает соединение 15, синтезируемое in vitro с использованием лабораторных методов, таких методов, которые хорошо известны химикам-синтетикам,либо синтезируемое с использованием способов in vivo, например, путем метаболизма, ферментации,гидролиза и т.д. Также предусматривается, что соединение в соответствии с настоящим изобретением может быть синтезировано путем сочетания методов in vitro и in vivo. Настоящее изобретение также включает изотопически обогащенные соединения, являющиеся идентичными соединению 15, за исключением того факта, что один или несколько атомов заменены атомом,имеющим атомную массу или массовое число, отличающееся от атомной массы или массового числа,обычно встречающегося в природе. Примеры изотопов, которые могут быть включены в соединение в соответствии с настоящим изобретением, включают изотопы водорода, углерода, азота, кислорода, фосфора, фтора и хлора, такие как 2 Н, 3 Н,13 С, 14 С, 15N, 16 О, 17 О, 31 Р, 32 Р, 35S, 18F и 36Cl. Кроме того, предусматривается замещение более тяжелыми изотопами, такими как дейтерий, т.е. 2 Н. Изотопически обогащенные соединения в соответствии с настоящим изобретением могут быть обычно получены путем замещения неизотопически обогащенного реагента общедоступным изотопически меченым реагентом. Например, включение дейтерия может быть достигнуто путем замещения боргидрата натрия боргидратом d4 натрия либо путем замены йодметана d3-йодметаном. Репрезентативные примеры конкретных дейтери-6 022061 рованных аналогов и их препаратов приведены в примере 1. Соединение 15 в соответствии с настоящим изобретением может существовать в несольватных, а также сольватных формах, в том числе в гидратных формах. Кроме того, соединение 15 в соответствии с настоящим изобретением может существовать в различных твердых состояниях, в том числе в кристаллической, полукристаллической и аморфной форме (некристаллической форме) и в форме клатратов,пролекарств, полиморфов, биогидролизуемых сложных эфиров, рацемических смесей, нерацемических смесей, либо в виде очищенных стереоизомеров, включая без ограничения оптически чистые энантиомеры и диастереомеры. В целом, все из указанных и иных таких форм предусматривается включить в объем термина "соединение 15". Ссылки на соединение 15 и на соединение в соответствии с настоящим изобретением и иные аналогичные фразы в настоящем описании изобретения и в формуле изобретения включают не только соединение формулы (I), но и фармацевтически приемлемые соли соединения 15, а также различные формы указанного соединения или его соли, такие как формы соединения или его соли, описание которых приведено выше или ниже. В дополнительных примерах осуществления настоящее изобретение предусматривает создание соединений, используемых в качестве промежуточных соединений при синтезировании соединения 15, а также в процессах получения таких промежуточных соединений и соединений 15. Например, в таких примерах осуществления настоящее изобретение предусматривает создание соединений, приведенных в примерах ниже, таких как соединения 9, 10, 11, 12, 13, 14, и изотопически обогащенных соединений, таких как соединения 18-32. Одним таким примером осуществления изобретения является соединение 15, в котором заместитель 4-ОН на пирролидиновой части защищен защитной группой. Иллюстративной защитной группой является ацетильная группа, проиллюстрированная в соединениях 11-14 ниже. Другие эффективные защитные группы очевидны для специалиста в данной области техники, и они включают,например, бензоильную, бензильную, триметилсилильную и трифенилметильную группы. Защитную группу удаляют, например, путем обеспечения взаимодействия между защищенным промежуточным соединением и кислотой или основанием, как показано в схемах XIII и XIV ниже. Таким образом, изобретение предусматривает создание изобретения, имеющего структуру соединения 15, а также защищенного вариантами соединения 15, такими как соединения 13 и 14, в которых N-концы защищены карбаматными частями, и(или) свободные гидроксильные группы защищены как сложные эфиры таких соединений, при этом на такие соединения в настоящем описании называются как защищенное соединение 15. Настоящее изобретение дополнительно включает этап снятия защиты с защищенного соединения 15 путем взаимодействия защищенного соединения 15 с кислотой или основанием, в результате чего происходит удаление защитной группы и получение соединения 15. Изотопически обогащенные соединения в соответствии с настоящим изобретением включают дейтерированные формы соединения 15, такие как соединения 20, 29 и 32. Защищенные формы указанных соединений, например, соединений 19, 28 и 31 также включены в объем настоящего изобретения. Примеры Нижеприведенные препараты и схемы иллюстрируют синтез соединений в соответствии с настоящим изобретением. Аббревиатуры, используемые во всех указанных схемах и в заявке в целом, определены в нижеприведенной таблице:(1,25 л) перемешивали на холодной водяной бане, при этом медленно добавляли суспензию TBS-Cl (188 г, 1,24 моль) в DMF (270 мл) при 21-26 С [примечание: умеренно экзотермическая реакция]. Полученную жидкую суспензию перемешивали в течение 22 ч при комнатной температуре. Реакционную смесь охлаждали до 2 С и быстро охлаждали водой (1,54 л) при 26 С [примечание: значение рН водного слоя составляло 8,5-9,0]. Добавляли МТВЕ (3 л) и смесь подкисляли до значения рН 3-4 концентрированнойHCl (168 г) при 17-19 С. Органический слой отделяли и промывали водой (21,5 л). Органический слой концентрировали под вакуумом и высушивали путем дополнительной дистилляции МТВЕ. Добавляли толуол (2500 мл), дистиллировали для удаления влаги и получали 603 г соединения 2 в виде масла светло-желтого цвета [примечание: содержание воды по методу Карла Фишера составляло 508 ppm]. Путем сушки получали небольшой образец соединения 2 в виде твердого вещества, конечный вес соединения 2 составил 412 г (выход - 96%, без учета поправки на чистоту). 1Z-Hyp(OTBS)-OH (2, 55,5 г, 145 ммоль) растворяли в толуоле (265 мл). Добавляли DMF (0,1 мл) и оксалил хлорид (22,4 г, 174 ммоль) при комнатной температуре. Через 2-3 ч кипение прекращалось. Через 4 ч смесь концентрировали под вакуумом (баня при 65 С, приблизительно 30 мин) и получали 95 г раствора светло-желтого цвета, который по результатам 1 Н ЯМР-анализа был определен как хлорангидрид. 6-Фториндол (39,2 г, 290 ммоль) растворяли в безводном хлорбензоле (300 мл) и толуоле (200 мл) и раствор охлаждали до -4 С с использованием ледяной/ацетоновой бани. Раствор 3 М EtMgBr в диэтиловом эфире (101 г, 294 ммоль) добавляли в течение 31 мин при 2,5 С, в результате чего получали раствор слабо-янтарного цвета. Через 30 мин добавляли раствор хлорангидрида/толуола (см. выше) в течение 45 мин при 2 С. Реакционную смесь выдерживали на холоде в течение 1 ч, затем происходил медленный нагрев смеси. Через приблизительно 4 ч (10,6 С) реакционную смесь быстро охлаждали ледяным НОАс(9,0 г, экзотермическая реакция до 17,5 С) и затем водой (экзотермическая реакция). Добавляли воду(200 мл) и EtOAc (300 мл) и органический слой отделяли и промывали водой (100 мл, медленное отделение). Органический слой концентрировали под вакуумом и получали 227 г соединения 3 в виде масла янтарного цвета, которое использовали без дальнейшей очистки. 1 Н ЯМР (300 МГц, CDCl3), 2:1 смесь ротамеров:9.38 (m, 0.7 Н), 8.58 (m, 0.3 Н), 8.35 (арр. dd, J = 5.2, 8.2 Гц, 0.3 Н), 8.03 (арр. dd, J = 5.2, 8.2 Гц, 0.7H), 7.74 (d, J = 2.9 Гц, 0.7H), 7.66 (d, J = 2.9 Гц, 0.3H),7.38-7.32 (m, 5H), 7.07 (m, 1H), 6.95 (m, 1H), 6.85 (m, 1H), 5.26-4.92 (m, 3H), 4.54 (m, 1H), 3.80 (app. dt, J = 5.2, 11.1 Гц, 1H), 3.61 (app. d, J = 11.1 Гц, 0.3H), 3.55 (app. d, J = 11.1 Гц, 0.7H), 2.25-2.07 (m, 2H), 0.88 (s,9H), 0.06 (s, 3H), 0.00 (s, 3H) ppm; 13C ЯМР (75 МГц, d6-DMSO), смесь ротамеров:193.4, 193.0, 159.3 (d,JCF = 235.5 Гц), 153.9 (d, JCF = 16.2 Гц), 136.7, 136.8 (d, JCF = 34.0 Гц), 134.6, 128.3, 127.8, 127.2, 126.6,122.4, 113.7 (d, JCF = 13.5 Гц), 110.2 (d, JCF = 20.2 Гц), 98.5 (d, JCF = 25.4 Гц), 70.6, 69.8, 65.8, 65.8, 60.6,60.3, 55.5, 55.0, 25.7, 25.6, 17.7, 17.7, -4.8, -4.9 ppm. Масс-спектр (ESI), отношение массы к заряду 518.9 Бензиловый эфир 2-(6-фтор-1 Н-индол-3-карбонил)-4-гидроксипирролидин-1-карбоновой кислоты (4). К раствору, содержащему соединение 3 (227 г) в THF (600 мл), добавляли 1 М TBAF в THF (160 мл) при комнатной температуре. Через 9 ч добавляли еще 20 мл раствора 1 М TBAF/THF. Через приблизительно 48 ч реакционную смесь концентрировали под вакуумом и затем повторно растворяли в EtOAc(600 мл). Органический раствор промывали водой (310 мл) и продукт осаждался с образованием густой суспензии, которую затем (медленно) фильтровали. Твердые вещества промывали EtOAc (165 мл порциями), высушивали и получали 43 г соединения 4. Комбинированный фильтрат концентрировали под вакуумом для осаждения дополнительно 4,8 г соединения 4 после процесса сушки. 1DIAD (37,4 мл, 194 ммоль) в течение 1 ч при 2-3 С. Через 1 ч раствор нагревался до комнатной температуры. Через приблизительно 16 ч реакционную смесь концентрировали под вакуумом, добавляли МеОН(250 мл) и концентрировали до получения густой суспензии (322 г). Дополнительно добавляли МеОН(250 мл), раствор концентрировали под вакуумом и получали густую суспензию (420 г), которую охлаждали в ледяной бане. Через приблизительно 1,5 ч твердое вещество собирали на вакуумном фильтре и промывали охлажденным МеОН (190 мл). Продукт высушивали на воздухе на фильтре и получали 82,9 г(100%) соединение 5 в виде твердого вещества светло-желтого цвета, которое использовали непосредственно в следующей реакции. 1 Н ЯМР (300 МГц, d6-DMSO), смесь ротамеров:12.14 (br s, 1H), 8.47 (app. d, J = 6.6 Гц, 1H), 8.298.21 (m, 3H), 8.03 (dd, J = 2.7, 8.4 Гц, 2H), 7.43-7.33 (m, 2H), 7.28 (app. dd, J = 2.1, 9.6 Гц, 1H), 7.20-7.08 (m,4H), 5.55 (br s, 1H), 5.42 (dd, J = 8.4, 15.3 Гц, 1H), 5.13 (dd, J = 12.6, 22.2 Гц, 1H), 5.04 (s, 1H), 3.99 (m, 1H),3.73 (d, J = 12.3 Гц, 1H), 2.91 (m, 1H), 2.36 (m, 1H) ppm; 13C ЯМР (75 MГц, d6-DMSO), смесь ротамеров:192.9, 192.4, 164.2, 160.0 (d, JCF = 235.5 Гц), 154.5 (d, JCF = 12.0 Гц), 150.9, 137.5, 137.1 (d, JCF = 12.6 Гц),135.6, 135.1, 131.3, 128.9 (d, JCF = 28.0 Гц), 128.5, 128.2, 128.1, 127.6, 124.2, 123.0, 113.5 (d, JCF = 8.5 Гц),110.9 (d, JCF = 21.9 Гц), 99.1 (d, JCF = 25.5 Гц), 75.2, 74.3, 66.7, 66.5, 62.4, 62.1, 53.6, 53.0, 38.6, 37.6 ppm.(6). К суспензии 5 (82,9 г) в THF (600 мл), МеОН (200 мл) и воде (100 мл) добавляли 50% водный раствор NaOH (16,0 г, 200 ммоль) [примечание: экзотермическая реакция; повышение температуры с 23,7 до 25,9 С]. Через 2 ч добавляли ледяной НОАс (5,3 г) для регулирования значения рН до 7-8 [примечание: раствор оранжевого цвета изменился на раствор бледно-желтого цвета], реакционную смесь концентрировали под вакуумом. Добавляли воду (500 мл) и растворитель удаляли под вакуумом до получения густой суспензии. Твердое вещество собирали на вакуумном фильтре и промывали водой (400 мл по порциям). Твердое вещество высушивали в вакуумной печи при 55 С и получали 42,6 г (83%, 2 этапа) соединения 6 в виде твердого вещества серовато-белого цвета. 1 Н ЯМР (300 МГц, d6-DMSO):8.38 (d, J = 11.1 Гц, 1H), 8.14 (ddd, J = 5.7, 8.7, 14.1 Гц, 1H), 7.357.29 (m, 2H), 7.25 (app. dd, J = 2.1, 9.9 Гц, 1H), 7.10-6.95 (m, 4H), 5.16-4.98 (m, 2H), 4.90 (app. q, J = 13.5,25.8 Гц, 1H), 4.26 (m, 1H), 3.74 (app. ddd, J = 6.3, 11.1, 18.3 Гц, 1H), 3.22 (m, 1H), 2.59 (m, 1H), 1.73 (app. Бензиловый эфир 2-(6-фтор-1 Н-индол-3-илметил)-4-гидроксипирролидин-1-карбоновой кислоты (7). К суспензии 6 (10,1 г, 26 ммоль) в безводном THF (200 мл) добавляли 2 М LiBH4 в THF (26,2 мл, 52 ммоль) в течение приблизительно 7 мин [примечание: экзотермическая реакция; повышение температуры с 21,5 до 28,2 С]. Через 2,5 ч раствор бледно-желтого цвета охлаждали до приблизительно 11 С и добавляли метансульфоновую кислоту (4,66 г, 48 ммоль) в течение приблизительно 4 мин [примечание: экзотермическая реакция; повышение температуры до 14,2 С]. Через 16 ч реакционную смесь охлаждали в ледяной бане и осторожно охлаждали водой (50 мл)[примечание: добавление воды вызвало экзотермическую реакцию и высвобождение большого количества газа]. После добавления воды значение рН регулировали до 1 с помощью концентрированной HCl(1,9 г). Реакционную смесь концентрировали для удаления THF и водный раствор экстрагировали EtOAc(110 мл). Органический слой отделяли и промывали водой (250 мл) [примечание: окончательное значение рН составило приблизительно 5]. Органический раствор концентрировали под вакуумом и азеотропно высушивали, используя безводный EtOAc и получали 10,2 г соединения 7 в виде пены белого цвета Бензиловый эфир 4-ацетокси-2-(6-фтор-1 Н-индол-3-илметил)пирролидин-1-карбоновой кислоты (8). К раствору, содержащему соединение 7 (4,7 г, 12,8 ммоль) и DMAP (81 мг, 0,66 ммоль) в DCM (100 мл), добавляли уксусный ангидрид (2,6 г, 25,5 ммоль) при комнатной температуре. Через 16 ч реакционную смесь быстро охлаждали МеОН (приблизительно 3 мл) и последовательно промывали 10% водным раствором Na2CO3 (50 мл), разбавленной HCl (50 мл) и 10% водным раствором Na2CO3 (50 мл). Органический раствор концентрировали под вакуумом и фильтровали через короткую колонку с силикагелемMeOH/DCM (100 мл) до 5% MeOH/DCM (100 мл)]. Содержащие продукт фракции комбинировали, концентрировали и получали 3,28 г (63%) соединения 8 в виде пены белого цвета [примечание: 94,3 А%,анализ методом высокоэффективной жидкостной хроматографии]. 1 Н ЯМР (300 МГц, CDCl3), 1:1 смесь ротамеров:7.99 (m, 1H), 7.75-6.61 (m, 9 Н), 5.28 (m, 1H), 5.20 Бензиловый эфир 4-ацетокси-2-[3'-(4-ацетокси-1-бензилоксикарбонилпирролидин-2-илметил)-6,6'дифтор-1 Н,1'Н-[2,2']бииндолил-3-илметил]пирролидин-1-карбоновой кислоты (9). Раствор, содержащий соединение 8 (2,9 г, 7,1 ммоль) в EtOAc (приблизительно 5 мл), охлаждали в ледяной бане и добавляли предварительно охлажденную TFA (20,3 мл) в виде одной порции. Полученный раствор желтого цвета перемешивали при 2-4 С. Через 4,75 ч холодную реакционную смесь при постоянном перемешивании перелили (через канюлю) в предварительно охлажденную смесь EtOAc (30 мл) и 25% водный раствор K2CO3 (80,7 г). Водный слой отделяли, экстрагировали EtOAc (330 мл) и комбинированные органические экстракты промывали 10% водным раствором Na2CO3 (30 г). Органический раствор концентрировали под вакуумом, азеотропно высушивали, используя безводный EtOAc, и получали 2,95 г соединения диастереомеров индолилиндолина в виде пены желтого цвета, которую использовали непосредственно в следующей реакции. Масс-спектр (ESI), отношение массы к заряду 821.3 [(М)+; рассчитано для C46H46F2N4O8: 820.9]. К раствору, содержащему диастереомеры индолилиндолина (2,95 г) в EtOAc (30 мл), добавлялиDDQ (885 мг, 3,9 ммоль) в виде однократной порции [примечание: экзотермическая реакция; повышение температуры с 26 до 31,6 С]. Через 3 ч реакционную смесь темно-оранжевого/коричневого цвета фильтровали через Celite с последующим промыванием EtOAc (50 мл) [примечание: вторую реакцию, проведенную при 0,5-ммольной шкале, комбинировали для выделения продукта реакции]. Фильтрат промывали 10% водным раствором Na2CO3 (2 промывки: 74 г, затем 58 г). Органический слой концентрировали под вакуумом и получали 2,14 г соединения 9 в виде твердого вещества светло-коричневого цвета. Слой Celite затем промывали THF (100 мл), который концентрировали под вакуумом и получали дополнительно 1,12 г соединения 9 в виде твердого вещества бежевого цвета. Комбинированные твердые вещества растворяли в изопропилацетате (iPrAc, 50 мл). Раствор iPrAc восстанавливали приблизительно до 20 мл и полученную суспензию нагревали до дефлегмирования, охлаждали до комнатной температуры и затем помещали в ледяную баню. Через 1 ч твердое вещество собирали путем вакуумного фильтрования, промывали iPrAc (10 мл), высушивали в вакуумной печи и получали 2,13 г (65%, 2 этапа) соеди- 12022061 нения 9 в виде твердого вещества бежевого цвета [примечание: 100 А%, анализ методом высокоэффективной жидкостной хроматографии]. 1 Н ЯМР (300 МГц, CDCl3):11.29 (br s, 2 Н), 7.57-7.36 (m, 14 Н), 6.90 (арр. dt, J = 2.1, 9.3 Гц, 2H),5.39-5.30 (m, 6H), 4.28 (t, J = 9.0 Гц, 2H), 3.84-3.73 (m, 4H), 3.66 (d, J = 13.2 Гц, 2H), 3.40 (dd, J = 12.0, 14.4 Гц, 2H), 2.31 (s, 6H), 2.17 (m, 2H), 2.05 (m, 2H) ppm; 13C ЯМР (75 МГц, CDCl3):170.7, 161.9, 158.8,156.3, 137.5, 137.3, 136.5, 128.9, 128.6, 128.5, 125.9, 118.8, 118.6, 108.8, 108.5, 108.3, 98.7, 98.3, 74.4, 68.0,60.1, 53.5, 34.5, 28.9, 21.7 ppm. Масс-спектр (ESI), отношение массы к заряду 818.2 [(М)+; рассчитано для 5-[3'-(4-Ацетоксипирролидин-2-илметил)-6,6'-дифтор-1 Н,1'Н-[2,2']бииндолил-3-илметил]пирролидин-3-ил эфир уксусной кислоты (10). Суспензию, содержащую соединение 9 (35 г, 42,7 ммоль) в EtOAc/MeOH (1:1) (400 мл), распределяли по двум 500-мл колбам Парра (приблизительно по 200 мл в каждой) и помещали в них 10% Pd-наугле (влажный, по 5000 мг в каждой, Aldrich). Реакционную смесь подвергали воздействию давления до 50 фунтов/дюйм 2 Н 2 и встряхивали в течение 3 ч. Реакционную смесь фильтровали через слой Celite и твердые вещества промывали EtOAc. Очищенный фильтрат концентрировали под вакуумом и получали 24 г соединения 10 в виде твердого вещества серовато-белого цвета, которое использовали непосредственно в следующей реакции. 1 Н ЯМР (300 МГц, CDCl3):13.10 (br s, 2 Н), 7.45 (dd, J = 5.2, 8.9 Гц, 2H), 7.03 (dd, J = 2.3, 9.8 Гц,2H), 6.85 (m, 2H), 5.35 (m, 2H), 3.71 (m, 2H), 3.18-3.35 (m, 4H), 2.90-3.14 (m, 4H), 2.56 (m, 2H), 2.00-2.10 5-(3'-[4-Ацетокси-1-(2-трет-бутоксикарбониламинобутирил)пирролидин-2-илметил]-6,6'-дифтор 1 Н,1'Н-[2,2']бииндолил-3-илметил-1-(2-трет-бутоксикарбониламинобутирил)пирролидин-3-ил эфир уксусной кислоты (11). К раствору, содержащему Boc-Abu-OH (20,4 г, 100 ммоль) и HATU (42,0 г, 110 ммоль) в безводномNMP (150 мл), при 0 С добавляли NMM (16 мл, 150 ммоль) с последующим добавлением раствора соединения 10 (24 г, 42 ммоль) в NMP (100 мл). Реакционную смесь медленно нагревали до комнатной температуры. Через 16 ч реакционную смесь разбавляли МТВЕ (1000 мл) и гетерогенную смесь промывали водой (500 мл). Слои отделяли и органическая фаза образовывала гетерогенную суспензию. Добавляли МТВЕ (1000 мл) и EtOAc (500 мл) и уже однородный раствор последовательно промывали 1N HCl(2100 мл), насыщенным водным раствором NaHCO3 (2100 мл), рассолом, высушивали над безводнымNa2SO4, фильтровали и концентрировали. Остаток растворяли в DCM/MeOH (соотношение 1:1) (600 мл) и DCM (приблизительно 200 мл) удаляли с помощью дистилляции при 50 С [примечание: наблюдалось выпадение незначительного количества осадка белого цвета]. Добавляли МеОН (200 мл) и удаляли дополнительный растворитель (приблизительно 200 мл) при 50 С. Гетерогенную смесь охлаждали при-5 С. Через 16 ч твердое вещество собирали методом вакуумной фильтрации и промывали холодным МеОН. Твердое вещество высушивали при низком вакууме и получали 32 г соединения 11 в виде твердо- 13022061 5-3'-[4-Ацетокси-1-(2-аминобутирил)пирролидин-2-илметил]-6,6'-дифтор-1 Н,1'Н-[2,2']бииндолил 3-илметил)-1-(2-аминобутирил)пирролидин-3-ил эфир уксусной кислоты (12). Раствор, содержащий соединение 11 (27,5 г, 30 ммоль) в DCM (200 мл), охлаждали до 0 С. Добавляли TFA (50 мл) и реакцию контролировали до тех пор, пока результаты ЖХ/МС анализа не указывали на полное преобразование соединения 11 в соединение 12 (приблизительно 3 ч). Растворитель удаляли под вакуумом и остаток темно-зеленого цвета растворяли в EtOAc (приблизительно 1 л). Раствор EtOAc осторожно вливали в смесь насыщенного водного раствора NaHCO3/льда/воды для нейтрализации остатка TFA. Отделяли органическую фазу и дважды промывали насыщенным водным раствором NaHCO3 и затем один раз рассолом. Комбинированные водные слои обратимо экстрагировали EtOAc (2100 мл) и комбинированные органические экстракты высушивали над безводным Na2SO4, фильтровали, концентрировали и получали 22 г неочищенного соединения 12 в виде твердого вещества серовато-белого цвета. 1 Н ЯМР (300 МГц, CDCl3 + d4-МеОН), смесь ротамеров:11.62 (br s, 2 Н), 7.48-7.62 (m, 4 Н), 6.89 5-(3'-4-Ацетокси-1-[2-(2-метил-(трет-бутоксикарбонил)аминопропиониламино)бутирил]пирролидин-2-илметил-6,6'-дифтор-1 Н,1'Н-[2,2']бииндолил-3-илметил)-1-[2-(2-метил-(трет-бутоксикарбонил) аминопропиониламино)бутирил]пирролидин-3-ил эфир уксусной кислоты (13). К раствору, содержащему Boc-N(Me)Ala-OH (14,6 г, 72 ммоль) и HATU (30,4 г, 80 ммоль) в безводном NMP (150 мл), при 0 С добавляли NMM (12 мл, 105 ммоль) с последующим добавлением соединения 12 (30 ммоль) в NMP (200 мл). Полученную смесь выдерживали до тех пор, пока она не нагревалась до комнатной температуры. Через 16 ч реакционную смесь разбавляли диэтиловым эфиром (1 л), последовательно промывали водой (1 л), 1N HCl (2100 мл), насыщенным водным раствором NaHCO3 (2100 мл), рассолом, высушивали над безводным Na2SO4, фильтровали, концентрировали и получали 33,5 г неочищенного соединения 13. Неочищенное соединение 13 растворяли в EtOH (50 мл) и затем медленно добавляли в воду (1000 мл), активно перемешивая при 50 С, в результате чего получали осадок в виде вещества белого цвета. Гетерогенную смесь охлаждали до -5 С. Через 16 ч твердое вещество собирали методом вакуумной фильтрации и промывали водой. Влажное твердое вещество высушивали при низком вакууме при 50 С и получали 29,9 г соединения 13 в виде твердого вещества серовато-белого цвета. 1 Н ЯМР (300 МГц, CDCl3):11.57 (br s, 2H), 7.40-7.60 (m, 4H), 6.89 (m, 2H), 5.50 (m, 2H), 4.75 (m,2H), 4.67 (q, J = 6.9 Гц, 2H), 4.50 (t, J = 9.6 Гц, 2H), 4.20 (dd, J = 3.9, 12.3 Гц, 2H), 3.85 (d, J = 12.3 Гц, 2H),3.57 (br d, J = 13.5 Гц, 2H), 3.34 (dd, J = 12.0, 13.8 Гц, 2H), 2.89 (s, 6H), 2.34 (s, 6H), 2.10 (m, 2H), 1.95 (dt, J = 6.0, 13.8 Гц, 2H), 1.79 (dt, J = 7.2, 14.1 Гц, 2H), 1.52 (s, 18H), 1.39 (d, J = 7.2 Гц, 6H), 1.03 (t, J = 7.2 Гц, 6H) 5-(3'4-Ацетокси-1-[2-(2-метиламинопропиониламино)бутирил]пирролидин-2-илметил-6,6'дифтор-1 Н,1'Н-[2,2']бииндолил-3-илметил)-1-[2-(2-метиламинопропиониламино)бутирил]пирролидин-3 ил эфир уксусной кислоты (14). Раствор, содержащий соединение 13 (28,5 г, 26 ммоль) в DCM (150 мл), охлаждали до 0 С. Добавляли TFA (50 мл). Через 30 мин реакционную смесь нагревали до комнатной температуры и контролировали до тех пор, пока результаты ЖХ/МС анализа не указывали на полное преобразование соединения 13 в соединение 14 (приблизительно 4 ч). Растворитель удаляли под вакуумом, остаток темно-зеленого цвета растворяли в EtOAc (500 мл) и осторожно вливали в смесь водного раствора NaHCO3/льда. Водную фазу отделяли и обратимо экстрагировали EtOAc (2250 мл). Комбинированные органические экстракты промывали несколько раз насыщенным водным раствором NaHCO3, затем рассолом, высушивали над безводным Na2SO4, фильтровали, концентрировали и получали 24 г соединения 14 в виде твердого вещества светло-желтого цвета. 1 Н ЯМР (300 МГц, CDCl3):11.66 (br s, 2 Н), 8.16 (d, J = 8.4 Гц, 2H), 7.52 (dd, J = 2.1, 9.6 Гц, 2H),7.43 (dd, J = 5.4, 8.4 Гц, 2H), 6.83 (ddd, J = 2.1, 9.0, 9.0 Гц, 2H), 5.41 (dd, J = 4.2, 4.5 Гц, 2H), 4.64 (dd, J = 7.8, 14.1 Гц, 2H), 4.36 (br d, J = 9.3, 9.6 Гц, 2H), 4.13 (dd, J = 4.8, 12.6 Гц, 2H), 3.81 (d, J = 12.0 Гц, 2H), 3.44N-1S-[2R-(6,6'-дифтор-3'-4S-гидрокси-1-[2S-(2S-метиламинопропиониламино)бутирил]пирролидин-2R-илметил-1H,1'Н-[2,2']бииндолил-3-илметил)-4S-гидроксипирролидин-1-карбонил]пропил 2S-метиламинопропионамид (15). К раствору, содержащему соединение 14 (24 г) в МеОН (200 мл), добавляли 1 М NaOH (80 мл) при 0 С. Реакционную смесь дегазировали и выдерживали в атмосфере азота, обернув емкость алюминиевой фольгой. Ледяную баню удаляли. Через 60 мин удаляли МеОН под вакуумом, остаток разбавили водой(200 мл) и экстрагировали EtOAc (500 мл). Водную фазу и обратимо экстрагировали EtOAc (2150 мл). Комбинированные органические экстракты промывали рассолом, высушивали над безводным Na2SO4,фильтровали, концентрировали и получали 22,5 г неочищенного соединения 15 в виде твердого вещества светло-коричневого/желтого цвета. Неочищенное соединение 15 (22,5 г) растворяли в МеОН (50 мл) и EtOAc (200 мл). Объем сокращали (50%) путем дистилляции при пониженном давлении при 60 С, используя роторный испаритель. До- 15022061 бавляли МТВЕ (300 мл) и непрозрачный раствор нагревали до 60 С. Через 30 мин раствор охлаждали до комнатной температуры и затем выдерживали при -5 С. Через 16 ч твердое вещество собирали методом вакуумной фильтрации и промывали холодным 25% EtOAc/MTBE, высушивали при низком вакууме при комнатной температуре и получали 16,6 г соединения 15 в виде твердого вещества серовато-белого цвета. Дополнительно получали 5,5 г соединения 15 из фильтрата путем удаления растворителя и вакуумной сушки. 1 Н ЯМР (300 МГц, CDCl3):11.74 (s, 2H), 8.27 (d, J = 8.7 Гц, 2H), 7.71 (dd, J = 5.4, 8.4 Гц, 2H), 7.55N-трет-бутоксикарбонил-N-d3-метил)аланин (17). К раствору Вос-Ala-ОН (16, 3,5 г, 18,5 ммоль) в безводном THF (50 мл) добавляли NaH (2,1 г, 60% в минеральном масле, 51,0 ммоль) при 0 С. Через 45 мин реакционную смесь нагревали до комнатной температуры и затем нагревали до 45 С в течение еще 20 мин. Реакционную смесь охлаждали до 0 С и добавляли d3-йодметан (10,0 г, 69,0 ммоль). Полученную смесь перемешивали при комнатной температуре. Через 16 ч реакционную смесь быстро охлаждали водой и экстрагировали EtOAc. Органическую фазу отделяли и водный раствор подкисляли до достижения значения рН 3 1N HCl и экстрагировалиEtOAc. Органическую фазу промывали рассолом, высушивали над безводным Na2SO4, фильтровали и концентрировали. Остаток очищали методом ОФ ВЭЖХ (колонка Dynamax 2" С 18; 10-100% растворACN/вода, содержащий 0,1% НОАс, в течение 30 мин; 40 мл/мин) и получали соединение 17 (3,6 г, 94%) в виде твердого вещества белого цвета после лиофилизации. 1 Н ЯМР (300 МГц, d4-МеОН), смесь ротамеров:4.80 (br s, 1H), 4.67 (q, J = 6.9 Гц, 0.5H), 4.38 (q, J = 6.9 Гц, 0.5H), 1.36-1.52 (m, 12H) ppm. Масс-спектр (ESI), отношение массы к заряду 207.0 [(М+Н)+; рассчитано для C9H15D3NO4: 207.2]. Схема XVI 5-(3'-4-Ацетокси-1-[2-(2-d3-метил-(трет-бутоксикарбонил)аминопропиониламино)бутирил]пирролидин-2-илметил-6,6'-дифтор-1 Н,1'Н-[2,2']бииндолил-3-илметил)-1-[2-(2-d3-метил-(трет-бутоксикарбонил)аминопропиониламино)бутирил]пирролидин-3-ил эфир уксусной кислоты (18). К раствору, содержащему Boc-N(d3-Ме)Ala-OH (17, 1,00 г, 4.83 ммоль) и HATU (2,00 г, 5,30 ммоль) в безводном NMP (20 мл), при 0 С добавляли NMM (0,8 мл, 7,20 ммоль) с последующим добавлением соединения 12 (неочищенное, 1,73 г, 2,40 ммоль) в NMP (20 мл). Полученную смесь выдерживали до тех пор, пока она не нагревалась до комнатной температуры. Через 16 ч реакционную смесь разбавляли диэтиловым эфиром (200 мл) и последовательно промывали водой (200 мл), IN HCl (2100 мл), насыщенным водным раствором NaHCO3 (2100 мл), рассолом, высушивали над безводным Na2SO4, фильтровали и концентрировали. Остаток очищали методом ОФ ВЭЖХ (колонка Dynamax 2" С 18; 10-100% растворACN/вода, содержащий 0,1% НОАс, в течение 30 мин; 40 мл/мин). Содержащие продукт фракции комбинировали, замораживали, лиофилизировали и получали 1,1 г соединения 18 (42%) в виде твердого вещества серовато-белого цвета. 1 Н ЯМР (300 МГц, CDCl3), смесь ротамеров:11.56 (br s, 2H), 7.56 (dd, J = 5.4, 8.7 Гц, 2H), 7.52 (m,2H), 7.10 (br s, 2H), 6.89 (ddd, J =2.1, 9.0, 9.0 Гц, 2H), 5.47 (t, J = 4.8 Гц, 2H), 4.75 (br s, 2H), 4.67 (q, J = 6.9 5-(3'-4-Ацетокси-1-[2-(2-d-метиламинопропиониламино)бутирил]пирролидин-2-илметил-6,6'дифтор-1 Н,1'Н-[2,2']бииндолил-3-илметил)-1-[2-(2-d3-метиламинопропиониламино)бутирил]пирролидин-3-ил эфир уксусной кислоты (19). Раствор, содержащий соединение 18 (1,10 г, 1,00 ммоль) в DCM (15 мл), охлаждали до 0 С. Добавляли TFA (5 мл). Через 30 мин реакционную смесь нагревали до комнатной температуры и контролировали до тех пор, пока результаты ЖХ/МС анализа не указывали на полное преобразование соединения 18 в соединение 19 (приблизительно 4 ч). Растворитель удаляли под вакуумом и остаток темно-зеленого цвета растворяли в EtOAc (100 мл) и осторожно вливали в смесь водного раствора NaHCO3/льда. Водную фазу отделяли и обратимо экстрагировали EtOAc (250 мл). Комбинированные органические экстракты промывали несколько раз насыщенным водным раствором NaHCO3, затем рассолом, высушивали над безводным Na2SO4, фильтровали, концентрировали и получали неочищенное соединение 19, которое использовали без дальнейшей очистки. Масс-спектр (ESI), отношение массы к заряду 897.5 [(М)+; рассчитано для C46H54D6F2N8O8: 897.0]. Схема XVIIIN-1S-[2R-(6,6'-Дифтор-3'-4S-гидрокси-1-[2S-(2S-d3-метиламинопропиониламино)бутирил]пирролидин-2R-илметил-1 Н,1'Н-[2,2']бииндолил-3-илметил)-4S-гидроксипирролидин-1-карбонил]пропил)2S-d3-метиламинопропионамид (20). К раствору, содержащему неочищенное соединение 19 (приблизительно 1,00 ммоль) в МеОН (20 мл), добавляли 1 М NaOH (2 мл) при комнатной температуре. Через 35 мин МеОН удаляли под вакуумом,остаток разбавляли водой (50 мл) и экстрагировали EtOAc (250 мл). Комбинированные органические экстракты промывали рассолом и высушивали над безводным Na2SO4, фильтровали и концентрировали. Остаток очищали методом ОФ ВЭЖХ (колонка Dynamax 2" С 18; 10-100% раствор ACN/вода, содержащий 0,1% НОАс, в течение 30 мин; 40 мл/мин). Содержащие продукт фракции комбинировали, замораживали, лиофилизировали и получали 0,6 г соединения 20 (75%) в виде хлопьевидного твердого вещества белого цвета. 1 Н ЯМР (300 МГц, CD3CN), смесь ротамеров:11.86 (s, 2 Н), 7.91 (d, J = 7.8 Гц, 2 Н), 7.71 (dd, J = 5.4,8.7 Гц, 2H), 7.45 (dd, J = 2.4, 9.9 Гц, 2H), 6.83 (m, 2H), 4.56 (m, 2H), 4.47 (m, 2H), 4.20 (m, 2H), 3.84 (dd, J = 4.2, 11.1 Гц, 2H), 3.66 (d, J = 11.1 Гц, 2H), 3.45 (m, 4H), 2.93 (q, J = 6.9 Гц, 2H), 1.60-1.89 (m, 8H), 1.19 (d, J = 6.9 Гц, 6H), 0.94 (t, J = 7.2 Гц, 6H) ppm; 13C ЯМР (75 МГц, CD3CN + d4-MeOH), смесь ротамеров:175.2,173.0, 162.4, 159.3, 137.8, 137.6, 128.8, 128.7, 126.8, 110.8, 120.7, 109.5, 108.7, 108.4, 98.5, 98.1, 71.6, 60.5,60.1, 56.8, 52.6, 36.6, 28.6, 26.0, 22.7, 19.0, 10.1 ppm. Масс-спектр (ESI), отношение массы к заряду 813.4d4-NaBH4 (0,66 г, 15,7 ммоль) в виде однократной порции с последующим добавлением BF3 этерата (1,1 мл, 8,60 ммоль). Через приблизительно 10 мин ледяную баню удаляли и реакционную смесь нагревали до дефлегмирования. Через 3 ч реакционную смесь охлаждали в ледяной бане и осторожно быстро охлаждали насыщенным водным раствором NH4Cl (50 мл). Двухфазную смесь разбавляли EtOAc, органический слой отделяли, промывали водой (250 мл) и затем рассолом. EtOAc слой высушивали над безводным Na2SO4, фильтровали, концентрировали и получали 3,2 г неочищенного соединения 21 (колич.), которое использовали без дальнейшей очистки. Масс-спектр (ESI), отношение массы к заряду 371.2 [(М+Н)+; рассчитано для C21H20D2FN2O3: 371.4]. Схема XX(22). К раствору, содержащему неочищенное соединение 21 (приблизительно 7,85 ммоль), Et3N (1,2 г,12,0 ммоль) и DMAP (50 мг, cat.) в DCM (30 мл), добавляли уксусный ангидрид (0,74 мл, 7,85 ммоль) при комнатной температуре. Через 3 ч реакционную смесь быстро охлаждали насыщенным водным раствором NaHCO3 (50 мл), затем разбавляли DCM. DCM слой отделяли и последовательно промывали разбавленной HCl (50 мл), водой (50 мл) и рассолом (50 мл). Органический раствор высушивали над безводнымNa2SO4, фильтровали и концентрировали. Неочищенный продукт очищали методом флэшхроматографии на силикагелевой колонке [30-40% EtOAc в гексане] и получали 2,0 г (62%, 2 этапа) соединения 22 в виде пены белого цвета. 1 Н ЯМР (300 МГц, CDCl3), 1:1 смесь ротамеров:8.41 (br s, 1H), 7.80-6.50 (m, 9 Н), 5.25 (m, 1H),5.21 (m, 2 Н), 4.27 (m, 1H), 3.82 (dt, J = 5.1, 13.2 Гц, 1H), 3.61 (dd, J = 11.4, 11.7 Гц, 1H), 2.13 (s, 3 Н), 2.00 Бензиловый эфир 4-ацетокси-2-[3'-(4-ацетокси-1-бензилоксикарбонилпирролидин-2-ил-d2-метил)6,6'-дифтор-1H,'Н-[2,2']бииндолил-3-ил-d2-метил]пирролидин-1-карбоновой кислоты (23). Индол 22 (2,0 г, 4,80 ммоль) растворяли в предварительно охлажденной (-5 С) TFA (10 мл). Полученный раствор желтого цвета выдерживали до тех пор, пока он медленно не нагревался до комнатной температуры в течение 2 ч. Реакционную смесь концентрировали под вакуумом для удаления TFA и неочищенную смесь диастереомеров индолилиндолина использовали непосредственно в следующей реакции. Масс-спектр (ESI), отношение массы к заряду 825.4 [(М)+; рассчитано для C46H42D4F2N4O8: 824.9]. К раствору, содержащему диастереомеры индолилиндолина в EtOAc (100 мл), добавляли DDQ (0,58 г, 2,5 ммоль) в виде однократной порции. Через 15 мин реакционную смесь темнооранжевого/коричневого цвета быстро охлаждали насыщенным водным раствором NaHCO3. Слои отделяли, органическую фазу последовательно промывали насыщенным водным раствором NaHCO3 (350 мл) и рассолом, высушивали над безводным Na2SO4, фильтровали и концентрировали. Неочищенный продукт растворяли в DCM (10 мл) и раствор затем разбавляли МеОН (50 мл). При медленном удаленииDCM под вакуумом получали осадок, который собирали вакуумным фильтрованием, промывали холодной МеОН, высушивали и получали 1,7 г соединения 23 (86%, 2 этапа). 1 Н ЯМР (300 МГц, CDCl3):11.30 (br s, 2H), 7.60-7.30 (m, 14H), 6.90 (арр. dt, J = 2.4, 9.3 Гц, 2H),5.40 (m, 2H), 5.36 (d, J = 3.6 Гц, 4H), 4.28 (d, J = 8.1 Гц, 2H), 3.79 (m, 4H), 2.31 (s, 6H), 2.06 (m, 4H) ppm. Масс-спектр (ESI), отношение массы к заряду 823.3 [(М)+; рассчитано для C46H40D4F2N4O8: 822.9]. Схема XXII 5-[3'-(4-Ацетоксипирролидин-2-ил-d2-метил)-6,6'-дифтор-1 Н,1'Н-[2,2']бииндолил-3-ил-d2-метил] пирролидин-3-ил эфир уксусной кислоты (24). Суспензию, содержащую соединение 23 (0,40 г, 0,48 ммоль) в EtOAc/МеОН (соотношение 1:1) (40 мл), помещали в колбу Парра объемом 500 мл и помещали в нее 10% Pd-на-угле (влажный, приблизительно 200 мг). Реакционную смесь подвергали воздействию давления до 50 фунтов/дюйм 2 Н 2 и встряхивали в течение 3 ч. Реакционную смесь фильтровали через слой Celite и твердые вещества промывалиEtOAc. Очищенный фильтрат концентрировали под вакуумом и получали неочищенное соединение 24 в виде твердого вещества серовато-белого цвета, которое использовали непосредственно в следующей реакции. Масс-спектр (ESI), отношение массы к заряду 555.2 [(М)+; рассчитано для C30H28D4F2N4O4: 554.6]. Схема XXIII 5-3'-[4-Ацетокси-1-(2-трет-бутоксикарбониламинобутирил)пирролидин-2-ил-d2-метил]-6,6'дифтор-1 Н,1'Н-[2,2']бииндолил-3-ил-d2-метил-1-(2-трет-бутоксикарбониламинобутирил)пирролидин-3 ил эфир уксусной кислоты (25). К раствору, содержащему Boc-Abu-OH (224 мг, 1,1 ммоль) и HATU (442 мг, 1,2 ммоль) в безводномNMP (10 мл) при 0 С, добавляли NMM (0,2 мл, 1,7 ммоль) с последующим добавлением раствора соединения 24 (0,48 ммоль) в NMP (10 мл). Реакционную смесь медленно нагревали до комнатной температуры. Через 16 ч реакционную смесь разбавляли диэтиловым эфиром (100 мл), смесь последовательно промывали водой (550 мл), 1N HCl (50 мл), насыщенным водным раствором NaHCO3 (50 мл) и рассолом, высушивали над безводным Na2SO4, фильтровали и концентрировали. Неочищенный продукт очищали методом ОФ ВЭЖХ (колонка Dynamax 2" С 18; 10-100% раствор ACN/вода, содержащий 0,1% НОАс, в течение 30 мин; 40 мл/мин). Содержащие продукт фракции комбинировали, концентрировали,лиофилизировали и получали 310 мг соединения 25 (70%, 2 этапа) в виде хлопьевидного твердого вещества белого цвета. 1 Н ЯМР (300 МГц, CDCl3), смесь ротамеров:11.17 (br s, 2H), 7.39 (dd, J = 5.4, 8.4 Гц, 2H), 7.29 (d,J = 9.3 Гц, 2H), 6.75 (dd, J = 8.40, 8.40, 2H), 6.40 (br s, 2H), 5.44 (m, 2H), 4.40 (dd, J = 7.8, 16.5 Гц, 2H), 4.22 5-3'-[4-Ацетокси-1-(2-аминобутирил)пирролидин-2-ил-d2-метил]-6,6'-дифтор-1H,1'Н[2,2']бииндолил-3-ил-d2-метил-1-(2-аминобутирил)пирролидин-3-ил эфир уксусной кислоты (26). Раствор, содержащий соединение 25 (310 мг, 0,34 ммоль) в DCM (20 мл), охлаждали до 0 С. Добавляли TFA (5 мл) и реакцию контролировали до тех пор, пока результаты ЖХ/МС анализа не указывали на полное преобразование соединения 25 в соединение 26 (приблизительно 3 ч). Растворитель удаляли под вакуумом и остаток темно-зеленого цвета растворяли в EtOAc (50 мл). Раствор EtOAc осторожно вливали в смесь насыщенного водного раствора NaHCO3/лед/вода для нейтрализации остатка TFA. Отделяли органическую фазу и дважды промывали насыщенным водным раствором NaHCO3, затем один раз рассолом. Комбинированные водные слои обратимо экстрагировали EtOAc (220 мл) и комбинированные органические экстракты высушивали над безводным Na2SO4, фильтровали, концентрировали и получали неочищенное соединение 26 (250 мг) в виде твердого вещества серовато-белого цвета. Массспектр (ESI), отношение массы к заряду 725.3 [(М)+; рассчитано для C38H42D4F2N6O6: 724.8]. Схема XXV 5-(3'-4-Ацетокси-1-[2-(2-метил-(трет-бутоксикарбонил)аминопропиониламино)бутирил]пирролидин-2-ил-d2-метил-6,6'-дифтор-1 Н,1'Н-[2,2']бииндолил-3-ил-d2-метил)-1-[2-(2-метил-(трет-бутоксикарбонил)аминопропиониламино)бутирил]пирролидин-3-ил эфир уксусной кислоты (27). К раствору, содержащему Boc-N(Me)Ala-OH (83 мг, 0,41 ммоль) и HATU (172 мг, 0,45 ммоль) в безводном NMP (5 мл) при 0 С, добавляли NMM (0,1 мл, 0,85 ммоль) с последующим добавлением неочищенного соединения 26 (123 мг, 0,17 ммоль) в NMP (5 мл). Полученную смесь выдерживали до тех пор, пока она не нагревалась до комнатной температуры. Через 16 ч реакционную смесь разбавляли диэтиловым эфиром (100 мл), последовательно промывали водой (50 мл), 1N HCl (250 мл), насыщенным водным раствором NaHCO3 (250 мл), рассолом, высушивали над безводным Na2SO4, фильтровали и концентрировали. Неочищенный продукт очищали методом ОФ ВЭЖХ (колонка Dynamax 2" С 18; 10100% раствор ACN/вода, содержащий 0,1% НОАс, в течение 30 мин; 40 мл/мин). Содержащие продукт фракции комбинировали, концентрировали, лиофилизировали и получали 170 мг соединения 27 (91%, 2 этапа) в виде хлопьевидного твердого вещества серовато-белого цвета. 1 Н ЯМР (300 МГц, CDCl3), смесь ротамеров:11.51 (br s, 2 Н), 7.40-7.60 (m, 4 Н), 6.86 (m, 2 Н), 5.46 5-(3'-4-Ацетокси-1-[2-(2-метиламинопропиониламино)бутирил]пирролидин-2-ил-d2-метил-6,6'дифтор-1 Н,1'Н-[2,2']бииндолил-3-ил-d2-метил)-1-[2-(2-метиламинопропиониламино)бутирил]пирролидин-3-ил эфир уксусной кислоты (28). Раствор, содержащий соединение 27 (170 мг, 0,15 ммоль) в DCM (15 мл), охлаждали до 0 С. Добавляли TFA (5 мл). Через 30 мин реакционную смесь нагревали до комнатной температуры и контролировали до тех пор, пока результаты ЖХ/МС анализа не указывали на полное преобразование соединения 27 в соединение 28 (приблизительно 4 ч). Растворитель удаляли под вакуумом и остаток темно-зеленого цвета растворяли в EtOAc (100 мл) и осторожно вливали в смесь водного раствора NaHCO3/льда. Водную фазу отделяли и обратимо экстрагировали EtOAc (220 мл). Комбинированные органические экстракты промывали несколько раз насыщенным водным раствором NaHCO3, затем рассолом, высушивали над безводным Na2SO4, фильтровали, концентрировали и получали неочищенное соединение 28 в виде твердого вещества светло-желтого цвета. Масс-спектр (ESI), отношение массы к заряду 895.3 [(М)+; рассчитано для C46H56D4F2N8O8: 895.0]. Схема XXVIIN-1S'-[2R-(6,6'-Дифтор-3'-4S'-гидрокси-1-[2S-(2S'-метиламинопропиониламино)бутирил]пирролидин-2R-ил-d2-метил-1 Н,1'Н-[2,2']бииндолил-3-ил-d2-метил)-4S-гидроксипирролидин-1-карбонилпропил)-2S-метиламинопропионамид (29). К раствору, содержащему неочищенное соединение 28 (0,15 ммоль) в МеОН (20 мл), добавляли 1 МNaOH (5 мл) при 0 С. Реакционную смесь дегазировали и выдерживали в атмосфере азота, при этом емкость была обернута алюминиевой фольгой. Ледяную баню удаляли. Через 60 мин МеОН удаляли под вакуумом, остаток разбавляли водой (20 мл) и экстрагировали EtOAc (50 мл). Водную фазу отделяли и обратимо экстрагировали EtOAc (250 мл). Комбинированные органические экстракты промывали рассолом, высушивали над безводным Na2SO4, фильтровали и концентрировали. Неочищенный продукт очищали методом ОФ ВЭЖХ (колонка Dynamax 2" С 18; 10-100% раствор ACN/вода, содержащий 0,1% НОАс, в течение 30 мин; 40 мл/мин). Содержащие продукт фракции комбинировали, концентрировали,лиофилизировали и получали 110 мг соединения 29 (90%, 2 этапа) в виде хлопьевидного твердого вещества белого цвета. 1 Н ЯМР (300 МГц, CDCl3 + d4-MeOH), смесь ротамеров:11.58 (s, 2H), 7.80 (dd, J = 5.4, 8.7 Гц, 2H),7.45 (dd, J = 2.4, 9.9 Гц, 2H), 6.87 (ddd, J = 2.4, 9.2, 9.2 Гц, 2H), 4.66 (dd, J = 5.7, 7.8 Гц, 2H), 4.60 (br s, 2H),4.47 (d, J = 7.2 Гц, 2H), 4.00 (dd, J = 4.8, 11.4 Гц, 2H), 3.76 (d, J = 11.4 Гц, 2H), 3.43 (q, J = 6.9 Гц, 2H), 2.55 5-(3'-4-Ацетокси-1-[2-(2-d3-метил-(трет-бутоксикарбонил)аминопропиониламино)бутирил]пирролидин-2-ил-d2-метил-6,6'-дифтор-1 Н,1'Н-[2,2']бииндолил-3-ил-d2-метил)-1-[2-(2-d3-метил-(третбутоксикарбонил)аминопропиониламино)бутирил]пирролидин-3-ил эфир уксусной кислоты (30). К раствору, содержащему Boc-N(d3-Me)Ala-OH (17, 83 мг, 0,41 ммоль) и HATU (172 мг, 0,45 ммоль) в безводном NMP (5 мл), при 0 С добавляли NMM (0,1 мл, 0,85 ммоль) с последующим добавлением неочищенного соединения 26 (123 мг, 0,17 ммоль) в NMP (5 мл). Полученную смесь выдерживали до тех пор, пока она не нагревалась до комнатной температуры. Через 16 ч реакционную смесь разбавляли диэтиловым эфиром (100 мл), последовательно промывали водой (50 мл), 1N HCl (250 мл), насыщенным водным раствором NaHCO3 (250 мл), рассолом, высушивали над безводным Na2SO4, фильтровали и концентрировали. Неочищенный продукт очищали методом ОФ ВЭЖХ (колонка Dynamax 2" С 18; 10100% раствор ACN/вода, содержащий 0,1% НОАс, в течение 30 мин; 40 мл/мин). Содержащие продукт фракции комбинировали, концентрировали, лиофилизировали и получали 160 мг соединения 30 (85%, 2 этапа) в виде хлопьевидного твердого вещества белого цвета. 1 Н ЯМР (300 МГц, CDCl3), смесь ротамеров:11.51 (br s, 2H), 7.40-7.60 (m, 4H), 6.87 (ddd, J = 2.1,9.0, 9.0 Гц, 2H), 5.47 (t, J = 4.8 Гц, 2H), 4.74 (br s, 2H), 4.65 (q, J = 12 Гц, 2H), 4.46 (d, J = 8.1 Гц, 2H), 4.18 5-(3'-4-Ацетокси-1-[2-(2-d3-метиламинопропиониламино)бутирил]пирролидин-2-ил-d2-метил-6,6'дифтор-1 Н,1'Н-[2,2']бииндолил-3-ил-d2-метил)-1-[2-(2-d3-метиламинопропиониламино)бутирил]пирролидин-3-ил эфир уксусной кислоты (31). Раствор, содержащий соединение 30 (160 мг, 0,14 ммоль) в DCM (15 мл), охлаждали до 0 С. Добавляли TFA (5 мл). Через 30 мин реакционную смесь нагревали до комнатной температуры и контролировали до тех пор, пока результаты ЖХ/МС анализа не указывали на полное преобразование соединения 30 в соединение 31 (приблизительно 4 ч). Растворитель удаляли под вакуумом, остаток темно-зеленого цвета растворяли в EtOAc (100 мл) и осторожно вливали в смесь водного раствора NaHCO3/льда. Водную фазу отделяли и обратимо экстрагировали EtOAc (220 мл). Комбинированные органические экстракты промывали несколько раз насыщенным водным раствором NaHCO3, затем рассолом, высушивали над безводным Na2SO4, фильтровали, концентрировали и получали неочищенное соединение 31 в виде твердого вещества светло-желтого цвета. Масс-спектр (ESI), отношение массы к заряду 901.5 [(М)+; рассчитано для C46H50D10F2N8O8: 901.1].N-1S'-[2R-(6,6'-Дифтор-3'-4S'-гидрокси-1-[2S'-(2S'-метиламинопропиониламино)бутирил]пирролидин-2R-ил-d2-метил)-1 Н,1'Н-[2,2']бииндолил-3-ил-d2-метил)-4S-гидроксипирролидин-1-карбонил] пропил)-2S-метиламинопропионамид (32). К раствору, содержащему неочищенное соединение 31 (0,14 ммоль) в МеОН (20 мл), добавляли 1 МNaOH (5 мл) при 0 С. Реакционную смесь дегазировали и выдерживали в атмосфере азота, при этом емкость была завернута в алюминиевую фольгу. Ледяную баню удаляли. Через 60 мин МеОН удаляли под вакуумом, остаток разбавляли водой (20 мл) и экстрагировали EtOAc (50 мл). Водную фазу отделяли и обратимо экстрагировали EtOAc (250 мл). Комбинированные органические экстракты промывали рассолом, высушивали над безводным Na2SO4, фильтровали и концентрировали. Неочищенный продукт очищали методом ОФ ВЭЖХ (колонка Dynamax 2" С 18; 10-100% раствор ACN/вода, содержащий 0,1% НОАс, в течение 30 мин; 40 мл/мин). Содержащие продукт фракции комбинировали, концентрировали,лиофилизировали и получали 100 мг соединения 32 (87%, 2 этапа) в виде хлопьевидного твердого вещества белого цвета. 1 Н ЯМР (300 МГц, CDCl3 + d4-MeOH), смесь ротамеров:11.62 (s, 2H), 7.79 (dd, J = 5.4, 8.4 Гц, 2H),7.47 (dd, J = 2.4, 10.2 Гц, 2H), 6.87 (ddd, J = 2.4, 9.2, 9.2 Гц, 2H), 4.68 (dd, J = 5.4, 7.5 Гц, 2H), 4.58 (m, 2H),4.45 (d, J = 6.6 Гц, 2H), 3.99 (dd, J = 4.8, 11.1 Гц, 2H), 3.75 (d, J = 11.1 Гц, 2H), 3.19 (q, J = 6.9 Гц, 2H), 2.15 Пример 2 А. Анализ деградации cIAP. Концентрация, индуцирующая деградацию cIAP-1 и cIAP-2 на 50% (IC50) в отношении различных соединений, была определена путем контроля за потерей GFP (зеленый флуоресцентный белок) сигнала в клетках А 375. Вкратце, линии клеток А 375, экспрессирующие GFP-меченый cIAP-1 и cIAP-2, были генерированы путем трансфицирования вектором HA2xEGFP-pcDNA3, содержащим кодирующую об- 23022061 ласть либо cIAP-1 (A375Gc1), либо cIAP-2 (A375Gc2). 2104 клеток A375Gc1 или A375Gc2 были выращены в 96-луночной плашке и обработаны испытуемыми соединениями при различных концентрациях в течение 2 ч. После инкубирования клетки собирали путем трипсинизации и суспендировали в 150 мклDMEM-10% FBS. В общей сложности было проанализировано 104 клеток с использованием прибора"FACScan" ("Becton Dickinson"). GFP флуоресценцию контролировали с помощью фильтров возбуждения при 488 нм и эмиссию измеряли с помощью 530 нм фильтра. IC50 определяли как концентрацию лекарственного препарата, при которой обеспечивалось 50% ингибирование GFP сигнала. Результаты анализа деградации cIAP-1 и -2 приведены в табл. 2. Таблица 2 Указанные данные демонстрируют, что соединение 15 обладает более высокой относительной активностью при деградировании cIAP-1 относительно cIAP-2 при сравнении с соединениями 2, 3, 4 и 5. Пример 2 В. Анализ дерепрессии каспазы-3. Экспоненциально растущие MDA-MB-231 опухолевые клетки (АТСС) получали путем трипсинизации и собирали путем центрифугирования в настольной центрифуге при 1000g в течение 10 мин при комнатной температуре. Клеточную массу промывали один раз путем ресуспендирования в 5 мл гипотонического лизисного буфера (20 ммоль HEPES, рН 7,5, 10 ммоль KCl, 1,5 ммоль MgCl2, 1,0 ммоль EDTA,1,0 ммоль DTT) и повторно собирали путем центрифугирования. Массу далее ресуспендировали в 1 объеме гипотонического лизисного буфера с добавлением целой таблетки ингибитора протеазы (Роше) и помещали на лед для набухания в течение 30 мин. Клетки измельчали путем пропускания приблизительно 50 раз через иглу 27 калибра. Лизис контролировали с использованием оптической микроскопии. Лизат центрифугировали при 12000g в течение 10 мин при 4 С для удаления мембранной фракции, нелизированных клеток и клеточных остатков. Собирали растворимую фракцию для определения концентрации белка и проведения последующего анализа. Гипотонический лизат (25 мкг белка), 50 мкг/мл цитохрома с и 10 ммоль dATP комбинировали в микроцентрифужной пробирке до окончательного объема в размере 9 мкл в гипотоническом лизисном буфере с последующим добавлением испытуемого соединения и проводили инкубирование в течение 30 мин при комнатной температуре. После инкубирования добавляли 50 мкл гипотонического лизисного буфера, содержащего 5 мкмоль zDEVD-R110(2) субстрата каспазы-3 на основе профлуоресцентного родамина-110(2) и контролировали интенсивность люминесценции с течением времени. Активация лизата путем добавления цитохрома с и dATP приводит к образованию апоптосомного комплекса и последующей активации каспазы-9 и -3. Эндогенный XIAP ингибирует значительную часть указанной активности,и добавление испытуемого соединения к активированному лизату приводит к повышению активности каспазы по сравнению с активностью, генерируемой только одним активированным лизатом, определяемой по увеличению интенсивности флуоресценции при расщеплении zDEVD-R110(2) каспазой-3. Значения IC50 были рассчитаны с использованием программы GraphPad Prism путем построения графика увеличения интенсивности флуоресценции в зависимости от различных концентраций испытуемых соединений (результаты приведены в табл. 3). Указанные данные показывают, что соединение 15 обладает более низкой активностью для антагонизирования функции XIAP по сравнению с соединениями 2, 3, 4 и 5. Пример 3. Цитотоксичность. Данные о цитотоксичности SKOV-3 овариальных опухолевых клеток были получены в соответствии с процедурой, изложенной ниже. Анализ на основе (3-(4,5-диметилтиазол-2-ил)-2,5-дифенилтетразол бромида) (МТТ) является примером анализа, использовавшегося для измерения роста клеток в соответствии с ранее приведенным описанием (Hansen, М.В., Nielsen, S.E., and Berr, K. (1989) J. Immunol. Methods 119, 203-210), инкорпорированным в настоящий патент путем отсылки во всей своей полноте. Вкратце, клетки SK-OV-3 высевали в 96-луночных плашках в среде Мак-Коя, содержащей альбумин 10% эмбриональной бычьей сыворотки (5000 на лунку) и инкубировали в течение ночи при 37 С. На следующий день добавляли испытуемые соединения при различных концентрациях (0,003-10 мкмоль) и плашки инкубировали при 37 С в течение дополнительно 72 ч. Указанное время инкубирования являлось оптимальным для определения ингибирующих эффектов различных аналогов. В каждую лунку добавляли 50 мкл реагента МТТ (5 мг/мл) и плашки инкубировали при 37 С в течение 3 ч. По завершению инкубационного периода в каждую плашку добавляли 50 мкл DMSO для растворения клеток, и проводилось измерение оптической плотности лунок с использованием считывающего устройства для микропланшетов (Victor2 1420, Wallac, Finland) при 535 нм. Была подсчитана выживаемость клеток на основе нижеприведенного уравнения: Выживаемость клеток (CS) = (оптическая плотность (OD) обработанных лунок/средняя оптическая плотность (OD) контрольных лунок)100% СС 50, определенная как концентрация лекарственного препарата, приводящая к 50% CS (выживаемости клеток), была получена путем расчета точки, в которой кривая зависимости "доза-эффект" пересекает точку 50% CS с использованием программы GraphPad Prism. Данные результаты указывают на то,что миметики белка SMAC, связывающиеся с cIAP-1, могут быть использованы при лечении рака либо в качестве монотерапии, либо в сочетании с химиотерапевтическими препаратами. Результаты анализов цитотоксичности SKOV-3 в отношении испытуемых соединений в данном анализе приведены в табл. 4. Таблица 4 Приведенные в таблице данные указывают на то, что соединение 15 по своей активности эквивалентно соединению 5 и является более активным по сравнению с соединениями 2, 3 и 4. Пример 4. Токсичность. Данные о потере массы тела, смертности и дополнительной токсичности получены в основном на основе проведения нижеследующей процедуры. Крысам линии Спраг Доули ежедневно вводили дозу(раз в день 4, внутривенное медленное болюсное введение) соединений 15, 4 и 5. На 4-й день измеряли массу тела крыс, значения массы приведены на диаграмме в виде процентного изменения по отношению к дню 1. Соединения 4 и 5 вводили в дозе 0,3, 1 или 3 мг/кг; соединение 15 вводили в дозе 1, 5 или 10 мг/кг. Результаты анализа потери массы тела приведены на фиг. 1. Смертность. Соединения 4 и 5 оказались непереносимыми при дозе 3 мг/кг, и такая доза вызывала гибель животных. Смертность не была зафиксирована при введении соединения 15 в дозе 5 мг/кг (смертность наблюдалась при дозе 10 мг/кг). Клинические результаты. При дозе 1 мг/кг/день не наблюдались клинические симптомы после 4 дней введения соединения 15. У животных, которым вводили соединение 15 в дозе 5 мг/кг/день, проявились клинические симптомы, аналогичные симптомам при введении соединений 4 и 5 в дозе 1 мг/кг/день, такие как вялость, учащенное/неравномерное дыхание и повышенная частота сердечных сокращений. У крыс, получавших соединение 5 в дозе 1 мг/кг, проявились дополнительные клинические симптомы, в том числе обезвоживание, неухоженный вид, хроморинорея, алопеция (головы) и чрезмерное почсывание со 2 по 4 день. Масса тела. При дозе 1 мг/кг у животных, получавших соединения 4 и 5, наблюдалась потеря массы тела, в то время как у животных, получавших соединение 15 в дозе 1 мг/кг/день, наблюдалось увеличение массы тела. Со дня 1 по день 4 наблюдалась связанная с лечением средняя потеря массы тела, составившая приблизительно 8% при введении животным соединения 15 в дозе 5 мг/кг/день. У животных, которым вводили соединения 4 и 5 в дозе 1 мг/кг/день, наблюдалась связанная с лечением средняя потеря массы тела, составившая приблизительно 4 и 6% соответственно. Патология. Оценка анатомической патологии после проведения лечения с использованием соединений 4 и 5 при дозе 1 мг/кг/день позволила сделать следующие выводы. Наблюдалась бедность ткани клетками костного мозга эритроидного ряда средней и тяжелой степени выраженности, повышенное содержание паренхиматозных клеток миелоидного ряда слабой и средней степени и слабая и средняя гипертрофия и гиперплазия мегакариоцитов в большеберцовой кости и грудине при введении соединений 4 и 5 в дозе 1 мг/кг/день. В отношении соединений 4 и 5 в легких наблюдалась диффузная гипертрофия/гиперплазия(слабой и средней степени) пневмоцитов 2 типа, сопровождаемая увеличением альвеолярных макрофагов, гипертрофированного бронхиолярного эпителия, пролиферирующих периваскулярных мононуклеарных клеток и гипертрофированных клеток висцеральной плевры. В противоположность этому при оценке анатомической патологии после проведения лечения соединением 15 при аналогичной дозе (1 мг/кг/день) была определена гипоцеллюлярность эритроидных клеток от минимальной до слабой степени выраженности, гиперцеллюлярность миелоидных клеток от минимальной до слабой степени выраженности и минимальная гипертрофия пневмоцитов 2 типа в легких. Приведенные выше данные указывают на то, что соединение 15 приблизительно в 5 раз лучше переносится организмом крыс по сравнению с соединениями 4 и 5 на дозовой основе. Пример 5. Уменьшение объема опухоли и изменение массы тела. Данные о ксенотрансплантате из линии клеток MDA-MB-231 были получены на основе нижеприведенной процедуры. Опухолевые клетки молочной железы человека MDA-MB-231 инъецировали в жировое тело молочной железы самок безтимусных мышей, и инъецирование доз началось двенадцать дней спустя после того, как средний объем опухоли составил приблизительно 148 нм 3. Ни одна из опухолевых масс не была ассоциирована с указанной моделью, основанной на отсутствии потери массы тела или смертности животных в контрольных группах. Мышам подкожно инъецировали в жировую ткань молочной железы 1107 клеток, суспендированных в 200 мкл раствора, содержащего сбалансированный солевой раствор Хенкса:Матригеля в отношении 1:1; инъецированные клетки находились на девяти пассажах исходной серии. Были зафиксированы объемы опухолей до проведения исследований, приблизительно за одну неделю до намеченной даты начала исследований. Когда размер опухолей достиг приблизительно 150 мм 3, животных отбирали в зависимости от объема опухоли в лечебные и контрольные группы, и к введению доз приступили на день 0; мыши были помечены, и за ними велось индивидуальное наблюдение на протяжении всего периода времени проведения эксперимента. Животным вводили дозу в зависимости от массы тела (0,01 мл на 1 г; 10 мл/кг). Начиная со дня 0, за животными ежедневно велось наблюдение, их взвешивали дважды в неделю на цифровых весах (Ohaus SP601); по каждой группе фиксировались данные, включающие индивидуальную и среднюю массу тела в граммах (средний WeSD), среднее изменение массы тела в процентном выражении по отношению ко дню 0 (% vD0) и среднее изменение массы тела в процентном выражении по отношению к предыдущим измерениям (% vD-x), и по завершению исследования на основании указанных данных были составлены графики. Начиная со дня 0, дважды в неделю проводили измерение размеров опухолей с использованием штангенциркуля с цифровой индикацией (Fowler Ultra-Cal IV), данные, включающие индивидуальные и средние определенные объемы опухолей (средний TVSEM), фиксировали по каждой группе; объем опухоли рассчитывали по следующей формуле: TV = width2length0,52 (Объем опухоли = ширина 2 длину 0,52). Отдельным мышам, достигшим предварительно установленной конечной точки исследования (определенный объем опухоли приблизительно 1 см 3), присваивали значение времени конечной точки (ТТЕ), соответствующее этому дню; исследование по изучению задержки роста опухоли (TGD) было завершено после того, как все мыши достигли конечной точки исследования, или спустя шестьдесят дней после начала исследования. По завершению исследования рассчитывали TGD и % TGD с использованием медианного значения ТТЕ (МТТЕ) для каждой лечебной группы (Т) по отношению к контрольной группе (С) по формулам: TGD(days)= T-C и % TGD=T-C/C100, в которых Т-С обозначает раз- 26022061 ницу между МТТЕ-лечебной группой и МТТЕ-контрольной группой. Животные с развившимися опухолями, не достигшими предварительно установленного конечного объма к завершению исследования,рассматривались как "долгожители" (LTS), и им присваивали значение ТТЕ, соответствующее последнему дню исследования; животные без опухоли не включены в расчеты TGD. Для определения статистически значимых различий между всеми опытными данными о выживаемости при сравнении каждой лечебной группы с контрольной группой использовали логранговый критерий. Отдельные мыши, у которых в соответствии с полученными данными объем опухоли составил 50% со дня 0 проведения измерений за два последовательных измерения в течение семидневного периода, рассматривались как животные, частично ответившие на лечение (PR). Если частичный ответ на лечение (PR) сохранялся до завершения исследования, процентную регрессию опухоли (% TR) определяли по формуле % TR = 1-Tf/Ti100; среднее значение рассчитывали, если несколько мышей, частично ответивших на лечение (PR), находились в одной группе. Отдельных мышей, у которых отсутствовали пальпируемые опухоли ( 44 мм 2 за два последовательных измерения в течение семидневного периода), классифицировали как животных,полностью ответивших на лечение (CR); животные, полный ответ на лечение (CR) которых сохранялся до завершения исследования, рассматривались как выжившие без опухоли животные (TFS); животных TFS исключали из расчетов TGD и статистического анализа. Сравнение статистических различий между значениями МТТЕ в контрольных и лечебных группах проводили с использованием логрангового критерия. Инъекционно вводили только одно соединение 15 интраперитонеально в дозах 20, 40 или 60 мг/кг по схеме q3d5 (один раз в день в течение трех дней, 5 циклов). Значения Т-С 22 дней рассчитывали для указанных групп, все из которых были определены как статистически значимые по сравнению с контрольной группой (р=0,005, р 0,0001 или р=0,0001). В группе, в которой животным вводили дозу 20 мг/кг, 6 из 10 мышей рассматривались как "долгожители", у трех мышей отмечалась частичная регрессия опухоли. В группе, в которой животным вводили дозу 40 мг/кг, 9 из 10 мышей рассматривались как"долгожители", у трех мышей отмечалась частичная регрессия опухоли. В группе, в которой животным вводили дозу 60 мг/кг, 8 из 10 мышей рассматривались как "долгожители", у семи мышей отмечалась частичная регрессия опухоли. Инъекционно вводили только одно соединение 5 интраперитонеально в дозе 15 мг/кг по схемеq3d5. Значение Т-С 21 дня рассчитывали для указанной группы, которая была определена как статистически значимая по сравнению с контрольной группой (р=0,002). В указанной группе 3 из 10 мышей рассматривались как "долгожители" и у пяти мышей отмечалась частичная регрессия опухоли. Эффективность указанной дозы позволила достичь половину количества "долгожителей", как и доза соединения 15 в размере 20 мг/кг. Результаты анализа ксенотрансплантата из линии клеток MDA-MB-231 приведены на фиг. 2 А и 2 В. Соединение 15 при дозе 20 мг/кг обладало противоопухолевой активностью, сопоставимой с соединением 5 при дозе 15 мг/кг. Дальнейшие исследования показали, что минимальная эффективная доза соединения 15 в этой модели составляет менее 1 мг/кг. Потеря массы тела была выше у мышей, которым вводили соединение 5 в дозе 15 мг/кг по сравнению с мышами, которым вводили соединение 15 в дозе 20 мг/кг. Таким образом, соединение 15 обладает эффективностью при меньшей токсичности, сопоставимой с эффективностью соединения 5, и, следовательно, имеет улучшенный терапевтический индекс. Соединение формулы 1 является исключительно хорошо переносимым и приемлемым для использования в фармацевтической композиции, а также в способе лечения пролиферативного заболевания или аутоиммунного заболевания. В частности, фармацевтическая композиция в соответствии с настоящим изобретением для лечения пролиферативного заболевания, включающая эффективное количество соединения 15 дополнительно по меньшей мере к одному фармацевтически приемлемому вспомогательному веществу, может улучшить терапевтический индекс путем снижения токсичности. Снижение токсичности включает, например, один из нижеперечисленных факторов или любое их сочетание: уменьшение потери массы тела; снижение смертности; снижение бедности ткани клетками костного мозга эритроидного ряда; снижение повышенного содержания паренхиматозных клеток миелоидного ряда; уменьшение гипертрофии и гиперплазии мегакариоцитов; уменьшение диффузной гипертрофии и гиперплазии пневмоцитов типа 2; снижение вялости; более регулярное дыхание; снижение частоты сердечных сокращений. Перечисленные выше факторы, обусловленные пониженной токсичностью, наблюдались у исследуемых животных. Аналогичные, дополнительные или отличающиеся факторы, обусловленные пониженной токсичностью, будут наблюдаться у человека. Снижение токсичности является относительным,например относительным к той степени, в которой токсичность наблюдалась бы после введения в организм фармацевтической композиции, в которой активный фармацевтический ингредиент является аналогом соединения 15, например, одного или нескольких аналогов, в которых R5 обозначает -СН 2 СН 3,- 27022061-СН(СН 3)СН 3, -R-СН(ОН)СН 3, -S-CH(OH)CH3 и -R-СН(ОСН 3)СН 3, например, при аналогичной дозе или при дозе, сопоставимой эффективности. Очевидно, что примеры и варианты осуществления настоящего изобретения, описанные в настоящем патенте, приведены исключительно в иллюстративных целях, и специалистам в данной области техники очевидно, что в свете вышеуказанного, в настоящее изобретение могут быть внесены различные модификации или изменения, не выходящие за пределы существа и объема настоящей заявки и объема прилагаемой формулы. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение формулы или его фармацевтически приемлемая соль. 2. Фармацевтическая композиция для лечения пролиферативного заболевания, содержащая соединение формулы или его фармацевтически приемлемую соль и фармацевтически приемлемое вспомогательное вещество. 3. Фармацевтическая композиция по п.2 для лечения рака. 4. Фармацевтическая композиция по п.2 или 3, выполненная в виде стерильной жидкости для инъекций. 5. Фармацевтическая композиция по пп.2, 3 или 4, являющаяся единичной лекарственной формой. 6. Применение соединения или его фармацевтически приемлемой соли по п.1 для лечения пролиферативного заболевания у млекопитающих. 7. Применение по п.6, в котором пролиферативным заболеванием является рак, выбранный из группы, включающей следующие виды рака: рак поджелудочной железы, рак яичников, рак молочной железы, мезотелиому, периферическую нейрому, глиобластому, меланому, адренокортикальную карциному,СПИД-ассоциированную лимфому, рак анального канала, менингиому, глиому, астроцитому, рак шейки матки, хронические миелопролиферативные заболевания, рак толстой кишки, эндометриальный рак,эпендимому, рак пищевода, саркому Юинга, экстракраниальные герминогенные опухоли, внегонадные герминогенные опухоли, рак внепеченочных желчных путей, рак желчного пузыря, рак желудка, карциноидные опухоли желудочно-кишечного тракта, гестационные трофобластические опухоли, лейкоз ворсистых клеток, лимфому Ходжкина, неходжкиновскую лимфому, гипофарингеальный рак, интраокулярную меланому, рак островковых клеток, саркому Капоши, ларингеальный рак, лейкемию, рак губы, рак ротовой полости, рак печени, рак мужской груди, злокачественную мезотелиому, медуллобластому, карциному из клеток Меркеля, метастатический сквамозный рак шеи, множественную миелому и иные неоплазмы плазмацитов, фунгоидный микоз и синдром Сезари, миелодиспластический синдром, назофа- 28022061 рингеальный рак, нейробластому, немелкоклеточный рак лгкого, мелкоклеточный рак лгкого, рак ротоглотки, рак костей, в том числе остеосаркому и злокачественную фиброзную гистиоцитоксантому костей, рак придаточных пазух носа, рак паращитовидной железы, рак полового члена, феохромоцитому,опухоли гипофиза, рак предстательной железы, рак прямой кишки, гипернефроидный рак, ретинобластому, рабдомиосаркому, рак слюнных желез, рак тонкого кишечника, саркому мягких тканей, супратенториальные примитивные нейроэктодермальные опухоли, пинеобластому, рак яичек, тимому, рак щитовидной железы, переходно-клеточный рак почечной лоханки и мочеточника, уретральный рак, саркому матки, влагалищный рак, вульварный рак, опухоль Уилма и иные опухоли почек у детей. 8. Применение по п.6, в котором пролиферативным заболеванием является рак, выбранный из группы, включающей саркомы, рак мочевого пузыря, рак яичников, рак молочной железы, рак мозга, рак поджелудочной железы, рак толстой кишки, рак крови, рак кожи, рак легких и рак костей. 9. Применение по п.6, в котором пролиферативным заболеванием является рак, выбранный из группы, включающей колоректальный рак, карциному почек, карциному яичника, карциному поджелудочной железы, карциному простаты, карциному молочных желез, меланому, глиобластому, острый миелолейкоз, мелкоклеточный рак лгкого, немелкоклеточный рак лгкого, рабдомиосаркому и базалиому. 10. Применение соединения или его фармацевтически приемлемой соли по п.1 для индуцирования апоптоза в клетке. 11. Применение по п.10, в котором клетка является раковой клеткой. 12. Применение по любому из пп.6-11, при котором соединение или его фармацевтическую соль по п.1 применяют (или назначают) в сочетании с другой противораковой терапией, выбранной из лучевой терапии, химиотерапии, иммунотерапии и(или) фотодинамической терапии или их сочетаний. 13. Применение соединения или его фармацевтически приемлемой соли по п.1 для лечения аутоиммунного заболевания, в котором аутоиммунное заболевание является заболеванием, при котором состояние вызвано или обусловлено аномальным регулированием апоптоза и выбрано из группы, включающей системную красную волчанку, псориаз и идиопатическую тромбоцитопеническую пурпуру (синдрома Верльгофа). 14. Соединение формулы
МПК / Метки
МПК: C07D 217/00
Код ссылки
<a href="https://eas.patents.su/30-22061-mimetiki-belka-smac.html" rel="bookmark" title="База патентов Евразийского Союза">Миметики белка smac</a>
Предыдущий патент: Соединение для лечения инфекционных заболеваний, соответствующий способ и фармацевтическая композиция, содержащая указанное соединение
Следующий патент: Катализаторы фишера-тропша
Случайный патент: Способ формирования стены из листов сухой штукатурки












