Способ лечения ретровирусной инфекции
Формула / Реферат
1. Применение ритонавира или его фармацевтически приемлемой соли для изготовления лекарственного средства для улучшения фармакокинетики ингибитора интегразы вируса иммунодефицита человека (ВИЧ), представленного формулой
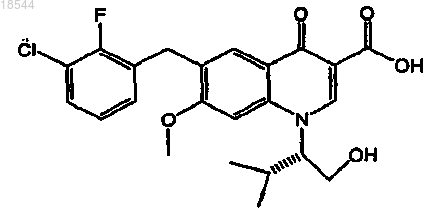
или его фармацевтически приемлемой соли в организме пациента, включающее пероральное введение ритонавира или его фармацевтически приемлемой соли один раз в день в пересчете на дозу ритонавира от 20 до 200 мг и пероральное введение указанного ингибитора интегразы или его фармацевтически приемлемой соли один раз в день в пересчете на дозу ингибитора от 20 до 500 мг.
2. Применение по п.1, в котором улучшение фармакокинетики представляет собой повышение уровня ингибитора интегразы ВИЧ в крови пациента.
3. Применение ритонавира или его фармацевтически приемлемой соли для изготовления лекарственного средства для повышения биодоступности ингибитора интегразы вируса иммунодефицита человека (ВИЧ), представленного формулой
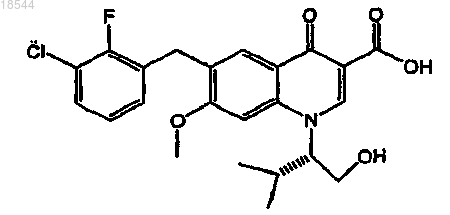
или его фармацевтически приемлемой соли в организме пациента, включающее пероральное введение ритонавира или его фармацевтически приемлемой соли один раз в день в пересчете на дозу ритонавира от 20 до 200 мг и пероральное введение указанного ингибитора интегразы или его фармацевтически приемлемой соли один раз в день в пересчете на дозу ингибитора от 20 до 500 мг.
4. Применение ритонавира или его фармацевтически приемлемой соли для изготовления лекарственного средства для повышения всасываемости ингибитора интегразы вируса иммунодефицита человека (ВИЧ), представленного формулой
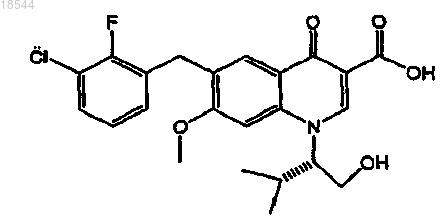
или его фармацевтически приемлемой соли в организме пациента, включающее пероральное введение ритонавира или его фармацевтически приемлемой соли один раз в день в пересчете на дозу ритонавира от 20 до 200 мг и пероральное введение указанного ингибитора интегразы или его фармацевтически приемлемой соли один раз в день в пересчете на дозу ингибитора от 20 до 500 мг.
5. Применение ритонавира или его фармацевтически приемлемой соли для изготовления лекарственного средства для ингибирования активности ретровирусной интегразы в организме пациента, включающее пероральное введение один раз в день указанного лекарственного средства, в котором ритонавир или его фармацевтически приемлемая соль содержится в пересчете на дозу ритонавира от 20 до 200 мг, вместе с ингибитором интегразы вируса иммунодефицита человека (ВИЧ), представленного формулой

или его фармацевтически приемлемой соли в пересчете на дозу ингибитора от 20 до 500 мг.
6. Применение ритонавира или его фармацевтически приемлемой соли для изготовления лекарственного средства для лечения или профилактики ретровирусной инфекции в организме пациента, включающее пероральное введение один раз в день указанного лекарственного средства, в котором ритонавир или его фармацевтически приемлемая соль содержится в пересчете на дозу ритонавира от 20 до 200 мг, вместе с ингибитором интегразы вируса иммунодефицита человека (ВИЧ), представленного формулой
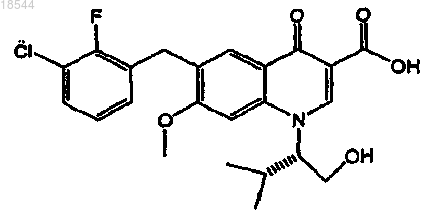
или его фармацевтически приемлемой соли в пересчете на дозу ингибитора от 20 до 500 мг.
7. Применение по любому из пп.1-6, в котором пациенту дополнительно вводят по меньшей мере один агент, выбранный из группы, состоящей из ставудина, эмтрицитабина, тенофовира, абакавира, ламивудина, зидовудина, диданозина, залцитабина, фосфазида, эфавиренца, невирапина, делавирдина, типранавира, саквинавира, индинавира, атазанавира, нелфинавира, ампренавира, сампренавира, фосампренавира, лопинавира, ритонавира, энфувиртида, фозивудина тидоксила, аловудина, декселвуцитабина, априцитабина, амдоксовира, элвуцитабина (АСН126443), рацивира (рацемического FTC, PSI-5004), MIV-210, KP-1461, фосалвудина тидоксила (HDP 99.0003), AVX756, диоксолана тимина (DOT), TMC-254072, INK-20, 4'-Ed4T, этравирина (ТМС-125), каправирина, рилпивирина (ТМС-278), GW-695634, каланолида A, BILR 355 BS, VRX 840773 и их фармацевтически приемлемых солей.
8. Применение по любому из пп.1-7, в котором лекарственное средство предназначено для введения пациенту с пищей.
9. Применение по любому из пп.1-7, в котором лекарственное средство выполнено в унифицированной лекарственной форме в виде таблетки.
10. Применение по любому из пп.1-9, в котором ингибитор интегразы и ритонавир или его фармацевтически приемлемую соль вводят пациенту в виде одной композиции.
11. Применение фармацевтической композиции, включающей ритонавир или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель, для улучшения фармакокинетики ингибитора интегразы ВИЧ, представленного формулой
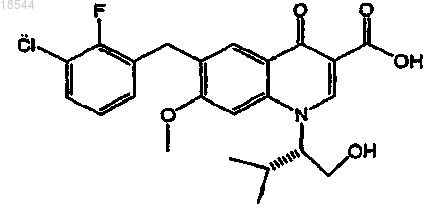
или его фармацевтически приемлемой соли в организме пациента, включающее пероральное введение ритонавира или его фармацевтически приемлемой соли один раз в день в пересчете на дозу ритонавира от 20 до 200 мг и пероральное введение указанного ингибитора интегразы или его фармацевтически приемлемой соли один раз в день в пересчете на дозу ингибитора от 20 до 500 мг.
12. Применение фармацевтической композиции, включающей ритонавир или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель, для повышения биодоступности ингибитора интегразы вируса иммунодефицита человека (ВИЧ), представленного формулой
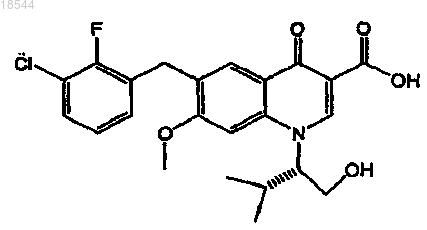
или его фармацевтически приемлемой соли в организме пациента, включающее пероральное введение ритонавира или его фармацевтически приемлемой соли один раз в день в пересчете на дозу ритонавира от 20 до 200 мг и пероральное введение указанного ингибитора интегразы или его фармацевтически приемлемой соли один раз в день в пересчете на дозу ингибитора от 20 до 500 мг.
13. Применение фармацевтической композиции, включающей ритонавир или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель, для повышения всасываемости ингибитора интегразы вируса иммунодефицита человека (ВИЧ), представленного формулой
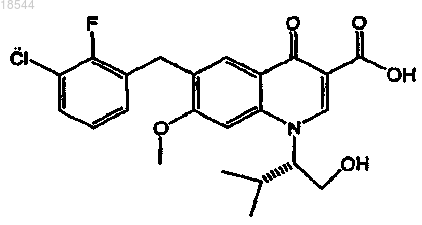
или его фармацевтически приемлемой соли в организме пациента, включающее пероральное введение ритонавира или его фармацевтически приемлемой соли один раз в день в пересчете на дозу ритонавира от 20 до 200 мг и пероральное введение указанного ингибитора интегразы или его фармацевтически приемлемой соли один раз в день в пересчете на дозу ингибитора от 20 до 500 мг.
14. Применение фармацевтической композиции, включающей ритонавир или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель, для ингибирования активности ретровирусной интегразы в организме пациента, включающее пероральное введение один раз в день фармацевтической композиции, которая содержит ритонавир или его фармацевтически приемлемую соль в пересчете на дозу ритонавира от 20 до 200 мг, с ингибитором интегразы вируса иммунодефицита человека (ВИЧ), представленного формулой
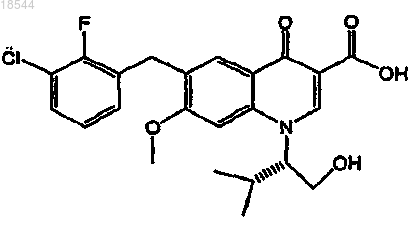
или его фармацевтически приемлемой соли в пересчете на дозу ингибитора от 20 до 500 мг.
15. Применение фармацевтической композиции, включающей ритонавир или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель, для лечения или профилактики ретровирусной инфекции в организме пациента, включающее пероральное введение один раз в день фармацевтической композиции, которая содержит ритонавир или его фармацевтически приемлемую соль в пересчете на дозу ритонавира от 20 до 200 мг, с ингибитором интегразы вируса иммунодефицита человека (ВИЧ), представленного формулой
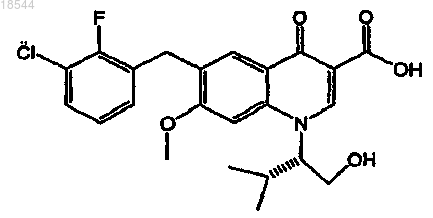
или его фармацевтически приемлемой соли в пересчете на дозу ингибитора от 20 до 500 мг.
16. Применение фармацевтической композиции по любому из пп.11-15, включающее введение указанной композиции с пищей.
Текст
СПОСОБ ЛЕЧЕНИЯ РЕТРОВИРУСНОЙ ИНФЕКЦИИ Изобретение относится к способу улучшения фармакокинетики ингибитора интегразы ВИЧ. В одном варианте изобретение относится к способу повышения биодоступности ингибитора интегразы ВИЧ. В еще одном варианте изобретение относится к способу повышения всасываемости ингибитора интегразы ВИЧ. В еще одном варианте изобретение относится к способу ингибирования активности ретровирусной интегразы. В еще одном варианте изобретение относится к способу лечения или профилактики ретровирусной инфекции. Способы по изобретению включают совместное введение ингибитора интегразы ВИЧ, представляющего собой 6-(3-хлоро-2-фторбензил)-1-[(2S)-1-гидрокси-3-метилбутан-2-ил]-7 метокси-4-оксо-1,4-дигидрохинолин-3-карбоновую кислоту, в количестве 20-500 мг и ритонавира в количестве 20-200 мг. Область техники, к которой относится изобретение Изобретение относится к способу улучшения фармакокинетики 4-оксохинолиновых соединений. Кроме того, изобретение относится к способу ингибирования ретровирусных интеграз, в частности ингибирования интегразы вируса иммунодефицита человека (ВИЧ), и к способу ингибирования ретровирусной инфекции, особенно ВИЧ-инфекции. Сведения о предшествующем уровне техники Инфекция ретровируса, известного как вирус иммунодефицита человека (ВИЧ), продолжает оставаться серьезной проблемой здравоохранения. Способы лечения ВИЧ-инфекций включают введение агентов, которые ингибируют активность вирусных ферментов, которые являются основными для жизненного цикла вируса. Ритонавир (сокращенно - RTV, или - р), имеющий наименование 2S,3S,5S)-5-(N-(N-N-метил-N-2 изопропил-4-тиазолил)метил)амино)карбонил)-L-валинил)амино)-2-(N-5-тиазолил)метоксикарбонил)амино)1,6-дифенил-3-гидроксигексан), представляет собой ингибитор протеазы ВИЧ, который можно синтезировать способами, описанными в публикации международной патентной заявки WO 1994/14436 и патенте США 5567823. Как ингибитор протеазы, ритонавир может быть эффективен в плане ингибирования ВИЧинфекции у человека. Показано также, что ритонавир в качестве ингибитора фермента обмена веществ цитохром Р 450 монооксигеназы, особенно изоформы 3 А 4 (CYP 3A4), включен в путь метаболизма многих лекарственных средств; см. патенты США 5541206, 5635523, 5648497, 5674882, 5846987 и 5886036. Ингибиторы протеазы метаболизируются цитохром Р 450 монооксигеназой, что приводит к неблагоприятной фармакокинетике и необходимости использования более частых и более высоких доз, чем это желательно. Введение данных лекарственных средств с агентом, который ингибирует метаболизм,опосредованный цитохром Р 450 монооксигеназой, может улучшить фармакокинетику (например, увеличить полупериод существования, время до максимальной концентрации в плазме и уровни в крови) лекарственного средства. Ритонавир можно использовать для улучшения фармакокинетики ряда ингибиторов протеазы ВИЧ,которые метаболизируются цитохром Р 450 монооксигеназой, см. патенты США 6037157 и 6703403. Совместное введение ритонавира с лекарственным средством, метаболизируемым цитохром Р 450 монооксигеназой, особенно изоформой Р 450 3 А 4 (изоферментом), может привести к улучшению фармакокинетики данного лекарственного средства. Более подробно, совместное введение ритонавира с другим ингибитором протеазы ВИЧ, который метаболизируется цитохром Р 450 монооксигеназой, может привести в результате к улучшению фармакокинетики ингибитора протеазы ВИЧ. В комбинированной терапии данного типа ритонавир можно использовать в субтерапевтических дозах, т.е. дозах, которые меньше чем используемые для значимой супрессии репликации вируса, но достаточно высокие для ингибирования цитохром Р 450 монооксигеназы и поддержки фармакокинетики другого ингибитора протеазы ВИЧ. Ряд 4-оксохинолинов, включая соединение 6-(3-хлор-2-фторбензил)-1-[(2S)-1-гидрокси-3 метилбутан-2-ил]-7-метокси-4-оксо-1,4-дигидрохинолин-3-карбоновая кислота, идентифицирован как агенты против вируса иммунодефицита человека (ВИЧ); см. патентную заявку США 10/492833, поданную 20 ноября 2003 г., которая опубликована как публикация патентной заявки США 2005/0239819. В частности, 6-(3-хлор-2-фторбензил)-1-[(2S)-1-гидрокси-3-метилбутан-2-ил]-7-метокси-4 оксо-1,4-дигидрохинолин-3-карбоновая кислота описана как обладающая ингибирующей способностью в отношении белка интегразы ВИЧ; см. там же. ВИЧ принадлежит к семейству ретровирусов и является этиологическим фактором синдрома приобретенного иммунодефицита (СПИДа). Соответственно фармацевтический агент, который снижает вирусную нагрузку, количество вирусного генома или репликацию ВИЧ в организме, может быть эффективным для лечения или профилактики СПИДа. В настоящее время существует потребность в агентах и способах, которые эффективны в плане повышения биодоступности или всасывания ингибиторов интегразы, таких как 6-(3-хлор-2-фторбензил)-1[(2S)-1-гидрокси-3-метилбутан-2-ил]-7-метокси-4-оксо-1,4-дигидрохинолин-3-карбоновая кислота, с целью повышения их терапевтического эффекта у пациента. В частности, существует потребность в агентах и способах, которые улучшают фармакокинетику данного ингибитора интегразы, так что приемлемый терапевтический эффект может достигаться введением один раз в день. Кроме того, в целом имеется потребность в улучшении фармакокинетики лекарственных средств (например, ингибиторов интегразы),которые используют для лечения ВИЧ-инфекции. Сущность изобретения Изобретение относится к способу улучшения фармакокинетики 4-оксохинолиновых соединений. Кроме того, изобретение относится к способу ингибирования ретровирусных интеграз, в частности ингибирования интегразы вируса иммунодефицита человека (ВИЧ), и к способу ингибирования ретровирусной инфекции, особенно ВИЧ-инфекции. В одном варианте осуществления изобретение предусматривает агенты и способы, которые используют для повышения биодоступности или всасывания ингибиторов интегразы, таких как 6-(3-хлор-2 фторбензил)-1-[(2S)-1-гидрокси-3-метилбутан-2-ил]-7-метокси-4-оксо-1,4-дигидрохинолин-3-карбоновая кислота (соединение 1), с целью повышения их терапевтического эффекта у пациента. Соединение 1 имеет следующую формулу: В одном варианте осуществления изобретение предусматривает способ улучшения фармакокинетики ингибитора интегразы, такого как соединение 1, путем введения ингибитора интегразы пациенту с ритонавиром или его фармацевтически приемлемой солью. В одном варианте осуществления изобретение предусматривает способ повышения биодоступности соединения 1 у пациента. Способ заключается во введении пациенту терапевтически эффективного количества соединения 1 с пищей. Повышение биодоступности соединения можно наблюдать по повышению максимальной концентрации в плазме или увеличению площади под кривой зависимости концентрации плазмы от времени (AUC) по сравнению с площадью, которая была бы, если бы соединение вводили без пищи. В одном варианте осуществления изобретение предусматривает способ повышения уровня всасывания соединения 1 у пациента, включающий введение пациенту терапевтически эффективного количества соединения 1 с пищей. Всасывание соединения можно измерить по концентрации, достигаемой в кровотоке после введения соединения. Повышение уровня всасывания можно наблюдать по повышению максимальной концентрации в плазме или по повышению площади под кривой зависимости концентрации плазмы от времени (AUC) по сравнению с площадью, которая была бы, если бы соединение вводили без пищи. В одном варианте осуществления изобретение предусматривает способ ингибирования активности интегразы ретровируса у пациента, включающий введение пациенту терапевтически эффективного количества соединения 1 с пищей. В одном варианте осуществления изобретение предусматривает способ лечения или профилактики ретровирусной инфекции у пациента, включающий введение пациенту терапевтически эффективного количества соединения 1 с пищей. В одном варианте осуществления изобретение предусматривает набор, включающий (1) фармацевтическую композицию, содержащую соединение 1 или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель; (2) информацию, касающуюся предписаний, и (3) контейнер. Информация, касающаяся предписаний, включает предупреждение или инструкцию для пациента, относящуюся к применению соединения 1 с пищей. В другом варианте осуществления изобретение предусматривает набор, включающий ингибитор интегразы, такой как соединение 1, информацию, касающуюся предписаний, и контейнер, причем информация, касающаяся предписаний, включает информацию, относящуюся к введению соединения с целью улучшения его биодоступности. В одном варианте осуществления изобретение предусматривает способ улучшения фармакокинетики ингибитора интегразы, такого как соединение 1, путем введения пациенту ингибитора интегразы с ритонавиром или его фармацевтически приемлемой соли и с пищей. В одном варианте осуществления изобретение предусматривает способ повышения биодоступности соединения 1 у пациента, включающий введение пациенту терапевтически эффективного количества соединения 1 с ритонавиром и с пищей. В одном варианте осуществления изобретение предусматривает способ повышения уровня всасывания соединения 1 у пациента, включающий введение пациенту терапевтически эффективного количества соединения 1 с ритонавиром и с пищей. В одном варианте осуществления изобретение предусматривает способ ингибирования активности ретровирусной интегразы у пациента, включающий введение пациенту терапевтически эффективного количества соединения 1 с ритонавиром и с пищей. В одном варианте осуществления изобретение предусматривает способ лечения или профилактики ретровирусной инфекции у пациента, включающий введение пациенту терапевтически эффективного количества соединения 1 с ритонавиром и с пищей. В одном варианте осуществления изобретение предусматривает применение соединения 6-(3-хлор 2-фторбензил)-1-[(2S)-1-гидрокси-3-метилбутан-2-ил]-7-метокси-4-оксо-1,4-дигидрохинолин-3-карбоновой кислоты или его фармацевтически приемлемой соли для изготовления лекарственного средства для повышения биодоступности соединения, включающий введение пациенту терапевтически эффективного количества соединения или его фармацевтически приемлемой соли, предназначенных для введения с пищей. В одном варианте осуществления изобретение предусматривает применение соединения 6-(3-хлор-2 018544 2-фторбензил)-1-[(2S)-1-гидрокси-3-метилбутан-2-ил]-7-метокси-4-оксо-1,4-дигидрохинолин-3-карбоновой кислоты или его фармацевтически приемлемой соли для изготовления лекарственного средства для повышения всасывания соединения у пациента, включающий введение пациенту терапевтически эффективного количества соединения или его фармацевтически приемлемой соли, предназначенных для введения с пищей. В одном варианте осуществления изобретение предусматривает применение соединения 6-(3-хлор 2-фторбензил)-1-[(2S)-1-гидрокси-3-метилбутан-2-ил]-7-метокси-4-оксо-1,4-дигидрохинолин-3-карбоновой кислоты или его фармацевтически приемлемой соли для изготовления лекарственного средства для ингибирования активности ретровирусной интегразы у пациента, включающий введение пациенту терапевтически эффективного количества соединения или его фармацевтически приемлемой соли, предназначенных для введения с пищей. В одном варианте осуществления изобретение предусматривает применение соединения 6-(3-хлор 2-фторбензил)-1-[(2S)-1-гидрокси-3-метилбутан-2-ил]-7-метокси-4-оксо-1,4-дигидрохинолин-3-карбоновой кислоты или его фармацевтически приемлемой соли для изготовления лекарственного средства для лечения или профилактики ретровирусной инфекции у пациента, включающий введение пациенту терапевтически эффективного количества соединения или его фармацевтически приемлемой соли, предназначенных для введения с пищей. В одном варианте осуществления изобретение предусматривает набор, включающий (1) фармацевтическую композицию, содержащую 6-(3-хлор-2-фторбензил)-1-[(2S)-1-гидрокси-3-метилбутан-2-ил]-7 метокси-4-оксо-1,4-дигидрохинолин-3-карбоновую кислоту или ее фармацевтически приемлемую соль и фармацевтически приемлемый носитель; (2) информацию, касающуюся предписаний, и (3) контейнер,причем информация, касающаяся предписаний, включает рекомендацию относительно введения 6-(3 хлор-2-фторбензил)-1-[(2S)-1-гидрокси-3-метилбутан-2-ил]-7-метокси-4-оксо-1,4-дигидрохинолин-3-карбоновой кислоты или ее фармацевтически приемлемой соли с пищей. В одном варианте осуществления набор может необязательно включать ритонавир или его фармацевтически приемлемую соль. В одном варианте осуществления изобретение предусматривает применение соединения 6-(3-хлор 2-фторбензил)-1-[(2S)-1-гидрокси-3-метилбутан-2-ил]-7-метокси-4-оксо-1,4-дигидрохинолин-3-карбоновой кислоты или его фармацевтически приемлемой соли для изготовления лекарственного средства для повышения биодоступности соединения 6-(3-хлор-2-фторбензил)-1-[(2S)-1-гидрокси-3-метилбутан-2-ил]7-метокси-4-оксо-1,4-дигидрохинолин-3-карбоновой кислоты у пациента при введении лекарственного средства с пищей, предназначенного для введения с ритонавиром или его фармацевтически приемлемой солью. В одном варианте осуществления изобретение предусматривает применение соединения 6-(3-хлор 2-фторбензил)-1-[(2S)-1-гидрокси-3-метилбутан-2-ил]-7-метокси-4-оксо-1,4-дигидрохинолин-3-карбоновой кислоты или его фармацевтически приемлемой соли для изготовления лекарственного средства для повышения всасывания соединения 6-(3-хлор-2-фторбензил)-1-[(2,S)-1-гидрокси-3-метилбутан-2-ил]-7 метокси-4-оксо-1,4-дигидрохинолин-3-карбоновой кислоты у пациента при введении лекарственного средства с пищей, предназначенного для введения с ритонавиром или его фармацевтически приемлемой солью. В одном варианте осуществления изобретение предусматривает применение соединения 6-(3-хлор 2-фторбензил)-1-[(2S)-1-гидрокси-3-метилбутан-2-ил]-7-метокси-4-оксо-1,4-дигидрохинолин-3-карбоновой кислоты или его фармацевтически приемлемой соли для изготовления лекарственного средства для ингибирования активности ретровирусной интегразы у пациента при введении лекарственного средства с пищей, предназначенного для введения с ритонавиром или его фармацевтически приемлемой солью. В одном варианте осуществления изобретение предусматривает применение соединения 6-(3-хлор 2-фторбензил)-1-[(2S)-1-гидрокси-3-метилбутан-2-ил]-7-метокси-4-оксо-1,4-дигидрохинолин-3-карбоновой кислоты или его фармацевтически приемлемой соли для изготовления лекарственного средства для лечения или профилактики ретровирусной инфекции у пациента при введении лекарственного средства с пищей, предназначенного для введения с ритонавиром или его фармацевтически приемлемой солью. В одном варианте осуществления изобретение предусматривает фармацевтическую композицию,включающую 6-(3-хлор-2-фторбензил)-1-[(2S)-1-гидрокси-3-метилбутан-2-ил]-7-метокси-4-оксо-1,4 дигидрохинолин-3-карбоновую кислоту или его фармацевтически приемлемую соль, для повышения биодоступности соединения, предназначенную для введения с пищей. В одном варианте осуществления изобретение предусматривает фармацевтическую композицию,включающую 6-(3-хлор-2-фторбензил)-1-[(2S)-1-гидрокси-3-метилбутан-2-ил]-7-метокси-4-оксо-1,4 дигидрохинолин-3-карбоновую кислоту или ее фармацевтически приемлемую соль, для повышения всасывания соединения у пациента, предназначенную для введения с пищей. В одном варианте осуществления изобретение предусматривает фармацевтическую композицию,включающую 6-(3-хлор-2-фторбензил)-1-[(2S)-1-гидрокси-3-метилбутан-2-ил]-7-метокси-4-оксо-1,4 дигидрохинолин-3-карбоновую кислоту или ее фармацевтически приемлемую соль для ингибирования активности ретровирусной интегразы у пациента, предназначенную для введения с пищей. В одном варианте осуществления изобретение предусматривает фармацевтическую композицию,-3 018544 включающую 6-(3-хлор-2-фторбензил)-1-[(2S)-1-гидрокси-3-метилбутан-2-ил]-7-метокси-4-оксо-1,4 дигидрохинолин-3-карбоновую кислоту или ее фармацевтически приемлемую соль, для лечения или профилактики ретровирусной инфекции у пациента, предназначенную для введения с пищей. В одном варианте осуществления изобретение предусматривает композицию антиретровирусных агентов, включающую 6-(3-хлор-2-фторбензил)-1-[(2S)-1-гидрокси-3-метилбутан-2-ил]-7-метокси-4 оксо-1,4-дигидрохинолин-3-карбоновую кислоту или ее фармацевтически приемлемую соль, для повышения биодоступности соединения, предназначенную для введения с пищей. В одном варианте осуществления изобретение предусматривает антиретровирусный агент, включающий 6-(3-хлор-2-фторбензил)-1-[(2S)-1-гидрокси-3-метилбутан-2-ил]-7-метокси-4-оксо-1,4 дигидрохинолин-3-карбоновую кислоту или ее фармацевтически приемлемую соль, для повышения всасывания соединения у пациента, предназначенный для введения с пищей. В одном варианте осуществления изобретение предусматривает антиретровирусный агент, включающий 6-(3-хлор-2-фторбензил)-1-[(2S)-1-гидрокси-3-метилбутан-2-ил]-7-метокси-4-оксо-1,4 дигидрохинолин-3-карбоновую кислоту или ее фармацевтически приемлемую соль, для ингибирования активности ретровирусной интегразы у пациента, предназначенный для введения с пищей. В одном варианте осуществления изобретение предусматривает антиретровирусный агент, включающий 6-(3-хлор-2-фторбензил)-1-[(2S)-1-гидрокси-3-метилбутан-2-ил]-7-метокси-4-оксо-1,4 дигидрохинолин-3-карбоновую кислота или ее фармацевтически приемлемую соль, для лечения или профилактики ретровирусной инфекции у пациента, предназначенный для введения с пищей. В одном варианте осуществления изобретение предусматривает применение ингибитора интегразы,такого как соединение 1, или его фармацевтически приемлемой соли для изготовления лекарственного средства для перорального введения с пищей с целью достижения повышенного всасывания ингибитора интегразы или его фармацевтически приемлемой соли при лечении состояния, чувствительного к интегразе (например, ретровирусной инфекции, такой как ВИЧ-инфекция или СПИД). В одном варианте осуществления изобретение предусматривает применение ингибитора интегразы,такого как соединение 1, или его фармацевтически приемлемой соли для изготовления лекарственного средства для введения с ритонавиром или его фармацевтически приемлемой солью для лечения состояния, чувствительного к интегразе (например, ретровирусной инфекции, такой как ВИЧ-инфекция или СПИД). В одном варианте осуществления изобретение предусматривает применение ритонавира или его фармацевтически приемлемой соли для изготовления лекарственного средства для введения с ингибитором интегразы, таким как соединение 1, или его фармацевтически приемлемой солью для лечения состояния, чувствительного к интегразе (например, ретровирусной инфекции, такой как ВИЧ-инфекция или СПИД). В одном варианте осуществления изобретение предусматривает применение ингибитора интегразы,такого как соединение 1, или его фармацевтически приемлемой соли и ритонавира или его фармацевтически приемлемой соли для изготовления лекарственного средства для лечения состояния, чувствительного к интегразе (например, ретровирусной инфекции, такой как ВИЧ-инфекция или СПИД). В одном варианте осуществления изобретение предусматривает применение ритонавира или его фармацевтически приемлемой соли для изготовления лекарственного средства для введения с ингибитором интегразы, таким как соединение 1, или его фармацевтически приемлемой солью для лечения состояния, чувствительного к интегразе (например, ретровирусной инфекции, такой как ВИЧ-инфекция или СПИД). В одном варианте осуществления изобретение предусматривает применение ингибитора интегразы,такого как соединение 1, или его фармацевтически приемлемой соли для изготовления лекарственного средства для введения с ритонавиром или его фармацевтически приемлемой солью и для введения с пищей для лечения состояния, чувствительного к интегразе (например, ретровирусной инфекции, такой как ВИЧ-инфекция или СПИД). В одном варианте осуществления изобретение предусматривает применение ритонавира или его фармацевтически приемлемой соли для изготовления лекарственного средства для введения с ингибитором интегразы, таким как соединение 1, или его фармацевтически приемлемой солью и для применения с пищей для лечения состояния, чувствительного к интегразе (например, ретровирусной инфекции, такой как ВИЧ-инфекция или СПИД). Данные и другие преимущества изобретения, а также дополнительные изобретательские признаки будут очевидны из описания изобретения, представленного в данном контексте. Перечень чертежей На фиг. 1 представлен график зависимости концентрации в плазме от времени для соединения 1 в виде монокомпонента и в комбинации с ритонавиром. На фиг. 2 представлен график, построенный на линейной шкале концентрации в плазме 6-(3-хлор-2 фторбензил)-1-[(2S)-1-гидрокси-3-метилбутан-2-ил]-7-метокси-4-оксо-1,4-дигидрохинолин-3-карбоновой кислоты (соединения 1) после ее введения в условиях натощак и после приема пищи. Фиг. 3 иллюстрирует данные, полученные в примере 3. Фиг. 4 иллюстрирует данные, полученные в примере 3. Фиг. 5 иллюстрирует данные, полученные в примере 3. Сведения, подтверждающие возможность осуществления изобретения Эффекты ритонавира. Соединение 1 представляет собой ингибиторы интегразы ВИЧ Соединение 1 описано в публикации патентной заявки США 2005/0239819, которая таким образом включена в данном контексте во всей своей полноте. Соединение 1 можно найти на с. 76 в примерах 4-32 данного документа. Способы получения и применения данного соединения также описаны в данном документе. Согласно одному варианту осуществления изобретение раскрывает способ улучшения фармакокинетики лекарственного средства (или его фармацевтически приемлемой соли) путем введения ритонавира или его фармацевтически приемлемой соли вместе с лекарственным средством. Предпочтительно,когда лекарственное средство представляет собой ингибитор интегразы ВИЧ. Кроме того, предпочтительно, когда лекарственное средство метаболизируется цитохром Р 450 монооксигеназой. При введении два агента могут быть получены в виде раздельных композиций, которые вводят в одно и то же или разное время (например, одновременно, непрерывно или последовательно), или они могут быть получены и введены в виде одной композиции. Некоторые ингибиторы протеазы ВИЧ, которые метаболизируются цитохром Р 450 монооксигеназой и которые было бы благоприятно вводить с ритонавиром, описаны в патентах США 6037157 и 6703403, которые, таким образом, включены в данном контексте в виде ссылки во всей своей полноте. Данные патенты описывают получение и схемы дозирования, которые можно использовать с ритонавиром. Получение и схемы дозирования ингибиторов интегразы ВИЧ можно найти в публикации патентной заявки США 2004/0167124, которая, таким образом, включена в данном контексте в виде ссылки во всей своей полноте. Вышеуказанные схемы можно использовать в изобретении, описанном в данном контексте. В случае комбинированной терапии, например, приблизительно от 20 до приблизительно 500 мг соединения 1 можно ввести приблизительно от 10 до приблизительно 1200 мг ритонавира/день. В одном специальном варианте осуществления изобретения приблизительно от 20 до приблизительно 500 мг соединения 1 можно ввести приблизительно от 10 до приблизительно 600 мг ритонавира/день. В варианте осуществления изобретения подходящая доза соединения 1 составляет приблизительно 20, 50, 75, 85,100, 125, 150, 175 или 200 мг, более приблизительно 85, приблизительно 125 или приблизительно 150 мг. В варианте осуществления изобретения подходящая доза ритонавира составляет от приблизительно 20 до приблизительно 200 мг, в частности от приблизительно 50 до приблизительно 125 мг, более подробно приблизительно 100 мг. Однако могут быть эффективными более высокие и более низкие дозы каждого агента. В одном варианте осуществления суточного введения предпочтительные количества соединения 1 и ритонавира представляют собой дозы, которые могут достигать концентрации соединения 1 в крови,поддерживающие IC95 (например, с поправкой на связывание белка in vitro IC95 100 нМ) в течение 24 ч. В одном варианте осуществления суточного введения предпочтительные количества соединения 1 и ритонавира представляют собой дозы, которые могут достигать концентрации соединения 1 в крови,поддерживающие более ЕС 90 (например, приблизительно 170 нг/мл на модели Emax) в течение 24 ч. В одном варианте осуществления предпочтительные количества соединения 1 представляют собой дозы, которые получают пациенты, которые могут достигать такого уровня, что среднее снижение уровней РНК ВИЧ в качестве активности в отношении ВИЧ составляет больше чем 1,5 log10 копий/мл, предпочтительно 2,0 log10. В специальном варианте осуществления изобретение предусматривает способ улучшения фармакокинетики ингибитора интегразы ВИЧ, такого как соединение 1 (или его фармацевтически приемлемой соли), в частности, метаболизируемого цитохром Р 450 монооксигеназой, более подробно изоформойCYP 3A4, у нуждающегося в данном лечении пациента, посредством введения или совместного введения ритонавира или его фармацевтически приемлемой соли с ингибитором интегразы. Данную комбинацию ритонавира или его фармацевтически приемлемой соли и ингибитора интегразы ВИЧ, такого как соединение 1, или его фармацевтически приемлемой соли, которая метаболизируется цитохром Р 450 монооксигеназой, используют для подавления, лечения или профилактики ВИЧ-инфекции или СПИДа (синдрома приобретенного иммунодефицита) у пациента. Пациенты включают любые живые существа, в частности млекопитающих (например, человека). Один аспект изобретения представляет применение эффективного количества ритонавира для улучшения фармакокинетики ингибитора интегразы ВИЧ, такого как соединение 1. Эффективное количество ритонавира, т.е. количество, требующееся для усиления действия ингибитора интегразы ВИЧ,представляет собой количество, необходимое для улучшения фармакокинетического профиля ингибитора интегразы ВИЧ по сравнению с его профилем при использовании в виде монотерапии. Ингибитор обладает более эффективным фармакокинетическим профилем, чем был бы без добавления ритонавира. Количество ритонавира, используемое для усиления действия ингибитора интегразы, может быть субтерапевтическим (например, дозы ниже количества ритонавира, обычно используемые для терапевтического лечения ВИЧ-инфекции у пациента). Усиливающая доза ритонавира является субтерапевтической для лечения ВИЧ-инфекции, но достаточно высокой для того, чтобы вызвать модуляцию метаболизма соединения 1, так что их воздействие на пациента усиливается посредством повышенной биодоступности,повышенных уровней в крови, увеличенного полупериода существования, увеличенного периода времени до достижения максимальной концентрации в плазме, повышенного/ускоренного ингибирования интегразы ВИЧ и/или пониженного системного клиренса. Соединение 1 представляет собой ингибитор интегразы ВИЧ, который метаболизируется цитохром Р 450 монооксигеназой, особенно изоформой CYP 3 А. В настоящее время обнаружено, что ритонавир можно использовать для улучшения фармакокинетики соединения 1, а также других ингибиторов интегразы ВИЧ. Ритонавир особенно эффективен в плане усиления эффектов ингибиторов интегразы, которые метаболизируются цитохром Р 450 монооксигеназой (например, изоформой CYP 3 А). Степень данного усиления оказывается неожиданно существенной. Ритонавир может ограничивать эффект первого прохождения данных соединений. Ритонавир может также ограничивать эффекты вторичного прохождения (системный или печеночный метаболизм/клиренс) данных соединений. Согласно способам, соответствующим изобретению, ингибитор интегразы, такой как соединение 1,или его фармацевтически приемлемую соль можно также вводить с одним или двумя другими агентами,которые используют для лечения вирусных инфекций, такими как ставудин, эмтрицитабин, тенофовир,абакавир, ламивудин, зидовудин, диданозин, залцитабин, фосфазид, эфавиренц, невирапин, делавирдин,типранавир, саквинавир, индинавир, атазанавир, нелфинавир, ампренавир, сампренавир, фосампренавир,лопинавир, ритонавир, энфувиртид, фозивудин тидоксил, аловудин, декселвуцитабин, априцитабин, амдоксовир, элвуцитабин (АСН 126443), рацивир (рацемический FTC, PSI-5004), MIV-210, KP-1461, фосалвудин тидоксил (HDP 99.0003), AVX756, диоксолан тимин (DOT), TMC-254072, INK-20, 4'-Ed4T, ТМС 125 (этравирин), каправирин, ТМС-278 (рилпивирин), GW-695634, каланолид A, BILR 355 BS и VRX 840773 или их фармацевтически приемлемые соли. Хотя вышеприведенный перечень включает торговые названия ряда соединений, следует иметь в виду, что ссылка на торговое название включает также лежащий в основе активный химический агент независимо от источника. Наборы, соответствующие изобретению, могут также необязательно далее включать один или более агентов, выбранных из вышеприведенного перечня. В одном варианте осуществления изобретения способы, соответствующие изобретению, далее включают введение одного или более других агентов, выбранных из тенофовира DF (TDF), эмтрицитабина (FTC), зидовудина (AZT), диданозина (ddI), ставудина (d4T), абакавира (ABC), атазанавира (ATV),лопинавира (LPV), сакцинавира (SQV), типранавира (TPV), фосампренавира (FosAPV) и эфавиренца(EFV). Наборы, соответствующие изобретению, могут также далее включать один или более других агентов из вышеприведенного перечня. Настоящее изобретение также представляет набор, включающий (i) ингибитор интегразы, такой как соединение 1, или его фармацевтически приемлемую соль, (ii) ритонавир или его фармацевтически приемлемую соль, (iii) информацию, относящуюся к предписаниям, и (iii) один или более контейнеров. Информация, относящаяся к предписаниям, может представлять информацию, относящуюся к предписаниям, соответствующую способам, представленным в изобретении, и/или как иным образом обсуждается в данном контексте. В варианте осуществления изобретения информация, относящаяся к предписаниям,включает введение ингибитора интегразы или его фармацевтически приемлемой соли с ритонавиром для улучшения фармакокинетики ингибитора интегразы. Эффекты пищи. Настоящее изобретение предусматривает также способы улучшения фармакокинетических свойств соединения 1 при введении пациенту. Настоящее изобретение предусматривает также способы повышения терапевтической эффективности соединения 1 в плане лечения или профилактики заболеваний, нарушений и состояний. Пример заболевания, нарушения или состояния включает, но без ограничения перечисленным, ретровирусную инфекцию или заболевание, нарушение или состояние, ассоциированное с ретровирусной инфекцией. Соединение 1 можно также вводить пациенту для ингибирования активности ретровирусной интегразы. В варианте осуществления изобретения ретровирус представляет собой ВИЧ. Ранее не проводили фармакокинетических исследования с целью оценки эффекта пищи на фармакокинетику соединения 1. Как правило, пища оказывает различное воздействие на биодоступность и всасывание активного агента. Взаимодействия типа лекарственное средство-лекарственное средство могут привести в результате к пониженной, замедленной или повышенной системной биодоступности лекарст-6 018544 венного средства; например, см. статью Welling, Clin. Pharmacokinet., 9: 404-434 (1984). Обнаруживают, что соединение 1 можно ввести пациенту в способе, который повышает терапевтическую эффективность соединения 1 у данных пациентов. При введении с пищей соединение 1 проявляет повышенную биодоступность и всасывание у пациентов. Соответственно изобретение предусматривает способ повышения биодоступности и всасывания соединения 1 у пациента, включающий введение пациенту терапевтически эффективного количества соединения 1 с пищей. Соединение 1 описано в патентной заявке США 10/492833, поданной 20 ноября 2003 г. (публикация патентной заявки США 2005/0239819), и в патентной заявке США 11/133463, поданной 20 мая 2005 г. (публикация патентной заявки США 2005/0288326), которые в данном контексте включены в виде ссылки во всей своей полноте. Соединение 1 существует по меньшей мере в трех различных кристаллических формах. Кристаллические формы I, II и III описаны в публикации международной патентной заявки WO 05/113508, которая также в данном контексте включена в виде ссылки во всей своей полноте. Данные три формы различают с помощью дифференциального сканирующего калориметра(DSC) и рентгеновского порошкового дифрактометра (XRD). Любую из кристаллических форм можно использовать в настоящем изобретении. В варианте осуществления изобретения пациенту вводят кристаллическую форму II или III либо их смешанные кристаллы. Хотя введение соединения 1 представляет собой конкретный вариант осуществления изобретения,изобретение также предусматривает введение других соединений, которые дают соединение 1, например пролекарственных форм соединения 1. Данные пролекарственные формы, например, могут включать соединения, которые имеют защитные группы, но такие, которые еще приводят в результате к формированию соединения 1 в организме пациента (т.е. in vivo). Защитные группы карбоновой кислоты включают, например, сложные алкиловые эфиры и сложные бензиловые эфиры, которые можно удалить с помощью кислоты или основания и гидрогенолиза соответственно. Более того, соединение, имеющее какой-либо органический остаток, который может диссоциировать in vivo с образованием соединения 1,можно ввести согласно способу, соответствующему изобретению. Таким образом, изобретение предусматривает также введение соединения 1' (где R' обозначает органический остаток), чтобы получить соединение 1. Соединение 1' имеет следующую структурную формулу: Настоящее изобретение далее предусматривает введение фармацевтически приемлемой соли соединения 1. Например, фармацевтически приемлемую соль соединения 1 можно получить путем реакции соединения 1 с неорганической кислотой, такой как соляная кислота, серная кислота, фосфорная кислота,бромоводородная кислота и т.п.; с органической кислотой, такой как щавелевая кислота, малоновая кислота, лимонная кислота, фумаровая кислота, молочная кислота, яблочная кислота, янтарная кислота,винная кислота, уксусная кислота, трифторуксусная кислота, глюконовая кислота, аскорбиновая кислота,метилсульфоновая кислота, бензилсульфоновая кислота и т.п.; неорганическим основанием, таким как гидроксид натрия, гидроксид калия, гидроксид кальция, гидроксид магния, гидроксид аммония и т.п.; органическим основанием, таким как метиламин, диэтиламин, триэтиламин, триэтаноламин, этилендиамин, трис-(гидроксиметил)метиламин, гуанидин, холин, цинхонин и т.п., или аминокислотой, такой как лизин, аргинин, аланин и т.п. Настоящее изобретение также охватывает введение содержащих воду продуктов и сольватов, таких как гидраты, соединения 1 и т.п. Вследствие этого, как используют в данном контексте, выражение "введение соединения 1" относится к введению любой формы соединения 1, которая дает соединение 1 in vivo. Как используют в данном контексте, термин "биодоступность" относится к скорости и степени, в которой активный ингредиент высвобождается из лекарственного продукта и становится доступным в области действия; см. Свод федеральных нормативных актов США, раздел 21, часть 320.1 (изд. 2001 г.). Для пероральных дозированных форм биодоступность относится к процессам, с помощью которых активный ингредиент высвобождается из пероральной дозированной формы, например таблетки, и движется в область действия, например всасывается в большой круг кровообращения. Вследствие этого термин"всасывание" относится к присутствию соединения 1 в его области действия, например в кровотоке или в иммуноцитах, таких как Т-клетка или макрофаг. Как используют в данном контексте, термин "с пищей" или "после приема пищи" относится к условиям после принятия пищи в период от приблизительно 1 ч перед введением соединения 1 до приблизительно 2 после введения соединения 1. В другом варианте осуществления термин "с пищей" или "после приема пищи" относится к условиям введения соединения 1 в период от приблизительно 1 ч до приема пищи до приблизительно 2 ч после приема пищи. Термин "пища", как используют в данном контексте,относится как к жидкой, так и к твердой пище. Пища также может быть диетой с низким содержанием жиров, высоким содержанием жиров, щадящей диетой или обогащенной диетой. В варианте осуществления изобретения пища представляет собой твердую пищу с существенным объемом и содержанием жиров, которые небыстро растворяются и всасываются в желудке. Пища может представлять собой прием пищи, такой как завтрак, ланч или обед. Кроме того, прием пищи можно осуществить механическим введением, например внутривенно, путем принудительного употребления пациентом. Альтернативно пациент может добровольно принимать пищу. Соединение 1 можно вводить в любое время суток с пищей. Пищу, как правило, можно принимать в любое время в период от приблизительно 1 ч перед введением соединения 1 до приблизительно 2 ч после введения соединения 1. Например, пищу можно принимать в период времени приблизительно за 1 ч,приблизительно за 45, приблизительно за 30, приблизительно за 15, приблизительно за 10 или приблизительно за 5 мин перед введением соединения 1. Аналогично пищу можно принимать в период времени приблизительно через 5, приблизительно через 10, приблизительно через 15, приблизительно через 30,приблизительно через 45 мин, приблизительно через 1, приблизительно через 1,25, приблизительно через 1,5, приблизительно через 1,75 или приблизительно через 2 ч после введения соединения 1. В другом варианте осуществления термин "с пищей" или "после приема пищи" относится к условиям введения соединения 1 в период от приблизительно 1 ч до приема пищи до приблизительно 2 ч после приема пищи. Например, соединение 1 можно ввести в период времени приблизительно за 1 ч, приблизительно за 45, приблизительно за 30, приблизительно за 15, приблизительно за 10 или приблизительно за 5 мин до приема пищи. Аналогично соединение 1 можно ввести в период времени приблизительно через 5, приблизительно через 10, приблизительно через 15, приблизительно через 30, приблизительно через 45 мин,приблизительно через 1, приблизительно через 1,25, приблизительно через 1,5, приблизительно через 1,75 или приблизительно через 2 ч после приема пищи. В другом варианте осуществления изобретения соединение 1 можно вводить непосредственно после приема пищи (например, в течение приблизительно 1 мин после приема пищи) до приблизительно 1 ч после приема пищи. Очень хорошо, когда соединение 1 вводят практически в одно и то же время с приемом пищи. Как используют в данном контексте, термины "без приема пищи" или "натощак" относятся к условию не принимать пищу в период времени приблизительно за 1 ч перед введением соединения 1 до приблизительно 2 ч после введения соединения 1. Способ, соответствующий изобретению, заключается во введении терапевтически эффективного количества соединения 1. В случае введения соединения 1 как монотерапии с пищей подходящая доза терапевтически эффективного количества соединения 1 для введения пациенту будет составлять от приблизительно 10 до приблизительно 2000 мг в день. В варианте осуществления изобретения подходящая доза составляет от приблизительно 400 до приблизительно 1600 мг в день. В другом варианте осуществления изобретения подходящая доза составляет от приблизительно 600 до приблизительно 1200 мг в день. В следующем варианте осуществления изобретения подходящая доза составляет приблизительно 800 мг в день. Если требуется, эффективная суточная доза соединения 1 может быть введена как две, три, четыре,пять, шесть или более субдоз, введенных раздельно через соответствующие интервалы в течение дня,необязательно в унифицированных лекарственных формах. Согласно способу, представленному в изобретении, соединение 1 можно ввести с пищей много раз в день или, альтернативно, один раз в день. В варианте осуществления изобретения соединение 1 вводят с пищей один или два раза в день. Как используют в данном контексте, термин "унифицированная лекарственная форма" относится к форме соединения 1, вводимой пациенту. Унифицированная лекарственная форма может представлять собой, например, пилюлю, капсулу или таблетку. В варианте осуществления изобретения унифицированная лекарственная форма представляет собой таблетку. В варианте осуществления изобретения унифицированная лекарственная форма включает от приблизительно 10 до приблизительно 2000 мг соединения 1. В варианте осуществления изобретения унифицированная лекарственная форма включает от приблизительно 50 или 200 мг соединения 1 и представлена в форме таблетки. В другом варианте осуществления изобретения унифицированная лекарственная форма включает приблизительно 125 или 150 мг соединения 1 и представлена в форме таблетки. В еще одном варианте осуществления изобретения чистота соединения 1 составляет не меньше чем 95%. Более предпочтительно, когда чистота соединения 1 составляет не меньше чем 98%. Концентрацию соединения 1 в кровотоке можно измерить как концентрацию в плазме (нг/мл). Фармакокинетические параметры для определения концентрации в плазме включают, но без ограничения перечисленным, максимальную наблюдаемую концентрацию в плазме (Cmax), площадь под кривой зависимости концентрации в плазме от времени (AUC) от нулевого времени до последней количественно определяемой точки времени (AUC0-t), AUC от нулевого времени до бесконечности (AUC0-inf), время максимальной наблюдаемой концентрации в плазме после введения (tmax) и полупериод существования соединения 1 в плазме (t1/2). Введение соединения 1 с пищей приводит в результате к повышенной биодоступности соединения 1, что доказывает повышение Cmax и/или AUC0-inf соединения 1 по сравнению со значениями, получаемыми, если бы соединение 1 вводили без приема пищи. Введение соединения 1 с пищей согласно способу, соответствующему изобретению, может также повышать всасывание соединения 1. Всасывание соединения 1 можно измерить по концентрации, образующейся в кровотоке через период времени после введения соединения 1. Повышения уровня всасывания путем введения соединения 1 с пищей можно также подтвердить посредством повышения Cmax и/илиAUC0-inf соединения 1 по сравнению со значениями, получаемыми, если бы соединение 1 вводили без приема пищи. Настоящее изобретение предусматривает также способ лечения или профилактики заболеваний, нарушений и состояний. Пример заболевания, нарушения или состояния включает, но без ограничения перечисленным, ретровирусную инфекцию, или заболевание, нарушение или состояние, связанное с ретровирусной инфекцией. Ретровирусы представляют собой РНК-вирусы и обычно их разделяют на семейства альфаретровирусов, бетаретровирусов, дельтаретровирусов, эпсилонретровирусов, гаммаретровирусов, лентивирусов и спумавирусов. Примеры ретровирусов включают, но без ограничения перечисленным, вирус иммунодефицита человека (ВИЧ), Т-лимфотропный вирус человека (HTLV), вирус саркомы Рауса (RSV) и вирус лейкоза птиц. Как правило, три гена ретровирусного генома кодируют белки зрелого вируса: ген gag (группоспецифического антигена), который кодирует кор и структурные белки вируса; ген pol (полимеразы), который кодирует ферменты вируса, включая обратную транскриптазу, протеазу и интегразу, и ген env (оболочки), который кодирует поверхностные белки ретровируса. Ретровирусы присоединяются и проникают в клетку-хозяин посредством выделения комплекса РНК и продуктов pol в числе других материалов в клетку-хозяин. Затем обратная транскриптаза продуцирует двухцепочечную ДНК из вирусной РНК. Двухцепочечная ДНК импортируется в ядро клеткихозяина и интегрируется в геном клетки-хозяина с помощью вирусной интегразы. Возникающий вирус из интегрированной ДНК образуется, когда интегрированная вирусная ДНК превращается в мРНК с помощью полимеразы клетки-хозяина и белки, необходимые для формирования вируса, продуцируются под действием вирусной протеазы. Вирусная частица отделяется и высвобождается из клетки-хозяина с образованием зрелого вируса. Один вариант осуществления изобретения представляет собой способ ингибирования активности ретровирусной интегразы у пациента, включающий введение пациенту терапевтически эффективного количества соединения 1 с пищей. В конкретном варианте осуществления изобретения ретровирус представляет собой ВИЧ. Как используют в данном контексте, "ингибирование" относится к снижению или остановке по меньшей мере одной активности, ассоциированной с белком, ферментом или любым другим соединением. Другой вариант осуществления изобретения представляет собой способ лечения или профилактики ретровирусной инфекции, включающий введение пациенту терапевтически эффективного количества соединения 1 с пищей. В конкретном варианте осуществления изобретения ретровирус представляет собой ВИЧ. Соединение 1 можно вводить пациенту любым принятым способом. Хотя возможно введение соединения 1 в виде неочищенного соединения, предпочтительным является введение в виде фармацевтической композиции. Выражение "фармацевтическая композиция, включающая соединение 1", относится к фармацевтической композиции, включающей соединение 1 или его фармацевтически приемлемую соль с одним или более фармацевтически приемлемыми носителями или наполнителями и, необязательно,другими лечебными факторами и/или компонентами. Соль, носитель или наполнитель должны быть приемлемыми в смысле совместимости с другими ингредиентами и безвредными для самого реципиента. Примеры носителей или наполнителей для перорального введения включают кукурузный крахмал, лактозу, стеарат магния, тальк, микрокристаллическую целлюлозу, стеариновую кислоту, повидон, кросповидон, дикальцийфосфат, натрий крахмалгликолят, гидроксипропилцеллюлозу (например, гидроксипропилцеллюлозу с низким уровнем замещения), гидроксипропилметилцеллюлозу (например, гидроксипропилметилцеллюлозу 2910), лаурилсульфат натрия. Фармацевтические композиции можно получить любым подходящим способом, таким как те способы, которые хорошо известны в области фармации, например такими способами, как описаны в справочнике Gennaro et al., Remington's Pharmaceutical Sciences (Фармацевтические науки Ремингтона) (18 изд., Mack Publishing Co., 1990), особенно часть 8: Pharmaceutical Preparations and their Manufacture (Фармацевтические препараты и их приготовление). Данные способы включают стадию приведения в контакт соединения 1 с носителем или наполнителем и, необязательно, одним или более вспомогательных ингредиентов. Данные вспомогательные ингредиенты включают принятые в области техники, такие как инертные наполнители, связующие компоненты, разбавители, разрыхлители, красители, вкусовые добавки и смачивающие агенты. Фармацевтические композиции могут обеспечить контролируемое замедленное действие или замедленное высвобождение соединения 1 в течение периода времени. Контролируемое замедленное действие или замедленное высвобождение соединения 1 может поддерживать уровень соединения 1 в кровотоке пациента в течение более длительного периода времени, чем при использовании принятых лекарственных средств. Фармацевтические композиции включают, но без ограничения перечисленным, таблетки с покрытием, пеллеты и капсулы и дисперсии соединения 1 в среде, которая нерастворима в фи-9 018544 зиологических жидкостях, или когда высвобождение терапевтического соединения следует за разложением фармацевтической композиции вследствие механической, химической или ферментной активности. Фармацевтическая композиция, соответствующая изобретению, может находиться, например, в форме пилюли, капсулы или таблетки, каждая из которых содержит предварительно заданное количество соединения 1 и предпочтительно имеет покрытие для облегчения проглатывания, в форме порошка или гранул либо в форме раствора или суспензии. В варианте осуществления изобретения фармацевтическая композиция находится в форме таблетки, содержащей соединение 1 и компоненты таблетки, используемые и описанные в примерах, приведенных в данном контексте. Для перорального введения тонкие порошки или гранулы могут включать разбавляющие, диспергирующие или поверхностно-активные агенты и могут находиться, например, в воде или в сиропе, в капсулах или пакетиках в сухом состоянии либо в безводном растворе или суспензии, в который могут быть включены суспендирующие агенты, или в таблетках, в которые могут быть включены связующие агенты и скользящие вещества. Фармацевтическая композиция может также включать дополнительные компоненты, такие как подсластители, вкусовые добавки, консерванты (например, антимикробные консерванты), суспендирующие агенты, сгустители и/или эмульгаторы. При введении в форме жидкого раствора или суспензии лекарственное средство может содержать соединение 1 и очищенную воду. Необязательные компоненты в жидком растворе или суспензии включают подходящие подсластители, вкусовые добавки, консерванты (например, антимикробные консерванты), забуферивающие агенты, растворители и их смеси. Компонент лекарственного средства может выполнять больше одной функции. Например, подходящий забуферивающий агент может также действовать как вкусовая добавка, а также как подсластитель. Подходящие подсластители включают, например, сахаринат натрия, сахарозу и маннит. Можно использовать смесь двух или более подсластителей. Подсластитель или их смеси, как правило, присутствуют в количестве от приблизительно 0,001 до приблизительно 70% от общей массы композиции. Подходящие вкусовые добавки могут присутствовать в фармацевтической композиции, чтобы обеспечить вишневый вкус, вкус сахарной ваты и другой подходящий вкус, чтобы пациенту было легче проглотить фармацевтическую композицию. Вкусовая добавка или их смеси, как правило, присутствуют в количестве от приблизительно 0,0001 до приблизительно 5% от общей массы композиции. Подходящие консерванты включают, например, метилпаребен, пропилпаребен, бензоат натрия и хлорид бензалкония. Можно использовать смесь двух или более консервантов. Консервант или их смеси,как правило, присутствуют в количестве от приблизительно 0,0001 до приблизительно 2% от общей массы композиции. Подходящие забуферивающие агенты включают, например, лимонную кислоту, цитрат натрия,фосфорную кислоту, фосфат калия и различные другие кислоты и соли. Можно использовать смесь двух или более забуферивающих агентов. Забуферивающий агент или их смеси, как правило, присутствуют в количестве от приблизительно 0,001 до приблизительно 4% от общей массы композиции. Подходящие растворители для жидкого раствора или суспензии включают, например, сорбит, глицерин, пропиленгликоль и воду. Можно использовать смесь двух или более растворителей. Растворитель или система растворителей, как правило, присутствуют в количестве от приблизительно от 1 до приблизительно 90% от общей массы композиции. Фармацевтическую композицию можно вводить с вспомогательными агентами. Например, неионогенные поверхностно-активные вещества, такие как сложный олеиловый эфир полиоксиэтилена и н-гексадециловый эфир полиэтилена можно вводить с фармацевтической композицией или включать в нее с целью искусственного повышения проницаемости стенок кишечника. Ферментные ингибиторы также можно вводить сфармацевтической композицией или включать в нее. Настоящее изобретение предусматривает также набор, содержащий (i) фармацевтическую композицию, включающую соединение 1 или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель, (ii) информацию, касающуюся предписаний, и (iii) контейнер. Информация, касающаяся предписаний, может обеспечивать информацию, касающуюся предписаний, соответствующих способам, представленным в изобретении и/или иным аспектам, обсуждаемым в данном контексте. В варианте осуществления изобретения информация, касающаяся предписаний, включает пероральное введение соединения 1 с пищей с целью улучшения биодоступности и всасывания соединения 1. Соединение 1 может быть представлено пациенту в контейнере вместе с информацией, касающейся предписаний, которая рекомендует пациенту принимать соединение 1 перорально с пищей и может также объяснять, что такой образ действий будет повышать биодоступность соединения 1. Соединение 1 может быть также представлено пациенту в контейнере вместе с информацией, касающейся предписаний, в которой пациенту сообщают, что прием соединения 1 с пищей приводит в результате к повышению всасывания соединения 1, что отражается в повышении максимальной концентрации в плазме соединения 1 по сравнению с приемом соединения натощак. Примеры, иллюстрирующие эффекты ритонавира на биодоступность репрезентативного ингибитора интегразы Эффекты ритонавира на биодоступность репрезентативного ингибитора интегразы теперь будут проиллюстрированы следующими неограничивающими примерами. Пример 1. Поддерживающие эффекты ритонавира на фармакокинетику соединения 1. Определяют эффекты совместного введения 100 мг ритонавира (RTV) на стабилизированную фармакокинетику соединения 1. Определяют также фармакокинетику соединения 1 при однократной дозе и многократной дозе. Кроме того, определяют безопасность многократной дозы соединения 1 при введении в виде монотерапии и с RTV. Способы. Исследование представляет собой фармакокинетическое исследование на 12 пациентах с открытыми этикетками, в фиксированной последовательности и с перекрыванием. Пациенты представляют собой здоровых мужчин и небеременных нелактирующих женщин в возрасте от 18 до 45 лет включительно. Продолжительность исследования составляет 20 дней с периодом 1 от 1 до 10 дня и периодом 2 от 11 до 20 дня. Последующий контакт осуществляют в День 27. Соединение 1 (100 мг) и RTV (100 мг) вводят два раза в день перорально сразу после принятия пищи. Соединение 1 (100 мг) вводят два раза в день перорально сразу после принятия пищи. Критерии оценки. Фармакокинетика. Для соединения 1 (и метаболитов при возможности) в плазме рассчитывают следующие параметры:Cmax, Tmax, Clast, Tlast, Ctau, Z, AUC0-last, AUCinf, %AUCexp, AUCtau, T1/2, VZ/F и CL/F. Безопасность. Безопасность определяют по оценке клинических лабораторных тестов на исходном уровне и в различных точках времени в течение исследования, по периодическим физическим исследованиям и документации неблагоприятных событий на протяжении исследования. Статистические методы. Фармакокинетика. Итоги исследования фармакокинетики соединения 1 и RTV подводят, используя описательную статистику. Кроме того, параметрический анализ (нормальная теория) расхождений (ANOVA) с использованием модели смешанных эффектов, подходящей для перекрывающегося типа, соответствует натуральному логарифмическому превращению фармакокинетических параметров соединения 1 (AUC и Cmax). Сравнения фармакокинетики соединения 1 при однократной дозе и многократной дозе и фармакокинетики соединения 1 при многократной дозе с введением и без введения RTV проводят, используя 90% доверительные интервалы для соотношения геометрических средних для каждой пары вариантов лечения. Безопасность. В данном фармакокинетическом исследовании не делают никакого статистического заключения в отношении данных по безопасности. Результаты. Фармакокинетические результаты. Средние (% CV) фармакокинетические параметры в плазме соединения 1 и RTV после однократного перорального введения дозы 1 (100 мг, День 1) и многократного перорального введения дозы соединения 1 (100 мг два раза в день, День 10) в отсутствие RTV или в присутствии RTV, вводимого перорально в виде однократной дозы (100 мг, День 11) или многократных доз (100 мг два раза в день, День 20) являются следующими.- Ctau представляет концентрацию в конце интервала дозирования для Дней 1, 10, 11 и 20. с - Среднее (min, max). Во время введения соединения 1 в виде монотерапии среднее стабилизированное системное воздей- 11018544 ствие (AUCtau) соединения 1 (День 10) составляет приблизительно на 20% ниже по сравнению со средним воздействием (AUCinf) после однократного введения (День 1), указывая на автоиндукцию метаболизма соединения 1. Совместное введение с RTV приводит в результате к общему ингибированию метаболизма соединения 1, что доказывают как по стабилизированным воздействиям, превышающим предсказываемые, так и по относительно длинному среднему полупериоду существования до элиминации(9,5 относительно 3,5 ч в стабилизированном состоянии). Повышение степени воздействия соединения 1 после совместного введения RTV, вероятно, обусловлено комбинацией повышенной пероральной биодоступности вследствие пониженного метаболизма при первом прохождении с компонентом пониженного системного клиренса, как показано путем изменения наблюдаемого Т 1/2. В целом данные результаты поддерживают применение RTV (например, RTV в низкой дозе) как фармакокинетического усилителя соединения 1, чтобы сделать возможным, например, достижение более высоких минимальных концентраций и менее частых интервалов дозирования. Результаты по безопасности. Возникающие при лечении неблагоприятные события (АЕ или AEs от англ. - adverse effect(s описаны у 4 из 12 пациентов (33%, пять событий) во время применения соединения 1 в виде монотерапии и у 7 из 12 пациентов (58%, 44 события) при применении соединения 1+RTV. Никакие отдельные АЕ не описаны у больше чем одного пациента при применении соединения 1 в виде монотерапии. При применении соединения 1+RTV наиболее частым описываемым АЕ, возникающем при лечении, является тошнота, испытываемая 4 пациентами (33%). Большинство AEs, возникающих при лечении, относятся к событиям слабой тяжести (степень 1) и устраняются без лечения. Возникающие при лечении AEs, рассматриваемые авторами как связанные с исследуемыми лекарственными средствами, описаны у 2 из 12 пациентов (17%, два события) после введения соединения 1 в виде монотерапии и у 5 из 12 пациентов (42%,21 событие) после введения соединения 1+RTV. Никаких связанных с лечением АЕ не описано у более чем одного пациента после введения соединения 1 в виде монотерапии. Связанные с лечением AEs, описанные у более чем одного пациента после введения соединения 1+RTV, представляют собой тошноту(три пациента), рвоту (два пациента), головную боль (два пациента) и зуд (два пациента). Никаких серьезных неблагоприятных событий не произошло, ни один пациент не исключен из испытания вследствие неблагоприятного события и ни одной беременности не случилось во время данного исследования. Ни один из пациентов не прекратил принимать исследуемые лекарственные средства вследствие клинической лабораторной патологии и ни одна клиническая лабораторная патология не описана как АЕ. Выводы. Совместное введение с RTV приводит в результате к общему ингибированию метаболизма соединения 1 и в существенной мере к повышенным системным воздействиям в особенности из-за повышения концентрации. Данные поддерживают применение RTV в низкой дозе в качестве фармакокинетического усилителя соединения 1. Пероральное введение соединения 1 (100 мг два раза в день) в период до 20 хорошо переносится участвующими в исследовании пациентами. После введения соединения 1 в виде монотерапии все неблагоприятные события являются слабыми и временными. Одновременное пероральное введение соединения 1 (100 мг два раза в день) и RTV (100 мг два раза в день) в период до 10 дней в основном хорошо переносится участвующими в исследовании пациентами. После введения соединения 1+RTV большинство описанных неблагоприятных событий являются слабыми и временными и в основном соответствующими описанным для RTV. Пример 2. Безопасность, фармакокинетика и антивирусная активность соединения 1 после перорального введения пациентам, инфицированным ВИЧ-1. Исследуют безопасность, фармакокинетику и антивирусную активность соединения 1, вводимого перорально в виде 10 последовательных суточных доз (два раза в день для групп 1, 2 и 4; один раз в день для групп 3 и 5) пациентам, хронически инфицированным ВИЧ-1, в настоящее время не получающим антиретровирусного лечения. Исследуют также фармакокинетику и фармакодинамику соединения 1. Способы. Исследования представляют собой проводимые двойным слепым методом, рандомизированные, с использованием контрольной группы с плацебо, с последовательными группами, ранжированные по дозам исследования фазы 1/2 лечения соединением 1 нелеченных или леченных антиретровирусными лекарственными средствами ВИЧ-инфицированных взрослых, которые в настоящее время не проходят антиретровирусное лечение. При отборе пациенты должны иметь нагрузку РНК ВИЧ-1 в плазме от 10000 до 300000 копий/мл и число CD4+ клеток 200 клеток/мм 3. Пять последовательных групп из 8 специфических пациентов (6 пациентов - на активном препарате и 2 - на плацебо) лечат в течение 10 последовательных дней, начиная с дня 1 исследуемым лекарственным препаратом или плацебо в условиях после приема пищи. Безопасность, переносимость, фармакокинетику и эффективность мониторируют до Дня 21 после введения дозы. Активными вариантами лечения в 5 группах являются следующие: группа 1, 400 мг соединения 1 два раза в день; группа 2, 800 мг соединения 1 два раза в день; группа 3, 800 мг соединения 1 один раз в день; группа 4, 200 мг соединения 1 два раза в день; группа 5, 50 мг соединения 1 + 100 мг RTV (RTV), каждый препарат один раз в день. Группа плацебо в группе 5 также получает 100 мг RTV. В группу включают восемь пациентов, 2 - получающих плацебо и 6 - активный препарат (рандомизированные: 48, вводят дозу 40). Безопасность оценивают для 8 пациентов/группу (2 получающих плацебо, 6 - активный препарат), всего 40 пациентов. Фармакокинетику оценивают у 28 пациентов в День 1, у 30 пациентов в День 10. Фармакокинетику оценивают у 30 пациентов и РНК ВИЧ-1 определяют у 40 пациентов. Эффективность определяют у 8 пациентов/группу (2 получающих плацебо, 6 - активный препарат), всего у 40 пациентов. Пациенты представляют собой мужчин и женщин в возрасте от 18 до 60 лет включительно, которые хронически инфицированы ВИЧ-1 и в настоящее время не проходят антиретровирусное лечение с определяемым при скрининге уровнем РНК ВИЧ-1 в плазме от 10,000 до 300000 копий/мл и определяемым при скрининге числа CD4+ клеток 200 клеток/мм 3. Пациенты могут быть прошедшими или не прошедшими антиретровирусное лечение, но не получающими антиретровирусные препараты в течение 90 дней до начала эксперимента (День 0). Продолжительность исследования составляет 21 день, причем 10 дней лечения и 11 дней изучения отдаленных результатов. Таблетки по 50 или 200 мг соединения 1 вводят перорально в условиях после приема пищи. Подходящее плацебо вводят перорально в условиях после приема пищи. Только в группе 5 капсулы по 100 мг RTV перорально вводят совместно в условиях после приема пищи. Критерии оценки. Эффективность. Первичная конечная точка эффективности представляет собой максимальное снижение уровня РНК ВИЧ-1 (log10 копий/мл) относительно исходного уровня до Дня 11. Максимальное снижение для отдельного пациента составляет максимальное падение среди изменений относительно исходного уровня в дни 2-11. Фармакокинетика. Для соединения 1 рассчитывают следующие фармакокинетические параметры: Cmax, Tmax, Clast, Tlast,Ctau, Z, AUC0.last, AUCinf, %AUCexp, AUCtau, VZ/F и CL/F. Определяют концентрации соединения 1 в мононуклеарных клетках периферической крови (РВМС) и используют фармакокинетику соединения 1 в РВМС. Безопасность. Неблагоприятные события, жизненные показатели, электрокардиограмму, данные офтальмологического исследования и клинических лабораторных анализов оценивают на безопасность. Статистические методы. Эффективность. Попарные сравнения проводят с использованием точного критерия ранговой суммы Уилкоксона для сравнения группы плацебо (2 пациента, каждый из объединенных групп 1-4) и каждого из 5 уровней доз соединения 1 (6 пациентов для каждого уровня дозы) и между каждой парой среди 5 уровней доз соединения 1. 2 пациентов, которые получают плацебо + 100 мг RTV, лечат как отдельную группу. Значения РНК ВИЧ-1 ниже предела определения (50 копий/мл) вводят как 49 копий/мл. Фармакокинетика. Фармакокинетические параметры соединения 1 в плазме и мононуклеарных клетках периферической крови суммируют, используя описательную статистику. Кроме того, для каждого уровня дозы соединение 1 проводят дисперсионный анализ фармакокинетических параметров (AUC и Cmax) для исследования пропорциональности доз и стабилизированной фармакокинетики. Минимальные уровни соединения 1, измеренные в дни 2, 4, 7, 10 и 11, включают соответствующим образом в данные анализы. Безопасность. Долю пациентов с неблагоприятными событиями суммируют по группе лечения, классу системного органа и предпочтительным образом по вызываемым лечением неблагоприятным событиям, связанным с лечением неблагоприятным событиям, тяжелым неблагоприятным событиям и неблагоприятным событиям, приводящим к прекращению введения исследуемого лекарственного препарата. Неблагоприятные события кодируют, используя Медицинский словарь по регуляторным активностям (MedDRA) версия 8.1. Дополнительные итоговые материалы по неблагоприятным событиям представлены самой высокой степенью даваемой исследователем оценки связи с исследуемым лекарственным препаратом и эффектом на прекращение введения исследуемого препарата. Лабораторные результаты отражают на исходной шкале измерений и в показателях степени токсичности. Итоги изменений относительно исходного уровня в количественных лабораторных тестах подводят при осмотре. Результаты. Эффективность, фармакокинетические и фармакодинамические результаты. Стабилизированные фармакокинетические параметры (среднее [%CV]) и антивирусную активность соединения 1 при введении в виде монотерапии (200 мг два раза в день, 400 мг два раза в день, 800 мг два раза в день или 800 мг один раз в день) или 50 мг один раз в день при совместном введении со 100 мг- Максимальное снижение уровня РНК ВИЧ-1 определяют как максимальное снижение относительно исходного уровня в log10 копий/мл в период от дня 2 до 11. Значения РНК ВИЧ-1 ниже предела количественного определения (50 копий/мл) вводят как 49 копий/мл. 5 уровней доз соединения 1 и группу плацебо + RTV сравнивают с группой плацебо.- р=0,0007 для каждого уровня доз соединения 1 относительно плацебо на основе парных значений р для непрерывных данных по 2-стороннему точному критерию ранговой суммы Уилкоксона. с- р=0,0152 для группы, получающей 800 мг соединения 1 один раз в день относительно уровня доз 800 мг соединения 1 два раза в день и относительно 400 мг соединения 1 два раза в день на основе парных значений р для непрерывных данных, рассчитанных по 2-стороннему точному критерию ранговой суммы Уилкоксона.- Уровень доз 50 мг соединения 1 + RTV один раз в день относительно плацебо + RTV, р=0,0714; относительно 200 мг два раза в день р=0,1797; относительно 400 мг два раза в день р=0,9372; относительно 800 мг один раз в день р=0,0022; относительно 800 мг два раза в день р=0,8182. е- Процент базируется на всех рандомизированных и леченых пациентах.- 12- и 24-часовые фармакокинетические образцы, соответствующие окончанию интервала введения доз (tau),собранные в День 10 (введение доз два раза в день) или 11 (введение доз один раз в день) устанавливают номинальное время 12 и 24 ч соответственно. Монотерапия соединением 1 существенно снижает уровни PHK ВИЧ-1 при всех уровнях доз по сравнению с плацебо (р 0,0007). В течение 10 следующих друг за другом дней введения дозы соединения 1 400 мг два раза в день, 800 мг два раза в день или 50 мг при введении совместно со 100 мг RTV один раз в день приводят в результате к максимальным снижениям уровней РНК ВИЧ-1 относительно исходного уровня -1,940,52, -1,910,60 и -1,990,38 log10 копий/мл (среднееSD (стандартное отклонение соответственно. Через 10 дней монотерапии соединением 1 ни у одного пациента не появляются мутации интегразы ВИЧ-1, которые соответствуют мутациям устойчивости к соединению 1, наблюдаемым в экспериментах по селекции in vitro, или мутациям, которые появляются при селекции на фоне других экспериментальных ингибиторов интегразы. Соединение 1 не проявляет пропорциональных дозе увеличений в фармакокинетике с повышающимися дозами (200, 400 и 800 мг два раза в день) и не демонстрирует дозозависимой аутоиндукции метаболизма. Совместное введение соединения 1 в дозе 50 мг + 100 мг RTV один раз в день приводит в результате общему ингибированию CYP3A-опосредованного метаболизма и высоким системным воздействиям, в особенности вследствие высоких концентраций. Фармакокинетические результаты в РВМС согласуются с фармакокинетическими данными в плазме. Связь воздействия соединения 1 - ответа идентифицируют с использованием значений Ctau соединения 1, которое вполне соответствует простой модели Emax с ЕС 50 14,4 нг/мл и снижению Emax 2,32 log10 копий/мл относительно исходного уровня. Предполагаемый ингибирующий коэффициент соединения 1, рассчитанный как полученное среднее Ctau, деленное на скорректированное связывание белка IC50 in vitro 7,17 нг/мл, составляет 5,9, 6,7 и 18,8 при уровнях доз 400 мг два раза в день, 800 мг два раза в день и 50 мг + RTV один раз в день соответственно. Минимальные концентрации соединения 1 при данных дозах также превышают скорректированное на связывание белка IC95 in vitro 44,9 нг/мл (100 нМ) для всего интервала дозирования. Результаты по безопасности. Вызванные лечением неблагоприятные события испытывает большинство пациентов, но головная боль и диарея являются единственными неблагоприятными событиями, описанными больше чем у 1 пациента в группе. Вероятность вызванных лечением неблагоприятных событий у пациентов, которые получают соединение 1, близка или ниже, чем вероятность в группах, получающих плацебо, и классы неблагоприятных событий подобны. Никакие неблагоприятные события, которые автор считает связанными с исследуемым лекарственным средством, не испытывают больше чем 2 пациента в группе, и только 3 вызванных лечением неблагоприятных события преимущественным образом имеют место у 2 пациентов в группе: диарея (плацебо), тошнота (плацебо и 200 мг соединения 1 два раза в день) и усталость (200 мг соединения 1 два раза в день). Все 40 пациентов, которые получают исследуемое лекарственное средство, завершают исследование. Отсутствуют нарушения доз, прекращения или серьезные неблагоприятные события. Пять пациентов имеют вызванные лечением лабораторные патологии степени 3 или 4: 2 пациента в группе плацебо и по 1 пациенту в каждой из следующих групп - плацебо + RTV один раз в день, 400 мг соединения 1 два раза в день и 50 мг соединения 1 + RTV один раз в день. Одну из лабораторных патологий степени 3 в группе плацебо, высокий уровень триглицеридов, которую устраняют без лечения, авторы рассматривают как неблагоприятное событие, которое не связано с исследуемым лекарственным средством. 2 пациента, леченных соединением 1, которые имеют лабораторные патологии степени 3 (повышенный не на голодный желудок уровень триглицеридов или повышенный уровень сывороточной амилазы), также имеют патологические значения на исходном уровне. В процессе исследования не происходит никаких клинически значимых изменений в результатах анализа крови и мочи, жизненных показателях, массе тела или электрокардиограмме и глазных исследованиях. Выводы. Эффективность. Введение соединения 1 в дозах 200, 400 или 800 мг два раза в день; 800 мг один раз в день или 50 мг+ 100 мг RTV один раз в день не подвергшихся или подвергшихся воздействию антивирусных лекарственных средств пациентов, инфицированных ВИЧ-1, в течение 10 следующих друг за другом дней в виде монотерапии существенно снижает уровень РНК ВИЧ-1 по сравнению с плацебо на всех уровнях доз. Дозы соединения 1 400 мг два раза в день, 800 мг два раза в день и 50 мг + 100 мг RTV один раз в день приводят в результате к среднему снижению относительно исходного уровня -1,94, -1,91 и -1,99 log10 копий/мл соответственно. В гене интегразы какого-либо пациента не определяют никакие мутации устойчивости к соединению 1 до дня 21. Фармакокинетика/фармакодинамика. Соединение 1 проявляет фармакокинетические свойства, поддерживающие дозирование два раза в день в виде монотерапии или дозирование один раз в день в сочетании с низкой дозой (100 мг) RTV. Связь воздействия соединения 1 - ответа идентифицируют с использованием значений Ctau соединения 1,которое вполне соответствует простой модели Emax. Предполагаемый ингибирующий коэффициент соединения 1, рассчитанный с использованием скорректированного на связывание белка IC50 in vitro 7,17 нг/мл, составляет 5,9, 6,7 и 18,8 при уровнях доз 400 мг два раза в день, 800 мг два раза в день и 50 мг +RTV один раз в день соответственно. Минимальные концентрации соединения 1 при данных дозах также превышают скорректированное на связывание белка IC95 in vitro 44,9 нг/мл (100 нМ) для всего интервала дозирования. Безопасность. Соединение 1, как правило, хорошо переносится при всех уровнях дозы без нарушений доз, прекращений или серьезных неблагоприятных событий. Большинство неблагоприятных событий являются слабыми и устраняются с помощью лечения. Наиболее распространенным вызываемым лечением неблагоприятным событием является головная боль и наиболее распространенным связанным с лечением неблагоприятным событием является тошнота. Классы, частота и тяжесть неблагоприятных событий и лабораторных патологий близки между группами, получающими активный препарат и плацебо. Пример 3. Эффекты доз ритонавира на фармакокинетику. Соединения 1. Оценивают эффекты интервала доз ритонавира (RTV) (20, 50, 100 и 200 мг один раз в день) на фармакокинетику соединения 1. Оценивают также эффекты интервала доз RTV (20, 50, 100 и 200 мг один раз в день) на активность печеночного цитохрома Р 450 3 А (CYP3A), используя субстрат CYP3 А. Кроме того, оценивают безопасность и переносимость интервала доз RTV в комбинации с соединением 1. Способы. Проводят рандомизированное, с открытыми этикетками, одноцентровое, с использованием множества доз исследование фазы 1 на двух группах (24 пациента (16 поддающихся оценке) в двух группах; 12(8 поддающихся оценке) в каждой группе) с приблизительно равным распределением пациентов - здоровых мужчин и небеременных нелактирующих женщин в возрасте от 18 до 45 лет включительно. Подходящими пациентами являются мужчины и небеременные, нелактирующие женщины с коэффициентом массы тела (BMI) 19BMI 30, без существенной истории болезни и с хорошим общим состоянием здоровья, как авторы определяют при отборочной оценке, проводимой не больше чем за 28 дней до введения запланированной первой дозы. Предполагаемый клиренс креатинина по КокрофтуГаульту (с использованием действительной массы тела) должен составлять 80 мл/мин. Используют следующие исследуемые варианты лечения соединением 1/RTV. Вариант лечения А: соединение 1, 1 таблетка 125 мг и RTV 20 мг (80 мг/мл раствора, разведенного для получения дозы 20 мг) QD (оба лекарственных препарата в AM). Вариант лечения В: соединение 1, 1 таблетка 125 мг и RTV 50 мг (80 мг/мл раствора, разведенного для получения дозы 50 мг) QD (оба лекарственных препарата в AM). Вариант лечения С: соединение 1, 1 таблетка 125 мг и RTV 100 мг (80 мг/мл раствора, разведен- 15018544 ного для получения дозы 100 мг) QD (оба лекарственных препарата в AM). Вариант лечения D: соединение 1, 1 таблетка 125 мг и RTV 200 мг (80 мг/мл раствора, разведенного для получения дозы 200 мг) QD (оба лекарственных препарата в AM). В каждом варианте лечения сначала вводят RTV с последующим немедленным введением соединения 1. Медленное внутривенное введение мидазолама (MDZ; 1 мг в течение 1 мин) в качестве зонда активности CYP3A проводят каждому пациенту в 14:00 в День 1 и через 6 ч после введение дозы соединения 1/RTV в Дни 11 и 21. После процедур отбора и оценок исходного уровня подходящих пациентов рандомизированно распределяют в одну из двух групп лечения, как описано ниже Все дозы соединения 1/RTV вводят сразу после завершения приема пищи до полудня с 240 мл воды. Серийные образцы крови для анализа концентраций соединения 1 и RTV в плазме собирают в дни 11 и 21 в следующие точки времени после введения дозы соединения 1/RTV: 0 (перед введением дозы), 0,5,1, 1,5, 2, 3, 3,5, 4, 4,5, 5, 5,5, 6, 8, 10, 12, 14, 16, 18 и 24 ч после введения дозы. Серийные образцы крови для анализа концентраций MDZ в плазме собирают в Дни 1, 11 и 21 в следующие точки времени после введение дозы MDZ: 0 (перед введением дозы), 5, 10, 15, 30 мин и 1, 2, 4, 6, 8, 10, 12 и 18 после введенияMDZ. Оценивают фармакокинетические параметры соединения 1, RTV и MDZ. Оценку ЭКГ (электрокардиограммы) проводят при отборе. Клинические лабораторные тесты, психические исследования и жизненные показатели (температуру, кровяное давление, частоту сердечных сокращений и частоту дыхания) проводят при отборе, на исходном уровне и в Дни 10 и 20. Жизненные показатели (температуру, кровяное давление, частоту сердечных сокращений и частоту дыхания) определяют также в Дни 1, 11 и 21 в 0 ч (перед введением дозы мидазолама) и через 0,5, 1,0, 1,5 и 2,0 ч после введения дозы мидазолама. Тестируемый продукт, доза и способ введения. 1. Соединение 1, 1 таблетка 125 мг и RTV 20 мг QD (в AM). 2. Соединение 1, 1 таблетка 125 мг и RTV 50 мг QD (в AM). 3. Соединение 1, 1 таблетка 125 мг и RTV 200 мг QD (в AM). Все дозы соединения 1/RTV вводят сразу после завершения приема стандартизированной пищи. Эталонное лечение, доза и способ введения. Соединение 1, 1 таблетка 125 мг и RTV 100 мг QD (в AM). Все дозы соединения 1/RTV вводят сразу после завершения приема стандартизированной пищи. Критерии оценки. Безопасность определяют на основании оценки клинических лабораторных тестов, ЭКГ, периодических психических исследований, включая жизненные показатели в различных точках времени во время исследования и по документации неблагоприятных событий. Рассчитывают следующие фармакокинетические параметры в плазме: для соединения 1 и RTV:Cmax, Tmax, Clast, Tlast, Ctau, Z, AUCtau, T1/2, CL/F и VZ/F. Для MDZ: AUC0-last, AUCinf, % AUCexp, Clast, Tlast, Z, T1/2, CL и VZ. Статистические методы. Данные по безопасности и фармакокинетическим параметрам для соединения 1, RTV и MDZ суммируют по пациентам и уровню дозы RTV, используя описательную статистику. Подбирают модели активности и/или модели ANOVA соответственно, используя фармакокинетические параметры соединения 1 (AUC, Cmax и Ctau), полученные во всех вариантах лечения. Наклон кривой математического ожидания определяют вместе с соответствующим 90% CI. Данное исследование проводят в соответствии с руководством по Современной клинической практике (GCP). дозы AU + RTV отличаются от MDZ в виде монотерапии (р 0,05) р 0,05 относительно 20 мг, p=ns для каждой из других Таблица 3 Средние параметры соединения 1 (CV%)IQ и количество раз IC95 основаны на IC50 и IC95 с поправкой на связывание белка в РВМС 1RTV 50, 100 и 200 мг отличаются от 20 мг для всех параметров PK 2 р 0,05 относительно 50 мг Воздействия RTV непропорциональны дозе, очень низкие уровни воздействия при концентрациях 20 мг с BLQ ( 0,5 нг/мл) к 16 ч. У ряда пациентов - данные по Т 1/2 и клиренсу MDZ предполагают дозозависимое первое прохождение RTV. Более высокие CV% при дозах 100 мг. Пример 4. Совместное введение эмтрицитабина/тенофовира дисопроксила. Фумарат и соединение 1, усиленное ритонавиром. Введение один раз в день соединения 1 с низкой дозой ритонавира приводит в результате к ингибированию метаболизма в дополнение к заметному усилению воздействия (в 10-16 раз). Кроме того, усиленное введением один раз в день ритонавира соединение 1 достигает высоких минимальных концентраций, приводя в результате к показателю ингибирования (с использованием IC50 с поправкой на связывание белка), который в 3 раза больше по сравнению с неусиленными схемами дозирования соединения 1,тем самым обеспечивая определенную простительность в отношении поздно принятых или пропущенных доз, связанную с удобной схемой дозирования для пациентов. В качестве нового агента из нового класса терапевтических средств с сильной кратковременной активностью благоприятным профилем безопасности и простой схемой дозирования один раз в день для поддержания соблюдения схемы усиленное ритонавиром соединение 1 предлагает огромный потенциал в плане лечения ВИЧ, включая пациентов, которые подверглись воздействию лекарственных средств многих классов. Комбинация с фиксированной дозой эмтрицитабина/тенофовира дисопроксила фумарата(FTC/TDF) представляет собой простую высокоэффективную комбинацию NRTI с высокобезопасным профилем по сравнению с аналогами тимидина и рекомендуется Министерством здравоохранения и социальных служб США в качестве предпочтительной нуклеозидной или нуклеотидной основы для лечения не подвергавшихся и подвергавшихся лечению взрослых и престарелых пациентов с ВИЧ. Настоящее исследование проводят отчасти с целью оценки потенциальной возможности для клинически соответствующего взаимодействия типа лекарственное средство-лекарственное средство при их совместном введении. Использование здоровых участников в данном исследовании устраняет потенциальные смешанные факторы, связанные с основной схемой, и позволяет избежать краткосрочных изменений в схеме лечения у пациентов с ВИЧ с целью оценки фармакокинетического (PK) взаимодействия. Таким образом, исследуют потенциальную возможность клинически соответствующих взаимодей- 17018544 ствий типа лекарственное средство-лекарственное средство между эмтрицитабин/тенофовир дисопроксил фумаратом (FTC/TDF) и ингибитором интегразы ВИЧ, усиленным ритонавиром соединением 1 (соединение 1/RTV). Здоровым взрослым участникам вводят FTC/TDF (200 мг/300 мг; один раз в день) в течение 7 дней с последующей рандомизацией порядка введения соединения 1/RTV (50 мг/100 мг; один раз в день) и соединения 1/RTV и FTC/TDF перекрывающимся образом в условиях после принятия пищи в течение 10 дней. Заборы крови для фармакокинетических анализов (PK) проводят в дни 7, 17 и 27. Отсутствие изменения PK для FTC, тенофовира и соединения 1 определяют как доверительные интервалы 90% (CI) для соотношения геометрических средних (GMR; совместное введение:монотерапия) от 70 до 143% для основных параметров PK: максимальной наблюдаемой концентрации в плазме (Cmax), площади под кривой зависимости концентрации в плазме от времени в течение интервала дозирования (AUCtau) и минимальной концентрации (Ctau). Двадцать четыре из 26 включенных пациентов завершают исследование без серьезных неблагоприятных событий (серьезные AEs) или прерываний эксперимента вследствие AEs. PK FTC, TFV5 и соединения 1 не оказывается воздействий во время совместного введения, причем все три основных параметра соответствуют протоколу определения эквивалентности, а также более строгим критериям биоэквивалентости (90% CI: 80-125%). Параметры РК FTC и TFV сравнимы со статистическими значениями. Клинически соответствующее взаимодействие типа лекарственное средство-лекарственное средство между FTC/TDF и соединением 1/RTV при их совместном введении отсутствует. Пример 5. Отсутствие клинически соответствующего взаимодействия типа лекарственное средстволекарственное средство между усиленным ритонавиром-ингибитором интегразы соединением 1/RTV и зидовудином (ZDV). Зидовудин представляет собой NRTI, используемый пациентами с ВИЧ. Потенциальное взаимодействие между зидовудином и соединением 1/RTV определяют в рандомизированном исследовании. Оценивают, имеется ли воздействие на фармакокинетику зидовудина или соединения 1 после совместного введения зидовудина и соединения 1/RTV по сравнению с введением в виде монотерапии. Кроме того,оценивают безопасность совместного введения зидовудина и соединение 1/RTV. Как описано ниже, клинически соответствующее фармакокинетическое взаимодействие типа лекарственное средство-лекарственное средство между зидовудином и соединением 1/RTV отсутствует. Совместное введение зидовудина и соединения 1/RTV является безопасным и хорошо переносится. Соединение 1 демонстрирует полупериод существования, поддерживаемый дозированием один раз в день, который продолжается в течение 48 ч после введения дозы. Исследуемые лекарственные средства (соединение 1/RTV 200/100 мг QD, ZDV 300 мг BID (два раза в день вводят с пищей (400 ккал, 13 г жира). Образцы для фармакокинетических анализов (PK) отбирают через 12 (ZDV) или 24 ч (соединение 1/RTV), 48-часовой РК профиль соединения 1 определяют через 27 дней дозирования. Уровни ZDV, G-ZDV и соединения 1 в плазме определяют, используя утвержденные ЖХ/МС/МС (жидкостная хроматография/тандемная масс-спектрометрия) анализы. Параметры PK оценивают с использованием программы WinNonlin(tm) 5.0.1 (Pharsight Corporation,Mountain View, CA, USA). Эквивалентные пределы для 90% доверительного интервала (CI) устанавливают при 70-143% (совместное введение:монотерапия) для соотношения геометрического среднего(GMR) AUCtau, Cmax и Ctau (только соединение 1). Демографические показатели включают 28 участников, и 24 участника завершают исследование (12 мужчин, 12 женщин; средний возраст: 31 год (интервал: 20-42 года); средняя масса тела: 70,2 кг (интервал: 50,9-101 кг; этническая принадлежность: 20 латиноамериканцев, 4 - европеоидной расы). Безопасность. Не происходит неблагоприятных событий степени 3/4 (AEs) или серьезных неблагоприятных событий. Имеется четыре прерывания исследования: беременность (1), отзыв согласия (1), рвота (1; группаZDV + соединение 1/RTV), вздутие живота (1; группа ZDV). Соединение 1/RTV и ZDV при введении в виде монотерапии и в комбинации, как правило, хорошо переносятся. Наиболее частыми AEs во всех группах лечения являются головная боль и тошнота. Все AEs являются легкими до умеренных и устраняются при лечении. Фармакокинетические результаты: 90% Cl AUCtau, Cmax, Ctau (только для соединения 1) ZDV, G-ZDV и соединения 1 находятся в предварительно заданных эквивалентных пределах PK, причем PK ZDV и GZDV близки статистическим значениям. Примеры, иллюстрирующие эффект пищи. Эффект пищи на фармакокинетические свойства соединения 1 и на терапевтическую эффективность соединения 1 иллюстрируют следующими примерами, которые не предусмотрены как ограничивающие каким-либо образом. Пример 6. Для клинических исследований соединения 1 получают унифицированные лекарственные формы соединения 1 в виде таблеток по 50 и 200 мг. Соединение 1 существует в форме I, форме II и форме III. Форму III используют в конечных препаратах, но форму II и форму III используют также во время ис- 18018544 следований препарата. Получение таблеток по 200 мг соединения 1. Конечная композиция таблеток 200 мг показана в табл. 5. Таблица 5 Очищенную воду удаляют при обработке. Соединение 1 сначала микронизируют в струйной мельнице. Микронизированное соединение смешивают с D-маннитом (Japanese Pharmacopoeia, JP), кросповидоном (Japanese Pharmaceutical Excipients,JPE) и светлой безводной кремниевой кислотой (JP) в полиэтиленовой (РЕ) емкости и затем три раза пропускают через сито 500 мкм. Гидроксипропилметилцеллюлозу (НРМС) 2910 (3 мм 2/с) (JP) отдельно растворяют в очищенной воде путем перемешивания и добавляют лаурилсульфат натрия (JP) и растворяют. Смесь D-маннита/кросповидона/светлой безводной кремниевой кислоты/соединения 1 помещают в гранулятор с псевдоожиженным слоем и гранулируют, используя раствор НРМС/лаурилсульфата натрия. После грануляции грануляты сушат в том же самом грануляторе. Высушенные гранулы пропускают через сито 500 мкм. Затем просеянные гранулы смешивают с натрий кроскармеллозой (JPE) в РЕ емкости и добавляют в емкость стеарат магния (JP). Гранулы прессуют в таблетки, используя ротационный таблеточный пресс. Двадцать таблеток упаковывают в стеклянный флакон с поглотителем влаги и прокладочным материалом (пластина из РЕ) и закрывают полипропиленовой (РР) навинчивающейся крышкой. Получение таблеток по 50 мг соединения 1. Конечная композиция таблетки 50 мг показана в табл. 6. Таблица 6 Очищенную воду удаляют при обработке. Размер и масса таблеток по 50 мг такие же, как у таблеток по 200 мг. Для облегчения процесса изготовления состав таблеток по 50 мг получают, используя просеянные гранулы соединения 1, приготовленные, как описано выше, в качестве исходного материала и разбавляя гранулы наполнителями, пригодными для прямого прессования. D-маннит и микрокристаллическую целлюлозу выбирают в качестве разбавляющих наполнителей вследствие совместимости с соединением 1 и свойствами прессования и распада таблеток. В табл. 7 показаны композиции таблеток с использованием просеянных гранул соединения 1 в качестве исходного материала. Таблица 7(JP) и микрокристаллической целлюлозой (JP) в РЕ емкости с последующим добавлением в емкость стеарата магния (JP). Затем гранулы прессуют в таблетки, используя ротационный таблеточный пресс. Двадцать таблеток упаковывают в стеклянный флакон с поглотителем влаги и прокладочным материалом (пластина из РЕ) и закрывают полипропиленовой (РР) навинчивающейся крышкой. Пример 7. Эффект пищи на фармакокинетические свойства соединения 1 выявляют в одностороннем слепом,рандомизированном расширенном исследовании приема однократной пероральной дозы с контролем плацебо, проводимом на 32 здоровых добровольных участниках эксперимента мужского пола японцах. Для отбора участников для исследования используют следующие критерии:(2) индекс массы тела (BMI) от 18,5 до 25,0, где BMI = [масса тела (кг)/рост (м)]2; и(3) участники, которые дали письменное информированное согласие перед тем, как принять участие в эксперименте. В качестве части более крупного исследования восемь участников (6 получающих активный препарат и 2 - плацебо) получают дозу 400 мг в состоянии натощак и после принятия пищи. Субъекты из группы, получающей 400 мг натощак, получают дополнительную дозу 400 мг с завтраком после периода выведения (как правило, минимум из десяти дней после исходного введения). Интервал из десяти дней между двумя дозами считают подходящим для исключения каких-либо остаточных эффектов в организме участника. Продолжительность лечения, доза, способ введения и продукт, вводимый в качестве компонента эффекта пищи в более крупном исследовании, показаны в табл. 8. Таблица 8 Участников принимают в больничное учреждение во второй половине дня перед введением ("День-1"). Соединение 1 или плацебо вводят на следующий день после госпитализации ("День 1"). Пациентов выписывают на следующий день после введения ("День 2"). Таким образом, участников госпитализируют в целом на три дня. Последующую оценку безопасности проводят через 6-8 дней после введения("Дни 7-9"). Соединение 1 или плацебо вводят перорально с 200 мл воды. Дозы вводят в близкое время каждому участнику в каждый из периодов лечения. Все участники воздерживаются от принятия пищи и жидкостей с послеобеденного времени дня перед введением дозы (День -1) до завтрака в День 1 (для участников, получающих соединение 1 или плацебо в состоянии после принятия пищи) или времени ленча в День 1 (для участников в состоянии натощак). Когда участникам вводят соединение 1 в состоянии после приема пищи, они получают завтрак приблизительно за 30 мин до введения дозы. Завтрак состоит из следующего: 160 мл яблочного сока вареное яйцо (50 г) булочка (105 г) 8 г масла 14 г клубничного джема 1 Общее содержание энергии: 574,6 Ккал; общее содержание жира: 21,4 г (33% от общего числа калорий); общее содержание белка: 17,5 г (12% от общего числа калорий); общее содержание углеводов: 79,0 г (55% от общего числа калорий). Образцы крови для фармакокинетического анализа берут за 1,5 ч до введения дозы и в следующие точки времени после введения дозы: 0,25, 0,5, 1, 2, 3, 4, 6, 8, 12 и 24 ч после введения дозы. Для соединения 1 в каждой исследуемой группе (в состоянии после приема пищи и натощак) рассчитывают следующие фармакокинетические параметры:tmax - время максимальной наблюдаемой концентрации в плазме;Cmax - максимальная наблюдаемая концентрация в плазме;AUC0-tz - площадь под кривой зависимости концентрации в плазме от времени (AUC) от времени нуль до последней количественно определяемой концентрации (AUC(0-tz;AUC0-inf - AUC от времени 0 до бесконечности. Концентрации в плазме соединения 1 определяют посредством следующего анализа. Образцы плазмы выделены у здоровых участников эксперимента, которым вводят соединение 1. Образцы плазмы экстрагируют путем твердофазной экстракции с использованием устройства Empore Disk Plate (C8SD) и затем измеряют с помощью высокоэффективной жидкостной хроматографии/тандемной массспектрометрии (ЖХ/МС/МС) (разделительный модуль ВЭЖХ модель 2795 фирмы Waters; масс- 20018544 спектрометр модель API4000 фирмы MDS SCIEX). Ионизацию и детекцию осуществляют с помощью электроспрей-ионизации и детекции положительного иона с множественным мониторированием реакции соответственно. Данный аналитический метод обоснован в плане избирательности, линейности, пониженного порога количественного определения (LLOQ), точности и достоверности анализов внутри и между групп, стабильности стандартных растворов, стабильности матрицы, постпрепаративной стабильности, целостности выделения и разведения, его считают достаточно надежным способом определения соединения 1 в интервале концентраций от 1 до 1000 нг/мл при использовании 50 мкг плазмы человека. Каждый из образцов плазмы по 50 мкл вводят с 10 мл 90% ацетонитрила и 20 моль/л буфера на основе формиата аммония-муравьиной кислоты (рН 3,0)/ацетонитрил (10:90, об./об.), добавляют 10 мл каждого из внутренних стандартных растворов. К данным образцам добавляют 200 мкл 0,1% муравьиной кислоты в 10% ацетонитрила. Данные растворы затем перемешивают в течение 10 с и центрифугируют при 10000 об/мин в течение 5 мин при 4 С. Аликвоту 250 мкл супернатанта вводят в устройство Empore Disk Plate (C8SD) (кондиционируют 150 мкл ацетонитрила и 200 мкл 0,1% муравьиной кислоты в данном порядке). Планшет дважды промывают 200 мкл 0,1% муравьиной кислоты в 20% ацетонитриле и дважды элюируют 100 мкл 0,1% муравьиной кислоты в 80% ацетонитриле (всего 200 мкл). К элюатам добавляют 200 мкл 0,1% муравьиной кислоты и перемешивают. Затем 10 мкл каждого раствора вводят в систему ЖХ/МС/МС и анализируют. Соотношение геометрических средних (после приема пищи/натощак) с доверительными интервалами 90% оценивают по Cmax и AUC0-inf после перорального введения 400 мг соединения 1 натощак и после приема пищи. Средняя концентрация через период времени после перорального введения 400 мг соединения 1 в условиях натощак и после приема пищи показана на фиг. 2. Средние результаты фармакокинетических параметров, AUC0-inf (нгч/мл), Cmax (нг/мл), t1/2z (ч) и tmax (ч) соединения 1 в условиях натощак и после приема пищи суммированы в табл. 9 и сведены в табл. 10. Таблица 9 Доза: 400 мг,n=6 участников/каждую группу. На фиг. 2, в табл. 9 и 10 показано, что, когда соединение 1 вводят в условиях после приема пищи,Cmax и AUC0-inf неизмененного лекарственного препарата в 3,30 и 2,69 раза выше соответственно по сравнению с данными результатами в условиях натощак. Данные результаты демонстрируют, что биодоступность и всасывание соединения 1 повышаются в присутствии пищи. Наблюдаемые повышения фармакокинетических параметров, когда соединение 1 вводят с пищей,показывают, что соединение 1 легче всасывается с пищей, например, после приема пищи. Таким образом, введение соединения 1 с пищей приводит в результате к повышению биодоступности лекарственного препарата по сравнению с введением лекарственного препарата в условиях натощак. Кроме того, соединение 1 безопасно и хорошо переносится без тяжелых неблагоприятных событий. Все неблагоприятные события являются легкими. Не отмечают никаких клинически значимых изменений электрокардиограммы (ЭКГ). Все ссылки, включая публикации, патентные заявки и патенты, приведенные в данном контексте,тем самым включены в виде ссылки во всей своей полноте. Использование терминов "какой-либо" и "определенный" и подобных ссылок в контексте описания изобретения (включая последующую формулу изобретения) следует истолковывать как покрывающие формы как единственного, так и множественного числа, пока в данном контексте не указано иначе или это явно не противоречит контексту. Термины "содержащий", "имеющий", "включающий" и "содержащий в себе" следует истолковывать как неограничивающие термины (т.е. означающие "включающие, но без ограничения перечисленным"), пока не указано иначе. Перечисление областей значений в данном контексте предназначено только для того, чтобы служить способом условного обозначения индивидуальной ссылки на каждое отдельное значение, входящее в интервал, пока в данном контексте не указано иначе, и каждое отдельное значение включено в описание, как если бы оно было индивидуально перечислено в данном контексте. Все способы, описанные в данном контексте, можно осуществить в любом подходящем порядке, пока в данном контексте не указано иначе или пока это явно не противоречит контексту. Использование любого или всех примеров или иллюстративная формулировка (например, "такой как"), представленная в данном контексте, предназначена только для лучшего освещения изобретения и не предусматривает ограничения объема изобретения,пока не заявлено иначе. Никакие формулировки в описании не следует истолковывать как указывающие на какой-либо незаявленный элемент как важный для практической реализации изобретения. Варианты осуществления в описании представляют собой иллюстрацию вариантов осуществления изобретения и не должны истолковываться как ограничивающие объем изобретения. Компетентный специалист понимает, что многие другие варианты осуществления охватываются заявленным изобретением и что следует рассматривать описание и примеры только как иллюстративные, при этом истинный объем и сущность изобретения показаны в следующей формуле изобретения. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Применение ритонавира или его фармацевтически приемлемой соли для изготовления лекарственного средства для улучшения фармакокинетики ингибитора интегразы вируса иммунодефицита человека (ВИЧ), представленного формулой или его фармацевтически приемлемой соли в организме пациента, включающее пероральное введение ритонавира или его фармацевтически приемлемой соли один раз в день в пересчете на дозу ритонавира от 20 до 200 мг и пероральное введение указанного ингибитора интегразы или его фармацевтически приемлемой соли один раз в день в пересчете на дозу ингибитора от 20 до 500 мг. 2. Применение по п.1, в котором улучшение фармакокинетики представляет собой повышение уровня ингибитора интегразы ВИЧ в крови пациента. 3. Применение ритонавира или его фармацевтически приемлемой соли для изготовления лекарственного средства для повышения биодоступности ингибитора интегразы вируса иммунодефицита человека (ВИЧ), представленного формулой или его фармацевтически приемлемой соли в организме пациента, включающее пероральное введение ритонавира или его фармацевтически приемлемой соли один раз в день в пересчете на дозу ритонавира от 20 до 200 мг и пероральное введение указанного ингибитора интегразы или его фармацевтически приемлемой соли один раз в день в пересчете на дозу ингибитора от 20 до 500 мг. 4. Применение ритонавира или его фармацевтически приемлемой соли для изготовления лекарственного средства для повышения всасываемости ингибитора интегразы вируса иммунодефицита человека (ВИЧ), представленного формулой или его фармацевтически приемлемой соли в организме пациента, включающее пероральное введение ритонавира или его фармацевтически приемлемой соли один раз в день в пересчете на дозу ритонавира от 20 до 200 мг и пероральное введение указанного ингибитора интегразы или его фармацевтически приемлемой соли один раз в день в пересчете на дозу ингибитора от 20 до 500 мг. 5. Применение ритонавира или его фармацевтически приемлемой соли для изготовления лекарственного средства для ингибирования активности ретровирусной интегразы в организме пациента, включающее пероральное введение один раз в день указанного лекарственного средства, в котором ритонавир или его фармацевтически приемлемая соль содержится в пересчете на дозу ритонавира от 20 до 200 мг,вместе с ингибитором интегразы вируса иммунодефицита человека (ВИЧ), представленного формулой или его фармацевтически приемлемой соли в пересчете на дозу ингибитора от 20 до 500 мг. 6. Применение ритонавира или его фармацевтически приемлемой соли для изготовления лекарственного средства для лечения или профилактики ретровирусной инфекции в организме пациента, включающее пероральное введение один раз в день указанного лекарственного средства, в котором ритонавир или его фармацевтически приемлемая соль содержится в пересчете на дозу ритонавира от 20 до 200 мг,вместе с ингибитором интегразы вируса иммунодефицита человека (ВИЧ), представленного формулой или его фармацевтически приемлемой соли в пересчете на дозу ингибитора от 20 до 500 мг. 7. Применение по любому из пп.1-6, в котором пациенту дополнительно вводят по меньшей мере один агент, выбранный из группы, состоящей из ставудина, эмтрицитабина, тенофовира, абакавира, ламивудина, зидовудина, диданозина, залцитабина, фосфазида, эфавиренца, невирапина, делавирдина, типранавира, саквинавира, индинавира, атазанавира, нелфинавира, ампренавира, сампренавира, фосампренавира, лопинавира, ритонавира, энфувиртида, фозивудина тидоксила, аловудина, декселвуцитабина,априцитабина, амдоксовира, элвуцитабина (АСН 126443), рацивира (рацемического FTC, PSI-5004), MIV210, KP-1461, фосалвудина тидоксила (HDP 99.0003), AVX756, диоксолана тимина (DOT), TMC-254072,INK-20, 4'-Ed4T, этравирина (ТМС-125), каправирина, рилпивирина (ТМС-278), GW-695634, каланолидаA, BILR 355 BS, VRX 840773 и их фармацевтически приемлемых солей. 8. Применение по любому из пп.1-7, в котором лекарственное средство предназначено для введения пациенту с пищей. 9. Применение по любому из пп.1-7, в котором лекарственное средство выполнено в унифицированной лекарственной форме в виде таблетки. 10. Применение по любому из пп.1-9, в котором ингибитор интегразы и ритонавир или его фармацевтически приемлемую соль вводят пациенту в виде одной композиции. 11. Применение фармацевтической композиции, включающей ритонавир или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель, для улучшения фармакокинетики ингибитора интегразы ВИЧ, представленного формулой или его фармацевтически приемлемой соли в организме пациента, включающее пероральное введение ритонавира или его фармацевтически приемлемой соли один раз в день в пересчете на дозу ритонавира от 20 до 200 мг и пероральное введение указанного ингибитора интегразы или его фармацевтически приемлемой соли один раз в день в пересчете на дозу ингибитора от 20 до 500 мг. 12. Применение фармацевтической композиции, включающей ритонавир или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель, для повышения биодоступности ингибитора интегразы вируса иммунодефицита человека (ВИЧ), представленного формулой или его фармацевтически приемлемой соли в организме пациента, включающее пероральное введение ритонавира или его фармацевтически приемлемой соли один раз в день в пересчете на дозу ритонавира от 20 до 200 мг и пероральное введение указанного ингибитора интегразы или его фармацевтически приемлемой соли один раз в день в пересчете на дозу ингибитора от 20 до 500 мг. 13. Применение фармацевтической композиции, включающей ритонавир или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель, для повышения всасываемости ингибитора интегразы вируса иммунодефицита человека (ВИЧ), представленного формулой или его фармацевтически приемлемой соли в организме пациента, включающее пероральное введение ритонавира или его фармацевтически приемлемой соли один раз в день в пересчете на дозу ритонавира от 20 до 200 мг и пероральное введение указанного ингибитора интегразы или его фармацевтически приемлемой соли один раз в день в пересчете на дозу ингибитора от 20 до 500 мг. 14. Применение фармацевтической композиции, включающей ритонавир или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель, для ингибирования активности ретровирусной интегразы в организме пациента, включающее пероральное введение один раз в день фармацевтической композиции, которая содержит ритонавир или его фармацевтически приемлемую соль в пересчете на дозу ритонавира от 20 до 200 мг, с ингибитором интегразы вируса иммунодефицита человека или его фармацевтически приемлемой соли в пересчете на дозу ингибитора от 20 до 500 мг. 15. Применение фармацевтической композиции, включающей ритонавир или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель, для лечения или профилактики ретровирусной инфекции в организме пациента, включающее пероральное введение один раз в день фармацевтической композиции, которая содержит ритонавир или его фармацевтически приемлемую соль в пересчете на дозу ритонавира от 20 до 200 мг, с ингибитором интегразы вируса иммунодефицита человека или его фармацевтически приемлемой соли в пересчете на дозу ингибитора от 20 до 500 мг. 16. Применение фармацевтической композиции по любому из пп.11-15, включающее введение указанной композиции с пищей.
МПК / Метки
МПК: A61K 31/426, A61K 31/47, A61P 31/18
Метки: способ, ретровирусной, инфекции, лечения
Код ссылки
<a href="https://eas.patents.su/26-18544-sposob-lecheniya-retrovirusnojj-infekcii.html" rel="bookmark" title="База патентов Евразийского Союза">Способ лечения ретровирусной инфекции</a>
Следующий патент: Терапевтические композиции
Случайный патент: Устойчивые коллоиды композита металла с электропроводным полимером и способы их получения и применения












