Соединения и их соли, специфичные к ppar рецепторам и egf рецепторам, и их применение в области медицины
Формула / Реферат
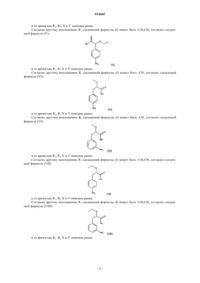
1. Соединения с общей формулой (I)
где R1и R2, которые могут быть одинаковы или различны, выбирают из группы, состоящей из -Н или линейной или разветвленной алкильной группы, содержащей от 1 до 6 атомов углерода, или вместе образуют 5- или 6-членное ароматическое или алифатическое кольцо;
Y выбирают из группы, состоящей из H, COOH, -OR3и -CH(OR3)COOH;
Z выбирают из группы, состоящей из -OR3и -CH(OR3)COOH;
R3 выбирают из фенила, бензила, -CF3 или -CF2CF3, винила, аллила и из линейной или разветвленной алкильной группы, содержащей от 1 до 6 атомов углерода;
причем соединение не является 2-метокси-3-(3'-аминофенил)пропионовой кислотой.
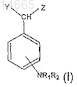
2. Соединения с общей формулой (Ia)
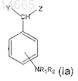
где NR1R2находится в 4-ом положении фенольного кольца;
R1 и R2, которые могут быть одинаковы или различны, выбирают из группы, состоящей из -Н или линейной или разветвленной алкильной группы, содержащей от 1 до 6 атомов углерода, или вместе образуют 5- или 6-членное ароматическое или алифатическое кольцо;
Y и Z, которые могут быть одинаковы или различны, выбирают из группы, состоящей из -Н, -OH, -OR3,
-CH(OR3)COOH, в которой R3выбирают из Н и из линейной или разветвленной алкильной группы, содержащей от 1 до 6 атомов углерода.
3. Соединение по п.1 или 2, где указанное соединение выбирают из группы, включающей
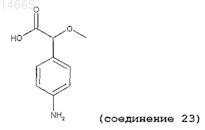
(±)-2-метокси-2-(4'-аминофенил)уксусную кислоту (соединение 23);
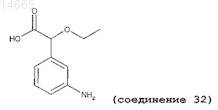
(±)-2-этокси-2-(3'-аминофенил)уксусную кислоту (соединение 32);
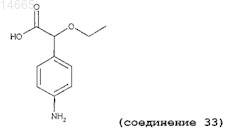
(±)-2-этокси-2-(4'-аминофенил)уксусную кислоту (соединение 33);
(±)-2-метокси-3-(4'-аминофенил)пропионовую кислоту (соединение 34);
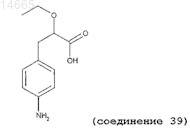
(±)-2-этокси-3-(4'-аминофенил)пропионовую кислоту (соединение 39);
(±)-2-этокси-3-(3'-аминофенил)пропионовую кислоту (соединение 40) и
(±)-2-метокси-2-(3'-аминофенил)пропионовую кислоту (соединение 22).
4. Соединение по любому из предыдущих пунктов, имеющее следующую структуру:
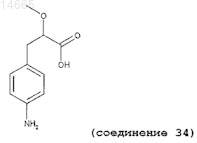
5. Соединение по любому из пп.1-3, имеющее следующую структуру:
6. Соединение по любому из пп.1-3, имеющее следующую структуру:
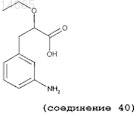
7. Соединение по любому из пп.1-3, имеющее следующую структуру:
8. Соединение по любому из пп.1-3, имеющее следующую структуру:
9. Соединение по любому из пп.1-3, имеющее следующую структуру:
10. Фармацевтическая композиция, включающая в себя одно или более соединений, которые определены по любому из пп.1-9, в качестве активных соединений в комбинации с одним или более фармацевтически приемлемыми носителями или адъювантами.
11. Фармацевтическая композиция по п.10, где соединение представляет собой смесь, в которой один энантиомер присутствует в избытке по отношению к другому в любой пропорции.
12. Способ лечения пациента, страдающего хроническим воспалительным заболеванием или от опухолей, экспрессирующих PPARg- и EGF-рецепторы, включающий введение пациенту фармацевтической композиции по любому одному из пп.10 или 11 или одного или более соединений общей формулы (I)
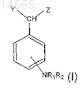
где R1и R2, которые могут быть одинаковы или различны, выбирают из группы, состоящей из -Н или линейной или разветвленной алкильной группы, содержащей от 1 до 6 атомов углерода, или вместе образуют 5- или 6-членное ароматическое или алифатическое кольцо;
Y и Z, которые могут быть одинаковые или различные, выбирают из группы, состоящей из -Н, -OH, COOH, -OR3 и -CH(OR3)COOH;
R3 выбирают из Н, фенила, бензила, -CF3 или -CF2CF3, винила, аллила и из линейной или разветвленной алкильной группы, содержащей от 1 до 6 атомов углерода.
13. Применение одного или более соединений общей формулы (I)
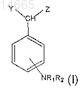
где R1и R2, которые могут быть одинаковы или различны, выбирают из группы, состоящей из -Н или линейной или разветвленной алкильной группы, содержащей от 1 до 6 атомов углерода, или вместе образуют 5- или 6-членное ароматическое или алифатическое кольцо;
Y и Z, которые могут быть одинаковые или различные, выбирают из группы, состоящей из -Н, -OH, COOH, -OR3 и -CH(OR3)COOH;
R3 выбирают из Н, фенила, бензила, -CF3 или -CF2CF3, винила, аллила и из линейной или разветвленной алкильной группы, содержащей от 1 до 6 атомов углерода, в области медицины.
14. Применение по п.13 в лечении хронических воспалительных заболеваний и/или лечении опухолей, экспрессирующих PPARg- и EGF-рецепторы.
15. Применение по п.13 для получения лекарственного средства для лечения хронических воспалительных заболеваний и/или лечения или предотвращения опухолей, экспрессирующих PPARg- и EGF-рецепторы.
16. Применение по любому одному из пп.13-15, где соединение выбирают из группы, включающей
(±)-2-метокси-3-(4'-аминофенил)пропионовую кислоту (соединение 34);
(±)-2-этокси-3-(4'-аминофенил)пропионовую кислоту (соединение 39);
(±)-2-этокси-3-(3'-аминофенил)пропионовую кислоту (соединение 40),
и где лечение является лечением хронического воспалительного заболевания.
17. Применение по любому одному из пп.13-15, где соединение выбирают из группы, включающей
(±)-2-метокси-3-(4'-аминофенил)пропионовую кислоту (соединение 34);
(±)-2-этокси-3-(4'-аминофенил)пропионовую кислоту (соединение 39),
и где лечение является лечением или предотвращением опухолей, экспрессирующих PPARg- и EGF-рецепторы.
18. Способ по п.12 или применение по любому одному из пп.13-17, где хроническим воспалительным заболеванием является болезнь Крона и язвенный ректоколит.
19. Способ по п.12 или применение по любому одному из пп.13-17, где опухоли выбирают из группы, состоящей из опухоли пищевода, желудка, поджелудочной железы, толстой кишки, простаты, молочной железы, матки и придатков, почек и легких.
Текст
(57) Настоящее изобретение относится к соединениям общей формулы (I) в которой R1 и R2, которые могут быть одинаковы или различны, выбирают из группы, включающей в себя -Н или линейную или разветвленную алкильную группу, содержащую от 1 до 6 атомов углерода, или вместе образуют 5- или 6-членное ароматическое или алифатическое кольцо; Y и Z, которые могут быть одинаковы или различны, выбирают из группы, включающей в себя -H, -OH, -COOH, -OR3, -CH(OR3)COOH, в которой R3 выбирают из Н, фенила, бензила, -CF3 или -CF2CF3, винила, аллила и из линейной или разветвленной алкильной группы, содержащей от 1 до 6 атомов углерода. 014665 Область техники, к которой относится изобретение Настоящее изобретение относится к соединениям и их солям, специфичным к PPAR-рецепторам иEGF-рецепторам и их применению в области медицины. Цель изобретения В частности, согласно настоящему изобретению, соединения и их соли могут быть успешно использованы для предотвращения и лечения опухолей, экспрессирующих PPAR-рецепторы (рецепторы,активируемые пероксисомальным пролифератором) и EGF-рецепторы (эпидермальные рецепторы фактора роста), таких как опухоли пищевода, желудка, поджелудочной железы, толстой кишки, простаты,молочной железы, матки и придатков, почек и легких. Кроме того, согласно изобретению соединения и их соли могут быть успешно использованы для лечения хронических воспалительных заболеваний, в частности хронических желудочно-кишечных заболеваний, таких как болезнь Крона и язвенный ректоколит. Уровень техники Рецепторы PPAR являются ядерными рецепторами (группа из 50 факторов транскрипции), которые контролируют экспрессию многих генов, которые важны для регуляции липидного метаболизма,синтеза инсулина, и процессы канцерогенеза и воспаления (Bull A.W., Arch. Pathol. Lab. Med. 2003, 127: 1121-1123; Koeffler H.P., Clin. Cancer Res. 2003, 9: 1-9; Youssef J. et al., J. Biomed. Biotec. 2004, 3: 156166). Существуют различные природные и синтетические агонисты, которые связываются сPPAR-рецепторами и меняют их конформацию, вызывая увеличение активации. Природные и синтетические лиганды описаны в "Ланцете", 2002, 360: 1410-1418. Последние исследования показали, что обработка опухолевых клеток лигандами PPAR-рецепторов вызывает снижение клеточной пролиферации и дифференциации и апоптоз, что предполагает перспективность применения данных соединений для предотвращения канцерогенеза (Osawa E. et al.,Gastroenterology, 2003, 124: 361-367) Другие исследования показали, что лиганды PPAR-рецепторов (например, троглитазон) обладают противовоспалительным действием и ингибируют воспалительный ответ слизистых в моделях IBD на животных (Tanaka T. et al., Cancer Res. 2001, 61: 2424-2428). Кроме того, недавно опубликованы данные о том, что кишечная противовоспалительная активность 5-ASA, "золотого стандарта" лечения IBD, зависит от связывания и последующей активацииPPAR-рецепторов (Rousseaux С. et al., J. Exp. Med. 2005, 201: 1205-1215). Трансмембранный рецептор с тирозинкиназной EGF активностью экспрессируется в высокой степени в активированной форме при различных типах опухолей (Mendelsohn J., Endocr. Relat. Cancer, 2001,8: 3-9; Harari P.M., Endocr. Relat. Cancer, 2004, 11: 689-708). Сверхэкспрессия рецептора также связана с потенциальной способностью опухолевых клеток к метастазированию. В связи с этим было показано, что EGF усиливает миграцию и инвазивность различных клеточных типов, связанных с повреждениями на уровне взаимодействий с внеклеточным матриксом(Brunton et al., Oncogene, 1997, 14: 283-293). В ряде исследований, проведенных с участием как экспериментальных животных, так и людей, установлена эффективность ингибиторов EGF-рецептора в контролировании пролиферации и распространения опухолей (Mendelsohn J., Endocr. Relat. Cancer, 2001, 8: 3-9; Harari P.M., Endocr. Relat. Cancer, 2004,11: 689-708). Нет сомнений, что внутриклеточные сигналы, включенные активацией EGF-рецептора, способствуют росту и выживаемости опухолевых клеток, внося свой вклад в развитие патологии, и что данные сигналы являются важными в ограничении способности опухолевых клеток распространяться и заселять удаленные органы (Mendelsohn J., Endocr. Relat. Cancer, 2001, 8: 3-9; Kari С. et al., Cancer Res. 2003,63: 1-5). Из вышеупомянутого и учитывая, более того, что с биологической точки зрения хронические воспалительные процессы играют роль в канцерогенезе, становится ясно, что существует реальная необходимость в прогрессивном исследовании новых химических объектов, которые по их комплементарному действию на PPAR- и EGF-рецепторы способны оказывать противовоспалительное и противопухолевое действие хемопревентивного, антипролиферативного и антиметастатического типа. Настоящее изобретение предоставляет новый класс соединений, которые подходят для предупреждения и лечения рака и хронического воспаления путем изменения активности специфических рецепторов, таких как PPAR и EGF.-1 014665 Сущность изобретения Настоящее изобретение относится к новым и имеющим изобретательский уровень медицинским и терапевтическим применениям серий соединений, которые являются новыми, изобретение также относится к данным соединениям. Настоящее изобретение относится к соединениям, включающим в себя общую формулу (I) где R1 и R2, которые могут быть одинаковы или различны, выбирают из группы, включающей в себя -Н или линейную или разветвленную алкильную группу, содержащую от 1 до 6 атомов углерода, или вместе образуют 5- или 6-членное, ароматическое или алифатическое кольцо;Y и Z, которые могут быть одинаковы или различны, выбирают из группы, включающей в себя -Н,-OH, -COOH, -OR3, -CH(OR3)COOH, в которой R3 выбирают из Н, фенила, бензила, -CF3 или -CF2CF3,винила, аллила и из линейной или разветвленной алкильной группы, содержащей от 1 до 6 атомов углерода. Настоящее соединение также относится к подгруппе соединений с общей формулой (Ia) где R1 и R2, которые могут быть одинаковы или различны, выбирают из группы, включающей в себя -Н или линейную или разветвленную алкильную группу, содержащую от 1 до 6 атомов углерода;Y и Z, которые могут быть одинаковы или различны, выбирают из группы, включающей в себя -Н,-OH, -COOH, -OR3, -CH(OR3)COOH, в которой R3 выбирают из -Н и из линейной или разветвленной алкильной группы, содержащей от 1 до 6 атомов углерода. В некоторых воплощениях изобретения Y и Z являются различными. В некоторых воплощениях изобретения по меньшей мере один из Y или Z заканчивается -COOH. Поэтому в некоторых воплощениях изобретения Y или Z (в некоторых воплощениях по меньшей мере один из Y или Z и в некоторых воплощениях только один из Y или Z) представляет собой -COOH. В некоторых воплощениях изобретенияY или Z (в некоторых воплощениях по меньшей мере один из Y или Z и в некоторых воплощениях только один из Y или Z) представляет собой -CH(OR3)COOH. Настоящее изобретение также относится к соединениям общих формул (I) и (1 а), за исключением таких, где Y и Z, которые могут быть одинаковы или различны, выбирают из группы, включающей в себя -Н, -COOH, -OR3, -CH(OR3)COOH. Поэтому в некоторых воплощениях изобретения Y или Z не могут быть -OH. В таких воплощениях изобретения соединения 10 и 11 исключаются. В некоторых воплощениях изобретения, где Y является -Н и Z является -CH(OH)COOH, группаNRXR2 присоединяется в положении 3'. Таким образом, в некоторых воплощениях изобретения соединение 21 исключается. В других воплощениях изобретения, где Z является -OCH3 и Y является -COOH, группа NR1R2 присоединяется в положении 4'. Таким образом, в некоторых воплощениях изобретения соединение 22 исключается. В некоторых воплощениях изобретения, где Y является -Н и Z является -CH(OCH3)COOH, группаNR1R2 присоединяется в положении 4'. Таким образом, в некоторых воплощениях изобретения соединение 35 исключается. В частности, вышеупомянутая линейная или разветвленная алкильная группа, содержащая от 1 до 6 атомов углерода, может быть выбрана из -CH3, -CH2CH3, -CH(CH3)2, -CH2CH2CH3, -CnH2n-1. Соединения формулы (I) и (Ia) могут быть выбраны из группы, включающей в себя 3-(3'-аминофенил)2-гидроксипропионовую кислоту (соединение 20); 2-(4-аминофенил)2-метоксиуксусную кислоту (соединение 23); 2-(3-аминофенил)2-этоксиуксусную кислоту (соединение 32); 2-(4-аминофенил)2-этоксиуксусную кислоту (соединение 33;) 3-(4'-аминофенил)2-метоксипропионовую кислоту (соединение 34); 3-(4'-аминофенил)2-этоксиропионовую кислоту (соединение 39); 3-(3'-аминофенил)2-этоксиропионовую кислоту (соединение 40).-2 014665 Упомянутые выше названия соединений также могут быть приведены согласно стандартной химической номенклатуре в следующем виде (который будет использован далее в тексте):-2-этокси-3-(3'-аминофенил)пропионовая кислота (соединение 40). Соединения согласно настоящему изобретению могут быть успешно использованы в области медицины. Таким образом, настоящее изобретение относится к фармацевтической композиции, включающей в себя одно или более соединений, описанных выше, в качестве активных соединений в комбинации с одним или более фармацевтически приемлемыми носителями или адъювантами. Настоящее изобретение относится, более того, к применению соединений, описанных выше,для получения лекарственного продукта для предотвращения и лечения опухолей, экспрессирующихPPAR- и EGF-рецепторы, таких как, например, опухоли пищевода, желудка, поджелудочной железы,толстой кишки, простаты, молочной железы, матки и придатков, почек и легких. Кроме того, изобретение относится к применению соединений согласно изобретению для получения лекарственного продукта для лечения хронических воспалительных заболеваний, таких как, например, болезнь Крона и язвенный ректоколит. В частности, помимо уже описанных соединений, соединения согласно изобретению, которые могут быть использованы в упомянутых выше приложениях, указаны ниже:(R,S)-2-метокси-3-(3-аминофенил)пропионовая кислота (соединение 34). Упомянутые выше названия соединений также могут быть приведены согласно стандартной химической номенклатуре в следующим виде (который будет использован далее в тексте):-2-метокси-3-(4'-аминофенил)пропионовая кислота (соединение 34). В одном воплощении R3 соединений формулы (I) может быть Н согласно следующей формуле (II): в то время как R1, R2, X и Y описаны ранее. В другом воплощении R3 соединений формулы (I) может быть -CH3 согласно следующей формуле в то время как R1, R2, X и Y описаны ранее. Согласно другому воплощению R3 соединений формулы (I) может быть -CH2CH3 согласно следующей формуле (IV):-3 014665 в то время как R1, R2, X и Y описаны ранее. Согласно другому воплощению R3 соединений формулы (I) может быть -CH2CH3 согласно следующей формуле (V): в то время как R1, R2 X и Y описаны ранее. Согласно другому воплощению R3 соединений формулы (I) может быть -CH3 согласно следующей формуле (VI): в то время как R1, R2 X и Y описаны ранее. Согласно другому воплощению R3 соединений формулы (I) может быть -CH3 согласно следующей формуле (VI): в то время как R1, R2 X и Y описаны ранее. Согласно другому воплощению R3 соединений формулы (I) может быть -CH2CH3 согласно следующей формуле (VII): в то время как R1, R2 X и Y описаны ранее. Согласно другому воплощению R3 соединений формулы (I) может быть -CH2CH3 согласно следующей формуле (VIII): в то время как R1, R2 X и Y описаны ранее.-4 014665 Согласно другому воплощению R3 соединений формулы (I) может быть -CH3 согласно следующей формуле (IX): в то время как R1, R2 X и Y описаны ранее. Предпочтительно соединения формулы (I) могут быть выбраны из группы, включающей в себя-2-этокси-3-(3'-аминофенил)пропионовую кислоту (соединение 40). Соединения согласно настоящему изобретению могут быть успешно использованы в области медицины. Поэтому настоящее изобретение относится к фармацевтической композиции, включающей в себя одно или более соединений, описанных выше, в качестве активных соединений в комбинации с одним или более фармацевтически приемлемыми носителями или адъювантами. Настоящее изобретение относится, более того, к использованию соединений, как описано выше, для получения лекарственного продукта для предупреждения и лечения опухолей, экспрессирующихPPAR-рецепторы и EGF-рецепторы, таких как, например, опухоли пищевода, желудка, поджелудочной железы, толстой кишки, простаты, молочной железы, матки и придатков, почек и легких. Более того, изобретение относится к применению соединений согласно изобретению для получения лекарственного продукта для лечения хронических воспалительных заболеваний, таких как, например,болезнь Крона и язвенный ректоколит. Настоящее изобретение также относится к способам лечения людей и/или млекопитающих (включая грызунов, сельскохозяйственных животных, домашних животных,мышей, крыс, хомячков, кроликов, собак, кошек, свиней, овец, коров, лошадей). В частности, соединения согласно изобретению, которые могут быть использованы в упомянутых выше применениях, кроме уже описанных, могут быть следующими:-2-метокси-3-(4'-аминофенил)пропионовая кислота (соединение 34). Применения описанных соединений не ограничиваются их применением в рацемической форме. Настоящее изобретение распространяется на использование любых описанных соединений в форме чистых энантиомеров R и S или любой смеси, в которой один энантиомер присутствует в избытке по отношению к другому в любой пропорции. В действительности, проведенные изучения докинга показывают, что энантиомер S более активен,чем энантиомер R, хотя чистый энантиомер R также демонстрирует активность. Молекулы настоящего изобретения были получены путем молекулярного моделирования с использованием в качестве основы месалазина и для получения наилучшего показателя (сродство и активация рецептора) в компьютерных экспериментах по докингу были оценены все химически возможные варианты. Следовательно, полагают, что соединения настоящего изобретения, которые показывают сравнимые с месалазином функцию и/или активность действуют через сходные биологические пути. Полагают, что присущие молекулам настоящего изобретения сходные с месалазином характеристики придают молекулам сходную активность в отношении EGF пути. Приведенные в настоящем описании примеры являются удобными моделями в прогнозировании применения соединений в различных областях медицины, которые уже обсуждались. Поэтому модели предоставляют полноценные и показательные результаты независимо от механизма их действия.-5 014665 В дополнение к вышеупомянутым соединениям настоящее изобретение предоставляет для использования следующие соединения: Настоящее изобретение будет теперь описано с целью иллюстрации, но не ограничиваясь этим, согласно его предпочтительным воплощениям, со специальной ссылкой на диаграммы в прилагаемых чертежах. Краткое описание чертежей и таблиц Таблица. Проценты ингибирования клеток DLD-1 дифференцированными дозами (0,5-10 мМ) указанных соединений. Клетки культивировали в присутствии соединений и без них и затем оценивали клеточный рост колориметрическим методом (BrdU) через 48 ч культивирования. Фиг. 1. Структура соединений 20, 23, 32, 33, 34, 35, 39 и 40. Фиг. 2. Активность PPAR при обработке соединениями. Фиг. 3, 4. Действие указанных субстанций на пролиферацию клеток линий карциномы толстой кишки человека (НТ 29, НТ 115 и DLD1). Клетки обрабатывали возрастающими концентрациями субстанций (0,5-10 мМ) в течение 48 ч и определяли пролиферацию клеток, используя колориметрическую реакцию для измерения включенияBrdU. Оптическую плотность (OD) определяли при 450 нм, используя ELISA ридер. Данные представлены как среднее значение SD 3 отдельных экспериментов. Фиг. 5. Докинг (R) соединения 34 и рецептора РРАР (обозначены аминокислотные остатки и показано образование водородных связей). Фиг. 6. Докинг (S) соединения 34 и рецептора РРАР (обозначены аминокислотные остатки и показано образование водородных связей). Фиг. 7. Докинг (R) соединения 35 и рецептора РРАР (обозначены аминокислотные остатки и показано образование водородных связей). Фиг. 8. Докинг (S) соединения 35 и рецептора РРАР (обозначены аминокислотные остатки и показано образование водородных связей). Фиг. 9. Докинг (R) соединения 39 и рецептора РРАР (обозначены аминокислотные остатки и показано образование водородных связей). Фиг. 10. Докинг (S) соединения 39 и рецептора РРАР (обозначены аминокислотные остатки и показано образование водородных связей). Фиг. 11. Докинг месаламина и рецептора РРАР (обозначены аминокислотные остатки) Фиг. 12. Схема синтеза и последующего энантиомерного разделения для соединения 39. Стадия 1. 3-Нитробензальдегид (45,3 г, 0,3 моль), N-ацетилглицин (42,1 г, 0,36 моль) и ацетат натрия (32 г,0,39 моль) смешивали с уксусным ангидридом (142 мл, 1,5 моль) и полученную смесь нагревали при перемешивании до 120 С в течение 6 ч, получая темный раствор. Затем смесь охлаждали до комнатной температуры в течение ночи, получая в результате осажденное твердое вещество. Реакционную смесь выливали в ледяную воду (130 г) и полученное суспендированное твердое вещество собирали фильтрацией. Неочищенный твердый продукт (72 г) промывали ацетоном (80 мл), затем перекристаллизовывали из горячего ацетона (320 мл) с получением кристаллического твердого вещества, которое затем промывали 50% водным этанолом, затем сушили при 40 С/40 мм рт.ст. с получением 2-метил-4-(3 нитробензилиден)оксазол-5(4 Н)-она (49,0 г, 78%) в виде бледно-желтых игл. 1H ЯМР (, 250 МГц, CDCl3): 2,47 (3 Н, с), 7,15 (1 Н, с), 7,63 (1 Н, дд, J=8,2 и 7,6 Гц), 8,27 (1 Н, д,J=8,2 Гц), 8,34 (1 Н, д, J=7,6 Гц), 9,02 (1 Н, с). Стадия 2. 2-Метил-4-(3-нитробензилиден)оксазол-5(4 Н)-он (52,0 г, 0,224 моль) смешивали с 3 М соляной кислотой (1,3 л) и перемешивали суспензию при 100 С в течение 6 ч. Полученную суспензию перемешивали при комнатной температуре в течение ночи, затем суспендированное твердое вещество собирали фильтрацией, промывали водой (240 мл), затем высушивали in vacuo с получением 2-гидрокси-3-(3 нитрофенил)акриловой кислоты (29,3 г). Объединенные фильтрат и промывочные растворы экстрагировали этилацетатом (40,5 л), затем объединенные органические экстракты высушивали над сульфатом натрия и концентрировали досуха с получением дополнительного количества 2-гидрокси-3-(3 нитрофенил)акриловой кислоты (12,0 г). Общий выход 2-гидрокси-3-(3-нитрофенил)акриловой кислоты составляет 41,3 г (88%). 1 Н ЯМР (, 250 МГц, ДМСО-d6): 6,56 (1 Н, с), 7,64 (1 Н, т, J=8 Гц), 8,0-8,1 (2 Н, м), 8,78 (1 Н, с), 9,95(1 Н, ушир. с), 12,80 (1 Н, ушир. с). Стадия 3. Этоксид натрия (1,8 г, 26,4 ммоль) добавляли по частям при 0 С к перемешиваемому раствору 2-гидрокси-3-(3-нитрофенил)акриловой кислоты (5,25 г, 25,0 ммоль) в метаноле (131 мл) до образования прозрачного бледно-желтого раствора. Затем осторожно добавляли боргидрид натрия (1 г, 26,4 ммоль) двумя частями и перемешивали смесь при 5-10 С в течение 30 мин. Затем добавляли небольшое количество воды для подавления реакции и разложения любого избыточного NaBH4. Метанол удаляли in vacuo с получением твердого остатка, который растирали в 5:2 смеси этилацетата и гептана (21 мл), затем растирали с 3% водным метанолом. Полученное твердое вещество собирали фильтрацией и высушивали invacuo с получением 2-гидрокси-3-(3-нитрофенил)пропионовой кислоты (3,0 г, 57%). 1 Н ЯМР (, 250 МГц, ДМСО-d6): 2,97 (1H, дд, J=14 и 8,2 Гц), 3,15 (1 Н, дд, J=14 и 4,2 Гц), 4,23 (1 Н,дд, J=8,2 и 4,2 Гц), 7,58 (1 Н, т, J=8 Гц), 7.70 (1 Н, д, J=8 Гц), 8,0-8,15 (2 Н, м). Стадия 4. Смесь 2-гидрокси-3-(3-нитрофенил)пропионовой кислоты (3,0 г, 14,2 ммоль), метанола (129 мл) и 5% палладия на активированном древесном угле (600 мг, 2 моль%) гидрировали при 10 psi в атмосфере Н 2 в течение 1 ч. Затем смесь фильтровали через целит, отфильтрованный осадок промывали метанолом и концентрировали фильтраты при 40 С в глубоком вакууме с получением продукта в виде пенящегося твердого вещества. Данное вещество растворяли в воде и раствор лиофилизировали с получением-2-гидрокси-3-(3'-аминофенил)пропионовой кислоты (2,6 г, 100%) в виде белого твердого вещества. 1 Стадия 1. Раствор гидроксида калия (6,72 г, 0,12 моль) в метаноле (25 мл) добавляли к охлажденному (-7 С) раствору 4-ацетамидобензальдегида (24,5 г, 0,15 моль) и хлороформа (40,1 г, 0,33 моль) в DMF (100 мл) с такой скоростью, чтобы сохранить температуру ниже 5 С. Затем смеси давали нагреться до 2 С в течение 5,5 ч и затем ее добавляли к смеси 1 M водной HCl (200 мл) и толуола (200 мл) и перемешивали в течение ночи. Полученный 2-(4-ацетамидофенил)трихлорокарбинол собирали фильтрацией (29 г) и высушивали в вакууме. Стадия 2. Растворы 2-(4-ацетамидофенил)трихлорокарбинола (14,0 г, 49,5 ммоль) в метаноле (330 мл) и гидрохлорида калия (13,8 г, 250 ммоль) в метаноле (150 мл) объединяли и смесь нагревали до 70-80 С в течение 3 ч. После охлаждения побочный продукт KCl удаляли фильтрацией затем концентрацией фильтрата in vacuo получали 2-(4-ацетамидофенил)-2-метоксиуксусную кислоту (14 г) в виде белого твердого вещества. Стадия 3. Нагревали 2-(4-ацетамидофенил)-2-метоксиуксусную кислоту (7,1 г, 31,8 ммоль) с моногидратом гидразина (40 мл) в течение 16 ч, охлаждали и концентрировали in vacuo. Полученное в результате остаточное масло очищали на хроматографической колонке с силикагелем (элюент 20-40% метанол в CH2Cl2) с получением 2,6 г (45%) -2-метокси-2-(4'-аминофенил)уксусной кислоты. 1 Стадия 1. 3-Нитробензальдегид (25 г, 165 ммоль) и хлороформ (30 мл, 375 ммоль) растворяли в DMF (100 мл) и охлаждали раствор до температуры между -5 и -10 С. Медленно добавляли свежеприготовленный раствор гидроксида калия (7,5 г, 134 ммоль) в метаноле (22,5 мл), так чтобы поддерживать температуру-5 С. Реакцию поддерживали при -5 С в течение 2 ч и затем останавливали добавлением охлажденной смесью водной соляной кислоты (225 мл) в толуоле (225 мл). Раствору давали медленно нагреться до комнатной температуры в течение ночи на ледяной бане. После этого интервала времени слой толуола отделяли и водный слой далее экстрагировали толуолом. Объединенные органические слои промывали водой (2225 мл), 5% раствором бикарбоната натрия (225 мл) и водой (225 мл). Раствор высушивали(MgSO4), фильтровали и концентрировали in vacuo с получением 2-(3-нитрофенил)трихлорокарбинола в виде оранжевого твердого вещества (42 г, 155 ммоль, 94%). 1 Н ЯМР (, 250 МГц, CDCl3): 3,7 (ушир. с, 1 Н), 5,4 (с, 1 Н), 7,6 (т, 1 Н, J=8,0 Гц), 8,0 (д, 1 Н, J=8,0 Гц),8,3 (д, 1 Н, J=8,0 Гц), 8,5 (с, 1 Н). Стадия 2. 2-(3-Нитрофенил)трихлорокарбинол (20 г, 74 ммоль) растворяли в абсолютном этаноле (74 мл) и медленно добавляли раствор гидроксида калия (20,7 г, 369 ммоль) в абсолютном этаноле (150 мл). Раствор нагревали с обратным холодильником в течение 4 ч, давали остыть и затем концентрировали invacuo. Остаток подкисляли разведенной соляной кислотой и экстрагировали продукт в этилацетате (3). Объединенные органические слои высушивали (MgSO4), фильтровали и концентрировали in vacuo с получением 2-этокси-2-(3-нитрофенил)уксусной кислоты в виде коричневого твердого вещества (6,4 г,28,4 ммоль, 38%). 1(500 мл), добавляли 5% палладий на активированном угле (влажный) (1,5 г) и гидрировали смесь при 60 psi в течение ночи. Суспензию фильтровали через целит и концентрировали фильтрат с получением-2-этокси-2-(3'-аминофенил)уксусной кислоты (3,0 г, 15,3 ммоль, 54%) в виде коричневого твердого вещества. 1 Н ЯМР (, 250 МГц, CD3OD): 1,2 (т, 3 Н, J=6,9 Гц), 3,5 (м, 1 Н), 3,6 (м, 1 Н), 4,6 (с, 1 Н), 6,7 (д, 1 Н,J=7,6 Гц), 6,9 (м, 2 Н), 7,0 (т, 1 Н, J=7,6 Гц). Пример 4. Способ получения -2-этокси-2-(4'-аминофенил)уксусной кислоты (соединение 33) Стадия 1. См. "Соединение 23 стадия 1". Стадия 2. Растворы 2-(4-ацетамидофенил)трихлорокарбинола (14,0 г, 49,5 ммоль) в этаноле (400 мл) и гидроксида калия (13,8 г, 250 ммоль) в этаноле (150 мл) объединяли и смесь нагревали при 70-80 С в течение 2,5 ч. Смесь охлаждали, фильтровали для удаления побочного продукта KCl и концентрировали in vacuo с получением 2-(4-ацетамидофенил)-2-этоксиуксусной кислоты (14 г) в виде желтого твердого вещества. Стадия 3. Нагревали 2-(4-ацетамидофенил)-2-этоксиуксусную кислоту (7,54 г, 31,8 ммоль) с моногидратом гидразина (40 мл) в течение 16 ч, охлажденную смесь затем концентрировали in vacuo. Затем оставшееся масло очищали на хроматографической колонке с силикагелем (элюент 20-40% метанол в CH2Cl2) с получением -2-этокси-2-(4'-аминофенил)уксусной кислоты (2,3 г, 37%) в виде белой пены. 1 Н ЯМР (, 250 МГц, CD3OD): 1,18 (3H, т, J=7,0 Гц), 4,42 (1 Н, кв д, J=7,3, 2,4 Гц), 4,56 (2 Н, с), 5,50(37,9 г, 0,463 моль) смешивали с уксусным ангидридом (168 г, 1,78 моль) и полученную смесь нагревали при перемешивании до 120 С в течение 6 ч, получая темную суспензию. Затем смесь охлаждали до комнатной температуры в течение ночи, получая в результате осажденное твердое вещество. Реакционную смесь выливали в ледяную воду (150 г) и полученное суспендированное твердое вещество собирали фильтрацией. Неочищенный твердый продукт промывали ацетоном (100 мл), затем перекристаллизовывали из горячего ацетона (650 мл) с получением кристаллического твердого вещества, которое затем промывали 50% водным этанолом, затем сушили in vacuo с получением 2-метил-4-(4 нитробензилиден)оксазол-5(4 Н)-она (55,0 г, 66%) в виде бледно-желтых игл. Кристаллизационные маточные растворы и растворы после промывки объединяли и выпаривали с получением твердого осадка,который перекристаллизовывали из ацетона с получением второго дополнительного количества 2-метил 4-(4-нитробензилиден)оксазол-5(4 Н)-она (8 г, 10%). 1 Н ЯМР (, 250 МГц, CDCl3): 2,47 (3 Н, с), 7,14 (1 Н, с), 8,28 (4 Н, м).-9 014665 Стадия 2. 2-Метил-4-(4-нитробензилиден)оксазол-5(4 Н)-он (63,0 г, 0,272 моль) смешивали с 3 М соляной кислотой (1,2 л) и перемешивали суспензию при 100 С в течение 6 ч. Полученную суспензию перемешивали при комнатной температуре в течение ночи, затем суспендированное твердое вещество собирали фильтрацией, промывали водой (250 мл), затем высушивали in vacuo с получением 2-гидрокси-3-(4 нитрофенил)акриловой кислоты (46,6 г, 81%). Объединенные фильтрат и растворы после промывки экстрагировали этилацетатом (40,5 л), затем объединенные органические экстракты высушивали над сульфатом натрия и концентрировали досуха с получением дополнительного количества 2-гидрокси-3-(4 нитрофенил)акриловой кислоты (0,8 г, 1%). Общий выход 2-гидрокси-3-(4-нитрофенил)акриловой кислоты составлял 47,4 г (82%). 1H ЯМР (, 250 МГц, ДМСО-d6): 6,52 (1 Н, с), 8,01 (2 Н, д, J=8,5 Гц), 8,22 (2 Н, д, J=8,5 Гц). Стадия 3. Смесь 2-гидрокси-3-(4-нитрофенил)акриловой кислоты (15 г, 71,7 моль), карбоната цезия (56 г,172,1 ммоль) и диметилсульфата (14,2 мл, 150,6 ммоль) в DMF (270 мл) перемешивали при комнатной температуре 18 ч. Добавляли воду (220 мл) и этилацетат (150 мл) и разделяли слои. Водный слой затем экстрагировали этилацетатом (4100 мл), затем объединенные органические слои промывали водой(6100 мл), соляным раствором (2120 мл) и концентрировали до половины объема. Добавляли гептан(70 мл) и концентрировали смесь до объема 200 мл. Полученное осажденное твердое вещество собирали фильтрацией, промывали гептаном (2100 мл) и сушили на фильтре в вакууме, с получением метил 2-метокси-3-(4-нитрофенил)акрилата в виде желтовато-коричневого твердого вещества (9,2 г, выход 54%), содержащего следы гептана. 1 Н ЯМР (, 250 МГц, ДМСО-d6): 3,82 (с, 3-Н, ОМе), 3,84 (с, 3-Н, ОМе), 7,02 (с, 1-Н, CH=), 8,04 (д,2-Н, CH-ароматический), 8,26 (д, 2-Н, CH-ароматический) Стадия 4. Метил 2-метокси-3-(4-нитрофенил)акрилат (7,8 г, 32,8 ммоль) растворяли в IMS (156 мл). Добавляли раствор NaOH (1,44 г, 36,1 ммоль) в воде (78 мл) и перемешивали смесь при комнатной температуре(18 С) в течение 18 ч. Реакционную смесь подкисляли 1 М HCl (120 мл) и полученное осажденное твердое вещество собирали фильтрацией, промывали водой (2100 мл) и частично высушивали в вакууме на фильтре в течение 30 мин с последующим высушиванием в вакуумной печи при 18 С в течение 18 ч. Таким образом получали 2-метокси-3-(4-нитрофенил)акриловую кислоту в виде желтовато-коричневого твердого вещества (6,7 г, 91%), содержащего некоторое количество кристаллизационной воды. 1THF (300 мл) и добавляли 10% Pd на С (влажная основа) (0,67 г). Смесь гидрировали при 45 psi в течение 43 мин с последующими повторными заполнениями до 45-48 psi каждый час в течение 3 ч и в заключение 48 psi в течение 18 ч. Полученную суспензию фильтровали через GF/F фильтровальную бумагу и остаток на фильтре промывали MeOH (200 мл). Фильтраты концентрировали не совсем до белого твердого вещества. Твердое вещество суспендировали в IMS (75 мл) при 20 С в течение 1,5 ч, фильтровали и промывали IMS/гептан (1:2) (20 мл) и высушивали на фильтре в течение 1 ч для получения-2-метокси-3-(4'-аминофенил)пропионовой кислоты в виде не совсем белого твердого вещества (5,1 г,выход 88%). 1- 10014665 Стадии 1 и 2. Проводили аналогично стадиям 1 и 2 для соединения 20. Стадия 3. Диметилсульфат (13,23 г, 105 ммоль) добавляли к перемешиваемой смеси 2-гидрокси-3-(3 нитрофенил)акриловой кислоты (10,5 г, 50,0 ммоль) и карбоната цезия (39,1 г, 120 ммоль) в DMF (105 мл) до образования прозрачной бледно-желтой смеси, которую перемешивали при комнатной температуре в течение ночи. Полученную темно-красную суспензию концентрировали in vacuo и остаток разделяли между водой (100 мл) и дихлорметаном (150 мл). Отделяли органический слой, далее промывали водой(2100 мл) и высушивали над сульфатом натрия и фильтровали через силикагель. Полученный желтый раствор выпаривали досуха in vacuo с получением метил 2-метокси-3-(3-нитрофенил)акрилата в виде желтого твердого вещества (8,1 г, 67%). 1H ЯМР (, 250 МГц, ДМСО-d6): 3,81 (3 Н, с), 3,83 (3 Н, с), 7,08 (1 Н, с), 7,71 (1 Н, дд, J=7,9 и 8,2 Гц),8,10-8,22 (2 Н, м), 8,66 (1 Н, с). Стадия 4. Раствор гидроксида калия (2,0 г, 35,9 ммоль) в воде (25 мл) добавляли к перемешиваемому раствору метил 2-метокси-3-(3-нитрофенил)акрилата (8,1 г, 34,2 ммоль) в метаноле (150 мл) и полученную смесь перемешивали при комнатной температуре в течение ночи. Добавляли дополнительное количество KOH(0,5 г, 8,9 ммоль) в воде (10 мл) и нагревали смесь до 80 С в течение 1 ч. Затем выпаривали метанол invacuo и разбавляли остаток водой (200 мл). Раствор промывали дихлорметаном (2100 мл), фильтровали через слой целита и затем подкисляли 3 М HCl до рН 3. Смесь охлаждали в течение 18 ч, затем собирали осажденное твердое вещество фильтрованием, промывали водой (330 мл) и высушивали in vacuo при 40 С с получением 2-метокси-3-(3-нитрофенил)акриловой кислоты в виде желтого твердого вещества(6,4 г, 84%). 1 Н ЯМР (, 250 МГц, ДМСО-d6): 3,82 (3 Н 1 с), 7,02 (1H, с), 7,70 (1 Н, т, J=7,93 Гц), 8,10-8,22 (2 Н, м),8,65 (1 Н, с). Стадия 5. Смесь 2-метокси-3-(3-нитрофенил)акриловой кислоты (3,4 г, 15,25 ммоль), метанола (340 мл) и 5% палладия на активированном древесном угле (1,36 г, 4 мол.%) гидрировали при 12-36 psi в атмосфере Н 2 в течение 1,5 ч. Затем смесь фильтровали через целит, осадок на фильтре промывали метанолом и концентрировали фильтраты при 40 С в вакууме до получения продукта в виде пенящегося твердого вещества. Данное вещество растворяли в воде (100 мл) и лиофилизировали раствор с получением-2-метокси-3-(3'-аминофенил)пропионовой кислоты (2,6 г, 100%) в виде не совсем белого твердого вещества. 1 Стадии 1 и 2. Стадии 1 и 2 проводили аналогично стадиям 1 и 2 соединения 34. Стадия 3. 2-Гидрокси-3-(4-нитрофенил)акриловую кислоту (20 г, 95,6 ммоль) суспендировали в DMF(200 мл). Добавляли Cs2CO3 (74,9 г, 229,9 ммоль) и диэтилсульфат (26,3 мл, 201 ммоль) и наблюдали растворение. После перемешивания в течение 18 ч при 18 С добавляли воду (350 мл) и этилацетат (250 мл) и разделяли слои. Водный слой далее экстрагировали этилацетатом (5200 мл), затем объединенные органические слои промывали водой (2200 мл), соляным раствором (2200 мл) и высушивали над сульфатом магния. Органические слои концентрировали досуха с получением этил 2-этокси-3-(4 нитрофенил)акрилата в виде оранжевого твердого вещества, содержащего 3,6 мас.% DMF (27,6 г влажного, выход 100%).H ЯМР (, 250 МГц, ДМСО-d6): 1,32 (т, 6-Н, 2CH2CH3), 4,13 (кв, 2-Н, CH2CH3), 4,30 (кв, 2-Н,CH2CH3), 6,99 (с, 1-Н, CH=), 8,06 (д, 2-Н, CH-ароматический), 8,26 (д, 2-Н, CH-ароматический). Стадия 4. Этил 2-этокси-3-(4-нитрофенил)акрилат, содержащий 3,6 мас.% DMF (26,07 г с поправкой,98,3 ммоль) растворяли в IMS (500 мл) и добавляли раствор NaOH (1,44 г, 36,1 ммоль) в воде (260 мл). Полученную смесь перемешивали при комнатной температуре в течение 18 ч, затем подкисляли 1 M HCl(120 мл) и полученное осажденное твердое вещество собирали фильтрацией, промывали водой(2100 мл) и осадок на фильтре высушивали в вакууме в течение 30 мин с последующим высушиванием в вакуумной печи при 18 С в течение 18 ч. Таким образом получали 2-этокси-3-(4 нитрофенил)акриловую кислоту в виде оранжевого твердого вещества, содержащего кристаллизационную воду (18,4 г, 79%). 1H ЯМР (, 250 МГц, ДМСО-d6): 1,31 (т, 3-Н, Me), 4,11 (кв, 2-Н, CH2), 6,98 (с, 1-Н, CH=), 8,05 (д,2-Н, CH-ароматический), 8,25 (д, 2-Н, CH-ароматический). Стадия 5. Растворяли 2-этокси-3-(4-нитрофенил)акриловую кислоту (18,4 г влажную, приблизительно 77,5 ммоль) в MeOH (1,1 л) и добавляли 10% Pd на С (влажная основа) (1,84 г). Смесь гидрировали при 12 psi 10 мин с последующим повторным заполнением до 20-28 psi каждые 10-20 мин в течение 5 ч, затем 46 psi в течение 18 ч. Смесь фильтровали через GF/F фильтровальную бумагу и остаток суспендировали в IMS (100 мл), фильтровали, промывали гептаном (100 мл) и высушивали осадок на фильтре. Таким образом, получали -2-этокси-3-(4'-аминофенил)пропионовую кислоту в виде не совсем белого твердого вещества (11,2 г, 69%). 1 Н ЯМР (, 250 МГц, ДМСО-d6): 1,03 (т, 3-Н, CH3), 2,73 (м, 2-Н,), 3,29 (м, 1 Н), 3,46 (м, 1 Н), 3,80 (дд,1-Н), 6,50 (д, 2-Н), 6,87 (д, 2-Н). Пример 8. Способ получения -2-этокси-3-(3'-аминофенил)пропионовой кислоты (соединение 40) Стадии 1 и 2. Стадии 1 и 2 проводили аналогично стадиям 1 и 2 как для соединения 20. Стадия 3. Диэтилсульфат (12 г, 78,2 ммоль) добавляли к перемешиваемой смеси 2-гидрокси-3-(3 нитрофенил)акриловой кислоты (6,1 г, 30,0 ммоль) и карбоната цезия (29,3 г, 90 ммоль) в DMF (61 мл) с образованием прозрачной бледно-желтой смеси, которую перемешивали при комнатной температуре в течение ночи. Полученную темно-красную суспензию нагревали до 50 С в течение 4 ч, затем концентрировали in vacuo и остаток разделяли между водой (100 мл) и дихлорметаном (150 мл). Отделяли органический слой, далее промывали водой (2100 мл) и высушивали над сульфатом натрия и фильтровали через слой силикагеля. Полученный желтый раствор выпаривали досуха in vacuo с получением этил 2-этокси-3-(3-нитрофенил)акрилата в виде желтого твердого вещества (5,6 г, 72%). Стадия 4. Раствор гидроксида калия (1,3 г, 22,2 ммоль) в воде (20 мл) добавляли к перемешиваемому раствору этил 2-этокси-3-(3-нитрофенил)акрилата (5,6 г, 21,1 ммоль) в метаноле (100 мл) и полученную смесь нагревали с обратным холодильником в течение ночи. Затем выпаривали метанол in vacuo и разводили остаток водой (150 мл). Раствор промывали дихлорметаном (280 мл), фильтровали через слой целита и затем подкисляли добавлением 3 M HCl до рН 3. Смесь охлаждали в течение 18 ч, затем осажденное твердое вещество собирали фильтрованием, промывали водой (330 мл) и высушивали in vacuo при 40 С. Полученное твердое вещество перекристаллизовывали из этилацетата и гептана с получением 2-этокси-3-(3-нитрофенил)акриловой кислоты в виде желтого твердого вещества (3,06 г, 61%). 1 Н ЯМР (, 250 МГц, ДМСО-d6): 1,34 (3 Н, т, J=7 Гц), 4,10 (2 Н, кв, J=7 Гц), 7,04 (1 Н, с), 7,69 (1 Н, т,J=7,93 Гц), 8,07-8,22 (2 Н, м), 8,80 (1 Н, м), 13,25 (1 Н, ушир. с).- 12014665 Стадия 5. Смесь 2-этокси-3-(3-нитрофенил)акриловой кислоты (3,06 г, 12,9 ммоль), метанола (150 мл) и 5% палладия на активированном древесном угле (0,60 г, 2 мол.%) гидрировали при 12-30 psi в атмосфере Н 2 в течение 2 ч. Затем смесь фильтровали через целит, осадок на фильтре промывали метанолом и концентрировали фильтраты при 4 0 С в вакууме до получения продукта в виде пенящегося твердого вещества. Данное вещество растворяли в воде (100 мл) и лиофилизировали раствор с получением -2-этокси-3-(3'аминофенил)пропионовой кислоты (2,7 г, 100%) в виде не совсем белого твердого вещества. 1H ЯМР (, 250 МГц, ДМСО-d6): 1,07 (3 Н, т, 7 Гц), 2,6-2,85 (2 Н, м), 3,20-3,38 (1 Н, м), 3,40-3,60 (1 Н,м), 3,92 (1 Н, дд, 5 и 7,7 Гц), 6,3-6,45 (3 Н, м), 7,01 (1 Н, т, 7,6 Гц). Пример 9. Молекулярное моделирование. Исследования по молекулярному моделированию проводили с использованием программы SYBYL версии 6.9.1, (Tripos Associates Inc, St Louis, МО) установленной на рабочей станции Silicon Graphics. Трехмерную модель цвиттерионной формы 5-ASA строили из стандартных фрагментов библиотеки и последовательно оптимизировали ее геометрию, используя Tripos force field (3). Поскольку pKa соединений остаются неизвестными, использовали он-лайн калькулятор SPARC для определения образцов, существующих при физиологическом значении рН (7,4) (http://ibralc2.chem.uga.edu/sparc/index.cfm). Трехмерную модель ионизированных соединений строили из стандартных фрагментов библиотеки и их геометрию последовательно оптимизировали с использованием Tripos force field (3), включая электростатический показатель, рассчитанный из атомных зарядов по Гаштейгеру и Хюккелю (Gasteiger and Huckel). Метод Повелла (Powell), доступный в процедуре Maximin2, использовали для минимизации энергии до величины градиента менее 0,001 ккал/мол Структуру человеческого PPAR лигандсвязывающего домена получили из его комплексной рентгеновской кристаллической структуры с тезаглитазаром (AZ 242), доступной в белковом банке данныхRCSB (1I7I), (4,5). Гибкий докинг соединений в активном сайте рецептора выполняли с использованием программы GOLD (6). Наиболее стабильные модели докинга выбирали согласно наиболее выигрышной конформации, предсказанной GoldScore (6) X-Score оценочными функциями (7). Комплексы были энергетически минимизированы по методу Повелла, доступному в процедуре Maximin2, с Tripos force field и с диэлектрической постоянной 4,0 до достижения величины градиента 0,01 ккал/мол Использовали нормализованную функцию, определяя вокруг лиганда "горячий" регион (10 ) и регион, представляющий интерес (15 ). Результаты. Исследования по молекулярному моделированию докинга с рецептором прогнозируют, что в целомS-энантиомер является более активным, чем R-энантиомер, несмотря на то, что R-энантиомер также проявляет активность. Данный феномен, когда один энантиомер является более биологически активным, чем другой, хорошо известен. Как следствие, настоящее изобретение предоставляет способ разделения соединений на энантиомеры. Способ разделения для соединения 32 схематически показан на фиг. 11. Без связи с какой-либо теорией авторы полагают, что S-энантиомеры соединений обеспечивают более высокую активность. Результаты исследований докинга представлены на фиг. 5-10. Пример 10. Способ получения -2-этокси-3-(4'-аминофенил)пропионовой кислоты (соединение 39). Энантиомерное разделение (фиг. 12). Стадии 1 и 2. Стадии 1 и 2 проводили аналогично стадиям 1 и 2 соединения 34.(200 мл). Добавляли Cs2CO3 (74,9 г, 229,9 ммоль) и диэтилсульфат (26,3 мл, 201 ммоль) и наблюдали растворение. После перемешивания в течение 18 ч при 18 С добавляли воду (350 мл) и этилацетат (250 мл) и разделяли слои. Водный слой далее экстрагировали этилацетатом (5200 мл), затем объединенные органические слои промывали водой (2200 мл), соляным раствором (2200 мл) и высушивали над сульфатом магния. Органические слои концентрировали досуха с получением этил 2-этокси-3-(4 нитрофенил)акрилата в виде оранжевого твердого вещества, содержащего 3,6 мас.% DMF (27,6 г влажного, выход 100%). 1H ЯМР (, 250 МГц, ДМСО-d6): 1,32 (т, 6-Н, 2CH2CH3), 4,13 (кв, 2-Н, CH2CH3), 4,30 (кв, 2-Н,CH2CH3), 6,99 (с, 1-H, CH=), 8,06 (д, 2-Н, CH-ароматический), 8,26 (д, 2-Н, CH-ароматический). Стадия 4. Этил 2-этокси-3-(4-нитрофенил)акрилат, содержащий 3,6 мас.% DMF (26,07 г с поправкой,98,3 ммоль) растворяли в IMS (500 мл) и добавляли раствор NaOH (1,44 г, 36,1 ммоль) в воде (260 мл). Полученную смесь перемешивали при комнатной температуре в течение 18 ч, затем подкисляли 1 М HCl(120 мл) и полученное осажденное твердое вещество собирали фильтрацией, промывали водой(2100 мл) и осадок на фильтре высушивали в вакууме в течение 30 мин. Результаты. Активация PPAR дает в результате каскад реакций, приводящих к связыванию специфических элементов последовательности ДНК, названных элементами пероксисомального пролиферативного ответа (PPRE) (7-9). Исследовали PPAR транскрипционную активность временными трансфекциями эпителиальных клеток renilla luciferase и PPRE плазмидами. Чтобы оценить имеют ли новые молекулы большую эффективность, чем 5-ASA для стимулирования активации PPAR, данные молекулы тестировали в концентрации 1 мМ. Воздействие новых молекул в концентрации 1 мМ сравнивали с 5-ASA и розиглитазоном,использованным как положительные контроли в оптимальных концентрациях 30 мМ и 10-5 М соответственно. Клетки стимулировали различными молекулами в течение 24 ч. Анализ PPAR активности в трансфекторных клетках НТ-29 показал, что новые молекулы 34, 39, 35 и 40 при 1 мМ увеличивали активность репортерного гена в 4,80,71; 2,730,31; 2,640,46; 3,40,97 раз соответственно, таким образом демонстрируя активность, сходную или превосходящую 30 мМ 5-ASA(2,80,7) и 10-5 М розиглитазона (3,170,29). На фиг. 2 представлены все результаты, полученные для каждой молекулы, оцененные в 2 или 3 экспериментах, сделанных в триплетах. Воспроизводимость между различными экспериментами является хорошей и сходной с данными, описанными в литературе. Настоящее исследование позволило идентифицировать 4 новые молекулы, имеющие от 30 до 50 раз большую эффективность, чем 5-ASA, для активации PPAR. Пример 11. Рост клеток рака толстого кишечника. Проверяли способность следующих субстанций (а именно 20, 34, 35, 39 и 40) изменять рост клеток рака толстой кишки. Для этого использовали три клеточные линии карциномы толстого кишки человека(а именно НТ-29, НТ-115 и DTD-1). Данные виды клеток выбирали на основе экспрессии циклооксигеназы-2 (СОХ-2). Фактически клетки НТ-115 экспрессируют биологически активную СОХ-2, НТ-29 экспрессируют нефункциональную изоформу СОХ-2, и DTD-1 являются СОХ-2 дефицитными клетками. Полагают, что указанные молекулы также являются активными на клетках, которые не экспрессируют СОХ-, и, следовательно, молекулы настоящего изобретения могут быть использованы в клетках, которые не экспрессируют СОХ-2, с целью лечения опухолей и в других применениях, описанных в настоящем изобретении. Клетки линий НТ-29 и DTD-1 культивировали в средах McCoy и RPMI1640 соответственно, дополненных 10% фетальной телячьей сывороткой (FBS), 1% пенициллином, стрептомицином (P/S) и 50 мг/мл гентамицином. НТ-115 культивировали в среде DMEM, дополненной 15% FBS и 1% P/S. Клетки сохраняли в увлажненном инкубаторе при 37 С, при наличии 5% СО 2. Для анализов клеточного роста клонированные суспензии высевали по 2103 клеток/лунка(4103 клеток/лунка для НТ 115) в 96-луночные культуральные планшеты в среде, содержащей 0,5% FBS,и давали прилипнуть. Не адгезированные клетки затем удаляли и в каждую лунку добавляли свежую среду, содержащую 0,5% FBS. Клетки культивировали в присутствии указанных субстанций или без них. Каждую субстанцию растворяли в виде 25 мМ стокового раствора в культуральной среде, содержащей 0,5% FBS, и при необходимости рН каждого стокового раствора доводили NaOH до 7,4. Субстанции использовали в конечной концентрации в диапазоне от 0,5 до 10 мМ. Клеточную пролиферацию определяли, измеряя включение 5-бром-2'-деоксиуридина (BrdU) в ДНК с использованием коммерчески доступного набора для клеточной пролиферации. (Roche Diagnostics,Monza, Италия). BrdU добавляли к клеточным культурам в течение последних 6 ч инкубации и определяли уровень BrdU-положительных клеток через 48 ч культуры ферментсвязанным иммуносорбентным- 14014665 анализом (ELISA). Оптическую плотность (OD) определяли при 450 нм ELISA ридером. Эксперименты выполняли в триплетах, и результаты представляли как среднее значение + стандартное отклонение (SD). Результаты. Соединения различались по своей способности ингибировать рост клеток рака толстой кишки. Результаты представлены в таблице, где показан процент ингибирования роста клеток DTD-1 указанными соединениями. Субстанция 20 демонстрирует выраженное антипролиферативное действие в дозозависимой форме на каждой из трех тестированных клеточных линий (фиг. 3 и 4). Наблюдается более 90% ингибирования клеточного роста при использовании соединений в конечной концентрации 10 мМ. Способность соединения 20 существенно ингибировать клеточный рост видна при его применении в конечной концентрации 5 или 10 мМ. Процент ингибирования клеток DLD-1 дифференцированными дозами Соединения 34 и 39 при использовании в высоких дозах немного снижали клеточный рост (10 мМ)(фиг. 4), но различия между группами были не достоверны. Также не наблюдали ингибирования клеточного роста в культурах с добавлением субстанций 35 и 40 (см. таблицу). Заключение. Данный первый набор примеров изобретения (пример 10) показывает способность четырех оптимизированных молекул 34, 39, 35 и 40 в концентрации 1 мМ увеличивать активность PPAR в трансфицированных НТ-29 клетках, демонстрирующих активность, сходную или превосходящую по отношению к 30 мМ 5-ASA и 10-5 М розиглитазону. Второй набор примеров изобретения (пример 11) показывает, что соединения воздействуют на ингибирование роста клеточных линий рака толстой кишки НТ-29, НТ-115 и DLD1 в различной степени. Соединения различались по своей способности ингибировать рост клеток рака толстой кишки. Субстанция 20 демонстрирует выраженное антипролиферативное действие на тестированных клеточных линиях. Указанные молекулы настоящего изобретения также активны на клетках, которые не экспрессируют СОХ-2, и, следовательно, молекулы настоящего изобретения могут быть использованы в клетках,которые не экспрессируют СОХ-2, с целью лечения опухолей и в других применениях, описанных в настоящем документе. Общий вывод. Синтезированные высокоранжированные соединения, показанные в исследованиях по моделированию, все, проявляют активность, которая равна или превосходит активность месалазина. Список литературы где R1 и R2, которые могут быть одинаковы или различны, выбирают из группы, состоящей из -Н или линейной или разветвленной алкильной группы, содержащей от 1 до 6 атомов углерода, или вместе образуют 5- или 6-членное ароматическое или алифатическое кольцо;R3 выбирают из фенила, бензила, -CF3 или -CF2CF3, винила, аллила и из линейной или разветвленной алкильной группы, содержащей от 1 до 6 атомов углерода; причем соединение не является 2-метокси-3-(3'-аминофенил)пропионовой кислотой. 2. Соединения с общей формулой (Ia)R1 и R2, которые могут быть одинаковы или различны, выбирают из группы, состоящей из -Н или линейной или разветвленной алкильной группы, содержащей от 1 до 6 атомов углерода, или вместе образуют 5- или 6-членное ароматическое или алифатическое кольцо;Y и Z, которые могут быть одинаковы или различны, выбирают из группы, состоящей из -Н, -OH,-OR3, -CH(OR3)COOH, в которой R3 выбирают из Н и из линейной или разветвленной алкильной группы,содержащей от 1 до 6 атомов углерода. 3. Соединение по п.1 или 2, где указанное соединение выбирают из группы, включающей-2-метокси-2-(3'-аминофенил)пропионовую кислоту (соединение 22). 4. Соединение по любому из предыдущих пунктов, имеющее следующую структуру: 5. Соединение по любому из пп.1-3, имеющее следующую структуру: 6. Соединение по любому из пп.1-3, имеющее следующую структуру: 7. Соединение по любому из пп.1-3, имеющее следующую структуру: 8. Соединение по любому из пп.1-3, имеющее следующую структуру: 9. Соединение по любому из пп.1-3, имеющее следующую структуру: 10. Фармацевтическая композиция, включающая в себя одно или более соединений, которые определены по любому из пп.1-9, в качестве активных соединений в комбинации с одним или более фармацевтически приемлемыми носителями или адъювантами. 11. Фармацевтическая композиция по п.10, где соединение представляет собой смесь, в которой один энантиомер присутствует в избытке по отношению к другому в любой пропорции. 12. Способ лечения пациента, страдающего хроническим воспалительным заболеванием или от опухолей, экспрессирующих PPAR- и EGF-рецепторы, включающий введение пациенту фармацевтической композиции по любому одному из пп.10 или 11 или одного или более соединений общей формулы где R1 и R2, которые могут быть одинаковы или различны, выбирают из группы, состоящей из -Н или линейной или разветвленной алкильной группы, содержащей от 1 до 6 атомов углерода, или вместе- 17014665 образуют 5- или 6-членное ароматическое или алифатическое кольцо;Y и Z, которые могут быть одинаковые или различные, выбирают из группы, состоящей из -Н, -OH,COOH, -OR3 и -CH(OR3)COOH;R3 выбирают из Н, фенила, бензила, -CF3 или -CF2CF3, винила, аллила и из линейной или разветвленной алкильной группы, содержащей от 1 до 6 атомов углерода. 13. Применение одного или более соединений общей формулы (I) где R1 и R2, которые могут быть одинаковы или различны, выбирают из группы, состоящей из -Н или линейной или разветвленной алкильной группы, содержащей от 1 до 6 атомов углерода, или вместе образуют 5- или 6-членное ароматическое или алифатическое кольцо;Y и Z, которые могут быть одинаковые или различные, выбирают из группы, состоящей из -Н, -OH,COOH, -OR3 и -CH(OR3)COOH;R3 выбирают из Н, фенила, бензила, -CF3 или -CF2CF3, винила, аллила и из линейной или разветвленной алкильной группы, содержащей от 1 до 6 атомов углерода, в области медицины. 14. Применение по п.13 в лечении хронических воспалительных заболеваний и/или лечении опухолей, экспрессирующих PPAR- и EGF-рецепторы. 15. Применение по п.13 для получения лекарственного средства для лечения хронических воспалительных заболеваний и/или лечения или предотвращения опухолей, экспрессирующих PPAR- и EGFрецепторы. 16. Применение по любому одному из пп.13-15, где соединение выбирают из группы, включающей-2-этокси-3-(3'-аминофенил)пропионовую кислоту (соединение 40),и где лечение является лечением хронического воспалительного заболевания. 17. Применение по любому одному из пп.13-15, где соединение выбирают из группы, включающей-2-этокси-3-(4'-аминофенил)пропионовую кислоту (соединение 39),и где лечение является лечением или предотвращением опухолей, экспрессирующих PPAR- иEGF-рецепторы. 18. Способ по п.12 или применение по любому одному из пп.13-17, где хроническим воспалительным заболеванием является болезнь Крона и язвенный ректоколит. 19. Способ по п.12 или применение по любому одному из пп.13-17, где опухоли выбирают из группы, состоящей из опухоли пищевода, желудка, поджелудочной железы, толстой кишки, простаты, молочной железы, матки и придатков, почек и легких. Пролиферация клеток линий карциномы толстой кишки человека НТ 29, НТ 115, DLD1 при обработке 0,5-10 мМ нового соединения 20 в течение 48 ч Фиг. 3 Пролиферация клеток линий карциномы толстой кишки человека НТ 29, НТ 115, DLD1 при обработке 0,5-10 мМ новых соединений 34, 35, 39, 40 в течение 48 ч- 20014665 Докинг соединения 34 (R) и рецептора РРАР (обозначены аминокислотные остатки и показано образование водородных связей) Фиг. 5 Докинг соединения 34 (S) и рецептора РРАР (обозначены аминокислотные остатки и показано образование водородных связей)- 21014665 Докинг соединения 35 (R) и рецептора РРАР (обозначены аминокислотные остатки и показано образование водородных связей) Фиг. 7 Докинг соединения 35 (S) и рецептора РРАР (обозначены аминокислотные остатки и показано образование водородных связей)- 22014665 Докинг соединения 39 (R) и рецептора РРАР (обозначены аминокислотные остатки и показано образование водородных связей) Фиг. 9 Докинг соединения 39 (S) и рецептора РРАР (обозначены аминокислотные остатки и показано образование водородных связей) Фиг. 11 Схема синтеза и последующего энантиомерного разделения для соединения 32
МПК / Метки
МПК: A61P 35/00, A61K 31/136, C07C 229/42
Метки: рецепторам, соединения, области, соли, применение, медицины, специфичные
Код ссылки
<a href="https://eas.patents.su/26-14665-soedineniya-i-ih-soli-specifichnye-k-ppar-receptoram-i-egf-receptoram-i-ih-primenenie-v-oblasti-mediciny.html" rel="bookmark" title="База патентов Евразийского Союза">Соединения и их соли, специфичные к ppar рецепторам и egf рецепторам, и их применение в области медицины</a>
Предыдущий патент: Фармацевтическая композиция, содержащая гестагены и/или эстрогены и 5-метил-(6s)-тетрагидрофолат
Следующий патент: Фунгицидные смеси
Случайный патент: Металлическая кровля для каркасных зданий