Порошковые лекарственные средства, содержащие соль тиотропия и ксинафоат салметерола
Номер патента: 10588
Опубликовано: 30.10.2008
Авторы: Вальц Михаэль, Зойка Райнер, Хартиг-Хаймель Мареке, Зигер Петер, Трунк Михаель, Гребнер Хаген
Формула / Реферат
1. Капсула, содержащая ингаляционный порошок, содержащий тиотропий 1' и ксинафоат салметерола 2, где 2 характеризуется температурой плавления примерно 124шС, в смеси с физиологически безвредным вспомогательным веществом, при том, что капсула содержит от 8 до 12 мг ингаляционного порошка.
2. Капсула по п.1, отличающаяся тем, что тиотропий 1' присутствует в комбинации с противоионом, выбранным из группы, включающей хлорид, бромид, иодид, метансульфонат и паратолуолсульфонат.
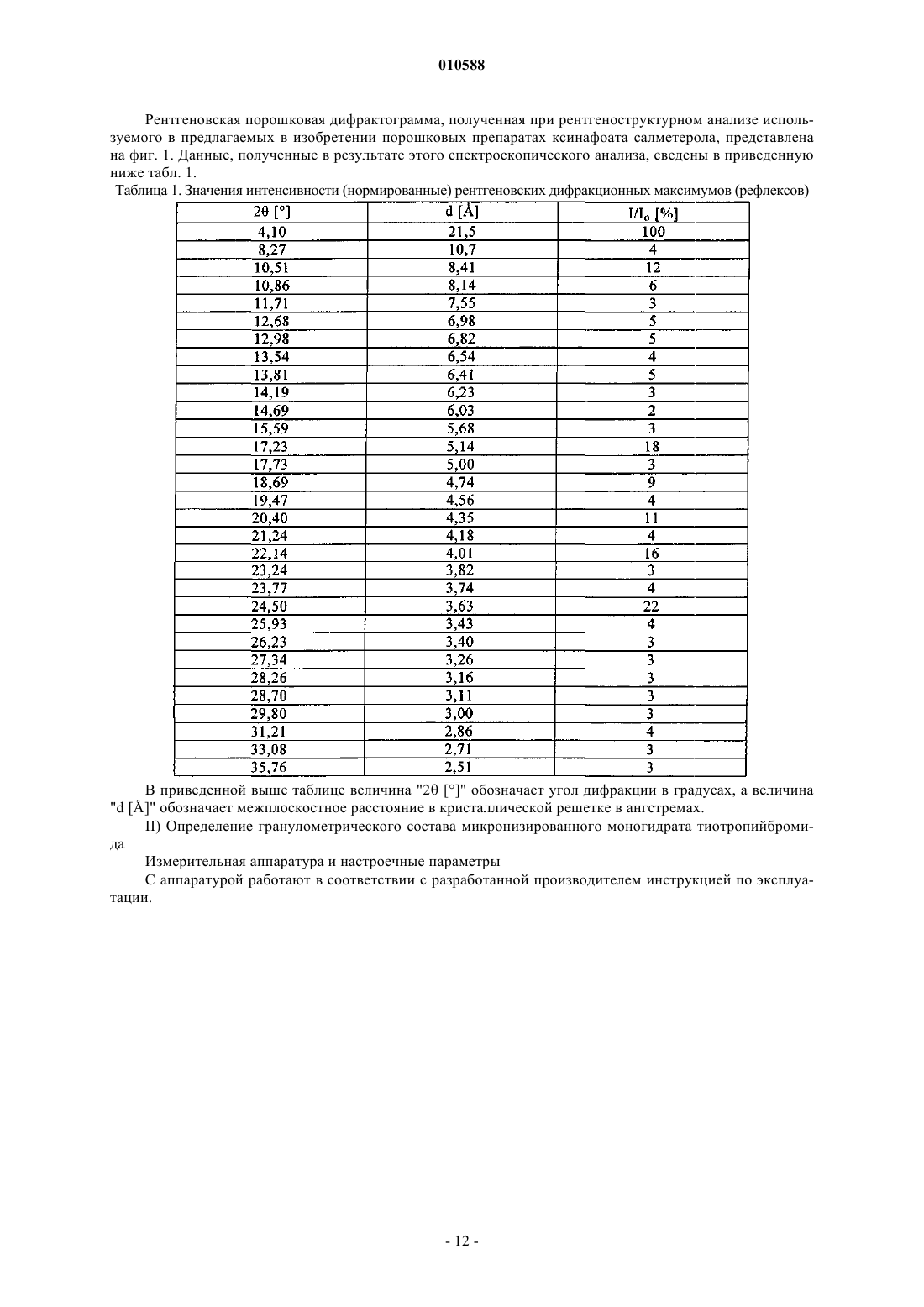
3. Капсула по п.1 или 2, при том, что на рентгеновской порошковой дифрактограмме используемого ксинафоата салметерола 2 имеются среди прочих следующие характеристические значения d: 21,5 Е, 8,41 Е, 5,14 Е, 4,35 Е, 4,01 Е и 3,63 Е.
4. Капсула по пп.1, 2 или 3, при том, что объем используемого ксинафоата салметерола 2 после уплотнения составляет не менее 0,134 г/см3, предпочтительно не менее 0,14 г/см3.
5. Капсула по одному из пп.1-4, отличающаяся тем, что содержание ксинафоата салметерола 2 составляет от 0,002 до 15%.
6. Капсула по одному из пп.1-5, отличающаяся тем, что содержание тиотропия 1' составляет от 0,001 до 5%.
7. Капсула по одному из пп.1-6, отличающаяся тем, что тиотропий 1' и ксинафоат салметерола 2 совместно содержатся в дозировках от 5 до 5000 мкг.
8. Капсула по одному из пп.1-7, отличающаяся тем, что физиологически безвредное вспомогательное вещество выбрано из группы, включающей моносахариды, дисахариды, олиго- и полисахариды, многоатомные спирты и соли.
9. Капсула по одному из пп.1-8, отличающаяся тем, что физиологически безвредное вспомогательное вещество выбрано из группы, включающей глюкозу, арабинозу, лактозу, сахарозу, мальтозу и трегалозу, необязательно в виде их гидратов.
10. Капсула по одному из пп.1-9, отличающаяся тем, что она содержит 10 мг ингаляционного порошка.
11. Набор для ингаляции, состоящий из капсулы по одному из пп.1-10 и ингалятора, который может использоваться для введения в организм ингаляционных порошков из содержащих их капсул.
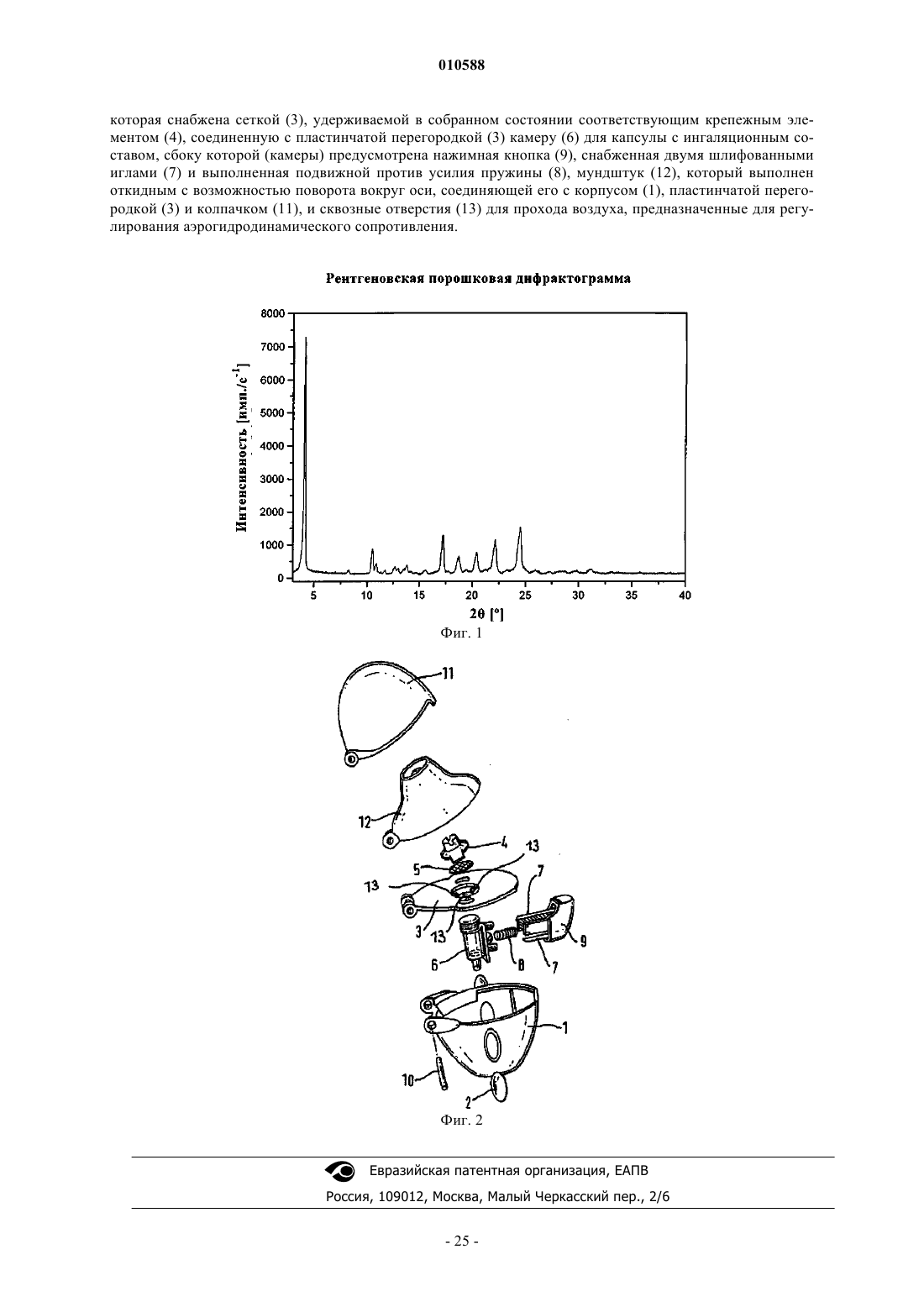
12. Набор для ингаляции по п.11, отличающийся тем, что ингалятор имеет корпус (1) с двумя окошками (2), пластинчатую перегородку (3), в которой предусмотрены впускные отверстия для воздуха и которая снабжена сеткой (3), удерживаемой в собранном состоянии соответствующим крепежным элементом (4), соединенную с пластинчатой перегородкой (3) камеру (6) для капсулы с ингаляционным составом, сбоку которой (камеры) предусмотрена нажимная кнопка (9), снабженная двумя шлифованными иглами (7) и выполненная подвижной против усилия пружины (8), мундштук (12), который выполнен откидным с возможностью поворота вокруг оси, соединяющей его с корпусом (1), пластинчатой перегородкой (3) и колпачком (11), и сквозные отверстия (13) для прохода воздуха, предназначенные для регулирования аэрогидродинамического сопротивления.
Текст
010588 Настоящее изобретение относится к порошковым препаратам для ингаляции, содержащим соль тиотропия и ксинафоат салметерола, к способу их получения, а также к их применению для получения лекарственного средства, предназначенного для лечения заболеваний дыхательных путей, прежде всего для лечения хронического обструктивного заболевания легких (ХОЗЛ) и астмы. Предпосылки создания изобретения Тиотропийбромид известен из заявки ЕР 418716 А 1 и имеет следующую химическую структуру: Тиотропийбромид, равно как и другие соли тиотропия, является высокоэффективным антихолинергическим средством с длительно сохраняющимся действием, которое можно использовать для лечения заболеваний дыхательных путей, прежде всего для лечения хронического обструктивного заболевания легких и астмы. Под тиотропием подразумевается свободный катион аммония. Бетамиметик салметерол также известен из уровня техники. Он используется, например, при терапии астмы. В WO 00/69468 описаны лекарственные комбинации из обладающих длительным действием бетамиметиков и обладающих длительным действием антихолинергических средств, проявляющие синергетический эффект при применении обоих этих лекарственных компонентов. Одной из конкретно описанных в WO 00/69468 лекарственных комбинаций является комбинация из тиотропийбромида и ксинафоата салметерола. Действующие вещества салметерол и тиотропий вводят в организм путем ингаляции. Для этой цели могут использоваться соответствующие ингаляционные порошки. Для получения указанных выше отвечающих необходимым требованиям составов, применяемых для ингаляционного введения в организм лекарственного действующего вещества, используется технология, базирующаяся на различных параметрах, которые в свою очередь связаны со свойствами самого лекарственного действующего вещества. В качестве примера таких параметров можно назвать, но не ограничиваясь только ими, сохранение исходным веществом его активности под влиянием различных окружающих факторов, стабильность действующего вещества в процессе получения фармацевтической композиции, а также его стабильность в конечных композициях лекарственного средства. Лекарственное действующее вещество, используемое для получения вышеуказанных лекарственных композиций, должно обладать максимально возможной степенью чистоты и должно сохранять стабильность при его длительном хранении в различных окружающих условиях. Обязательное соблюдение этого условия обусловлено необходимостью исключить применение лекарственных препаратов, в которых наряду с собственно действующим веществом присутствуют, например, и продукты его разложения. В подобном случае содержание действующего вещества в предварительно расфасованном в капсулы лекарственном препарате может оказаться ниже указанного производителем. Важное значение имеет далее равномерное распределение действующего вещества в лекарственной композиции и прежде всего при необходимости его введения в организм в низкой дозировке. При необходимости использования смеси действующих веществ равномерное их распределение в лекарственной композиции приобретает особо важное значение. Еще один аспект, который необходимо учитывать при получении действующих веществ, предназначенных для ингаляционного введения в организм в виде или в составе порошка, состоит в том, что в дыхательные пути и легкие при ингаляции способны попадать только частицы определенного размера. Размер таких частиц, способных проникать в дыхательные пути и легкие (ингалируемая доля порошка), лежит в субмикронном диапазоне. Поэтому для получения действующих веществ с частицами соответствующего размера такие действующие вещества также необходимо подвергать измельчению или размолу (так называемой микронизации). Поскольку несмотря на наличие жестких условий, преобладающих в процессе измельчения лекарственного действующего вещества, в ходе этого процесса необходимо практически полностью исключить деструкцию действующего вещества, сопутствующую его размолу (соответственно микронизации), обязательным требованием, которому должно удовлетворять действующее вещество, является его высокая стабильность, позволяющая ему сохранять свои свойства в процессе размола. Получение гомогенной лекарственной композиции с постоянно воспроизводимым заданным содержанием в ней действующего вещества возможно только при достаточно высокой стабильности действующего вещества в процессе его размола. Еще одна проблема, с которой можно столкнуться в процессе размола действующего вещества при получении требуемой лекарственной композиции, связана с сопровождающим подобный процесс подводом энергии к кристаллам и с приложением к их поверхности механической нагрузки. Указанные факто-1 010588 ры при определенных условиях могут приводить к полиморфным изменениям, к превращению кристаллической структуры в аморфную или к изменению кристаллической решетки. Поскольку для получения лекарственной композиции требуемого фармацевтического качества необходимо обеспечить наличие у кристаллов действующего вещества всегда одной и той же морфологии, с учетом этого аспекта к стабильности и свойствам кристаллического действующего вещества также следует предъявлять повышенные требования. Помимо указанных выше требований, предъявляемых к действующим веществам, в целом следует учитывать и тот факт, что любое изменение твердофазного состояния лекарственного средства, позволяющее улучшить его физическую и химическую стабильность, позволяет достичь существенных преимуществ перед обладающими меньшей стабильностью формами того же самого лекарственного средства. В основу настоящего изобретения была положена задача предложить содержащую соль тиотропия и ксинафоат салметерола лекарственную композицию, в которой оба входящих в ее состав действующих вещества удовлетворяли бы вышеуказанным условиям. Еще одна задача настоящего изобретения состояла прежде всего в том, чтобы предложить содержащую соль тиотропия и ксинафоат салметерола лекарственную композицию с максимально высокой стабильностью в ней обоих действующих веществ. Действующие вещества тиотропий и салметерол обладают особо высокой активностью. При применении действующих веществ, обладающих особо высокой активностью, для достижения требуемого терапевтического эффекта разовая доза препарата должна содержать действующее вещество лишь в небольшом количестве. В подобных случаях для получения ингаляционного порошка входящее в его состав действующее вещество необходимо разбавлять пригодными для этой цели вспомогательными веществами. Свойства ингаляционного порошка из-за высокого содержания в нем вспомогательного вещества в значительной степени зависят от выбора соответствующего вспомогательного вещества. При выборе вспомогательного вещества особое значение имеют размеры его частиц. При этом чем мельче частицы вспомогательного вещества, тем обычно хуже его подвижность (текучесть). Однако хорошая подвижность порошка является, как очевидно, одним из основополагающих факторов, определяющим высокую точность дозирования при расфасовывании препарата и его дроблении на разовые дозы, например, при изготовлении капсул с ингаляционными порошками (ингалеток) или при отмеривании пациентом индивидуальной дозы препарата до пользования ингалятором для порошков, содержимое которого рассчитано на многократное введение. Помимо этого размеры частиц вспомогательного вещества оказывают существенное влияние на степень опорожнения вставленных в ингалятор капсул при его использовании. Кроме того, размеры частиц вспомогательного вещества, как было установлено, существенно влияют и на ингалируемую долю действующего вещества в выдаваемой ингалятором порции ингаляционного порошка. Под "ингалируемой", соответственно "способной к ингаляции" долей действующего вещества в ингаляционном порошке имеется в виду содержание в нем тех частиц, которые при ингаляции достаточно глубоко проникают вместе с вдыхаемым воздухом в разветвления легких. Для достижения подобного эффекта размеры частиц порошка должны составлять от 1 до 10 мкм, предпочтительно должны быть меньше 6 мкм. В соответствии с этим в основу настоящего изобретения была положена также задача получить содержащий соль тиотропия и ксинафоат салметерола порошок, который при высокой точности его дозирования (что относится к расфасовываемому в каждую капсулу для ингаляции на предприятииизготовителе количеству действующего вещества и порошковой смеси, а также к выдаваемому из каждой капсулы при ингаляции и попадающему в дыхательные пути и легкие количеству действующего вещества) и при незначительном разбросе параметров между различными партиями продукции обеспечивал бы введение в организм действующего вещества с высокой его ингалируемой долей. Еще одна задача настоящего изобретения состояла в получении содержащего соль тиотропия и ксинафоат салметерола ингаляционного порошка, который обеспечивал бы высокую степень опорожнения содержащих его капсул вне зависимости от того, предполагается ли, например, его вводить в организм пациента с помощью ингалятора, описанного, например, в WO 94/28958, или применять in vitro с помощью импактора или импингера. Тот факт, что главным образом соли тиотропия, но также ксинафоат салметерола уже в исключительно низких дозах обладают высоким терапевтическим эффектом, предъявляет и другие требования к ингаляционному порошку, применяемому с высокой точностью дозирования и содержащему оба указанных действующих вещества. Из-за низкой, необходимой для достижения требуемого терапевтического эффекта концентрации действующих веществ в ингаляционном порошке важно обеспечить высокую степень однородности порошковой смеси и уменьшить до минимума колебание условий диспергирования от одной партии капсул с порошком к другой. При этом и однородность порошковой смеси, и минимальный разброс параметров дисперсности его частиц являются решающими факторами, которые обеспечивают выдачу ингалируемой доли действующих веществ в постоянно высоких количествах с высокой степенью воспроизводимости и тем самым с минимально возможными колебаниями. В соответствии с этим еще одна задача настоящего изобретения состояла в получении содержащего соль тиотропия и ксинафоат салметерола ингаляционного порошка, который отличался бы высокой сте-2 010588 пенью однородности и равномерностью составляющих его дисперсных частиц. Задача изобретения состояла также в получении ингаляционного порошка, который обеспечивал бы возможность введения в организм действующих веществ с исключительно малыми колебаниями их ингалируемой доли. Степень опорожнения содержащей порошок емкости (т.е. емкости, из которой выдается содержащий действующее вещество ингаляционный порошок в целях его введения в организм путем ингаляции) играет важную роль хотя и не исключительно, но все же не в последнюю очередь при введении в организм ингаляционных порошков из содержащих их капсул. При выходе порошкового препарата из содержащей его емкости лишь в небольшом из-за малой, соответственно низкой степени ее опорожнения количестве внутри емкости (например, капсулы) остаются значительные количества содержащего действующее вещество ингаляционного порошка, который уже не может использоваться пациентом в терапевтических целях. В результате приходится увеличивать дозировку действующего вещества в порошковой смеси с тем, чтобы количество действующего вещества в одной порции ингаляционного порошка, выдаваемого из содержащей его емкости, было достаточным для достижения требуемого терапевтического эффекта. С учетом этого еще одна задача настоящего изобретения состояла в получении содержащего соль тиотропия и ксинафоат салметерола ингаляционного порошка, свойства которого обеспечивали бы возможность эффективного опорожнения содержащей его емкости. Подробное описание изобретения Согласно изобретению неожиданно было установлено, что указанные выше задачи удается решить с помощью предлагаемых в изобретении порошковых препаратов для ингаляции (ингаляционных порошков), которые содержат соль тиотропия 1 и ксинафоат салметерола 2 и которые более подробно рассмотрены ниже. Согласно настоящему изобретению под солями тиотропия 1. подразумеваются соли, образованные фармакологически активным катионом - тиотропием 1'. В описании настоящего изобретения в тех случаях, когда речь конкретно идет о катионе тиотропии, для ссылки на него используется обозначение 1'. Предлагаемые в изобретении ингаляционные порошки содержат тиотропий 1' и ксинафоат салметерола 2, имеющий температуру плавления примерно 124 С, в смеси с физиологически безвредным вспомогательным веществом. Указанную выше температуру плавления определяли дифференциальной сканирующей калориметрией (ДСК) с помощью прибора Mettler DSC 820, используя для обработки полученных данных пакет программ STAR фирмы Mettler. Данные получали при скорости нагрева 10 К/мин. В предпочтительном варианте в составе предлагаемых в изобретении ингаляционных порошков используется ксинафоат салметерола 2, на рентгеновской порошковой дифрактограмме которого имеются среди прочих следующие характеристические значения d: 21,5, 8,41, 5,14, 4,35, 4,01 и 3,63 . Подробная информация, касающаяся определения этих характеристических значений путем рентгеновской порошковой дифрактометрии, представлена в экспериментальной части настоящего описания. Рентгеновская порошковая дифрактограмма ксинафоата салметерола, применение которого предпочтительно согласно настоящему изобретению, приведена на фиг. 1. В наиболее предпочтительном варианте используемый в предлагаемых в изобретении ингаляционных порошках ксинафоат салметерола 2 имеет объем после уплотнения не менее 0,134 г/см 3, предпочтительно не менее 0,14 г/см 3, наиболее предпочтительно не менее 0,145 г/см 3. Объем порошкового материала после уплотнения определяют при этом в соответствии с методом испытаний согласно Европейской фармакопее 4 (2002): "кажущаяся плотность после оседания"/"плотность осевшего продукта" ("apparent density after settling"/"density of settled product"), которая идентична "плотности сыпучего материала после уплотнения путем легкого постукивания" ("tapped density") и которая измеряется в граммах на миллилитр, соответственно определяют как "объемную плотность сыпучих материалов по методу Карра" ("Carr packed bulk density") согласно стандарту ASTM(D6393-99, Standard Test Method for Bulk Solids Charakterizaion by Carr Indices), измеряемую в граммах на см 3. Объем после уплотнения является при этом мерой объема, который занимают твердые измельченные материалы после их уплотнения при определенных условиях. Ксинафоат салметерола, характеризующийся описанными выше параметрами, одинаково пригоден и для применения в качестве исходного материала в процессе микронизации, и для применения в виде микронизированного продукта с описанными выше физическими свойствами в процессе получения ингаляционного порошка. Полученный после микронизации продукт, равно как и подвергаемый микронизации ксинафоат салметерола, характеризуются описанными выше параметрами. Содержание описанного выше ксинафоата салметерола 2 в предлагаемых в изобретении ингаляционных порошках предпочтительно должно составлять от 0,002 до 15%. Предпочтительны согласно изобретению ингаляционные порошки, содержание в которых компонента 2 составляет от 0,01 до 10%. Наиболее предпочтительны ингаляционные порошки, в которых содержание компонента 2 составляет от 0,05 до 5%, предпочтительно от 0,1 до 3%, наиболее предпочтительно от 0,125 до 2%, особенно предпочтительно от 0,25 до 2%. В следующем предпочтительном варианте предлагаемые в изобретении ингаляционные порошки-3 010588 содержат тиотропий 1' в количестве от 0,001 до 5%. Согласно изобретению предпочтительны ингаляционные порошки, содержащие тиотропий 1' в количестве от 0,01 до 3%. Наиболее предпочтительны ингаляционные порошки с содержанием тиотропия 1' в количестве от 0,02 до 2,5%, предпочтительно от 0,03 до 2,5%, особенно предпочтительно от 0,04 до 2%. Под тиотропием 1' подразумевается свободный катион аммония. Под используемым в настоящем описании обозначением 1 подразумевается тиотропий в сочетании с соответствующим противоионом. Таким противоионом (анионом) предпочтительно является хлорид, бромид, иодид, метансульфонат или лора-толуолсульфонат. Из числа этих анионов предпочтителен бромид. В соответствии с этим в изобретении в предпочтительном варианте предлагаются ингаляционные порошки, содержащие тиотропийбромид 1 в количестве от 0,0012 до 6%, предпочтительно от 0,012 до 3,6%. Особый интерес согласно изобретению представляют ингаляционные порошки, содержащие тиотропийбромид 1 в количестве примерно от 0,024 до 3%, предпочтительно от 0,036 до 3%, наиболее предпочтительно примерно от 0,048 до 2,4%. Тиотропийбромид, который предпочтительно использовать в предлагаемых в изобретении ингаляционных порошках, может содержать молекулы использовавшегося для его кристаллизации растворителя. Для получения предлагаемых в изобретении содержащих тиотропий ингаляционных порошков предпочтительно использовать гидраты тиотропийбромида. Наиболее предпочтительно при этом использовать известный из WO 02/30928 кристаллический моногидрат тиотропийбромида. Этот кристаллический моногидрат тиотропийбромида отличается наличием проявляющегося при его термическом анализе путем ДСК при скорости нагрева 10 К/мин эндотермического максимума, приходящегося на температуру 2305 С. Помимо этого такой кристаллический моногидрат тиотропийбромида отличается наличием в его ИК-спектре полос, соответствующих волновым числам 3570, 3410, 3105, 1730, 1260, 1035 и 720 см-1. Подобный кристаллический моногидрат тиотропийбромида по данным рентгеноструктурного анализа монокристаллов имеет далее простую моноклинную ячейку следующих размеров: а = 18,0774 , b = 11,9711 , с = 9,9321 ,= 102,691, V = 2096,96 3. В соответствии с этим в изобретении в предпочтительном варианте предлагаются ингаляционные порошки, содержащие кристаллический моногидрат тиотропийбромида в количестве от 0,00125 до 6,25%, предпочтительно от 0,0125 до 3,75%. Согласно изобретению особый интерес представляют ингаляционные порошки с содержанием в них моногидрата тиотропийбромида примерно от 0,025 до 3,125%,предпочтительно примерно от 0,0375 до 3,125%, наиболее предпочтительно примерно от 0,05 до 2,5%. В соответствии с настоящим изобретением приведенные выше в процентах данные во всех случаях,если конкретно не указано иное, представляют собой массовые проценты (мас.%). Обычно при применении предлагаемых в изобретении лекарственных средств, содержащих комбинации действующих веществ 1 и 2, тиотропий 1' и ксинафоат салметерола 2 совместно вводят в организм в дозировке, составляющей из расчета на один прием от 5 до 5000 мкг, предпочтительно от 10 до 2000 мкг, более предпочтительно от 15 до 1000 мкг, преимущественно от 20 до 500 мкг, согласно изобретению предпочтительно от 25 до 250 мкг, более предпочтительно от 30 до 125 мкг, наиболее предпочтительно 40 до 70 мкг. Предлагаемые в изобретении комбинации действующих веществ 1 и 2 могут содержать тиотропий 1' и ксинафоат салметерола 2', например, в таких количествах (но не ограничиваясь только ими), чтобы обеспечить за один прием введение в организм 4,5 мкг компонента 1' и 25 мкг компонента 2, 4,5 мкг компонента 1' и 30 мкг компонента 2, 4,5 мкг компонента 1', и 35 мкг компонента 2, 4,5 мкг компонента 1' и 40 мкг компонента 2, 4,5 мкг компонента 1' и 43,5 мкг компонента 2, 4,5 мкг компонента 1' и 50 мкг компонента 2, 4,5 мкг компонента 1' и 60 мкг компонента 2, 4,5 мкг компонента 1' и 70 мкг компонента 2,4,5 мкг компонента 1' и 80 мкг компонента 2, 4,5 мкг компонента 1' и 90 мкг компонента 2, 4,5 мкг компонента 1', и 100 мкг компонента 2, 4,5 мкг компонента 1' и 110 мкг компонента 2, 10 мкг компонента 1' и 25 мкг компонента 2, 10 мкг компонента 1' и 30 мкг компонента 2, 10 мкг компонента 1' и 35 мкг компонента 2, 10 мкг компонента 1', и 40 мкг компонента 2, 10 мкг компонента 1' и 50 мкг компонента 2, 10 мкг компонента 1' и 60 мкг компонента 2, 10 мкг компонента 1' и 70 мкг компонента 2, 10 мкг компонента 1' и 80 мкг компонента 2, 10 мкг компонента 1' и 90 мкг компонента 2, 10 мкг компонента 1' и 100 мкг компонента 2, 10 мкг компонента 1' и 110 мкг компонента 2, 18 мкг компонента 1', и 25 мкг компонента 2, 18 мкг компонента 1', и 30 мкг компонента 2, 18 мкг компонента 1' и 35 мкг компонента 2, 18 мкг компонента 1' и 40 мкг компонента 2, 18 мкг компонента 1' и 50 мкг компонента 2, 18 мкг компонента 1' и 60 мкг компонента 2,18 мкг компонента 1' и 70 мкг компонента 2, 18 мкг компонента 1' и 80 мкг компонента 2, 18 мкг компонента 1', и 90 мкг компонента 2, 18 мкг компонента 1' и 100 мкг компонента 2, 18 мкг компонента 1' и 110 мкг компонента 2, 36 мкг компонента 1' и 25 мкг компонента 2, 36 мкг компонента 1' и 30 мкг компонента 2, 36 мкг компонента 1' и 35 мкг компонента 2, 36 мкг компонента 1', и 40 мкг компонента 2, 36 мкг компонента 1' и 50 мкг компонента 2, 36 мкг компонента 1' и 60 мкг компонента 2, 36 мкг компонента 1' и 70 мкг компонента 2, 36 мкг компонента 1' и 80 мкг компонента 2, 36 мкг компонента 1' и 90 мкг компонента 2, 36 мкг компонента 1' и 100 мкг компонента 2, 36 мкг компонента 1' и 110 мкг компонента 2.-4 010588 Если в качестве предпочтительной согласно изобретению комбинации действующих веществ 1 и 2 используется комбинация, в которой солью 1, является бромид, то указанные выше в качестве примера количества вводимых в организм за один прием действующих веществ 1' и 2 соответствуют следующим количествам действующих веществ 1 и 2 из расчета на один прием: 5,4 мкг компонента 1 и 25 мкг компонента 2, 5,4 мкг компонента 1 и 30 мкг компонента 2, 5,4 мкг компонента 1 и 35 мкг компонента 2, 5,4 мкг компонента 1 и 40 мкг компонента 2, 5,4 мкг компонента 1 и 50 мкг компонента 2, 5,4 мкг компонента 1, и 60 мкг компонента 2, 5,4 мкг компонента 1, и 70 мкг компонента 2, 5,4 мкг компонента 1, и 80 мкг компонента 2, 5,4 мкг компонента 1 и 90 мкг компонента 2, 5,4 мкг компонента 1 и 100 мкг компонента 2, 5,4 мкг компонента 1 и 110 мкг компонента 2, 12 мкг компонента 1 и 25 мкг компонента 2, 12 мкг компонента 1 и 30 мкг компонента 2, 12 мкг компонента 1, и 35 мкг компонента 2, 12 мкг компонента 1 и 40 мкг компонента 2, 12 мкг компонента 1, и 50 мкг компонента 2, 12 мкг компонента 1 и 60 мкг компонента 2, 12 мкг компонента 1 и 70 мкг компонента 2, 12 мкг компонента 1 и 80 мкг компонента 2, 12 мкг компонента 1 и 90 мкг компонента 2, 12 мкг компонента 1 и 100 мкг компонента 2, 12 мкг компонента 1 и 110 мкг компонента 2, 21,7 мкг компонента 1 и 25 мкг компонента 2, 21,7 мкг компонента 1 и 30 мкг компонента 2, 21,7 мкг компонента 1, и 35 мкг компонента 2, 21,7 мкг компонента 1 и 40 мкг компонента 2, 21,7 мкг компонента 1 и 50 мкг компонента 2, 21,7 мкг компонента 1, и 60 мкг компонента 2, 21,7 мкг компонента 1 и 70 мкг компонента 2, 21,7 мкг компонента 1 и 80 мкг компонента 2, 21,7 мкг компонента 1 и 90 мкг компонента 2, 21,7 мкг компонента 1 и 100 мкг компонента 2, 21,7 мкг компонента 1 и 110 мкг компонента 2, 43,3 мкг компонента 1 и 25 мкг компонента 2, 43,3 мкг компонента 1, и 30 мкг компонента 2, 43,3 мкг компонента 1 и 35 мкг компонента 2, 43,3 мкг компонента 1 и 40 мкг компонента 2, 43,3 мкг компонента 1 и 50 мкг компонента 2, 43,3 мкг компонента 1 и 60 мкг компонента 2, 43,3 мкг компонента 1 и 70 мкг компонента 2, 43,3 мкг компонента 1 и 80 мкг компонента 2, 43,3 мкг компонента 1 и 90 мкг компонента 2, 43,3 мкг компонента 1 и 100 мкг компонента 2, 43,3 мкг компонента 1, и 110 мкг компонента 2. Если в качестве предпочтительной согласно изобретению комбинации действующих веществ 1 и 2 используется комбинация, в которой солью 1 является кристаллический моногидрат тиотропийбромида,то указанные выше в качестве примера количества вводимых в организм за один прием действующих веществ 1 и 2 соответствуют следующим количествам моногидрата тиотропийбромида 1 и действующего вещества 2 из расчета на один прием: 5,6 мкг компонента 1 и 25 мкг компонента 2, 5,6 мкг компонента 1 и 30 мкг компонента 2, 5,6 мкг компонента 1 и 35 мкг компонента 2, 5,6 мкг компонента ,1 и 40 мкг компонента 2, 5,6 мкг компонента 1 и 50 мкг компонента 2, 5,6 мкг компонента 1 и 60 мкг компонента 2,5,6 мкг компонента 1 и 70 мкг компонента 2, 5,6 мкг компонента 1 и 80 мкг компонента 2, 5,6 мкг компонента 1 и 90 мкг компонента 2, 5,6 мкг компонента 1 и 100 мкг компонента 2, 5,6 мкг компонента 1 и 110 мкг компонента 2, 12,5 мкг компонента 1 и 25 мкг компонента 2, 12,5 мкг компонента 1 и 30 мкг компонента 2, 12,5 мкг компонента 1 и 35 мкг компонента 2, 12,5 мкг компонента 1 и 40 мкг компонента 2, 12,5 мкг компонента 1 и 50 мкг компонента 2, 12,5 мкг компонента 1 и 60 мкг компонента 2, 12,5 мкг компонента 1 и 70 мкг компонента 2, 12,5 мкг компонента 1 и 80 мкг компонента 2, 12,5 мкг компонента 1, и 90 мкг компонента 2, 12,5 мкг компонента 1 и 100 мкг компонента 2, 12,5 мкг компонента 1 и 110 мкг компонента 2, 22,5 мкг компонента 1 и 25 мкг компонента 2, 22,5 мкг компонента 1 и 30 мкг компонента 2,22,5 мкг компонента 1 и 35 мкг компонента 2, 22,5 мкг компонента 1 и 40 мкг компонента 2, 22,5 мкг компонента 1. и 50 мкг компонента 2, 22,5 мкг компонента 1 и 60 мкг компонента 2, 22,5 мкг компонента 1 и 70 мкг компонента 2, 22,5 мкг компонента 1, и 80 мкг компонента 2, 22,5 мкг компонента 1 и 90 мкг компонента 2, 22,5 мкг компонента 1 и 100 мкг компонента 2, 22,5 мкг компонента 1 и 110 мкг компонента 2, 45 мкг компонента 1 и 25 мкг компонента 2, 45 мкг компонента 1 и 30 мкг компонента 2, 45 мкг компонента 1 и 35 мкг компонента 2, 45 мкг компонента 1 и 40 мкг компонента 2, 45 мкг компонента 1 и 50 мкг компонента 2, 45 мкг компонента 1 и 60 мкг компонента 2, 45 мкг компонента 1 и 70 мкг компонента 2, 45 мкг компонента 1 и 80 мкг компонента 2, 45 мкг компонента 1 и 90 мкг компонента 2, 45 мкг компонента 1 и 100 мкг компонента 2, 45 мкг компонента 1 и 110 мкг компонента 2. В качестве примера физиологически безвредных вспомогательных веществ, которые могут использоваться для получения ингаляционных порошков, применяемых в качестве предлагаемых в изобретении лекарственных средств, можно назвать моносахариды (например, глюкозу или арабинозу), дисахариды(например, лактозу, сахарозу, мальтозу, трегалозу), олиго- и полисахариды (например, декстраны), полиспирты (например, сорбит, маннит, ксилит) или соли (например, хлорид натрия, карбонат кальция). Предпочтительно применять моно- или дисахариды, при этом особенно предпочтительно применение лактозы или глюкозы, прежде всего, но не исключительно, в форме их гидратов. Особенно предпочтительным согласно изобретению является применение в качестве вспомогательного вещества лактозы,наиболее предпочтительно в виде ее моногидрата. Наиболее предпочтительно применять вспомогательные вещества со средним размером частиц от 10 до 50 мкм. Под средним размером (или средней крупностью) частиц при этом в данном контексте подразумевается размер 50% всех частиц, объемное распределение которых по крупности определяли с помощью лазерного дифрактометра методом сухого диспергирования. В наиболее предпочтительных ингаляционных порошках используют вспомогательное вещество со средним размером частиц от 12 до-5 010588 35 мкм, особенно предпочтительно от 13 до 30 мкм. Наиболее предпочтительно применять далее те вспомогательные вещества, в которых 10% приходится на долю мелкой фракции частиц с размером от 0,5 до 6 мкм. Под мелкой фракцией, на долю которой приходится 10%, при этом подразумевается фракция, составляющая 10% от всего количества частиц,объемное распределение которых по крупности определяли с помощью лазерного дифрактометра. Иными словами, под мелкой фракцией, на долю которой приходится 10%, в контексте настоящего изобретения имеется в виду фракция частиц с размером, который имеют не более 10% частиц от всего их количества (в пересчете на их объемное распределение по крупности). Наиболее предпочтительны далее прежде всего те ингаляционные порошки, в которых размер частиц вспомогательного вещества в мелкой фракции, на долю которой приходится 10% от всего количества частиц вспомогательного вещества, составляет примерно от 1 до 4 мкм, предпочтительно примерно от 1,5 до 3 мкм. Согласно изобретению предпочтительны далее те ингаляционные порошки, в которых используется вспомогательное вещество с удельной поверхностью от 0,2 до 1,5 м 2/г, предпочтительно от 0,3 до 1,0 м 2/г. В предлагаемых в изобретении порошковых препаратах предпочтительно использовать вспомогательные вещества с высокой степенью кристалличности. Степень кристалличности можно оценить на основе высвобождающейся при растворении вспомогательного вещества теплоты (энтальпии растворения). В случае моногидрата лактозы, который является наиболее предпочтительным для применения в предлагаемых в изобретении ингаляционных порошках вспомогательным веществом, предпочтительно применять лактозу с энтальпией растворения не менее 45 Дж/г, предпочтительно не менее 50 Дж/г, наиболее предпочтительно не менее 52 Дж/г. Одна из отличительных особенностей предлагаемых в изобретении ингаляционных порошков состоит в соответствии с положенной в основу изобретения задачей в возможности их введения в организм со стабильно высокой точностью однократной дозировки. При этом колебания вводимых за один раз количеств ингаляционного порошка составляют менее 8%, предпочтительно менее 6%, наиболее предпочтительно менее 4%, от номинального количества. При определенных условиях может оказаться целесообразным использовать вместо указанных выше вспомогательных веществ их смеси, состоящие из действующего вещества, представленного в виде частиц большей крупности со средним размером от 17 до 50 мкм, предпочтительно от 20 до 40 мкм, наиболее предпочтительно от 25 до 35 мкм, и вспомогательного вещества, представленного в виде частиц меньшей крупности со средним размером от 1 до 8 мкм, предпочтительно от 2 до 7 мкм, наиболее предпочтительно от 3 до 6 мкм. Под средним размером, соответственно средней крупностью частиц и в этом случае подразумевается размер 50% всех частиц, объемное распределение которых по крупности определяли с помощью лазерной дифракции по методу сухого диспергирования. При применении вышеуказанных смесей вспомогательных веществ размер частиц в мелкой фракции вспомогательного вещества,представленного в виде частиц большей крупности, на долю которой приходится 10% от всего количества частиц этого вспомогательного вещества, составляет примерно от 2 до 5 мкм, предпочтительно примерно от 3 до 4 мкм, а размер частиц в мелкой фракции вспомогательного вещества, представленного в виде частиц меньшей крупности, на долю которой приходится 10% от всего количества частиц этого вспомогательного вещества, составляет примерно от 0,5 до 1,5 мкм. Предпочтительны ингаляционные порошки, в которых на долю вспомогательного вещества, представленного в виде частиц меньшей крупности, в составе всей композиции приходится от 2 до 10%, предпочтительно от 3 до 7%, наиболее предпочтительно от 4 до 6%. Под упоминаемой в описании настоящего изобретения смесью вспомогательных веществ во всех случаях имеется в виду смесь, полученная смешением между собой заранее точно определенных компонентов. В соответствии с этим под смесью, например, вспомогательных веществ, одно из которых представлено в виде частиц большей крупности, а другое - в виде частиц меньшей крупности, подразумеваются только такие смеси, которые получают смешением вспомогательного вещества, являющегося компонентом с частицами большей крупности, со вспомогательным веществом, являющимся компонентом с частицами меньшей крупности. Вспомогательные вещества, представленные в виде частиц большей и меньшей крупности, могут представлять собой химически идентичные или химически различные вещества из числа уже упоминавшихся выше в качестве вспомогательных веществ, при этом предпочтительны ингаляционные порошки, в которых вспомогательное вещество, представленное в виде частиц большей крупности, и вспомогательное вещество, представленное в виде частиц меньшей крупности, являются одним и тем же химическим соединением. Так, например, при использовании в качестве вспомогательного вещества моногидрата лактозы его же предпочтительно применять и в случае специально предусмотренного добавления вспомогательного вещества в виде фракции с указанным выше меньшим средним размером частиц. Для получения предлагаемых в изобретении лекарственных средств сначала необходимо получить ксинафоат салметерола 2 в форме, соответствующей указанным выше для этого компонента 2 спецификациям. Для этого согласно изобретению предпочтительно работать следующим образом. Салметерол в виде известного из уровня техники свободного основания совместно с 1-гидрокси-2-нафтойной кислотой растворяют в растворителе, представляющем собой смесь из спирта и простого эфира. На моль исполь-6 010588 зуемого салметерола применяют по меньшей мере 1 моль, предпочтительно от 1 до 1,1 моля, наиболее предпочтительно 1 моль, 1-гидрокси-2-нафтойной кислоты. В качестве спирта согласно изобретению можно использовать спирты с короткой цепью, предпочтительно этанол, н-пропанол или изопропанол,наиболее предпочтительно этанол. В качестве простого эфира согласно изобретению наиболее предпочтительно использовать диэтиловый эфир, метилэтиловый эфир, тетрагидрофуран, диоксан или третбутилметиловый эфир, самым предпочтительным из которых согласно изобретению является третбутилметиловый эфир. Спирт и простой эфир предпочтительно использовать согласно изобретению в(объемном) соотношении между ними, составляющем примерно от 1:2 до 2:1, наиболее предпочтительно примерно от 1:1,5 до 1,5:1. В особенно предпочтительном варианте указанное соотношение между спиртом и простым эфиром должно составлять 1:1. Общее количество используемого растворителя определяется, как очевидно, объемом реакционной смеси. На моль используемого в виде свободного основания салметерола растворитель предпочтительно применять в количестве примерно от 5 до 20 л, наиболее предпочтительно примерно от 7 до 15 л. В особенно предпочтительном варианте на моль используемого салметерола применяют примерно от 9 до 12 л растворителя, объемное соотношение в котором между обоими компонентами, которыми являются спирт и простой эфир, может соответствовать указанным выше значениям. Полученную суспензию после добавления всех вышеуказанных компонентов при перемешивании нагревают до температуры, равной или большей 40 С, предпочтительно до температуры,равной или большей 50 С, наиболее предпочтительно до температуры порядка 55-56 С. Нагрев продолжают до образования прозрачного раствора. Этот раствор затем фильтруют и фильтр при необходимости промывают небольшим количеством указанного выше растворителя (который используют в количестве примерно от 1 до 1,5 л на моль применяемого салметерола). После этого полученный фильтрат охлаждают до температуры примерно 30-40 С, предпочтительно примерно 35-38 С, и перемешивают при этой температуре до начала кристаллизации ксинафоата салметерола. На этом этапе при определенных условиях может оказаться целесообразным добавление к суспензии затравочных кристаллов ксинафоата салметерола. С началом кристаллизации суспензию при перемешивании охлаждают до еще более низкой температуры, предпочтительно до температуры примерно от -10 до примерно 10 С, наиболее предпочтительно до температуры от примерно 0 до примерно 5 С. Кристаллизация завершается по истечении примерно 20-60 мин, после чего полученный продукт отделяют фильтрацией через соответствующий фильтр и при необходимости промывают спиртом и/или простым эфиром. Полученный таким путем ксинафоат салметерола соответствует указанным выше спецификациям, которыми отличаются предлагаемые в изобретении ингаляционные порошки. В соответствии с этим еще одним объектом настоящего изобретения являются ингаляционные порошки, который наряду с тиотропием 1' содержат также ксинафоат салметерола 2, получаемый описанным выше способом. После отмеривания взвешиванием необходимых порций исходных материалов из вспомогательного вещества и действующего вещества с использованием известных из уровня техники методов приготавливают ингаляционный порошок. При этом можно сослаться, например, на публикацию WO 02/30390. В соответствии с этим предлагаемые в изобретении ингаляционные порошки можно получать, например,описанным ниже методом. В рассмотренных ниже методах получения ингаляционных порошков указанные компоненты применяют в массовых количествах, которые соответствуют количествам, указанным выше при описании составов ингаляционных порошков. Сначала в соответствующий смеситель загружают вспомогательное вещество и соль тиотропия 1. Средний размер частиц используемого действующего вещества 1 составляет от 0,5 до 10 мкм, предпочтительно от 1 до 6 мкм, наиболее предпочтительно от 2 до 5 мкм. Действующее вещество 1 и вспомогательное вещество предпочтительно подавать в смеситель через сито или ситовый гранулятор с размером отверстий сита от 0,1 до 2 мм, более предпочтительно от 0,3 до 1 мм, наиболее предпочтительно от 0,3 до 0,6 мм. При этом в смеситель предпочтительно сначала загружать вспомогательное вещество, а затем подавать в него действующее вещество. При такой технологии смешения оба компонента смеси предпочтительно подавать в смеситель отдельными порциями. Наиболее предпочтительно подавать в смеситель оба компонента путем их поочередного, послойного просеивания. Вспомогательное вещество и действующее вещество 1 можно смешивать между собой уже в процессе подачи обоих этих компонентов в смеситель. Более предпочтительно, однако, начинать смешение обоих компонентов только после их послойного просеивания. При использовании в качестве вспомогательного вещества смеси вспомогательных веществ, одно из которых представлено в виде частиц большей крупности со средним размером от 17 до 50 мкм, наиболее предпочтительно от 20 до 35 мкм, а другое - в виде частиц меньшей крупности со средним размером от 1 до 8 мкм, предпочтительно от 2 до 7 мкм, наиболее предпочтительно от 3 до 6 мкм, сначала приготавливают подобную смесь обоих вспомогательных веществ, подавая их в смеситель путем их поочередного, послойного просеивания с последующим их смешением. После получения описанной выше содержащей действующее вещество 1 порошковой смеси к ней аналогичным путем добавляют ксинафоат салметерола 2. Средний размер частиц действующего вещества 2 при этом также составляет от 0,5 до 10 мкм, предпочтительно от 1 до 6 мкм, наиболее предпочти-7 010588 тельно от 2 до 5 мкм. Действующее вещество 2 и содержащую компонент 1 порошковую смесь предпочтительно подавать в смеситель через сито или ситовый гранулятор с размером отверстий сита от 0,1 до 2 мм, более предпочтительно от 0,3 до 1 мм, наиболее предпочтительно от 0,3 до 0,6 мм. При этом в смеситель предпочтительно сначала загружать содержащую компонент 1 порошковую смесь, а затем подавать в него действующее вещество 2. При такой технологии смешения оба компонента смеси предпочтительно подавать в смеситель отдельными порциями. Наиболее предпочтительно подавать в смеситель оба компонента путем их поочередного, послойного просеивания. Содержащую компонент 1 порошковую смесь и действующее вещество 2 можно смешивать между собой уже в процессе подачи обоих этих компонентов в смеситель. Более предпочтительно, однако, начинать смешение обоих компонентов только после их послойного просеивания. В другом варианте осуществления изобретения предлагаемый в нем ингаляционный порошок можно также получать, приготавливая сначала аналогично рассмотренной выше методике порошковую смесь из вспомогательного вещества и действующего вещества 2 и затем добавляя к ней в соответствии с описанной выше методикой компонент 1. Согласно еще одному варианту осуществления изобретения предлагаемый в нем ингаляционный порошок можно также получать, загружая сначала в смеситель первую порцию вспомогательного вещества, затем подавая в смеситель первую порцию действующего вещества 1 или первую порцию действующего вещества 2, после чего вновь просевая в смеситель следующую порцию вспомогательного вещества и в завершение добавляя первую порцию действующего вещества 2, соответственно первую порцию действующего вещества 1. Добавление в смеситель компонентов приготавливаемой смеси, которыми являются вспомогательное вещество, действующее вещество 1 и действующее вещество 2, в такой последовательности повторяют затем до загрузки в смеситель всех компонентов в необходимых количествах. И в этом случае все три компонента наиболее предпочтительно подавать в смеситель путем их поочередного, послойного просеивания. Все эти три компонента можно смешивать между собой уже в процессе их подачи в смеситель. Более предпочтительно, однако, начинать смешение трех указанных компонентов только после их послойного просеивания. В том случае, когда используемые при получении ингаляционного порошка описанным выше методом действующие вещества 1 и 2 не представлены сразу же после их химического получения в кристаллической форме с частицами, размер которых соответствует указанным выше значениям, их можно подвергать размолу (так называемой микронизации) для доведения среднего размера их частиц до величины,которая удовлетворяет вышеуказанным параметрам. При применении в качестве действующего вещества 1 наиболее предпочтительного согласно изобретению кристаллического моногидрата тиотропийбромида,который описан в WO 02/30928, для микронизации такой кристаллической модификации действующего вещества 1 наиболее целесообразно использовать рассмотренный ниже метод. Для проведения этого процесса можно использовать традиционные мельницы. Микронизацию предпочтительно при этом проводить в условиях, исключающих доступ влаги, наиболее предпочтительно с использованием соответствующего инертного газа, например азота. Для применения в указанных выше целях как особо предпочтительные зарекомендовали себя пневматические струйные мельницы, в которых измельчение размалываемого материала происходит в результате соударений его частиц между собой, а также в результате их удара о стенку помольной камеры. В качестве рабочего газа в подобного типа мельницах согласно изобретению предпочтительно использовать азот. Размалываемый материал перемещается/транспортируется рабочим газом при особых значениях давления (рабочего давления). В соответствии с настоящим изобретением такое рабочее давление обычно устанавливают на значение в интервале от примерно 2 до примерно 8 бар, предпочтительно от примерно 3 до примерно 7 бар, наиболее предпочтительно от примерно 3,5 до примерно 6,5 бара. Размалываемый материал подается в пневматическую струйную мельницу с помощью транспортирующего газа при особых значениях давления (давления подачи). Согласно настоящему изобретению оптимальное давление подачи составляет от примерно 2 до примерно 8 бар, предпочтительно от примерно 3 до примерно 7 бар, наиболее предпочтительно от примерно 3,5 до примерно 6 бар. В качестве транспортирующего газа также предпочтительно использовать инертный газ, в качестве которого также наиболее предпочтительно применять азот. Размалываемый материал (кристаллический моногидрат тиотропийбромида 1) можно при этом подавать в мельницу со скоростью или расходом примерно от 5 до 35 г/мин, предпочтительно примерно от 10 до 30 г/мин. В качестве не ограничивающего объем изобретения примера пневматической струйной мельницы, которую можно использовать в предусмотренных изобретением целях, можно назвать 2-дюймовую микронную коллоидную мельницу, снабженную рабочим кольцом с отверстием 0,8 мм, фирмы Sturtevant Inc., расположенной по адресу: 348 Circuit Street, Hanover, MA 02239, USA. При использовании этой мельницы процесс размола предпочтительно проводят при следующих параметрах:-8 010588 Полученный таким путем размолотый продукт после этого подвергают дальнейшей переработке при указанных ниже особых условиях. С этой целью полученный микронизированный продукт выдерживают в атмосфере водяного пара с температурой от 15 до 40 С, предпочтительно от 20 до 35 С, наиболее предпочтительно от 25 до 30 С, при относительной влажности, равной по меньшей мере 40%. Более предпочтительно выдерживать микронизированный продукт при относительной влажности, составляющей от 50 до 95%, более предпочтительно от 60 до 90%, наиболее предпочтительно от 70 до 80%. Под относительной влажностью (ОВ) при этом подразумевается отношение упругости водяного пара(парциального давления водяного пара) к упругости насыщенного водяного пара при той же температуре. Полученный в результате описанного выше процесса размола микронизированный продукт предпочтительно выдерживать при указанных выше условиях в течение по меньшей мере 6 ч. Более предпочтительно, однако, выдерживать микронизированный продукт при описанных выше условиях в течение периода времени, составляющего от примерно 12 до примерно 48 ч, более предпочтительно от примерно 18 до примерно 36 ч, наиболее предпочтительно от примерно 20 до примерно 28 ч. Частицы получаемого описанным выше методом предлагаемого в изобретении микронизированного тиотропийбромида 1, имеют средний размер в пределах от 1,0 до 3,5 мкм, предпочтительно от 1,1 до 3,3 мкм, наиболее предпочтительно от 1,2 до 3,0 мкм, при значении Q(5,8) более 60%, предпочтительно более 70%, наиболее предпочтительно более 80%. Показатель Q(5,8) соответствует при этом количеству частиц, размер которых в пересчете на объемное распределение частиц по крупности составляет менее 5,8 мкм. Размер частиц согласно настоящему изобретению определяли методом лазерной дифракции(дифракция Фраунгофера). Более подробная информация касательно метода определения размеров частиц приведена в последующем описании в разделе, посвященном экспериментальной части. Другим характерным показателем полученного описанным выше методом микронизированного тиотропия, применение которого предпочтительно согласно настоящему изобретению, является значение его удельной поверхности, лежащее в пределах от 2 до 5 м 2/г, предпочтительно от 2,5 до 4,5 м 2/г, наиболее предпочтительно от 3,0 до 4,0 м 2/г. Одним из наиболее предпочтительных объектов настоящего изобретения являются предлагаемые в нем ингаляционные порошки, отличающиеся тем, что они содержат в качестве компонента 1 описанный выше микронизированный моногидрат тиотропийбромида. Для микронизации используемого согласно изобретению ксинафоата салметерола 2 наиболее целесообразно использовать рассмотренный ниже метод. Для проведения этого процесса можно использовать традиционные мельницы. Микронизацию предпочтительно при этом проводить в условиях, исключающих доступ влаги, наиболее предпочтительно с использованием соответствующего инертного газа, например азота. Для применения в указанных выше целях как особо предпочтительные зарекомендовали себя пневматические струйные мельницы, в которых измельчение размалываемого материала происходит в результате соударений его частиц между собой, а также в результате их удара о стенку помольной камеры. В качестве рабочего газа в подобного типа мельницах согласно изобретению предпочтительно использовать азот. Размалываемый материал перемещается/транспортируется рабочим газом при особых значениях давления (рабочего давления). В соответствии с настоящим изобретением такое рабочее давление обычно устанавливают на значение в интервале от примерно 2 до примерно 12 бар, предпочтительно от примерно 5 до примерно 10 бар, наиболее предпочтительно от примерно 5 до примерно 8,5 бара. Размалываемый материал подается в пневматическую струйную мельницу с помощью транспортирующего газа при особых значениях давления (давления подачи). Согласно настоящему изобретению оптимальное давление подачи составляет от примерно 2 до примерно 12 бар, предпочтительно от примерно 5,5 до примерно 10,5 бара, наиболее предпочтительно от примерно 5,5 до примерно 9 бар. В качестве транспортирующего газа также предпочтительно использовать инертный газ, в качестве которого также наиболее предпочтительно применять азот. Размалываемый материал (кристаллический ксинафоат салметерола) можно при этом подавать в мельницу со скоростью или расходом примерно от 5 до 100 г/мин, предпочтительно примерно от 10 до 60 г/мин. В соответствии с этим еще одним наиболее предпочтительным объектом настоящего изобретения являются предлагаемые в нем ингаляционные порошки, отличающиеся тем, что они содержат микронизированный ксинафоат салметерола 2, полученный путем микронизации описанным выше методом. Настоящее изобретение относится также к применению предлагаемых в нем ингаляционных порошков для получения лекарственного средства, предназначенного для лечения заболеваний дыхательных путей, прежде всего для лечения ХОЗЛ и/или астмы. Предлагаемые в изобретении ингаляционные порошки можно вводить в организм, например, с помощью ингаляторов, в которых разовая доза из расходной емкости выдается с помощью дозирующей камеры (например, согласно US 4570630) или с помощью других устройств (например, согласно DE 3625685 А). Очевидно, что предлагаемые в изобретении ингаляционные порошки предпочтительно расфасовывать в капсулы (с получением так называемых ингалеток), которые применяются в ингаляторах,описанных, например, в WO 94/28958. Для введения в организм предлагаемых в изобретении ингаляционных порошков из содержащих их капсул наиболее предпочтительно использовать ингалятор, показанный на фиг. 2. Показанный на этом-9 010588 чертеже ингалятор отличается наличием корпуса 1 с двумя окошками 2, пластинчатой перегородки 3, в которой предусмотрены впускные отверстия для воздуха и которая снабжена сеткой 5, удерживаемой в собранном состоянии соответствующим крепежным элементом 4, соединенной с пластинчатой перегородкой 3 камеры 6 для капсулы с ингаляционным порошком, сбоку которой (камеры) предусмотрена нажимная кнопка 9, снабженная двумя шлифованными иглами 7 и выполненная подвижной против усилия пружины 8, мундштука 12, который выполнен откидным с возможностью поворота вокруг оси 10,соединяющей его с корпусом 1, пластинчатой перегородкой 3 и колпачком 11, и сквозных отверстий 13 для прохода воздуха, служащих для регулирования аэрогидродинамического сопротивления. Настоящее изобретение относится далее к применению предлагаемых в нем ингаляционных порошков для получения лекарственного средства, предназначенного для лечения заболеваний дыхательных путей, прежде всего для лечения ХОЗЛ и/или астмы, отличающемуся тем, что используют описанный выше и показанный на фиг. 2 ингалятор. При расфасовывании предлагаемых в изобретении ингаляционных порошков в капсулы наиболее предпочтительно использовать капсулы, материал которых выбирают из группы синтетических полимеров, особенно предпочтительно из группы, включающей полиэтилен, поликарбонат, сложные полиэфиры, полипропилен и полиэтилентерефталат. Наиболее предпочтительным синтетическим полимером в качестве материала для изготовления капсул является полиэтилен, поликарбонат или полиэтилентерефталат. При изготовлении капсул из полиэтилена, который является одним из предпочтительных согласно изобретению материалов, предпочтительно применять полиэтилен с плотностью от 900 до 1000 кг/м 3,более предпочтительно от 940 до 980 кг/м 3, наиболее предпочтительно примерно от 960 до 970 кг/м 3 (полиэтилен высокой плотности). Подобные полимерные материалы согласно изобретению можно перерабатывать в капсулы разнообразными, известными из уровня техники методами. Предпочтительным согласно изобретению методом переработки полимеров является литье под давлением. При изготовлении капсул литьем под давлением согласно наиболее предпочтительному варианту не используют антиадгезионные смазки для извлечения капсул из формы. Для подобного метода изготовления капсул характерна хорошо отработанная на практике технология и особо высокая воспроизводимость. Еще одним объектом настоящего изобретения являются описанные выше капсулы, содержащие предлагаемый в изобретении ингаляционный порошок, описанный выше. Содержание ингаляционного порошка в таких капсулах может составлять примерно от 1 до 20 мг, предпочтительно примерно от 3 до 15 мг, наиболее предпочтительно примерно от 4 до 12 мг. Предпочтительные согласно изобретению капсулы содержат от 4 до 6 мг ингаляционного порошка. Равным образом предпочтительны согласно изобретению и капсулы для ингаляции, содержащие предлагаемые в изобретении порошковые препараты в количестве от 8 до 12 мг, наиболее предпочтительно от 9 до 11 мг. Настоящее изобретение относится также к набору для ингаляции, состоящему из одной или нескольких описанных выше капсул, содержащих предлагаемые в изобретении ингаляционные порошки, и ингалятора, показанного на фиг. 2. Настоящее изобретение относится далее к применению описанных выше капсул, содержащих предлагаемые в изобретении ингаляционные порошки, для получения лекарственного средства, предназначенного для лечения заболеваний дыхательных путей, прежде всего для лечения ХОЗЛ и/или астмы. Заполненные предлагаемыми в изобретении ингаляционными порошками капсулы изготавливают известными из уровня техники методами путем расфасовывания предлагаемых в изобретении ингаляционных порошков в пустые капсулы. Ниже изобретение более подробно рассмотрено на примерах, при этом, однако, объем изобретения не ограничен рассмотренными в этих примерах конкретными вариантами его осуществления. Исходные материалыIa В приведенных ниже примерах 1-24 в качестве вспомогательного вещества используют моногидрат лактозы. В качестве такового можно использовать, например, продукт, выпускаемый фирмой BorculoDomo Ingredients, расположенной по адресу: Borculo, NL, под торговым наименованием Lactochem ExtraFine Powder. Лактоза этого сорта удовлетворяет соответствующим изобретению спецификациям касательно размера ее частиц и удельной поверхности. Помимо этого такая лактоза имеет указанные выше,предпочтительные согласно изобретению для лактозы значения энтальпии растворения. В рассмотренных ниже примерах использовали, например, порошковую лактозу со следующими параметрами: а) средний размер частиц: 17,9 мкм, размер частиц в мелкой фракции, на долю которой приходится 10%: 2,3 мкм, удельная поверхность: 0,61 м 2/г; б) средний размер частиц: 18,5 мкм, размер частиц в мелкой фракции, на долю которой приходится 10%: 2,2 мкм, удельная поверхность: 0,83 м 2/г; в) средний размер частиц: 21,6 мкм, размер частиц в мелкой фракции, на долю которой приходится 10%: 2,5 мкм, удельная поверхность: 0,59 м 2/г; г) средний размер частиц: 16,0 мкм, размер частиц в мелкой фракции, на долю которой приходится 10%: 2,0 мкм, удельная поверхность: 0,79 м 2/г.Iб В приведенных ниже примерах 25-36 в качестве вспомогательного вещества, представленного в виде частиц большей крупности, используют моногидрат лактозы (200 М). В качестве такового можно использовать, например, продукт, выпускаемый фирмой DMV International, расположенной по адресу: 5460Veghel, NL, под торговым наименованием Pharmatose 200M. Средний размер частиц этой лактозы составляет примерно от 30 до 35 мкм. Используемая в примерах лактоза 200 М имеет, например, средний размер частиц, равный 31 мкм, при размере частиц в мелкой фракции, на долю которой приходится 10%,3,2 мкм или же имеет средний размер частиц, равный 34 мкм, при размере частиц в мелкой фракции, на долю которой приходится 10%, 3,5 мкм. В приведенных ниже примерах 25-36 в качестве вспомогательного вещества, представленного в виде частиц меньшей крупности, используют моногидрат лактозы со средним размером частиц, равным 3-4 мкм. Его можно получать традиционными методами (микронизацией) из коммерчески доступного моногидрата лактозы, например, из вышеуказанной лактозы 200 М. Используемая в примерах микронизированная лактоза имеет, например, средний размер частиц, равный, 3,7 мкм, при размере частиц в мелкой фракции, на долю которой приходится 10%, 1,1 мкм или же имеет средний размер частиц, равный 3,2 мкм, при размере частиц в мелкой фракции, на долю которой приходится 10%, 1,0 мкм.II) Получение предлагаемого в изобретении ксинафоата салметерола 20 г салметерола в виде свободного основания и 9,1 г 1 -гидрокси-2-нафтойной кислоты суспендируют в 260 мл абсолютного этанола и 260 мл трет-бутилметилового эфира. Полученную суспензию нагревают до 55-56 С и перемешивают до образования прозрачного раствора. Этот раствор затем фильтруют и фильтр промывают 30 мл абсолютного этанола и 30 мл трет-бутилметилового эфира. Фильтрат охлаждают до 38 С и в качестве затравки вводят несколько кристаллов ксинафоата салметерола. Раствор перемешивают в течение 1 ч при 34-37 С, что сопровождается началом кристаллизации. Затем суспензию охлаждают до 1-3 С и перемешивают при этой температуре около 30 мин. Осадок отделяют вакуумфильтрацией через нутч-фильтр и промывают 20 мл этанола и 120 мл трет-бутилметилового эфира. Полученное твердое вещество сушат при 45 С в атмосфере азота. Выход: 26 г (89,5%). Полученный таким путем кристаллический ксинафоат салметерола имеет объем после уплотнения,равный 0,27 г/см 3.III) Микронизация ксинафоата салметерола Полученный описанным выше методом ксинафоат салметерола микронизируют в пневматической струйной мельнице типа МС JETMILL 50 фирмы Jetpharma, расположенной по адресу: Via Sotto Bisio 42 а/с, 6828-Balerna, Schweiz. При использовании азота в качестве рабочего газа размол при этом проводят,например, при следующих параметрах: Полученный таким путем микронизированный ксинафоат салметерола имеет объем после уплотнения, равный 0,19 г/см 3.IV) Микронизация кристаллического моногидрата тиотропийбромида Полученный согласно WO 02/30928 кристаллический моногидрат тиотропийбромида микронизируют в пневматической струйной мельнице, в качестве которой используют 2-дюймовую микронную коллоидную мельницу, снабженную рабочим кольцом с отверстием 0,8 мм, фирмы Sturtevant Inc., расположенной по адресу: 348 Circuit Street, Hanover, MA 02239, USA. При использовании азота в качестве рабочего газа размол при этом проводят, например, при следующих параметрах: Полученный размолотый материал затем распределяют по противням слоем толщиной примерно 1 см и в течение 24-24,5 ч выдерживают в атмосфере с температурой 25-30 С и относительной влажностью 70-80%. Методы измеренийI) Рентгеноструктурный анализ ксинафоата салметерола Измерительная аппаратура и настроечные параметры Для получения рентгеновской порошковой дифрактограммы согласно изобретению использовали дифрактометр Bruker D8 Advanced, оснащенный позиционно-чувствительным детектором (детектором оптического излучения) и медным анодом в качестве источника рентгеновского излучения (Kизлучение меди,= 1,5418 , 40 кВ, 40 мА).- 11010588 Рентгеновская порошковая дифрактограмма, полученная при рентгеноструктурном анализе используемого в предлагаемых в изобретении порошковых препаратах ксинафоата салметерола, представлена на фиг. 1. Данные, полученные в результате этого спектроскопического анализа, сведены в приведенную ниже табл. 1. Таблица 1. Значения интенсивности (нормированные) рентгеновских дифракционных максимумов (рефлексов) В приведенной выше таблице величина "2 []" обозначает угол дифракции в градусах, а величина"d []" обозначает межплоскостное расстояние в кристаллической решетке в ангстремах.II) Определение гранулометрического состава микронизированного моногидрата тиотропийбромида Измерительная аппаратура и настроечные параметры С аппаратурой работают в соответствии с разработанной производителем инструкцией по эксплуатации. Подготовка образца/подача продукта Примерно 200 мг анализируемого вещества насыпают на игральную карту. Ребром другой игральной карты измельчают все сравнительно крупные агломераты. Затем порошок равномерным тонким слоем распределяют по передней половине виброжелоба (начиная с расстояния приблизительно 1 см от переднего края). После начала измерений частоту вибраций виброжелоба изменяют таким образом, чтобы обеспечить по возможности непрерывную подачу образца. Вместе с тем для достижения требуемой степени диспергирования количество продукта не должно быть слишком большим.III) Определение гранулометрического состава лактозы Измерительная аппаратура и настроечные параметры С аппаратурой работают в соответствии с разработанной производителем инструкцией по эксплуатации.- 13010588 Подготовка образцов/подача продукта Примерно 200 мг анализируемого вещества насыпают на игральную карту. Ребром другой игральной карты измельчают все сравнительно крупные агломераты. Затем порошок помещают на виброжелоб. Расстояние между виброжелобом и нутч-фильтром устанавливают на 1,2-1,4 мм. После начала измерений частоту вибраций виброжелоба изменяют по возможности непрерывно до 100% к концу процесса измерения.IV) Определение удельной поверхности микронизированного моногидрата тиотрпийбромида (1 точечный БЭТ-метод) Принцип метода измерений Для определения удельной поверхности образец порошка выдерживают в атмосфере из смеси азота с гелием при различных значениях давления. В результате охлаждения образца происходит конденсация молекул азота на поверхности частиц. Количество сконденсировавшегося азота определяют по изменению теплопроводности смеси азота с гелием, а площадь поверхности образца рассчитывают на основе потребной для конденсации азота площади поверхности. На основе этого значения и взвешенного количества образца рассчитывают его удельную поверхность. Измерительная аппаратура и настроечные параметры Расчет удельной поверхности Измеренные значения выводятся на индикатор измерительного прибора в [м 2] и обычно пересчитываются в [см 2/г] в пересчете на навеску (массу сухого вещества) по следующей формуле: где Ауд обозначает удельную поверхность в [см 2/г],ИЗ обозначает измеренное значение в [м 2],mсв обозначает массу сухого вещества в [г],10000 представляет собой коэффициент пересчета в [см 2/м 2].V) Определение теплоты растворения (энтальпии растворения) Ec лактозы Энтальпию растворения определяют с помощью калориметра растворения типа 2225 Precision Solution Calorimeter фирмы Thermometric. Теплоту растворения рассчитывают на основе происходящего в результате процесса растворения изменения температуры и на основе рассчитанного исходя из базовой линии изменения температуры, обусловленного особенностями системы. До и после вскрытия ампул выполняют электрическую калибровку с помощью встроенного нагревательного элемента сопротивления точно известной мощности. При этом в систему в течение строго заданного промежутка времени отдается определенное количество тепла, и измеряется скачок температуры. Электрическая калибровка Электрическую калибровку выполняют в процессе измерения один раз до и один раз после вскрытия ампулы. Для обработки результатов измерений калибровку используют после вскрытия ампулы. Получение предлагаемых в изобретении порошковых препаратов Оборудование Для получения ингаляционных порошков можно использовать, например, указанные ниже машины и аппараты. Смеситель, соответственно смеситель для порошков: турбосмеситель объемом 2 л, тип 2 С, производитель: фирма Willy A. Bachofen AG, расположенная по адресу: СН-4500, Basel. Ручное сито: размер ячеек 0,135 мм. Расфасовывать содержащие тиотропий ингаляционные порошки в пустые капсулы для ингаляции можно вручную либо в автоматизированном режиме. При этом можно использовать следующее оборудование. Машина для заполнения капсул: MG2, тип G100, производитель: фирма MG2 S.r.l., расположенная по адресу: I-40065 Pian di Macina di Pianoro (BO), Italy.- 15010588 Пример 1. Порошковая смесь Для получения порошковой смеси используют 295,43 г вспомогательного вещества, 0,61 г микронизированного моногидрата тиотропийбромида и 3,96 микронизированного ксинафоата салметерола. В полученном из этих количеств вспомогательного вещества и действующих веществ ингаляционном порошке массой 300 г на долю действующего вещества 1' приходится 0,2%, а на долю действующего вещества 2-1,32%. В соответствующий смеситель через ручное сито с размером ячеек 0,315 мм засыпают около 40-45 г вспомогательного вещества. Затем в смеситель поочередно послойно просеивают моногидрат тиотропийбромида 1 порциями примерно по 90-110 мг и вспомогательное вещество порциями примерно по 4045 г. Вспомогательное вещество и действующее вещество 1 загружают в смеситель 7-ю, соответственно 6-ю слоями. Просеянные таким образом компоненты ингаляционного порошка затем перемешивают в смесителе (перемешивание при 900 оборотах). Полученную таким путем окончательную смесь еще дважды просеивают через ручное сито и после каждого просеивания перемешивают (перемешивание при 900 оборотах). Затем в соответствующий смеситель через ручное сито с размером ячеек 0,315 мм засыпают около 40-45 г полученной по описанной выше методике порошковой смеси, содержащей действующее вещество 1. После этого в смеситель поочередно послойно просеивают ксинафоат салметерола 2 порциями примерно по 650-670 мг и содержащую действующее вещество 1 порошковую смесь порциями примерно по 40-45 г. Содержащую действующее вещество 1 порошковую смесь и действующее вещество 2 загружают в смеситель 7-ю, соответственно 6-ю слоями. Просеянные таким образом компоненты ингаляционного порошка затем перемешивают в смесителе (перемешивание при 900 оборотах). Полученную таким путем окончательную смесь еще дважды просеивают через ручное сито и после каждого просеивания перемешивают (перемешивание при 900 оборотах). По описанной в примере 1 методике или аналогично ей можно получать ингаляционные порошки,после расфасовывания которых в соответствующие полимерные капсулы получают, например, рассмотренные ниже капсулы для ингаляции. Пример 2. Пример 13. Порошковая смесь Для получения порошковой смеси используют 295,43 г вспомогательного вещества, 0,61 г микронизированного моногидрата тиотропийбромида и 3,96 микронизированного ксинафоата салметерола. В полученном из этих количеств вспомогательного вещества и действующих веществ ингаляционном порошке массой 300 г на долю действующего вещества 1' приходится 0,2%, а на долю действующего вещества 2-1,32%. В соответствующий смеситель через ручное сито с размером ячеек 0,315 мм засыпают около 20-23 г вспомогательного вещества. Затем в смеситель поочередно послойно просеивают моногидрат тиотропийбромида 1 порциями примерно по 90-110 мг, вспомогательное вещество порциями примерно по 20-23 г и ксинафоат салметерола 2 порциями примерно по 650-670 мг. Этот процесс повторяют 6 раз. В завершение в смеситель загружают последнюю порцию вспомогательного вещества в количестве около 20-23 г. Просеянные таким образом компоненты ингаляционного порошка (по 6 слоев действующих веществ 1- 18010588 и 2, а также 13 слоев вспомогательного вещества) затем перемешивают в смесителе (перемешивание при 900 оборотах). Полученную таким путем окончательную смесь еще дважды просеивают через ручное сито и после каждого просеивания перемешивают (перемешивание при 900 оборотах). По описанной в примере 13 методике или аналогично ей можно получать ингаляционные порошки,после расфасовывания которых в соответствующие полимерные капсулы получают, например, рассмотренные ниже капсулы для ингаляции. Пример 25. Порошковая смесь Для получения порошковой смеси используют 295,43 г вспомогательного вещества, 0,61 г микронизированного моногидрата тиотропийбромида и 3,96 микронизированного ксинафоата салметерола. В полученном из этих количеств вспомогательного вещества и действующих веществ ингаляционном порошке массой 300 г на долю действующего вещества 1' приходится 0,2%, а на долю действующего вещества 2-1,32%. В качестве вспомогательного вещества используют смесь из 280,43 г указанного выше в п.16 моногидрата лактозы и 15 г указанного выше в п.16 микронизированного моногидрата лактозы со средним размером частиц примерно 3-4 мкм. В полученном из этих компонентов лекарственном средстве на долю фракции вспомогательного вещества с меньшим средним размером частиц приходится 5%. В соответствующий смеситель через ручное сито с размером ячеек 0,315 мм засыпают около 29-33 г вспомогательного вещества, представленного в виде частиц большей крупности. Затем в смеситель послойно просеивают около 1,5-2 г вспомогательного вещества, представленного в виде частиц меньшей крупности. Этот процесс повторяют 8 раз. В завершение в смеситель загружают последнюю порцию вспомогательного вещества, представленного в виде частиц большей крупности, в количестве около 2023 г. Просеянные таким образом компоненты (9 слоев вспомогательного вещества, представленного в виде частиц большей крупности, и 8 слоев микронизированного вспомогательного вещества) затем перемешивают в смесителе (перемешивание при 900 оборотах). Полученную таким образом смесь вспомогательных веществ используют при приготовлении окончательной смеси по описанной в примере 13 методике. Просеянные таким образом компоненты ингаляционного порошка (по 6 слоев действующих веществ 1 и 2, а также 13 слоев смеси вспомогательных веществ) затем перемешивают в смесителе (перемешивание при 900 оборотах). Полученную таким путем окончательную смесь еще дважды просеивают через ручное сито и после каждого просеивания перемешивают (перемешивание при 900 оборотах).- 21010588 По описанной в примере 25 методике или аналогично ей можно получать ингаляционные порошки,после расфасовывания которых в соответствующие полимерные капсулы получают, например, рассмотренные ниже капсулы для ингаляции. В приведенных ниже примерах обозначение "моногидрат лактозы(3-4 мкм)" соответствует микронизированной лактозе, а обозначение "моногидрат лактозы" соответствует лактозе, представленной в виде частиц большей крупности. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Капсула, содержащая ингаляционный порошок, содержащий тиотропий 1' и ксинафоат салметерола 2, где 2 характеризуется температурой плавления примерно 124 С, в смеси с физиологически безвредным вспомогательным веществом, при том, что капсула содержит от 8 до 12 мг ингаляционного порошка. 2. Капсула по п.1, отличающаяся тем, что тиотропий 1' присутствует в комбинации с противоионом,выбранным из группы, включающей хлорид, бромид, иодид, метансульфонат и паратолуолсульфонат. 3. Капсула по п.1 или 2, при том, что на рентгеновской порошковой дифрактограмме используемого ксинафоата салметерола 2 имеются среди прочих следующие характеристические значения d: 21,5, 8,41, 5,14 , 4,35 , 4,01 и 3,63 . 4. Капсула по пп.1, 2 или 3, при том, что объем используемого ксинафоата салметерола 2 после уплотнения составляет не менее 0,134 г/см 3, предпочтительно не менее 0,14 г/см 3. 5. Капсула по одному из пп.1-4, отличающаяся тем, что содержание ксинафоата салметерола 2 составляет от 0,002 до 15%. 6. Капсула по одному из пп.1-5, отличающаяся тем, что содержание тиотропия 1' составляет от 0,001 до 5%. 7. Капсула по одному из пп.1-6, отличающаяся тем, что тиотропий 1' и ксинафоат салметерола 2 совместно содержатся в дозировках от 5 до 5000 мкг. 8. Капсула по одному из пп.1-7, отличающаяся тем, что физиологически безвредное вспомогательное вещество выбрано из группы, включающей моносахариды, дисахариды, олиго- и полисахариды, многоатомные спирты и соли. 9. Капсула по одному из пп.1-8, отличающаяся тем, что физиологически безвредное вспомогательное вещество выбрано из группы, включающей глюкозу, арабинозу, лактозу, сахарозу, мальтозу и трегалозу, необязательно в виде их гидратов. 10. Капсула по одному из пп.1-9, отличающаяся тем, что она содержит 10 мг ингаляционного порошка. 11. Набор для ингаляции, состоящий из капсулы по одному из пп.1-10 и ингалятора, который может использоваться для введения в организм ингаляционных порошков из содержащих их капсул. 12. Набор для ингаляции по п.11, отличающийся тем, что ингалятор имеет корпус (1) с двумя окошками (2), пластинчатую перегородку (3), в которой предусмотрены впускные отверстия для воздуха и- 24010588 которая снабжена сеткой (3), удерживаемой в собранном состоянии соответствующим крепежным элементом (4), соединенную с пластинчатой перегородкой (3) камеру (6) для капсулы с ингаляционным составом, сбоку которой (камеры) предусмотрена нажимная кнопка (9), снабженная двумя шлифованными иглами (7) и выполненная подвижной против усилия пружины (8), мундштук (12), который выполнен откидным с возможностью поворота вокруг оси, соединяющей его с корпусом (1), пластинчатой перегородкой (3) и колпачком (11), и сквозные отверстия (13) для прохода воздуха, предназначенные для регулирования аэрогидродинамического сопротивления.
МПК / Метки
МПК: A61P 11/00, A61K 31/137, A61K 31/46, A61K 9/72, A61P 11/06
Метки: средства, соль, салметерола, порошковые, лекарственные, тиотропия, ксинафоат, содержащие
Код ссылки
<a href="https://eas.patents.su/26-10588-poroshkovye-lekarstvennye-sredstva-soderzhashhie-sol-tiotropiya-i-ksinafoat-salmeterola.html" rel="bookmark" title="База патентов Евразийского Союза">Порошковые лекарственные средства, содержащие соль тиотропия и ксинафоат салметерола</a>
Предыдущий патент: Диспергируемая во рту фармацевтическая композиция и способ ее получения
Следующий патент: Способ получения простых эфиров
Случайный патент: Фильтрующее устройство, аппарат для приготовления горячих напитков и капсула для фильтровального устройства