Стентовое устройство, содержащее соединения хинолина и хиноксалина, способ лечения рестеноза
Номер патента: 7807
Опубликовано: 27.02.2007
Авторы: Персонс Пол Э., Майерс Майкл Р., Магвайер Мартин П., Спада Альфред П.
Формула / Реферат
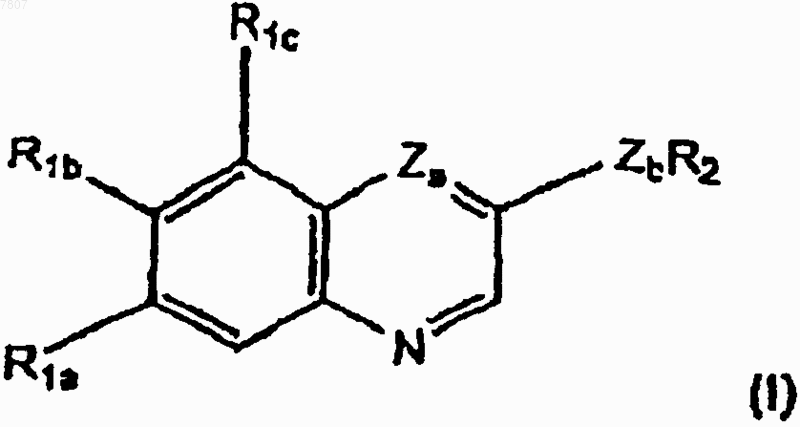
1. Стентовое устройство, включающее полимерное покрытие с включенным в него соединением формулы I в количестве, эффективном для ингибирования рестеноза
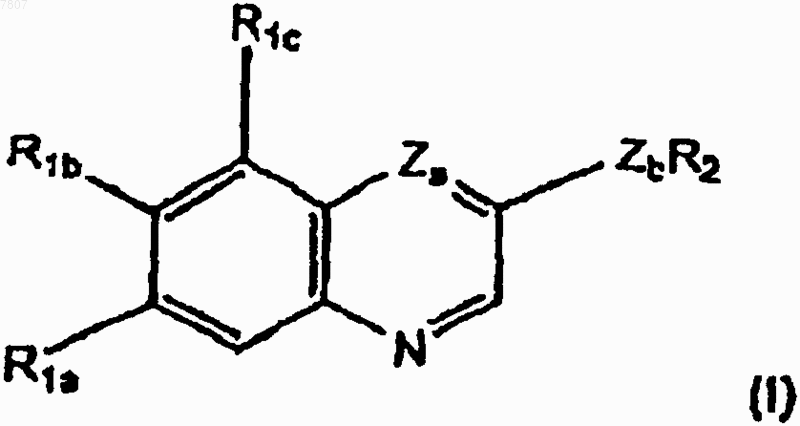
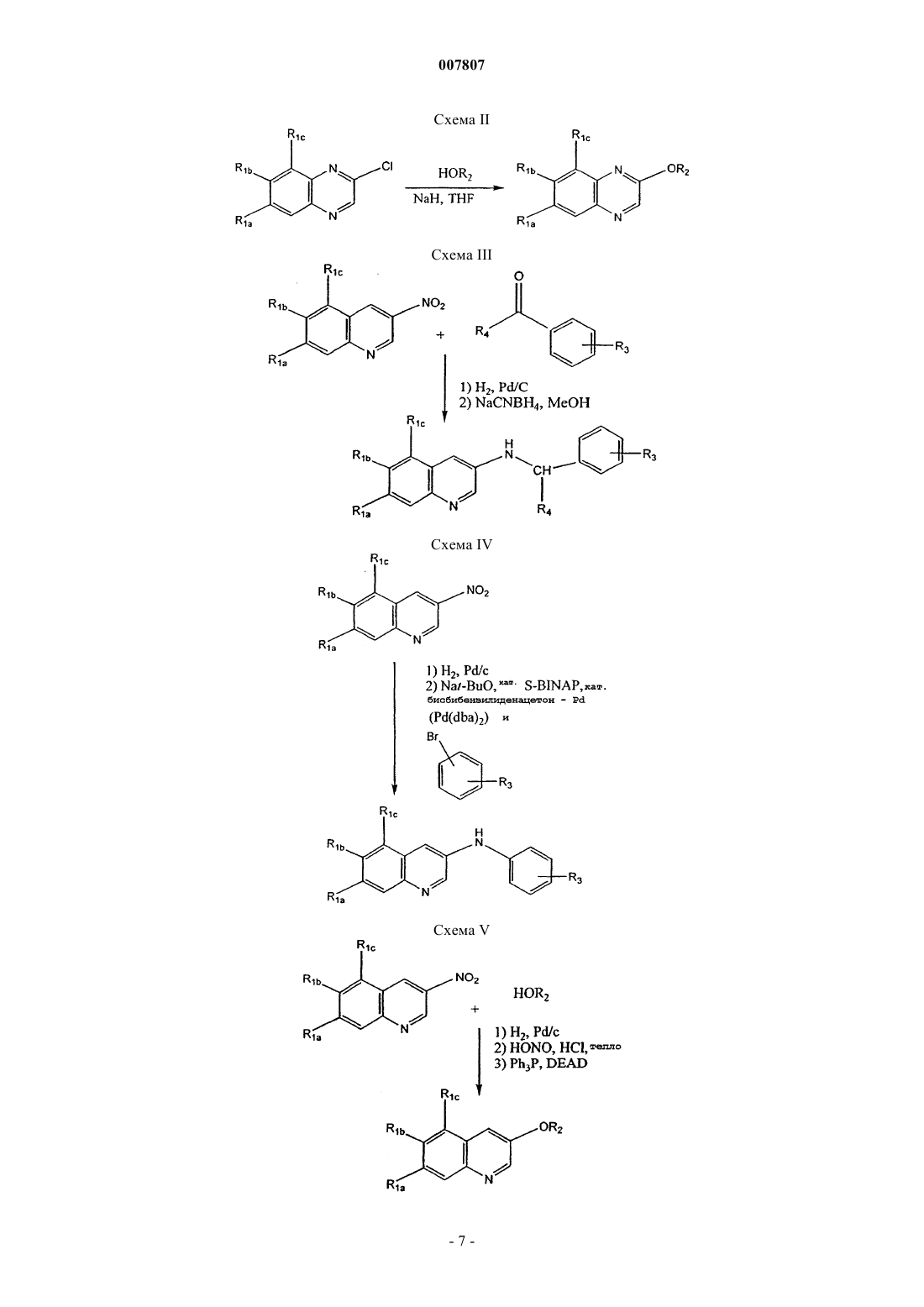
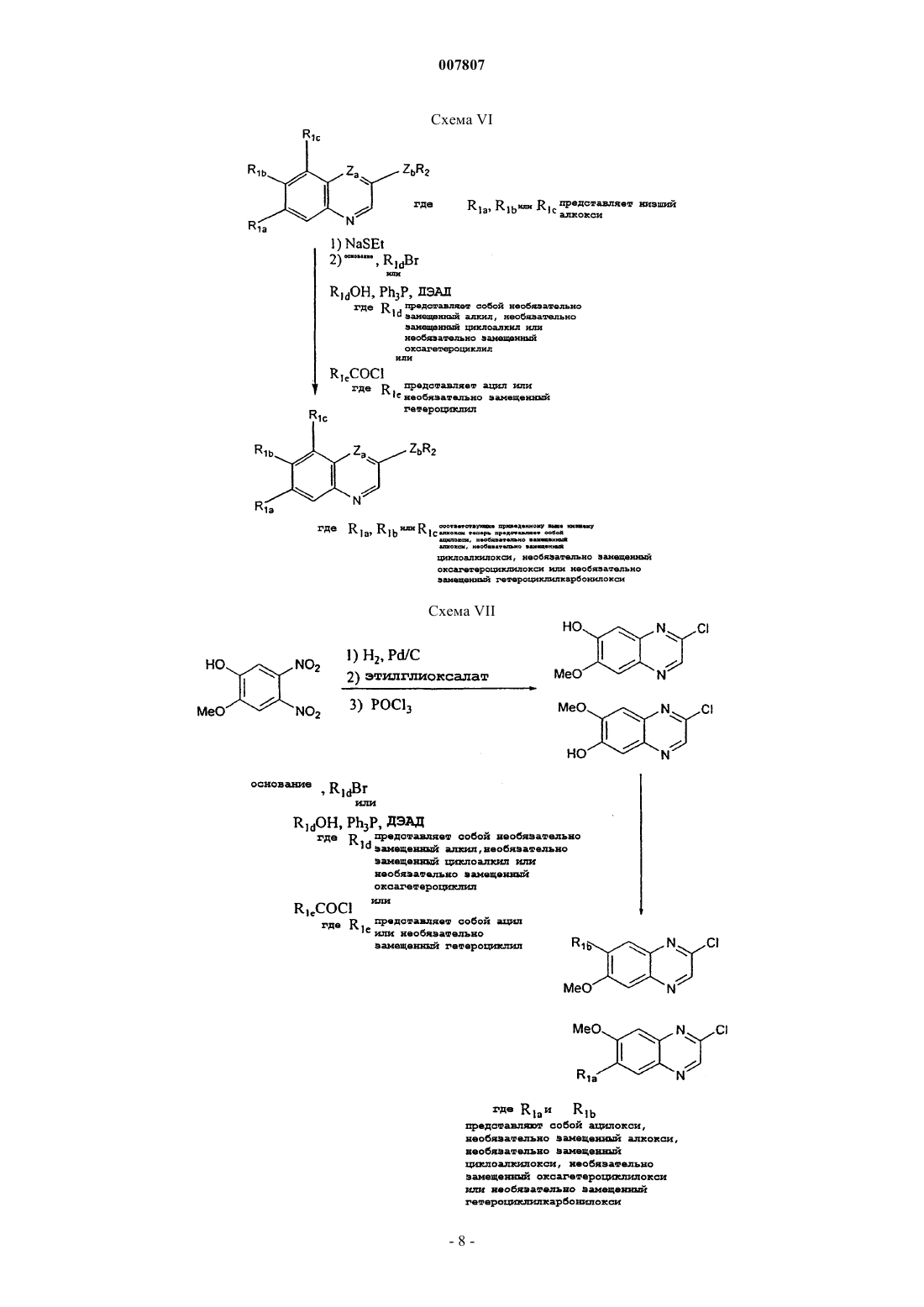
где R1a представляет необязательно замещенный С1-С10алкил, гидрокси, необязательно замещенный С1-С10алкокси, необязательно замещенный С3-С7циклоалкилокси, необязательно замещенный 4-7-членный оксагетероциклилокси или галоген;
R1b представляет собой водород, необязательно замещенный С1-С10алкил, гидрокси, необязательно замещенный С1-С10алкокси, необязательно замещенный С3-С7циклоалкилокси, необязательно замещенный 4-7-членный оксагетероциклилокси или галоген;
R1c представляет собой водород, необязательно замещенный С1-С10алкил или необязательно замещенный С1-С10алкокси,
где С1-С10алкил необязательно замещен С1-С10алкокси, галогеном, карбокси, гидрокси или R5R6N- (где R5 и R6 независимо представляют собой водород или С1-С10алкил, или R5 и R6, взятые вместе с атомом азота, к которому присоединены R5 и R6, образуют азагетероциклил),
С1-С10алкокси необязательно замещен С1-С10алкокси, карбокси, С1-С10алкоксикарбонилом, карбоксиарилом или R5R6N- (где R5 и R6 принимают значения, определенные выше),
4-7-членный оксагетероциклилокси необязательно замещен гидрокси, галогеном, С1-С10алкилом, С1-С10алкокси, карбокси, С1-С10алкоксикарбонилом или Y1Y2NCO-, где Y1 и Y2 независимо представляют водород или С1-С10алкил,
R2 представляет группу
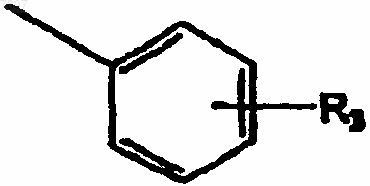
R3 представляет водород или фтор в орто- или пара-положении или С1-С3алкил, С1-С3алкокси, галоген или карбамоил;
Za представляет N или СН; и
Zb представляет NH или О, или
его N-оксид, гидрат, сольват, пролекарство или соль.
2. Стентовое устройство по п.1, где R1a в указанном соединении представляет необязательно замещенный С1-С3алкокси, необязательно замещенный моноциклический С3-С7циклоалкокси или 4-7-членный необязательно замещенный моноциклический оксагетероциклилокси; и
R1b в указанном соединении представляет водород, необязательно замещенный С1-С3алкокси, необязательно замещенный моноциклический С3-С7циклоалкокси или 4-7-членный необязательно замещенный моноциклический оксагетероциклилокси.
3. Стентовое устройство по п.2, где R1a в указанном соединении представляет необязательно замещенный С1-С3алкокси или 4-7-членный необязательно замещенный моноциклический оксагетероциклилокси, предпочтительно метокси, этокси, 2-(этокси)этокси, 2-(4-морфолинил)этокси или фуранилокси и R1b в указанном соединении представляет необязательно замещенный С1-С3алкокси, предпочтительно метокси или этокси.
4. Стентовое устройство по п.1, где
R1a и R1b в указанном соединении представляют С1-С3алкокси, предпочтительно метокси или этокси;
R1c в указанном соединении представляет водород; и
R3 в указанном соединении представляет водород, орто- или парафтор или метаметил, трифторметил, метокси, фтор, хлор, бром или карбамоил.
5. Стентовое устройство по п.1, где Za в указанном соединении представляет N.
6. Стентовое устройство по п.1, где Za в указанном соединении представляет СН.
7. Стентовое устройство по п.1, где Zb в указанном соединении представляет NH.
8. Стентовое устройство по п.1, где Zb в указанном соединении представляет О.
9. Стентовое устройство по п.1, где указанное соединение выбрано из группы, включающей
2-анилино-6-хиноксалинол;
2-анилино-6-изопропоксихиноксалин;
2-фенокси-6-метоксихиноксалин;
2-(3-карбамоилфениламино)-6-метоксихиноксалин;
2-(2-фторфениламино)-6,7-диэтоксихиноксалин;
2-(3-трифторметилфениламино)-6,7-диэтоксихиноксалин;
фенил-[6-(тетрагидрофуран-3(R)-илокси)хиноксалин-2-ил]амин;
(6-метоксихиноксалин-2-ил)-(3-метилфенил)амин;
2-анилино-6-этоксихиноксалин;
2-(3-метоксифениламино)-6,7-диэтоксихиноксалин;
2-(4-фторфениламино)-6,7-диэтоксихиноксалин;
6,7-диэтокси-2-феноксихиноксалин;
2-фениламино-6,7-диэтоксихиноксалин;
(6,7-диметоксихиноксалин-2-ил)-(3-фторфенил)амин;
2-(3-фторфениламино)-6,7-диэтоксихиноксалин;
(3-бромфенил)-(6,7-диметоксихиноксалин-2-ил)амин;
(6,7-диметоксихиноксалин-2-ил)фениламин или
(3-хлорфенил)-(6,7-диметоксихиноксалин-2-ил)амин, или
их N-оксид, гидрат, сольват, пролекарство, или их фармацевтически приемлемую соль.
10. Способ лечения рестеноза у пациентов, который включает введение названному пациенту фармацевтически эффективного количества соединения формулы I
где R1a и R1b представляют С1-С3алкокси;
R1c представляет водород;
R2 представляет R3-замещенный фенил;
R3 представляет водород или метагалоген;
Za представляет N или СН и
Zb представляет NH или О; или
его N-оксида, гидрата, сольвата, пролекарства или соли в виде покрытия на стентовом устройстве.
11. Способ по п.10, в котором рестеноз находится в участке механического повреждения артериальной стенки, полученного при лечении атеросклеротического повреждения ангиопластикой.
12. Стентовое устройство по п.1, где полимерное покрытие включает один или более полимеров, выбранных из группы, состоящей из поликапролактона, сополимера поли(этилен-винилацетата), поли(винилацетата) и силиконовой ненаполненной резиновой смеси, или один или более полимеров, выбранных из группы, состоящей из латексов, уретанов, полисилоксанов и блоксополимеров стирола-этилена/бутилена-стирола, или один или более полимеров, выбранных из группы, состоящей из поли-DL-молочной кислоты, поли-L-молочной кислоты, сложных полиортоэфиров, полииминокарбонатов, алифатических поликарбонатов и полифосфазенов.
13. Стентовое устройство по п.1, где полимерное покрытие дополнительно включает порообразователь, выбранный из группы, состоящей из микрогранул хлорида натрия, лактозы или натрийсодержащего гепарина, или из группы, состоящей из полиэтиленгликоля и сополимеров полиэтиленоксида/полипропиленоксида.
14. Стентовое устройство по п.1, где на полимерное покрытие нанесена мембрана, контролирующая скорость высвобождения, для ограничения скорости высвобождения соединения формулы I из полимерного покрытия, которая включает порообразователь, выбранный из группы, состоящей из хлорида натрия, лактозы, натрийсодержащего гепарина, полиэтиленгликоля, сополимеров полиэтиленоксида/полипропиленоксида и их смесей.
15. Стентовое устройство по п.1, где соединение формулы I включено в полимерное покрытие нанесением соединения формулы I по крайней мере на одну поверхность стентового устройства с образованием биологически активного слоя с последующим нанесением одного или нескольких покрытий пористого полимерного материала поверх биологически активного слоя, где пористый полимерный материал включает полиамид, парилен или производное парилена.
16. Стентовое устройство пю я.15, где пористый полимерный материал наносят осаждением плазмы.
17. Стентовое устройство по п.16, где пористый полимерный материал выбирают из группы, состоящей из поли(этиленоксида), поли(этиленглиоля), поли(пропиленоксида), и полимеров метана, силикона и тетрафторэтилен-тетраметилдисилоксана.
18. Стентовое устройство по п.1, где полимерное покрытие получают добавлением фотополимеризуемого полиэтиленненасыщенного сложного эфира акриловой или метакриловой кислоты, содержащего две или более акрилатных и метакрилатных групп на молекулу или их смесей.
19. Стентовое устрйство по п.18, где мономер выбирают из группы, состоящей из диакрилата этиленгликоля, диметакрилата этиленгликоля, триакрилата триметилпропана, триметакрилата триметилпропана, тетраакрилата пентаэритрита, тетраметакрилата пентаэритрита, диметакрилата 1,6-гександиола и диметакрилата диэтиленгликоля или группы, состоящей из н-бутилакрилата, н-бутилметакрилата, 2-этилгексилакрилата, лаурилакрилата и 2-гидроксипропилакрилата.
20. Стентовое устройство по п.1, где полимерное покрытие включает полимер, выбранный из группы, состоящей из поли(L-молочной кислоты), поликапролактона, сополимера поли(лактид-гликолид), поли(гидроксибутирата), сополимера поли(гидроксибутират-валерат), полидиоксанона, полиортоэфира, полиангидрида, поли(гликолевой кислоты), поли(D,L-молочной кислоты), сополимера поли(гликолевая кислота-триметиленкарбонат), полифосфоэфира, полифосфоэфируретана, поли(аминокислот), цианоакрилатов, поли(триметиленкарбоната), поли(иминокарбоната), поли(простой эфир-сложные эфиры), полиалкиленоксалатов, полифосфазенов, фибрина, фибриногена, целлюлозы, крахмала, коллагена и гиалуроновой кислоты или полимер, выбранный из группы, состоящей из полиуретанов, силиконов, полиэфиров, полиолефинов, полиизобутилена и споплимера этилен-альфаолефин, полимеров и сополимеров акриловой кислоты, полимеров и сополимеров винилгалогенида, таких как поливинилхлорид, поливиниловых простых эфиров, таких как поливиниловый метиловый эфир, поливинилиденгалогенидов, таких как поливинилиденфторид и поливинилиденхлорид, полиакрилонитрила, поливинилкетонов, поливиниловых ароматических соединений, таких как полистирол, поливиниловых сложных эфиров, таких как поливинилацетат, сополимеров виниловых мономеров друг с другом и олефинами, таких как сополимеры этилена-метилметакрилата, сополимеры акрилонитрила-стирола, смолы ABS и сополимеры этилена-винилацетата, полиамидов, таких как Nylon 66 и поликапролактам, алкиловых смол, поликарбонатов, полиоксиметиленов, полиимидов, полиэфиров, эпоксидных смол, полиуретанов, искусственного волокна, триацетатного искусственного волокна, целлюлозы, ацетата целлюлозы, бутирата целлюлозы, ацетатбутирата целлюлозы, целлофана, нитрата целлюлозы, пропионата целлюлозы, простых эфиров целлюлозы и карбоксиметилцеллюлозы.
21. Применение соединения формулы I по п.1 для производства стентового устройства для ингибирования рестеноза, где соединение формулы I включено в полимерное покрытие, нанесенное на указанный стент.
22. Применение по п.21, где рестеноз имеется в месте механического повреждения артериальной стенки, вызванного лечением атеросклеротического повреждения ангиопластикой.
Текст
007807 Данная заявка представляет собой частичное продолжение патентной заявки США 09/198716,поданной 24 ноября 1998 г., которая, в свою очередь, является частичным продолжением международной патентной заявкиРСТ/США 98/10999, поданной 28 мая 1998 г., которая, в свою очередь, является частичным продолжением заявки США 08/972614, поданной 18 ноября 1997 г., которая в настоящее время аннулирована, которая, в свою очередь, является частичным продолжением заявки США 08/864455, поданной 18 мая 1997 г., которая в настоящее время аннулирована. Область техники Данное изобретение относится к ингибированию пролиферации клеток, и/или продуцирования клеточного матрикса, и/или перемещения клетки (хемотаксиса), и/или активации и пролиферации Т-клетки,с использованием соединения хинолина/хиноксалина, которые являются полезными ингибиторами белка тирозинкиназы (TKIs). Клеточная передача сигналов опосредуется через систему интервзаимодействий, которые включают контакт клетка-клетка или контакт клетка-матрикс или внеклеточный контакт рецептор-субстрат. Внеклеточный сигнал часто передается другим частям клетки посредством опосредованного тирозинкиназой фосфорилирования, которое воздействует на белки субстрата, расположенные в нижней части сигнального комплекса, связанного с клеточной мембраной. Специфические комплексы рецептор-фермент, такие как рецептор инсулина, рецептор эпидермального фактора роста (EGF-R) или рецептор тромбоцитарного фактора роста (PDGF-R), представляют собой примеры ферментов тирозинкиназы, которые вовлечены в передачу сигналов в клетке. Для эффективного опосредованного ферментом фосфорилирования белкового субстрата, содержащего тирозиновые остатки, требуется автофосфорилирование фермента. Эти субстраты, как известно, являются ответственными за разнообразные клеточные явления, включая, например, пролиферацию клеток, продукцирование клеточного матрикса, миграцию клеток и апоптоз. Понятно, что большое количество болезненных состояний вызвано или неуправляемым воспроизводством клеток, или сверхпродуцированием матрикса, или плохо регулируемой программированной гибелью клеток (апоптоз). Эти болезненные состояния охватывают различные виды клеток и включают такие заболевания, как лейкемия, рак, глиобластома, псориаз, воспалительные заболевания, заболевания костей, фиброзные заболевания, атеросклероз и рестеноз, встречающийся после ангиопластики коронарных сосудов, бедренной или почечной артерий или фибропролиферативные заболевания, такие как артрит, фиброз легкого, почки и печени. Кроме того, нарушение регулирования условий клеточной пролиферации может быть следствием операции коронарного шунтирования. Ингибирования активности тирозинкиназы, как полагают, может быть полезным для контроля неуправляемого воспроизводства клеток или сверхпродуцирования матрикса или плохо регулируемой запрограммированной гибели клетки(апоптоз). Также известно, что некоторые ингибиторы тирозинкиназы могут взаимодействовать с более чем одним видом ферментов тирозинкиназы. Несколько ферментов тирозинкиназы являются критическими для нормального функционирования организма. Например, в большинстве нормальных случаев было бы нежелательно ингибировать действие инсулина. Поэтому соединения, которые ингибируют активностьPDGF-R тирозинкиназы при меньших концентрациях, чем концентрации, эффективные для ингибирования киназы инсулинового рецептора, могут обеспечить ценные агенты для избирательного лечения заболеваний, характеризующихся клеточной пролиферацией, и/или продуцированием клеточного матрикса,и/или перемещением клетки (хемотаксис), таких как рестеноз. Данное изобретение относится к модулированию и/или ингибированию клеточной передачи сигналов, клеточной пролиферации, внеклеточного продуцирования матрикса, хемотаксиса, контролю аномального роста клетки и воспалительной реакции клетки. Более конкретно, изобретение относится к использованию замещенных соединений хиноксалина, которые обладают селективным ингибированием дифференциации, пролиферации или высвобождения медиатора путем эффективного ингибирования активности рецептора тромбоцитарного фактора роста (PDGF-R) тирозинкиназы и/или активности Lck тирозинкиназы (нерецепторная тирозинкиназа р 56lсk). Уровень техники Ряд сообщений в литературе описывают ингибиторы тирозинкиназы, которые являются селективными для ферментов рецептора тирозинкиназы, таких как EGF-R или PDGF-R, или нерецепторных цитосолитических ферментов тирозинкиназы, таких как v-abl, p561ck или c-src. Недавние обзоры Spada иMyers (Exp. Opin. Ther. Patents 1995, 5 (8), 805) и Bridges (Exp. Opin. Ther. Patents 1995, 5 (12), 1245) обобщают сведения, имеющиеся в литературе по ингибиторам тирозинкиназы и селективным ингибиторам EGF-R соответственно. Кроме того, Law и Lydon суммировали данные по противораковой активности ингибиторов тирозинкиназы (Emerging Drugs: The Prospect For Improved Medicines 1996, 241-260). Известные ингибиторы активности PDGF-R тирозинкиназы включают ингибиторы, производные хинолина, приведенные в Maguire et al. (J. Med. Chem. 1994, 37, 2129) и Dolle et al. (J. Med. Chem. 1994,37, 2627). Класс ингибиторов, производных фениламинопиримидина, описан в Traxler et al. в ЕР 564409and by Zimmerman, J.; и Traxler, P. et al. (Biorg.Med. Chem. Lett. 1996; 6(11), 1221-1226) и Buchdunger,E. et al. (Proc. Nat. Acad. Sci. 1995, 92, 2558). Несмотря на достижения в данной области, не существует-1 007807 агентов из этих классов соединений, которые были бы одобрены для использования для лечения пролиферативных заболеваний человека. Корреляция между таким мультифакторным заболеванием, как рестеноз, и PDGF и PDGF-R имеет хорошо документированное подтверждение в научной литературе. Однако последние достижения в понимании фиброзных заболеваний легких (Antoniades, H.N.; et al. J. Clin. Invest. 1990, 86, 1055), почек и печени (Peterson, Т.С. Hepatology, 1993, 17, 486) также включают PDGF и PDGF-R в ряд факторов, играющих роль в их развитии. Например, гломерулонефрит является основной причиной почечной недостаточности, причем установлено, что PDGF является сильным митогеном для мезангиальных клеток inPDGF (полученные от пациентов, страдающих ревматоидным артритом) являются основными цитокинами, вовлеченными в пролиферацию синовиальных клеток. Более того, идентифицированы определенные виды раковых клеток (см. Silver, В.J., BioFactors, 1992, 3, 217), такие как глиобластома и саркома Капоши, которые экспрессируют в избыточном количестве либо белок PDGF, или рецептор, приводя, таким образом, к неконтролируемому росту раковых клеток посредством аутокринного или паракринного механизма. Таким образом можно ожидать, что ингибитор PDGF тирозинкиназы будет полезен в лечении ряда кажущихся не связанными с ним болезненных состояний человека, которые могут быть охарактеризованы тем, что в их этиологию вовлечены PDGF и/или PDGF-R. Роль различных нерецепторных тирозинкиназ, таких как p56Lck (в дальнейшем Lck) в состояниях,связанных с воспалением, включающих активацию и пролиферацию Т-клеток, рассмотрена Hanke, et al.(Inflamm. Res. 1995, 44, 357) и Bolen and Brugge (Ann. Rev. Immunol., 1997, 15, 371). Эти воспалительные состояния включают аллергию, аутоиммунные заболевания, ревматоидный артрит и отторжение трансплантата. Другой недавний обзор суммирует различные классы ингибиторов тирозинкиназы, включая соединения, имеющие Lck ингибирующую активность (Groundwater, et al. Progress in Medicinal Chemistry, 1996, 33, 233). Ингибиторы активности Lck тирозинкиназы включают несколько естественных продуктов, которые обычно являются неселективными ингибиторами тирозинкиназы, такие как стауроспорин, генистеин, некоторые флавоны и эрбстатин. Недавно появилось сообщение о том, что дамнакантол является ингибитором Lck в низких нМ концентрациях (Faltynek, et al., Biochemistry, 1995, 34, 12404). Примеры синтетических ингибиторов Lck включают ряд дигидроксиизохинолиновых ингибиторов, которые, как описано, имеют низкую, от микромолярной до субмикромолярной активность (Burke, et al., J.Med. Chem. 1993, 36, 425); и производные хинолина, которые, как обнаружено, имеют значительно более низкую активность, имеющую IC50 Lck 610 мкмоль. Исследователи также открыли ряд 4-замещенных хиназолинов, которые ингибируют Lck при низкой, от микромольной до субмикромольной концентрации (Myers et al., WO 95/15758 and Myers, et al., Bioorg. Med. Chem. Lett. 1997, 7, 417). ИсследователиPfizer (Hanke, et al., J. Biol Chem. 1996, 271, 695) обнаружили два специфических пиразолопиримидиновых ингибитора, известных как РР 1 и РР 2, которые обладают активностью при низкой наномолярной концентрации в отношении Lck и Fyn (другая киназа семейства Src). He имеется сообщений об ингибировании Lck соединениями, производными хинолина или хиноксалина. Поэтому ожидается, что ингибитор активности Lck тирозинкиназы, производные хинолина или хиноксалина может быть полезен для лечения различных, кажущихся не связанными с ней, болезненных состояний человека, которые могут быть охарактеризованы тем, что в их этиологию вовлечена тирозинкиназа Lck сигнальной системы. Сущность изобретения Данное изобретение относится к стентовому устройству, включающему полимерное покрытие с включенным в него соединением формулы I в количестве, эффективном для ингибирования рестеноза где R1a представляет необязательно замещенный C1-С 10 алкил, гидрокси, необязательно замещенный C1 С 10 алкокси, необязательно замещенный С 3-С 7 циклоалкилокси, необязательно замещенный 4-7-членный оксагетероциклилокси или галоген;R1c представляет собой водород, необязательно замещенный C1-С 10 алкил или необязательно замещенный C1-С 10 алкокси,где C1-С 10 алкил необязательно замещен C1-С 10 алкокси, галогеном, карбокси, гидрокси или R5R6N(где R5 и R6 независимо представляют собой водород или C1-С 10 алкил, или R5 и R6, взятые вместе с атомом азота, к которому присоединены R5 и R6, образуют азагетероциклил),C1-С 10 алкокси необязательно замещен C1-С 10 алкокси, карбокси, C1-С 10 алкоксикарбонилом, карбок-2 007807 сиарилом или R5R6N- (где R5 и R6 принимают значения, определенные выше),4-7-членный оксагетероциклилокси необязательно замещен гидрокси, галогеном, C1-С 10 алкилом,C1-С 10 алкокси, карбокси, C1-С 10 алкоксикарбонилом или Y1Y2NCO-, где Y1 и Y2 независимо представляют водород или C1-С 10 алкил,R2 представляет R3-зaмeщeнный фенил,R3 представляет водород или фтор в орто- или пара-положении, или C1-С 3 алкил, C1-С 3 алкокси, галоген или карбамоил;Zb представляет NH или О, или его N-оксид, гидрат, сольват, пролекарство, или соль. Другим объектом изобретения является способ лечения рестеноза у пациентов, который включает введение названному пациенту фармацевтически эффективного количества соединения формулы I. Изобретение также относится к применению соединения формулы I для производства стентового устройства для ингибирования рестеноза. Детальное описание изобретения Следующие термины, использованные выше и далее по всему описанию изобретения, если не указано иное, имеют следующие значения. Определения Пациент означает млекопитающее, включая человека. Эффективное количество означает количество соединения настоящего изобретения, эффективное в подавлении активности PDGF-R тирозинкиназы и/или активности тирозинкиназы Lck, и, таким образом, дающее желательный терапевтический эффект. Алкил означает алифатическую углеводородную группу с разветвленной или неразветвленной цепью, имеющую от около 1 до около 10 атомов углерода. Предпочтительный алкил представляет собой низший алкил, имеющий от около 1 до около 3 атомов углерода; более предпочтительным является метил. Разветвленный означает, что одна или более низших алкильных групп, таких как метил, этил или пропил, присоединены к неразветвленной алкильной цепи. Алкильная группа также необязательно замещена алкокси, галогеном, карбокси, гидрокси или R5R6N- (где R5 и R6 независимо представляют собой водород или алкил, или R5 и R6, взятые вместе с атомом азота, к которому присоединены R5 и R6, образуют азагетероциклил); более предпочтительно необязательно замещена фтором. Примеры алкила включают метил, фторметил, дифторметил, трифторметил, этил, н-пропил, изопропил, бутил, втор-бутил,трет-бутил, амил и гексил. Циклоалкил означает неароматическую моноциклическую кольцевую систему, содержащую приблизительно от около 3 до около 7 атомов углерода. Предпочтительное моноциклическое циклоалкильное кольцо включает циклопентил, циклогексил и циклогептил; более предпочтительными являются циклогексил и циклопентил. Арил означает ароматический карбоциклический радикал, содержащий от около 6 до около 10 атомов углерода. Примеры арила включают фенил или нафтил или фенил или нафтил, замещенные одним или более заместителями арильной группы, которые могут быть одинаковыми или разными, где заместитель арильной группы включает водород, гидрокси, галоген, алкил, алкокси, карбокси, алкоксикарбонил или Y1Y2NCO-, где Y1 и Y2 независимо представляют водород или алкил. Гетероарил означает приблизительно 5-10-членную ароматическую моноциклическую или полициклическую кольцевую углеводородную систему, в которой один или более атомов углерода в кольцевой системе является(ются) элементом(ами), отличными от углерода, например азотом, кислородом или серой. Гетероарил может также быть замещен одним или более вышеупомянутым заместителей арильной группы. Примеры гетероарильной группы включают замещенный пиразинил, фуранил, тиенил, пиридил, пиримидинил, изоксазолил, изотиазолил, оксазолил, тиазолил, пиразолил, фуразанил, пирролил, имидазо[2,1-b]тиазолил, бензофуразанил, индолил, азаиндолил, бензимидазолил, бензотиенил,хинолинил, имидазолил и изохинолинил. Гетероциклил означает приблизительно 4-7-членную моноциклическую кольцевую систему, где один или более атомов в кольцевой системе представляют элемент, отличный от углерода, выбранный из азота, кислорода или серы. Обозначение аза или окса в виде приставки перед термином гетероциклил означает, что по крайней мере один атом азота или атом кислорода присутствует, соответственно, как кольцевой атом. Примеры моноциклических гетероциклических группы включают пиперидил, пирролидинил, пиперазинил, морфолинил, тиоморфолинил, тиазолидинил, 1,3-диоксоланил, 1,4-диоксанил, тетрагидрофуранил, тетрагидротиофенил, тетрагидротиопиранил, и т.п. Примеры гетероциклических групп включают хинуклидил, пентаметиленсульфид, тетрагидропиранил, тетрагидротиофенил, пирролидинил,тетрагидрофуранил или 4-пиперидинопиперидин. Гетероциклилкарбонилокси означает гетероциклил-С(О)O-группу, где гетероциклил является таким, как определено выше. Примером гетероциклилкарбонилоксигруппы является [1,4']бипиперидин-1'илкарбонилокси(4-пиперидинопиперид-1-илкарбонилокси). Ацил означает Н-СО- или алкил-СО-группу, в которой алкильная группа такая, как описано ра-3 007807 нее. Предпочтительные арилы содержат низший алкил. Примеры арильных групп включают формил,ацетил, пропаноил, 2-метилпропаноил, бутаноил и капроил. Алкокси означает алкил-О-группу, в которой алкильная группа такая, как описано ранее. Предпочтительным алкокси является "низший алкокси", имеющий от около 1 до около 3 атомов углерода; более предпочтительным является метокси. Алкокси может быть необязательно замещен одним или более алкокси, карбокси, алкоксикарбонилом, карбоксиарилом или R5R6N- (где R5 и R6 такие, как определено выше). Примеры алкоксигруппы включают метокси, этокси, н-пропокси, изопропокси, н-бутокси,гептокси, 2-(морфолин-4-ил)этокси и 2-(этокси)этокси. Циклоалкилокси означает циклоалкил-О-группу, в которой циклоалкильная группа такая, как описано ранее. Примеры циклоалкоксигрупп включают циклопентилокси или циклогексилокси. Гетероциклилокси означает гетероциклил-О-группу, в которой гетероциклильная группа такая,как описано ранее. Примеры гетероциклилоксигрупп включают пентаметиленсульфидокси, тетрагидропиранилокси, тетрагидротиопентилокси, пирролидинилокси или тетрагидрофуранилокси. Арилокси означает арил-О-группу, в которой арильная группа такая, как ранее описано. Гетероарилокси означает гетероарил-О-группу, в которой гетероарильная группа такая, как ранее описано. Ацилокси означает ацил-О-группу, в которой арильная группа такая, как ранее описано. Карбокси означает НО(О)С-группу (карбоновой кислоты).R5R6N- означает замещенную или незамещенную аминогруппу, где R5 и R6 такие, как ранее описано. Примеры групп включают амино (H2N-), метиламино, этилметиламино, диметиламино и диэтиламино.R5R6NCO означает замещенную или незамещенную карбамоильную группу, где R5 и R6 такие, как ранее описано. Примерами групп являются карбамоил (Н 2NСО-) и диметиламинокарбамоил (Me2NCO-). Ацил R5N- означает группу ациламино, где R5 и арил такие, как определено здесь. Галоген означает фтор, хлор, бром или йод. Предпочтительными являются фтор, хлор или бром и более предпочтительными - фтор или хлор. Пролекарство означает форму соединения формулы I, пригодную для введения пациенту, не имеющую неприемлемой токсичности, не вызывающую раздражения, аллергической реакции и т.п., и эффективную для предназначенного использования, включая кеталь, сложный эфир и цвиттерионные формы. Пролекарство преобразуется in vivo с выделением исходного соединения вышеуказанной формулы, например гидролизом в крови. Полное обсуждение представлено в Т. Higuchi и V. Stella, Pro-drugs asCarriers in Drug Design, American Pharmaceutical Association and Pergamon Press, 1987, оба из которых включены сюда в качестве ссылки. Сольват означает физическую связь соединения данного изобретения с одним или большим количеством молекул растворителя. Эта физическая связь включает различные степени ионной и ковалентной связи, включая водородную связь. В некоторых случаях сольват может быть выделен, например, когда один или более молекул растворителя встроены в кристаллическую решетку кристаллического твердого тела. Сольват включает как сольваты, существующие в фазе раствора, так и выделенные сольваты. Характерные сольваты включают этанолаты, метанолаты и т.п. Гидрат представляет собой сольват,где молекула(ы) растворителя представляет(ют) Н 2O. Предпочтительные варианты изобретения Предпочтительное стентовое устройство по изобретению включает соединение формулы I, где R1a представляет собой необязательно замещенный С 1-С 10 алкокси, необязательно замещенный моноциклический С 3-С 7 циклоалкилокси, необязательно замещенный 4-7-членный моноциклический оксагетероциклилокси; более предпочтительно R1a представляет собой метокси, этокси, 2-(этокси)этокси, 2-(4 морфолинил)этокси или фуранилокси. Другое предпочтительное стентовое устройство по изобретению включает соединение формулы I,где R1b представляет собой водород, необязательно замещенный низший алкокси, необязательно замещенный моноциклический С 3-С 7 циклоалкилокси, необязательно замещенный 4-7-членный моноциклический оксагетероциклилокси; более предпочтительно R1b представляет собой метокси или этокси. Другое предпочтительное стентовое устройство по изобретению включает соединение формулы I,где R1a и R1b представляют собой низший алкокси; более предпочтительно низший алкокси представляет метокси или этокси. Другое предпочтительное стентовое устройство по изобретению включает соединение формулы I,где R1c представляет собой водород или необязательно замещенный низший алкокси; более предпочтительно R1c представляет собой водород, метокси или этокси. Другое предпочтительное стентовое устройство по изобретению включает соединение формулы I,где R3 представляет собой водород, фтор в орто- или пара-положении или метил в мета-положении,трифторметил, метокси, фтор, хлор, бром или карбамоил. Другое предпочтительное стентовое устройство по изобретению включает соединение формулы I,где Za является N. Другое предпочтительное стентовое устройство по изобретению включает соединение формулы I,-4 007807 где Z3 является СН. Другое предпочтительное стентовое устройство по изобретению включает соединение формулы I,где Zb является NH. Другое предпочтительное стентовое устройство по изобретению включает соединение формулы I,где Zb является О. Предпочтительное стентовое устройство по изобретению включает соединения, выбранные из 2-анилино-6-хиноксалинол; 2-R)метилбензиламино)-6,7-диэтоксихиноксалин; 2-анилино-6-изопропоксихиноксалин; 2-фенокси-6-метоксихиноксалин;(3-хлорфенил)-(6,7-диметоксихиноксалин-2-ил)амин. Более предпочтительными видами являются следующие соединения: фенил[6-(тетрагидрофуран-3(R)-илокси)хиноксалин-2-ил]амин; бензил(6,7-диметоксихиноксалин-2-ил)амин; 2-S)метилбензиламино)-6,7-диэтоксихиноксалин; 2-бензиламино-6,7-диэтоксихиноксалин;(3-хлорфенил)-(6,7-диметоксихиноксалин-2-ил)амин. Предпочтительное стентовое устройство по изобретению представляет собой устройство, где полимерное покрытие включает один или более полимеров, выбранных из группы, состоящей из поликапролактона, сополимера поли(этиленвинилацетат), поли(винилацетата) и силиконовой ненаполненной резиновой смеси или один или более полимеров, выбранных из группы, состоящей из латексов, уретанов,полисилоксанов и блоксополимеров стирола-этилена /бутилена-стирола, или один или более полимеров,выбранных из группы, состоящей из поли-DL-молочной кислоты, поли-L-молочной кислоты, сложных полиортоэфиров, полииминокарбонатов, алифатических поликарбонатов и полифосфазенов. Предпочтительное стентовое устройство по изобретению представляет собой устройство, где полимерное покрытие дополнительно включает порообразователь, выбранный из группы, состоящей из микрогранул хлорида натрия, лактозы или натрийсодержащего гепарина или из группы, состоящей из полиэтиленгликоля и сополимеров полиэтиленоксида/полипропиленоксида. Предпочтительное стентовое устройство по изобретению представляет собой устройство, где на полимерное покрытие нанесена мембрана, контролирующая скорость высвобождения, для ограничения скорости высвобождения соединения формулы I из полимерного покрытия, которая включает порообра-5 007807 зователь, выбранный из группы, состоящей из хлорида натрия, лактозы, натрийсодержащего гепарина,полиэтиленгликоля, сополимеров полиэтиленоксида/полипропиленоксида и их смесей. Предпочтительное стентовое устройство по изобретению представляет собой устройство, где соединение формулы I включено в полимерное покрытие нанесением соединения формулы I по крайней мере на одну поверхность стентового устройства с образованием биологически активного слоя с последующим нанесением одного или нескольких покрытий пористого полимерного материала поверх биологически активного слоя, где пористый полимерный материал включает полиамид, парилен или производное парилена. Предпочтительное стентовое устройство по изобретению представляет собой устройство, где пористый полимерный материал наносят осаждением плазмы. Предпочтительное стентовое устройство по изобретению представляет собой устройство, где пористый полимерный материал выбирают из группы, состоящей из поли(этиленоксида), поли(этиленглиоля), поли(пропиленоксида), и полимеров метана, силикона и тетрафторэтилентетраметилдисилоксана. Предпочтительное стентовое устройство по изобретению представляет собой устройство, где полимерное покрытие получают добавлением фотополимеризуемого полиэтиленненасыщенного сложного эфира акриловой или метакриловой кислоты, содержащего две или более акрилатных и метакрилатных групп на молекулу или их смесей. Предпочтительное стентовое устройство по изобретению представляет собой устройство, где мономер выбирают из группы, состоящей из диакрилата этиленгликоля, диметакрилата этиленгликоля,триакрилата триметилпропана, триметакрилата триметилпропана, тетраакрилата пентаэритрита, тетраметакрилата пентаэритрита, диметакрилата 1,6-гександиола и диметакрилата диэтиленгликоля или группы,состоящей из н-бутилакрилата, н-бутилметакрилата, 2-этилгексилакрилата, лаурилакрилата и 2 гидроксипропилакрилата. Предпочтительное стентовое устройство по изобретению представляет собой устройство, где полимерное покрытие включает полимер, выбранный из группы, состоящей из поли(L-молочной кислоты),поликапролактона, сополимера поли(лактидгликолид), поли(гидроксибутирата), сополимера поли(гидроксибутират-валерат), полидиоксанона, полиортоэфира, полиангидрида, поли(гликолевой кислоты), поли(D,L-молочной кислоты), сополимера поли(гликолевая кислота-триметиленкарбонат), полифосфоэфира, полифосфоэфируретана, поли(аминокислот), цианоакрилатов, поли(триметиленкарбоната),поли(иминокарбоната), поли(простой эфир-сложные эфиры), полиалкиленоксалатов, полифосфазенов,фибрина, фибриногена, целлюлозы, крахмала, коллагена и гиалуроновой кислоты или полимер, выбранный из группы, состоящей из полиуретанов, силиконов, полиэфиров, полиолефинов, полиизобутилена и споплимера этилен-альфаолефин, полимеров и сополимеров акриловой кислоты, полимеров и сополимеров винилгалогенида, таких как поливинилхлорид, поливиниловых простых эфиров, таких как поливиниловый этиловый эфир, поливинилиденгалогенидов, таких как поливинилиденфторид и поливинилиденхлорид, полиакрилонитрила, поливинилкетонов, поливиниловых ароматических соединений, таких как полистирол, поливиниловых сложных эфиров, таких как поливинилацетат, сополимеров виниловых мономеров друг с другом и олефинами, таких как сополимеры этилена-метилметакрилата, сополимеры акрилонитрила-стирола, смолы ABS и сополимеры этилена-винилацетата, полиамидов, таких как Nylon 66 и поликапролактам, алкиловых смол, поликарбонатов, полиоксиметиленов, полиимидов, полиэфиров,эпоксидных смол, полиуретанов, искусственного волокна, триацетатного искусственного волокна, целлюлозы, ацетата целлюлозы, бутирата целлюлозы, ацетатбутирата целлюлозы, целлофана, нитрата целлюлозы, пропионата целлюлозы, простых эфиров целлюлозы и карбоксиметилцеллюлозы. Предпочтительным способом лечения рестеноза по изобретению является способ, где рестеноз находится в участке механического повреждения артериальной стенки, полученного при лечении атеросклеротического повреждения ангиопластикой. Данное изобретение охватывает все соответствующие комбинации характерных и предпочтительных сочетаний, упомянутых здесь. Соединения данного изобретения могут быть получены с использованием известных в литературе способов, исходя из известных соединений или легко получаемых промежуточных соединений. Примеры общих способов представлены далее. Кроме того, соединения формулы I получают согласно следующим схемам I-VI, где переменные такие, как описано выше, за исключением тех переменных, которые по оценке квалифицированного в данной области специалиста неприемлемы для описанного способа. Схема II. Общие методики. 1. Связывание 2-хлорзамещенного хиноксалина и аминов или анилинов. Смесь 2-хлор-6,7-диметоксихиноксалина (1 экв.) и амина (от около 1 до около 5 экв.) нагревают при от около 160 до около 180 С от около 3 ч до в течение ночи. Темно-коричневый остаток растворяют в смеси метанол/метиленхлорид (0-10%) и хроматографируют на силикагеле, элюируя смесью гексан/этилацетат или метанол/метиленхлорид (0-100%), получая требуемый продукт. Требуемый продукт должен быть далее очищен перекристаллизацией в метаноле, метиленхлориде или смеси метанол/вода. 2. Связывание 2-хлорзамещенного хиноксалина и спиртов или фенолов. Суспензию спирта или меркаптана (1 экв.) и гидрида натрия (от около 1 до около 3 зкв.) в безводном ДМФ/ТГФ (0-50%) кипятят с обратным холодильником в течение 1 ч перед добавлением 2-хлор-6,7 диметоксихиноксалина (1 экв.). Полученную смесь кипятят с обратным холодильником от около 1 до около 4 ч. Суспензию нейтрализуют до рН около 5-8 и распределяют между метиленхлоридом и насыщенным раствором соли. Остаток после концентрации метиленхлорида хроматографируют на силикагеле, элюируя смесью гексан/этилацетат или метанол/метиленхлорид (0-100%), получая требуемый продукт. 3. Реакция восстановительного аминирования с аминохинолинами и альдегидами или кетонами. Соответственно замещенный 3-аминохинолин (1 экв.) перемешивают с 1 экв. соответствующего альдегида или кетона в метаноле (или другой соответствующей смеси растворителей), пока ТСХ не покажет, что образование имина полностью завершено. Добавляют избыток NaCNBH4, или NaBH4, или другого соответствующего восстанавливающего агента и смесь перемешивают, пока ТСХ не покажет полный расход промежуточного имина. Смесь концентрируют и остаток хроматографируют на силикагеле со смесью гексан/этилацетат (0-100%) или хлороформ/метанол (0-20%), получая требуемый продукт. 4. Реакция связывания 3-аминозамещенных хинолинов и соединений бромфенила. Соответственно замещенный 3-аминохинолин (1 экв.) перемешивают с 1,4 экв. сильного основания, такого как т-бутоксид натрия, 1 экв. соответствующего соединения бромфенила и каталитическое количество 2,2'-бис(дифенилфосфино)-1-1'-бинафтила (S-BINAP) и бис(дибензилиденацетона)палладия(Pd(dba)2) смешивают в инертном органическом растворителе, таком как толуол, в атмосфере инертного газа, такого как аргон, и нагревают до около 80 С в течение ночи. Смесь охлаждают, разбавляют растворителем, таким как простой эфир, фильтруют, концентрируют и хроматографируют с 50%EtOAc/гексаном, получая требуемый продукт. 5. Образование простого эфира из 3-гидроксизамещенных хинолинов в условиях реакцииMitsunobu. Раствор в ТГФ соответственно замещенного гидроксихиноксалина (при температуре от около 0 до около 25 С) обрабатывают 1 экв. каждого из желательных спиртов, трифенилфосфином и, наконец, диэтилазадикарбоксилатом (ДЭАД) или подходящим эквивалентом. За развитием реакции следят с помощью ТСХ и после завершения реакции (от около 1 до около 24 ч) смесь концентрируют и остаток хроматографируют на силикагеле, получая требуемый продукт. 6. Деалкилирование хинолина или хиноксалина, замещенных низшим алкокси, и последующее алкилирование. Хинолин или хиноксалин, соответствующим образом замещенный низшим алкокси (1 экв.) в ДМФ обрабатывают избытком этантиолата натрия (обычно около 2 или более экв.), и реакционную смесь перемешивают при нагревании от около 1 до около 24 ч. Смесь распределяют между водой и этилацетатом. Экстракция с последующей хроматографией, если необходимо, дает требуемый гидроксизамещенный продукт хинолина или хиноксалина. Гидроксизамещенный хинолин или хиноксалин может быть алкилирован, используя условия реакции Mitsunobu, как детализировано выше. Альтернативно, простое алкилирование с использованием известных в уровне техники способов, реакционноспособным алкил- или бензил-галлогенидом, используяNaH или другое соответствующее основание, в подходящем растворителе дает требуемый алкилированный продукт. 7. Окисление азота в хинолине или хиноксалине с получением соответствующего N-оксида. Иминная (=N-) группа в соединении хинолина или хиноксалина формулы (I) может быть преобразована в соответствующее соединение, где иминная часть окислена до N-оксида предпочтительно взаимодействием с перкислотой, например перуксусной кислотой в уксусной кислоте или мхлорпероксибензойной кислотой в инертном растворителе, таком как дихлорметан, при температуре от комнатной до температуры кипения, предпочтительно при повышенной температуре. Соединения настоящего изобретения полезны в форме свободного основания или кислоты, или в форме их фармацевтически приемлемой соли. Все формы входят в объем изобретения. Если соединение по настоящему изобретению замещено основной группой, образуются аддитивные соли кислоты, которые являются простой и более удобной для использования формой; и на практике,использование солевых форм, по существу, количественно приравнено к использованию формы свободного основания. Кислоты, которые могут использоваться для получения кислотно-аддитивных солей,-9 007807 включают предпочтительно те, которые образуют при соединении со свободным основанием фармацевтически приемлемые соли, т.е. соли, анионы которых нетоксичны для пациента в фармацевтических дозах солей, так, что полезные ингибирующие эффекты на PDGF, присущие свободному основанию, не искажаются побочными эффектами, вызванными анионам. Хотя фармацевтически приемлемые соли указанных основных соединений являются предпочтительными, все кислотно-аддитивные соли полезны как источники формы свободного основания, даже если конкретная соль, как таковая, желательна только как промежуточный продукт, как, например, в том случае, когда соль образуется только для целей очистки и идентификации, или когда она используется как промежуточное соединение для получения фармацевтически приемлемой соли с использованием ионобменной методики. Фармацевтически приемлемые соли в объеме изобретения представляют собой такие, которые являются производными следующих кислот: неорганических кислот, таких как хлористо-водородная кислота, серная кислота, фосфорная кислота и сульфамовая кислота; и органических кислот, таких как уксусная кислота, лимонная кислота, молочная кислота, винная кислота, малоновая кислота, метансульфоновая кислота, этансульфоновая кислотная,бензолсульфоновая кислота, паратолуолсульфоновая кислота, циклогексилсульфамовая кислота, хинная кислота, и т.п Соответствующие кислотно-аддитивные соли включают следующие: гидрогалогениды,например, гидрохлорид и гидробромид, сульфат, фосфат, нитрат, сульфамат, ацетат, цитрат, лактат, тартрат, малонат, оксалат, салицилат, пропионат, сукцинат, фумарат, малеат, метилен-бис-гидроксинафтоаты, гентисаты, мезилаты, изотионаты и ди-паратолуолтартратметансульфонат, этансульфонат, бензолсульфонат, паратолуолсульфонат, циклогексилсульфамат и хинат соответственно. В соответствии с настоящим изобретением, кислотно-аддитивные соли соединений данного изобретения получают взаимодействием свободного основания с соответствующей кислотой, применяя или адаптируя известные способы. Например, кислотно-аддитивные соли соединений данного изобретения получают или растворением свободного основания в водном или водно-спиртовом растворе или в других подходящих растворителях, содержащих соответствующую кислоту, и выделением соли выпариванием раствора, или взаимодействием свободного основания и кислоты в органическом растворителе, когда соль непосредственно выделяется или может быть получена концентрированием раствора. Соединения данного изобретения можно регенерировать из кислотно-аддитивных солей, применяя или адаптируя известные способы. Например, исходные соединения изобретения могут быть регенерированы из их кислотно-аддитивных солей обработкой щелочью, например водным раствором бикарбоната натрия или водным раствором аммония. Если соединение по изобретению замещено кислотной группой, могут образовываться аддитивные соли основания, являясь простой более удобной для использования формой; и на практике использование формы соли, по существу, количественно приравнивается к использованию формы свободной кислоты. Основания, которые могут использоваться для получения основно-аддитивных солей, включают предпочтительно те, которые образуют при соединении со свободной кислотой фармацевтически приемлемые соли, т.е. соли, катионы которых нетоксичны для организма животного в фармацевтических дозах солей, так, чтобы полезные ингибирующие эффекты на PDGF свойственные свободной кислоте не искажались побочными эффектами, вызванными катионам. Фармацевтически приемлемые соли, включая, например, соли щелочных и щелочно-земельных металлов, в объеме изобретения представляют собой такие, которые являются производными от следующих оснований: гидрида натрия, гидроксида натрия, гидроксида калия, гидроксида кальция, гидроксида алюминия, гидроксида лития, гидроксида магния, гидроксида цинка, аммиака, триметиламмония, триэтиламмония, этилендиамина, н-метилгликамина, лизина, аргинина, орнитина, холина, N,N'дибензилэтилендиамина, хлорпрокаина, диэтаноламина, прокаина, н-бензилфенэтиламина, диэтиламина,пиперазина, трис(гидроксиметил)аминометана, гидроксида тетраметиламмония, и т.п. Соли металлов соединений настоящего изобретения могут быть получены при контактировании гидрида, гидроксида, карбоната или подобных реакционноспособных соединений выбранного металла в водном или органическом растворителе с соединением в форме свободной кислоты. Используемый водный растворитель может быть водой, или это может быть смесь воды с органическим растворителем,предпочтительно этиловым спиртом, таким как метанол или этанол, кетоном, таким как ацетон, простым эфиром алифатического ряда, таким как тетрагидрофуран, или сложным эфиром, таким как этилацетат. Такие реакции обычно проводятся при температуре окружающей среды, но их, если желательно, можно проводить с нагреванием. Аминные соли соединений настоящего изобретения могут быть получены контактированием амина в водном или органическом растворителе со свободной кислотной формой соединения. Соответствующие водные растворители включают воду и смеси воды со спиртами, такими как метанол или этанол,простыми эфирами, такими как тетрагидрофуран, нитрилами, такими как ацетонитрил, или кетонами,такими как ацетон. Аналогично можно получить соли аминокислот. Соединения данного изобретения можно регенерировать из основно-аддитивных солей, применяя или адаптируя известные способы. Например, исходные соединения по изобретению могут быть регенерированы из их основно-аддитивных солей обработкой кислотой, например, хлористо-водородной кислотой.- 10007807 Соли соединения по изобретению, являясь полезными сами по себе, как активные соединения, полезны и для целей очистки соединений, например, используя различие в растворимости между солями и исходными соединениями, побочными продуктами и/или исходными веществами, используя известные в уровне техники методики. Соединения по настоящему изобретению могут иметь центры асимметрии. Эти центры асимметрии могут независимо быть в S, или R конфигурации. Для специалиста в данной области также очевидно, что некоторые соединения формулы I могут проявлять геометрическую изомерию. Геометрические изомеры включают цис- и транс-формы соединений по изобретению, то есть соединения, имеющие алкенильные группы или заместители в кольцевых системах. Кроме того, бициклические кольцевые системы включают эндо и экзо изомеры. Настоящее изобретение включает отдельные геометрические изомеры, стереоизомеры, энантиомеры и их смеси. Такие изомеры могут быть выделены из их смесей с применением или адаптацией известных способов, например хроматографическими способами и способами перекристаллизации, или их отдельно получают из соответствующих изомеров их промежуточных соединений,например с применением или адаптацией описанных здесь способов. Исходные вещества и промежуточные соединения получают с применением или адаптацией известных способов, например способов, описанных в ссылочных примерах, или их очевидных химических эквивалентов, или описанных здесь в соответствии с изобретением способов. Настоящее изобретение далее иллюстрируется, не ограничиваясь ими, следующими иллюстративными примерами, которые описывают получение соединений согласно изобретению. Кроме того, следующие примеры представляют способы, использующиеся для синтеза соединений настоящего изобретения. Пример 1. 2-(3-Фторфениламино)-6,7-диэтоксихиноксалин. К 0,25 г (0,989 ммоль) 2-хлор-6,7-диэтоксихиноксалина добавляют 2 мл м-фторанилина. Смесь нагревают под азотом в течение ночи до 120 С. Полученную в результате смесь хроматографируют (30:1CH2Cl2:EtOH) для получения частично очищенного продукта. Полученное твердое вещество растирают с этилацетатом, получая 0,175 г продукта в виде коричневато-желтого твердого вещества с выходом 54,1%(т.п. 193 С). Элементный анализ. Рассчитано для C18H18N3O2F0,25 Н 2O: С 65,15; Н 5,62; N 12,66. Найдено: С 65,30; Н 5,30; N 12,41. Пример 2. 2-Анилино-6-метоксихиноксалина гидрохлорид. К 2-хлор-6-метоксихиноксалину (0,93 г, 4,8 ммоль) под аргоном добавляют анилин (1,3 мл, 14,3 ммоль). Реакционную смесь нагревают при 120 С в течение 2 ч, затем при 150 С в течение 1,5 ч. Смесь охлаждают и добавляют CH2Cl2. Полученную в результате суспензию перемешивают и оранжевое твердое вещество отфильтровывают, промывают CH2Cl2/Et2O, затем энергично перемешивают в Н 2 О в течение 40 мин,фильтруют и промывают Et2O, получая ярко-желтое твердое вещество. Следующие соединения получают аналогичным образом, используя соответствующие исходные соединения. 2-(3-Карбамоилфениламино)-6-метоксихиноксалин, т.п. 247 С. Элементный анализ. Рассчитано для C16H14N4O20,25 Н 2O: С 64,31; Н 4,89; N 18,75. Найдено: С 64,24; Н 5,04; N 18,75. 2-(2-Фторфениламино)-6,7-диэтоксихиноксалин, т.п. 184 С. Элементный анализ. Рассчитано для C18H18FN3O2: С 66,04; Н 5,54; F 5,80; N 12,84. Найдено: С 65,75; Н 5,61; N 12,68. 2-(3-Трифторметилфениламино)-6,7-диэтоксихиноксалин, т.п. 158 С. Элементный анализ. Рассчитано для C19H18F3N3O2: С 60,47; Н 4,81; F 15,10; N 11,14. Найдено: С 60,27; Н 4,84; N 10,97.(3-Хлорфенил)-(6,7-диметоксихиноксалин-2-ил)амин, т.п. 187-188 С. Элементный анализ. Рассчитано для C18H14ClN3O2: С 60,86; Н 4,47; Сl 11,23; N 13,31. Найдено: С 60,85; Н 4,59; N 13,26. Пример 3. 2-Бензиламино-6,7-диэтоксихиноксалин. К 0,3 г (1,19 ммоль) 2-хлор-6,7-диэтоксихиноксалина добавляют 2 мл бензиламина. Эту смесь нагревают под азотом в течение ночи до 120 С. Полученную в результате смесь распределяют между СН 2 Сl2 и насыщенным раствором NaHCO3. Органический слой концентрируют и остаток хроматографируют (30:1 СН 2 Сl2:EtOH) с получением 0,337 г продукта в виде желтого твердого вещества с выходом 87,6% (т.п.136 С). Элементный анализ. Рассчитано для C19H21N3O2: С 70,57; Н 6,54; N 12,99. Найдено: С 70,54; Н 6,66;N 12,80. Следующие соединения получены аналогичным образом, с использованием соответствующих исходных веществ.N 12,80. Пример 4. 2-R)- -метилбензиламино-6,7-диэтоксихиноксалин. К 0,3 г (1,19 ммоль) 2-хлор-6,7-диэтоксихиноксалина добавляют 2 мл (R)-(+)- -метилбензиламина. Эту смесь нагревают в течение 3 дней под азотом до 120 С. Полученную в результате смесь распределяют между СНСl3 и насыщенным раствором NaHCO3. Органический слой концентрируют и остаток хроматографируют (30:1 СН 2 Сl2:EtOH), получая 0,118 г продукта в виде желтого твердого тела с выходом 29,4% (т.п.53-56 С). Элементный анализ. Рассчитано для C20H23N3O20,25 Н 2O: С 70,26; Н 6,93; N 12,29. Найдено: С 70,56; Н 6,80; N 12,35. Следующее соединение получено аналогичным образом с использованием соответствующих исходных веществ. 2-S)- -Метилбензиламино)-6,7-диэтоксихиноксалин, т.п. 55-58 С. Элементный анализ. Рассчитано для C20H23N3O20,25 Н 2O: С 70,26; Н 6,93; N 12,29. Найдено: С 70,49; Н 6,89; N 12,23. Пример 5. 2,7-бис-Циклогексилокси-6-метоксихиноксалин. К раствору NaH (0,32 г, 8 ммоль) в ДМФ (5 мл) под аргоном добавляют по каплям циклогексанол(0,7 мл, 6,7 ммоль). Смесь перемешивают при комнатной температуре в течение 25 мин, затем по порциям добавляют 2-хлор-6,7-диметоксихиноксалин. Реакционную смесь перемешивают при комнатной температуре в течение 15 мин, при 90 С в течение 2 ч и при 110 С в течение 1 ч. Смесь охлаждают, гасят Н 2O и распределяют между EtOAc/H2O. Органический слой промывают Н 2O и насыщенным раствором соли, сушат (MgSO4) и хроматографируют (10% EtOAc/гексан), получая воскообразное твердое вещество белого цвета (т.п. 75-78 С). Элементный анализ. Рассчитано для C21H28N2O3: С 70,76; Н 7,92; N 7,86; Найдено: С 70,81; Н 7,79;N 7,70. Следующие соединения получены аналогичным образом с использованием соответствующих исходных веществ. 2-Фенокси-6-метоксихиноксалин, т.п. 79-81 С и(7,5 мл, 0,5 ммоль) добавляют циклогексиламин (0,11 мл, 0,9 ммоль). Реакционную смесь оставляют перемешиваться при комнатной температуре в течение ночи, затем добавляют NaBH4 (0,038 г, 1 ммоль) и реакционную смесь перемешивают в течение ночи. Затем смесь концентрируют и хроматографируютEtOAc/гексан и обрабатывают НСl в EtOH. Полученный в результате раствор концентрируют и твердые частицы растирают с изопропиловым спиртом, получая белое твердое вещество после сушки в вакууме при 60 С (т.п. 185-190 С, с разл.). Элементный анализ. Рассчитано для C17H23N3O2 НСl: С 60,44; Н 7,16; N 12,44; Найдено: С 60,48; Н 6,88; N 12,07. Пример 7. Циклогексил-(6-метокси-7-морфолин-4-ил-хиноксалин-2-ил)амин. Для получения данного вещества используется адаптированный способ, описанный в Buchwald, et(0,1 г, 0,3 ммоль) в толуоле под аргоном добавляют тетрагидрооксазин (0,1 г, 0,3 ммоль), трет-бутоксид натрия (0,04 г, 0,42 ммоль), S-(-)-BINAP (кат., 0,001 г), и Pd(dba)2 (кат., 0,001 г). Реакционную смесь нагревают до 80 С в течение ночи. Смесь охлаждают, разбавляют Et2 О, фильтруют, концентрируют и хроматографируют (50% EtOAc/гексан). Продукт перекристаллизовывают из смеси EtOAc/гексан, получая в двух порциях желтое твердое вещество (т.п.194-196 С). Элементный анализ. Рассчитано для C19H26N4O2: С 66,64; Н 7,65; N 16,36; Найдено: С 66,60; Н 7,60;N 16,51. Пример 8. 3-Циклогексилокси-6,7-диметоксихинолин. К раствору ТГФ (30 мл) при 0 С добавляют 3-гидрокси-6,7-диметоксихинолин (0,237 г, 1,15 ммоль),циклогексанол (0,347 г, 3,46 ммоль), Ph3P (0,908 г, 3,46 ммоль). По порциям добавляют диэтилазодикарбоксилат до тех пор, пока раствор остается глубокого красного цвета (0,663 г, 3,81 ммоль). Через 4 ч раствор концентрируют и остаток хроматографируют (50% EtOAc в гексане). Продукт перекристаллизовывают из смеси изопропанол/гексан, получая соль НСl в виде твердого белого вещества (т.п. 229-232 С, с разл.). Пример 9. 2-Анилино-6-хиноксалинол. Способом, описанным в Feutrill, G.I.: Mirrington, R.N. Tet. Lett. 1970. 1327; метиловый эфир арила превращают в фенольное производное. К 2-анилино-6-метоксихиноксалину (0,27 г, 1,07 ммоль) под аргоном в ДМФ добавляют натриевую соль этантиола (0,19 г, 2 ммоль). Реакционную смесь нагревают до 110 С в течение ночи. Смесь концентрируют и распределяют между EtOAc и Н 2O/5% винной кислотой так, чтобы рН водного слоя составлял приблизительно 4. Органический слой промывают Н 2O (4 Х), затем 2,5% NaOH (4X). Основные слои объединяют, промывают EtOAc (2X), снова подкисляют 5% винной кислотой и промывают несколькими порциями EtOAc. Органические слои объединяют, промывают насыщенным раствором соли, сушат (Na2SO4) и концентрируют. Полученное в результате твердое вещество хроматографируют (50% EtOAc/гексан). Аналитический образец получают, растирая продукт с Et2O с получением желтого порошка, (т.п. 211-213 С). Элементный анализ. Рассчитано для C14H11N3O: С 70,88; Н 4,67; N 17,71; Найдено: С 70,64; Н 4,85;N 17,58. Пример 10. Фенил-[6-(тетрагидрофуран-3-(R)-ил-окси)хиноксалин-2-ил]амин. К раствору ТГФ при 0 С под аргоном добавляют 2-анилино-6-хиноксалинол (0,23 г, 0,97 ммоль),(S)-(+)-3-гидрокситетрагидрофуран (0,086 мл, 1,3 ммоль), и трифенилфосфин (0,31 г, 1,2 ммоль). По порциям добавляют ДЭАД (0,18 мл, 1,2 ммоль). Реакционной смеси дают нагреться до комнатной температуры и перемешивают в течение 1,5 ч. Смесь концентрируют и распределяют между EtOAc и Н 2O. Органический слой промывают Н 2O, насыщенным раствором соли, сушат (MgSO4) и концентрируют. Полученное в результате желтое масло подвергают хроматографии (50% EtOAc/гексан) и переносят вEt2O/IPA (изопропанол). По каплям добавляют раствор HCl/Et2O и полученный в результате краснооранжевый порошок сушат в вакууме. Порошок переводят в форму свободного основания, перемешивая в МеОН с промытой (3 Х Н 2O, 5 Х МеОН) основной ионообменной смолой. Смесь перемешивают 30 мин,фильтруют, концентрируют и перекристаллизовывают из смеси EtOAc/гексан, получая в двух порциях продукт (т.п. 173-175 С). Элементный анализ. Рассчитано для C18H17N3O2: С 70,35; Н 5,57; N 13,67; Найдено: С 70,19; Н 5,60;N 13,66. Пример 11. 2-Анилино-6-изопропоксихиноксалина гидрохлорид. К NaH (0,033 г, 0,84 ммоль) под аргоном добавляют 1 мл ДМФ. 2-Анилино-6-хиноксалинол (0,1 г,0,42 ммоль) в 1,5 мл ДМФ добавляют по порциям. Через 30 мин добавляют по каплям 2-бромпропан и раствор нагревают до 50 С в течение 1,5 ч. Охлажденную реакционную смесь гасят водой и распределя- 13007807 ют между EtOAc и Н 2O, промывают Н 2O (3 Х), насыщенным солевым раствором, сушат (MgSO4) и концентрируют. Полученный в результате остаток подвергают хроматографии (30% EtOAc/гексан), получая 0,05 г диалкилированного продукта и 0,1 г названного в заголовке соединения. Аналитический образец соли НСl получают добавлением ИПА/НСl к раствору свободного основания в Et2O/ИПA, (т.п. 205-210 С с разл.). Элементный анализ. Рассчитано для C17H17N3OНСl: С 64,65; Н 5,74; N 13,31; Найдено: С 64,51; Н 5,90; N 13,09. Пример 12. 3-Циклогексилокси-6,7-диметоксихиноксалин 1-оксид. Смесь 2-циклогексилокси-6,7-диметоксихиноксалина (110 мг, 0,38 ммоль) и метахлорбензойной перкислоты (70%, 113 мг, 0,46 ммоль) в 10 мл метиленхлорида перемешивают при комнатной температуре в течение 1 дня. Раствор после фильтрации концентрируют и остаток хроматографируют на силикагеле (20% этилацетат/гексан), получая требуемый продукт (т.п. 167-169 С). транс-4-(6,7-Диметокси-4 оксихиноксалин-2-иламино)циклогексанол (т.п. 220-222 С) получают аналогичным образом. Элементный анализ. Рассчитано для C16H21N3O40,2 Н 2O: С 59,42; Н 6,69; N 12,99; Найдено: С 59,43; Н 6,64; N 12,95. Ппимер 1 (промежуточное соединение). 4-Бром-5-метоксибензол-1,2-диамина дигидрохлорид. К раствору EtOAc (50 мл) и 5-бром-4-метокси-2-нитрофениламина (2,5 г, 10 ммоль) под аргоном добавляют 5% Pd/C (0,5 г). Реакционную смесь гидрируют при 3,515 кг/см 2 в течение 1 ч. Смесь фильтруют через целит в раствор HCl/ИПA/EtOAc, и слой целита промывают дополнительным количествомEtOAc. Полученный в результате осадок отфильтровывают, получая белое твердое вещество. Пример 2 (промежуточное соединение). 7-Бром-6-метоксихиноксалин-2-ол и 6-бром-7 метоксихиноксалин-2-ол. К раствору МеОН (15 мл) под аргоном добавляют NaOH в виде пуливеризованных гранул (0,86 г,21 ммоль) и 4-бром-5-метоксибензол-1,2-диамина дигидрохлорид (2,7 г, 9,3 ммоль). Смесь перемешивают в течение 10 мин, затем порциями добавляют раствор 45% этилглиоксилата в толуоле (2,7 г, 12 ммоль). Реакционную смесь кипятят с обратным холодильником в течение 1 ч, затем охлаждают. Добавляют воду, затем суспензию фильтруют. Полученное в результате твердое вещество промывают последовательно Н 2O, МеОН, ИПА и Et2O, получая желтый порошок. Пример 3 (промежуточное соединение). 7-Бром-2-хлор-6-метоксихиноксалин и 6-бром-2-хлор-7 метоксихиноксалин. К смеси 7-бром-6-метоксихиноксалин-2-ола и 6-бром-7-метоксихиноксалин-2-ола (1 г, 3,9 ммоль) добавляют РОСl3 (5 мл). Реакционную смесь кипятят с обратным холодильником 1 ч, выливают в ледяную воду, фильтруют, затем промывают водой, получая твердое светло-рыжеватое вещество. Соотношение 7-бром-2-хлор-6-метоксихиноксалин:6-бром-2-хлор-7-метоксихиноксалин приблизительно составляет 7:1 при определении по 1 Н ЯМР. Пример 4 (промежуточное соединение). 5-Хлор-4-метокси-2-нитроанилин. К раствору N-(5-хлор-4-метокси-2-нитрофенил)ацетамида (2 г, 8,2 ммоль) в 5 н. НСl (20 мл) добавляют 1,4-диоксан (10 мл) и смесь перемешивают при 60 С в течение 1,5 ч. Реакционную смесь концентрируют и распределяют между EtOAc/2H NaOH. Водные слои промывают EtOAc (3X), насыщенным солевым раствором, сушат (MgSO4), адсорбируют на силикагель и подвергают хроматографии (70%EtOAc/гексаны), получая оранжевый порошок. Пример 5 (промежуточное соединение). 4-Хлор-5-метоксибензол-1,2-диамина дигидрохлорид. К раствору EtOAc (25 мл) и 5-хлор-4-метокси-2-нитрофениламина (1,6 г, 7,9 ммоль) под аргоном добавляют 5% Pd/C (0,5 г). Реакционную смесь гидрируют при 3,515 кг/см 2 в течение 1 ч. Смесь фильтруют под N2 через целит в раствор 1 н. HCl/Et2O в EtOAc и слой целита промывают дополнительным количеством EtOAc. Полученный в результате осадок фильтруют, получая белое твердое вещество. Пример 6 (промежуточное соединение). 7-Хлор-6-метоксихиноксалин-2-ол и 6-хлор-7-метоксихиноксалин-2-ол. К раствору 4-хлор-5-метоксибензол-1,2-диамина дигидрохлорида (1,8 г, 7,2 ммоль) в EtOH (15 мл) под аргоном добавляют ТЭА (2,5 мл, 18 ммоль) при 0 С. Смесь перемешивают в течение 20 мин, затем по порциям добавляют раствор 45% этилгиколата в толуоле (2,1 г, 9,3 ммоль). Реакционную смесь нагревают до комнатной температуры, кипятят с обратным холодильником в течение 1,5 ч, затем охлаждают,добавляют воду, затем суспензию фильтруют и промывают последовательно Н 2O, ИПА, и Et2O, получая светло-желтый порошок. Продукт подвергают азеотропной перегонке несколько раз с толуолом и сушат в вакууме перед использованием. Пример 7 (промежуточное соединение). 2,7-Дихлор-6-метоксихиноксалин и 2,6-дихлор-7-метоксихиноксалин. К смеси 7-хлор-6-метоксихиноксалин-2-ола и 6-хлор-7-метоксихиноксалин-2-ола (1 г, 4,7 ммоль) под осушающей трубкой с СаСl2 добавляют РOСl3 (5 мл). Реакционную смесь кипятят с обратным холодильником 30 мин, выливают в холодный насыщенный раствор NаНСО 3, фильтруют, затем промывают водой, получая твердое вещество. Соотношение 2,7-дихлор-6-метоксихиноксалин:2,6-дихлор-7- 14007807 метоксихиноксалин составляет приблизительно 6:1 при определении по 1 Н ЯМР. Соединения формулы I, как описано здесь, ингибируют клеточную пролиферацию и/или продуцирование клеточного матрикса, и/или перемещение клетки (хемотаксис) посредством ингибирования активности тирозинкиназы PDGF-R. Большое количество болезненных состояний вызвано или неуправляемым воспроизводством клеток, или сверхпродуцированием матрикса, или плохо регулируемой программированной гибелью клетки (апоптоз). При этих болезненных состояниях вовлечены различные типы клеток и они включают такие заболевания, как лейкемия, рак, глиобластома, псориаз, воспалительные заболевания, заболевания костей, фиброзные заболевания, атеросклероз и последствия пластических операций на коронарных сосудах, бедренных или почечных артериях или фибропролиферативные заболевания, такие как артрит, фиброз легкого, почки и печени. В частности, есть сообщения, что PDGF иPDGF-R вовлечены в определенные виды раковых заболеваний и опухолей, таких как рак мозга, рак яичника, рак ободочной кишки, рак легкого, рак простаты, саркома Капоши и злокачественная меланома. Кроме того, нерегулируемая клеточная пролиферация может быть следствием коронарного шунтирования. Ингибирование активности тирозинкиназы, как полагают, может использоваться для контроля неуправляемого воспроизводства клеток, или сверхпродуцирования матрикса, или плохо регулируемой программированной гибели клетки (апоптоз). Данное изобретение касается модуляции и/или ингибирования передачи сигналов клетки, клеточной пролиферации и/или продуцирования клеточного матрикса, и/или перемещения клетки (хемотаксис),контроля аномального роста клетки и клеточной воспалительной реакции. Более определенно, это изобретение касается использования соединений замещенного хинолина и хиноксалина, которые обладают селективным ингибированием дифференциации, пролиферации, продуцирования матрикса, хемотаксиса или высвобождения медиатора путем эффективного ингибирования активности тирозинкиназырецептора тромбоцитарного фактора роста (PDGF-R). Инициирование автофосфорилирования, то есть фосфорилирования непосредственно рецептора фактора роста, и фосфорилирования хозяина внутриклеточных субстратов является одним из биохимических явлений, которые вовлечены в передачу сигналов клетки, клеточную пролиферацию, продуцирования матрикса, хемотаксис и высвобождении медиатора. Вследствие эффективного подавления активности Lck тирозинкиназы, соединения данного изобретения также полезны для лечения сопротивляемости при трансплантации и аутоиммунных заболеваний,таких как ревматоидный артрит, множественный склероз и системная красная волчанка, отторжения трансплантата, реакции трансплантат против хозяина, гиперпролиферативных заболеваний, таких как опухоли и псориаз, и заболеваний, при которых клетки получают провоспалительные сигналы, таких как астма, воспалительные заболевания кишечника и панкреатит. При лечении сопротивляемости при трансплантации, соединения данного изобретения могут использоваться или профилактически, или в ответ на враждебную реакцию организма человека, подвергнутого пересадке органа или ткани. При профилактическом использовании соединение данного изобретения вводится пациенту или в ткань или орган, который будет пересажен перед операцией по трансплантации. Профилактическое лечение может также включать введение медикамента после операции по трансплантации, но до того, как начнут наблюдаться какие-либо признаки враждебной реакции к трансплантации. При введении в ответ на враждебную реакцию, соединение данного изобретения вводится непосредственно пациенту с целью лечения сопротивляемости к трансплантации после проявления видимых признаков сопротивляемости. Следует понимать, что используемый здесь термин лечение включает профилактическое лечение,а также лечение установленных состояний. Композиции в соответствии с изобретением могут быть получены в виде готовой препаративной формы таким способом, который предотвращает быстрый клиренс из сосудистой (артериальной или венозной) стенки конвекцией и/или диффузией, увеличивая таким образом время удерживания вирусных частиц в желательном месте действия. Для замедленного высвобождения может использоваться периадвентициальное депо, включающее соединение по изобретению. Одно из таких удобных депо для введения соединения по изобретению может представлять собой матрицу сополимера, такого как этиленвинилацетат, или гель поливинилового спирта, окруженный оболочкой Силастика. Альтернативно, соединение по изобретению может доставляться в определенное место из селиконового полимера, имплантированного в адвентициальную оболочку. Альтернативный способ уменьшения вымывания соединения по изобретению в процессе чрескожной, трансваскулярной доставки включает использование препятствующих диффузии элюирующих лекарственное средство микрочастиц. Микрочастицы могут состоять из различных синтетических полимеров, таких как, например, полилактид, или природных материалов, включая белки или полисахариды. Такие микрочастицы предоставляют возможность для стратегической манипуляции изменяемыми величинами, включающими общую дозу лекарственного средства и кинетику его высвобождения. Микрочастицы могут быть эффективно инъецированы в артериальную или венозную стенку через пористый баллонный катетер или баллон на стенте, и сохраняются в стенке сосуда и периадвентициальной ткани в течение по крайней мере приблизительно 2 недель. Готовые препаративные формы и способы местной внутрисосудистой доставки терапевтических агентов в конкретный участок обсуждены в Reissen et al. (J.Am. Coll. Cardiol. 1994; 23: 1234-1244), полное содержание которого включено сюда в качестве ссылки. Композиция в соответствии с изобретением может также включать гидрогель, который получают из любого биологически совместимого или нецитотоксического (гомо или гетеро) полимера, такого как гидрофильный полимер полиакриловой кислоты, который может действовать как губка, абсорбирующая лекарственное средство. Такие полимеры описаны, например, в заявке WO93/08845, полное содержание которой включено сюда в качестве ссылки. Некоторые из них, в частности, такие, которые получены из этилена и/или окиси пропилена, являются коммерчески доступными. При использовании соединений по изобретению для лечения патологий, связанных с гиперпролиферативными заболеваниями, соединения по изобретению могут вводиться различными способами. Для лечения рестеноза, соединения по изобретению вводятся непосредственно в стенку кровеносного сосуда посредством баллона для ангиопластики, покрытого гидрофильной пленкой (например гидрогелем), насыщенной соединением, или посредством любого другого катетера, содержащего инфузионную камеру для соединения, который может таким образом вводиться точно в место, нуждающееся в лечении, и позволяет соединению высвобождаться в определенном месте и эффективно в области расположения клеток, подлежащих лечению. Этот способ введения преимущественно обеспечивает быстрый контакт соединения с клетками, нуждающимися в лечении. Способ лечения по изобретению предпочтительно включает введение соединения по изобретению в место, подлежащее лечению. Например, гидрогель, содержащий композицию, может быть нанесен непосредственно на поверхность ткани, подлежащую лечению, например в процессе хирургического вмешательства. В предпочтительном варианте гидрогель вводится в желательный внутрисосудистый участок путем покрытия катетера, например баллонного катетера, и доставки к сосудистой стенке предпочтительно во время пластической операции на сосудах. В особенно предпочтительном варианте, насыщенный гидрогель вводится в область, подлежащую лечению, посредством балонного катетера. Баллон может обеспечиваться защитной оболочкой во время продвижения катетера к целевому сосуду, чтобы минимизировать вымывание лекарственного средства после введения катетера в кровоток. Соединение по изобретению можно вводить посредством перфузионных баллонов. Такие перфузионные баллоны, которые делают возможным сохранение кровотока и, таким образом, уменьшают риск ишемии миокарда при раздувании баллона, также позволяют доставлять соединение в определенную область при нормальном давлении в течение относительно длительного времени, более двадцати минут,которое может быть необходимо для его оптимального действия. Альтернативно, можно использовать канальный баллонный катетер (канальный баллонный катетер для ангиопластики, Mansfield Medical,Boston Scientific Corp., Watertown, MA). Последний состоит из обычного баллона, покрытого слоем из 24 перфорированных каналов, которые обрызгивают через независимую полость через дополнительное инфузионное отверстие. Различные типы баллонных катетеров, такие как двойной баллон, пористый баллон, микропористый баллон, канальный баллон, баллон над стентом и катетер с гидрогелем, все из которых могут использоваться в практическом применении изобретения, раскрыты в Reissen et al. (1994),полное содержание которого включено сюда в качестве ссылки. Использование перфузионного баллонного катетера особенно выгодно, поскольку он одновременно имеет преимущества как в хранении раздутого баллона в течение длительного периода времени, сохраняя свойства облегченного скольжения, так и в сайт-специфичности гидрогеля. Другой аспект настоящего изобретения касается фармацевтической композиции, включающей соединение по изобретению и полоксамер, такой как Poloxamer 407 - нетоксичный, биологически совместимый полиол, коммерчески доступный (BASF, Parsippany, NJ). Полоксамер, импрегнированный соединением по изобретению, может быть нанесен непосредственно на поверхности ткани, подлежащей лечению, например во время хирургического вмешательства. Полоксамер обладает, по существу, теми же самыми преимуществами, что и гидрогель, при наличии более низкой вязкости. Особенно выгодно использование канального баллонного катетера с полоксамером, импрегнированным соединением по изобретению. В этом случае, одновременно получают преимущества как в хранении раздутого баллона в течение длительного периода времени, при сохранении свойств облегченного скольжения, так и в сайт-специфичности полоксамера. Процент активного ингредиента в композициях по изобретению может меняться, причем необходимо, чтобы они содержали такое его количество, которое обеспечивало бы подходящую дозу. Очевидно, несколько единичных дозированных форм могут вводиться примерно в одно и то же время. Используемая доза может быть определена врачом или квалифицированым медицинским профессионалом и зависит от желательного терапевтического эффекта, пути введения и продолжительности лечения и состояния пациента. Дозы для взрослого составляют в целом от около 0,001 до около 50, предпочтительно от около 0,001 до около 5 мг/кг веса тела в день при введении ингаляцией, от около 0,01 до около 100,предпочтительно от 0,1 до 70, особенно от 0,5 до 10 мг/кг веса тела в день при пероральном введении и от около 0,001 до около 10, предпочтительно от 0,01 до 10 мг/кг веса тела в день при внутривенном введении. В каждом конкретном случае дозы определяются в соответствии с факторами, характерными для конкретного пациента, нуждающегося в лечении, такими как возраст, вес, общее состояние здоровья и- 16007807 другими характеристиками, которые могут влиять на эффективность соединения по изобретению. Соединения/композиции в соответствии с изобретением могут вводиться настолько часто, насколько необходимо для получения желательного терапевтического эффекта. Некоторые пациенты могут реагировать быстро на высокую или низкую дозу, а для некоторых адекватными могут быть намного более слабые поддерживающие дозы. Для других пациентов, может быть необходимо проводить долговременное лечение при норме от 1 до 4 доз в день в соответствии с физиологическими требованиями каждого конкретного пациента. В целом активный продукт можно вводить перорально 1-4 раза в день. Конечно,для других пациентов необходимо прописывать не более 1 или 2 доз в день. Соединения настоящего изобретения могут также быть получены в виде препаратов для использования в сочетании с другими терапевтическими агентами, или в сочетании с применением терапевтических методов, направленных на фармакологические состояния, которые могут быть облегчены введением соединения формулы I, такие как следующие. Соединения настоящего изобретения могут использоваться для лечения рестеноза после ангиопластики, использующей любое средство, такое как баллон, ампутация или лазерные методики. Соединения настоящего изобретения могут использоваться для лечения рестеноза следующего за введением стента в сосудистую сеть, или в качестве 1) первичного лечения при сосудистой блокаде или 2) в случаях, когда при ангиопластике с использованием любых устройств невозможно получить доступную артерию. Соединения настоящего изобретения могут использоваться перорально, парентеральным введением, или соединение может наноситься местно посредством введения специального устройства или в виде соответствующим образом сформированного покрытия на стентовом устройстве. Для местного применения в виде покрытия на стенте стентовое устройство с покрытием получают,нанося полимерный материал с включенным в него соединением по изобретению по крайней мере на одну поверхность стентового устройства. Полимерные материалы, подходящие для включения соединения по изобретению, включают полимеры, имеющие относительно низкие температуры обработки, такие как поликапролактон, поли(этиленсо-винилацетат) или поли(винилацетат) или силиконовый каучук, и полимеры, имеющие подобные относительно низкие температуры обработки. Другие подходящие полимеры включают неразлагающиеся полимеры, способные к переносу и доставке терапевтических лекарственных средств, такие как латексы,уретаны, полисилоксаны, блок-сополимеры стирол-этилен/бутилен-стирол (SEBS), и биоразлагаемые,биоабсорбируемые полимеры, способные к переносу и доставке терапевтических лекарственных средств,такие как поли-DL-молочная кислота (DL-PLA), и поли-L-молочная кислота (L-PLA), полиортоэфиры,полиполииминокарбонаты, алифатические поликарбонаты и полифосфазены. Порозиген может также быть включен в полимер, загруженный лекарственным средством, путем добавления порозигена к полимеру наряду с терапевтическим лекарственным средством с целью образования пористой полимерной мембраны, загруженной лекарственным средством. Порозиген означает любую часть, такую, например, как микрогранулы хлорида натрия, лактозы или гепарина натрия, который будет растворяться или иначе разлагаться при погружении в жидкости тела, оставляя пористую сетку в полимерном материале. Поры, оставляемые такими порозигенами, обычно могут быть более 10 мкм. Поры, образованные порозигенами, такими как полиэтиленгликоль (ПЭГ), сополимеры полиэтиленоксид/полипропиленоксид (РЭО/РПО), например, могут также быть меньше одного микрона, хотя другие подобные материалы, которые образуют фазовые разделения в непрерывной полимерной матрице, загруженной лекарственным средством, и могут позже выщелачиваться жидкостями тела, также могут подходить для образования пор менее одного микрона. Полимерный материал может наноситься на стент, в то время как терапевтическое лекарственное средство и порозигенный материал содержатся в полимерном материале, чтобы порозиген мог растворяться или разлагаться жидкостями тела при размещении стента в кровеносном сосуде, или альтернативно, порозиген может растворяться и удаляться из полимерного материала с образованием пор в полимерном материале до размещения полимерного материала, объединенного со стентом в кровеносном сосуде. Если требуется, поверх полимера, загруженного лекарственным средством, может также наноситься мембрана с контролируемой скоростью, для ограничения скорости высвобождения соединения по изобретению. Скорость-контролирующая мембрана может добавляться нанесением раствора образующего покрытие или ламинированием. Скорость-контролирующая мембрана, нанесенная на полимерный материал, может быть формирована таким образом, чтобы включать однородную дисперсию порозигена,и порозиген в мембране, контролирующей скорость, может быть растворен, чтобы оставлять в скоростьконтролирующей мембране большие поры размером 10 мкм или небольшие, например всего 1 мкм, хотя поры могут также быть меньше 1 мкм. Порозигеном в скорость-контролирующей мембране может быть,например, хлорид натрия, лактоза, гепарин натрия, полиэтиленгликоль, сополимеры полиэтиленоксид/полипропиленаоксид и их смеси. В другом аспекте покрытие на стентовом устройстве может быть образовано нанесением соединения по изобретению по крайней мере на одну поверхность стентового устройства для образования биоактивного слоя с последующим нанесением одной или большего количества оболочек пористого полимерного материала поверх биоактивного слоя так, чтобы пористый полимерный материал имел толщину,- 17007807 подходящую для обеспечения контролируемого высвобождения соединения. Пористый полимерный материал состоит из полиамида, парилена или производных парилена, которые наносятся на зондовое устройство осаждением пара без катализатора. Парилен относится к полимеру, основанному на пара-ксилилене и получаемому полимеризацией в паровой фазе, как описано в патенте США 5824049, включенном сюда в качестве ссылки. Альтернативно, пористый полимерный материал наносится осаждением плазмы. Характерные полимеры, подходящие для осаждения плазмы, включают поли(этиленоксид), поли(этиленгликоль), поли(пропиленоксид), и полимеры метана, кремния, тетрафторэтилена тетраметилдисилоксана и т.п. Другие подходящие полимерные системы включают полимеры, производные фотополимеризуемых мономеров, таких как жидкие мономеры, предпочтительно имеющие по крайней мере две поперечные СС (углерод-углерод) двойные связи, и являющиеся этиленненасыщенными соединениями полимеризуемыми присоединением в негазовой фазе с температурой кипения более 100 С при атмосферном давлении, с молекулярным весом около 100-1500 и способными к легкому образованию высокомолекулярных полимеров присоединения. Более предпочтительно, мономер представляет собой фотополимеризуемый присоединением полиэтиленненасыщенный эфир акриловой или метакриловой кислоты, содержащий две или более акрилатных или метакрилатных групп на молекулу, или их смеси. Характерные примеры таких полифункцональных акрилатов представляют этиленгликольдиакрилат, этиленгликоль диметакрилат, триметилпропантриакрилат, триметилпропантриметакрилат, пентаэритриолтетраакрилат или пентаэритритолтетраметакрилат, 1,6-гександиолдиметакрилат и диэтиленгликольдиметакрилат. В некоторых конкретных случаях также полезны моноакрилаты, такие как н-бутилакрилат, нбутилметакрилат, 2-этилгексилакрилат, лаурилакрилат и 2-гидроксипропилакрилат. Также могут использоваться небольшие количества амидов (мет)акриловой кислоты, таких как бутиловый эфир Nметилолметакриламида, N-виниловые соединения, такие как N-винилпирролидон, виниловые эфиры алифатических монокарбоновых кислот, такие как винилолеат, виниловые эфиры диолов, такие как бутандиол-1,4-дивиниловый эфир и аллиловый простой эфир, и аллиловый сложный эфир. Также могут включаться другие мономеры, такие как продукты взаимодействия ди- или полиэпоксидов, такие как бутандиол-1,4-диглицидилового эфира или бисфенолдиглицидилового эфира с (мет)акриловой кислотой. Характеристики фотополимеризуемой жидкой дисперсионной среды могут быть изменены для конкретных целей подходящим выбором мономеров или их смесей. Другие полезные полимерные системы включают полимер, который является биологически совместимым и минимизирует раздражение стенки сосуда при имплантации стента. Полимер может быть или биостабильным или биоабсорбируемым полимером в зависимости от желаемой скорости выделения или желаемой степени стабильности полимера. Возможные для использования биоабсорбируемые полимеры включают поли(L-молочную кислоту), поликапролактон, поли(лактид-согликолид), поли(гидроксибутират), поли(гидроксибутират-совалерат), полидиоксанон, полиортоэфир, полиангидрид, поли(гликолевую кислоту), поли(D,L-молочную кислоту), поли(гликолевая кислота-котриметиленкарбонат),полифосфо(сложный)эфир, полифосфо(сложный эфир)уретан, поли(аминокислоты), цианоакрилаты, поли(триметилкарбонат), поли(иминокарбонат), сополи(простой эфир-сложный эфир) (например,PEO/PLA), полиалкиленоксалаты, полифосфофазены и биомолекулы, такие как фибрин, фибриноген,целлюлоза, крахмал, коллаген и гиалуроновая кислота. Также могут использоваться биостабильные полимеры с относительно низким хроническим ответом ткани, такие как полиуретаны, селиконы и поли(сложные)эфиры, и также могут использоваться другие полимеры, если они могут быть растворены и отверждены или полимеризованы на стенте, такие как полиолефины, полиизобутилен и сополимеры этилен-альфаолефин; акриловые полимеры и сополимеры, винилгалогенидные полимеры и сополимеры,такие как поливинилхлорид; поливиниловые эфиры, такие как поливинилметиловый эфир; поливинилиденовые галогениды, такие как поливинилиденфторид и поливинилиденхлорид; полиакрилонитрил, поливиниловые кетоны, поливиниловые ароматические соединения, такие как полистирол, поливиниловые сложные эфиры, такие как поливинилацетат; сополимеры виниловых мономеров друг с другом и с олефинами, такие как сополимеры этилен-метилметакрилат, сополимеры акрилонитрил-стирол, ABS резины, и сополимеры этилен-винилацетат; полиамиды, такие как Nylone 66 и поликапролактам; алкиловые смолы, поликарбонаты; полиоксиметилены; полиимиды, полиэфиры; эпоксидные смолы, полиуретаны; искусственный шелк; искусственный шелк-триацетат: целлюлоза, ацетатцеллюлозы, бутират целлюлозы; бутират ацетат целлюлозы; целлофан, нитрат целлюлозы; пропионат целлюлозы; эфиры целлюлозы и карбоксилметилцеллюлоза. Кроме плазменного осаждения и осаждения паровой фазы могут использоваться другие методы для нанесения различных покрытий на поверхностях стента. Например, на стент может наноситься раствор полимера, и растворителю дают испариться, таким образом оставляя на поверхности стента полимерное покрытие и терапевтическое вещество. Как правило, раствор может наноситься на стент или распылением раствора на стент или погружением стента в раствор. Соединения настоящего изобретения могут использоваться для лечения рестеноза в сочетании с любым антикоагулирующим, антитромбоцитарным, антитромботическим или профибролитическим агентом. Часто пациенты получают конкурентное лечение до, в течение и после процедуры введения- 18007807 агентов данных классов или с целью безопасного проведения процедуры введения или предотвращения вредных эффектов тромбообразования. Некоторые примеры классов агентов, известных как антикоагулянты, антитромбоцитарные, антитромботические или профибролитические агенты, включают любую готовую препаративную форму гепарина, гепарины с низким молекулярным весом, пентасахариды, антагонисты рецептора фибриногена, ингибиторы тромбина, ингибиторы фактора Ха, ингибиторы фактораVIIa. При лечении рестеноза или атеросклероза одновременно с лечением высокого кровяного давления или атеросклероза соединения настоящего изобретения могут использоваться в сочетании с любым гипотензивным агентом или агентом, регулирующим обмен холестерина или липидов. Некоторые примеры агентов, которые являются полезными для лечения высокого кровяного давления, включают соединения следующих классов: бета-блокаторы, ингибиторы АСЕ, антагонисты кальциевого канала и альфарецепторные антагонисты. Некоторые примеры агентов, которые являются полезными для лечения повышенного уровня холестерина или нерегулированного уровня липидов, включают соединения, известные, как ингибиторы HMGCoA редуктазы, содинения фибратного класса. Соединения настоящего изобретения могут использоваться для лечения различных форм рака или сами по себе, или в сочетании с соединениями, известными, как применяющиеся для лечения рака. Следует понимать, что настоящее изобретение включает комбинации соединений настоящего изобретения с одним или более вышеупомянутых классов терапевтических средств. Соединения в объеме настоящего изобретения проявляют отмеченную фармакологическую активность в соответствии с тестами, описанными в литературе, причем, как известно, результаты тестов коррелируют с фармакологической активностью у человека и других млекопитающих. Результаты следующих фармакологических in vitro и in vivo тестов типичны для характеристики соединений настоящего изобретения. Получение фармацевтических композиций и фармакологический тест Соединения, входящие в объем данного изобретения, проявляют значительную активность как ингибиторы белковой тирозинкиназы и обладают терапевтической ценностью в качестве клеточных антипролиферативных агентов для лечения некоторых состояний, включая псориаз, атеросклероз и рестеноз. Соединения в объеме настоящего изобретения показывают модуляцию и/или ингибирование передачи сигналов клетки, и/или клеточной пролиферации, и/или продуцирования матрикса, и/или хемотаксиса,и/или клеточной воспалительной реакции и могут быть использованы для предупреждения или задержки возникновения или повторения таких состояний или, иначе, для лечения подобных состояний. Для определения эффективности соединений данного изобретения используется описанные ниже фармакологические тесты, которые приняты в уровне техники и признаны, как коррелирующие с фармакологической активностью у млекопитающих. Соединения в объеме данного изобретения были подвергнуты данным тестам, и полученные результаты, как полагают, коррелируют с полезной активностью медиатора клеточной дифференциации. Полагают, что результаты данных тестов предоставляют квалифицированным специалистам в области фармакологии и лекарственной химии достаточную информацию для определения параметров использования изучаемых соединений в одном или более описанных здесь видов терапии. 1. Анализ ELISA автофосфорилирования тирозинкиназы PDGF-R. Названный в заголовке анализ проводят, как описано в Dolle et al. (J. Med. Chem. 1994, 37, 2627),которая включена сюда в качестве ссылки, за исключением использования клеточных лизатов, полученных из клеток (HAMSC) гладких мышц аорты, как описано ниже. 2. Общая методика исследования митогенеза.a). Культура клеток. Клетки гладких мышц аорты (пассажи 4-9) помещают в 96-луночные планшеты в поддерживающей рост среде при концентрации 6000 клеток/лунка и оставляют для роста в течение 2-3 дней. При слиянии около 85% рост клеток останавливают с помощью свободной от сыворотки среды (SFM).b). Анализ митогенеза. После выдерживания в течение 24 ч в отсутствие сыворотки среду удаляют и заменяют тестируемым соединением/наполнителем в SFM (200 мкл/лунку). Соединения солюбилизируют в культуре клеток ДМСО при концентрации 10 мМ и дальнейшие разбавления делают в SFM. Через 30 мин предварительной инкубации с соединением клетки стимулируют PDGF при 10 нг/мл. Определения выполняют в двойном экземпляре со стимулированными и нестимулированными лунками для каждой концентрации соединения. Через 4 ч добавляют 1 мкКюри 3 Н тримидина/лунку. Рост культуры останавливают через 24 ч после добавления фактора роста. Клетки поднимают трипсином и собирают на фильтровальную подложку, используя автоматический сборщик клеток (WallacMachI196). Производят подсчет с фильтровальной подложки на сцинцилляционном счетчике (WallacBetaplate) для определения ДНК-встроенной метки. 3. Анализ хемотаксиса. Клетки гладких мышц аорты (HASMC) ранних пассажей получены от АТСС. Клетки выращивают вClonetics SmGM 2 SingleQuots (используются среда и клетки пассажей 4-10). При 80% слиянии клеток к среде добавляют флуоресцентный зонд, кальцеин AM (5 мМ, молекулярный зонд) и клетки инкубируют в течение 30 мин. После промывки буферным физиологическим раствором HEPES, клетки поднимают трипсином и нейтрализуют буфером MCDB 131 (Gibco) с 0,1% БСА, 10 мМ глютамина и 10% фетальной бычьей сыворотки. После центрифугирования, клетки промывают еще раз и повторно суспендируют в том же самом буфере без фетальной бычьей сыворотки при 30000 клеток/50 мл. Клетки инкубируют с различными концентрациями соединения формулы 1 (конечная концентрация в ДМСО=1%) в течение 30 мин при 37 С. Для изучения хемотаксиса используют 96-луночные модифицированные Boyden камеры(Neuroprobe, Inc.) и поликарбонатную мембрану с размером пор 8 мм (Poretics. CA). Мембрана покрыта коллагеном (Sigma C3657, 0,1 мг/мл). PDGF- (3 нг/мл) в буфере с и без соединения формулы I помещают в нижнюю камеру. Клетки (30,000) с и без ингибитора помещают в верхнюю камеру. Клетки инкубируют в течение 4 ч. Мембрану фильтра удаляют и удаляют клетки с верхней стороны мембраны. После сушки определяется флуоресценция на мембране, используя Cytofluor 11 (Millipore) при длинах волн возбуждения/эмиссии 485/530 нм. В каждом эксперименте среднее перемещение клетки получено от шести измерений. Процент ингибирования определен по отношению к значению обработанного ДМСО контроля. Из пяти значений ингибирования, зависящего от концентрации, рассчитано значение IC50. Результаты представлены как среднееСКО от пяти подобных экспериментов. 4. Очистка EGF-рецептора. Очистка EGF-рецептора основана на методике Yarden и Schlessinger. Клетки А 431 в 80 см 2 колбах выращивают до слияния (2107 клеток на колбу). Клетки дважды промывают забуференным физиологическим раствором (PBS) и собирают PBS, содержащим 11,0 ммоль EDTA (1 ч при 37 С) и центрифугируют при 600g в течение 10 мин. Клетки солюбилизируют в 1 мл на 2107 клеток холодного буфера для солюбилизации (50 ммоль буфера Hepes, pH 7,6, 1% Тритон Х-100, 150 ммоль NaCl, 5 ммоль EGTA, 1 ммоль PMSF, 50 мг/мл апротинина, 25 ммоль бензамидина, 5 мг/мл леупептина и 10 мг/мл ингибитор трипсина сои) в течение 20 мин при 4 С. После центрифугирования при 100000g в течение 30 мин супернатант загружают в колонку WGA-агароза (100 мл упакованной смолы на 2107 клеток) и встряхивают в течение 2 ч при 4 С. Неабсорбированный материал удаляют и смолу дважды промывают буферомHTN (50 ммоль Hepes, pH 7,6, 0,1% Тритон Х-100, 150 ммоль NaCl), дважды буфером HTN, содержащим 1 М NaCl и дважды буфером HTNG (50 ммоль Hepes, pH 7,6, 0,1% Тритон Х-100, 150 ммоль NaCl и 10% глицерина). EGF рецептор элюируют партиями буфером HTNG, содержащим 0,5 М N-ацетил-Dглюкозамин (200 мл на 2107 клеток). Элюированный материал хранят в аликвотах при -70 С и разбавляют перед использованием буфером TMTNG (50 ммоль буфера Трис - Mes, pH 7,6, 0,1% Тритон Х-100,150 ммоль NaCl 10% глицерина). 5. Ингибирование автофосфорилирования EGF-R. А 431 клетки выращивают до слияния в чашках для тканевых культур, покрытых фибронектином человека. После промывания 2 раза ледяным PBS, клетки лизируют добавлением 500 мл/чашку лизирующего буфера (50 ммоль Hepes pH 7,5, 150 ммоль NaCl, 1,5 ммоль МgСl2, 1 ммоль EGTA, 10% глицерина, 1% Тритон Х-100, 1 ммоль PMSF, 1 мг/мл апротинина, 1 мг/мл лейпептина) и инкубируют 5 мин при 4 С. После стимуляции EGF (500 мг/мл, 10 мин при 37 С) проводят иммуноосаждение с анти-EGF-R(Аb 108) и реакцию автофосфорилирования (50 мл аликвота, 3 мКюри [g-32 Р] АТФ) образца в присутствии 2 или 10 мМ соединения настоящего изобретения в течение 2 мин при 4 С. Реакцию останавливают добавлением горячего буфера для электрофореза. СДС-электрофорез на ПААГ (7,5% els) сопровождается авторадиографией и реакцию количественно оценивают денситометрическим сканированием рентгеновских пленок.a). Культура клеток. Клетки, имеющие название HER 14, и К 721 А получают трансфекцией клеток NIH3T3 (клон 2.2) (из С. Fryling, NCI NIH), в которых отсутствуют эндогенные EGF-рецепторы, с конструкциями кДНК EGFрецептора дикого типа или мутантного EGF-рецептора с отсутствием тирозинкиназной активности (в котором Lys 721 на АТФ-связывающем сайте заменен остатком Ala соответственно). Все клетки выращивают в DMEM с 10% телячьей сывороткой (Hyclone, Logan, Utah). 6. Селективность в отношении ПКА и ПКС определяют, используя коммерческие наборы.a. Набор для калориметрического ПКА экспресс-анализа, Spinzyme Format Краткий Протокол: ПКА фермент (бычье сердце) 1 ед./пробирку Субстрат пептида Kemptide (меченый красителем) 45 мин при 30 С Абсорбция при 570 нмb. Набор для калориметрического ПКС экспресс-анализа, Spinzyme Format Краткий Протокол: ПКС фермент (мозг крысы) 0,025 ед./пробирку Субстрат пептида Neurogranin (меченный красителем)- 20007807 30 мин при 30 С Абсорбция при 570 нм 7. Измерение ингибирования активности Р 56lck тирозинкиназы. Ингибирование активности Р 56lсk тирозинкиназы определяют в соответствии с методикой, раскрытой в патенте США 5714493, включенном сюда в качестве ссылки. Альтернативно ингибирующую тирозинкиназу активность определяют в соответствии со следующим способом. Субстрат (тирозинсодержащий субсрат, Biot-( Ala)3-Lys-Val-Glu-Lys-Ile-Gly-Glu-GlyThr-Tyr-Glu-Val-Val-Tyr-Lys-(NH2), распознаваемый P56lck, 1 мкМ) сначала фосфорилируют в присутствии или в отсутствие данной концентрации тестируемого соединения, данным количеством фермента(фермент получен экспрессией Р 56lсk гена в конструкции дрожжей), очищенного от клонированных дрожжей (очистка фермента производится классическими способами) в присутствии АТФ (10 мкМ) МgСl2 (2,5 мМ), МnСl2 (2,5 мМ), NaCl (25 мМ), DTT (0,4 мМ) в Hepes 50 мМ, рН 7,5, в течение более 10 мин при температуре окружающей среды. Полный объем реакционной смеси составляет 50 мкл, и реакцию проводят в черном 96-луночном флуоресцентном планшете. Реакцию останавливают добавлением 150 мкл буфера для прекращения реакции (100 мМ Hepes рН 7,5, KF 400 мМ, EDTA 133 мМ, БСА 1 г/л),содержащего выбранные антитирозиновые антитела, помеченные Europium криптатом (PY20-K) при 0,8 мкг/мл, и стрептавидин, помеченный аллофикоциамином (XL665) при 4 мкг/мл. Мечение стрептавидина и антитирозиновых антител выполнена Cis-Bio International (Франция). Смесь обсчитывают, используя счетчик Packard Discovery, который может измерять гомогенный флуоресцентный переход с временным разрешением (возбуждение при 337 нм, считывание при 620 нм и 665 нм). Отношение сигнал при 665 нм/сигнал при 620 нм определяет величину концентрации фосфорилированного тирозина. Контроль получают, заменяя фермент буфером. Специфический сигнал представляет разность между соотношением,полученным без ингибитора и соотношением, полученным с контролем. Рассчитывают процент специфического сигнала. IC50 рассчитывают с 10 концентрациями ингибитора, в двойном экземпляре, используя мягкий Xlfit. Соединение для сравнения представляет стауроспорин (Sigma), имеющий IС 50 306 нм(н=20). 8. Измерение ингибирования опухоли in vitro. Ингибирование роста опухоли in vitro соединениями данного изобретения определяют следующим образом. Клеточную линию С 6 глиомы крысы (обеспеченную АТСС) выращивают в виде монослоя в модифицированной Dubelcco среде Игла, содержащей 2 мМ L-глютамина, 2 ед./мл пенициллина, 200 мкг/мл стрептомицина с добавлением 10% (об./об.) теплой неактивированной фетальной телячьей сывороткой. Клетки в экспоненциальной фазе роста обрабатывают трипсином, промывают PBS и разбавляют до конечной концентрации 6500 клеток/мл в полной среде. Тестируемое лекарственное средство или контрольный растворитель добавляют к клеточной суспензии (2,5 мл) при объеме 50 мкл, добавляют и 0,4 мл 2,4% агара Noble Difco, поддерживаемого при 45 С, и перемешивают. Смесь немедленно выливают в чашки Петри и оставляют на 5 мин при 4 С. Число клеточных клонов (60 клеток) измеряют после 12 дней инкубирования при 37 С в атмосфере 5% СО 2. Каждое лекарственное средство тестируют при 10, 1,0,1 и 0,01 мкг/мл (конечная концентрация в агаре) в двойном экземпляре. Результаты выражены в процентах ингибирования клоногенности относительно необработанных контролей. IC50 определяют графически по полулогарифмическим кривым среднего значения, определенного для каждой концентрации лекарственного средства. 9. Измерение ингибирования опухоли in vivo. Ингибирование роста опухоли in vivo соединениям данного изобретения определяют, используя модель подкожного ксенотрансплантата, как описано в патентах США 5700823 и 5760066, в который мыши имплантируют клетки глиомы С 6, и рост опухоли измеряют, используя штангенциркуль. Результаты, полученные в вышеупомянутых экспериментальных способах, делают очевидным, что соединения, входящие в объем настоящего изобретения, обладают полезными ингибирующими свойствами в отношении белковой тирозинкиназы-рецептора PDGF или ингибирующими свойствами в отношении р 56lck тирозинкиназы и, таким образом, имеют терапевтическую ценность. Результаты вышеупомянутых фармакологических тестов могут использоваться для определения дозы и способа введения при конкретном виде терапии. Настоящее изобретение может быть воплощено в других конкретных формах в рамках заявленного объема. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Стентовое устройство, включающее полимерное покрытие с включенным в него соединением формулы I в количестве, эффективном для ингибирования рестеноза где R1a представляет необязательно замещенный С 1-С 10 алкил, гидрокси, необязательно замещенный С 1 С 10 алкокси, необязательно замещенный С 3-С 7 циклоалкилокси, необязательно замещенный 4-7-членный оксагетероциклилокси или галоген;R1c представляет собой водород, необязательно замещенный С 1-С 10 алкил или необязательно замещенный С 1-С 10 алкокси,где С 1-С 10 алкил необязательно замещен С 1-С 10 алкокси, галогеном, карбокси, гидрокси или R5R6N(где R5 и R6 независимо представляют собой водород или С 1-С 10 алкил, или R5 и R6, взятые вместе с атомом азота, к которому присоединены R5 и R6, образуют азагетероциклил),С 1-С 10 алкокси необязательно замещен С 1-С 10 алкокси, карбокси, С 1-С 10 алкоксикарбонилом, карбоксиарилом или R5R6N- (где R5 и R6 принимают значения, определенные выше),4-7-членный оксагетероциклилокси необязательно замещен гидрокси, галогеном, С 1-С 10 алкилом,С 1-С 10 алкокси, карбокси, С 1-С 10 алкоксикарбонилом или Y1Y2NCO-, где Y1 и Y2 независимо представляют водород или С 1-С 10 алкил,R2 представляет группуR3 представляет водород или фтор в орто- или пара-положении или С 1-С 3 алкил, С 1-С 3 алкокси, галоген или карбамоил;Zb представляет NH или О, или его N-оксид, гидрат, сольват, пролекарство или соль. 2. Стентовое устройство по п.1, где R1a в указанном соединении представляет необязательно замещенный С 1-С 3 алкокси, необязательно замещенный моноциклический С 3-С 7 циклоалкокси или 4-7 членный необязательно замещенный моноциклический оксагетероциклилокси; иR1b в указанном соединении представляет водород, необязательно замещенный С 1-С 3 алкокси, необязательно замещенный моноциклический С 3-С 7 циклоалкокси или 4-7-членный необязательно замещенный моноциклический оксагетероциклилокси. 3. Стентовое устройство по п.2, где R1a в указанном соединении представляет необязательно замещенный С 1-С 3 алкокси или 4-7-членный необязательно замещенный моноциклический оксагетероциклилокси, предпочтительно метокси, этокси, 2-(этокси)этокси, 2-(4-морфолинил)этокси или фуранилокси иR1b в указанном соединении представляет необязательно замещенный С 1-С 3 алкокси, предпочтительно метокси или этокси. 4. Стентовое устройство по п.1, гдеR1a и R1b в указанном соединении представляют С 1-С 3 алкокси, предпочтительно метокси или этокси;R1c в указанном соединении представляет водород; иR3 в указанном соединении представляет водород, орто- или парафтор или метаметил, трифторметил, метокси, фтор, хлор, бром или карбамоил. 5. Стентовое устройство по п.1, где Za в указанном соединении представляет N. 6. Стентовое устройство по п.1, где Za в указанном соединении представляет СН. 7. Стентовое устройство по п.1, где Zb в указанном соединении представляет NH. 8. Стентовое устройство по п.1, где Zb в указанном соединении представляет О. 9. Стентовое устройство по п.1, где указанное соединение выбрано из группы, включающей 2-анилино-6-хиноксалинол; 2-анилино-6-изопропоксихиноксалин; 2-фенокси-6-метоксихиноксалин; 2-(3-карбамоилфениламино)-6-метоксихиноксалин; 2-(2-фторфениламино)-6,7-диэтоксихиноксалин; 2-(3-трифторметилфениламино)-6,7-диэтоксихиноксалин; фенил-[6-(тетрагидрофуран-3(R)-илокси)хиноксалин-2-ил]амин;(3-хлорфенил)-(6,7-диметоксихиноксалин-2-ил)амин, или их N-оксид, гидрат, сольват, пролекарство, или их фармацевтически приемлемую соль. 10. Способ лечения рестеноза у пациентов, который включает введение названному пациенту фармацевтически эффективного количества соединения формулы IR3 представляет водород или метагалоген;Zb представляет NH или О; или его N-оксида, гидрата, сольвата, пролекарства или соли в виде покрытия на стентовом устройстве. 11. Способ по п.10, в котором рестеноз находится в участке механического повреждения артериальной стенки, полученного при лечении атеросклеротического повреждения ангиопластикой. 12. Стентовое устройство по п.1, где полимерное покрытие включает один или более полимеров,выбранных из группы, состоящей из поликапролактона, сополимера поли(этилен-винилацетата), поли(винилацетата) и силиконовой ненаполненной резиновой смеси, или один или более полимеров, выбранных из группы, состоящей из латексов, уретанов, полисилоксанов и блоксополимеров стиролаэтилена/бутилена-стирола, или один или более полимеров, выбранных из группы, состоящей из полиDL-молочной кислоты, поли-L-молочной кислоты, сложных полиортоэфиров, полииминокарбонатов,алифатических поликарбонатов и полифосфазенов. 13. Стентовое устройство по п.1, где полимерное покрытие дополнительно включает порообразователь, выбранный из группы, состоящей из микрогранул хлорида натрия, лактозы или натрийсодержащего гепарина, или из группы, состоящей из полиэтиленгликоля и сополимеров полиэтиленоксида/ полипропиленоксида. 14. Стентовое устройство по п.1, где на полимерное покрытие нанесена мембрана, контролирующая скорость высвобождения, для ограничения скорости высвобождения соединения формулы I из полимерного покрытия, которая включает порообразователь, выбранный из группы, состоящей из хлорида натрия, лактозы, натрийсодержащего гепарина, полиэтиленгликоля, сополимеров полиэтиленоксида/полипропиленоксида и их смесей. 15. Стентовое устройство по п.1, где соединение формулы I включено в полимерное покрытие нанесением соединения формулы I по крайней мере на одну поверхность стентового устройства с образованием биологически активного слоя с последующим нанесением одного или нескольких покрытий пористого полимерного материала поверх биологически активного слоя, где пористый полимерный материал включает полиамид, парилен или производное парилена. 16. Стентовое устройство по п.15, где пористый полимерный материал наносят осаждением плазмы. 17. Стентовое устройство по п.16, где пористый полимерный материал выбирают из группы, состоящей из поли(этиленоксида), поли(этиленглиоля), поли(пропиленоксида), и полимеров метана, силикона и тетрафторэтилен-тетраметилдисилоксана. 18. Стентовое устройство по п.1, где полимерное покрытие получают добавлением фотополимеризуемого полиэтиленненасыщенного сложного эфира акриловой или метакриловой кислоты, содержащего две или более акрилатных и метакрилатных групп на молекулу или их смесей. 19. Стентовое устрйство по п.18, где мономер выбирают из группы, состоящей из диакрилата этиленгликоля, диметакрилата этиленгликоля, триакрилата триметилпропана, триметакрилата триметилпропана, тетраакрилата пентаэритрита, тетраметакрилата пентаэритрита, диметакрилата 1,6-гександиола и диметакрилата диэтиленгликоля или группы, состоящей из н-бутилакрилата, н-бутилметакрилата, 2- 23007807 этилгексилакрилата, лаурилакрилата и 2-гидроксипропилакрилата. 20. Стентовое устройство по п.1, где полимерное покрытие включает полимер, выбранный из группы, состоящей из поли(L-молочной кислоты), поликапролактона, сополимера поли(лактид-гликолид),поли(гидроксибутирата), сополимера поли(гидроксибутират-валерат), полидиоксанона, полиортоэфира,полиангидрида, поли(гликолевой кислоты), поли(D,L-молочной кислоты), сополимера поли(гликолевая кислота-триметиленкарбонат), полифосфоэфира, полифосфоэфируретана, поли(аминокислот), цианоакрилатов, поли(триметиленкарбоната), поли(иминокарбоната), поли(простой эфир-сложные эфиры), полиалкиленоксалатов, полифосфазенов, фибрина, фибриногена, целлюлозы, крахмала, коллагена и гиалуроновой кислоты или полимер, выбранный из группы, состоящей из полиуретанов, силиконов, полиэфиров, полиолефинов, полиизобутилена и споплимера этилен-альфаолефин, полимеров и сополимеров акриловой кислоты, полимеров и сополимеров винилгалогенида, таких как поливинилхлорид, поливиниловых простых эфиров, таких как поливиниловый метиловый эфир, поливинилиденгалогенидов, таких как поливинилиденфторид и поливинилиденхлорид, полиакрилонитрила, поливинилкетонов, поливиниловых ароматических соединений, таких как полистирол, поливиниловых сложных эфиров, таких как поливинилацетат, сополимеров виниловых мономеров друг с другом и олефинами, таких как сополимеры этилена-метилметакрилата, сополимеры акрилонитрила-стирола, смолы ABS и сополимеры этиленавинилацетата, полиамидов, таких как Nylon 66 и поликапролактам, алкиловых смол, поликарбонатов,полиоксиметиленов, полиимидов, полиэфиров, эпоксидных смол, полиуретанов, искусственного волокна, триацетатного искусственного волокна, целлюлозы, ацетата целлюлозы, бутирата целлюлозы, ацетатбутирата целлюлозы, целлофана, нитрата целлюлозы, пропионата целлюлозы, простых эфиров целлюлозы и карбоксиметилцеллюлозы. 21. Применение соединения формулы I по п.1 для производства стентового устройства для ингибирования рестеноза, где соединение формулы I включено в полимерное покрытие, нанесенное на указанный стент. 22. Применение по п.21, где рестеноз имеется в месте механического повреждения артериальной стенки, вызванного лечением атеросклеротического повреждения ангиопластикой.
МПК / Метки
МПК: C07D 453/06, A61K 31/50, C07D 215/20, C07D 215/38, C07D 241/44, A61P 9/00, C07D 405/12, C07D 241/42
Метки: устройство, содержащее, способ, соединения, хиноксалина, хинолина, рестеноза, лечения, стентовое
Код ссылки
<a href="https://eas.patents.su/25-7807-stentovoe-ustrojjstvo-soderzhashhee-soedineniya-hinolina-i-hinoksalina-sposob-lecheniya-restenoza.html" rel="bookmark" title="База патентов Евразийского Союза">Стентовое устройство, содержащее соединения хинолина и хиноксалина, способ лечения рестеноза</a>
Предыдущий патент: Способы и системы для осуществления операций с платежными картами
Следующий патент: Средство для лечения болезней суставов
Случайный патент: Способ и устройство для введения оборудования в трубопровод и перемещения его по трубопроводу