Соединения для применения в визуализации, диагностике и/или лечении заболеваний центральной нервной системы
Номер патента: 23820
Опубликовано: 29.07.2016
Авторы: Генрих Тобиас, Леманн Лутц, Халльдин Кристер, Наг Санграм, Варроне Андреа, Гуляш Балаж, Тиле Андреа, Кеттшау Георг
Формула / Реферат
1. Соединение формулы I

где D представляет собой дейтерий;
R1 выбирают из метила, этила, н-пропила, н-бутила, изобутила;
R2 представляет собой [19F]фтор, [18F]фтор или уходящую группу, где уходящие группы выбирают из галогена, C1-С6-алкилсульфонилокси, который необязательно замещен фтором, и арилсульфонилокси, который необязательно замещен водородом, метилом, гало и нитро;
n и m выбирают из 0 и 1 при условии, что, если n = 0, m должно быть 1, и, если n = 1, m должно быть 0, и, если R2 представляет собой фтор, то n должно быть 1, и m должно быть 0;
включая все стереоизомерные формы указанных соединений, включая, но не ограничиваясь ими, энантиомеры и диастереоизомеры, так же как и рацемические смеси, а также любую подходящую соль с органической или неорганической кислотой или сольват.
2. Соединение в соответствии с п.1,
где R2 выбирают из группы, состоящей из хлора, брома, метансульфонилокси и п-толуолсульфонилокси.
3. Соединение в соответствии с п.1 или 2, где
D представляет собой дейтерий;
R1 представляет собой метил;
R2 выбирают из фтора или хлора.
4. Соединение в соответствии с п.1 формулы Ia
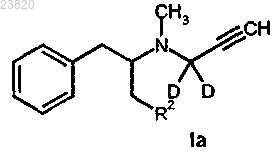
где D представляет собой дейтерий;
R2 выбирают из фтора или хлора;
включая энантиомеры, так же как и рацемические смеси, а также любую подходящую соль с органической или неорганической кислотой или их сольват.
5. Соединение в соответствии с п.1 формулы Ib
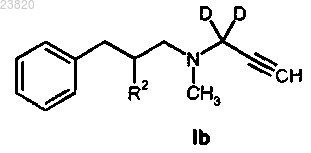
где D представляет собой дейтерий;
R2 представляет собой хлор;
включая энантиомеры, так же как и рацемические смеси, а также любую подходящую соль с органической или неорганической кислотой или их сольват.
6. Соединение в соответствии с п.1, выбранное из группы соединений, состоящей из соединения формулы Ic
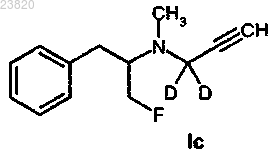
соединения формулы Id
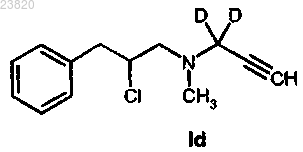
соединения формулы Ie
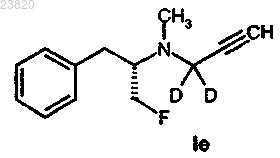
где F = 18F,
соединения формулы Ie

где F = 19F,
соединения формулы If
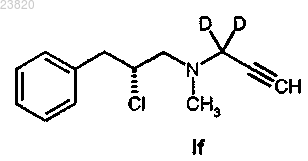
и любой подходящей соли с органической или неорганической кислотой или их сольвата.
7. Меченое [18F] соединение в соответствии с пп.1, 3, 4 или 6 с R2, представляющим собой [18F] в качестве диагностического соединения для ПЭТ визуализации.
8. Диагностическая композиция, содержащая меченое [18F] соединение в соответствии с пп.1, 3, 4 или 6 с R2, представляющим собой [18F] для ПЭТ визуализации.
9. Меченое [18F] соединение в соответствии с пп.1, 3, 4 или 6 с R2, представляющим собой [18F] в качестве диагностического соединения для ПЭТ визуализации заболеваний ЦНС.
10. Диагностическая композиция, содержащая меченое [18F] соединение в соответствии с пп.1, 3, 4 или 6 с R2, представляющим собой [18F] для ПЭТ визуализации заболеваний ЦНС.
11. Соединение в соответствии с п.7 или 9 для визуализации болезни Альцгеймера.
12. Композиция в соответствии с п.8 или 10 для визуализации болезни Альцгеймера.
13. Соединение в соответствии с пп.7, 9 или 11, где меченое [18F] соединение представляет собой соединение формулы Ie

где F = 18F.
14. Композиция в соответствии с пп.8, 10 или 12, где меченое [18F] соединение представляет собой соединение формулы Ie
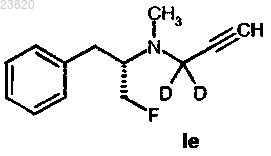
где F = 18F.
15. Способ синтеза соединения формулы I по п.1
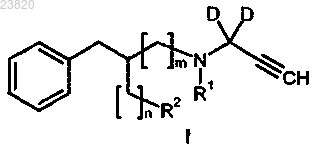
где D представляет собой дейтерий;
R1 выбирают из метила, этила, н-пропила, н-бутила, изобутила;
R2 представляет собой уходящую группу, где уходящие группы выбирают из галогена, C1-С6-алкилсульфонилокси, который необязательно замещен фтором, и арилсульфонилокси, который необязательно замещен водородом, метилом, гало и нитро;
n и m выбирают из 0 и 1, при условии, что, если n = 0, m должно быть 1, и, если n = 1, m должно быть 0, и, если R2 представляет собой фтор, то n должно быть 1, и m должно быть 0;
отличающийся тем, что соединение формулы IIa
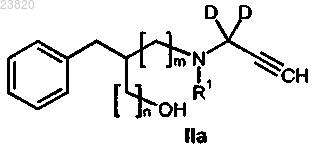
вступает в реакцию с сульфонилангидридом или сульфонилгалогенидом.
16. Способ синтеза соединения формулы Ib по п.5
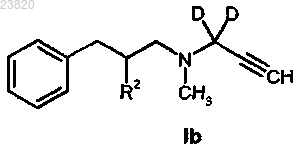
где D представляет собой дейтерий;
R2 представляет собой хлор;
отличающийся тем, что соединение формулы IIb
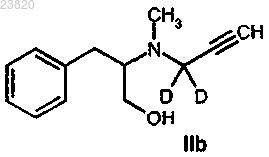
вступает в реакцию с сульфонилхлоридом.
17. Способ в соответствии с п.16, где сульфонилхлорид представляет собой метансульфонилхлорид.
18. Способ в соответствии с п.16 или 17 синтеза соединения формулы If
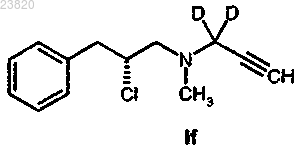
отличающийся тем, что соединение формулы IIc
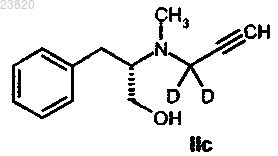
вступает в реакцию с метансульфонилхлоридом.
19. Способ синтеза соединения формулы I по п.1
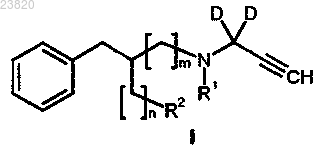
где D представляет собой дейтерий;
R1 выбирают из метила, этила, н-пропила, н-бутила, изобутила;
R2 представляет собой [18F]фтор;
n представляет собой 1 и m представляет собой 0;
отличающийся тем, что соединение формулы I
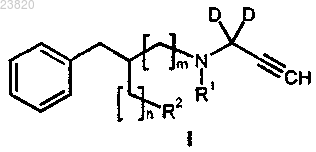
где D представляет собой дейтерий;
R1 выбирают из метила, этила, н-пропила, н-бутила, изобутила;
R2 представляет собой уходящую группу, где уходящие группы выбирают из галогена, C1-С6-алкилсульфонилокси, который необязательно замещен фтором, и арилсульфонилокси, который необязательно замещен водородом, метилом, гало и нитро;
n представляет собой 0 и m представляет собой 1;
вступает в реакцию с подходящим F-фторирующим агентом, где F представляет собой 18F.
20. Способ в соответствии с п.19 синтеза соединения формулы Ic
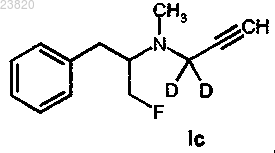
где F представляет собой 18F,
отличающийся тем, что соединение формулы Id
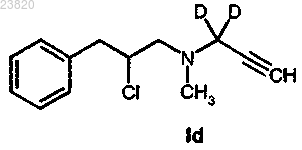
вступает в реакцию с подходящим F-фторирующим агентом, где F представляет собой 18F.
21. Способ в соответствии с п.19 или 20 синтеза соединения формулы Ie
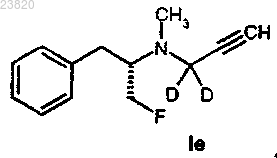
где F представляет собой 18F,
отличающийся тем, что соединение формулы If
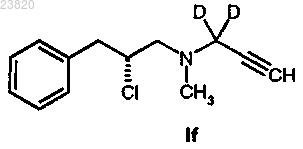
вступает в реакцию с подходящим F-фторирующим агентом, где F представляет собой 18F.
22. Набор для ПЭТ визуализации, содержащий по крайней мере одну закрытую емкость, содержащую соединение по одному из пп.1-7, 9, 11 и 13 или композицию по одному из пп.8, 10, 12 и 14.
23. Набор для ПЭТ визуализации, содержащий по крайней мере одну закрытую емкость, содержащую соединение в соответствии с п.6.
Текст
СОЕДИНЕНИЯ ДЛЯ ПРИМЕНЕНИЯ В ВИЗУАЛИЗАЦИИ, ДИАГНОСТИКЕ И/ИЛИ ЛЕЧЕНИИ ЗАБОЛЕВАНИЙ ЦЕНТРАЛЬНОЙ НЕРВНОЙ СИСТЕМЫ Изобретение относится к новым соединениям, подходящим в качестве прекурсоров для изготовления соответствующих меченых 18F радиоактивных индикаторов позитронноэмиссионной томографии (ПЭТ). Кроме того, изобретение относится к изготовлению указанных молекул прекурсора и к изготовлению радиоактивных индикаторов ПЭТ посредством мечения указанных прекурсоров 18F.(71)(73) Заявитель и патентовладелец: ПИРАМАЛЬ ИМЭДЖИНГ СА (CH) Область техники, к которой относится изобретение Изобретение относится к новым соединениям, подходящим для мечения, или уже меченых 18F, к способам изготовления таких соединений, к композициям, содержащим такие соединения, к наборам,содержащим такие соединения или композиции, и к применению таких соединений, композиций или наборов для диагностической визуализации посредством позитронно-эмиссионной томографии (ПЭТ). Предпосылки создания изобретения и уровень техники Молекулярная визуализация имеет потенциал для выявления заболевания, для выявления прогрессирования заболевания или терапевтической эффективности раньше, чем большинство традиционных методов в области онкологии, неврологии и кардиологии. Среди ряда перспективных технологий молекулярной визуализации были разработаны такие, как оптическое формирование изображений, магнитнорезонансная томография (МРТ), однофотонная эмиссионная компьютерная томография (ОФЭКТ) и позитронно-эмиссионная томография (ПЭТ), ПЭТ также представляет особый интерес для разработки лекарственных средств по причине высокой чувствительности и способности обеспечить количественные и кинетические данные. Например, позитронно-активные изотопы включают углерод, йод, фтор, азот и кислород. Эти изотопы могут заменить их нерадиоактивные эквиваленты в целевых соединениях, для того чтобы обеспечить радиоактивные индикаторы, которые и биологически действуют, и химически идентичны оригинальным молекулам, которые применяют для формирования изображений ПЭТ, или могут быть прикреплены к указанным эквивалентам, для того чтобы получить наиболее близкие аналоги соответствующих исходных эффекторных молекул. Среди указанных изотопов 18F является наиболее подходящим изотопом, который применяют для мечения, по причине его относительно длинного периода полувыведения (110 мин), что позволяет изготовить диагностические радиоактивные индикаторы и далее изучать биохимические процессы. Кроме того, его низкая энергия + частиц (634 кэВ) также является преимуществом. Нуклеофильная ароматическая и алифатическая реакция [18F]-фторфторирования имеет большое значение для меченых фтором [18F] радиофармацевтических препаратов, которые применяются в качестве веществ визуализации in vivo, которые определяют и визуализируют заболевания, например солидные опухоли или заболевания головного мозга. Очень важной технической задачей в применении меченых фтором [18F] радиофармацевтических препаратов является быстрое изготовление и введение радиоактивного соединения. Моноаминоксидазы (МАО, КФ, 1.4.3.4) представляют собой отдельный класс аминооксидаз. Моноаминоксидазы присутствуют в двух изоформах, известных как МАО-А и МАО-В (Med. Res. Rev. 1984, 4: 323-358). Кристаллическая структура МАО-А и МАО-В, образованных в комплексе с лигандами, была описана (J. Med. Chem. 2004, 47: 1767-1774 и Proc. Nat. Acad. Sci. USA 2005, 102: 12684-12689). В головном мозге человека присутствие МАО-В преобладает над МАО-А. Уровень МАО-В в головном мозге повышается с возрастом и, кроме того, активизируются в головном мозге у пациентов с болезнью Альцгеймера (БА), в основном, за счет увеличения реактивных астроцитов. Поскольку активность астроцитов и, следовательно, активность системы МАО-В повышается при нейровоспалительных процессах, то меченые радиоактивным изотопом ингибиторы МАО-В могут служить в качестве биомаркера изображений при нейровоспалении и нейродегенерации, в том числе при болезни Альцгеймера. Ингибиторы, которые являются селективными в отношении как МАО-А, так и МАО-В, были идентифицированы и исследованы (например, J. Med. Chem. 2004, 47: 1767-1774 и Proc. Nat. Acad. Sci. USA,2005, 102: 12684-12689). Депренил (соединение А), ингибитор МАО-В (Biochem. Pharmacol. 1972, 5: 393408) и клоргилин (В), ингибитор МАО-А (Acta Psychiatr. Scand. Suppl. 1995, 386: 8-13), являются мощными ингибиторами моноаминоксидазы, которые вызывают необратимое ингибирование соответствующих ферментов. (R)-изомер депренила (Selegilin, соединение (R)-A) является более мощным ингибитором, чем (S)-изомер (не показано). В отношении ингибиторов также были описаны нейропротекторные и другие фармацевтические воздействия (Curr. Pharm. Des. 2010, 16: 2799-2817, Nature Reviews Neuroscience 2006, 295: 295-309; Br. J.Pharmacol. 2006, 147: 5287-5296, J. Alzheimers Dis. 2010, 21: 361-371, Prog. Neurobiol. 2010, 92: 330-344). Ингибиторы МАО-В применяют, например, для повышения уровней ДОФА в ЦНС (Progr. DrugRes. 1992, 38: 171-297), а также их применяют в клинических исследованиях при лечении болезни Альцгеймера (БА), на основании того факта, что повышенный уровень МАО-В вызван астроцитами, связанными с бляшками Альцгеймера (Neuroscience 1994, 62: 15-30). Фторированные ингибиторы МАО былиthe Neurological Science 2007, 255: 17-22; review: Methods 2002, 27: 263-277). Также были описаны меченые 18F депренил и аналоги депренила (D) и (Е) Int. J. Radiat. Appl. Instrument. Part A, Applied Radiation Isotopes, 1991, 42: 121; J. Med. Chem. 1990, 33: 2015-2019 и Nucl. Med. Среди указанных меченых 11 С ингибиторов МАО, [11 С]-L-депренил-D2, также известный как DED([11 С]-L-бис-дейтерийдепренил), широко применяется многими исследовательскими группами по изучению заболеваний ЦНС в отношении его влияния на активность МАО, например, таких как эпилепсия(Acta Neurol. Scand. 2001, 103: 360; Acta Neurol. Scand. 1998, 98: 224; Epilepsia 1995, 36: 712), боковой амиотрофический склероз (БАС, см. J. Neurolog. Sci. 2007, 255: 17) и черепно-мозговые травмы (Clin. Кроме того, сравнительное исследование с применением многокомпонентных радиоактивных индикаторов, включая DED, было проведено среди пациентов, страдающих от болезни Альцгеймера (БА), и среди здоровых людей (2006 Neurolmage, 33: 588). Кроме того, DED применяли в исследовании влияния курения и возраста на активность МАО (Neurobiol. Aging 1997, 18: 431; Nucl. Med. Biol. 2005, 32: 521; Proc. Nat. Acad. Sci. USA 2003, 20: 11600; LifeSci. 1998, 63: 2, PL19; J. Addict. Disease 1998, 17: 23). Недейтерированный аналог DED, [11 С]-L-депренил, очень быстро и необратимо связывается с МАО-В. В результате этого радиоактивный индикатор может быть захвачен при уровне, аналогичном или выше, чем его доставка плазмой, обеспечивая визуализацию ПЭТ областей с высоким уровнем МАО-В и/или низким кровотоком, представляя перфузию вместо активности МАО-В. Связывание DED является более медленным по причине кинетического изотопного эффекта и, следовательно, DED позволяет более точно оценивать активность МАО-В, чем его недейтерированный эквивалент (см., например,J. Nucl. Med. 1995, 36: 1255; J. Neurochem. 1988,51: 1524).WO 2009/052970 A2 раскрывает новые меченые 18F аналоги L-депренила. Соединение F, показанное ниже, представляет подходящее поглощение в головном мозге бабуина и улучшенные характеристики,такие как превосходная метаболическая стабильность, по сравнению с [11 С]-L-депренилом и упомянутыми выше мечеными 18F ингибиторами МАО D и Е. Можно ожидать, что дейтерирование в пропаргиловом положении, как представлено в DED, также приведет к снижению скорости захвата соединения F Для понимания внимание читателя обращается к тому факту, что синтез F, точно также как изготовление его подходящих прекурсоров, таких как J, из спиртсодержащих интермедиатов, таких как G,как полагают, протекают посредством реакции перегруппировки, с использованием иона азиридиния Н. Указанная перегруппировка может привести к региоизомерным смесям продуктов, как показано в качестве примера здесь. Таким образом, региоизомерные прекурсоры J1 и J2 благодаря уходящей группе,наделенной качеством ее хлорсодержащих групп, могут быть уравновешены при подходящих условиях,в то время как F может быть легко отделено от его вторичных региоизомеров и является стабильным с точки зрения равновесного состояния. Для получения дополнительной информации о перегруппировке с использованием иона азиридиния см., например, P. Gmeiner и др., J. Org. Chem. 1994, 59: 6766. Перегруппировка с использованием азиридиния протекает стереоспецифическим образом, как описано в WO 2010/121719 А 1 (см. также упомянутую выше публикацию и J. Cossy и др., Chem. Eur. J. 2009, 15: 1064). Целью настоящего изобретения было найти меченое 18F соединение, которое связывается с МАО-В,показывая превосходное соотношение "сигнал-фон", по сравнению с существующим уровнем техники, и которое может быть применено для обнаружения реактивных астроцитов с помощью ПЭТ визуализации моноаминоксидазы В, а также определить соответствующие прекурсоры для его изготовления. Указанное было достигнуто с помощью предоставления соединений в соответствии с настоящим изобретением, которые показали отличное поглощение в целевых областях, которое при этом неожиданно сопровождалось значительно улучшенной отмывкой, что приводило к снижению нежелательных сигналов, таких как сигналы неспецифического связывания, как было показано на фиг. 5 а и 5b. Эффект сильно превышает эффекты, о которых сообщалось для наиболее близких соединений уровня техники (см. литературу ниже) и, следовательно, является неожиданным для специалиста в данной области. Неожиданно снижение в 6-8 раз интенсивности сигнала [18F] депренила по отношению к [18F] D2 депренилу наблюдали в областях головного мозга, которые исследовали во время фазы равновесного состояния (см. фиг. 5 а). Из исследований с использованием [11 С] депренила известно, что сигнал МАО-В занижен в областях с высокой активность МАО-В, по причине высокой скорости захвата, которая является подобной или превышает скорость доставки (Fowler и др. J Nucl Med 1995, 36: 1255). Дейтерирование [11 С] депренила, как сообщалось, приводит к снижению скорости захвата, что, в свою очередь, приводит к более надежному количественному выражению сигнала. В то же время, воздействие дейтерирования на снижение интенсивности сигнала для [11 С] D2 депренила (DED), которое наблюдали в здоровых областях головного мозга павиана и человека, сопоставимо с тем, что было исследовано нами, например стриатум, таламус, кора головного мозга, показали только приблизительно 1,2-2,0 (Fowler и др. J. Neurochem 1988, 51: 1524-1534; J. Nucl. Med. 1995, 36: 1255-1262; Mol. Imaging Biol. 2005, 7: 377-387). Неожиданно отчетливо проявленное улучшение вышеупомянутого соотношения (6-8 по сравнению с 1,2-2,0 в предшествующем уровне техники) показывают соединения в соответствии с изобретением, что обеспечивает их в качестве превосходных веществ для ПЭТ визуализации. Краткое описание изобретения Изобретение охватывает соединения общей формулы I-3 023820 быть 0, и, если R2 представляет собой фтор, то n должно быть 1, и m должно быть 0; включая все стереоизомерные формы указанных соединений, включая, но не ограничиваясь ими,энантиомеры и диастереоизомеры, также как и рацемические смеси, а также любую подходящую соль с органической или неорганической кислотой, их сложный эфир, комплекс или сольват. Кроме того, изобретение относится к способам получения таких соединений, к композициям, содержащим такие соединения, к наборам, содержащим такие соединения или композиции, и к способам применения таких соединений, композиций или наборов для диагностической визуализации с помощью позитронно-эмиссионной томографии (ПЭТ). Подробное описание изобретения Определения Используемый здесь термин "уходящая группа" относится к функциональной группе, выбранной из группы, включающей галоген, в частности хлор, бром, йод, метансульфонилокси, п-толуолсульфонилокси, трифторметансульфонилокси, нонафторбутансульфонилокси, (4-бромбензол)сульфонилокси,(4-нитробензол)сульфонилокси, (2-нитробензол)сульфонилокси, (4-изопропилбензол)сульфонилокси,(2,4,6-триизопропилбензол)сульфонилокси, (2,4,6-триметилбензол)сульфонилокси, (4-трет-бутилбензол)сульфонилокси, бензолсульфонилокси и (4-метоксибензол)сульфонилокси. Термин "арил", используемый в данном описании, сам по себе или как часть другой группы относится к моноциклическим или бициклическим ароматическим группам, содержащим от 6 до 12 атомов углерода в кольцевой части, предпочтительно 6-10 атомов углерода в циклической части, таким как фенил, бифенил, нафтил или тетрагидронафтила. Предпочтительной арильной группой является фенил. Используемый здесь в описании изобретения и в формуле изобретения термин "алкил", сам по себе или как часть другой группы, относится к прямой или разветвленной алкильной группе, содержащей от 1 до 6 атомов углерода, такой как, например, метил, этил, пропил, изопропил, бутил, изо-бутил, третбутил, пентил, изо-пентил, неопентил, гексил. Используемые здесь в описании изобретения и в формуле изобретения термины "неорганическая кислота" и "органическая кислота" относятся к минеральным кислотам, включающим, но не ограничивающимися ими, такие кислоты, как угольная, азотная, фосфорная, соляная, перхлорная или серная кислота или их кислые соли, такие как гидросульфат калия, или к соответствующим органическим кислотам, которые включают, но не ограничиваются ими, такие кислоты, как алифатическая, циклоалифатическая, ароматическая, аралифатическая, гетероциклическая, карбоновая и сульфоновая кислота, примерами которых являются муравьиная, уксусная, трифторуксусная, пропионовая, янтарная, гликолевая, глюконовая, молочная, яблочная, фумаровая, пировиноградная, бензойная, антраниловая, мезиловая, фумаровая, салициловая, фенилуксусная, миндальная, эмбоновая, метансульфоновая, этансульфоновая, бензолсульфоновая, пантотеновая, толуолсульфоновая, трифторметансульфоновая и сульфаниловая кислота соответственно. Соединения в соответствии с настоящим изобретением могут существовать в виде сольватов, таких как гидраты, где соединения в соответствии с настоящим изобретением могут включать органические растворители или воду в качестве структурного элемента кристаллической решетки этих соединений. Количество указанных растворителей могут существовать в стехиометрическом или в нестехиометрическом соотношении. В случае стехиометрических сольватов, например гидратов, являются возможными геми-, (семи-), моно-, сескви-, ди-, три-, тетра-, пента- и подобные сольваты или гидраты. Учитывая, что в соединениях в соответствии с настоящим изобретением присутствует по крайней мере один хиральный центр и может присутствовать другая форма изомерного центра, то все изомерные формы, являющиеся результатом указанных изомерных центров, включая энантиомеры и диастереоизомеры, считаются охваченными здесь. Соединения, включающие хиральный центр, могут быть применены в качестве рацемической смеси или в качестве энантиомерно обогащенной смеси, или рацемическая смесь может быть выделена посредством использования хорошо известных методов, и может быть применен отдельный энантиомер. Термины "галоген" или "гало" относятся к фтору (F), хлору (Cl), брому (Br) или йоду (I), термин"галид" относится к фториду, хлориду, бромиду или йодиду. Объект изобретения В первом аспекте изобретение относится к соединениям общей формулы IR2 представляет собой фтор, [18F]фтор или уходящую группу, где предпочтительные уходящие группы выбирают из галогена, C1-C6-алкилсульфонилокси, который необязательно замещен фтором, и арилсульфонилокси, который необязательно замещен водородом, метилом, гало и нитро, и где особенно предпочтительные уходящие группы представляют собой хлор, бром, метансульфонилокси, и птолуолсульфонилокси, и где наиболее предпочтительная уходящая группа представляет собой хлор;n и m выбирают из 0 и 1, при условии, что, если n = 0, m должно быть 1, и, если n = 1, m должно быть 0, и, если R2 представляет собой фтор, то n должно быть 1, и m должно быть 0; включая все стереоизомерные формы указанных соединений, включая, но не ограничиваясь ими,энантиомеры и диастереоизомеры, также как и рацемические смеси, а также любую подходящую соль с органической или неорганической кислотой, их сложный эфир, комплекс или сольват. В предпочтительном варианте осуществления изобретение относится к соединениям общей формулы I где D представляет собой дейтерий; R1 представляет собой метил; R2 выбирают из фтора или хлора;n и m выбирают из 0 и 1, при условии, что, если n = 0, m должно быть 1, и, если n = 1, m должно быть 0, и, если R2 представляет собой фтор или [18F]фтор, то n должно быть 1, и m должно быть 0; включая энантиомеры, также как и рацемические смеси, а также любую подходящую соль с органической или неорганической кислотой или их сольват. В более предпочтительном варианте осуществления изобретение относится к соединению общей формулы IaR2 выбирают из фтора или хлора; включая энантиомеры, также как и рацемические смеси, а также любую подходящую соль с органической или неорганической кислотой или их сольват. В другом более предпочтительном варианте осуществления изобретение относится к соединению общей формулы IbR2 представляет собой хлор; включая энантиомеры, также как и рацемические смеси, а также любую подходящую соль с органической или неорганической кислотой или их сольват. В еще более предпочтительном варианте осуществления изобретение относится к соединению общей формулы Ic включая энантиомеры, также как и рацемические смеси, а также любую подходящую соль с органической или неорганической кислотой или их сольват. В другом еще более предпочтительном варианте осуществления изобретение относится к соединению общей формулы Id включая энантиомеры, также как и рацемические смеси, а также любую подходящую соль с органической или неорганической кислотой или их сольват. В особенно предпочтительном варианте осуществления изобретение относится к соединению общей формулы Ie-5 023820 где F = 18F; и к любой подходящей соли с органической или неорганической кислотой или к их сольвату. В особенно предпочтительном варианте осуществления изобретение относится к соединению общей формулы Ie где F = 19F; и к любой подходящей соли с органической или неорганической кислотой или к их сольвату. В особенно предпочтительном варианте осуществления изобретение относится к соединению общей формулы If и к любой подходящей соли с органической или неорганической кислотой или к их сольвату. Во втором аспекте настоящее изобретение относится к синтезу соединений формулы I, в которой R2 обозначает уходящую группу, как определено выше, из соответствующих исходных материалов. Такие соединения являются полезными прекурсорами для введения R2 = 18F, т.е. для образования меченых 18F радиоактивных индикаторов. Указанные исходные материалы могут включать, но не ограничиваются ими, спирты общей формулы IIa Такие синтезы включают, но не ограничиваются ими, реакцию с сульфонилгалогенидом, таким как метансульфонилхлорид или п-толуолсульфонилхлорид, в присутствии подходящего основания, такого как триалкиламин, например триэтиламин, или такого как гетероароматическое основание, например пиридин или 2,6-лутидин, в подходящем растворителе, таком как галогенизированный углеводород, например дихлорметан, или простой эфир, такой как тетрагидрофуран. Указанные синтетические способы могут также включать, но не ограничиваются ими, применение сульфонилангидридов вместо вышеупомянутых сульфонилгалогенидов, таких как метансульфоновый ангидрид, для того чтобы получить соединение формулы II, в которой R2 представляет собой сложный эфир сульфоновой кислоты. Указанные способы синтеза могут дополнительно включать применение четырехгалоидного углерода, такого как тетрахлорметан или тетрабромметан, и подходящих фосфорорганических реагентов, таких как трифенилфосфан или три-н-бутилфосфан, для превращения спиртов общей формулы IIa в соединения общей формулы I, в которой R2 обозначает уходящую группу. В предпочтительном варианте осуществления изобретение относится к синтезу соединения с формулой Id, как описано выше, из спирта с формулой IIb В более предпочтительном варианте осуществления изобретение относится к синтезу соединения с формулой Id, как описано выше, из спирта с формулой IIb при помощи реакции IIb с подходящим сульфонилхлоридом в присутствии подходящего основания в соответствующем растворителе, как описано выше. В особенно предпочтительном варианте осуществления изобретение относится к синтезу соединения с формулой If, как описано выше, из спирта с формулой IIc при помощи реакции IIc с подходящим сульфонилхлоридом в присутствии подходящего основания в соответствующем растворителе, как описано выше В другом особенно предпочтительном варианте осуществления настоящее изобретение относится к синтезу соединений формулы Id или If, как описано выше, из спиртов формулы IIb или IIc при помощи реакции указанных спиртов с сульфонилхлоридом, таким как метансульфонилхлорид или п-6 023820 толуолсульфонилхлорид, в присутствии подходящего основания, такого как триалкиламин, например триэтиламин, в подходящем растворителе, таком как галогенизированный углеводород, например дихлорметан, для того чтобы осуществить превращение гидроксильной группы, представленной соединениями формулы Ia, в хлорсодержащую группу. Реакционную смесь, полученную в результате объединения всех реагентов, вначале подвергали реакции на протяжении подходящего периода времени, который варьировался от 5 мин до 6 ч, предпочтительно 15 мин -4 ч, еще более предпочтительно 30 мин - 2 ч, при температуре в диапазоне, составляющем -50 - +30 С, предпочтительно -30 - +30 С, еще более предпочтительно -10 - +25 С, с последующим нагреванием реакционной смеси на протяжении подходящего периода времени, который варьировался от 5 мин до 6 ч, предпочтительно 15 мин -4 ч, еще более предпочтительно 30 мин - 2 ч до температуры в диапазоне от 70 до 130 С, предпочтительно 80-120 С, еще более предпочтительно 90-110 С. Период нагревания воздействует на превращение образованных вначале смесей Id/If с их соответствующими первичными региоизомерами, отражающими строение соответствующего исходного материала IIb или IIc. В третьем аспекте изобретение относится к способу синтеза, содержащему реакцию соединения общей формулы I, где R2 обозначает уходящую группу, с F-фторирующим агентом, в которой F = 18F, с получением соединения, в котором R2 замещен 18F. Указанный F-фторирующий агент представляет собой соединение, содержащее F-анионы, предпочтительно соединение, выбранное из, но не ограничиваясь ею, группы, содержащей 4, 7, 13, 16, 21, 24-гексаокса-1,10-диазабицикло[8.8.8]гексакозан KF, т.е. соль краун-эфира Kryptofix KF, KF, HF, KH F2, CsF, NaF и тетраалкиламмониевые соли F, такие как фторид тетрабутиламмония, и где F = 18F, с получением соединения, в котором R2 замещен 18F. В предпочтительном варианте осуществления настоящее изобретение относится к способу синтеза соединения общей формулы Ic, в которой F = 18F, при помощи реакции соединения общей формулы Id сF-фторирующим агентом, в которой F = 18F. Указанный F-фторирующий агент представляет собой соединение, содержащее F-анионы, предпочтительно соединение, выбранное из, но не ограничиваясь ею,группы, содержащей 4, 7, 13, 16, 21, 24-гексаокса-1,10-диазабицикло[8.8.8]-гексакозан KF, т.е. соль краун-эфира Kryptofix KF, KF, HF, F2 KH, CsF, NaF и тетраалкиламмониевые соли F, такие как фторид тетрабутиламмония, и где F = 18F. В другом предпочтительном варианте осуществления настоящее изобретение относится к способу синтеза соединения общей формулы Ie, в которой F = 18F, при помощи реакции соединения общей формулы If с F-фторирующим агентом, в которой F = 18F. Указанный F-фторирующий агент представляет собой соединение, содержащее F-анионы, предпочтительно соединение, выбранное из, но не ограничиваясь ею, группы, содержащей 4, 7, 13, 16, 21, 24-гексаокса-1,10-диазабицикло[8.8.8]-гексакозан KF, т.е. соль краун-эфира Kryptofix KF, KF, HF, F2 KH, CsF, NaF и тетраалкиламмониевые соли F, такие как фторид тетрабутиламмония, и где F = 18F. В четвертом аспекте настоящее изобретение относится к применению соединений общей формулы I для изготовления меченого 18F вещества для диагностической визуализации или визуализирующего вещества, предпочтительно визуализирующего вещества для применения в ПЭТ. В более предпочтительном варианте осуществления указанное применение ПЭТ используется для визуализации заболеваний ЦНС. Заболевания центральной нервной системы включают, но не ограничиваются ими, воспалительные и аутоиммунные, аллергические, инфекционные и вызванные токсинами и вызванные ишемией заболевания, фармакологически вызванное воспаление, имеющее патофизиологическое значение, нейровоспалительные, нейродегенеративные заболевания. Более предпочтительно, ЦНС заболевание выбирают из рассеянного склероза, болезни Альцгеймера, лобно-височной деменции, деменции с тельцами Леви, лейкоэнцефалопатии, эпилепсии, невропатической боли, бокового амиотрофического склероза, болезни Паркинсона, энцефалопатии, опухоли головного мозга, депрессии, злоупотребления лекарственными средствами, аддиктивных болезней, атеромы, атеросклероза, фармакологически вызванного воспаления, системного воспаления неясного происхождения. В особенно предпочтительном варианте осуществления указанное применение ПЭТ используется для визуализации заболеваний, связанных с деменцией, таких как болезнь Альцгеймера. В другом особенно предпочтительном варианте осуществления указанное применение ПЭТ используется для визуализации нейровоспалительных заболеваний, таких как рассеянный склероз. Изобретение также относится к наборам, содержащим соединение формулы I. Такие наборы могут включать по крайней мере одну закрытую емкость, содержащую соединение формулы I. Указанный набор также может включать подходящие реагенты для проведения описанных здесь реакций. Реагенты,описанные здесь, также могут быть включены в такой набор и могут быть помещены в закрытую емкость. Набор также может включать меченые 18F реагенты. Кроме того, набор может включать инструкцию по его применению. В пятом аспекте настоящее изобретение относится к применению соединений общей формулы I для проведения биологических тестов и хроматографической идентификации. Более предпочтительно, применение относится к соединениям общей формулы I, где R2 представляет собой 18F и 19F, более предпочтительно 19F. Соединения общей формулы I, в которой изотоп фтора представляет собой 19F, являются полезными в качестве эталонов и/или веществ, используемых в анализе. Соединения общей формулы I определены здесь, как указано выше, и охватывают все варианты осуществления и предпочтительные признаки. В частности, изобретение относится к: 1. соединению формулы IR2 представляет собой фтор, [18F]фтор или уходящую группу, где уходящие группы выбирают из галогена, С 1-С 6-алкилсульфонилокси, который необязательно замещен фтором, и арилсульфонилокси,который необязательно замещен водородом, метилом, гало и нитро;n и m выбирают из 0 и 1, при условии, что, если n = 0, m должно быть 1, и, если n = 1, m должно быть 0, и, если R2 представляет собой фтор, то n должно быть 1, и m должно быть 0; включая все стереоизомерные формы указанных соединений, включая, но не ограничиваясь ими,энантиомеры и диастереоизомеры, также как и рацемические смеси, а также любую подходящую соль с органической или неорганической кислотой, их сложный эфир, комплекс или сольват. 2. Соединению в соответствии с п.1,где R2 выбирают из группы, состоящей из хлора, брома, метансульфонилокси и птолуолсульфонилокси. 3. Соединению в соответствии с п.1 или 2, где D представляет собой дейтерий;R2 выбирают из фтора или хлора. 4. Соединению формулы IaR2 выбирают из фтора или хлора; включая энантиомеры, также как и рацемические смеси, а также любую подходящую соль с органической или неорганической кислотой или их сольват. 5. Соединению формулы IbR2 представляет собой хлор; включая энантиомеры, также как и рацемические смеси, а также любую подходящую соль с органической или неорганической кислотой или их сольват. 6. Соединению, выбранному из группы соединений, состоящей из соединения формулы Ic и любой подходящей соли с органической или неорганической кислотой или их сольвата. 7. Меченому [18F] соединению в соответствии с пп.1, 3, 4 и 6 в качестве диагностического соединения для ПЭТ визуализации. 8. Диагностической композиции, содержащей меченое [18F] соединение в соответствии с пп.1, 3, 4 и 6 для ПЭТ визуализации. 9. Меченому [18F] соединению в соответствии с пп.1, 3, 4 и 6 в качестве диагностического соединения для ПЭТ визуализации заболеваний ЦНС. 10. Диагностической композиции, содержащей меченое [18F] соединение в соответствии с пп.1, 3, 4 и 6 для ПЭТ визуализации заболеваний ЦНС. 11. Соединению или композиции в соответствии с пп.7-10 для визуализации болезни Альцгеймера. 12. Соединению или композиции в соответствии с пп.7-11, где меченое [18F] соединение представляет собой соединение формулы Ie где F = 18F. 13. Способу синтеза соединения в соответствии с формулой IR2 представляет собой уходящую группу, где уходящие группы выбирают из галогена, C1-С 6 алкилсульфонилокси, который необязательно замещен фтором, и арилсульфонилокси, который необязательно замещен водородом, метилом, гало и нитро;n и m выбирают из 0 и 1, при условии, что, если n = 0, m должно быть 1, и, если n = 1, m должно быть 0, и, если R2 представляет собой фтор, то n должно быть 1, и m должно быть 0; отличающемуся тем, что соединение формулы IIa вступает в реакцию с сульфонилангидридом или сульфонилгалогенидом. 14. Способу синтеза соединения в соответствии с формулой IbR2 представляет собой хлор; отличающемуся тем, что соединение формулы IIb вступает в реакцию с сульфонилхлоридом. 15. Способу в соответствии с п.14, где сульфонилхлорид представляет собой метансульфонилхлорид. 16. Способу в соответствии с п.14 или 15 синтеза соединения формулы If отличающемуся тем, что соединение формулы IIc вступает в реакцию с метансульфонилхлоридом. 17. Способу синтеза соединения в соответствии с формулой In представляет собой 1 и m представляет собой 0; отличающемуся тем, что соединение формулы IR2 представляет собой уходящую группу, где уходящие группы выбирают из галогена, C1-С 6 алкилсульфонилокси, который необязательно замещен фтором, и арилсульфонилокси, который необязательно замещен водородом, метилом, гало и нитро;n представляет собой 0 и m представляет собой 1; вступает в реакцию с подходящим F-фторирующим агентом, где F представляет собой 18F. 18. Способу в соответствии с п.17 синтеза соединения формулы Ic где F представляет собой 18F; отличающемуся тем, что соединение формулы Id вступает в реакцию с подходящим F-фторирующим агентом, где F представляет собой 18F. 19. Способу в соответствии с п.17 или 18 синтеза соединения формулы Ie где F представляет собой 18F,отличающемуся тем, что соединение формулы If вступает в реакцию с подходящим F-фторирующим агентом, где F представляет собой 18F. 20. Набору, содержащему по крайней мере одну закрытую емкость, содержащую соединение или композицию в соответствии с пп.1-12. 21. Набору, содержащему по крайней мере одну закрытую емкость, содержащую соединение в соответствии с п.6. 22. Набору в соответствии с пп.20 и 21, содержащему дополнительную закрытую емкость, содержащую реагенты. 23. Применению 18F-меченого соединения в соответствии с пп.1-6 в приготовлении диагностической композиции для ПЭТ визуализации заболевания ЦНС, где более предпочтительно заболевание ЦНС представляет собой болезнь Альцгеймера. 24. Применению 18F-меченого соединения в соответствии с пп.1-6 в способе ПЭТ диагностики заболевания ЦНС, более предпочтительно болезни Альцгеймера, содержащему введение указанного соединения в диагностически эффективном количестве пациенту. 25. Применению F-меченого соединения в соответствии с пп.1-6 для проведения биологических тестов и хроматографической идентификации, где F представляет собой 18F или 19F. В контексте настоящего изобретения заболевания центральной нервной системы включают, но не ограничиваются ими, воспалительные и аутоиммунные, аллергические, инфекционные и вызванные токсинами и вызванные ишемией заболевания, фармакологически вызванное воспаление патофизиологической значимости, нейровоспалительные, нейродегенеративные заболевания. Более предпочтительно, заболевание ЦНС выбирают из рассеянного склероза, болезни Альцгеймера, фронтотемпоральной деменции, деменции с тельцами Леви, лейкоэнцефалопатии, эпилепсии, невропатической боли, бокового амиотрофического склероза, болезни Паркинсона, энцефалопатии, опухоли головного мозга, депрессии, злоупотребления лекарственными средствами, заболеваний привыкания, атеромы, атеросклероза, фармакологически вызванного заболевания, системного воспаления неясного происхождения. В особенно предпочтительном варианте осуществления указанное применение ПЭТ используют для визуализации связанных с деменцией заболеваний, таких как болезнь Альцгеймера. В другом особенно предпочтительном варианте осуществления указанное применение ПЭТ используют для визуализации нейровоспалительных болезней, таких как рассеянный склероз. В соответствии с изобретением меченые 18F соединения в соответствии с изобретением применяют для ПЭТ визуализации или диагностики заболеваний центральной нервной системы, в частности болезни Альцгеймера и рассеянного склероза. Общий синтез соединений в соответствии с изобретением. Синтез соединений в соответствии с изобретением начинают с интермедиатов аминоспиртов общей формулы II. Многие из этих аминоспиртов известны специалистам в данной области техники и могут быть легко синтезированы из соответствующих аминокислотных составляющих или соответствующим образом защищенных интермедиатов, которые часто являются коммерчески доступными. Впоследствии вводят дейтерированную пропаргиловую группу, для того чтобы получить третичные амины IIa. Указанное может быть выполнено посредством применения неочищенного 3-бром (3,3-2 Н 2)проп-1-ина, изготовленного в соответствии с Fowler и др., Nucl. Med. Biol. 2001, 28 (7): 779 -785; однако, нами было установлено, что соответствующий тозилат III является более практичным по причине его низкой летучестью и лучшей способности поддаваться обнаружению. Он легко может быть получен из дейтерированного пропаргилового спирта, описанного в ссылке, приведенной выше. Схема 1. Изготовление интермедиатов общей формулы IIa из исходных материалов общей формулыII, где R1, n и m определены, как в формуле изобретения и описании этого изобретения. Гидроксильную группу полученного аминоспирта IIa затем перемещают в уходящую группу при помощи способов, известных специалисту в данной области техники, таких как сульфонилирование или галогенизация. Схема 2. Изготовление соединений изобретения общей формулы I, где R1, n и m определены, как в формуле изобретения и описании этого изобретения, и где R2 представляет собой уходящую группу, из интермедиатов общей формулы IIa, где R1, n и m определены, как в формуле изобретения и описании этого изобретения. Здесь стоит отметить, что сульфонаты можно получить только из сульфонилангидридов, так как сульфонаты, образованные вначале из сульфонилхлоридов, были легко заменены сопутствующим противоионом хлорида. Указанные сульфонаты, как было описано, легко претерпевают перегруппировку посредством использования промежуточного иона азиридиния, что может приводить к региоизомерным смесям продуктов, см., например, L. Lehmann и др., WO 2009/052970 А 2. Для получения дополнительной информации о перегруппировке с использованием иона азиридиния см., например, P. Gmeiner и др., J.Org. Chem. 1994, 59: 6766. Перегруппировка с использованием азиридиния протекает стереоспецифическим образом, как описано в WO 2010/121719 А 1 (см. также упомянутую выше публикацию и J. Cossy и др., Chem. Eur. J. 2009, 15: 1064). В подходящих условиях с термодинамическим контролем термодинамически более стабильный продукт может быть образован с высокой селективностью, как показано в приведенном ниже примере, как показано ниже для синтеза соединения If. Схема 3. Изготовление соединения изобретения общей формулы If посредством перегруппировки с использованием иона азиридиния. Полученные соединения общей формулы I, где R2 представляет собой уходящую группу, могут быть превращены в радиоизотопные индикаторы (где R2 = 18F) посредством способов фторирования радиоактивными изотопами фтора, известными специалисту в данной области техники, например, посредством 4, 7, 13, 16, 21, 24-гексаокса-1,10-диазабицикло[8.8.8]гексакозана KF, т.е. соли краун-эфира Kryptofix KF, KF, HF, KH, F2, CsF, NaF и тетраалкиламмониевых солей F, таких как фторид тетрабутиламмония, и где F = 18F. Кроме того, в результате этих реакций обычно получают региоизомерные смеси, предположительно посредством промежуточного иона азиридиния, которые могут быть разделены при помощи использования метода ВЭЖХ, для того чтобы получить требуемые первичные региоизомеры Ig. Схема 4. Изготовление соединений изобретения общей формулы Ig, где R1 определен, как в формуле изобретения и описании этого изобретения, из соединений изобретения общей формулы I, где R1, n иm определены, как в формуле изобретения и описании этого изобретения, и где R2 представляет собой уходящую группу. Аналогичным образом, аминоспирты IIa могут быть превращены в соответствующие нерадиоактивных фториды Ih при помощи способов, известных специалисту в данной области техники, таких как реакция с фторидом нонафторбутилсульфонила в присутствии Et3N3 HF. В результате этих реакций также обычно получают региоизомерные смеси, предположительно посредством промежуточного иона азиридиния. Схема 5. Изготовление соединений изобретения общей формулы Ih, где R1 определен, как в формуле изобретения и описании этого изобретения, из интермедиатов общей формулы IIa, где R1, n и m определены, как в формуле изобретения и описании этого изобретения. Описание фигур Фиг. 1 - распределение [18F] D2 депренила (соединение примера 3) в головном мозге мыши (n = 3),определенное с помощью гамма-детектора, показанное за период времени, составляющий 4 ч; фиг. 2 - ауторадиографии тонкослойных хроматограмм (ТСХ), полученных с использованием растворителя, состоящего из 10% гексана/ 90% этилацетата. Плазму мышей, сгусток крови и ткань головного мозга исследовали через 5 мин п.и. для того, чтобы обнаружить метаболиты, образованные из (a) [18F]D2 депренила и (b) недейтерированного [18F] депренила (соединение F). Круги изображают интересующие области (ИО) для измерения соответствующих слоев с использованием программного обеспеченияImage Quant 5.2. Диапазон, представленный на ИО 2, (а) имеет более низкую интенсивность по сравнению с (b) (отмечен прямоугольником). 18F - свободный фторид, par. - исходное соединение, Р - плазма,С - кровяной сгусток (n = 3 мыши); cereb. - мозжечок, ctx - кора головного мозга, mid - средний мозг(ткань от 3 мышей объединена для каждой области); 1 - [18F] метамфетамин, 2 - [18F] амфетамин, 3 - [18F] нордепренил и [18F] нордепренил D2 соответственно; 4 - [18F] D2 депренил и недейтерированный [18F] депренил соответственно; фиг. 3 - демонстрация in vivo периода действия [18F] D2 депренила и недейтерированного [18F] депренила в плазме яванского макаки; фиг. 4 - демонстрация in vivo метаболизма (a) [18F] D2 депренила и (b) недейтерированного [18F] депренила в плазме яванского макаки. Показаны период действия исходных соединений, а также метаболиты, выраженные в [% площади], полученные из соответствующих хроматограмм ВЭЖХ; фиг 5 - ПЭТ в различных областях головного мозга яванского макаки с использованием [18F] D2 депренила и недейтерированного [18F] депренила соответственно, (а) кривые зависимости активности от времени (КАВ) выражены как проценты СУН (стандартизированного уровня накопления) [18F] D2 депренила на протяжении 120 мин и сравнены с соответствующими КАВ недейтерированного [18F] депренила. (b) Визуализации трех плоскостей (поперечной, фронтальной и сагиттальной) головного мозга того же самого яванского макаки после инъекции [18F] D2 депренила. Неожиданно в исследуемых областях головного мозга яванского макаки снижение сигнала [18F] D2 депренила, выраженного как % стандартизированного уровня накопления (СУН) на КАВ, было в 6-8 раз больше по сравнению с сигналом от недейтерированного [18F] депренила в период времени между 30 и 120 мин (фиг 5 а). Это было неожиданным, так как снижение сигнала вследствие эффекта дейтерирования, известное из сравнения [11 С] депренила с [11 С] D2 депренилом (DED), составляет только приблизительно 1,2-2,0 раза, что наблюдалось в областях головного мозга бабуина и человека, которые сопоставимы с исследованными нами, например,в стриатуме, таламусе, коре головного мозга (Fowler J. и др. Neurochem 1988, 51: 1524-1534; J. Nucl. Med. 1995, 36: 1255-1262; Mol. Imaging Biol. 2005, 7: 377-387). Таким образом, поглощение головным мозгом, в том числе целевыми областями, было менее выраженным (фиг 5b), и приводит к преимуществу над [11 С] D2 депренилом в отношении фонового сигнала; фиг 6 - хроматограмма препаративной ВЭЖХ [18F] D2 депренила, показывающая время удерживания требуемого радиоактивно меченого 18F продукта, где tR = 12,5 мин; фиг 7 - хроматограмма аналитической ВЭЖХ [18F] D2 депренила, показывающая время удерживания требуемого радиоактивно меченого 18F продукта, где tR = 2,59 мин; фиг 8 - хроматограмма аналитической ВЭЖХ [19F] D2 депренила (соединение примера 2), показывающая время удерживания искомого нерадиоактивного 19F эталонного соединения, где tR = 2,36 мин; фиг 9 - in vitro каскад реакций метаболитов в микросомах крысы, мыши, собаки, обезьяны и человека, и в препаратах гепатоцитов крысы и человека. Метаболиты определяли с помощью ЖХ/МС. (а) Каскад реакций метаболитов недейтерированного [18F] депренила и (b) каскад реакций метаболитов [18F]D2 депренила; фиг 10 - распределение [18F] D2 депренила, наблюдаемое посредством ПЭТ в различных областях головного мозга яванского макаки. Кривые зависимости активности от времени (КАВ) выражены в процентах стандартизированного уровня накопления (СУН [%]) на протяжении 120 мин. Экспериментальная часть Общее. Все растворители и химические вещества были получены из коммерческих источников и использовались без последующей очистки. В нижеприведенной таблице перечислены сокращения, которые используются в этом разделе и в разделе примеров, поскольку они не объясняются в тексте. Виды пиков ЯМР указаны так, как они появляются в спектрах, возможные эффекты более высокого порядка не рассмотрены. Химические названия были образованы посредством использования программного обеспечения для присвоения названий ACD IUPAC компании Advanced Chemical Development. В некоторых случаях были использованы общепринятые названия коммерчески доступных реагентов вместо названий, полученных посредством ACD/IUPAC. В реакциях с применением микроволнового излучения может быть использована высокочастотная печь Biotage Initator, необязательно оснащенная роботизованным блоком. Соединения и интермедиаты, полученные в соответствии со способами согласно изобретению, могут нуждаться в очистке. Очистка органических соединений хорошо известна специалистам в данной области, и для одного соединения может существовать несколько способов очистки. В некоторых случаях может быть необходимым отсутствие очистки. В некоторых случаях соединения могут быть очищены при помощи кристаллизации. В некоторых случаях примеси могут быть удалены посредством ресуспендирования с использованием подходящего растворителя. В некоторых случаях соединения могут быть очищены с помощью хроматографии, в частности колоночной флэш-хроматографии, используя,например, предварительно заполненные силикагелем картриджи, например, от компании Separtis, такие как заполненные силикагелем Isolute Flash или силикагелем Isolute Flash NH2 в комбинации с, например, автоочистителем FlashMaster II (от компаний Argonaut/Biotage) и элюенты, такие как градиенты гексана/EtOAc или дихлорметана/этанола. В некоторых случаях соединения могут быть очищены с помощью препаративной ВЭЖХ с использованием, например, автоочистителя от компании Waters, оснащенного детектором на диодной матрице и/или интерактивного масс-спектрометра с ионизацией электрораспылением, в комбинации с подходящей заполненной колонкой с обращенной фазой и элюентами,такими как градиенты воды и ацетонитрила, которые могут содержать добавки, такие как трифторуксусная кислота или водный аммиак. В некоторых случаях способы очистки, как описано выше, могут обеспечить такие соединения в соответствии с настоящим изобретением, которые обладают достаточной основной функциональностью в виде соли, как, например, в случае соединения в соответствии с настоящим изобретением, которое является достаточно основным, например трифторацетат или соль муравьиной кислоты. Соль этого типа может быть превращена в вид ее свободного основания, соответственно,различными способами, известными специалисту в данной области. Сокращения К суспензии N-метил-L-фенилаланина (20 г, 112 ммоль) в ТГФ (1200 мл), охлажденной до -10 С,добавляли небольшими порциями алюмогидрид лития (6,35 г, 167 ммоль). После прекращения начальной экзотермической реакции охлаждающую ванну удаляли и реакционную смесь нагревали с обратным холодильником на протяжении ночи. После этого после охлаждения до -10 С добавляли другую часть алюмогидрида лития (4,24 г, 112 ммоль), за чем следовало нагревание с обратным холодильником на протяжении дополнительных 3 ч. Реакционную смесь охлаждали до -40 С и осторожно добавляли 2N водного гидрооксида натрия. После подогрева до к.т. смесь фильтровали, остаток промывали МТБ и фильтрат упаривали до получения неочищенного целевого соединения (17,7 г, 96% выхода), которое применяли без дополнительной очистки. 1 Н ЯМР (400 МГц, ДМСО-d6)м.д. 2.26 (s, 3 Н), 2.51-2.62 (m, 3 Н), 3.16-3.30 (m, 3 Н), 7.11-7.25Med. Biol. 2001, 28 (7): 779-785, отделение от остаточного этанола проводили посредством фракционной дистилляции) в дихлорметане (250 мл) добавляли пиридин (7 мл) и смесь охлаждали до 0 С. Добавляли тозильный ангидрид (21,0 г, 1,1 экв) и реакционную смесь подвергали перемешиванию на протяжении 30 мин, охлаждающую ванну удаляли и перемешивание продолжали на протяжении 1,5 ч. Смесь выпаривали в вакууме и остаток очищали посредством колоночной хроматографии на силикагеле (EtOAc в гексане 2,5%25%) до получения целевого соединение при прибл. 90% чистоты (9,39 г, 68% выхода). 1 Н ЯМР (300 МГц, CDCl3)м.д. 2.47 (m app s, 4 Н), 7.36 (d, 2 Н), 7.83 (d, 2 Н). МС (ЭИ): [М + Н]+ = 213. Интермедиат 1 С. (2S)-2-Метил[(1,1-2 Н 2)проп-2-ин-1-ил]амино-3-фенилпропан-1-ол К раствору (2S)-2-(метиламино)-3-фенилпропан-1-ола (3,00 г, 18,2 ммоль) в ТГФ (150 мл) добавляли карбонат калия (номер зерна 325, 3,76 г, 1,50 экв) при к.т. Добавляли интермедиат 1 В и смесь перемешивали на протяжении ночи при к.т., для того чтобы получить полный цикл, добавляли другую часть карбоната калия (0,50 экв) и смесь перемешивали при к.т. на протяжении дополнительных 2 ч. Смесь выпаривали в вакууме и разделяли между дихлорметаном и соляным раствором. Органический слой сушили над сульфатом натрия и упаривали. Остаток очищали посредством колоночной хроматографии на силикагеле (EtOAc в гексане 9%90%) до получения требуемого продукта (2,07 г, 50% выхода). 1 Н ЯМР (600 МГц, ХЛОРОФОРМ-d)м.д. 2.29 (s, 1 Н), 2.37-2.43 (m, 1 Н), 2.44 (s, 3 Н), 2.75-2.95 (s К раствору (2S)-2-метил[(1,1-2 Н 2)проп-2-ин-1-ил]амино-3-фенилпропан-1-ола (57 мг, 0,28 ммоль) в дихлорметане (3 мл) добавляли триэтиламин (58 мкл, 0,42 ммоль) и смесь охлаждали до 0 С. Добавляли метансульфонилхлорид (28 мкл, 0,36 ммоль) и охлаждающую ванну удаляли. После перемешивания при к.т. на протяжении 1 ч реакционную смесь нагревали до 100 С в высокочастотной печи на протяжении 1 ч. После охлаждения до к.т. смесь разбавляли простым диэтиловым эфиром (3 мл) и затем промывали с помощью использования водного бикарбоната натрия. Водные слои экстрагировали простым диэтиловым эфиром (23 мл) и комбинированные органические слои разбавляли дихлорметаном и окончательно промывали соляным раствором. Органический слой сушили над сульфатом натрия и упаривали. С помощью колоночной хроматографии на кварце (Et2O в пентане 5%15%) получали указанное в заголовке соединение, содержащее лишь небольшое количество соответствующего первичного региоизомера[19F] D2 депренил. К раствору (2S)-2-метил[(1,1-2 Н 2)проп-2-ин-1-ил]амино-3-фенилпропан-1-ола (2,00 г, 9,74 ммоль) в ТГФ (50 мл) добавляли последовательно нонафторбутансульфонил фторид (5,89 г, 2,0 экв), триэтиламин трис-гидрофторид (3,14 г, 2,0 экв) и триэтиламин (8,15 мл, 6,0 экв) и полученную смесь перемешивали на протяжении 24 ч при к.т. После выпаривания в вакууме неочищенный остаток очищали с помощью применения колоночной хроматографии на кварце (5%15% EtOAc в гексане) до получения чистого указанного в заголовке соединения в качестве масла (220 мг, 10% выхода). Кроме того, получали региоизомер N-[(2R)-2-фтор-3-фенилпропил]-N-метил(1,1-2 Н 2)проп-2-ин-1-амина (380 мг, 19 % выхода),- 15023820 и смешанную фракцию, состоящую из обоих региоизомеров (400 мг, 20%). Пример 3. N-[(2S)-1-[18F]фтор-3-фенилпропан-2-ил]-N-метил(1,1-2 Н 2)-проп-2-ин-1-амин Раствор [18F]фторида в [18 О], обогащенный водой, прокачивали через неконцентрированный картриджSep-Pak QMA (предварительно обработанный карбонатом калия [0,5 М, 5 мл], 18 M Н 2 О, 10 мл), для того чтобы отделить 15 ГБк [18F]фторида, который затем элюировали из картриджа с использованием 1,5 мл раствора карбоната калия и Kryptofix 2.2.2 в воде и ацетонитриле (5 мг К 222 в 0,95 мл MeCN, 1 мг К 2 СО 3 в 0,05 мл воды). Растворитель выпаривали при 120 С в непрерывном потоке азота и получали осадок [18F]F/K2CO3/K2.2.2 желтого цвета. Дополнительно добавляли 1 мл экстрасухого ацетонитрила и выпаривали, как раньше. Затем остаток охлаждали до 50 С и добавляли N-[(2R)-2-хлор-3-фенилпропил]-N-метил(1,12 Н 2)проп-2-ин-1-амин (пример 2;2 мг), разбавленного в ДМСО (600 мкл). Закрытый реакционный сосуд нагревали при 120 С на протяжении 20 мин. Реакционную смесь охлаждали до 50 С и разбавляли с использованием 4 мл подвижной фазы перед введением в препаративную ВЭЖХ для очистки. Искомый первичный региоизомер N-[(2S)-1-[18F]фтор-3-фенил-пропан-2-ил]-N-метил-(1,1-2 Н 2)проп-2-ин-1-амина очищали с применением ВЭЖХ с обращенной фазой на АСЕ 5 С 18 HL 25010 мм, 5 мкм и 85% 0,01 М Н 3 РО 4 /15%MeCN применяли в качестве элюента при скорости потока 4 мл/мин. Элюат контролировали с помощью детектора поглощения УФ ( = 254 нм) последовательно с детектором радиоактивного излучения. Фракцию искомого соединения собирали при tR = 12,5 мин (фиг. 6) и разбавляли с использованием 40 мл воды. Разбавленный продукт помещали в картридж Sep-Pak C18 plus. Картридж промывали 5 мл воды и искомый меченый 18F продукт элюировали с использованием 1 мл этанола в сосуд для продукта (2,77 ГБк). Радиохимическую чистоту радиолиганда анализировали с помощью ВЭЖХ с обращенной фазой на АСЕ 3 С 18S/N- A67537, 504,6 мм, 3 мкм с градиентом растворителя: начало 5% ацетонитрил - 95% ацетонитрила в 0,1% трифторуксусной кислоты в течение 7 мин, скорость потока: 2 мл/мин. Искомый меченый 18F продукт примера 3 выделяли с радиохимической чистотой 99% и радиохимическим выходом 27,5%, с поправкой на радиоактивный распад в течение 70 мин, что подтверждено при совместной инъекции с соответствующим нерадиоактивным F-19 фторстандартным эталоном из примера 2. Элюат контролировали с помощью детектора поглощения УФ ( = 254 нм) последовательно с детектором радиоактивного излучения. Время удерживания меченого 18F продукта составляло tR = 2,59 мин (фиг. 7) и время удержания нерадиоактивного эталонного соединения было определен как tR = 2,36 мин (фиг. 8). Примеры, демонстрирующие превосходящие свойства соединений настоящего изобретения по сравнению с соединениями, описанными в предшествующем уровне техники.[19F] D2 депренил (соединение примера 2) обладает сродством к МАО-В, IC50 = 41,3 нМ. Это было определено посредством инкубации МАО-В человека, полученной из клеток насекомых, инфицированных рекомбинантным бакуловирусом, содержащим соответствующие вставки кДНК (компания Sigma) с соответствующими реактивами Amplex Red Monoamine Oxidase Assay-Kit (компания Molecular Probes). Сродство к МАО-А составляет больше чем 2 мкМ. Биораспределение [18F] D2 депренила (соединение примера 3) исследовали на мышах массой 31,138,5 г, используя ЯМР-визуализацию на семь моментов времени. Для каждого момента времени использовали 3 мыши. Каждой мыше вводили 0,256 МБк [18F] D2 депренила. После прохождения соответствующих моментов времени мышей умерщвляли, органы вынимали и измеряли посредством счетчика гамма-излучения. Результаты коррегировали на радиоактивный распад. Соединение показало высокое начальное поглощение головным мозгом радиоактивности (пик: 6,031,09% ИР/г через 2 мин п.и.) и высокое начальное выведение радиоактивности из головного мозга (1,440,15% ИР/г через 30 мин п.и.),с дальнейшим снижением (0,910,09% ИР/г, 4 ч п.и.), как показано на фиг. 1. Неожиданно соотношение выведения, определенного с помощью пика поглощения через 2 мин, к поглощению через 30 мин составило 4,2 раза. Указанное улучшено по сравнению с недейтерированным соединением, в котором указанное соотношение составляло 3,6 (пик: 7,50,04% ИР/г через 2 мин п.и. и 2,100,33% ИР/г через 30 мин п.и.) и обеспечивает лучшее качество визуализации головного мозга. Таким образом, можно ожидать улучшенного качества диагностики.[18F] D2 депренил и [19F] D2 депренил исследовали в отношении их метаболических свойств in vitro и in vivo. Исследования профиля метаболитов в микросомах печени крысы, мыши и человека и в гепатоцитах человека и крысы показали, что N-деалкилирование является главным метаболическим путем как для дейтерированного, так и для недейтерированного соединения. Однако окисление на пропаргиловом фрагменте, которое наблюдалось в качестве дополнительного метаболического пути для недейтерированного соединения (М-7), неожиданно больше не обнаруживалось при инкубации с использованием[19F] D2 депренила (фиг. 9). Кроме того, в ткани головного мозга метаболит 18F, представленный интересующей областью 2(ИО 2, отмеченный прямоугольником) тонкослойной хроматографии (ТСХ), был определен как [18F] амфетамин (фиг. 2b). Оптическая плотность указанного слоя метаболита была измерена с помощью использования программного обеспечения Image Quant 5.2 (компания Molecular Dynamics 1999) и было установлено снижение примерно в 2,4 раза для [18F] D2 депренила, по сравнению с недейтерированным [18F] депренилом (соединение F) (фиг. 2 а). Характерно, что указанные данные указывают на улучшенный метаболический профиль [18F] D2 депренила в качестве преимущества перед недейтерированным соединением, что может привести к более низкому фоновому сигналу при ПЭТ визуализации головного мозга. Метаболические профили радиоактивности плазмы наблюдали с течением времени для [18F] D2 депренила по сравнению с недейтерированным [18F] депренилом в плазме яванского макаки (фиг. 3). Как видно из сравнения графиков, изображающих радиоактивность [18F] D2 депренила в плазме, на моменты времени, составляющие 30 и 60 мин соответственно, радиоактивность для [18F] D2 депренила была на 18 и 31% выше, как это наблюдалось для [18F] депренила (фиг. 3). Кроме того, метаболиты, которые появлялись в плазме яванского макаки с течением времени, наблюдались для обоих лигандов (фиг. 4). Как видно из фиг. 3, [18F] D2 депренил был более стабильным в плазме, чем недейтерированный [18F] депренил. Характерно, что метаболит М 1 был получен в меньшем количестве (фиг. 4 а). Кроме того, кривые зависимости активности от времени (КАВ) [18F] D2 депренила показали особенности обратимого поведения(фиг. 10). Это дает большую гибкость в отношении количественного определения данных ПЭТ и, таким образом, является преимуществом. Особенно важное улучшение МАО-В визуализации является неожиданным техническим эффектом,в соответствии с которым интенсивность сигнала [18F] депренила относительно [18F] D2 депренила меньше в 6-8 раз в областях головного мозга, исследованных во время фазы равновесного состояния (см. фиг. 5 а). Из исследований с применением [11 С] депренила известно, что сигнал МАО-В является заниженным в областях с высокой активность МАО-В, связи с высокой скоростью захвата, которая подобна или превышает доставку (Fowler и др. J. Nucl. Med. 1995, 36: 1255). Как сообщалось, дейтерирование[11 С] депренила приводит к уменьшению скорости захвата, что, в свою очередь, приводит к более достоверному количественному определению сигнала. Воздействие дейтерирования на снижение интенсивности сигнала [11 С] D2 депренила (DED) наблюдалось в здоровых областях головного мозга бабуина и человека, которые сопоставимы с исследованными нами областями, например стриатум, таламус, кора головного мозга показывали лишь приблизительно 1,2-2,0 (Fowler и др. J. Neurochem. 1988, 51: 1524-1534;J. 5 Nucl. Med. 1995, 36: 1255-1262; Mol. Imaging Biol. 2005, 7: 377-387). Это неожиданно проявленное улучшение вышеупомянутого соотношения (6-8, по сравнению с 1,2-2,0 в предшествующем уровне техники) представляет соединения в соответствии с изобретением в качестве превосходных веществ для ПЭТ визуализации. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение формулы IR2 представляет собой [19F]фтор, [18F]фтор или уходящую группу, где уходящие группы выбирают из галогена, C1-С 6-алкилсульфонилокси, который необязательно замещен фтором, и арилсульфонилокси,который необязательно замещен водородом, метилом, гало и нитро;n и m выбирают из 0 и 1 при условии, что, если n = 0, m должно быть 1, и, если n = 1, m должно быть 0, и, если R2 представляет собой фтор, то n должно быть 1, и m должно быть 0; включая все стереоизомерные формы указанных соединений, включая, но не ограничиваясь ими,энантиомеры и диастереоизомеры, так же как и рацемические смеси, а также любую подходящую соль с органической или неорганической кислотой или сольват. 2. Соединение в соответствии с п.1,где R2 выбирают из группы, состоящей из хлора, брома, метансульфонилокси и птолуолсульфонилокси. 3. Соединение в соответствии с п.1 или 2, гдеR2 выбирают из фтора или хлора. 4. Соединение в соответствии с п.1 формулы IaR2 выбирают из фтора или хлора; включая энантиомеры, так же как и рацемические смеси, а также любую подходящую соль с органической или неорганической кислотой или их сольват. 5. Соединение в соответствии с п.1 формулы IbR2 представляет собой хлор; включая энантиомеры, так же как и рацемические смеси, а также любую подходящую соль с органической или неорганической кислотой или их сольват. 6. Соединение в соответствии с п.1, выбранное из группы соединений, состоящей из соединения формулы Ic и любой подходящей соли с органической или неорганической кислотой или их сольвата. 7. Меченое [18F] соединение в соответствии с пп.1, 3, 4 или 6 с R2, представляющим собой [18F] качестве диагностического соединения для ПЭТ визуализации. 8. Диагностическая композиция, содержащая меченое [18F] соединение в соответствии с пп.1, 3,или 6 с R2, представляющим собой [18F] для ПЭТ визуализации. 9. Меченое [18F] соединение в соответствии с пп.1, 3, 4 или 6 с R2, представляющим собой [18F] качестве диагностического соединения для ПЭТ визуализации заболеваний ЦНС. 10. Диагностическая композиция, содержащая меченое [18F] соединение в соответствии с пп.1, 3,или 6 с R2, представляющим собой [18F] для ПЭТ визуализации заболеваний ЦНС. 11. Соединение в соответствии с п.7 или 9 для визуализации болезни Альцгеймера. 12. Композиция в соответствии с п.8 или 10 для визуализации болезни Альцгеймера. 13. Соединение в соответствии с пп.7, 9 или 11, где меченое [18F] соединение представляет собой соединение формулы Ie где F = 18F. 14. Композиция в соответствии с пп.8, 10 или 12, где меченое [18F] соединение представляет собой соединение формулы Ie где F = 18F. 15. Способ синтеза соединения формулы I по п.1R2 представляет собой уходящую группу, где уходящие группы выбирают из галогена, C1-С 6 алкилсульфонилокси, который необязательно замещен фтором, и арилсульфонилокси, который необязательно замещен водородом, метилом, гало и нитро;n и m выбирают из 0 и 1, при условии, что, если n = 0, m должно быть 1, и, если n = 1, m должно быть 0, и, если R2 представляет собой фтор, то n должно быть 1, и m должно быть 0; отличающийся тем, что соединение формулы IIa вступает в реакцию с сульфонилангидридом или сульфонилгалогенидом. 16. Способ синтеза соединения формулы Ib по п.5R2 представляет собой хлор; отличающийся тем, что соединение формулы IIb вступает в реакцию с сульфонилхлоридом. 17. Способ в соответствии с п.16, где сульфонилхлорид представляет собой метансульфонилхлорид. 18. Способ в соответствии с п.16 или 17 синтеза соединения формулы If отличающийся тем, что соединение формулы IIc вступает в реакцию с метансульфонилхлоридом. 19. Способ синтеза соединения формулы I по п.1n представляет собой 1 и m представляет собой 0; отличающийся тем, что соединение формулы IR2 представляет собой уходящую группу, где уходящие группы выбирают из галогена, C1-С 6 алкилсульфонилокси, который необязательно замещен фтором, и арилсульфонилокси, который необязательно замещен водородом, метилом, гало и нитро;n представляет собой 0 и m представляет собой 1; вступает в реакцию с подходящим F-фторирующим агентом, где F представляет собой 18F. 20. Способ в соответствии с п.19 синтеза соединения формулы Ic где F представляет собой 18F,отличающийся тем, что соединение формулы Id вступает в реакцию с подходящим F-фторирующим агентом, где F представляет собой 18F. 21. Способ в соответствии с п.19 или 20 синтеза соединения формулы Ie где F представляет собой 18F,отличающийся тем, что соединение формулы If вступает в реакцию с подходящим F-фторирующим агентом, где F представляет собой 18F. 22. Набор для ПЭТ визуализации, содержащий по крайней мере одну закрытую емкость, содержащую соединение по одному из пп.1-7, 9, 11 и 13 или композицию по одному из пп.8, 10, 12 и 14. 23. Набор для ПЭТ визуализации, содержащий по крайней мере одну закрытую емкость, содержащую соединение в соответствии с п.6. Фиг. 3 Период действия исходного соединения в плазме
МПК / Метки
МПК: C07C 209/16, C07B 59/00, C07C 211/29
Метки: центральной, нервной, системы, применения, заболеваний, визуализации, соединения, лечении, диагностике
Код ссылки
<a href="https://eas.patents.su/25-23820-soedineniya-dlya-primeneniya-v-vizualizacii-diagnostike-i-ili-lechenii-zabolevanijj-centralnojj-nervnojj-sistemy.html" rel="bookmark" title="База патентов Евразийского Союза">Соединения для применения в визуализации, диагностике и/или лечении заболеваний центральной нервной системы</a>
Предыдущий патент: Электропроводящее ламинированное остекление
Следующий патент: Хиназолинкарбоксамидазетидины, их применение в лечении гиперпролиферативных заболеваний и содержащие их композиции
Случайный патент: Способ и устройство для беспроводного управления цифровым контентом












