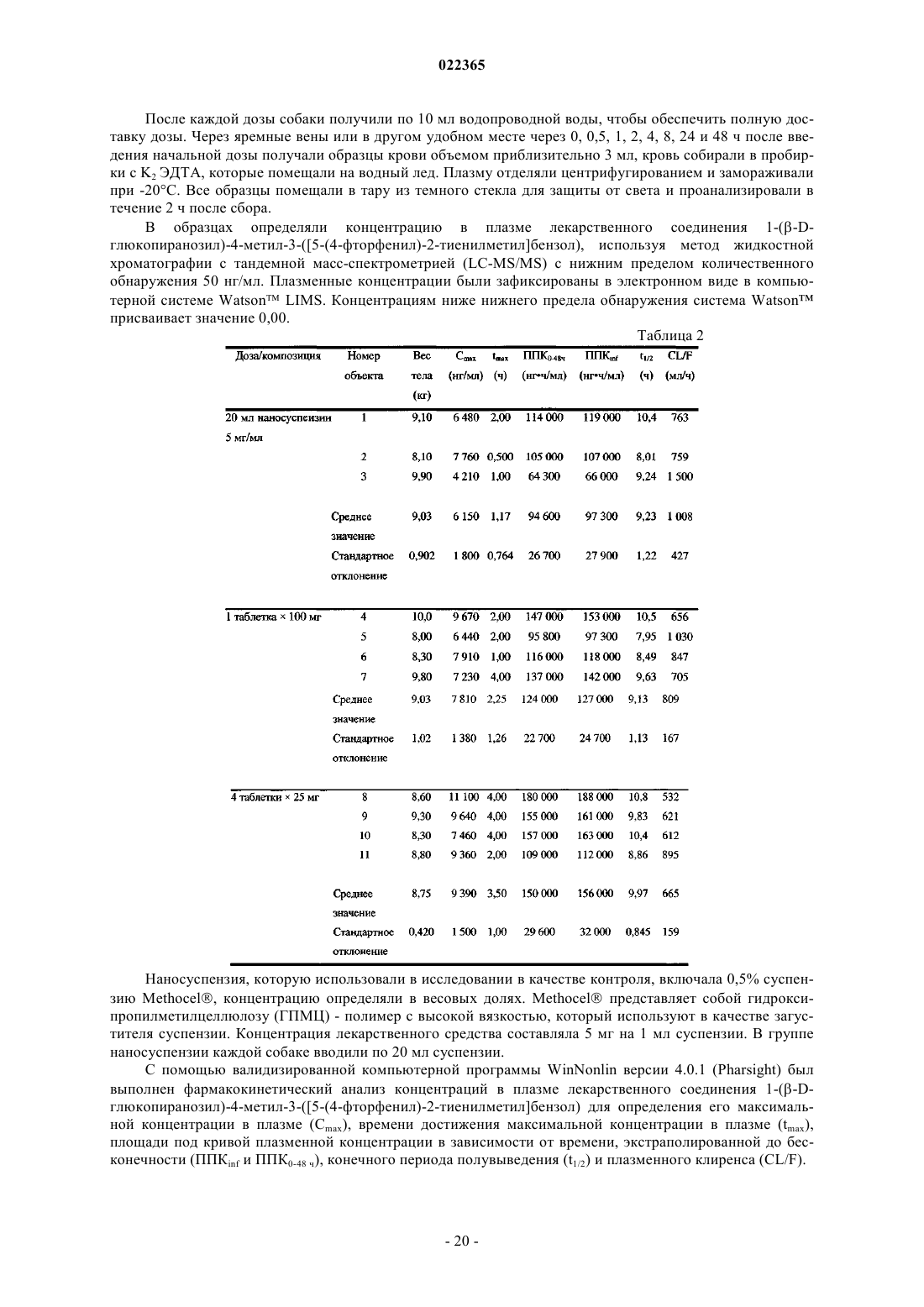
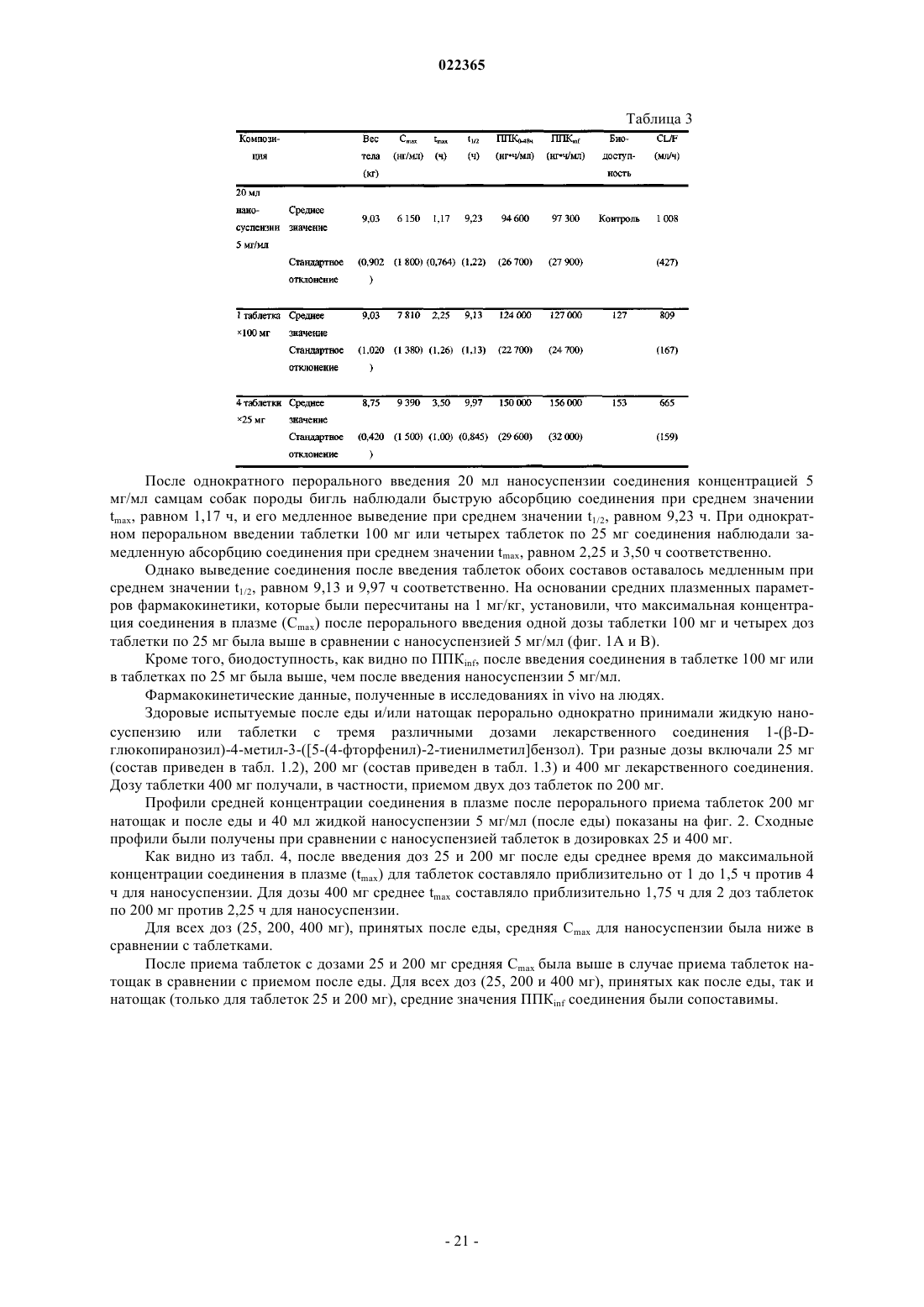
Фармацевтические композиции, содержащие производные 1-(бета-d-глюкопиранозил)-2-тиенилметилбензола как ингибиторы нзпг
Формула / Реферат
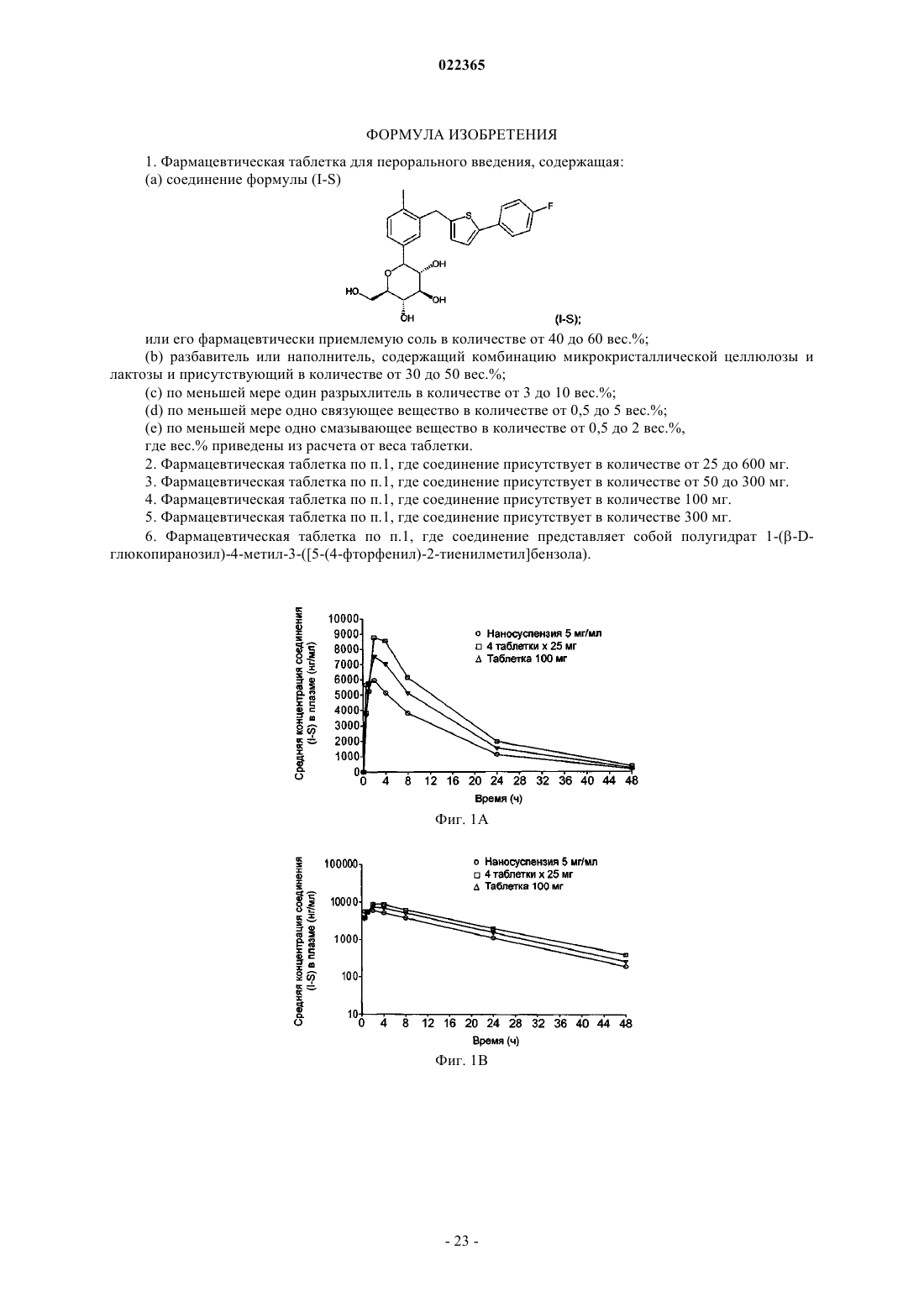
1. Фармацевтическая таблетка для перорального введения, содержащая:
(а) соединение формулы (I-S)
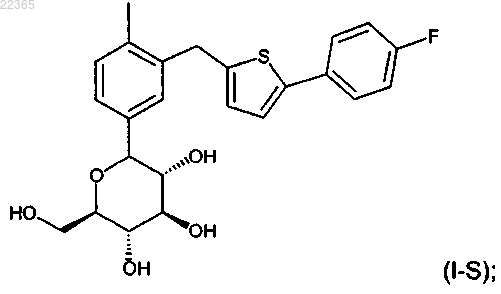
или его фармацевтически приемлемую соль в количестве от 40 до 60 вес.%;
(b) разбавитель или наполнитель, содержащий комбинацию микрокристаллической целлюлозы и лактозы и присутствующий в количестве от 30 до 50 вес.%;
(c) по меньшей мере один разрыхлитель в количестве от 3 до 10 вес.%;
(d) по меньшей мере одно связующее вещество в количестве от 0,5 до 5 вес.%;
(e) по меньшей мере одно смазывающее вещество в количестве от 0,5 до 2 вес.%,
где вес.% приведены из расчета от веса таблетки.
2. Фармацевтическая таблетка по п.1, где соединение присутствует в количестве от 25 до 600 мг.
3. Фармацевтическая таблетка по п.1, где соединение присутствует в количестве от 50 до 300 мг.
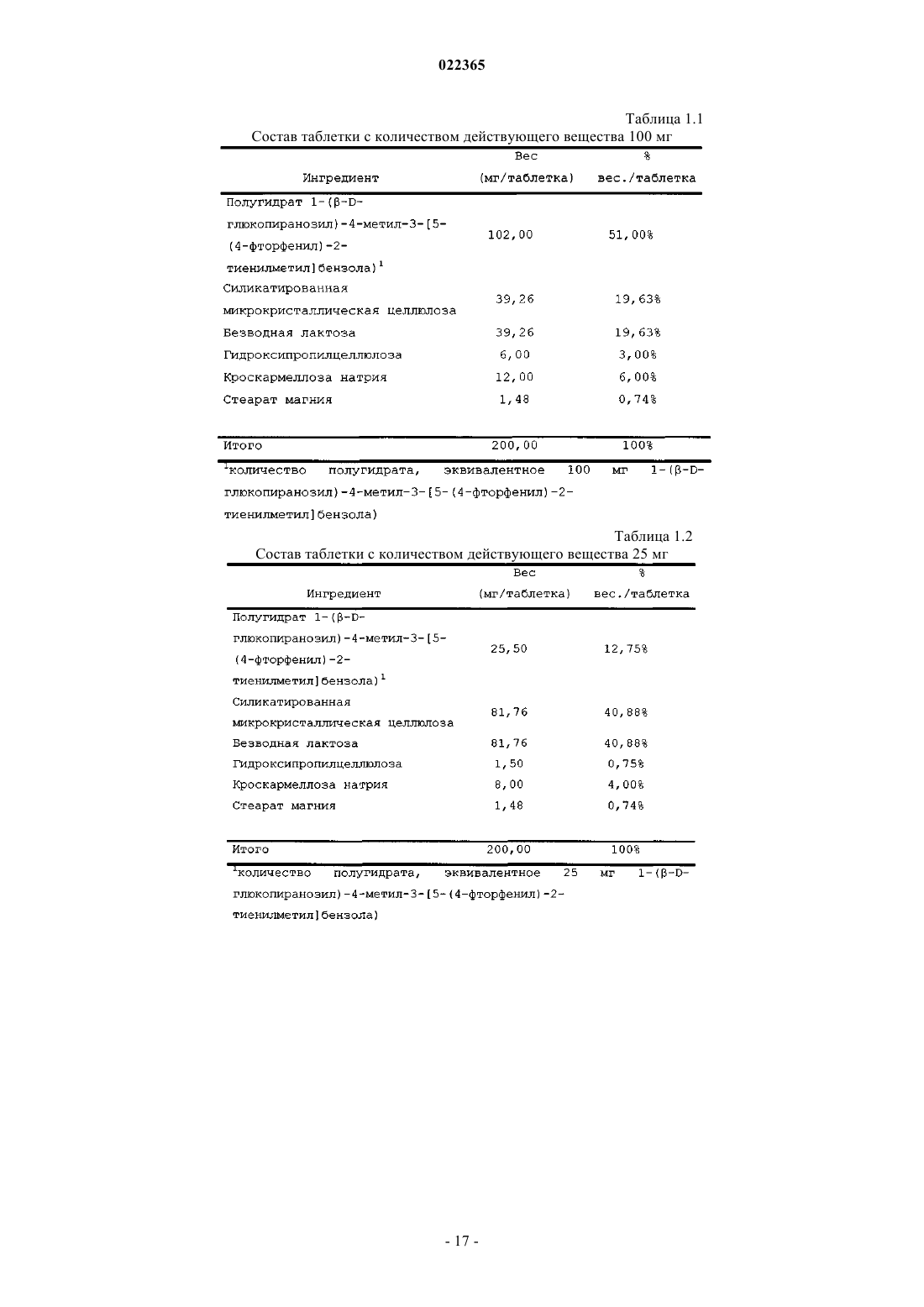
4. Фармацевтическая таблетка по п.1, где соединение присутствует в количестве 100 мг.
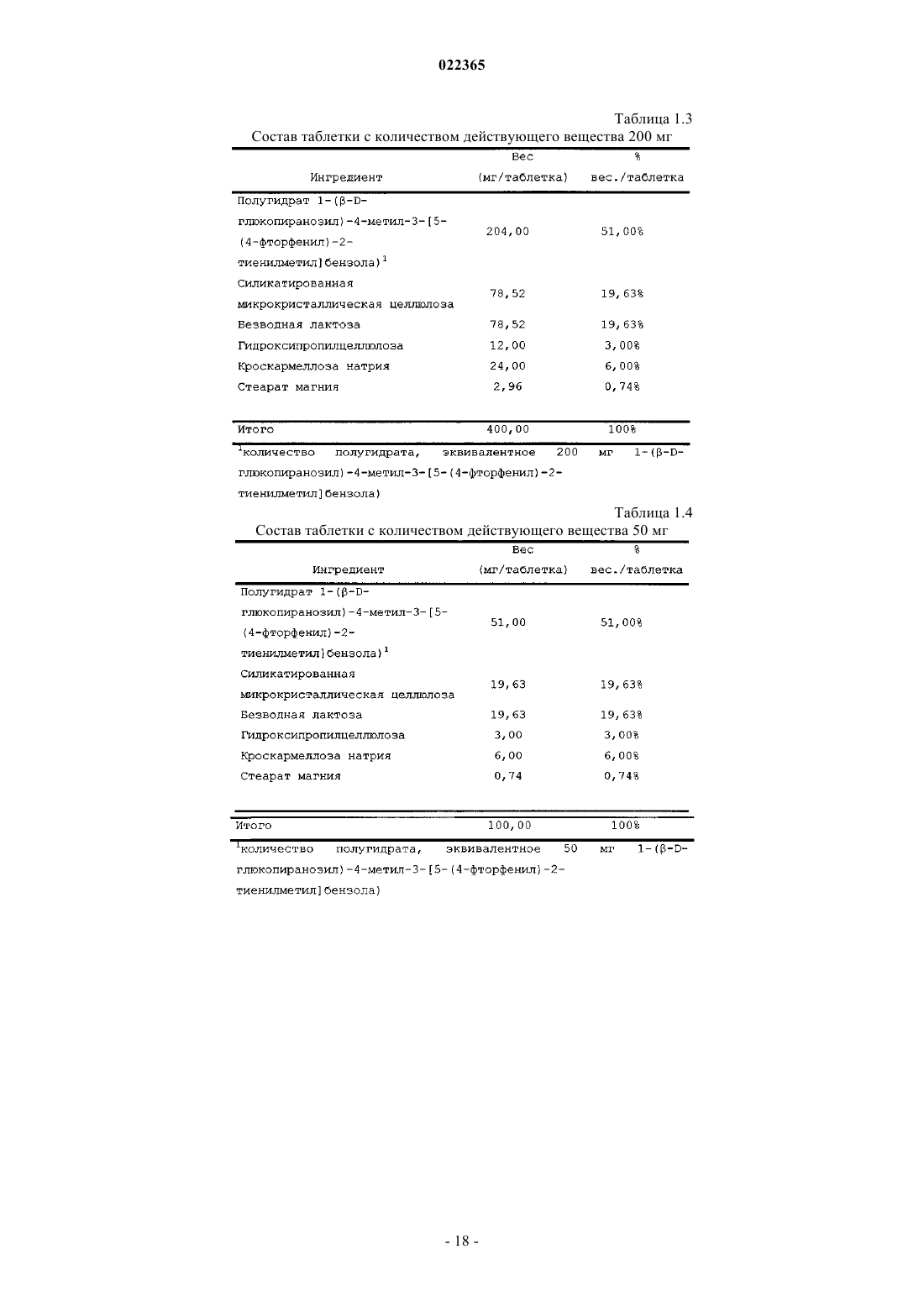
5. Фармацевтическая таблетка по п.1, где соединение присутствует в количестве 300 мг.
6. Фармацевтическая таблетка по п.1, где соединение представляет собой полугидрат 1-(β-D-глюкопиранозил)-4-метил-3-([5-(4-фторфенил)-2-тиенилметил]бензола).
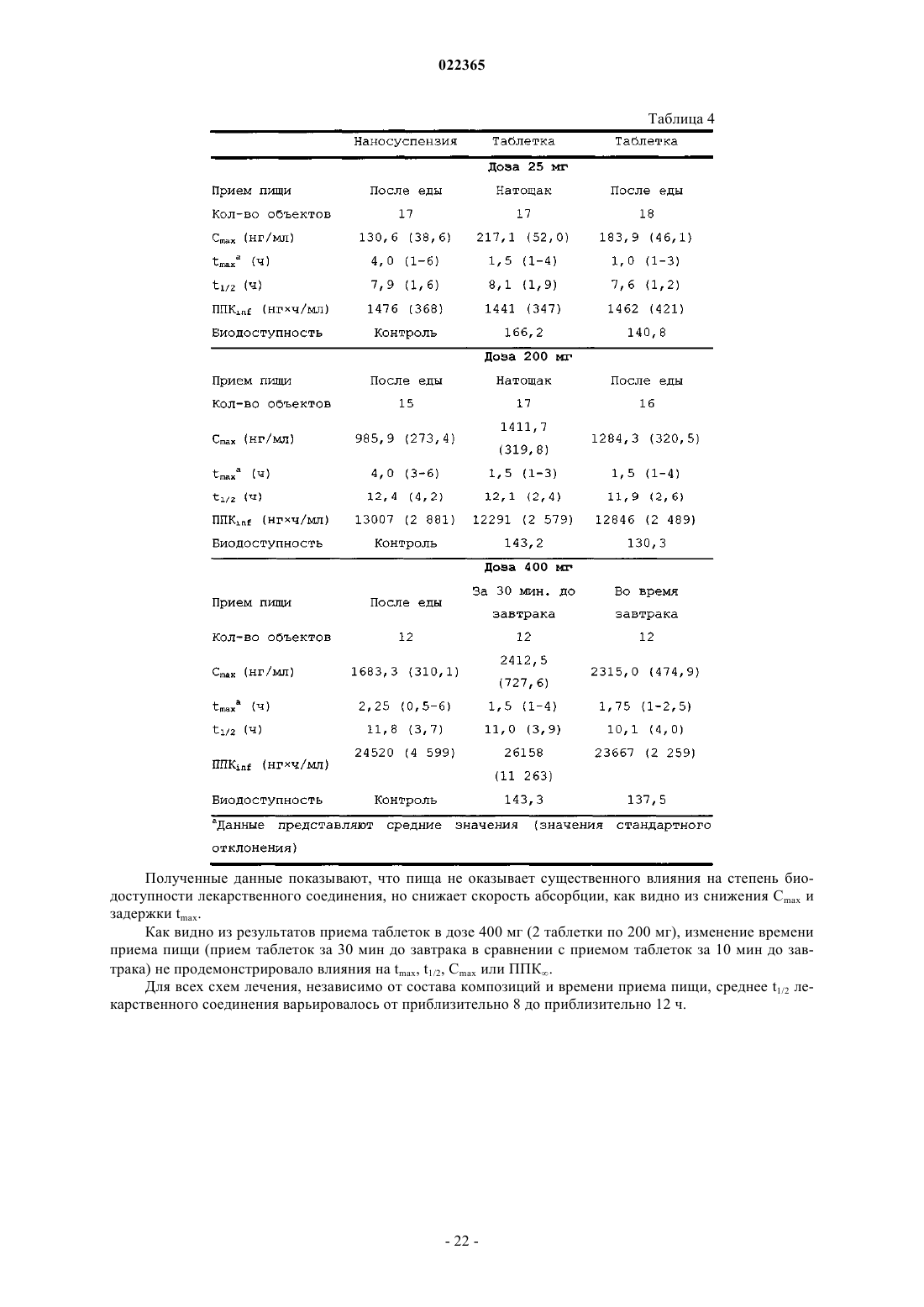
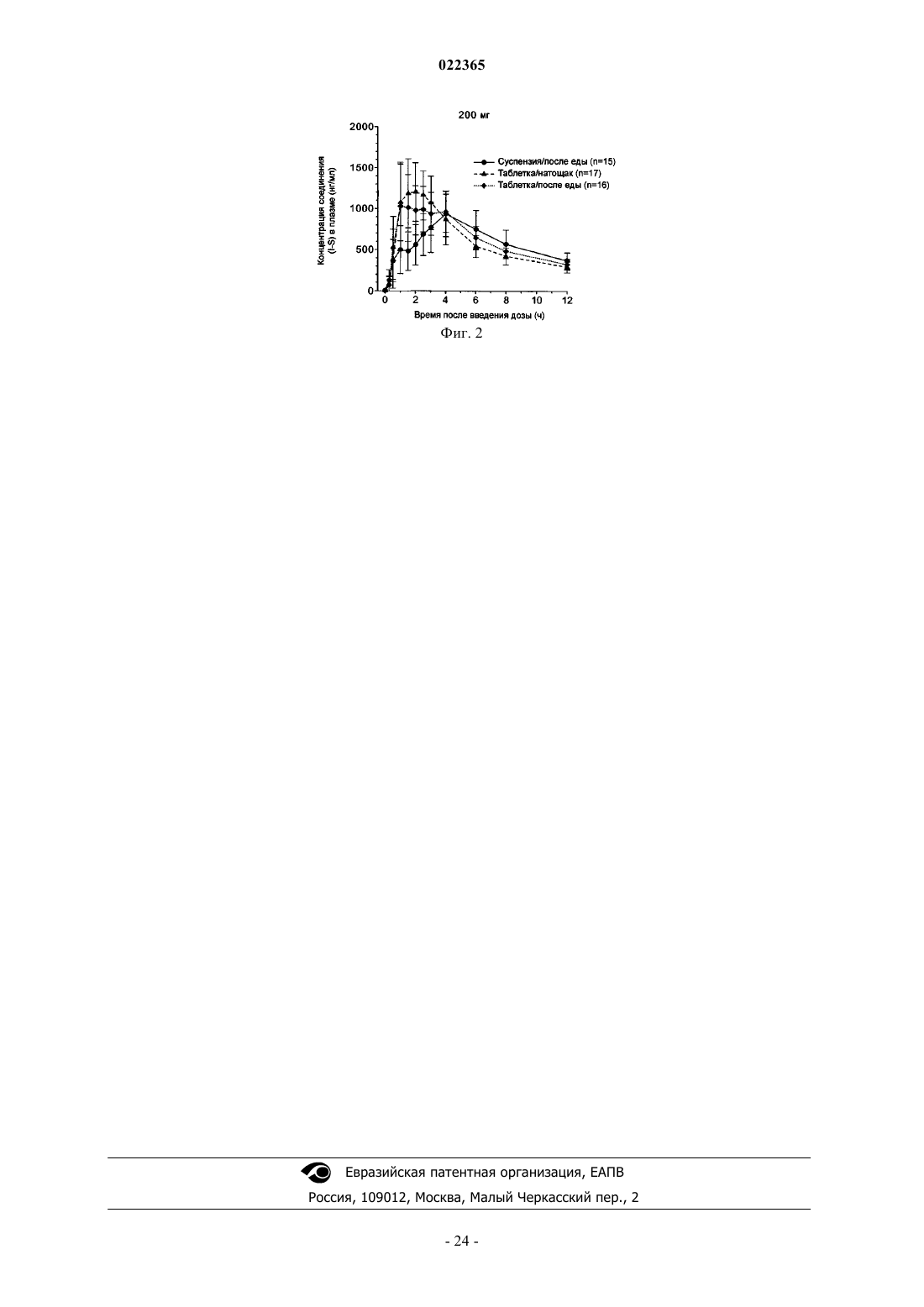
Текст
Изобретение относится к композициям, включающим в себя соединения формулы (I) или их пролекарство, или фармацевтически приемлемую соль.(71)(73) Заявитель и патентовладелец: ЯНССЕН ФАРМАЦЕВТИКА НВ (BE) Перекрестные ссылки на смежные изобретения Данная заявка истребует приоритет предварительной заявки на патент США 61/333495, поданной 11 мая 2010 г., которая полностью включена в настоящий документ путем ссылки. Использовалось ли в данном исследовании федеральное финансирование Научное исследование и разработка изобретения, описанного ниже, не финансировались из федерального бюджета. Область техники, к которой относится изобретение Настоящее изобретение относится к новым фармацевтическим композициям, содержащим описанные в настоящем документе соединение формулы (I), его пролекарство или фармацевтически приемлемую соль, которые можно использовать для лечения сахарного диабета, ожирения, диабетических осложнений и сопутствующих заболеваний. Предпосылки создания изобретения Международная заявкаWO 2005/012326, включенная в настоящий документ в полном объеме путем ссылки, раскрывает класс соединений, которые являются ингибиторами натрийзависимого переносчика глюкозы (НЗПГ), а также использование таких соединений в терапевтических целях для лечения диабета, ожирения, диабетических осложнений и т.п. Международная заявкаWO 2005/012326 раскрывает соединение 1-(-D-глюкопиранозил)-4-метил-3-([5-(4-фторфенил)-2-тиенилметил]бензол). Полугидрат 1-(-D-глюкопиранозил)-4-метил-3-([5-(4-фторфенил)-2-тиенилметил]бензола) и его определенная кристаллическая форма раскрыты в международной заявкеWO 2008/069327, которая также в полном объеме включена в настоящий документ путем ссылки. Краткое описание изобретения В своих многочисленных вариантах осуществления настоящее изобретение представляет новую фармацевтическую композицию соединений формулы (I), их пролекарства или фармацевтически приемлемой соли, а также способы лечения, профилактики, подавления или снижения интенсивности симптомов одного или более заболеваний, ассоциированных с натрийзависимым переносчиком глюкозы, при использовании таких фармацевтических композиций. Одним аспектом настоящего изобретения является пероральная фармацевтическая композиция, содержащая: где R1 представляет собой галоген, циано, необязательно замещенный низший алкил или необязательно замещенный низший алкоксил;R2 представляет собой необязательно замещенный арил или необязательно замещенный гетероциклил,или его пролекарство, или фармацевтически приемлемую соль;(b) по меньшей мере один разбавитель или наполнитель;(c) необязательно по меньшей мере один разрыхлитель;(d) необязательно по меньшей мере одно связующее вещество;(e) необязательно по меньшей мере одно смазывающее вещество,где соединение формулы (I) присутствует в количестве от приблизительно 1 до приблизительно 80 вес.%; разбавитель или наполнитель присутствует в количестве от приблизительно 10 до приблизительно 95 вес.%; разрыхлитель, если применимо, присутствует в количестве от приблизительно 0,1 до приблизительно 20 вес.%; связующее вещество, если применимо, присутствует в количестве от приблизительно 0,1 до приблизительно 20 вес.%; смазывающее вещество, если применимо, присутствует в количестве от приблизительно 0,1 до приблизительно 5 вес.%, где все указанные выше процентные количества приведены из расчета от веса композиции. В некоторых вариантах осуществления соединение формулы (I) представляет собой соединение формулы (I-S), как описано в настоящем документе. В некоторых вариантах осуществления настоящее изобретение относится к пероральной фармацевтической композиции, содержащей соединение формулы (I), как описано в настоящем документе, в ком-1 022365 бинации с веществом, улучшающим биодоступность. В некоторых вариантах осуществления вещество, улучшающее биодоступность, повышает биодоступность соединения и включает в себя эксципиенты, известные в области создания фармацевтических препаратов. Предпочтительное сочетание соединения формулы (I) с веществом, улучшающим биодоступность, приводит к заметному повышению биодоступности соединения при введении препарата. Предпочтительно настоящее изобретение дополнительно относится к веществу, улучшающему биодоступность, которое включает в себя композицию эксципиентов, таких как связующие вещества,наполнители, разрыхлители, смазывающие вещества или их комбинации. В некоторых вариантах осуществления композиция, составляющая предмет настоящего изобретения, представляет собой твердую пероральную дозированную форму, которая обеспечивает повышенную биодоступность содержащегося в ней соединения по сравнению с суспензией для перорального применения, содержащей соединение в том же количестве, что и твердая пероральная дозированная форма. Дополнительные варианты осуществления и преимущества настоящего изобретения станут очевидны из подробного описания, чертежей, примеров и формулы изобретения, представленных ниже. Краткое описание чертежей На фиг. 1 А и В показаны линейные и логарифмические профили концентрации соединения формулы (I-S) в плазме после перорального введения различных композиций соединения формулы (I-S) собакам; на фиг. 2 показаны профили концентрации соединения (I-S) в плазме после перорального введения различных композиций соединения формулы (I-S) людям. Подробное описание изобретения Настоящее изобретение частично относится к пероральной фармацевтической композиции, содержащей: или его пролекарство, или фармацевтически приемлемую соль;(b) по меньшей мере один разбавитель или наполнитель;(c) необязательно по меньшей мере один разрыхлитель;(d) необязательно по меньшей мере одно связующее вещество;(e) необязательно по меньшей мере одно смазывающее вещество,где соединение формулы (I-S) присутствует в количестве от приблизительно 1 до приблизительно 80 вес.%; разбавитель или наполнитель присутствует в количестве от приблизительно 10 до приблизительно 95 вес.%; разрыхлитель, если применимо, присутствует в количестве от приблизительно 0,1 до приблизительно 20 вес.%; связующее вещество, если применимо, присутствует в количестве от приблизительно 0,1 до приблизительно 20 вес.%; смазывающее вещество, если применимо, присутствует в количестве от приблизительно 0,1 до приблизительно 5 вес.%, где все указанные выше процентные количества приведены из расчета от веса композиции. В некоторых вариантах осуществления настоящее изобретение относится к пероральной фармацевтической композиции, содержащей:(a) соединение формулы (I-S) или его пролекарство, или фармацевтически приемлемую соль, присутствующее в количестве от приблизительно 40 до приблизительно 60 вес.%;(b) по меньшей мере один разбавитель или наполнитель, присутствующий в количестве от приблизительно 30 до приблизительно 50 вес.%;(c) по меньшей мере один разрыхлитель, присутствующий в количестве от приблизительно 3 до приблизительно 10 вес.%;(d) по меньшей мере одно связующее вещество, присутствующее в количестве от приблизительно 0,5% до приблизительно 5 вес.%;(e) по меньшей мере одно смазывающее вещество, присутствующее в количестве от приблизитель-2 022365 но 0,5 до приблизительно 2 вес.%,где вес.% рассчитывают от веса композиции. Соединение формулы (I-S) может также именоваться 1-(-D-глюкопиранозил)-4-метил-3-([5-(4 фторфенил)-2-тиенилметил]бензолом). В некоторых предпочтительных вариантах осуществления соединение формулы (I-S) представляет собой полугидрат соединения формулы (I-S) и может также именоваться как полугидрат 1-(-Dглюкопиранозил)-4-метил-3-([5-(4-фторфенил)-2-тиенилметил]бензола). В некоторых вариантах осуществления настоящее изобретение относится к фармацевтической композиции, описанной в настоящем документе, которая предназначена для производства фармацевтической дозированной формы для перорального введения млекопитающему в терапевтических целях и отличается тем, что указанную дозированную форму можно вводить указанному млекопитающему в любое время суток, независимо от приема пищи. В некоторых вариантах осуществления настоящее изобретение относится к способу лечения человека или животного, содержащему введение в указанный организм терапевтически эффективной дозы фармацевтической композиции, описанной в настоящем документе. В некоторых вариантах осуществления настоящее изобретение относится к фармацевтической упаковке, допустимой для продажи, содержащей контейнер, пероральную дозированную форму, описанную в настоящем документе, а также сопутствующие инструкции, не ограниченные только указаниями по введению дозированной формы натощак или во время приема пищи. А) Термины. Ниже представлены определения некоторых терминов и значения, в которых они используются в настоящем описании. Термины "прием" или "введение" означают доставку в организм пациента лекарственного препарата любым способом, известным в фармакологии. Термины "пациент" или "объект" означают животное, предпочтительно млекопитающее, более предпочтительно человека, нуждающегося в терапевтическом воздействии. Термин "дозированная форма" означает одно или более соединений в среде, носителе или устройстве, допустимом для введения пациенту. Термин "пероральная дозированная форма" означает дозированную форму, допустимую для перорального введения. Термин "доза" означает единицу лекарственного препарата. Как правило, доза обусловлена дозированной формой. Введение дозы лекарственного препарата пациентам производится в соответствии с различными режимами дозирования. Наиболее распространенные режимы дозирования включают в себя прием препарата перорально один раз в сутки (qd), перорально два раза в сутки (bid) и перорально три раза в сутки (tid)."Конечный период полувыведения" (t1/2) рассчитывают как 0,693/k, где "k" означает константу скорости выведения, вычисленную по линейной регрессии логарифмического преобразования концентрации в плазме во время конечной логарифмически-линейной фазы выведения. Период полувыведения лекарственного препарата из плазмы (t1/2) - это время, необходимое для снижения концентрации препарата в плазме вдвое, например с 100 до 50 мг/л. Знание периода полувыведения необходимо для определения частоты введения лекарственного препарата (количества приемов в сутки) с целью получения необходимой концентрации в плазме. Как правило, период полувыведения конкретного препарата не зависит от вводимой дозы. В некоторых исключительных случаях он изменяется в зависимости от дозы: он может увеличиваться или уменьшаться в зависимости, например, от механизма насыщения (элиминация, катаболизм, связывание с белками плазмы и т.д.)."Площадь под фармакокинетической кривой" (или ППК) представляет собой площадь, измеренную под кривой концентрации лекарственного средства в плазме, которая также называется профилем концентрации в плазме. Часто для ППК указывают временной интервал, в котором берется интеграл кривой концентрации лекарственного средства в плазме, например ППКначало-конец. Таким образом, ППК 0-48 ч обозначает ППК, полученную в результате интегрирования кривой концентрации в плазме за период от 0 до 48 ч, где за ноль традиционно принимают момент введения пациенту лекарственного средства или содержащей его дозированной формы. ППКt обозначает площадь под кривой концентрации в плазме от момента времени 0 до последней определяемой концентрации в момент времени t, вычисленную по правилу трапеции. ППКinf обозначает значение ППК, экстраполированное до бесконечности и вычисляемое как сумма ППКt и площади, экстраполированной до бесконечности, которая рассчитывается по концентрации в момент времени t (Ct), разделенной на k (в случае если значение t1/2 для объекта не поддавалось оценке, в качестве среднего значения t1/2 использовали расчетную ППКinf)."Средняя площадь под профилем концентрации в плазме" означает среднюю ППКinf, полученную для нескольких пациентов или в результате многократных введений лекарственного средства одному пациенту в различных случаях с перерывами между введениями, достаточными для вымывания препарата, чтобы после каждого однократного введения дозированной формы каждому пациенту обеспечить возможность снижения уровня содержания лекарственного средства до уровня перед его введением."С" обозначает концентрацию лекарственного средства в плазме, или сыворотке, крови объекта и,как правило, выражается в виде массы на единицу объема, обычно в нанограммах на миллилитр. Для удобства эта концентрация может называться в настоящем документе как "концентрация лекарственного средства в плазме", "концентрация лекарственного средства в плазме крови" или "концентрация в плазме". Концентрация лекарственного средства в плазме крови в любое время после введения лекарственного средства называется Свремя, как, например, C9 ч или С 24 ч и т.д. Максимальная концентрация в плазме после введения дозированной формы, полученная непосредственно из экспериментальных данных без интерполяции, называется Cmax. Усредненная или средняя концентрация в плазме за интересующий период называется Cavg или Cmean. "Средняя максимальная концентрация одной дозы в плазме Cmax" означает среднюю Cmax, полученную для нескольких пациентов или в результате многократных введений лекарственного средства одному пациенту в различных случаях с перерывами между введениями, достаточными для вымывания препарата, чтобы после каждого однократного введения дозированной формы каждому пациенту обеспечить возможность снижения уровня содержания лекарственного средства до уровня перед его введением."Профиль концентрации в плазме" относится к кривой, полученной при построении графика зависимости концентрации лекарственного соединения в плазме от времени. Как правило, традиционно за нулевую точку временной шкалы (как правило, на оси х) принимают время введения пациенту лекарственного соединения или дозированной формы, содержащей лекарственное соединение."Среднее время до максимальной концентрации в плазме" представляет собой среднее значение времени, прошедшее с момента введения пациенту дозированной формы, содержащей лекарственное средство, до момента достижения Cmax данного лекарственного средства, полученной для нескольких пациентов или в результате многократных введений препарата одному пациенту с перерывами между введениями, достаточными для вымывания препарата, чтобы после каждого однократного введения дозированной формы каждому пациенту обеспечить возможность снижения уровня содержания лекарственного средства до уровня перед его введением. Данное значение получают непосредственно из экспериментальных данных без интерполяции. Биодоступность показывает процент введенного лекарственного средства, поступивший в центральный компартмент. Она, как правило, определяется сравнением ППК, полученной, например, после внутривенного введения и после перорального введения лекарственного средства. ППК, полученная после внутривенного введения, соответствует биодоступности, принятой за 100%; ППК, полученная после перорального введения, в наилучшем варианте соответствует идентичной биодоступности. Как правило,она ниже, в отдельных случаях равна нулю. В данном изобретении, напротив, биодоступность определяется по максимальной концентрации в плазме Cmax, которая достигается после введения лекарственного средства. Более высокая Cmax дозированной формы указывает на лучшую биодоступность лекарственного средства при введении в данной дозированной форме. Компартмент обозначает воображаемый объем, в котором будет распределяться лекарственное средство. Он может соответствовать или не соответствовать реальному объему, например объему крови,который называют первым или центральным компартментом, или всему телу, за исключением крови,которое называют вторым компартментом. Центральный компартмент обычно включает в себя плазму и дополнительно те ткани или части тканей, в которых концентрации лекарственного средства быстро приходят в равновесие с концентрациями в плазме. Реальные части организма, в которых лекарственное средство распределяется в различных концентрациях, представлены одним, двумя, реже тремя виртуальными компартментами, в которых концентрацию лекарственного средства считают однородной. Таким образом, понятие компартмента позволяет моделировать метаболический путь лекарственного средства. Термин "галоген" обозначает хлор, бром, йод и фтор, при этом предпочтительными являются хлор и фтор. Термин "алкил" или "алкильная группа" означает линейную или разветвленную одновалентную насыщенную углеводородную цепь, имеющую от 1 до 12 атомов углерода. Предпочтительной является алкильная группа с линейной или разветвленной цепью, имеющей от 1 до 6 атомов углерода, более предпочтительной является алкильная группа с линейной или разветвленной цепью, имеющей от 1 до 4 атомов углерода. Примером может являться метильная группа, этильная группа, пропильная группа,изопропильная группа, бутильная группа, трет-бутильная группа, изобутильная группа, пентильная группа, гексильная группа, изогексильная группа, гептильная группа, 4,4-диметилпентильная группа,октильная группа, 2,2,4-триметилпентильная группа, нонильная группа, децильная группа и различные изомеры этих групп с разветвленной цепью. Кроме того, алкильная группа может быть при необходимости необязательно и независимо замещена одним-пятью перечисленными ниже заместителями."Алкоксильные" радикалы представляют собой кислородные эфиры, образованные из описанных выше линейных или разветвленных алкильных групп. В некоторых вариантах осуществления алкоксильные радикалы могут быть необязательно и независимо замещены указанными ниже заместителями в количестве от одного до пяти, предпочтительно от одного до трех. Термин "алкиленовая группа" или "алкилен" означает линейную или разветвленную двухвалентную насыщенную углеводородную цепь, имеющую от 1 до 12 атомов углерода. Предпочтительной является алкиленовая группа с линейной или разветвленной цепью, имеющей от 1 до 6 атомов углерода, более предпочтительной является алкиленовая группа с линейной или разветвленной цепью, имеющей от 1 до 4 атомов углерода. Примерами могут являться метиленовая группа, этиленовая группа, пропиленовая группа, триметиленовая группа и т.п. При необходимости алкиленовая группа может необязательно замещаться таким же образом, как описанная выше "алкильная группа". Определенные выше алкиленовые группы, присоединяемые к двум разным атомам углерода бензольного кольца, образуют аннелированное пяти-, шестиили семичленное углеродное кольцо с атомами углерода, к которым они присоединяются, и могут быть необязательно замещены один или более заместителями, указанными ниже. Термин "алкенильная группа" означает линейную или разветвленную одновалентную углеводородную цепь, имеющую от 2 до 12 атомов углерода и по меньшей мере одну двойную связь. Предпочтительной является алкенильная группа с линейной или разветвленной цепью, имеющей от 2 до 6 атомов углерода, более предпочтительной является алкенильная группа с линейной или разветвленной цепью,имеющей от 2 до 4 атомов углерода. Примерами таких групп являются винильная группа, 2 пропенильная группа, 3-бутенильная группа, 2-бутенильная группа, 4-пентенильная группа, 3 пентенильная группа, 2-гексенильная группа, 3-гексенильная группа, 2-гептенильная группа, 3 гептенильная группа, 4-гептенильная группа, 3-октенильная группа, 3-ноненильная группа, 4 деценильная группа, 3-ундеценильная группа, 4-додеценильная группа, 4,8,12-тетрадекатриенильная группа и т.п. Алкенильная группа при необходимости может быть необязательно и независимо замещена от 1 до 4 заместителями, как описано ниже. Термин "алкениленовая группа" означает линейную или разветвленную двухвалентную углеводородную цепь, имеющую от 2 до 12 атомов углерода и по меньшей мере одну двойную связь. Предпочтительной является алкениленовая группа с линейной или разветвленной цепью, имеющей от 2 до 6 атомов углерода, более предпочтительной является алкениленовая группа с линейной или разветвленной цепью,имеющей от 2 до 4 атомов углерода. Примерами могут служить виниленовая группа, пропениленовая группа, бутадиениленовая группа и т.п. При необходимости алкениленовая группа может быть необязательно замещена от 1 до 4 заместителями, как описано ниже. Определенные выше алкениленовые группы, присоединяемые к двум разным атомам углерода бензольного кольца, образуют аннелированное пяти-, шести- или семичленное углеродное кольцо (например, конденсированное бензольное кольцо) с атомами углерода, к которым они присоединяются, и могут необязательно быть замещены одним или более заместителями, указанными ниже. Термин "алкинильная группа" означает линейную или разветвленную одновалентную углеводородную цепь, содержащую по меньшей мере одну тройную связь. Предпочтительной является алкинильная группа с линейной или разветвленной цепью, имеющей от 2 до 6 атомов углерода, более предпочтительной является алкинильная группа с линейной или разветвленной цепью, имеющей от 2 до 4 атомов углерода. Примерами таких групп являются 2-пропинильная группа, 3-бутинильная группа, 2-бутинильная группа, 4-пентинильная группа, 3-пентинильная группа, 2-гексинильная группа, 3-гексинильная группа,2-гептинильная группа, 3-гептинильная группа, 4-гептинильная группа, 3-октинильная группа, 3 нонинильная группа, 4-децинильная группа, 3-ундецинильная группа, 4-додецинильная группа и т.п. Алкинильная группа при необходимости может быть необязательно и независимо замещена от 1 до 4 заместителями, как описано ниже. Термин "циклоалкильная группа" означает моноциклическое или бициклическое одновалентное насыщенное углеводородное кольцо, содержащее от 3 до 12 атомов углерода, более предпочтительной является моноциклическая насыщенная углеводородная группа с количеством атомов углерода от 3 до 7. Примерами таких групп могут являться моноциклическая алкильная группа и бициклическая алкильная группа, например циклопропильная группа, циклобутильная группа, циклопентильная группа, циклогексильная группа, циклогептильная группа, циклооктильная группа, циклодецильная группа и т.п. Эти группы могут быть при необходимости необязательно и независимо замещены от 1 до 4 заместителями,как описано ниже. Циклоалкильная группа может быть необязательно сконденсирована с насыщенным углеводородным кольцом или с ненасыщенным углеводородным кольцом (указанные насыщенное углеводородное кольцо и ненасыщенное углеводородное кольцо могут при необходимости необязательно включать атом кислорода, азота, серы, группу SO или SO2). Конденсированное насыщенное углеводородное кольцо и конденсированное ненасыщенное углеводородное кольцо могут быть необязательно и независимо замещены от 1 до 4 заместителями, как указано ниже. Термин "циклоалкилиденовая группа" означает моноциклическое или бициклическое двухвалентное насыщенное углеводородное кольцо, содержащее от 3 до 12 атомов углерода, более предпочтительной является моноциклическая насыщенная углеводородная группа с числом атомов углерода от 3 до 6. Примерами таких групп могут являться моноциклическая алкилиденовая группа и бициклическая алкилиденовая группа, например циклопропилиденовая группа, циклобутилиденовая группа, циклопентилиденовая группа, циклогексилиденовая группа и т.п. Эти группы могут быть при необходимости необязательно и независимо замещены от 1 до 4 заместителями, как описано ниже. Кроме того, циклоалкилиденовая группа может быть необязательно сконденсирована с насыщенным углеводородным кольцом или с ненасыщенным углеводородным кольцом (указанные насыщенное углеводородное кольцо и ненасыщенное углеводородное кольцо могут при необходимости необязательно включать атом кислорода, азота,серы, группу SO или SO2). Конденсированное насыщенное углеводородное кольцо и ненасыщенное углеводородное кольцо могут быть необязательно и независимо замещены от 1 до 4 заместителями, как указано ниже. Термин "циклоалкенильная группа" означает моноциклическое или бициклическое одновалентное ненасыщенное углеводородное кольцо, содержащее от 4 до 12 атомов углерода и имеющее по меньшей мере одну двойную связь. Предпочтительной циклоалкенильной группой является моноциклическая ненасыщенная углеводородная группа, содержащая от 4 до 7 атомов углерода. Примерами таких групп могут являться моноциклические алкенильные группы, такие как циклопентенильная группа, циклопентадиенильная группа, циклогексенильная группа и т.п. Эти группы могут быть при необходимости необязательно и независимо замещены от 1 до 4 заместителями, как описано ниже. Кроме того, циклоалкенильная группа может быть необязательно сконденсирована с насыщенным углеводородным кольцом или с ненасыщенным углеводородным кольцом (указанные насыщенное углеводородное кольцо и ненасыщенное углеводородное кольцо могут при необходимости необязательно включать атом кислорода,азота, серы, группу SO или SO2). Конденсированное насыщенное углеводородное кольцо и ненасыщенное углеводородное кольцо могут быть необязательно и независимо замещены от 1 до 4 заместителями,как указано ниже. Термин "циклоалкинильная группа" означает моноциклическое или бициклическое ненасыщенное углеводородное кольцо, содержащее от 6 до 12 атомов углерода и имеющее по меньшей мере одну тройную связь. Предпочтительной циклоалкинильной группой является моноциклическая ненасыщенная углеводородная группа, содержащая от 6 до 8 атомов углерода. Примерами могут являться моноциклические алкинильные группы, такие как циклооктинильная группа, циклодецинильная группа. Эти группы могут быть при необходимости необязательно замещены от 1 до 4 заместителями, как описано ниже. Кроме того, циклоалкинильная группа может быть необязательно и независимо сконденсирована с насыщенным углеводородным кольцом или с ненасыщенным углеводородным кольцом (указанные насыщенное углеводородное кольцо и ненасыщенное углеводородное кольцо могут при необходимости необязательно включать атом кислорода, азота, серы, группу SO или SO2). Конденсированное насыщенное углеводородное кольцо и ненасыщенное углеводородное кольцо могут быть необязательно и независимо замещены от 1 до 4 заместителями, как указано ниже. Термин "арильная группа" означает моноциклическую или бициклическую одновалентную ароматическую углеводородную группу, содержащую от 6 до 10 атомов углерода. Примерами такой группы являются фенильная группа, нафтильная группа (в том числе 1-нафтильная группа и 2-нафтильная группа). Эти группы могут быть при необходимости необязательно и независимо замещены от 1 до 4 заместителями, как описано ниже. Кроме того, арильная группа может быть необязательно сконденсирована с насыщенным углеводородным кольцом или с ненасыщенным углеводородным кольцом (указанные насыщенное углеводородное кольцо и ненасыщенное углеводородное кольцо могут при необходимости необязательно включать атом кислорода, азота, серы, группу SO или SO2). Конденсированное насыщенное углеводородное кольцо и ненасыщенное углеводородное кольцо могут быть необязательно и независимо замещены от 1 до 4 заместителями, как указано ниже. Термин "ненасыщенное моноциклическое гетероциклическое кольцо" означает ненасыщенное углеводородное кольцо, содержащее от 1 до 4 гетероатомов, независимо выбранных из атомов азота, кислорода и серы, предпочтительным является 4-7-членное ненасыщенное или насыщенное углеводородное кольцо, содержащее от 1 до 4 гетероатомов, независимо выбранных из атомов азота, кислорода и серы. Примерами такого кольца являются пиридин, пиримидин, пиразин, фуран, тиофен, пиррол, имидазол, пиразол, оксазол, изоксазол, 4,5-дигидрооксазол, тиазол, изотиазол, тиадиазол, триазол, тетразол и т.п. Среди них предпочтительными являются пиридин, пиримидин, пиразин, фуран, тиофен, пиррол,имидазол, оксазол и тиазол. "Ненасыщенное моноциклическое гетероциклическое кольцо" при необходимости может быть необязательно и независимо замещено от 1 до 4 заместителями, как указано ниже. Термин "ненасыщенное конденсированное гетеробициклическое кольцо" означает углеводородное кольцо, содержащее насыщенное или ненасыщенное углеводородное кольцо, сконденсированное с указанным выше ненасыщенным моноциклическим гетероциклическим кольцом, причем указанное насыщенное углеводородное кольцо и указанное ненасыщенное углеводородное кольцо могут при необходимости необязательно включать атом кислорода, атом азота, атом серы, группу SO или SO2. К "ненасыщенным конденсированным гетеробициклическим кольцам" относятся, например, бензотиофен, индол,тетрагидробензотиофен, бензофуран, изохинолин, тиенотиофен, тиенопиридин, хинолин, индолин, изоиндолин, бензотиазол, бензоксазол, индазол, дигидроизохинолин и т.п. Также к "гетероциклическим кольцам" относятся возможные N- или S-оксиды этих групп. Термин "гетероциклил" означает одновалентную группу вышеупомянутого ненасыщенного моноциклического гетероциклического кольца или ненасыщенного конденсированного гетеробициклического кольца и одновалентную группу насыщенного варианта вышеуказанного ненасыщенного моноциклического гетероциклического или ненасыщенного конденсированного гетеробициклического кольца. При необходимости гетероциклил может быть необязательно и независимо замещен от 1 до 4 заместителями,как указано ниже. Термин "алканоильная группа" означает формильную группу, а также группы, образующиеся при связывании "алкильной группы" с карбонильной группой. Термин "замещенный" относится к радикалу, в котором один или более атомов водорода, каждый независимо, замещен одинаковыми или разными заместителями. По отношению к заместителям термин "независимо" обозначает, что при возможности ввести более одного из таких заместителей вводимые заместители могут быть одинаковыми или разными. Предполагается, что определение какого-либо заместителя или переменной в определенном положении в молекуле не зависит от соответствующих определений на других участках молекулы. Считается,что заместители и схемы замещения соединений, составляющих предмет настоящего изобретения, могут быть выбраны специалистом в данной области для получения химически устойчивых соединений, которые могут быть синтезированы по известным в данной области методикам, а также способами, изложенными в настоящем документе. К заместителям для всех упомянутых выше групп относятся, например, атом галогена (фтор, хлор,бром), нитрогруппа, цианогруппа, оксогруппа, гидроксигруппа, меркаптогруппа, карбоксильная группа,сульфогруппа, алкильная группа, алкенильная группа, алкинильная группа, циклоалкильная группа, циклоалкилиденметильная группа, циклоалкенильная группа, циклоалкинильная группа, арильная группа,гетероциклильная группа, алкоксигруппа, алкенилоксигруппа, алкинилоксигруппа, циклоалкилоксигруппа, циклоалкенилоксигруппа, циклоалкинилоксигруппа, арилоксигруппа, гетероциклилоксигруппа,алканоильная группа, алкенилкарбонильная группа, алкинилкарбонильная группа, циклоалкилкарбонильная группа, циклоалкенилкарбонильная группа, циклоалкинилкарбонильная группа, арилкарбонильная группа, гетероциклилкарбонильная группа, алкоксикарбонильная группа, алкенилоксикарбонильная группа, алкинилоксикарбонильная группа, циклоалкилоксикарбонильная группа, циклоалкенилоксикарбонильная группа, циклоалкинилоксикарбонильная группа, арилоксикарбонильная группа, гетероциклилоксикарбонильная группа, алканоилоксигруппа, алкенилкарбонилоксигруппа, алкинилкарбонилоксигруппа, циклоалкилкарбонилоксигруппа, циклоалкенилкарбонилоксигруппа, циклоалкинилкарбонилоксигруппа, арилкарбонилоксигруппа, гетероциклилкарбонилоксигруппа, алкилтиогруппа, алкенилтиогруппа, алкинилтиогруппа, циклоалкилтиогруппа, циклоалкенилтиогруппа, циклоалкинилтиогруппа, арилтиогруппа, гетероциклилтиогруппа, аминогруппа, моно- или диалкиламиногруппа, моноили диалканоиламиногруппа, моно- или диалкоксикарбониламиногруппа, моно- или диарилкарбониламиногруппа, алкилсульфиниламиногруппа, алкилсульфониламиногруппа, арилсульфиниламиногруппа,арилсульфониламиногруппа, карбамоильная группа, моно- или диалкилкарбамоильная группа, моно- или диарилкарбамоильная группа, алкилсульфинильная группа, алкенилсульфинильная группа, алкинилсульфинильная группа, циклоалкилсульфинильная группа, циклоалкенилсульфинильная группа, циклоалкинилсульфинильная группа, арилсульфинильная группа, гетероциклилсульфинильная группа, алкилсульфонильная группа, алкенилсульфонильная группа, алкинилсульфонильная группа, циклоалкилсульфонильная группа, циклоалкенилсульфонильная группа, циклоалкинилсульфонильная группа, арилсульфонильная группа и гетероциклилсульфонильная группа. Каждая из перечисленных выше групп может быть необязательно замещена указанными заместителями. Также термины "галогеналкильная группа", "галоген-низшая алкильная группа", "галогеналкоксигруппа", "галоген-низшая алкоксигруппа", "галогенфенильная группа" или "галогенгетероциклильная группа" означают алкильную группу, низшую алкильную группу, алкоксигруппу, низшую алкоксигруппу, фенильную группу или гетероциклильную группу (далее называемые "алкильной и прочими группами"), замещенную одним и более заместителями - атомами галогена соответственно. Предпочтительными являются алкильная и прочие группы, замещенные от 1 до 7 атомами галогена,более предпочтительными алкильная и прочие группы, замещенные от 1 до 5 атомами галогена. Аналогично, термины гидроксиалкильная группа, гидрокси-низшая алкильная группа, гидроксиалкоксигруппа,гидрокси-низшая алкоксигруппа и гидроксифенильная группа означают алкильную и прочие группы,замещенные одной или более гидроксигруппами. Предпочтительными являются алкильная и прочие группы, замещенные от 1 до 4 гидроксигруппами, более предпочтительными алкильная и прочие группы,замещенные от 1 до 2 гидроксигруппами. Также термины "алкоксиалкильная группа", "низшая алкоксиалкильная группа", "алкокси-низшая алкильная группа", "низшая алкокси-низшая алкильная группа","алкоксиалкоксигруппа", "низшая алкоксиалкоксигруппа", "алкокси-низшая алкоксигруппа", "низшая алкокси-низшая алкоксигруппа", "алкоксифенильная группа" и "низшая алкоксифенильная группа" означают алкильную и прочие группы, замещенные одной и более алкоксигруппами. Предпочтительными являются алкильная и прочие группы, замещенные от 1 до 4 алкоксигруппами, более предпочтительными алкильная и прочие группы, замещенные от 1 до 2 алкоксигруппами. Термины "арилалкил" и "арилалкокси", используемые отдельно или в составе другой группы, означают описанную выше алкильную или алкоксигруппу, замещенную арильной группой. Термин "низший", используемый в определениях формул в настоящем описании, означает линейную или разветвленную углеродную цепь, содержащую от 1 до 6 атомов углерода, если не указано иное. Более предпочтительно данный термин означает линейную или разветвленную углеродную цепь, содержащую от 1 до 4 атомов углерода. Термин "композиция" относится к любому продукту, содержащему указанные компоненты в указанных количествах, а также к любым продуктам, которые могут быть получены прямо или косвенно из комбинаций указанных компонентов в указанных количествах. Термин "пролекарство" означает эфир или карбонат, образующийся при реакции одной или более гидроксильных групп соединения формулы (I) с ацилирующим агентом, замещенным алкилом, алкокси или арилом, в ходе традиционного способа получения ацетата, пивалата, метилкарбоната, бензоата и др. Также к пролекарствам относятся эфир или амид, аналогично образующийся при реакции одной или более гидроксигрупп соединения формулы (I) с -аминокислотой или -аминокислотой и т.д. по традиционному способу с использованием конденсирующего агента. Кроме того, пролекарство включает в себя также эфир, который аналогичным образом получают реакцией одной или более гидроксигрупп соединения формулы (I) с конденсирующим агентом, используя традиционный способ. Термин "фармацевтически приемлемый" включает молекулярные элементы и композиции, степень чистоты и качество которых позволяют использовать их в составе композиции или лекарственного препарата, составляющего предмет настоящего изобретения. Так как объемом настоящего изобретения предусмотрено применение препарата как при лечении человека (клиническом и безрецептурном), так и в ветеринарии, разработка композиции или лекарственного средства предусматривает возможность его применения как при лечении человека, так и в ветеринарии. Термин "фармацевтически приемлемая соль" относится, например, к соли щелочного металла, такого как литий, натрий, калий и т.д.; соли щелочно-земельного металла, например кальция, магния и т.д.; соли цинка или алюминия; соли с органическим основанием, например аммония, холина, диэтаноламина,лизина, этилендиамина, трет-бутиламина, трет-октиламина, трис-(гидроксиметил)аминометана, Nметилглюкозамина, триэтаноламина и дегидроабиэтиламина; соли с неорганической кислотой, например хлористо-водородной, бромисто-водородной, йодисто-водородной, серной, азотной, фосфорной и т.д.; или соли с органической кислотой, например муравьиной, уксусной, пропионовой, щавелевой, малоновой, янтарной, фумаровой, малеиновой, молочной, яблочной, винной, лимонной, метансульфоновой,этансульфоновой, бензолсульфоновой и т.д.; или соли с кислой аминокислотой, например аспарагиновой, глутаминовой и т.д. Соединение формулы (I), составляющее предмет настоящего изобретения, также включает в себя смесь стереоизомеров или каждый чистый или по существу чистый изомер. Например, настоящее соединение может необязательно иметь один или более асимметричных центров на атоме углерода, содержащих любой из заместителей. Следовательно, соединение формулы (I) может существовать в форме энантиомера, диастереоизомера или их смеси. Если настоящее соединение формулы (I) содержит двойную связь, то настоящее соединение может существовать в форме геометрической изомерии (цис-соединение,транс-соединение), а если настоящее соединение формулы (I) содержит ненасыщенную связь, например карбонильную, то настоящее соединение может существовать в форме таутомера; и настоящее соединение также включает в себя данные изомеры или их смесь. В процессе получения настоящего соединения можно использовать исходное соединение в форме рацемической смеси, энантиомера или диастереоизомера. Если настоящее соединение получено в форме диастереоизомера или энантиомера, их можно разделить традиционным способом, например хроматографией или дробной кристаллизацией. Кроме того, настоящее соединение формулы (I) включает в себя его внутримолекулярную соль,гидрат, сольват или полиморфный вариант. Для большей краткости описания некоторые из используемых в настоящем изобретении количественных выражений не сопровождаются модификатором "приблизительно". При этом подразумевается,что вне зависимости от того, используется ли явно термин "приблизительно" или нет, каждое приводимое в настоящем изобретении количество подразумевает действительное численное значение, а также подразумевает разумное приближение к таковому численному значению, основанное на имеющихся у специалиста знаниях, включая приближение, основанное на экспериментальных условиях и/или измерениях, имеющих отношение к таковому численному значению. Для большей краткости описания ряд приводимых в настоящем изобретении количественных выражений дается в виде диапазона от приблизительно количества X до приблизительно количества Y. Подразумевается, что при указании диапазона значений диапазон не ограничивается указанными верхней и нижней границами, но включает в себя полный диапазон от приблизительно количества X до приблизительно количества Y, или любое входящее в этот диапазон количество или меньший диапазон. В) Соединения. Соединения формулы (I) проявляют отличную ингибирующую активность в отношении натрийзависимого переносчика глюкозы и значительный эффект снижения уровня глюкозы. Таким образом, композиция, составляющая предмет настоящего изобретения, пригодна для лечения, замедления развития или отсрочивания начала проявления расстройства, связанного с натрийзависимым переносчиком глюкозы. В частности, композиция, составляющая предмет настоящего изобретения, применима для лечения,замедления развития или отсрочивания сахарного диабета, диабетической ретинопатии, диабетической нейропатии, диабетической нефропатии, медленного заживления раны, резистентности к инсулину, гипергликемии, гиперинсулинемии, повышенного уровня жирных кислот в крови, повышенного уровня глицерина в крови, гиперлипидемии, ожирения, гипертриглицеридемии, метаболического синдрома X,диабетических осложнений, атеросклероза или артериальной гипертензии. В частности, композиция,составляющая предмет настоящего изобретения, применима для лечения и профилактики сахарного диабета (сахарный диабет 1 и 2 типов и т.д.), диабетических осложнений (например, диабетической ретинопатии, диабетической нейропатии, диабетической нефропатии) или ожирения, или может применяться для лечения гипергликемии, возникающей после приема пищи. В некоторых предпочтительных вариантах осуществления R1, как показано в формуле (I), представляет собой атом галогена или низшую алкильную группу; а R2, как показано в формуле (I), - фенил, необязательно замещенный заместителями в количестве от 1 до 3, выбранными из группы, состоящей из атома галогена, цианогруппы, низшей алкильной группы, галоген-низшей алкильной группы, низшей алкоксигруппы, галоген-низшей алкоксигруппы, метилендиоксигруппы, этиленоксигруппы, моно- или ди-низшей алкиламиногруппы, карбамоильной группы и моно- или ди-низшей алкилкарбамоильной группы. Предпочтительно лекарственные соединения формулы (I), использованные в раскрытой композиции, обычно в своей кристаллической или аморфной форме обладают слабой или низкой растворимостью в воде и, следовательно, низкой биодоступностью, однако настоящее изобретение не ограничивается нерастворимыми или малорастворимыми в воде соединениями. Предпочтительные типичные соединения, используемые в композициях, составляющих предмет настоящего изобретения, включают в себя 1-(-D-глюкопиранозил)-4-метил-3-([5-(4-фторфенил)-2 тиенилметил]бензол) или его пролекарство или фармацевтически приемлемую соль. В некоторых дополнительных предпочтительных вариантах осуществления соединением для использования в композициях,составляющих предмет настоящего изобретения, является полугидрат 1-(-D-глюкопиранозил)-4-метил 3-([5-(4-фторфенил)-2-тиенилметил]бензола). Предпочтительно 1-(-D-глюкопиранозил)-4-метил-3-([5-(4-фторфенил)-2-тиенилметил]бензол) или его пролекарство или фармацевтически приемлемую соль включают в композицию, составляющую предмет настоящего изобретения, в количестве от приблизительно 25 до приблизительно 600 мг, предпочтительно от приблизительно 50 до приблизительно 400 мг. В некоторых дополнительных предпочтительных вариантах осуществления 1-(-Dглюкопиранозил)-4-метил-3-([5-(4-фторфенил)-2-тиенилметил]бензол), или его пролекарство, или фармацевтически приемлемую соль включают в композицию, составляющую предмет настоящего изобретения, в количестве приблизительно 25, приблизительно 50, приблизительно 75, приблизительно 100, приблизительно 150, приблизительно 200, приблизительно 250, приблизительно 300, приблизительно 350 или приблизительно 400 мг. В некоторых дополнительных предпочтительных вариантах осуществления 1-(-D-глюкопиранозил)-4-метил-3-([5-(4-фторфенил)-2-тиенилметил]бензол), или его пролекарство, или фармацевтически приемлемую соль включают в композицию, составляющую предмет настоящего изобретения, в количестве приблизительно 100 или приблизительно 300 мг. В некоторых вариантах осуществления, где 1-(-D-глюкопиранозил)-4-метил-3-([5-(4-фторфенил)-2-тиенилметил]бензол) представлен в форме полугидрата,полугидрат 1-(-D-глюкопиранозил)-4-метил-3-([5-(4-фторфенил)-2 тиенилметил]бензола) предпочтительно включают в композицию в количестве приблизительно 25,5,приблизительно 51, приблизительно 102, приблизительно 204 или приблизительно 306 мг, предпочтительно в количестве приблизительно 102 или приблизительно 306 мг. С) Композиция. В вариантах осуществления настоящего изобретения соединение включено в состав пероральных дозированных форм, допустимых для назначения нуждающимся в них пациентам. Пероральная дозированная форма может быть представлена в виде любой фармацевтически приемлемой твердой дозированной формы. Предпочтительно твердая дозированная форма включает в себя,например, такие твердые лекарственные формы, как таблетки, драже, гранулы, капсулы, порошки и прочие. Более предпочтительно твердая дозированная форма представляет собой пероральную таблетку или капсулу. Наиболее предпочтительной твердой дозированной формой является пероральная таблетка. В некоторых вариантах осуществления настоящего изобретения композиция включает в себя наполнитель или разбавитель в количестве от приблизительно 10 до приблизительно 95% от веса композиции, предпочтительно от приблизительно 25 до приблизительно 90% от веса композиции, более предпочтительно от приблизительно 30 до приблизительно 50% от веса композиции или от приблизительно 35 до приблизительно 45% от веса композиции. В некоторых вариантах осуществления настоящего изобретения композиция включает в себя разрыхлитель в количестве от приблизительно 0,1 до приблизительно 20% от веса композиции, предпочтительно от приблизительно 0,25 до приблизительно 10% от веса композиции, более предпочтительно от приблизительно 3 до приблизительно 10% от веса композиции или от приблизительно 5 до приблизительно 7% от веса композиции. В некоторых вариантах осуществления настоящего изобретения композиция включает в себя связующее вещество в количестве от приблизительно 0,1 до приблизительно 20% от веса композиции, предпочтительно от приблизительно 0,1 до приблизительно 10% от веса композиции, более предпочтительно от приблизительно 0,5 до приблизительно 5% от веса композиции или от приблизительно 1 до приблизительно 4% от веса композиции. В некоторых вариантах осуществления настоящего изобретения композиция включает в себя смазывающее вещество в количестве от приблизительно 0,1 до приблизительно 5% от веса композиции,предпочтительно от приблизительно 0,1 до приблизительно 2% от веса композиции, более предпочтительно от приблизительно 0,5 до 2% от веса композиции или от 0,5 до 1,5% от веса композиции. В некоторых вариантах осуществления настоящего изобретения композиция необязательно включает в себя поверхностно-активное вещество в количестве от приблизительно 0 до приблизительно 10% от веса композиции, предпочтительно от приблизительно 0 до приблизительно 5% от веса композиции. Твердые дозированные формы могут содержать соединение в комбинации с различными фармацевтически приемлемыми эксципиентами; предпочтительно состав дозированной формы подобран таким образом, чтобы обеспечить повышенную биодоступность соединения для получения необходимого клинического эффекта при пероральном введении пациенту. Вещество, улучшающее биодоступность, в соответствии с настоящим изобретением включает в себя любую комбинацию эксципиентов, описанных в настоящем документе, при использовании которой композиция обеспечивает повышенную биодоступность входящего в нее соединения. В некоторых предпочтительных вариантах осуществления вещество, улучшающее биодоступность, включает в себя два или более эксципиента, описанных в настоящем документе. Фармацевтически приемлемые эксципиенты известны специалистам в данной области и могут быть выбраны в соответствии с необходимыми функциональными и технологическими характеристиками. Эксципиенты в пероральной дозированной форме играют роль, без ограничения, наполнителей, связующих веществ, разрыхлителей, веществ, регулирующих высвобождение, скользящих веществ, смазывающих веществ, покрытий и т.п. Например, в одном варианте осуществления настоящего изобретения необходимо, чтобы дозированная форма имела профиль немедленного высвобождения. Для получения такого профиля высвобождения из твердой дозированной формы дозированная форма предпочтительно содержит разрыхлитель в количестве, указанном в настоящем документе. В другом варианте осуществления настоящего изобретения требуется композиция соединения с контролируемым или замедленным высвобождением. Такая композиция может быть получена изменением количеств, концентраций и соотношений определенных полимеров, обеспечивающих контролируемое высвобождение. В одном варианте осуществления композиция, составляющая предмет настоящего изобретения,включает в себя соединение в количестве от приблизительно 1 до приблизительно 80%, предпочтительно от приблизительно 5 до приблизительно 60% от веса композиции, более предпочтительно от приблизительно 40 до приблизительно 60% от веса композиции или от приблизительно 45 до приблизительно 55% от веса композиции. В зависимости от желаемой дозы соединения могут быть назначены одна или более дозированных форм. Например, в одном предпочтительном варианте осуществления настоящего изобретения композиция для перорального приема представлена в виде таблетки, содержащей приблизительно 100 мг 1-(-Dглюкопиранозил)-4-метил-3-([5-(4-фторфенил)-2-тиенилметил]бензола), микрокристаллическую целлюлозу, гидроксипропилцеллюлозу, кроскармеллозу натрия, безводную лактозу и стеарат магния. В другом предпочтительном варианте осуществления настоящего изобретения композиция для перорального приема представлена в виде таблетки, содержащей приблизительно 300 мг 1-(-Dглюкопиранозил)-4-метил-3-([5-(4-фторфенил)-2-тиенилметил]бензола), микрокристаллическую целлюлозу, гидроксипропилцеллюлозу, кроскармеллозу натрия, безводную лактозу и стеарат магния. В другом предпочтительном варианте осуществления настоящего изобретения композиция для перорального приема представлена в виде таблетки, содержащей приблизительно 102 мг полугидрата 1-(D-глюкопиранозил)-4-метил-3-([5-(4-фторфенил)-2-тиенилметил]бензола), микрокристаллическую целлюлозу, гидроксипропилцеллюлозу, кроскармеллозу натрия, безводную лактозу и стеарат магния. В другом предпочтительном варианте осуществления настоящего изобретения композиция для перорального приема представлена в виде таблетки, содержащей приблизительно 306 мг полугидрата 1-(D-глюкопиранозил)-4-метил-3-([5-(4-фторфенил)-2-тиенилметил]бензола), микрокристаллическую целлюлозу, гидроксипропилцеллюлозу, кроскармеллозу натрия, безводную лактозу и стеарат магния. Наполнители или разбавители, пригодные для использования в композициях, составляющих предмет настоящего изобретения, включают в себя наполнители или разбавители, обычно используемые в фармацевтических композициях. Примеры наполнителей или разбавителей для использования в соответствии с настоящим изобретением включают в себя, без ограничения, сахара, такие как лактоза, декстроза,глюкоза, сахароза, целлюлоза, крахмалы и производные углеводородов, полисахариды (в том числе декстраты и мальтодекстрин), полиолы (в том числе маннит, ксилит и сорбит), циклодекстрины, карбонаты кальция, карбонаты магния, микрокристаллическую целлюлозу, их комбинации и т.п. В некоторых предпочтительных вариантах осуществления наполнитель или разбавитель представлен лактозой, микрокристаллической целлюлозой или их комбинацией. Для использования в композициях, описанных в настоящем документе, пригодны несколько типов микрокристаллической целлюлозы, например микрокристаллическая целлюлоза, выбранная из группы, состоящей из Avicel типов РН 101, РН 102, РН 103, РН 105,РН 112, РН 113, РН 200, РН 301, и другие типы микрокристаллической целлюлозы, такие как силикатированная микрокристаллическая целлюлоза. Для использования в композициях, описанных в настоящем документе, пригодны несколько типов лактозы, например лактоза, выбранная из группы, состоящей из безводной лактозы, моногидрата лактозы, лактозы Fast Flo, безводной лактозы для прямого прессования,а также модифицированного моногидрата лактозы. В одном варианте осуществления настоящего изобретения наполнитель или разбавитель является комбинацией микрокристаллической целлюлозы и лактозы. Связующие вещества, пригодные для использования в композициях, составляющих предмет настоящего изобретения, включают в себя связующие вещества, обычно использующиеся в фармацевтических композициях. Примеры связующих веществ для использования в соответствии с настоящим изобретением включают в себя, без ограничения, производные целлюлозы (в том числе гидроксипропилцеллюлозу, гидроксипропилметилцеллюлозу, метилцеллюлозу и натрий-карбоксиметилцеллюлозу), гликоль,сахарозу, декстрозу, кукурузный сироп, полисахариды (в том числе гуммиарабик, трагакантовую камедь,гуаровую камедь, альгинаты и крахмал), кукурузный крахмал, прежелатинизированный крахмал, модифицированный кукурузный крахмал, желатин, поливинилпирролидон, полиэтилен, полиэтиленгликоль,их комбинации и т.п. Предпочтительным связующим веществом, при наличии, является гидроксипропилцеллюлоза. Разрыхлители, пригодные для использования в композициях, составляющих предмет настоящего изобретения, включают в себя разрыхлители, обычно используемые в фармацевтических композициях. Примеры разрыхлителей для использования в соответствии с настоящим изобретением включают в себя,без ограничения, крахмалы, глины, целлюлозы, альгинаты, а также камеди и сшитые крахмалы, целлюлозы и полимеры, их комбинации и т.п. Типичными разрыхлителями являются микрокристаллическая целлюлоза, кроскармеллоза натрия, альгиновая кислота, альгинат натрия, кросповидон, целлюлоза, агар и родственные ему камеди, крахмалгликолят натрия, кукурузный крахмал, картофельный крахмал, крахмалгликолят натрия, Veegum HV, метилцеллюлоза, агар, бентонит, карбоксиметилцеллюлоза, альгиновая кислота, гуаровая камедь, их комбинации и т.п. Предпочтительным разрыхлителем, при наличии, является сшитая целлюлоза, более предпочтительно сшитая натрий-карбоксиметилцеллюлоза или кроскармеллоза натрия. Смазывающие вещества, пригодные для использования в композициях, составляющих предмет настоящего изобретения, включают в себя смазывающие вещества, обычно используемые в фармацевтических композициях. Примеры смазывающих веществ для использования в соответствии с настоящим изобретением включают в себя, без ограничения, карбонат магния, лаурилсульфат магния, силикат кальция,тальк, высокодисперсный диоксид кремния, их комбинации и т.п. Другие пригодные смазывающие вещества включают в себя, без ограничения, стеарат магния, стеарат кальция, стеариновую кислоту, стеарилфумарат натрия, полиэтиленгликоль, лаурилсульфат натрия, лаурилсульфат магния, бензоат натрия,коллоидный диоксид кремния, оксид магния, микрокристаллическую целлюлозу, крахмалы, минеральное масло, воски, бегенат глицерина, полиэтиленгликоль, ацетат натрия, хлорид натрия, их комбинации и т.п. Предпочтительным смазывающим веществом, при наличии, является стеарат магния или стеариновая кислота, более предпочтительно стеарат магния. Поверхностно-активные вещества, пригодные для использования в композициях, составляющих предмет настоящего изобретения, включают в себя поверхностно-активные вещества, обычно используемые в фармацевтических композициях. К примерам ПАВ, которые можно использовать в соответствии с настоящим изобретением, относятся, помимо прочего, ионные и неионные ПАВ или смачивающие вещества, часто применяемые при изготовлении фармацевтических препаратов, такие как этоксилированное касторовое масло, полигликолизированные глицериды, ацетилированные моноглицериды, эфиры жирных кислот и сорбита, полоксамеры, полиоксиэтиленовые эфиры сорбита и жирных кислот, производные полиоксиэтилена, моноглицериды или их этоксилированные производные, диглицериды или их полиоксиэтиленовые производные, докузат натрия, лаурилсульфат натрия, холевая кислота или ее производные, лецитины, фосфолипиды, их комбинации и т.п. Другие полимеры, обычно используемые в качестве эксципиентов, включают в себя, без ограничения, метилцеллюлозу (МЦ), этилцеллюлозу (ЭЦ), гидроксиэтилцеллюлозу (ГЭЦ), метилгидроксиэтилцеллюлозу (МГЭЦ), гидроксипропилцеллюлозу (ГПЦ), гидроксипропилметилцеллюлозу (ГПМЦ), натрий-карбоксиметилцеллюлозу (Na-КМЦ) и т.п. Указанные полимеры, как по отдельности, так и в различных комбинациях, могут быть включены в композиции с различными целями, в том числе, без ограничения, для контролируемого высвобождения соединения композиций, составляющих предмет настоящего изобретения. В любом случае, пригодные эксципиенты должны быть выбраны таким образом, чтобы они были совместимы с другими эксципиентами и не связывались с лекарственным соединением, а также не спо- 11022365 собствовали распаду лекарственного средства. Фармацевтические композиции, раскрытые в настоящем документе, могут дополнительно содержать антиоксиданты и хелатирующие вещества. Например, фармацевтические композиции могут содержать бутилированный гидроксианизол (БГА), бутилированный гидрокситолуол (БГТ), пропилгаллат(ПГ), метабисульфит натрия, аскорбилпальмитат, метабисульфит калия, двунатриевую ЭДТА (этилендиаминтетрауксусную кислоту, известную также как эдетат динатрия), ЭДТА, винную кислоту, лимонную кислоту, моногидрат лимонной кислоты и сульфит натрия. В другом варианте осуществления таблетка или капсула, составляющие предмет настоящего изобретения, имеют защитный внешний слой. Защитный внешний слой таблетки или капсулы, в случае наличия, может включать в себя от приблизительно 10 до приблизительно 95% полимера от веса покрывающего слоя и может быть получен с помощью общепринятых методик. В одном варианте осуществления внешний слой таблетки или капсулы включает в себя от приблизительно 20 до приблизительно 90% полимера от веса покрывающего слоя. Композиция может содержать по меньшей мере один полимер покрывающего слоя и растворитель покрытия, например воду, которую используют в процессе изготовления и удаляют высушиванием. Примеры пригодных для покрывающего слоя полимеров включают в себя, без ограничения, гидроксипропилметилцеллюлозу, поливиниловый спирт (ПВС), этилцеллюлозу,метакриловые полимеры, гидроксипропилцеллюлозу и крахмал. В одном варианте осуществления полимером покрывающего слоя является ПВС. В другом варианте осуществления полимером покрывающего слоя является гидроксипропилцеллюлоза. Покрытие может также необязательно включать в себя пластификатор от приблизительно 0 до приблизительно 30% от веса покрывающего слоя. В одном варианте осуществления пластификатор присутствует в количестве от приблизительно 15 до приблизительно 25% от веса покрывающего слоя. Примеры допустимых пластификаторов включают в себя, без ограничения, триацетин, диэтилфталат, трибутилсебацинат, полиэтиленгликоль (ПЭГ), глицерин, триацетин и триэтилцитрат. В другом варианте осуществления покрытие может также необязательно включать в себя антиадгезив или скользящее вещество, например тальк, высокодисперсный диоксид кремния или стеарат магния. В другом варианте осуществления покрытие может также необязательно включать в себя замутняющее вещество, например диоксид титана. В следующем варианте осуществления, где композиция представлена в виде таблетки, таблетка может быть покрыта дополнительным слоем, улучшающим внешний вид дозированной формы. В некоторых вариантах осуществления такое покрытие защищает таблетки. В некоторых вариантах осуществления такое покрытие содержит гидроксипропилметилцеллюлозу, полиэтиленгликоль, полидекстрозу,диоксид титана и триацетин. В некоторых других вариантах осуществления такое покрытие содержит гидроксипропилметилцеллюлозу 2910, полиэтиленгликоль 400, полидекстрозу, диоксид титана, карнаубский воск и оксид железа желтый. По меньшей мере в одном варианте осуществления такой покрывающий слой содержит Opadry II (белый) в количестве от приблизительно 0 до приблизительно 10% от веса таблетки; в некоторых других вариантах осуществления в количестве от приблизительно 0 до приблизительно 6% от веса таблетки; в других вариантах осуществления в количестве от приблизительно 0 до приблизительно 3% от веса таблетки и в других вариантах осуществления от приблизительно 2 до приблизительно 4% от веса таблетки.D) Дополнительные терапевтические агенты. В другом варианте осуществления для достижения желаемого терапевтического эффекта композиции, составляющие предмет настоящего изобретения, дополнительно включают в себя один или более дополнительных терапевтических агентов. Другой терапевтический агент (агенты), допустимый для включения в композиции, составляющие предмет настоящего изобретения, включает в себя, без ограничения, известные терапевтические агенты,используемые при лечении вышеупомянутых расстройств, связанных с активностью НЗПГ 2: вещества с антидиабетической активностью; вещества с антигипергликемическими свойствами; гиполипидемические агенты, или вещества, снижающие уровень липидов; вещества для лечения ожирения; вещества с антигипертензивной активностью и вещества, подавляющие аппетит. Настоящее изобретение дополнительно предлагает способ лечения, замедления развития или отсрочивания начала заболеваний или нарушений, связанных с активностью НЗПГ 2, содержащий введение млекопитающим, нуждающимся в таком лечении, терапевтически эффективного количества фармацевтической композиции, составляющей предмет настоящего изобретения, с одним или более веществом из следующих: вещество (вещества) с антидиабетической активностью, вещество (вещества) с антигипергликемическими свойствами; гиполипидемический агент (агенты), или вещество (вещества), снижающее уровень липидов; вещество (вещества) для лечения ожирения; вещество (вещества) с антигипертензивной активностью и вещество (вещества), подавляющее аппетит. В одном варианте осуществления настоящее изобретение предлагает способ лечения диабета II типа, содержащий введение млекопитающему, нуждающемуся в таком лечении, терапевтически эффективного количества фармацевтической композиции, составляющей предмет настоящего изобретения, с одним или более веществом с антидиабетической активностью. В другом варианте осуществления настоя- 12022365 щее изобретение предлагает способ замедления развития или отсрочивания начала диабета II типа, содержащий введение млекопитающему, нуждающемуся в таком лечении, терапевтически эффективного количества фармацевтической композиции, составляющей предмет настоящего изобретения, с одним или более веществом с антидиабетической активностью. В другом варианте осуществления настоящее изобретение предлагает способ лечения, замедления развития или отсрочивания начала диабета II типа, содержащий введение млекопитающему, нуждающемуся в таком лечении, терапевтически эффективного количества фармацевтической композиции, составляющей предмет настоящего изобретения, с одним или более веществом из следующих: вещество (вещества) с антигипергликемическими свойствами; гиполипидемический агент (агенты), или вещество (вещества), снижающее уровень липидов; вещество (вещества) для лечения ожирения; вещество (вещества) с антигипертензивной активностью и вещество (вещества), подавляющее аппетит. Например, настоящее изобретение предлагает способ лечения, замедления развития или отсрочивания начала диабета II типа,содержащий введение млекопитающему, нуждающемуся в таком лечении, терапевтически эффективного количества фармацевтической композиции, составляющей предмет настоящего изобретения, и вещества(веществ) с антигипергликемическими свойствами. В другом варианте осуществления настоящее изобретение предлагает способ лечения, замедления развития или отсрочивания начала диабета II типа, содержащий введение млекопитающему, нуждающемуся в таком лечении, терапевтически эффективного количества фармацевтической композиции, составляющей предмет настоящего изобретения, и гиполипидемического агента (агентов). В другом варианте осуществления настоящее изобретение предлагает способ лечения, замедления развития или отсрочивания начала диабета II типа, содержащий введение млекопитающему, нуждающемуся в таком лечении, терапевтически эффективного количества фармацевтической композиции, составляющей предмет настоящего изобретения, и вещества (веществ) для лечения ожирения. В другом варианте осуществления настоящее изобретение предлагает способ лечения, замедления развития или отсрочивания начала диабета II типа, содержащий введение млекопитающему, нуждающемуся в таком лечении, терапевтически эффективного количества фармацевтической композиции,составляющей предмет настоящего изобретения, и вещества (веществ) с антигипертензивной активностью. В другом варианте осуществления настоящее изобретение предлагает способ лечения, замедления развития или отсрочивания начала диабета II типа, содержащий введение млекопитающему, нуждающемуся в таком лечении, терапевтически эффективного количества фармацевтической композиции, составляющей предмет настоящего изобретения, и вещества (веществ), подавляющего аппетит. Примеры соответствующих веществ с антидиабетической активностью для использования в комбинации с композициями, составляющими предмет настоящего изобретения, включают в себя, без ограничения, бигуаниды (например, метформин или фенформин), ингибиторы глюкозидазы (например, акарбозу или миглитол), инсулины (включая стимуляторы секреции инсулина и вещества, повышающие чувствительность рецепторов к инсулину), меглитиниды (например, репаглинид), препараты сульфонилмочевины (например, глимепирид, глибурид, гликлазид, хлорпропамид и глипизид), комбинации бигуанида с глибуридом (например, Глюкованс), тиазолидиндионы (например, троглитазон, розиглитазон и пиоглитазон), агонисты РАПП-альфа, агонисты РАПП-гамма, двойные агонисты РАПП-альфа/гамма, ингибиторы гликогенфосфорилазы, ингибиторы белков, связывающихся с жирными кислотами (аР 2), глюкагонподобный пептид-1 (ГПП-1) и другие агонисты рецепторов к ГПП-1, а также ингибиторы дипептидилпептидазы IV (ДПП-4). Другие соответствующие тиазолидиндионы включают в себя, без ограничения, МСС-555, фарглитазар, энглитазон или дарглитазон; изаглитазон, реглитазар, ривоглитазон, лираглутид и (Z)-1,4-бис-4[(3,5-диоксо-1,2,4-оксадиазолидин-2-ил-метил)]феноксибут-2-ен. Примеры агонистов РАПП-альфа, агонистов РАПП-гамма и двойных агонистов РАПП-альфа/гамма включают в себя, без ограничения, мураглитазар, пелиглитазар, тезаглитазар, AR-НО 39242, GW-501516 и IRP297. Соответствующие ингибиторы ДПП-4 включают в себя, без ограничения, ситаглиптин и саксаглиптин. Примеры соответствующих веществ с антигипергликемическими свойствами для использования в комбинации с композициями, составляющими предмет настоящего изобретения, включают в себя, без ограничения, глюкагонподобный пептид-1 (ГПП-1), такой как амид ГПП-1 (1-36), амид ГПП-1 (7-36),ГПП-1 (7-37), экзенатид, LY-315902, MK-0431, лираглутид, ZP-10 и CJC-1131. Примеры соответствующих гиполипидемических агентов или веществ, снижающих уровень липидов, для использования в комбинации с композициями, составляющими предмет настоящего изобретения, включают в себя одно или более веществ из ингибиторов микросомального белка, переносящего триглицериды (МТР), ингибиторов ГМГ-КоА-редуктазы (например, мевастатин, ловастатин, правастатин, симвастатин, флувастатин, церивастатин, аторвастатин, атавастатин, розувастатин), ингибиторов скваленсинтетазы, производных фиброевой кислоты (например, фенофибрат, гемфиброзил, клофибрат,безафибрат, ципрофибрат, клинофибрат и т.п., пробукол, секвестранты желчных кислот, такие как холестирамин, колестипол и ДЭАЭ-сефадекс, а также липостабил), ингибиторов ацил-КоА-холестеринацилтрансферазы (АСАТ), ингибиторов липоксигеназы, ингибиторов абсорбции холестерина, ингибито- 13022365 ров Na+-зависимого транспортера желчных кислот, активаторов ЛПНП-рецепторов, секвестрантов желчных кислот, белка-переносчика эфиров холестерина (например, ингибиторы СЕТР, такие как торцетрапиб и JTT-705, агонисты РАПП (как было описано выше) и/или никотиновой кислоты и ее производных. Примеры предпочтительных гиполипидемических агентов включают в себя правастатин, ловастатин,симвастатин, аторвастатин, флувастатин, церивастатин, атавастатин и розувастатин. Примеры соответствующих веществ с антигипертензивной активностью для использования в комбинации с композициями, составляющими предмет настоящего изобретения, включают в себя, без ограничения, бета-адреноблокаторы, блокаторы кальциевых каналов (L-типа и Т-типа; например дилтиазем,верапамил, нифедипин, амлодипин и мибефрадил), диуретики (например, хлортиазид, гидрохлортиазид,флуметиазид, гидрофлуметиазид, бендрофлуметиазид, метилхлортиазид, трихлорметиазид, политиазид,бензтиазид, этакриновая кислота, трикринафен, хлорталидон, фуросемид, мусолимин, буметанид, триамтерен, амилорид, спиронолактон), ингибиторы ренина, ингибиторы АПФ (например, каптоприл, зофеноприл, фозиноприл, эналаприл, цераноприл, цилазаприл, делаприл, пентоприл, хинаприл, рамиприл, лизиноприл), антагонисты AT-1-рецепторов (например, лозартан, ирбесартан, валсартан) и антагонисты ЕТ-рецепторов (например, ситаксентан и атрасентан). Примеры веществ для лечения ожирения, пригодных для использования в комбинации с композициями, составляющими предмет настоящего изобретения, включают в себя, без ограничения, агонисты бета-3-адренорецепторов, ингибиторы липазы, ингибиторы обратного захвата серотонина (и дофамина), агонисты рецепторов тиреоидных гормонов бета-типа,агонисты 5 НТ 2 С-рецепторов; антагонисты MCHR1, такие как Synaptic SNAP-7941 и Takeda T-226926,агонисты рецепторов меланокортина (MC4R), антагонисты рецепторов меланиноконцентрирующего гормона (MCHR), модуляторы галаниновых рецепторов, антагонисты орексина, агонисты рецепторов холецистокинина, антагонисты NPY1 и NPY5, модуляторы NPY2 и NPY4, агонисты фактора высвобождения кортикотропина, модуляторы гистаминовых рецепторов подтипа 3 (Н 3), ингибиторы 11-бета-HSD1, модуляторы рецепторов к адипонектину, ингибиторы обратного захвата или факторы высвобождения моноаминов, цилиарные нейротрофические факторы, BDNF (нейротрофический фактор головного мозга), лептин и модуляторы рецепторов к лептину, антагонисты каннабиоидных рецепторов 1-го типа, а также анорексигенные вещества. Примеры ингибиторов липазы, которые могут быть использованы в комбинации с композициями,составляющим предмет настоящего изобретения, включают в себя, без ограничения, орлистат и ATL-962(Alizyme). Ингибиторы обратного захвата серотонина (и дофамина) (или агонисты серотониновых рецепторов), которые можно использовать в комбинации с композициями, составляющими предмет настоящего изобретения, включают в себя, без ограничения, BVT-933, сибутрамин, топирамат и аксокин. Примеры ингибиторов обратного захвата моноаминов, которые можно использовать в комбинации с композициями, составляющими предмет настоящего изобретения, включают в себя, без ограничения,фенфлурамин, дексфенфлурамин, флувоксамин, флуоксетин, пароксетин, сертралин, хлорфентермин,клофорекс, клортермин, пицилорекс, сибутрамин, дексамфетамин, фентермин, фенилпропаноламин и мазиндол. Анорексигенные вещества, которые можно использовать в комбинации с композициями, составляющими предмет настоящего изобретения, включают в себя, без ограничения, топирамат, дексамфетамин, фентермин, фенилпропаноламин и мазиндол. Если композиции, составляющие предмет настоящего изобретения, используются в комбинации с другим терапевтическим агентом (агентами), другой терапевтический агент (агенты) может быть использован, например, в количествах, указанных в справочнике Physician's Desk Reference, или в соответствии с назначением специалиста в данной области. Если какие-либо композиции, составляющие предмет настоящего изобретения, используются в комбинации с другим терапевтическим агентом (агентами), каждое из соединений комбинации может быть введено одновременно или последовательно в любом порядке, и компоненты могут быть введены по отдельности или в виде комбинированного препарата в совместно эффективных терапевтических количествах, например в суточных дозах, как описано в настоящем документе. В одном варианте осуществления настоящего изобретения комбинированный препарат, составляющий предмет настоящего изобретения, может быть получен смешиванием сухого гранулята соединения формулы (I) или (I-S) или композиции, составляющей предмет настоящего изобретения, и сухого гранулята другого терапевтического агента (агентов) и заполнением смесью капсул необходимого размера, формы, цвета или с другими необходимыми характеристиками, или прессованием в таблетки. Е) Изготовление композиции. В определенных вариантах осуществления композиции, составляющие предмет настоящего изобретения, получают смешиванием лекарственного соединения и вещества, улучшающего биодоступность. Для этой цели наиболее эффективным способом является растворение данных компонентов в жидком растворителе с последующим удалением растворителя. Таким образом, дополнительным аспектом настоящего изобретения является способ приготовления фармацевтической композиции, содержащий растворение лекарственного соединения и фармацевтически приемлемых эксципиентов в растворителе; удаление растворителя из полученного раствора; необязательное придание полученному продукту желаемой формы; необязательное покрытие полученного продукта физиологически приемлемым покрывающим материалом. Предпочтительно дозированные формы в соответствии с описанными в настоящем документе вариантами осуществления изготавливают с помощью стандартных методик. Например, дозированная форма может быть изготовлена с использованием технологии влажного гранулирования. В соответствии с технологией влажного гранулирования лекарственное средство и носитель смешивают в водном или органическом растворителе (таком как денатурированный безводный этанол) в качестве гранулирующей жидкости. Остальные ингредиенты могут быть растворены в части гранулирующей жидкости, такой как вышеуказанный растворитель; затем эту подготовленную часть влажной смеси медленно добавляют к лекарственной смеси при постоянном перемешивании в смесителе. Гранулирующую жидкость добавляют до тех пор, пока смесь не станет влажной, после чего влажную массу продавливают через сито с заданным размером ячеек и высушивают в псевдоожиженном слое. Затем высушенные гранулы доводят до нужного размера. Далее к грануляту с лекарственным веществом добавляют стеарат магния или другое соответствующее смазывающее вещество и другие эксципиенты, затем гранулят помещают в вибрационную мельницу, и формовочная смесь находится в вибрационной мельнице 10 мин. Композицию прессуют в пласт, например, на прессе Manesty или прессе Korsch LCT. Для получения трехслойного ядра гранулы или порошки слоя с лекарственными композициями и композицию промежуточного слоя последовательно помещают в матрицу необходимого размера, прилагая к каждому из первых двух слоев промежуточное давление, после добавления последнего слоя в матрицу следует финальное прессование с получением трехслойного ядра. Промежуточное прессование обычно проходит под действием силы приблизительно 50-100 Н. Финальное прессование обычно проходит под действием силы 3500 Н или более,часто при 3500-5000 Н. Спрессованные ядра загружают в пресс для сухого нанесения покрытий, например Kilian Dry Coaterpress, и покрывают материалами покрытий, описанными в настоящем документе. Для получения готовой дозированной формы на нее может быть нанесена оболочка. В системе для нанесения оболочки композицию оболочки для внутренней или внешней стенки (в зависимости от ситуации) наносят последовательным распылением соответствующих композиций на спрессованное ядро,помещенное во вращающийся барабан. Устройство для нанесения покрытия в барабане используют вследствие его коммерческой доступности. Для покрытия спрессованного ядра оболочкой можно использовать и другие способы. После нанесения покрытия его высушивают в печи с принудительной подачей воздуха или в печи с контролируемой влажностью и температурой с целью удаления из дозированной формы растворителя (растворителей), использованных в ходе производственного процесса. Условия сушки традиционно выбирают с учетом имеющегося оборудования, условий окружающей среды,использованных растворителей, типов покрытий, толщины покрытия и т.п. Также можно применять другие способы нанесения покрытий. Например, альтернативным является воздушно-суспензионный способ. Этот способ заключается в суспендировании и вращении спрессованного ядра во время нанесения покрытия в потоке воздуха. Воздушно-суспензионный способ описан в патенте США 2799241; в J. Am. Pharm. Assoc., т. 48, с. 451-459 (1959); и там же, т. 49, с. 82-84 (1960). Покрытие может быть также нанесено на дозированную форму с помощью установки для воздушносуспензионного нанесения покрытий Wurster с использованием, например, в качестве сорастворителя в материале оболочки смеси дихлорметан-метанол. Может быть также использована установка для воздушно-суспензионного нанесения покрытий Aeromatic при использовании сорастворителя. В другом варианте осуществления лекарственное средство и другие составляющие лекарственного слоя смешивают и прессуют в твердый пласт. Размеры пласта соответствуют площади, занимаемой лекарственным слоем внутри оболочки дозированной формы; его размеры также соответствуют размерам промежуточного слоя, если таковой присутствует, для расположения слоев в непосредственном контакте друг с другом. Лекарственное средство и прочие ингредиенты могут также быть смешаны с растворителем и вымешаны в твердую или полутвердую массу традиционными способами, такими как размол в шаровой мельнице, каландрирование, размешивание или дробление на валковой дробилке, с последующим прессованием в заданную форму. Спрессованные ядра затем могут быть покрыты материалом для внутреннего покрытия и материалом для полупроницаемого покрытия, как описано в настоящем документе. Другой возможный способ производства содержит смешивание измельченных в порошок ингредиентов в аппарате для гранулирования в псевдоожиженном слое. После сухого смешивания порошковых ингредиентов в грануляторе на порошок напыляется гранулирующая жидкость, например раствор поливинилпирролидона в воде. Затем порошки с нанесенным покрытием высушивают в грануляторе. При данном процессе все присутствующие ингредиенты гранулируются при добавлении гранулирующей жидкости. После высушивания гранул к ним добавляют смазывающее вещество, например стеариновую кислоту или стеарат магния, для чего используют смеситель, например V-образный смеситель или смеситель бункерного типа. Затем гранулы прессуют и наносят на них покрытие описанными выше способами. Примеры растворителей, допустимых для получения компонентов дозированной формы, включают в себя водные или инертные органические растворители, не взаимодействующие с материалами системы. К растворителям в широком смысле относятся вещества, собранные из группы, состоящей из водных растворителей, спиртов, кетонов, сложных и простых эфиров, алифатических углеводородов, галогензамещенных растворителей, циклоалифатических соединений, ароматических соединений, гетероциклических соединений и их смесей. К типичным растворителям относятся ацетон, диацетоновый спирт, метанол, этанол, изопропиловый спирт, бутиловый спирт, метилацетат, этилацетат, изопропилацетат, нбутилацетат, метилизобутилкетон, метилпропилкетон, н-гексан, н-гептан, моноэтиловый эфир этиленгликоля, моноэтилацетат этиленгликоля, дихлорметан, дихлорэтан, дихлорпропан, нитроэтанчетыреххлористый углерод, нитропропан-тетрахлорэтан, этиловый эфир, изопропиловый эфир, циклогексан, циклооктан, бензол, толуол, лигроин, 1,4-диоксан, тетрагидрофуран, диметиловый эфир диэтиленгликоля, вода, водные растворители, содержащие неорганические соли, такие как хлорид натрия,хлорид кальция и т.п., и их смеси, например ацетон и вода, ацетон и метанол, ацетон и этиловый спирт,дихлорметан и метанол, дихлорэтан и метанол. Примеры жидких носителей настоящего изобретения включают в себя липофильные растворители(например, масла или жиры), поверхностно-активные вещества, а также гидрофильные растворители. Примеры липофильных растворителей включают в себя, без ограничения, Capmul PG-8, Caprol MPGO,Capryol 90, Plurol Oleique CC497, Capmul MCM, Labrafac PG, н-дециловый спирт, Caprol 10G10O, олеиновую кислоту, витамин Е, Maisine 35-1, Gelucire 33/01, Gelucire 44/14, лауриловый спирт, Captex 355EP,Captex 500, каприловые/каприновые триглицериды, Peceol, Caprol ET, Labrafil M2125 CS, Labrafac CC,Labrafil M20 1944 CS, Captex 8277, Myvacet 9-45, изопропилмиристат, Caprol PGE 860, оливковое масло,Plurol Oleique, арахисовое масло, Captex 300 Low С 6 и каприновую кислоту. Примеры поверхностно-активных веществ включают в себя, без ограничения, витамин Е, токоферилполиэтиленгликольсукцинат, Cremophor (EL, EL-P и RH40), Labrasol, Tween (20, 60, 80), Pluronic (L31, L-35, L-42, L-64 и L-121), Acconon S-35, Solutol HS-15 и Span (20 и 80). Примеры гидрофильных растворителей включают в себя, без ограничения, диметиловый эфир изосорбида, полиэтиленгликоль (ПЭГ 300, 400, 600, 3000, 4000, 6000 и 8000) и пропиленгликоль (ПГ). В целом, будет предпочтительным, по существу, полное удаление растворителя для получения продукта, хорошо поддающегося формованию. Формование может быть выполнено сушкой распылением(для получения продукта в форме частиц), выпариванием растворителя из раствора, распределенного по пресс-формам, литьем (например, литьем под давлением), экструзией и т.п. В целом, продукт может быть сформован горячим и затем оставлен для затвердевания при охлаждении. Продукт может быть также сформован в пленку или пластину выпариванием или заливкой нагретой массы на поддон и выпариванием растворителя.F) Примеры композиций. Следующие примеры композиций приведены исключительно в иллюстративных целях и не ограничивают объем настоящего изобретения. Таблетки были получены с использованием ингредиентов, перечисленных в табл. 1.1-1.6, с использованием следующего способа. В следующих примерах, приведенных в табл. 1.1-1.6, указанное в примере соединение, безводную лактозу, микрокристаллическую целлюлозу и кроскармеллозу натрия просеяли и поместили в псевдоожиженный слой. Гидроксипропилцеллюлозу и очищенную воду смешали для получения гранулирующего раствора. Гранулирующий раствор распыляли в псевдоожиженном слое для гранулирования сухих ингредиентов. После завершения распыления гранулирующего раствора гранулят высушивали в псевдоожиженном слое. Высушенные гранулы пропустили через соответствующую мельницу с трафаретом нужного размера. Измельченный гранулят поместили в соответствующий смеситель и добавили к нему просеянный стеарат магния. Смесь перемешивали в течение необходимого времени. Готовую смесь спрессовали в таблетки, используя соответствующий роторный таблеточный пресс. В случае нанесения пленочного покрытия (например, Opadry II) порошок для нанесения пленочного покрытия смешивали с очищенной водой для получения покрывающей суспензии. Таблетки покрыли оболочкой в соответствующем барабане для нанесения покрытий и высушили. Таблица 1.1 Состав таблетки с количеством действующего вещества 100 мг Таблица 1.2 Состав таблетки с количеством действующего вещества 25 мг Таблица 1.3 Состав таблетки с количеством действующего вещества 200 мг Таблица 1.4 Состав таблетки с количеством действующего вещества 50 мг Таблица 1.5 Состав таблетки, покрытой оболочкой, с количеством действующего вещества 300 мг Таблица 1.6 Состав таблетки, покрытой оболочкой, с количеством действующего вещества 100 мгG) Биологические примеры. Фармакокинетические данные, полученные в исследованиях in vivo на собаках. Результаты введения 1-(-D-глюкопиранозил)-4-метил-3-([5-(4-фторфенил)-2 тиенилметил]бензола) собакам сравнивали, используя различные пероральные композиции. Для исследования были отобраны одиннадцать самцов собак породы бигль весом от 8,0 до 10,0 кг на момент введения дозы с хорошим общим состоянием здоровья. Собак разделили на 3 группы в соответствии с их весом. После отсутствия кормления в течение одной ночи каждой собаке перорально ввели разовую дозу препарата в виде суспензии или таблетки. В общей сложности вводили три дозированные формы лекарственного соединения 1-(-D-глюкопиранозил)-4-метил-3-([5-(4-фторфенил)-2-тиенилметил]бензол): наносуспензию 5 мг/мл, таблетку 100 мг и таблетку 25 мг. Три собаки из группы 1 получили натощак по 20 мл наносуспензии 5 мг/мл; 4 собаки из группы 2 получили натощак таблетки по 100 мг (по 1 таблетке каждой собаке; ингредиенты перечислены в таблице 1.1); 4 собаки из группы 3 получили натощак таблетки по 25 мг (по 4 таблетки каждой собаке; ингредиенты перечислены в табл. 1.2). После каждой дозы собаки получили по 10 мл водопроводной воды, чтобы обеспечить полную доставку дозы. Через яремные вены или в другом удобном месте через 0, 0,5, 1, 2, 4, 8, 24 и 48 ч после введения начальной дозы получали образцы крови объемом приблизительно 3 мл, кровь собирали в пробирки с K2 ЭДТА, которые помещали на водный лед. Плазму отделяли центрифугированием и замораживали при -20 С. Все образцы помещали в тару из темного стекла для защиты от света и проанализировали в течение 2 ч после сбора. В образцах определяли концентрацию в плазме лекарственного соединения 1-(-Dглюкопиранозил)-4-метил-3-([5-(4-фторфенил)-2-тиенилметил]бензол), используя метод жидкостной хроматографии с тандемной масс-спектрометрией (LC-MS/MS) с нижним пределом количественного обнаружения 50 нг/мл. Плазменные концентрации были зафиксированы в электронном виде в компьютерной системе Watson LIMS. Концентрациям ниже нижнего предела обнаружения система Watson присваивает значение 0,00. Таблица 2 Наносуспензия, которую использовали в исследовании в качестве контроля, включала 0,5% суспензию Methocel, концентрацию определяли в весовых долях. Methocel представляет собой гидроксипропилметилцеллюлозу (ГПМЦ) - полимер с высокой вязкостью, который используют в качестве загустителя суспензии. Концентрация лекарственного средства составляла 5 мг на 1 мл суспензии. В группе наносуспензии каждой собаке вводили по 20 мл суспензии. С помощью валидизированной компьютерной программы WinNonlin версии 4.0.1 (Pharsight) был выполнен фармакокинетический анализ концентраций в плазме лекарственного соединения 1-(-Dглюкопиранозил)-4-метил-3-([5-(4-фторфенил)-2-тиенилметил]бензол) для определения его максимальной концентрации в плазме (Cmax), времени достижения максимальной концентрации в плазме (tmax),площади под кривой плазменной концентрации в зависимости от времени, экстраполированной до бесконечности (ППКinf и ППК 0-48 ч), конечного периода полувыведения (t1/2) и плазменного клиренса (CL/F). После однократного перорального введения 20 мл наносуспензии соединения концентрацией 5 мг/мл самцам собак породы бигль наблюдали быструю абсорбцию соединения при среднем значенииtmax, равном 1,17 ч, и его медленное выведение при среднем значении t1/2, равном 9,23 ч. При однократном пероральном введении таблетки 100 мг или четырех таблеток по 25 мг соединения наблюдали замедленную абсорбцию соединения при среднем значении tmax, равном 2,25 и 3,50 ч соответственно. Однако выведение соединения после введения таблеток обоих составов оставалось медленным при среднем значении t1/2, равном 9,13 и 9,97 ч соответственно. На основании средних плазменных параметров фармакокинетики, которые были пересчитаны на 1 мг/кг, установили, что максимальная концентрация соединения в плазме (Cmax) после перорального введения одной дозы таблетки 100 мг и четырех доз таблетки по 25 мг была выше в сравнении с наносуспензией 5 мг/мл (фиг. 1 А и В). Кроме того, биодоступность, как видно по ППКinf, после введения соединения в таблетке 100 мг или в таблетках по 25 мг была выше, чем после введения наносуспензии 5 мг/мл. Фармакокинетические данные, полученные в исследованиях in vivo на людях. Здоровые испытуемые после еды и/или натощак перорально однократно принимали жидкую наносуспензию или таблетки с тремя различными дозами лекарственного соединения 1-(-Dглюкопиранозил)-4-метил-3-([5-(4-фторфенил)-2-тиенилметил]бензол). Три разные дозы включали 25 мг(состав приведен в табл. 1.2), 200 мг (состав приведен в табл. 1.3) и 400 мг лекарственного соединения. Дозу таблетки 400 мг получали, в частности, приемом двух доз таблеток по 200 мг. Профили средней концентрации соединения в плазме после перорального приема таблеток 200 мг натощак и после еды и 40 мл жидкой наносуспензии 5 мг/мл (после еды) показаны на фиг. 2. Сходные профили были получены при сравнении с наносуспензией таблеток в дозировках 25 и 400 мг. Как видно из табл. 4, после введения доз 25 и 200 мг после еды среднее время до максимальной концентрации соединения в плазме (tmax) для таблеток составляло приблизительно от 1 до 1,5 ч против 4 ч для наносуспензии. Для дозы 400 мг среднее tmax составляло приблизительно 1,75 ч для 2 доз таблеток по 200 мг против 2,25 ч для наносуспензии. Для всех доз (25, 200, 400 мг), принятых после еды, средняя Cmax для наносуспензии была ниже в сравнении с таблетками. После приема таблеток с дозами 25 и 200 мг средняя Cmax была выше в случае приема таблеток натощак в сравнении с приемом после еды. Для всех доз (25, 200 и 400 мг), принятых как после еды, так и натощак (только для таблеток 25 и 200 мг), средние значения ППКinf соединения были сопоставимы. Полученные данные показывают, что пища не оказывает существенного влияния на степень биодоступности лекарственного соединения, но снижает скорость абсорбции, как видно из снижения Cmax и задержки tmax. Как видно из результатов приема таблеток в дозе 400 мг (2 таблетки по 200 мг), изменение времени приема пищи (прием таблеток за 30 мин до завтрака в сравнении с приемом таблеток за 10 мин до завтрака) не продемонстрировало влияния на tmax, t1/2, Cmax или ППК. Для всех схем лечения, независимо от состава композиций и времени приема пищи, среднее t1/2 лекарственного соединения варьировалось от приблизительно 8 до приблизительно 12 ч. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Фармацевтическая таблетка для перорального введения, содержащая: или его фармацевтически приемлемую соль в количестве от 40 до 60 вес.%;(b) разбавитель или наполнитель, содержащий комбинацию микрокристаллической целлюлозы и лактозы и присутствующий в количестве от 30 до 50 вес.%;(c) по меньшей мере один разрыхлитель в количестве от 3 до 10 вес.%;(d) по меньшей мере одно связующее вещество в количестве от 0,5 до 5 вес.%;(e) по меньшей мере одно смазывающее вещество в количестве от 0,5 до 2 вес.%,где вес.% приведены из расчета от веса таблетки. 2. Фармацевтическая таблетка по п.1, где соединение присутствует в количестве от 25 до 600 мг. 3. Фармацевтическая таблетка по п.1, где соединение присутствует в количестве от 50 до 300 мг. 4. Фармацевтическая таблетка по п.1, где соединение присутствует в количестве 100 мг. 5. Фармацевтическая таблетка по п.1, где соединение присутствует в количестве 300 мг. 6. Фармацевтическая таблетка по п.1, где соединение представляет собой полугидрат 1-(-Dглюкопиранозил)-4-метил-3-([5-(4-фторфенил)-2-тиенилметил]бензола).
МПК / Метки
МПК: A61K 31/7042, A61P 3/10, A61K 9/20
Метки: композиции, нзпг, производные, содержащие, ингибиторы, фармацевтические, 1-(бета-d-глюкопиранозил)-2-тиенилметилбензола
Код ссылки
<a href="https://eas.patents.su/25-22365-farmacevticheskie-kompozicii-soderzhashhie-proizvodnye-1-beta-d-glyukopiranozil-2-tienilmetilbenzola-kak-ingibitory-nzpg.html" rel="bookmark" title="База патентов Евразийского Союза">Фармацевтические композиции, содержащие производные 1-(бета-d-глюкопиранозил)-2-тиенилметилбензола как ингибиторы нзпг</a>
Предыдущий патент: Усовершенствованный способ получения вспененного пвх
Следующий патент: Способ получения вспененных пластмасс, в частности пенополимеров на основе пвх, и состав полимерной смеси для осуществления указанного способа
Случайный патент: Раствор для диализа, включающий одно или более соединений креатина и способ его получения