Производные бензимидазола и их применение для лечения вирусных инфекций
Номер патента: 1770
Опубликовано: 27.08.2001
Авторы: Чеймберлейн Стенли Доз, Козалка Джордж Уолтер, Тидвелл Джеффри Х., Ван Драанен Нэнин Агнета
Формула / Реферат
1. Соединение формулы
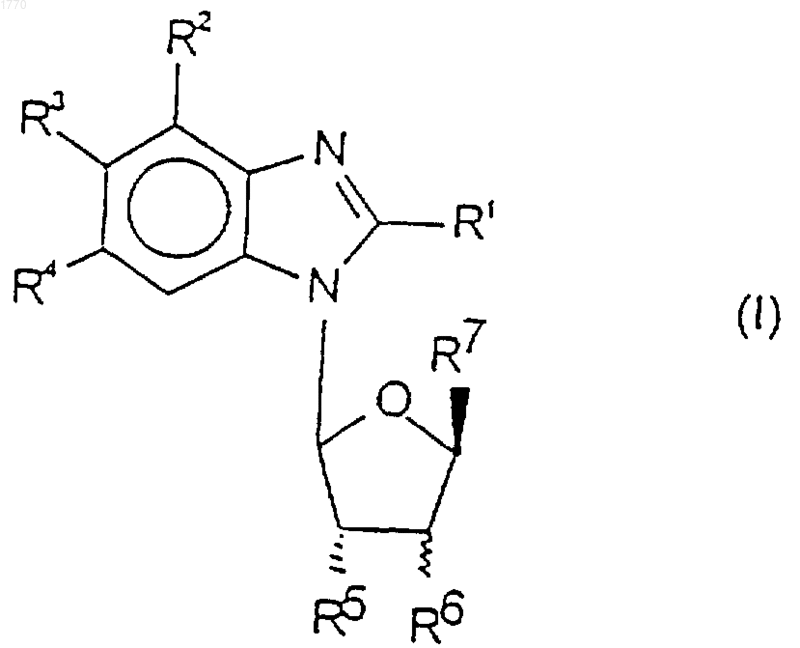
где R1 представляет собой водород, атом галогена или азидогруппу;
-NR8R9, где R8 и R9, которые могут быть одинаковыми или разными, каждый независимо выбран из водорода, гидроксила, С1-12алкила, например C1-6алкила (где алкильная группировка может быть возможно замещена одним или более чем одним заместителем, выбранным из групп: галогено, амино, азидо, гидрокси, циано, NO2, NHR10, SO2R10, SR10, OR10, COR10 и галогеноС1-6алкила, где R10 представляет собой C1-6алкил, С3-6алкенил, С2-6алкинил или арил), С2-8алкенила, C1-6алкокси, С3-7циклоалкила, С2-8алкинила, С3-7циклоалкенила, С3-7циклоалкилС1-6алкила, арила, арилС1-6алкила, гетероарила, гетероарилС1-6алкила, гетероциклила и гетероциклилС1-6алкила, либо R8R9 вместе с атомом азота, к которому они присоединены, образуют 3, 4, 5 или 6 членное гетероциклическое кольцо;
-NHNR11R12, где R11 и R12, которые могут быть одинаковыми или разными, каждый представляет собой водород или С1-6алкил;
-N=NС1-6алкил или -NHOC1-6алкил;
R2 представляет собой водород или атом галогена;
R3 и R4, которые могут быть одинаковыми или разными, каждый представляет собой водород, галоген или NO2;
R5 и R6, которые могут быть одинаковыми или разными, каждый представляет собой водород или гидрокси;
R7 представляет собой водород, СН3 или CH2R13, где R13 может быть выбран из гидрокси, атома галогена и OR14 (где R14 представляет собой водород, C1-8алкил, арил или арилС1-6алкил);
при условии, что когда R2 представляет собой водород, R3 и R4 каждый представляет собой хлор-, R5 и R6 представляют собой группу эритрогидрокси и R7 представляет собой CH2OH, тогда R1 представляет собой азидо, -NR8R9, где R8 и R9, которые могут быть одинаковыми или разными, каждый независимо выбран из гидроксила, C1-6алкила (где алкильная группировка замещена одним или более чем одним заместителем, выбранным из групп: амино, азидо, NO2, NHR10, SO2R10, SR10, OR10, галогеноС1-6алкила, где R10 такой, как определено выше), С7-12алкила (где алкильная группировка возможно замещена одним или более заместителями, выбранными из групп: галогено, амино, азидо, гидрокси, циано, NO2, NHR10, SO2R10, SR10, OR10, COR10 и галогеноС1-6алкила, где R10 такой, как определено выше), C1-6алкокси, С3-7циклоалкенила, гетероарила, гетероарилС1-6алкила или гетероциклила;
-NHNR11R12, где R11 и R12 такие, как определено выше;
-N=NC1-6aлкил или -NHOC1-6алкил;
кроме того, при условии, что когда R1, R2, R3 и R4 являются такими, как определено выше, и оба R5 и R6 представляют собой гидрокси, тогда R7 представляет собой водород, СН3 или CH2R13, где R13 может быть выбран из гидрокси и OR14 (где R14 представляет собой водород или C1-6арил);
или их фармацевтически приемлемое производное.
2. Соединение формулы (I) по п.1, в котором сахарная группировка выбрана из следующих:
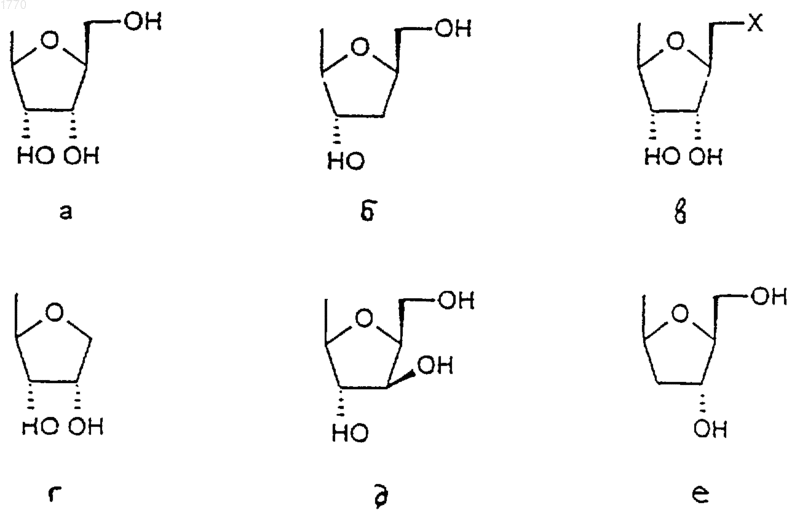
3. Соединение формулы (I) по п.1 или 2, в котором R1 представляет собой -NR8R9, где R8 и R9, которые могут быть одинаковыми или разными, выбраны из C1-6алкила или С3-7циклоалкила.
4. Соединение формулы (I) по любому из пп.1-3, в которых R2 представляет собой водород или атом галогена.
5. Соединение формулы (I) по любому из пп.1-4, в которых R3 и R4 оба представляют собой атом галогена.
6. Соединение формулы (I) по любому из пп.1-5, в которых R1 представляет собой -NR8R9, где R8 представляет собой водород и R9 представляет собой С1-6алкил, R2 представляет собой водород или атом галогена, R3 и R4 оба представляют собой атом галогена и сахарная группировка выбрана из 3'-дезокси-L-рибофуранозила, 5'-дезокси-L-рибофуранозила и 2'-дезокси-L-рибофуранозила, или его фармацевтически приемлемое производное.
7. Соединение формулы (I), выбранное из
4-бром-5,6-дихлор-2-изопроиламино-1-(бета-L-рибофуранозил)-1Н-бензимидазола;
5,6-дихлор-1-(3-дезокси-бета-L-рибофуранозил)-2-изопропиламино-1Н-бензимидазола;
5,6-дихлор-1-(5-дезокси-бета-L-рибофуранозил)-2-изопропиламино-1Н-бензимидазола;
5,6-дихлор-1-(бета-L-эритрофуранозил)-2-изопропиламино-1Н-бензимидазола;
5,6-дихлор-2-изопропиламино-1-(бета-L-ксилофуранозил)-1Н-бензимидазола;
1-(2-дезокси-бета-L-рибофуранозил)-5,6-дихлор-2-изопропиламино-1Н-бензимидазола;
2-изопропиламино-1-(бета-L-рибофуранозил)-4,5,6-трихлор-1Н-бензимидазола;
4-бром-2-циклопропиламино-5,6-дихлор-1-(бета-L-рибофуранозил)-1Н-бензимидазола;
2-циклопропиламино-1-(бета-L-рибофуранозил)-4,5,6-трихлор-1Н-бензимидазола;
4,6-дихлор-2-изопропиламино-1-(бета-L-рибофуранозил)-1Н-бензимидазола и
1-(бета-L-эритрофуранозил)-2-изопропиламино-4,5,6-трихлор-1Н-бензимидазола.
8. Фармацевтическая композиция, содержащая соединение формулы (I) по любому из пп.1-7 и его фармацевтически приемлемый эксципиент.
9. Применение соединения формулы (I) по любому из пп.1-7 в медицинской терапии.
10. Применение соединения формулы (I) по любому из пп.1-7 в производстве лекарственного средства для лечения или профилактики вирусных инфекций.
Текст
1 Настоящее изобретение относится к производным бензимидазола и их применению в медицинской терапии, в частности, для лечения или профилактики вирусных инфекций, таких как инфекции, вызываемые вирусами герпеса. Изобретение также относится к получению производных бензимидазола и фармацевтическим препаратам, их содержащих. Среди ДНК-вирусов вирусы, принадлежащие к группе герпеса, служат источниками наиболее частых вирусных заболеваний у человека. Эта группа включает в себя вирус простого герпеса, типы 1 и 2 (HSV), вирус ветряной оспы(HHV-6), и вирус герпеса человека, тип 7 (HHV7). HSV-1 и HSV-2 являются одними из наиболее распространенных инфекционных агентов у человека. Большинство этих вирусов способны к персистенции в нервных клетках хозяина; будучи инфицированными, лица попадают в группу риска повторяющихся клинических проявлений инфекции, которая может приводить как к физическим, так и физиологическим расстройствам.HSV инфекция часто характеризуется обширными и истощающими повреждениями кожи, рта и/или гениталий. Первичные инфекции могут быть бессимптомными, хотя имеют тенденцию быть более серьезными, чем инфекции у отдельных лиц, предварительно инфицированных вирусом. Глазные HSV инфекции могут привести к кератиту или катарактам, угрожающим зрению. Инфекция у новорожденного, у пациентов с ослабленным иммунитетом или инфицированной центральной нервной системой, может привести к смертельному исходу.VZV является вирусом герпеса, вызывающим ветряную оспу и опоясывающие лишаи. Ветряная оспа является первичным заболеванием, возникающим у больного без иммунитета, и у маленьких детей обычно проявляется как умеренное заболевание, характеризующееся везикулярной сыпью и лихорадкой. Опоясывающие лишаи представляют собой рецидивирующую форму заболевания, которое имеет место у взрослых, ранее инфицированных вирусомVZV. Клинические проявления опоясывающих лишаев характеризуются невралгией и везикулярной кожной сыпью, которая может быть по характеру распределения односторонней и дерматомальной. Распространение раздражения может привести к параличу или конвульсиям. В случае инфекции области оболочек мозга, может произойти кома. VZV может приводить к серьезным последствиям у пациентов, принимающих иммунносупрессорные препараты в целях трансплантации или для лечения злокачественной неоплазии и может приводить к серьезным осложнениям у больных СПИДом из-за их ослабленной иммунной системы. 2 Вместе с другими вирусами герпеса, инфекция CMV приводит к пожизненной связи вируса и хозяина. Конгенитальная инфекция в результате инфицирования матери во время беременности может вызывать клинические воздействия, такие как смерть или тяжелые заболевания плода (микроцефалия, гепатоспленомегалия, желтуха, умственная отсталость), ретиниты, приводящие к слепоте или, в менее тяжелых формах, недостатки в развитии, предрасположенность к грудным и ушным инфекциям. CMV инфекция у пациентов с ослабленным иммунитетом, например вследствие злокачественного образования, лечения иммуносупрессорными препаратами после трансплантации или инфицирования вирусом иммунодефицита человека(ВИЧ), может приводить к ретиниту, пневмонии, желудочно-кишечным расстройствам и неврологическим заболеваниям. Главным заболеванием, вызываемым EBV,является острый или хронический инфекционный мононуклеоз (гландулярная лихорадка). Примеры других EBV или EBV ассоциированных заболеваний включают в себя лимфопролиферативное заболевание, которое часто случается у людей с конгенитальным или приобретенным клеточным иммунным дефицитом, связанное с Х-хромосомой лимфопролиферативное заболевание, которое случается именно у маленьких мальчиков, EBV-ассоциированные Вклеточные опухоли, болезнь Ходжкина (Hodgkin), носоглоточную карциному, лимфому Баркитта (Burkitt), неходжкинскую клеточную лимфому, тимомы или оральную волосяную лейкоплакию. EBV инфекции также были обнаружены в ассоциации со множеством эпителиально-клеточных опухолей верхних и нижних дыхательных путей, включая легкие. Показано, что HHV-6 является агентом,вызывающим infantum subitum у детей и отторжение почек и интерстициальную пневмонию у пациентов с трансплантированной почкой и костным мозгом, соответственно, и может быть ассоциирован с другими заболеваниями, такими как рассеянный склероз. Также существует доказательство подавления количества стволовых клеток у пациентов с трансплантированным костным мозгом. HHV-7 имеет неясную этиологию заболевания. Вирус гепатита В (HBV) является вирусным патогеном, имеющим мировое значение. Этот вирус этиологически ассоциирован с первичной гепатоклеточной карциномой и считается причиной 80% случаев рака печени в мире. Клинические эффекты инфекции HBV могут проявляться в виде головной боли, лихорадки,недомогания, тошноты, рвоты, анорексии и абдоминальных болей. Репликация вируса обычно контролируется иммунным ответом с течением периода восстановления, длящимся от недель до месяцев у людей, но инфекция может быть и более тяжелой, приводящей к персистентному 3 хроническому заболеванию печени, описаному выше. В WO 92/07867 и WO 94/08456 описаны некоторые противовирусные полизамещенные нуклеозидные аналоги бензимидазола, включая-D-рибофуранозилрибозидные аналоги. В WO 93/18009 описаны некоторые противовирусные аналоги бензимидазола, в которых сахарный остаток замещен карбоциклической группой. Теперь обнаружено, что некоторые соединения бензимидазола, замещенного L-сахаром,перечисленные ниже, применимы для лечения или профилактики некоторых вирусных инфекций. В соответствии с первым аспектом настоящего изобретения предлагаются новые соединения формулы (I)R1 представляет собой водород, атом галогена или азидогруппу;-NR8R9, где R8 и R9, которые могут быть одинаковыми или разными, каждый независимо выбран из водорода, гидроксила, С 1-12 алкила,например, С 1-6 алкила (где алкильная группировка может быть возможно замещена одним или более чем одним заместителем, выбранным из групп: галогено, амино, азидо, гидрокси, циано,NO2, NHR10, SO2R10, SR10, OR10, COR10 и галогеноС 1-6 алкила, где R10 представляет собой С 1-6 алкил, С 3-6 алкенил, С 2-6 алкинил или арил), С 2-8 алкенила, С 1-6 алкокси, С 3-7 циклоалкила, C2-8 алкинила, С 3-7 циклоалкенила, С 3-7 циклоалС 1-6 алкила, арила, арилС 1-6 алкила, гетероарила, гетероарилС 1-6 алкила, гетероциклила и гетероциклилС 1-6 алкила, либо R8R9 вместе с атомом азота,к которому они присоединены, образуют 3, 4, 5 или 6 членное гетероциклическое кольцо;-NHNR11R12, где R11 и R12, которые могут быть одинаковыми или разными, каждый представляет собой водород или С 1-6 алкил;R2 представляет собой водород или атом галогена;R3 и R4, которые могут быть одинаковыми или разными, каждый представляет собой водород, галоген или NO2;R5 и R6, которые могут быть одинаковыми или разными, каждый представляет собой водород или гидрокси;CH3R13, где R13 может быть выбран из гидрокси,атома галогена и OR14 (где R14 представляет собой водород, С 1-8 алкил, арил или арилС 1-6 алкил); 4 при условии, что когда R2 представляет собой водород, R3 и R4 каждый представляет собой хлор, R5 и R6 представляют собой группу эритрогидрокси иR7 представляет собой -СН 2OН, тогда R1 представляет собой азидо, -NR8R9, где R8 и R9,которые могут быть одинаковыми или разными,каждый независимо выбран из гидроксила, C1-6 алкила (где алкильная группировка замещена одним или более чем одним заместителем, выбранным из групп: амино, азидо, NO2, NHR10,SO2R10, SR10, OR10, галогеноС 1-6 алкила, где R10 такой, как определено выше), С 7-12 алкила (где алкильная группировка возможно замещена одним или более чем одним заместителем, выбранным из групп: галогено, амино, азидо, гидрокси, циано, NО 2, NHR10, SO2R10, SR10, OR10,COR10 и галогеноС 1-6 алкила, где R10 такой, как определено выше), С 1-6 алкокси, С 3-7 циклоалкенила, гетероарила, гетероарилС 1-6 алкила или гетероциклила;CH2R13, где R13 может быть выбран из гидрокси и OR14 (где R14 представляет собой водород или С 1-6 арил); или их фармацевтически приемлемое производное. В настоящем изобретении дополнительно предлагаются соединения формулы (I), где сахарная группировка выбрана из следующих: Дополнительные примеры вышеуказанных соединений формулы (I) включают в себя примеры 1-65, как описано ниже. Здесь термин алкил как группа или часть группы, обозначает алкильную группу с прямой или разветвленной цепью. Такие алкильные группы предпочтительно имеют 1-6 атомов углерода, наиболее предпочтительно от 1 до 4 и, в частности, включают в себя метил, этил, изопропил, трет-бутил. Ссылки на алкенильные группы включают в себя группы, которые могут быть в Е- или Z-форме или их смесь, которые,когда они содержат по меньшей мере три атома углерода, могут быть разветвленными. Термин 5 галогено включает в себя хлор-, бром-, фторили йод-. Термин галогеноС 1-6 алкил обозначает алкильную группу, в которой один или более чем один атом водорода замещен галогено, и предпочтительно содержащую одну, две или три галогено-группы. Примеры таких групп включают в себя трифторметил и фторизопропил. Термин арил как группа или часть группы обозначает фенил, возможно замещенный одним или более чем одним заместителем, выбранным из C1-6 алкокси (например, метокси),нитро, атома галогена (например, хлора), амино,карбоксилата и гидрокси. Термин гетероциклил как группа или часть группы обозначает насыщенное или частично насыщенное (т.е. неароматическое) 3-, 4-, 5- или 6-членное кольцо, содержащее один или более чем один (например,1-4) гетероатом, независимо выбранный из азота, кислорода и серы. Примеры таких групп включают в себя пирролидин. Термин гетероарил обозначает 4-, 5- или 6-членное ароматическое кольцо, содержащее один или более чем один (например, от 1 до 4) гетероатом, независимо выбранный из азота, кислорода и серы,например, пиразол, пиррол, имидазол и пиридин. Настоящее изобретение включает в свой объем каждый возможный альфа и бета аномер соединений формулы (I) и их физиологически функциональные производные, по существу свободные от другого аномера, то есть не более чем примерно 5% мас./мас. другого аномера,предпочтительно не более чем примерно 2% мас./мас., в особенности менее чем 1% мас./мас., будет присутствовать, и смеси таких альфа и бета аномеров в любых пропорциях. Предпочтительны соединения формулы (I) в форме бета аномера. Предпочтительные соединения формулыR , которые могут быть одинаковыми или разными, выбраны из С 1-6 алкила или С 3-7 циклоaлкила, предпочтительно изопропила или циклопропила;(II) R2 представляет собой водород или атом галогена;(III) R3 и R4 оба представляют собой атом галогена, предпочтительно хлор;(IV) сахарная группировка представляет собой 3'-дезокси-L-рибофуранозил (формула (б) как определено выше);(V) сахарная группировка представляет собой 5'-дезокси-L-рибофуранозил (формула (в) как определено выше, где R7 представляет собой Н);(VI) сахарная группировка представляет собой 2'-дезокси-L-рибофуранозил (формула (е) как определено выше); или их фармацевтически приемлемое производное. 6 Особенно предпочтительные соединения формулы (I) включают в себя те, в которых R1 представляет собой -NR8R9, где R8 представляет собой водород, и R9 представляет собой C1-6 алкил, предпочтительно изопропил, или С 3-7 циклоaлкил, предпочтительно циклопропил;R2 представляет собой водород или атом галогена (например, бром), R3 и R4 оба представляют собой атом галогена, предпочтительно хлор, и сахарная группировка выбрана из 3'-дезокси-L-рибофуранозила; 5'-дезокси-L-рибофуранозила; 2'-дезокси-L-рибофуранозила; или их фармацевтически приемлемое производное. Предпочтительные соединения согласно изобретению включают в себя: 4-бром-5,6-дихлор-2-изопропиламино-1(бета-L-рибофуранозил)-1 Н-бензимидазол; 5,6-дихлор-1-(3-дезокси-бета-Lрибофуранозил)-2-изопропиламино-1 Нбензимидазол; 5,6-дихлор-1-(5-дезокси-бета-Lрибофуранозил)-2-изопропиламино-1 Нбензимидазол; 5,6-дихлор-1-(бета-L-эритрофуранозил)-2 изопропиламино-1 Н-бензимидазол; 5,6-дихлор-2-изопропиламино-1-(бета-Lксилофуранозил)-1 Н-бензимидазол; 1-(2-дезокси-бета-L-рибофуранозил)-5,6 дихлор-2-изопропиламино-1 Н-бензимидазол; 2-изопропиламино-1-(бета-L-рибофуранозил)-4,5,6-трихлор-1 Н-бензимидазол; 4-бром-2-циклопропиламино-5,6-дихлор-1(бета-L-рибофуранозил)-1 Н-бензимидазол; 2-циклопропиламино-1-(бета-L-рибофуранозил)-4,5,6-трихлор-1 Н-бензимидазол; 4,6-дихлор-2-изопропиламино-1-(бета-Lрибофуранозил)-1 Н-бензимидазол; 1-(бета-L-эритрофуранозил)-2-изопропиламино-4,5,6-трихлор-1 Н-бензимидазол; и их фармацевтически приемлемые производные. На вышеуказанные соединения формулы(I) и их фармацевтически приемлемые производные ссылаются как на соединения по изобретению. Термин фармацевтически приемлемое производное обозначает любую фармацевтически или фармакологически приемлемую соль,сложный эфир или соль такого сложного эфира соединения по изобретению или любое соединение, которое при введении реципиенту способно обеспечить (прямо или опосредованно) соединение согласно изобретению или противовирусный активный метаболит или его остаток. Предпочтительные сложные эфиры соединений согласно изобретению независимо выбраны из следующих групп: (1) сложные эфиры карбоновых кислот, полученные этерификацией 2'-, 3'- и/или 5'-гидроксильных групп, в которых некарбонильная составляющая карбоновой ки 7 слоты эфирной группировки выбрана из нормального или разветвленного алкила (например,н-пропила, трет-бутила или н-бутила), алкоксиалкила (например, метоксиметила), аралкила(например, бензила), арилоксиалкила (например, феноксиметила), арила (например, фенила,возможно замещенного, например, галогеном,С 1-4 алкилом или С 1-4 алкоксилом или амино); (2) сульфонатные эфиры, такие как алкил- или аралкилсульфонильные (например, метансульфонильный); (3) эфиры аминокислот (например,L-валил или L-изолейцил); (4) фосфонатные эфиры и (5) моно-, ди- или трифосфатные эфиры. Фосфатные эфиры могут быть еще этерифицированы, например, C1-20 спиртом или его реактивным производным, или 2,3-ди(С 6-24)ацилглицеролом. В таких эфирах, если не оговорено иначе,любая присутствующая алкильная группировка преимущественно содержит от 1 до 18 атомов углерода, в особенности от 1 до 6 атомов углерода, конкретнее, от 1 до 4 углеродных атома. Любая циклоалкильная группировка, присутствующая в таких эфирах, преимущественно содержит от 3 до 6 углеродных атомов. Любая арильная группировка, присутствующая в таких эфирах, преимущественно содержит фенильную группу. Предпочтительные сложные эфиры карбоновых кислот согласно настоящему изобретению включают в себя ацетат, бутират и валерат эфиры, L-валил представляет собой особенно предпочтительный эфир карбоновой кислоты. Любая ссылка на любое из вышеупомянутых соединений также включает в себя ссылку на его фармацевтически приемлемые соли. Фармацевтически приемлемые соли включают в себя соли органических карбоновых кислот, таких как аскорбиновая, уксусная, лимонная, молочная, винная, малеиновая, яблочная,изэтионовая, лактобионовая, п-аминобензойная и янтарная кислоты: органических сульфоновых кислот, таких как метансульфоновая, этансульфоновая, бензолсульфоновая и п-толуолсульфоновая кислоты: и неорганических кислот,таких как соляная, серная, фосфорная, сульфаминовая и пирофосфорная кислоты. Для терапевтического применения будут фармацевтически приемлемы соли соединений формулы (I). Однако соли кислот или оснований, которые не являются физиологически приемлемыми, могут также найти применение, например, при получении или очистке фармацевтически приемлемого соединения. Все соли, вне зависимости от того, являются ли они или нет производными фармацевтически приемлемой кислоты или основания, включены в рамки настоящего изобретения. Предпочтительные соли включают в себя соли, образованные из соляной, серной, уксусной, янтарной, лимонной и аскорбиновой кислоты. 8 Согласно еще одному аспекту данного изобретения предложена фармацевтическая композиция, содержащая соединения по изобретению, как оно определено выше, и его фармацевтически приемлемый эксципиент. В дополнительном аспекте изобретения предложено применение соединения по изобретению, как оно определено выше, в медицинской терапии. Соединения по настоящему изобретению особенно подходят для лечения или профилактики CMV инфекций и ассоциированных состояний. Примеры CMV состояний, которые можно лечить в соответствии с изобретением, обсуждались в вышеприведенном введении. В соответствии с другим аспектом настоящее изобретение предусматривает способ лечения или предупреждения симптомов или воздействий вирусной инфекции у инфицированного животного, например млекопитающего,включая человека, при котором указанное животное лечат терапевтически эффективным количеством соединения по изобретению. В соответствии с конкретным воплощением этого аспекта изобретения, вирусной инфекцией является инфекция вируса герпеса, такого как CMV,HSV-1, HSV-2, VZV, EBV, HHV-6 или HHV-7. Дополнительный аспект изобретения включает в себя способ лечения или предотвращения симптомов или воздействий HBV инфекции. В настоящем изобретении дополнительно предлагается способ лечения клинического состояния у животного, например млекопитающего, включая человека, причем клиническое состояние включает в себя те состояния, которые обсуждались в вышеприведенном введении, при котором указанное животное лечат терапевтически эффективным количеством соединения по изобретению. Настоящее изобретение также включает в себя способ лечения или профилактики вирусных инфекций. В еще одном дополнительном аспекте настоящего изобретения предлагается применение соединения согласно изобретению в производстве лекарственного средства для лечения или профилактики любых из вышеупомянутых инфекций или состояний. В дополнение к применению соединений формулы (I) при лечении или профилактике вышеупомянутых вирусных инфекций и ассоциированных состояний, данные соединения можно также применять для лечения или профилактики сердечно-сосудистых заболеваний, в частности рестеноза после ангиопластики. Вышеуказанные соединения согласно изобретению и их фармацевтически приемлемые производные можно использовать в комбинации с другими терапевтическими агентами для лечения вышеуказанных инфекций или состояний. Комбинированные терапии согласно настоящему изобретению представляют собой введение,по меньшей мере, одного соединения формулы(I) или его фармацевтически приемлемого производного и, по меньшей мере, одного другого фармацевтически активного ингредиента. Активный ингредиент(ы) и фармацевтически активные агенты могут быть введены одновременно в одинаковых или разных фармацевтических препаратах, или последовательно в любом порядке. Количества активного ингредиента(ов) и фармацевтически активного агента(ов) и относительное время введения быть выбираться для того, чтобы достигнуть желаемого комбинированного терапевтического эффекта. Предпочтительно комбинированная терапия включает в себя введение одного соединения согласно изобретению и одного из агентов, упомянутых ниже. Примеры таких дополнительных терапевтических агентов включают в себя агенты, которые эффективны для лечения вирусных инфекций или ассоциированных состояний, такие как ациклические нуклеозиды (например, ацикловир, валацикловир, фамцикловир, ганцикловир, пенцикловир) и ациклические нуклеозидные фосфонаты (например, (S)-1-(3-гидрокси-2 фосфонил-метоксипропил)цитозин (НРМС). Настоящее изобретение дополнительно включает в себя применение соединения согласно изобретению в производстве лекарственного средства для одновременного или последовательного введения, по меньшей мере, с одним другим терапевтическим агентом, таким как определено выше. Соединения согласно изобретению, на которые также ссылаются здесь как на активный ингредиент, могут быть введены при терапии любым подходящем путем, включая пероральный, ректальный, назальный, местный (в том числе чрезкожный, трансбуккальный и подъязычный), вагинальный и парентеральный (в том числе подкожный, внутримышечный, внутривенный, внутрикожный и внутривитреальный). Очевидно, что предпочтительный путь будет выбран в зависимости от состояния и возраста реципиента, природы инфекции и выбранного активного ингредиента. В общем, подходящая доза для каждого из вышеупомянутых состояний будет находиться в диапазоне от 0,01 до 250 мг на килограмм массы тела реципиента (например человека) в день,предпочтительно в диапазоне от 0,1 до 100 мг на килограмм массы тела в день и наиболее предпочтительно в диапазоне от 0,5 до 30 мг на килограмм массы тела в день, и особенно в диапазоне от 1,0 до 20 мг на килограмм массы тела в день. (Если не указано иначе, все массы активного ингредиента рассчитывают как родительское соединение формулы (I); для его солей или эфиров массы будут возрастать пропорционально). Необходимая доза может быть представлена в виде одной, двух, трех, четырех, пяти, шести или более субдоз, вводимых с соответствующими интервалами в течение дня. В некоторых 10 случаях необходимая доза может быть введена в другие дни. Эти субдозы могут быть введены в стандартных дозовых формах, например содержащих от 10 до 1000 мг или от 50 до 500 мг,предпочтительно от 20 до 500 мг и наиболее предпочтительно от 100 до 400 мг активного ингредиента на стандартную дозовую форму. В идеале активный ингредиент следует вводить так, чтобы достигать пиковых значений концентраций активного соединения в плазме от примерно 0,025 мкмоль до примерно 100 мкмоль, предпочтительно от примерно 0,1 до 70 мкмоль, наиболее предпочтительно примерно от 0,25 до 50 мкмоль. Этого можно достичь, например, внутривенной инъекцией 0,1-5%-ного раствора активного ингредиента, возможно в физиологическом растворе, или перорально в виде болюса, содержащего от примерно 0,1 до примерно 250 мг/кг активного ингредиента. Необходимые уровни в крови можно поддерживать непрерывной инфузией для обеспечения концентрации от примерно 0,01 до примерно 5,0 мг/кг/час, или периодическими инфузиями, содержащими от примерно 0,4 до примерно 15 мг/кг активного ингредиента. Несмотря на то, что возможно вводить один активный ингредиент, предпочтительно представлять его в виде фармацевтического препарата. Препараты по настоящему изобретению содержат, по меньшей мере, один активный ингредиент, как определено выше, вместе с одним или более чем одним приемлемым носителем и возможно другими терапевтическими агентами. Каждый носитель должен быть приемлемым, то есть быть совместимым с другими ингредиентами препарата, и безвредным для пациента. Препараты включают в себя те из них, которые являются подходящими для перорального, ректального, назального, местного(включая чрезкожное, буккальное и подъязычное), вагинального или парентерального (включая подкожное, внутримышечное, внутривенное, внутрикожное и внитривитреальное) введение. Препараты могут быть удобно представлены в стандартной дозовой форме или могут быть получены любыми способами, хорошо известными в области фармации. Такие способы включают в себя стадию приведения в контакт активного ингредиента с носителем, который несет один или более дополнительных ингредиентов. В общем, препараты получают путем равномерного и глубокого приведения в контакт активного ингредиента с жидкими носителями или тонко размельченными твердыми носителями или как с теми, так и с другими, и затем,при необходимости, придают продукту определенную форму. Настоящее изобретение дополнительно включает в себя фармацевтический препарат как определено выше, в котором соединение формулы (I) или его фармацевтически приемлемое производное и, по меньшей мере, один до 11 полнительный терапевтический агент присутствуют отдельно друг от друга и в виде набора,состоящего из частей. Композиции, пригодные для чрезкожного введения, могут быть представлены в виде отдельных пластырей, способных оставаться в тесном контакте с эпидермисом реципиента в течение продолжительного времени. Такие пластыри соответственно содержат активное соединение 1) в возможно забуференном водном растворе или 2) растворенное и/или диспергированное в связующем веществе или 3) диспергированное в полимере. Подходящая концентрация активного соединения составляет от примерно 1 до 25%, предпочтительно от примерно 3 до 15%. Как одна из конкретных возможностей, активное соединение может быть доставлено из пластыря посредством электротранспорта или ионтофореза, как в общих чертах описано в Pharmaceutical Research 3 (6), 318(1986). Препараты по настоящему изобретению,годные для перорального введения могут быть представлены в форме отдельных стандартных доз, таких как капсулы, крахмальные капсулы или таблетки, каждая из которых содержит заранее заданное количество активного ингредиента; в форме порошка или гранул; в форме раствора или суспензии в водной или неводной жидкости; или в форме жидкой эмульсии маслов-воде или вода-в-масле. Активный ингредиент может также быть представлен в форме болюса,электуария или пасты. Таблетка может быть изготовлена прессованием или отливкой, возможно с одним или более дополнительным ингредиентом. Прессованные таблетки можно получить прессованием в подходящем аппарате активного ингредиента в свободно-текучей форме, такой как порошок или гранулы, возможно смешанные со связывающим веществом (например, повидоном, желатином,гидроксипропилметилцеллюлозой),смазывающим веществом, инертным разбавителем, консервантом, разрыхлителем (например,крахмальным гликолятом натрия, поперечносвязанным повидоном, поперечно-связанной натрий-карбоксиметилцеллюлозой), поверхностно-активным или диспергирующим агентом. Отлитые таблетки могут быть приготовлены путем отливки в подходящем аппарате смеси порошкообразного соединения, увлажненного инертным жидким разбавителем. Таблетки возможно могут быть покрыты оболочкой или маркированы и могут быть приготовлены таким образом, чтобы обеспечивать медленное или регулируемое высвобождение активного ингредиента с использованием, например, гидроксиметилцеллюлозы в различных пропорциях для обеспечения желаемого профиля высвобождения. Таблетки могут быть возможно покрыты энтеросолюбильной оболочкой для обеспечения 12 высвобождения в отделах кишечника, а не в желудке. Препараты, подходящие для местного введения через рот, включают в себя таблетки, содержащие активный ингредиент на основе корригента, обычно сахарозы, аравийской камеди или трагаканта; пастилки, содержащие активный ингредиент на инертной основе, такой как желатин и глицерин или сахароза и аравийская камедь; и полоскания, содержащие активный ингредиент в подходящем жидком носителе. Препараты для ректального введения могут быть представлены в форме суппозитория с подходящей основой, содержащей, например,масло какао или салицилат. Препараты, подходящие для вагинального введения, могут быть представлены в форме пессариев, тампонов, кремов, гелей, паст, пенок или спреев, содержащих кроме активного ингредиента такие носители, как те которые известны из уровня техники как подходящие. Фармацевтические препараты, подходящие для ректального введения, где носителем является твердое вещество, наиболее предпочтительно представлены в форме суппозиториев стандартной дозы. Подходящие носители включают масло какао и другие традиционно используемые материалы. Суппозитории могут быть подходящим образом приготовлены путем смешивания активной комбинации с размягченным или расплавленным носителем(и) с последующим охлаждением и формованием. Препараты, подходящие для парентерального введения, включают в себя водные и неводные изотонические стерильные инъекционные растворы, которые могут содержать антиоксиданты, буферные растворы, бактериостаты и растворы препарата, которые делают препарат изотоническим с кровью предполагаемого реципиента; и водные и неводные стерильные суспензии, которые могут включать в себя суспендирующие агенты и загустители. Препараты могут быть представлены в герметичных запечатанных контейнерах, содержащих стандартную и мультидозу, например ампулах и флаконах, и могут храниться лиофилизированными в условиях, требующих только добавления стерильного жидкого носителя, например воды для инъекций, непосредственно перед использованием. Растворы и суспензии для экстемпоральных инъекций могут быть приготовлены из стерильных порошков, гранул и таблеток, подобных тем, что описаны выше. Предпочтительные препараты в стандартной лекарственной форме представляют собой такие препараты, которые содержат суточную или стандартную дозу, суточную субдозу, как перечислено выше, или ее подходящую фракцию, активного ингредиента. Следует понимать, что кроме ингредиентов, упомянутых выше, препараты по настоящему изобретению могут включать в себя дру 13 гие агенты, традиционные в данной области относительно типа рассматриваемого препарата,например препараты, пригодные для перорального введения, могут включать в себя дополнительные агенты, такие как подсластители, загустители и корригенты. В соответствии с еще одним аспектом изобретения предложен способ получения вышеуказанных соединений формулы (I) и его производных, при котором:(где L представляет собой водород либо уходящий атом или группу, a R2, R3 и R4 такие, как определено выше, Z1 и Z2 являются одинаковыми или разными и группы R5 и R6 такие, как определено в отношении формулы (I) или защищенные гидроксильные группы и Z3 представляет собой группу R7 как определено в формуле (I) или защищенную гидрокси или гидроксиметильную группу) подвергают взаимодействию с подходящим галогенирующим агентом, таким как N-бромсукцинамид, или когда L представляет собой уходящий атом или группу, например атом галогена, такой как бром, или органo (например, алкил) сульфон или органо (например, алкил или аралкил) сульфат,такие как метилсульфоновуюR4, Z1, Z2 и Z3 такие, как определено выше, с амином формулы H-NR8R9 (где R8 и R9 такие,как определено выше), гидразином формулы HNHNR11R12 (где R11 и R12 такие, как определено выше), алкилазосоединением формулы H-NNC1-6 алкил, алкоксиаминосоединением формулы НN=НОС 1-6 алкил,или подходящим замещающим агентом,таким как тетрабутиламмония азид либо азид натрия или калия;(где Z1, Z2 и Z3 такие, как определено выше, a L1 представляет собой подходящую уходящую группу или атом в альфа или бета положении,например, галогено (например, фтор-, хлор- или 14 бром-), алкил- или арилтио (например, фенилтио) или арильную или алифатическую эфирную группу, такую как бензоат или ацетат; и с этого момента, или одновременно с этим, можно осуществить одну или более чем одну следующую дальнейшую стадию в любом желаемом или необходимом порядке:(1) удаляют любую оставшуюся защитную группу(ы);(2) превращают соединение формулы (I) или его защищенную форму в другое соединение формулы (I) или его защищенную форму;(3) превращают соединение формулы (I) или его защищенную форму в фармацевтически приемлемое производное соединения формулы(I) или его защищенную форму;(4) превращают фармацевтически приемлемое производное соединения формулы (I) или его защищенную форму в соединение формулы(I) или его защищенную форму;(5) превращают фармацевтически приемлемое производное соединения формулы (I) или его защищенную форму в другое фармацевтически приемлемое производное соединения формулы (I) или его защищенную форму;(6) при необходимости, разделяют альфа и бета аномеры соединения формулы (I) или его защищенного производного или фармацевтически приемлемого производного соединения формулы (I). Способ А может быть приемлемым образом использован для получения соединения формулы (I), где R1 представляет собой галоген. Такие соединения могут быть приемлемым образом получены путем взаимодействия соединения формулы (II), где L представляет собой водород, a R2, R3, R4, Z1, Z2, Z3 такие, как определено выше, с галогенирующим агентом. Галогенирование может быть произведено традиционным способом, например бромированием с использованием бромирующего агента, такого как N-бромсукцинимид (NBS), в апротонном растворителе, таком как тетрагидрофуран (ТГФ) или предпочтительно 1,4-диоксан, нагретом до 60-150 С, предпочтительно 100 С. Соединения формулы (I), где R1 представляет собой -NR8R9 или -NHNR11R12, (где R8, R9,R10 и R11 такие, как определено выше), -N=NС 1-6 алкил или -NHOC1-6 алкил, могут быть приемлемым образом получены из соединений формулы(II), где L является атомом галогена, таким как атом брома или хлора, путем взаимодействия с подходящим амином NHR8R9, гидразиномHNHNR11R12 (где R8, R9, R10 и R11 такие, как определено выше), азоалкилом НN=NС 1-6 алкилом или алкоксиамином HNHOC1-6 алкил. Обычно взаимодействие осуществляют при повышенной температуре, например, 70-80 С, в органическом растворителе, таком как этанол или диметилсульфоксид. Соединения формулы (I), где R1 представляет собой азидогруппу, могут быть преимуще 15 ственно получены из соединений формулы (II),где L является атомом галогена, таким как бром или хлор, путем взаимодействия с подходящим замещающим агентом, таким как азид натрия или калия или азид тетрабутиламмония в апротонном растворителе, таком как ТГФ или 1,4 диоксан, при повышенной температуре, такой как 60-150 С, более предпочтительно 100 С. Соединения формулы (II), где Z1 и/или Z2 являются гидроксигруппами и/или Z3 является гидрокси или гидроксиметильной группой, могут, например, быть получены из соответствующего соединения формулы (II), где Z1 и/илиZ2 каждый является защищенной гидроксигруппой и/или Z3 является защищенной гидрокси или гидроксиметильной группой. Защитные группы могут быть использованы для Z1, Z2 иZ3. Преимущественно могут быть использованы эфирные группы, такие как те, что описаны выше относительно сложных эфиров соединений формулы (I). Эти защитные группы могут быть удалены либо с помощью обычных химических технических средств, таких как карбонат натрия в метаноле, или ферментативно, например, с применением фермента печени свиньи. Альтернативно, Z1, Z2 и Z3 могут включать в себя силильные защитные группы, такие как третбутилдифенил-, трет-бутилдиметилтриизопропропилсилильные группы, которые могут быть удалены с использованием соответствующего фторидного источника, например, HF/пиридина,н-Bu4NF или Et4NH, либо циклический ацеталь или кеталь, такой как бензилиденовые или изопропилиденовые группы, которые могут быть удалены в кислых условиях, например, с использованием толуолсульфоновой кислоты и метанола. Альтернативно, соединение формулы (II),где Z1 и/или Z2 являются защищенными гидроксигруппами и/или Z3 является защищенной гидрокси- или гидроксиметильной группой, могут взаимодействовать с агентом в условиях,при которых уходящая группа L превращается в желаемую R1 группу одновременно с удалением защитных групп. Примеры таких агентов включают в себя циклопропиламин или другие первичные или вторичные амины при условии, что эти агенты являются достаточно нуклеофильными и не являются стерически затрудненными. Соединения формулы (II), где L, R2, R3 и 4R такие, как определено выше, Z1 является защищенной гидроксигруппой, Z2 представляет собой водород и Z3 является защищенной гидроксиметильной группой, могут быть синтезированы из соответствующего соединения формулы (II), где L, R2, R3 и R4 такие, как определено выше, Z1 является гидроксигруппой, Z2 является эритрогидроксигруппой и Z3 является гидроксиметильной группой, в соответствии с методикой [Kawana et al. J. Chem. Soc., PerlanR такие, как определено выше, Z1 является водородом, Z2 является защищенной эритрогидроксигруппой и Z3 является защищенной гидроксиметильной группой, могут быть получены из соответствующего соединения, в котором С 2 представляет собой гидроксигруппу, с использованием процесса дезоксигенирования по Бартону, как описано в D.H.R. Barton, J.Cs. Jaszberenyl Tetrahedron Lett. 1989, 30, 2619-2622. С 2 гидрокси-соединение, ссылка на которое приведена выше, может быть получено из соответствующего рибозного соединения путем обработки подходящим защитным агентом или агентами, например, силилирующим агентом, таким как 1,3-дихлор-1,1,3,3-тетраизопропилдисилоксан, в присутствии растворителя, такого как пиридин, при температуре от 5 до 70 С и предпочтительно при температуре окружающей среды. Соединения формулы (I), где R1 такой, как определено выше, и соединения формулы (II),где L такой как определено выше, могут быть получены путем взаимодействия соединения формулы (V) 4(где Z1, Z2, Z3 и L1 такие, как определено выше). Взаимодействие соединений формулы (IV) и (V) можно осуществить с использованием кислоты Льюиса, такой как триметилсилилтрифлат, тетрахлорид олова или трифторид бора,первая является предпочтительной. Взаимодействие, в общем, осуществляется в апротонном растворителе при повышенной температуре,например, в ацетонитриле при 15-30 С или 1,2 дихлорэтане при 70-90 С. В вышеуказанных методиках соединение формулы (V) для улучшения растворимости преимущественно подвергают триметилсилилированию по N1-положению, например, путем обработки триметилсилилхлоридом, гексаметилдисилазаном или, наиболее предпочтительно, N,O-бис-триметилсилилацетамидом (BSA). Силилирование можно проводить в растворителе, предпочтительно в 1,2-дихлорэтане или ацетонитриле, предпочтительно при 70-80 С. После завершения реакции силилирования, может быть добавлена кислота Льюиса с последующим добавлением соединения формулы (IV). Соединения формулы (IV) могут быть получены общепринятыми способами до сочета 17 ния с основанием, или может быть получено при модификации другой сахарной группировки, уже являющейся частью нуклеозида. Например, соединения формулы (IV), где L1 такой,как определено выше, Z1 является гидрокси или защищенной гидроксигруппой, Z2 является эритрогидрокси или защищенной эритрогидроксигруппой и Z3 является гидроксиметильной или защищенной гидроксиметильной группой,могут быть получены способами, аналогичными способам, которые известны для производныхD-рибозы, или способами, легко доступными из химической литературы, например, способами,описанными Acton et al. в J. Am. Chem. Soc,1964, 86, 5352. Предпочтительным соединением формулы (IV) является соединение, где Z1, Z2 иL1 каждый представляет собой ОС(O)СН 3, a Z3 представляет собой -СН 2OС(O)СН 3. Это соединение может быть получено способом, аналогичным способу, разработанному для D-рибозы[R.D. Guthrie and S.C. Smith, Chemistry and Industry, 1968, pp 547-548], преимущественно с последующей перекристаллизацией из этанола. Соединения формулы (IV), где L1 такой,как определено выше, Z1 и Z2 являются защищенными эритрогидроксигруппами и Z3 является СН 3 или CH2R13, где R13 является атомом галогена, включая Cl, Br, F и I, могут быть синтезированы из соответствующей сахарной группировки, где Сl представляет собой подходящую эфирную группу, такую как арилокси, арилалкокси (например, бензилокси) или алкокси(например, метокси), путем обработки подходящим этерифицирующим агентом, таким как ацилирующий агент, например, ангидрид кислоты, такой как уксусный ангидрид или ангидрид бензойной кислоты, в присутствии минеральной кислоты, например, серной кислоты. Эту реакцию можно осуществить при температуре от -20 до 30 С и предпочтительно при температуре 5 С в растворителе, таком как уксусная кислота. Такие этилированные соединения могут быть синтезированы из соответствующего С 2,С 3 диола путем обработки подходящим этерифицирующим агентом, таким как ацилирующий агент, например, ангидрид кислоты, такой как уксусный ангидрид или ангидрид бензойной кислоты, в подходящем растворителе, таком как пиридин, или органическом растворителе, таком как ацетонитрил, в присутствии основания, например, триэтиламина (ТЭА), и нуклеофильного катализатора, такого как N1N-диметиламинопиридин (ДМАП). Такие диольные соединения могут быть приемлемым образом получены расщеплением соответствующего С 2, С 3 циклического эфирного соединения путем обработки слабой кислотой, такой как Dowex 50, в присутствии спирта, например, метанола. Подходящие циклические эфиры включают в себя циклические кетали, например, изопропилидин. 18 Циклические эфирные соединения, в которых Z3 представляет собой СН 3, могут быть получены путем дегалогенирования соответствующего соединения, в котором Z3 представляет собой СН 2 галогеногруппу, например, CH2Cl илиCH2F. Обычно эту реакцию осуществляют в присутствии свободнорадикального инициатора, такого как азоизобутиронитрил (AIBN), растворителя, например, толуола, и при температуре от 70 до 110 С, например 90 С. Соединение,в котором Z3 представляет собой СН 2 галогеногруппу, могут быть получены путем галогенирования соответствующей сахарной группировки, в которой Z3 представляет собой CH2OH. Галогенирование может быть проведено общепринятым способом, например, хлорированием с использованием агента, такого как трифенилфосфин (Рh3 Р), в органическом растворителе,например, ацетонитриле. Такие галогенометильные соединения могут быть получены из коммерчески доступнойL-рибозы путем обработки спиртом, например,метанолом, в минеральной кислоте, например,серной кислоте, при температуре от 0 до 50 С,приемлемо при комнатной температуре, с последующей обработкой защитным агентом, таким как 2,2-диметоксипропан, в подходящем апротонном растворителе, таком как тетрагидрофуран, или предпочтительно в самом 2,2 диметоксипропане. Реакцию можно проводить в диапазоне температур от -10 до 60 С и предпочтительно при температуре окружающей среды. Соединения формулы (IV), в которых L1 такой, как определено выше, Z1 является эритрозащищенной гидроксигруппой, Z2 являются треозащищенной гидроксигруппой и Z3 является защищенной гидроксиметильной группой,могут быть синтезированы из L-ксилозы способом, аналогичным способу, описанному Gosselin et al. [Nucleic Acid Chemistry Improved andNew Synthetic Procedures, Methods and Techniques, Part 4, Ed. L. B. Townsend, R. S. Tipson],исходя из D-ксилозы. Соединения формулы (IV), в которых L1 такой, как определено выше, Z1 является эритрозащищенной гидроксигруппой, Z2 являются треозащищенной гидроксигруппой и Z3 является защищенной гидроксиметильной группой,могут быть синтезированы из L-ксилозы способом, аналогичным способу, описанному Gosselin et al. [Nucleic Acid Chemistry Improved andNew Synthetic Procedures, Methods and Techniques, Part 4, Ed. L. B. Townsend, R. S. Tipson],исходя из D-ксилозы. Соединения формулы (IV), в которых L1 такой, как определено выше, Z1 и Z2 являются защищенными эритрогидроксигруппами и Z3 является водородом, могут быть приемлемо получены путем обработки соответствующей сахарной группировки, в которой С 1 является гидроксигруппой, а С 2 и С 3 являются эфирными группами, например, циклическими кеталями, 19 такими как изопропилидин. Такие вицинальные сахарные группировки могут быть получены способом, описанным Hudlicky et al [1990, J. Оrg. Chem., 55, 4683]. Соединения формулы (V), в которых Х представляет собой L или группу -NR8R9 (где L,R8 и R9 такие, как определено выше), могут быть получены в соответствии со способами,описанными в РСТ WO 92/07867, включенном здесь ссылкой. Альтернативно, соединения формулы (V),в которых Х представляет собой R, a R представляет собой группу -NR8R9, где R8 и R9 такие,как определено выше, могут быть получены путем взаимодействия соединения формулы с агентом или агентами, способными циклизовать диамин в бензимидазол. Обычно соединения формулы (I) могут быть подвергнуты взаимодействию с изотиоцианатом формулы (VII)(VII) 8 9 где R и R такие, как определено выше. Взаимодействие может быть осуществлено в присутствии карбодиимда, такого как дициклогексилкарбодиимид или 1-циклогексил-3-(2 морфолиноэтил)карбодиимида мето-п-толуолсульфонат в присутствии апротонного ароматического растворителя, такого как толуол и наиболее предпочтительно пиридин, при повышенной температуре, предпочтительно 70-150 С. Соединения формулы (V), в которых Х представляет собой водород, можно получить коммерчески или, альтернативно, они могут быть получены взаимодействием соединения формулы (VI) с формамидином в воднокислотных условиях при температуре до 80 С. Соединения формулы (VI) могут быть получены из подходящего соответствующего ортонитроанилина в присутствии восстанавливающего агента, такого как восстановленное железо, например, в присутствии кислоты, наиболее предпочтительно соляной кислоты. Эту реакцию обычно проводят в присутствии растворителя, например этилового спирта, в диапазоне температур от 50 до 78 С [В. Fox and T.L.Threlfall, Org. Syn. Coll. Vol. 5, 1973, p. 346]. Альтернативно, такие ортофенилендиамины могут быть получены в присутствии восстанавливающего агента, такого как каталитический никель Ренея, в присутствии водорода. Эта реакция обычно протекает в присутствии растворителя, например этилового спирта, при температуре окружающей среды [К. Dimroth, et al,Org. Syn. Coll. Vol. 5, 1973, p. 1130]. Особенно,такие ортофенилендиамины могут быть получены способами, описанными в литературе. 20 Соединения формулы (VI) и (VII) могут быть получены способами, хорошо известными специалистам или легко доступными из химической литературы или доступными коммерчески. Сложные эфиры по изобретению могут быть получены способами, хорошо известными из уровня техники, например, соединение формулы (I) может быть превращено в фармацевтически приемлемый сложный эфир путем взаимодействия с соответствующим этерифицирующим агентом, например, соответствующим галогенидом или ангидридом кислоты. Соединение формулы (I) может быть превращено в соответствующий фармацевтически приемлемый простой эфир формулы (I) путем взаимодействия с подходящим алкилирующим агентом общепринятым способом. Соединения формулы (I), включая их сложные эфиры, могут быть превращены в их фармацевтически приемлемые соли общепринятым способом, например, путем обработки подходящей кислотой. Сложный эфир или соль сложного эфира формулы (I) может быть превращена в родительское соединение, например,путем гидролиза. Бета и альфа аномеры могут быть разделены и выделены в чистом виде хроматографией на силикагеле с использованием единственного растворителя или комбинации растворителей,такой как 1:20 метанол:дихлорметан. Следующие примеры предназначены только для иллюстрации и не ограничивают объем изобретения никоим образом. Термин активный ингредиент, который использован в фармацевтических примерах, обозначает соединение формулы (I) или его фармацевтически приемлемое производное. Под этим термином также подразумевается соединение формулы (I) или его фармацевтически приемлемое производное в комбинации с одним или более чем одним терапевтическим агентом. Пример 1. Таблетированные препараты. Следующие препараты А и Б готовят путем влажного гранулирования ингредиентов с раствором повидона с последующим добавлением стеарата магния и прессованием. Препарат А. а) Активный ингредиент б) Лактоза В.Р. в) Повидон В.Р. г) Крахмальный гликолят натрия д) Стеарат магния Препарат Б. а) Активный ингредиент б) Лактоза в) Авицел (Avicel) PH 101 г) Повидон В.Р. д) Крахмальный гликолят натрия е) Стеарат магния капсулы из твердого желатина, состоящей из двух частей. Препарат Г. Препарат В. Активный ингредиент Лактоза Крахмал Повидон Стеарат магния Активный ингредиент Лецитин Арахисовое масло Следующие препараты, Г и Д, получают непосредственным прессованием смешанных ингредиентов. Лактоза, используемая в препарате Д, относится к типу непосредственного прессования (Dairy Crest - Zeparox). Препарат Г. Активный ингредиент Прежелатинизированный крахмал NF15 Препарат Д. Активный ингредиент Лактоза Авицел (Avicel) Препарат Е (препарат с регулируемым высвобождением). Препарат получают путем влажного гранулирования ингредиентов (смотри ниже) с раствором повидона с последующим добавлением стеарата магния и прессованием. Пример 2. Капсульные препараты. Препарат А. Капсульный препарат готовят путем смешивания ингредиентов препарата Г из приведенного выше примера 1 и заполнения ими капсулы из твердого желатина, состоящей из двух частей. Препарат Б (смотри ниже) готовят аналогичным способом. Препарат Б. Капсулы получают путем расплавления макрогола 4000 ВР, диспергирования активного ингредиента в расплаве и заполнения расплавом Капсулы получают путем диспергирования активного ингредиента в лецитине и арахисовом масле и заполнения дисперсией капсул из мягкого эластичного желатина. Препарат Д (капсула с регулируемым высвобождением). Следующий препарат в виде капсулы с регулируемым высвобождением готовят путем экструдирования ингредиентов а, б и в с помощью экструдера с последующей сфероидизацией экструдата и его сушкой. Высушенные шарики затем покрывают мембраной регулируемого высвобождения (г) и заполняют ими твердую желатиновую капсулу, состоящую из двух частей. Пример 3. Инъекционный препарат препарат А. Активный ингредиент Раствор соляной кислоты, 0,1 М Раствор гидроксида натрия, 0,1 М Стерильная вода 0,200 г Сколько требуется до рН 4,0-7,0 Сколько требуется до рН 4,0-7,0 Сколько требуется до 10 мл Активный ингредиент растворяют в большей части воды (35-40 С) ирН доводят до значения 4,0-7,0 с помощью соляной кислоты или гидроксида натрия, как целесообразно. Порцию затем доводят до объема водой, фильтруют через стерильный фильтр с микропорами в стерильный флакон из янтарного стекла емкостью 10 мл (тип 1) и герметизируют стерильными пробками и наружными уплотнениями. Препарат Б. Активный ингредиент Стерильный апирогенный фосфатный буфер, рН 7, 0,125 г Сколько требуется до 25 мл Пример 4. Внутримышечная инъекция. Активный ингредиент Бензиловый спирт Гликофурол Вода для инъекций 0,20 г 0,10 г 1,45 г Сколько требуется до 3,00 мл Активный ингредиент растворяют в гликофуроле. Затем добавляют и растворяют бензиловый спирт и добавляют воду до 3 мл. Затем смесь фильтруют через стерильный фильтр с микропорами и герметизируют в стерильных флаконах из янтарного стекла емкостью 3 мл(тип 1). Пример 5. Сироп. Активный ингредиент Раствор сорбита Глицерин Бензоат натрия Корригент, персик 17.42.3169 Очищенная вода 0,2500 г 1,5000 г 2,0000 г 0,0050 г 0,0125 мл Сколько требуется до 5,0000 мл Активный ингредиент растворяют в смеси глицерина и большей части очищенной воды. Затем к раствору добавляют водный раствор бензоата натрия с последующим добавлением раствора сорбита и, затем, корригента. Объем доводят очищенной водой и тщательно перемешивают. Пример 6. Суппозиторий. Активный ингредиент (631 m) Твердый жир, ВР (Witepsol H15 Dynamit Nobel Активный ингредиент используют в виде порошка, в котором, по меньшей мере, 90% частиц имеют диаметр 631 m или менее. Одну пятую часть Witepsol H15 расплавляют в котле с паровой рубашкой при температуре максимум 45 С. Активный ингредиент просеивают через сито 1001 m и добавляют при перемешивании к расплавленной основе, используя силверсон, снабженный режущей головкой, до получения выровненной дисперсии. Поддерживая температуру смеси равной 45 С, к суспензии добавляют оставшийся Witepsol H15 и перемешивают до образования гомогенной смеси. Всю суспензию пропускают через сито 2501 m из нержавеющей стали при непрерывном перемешивании и дают остыть до 40 С. При температуре от 38 до 40 С 2,02 г смеси заполняют подходящие пластиковые формы емкостью 2 мл. Суппозиториям дают остыть до комнатной температуры. Химические примеры Пример 1. 2-Циклопропиламино-5,6 дихлор-1-(5-дезокси-бета-L-рибофуранозил)1 Н-бензимидазол. Циклопропиламин (5 мл) и 2-бром-5,6 дихлор-1-(5-дезокси-2,3-диацетил-бета-L-рибофуранозил)-1 Н-бензимидазол (0,45 г, 0,96 ммоль) объединяют с абсолютным этанолом (15 мл) и перемешивают при 80 С в течение 24 ч. Реакционную смесь концентрируют и очищают на колонке с силикагелем (2,5 х 18 см, 230-400 меш) смесью 1:25 метанол:дихлорметан, получая 0,42 г неочищенного продукта. Этот материал далее очищают на второй колонке с силикагелем (2,5 х 18 см, 230-400 меш) смесью 1:2 гексаны:этилацетат, получая белое твердое вещество (0,050 г, 0,14 ммоль, 31%); т.пл. 186187 С [a]20D = (+) 62.0 (с=0,5 ДМФ);H ЯМР (ДМСО-d6) d 7.46 (s, 1 Н, Ar-H),7.33 (s, 1 Н, Ar-H), 7.10 (d, 1H, NH, J=2.4 Гц),5.59 (d, 1 Н, Н-1', J=6.6 Гц), 5.22 (d, 1H, ОН, J=4.8 Гц), 5.20 (d, 1H, ОН, J=7.2 Гц), 4.30 (q, 1H, Н-4',J=6.6 Гц), 3.89 (m, 1H), 3.79-3.75 (m, 1H), 2.772.71 (m, 1H, циклопропил-СН), 1.34 (d, 6H, Н-5',J=6.6 Гц), 0.70-0.67 (m, 2H, циклопропил-СН 2),0.56-0.48 (m, 2H, циклопропил-СН 2). Анал. рассчитано для С 15 Н 17N3 О 3 Сl2: С,50.29; Н, 4.78; N, 11.73. Найдено: С, 50.38; Н, 4.88, N, 11.52. Пример 2. 2-Циклопентиламино-5,6-дихлор-1-(5-дезокси-бета-L-рибофуранозил)-1 Нбензимидазол. Циклопентиламин (1 мл) и 2-бром-5,6 дихлор-1-(5-дезокси-2,3-диацетил-бета-L-рибофуранозил)-1 Н-бензимидазол (0,40 г, 0,86 ммоль) объединяют с абсолютным этанолом (10 мл) и перемешивают при 80 С в течение 24 ч. Реакционную смесь концентрируют и очищают на колонке с силикагелем (2,5 х 18 см, 230-400 меш) смесью 1:20 метанол: дихлорметан, получая 0,36 г неочищенного продукта. Этот материал далее очищают на второй колонке с силикагелем (2,5 х 17 см, 230-400 меш) смесью 1:1 гексаны: этилацетат, получая белое твердое вещество (0,27 г, 0,70 ммоль, 81%); т.пл. 172173 С [a]20D = (+) 39.6 (с=0.5 ДМФ); УФ mах : рН 7,0: 304 нм (10,200), 276(m, 2H, циклопентил-СН 2), 1.97-1.93 (m, 2H,циклопентил-СН 2), 1.36 (d, 3H, H-5', J=6.3 Гц). Анал. рассчитано для С 17H21N3O3 Сl2: С,52.86; Н, 5.48; N, 10.88. Найдено: С, 52.93; Н, 5.50, N, 10.77. Пример 3. 2-Изопропиламино-5,6-дихлор 1-(5-дезокси-бета-L-рибофуранозил)-1 Н-бензимидазол. Изопропиламин (5 мл) и 2-бром-5,6 дихлор-1-(5-дезокси-2,3-диацетил-бета-L-рибофуранозил)-1 Н-бензимидазол (0,40 г, 0,86 ммоль) объединяют с абсолютным этанолом (20 мл) и перемешивают при 80 С в течение 24 ч. Реакционную смесь концентрируют и очищают путем многократных повторений на хроматотроне, оснащенном 2 мм силикагельным ротором, с использованием смесей 1:30 метанол:дихлорметан, 1:1 этилацетат:гексаны и 1:4 ацетон:дихлорметан, получая белое твердое вещество (0,18 г, 0,70 ммоль, 60%); т.пл. 103105 С [a]20D = (+) 38.8 (с=0.5 ДМФ);(17 мл) и этаноле (17 мл) объединяют с раствором карбоната натрия (0,22 г, 2,1 ммоль) в воде(4 мл). Раствор перемешивают при комнатной температуре 2 ч, затем добавляют уксусную кислоту (0,24 мл, 4 ммоль), и метанол с этанолом удаляют на роторном испарителе. Затем раствор экстрагируют между этилацетатом (150 мл) и водой (2 х 50 мл). Органическую фазу концентрируют и очищают на колонке с силикагелем (2,5 х 17 см, 230-400 меш) смесью 1:20 метанол:дихлорметан. Дальнейшая очистка на хроматотроне, оснащенном 2 мм ротором с использованием смеси 1:8 ацетон:дихлорметан приводит к получению белого твердого вещества (0,43 г, 1,1 ммоль, 57%); т.пл. 136-138 СH ЯМР (ДМСО-d6) d 7.97 (s, 1H, Ar-H),7.85 (s, 1H, Ar-H), 5.84 (d, 1H, Н-1', J=6.8 Гц),5.49 (d, 1H, ОН, J=6.0 Гц), 5.26 (d, 1H, ОН, J=5.0 Гц), 4.48 (q, 1H, H-4', J=6.4 Гц), 4.02-3.97 (m,1H), 3.95-3.85 (m, 1H), 1.40 (d, 3H, H-5', J=6.5 Гц). Анал. рассчитано для С 12 Н 11N2 О 3 Сl2 Вr: С,37.73; Н, 2.90; N, 7.33. Найдено: С, 37.84; Н, 2.99, N, 7.32. Пример 5. 2-Бром-5,6-дихлор-1-(2,3-ди-Oацетил-5-дезокси-бета-L-рибофуранозил)-1 Нбензимидазол. 2-Бром-5,6-дихлорбензимидазол (1,9 г, 7,0 ммоль), N,O-бис(триметилсилил)ацетамид (2,1 мл, 10,5 ммоль) и ацетонитрил (50 мл) объединяют и кипятят с обратным холодильником в атмосфере азота 20 мин. Раствор охлаждают до комнатной температуры и добавляют триметилсилилтрифлат (2,5 мл, 12,8 ммоль). Через 15 мин добавляют раствор 1,2,3-три-О-ацетил-5 дезокси-L-рибофуранозы в ацетонитриле (10 мл). Раствор перемешивают в атмосфере азота при комнатной температуре 2 ч, затем разбав 001770 26 ляют смесью 1:2 гексаны:этилацетат (150 мл) и экстрагируют холодным 10%-ным водным бикарбонатом натрия (50 мл) и водой (50 мл). Органические слои сушат сульфатом магния (безводным), фильтруют и выпаривают. Неочищенный остаток очищают на колонке с силикагелем(5 мл). Раствор охлаждают до температуры ледяной бани и по каплям добавляют концентрированную серную кислоту (1 мл). Раствор выдерживают 4 дня при температуре 5 С, затем его выливают в смесь воды со льдом (50 мл) и экстрагируют смесью 3:1 этилацетат:гексаны(200 мл и 75 мл). Объединенные органические фазы промывают 10%-ным бикарбонатом натрия (2 х 50 мл) и водой (50 мл). Органические слои сушат, концентрируют и остаток очищают на колонке с силикагелем (5 х 15 см, 230-400 меш) смесью этилацетат:гексаны (1:3). Наблюдают оба аномера, но выделяют их вместе в виде прозрачного масла (2,2 г, 8,8 ммоль, 58%); 1H ЯМР (ДМСО-d6)5.96 (d, 1H, J=1 Гц),5.23 (t, 1H, H-2, J=5 Гц), 4.96 (t, 1H, Н-3, J=5.7 Гц), 4.24-4.16 (m, 1H, H-4), 2.07 (s, 3 Н, ОАс),2.05 (s, 3 Н, ОАс), 2.02 (s, 3 Н, ОАс), 1.27 (d, 3 Н,Н-5', J=6.3 Гц). Анал. рассчитано для C11H16O7: С, 50.77; Н, 6.20. Найдено: С, 50.59; Н, 6.17. Пример 7. Метил-5-дезокси-2,3-ди-O-ацетил-L-рибофуранозид. Метил-5-дезокси-L-рибофуранозид (2,25 г,15,2 ммоль) объединяют с уксусным ангидридом (10 мл, 106 ммоль), триэтиламином (20 мл) и N,N-диметиламинопиридином (0,2 г, 1,6 ммоль) в ацетонитриле (100 мл). Раствор перемешивают при комнатной температуре 18 ч,затем концентрируют до густого масла, затем растворяют в 150 мл смеси этилацетат:гексаны(3:1) и экстрагируют насыщенным карбонатом натрия (2 х 25 мл) и водой (25 мл). Органический слой сушат и концентрируют до желтого масла (3,3 г, 14,2 ммоль, 93%), которое используют непосредственно без дальнейшей очистки. 27 Пример 8. Метил-5-дезокси-L-рибофуранозид. Метил-5-дезокси-2,3-O-изопропилиден-Lрибофуранозид (7,1 г, 37,7 ммоль) объединяют с 80%-ной трифторуксусной кислотой (50 мл) и перемешивают при температуре окружающей среды 4 ч. Растворители удаляют в вакууме. Неочищенный продукт обрабатывают H2SO4(0,5 мл) в метаноле (50 мл) при комнатной температуре в течение 18 ч, затем резко охлаждают твердым NаНСО 3, фильтруют и концентрируют. Золотистый остаток очищают на колонке с силикагелем (5 х 18 см) смесью 1:15 метанол:дихлорметан. Продукт выделяют как смесь бета и альфа аномеров: (2,25 г, 15,2 ммоль,40%), которую используют непосредственно без дальнейшей очистки. МС (API-; m/z (отн. интенсивность) 147(изобутилнитрил)ом, AIBN (0,33 г, 0,4 ммоль) и толуолом. Раствор продувают сухим азотом в течение 20 мин. Добавляют гидрид трибутилолова и раствор нагревают до 90 С 18 ч. Реакционную смесь концентрируют, повторно растворяют в эфире (100 мл) и объединяют с одним эквивалентом KF в воде (50 мл). Через 30 мин белый осадок отфильтровывают и разделяют две фазы. Органическую фазу сушат (Na2SO4),фильтруют и концентрируют. Остаток очищают на колонке с силикагелем (5 х 16 см) смесью 1:18 этилацетат:гексаны. Чистый продукт получают в виде прозрачного масла: (7,3 г, 39 ммоль,94%); [a]20D = (-) 0.6 (с=0.5 ДМФ); МС (АР+):(d, 1H, Н-2, J=6.0 Гц), 4.52 (d, 1H, Н-3, J=6.0 Гц),4,20 (q, 1H, Н-4, J=7.0 Гц), 3.21 (s, 3 Н, ОМе),1.35 (s, 3 Н, СН 3), 1.22 (s, 3 Н, СН 3), 1.17 (d, 3 Н,Н-5, J=7.1 Гц). Анал. рассчитано для C9H16O40.5 С 6 Н 14: С,58.02; Н, 8.74. Найдено: С, 58.31; Н, 8.47. Пример 10. Метил-5-хлор-2,3-изопропилиден-бета-L-рибофуранозид. Метил-2,3-изопропилиден-бета-L-рибофуранозид (16,5 г, 80,8 ммоль) объединяют с безводным ацетонитрилом и четыреххлористым углеродом. Добавляют трифенилфосфин и этот раствор перемешивают в атмосфере азота при температуре окружающей среды. Через 18 ч 28 раствор концентрируют до густой суспензии. Смесь частично очищают на фильтрующем слое силикагеля (4 х 14 см) смесью 1:2 этилацетат:гексаны, получая светло-желтый масляный продукт: (17,8 г, 80 ммоль, 99%); [a]20D = (+) 81.6 (с=0.5 ДМФ); МС (Cl): m/z (отн. интенсивность) 191L-рибозу (15,5 г, 98 ммоль) объединяют с метанолом (150 мл) и концентрированной серной кислотой (0,5 мл). Этот раствор перемешивают при температуре ледяной бани в течение 18 ч. К раствору добавляют 2,2 диметоксипропан (300 мл) и перемешивание продолжают при температуре окружающей среды еще 18 ч. Добавляют пиридин (40 мл) и раствор концентрируют. Остаток разделяют между этилацетатом (300 мл) и 1 Н HCl (4 х 100 мл) и затем органическую фазу промывают 10%-нымNaHCО 3, сушат с помощью Na2SО 4, декантируют и концентрируют. Остаток представляет собой золотистое масло 20,0 г, 98 ммоль, 95%;(d, 1H, H-2, J=6.0 Гц), 4.51 (d. 1H, H-3, J=6.0 Гц),3,98 (t, 1H, Н-4, J=5.8 Гц, J=8.9 Гц), 3.37-3.26 (d,2H, Н-5), 3.19 (s, 3 Н, ОМе), 1.36 (s, 3 Н, СН 3),1.23 (s, 3 Н, СН 3). Анал. рассчитано для C9H16O5: С, 52.93; Н,7.90. Найдено: С, 52.90; Н, 7.88. Пример 12. 1-(5-Хлор-5-дезокси-бета-Lрибофуранозил)-5,6-дихлор-2-изопропиламино 1 Н-бензимидазол. Раствор 1-(2,3-ди-O-ацетил-5-хлор-5-дезокси-бета-L-рибофуранозил)-5,6-дихлор-2-изопропиламино-1 Н-бензимидазола (0,52 г, 1,1 ммоль) в метаноле (10 мл) и этаноле (10 мл) объединяют с раствором карбоната натрия (0,17 г, 1,6 ммоль) в воде (5 мл). Раствор перемешивают при комнатной температуре в течение 24 ч, затем метанол и этанол удаляют на роторном испарителе. Раствор разводят этилацетатом (150 мл) и экстрагируют водой (2 х 50 мл). Органическую фазу сушат, концентрируют и очищают на колонке с силикагелем (2,5 х 17 см, 230-400 меш) смесью 1:25 метанол:дихлорметан, получая белое твердое вещество (0,34 г, 0,86 ммоль,79%); т.пл. 95-97 С; [a]20D = (+) 13.6 (с=0.5 ДМФ);(20 мл) объединяют и нагревают при 80 С в атмосфере азота в течение 20 мин. Раствор охлаждают до комнатной температуры и добавляют триметилсилилтрифлат (0,27 мл, 1,4 ммоль). Через 15 мин в виде белого твердого вещества добавляют 1,2,3-три-O-ацетил-5-хлор-5-дезоксиL-рибофуранозу. Раствор перемешивают в атмосфере азота при 80 С в течение 3 ч, затем разводят смесью 1:3 гексаны:этилацетат (150 мл) и экстрагируют холодным 10%-ным бикарбонатом натрия (2 х 50 мл). Органические слои сушат безводным сульфатом натрия, декантируют и выпаривают. Неочищенный остаток очищают на колонке с силикагелем (2,5 х 18 см,230-400 меш) смесью (1:40) метанол : дихлорметан, получая неочищенный продукт (0,71 г). Этот материал далее очищают путем многократных повторений на хроматотроне, оснащенном 2 мм силикагельным ротором, используя смеси (2:3) этилацетат:гексаны и (1:200) метанол:дихлорметан. Получают продукт в виде грязно-белого твердого вещества (0,59 г, 1,2 ммоль, 58%); [a]20D = (-) 4.8 (с=0.5 ДМФ); MC(API+): m/z 478 (М+, 5.07). Анал. рассчитано для С 19 Н 22N3 О 5 Сl30.60 С 4H8O20.50 CH2Cl2: С, 45.82; Н, 4.88; N, 7.32. Найдено: С, 46.04; Н, 4.71, N, 7.14. Пример 14. 2-Трет-бутиламино-1-(5-хлор 5-дезокси-бета-L-рибофуранозил)-5,6-дихлор 1 Н-бензимидазол. Раствор 2-трет-бутиламино-1-(2,3-ди-Oацетил-5-хлор-5-дезокси-бета-L-рибофуранозил)-5,6-дихлор-1 Н-бензимидазола (0,38 г, 0,77 ммоль) в метаноле (10 мл) и этаноле (10 мл) объединяют с раствором карбоната натрия (0,12 г, 1,2 ммоль) в воде (5 мл). Раствор перемешивают при комнатной температуре в течение 18 ч, затем метанол и этанол удаляют на роторной испарителе. Раствор разбавляют этилацетатом 30 метанол:дихлорметан, получая белое твердое вещество (0,29 г, 0,71 ммоль, 92%); т.пл. 112114 С; [a]20D = (+) 0.80 (с=0.5 ДМФ); УФ max : pH 7,0: 304 нм (11.000), 276(d, 1H, ОН, J=7.8 Гц), 4.36 (видимый q, 1H, H-4,J=7.4 Гц), 4.18-4.02 (m, 4H, Н-2', Н-3' и Н-5'),1.51 (d, 9H, СН(СН 3)3). Анал. рассчитано для С 16 Н 20N3 О 3Cl30.50 Н 2O: С, 46.11; Н, 5.05; N, 10.08. Найдено: С, 46.04; Н, 5.02, N, 9.99. Пример 15. 2-Трет-бутиламино-1-(2,3-диO-ацетил-5-хлор-5-дезокси-бета-L-рибофуранозил)-5,6-дихлор-1 Н-бензимидазол. 2-Трет-бутиламино-5,6-дихлорбензимидазол (0,43 г, 1,6 ммоль), N,O-бис(триметилсилил)ацетамид (0,45 мл, 1,8 ммоль) и 1,2 дихлорэтан (20 мл) объединяют и нагревают в атмосфере азота при 80 С в течение 20 мин. Раствор охлаждают до комнатной температуры и добавляют триметилсилилтрифлат (0,21 мл,1,1 ммоль). Через 15 мин в виде белого твердого вещества добавляют 1,2,3-три-O-ацетил-5-хлор 5-дезокси-L-рибофуранозу. Раствор перемешивают в атмосфере азота при 80 С в течение 2,5 ч, затем разводят смесью 1:4 гексаны:этилацетат(150 мл) и экстрагируют холодным 10%-ным бикарбонатом натрия (2 х 50 мл). Органические слои сушат безводным сульфатом натрия, декантируют и выпаривают. Неочищенный остаток очищают на колонке с силикагелем (2,5 х 16 см, 230-400 меш) смесью (1:100) ацетон:дихлорметан, получая грязно-белое твердое вещество (0,42 г, 0,85 ммоль, 57%); [a]20D = (-) 10.8 (с=0.5 ДМФ); МС (API+): m/z 492 (M+,5.35). Анал. рассчитано для С 20 Н 24N3O5 Сl30.50 С 3 Н 6 О 0.25CH2Cl2: С, 48.11; Н, 5.10; N, 7.74. Найдено: С, 48.19; Н, 5.00, N, 7.57. Пример 16. 5,6-Дихлор-1-(3-дезокси-бетаL-рибофуранозил)-2-изопропиламино-1 Н-бензимидазол. Раствор 1-(3-дезокси-2,5-ди-O-ацетилбета-L-рибофуранозил)-5,6-дихлор-2-изопропиламино-1 Н-бензимидазола (0,36 г, 0,81 ммоль) в метаноле (10 мл) и этаноле (10 мл) объединяют с раствором карбоната натрия (0,13 г, 1,2 ммоль) в воде (3 мл). Раствор перемешивают при комнатной температуре в течение 24 ч, затем метанол и этанол удаляют на роторном испарителе. Раствор разбавляют этилацетатом(120 мл) и экстрагируют насыщенным NaCl (2 х 50 мл). Органическую фазу высушивают (безводный сульфат натрия), концентрируют и очищают на колонке с силикагелем (2,5 х 16 см,230-400 меш) смесью 1:20 метанол: дихлорметан, получая белое твердое вещество (0,21 г, 31 0,59 ммоль, 79%); т.пл. 153-155 С; [a]20D = (-) 32.8 (с=0.5 ДМФ); УФ mах : pH 7.0: 305 нм (11.300), 276(отн. интенсивность) 360 (90.85, М+). Анал. рассчитано для C15H19N3O3Cl20.50 Н 2 О: С, 48.79; Н, 5.46; N, 11.38. Найдено: С, 48.91; Н, 5.39, N, 11.20. Пример 17. 1-(3-Дезокси-2,5-ди-O-ацетилбета-L-рибофуранозил)-5,6-дихлор-2-изопропиламино-1 Н-бензимидазол. 1-(3-Бром-3-дезокси-2,5-ди-O-ацетил-бетаL-ксилофуранозил)-5,6-дихлор-2-(изопропиламино)-1 Н-бензимидазол (0,67 г, 1,3 ммоль),гидрид трибутилолова и AIBN объединяют в безводном толуоле. Раствор продувают азотом,затем нагревают до 90 С на масляной бане. Через 2 ч раствор охлаждают до температуры окружающей среды, разбавляют ацетонитрилом(200 мл) и экстрагируют гексанами (3 х 50 мл). Слой ацетонитрила концентрируют, получая 0,53 г неочищенного продукта. Материал очищают на колонке с силикагелем (2,5 х 16 см,230-400 меш), используя (1:40) смесь метанол:дихлорметан, получая белое твердое вещество (0,41 г, 0,92 ммоль, 72%); [a]20D = (-) 26.4(с=0.5 ДМФ); МС (API+): m/z (отн. интенсивность) 444 (21.63, M+). Анал. рассчитано для C19H23N3O5Cl2: С,51.36; Н, 5.22; N, 9.46. Найдено: С, 51.50; Н, 5.25, N, 9.28. Пример 18. 1-(3-Бром-3-дезокси-2,5-ди-Oацетил-бета-L-ксилорибофуранозил)-5,6 дихлор-2-(изопропиламино)-1 Н-бензимидазол. 5,6-Дихлор-2-изопропиламино-(бета-Lрибофуранозил)-1 Н-бензимидазол (1,7 г, 4,5 ммоль), триэтил-ортоацетат и моногидрат тозиновой кислоты объединяют в ацетонитриле и перемешивают при температуре окружающей среды в течение 18 ч. Раствор обрабатывают избытком метанольного аммония (аммоний барботируют через 50 мл холодного метанола в течение 15 мин). Полученную твердую фазу фильтруют и промывают дихлорметаном (100 мл). Фильтрат и промывные воды концентрируют до желтой пены, которую объединяют с ацетилбромидом в 1,2-дихлорэтане. Раствор нагревают при 80 С в масляной бане в течение 30 минут, охлаждают, затем выливают в холодный насыщенный NaHCO3. Этот раствор экстрагируют дихлорметаном (2 х 100 мл). Органическую фазу сушат (безводный сульфат натрия),декантрируют и концентрируют до желтокоричневого масла (3,1 г). Очистка на колонке с силикагелем (5 х 10 см, 230-400 меш) с использованием смеси (1:20) метанол : дихлорметан обеспечивает получение 2,5 г неочищенного материала. Дальнейшая очистка на колонке с силикагелем (5 х 14 см, 230-400 меш) с использованием смеси (1:50) ацетон:дихлорметан дает чистый продукт в виде грязно-белого твердого 32 вещества (0,86 г, 1.6 ммоль, 36%): [а]20D = (+) 14.8 (с=0.5 ДМФ); МС (API+): m/z (отн. интенсивность) 523 (100, М+). Анал. рассчитано для C19H22N3O5Cl2Br: С,43.62; Н, 4.24; N, 8.03. Найдено: С, 43.79; Н, 4.35, N, 7.87. Пример 19. 5,6-Дихлор-1-(2-дезокси-бетаL-эритро-пентофуранозил)-2-изопропиламино 1 Н-бензимидазол. Раствор 1-(2-дезокси-3,5-O-(1,1,3,3-тетраизопропил)дисилоксанил-бета-L-эритропентофуранозил)-5,6-дихлор-2-изопропиламино-1 Нбензимидазола (0,25 г, 0,41 ммоль) и фторид тетрабутиламмония на силикагеле (1,0 г) объединяют в ТГФ (8 мл). Раствор перемешивают при комнатной температуре в течение 6 ч, затем фильтруют. Твердую фазу промывают смесью(1:9) метанол:дихлорметан, фильтрат и промывные воды концентрируют и очищают на хроматотроне, оснащенном 2 мм силикагельным ротором, используя смесь (1:20) метанол : дихлорметан. После лиофилизации получают продукт в виде белого твердого вещества (0,13 г,0,36 ммоль, 87%); 114-115 С; [а]20D = (-) 43.6AIBN (0,011 г, 0,07 ммоль) в толуоле (20 мл) и раствор продувают азотом. Добавляют гидрид трибутилолова (0,20 мл, 0,74 ммоль) и раствор нагревают при 90 С в масляной бане в течение 18 ч. Реакционную смесь концентрируют, затем растворяют в ацетонитриле (100 мл) и экстрагируют гексанами (50 мл). Гексановый слой переэкстрагируют ацетонитрилом (3 х 100 мл). Объединенный слои ацетонитрила концентрируют и очищают на колонке с силикагелем (2,5 х 18 см,230-400 меш), используя смесь (1:100) ацетон:дихлорметан, получая белое твердое вещество (0,34 г, 0,56 ммоль. 83%); [а]20D = (+) 17.0 33 5,6-Дихлор-2-изопропиламино-1-(3,5-O(1,1,3,3-тетраизопропил)дисилоксанил-бета-Lрибофуранозил)-1 Н-бензимидазол объединяют с 4-(N,N-диметиламино)пиридином (0,46 г, 3,76 ммоль) в ацетонитриле (25 мл). По каплям добавляют хлорфенилтионокарбонат и раствор перемешивают при температуре окружающей среды в атмосфере N2. Через 18 ч раствор разбавляют смесью (1:1) гексан:этилацетат, затем экстрагируют насыщенным NaCl (2 х 50 мл). Органическую фазу сушат безводным сульфатом натрия и концентрируют. Неочищенный продукт очищают на колонке с силикагелем (2,5 х 18 см, 230-400 меш), используя смесь (1:6) этилацетат : гексан. Чистый продукт получают в виде белого твердого вещества (1,1 г, 1,4 ммоль,72%); [a]20D = (+) 61.2 (с=0.5 ДМФ); МС (ESP+):m/z (отн. интенсивность) 754 (100, М+). Анал. рассчитано для C34H49N3O6SCl2Si2 0.20 С 6 Н 14: С, 54.75; Н, 6.76; N, 5.44. Найдено: С, 54.84; Н, 6.72, N, 5.45. Пример 22. 5,6-Дихлор-2-(изопропиламино)-1-(3,5-O-(1,1,3,3-тетраизопропил-1,3 дисилоксандиил)-бета-L-рибофуранозил)-1 Нбензимидазол. 5,6-Дихлор-2-(изопропиламино)-1-(бета-Lрибофуранозил)-1 Н-бензимидазол (5,0 г, 13,3 ммоль) объединяют с 1,3-дихлор-1,1,3,3-тетраизопропилдисилоксаном (4,6 мл, 14,6 ммоль) и имидазолом (3,6 г, 53,2 ммоль) в ДМФ (14 мл). Раствор перемешивают в атмосфере азота при комнатной температуре в течение 18 ч. К раствору добавляют воду (160 мл), а твердую фазу отфильтровывают. Твердые вещества растворяют в смеси 1:1 этилацетат : гексан (360 мл) и этот раствор экстрагируют насыщенным NaCl(100 мл). Органическую фазу сушат безводным сульфатом натрия, декантируют и концентрируют. Неочищенный продукт массой 8,4 г очищают на колонке с силикагелем (5 х 16 см, 230400 меш) смесью 1:100 метанол: дихлорметан,получая 7,4 г все еще неочищенного материала. Окончательная очистка на радиальном компрессионном модуле Biotage (Biotage Inc., Charlottesville, Va.) с 7,5 х 15 см предварительно упакованным силикагельным патроном обеспечивает получение чистого продукта в виде белого твердого вещества (3,8 г, 6,3 ммоль, 47%); т.пл. 129-130 С; [a]20D = (+) 48.4 (с=0.5 ДМФ); МС (АР+): m/z (отн. интенсивность) 618 (100,М+). Анал. рассчитано для С 27 Н 45N3O5 Сl2Si2 0.25 C6H14: С, 53.46; Н, 7.63; N, 6.56. Найдено: С, 53.55; Н, 7.60, N, 6.74. Пример 23. 2-Бром-5,6-дихлор-1-(2,3,5 три-O-ацетил-бета-L-рибофуранозил)-1 Нбензимидазол после реакции бромирования. 5,6-Дихлор-1-(2,3,5-три-O-ацетил-бета-Lрибофуранозил)-1 Н-бензимидазол (1,0 г, 2,25 ммоль) объединяют с N-бромсукцинимидом(50 мл). Раствор нагревают при 80 С на масляной бане в течение 15 мин. Раствор охлаждают,разбавляют этилацетатом и экстрагируют 10%ным бикарбонатом натрия (2 х 50 мл). Органическую фазу сушат безводным Na2SO4, декантируют и концентрируют. Остаток очищают на колонке с силикагелем (5 х 11 см, 230-400 меш) смесью (1:50) метанол:дихлорметан, получая белое твердое вещество, которое идентифицируют как продукт путем сравнения его 1H ЯМР данных с данными из примера 1. Пример 24. 5,6-Дихлор-2-(изопропиламино)-1-(2,3,5-три-O-ацетил-бета-L-рибофуранозил)-1 Н-бензимидазол. Безводный 1,2-дихлорэтан (15 мл), 2(изопропиламино)-5,6-дихлорбензимидазол (5,9 ммоль) и N,О-бис-триметилсилилацетимид (11,8 ммоль) объединяют и перемешивают при 80 С в течение 30 мин. Добавляют триметилсилилтрифталат (5,9 ммоль) и раствор перемешивают при 80 С в течение 45 мин. Добавляют твердый 1,2,3,4-тетра-O-ацетил-L-рибофуранозид(LTAR) и продолжают перемешивание при 80 С в течение 3 ч. В это время добавляют еще L-TAR(0,5 г, 1,6 ммоль). Через 1 ч реакционную смесь резко охлаждают холодным насыщенным бикарбонатом натрия (40 мл), затем экстрагируют дихлорметаном (2 х 150 мл). Объединенные органические фазы сушат (сульфат натрия), декантируют и концентрируют, получая 4,0 г золотистого твердого вещества. Этот материал очищают на колонке с силикагелем (5 см х 16 см, 230-400 меш) смесью метанол:дихлорметан,получая грязно-белое твердое вещество (2,21 г,4,3 ммоль, 73%); [a]20D = (-) 28.4 (с=0.5 ДМФ). Анал. рассчитано для С 22 Н 27N3O7 Сl2 1CH4O: С, 50.37; Н, 5.70; N, 7.66. Найдено: С, 50.74; Н, 5.41, N, 7.28. Общая методика I. Синтез 2-(алкиламино)1 Н-бензимидазолов с использованием 1 циклогексил-3-(2-морфолиноэтил)карбодиимид мето-п-толуолсульфоната в качестве десульфирующего агента. Соответствующий 1,2-фенилендиамин объединяют с соответствующим изотиоцианатом (1,0-1,25 ммоль/ммоль диамина) и безводным пиридином (3-5 мл/ммоль диамина). Полученную смесь нагревают до 80 С в течение 30 мин, затем добавляют в одну порцию 1 циклогексил-3-(2-морфолиноэтил)карбодиимид мето-п-толуолсульфонат (1,1-1,35 ммоль/ммоль диамина) в виде твердого вещества. Полученную смесь оставляют перемешиваться при 8090 С в течение 3-20 ч, по истечении этого времени ее оставляют остывать до комнатной температуры. Остальная часть методики такая же,что и в примере X, с тем исключением, что продукт очищают либо хроматографией на силикагеле, либо перекристаллизацией либо из ацетонитрила, либо из 1,4-диоксана.(2-3 мл/ммоль бензимидазола) и N,O-бис (триметилсилил)ацетамидом (1-1,25 ммоль/ммоль бензимидазола) и полученную смесь нагревают до 80 С в течение 30 мин. Добавляют триметилсилилтрифторметансульфонат (0,5-0,7 ммоль/ ммоль бензимидазола) и смесь перемешивают при 80 С в течение дополнительных 15 мин,после чего в одну порцию добавляют 1,2,3,5 тетра-O-ацетил-L-рибофуранозу(1-1,25 ммоль/ммоль бензимидазола) в виде твердого вещества. Полученную смесь перемешивают при 80 С в течение 2-20 ч, после чего ей позволяют охладиться до комнатной температуры. Затем ее разводят 5%-ным водным бикарбонатом натрия (10 мл/ммоль бензимидазола) и дихлорметаном (3-5 мл/ммоль бензимидазола) и двухфазную смесь перемешивают при комнатной температуре в течение 30 мин. Органический слой собирают, водный слой переэкстрагируют дополнительной порцией дихлорметана(3-5 мл/ммоль бензимидазола), объединенные органические слои сушат над сульфатом магния, фильтруют и растворители удаляют при пониженном давлении, используя роторный испаритель. Продукты дополнительно очищают с помощью хроматографии на силикагеле. Общая методика III: снятие защиты с 2(алкиламино)-1-(2,3,5-три-O-ацетил-бета-Lрибофуранозил)-1 Н-бензимидазолов. Соответствующий 2-(алкиламино)-1-(2,3,5 три-O-ацетил-бета-L-рибофуранозил)-1 Нбензимидазол растворяют в этаноле (4-5 мл/ммоль триацетата). В отдельную колбу помещают карбонат натрия (1,0-1,3 ммоль/ммоль триацетата), воду (1-2 мл/ммоль триацетата) и метанол (3 мл/ммоль триацетата). При комнатной температуре суспензию карбоната натрия в одну порцию добавляют к этанольному раствору триацетата. Полученную смесь перемешивают при комнатной температуре в течение 18 ч. Затем смесь разбавляют этилацетатом (25 мл/ммоль триацетата). Органический слой собирают и промывают насыщенным водным рассолом (100 мл/ммоль триацетата), сушат над сульфатом магния, фильтруют и растворители удаляют путем роторного испарения. Продукты дополнительно очищают путем хроматографии на силикагеле. Пример 25. 5,6-Дихлор-2-(изопропиламино)-1 Н-бензимидазол. 5,6-Дихлор-1,2-фенилендиамин (200,0 г,1,13 моль), изопропилизотиоцианат (122,0 г,1,21 моль), 1-циклогексил-3-(2-морфолиноэтил) карбодиимд мето-п-толуолсульфонат (622,0 г,1,47 моль) и пиридин (4 л) используют согласно общей процедуре I. Продукт перекристаллизовывают из ацетонитрила, получая 184 г (67%) 36 коричневого твердого вещества. Аналитические данные согласуются с приведенными выше. Пример 26. 2-(Циклопропиламино)-5,6 дихлор-1 Н-бензимидазол. 4,5-Дихлор-1,2-фенилендиамин (6,04 г,34,1 моль), циклопропилизотиоцианат (3,69 г,37,2 ммоль), 1-циклогексил-3-(2-морфолиноэтил)карбодиимд мето-п-толуолсульфонат (20,1 г, 47,4 ммоль) и пиридин (135 мл) используют согласно общей методике I. Продукт перекристаллизовывают из ацетонитрила, получая 5,82 г(70%) желтого твердого вещества; т.пл. 223225 С. Анал. рассчитано для C10H9Cl2N3: С, 49.61; Н, 3.75; N, 17.36. Найдено: С, 49.53; Н, 3.78; N, 17.12. Пример 27. 2,3,4-Трихлор-6-нитроанилин. 4,5-Дихлор-2-нитроанилин (15,2 г, 73,2 ммоль), N-хлорсукцинимид (12,2 г, 91,6 ммоль) и N,N-диметилформамид (150 мл) объединяют и полученный оранжевый раствор нагревают при 100 С в течение 1 ч. Раствору позволяют охладиться до комнатной температуры и выливают в колбу, содержащую смесь воды со льдом (1,2 л). Собирают желтое твердое вещество и растворяют его в дихлорметане (1,5 л), получая 2 фазы. Органический слой собирают и сушат над сульфатом магния, фильтруют и растворители удаляют при пониженном давлении путем роторного выпаривания, получая 17,6 г (98%) желтого твердого вещества. МС (Cl): m/z 239. Пример 28. 3,4,5-Трихлор-1,2-фенилендиамин. Объединяют 6-нитро-2,3,4-трихлоранилин(17,6 г, 72,8 ммоль), порошок железа (14,0 г, 250 ммоль) и этанол (400 мл) и полученную суспензию охлаждают до 0 С. Через 15 мин по каплям добавляют концентрированную соляную кислоту (37%, 93 мл, 1,14 моль) с помощью капельной воронки. После завершения добавления полученную суспензию кипятят с обратным холодильником в течение 3,5 ч, после чего позволяют охладиться до комнатной температуры и затем разбавляют водой (2 л). Доводят рН смеси примерно до 8 путем медленного добавления карбоната натрия. Продукт экстрагируют этилацетатом (2 л), сушат над сульфатом магния и удаляют растворители при пониженном давлении путем роторного выпаривания. Продукт дополнительно очищают путем хроматографии на силикагеле, используя смесь 65:35 гексан/этилацетат, получая 10,9 г (72%) желтоватокоричневого твердого вещества; т.пл. 113115 С. Анал. рассч. для С 6 Н 5 Сl3N2: С, 34.08; Н,2.38; N, 13.25. Найдено: С, 34.14; Н, 2.41; N. 13.18. Пример 29. 2-(Изопропиламино)-4,5,6 трихлор-1-Н-бензимидазол. 3,4,5-трихлор-1,2-фенилендиамин (3,12 г,14,8 ммоль), изопропилизотиоцианат (1,62 г,16,0 ммоль),1-циклогексил-3-(2-морфоли 37 ноэтил)карбодиимид мето-п-толуолсульфонат(8,4 г, 19,9 ммоль) и пиридин (50 мл) используют согласно общей методике II. Продукт перекристаллизовывают из 1,4-диоксана, получая 2,9 г (72%) желтовато-коричневого твердого вещества. МС (Cl): m/z 276 (М+1). Анал. рассч. для С 10 Н 10 Сl3N3(0.10 С 4 Н 8O2): С, 43.47; Н, 3.79; N, 14.62. Найдено: С, 43.70; Н, 3.89; N, 14.43. Пример 30. 2-(Изопропиламино)-4,5,6 трихлор-1-(2,3,5-три-O-ацетил-бета-L-(рибофуранозил)-1 Н-бензимидазол. 2-(Изопропиламино)-4,5,6-трихлор-1-Нбензимидазол (1,15 г, 4,00 ммоль), N,O-бис(0,5 мл, 0,58 г, 2,59 ммоль), 1,2,3,5-тетра-Oацетил-L-рибофуранозид (1,50 г, 4,71 ммоль) и 1,2-дихлорэтан (10 мл) используют согласно общей методике II. Продукт выделяют путем хроматографии на силикагеле, применяя смесь 60:1 дихлорметан/метанол, получая 1,05 г (49%) желтой пены. МС (Cl): m/z 536 (М+1). Пример 31. 2-(Изопропиламино)-4,5,6-трихлор-1-(бета-L-рибофуранозил)-1 Н-бензимидазол. 2-(Изопропиламино)-4,5,6-трихлор-1(2,3,5-три-O-ацетил-бета-L-(рибофуранозил)1 Н-бензимидазол (1,00 г, 1,86 ммоль), карбонат натрия (0,26 г, 2,45 ммоль), воду (4 мл), метанол(6 мл) и этанол (8 мл) используют согласно общей методике III. Продукт очищают путем хроматографии на силикагеле, применяя смесь 10:1 дихлорметан/метанол, получая 0,57 г (75%) белого порошка; т.пл. 223-224 С. Анал. рассч. для С 15 Н 18 Сl3N3 О 4: С, 43.87; Н, 4.42; N, 10.23. Найдено: С, 43.63; Н, 4.55; N, 9.98. Пример 32. 2-(Цикпопропиламино)-4,5,6 трихлор-1 Н-бензимидазол. 3,4,5-Трихлор-1,2-фенилендиамин (3,02 г,14,28 ммоль), циклопропилизотиоцианат (1,53 г,15,42 ммоль), 1-циклогексил-3-(2-морфолиноэтил)карбодиимид мето-п-толуолсульфонат(8,24 г, 19,45 ммоль) и пиридин (55 мл) используют согласно общей методике I. Продукт перекристаллизовывают из 1,4-диоксана, получая 3,29 г (83%) белого твердого вещества. МС (Cl): 38 ацетил-L-рибофуранозу (1,70 г, 5,34 ммоль) и 1,2-дихлорэтан (12 мл) используют согласно общей методике II. Продукт очищают путем хроматографии на силикагеле, используя смесь 60:1 дихлорметан/метанол, получая 1,11 г (52%) желтой пены. МС (Cl): m/z 534 (М+1). Пример 34. 2-(Циклопропиламино)-4,5,6 трихлор-1-(бета-L-рибофуранозил)-1 Н-бензимидазол. 2-(Циклопропиламино)-4,5,6-трихлор-1(2,3,5-три-O-ацетил-бета-L-рибофуранозил)-1 Нбензимидазол (1,11 г, 2,08 ммоль), карбонат натрия (0,29 г, 2,77 ммоль), воду (4 мл), метанол (6 мл) и этанол (8 мл) используют согласно общей методике III. Продукт очищают путем хроматографии на силикагеле, используя смесь 10:1 дихлорметан/метанол, получая 0,47 г (56%) белого порошка; т.пл. 208-209 С. Анал. рассч. для С 15 Н 16 Сl3N3O4: С, 44.09; Н, 3.95; N, 10.28. Найдено: С, 44.14; Н, 3.98; N, 10.18. Пример 35. 2-Бром-3,4-дихлор-6-нитроанилин. 4,5-Дихлор-2-нитроанилин (41,0 г, 198 ммоль), N-бромсукцинимид (42,86 г, 241 ммоль) и N,N-диметилформамид объединяют и нагревают до 100 С в течение 1 ч. Смеси позволяют охладиться до комнатной температуры и выливают ее в колбу, содержащую смесь воды со льдом (1 л). Желтое твердое вещество собирают и растворяют в дихлорметане (2 л), получая 2 фазы. Органический слой собирают и сушат над сульфатом магния, фильтруют и растворители удаляют при пониженном давлении, используя роторный испаритель, получая 48,62 г (86%) коричневого твердого вещества. Анал. рассч. для С 6 Н 3 ВrСl2N2O2: С, 25.21; Н, 1.06; N, 9.80. Найдено: С, 25.32; Н, 1.13; N, 9.68. Пример 36. 3-Бром-4,5-дихлор-1,2-фенилендиамин. 2-Бром-3,4-дихлор-6-нитроанилин (48,3 г,168,9 ммоль), порошок железа (30,0 г, 537,2 ммоль) и этанол (1 л) объединяют и полученную суспензию охлаждают до 0 С. Затем в течение 15 мин по каплям добавляют концентрированную соляную кислоту (37%, 193,0 мл, 2,36 моль) при помощи капельной воронки. Полученную смесь кипятят с обратным холодильником 1 ч,после чего ей позволяют охладиться до комнатной температуры. Смесь разбавляют водой (1.5 л) и доводят рН примерно до 8 путем добавления карбоната натрия. Продукт экстрагируют этилацетатом (1 л), сушат над сульфатом магния, фильтруют и растворители удаляют при пониженном давлении, применяя роторный испаритель. Продукт кристаллизуют из смеси метанол/вода, получая 34,21 г (79%) коричневого твердого вещества; т.пл. 128-129 С. Анал. рассч. для C6H5BrCl2N2: С, 28.16; Н,1.97; N, 10.95. Найдено: С, 28.29; Н, 1.96; N, 10.79.(11,2 г, 110,5 ммоль), 1-циклогексил-3-(2-морфолиноэтил)карбодиимид мето-п-толуолсульфонат (56,8 г, 134,1 ммоль) и пиридин (500 мл) используют согласно общей методике I. Продукт выделяют с помощью хроматографии на силикагеле,применяя смесь 7:3 гексан:этилацетат, получая 19,2 г (62%) желтоватокоричневого твердого вещества; т.пл. 247249 С. Анал. рассч. для C10H10BrCl2N3(0.08 С 6 Н 14): С, 38.15; Н, 3.40; N, 12.74. Найдено: С, 38.15; Н, 3.39; N, 12.77. Пример 38. 4-Бром-5,6-дихлор-2-(изопропиламино)-1-(2,3,5-три-О-ацетил-бета-L-рибофуранозил)-1 Н-бензимидазол. 4-Бром-5,6-дихлор-2-(изопропиламино)1 Н-бензимидазол (1,33 г, 4,03 ммоль), N,Oбис(триметилсилил)ацетамид (1,0 мл, 0,82 г,4,05 ммоль), триметилсилилтрифторметансульфонат (0,5 мл, 0,58 г, 2,59 ммоль), 1,2,3,5-тетраO-ацетил-L-рибофуранозид (1,69 г, 5,31 ммоль) и 1,2-дихлорэтан (12 мл) применяют согласно общей методике II. Продукт выделяют путем хроматографии на силикагеле, применяя смесь 60:1 дихлорметан/метанол, получая 1,16 г (50%) желтой пены. МС (Cl): m/z (M+1). Пример 39. 4-Бром-5,6-дихлор-2-(изопропиламино)-1-(бета-L-рибосруранозил)-1 Н-бензимидазол. 4-Бром-5,6-дихлор-2-(изопропиламино)-1(2,3,5-три-O-ацетил-бета-L-рибофуранозил)-1 Нбензимидазол (1,16 г, 2,0 ммоль), карбонат натрия (0,28 г, 2,64 ммоль), воду (4 мл), метанол (6 мл) и этанол (8 мл) применяют согласно общей методике III. Продукт очищают путем хроматографии на силикагеле, применяя смесь 10:1 дихлорметан/метанол, получая 0,64 г (70%) белого порошка; т.пл. 221-222 С. Анал. рассч. для С 15 Н 18 ВrСl2N3 О 4: С, 39.59; Н, 3.99; N, 9.23. Найдено: С, 39.42; Н, 4.20; N, 9.05. Пример 40. 4-Бром-2-(циклопропиламино)5,6-дихлор-1 Н-бензимидазол. 3-Бром-4,5-дихлор-1,2-фенилендиамин(2,18 г, 21,98 ммоль), 1-циклогексил-3-(2 морфолиноэтил)карбодиимид мето-п-толуолсульфонат (11,0 г, 25,97 ммоль) и пиридин (75 мл) используют согласно общей методике I. Продукт перекристаллизовывают из 1,4 диоксана, получая 2,23 г (53%) грязно-белого твердого вещества. МС (Cl): m/z 319 а.е.м. Анал. рассч. для С 10 Н 8 ВrСl2N3(0.35 С 4 Н 8O2: С, 38.92; Н, 3.09; N, 11.94. Найдено: С, 39.17; Н, 3.05; N, 11.94. 40 Пример 41. 4-Бром-2-(циклопропиламино)5,6-дихлор-1-(2,3,5-три-O-ацетил-бета-L-рибофуранозил)-1 Н-бензимидазол. 4-Бром-2-(циклопропиламино)-5,6-дихлор 1 Н-бензимидазол (1,40 г, 3,98 ммоль), N,Oбис(триметилсилил)ацетамид (1,0 мл, 0,82 г,4,05 ммоль), триметилсилилтрифторметансульфонат (0,5 мл, 0,58 г, 2,59 ммоль), 1,2,3,5-тетраO-ацетил-L-рибофуранозид (1,68 г, 5,28 ммоль) и 1,2-дихлорэтан (12 мл) используют согласно общей методике II. Продукт очищают путем хроматографии на силикагеле, используя смесь 60:1 дихлорметан/метанол, получая 1,01 г (45%) желтой пены. МС (Cl): m/z 578 (М+1). Пример 42. 4-Бром-2-(циклопропиламино)5,6-дихлор-1-(бета-L-рибофуранозил)-1 Н-бензимидазол. 4-Бром-2-(циклопропиламино)-5,6-дихлор 1-(2,3,5-три-O-ацетил-бета-L-рибофуранозил)1 Н-бензимидазол (1,01 г, 1,74 ммоль), карбонат натрия (0,265 г, 2,50 ммоль), воду (4 мл), метанол (5 мл) и этанол (8 мл) используют согласно общей методике III. Продукт очищают путем хроматографии на силикагеле, используя смесь 10:1 дихлорметан/метанол, получая 0,28 г (36%) белого твердого вещества: т.пл. 205-208 С. Анал. рассч. для C15H16Cl2BrN3O4(0.25 С 4 Н 7O2): С, 40.45; Н, 3.82; N, 8.84. Найдено: С, 40.38; Н. 3.95; N, 8.90. Пример 43. 4,5-Дифтор-1,2-фенилендиамин. В склянку Парра помещают 4,5-дифтор-2 нитроанилин (5,00 г, 28,72 ммоль), оксид платины (IV) (0,31 г, 1,13 ммоль) и метанол (60 мл). Склянку три раза продувают струeй водорода и в конце доводят давление до 45 psi водородом. Колбу качают 5 ч, после чего сбрасывают давление и содержимое выливают в делительную воронку, содержащую этилацетат (300 мл) и воду (300 мл). Органический слой собирают и промывают насыщенным водным соляным раствором (100 мл), сушат над сульфатом магния и растворители удаляют при пониженном давлении с использованием роторного испарителя,получая 3,37 Г (81%) коричневого твердого вещества. МС (Cl): m/z 145 (М+1). Пример 44. 5,6-Дифтор-2-(изопропиламино)-1 Н-бензимидазол. 4,5-Дифтор-1,2-фенилендиамин (2,87 г,19,91 ммоль), изопропилизотиоцианат (2,19 г,21,65 ммоль), 1-циклогексил-3-(2-морфолиноэтил)карбодиимид мето-п-толуолсульфонат(11,38 г, 26,87 ммоль) и пиридин (75 мл) используют согласно общему методу I. Продукт перекристаллизовывают из 1,4-диоксана, получая 2,23 г (53%) белого твердого вещества; т.пл. 188-189 С. Анал. рассч. для С 10 Н 11F2N3: С, 56.87; Н,5.25; N, 19.89. Найдено: С, 56.95; Н, 5.25; N, 19.98. 41 Пример 45. 5,6-Дифтор-2-(изопропиламино)-1-(2,3,5-три-O-ацетил-бета-L-рибофуранозил)-1 Н-бензимидазол. 5,6-Дифтор-2-(изопропиламино)-1 Н-бензимидазол (0,84 г, 4,00 ммоль), N,O-бис (триметилсилил)ацетамид (0,70 мл, 0,58 г, 2,83 ммоль),триметилсилилтрифторметансульфонат (0,5 мл,0,58 г, 2.60 ммоль), 1,2,3,5-тетра-O-ацетил-Lрибофуранозид (1,50 г, 4,71 ммоль) и 1,2 дихлорэтан (9 мл) используют согласно общей методике II. Продукт очищают путем хроматографии на силикагеле, используя смесь 35:1 дихлорметан/метанол, получая 1,33 г (70%) желтой пены. МС (Cl): m/z 470 (М+1). Пример 46. 5,6-Дифтор-2-(изопропиламино)-1-(бета-L-рибофуранозил)-1 Н-бензимидазол. 5,6-Дифтор-2-(изопропиламино)-1-(2,3,5 три-O-ацетил-бета-L-рибофуранозил)-1 Н-бензимидазол (1,33 г, 2,83 ммоль), карбонат натрия(0,31 г, 2,92 ммоль), воду (5 мл), метанол (10 мл) и этанол (15 мл) используют согласно общей методике II. Продукт очищают путем хроматографии на силикагеле, используя смесь 10:1 дихлорметан/метанол, получая 0,52 г (53%) белого твердого вещества; т.пл. 156-158 С. Анал. рассч. для C15H19F2N3O4: С, 52.48; Н,5.58; N, 12.24. Найдено: С, 52.23; Н, 5.63; N, 12.15. Пример 47. 3-Хлор-1,2-фенилендиамин. 2-Хлор-6-нитроанилин (14,10 г, 81,71 ммоль), никель Ренея (5,02 г 50%-ной суспензии в воде) и этанол (200 мл) объединяют в автоклаве, давление которого доводят водородом до 150 пси. Полученную смесь оставляют стоять в течение ночи при комнатной температуре. Затем смесь фильтруют через слой броунмиллерита,который последовательно промывают несколькими порциями метанола, и растворители удаляют роторным испарением, получая 10,43 г(89%) вязкого, коричневого масла, которое темнеет при стоянии. МС (EI): m/z 143.1 (М+Н). Пример 48. 4-Хлор-2-(изопропиламино)1 Н-бензимидазол. 3-Хлор-1,2-фенилендиамин (6,41 г, 44,95 ммоль), изопропилизотиоцианат (5,20 г, 51,6 ммоль),1-циклогексил-3-(2-морфолиноэтил) карбодиимид мето-п-толуолсульфонат (25,0 г,59,02 ммоль) и пиридин (300 мл) используют согласно общей методике I. Продукт перекристаллизовывают из 1,4-диоксана, получая 5,45 г 42 силил)ацетамид (3,00 мл, 2,47 г, 12,14 ммоль),триметилсилилтрифторметансульфонат (1,2 мл. 1,42 г, 6,00 ммоль), 1,2,3,5-тетра-O-ацетил-Lрибофуранозу (4,46 г, 14,01 ммоль) и 1,2 дихлорэтан (35 мл) используют согласно общей методике II. Продукт очищают путем хроматографии на силикагеле, используя смесь 95:5 дихлорметан/ацетонитрил, получая 2,34 г (47%) грязно-белой пены. МС (EI): m/z 468.2 (М+Н). Пример 50. 4-Хлор-2-(изопропиламино)-1(бета-L-рибофуранозил)-1 Н-бензимидазол. 4-Хлор-2-(изопропиламино)-1-(2,3,5-триO-ацетил-бета-L-рибофуранозил)-1 Н-бензимидазол (2,24 г, 4,79 ммоль), карбонат натрия (0,67 г, 6,32 ммоль), воду (7 мл), метанол (14 мл) и этанол (20 мл) используют согласно общей методике III. Продукт очищают путем хроматографии на силикагеле, используя смесь 10:1 дихлорметан/метанол, получая 1,12 г (68%) белого твердого вещества: т.пл. 225-227 С. Анал. рассч. для С 15 Н 20ClN3 О 4: С, 52.77; Н,5.91; N, 12.32. Найдено: С, 52.79; Н, 5.96; N, 12.25. Пример 51. 4,6-Дихлор-2-(изопропиламино)-1 Н-бензимидазол. 3,5-Дихлор-1,2-фенилендиамин (1,30 г,7,32 ммоль), изопропилизотиоцианат (0,81 г. 8,00 ммоль), 1-циклогексил-3-(2-морфолиноэтил)карбодиимид мето-п-толуолсульфонат(4,19 г, 9,89 ммоль) и пиридин (25 мл) используют согласно общей методике I. Продукт перекристаллизовывают из 1,4-диоксана, получая 1,07 г (60%) белого твердого вещества. Анал. рассч. для С 10 Н 11 Сl2N3(0.25 С 4 Н 8O2): С, 49.64; Н, 4.92; N, 15.79. Найдено: С, 49.54; Н, 4.94; N, 15.79. Пример 52. 4,6-Дихлор-2-(изопропиламино)-1-(2,3,5-три-O-ацетил-L-рибофуранозил)-1 Н-бензимидазол. 4,6-Дихлор-2-(изопропиламино)-1 Н-бензимидазол (0,83 г, 3,40 ммоль), N,O-бис (триметилсилил)ацетамид (0,88 мл, 0,72 г, 3,56 ммоль),триметилсилилтрифторметансульфонат(0,43 мл, 0,49 г, 2,20 ммоль), 1,2,3,5-тетра-O-ацетилрибофуранозу (1,31 г, 4,12 ммоль) и 1,2 дихлорэтан (10 мл) используют согласно общей методике II. Продукт очищают путем хроматографии на силикагеле, используя смесь 60:1 дихлорметан/метанол, получая 0,63 г (37%) белой пены. МС (Cl): m/z 502.1 (М+Н). Пример 53. 4,6-Дихлор-2-(изопропиламино)-1-(бета-L-рибофуранозил)-1 Н-бензимидазол. 4,6-Дихлор-2-(изопропиламино)-1-(2,3,5 три-O-ацетил-бета-L-рибофуранозил)-1 Н-бензимидазол (0,63 г, 1,26 ммоль), карбонат натрия(0,19 г, 1,82 ммоль), воду (3 мл), метанол (4 мл) и этанол (6 мл) используют согласно общей методике III. Продукт очищают путем хроматографии на силикагеле, используя смесь 10:1 дихлорметан/метанол, получая 0,33 г (70%) белого твердого вещества: т.пл. 212-214 С.al. (Journal of Organic chemistry, 1990, 55, 4683 методом, объединяют с пиридином (150 мл). При комнатной температуре добавляют 4 диметиламинопиридин (0,20 г, 1,67 ммоль) и уксусный ангидрид (23,61 мл, 25,50 г, 249,52 ммоль) и смесь перемешивают в течение 3 ч. Затем ее выливают в колбу, содержащую насыщенный водный раствор бикарбоната натрия(500 мл) и растворители удаляют при пониженном давлении с использованием роторного испарителя. Оставшийся остаток растворяют в этилацетате (500 мл), промывают 0,1 Н соляной кислотой (200 мл) и растворители снова удаляют при пониженном давлении. Продукт очищают путем хроматографии на силикагеле, используя смесь 3:1 гексан/этилацетат, получая 4,35 г (42%) желтого масла. Анал. рассч. для С 10 Н 14O7: С, 48.78; Н,5,73. Найдено: С, 49.14; Н, 5.85. Пример 55. 5,6-Дихлор-2-(изопропиламино)-1-(2.3-ди-O-ацетил-бета-L-эритропентофуранозил)-1 Н-бензимидазол. 5,6-Дихлор-2-(изопропиламино)-1 Н-бензимидазол (1,00 г, 4,09 ммоль), N,O-бис (триметилсилил)ацетамид (1,06 мл, 0,87 г, 4,29 ммоль),триметилсилилтрифторметансульфонат(0,51 мл,0,59 г, 2,66 ммоль), 1,2,3-три-O-ацетил-Lэритропентофуранозид (1,10 г, 4,49 ммоль) и 1,2-дихлорэтан (25 мл) используют согласно общей методике II. Продукт очищают путем хроматографии на силикагеле, используя смесь 30:1 дихлорметан/метанол, получая 0,45 г (26%) коричневого твердого вещества; т.пл. 59-63 С. МС (Cl): m/z 430 (M+1). Пример 56. 5,6-Дихлор-2-(изопропиламино)-1-(бета-L-эритропентофуранозил)-1 Нбензимидазол. 5,6-Дихлор-2-(изопропиламино)-1-(2,3-диO-ацетил-бета-L-эритропентофуранозил)-1 Нбензимидазол (0,34 г, 0,79 ммоль), карбонат натрия (0,13 г, 1,23 ммоль), воду (3 мл), метанол (3 мл) и этанол (10 мл) используют согласно общей методике III. После удаления растворителей при пониженном давлении устанавливают,что материал (0,17 г, 63%) является аналитически чистым и не требующим дополнительной очистки; т.пл. 180-181 С. Анал. рассч. для С 14 Н 17 Сl2N3 О 3: С, 48.57; Н, 4.95; N, 12.14. Найдено: С, 48.33; Н, 4.89; N, 11.97. Пример 57. 2-(Изопропиламино)-4,5,6 трихлор-1-(2,3-ди-O-ацетил-бета-L-эритропентофуранозил)-1 Н-бензимидазол. 44 2-(Изопропиламино)-4,5,6-трихлор-1 Нбензимидазол (0,86 г, 3,10 ммоль), N,Oбис(триметилсилил)ацетамид (0,80 мл, 0,66 г,3.26 ммоль), триметилсилилтрифторметансульфонат (0,39 мл, 0,45 г, 2,01 ммоль), 1,2,3-три-Oацетил-L-эритропентофуранозид (0,84 г, 3,41 ммоль) и 1,2-дихлорэтан (25 мл) используют согласно общей методике II. Продукт очищают путем хроматографии на силикагеле, используя смесь 60:1 дихлорметан/метанол, получая 0,28 г(0,05 г, 0,12 ммоль), карбонат натрия (0,02 г,0,17 ммоль), воду (3 мл), метанол (3 мл) и этанол (5 мл) используют согласно общей методике III. Продукт очищают, используя смесь 98:2 дихлорметан/метанол, получая 0,04 г (91%) белого твердого вещества: т.пл. 199-200 С (разл.). Анал. рассч. для С 14 Н 16 Сl3N3 О 3: С, 44.32; Н, 4.25; N, 11.08. Найдено: С, 44.34; Н, 4.30; N, 10.89. Пример 59. 3,4-Дихлор-1,2-фенилендиамин. 2,3-Дихлор-6-нитроанилин (20,11 г, 97,14 ммоль), никель Ренея (4,78 г 50%-ной суспензии в воде) и этанол (250 мл) объединяют в автоклаве, давление в котором доводят водородом до 150 пси. Полученную реакционную смесь перемешивают при комнатной температуре в течение ночи. Затем смесь фильтруют через слой броунмиллерита, который последовательно промывают несколькими порциями метанола, и растворители удаляют роторным испарением,получая темно-коричневое твердое вещество. Твердое вещество суспендируют в гексанах и собирают на воронке Бюхнера, получая 16,31 г(25,0, 59,02 ммоль) и пиридин (250 мл) применяют согласно общей методике I. Продукт перекристаллизовывают из 1,4-диоксана, получая 6,12 г (55%) белого твердого вещества. МС (EI): m/z 244 (М+Н). Анал. рассч. для C10H11Cl2N3(0,35 С 4 Н 8O2): С, 49.80; Н, 5.06; N, 15.28. Найдено: С, 49.95; Н, 5.05; N, 15.08. Пример 61. 3,4-Дихлор-2-(изопропиламино)-1-(2,3,5-три-O-ацетил-бета-L-рибофуранозил)-1 Н-бензимидазол. 3,4-Дихлор-2-(изопропиламино)-1 Н-бензимидазол (2,01 г, 7,31 ммоль), N,O-бис (триме 45 тилсилил)ацетамид (2,0 мл, 1,65 г, 8,09 ммоль),триметилсилилтрифторметансульфонат (0,9 мл,1,06 г, 4,50 ммоль), 1,2,3,5-тетра-O-ацетил-бетаL-рибофуранозу (3,03 г, 9,52 ммоль) и 1,2 дихлорэтан (35 мл) используют согласно. общей методике II. Продукт очищают путем хроматографии на силикагеле, используя смесь 95:5 дихлорметан/ацетонитрил, получая 2,08 г (56%) желтой пены. МС (EI): m/z 502.0 (М+Н). Пример 62. 3,4-Дихлор-2-(изопропиламино)-1-(бета-L-рибофуранозил)-1 Н-бензимидазол. 3,4-Дихлор-2-(изопропиламино)-1-(2,3,5 три-O-ацетил-бета-L-рибофуранозил)-1 Н-бензимидазол (2,06 г, 4,10 ммоль), карбонат натрия(0,60 г, 5,66 ммоль), воду (12 мл), метанол (10 мл) и этанол (24 мл) используют согласно общей методике III. Продукт очищают путем хроматографии на силикагеле, используя смесь 10:1 дихлорметан/метанол, получая белое твердое вещество. Пример 63. Тест с цитомегаловирусом человека (HCMV).HCMV штамм AD169 выращивают на монослоях человеческих эмбриональных клеток легкого (MRC5 клетки) в 96 луночных планшетах. После инфицирования клеток в соотношении примерно 0,01 инфицирующих вирусных частиц на клетку, добавляют тестируемые соединения в выбранные ячейки в шести различных концентрациях, каждую трижды. Те же концентрации соединения также вносят в лунки,содержащие монослои неинфицированных клеток для того, чтобы оценить цитотоксичность соединения. Планшеты инкубируют в течение 5 дней и устанавливают минимальную цитотоксическую дозу путем микроскопического исследования. ИК 50 для противовирусного действия устанавливают по результатам измерений ДНКHCMV в каждой лунке, осуществляемых путем блоттинга и количественной специфичной ДНК гибридизации аналогично методу Гадлера где R1 представляет собой водород, атом галогена или азидогруппу;-NR8R9, где R8 и R9, которые могут быть одинаковыми или разными, каждый независимо выбран из водорода, гидроксила, С 1-12 алкила,например C1-6 алкила (где алкильная группировка может быть возможно замещена одним или более чем одним заместителем, выбранным из групп: галогено, амино, азидо, гидрокси, циано,NO2, NHR10, SO2R10, SR10, OR10, COR10 и галогеноС 1-6 алкила, где R10 представляет собой C1-6 алкил, С 3-6 алкенил, С 2-6 алкинил или арил), С 2-8 алкенила, C1-6 алкокси, С 3-7 циклоалкила, С 2-8 алкинила, С 3-7 циклоалкенила, С 3-7 циклоалкилС 1-6 алкила, арила, арилС 1-6 алкила, гетероарила, гетероарилС 1-6 алкила, гетероциклила и гетероциклилС 1-6 алкила, либо R8R9 вместе с атомом азота,к которому они присоединены, образуют 3, 4, 5 или 6 членное гетероциклическое кольцо;-NHNR11R12, где R11 и R12, которые могут быть одинаковыми или разными, каждый представляет собой водород или С 1-6 алкил;R2 представляет собой водород или атом галогена;R3 и R4, которые могут быть одинаковыми или разными, каждый представляет собой водород, галоген или NO2;R5 и R6, которые могут быть одинаковыми или разными, каждый представляет собой водород или гидрокси;CH2R13, где R13 может быть выбран из гидрокси,атома галогена и OR14 (где R14 представляет собой водород, C1-8 алкил, арил или арилС 1-6 алкил); при условии, что когда R2 представляет собой водород, R3 и R4 каждый представляет собой хлор-, R5 и R6 представляют собой группу эритрогидрокси и R7 представляет собойCH2OH, тогда R1 представляет собой азидо,-NR8R9, где R8 и R9, которые могут быть одинаковыми или разными, каждый независимо выбран из гидроксила, C1-6 алкила (где алкильная группировка замещена одним или более чем одним заместителем, выбранным из групп: амино, азидо, NO2, NHR10, SO2R10, SR10, OR10, галогеноС 1-6 алкила, где R10 такой, как определено выше), С 7-12 алкила (где алкильная группировка возможно замещена одним или более заместителями, выбранными из групп: галогено, амино,азидо, гидрокси, циано, NO2, NHR10, SO2R10, 47CH2R13, где R13 может быть выбран из гидрокси и OR14 (где R14 представляет собой водород илиC1-6 арил); или их фармацевтически приемлемое производное. 2. Соединение формулы (I) по п.1, в котором сахарная группировка выбрана из следующих:R9, которые могут быть одинаковыми или разными, выбраны из C1-6 алкила или С 3-7 циклоалкила. 4. Соединение формулы (I) по любому из пп.1-3, в которых R2 представляет собой водород или атом галогена. 5. Соединение формулы (I) по любому из пп.1-4, в которых R3 и R4 оба представляют собой атом галогена. 6. Соединение формулы (I) по любому из пп.1-5, в которых R1 представляет собой -NR8R9, 48 где R8 представляет собой водород и R9 представляет собой С 1-6 алкил, R2 представляет собой водород или атом галогена, R3 и R4 оба представляют собой атом галогена и сахарная группировка выбрана из 3'-дезокси-L-рибофуранозила, 5'-дезокси-L-рибофуранозила и 2'-дезокси-L-рибофуранозила, или его фармацевтически приемлемое производное. 7. Соединение формулы (I), выбранное из 4-бром-5,6-дихлор-2-изопроиламино-1(бета-L-рибофуранозил)-1 Н-бензимидазола; 5,6-дихлор-1-(3-дезокси-бета-L-рибофуранозил)-2-изопропиламино-1 Н-бензимидазола; 5,6-дихлор-1-(5-дезокси-бета-L-рибофуранозил)-2-изопропиламино-1 Н-бензимидазола; 5,6-дихлор-1-(бета-L-эритрофуранозил)-2 изопропиламино-1 Н-бензимидазола; 5,6-дихлор-2-изопропиламино-1-(бета-Lксилофуранозил)-1 Н-бензимидазола; 1-(2-дезокси-бета-L-рибофуранозил)-5,6 дихлор-2-изопропиламино-1 Н-бензимидазола; 2-изопропиламино-1-(бета-L-рибофуранозил)-4,5,6-трихлор-1 Н-бензимидазола; 4-бром-2-циклопропиламино-5,6-дихлор-1(бета-L-рибофуранозил)-1 Н-бензимидазола; 2-циклопропиламино-1-(бета-L-рибофуранозил)-4,5,6-трихлор-1 Н-бензимидазола; 4,6-дихлор-2-изопропиламино-1-(бета-Lрибофуранозил)-1 Н-бензимидазола и 1-(бета-L-эритрофуранозил)-2-изопропиламино-4,5,6-трихлор-1 Н-бензимидазола. 8. Фармацевтическая композиция, содержащая соединение формулы (I) по любому из пп.1-7 и его фармацевтически приемлемый эксципиент. 9. Применение соединения формулы (I) по любому из пп.1-7 в медицинской терапии. 10. Применение соединения формулы (I) по любому из пп.1-7 в производстве лекарственного средства для лечения или профилактики вирусных инфекций.
МПК / Метки
МПК: A61K 31/7056, C07H 19/052, A61P 31/20
Метки: вирусных, инфекций, производные, применение, бензимидазола, лечения
Код ссылки
<a href="https://eas.patents.su/25-1770-proizvodnye-benzimidazola-i-ih-primenenie-dlya-lecheniya-virusnyh-infekcijj.html" rel="bookmark" title="База патентов Евразийского Союза">Производные бензимидазола и их применение для лечения вирусных инфекций</a>
Предыдущий патент: Антагонисты рецепторов возбудительной аминокислоты
Следующий патент: Производные хинолин-4-карбоксамида, их получение и их применение в качестве антагонистов рецептора нейрокинина-3 (-к-3) и нейрокинина-2 (-к-2)
Случайный патент: Способ осуществления электромагнитной разведки с управляемым источником с использованием множественных передатчиков





























