Применение неограниченных соматических стволовых клеток (ussc) для получения лекарственного средства
Формула / Реферат
1. Применение неограниченных соматических стволовых клеток (USSC) для получения лекарственного средства для лечения сосудистого заболевания, заболевания сердечной мышцы или гладкой мышцы, заболевания печени, заболевания поджелудочной железы, в частности диабета типа I, заболевания нервной ткани, в частности болезни Паркинсона, или гематологического заболевания, где указанные USSC получены из пуповинной крови или плацентарной крови, причем указаные стволовые клетки обладают следующими свойствами:
(i) негативны по отношению к поверхностным антигенам CD14 и CD45;
(ii) позитивны по отношению к поверхностным антигенам CD13, CD29, CD44 и CD49e;
(iii) позитивны по экспрессии YB1, AML-1, RUNX-1 и фибулина-2; и
(iv) негативны по экспрессии гиалуронансинтазы, фибромодулина и 1NFLS.
2. Применение по п.1, где указанное лекарственное средство дополнительно содержит потомство указанных USSC, дифференцированных in vitro.
Текст
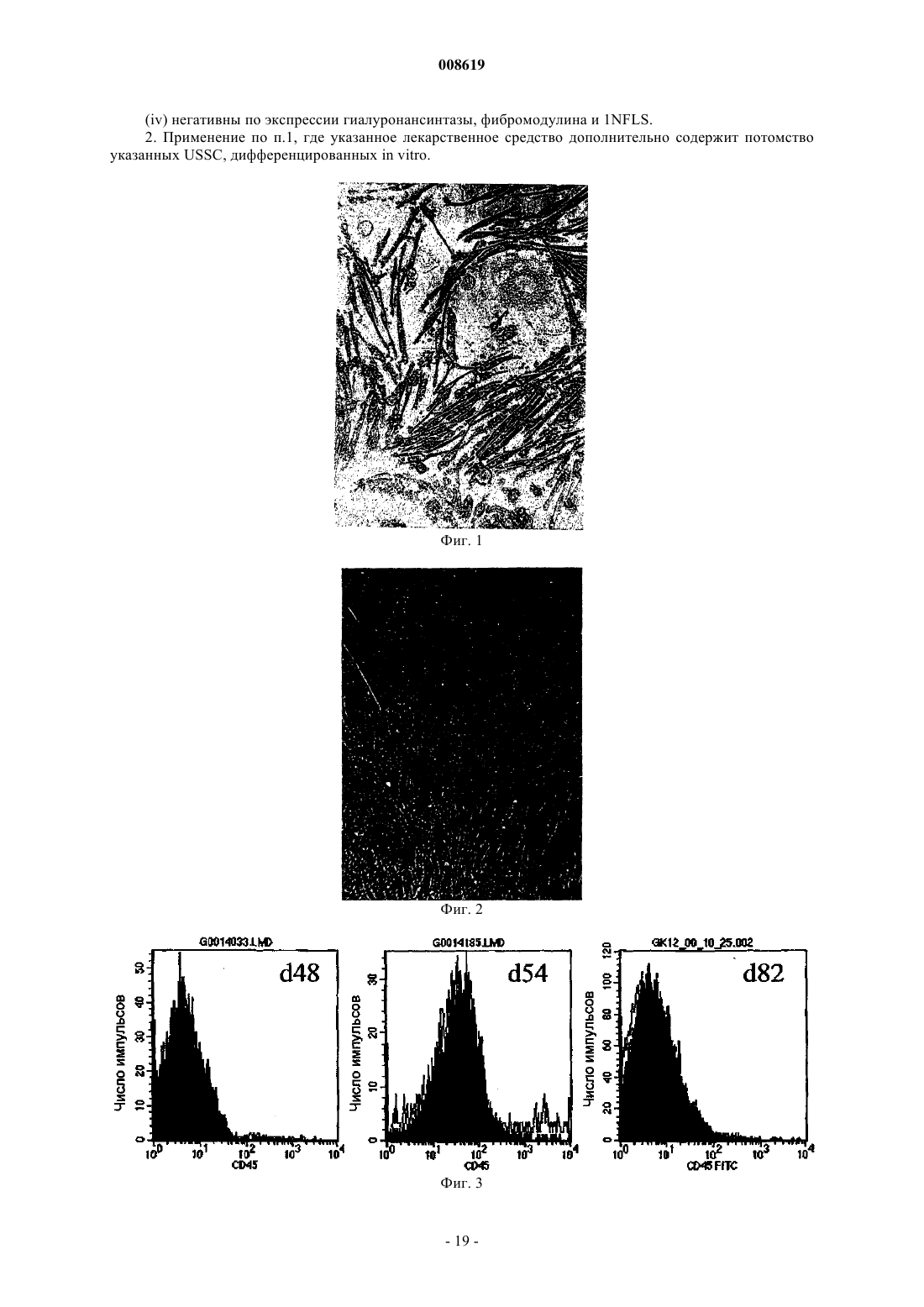
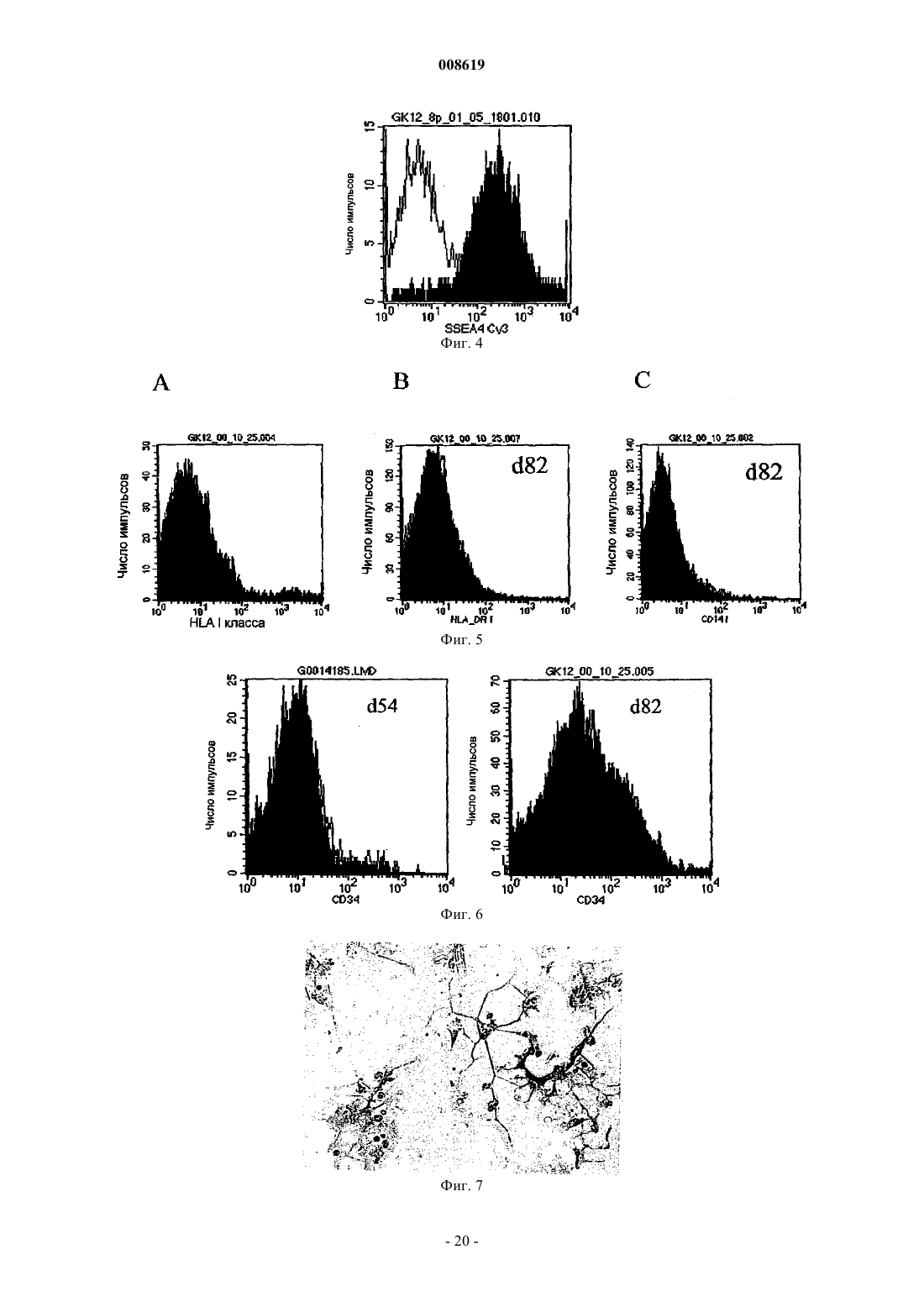
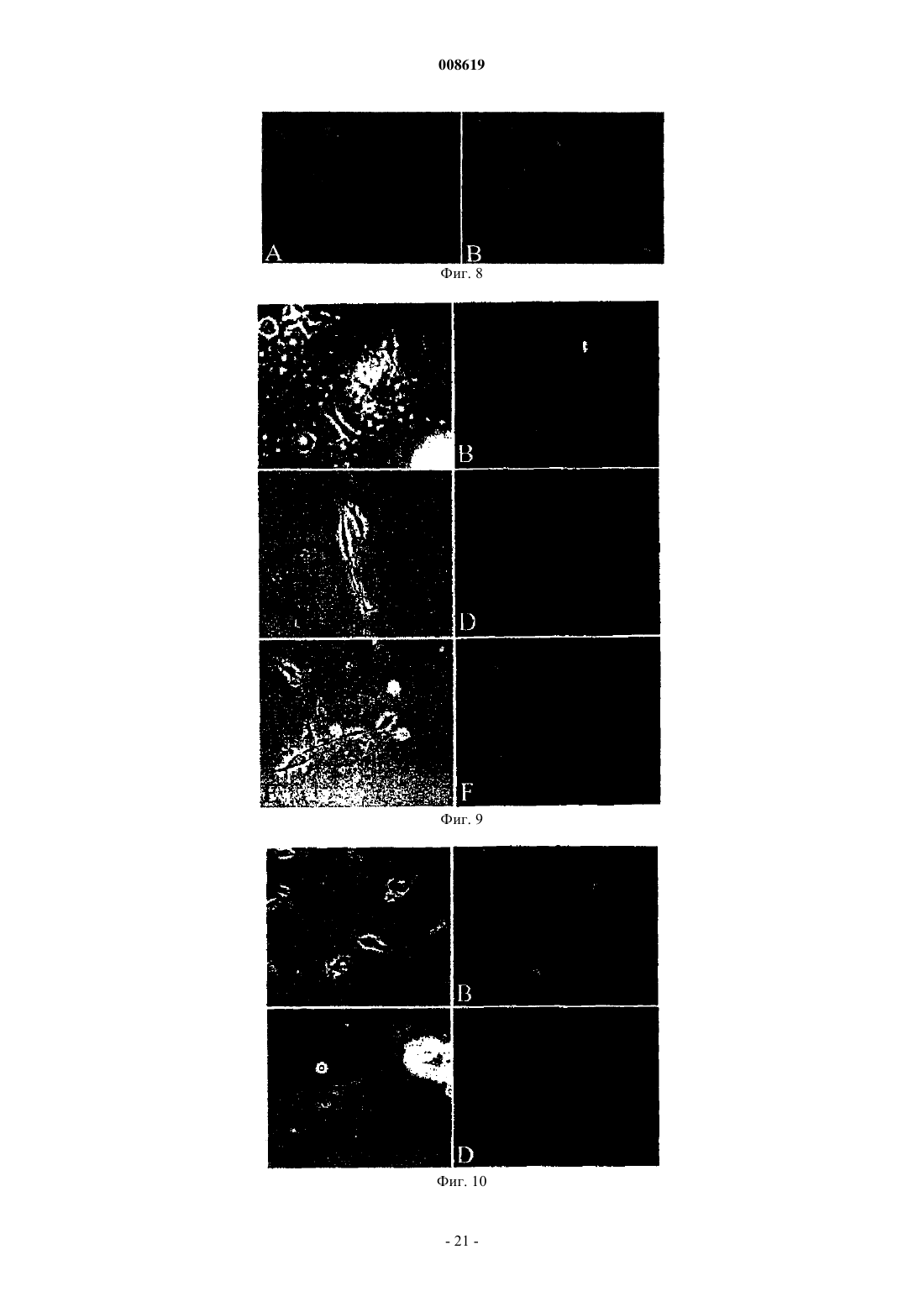
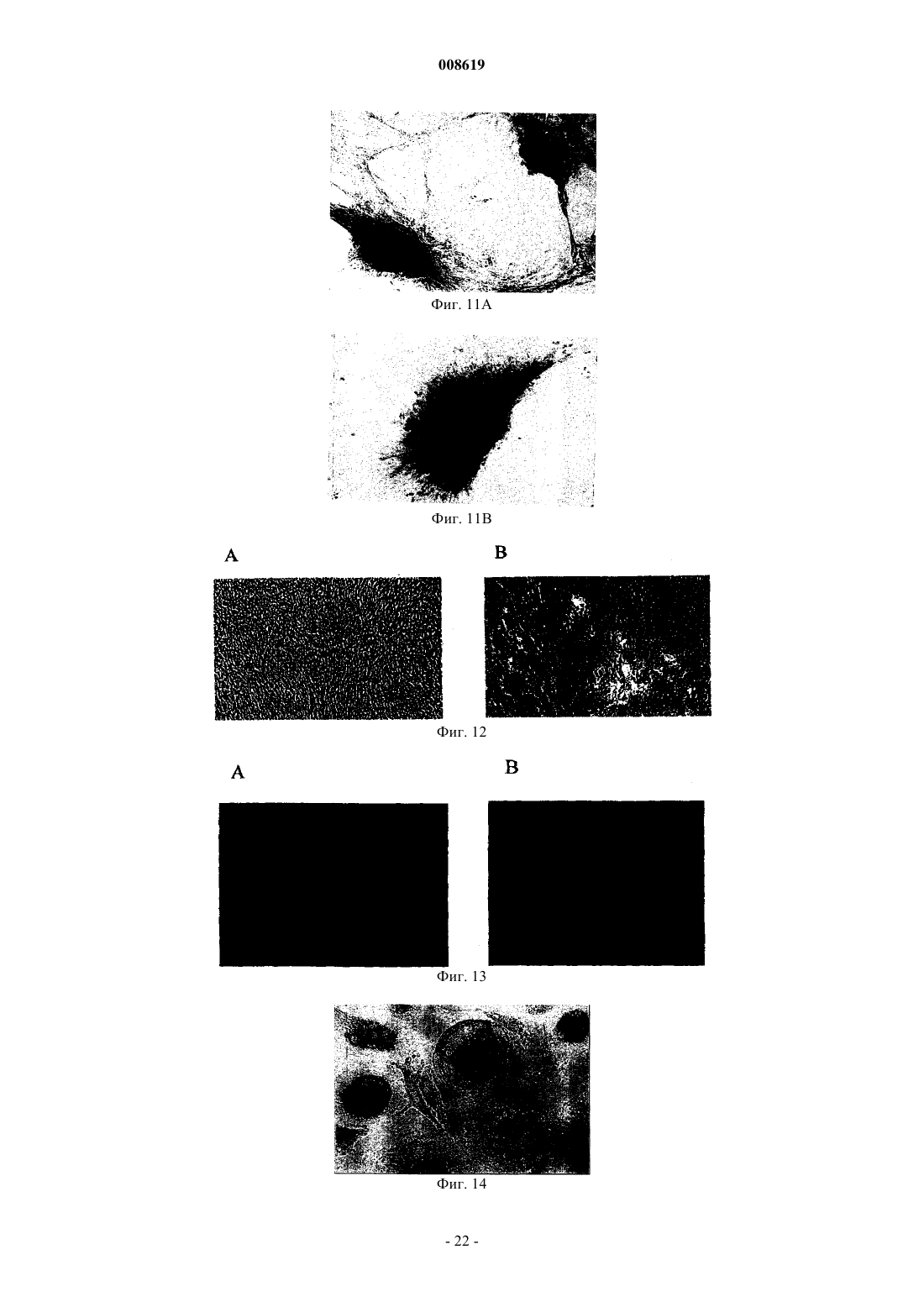
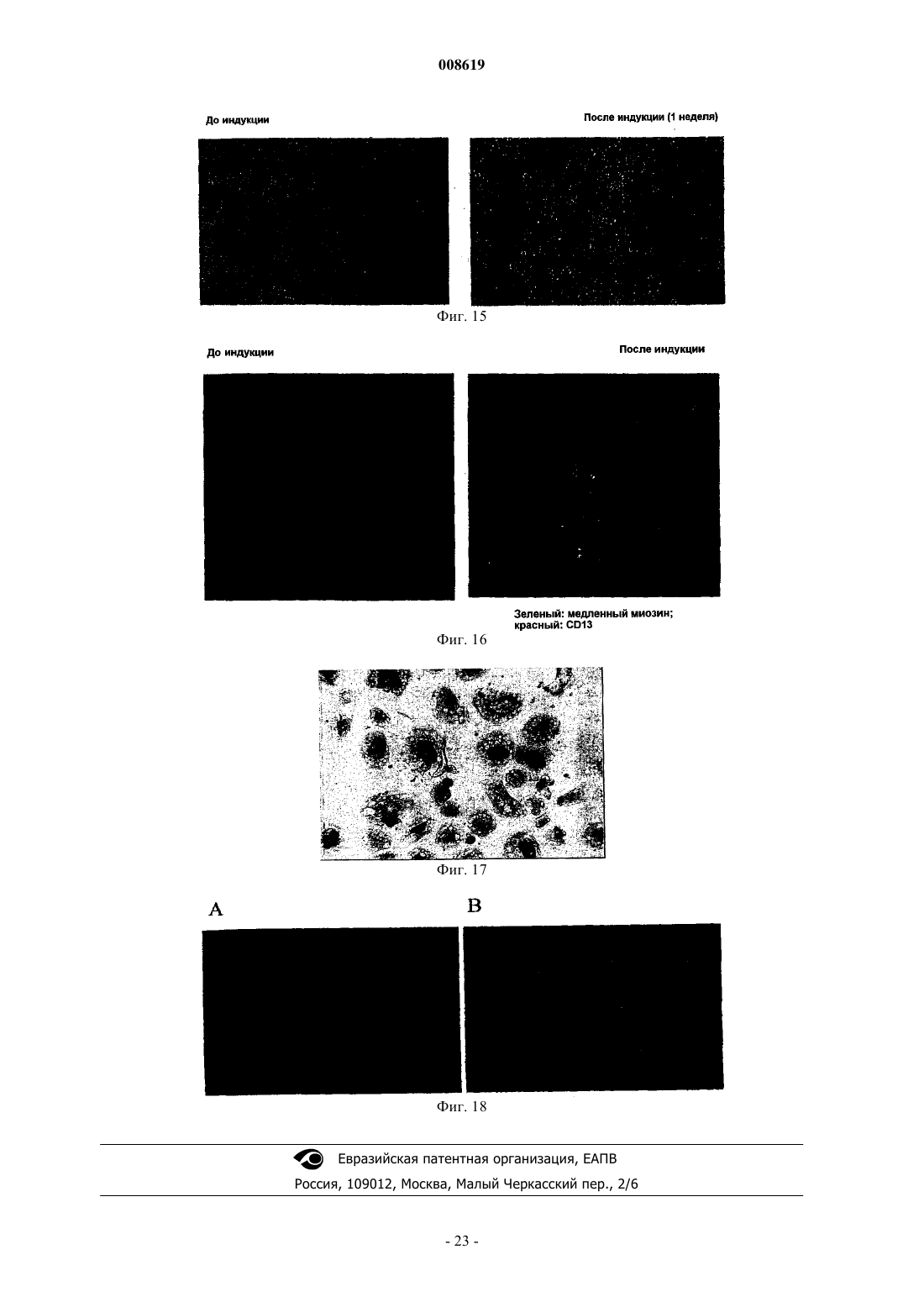
008619 Настоящее изобретение относится к соматической стволовой клетке, лекарственному средству,включающему стволовую клетку по изобретению, и к применению соматической стволовой клетки по изобретению для получения лекарственного средства. Хотя стволовые клетки постоянно самозамещаются, они, в основном, характеризуются медленным циклом. Обычно полагают, что данные клетки дают начало временной размножающейся клеточной популяции с ограниченной способностью к самовозобновлению для увеличения числа дифференцированных клеток. До настоящего времени существовала проблема локализации стволовых клеток в организме взрослого человека, и поэтому применяется некоторое количество суррогатных маркеров (например, тесты образования колоний для гемопоэтического ростка), описанных в существующей литературе. Некоторые патенты США, например патенты США 5486359; 5591625; 5736396; 5811094; 5827740; 5837539; 5908782; 5908784; 5942225; 5965436; 6010696; 6022540; 6087113; 5858390; 5804446; 5846796; 5654186; 6054121; 5827735; 5906934, имеют отношение к мезенхимальным стволовым клеткам (MSC),которые могут дифференцироваться в некоторые клетки-предшественники, например в мышечные клетки-предшественники (прогениторные клетки), клетки-предшественники соединительной ткани или овальные клетки. Мышечные клетки-предшественники далее дифференцируются в сердечные, скелетные, а также гладкомышечные клетки, в то время как клетки-предшественники соединительной ткани могут дифференцироваться в костные, хрящевые, а также жировые клетки. Овальные клетки могут дифференцироваться в клетки печени или поджелудочной железы (Grompe et al., 2001). Наличие в пуповинной крови негемопоэтических стволовых клеток пока является предметом дискуссии(Mayani et al., 2000, Mareschi et al., 2001). Заявка на патент Германии DE 198 03 267 A1 является первым источником, в котором описаны предшественники остеобластов и образование кости из пуповинной крови человека. Однако применение данных мезенхимальных клеток-предшественников предшествующего уровня техники часто ограничено, поскольку они слишком далеко зашли по пути развития, чтобы представлять собой инструмент, который может использоваться для образования органов или тканей. Другими словами, кажется, что они уже слишком детерминированы и специализированы для того, чтобы дать функциональный регенерирующийся орган или ткань. Поэтому целью данного изобретения является предоставление стволовой клетки, которая способна дифференцироваться в разные клетки-предшественники, такие как мезенхимальные клетки, нервные клетки, клетки крови или эндотелиальные клетки. Другой целью изобретения является предоставление стволовой клетки, которая не имеет недостатков эмбриональных стволовых клеток. Было обнаружено, что впервые идентифицированная соматическая стволовая клетка способна удовлетворять сформулированным выше целям. Соматическая стволовая клетка по изобретению получена из пуповинной крови человека, крови плаценты и/или крови новорожденного ребенка, причем указанная соматическая клетка отличается от мезенхимальных стволовых клеток или клеток-предшественников, стволовых клеток или клеток-предшественников гемопоэтического ростка, нервных стволовых клеток или клеток-предшественников или эндотелиальных стволовых клеток или печеночных клетокпредшественников, но способна дифференцироваться в них. Данные клетки представляют собой предшественники гемопоэтического ростка, мезенхимальные стволовые клетки, а также нервные стволовые клетки. Данные уникальные многофункциональные возможности и технология культивирования данных неограниченных соматических стволовых клеток (USSC), полученных из пуповинной крови (СВ), будь то такие соматические стволовые клетки или клетки, детерминированные по различным протоколам дифференцировки, дают возможность для точной характеристики, стандартизации и применения в целях продукции и проведения терапии стволовыми клетками в рамках регенеративной медицины. На фиг. 1 показана микрофотография первичной культуры USSC с клетками, высеянными с низкой плотностью. На фиг. 2 показана микрофотография сливающейся культуры USSC. На фиг. 3 показан FACS-анализ антигена CD45 по ходу культивирования in vitro. На фиг. 4 показан FACS-анализ эмбрионального маркера SSEA4. На фиг. 5 показан FACS-анализ HLA класса I (А, В, С), HLA DR и CD14. На фиг. 6 показана кинетика FACS поверхностного маркера CD34. На фиг. 7 показана микрофотография клеток USSC после нейрональной индукции. На фиг. 8 показано, что USSC по изобретению экспрессируют маркер нервного ствола нестин путем иммунного окрашивания антителами против нестина. На фиг. 9 показаны USSC, генерирующие клетки нейронального ростка. На фиг. 10 показаны USSC, генерирующие клетки глиального ростка. На фиг. 11 показано образование минерализованного узелка после остеогенной индукции и после окрашивания ализарином красным (В). На фиг. 12 показано окрашивание Alcian Blue сферической культуры, происходящей из USSC. На фиг. 13 показано окрашивание коллагена II (зеленое) в культурах USSC после хондрогенной дифференцировки. На фиг. 14 показана адипогенная дифференцировка культур USSC, продемонстрированная окраши-1 008619 ванием Oil Red. На фиг. 15 показаны микрофотографии культур USSC до и после миогенной дифференцировки. На фиг. 16 показан иммуноцитохимический анализ медленно действующего миозина после обработки азацитидином. На фиг. 17 показан фенотип овальных клеток, происходящих от USSC. На фиг. 18 показаны выживание и интеграция культур USSC после инъекции в паренхиму печени мыши SCID. Соматические стволовые клетки по изобретению могут быть выделены и очищены различными способами, включающими стадии выделения в градиенте плотности, культуры прилипающих клеток и субкультуры с применением факторов роста, как описано в примере 1. После установления слияния клеточного слоя процессы выделения полученных клеток по изобретению контролировали традиционными морфологическими методоми (фибробластоидная морфология), а для фенотипического анализа использовали антитела против поверхностных антигенов CD13 (положительный), CD14 (отрицательный), CD45(отрицательный) и CD29 (положительный; см. пример 2). Соматическая стволовая клетка по изобретению не взаимодействует с маркерами, специфичными для гемопоэтического ростка, такими как CD45, и, следовательно, отличается от гемопоэтических стволовых клеток, которые также могут выделяться из пуповинной крови. CD14 представляет собой еще один поверхностный антиген, который не может быть детектирован на USSC. Кроме того, стволовая клетка по данному изобретению характеризуется набором антигенов, которые присутствуют на клеточной поверхности, таких как CD13, CD29, CD44 и CD49e. Препараты USSC дополнительно характеризуются наличием транскриптов мРНК некоторых рецепторных молекул, таких как рецептор эпидермального фактора роста (EGF-R), альфа-рецептор фактора роста, полученного из тромбоцитов (PDGF-RA), рецептор инсулиноподобного фактора роста (IGF-R). Данные клетки также обычно экспрессируют транскрипционные факторы, такие как YB1 (транскрипционный фактор Y-бокса 1), Runx1 (связанный с карликовостью транскрипционный фактор 1) и AML1C (транскрипционный фактор острой миелоидной лейкемии 1), что определено путем RT-PCR. Однако препараты USSC обычно не содержат транскрипты хондрогенного транскрипционного фактора Cart-1 и маркеров нервной ткани, таких как нейрофиламенты, синаптофизин, тирозингидроксилаза (ТН) и глиальный фибриллярный кислый белок (GFAP). Таблица 1 Анализ транскрипционных профилей USSC путем RT-PCR-2 008619 Результаты RT-PCR получали с предсказанными олигонуклеотидными праймерами и с мРНК изUSSC, и, в качестве положительного контроля, с мРНК из других тканей, таких как кость, хрящ, головной мозг или мононуклеарные клетки пуповинной крови. Экспрессию РНК препаратов USSC и выделенных из костного мозга MSC (Caplan, 1991) непосредственно сравнивали путем использования количественных микроматриц Affymetrix GeneChip. Транскрипт гена фибулина-2 (номер генного банка Х 82494) детектировали на высоком уровне экспрессии в USSC, но не детектировали в MSC. Продукция фибулина-2 была ранее продемонстрирована в фибробластах (Pan et al., 1993). При анализе путем нозерн-блоттинга мРНК из различных тканей человека были выявлены обильные транскрипты массой 4,5 тыс.н.п. в сердце, плаценте и тканях яичника(Zhang et al., 1994). Данный белок был локализован на уровне световой микроскопии в человеческих эмбрионах 4-10 недель гестации с использованием поликлональных антител. Фибулин-2 вначале детектировали в нейроэпителии, спинальных ганглиях и периферических нервах (Miosge et al., 1996). В модели на крысах миофибробласты печени крысы (rMF) локализованы совместно с фибулином-2. Данные клетки были локализованы в портальной области, в стенках центральных вен и лишь рассеянно в паренхиме. На ранних стадиях фиброза rMF детектировали внутри развивающихся рубцов. На развернутых стадиях фиброза rMF составляли большинство клеток, локализованных внутри шрама (Knittel et al.,1999). У других экспериментальных животных мышиный белок фибулин-2 экспрессируется в течение эпителиально-мезенхимальной трансформации в матриксе эндокардиального валика в течение развития сердца эмбриона. Фибулин-2 также синтезируется гладкомышечными клетками-предшественниками развивающихся сосудов аортальной дуги и коронарными эндотелиальными клетками, которые берут начало от клеток нервного гребня и эпикардиальных клеток, соответственно (Tsuda et al., 2001). Транскрипты гена гиалуронансинтазы (D84424), гена фибромодулина (U05291) и транскрипт 1NFLS (WO3846) не детектировались в USSC, но имели место на высоком уровне в MSC. Путем анализа нозерн-блоттингом было показано, что гиалуронансинтаза повсеместно экспрессирована в тканях человека (Itano and Kimata, 1996). Продукт данного фермента, гиалуронан, выполняет разнообразные функции, включая заполнение пространства, смазку суставов и предоставления матрикса, сквозь который могут мигрировать клетки (Hall et al., 1995). Фибромодулин является представителем семейства малых интерстициальных протеогликанов. Данный белок характеризуется широким тканевым распределением с наивысшим обилием, наблюдаемым в суставном хряще, сухожилиях и связках (Sztrolovics et al., 1994). Транскрипт 1NFLS был клонирован из фетальной печени человека. Ген CD24 (L33930) экспрессируется на очень низком уровне в USSC по сравнению с его уровнем экспрессии в MSC. CD24 экспрессирован во многих клетках В-ростка и на зрелых гранулоцитах (Van derSchoot et al., 1989). Соматические клетки по данному изобретению отличаются от MSC, что основывается на тканевом источнике, из которого они выделены. Кроме того, USSC характеризуются отсутствием экспрессии человеческого лейкоцитарного антигена I класса (HLA I класса). В отличие от соматических стволовых клеток по данному изобретению, ранее описанные MSC, выделенные из костного мозга и мышечной ткани, экспрессируют на своей клеточной поверхности антиген HLA I класса на очень высоком уровне. Клетка по данному изобретению также экспрессирует стадиоспецифический ранний антиген 4 (SSEA4)(см. фиг. 4). Обычно соматическая стволовая клетка по изобретению характеризуется фибробластоидной формой клетки и пролиферирует по типу прилипания. В предпочтительном осуществлении настоящего изобретения соматическая стволовая клетка по изобретению (USSC) представлена во множестве или в смесях, включающих в себя предшественники других соматических стволовых клеток, например гемопоэтического ростка, предпочтительно экспрессирующих АС 133 и CD34, мезенхимальные соматические стволовые клетки-предшественники, нейрональные соматические стволовые клетки-предшественники или их комбинации. Данное осуществление обладает преимуществом, поскольку оно обладает высоким регенеративным потенциалом, основанным на способности дифференцироваться в другие соматические стволовые клетки или на наличии таких стволовых клеток в предпочтительном осуществлении настоящего изобретения. Предпочтительно мезенхимальные соматические стволовые клетки-предшественники или нейрональные соматические стволовые клетки-предшественники продуцируются путем дифференцировки из стволовой клетки по изобретению. По изобретению предоставляется лекарственное средство (регенеративное терапевтическое средство), включающее в себя соматические стволовые клетки по изобретению, а также множество или смеси соматических стволовых клеток по изобретению. Данное лекарственное средство может, кроме того, содержать носители или добавочные вещества, которые являются приемлемыми в медицинском и фармакологическом смысле. Настоящее изобретение также относится к способу применения USSC или множества или смесей стволовых клеток по изобретению при генной терапии, пересадке органов, тестировании фармацевтического средства, выращивании кровеносных сосудов in vitro, терапии сосудистых, костных заболеваний, при заболеваниях печени, поджелудочной железы и нервных заболеваниях.-3 008619 Например, USSC по настоящему изобретению могут применяться местно на участке, где это необходимо, например, с биоматериалами или без них. В зависимости от вида заболевания подходящим является местное и/или системное введение USSC.USSC могут применяться непосредственно или вместе с фармацевтически приемлемыми носителями или адъювантами. Может быть благоприятным добавление дополнительных веществ, которые способствуют излечению заболеваний. Например, в ортопедических применениях вместе с USSC могут быть добавлены вещества, которые улучшают регенерацию кости. В основном, способы, известные для применения MSC, могут аналогичным образом использоваться для применения USSC. Более того, применение стволовых клеток описано, например, В.Е. Strauer et al.Engl. J. Med. 2000; 343: 230-238. Данные ссылки включены в качестве ссылки. Стволовые клетки по изобретению далее описаны более подробно. Стволовые клетки по изобретению представляют собой прилипающие клетки с фибробластоидной клеточной формой и двумя или тремя ядрышками (см. фиг. 1), полученные после обработки трипсином иEDTA, и при пересеве в подходящие условия культивирования (пример 1) они быстро размножались до сомкнутого состояния с вытянутой в длину морфологией (фиг. 2). На фиг. 1 показана микрофотография первичной культуры USCC. Клетки, высеянные с низкой плотностью, демонстрировали фибробластоидную морфологию USSC. Данные клетки могут легко выращиваться в течение более чем 14 культуральных пассажей. На фиг. 2 показана микрофотография сливающейся культуры USSC. Почти слитый клеточный слой USSC характеризуется параллельной ориентацией клеток. Фенотип поверхностных маркеров первичного слоя прилипающих клеток, а также всех их производных в последующих пассажах является негативным в плане маркера CD45 и остается таковым. На фиг. 3 показан FACS-анализ на предмет антигена CD45 в течение цикла культивирования in vitro. CD45,характеристический для гемопоэтических клеток маркерный антиген, почти не детектируется в USSC из позднейших пассажей (фиг. 3 на 48, 54, 82 сутки). После культивирования in vitro с использованием способа А (пример 1) препараты USSC становятся позитивными в плане стадиоспецифического раннего антигена 4 (SSEA4) и характеризуются гомогенной экспрессией данного эмбрионального маркера. На фиг. 4 показан FACS-анализ эмбрионального маркераSSEA4. Клетки, выращенные по способу А (пример 1), характеризуются сильной экспрессией стадиоспецифического раннего антигена 4 (SSEA4). В то же время культуры USSC являются негативными в плане экспрессии поверхностного антигена HLA I класса (фиг. 5 А), экспрессии антигена HLA-DR (фиг. 5 В), а также являются СD14-негативными (фиг. 5 С). На фиг. 5 показан FACS-анализ на предмет HLA I класса(А, В, С), HLA-DR и CD14. Культуры USSC по изобретению после размножения in vitro являются негативными в плане антигенов HLA I класса (секция А). Данные клетки также являются негативными в плане поверхностных антигенов HLA-DR (секция В) и CD14 (секция С), характерных для антигенпредставляющих клеток (HLA-DR) и моноцитов (CD14). На фиг. 6 показана кинетика FACS для поверхностного маркера CD34. USSC выращивали вH5100/PEI в течение 10 пассажей. В течение данного периода культивирования наблюдали значительное повышение экспрессии антигена CD34. Касательно маркера гемопоэтической стволовой клетки CD34, на фиг. 6 показано, что в пассаже 3 до 54 суток не смогли выявить CD34-позитивные клетки. Наоборот, в седьмом пассаже на 82 сутки появляется новая CD34-позитивная субпопуляция. С другой стороны, если такие CD34- или/и FIK1-позитивные предшественники культивировали со средой, кондиционированной цитокинами, специфичными для гемопоэтической дифференцироваки, развивались типичные смешанные или гемопоэтические колонии предшественников эритроцитов и лейкоцитов (CFU-GM и BFU-E),сравнимые с таковыми для CD45+ гемопоэтических клеток-предшественников (пример 9). С другой стороны, если мононуклеарные клетки пуповинной крови, лишенные CD14, культивировали в среде с высоким содержанием глюкозы, они проявляли типичные характеристики нервных стволовых клеток. На фиг. 7 показана микрофотография клеток USSC после нейронной индукции. USSC по изобретению, культивированные в модифицированной по Дульбекко среде Игла (DMEM) с глюкозой,демонстрировали астроцитоподобную морфологию. На фиг. 7 показан пример таких культивируемых клеток, характеризующихся глиальной морфологией, полученных через 13 суток в культуре (пример 6). После стимуляции размножения с PEI USSC экспрессируют маркер нервных стволовых клеток нестин. Первое наблюдение показало, что окрашивание на нестин слабее выражено после того, как стимулирова-4 008619 ли средствами нейронной индукции, такими как ретиноевая кислота (RA), основной фактор роста фибробластов bFGF и фактор роста нервов(NGF-) (McKay, 1997). На фиг. 8 подробно показаны USSC по изобретению, экспрессирующие маркер нервной стволовой клетки нестин. (A) USSC инкубировали в среде H5100/PEI в течение 7 суток и подвергали стандартному иммуногистохимическому анализу с антителами против нестина. (В) Клетки инкубировали в течение 7 суток в среде H5100/PEI с последующей индукцией RA, bFGF и NGF в Н 5100 в течение 9 суток. Заметьте, что окрашивание нестина снижено по сравнению с клетками, выращиваемыми в условиях (А). При дальнейшем анализе данных клеток также выявлена экспрессия белков, характерных для нервных клеток, таких как -аминомасляная кислота (GABA, фиг. 9 В), тирозингидроксилаза (фиг. 9 В), синаптофизин (фиг. 9D), нейрофиламент (фиг. 9F), или типичных глиальных антигенов, таких как галактоцереброзид (GalC, фиг. 10 В) и глиальный фибриллярный кислый белок (GFAP, фиг. 10D). На фиг. 9 показаны USSC по изобретению, генерирующие клетки нервного ростка. USSC по изобретению выращивали на H5100/PEI в течение 7 суток и выдерживали в течение 27 суток на Н 5100, содержащем RA, bFGF иNGF. После стандартных протоколов фиксации применяли нейронные специфические антитела. (А, С,D) Фазово-контрастные фотографии, (В, D, F) флуоресцентные фотографии тех же препаратов, что в А,С, D. ДНК-краситель DAPI (голубой) применяют для окраски ядра клеток. (В) Фотография двойной флуоресценции с использованием антител против GABA (красные) и антител против тирозингидрокислазы (ТН, зеленые). (D) Окрашивание антителами против синаптофизина (зеленые). (F) Показано специфическое для нейронов окрашивание антителами против нейрофиламентов (красный). Применяли коктейль антител против разных субтипов нейрофиламентов. На фиг. 10 показаны USSC по изобретению,генерирующие клетки глиального ростка. Клетки подвергали тем же культуральным условиям, что показаны для фиг. 9. DAPI является голубым. (А, С) Представление фазово-контрастных фотографий. (В) Те же клетки, что видны на (А), которые подвергались окрашиванию антителами против GalC (красные).(D) Те же клетки, что на (С), окрашенные антителами против глиального фибриллярного кислого белка(GFAP, красные). Если, однако, описанные выше универсальные стволовые клетки берут из любого из пассажей разведения и индуцируют в условиях культивирования с содержанием DAG (дексаметазон, аскорбиновая кислота, -глицеролфосфат) или в среде, содержащей фибронектин, индуцируется дифференцировка по остеогенному пути (пример 3). Как показано в табл. 2, специфичные для кости маркерные гены (щелочная фосфатаза, остеокальцин, коллаген II типа) легко индуцируются и детектируются путем RT-PCR. Таблица 2 Анализ путем RT-PCR во время остеогенной дифференцировки USSC Все три маркерных гена остеогенной дифференцировки характеризуются повышенной экспрессией мРНК на 7 сутки индукции DAG. -актин служит положительным контролем. На фиг. 11 показано формирование минерализованных узелков после остеогенной индукции и после окрашивания ализарином красным (В). Остеогенную дифференцировку почти сливающихся слоевUSSC индуцировали путем добавления дексаметазона, аскорбиновой кислоты и -глицеролфосфата к культуральной среде Н 5100. На 10 сутки стимуляции появились характерные костные узелки (11 А). Минеральное замещение таких узелков может демонстрироваться за счет окрашивания ализарином красным (11 В). При данных условиях остеогенной индукции клетки по изобретению претерпевают полную остеогенную дифференцировку, что продемонстрировано накоплением в отдельных узелках минерализованной кости (фиг. 11 А), которая может окрашиваться ализарином красным (фиг. 11 В). Альтернативно, накопление гидроксиапатита в клеточной культуре может выявляться через 6 дней путем окрашивания по von Kossa. Из данных результатов ясно, что кровь пуповины содержит не выявленную до этого очень раннюю стволовую клетку, которая подлежит размножению до больших количеств. Кроме того, данная клетка может индуцироваться таким образом, что она дифференцируется в MSC и из них в остеобласты, как уже продемонстрировано на фиг. 11 А. После окончательной индукции DAG может быть получена дальнейшая дифференцировка до минерализованных костных узелков, как показано на фиг. 11 В, посредством окрашивания ализарином красным. Клетки по данному изобретению обладают даже большей многосторонностью, что демонстрирует-5 008619 ся хондрогенной дифференцировкой после культивирования в DMEM с высоким содержанием глюкозы,содержащей дексаметазон, пролин, пируват натрия, добавки ITS+, и TGF-1 (Johnstone et al., 1998). На 0 и 14 сутки данных экспериментов по дифференцировке клетки собирали и анализировали путем RT-PCR(табл. 3, пример 4). Таблица 3 Анализ путем RT-PCR во время хондрогенной дифференцировки USSC На 14 сутки хондрогенной стимуляции зкспрессировались три характеристических маркерных гена текущего хондрогенеза. Результаты данных исследований ясно демонстрируют наличие положительной регуляции Cart-1,специфического хондрогенного транскрипционного фактора, через 14 дней после хондрогенной стимуляции. Более того, также положительно регулировались мРНК-транскрипты двух типичных хрящевых внеклеточных белков (коллаген II типа и хондроадгерин). Более того, клетки по данному изобретению явственно продуцировали внеклеточные молекулы протеогликана, типичные для хондроцитарной дифференцировки, что продемонстрировано путем окрашивания Alcian Blue. На фиг. 12 показано окрашивание Alcian Blue происходящей от USSC осадочной культуры. USSC выращивали в седиментационной культуре в среде хондрогенной дифференцировки. Через 6 суток в индукционной среде посредством окрашивания Alcian Blue не было выявлено значимого количества протеогликанов (PG), используемых в качестве характеристических маркеров хондрогенной дифференцировки (секция А). Наоборот, PG легко детектировались при выявлении посредством голубой/зеленой окраски (секция В). Более того, присутствие специфичного для хряща коллагена II типа могло быть продемонстрировано на белковом уровне. Фиг. 13: окрашивание коллаген II типа (зеленое) культур USSC после хондрогенной дифференцировки.USSC культивировали в среде хондрогенной дифференцировки. Экспрессию белка внеклеточного матрикса коллагена II типа на 14 сутки демонстрировали путем флуоресцентной микроскопии с использованием первичного антитела против коллагена II типа и меченного FITC антимышиного вторичного антитела (фиг. 13 В). Дальнейшая многосторонность неограниченной стволовой клетки показана здесь ранее путем дифференцировки таковой в жировые клетки в культуре, размноженной по PEI-протоколу с высокими концентрациями дексаметазона (пример 5). На фиг. 14 показаны жировые клетки, которые могут специфично окрашиваться Oil Red (Sigma). Адипоциты характеризуются высоким содержанием внутриклеточных везикул и специфичным красным окрашиванием Oil Red. Более того, USSC при культивировании в течение 24 ч в Н 5100 с 10 мкМ 5'-азацитидина и впоследствии с 100 нг/мл bFGF демонстрируют ясные признаки мышечной дифференцировки. Изменение клеточной морфологии сопровождается экспрессией миозина длительного действия (фиг. 15 и 16). Кроме того, возникновение и пролиферация типичных овальных клеток регулярно наблюдается в поздних пассажах (фиг. 17) при субклонировании индуцированных PEI USSC из СD34+-субпопуляции,что было показано на фиг. 6 (пример 8). Данные клетки в вариабельной степени зкспрессируют фермент дипептидилпептидазу IV, и это означает, что данные овальные клетки могут далее дифференцироваться в клетки печени. Размноженные in vitro USSC выживают и персистируют после инъекции в регенерирующие печени мышей SCID с 50% частичной гепатэктомией, а также в печенях без гепатэктомии, в то время как полученные из пуповинной крови мононуклеарные клетки невозможно детектировать даже при трансплантации в 25 раз большего количества клеток. На фиг. 18 показано выживание и интеграция культур USSC после инъекции в паренхиму печени мышей SCID. Фиг. 18 А: красная флуоресценция через 7 суток после трансплантации означает выживание и интеграцию человеческих USSC по изобретению, меченных РКН 26, в ткани мышиной печени (без гепатэктомии). После введения выделенных из пуповинной крови мононуклеарных клеток (MNC), наоборот, не наблюдается какой-либо красной флуоресценции, которая бы указывала на интеграцию человеческих MNC. Фиг. 18 В: криосекция ткани мышиной печени, соответствующая А: светопропускающая микрофотография ткани мышиной печени с интегрированными чело-6 008619 веческими USSC. Поскольку предшественник для клеток печени и клеток -островков поджелудочной железы является одним и тем же, такие выделенные из СВ овальные клетки также могут дифференцироваться в продуцирующие инсулин клетки -островка, что делает их подходящим инструментом для клеточной терапии пациентов с диабетом или пациентов с потерей клеток печени. В дополнение к данным очевидным клиническим способам применения любые, хорошо охарактеризованные и размноженные в стандартизованных условиях компоненты, представляющие собой стволовые клетки, и их потомки могут использоваться для мониторинга и определения видов действия и молекулярных, а также клеточных эффектов вновь разработанных фармакологических средств и, таким образом, замещать также некоторые эксперименты, основанные на животных. Таким образом, эти хорошо стандартизованные стволовые клетки и дифференцированные клетки,полученные из культур пуповинной крови человека, описанные здесь, могут применяться в качестве реагентов для теста ценности в фармацевтической промышленности и промышленности биологически совместимых материалов. Препараты USSC, полученные при подходящих условиях культивирования, приводили к образованию множественных колоний различных гемопоэтических ростков, обеспечивая подтверждение того,что данные клетки могут давать начало гемопоэзу. В составленной надлежащим образом культуральной среде с определенными концентрациямиVEGF, Flt 3L, SCGF (фактор роста стволовых клеток) и на метилцеллюлозе такие клетки приводили к образованию смешанных колоний с клетками, которые также были позитивными в плане маркеровFLK1+ и АС 133+, Tie1 и Tie2. После дальнейшей дифференцировки развивался профиль маркеров, характерный для эндотелиальных клеток, негативный по АС 133, CD31+, CD54+, VWF+, VЕ-катерин+. Здесь заявляется очевидная полезность таких эндотелиальных клеток при выращивании аутологических и аллогенных кровеносных сосудов in vitro для лечения сосудистых заболеваний. В то же время ясно, что все эти сгенерированные in vitro и однородно размноженные предшественники и соответствующие им дифференцированные клетки на клональном уровне будут служить особо значимым инструментом для определения роли специфических генов и их продуктов в клеточной биологии и всех последующих медицинских применениях, основанных на способах лечения, опосредованных клетками и молекулами. Лишь малых количеств клеток данных уникальных клеточных типов достаточно для того, чтобы генерировать большие количества растущих, прилегающих к поверхности USSC по изобретению и более дифференцированных мезенхимальных стволовых клеток для продукции применяемых в медицине регенеративных клеточных типов. Одним из абсолютно новых аспектов данной области знания является тот факт, что такие предшественники могут асимметрично развиваться с образованием двух или более различно дифференцирующихся клеточных типов. Это выявляет новый биологический принцип регуляции совместными компонентами при функционально ориентированной регенерации клеток, который имеет место даже in vitro. Результатом данного изобретения является то, что по данному принципу следует конструировать основанные на стволовой клетке терапевтические средства, которые должны состоять не только из одного клонального клеточного типа. Данное изобретение далее описывается следующими неограничивающими примерами. Пример 1. Сбор пуповинной крови (СВ). Сбор пуповинной крови в акушерских отделениях проводили с информированного согласия матери. После рождения ребенка, пока плацента еще оставалась в матке, пуповину дважды зажимали и рассекали в 7-10 см от пупка. После дезинфекции пуповины пунктировали пупочную вену и собирали СВ в резервуары для сбора, содержащие цитрат-фосфат декстрозы (CPD) в качестве антикоагулянта. Выделение из пуповинной крови мононуклеарных клеток Пуповинную кровь осторожно загружали на раствор Ficoll (плотность 1,077 г/см 3). Проводили центрифугирование в градиенте плотности (450 г, комнатная температура, 25 мин). Мононуклеарные клетки(MNC) собирали из интерфазы и дважды промывали в фосфатно-солевом буфере, рН 7,3 (PBS). Получение прилипающих слоев фибробластоидной морфологии. Мононуклеарные клетки высевали с плотностью примерно 5x103 клеток/см 3 в культуральные флаконы Т 25 (Nunclon) [А.), В.), С.)]. Для инициации роста прилипающих клеточных слоев применяли четыре разных способа культивирования. А.) Полученные из СВ MNC вначале культивировали в среде Myelocult H5100 (StemCell Technologies,Ванкувер/Канада), содержащей 10-7 М дексаметазона. В.) Полученные из СВ MNC вначале культивировали в среде Mesencult (StemCell Technologies,Ванкувер/Канада), содержащей 10-7 М дексаметазона. С.) Полученные из СВ MNC вначале культивировали в среде DMEM с низким содержанием глюкозы (Bio Whittaker) с 30% FCS, содержащей 10-7 М дексаметазона.D.) Полученные из СВ MNC высевали с плотностью 5x106/мл в 10 мл среды Myelocult H5100(StemCell Technologies, Ванкувер/Канада) в культуральные флаконы объемом 50 мл (Nunclon) без дексаметазона. Все культуры инкубировали при 37 С в 5% СО 2 в полностью увлажненной атмосфере и подпитывали раз в неделю путем удаления полной среды с неприлипшими клетками и добавлением 10 мл свежей среды. Через некоторое время прилипающие веретеновидные клетки удаляли обработкой 0,05% трипсином и 0,53 мМ EDTA в течение 2 мин, смывали средой, содержащей 50% сыворотку, собирали путем центрифугирования при 780 g и анализировали путем проточной цитометрии или RT-PCR. Через 2-3 недели прилипающие клетки фибробластоидной морфологии появляются примерно в 30% всех клеточных культур. Условия культивирования для размножения USSC по изобретениюUSSC по изобретению могут размножаться в среде Н 5100, содержащей 10 нг/мл IGF I (инсулиноподобный фактор роста-I), 10 нг/мл PDGF-BB (полученный из тромбоцитов фактор роста-ВВ) и 10 нг/мл рек. человеческого EGF (рекомбинантный человеческий эпидермальный фактор роста) (среда PEI), с плотностью, изменяющейся от 1x104 до 1 х 105 клеток/мл (способ размножения А). Альтернативно, препараты USSC могут быть размножены в исходной ростовой среде А, В и С. Пример 2. Иммунофенотипирование клеток путем цитофлуориметрии. Для определения иммунофенотипа USSC клетки окрашивали конъюгированным с FITC антителом против CD45 (Becton Dickinson, Coulter), конъюгированным с РЕ антителом против CD14 (PharMingen,Coulter), антителом против SSEA-4 (МС-813-70), меченным козьим F (ab')2-фрагментом против мышиныхUSSC, полученные, как описано в примере 1, культивировали в стандартной среде до достижения ими 70% конфлюентности. Остеогенную дифференцировку данных клеток индуцировали добавлением 10-7 М дексаметазона, 50 мкг/мл аскорбиновой кислоты и 10 мМ -глицеролфосфата (Bruder et al., 1994,Jaiswal et al., 1997). Нa 10 сутки стимуляции клетки характеризовались накоплениями фосфата кальция,результатом которых было образование костных узелков. Минерализованные костные узелки детектировали путем окрашивания ализарином красным следующим образом: прилипшие клетки в культуре дважды отмывали PBS, рН 7,3, и окрашивали 5 мл 0,1% раствора ализарина красного в течение 1 ч при комнатной температуре и затем 0,1% уксусной кислотой и абсолютным этанолом, а также PBS. Окрашивание кальция ализарином красным и окрашивание кальция по von Kossa демонстрировало потенциал данных клеток в плане минерализации (Stanford et al., 1995, Rungby et al., 1993). Остеогенную дифференцировку также демонстрировали путем RT-PCR с использованием специфических для дифференцировки кости маркеров остеокальцина (ОС), остеопонтина (ОР), специфической для кости щелочной фосфатазы(АР), костного сиалопротеина (BSP), альфа-рецептора, полученного из тромбоцитов фактора роста(PDGF-Ra), рецептора эпидермального фактора роста (EGFR) и коллагена I типа. Пример 4. Демонстрация потенциала USSC в плане хондрогенной дифференцировки. Для хондрогенной дифференцировки 2x105 прилипших стволовых клеток помещали в седиментационную культуру в полипропиленовые пробирки объемом 15 мл. В качестве среды для клеточной культуры применяли DMEM с высокой концентрацией глюкозы, содержащую дексаметазон, пролин, пируват натрия, добавку ITS+ и TGF-1 (Johnstone et al., 1998, Yoo et al., 1998). Ha 7, 14 и 21 сутки фракции клеток анализировали путем RT-PCR на предмет специфичных для хряща продуктов генов, кодирующихCart-1, коллаген II типа и хондроадгерин. В дополнение, USSC применяли в седиментационных культурах. Через 2 недели секции Dewax фиксировали в 4% параформальдегиде в течение 15 мин при комнатной температуре и промывали этанолом. Секции окрашивали в 1% Alcian Blue/3% уксусной кислоте, рН 2,5 (Sigma) в течение 5 мин и промывали в дистиллированной воде. Они ясно демонстрировали позитивное окрашивание на специфические протеогликаны, что было показано путем окрашивания Alcian Blue(фиг. 12) (Chao, G. et al., 1993). После периода хондрогенной индукции продолжительностью 14 суток клетки фиксировали по стандартному протоколу и анализировали путем флуоресцентной микроскопии(Rosenbaum et al., 1998), демонстрируя наличие специфического для коллагена II типа внеклеточного матрикса (фиг. 13 В). Пример 5. Демонстрация потенциала USSC в плане адипогенной дифференцировки.USSC культивировали в Н 5100, содержащей 10-6 М дексаметазона, 50 мкг/мл аскорбиновой кислоты и 10 мМ -глицеролфосфата, что приводило к дифференцировке части USSC в адипоциты, что было продемонстрировано окрашиванием Oil Red (Ramirez-Zacarias et al., 1992). Пример 6. Демонстрация потенциала USSC в плане нейрогенной дифференцировки. Выделение клеток и условия культивирования глиальных клеток Мононуклеарные клетки пуповинной крови, полученные, как описано здесь, истощали для получения CD14+ клеток посредством системы выделения за счет CD14/магнитного активированного сортиро-8 008619 вания клеток (MACS), в которой использованы колонки для разделения VS+, по инструкции производителя (Miltenyl Biotec, Bergisch Gladbach). Истощенные по CD14 мононуклеарные клетки культивировали с плотностью 2 х 106/мл в 10 мл среды с высоким содержанием глюкозы (MEM по Дульбекко с 4500 г/л глюкозы) в культуральных флаконах Т 25 (Nunclon) и инкубировали при 37 С в 5% СО 2 в полностью увлажненной атмосфере. Через 10-15 суток в культуре детектировали клетки глиальной формы. Дифференцировка в нервные клетки А) Клетки размножали в течение 7 суток или только в среде Н 5100, или в присутствии 40 пг/млPDGFB, 10 пг/мл EGF, 10 пг/мл IGF-I. Клетки обрабатывали трипсином и высевали с плотностью примерно 3,5 х 103 клеток/см 2 в 24-луночные культуральные чашки на наклейки, покрытые поли-D-лизином(PDL) и ламинином (PDL/lam). Впоследствии инициировали нейрональную дифференцировку добавлением индуцирующих агентов, таких как полностью транс-ретиноевая кислота (10-5 М), bFGF (20 нг/мл) иNGF- (50 нг/мл). Флуоресцентная микроскопия После периода инкубации (27 суток) клетки фиксировали по стандартному протоколу (Rosenbaumet al., 1998) и окрашивали антителами против специфических для нервных клеток антигенов. Образцы анализировали с использованием флуоресцентной и светопропускающей микроскопии. Пример 7. Демонстрация потенциала в плане дифференцировки по миоцитарному ростку. 1x104 USSC культивировали в среде Н 5100 (StemCell Technology), дополненной 10 нг/мл PDGFBB,10 нг/мл EGF, 10 нг/мл IGF при 37 С, 5% СО 2, пока они не достигали примерно 70% конфлюентности. После этого клетки инкубировали с 10 мкМ 5'-азацитидина (Sigma) в течение 24 ч, дважды промывалиPBS и культивировали в среде Н 5100, дополненной 100 нг/мл bFGF (Sigma). Через 1 неделю инкубации в среде для дифференцировки изменялась морфология клеток (фиг. 15). Через 10 суток клетки трипсинизировали и переносили в стеклянные камеры, покрытые фибронектином, для окрашивания. Иммуногистохимия Клетки фиксировали 5% формальдегидом/PBS в течение 15 мин и промывали дважды в PBS, рН 7,3. С использованием стандартного протокола инкубировали клетки со специфическим первичным антителом против скелетного миозина (медленного) (клон NOQ7.5.4D, 1:400) (показано зеленым) и первичным антителом против CD13 (показано красным) или моноклональным первичным антителом против скелетного миозина (клон MY-32, 1:4000). Окрашивание было положительным для USSC, культивированных при указанных выше условиях культивирования (фиг. 16). Пример 8. Человеческие клетки USSC, а также полученные из пуповинной крови мононуклеарные клетки(MNC) метили посредством РКН 26 RED Fluorescent Cell Linker Kit (Sigma, PKH26 GL). 2x105 USSC и 5x106 MNC вводили инъекцией в паренхиму печени мышей SCID с 50% гепатэктомией и без нее. Через 7 суток после трансплантации достигалась полная регенерация печени подвергнутых гепатэктомии животных. Ткань печени анализировали путем флуоресцентной микроскопии криосекций на предмет наличия меченных красным клеток человека (фиг. 18). Пример 9. Демонстрация потенциала USSC в плане дифференцировки по гемопоэтическому ростку. Три различных препарата USSC (USSCKCB55 в среде DMEM, содержащей 30% FCS, USSCKCB12 в среде Н 5100, содержащей дексаметазон, USSCKCB13 в среде MesenCult, содержащей дексаметазон, иUSSCGK12 в среде Н 5100, содержащей PEI), растущих в подходящей среде размножения в течение длительных периодов (пассажи от 5 до 8), высевали в объеме 250 мкл (2x104-2x105 клеток) клеточной суспензии в трех параллелях на 24-луночные планшеты в специальную гемопоэтическую среду культивирования (Methocult 4434). Колонии размером более 50 клеток подсчитывали и классифицировали как происходящие из гранулоцитарных/макрофагальных (CFU-GM), ранних эритроидных (BFU-E) или мультипотентных (CFU-GEMM) клеток-предшественников по установленным критериям. Образование колоний в различных культурах было очевидным, начиная с 1 недели наблюдения, и продолжалось до 3 недель в условиях дифференцировки. Препараты USSC образовывали множественные колонии различных ростков, что обеспечивало доказательство того, что данные клетки могут давать начало гемопоэзу. Пример 10. Молекулярные способы анализа неограниченных соматических стволовых клеток и продуктов их последующей дифференцировки.PCR-праймеры для амплификации специфических последовательностей кДНК из остеокальцина,остеопонтина, костного сиалопротеина, щелочной фосфатазы, PDGFRa и рецептора EGF выбирали из различных соответствующих экзонов так, чтобы была возможность различить их по размеру соответственно генерированных фрагментов ДНК. Путем клонирования в вектор pCRL1 (Invitrogen/США) и последующей трансформации штамма Е.coli TOP 10F получали соответственные специфичные клоны кДНК и характеризовали их путем циклического определения последовательности на автоматическом секвенаторе (Applied Biosystems). Реакции RT-PCR проводили по двухстадийной процедуре. 200 нг общей РНК клеток вначале подвергали обратной транскрипции с использованием 10 ед. обратной транскриптазы AMV (Promega, Mannheim),15 пмоль 3'-геноспецифических праймеров, 1 мМ dNTP и буфера от поставщика (Promega, Mannheim) в объеме 20 мкл в течение 1 ч при 50 С. Реакцию PCR проводили с использованием 2 мкл кДНК, 1 ед.-9 008619 ДНК-полимеразы HotStarTaq, буфера и Q-раствора (Qiagen, Hilden), 1,5 мМ dNTP и 20 пмоль 3'- и 5'геноспецифического праймера. Реакцию PCR проводили с использованием инициирующей стадии в течение 15 мин при 95 С, 37 циклов по 94 С в течение 30 с, 56 С в течение 30 с, 68 С в течение 1 мин и конечной стадии полимеризации в течение 5 мин при 68 С. Таблица 4PCR-праймеры для амплификации специфичных последовательностей кДНК В таблице показаны последовательности 5'- и 3'-праймеров исследуемых генов и ожидаемая длина фрагментов PCR в н.п. СсылкиSSEA4 - стадиоспецифический ранний антиген 4USSC - неограниченная соматическая стволовая клетка ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Применение неограниченных соматических стволовых клеток (USSC) для получения лекарственного средства для лечения сосудистого заболевания, заболевания сердечной мышцы или гладкой мышцы, заболевания печени, заболевания поджелудочной железы, в частности диабета типа I, заболевания нервной ткани, в частности болезни Паркинсона, или гематологического заболевания, где указанныеUSSC получены из пуповинной крови или плацентарной крови, причем указаные стволовые клетки обладают следующими свойствами:(i) негативны по отношению к поверхностным антигенам CD14 и CD45;(ii) позитивны по отношению к поверхностным антигенам CD13, CD29, CD44 и CD49e;(iii) позитивны по экспрессии YB1, AML-1, RUNX-1 и фибулина-2; и(iv) негативны по экспрессии гиалуронансинтазы, фибромодулина и 1NFLS. 2. Применение по п.1, где указанное лекарственное средство дополнительно содержит потомство указанных USSC, дифференцированных in vitro.
МПК / Метки
МПК: A61P 43/00, C12N 5/08, A61K 35/14
Метки: лекарственного, получения, средства, применение, ussc, стволовых, неограниченных, соматических, клеток
Код ссылки
<a href="https://eas.patents.su/24-8619-primenenie-neogranichennyh-somaticheskih-stvolovyh-kletok-ussc-dlya-polucheniya-lekarstvennogo-sredstva.html" rel="bookmark" title="База патентов Евразийского Союза">Применение неограниченных соматических стволовых клеток (ussc) для получения лекарственного средства</a>
Предыдущий патент: Способ и система подводного хранения нефти
Следующий патент: Водная адгезивная композиция на основе крахмала бобовых культур
Случайный патент: Соединение и фармацевтическая композиция для ингибирования экспрессии vcam-1