Замещенные аналоги бензопирана
Номер патента: 5599
Опубликовано: 28.04.2005
Авторы: Нагараян Шринивасан Р., Хано Кэтлин Э., Браун Дейвид Л., Обуковиц Марк Г., Людвиг Синди Л., Картер Джеффери С., Девадас Балекудру, Талли Джон Дж., Роджир Дональд Дж., Бертеншо Стивен Р., Грането Меттью Дж., Мец Сьюзен, Хартманн Сьюзен Дж., Корт Дональд Э.
Формула / Реферат
1. Соединение формулы I"
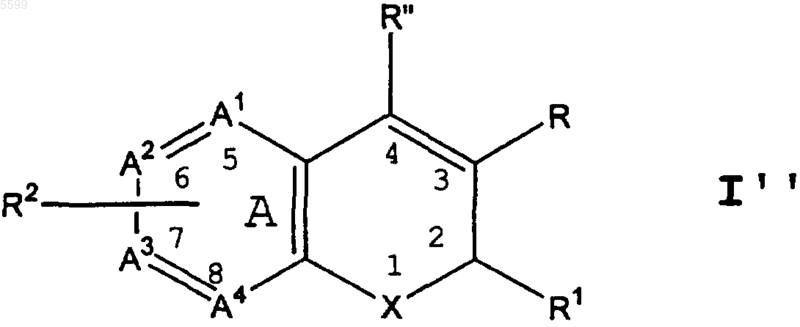
где X - O;
R выбирают из группы, включающей карбоксил и C1-C6-алкоксикарбонил;
R" выбирают из группы, включающей водород, фенил, тиенил, C1-C6-алкил и C2-C6-алкенил;
R1 выбирают из группы, включающей C1-C3-перфторалкил и C1-C6-алкоксигруппу;
R2 представляет собой один или несколько радикалов, выбранных независимо друг от друга из группы, включающей водород, галоид, C1-C6-алкил, C2-C6-алкенил, C2-C6-алкинил, галоид-C2-C6-алкинил, арил-C1-C3-алкил, арил-C2-C6-алкинил, арил-C2-C6-алкенил, арил-C1-C6-алкокси-C1-C6-алкил,
где атомы цикла A-A1, A2, A3 и A4 - являются атомами углерода;
или изомер или фармацевтически приемлемая соль такого соединения.
2. Соединение по п.1, представляющее собой одно из следующих соединений:
6-хлор-4-этил-2-трифторметил-2H-1-бензопиран-3-карбоновая кислота;
6-хлор-2-трифторметил-4-этенил-2H-1-бензопиран-3-карбоновая кислота;
6-хлор-2-трифторметил-4-фенил-2H-1-бензопиран-3-карбоновая кислота;
6-хлор-4-(2-тиенил)-2-трифторметил-2H-1-бензопиран-3-карбоновая кислота.
Текст
005599 Родственные заявки Настоящая заявка представляет собой частичное продолжение заявки 09/062,537, поданной 17 апреля 1998 г., которая является частичным продолжением заявки 60/044,485, поданной 21 апреля 1997 г. Область, к которой относится изобретение Настоящее изобретение относится к области противовоспалительных фармацевтических средств и,конкретно, к соединениям, пригодным для лечения расстройств, опосредованных циклооксигеназой-2,таких как воспаления и расстройства, связанные с воспалением. Предпосылки создания изобретения Простагландины играют главную роль при воспалительных процессах, и ингибирование вырабатывания простагландинов, в частности, вырабатывания PGG2, РGН 2 и PGE2, является обычной целью создания противовоспалительных лекарственных средств. Однако обычные нестероидные противовоспалительные средства (НСПВС), проявляющие активность в отношении индуцированных простагландинами болевых ощущений и отеков, связанных с воспалительным процессом, активны также и в отношении влияния на другие процессы, регулируемые простагландинами, но не связанные с воспалением. Таким образом, применение наиболее распространенных НСПВС в больших дозах может вызывать сильные побочные эффекты, в том числе опасные для жизни язвы, что ограничивает их терапевтический потенциал. Альтернативой НСПВС является применение кортикостероидов, которые вызывают еще более сильные негативные эффекты, особенно в случаях длительного лечения. Обнаружено, что НСПВС предотвращают вырабатывание простагландинов путем подавления ферментов, участвующих в реакциях превращения арахидоновой кислоты в простагландины в организме человека, в том числе фермента, называемого циклооксигеназой (ЦОГ). Недавнее открытие индуцируемого фермента, связанного с воспалениями (названного "циклооксигеназой-2 (ЦОГ-2)" или "простагландин G/H-синтазой II"), указывает на практически достижимую мишень для ингибирования, обеспечивающего более эффективное подавление воспаления и смягчение побочных эффектов. В последнее время значительные усилия были затрачены на исследование некоторых аспектов действия циклооксигеназы-2. Установили, что циклооксигеназа-2 активирована в доброкачественных и злокачественных опухолях (К. Суббарамайя (К. Subbaramaiah) и др., Рrос. Soc. Exp. Biol. Med., 216, 201(1997, в том числе при раке легких (Т. Хайде (Т. Hida) и др., Anticancer Res., 18, 775-82 (1998, синдроме Барретта (К. Уилсон (К. Wilson), Cancer Res., 58, 2929-34 (1998 и раке кожи (С. Бакмен (S. Buckman) и др., Carcinogenesis, 19, 723-29 (1998. Это находит свое выражение в легочных альвеолах с причастностью к астме (П. Барнес (Р. Barnes) и др., Lung Biol. Health Dis., 114, 111-27 (1998. Циклооксигеназа задействована также, наряду с прочим, при преждевременных родах, ангиогенезе (М. Цуджии (М. Tsujii) и др., Cell, 93, 705-16 (1998, отторжении сосудов (М. Бастос (М. Bustos), J. Clin. Invest., 100, 1150-58(1998, церебральной ишемии (С. Ногава (S. Nogawa) и др., Рrос. Natl. Acad. Sci., 95, 10966-71 (1998,гипертензии (А. Населетти (A. Nasjletti), Hypertension, 31, 194-200 (1997. Лекарственные препараты, угнетающие циклооксигеназу, оказывают воздействие, наряду с прочим,на рак толстой кишки (Т. Кавамори (Т. Kawamori) и др., Cancer Res., 58, 409-12 (1988, аллергический неврит (К. Миямото (К. Miyamoto) и др., Neuro Report, 9, 2331-4 (1998, слабоумие, ожоговые инфекцииOpin., 14, 29-38 (1997. Нижеприведенные литературные ссылки, относящиеся к противовоспалительной активности, иллюстрируют непрерывные усилия, направленные на поиск безопасных и эффективных противовоспалительных агентов. Новые производные бензопирана, дигидрохинолина, бензтиопирана и дигидронафталина, предлагаемые в этих работах, являются именно такими безопасными и одновременно эффективными противовоспалительными агентами, способствующими эффективности этих усилий. Предложенные замещенные производные бензопирана, дигидрохинолина, бензтиопирана и дигидронафталина предпочтительно селективно ингибируют циклооксигеназу-2 по сравнению с циклооксигеназой-1. В патенте США 5,618,843 на имя Фишера и др. (Fisher et al.) описаны как класс соединения, содержащие бициклические фрагменты, замещенные кислотными группами, в качестве антагонистовIIb/IIIa. В документе WO 94/13659, опубликованном 23 июня 1994 г., описаны конденсированные бензосоединения для лечения расстройств центральной нервной системы. Манрао и др. (Manrao et al., J. Indian.Counc. Chem. 12, 38-41 (1996 описывают производные карбоксикумаринимида и их противогрибковую активность. В патенте США 5,348,976, выданном Шибата и др. (Shibata et al.), описаны амидозамещенные бензопираны как противогрибковые средства. Документ WO 96/40110, опубликованный 19 декабря 1996 г., описывает производные бензопирана в качестве модуляторов тирозинкиназы. Лойодис и др. (Loiodice et al., Tetrahedron 6, 1001-11 (1995 описывают получение 6-хлор-2,3-дигидро-4 Н-1-бензопиранкарбоновых кислот.-1 005599 Клеменс и др. (Clemence et al., J. Med. Chem. 31, 1453-62 (1988 описывают 4-гидрокси-3 хинолинкарбоновые кислоты в качестве исходных материалов для получения противовоспалительных препаратов. Лейзер и др. (Lazer et al., J. Med. Chem. 40, 980-89 (1997 также описывают бензтиопиранкарбоксилаты как исходные материалы для получения противовоспалительных средств. В патенте США 5,281,720, выданном на имя Юнга (Young) и др., описаны нафтойные кислоты как ингибиторы липоксигеназы. В патенте США 5,348,976, выданном на имя Шибата (Shibata) и др., описаны амидозамещенные бензопираны как противогрибковые препараты. В патенте США 5,004,744, выданном на имя Вейссмиллера (Weissmiller) и др., описана 2 Н-бензопиран-3-карбоновая кислота как промежуточное химическое соединение для получения пестицидов. В патенте США 4,814,346, выданном на имя Альберт (Albert) и др., описаны 3-фенилбензопираны как ингибиторы 5-липоксигеназы. В патенте США 4,761,425, выданном на имя Жирард (Girard) и Рокач (Rokach), описаны 4-оксобензопираны как антагонисты лейкотриена. В патенте США 4,609,744, выданном на имя Юнг (Young) и др., описаны 4 оксобензопиранкарбоновые кислоты как антагонисты лейкотриена. В патенте США 5,082,849, выданном на имя Хуанг (Huang) и др., описаны 4-оксобензопираны как антагонисты лейкотриена. В заявкеWO95/07274, опубликованной 16 марта 1996 г., описана 2 Н-бензопиран-3-карбоновая кислота как промежуточные химические соединения. В заявкеWO88/04654, опубликованной 30 июня 1988 г., описана 2 Н-бензопиран-3-карбоновая кислота как промежуточные химические соединения. В патенте ЕР 412,939,опубликованном 13 февраля 1991 г., описаны замещенные хромены как ингибиторы 5-липоксигеназы. В патенте Японии 2-22272 описаны бензопиран-3-карбоновые кислоты. В патенте Японии 59-29681 описана 8-метоксибензопиран-3-карбоновая кислота как промежуточное химическое соединение. Бантинг (Bunting) и др. (Can. J. Chem., 62, 1301-07 (1984 описывает синтез 2-гидрокси-1,2 дигидрохинолинов. Ухин (Ukhin) и др. (Izv. Akad. Nauk Ser. Khim., 5, 1222-28 (1996 описывает синтез(1982 описывает хромен-3-карбоновую кислоту как промежуточное химическое соединение для получения миорелаксантов, воздействующих на кору головного мозга. Рене и Руайе (Rene and Royer, Eur. J.Med. Chem. - Chim. Ter. 10, 72-78 (1975 описали способ получения хромен-3-карбоновой кислоты. В патенте США 4,665,202, выданном Рембо и др. (Rimbault et al.), описаны 2-фенилзамещенные флавены и тиофлавены как ингибиторы 5-липоксигеназы. Производные бензопирана как ингибиторы 5 липоксигеназы описаны также в патенте США 5,250,547 на имя Локхида и др. (Lochead et al.). В работе Сато и др. (Satoh et al., J. Med. Chem. 36, 3580-94 (1993 описаны замещенные хромены в качестве ингибиторов 5-липоксигеназы. В патенте США 5,155,130, выданном Стентону и др. (Stanton et al.),описаны замещенные хромены в качестве ингибиторов 5-липоксигеназы и конкретно 6-бензилокси-2 Нбензопиран-3-карбоновая кислота как промежуточный продукт. Описание изобретения Класс соединений, полезных при лечении расстройств, опосредствованных циклооксигеназой-2,включает соединения формулы I"R2 представляет собой один или несколько радикалов, выбранных независимо друг от друга из группы, включающей водород, галоид, C1-С 6-алкил, C2-С 6-алкенил, C2-С 6-алкинил, галоид-C2-С 6 алкинил, арил-C1-С 3-алкил, арил-C2-С 6-алкинил, арил-C2-С 6-алкенил, арил-C1-С 6-алкокси-C1-С 6-алкил,где атомы цикла А - А 1, А 2, А 3 и А 4 - являются атомами углерода; а также изомеры и фармацевтически приемлемые соли таких соединений. Соединения в соответствии с настоящим изобретением могут быть полезны (однако эти применения не следуeт рассматривать как единственно возможные) для лечения у пациента воспалительных процессов и для лечения других расстройств, опосредствованных циклооксигеназой-2, при лечении болевых симптомов и головных болей в качестве анальгетиков или при лечении состояний с повышенной температурой в качестве антипиретиков. Например, соединения в соответствии с настоящим изобретением могут быть полезны при лечении артритов, включая, но не ограничиваясь этим, ревматоидного артрита,спондилоартропатии, подагрического артрита, остеоартрита, системной красной волчанки и ювенильного артрита. Такие соединения в соответствии с настоящим изобретением могут быть полезны при лечении астмы, бронхита, менструальных судорог, при преждевременных родах, при лечении тендинита,бурсита, аллергического неврита, инфективности цитомегаловируса, апоптоза, включая ВИЧиндуцированный апоптоз, люмбаго, заболеваний печени, в том числе гепатита, болезненных состояний-2 005599 кожи, например, псориаза, экземы, угрей, УФ-поражения, ожогов и дерматитов, а также послеоперационных воспалений, в том числе после офтальмологических операций, включая удаление катаракты и хирургические операции на хрусталике. Соединения в соответствии с настоящим изобретением могут быть полезны также при лечении желудочно-кишечных расстройств, например, воспалительных процессов в кишечнике, болезни Крона, гастрита, синдрома раздражения кишечника и язвенного колита. Соединения в соответствии с настоящим изобретением могут быть полезны при лечении воспалительных процессов,связанных с такими заболеваниями, как мигрень, узелковый периартериит, тироидит, апластическая анемия, болезнь Ходжкина, склеродома, ревматическая лихорадка, диабет типа I, заболевания нервномышечных соединений, в том числе миастения, заболевания белого вещества мозга, в том числе рассеянный склероз, саркоидоз, нефротический синдром, синдром Бехчета, полимиозит, гингивит, нефрит,гиперчувствительность, отеки после повреждений, в том числе отек мозга, ишемия миокарда и др. Эти соединения могут быть полезны также при лечении офтальмологических заболеваний, например, ретинита, конъюнктивита, ретинопатии, увеита, светобоязни и острых повреждений тканей глаза. Они могут быть полезны также при лечении воспалительных процессов в легких, например, связанных с вирусными инфекциями, и кистозного фиброза, резорбции кости, например, связанной с остеопорозом. Эти соединения могут также быть полезны при лечении расстройств центральной нервной системы,например, кортикального слабоумия, в том числе болезни Альцгеймера, нейродегенерации и нарушений деятельности центральной нервной системы вследствие удара, ишемии и травм. Термин "лечение" охватывает частичное или полное снятие симптомов слабоумия, в том числе болезни Альцгеймера, слабоумия вследствие сосудистых расстройств, слабоумия, связанного с множественными кровоизлияниями,пресенильного слабоумия, алкогольного слабоумия и старческого слабоумия. Соединения в соответствии с настоящим изобретением полезны в качестве противовоспалительных средств, например, при лечении артрита, с дополнительным преимуществом, которое заключается в значительном ослаблении побочных эффектов. Эти соединения могут быть также полезны при лечении аллергического ринита, синдрома расстройства дыхания, синдрома эндотоксинного шока и заболеваний печени. Они могут быть полезны также для снятия болевых ощущений, например (но не только) послеоперационных болей, зубной боли, мышечных болей и болей, возникающих при раке. Вышеописанные соединения могут быть полезны (но не ограничиваясь этим) для лечения и предупреждения связанных с воспалительными процессами сердечно-сосудистых расстройств у пациента. Соединения могут быть полезны при лечении и предупреждении сосудистых расстройств, заболеваний коронарных артерий, аневризм, отторжения сосудов, артериосклероза, атеросклероза, в том числе атеросклероза сердечных трансплантатов, инфаркта миокарда, эмболий, припадков, тромбоза, в том числе венозного тромбоза, стенокардии, в том числе неустойчивой стенокардии, воспаления коронарных бляшек,воспалительных процессов бактериальной этиологии, в том числе вызываемых хламидиями, воспалительных процессов вирусной этиологии, а также воспалительных процессов, связанных с хирургическими вмешательствами, например, с трансплантацией сосудов, в том числе аорто-коронарным шунтированием; с операциями по восстановлению сосудов, в том числе ангиопластикой; с установкой расширителей (стентов), эндартерэктомией и с прочими вмешательствами, затрагивающими артерии, вены и капилляры. Соединения могут быть полезны (но не ограничиваясь этим) для лечения у пациента расстройств,связанных с развитием кровеносных сосудов (ангиогенезом). Согласно настоящему изобретению соединения назначают пациенту в случае необходимости ингибирования развития кровеносных сосудов. Соединения могут быть полезными при лечении опухолей, в том числе метастазов; офтальмологических болезненных состояний, например, отторжения трансплантата роговицы, образования новых сосудов в тканях глаза, разрастания сосудов в сетчатке, в том числе разрастания вследствие повреждения или инфекции, диабетической ретинопатии, дегенерации желтого пятна, ретролентальной фиброплазии и неоваскулярной глаукомы; язвенных заболеваний, включая язву желудка; патологических, но не злокачественных состояний, например, гемангиом, в том числе инвантильных гемангиом, ангиофибромы носоглотки и аваскулярного некроза кости; и расстройств женских репродуктивных органов, например, эндометриоза. Соединения, соответствующие настоящему изобретению, могут быть пригодны для предотвращения либо лечения доброкачественных и злокачественных опухолей/неоплазий, включая рак, например,рака прямой кишки, рака головного мозга, рака кости, опухолей, возникающих в эпителиальных тканях(эпителиальных карцином), например, базально-клеточной эпителиомы, аденокарциномы, рака пищеварительного тракта, например, рака губы, рака ротовой полости, рака пищевода, рака тонкой кишки, рака желудка, рака толстой кишки, рака печени, рака мочевого пузыря, рака поджелудочной железы, рака яичников, рака шейки матки, рака легкого, рака груди и рака кожи, например, плоскоклеточного рака и базально-клеточной эпителиомы, рака простаты, рака почки и других видов рака, поражающих эпителиальные клетки организма. Предпочтительно опухоли выбираются из группы, включающей рак пищеварительного тракта, синдром Барретта, рак печени, рак мочевого пузыря, рак поджелудочной железы, рак яичников, рак простаты, рак шейки матки, рак легкого, рак груди и рак кожи, например, плоскоклеточный рак и базально-клеточную эпителиому. Соединения могут быть применены для лечения фиброзов,-3 005599 связанных с лучевой терапией. Этот способ может быть применен при лечении пациентов, страдающих аденоматозными полипами, в том числе связанными с семейным аденоматозным полипозом (САП). Кроме того, этот способ может быть использован для предупреждения развития полипов у пациентов,входящих в группу риска по САП. Прием соединений в соответствии с настоящим изобретением может быть применен сам по себе либо в сочетании с другими видами лечения, известными специалистам в области предупреждения и лечения опухолей. В альтернативном варианте соединения, описанные в настоящем описании, могут быть использованы при комбинированной терапии. Например, эти соединения могут быть применены сами по себе либо в сочетании с другими противоопухолевыми агентами или иными ингибиторами роста, либо с другими лекарственными средствами или питательными веществами. В промышленном производстве, в процессе клинических испытаний и доклинической разработки находится большое количество противоопухолевых препаратов, которые можно выбрать для лечения опухолей методами комбинированной лекарственной химиотерапии. Такие противоопухолевые средства подразделяются на несколько основных категорий, а именно: средства типа антибиотиков, алкилирующие средства, антиметаболиты, гормональные препараты, иммунологические средства, препараты типа интерферона и прочие препараты смешанного действия. В качестве альтернативных вариантов могут быть применены другие противоопухолевые средства, например, металломатричные протеазы (ММП),имитаторы SOD или ингибиторы v3. Первое семейство противоопухолевых средств, которые могут быть применены в сочетании с соединениями, соответствующими настоящему изобретению, состоит из противоопухолевых средств типа антиметаболитов. Пригодные для этой цели противоопухолевые средства типа антиметаболитов могут быть выбраны из группы, состоящей из 5-FU-фибриногена, акантифолиевой кислоты, аминотиадиазола,брекинар-натрия, кармофура, препарата CGP-30694 (фирма Ciba-Geigy), циклопентилцитозина, цитарабин-фосфатстеарата, сопряженных цитарабинов, препарата DATHF (фирма Lilly), DDFC (фирма Merrel(фирма Takeda), тиогуанина, тиазофурина, препарата TIF (фирма Erbamont), триметрексата, ингибиторов тирозинкиназы, ингибиторов тирозин-протеинкиназы, препарата UFT (фирма Taiho) и урицитина. Вторая группа противоопухолевых средств, которые могут быть применены в сочетании с соединениями, соответствующими настоящему изобретению, состоит из противоопухолевых препаратов алкилирующего типа. Пригодные для этой цели противоопухолевые препараты алкилирующего типа могут быть выбраны из группы, состоящей из препарата 254-S (фирма Shionogi), аналогов альдо-фосфамида,альтретамина, анаксирона, препарата BBR-2207 (фирма Boehringer Mannheim), бестрабуцила, будотитана, препарата СА-102 (фирма Wakunaga), карбоплатина, кармустина, препаратов Сhinoin-139, Chinoin153, хлорамбуцила, цисплатина, циклофосфамида, препарата CL-286558 (фирма American Cyanamid),препарата CY-233 (фирма Sanofi), циплатата, препарата D-19-384 (фирма Degussa), препаратаSeiyaku), тауромустина, темозоломида, тероксирона, тетраплатина и тримеламола. Третье семейство противоопухолевых средств, которые могут быть применены в сочетании с соединениями, соответствующими настоящему изобретению, состоит из противоопухолевых препаратов типа антибиотиков. Пригодные для этой цели противоопухолевые препараты типа антибиотиков могут быть выбраны из группы, состоящей из препарата 4181-А (фирма Taiho), акларубицина, актиномицинаSM-5887 (фирма Sumitomo), препаратов SN-706 (фирма Snow Brand), SN-07 (фирма Snow Brand), сорангицина-А, спарсомицина, препаратов SS-21020 (фирма SS Pharmaceutical), SS-7313B (фирма SS Pharmaceutical), SS-9816B (фирма SS Pharmaceutical), стеффимицина В, препарата 4181-2 (фирма Taiho), талисомицина, препарата TAN-868A (фирма Takeda), терпентецина, тразина, трикрозарина А, препарата U73975 (фирма Upjohn), препарата UCN-10028A (фирма Kyowa Hakko), препарата WF-3405 (фирма Fudjisawa), препарата Y-25024 (фирма Yoshitomi) и зорубицина. Четвертое семейство противоопухолевых средств, которые могут быть применены в сочетании с соединениями, соответствующими настоящему изобретению, включает различные противоопухолевые препараты. Пригодные для этой цели противоопухолевые препараты могут быть выбраны из группы,состоящей из альфа-каротена, альфа-дифторметиларгинина, ацитретина, препарата AD-5 (фирма Biotec),препарата АНС-52 (фирма Kyorin), альстонина, амонафида, амфетинила, амсакрина, препарата "Ангиостат", анкиномицина, антинеопластона А 10, антинеопластона А 2, антинеопластона A3, антинеопластона А 5, антинеопластона AS2-1, препарата APD (фирма Henkel), афидиколинглицината, аспарагиназы, препарата "Аварол", бахарина, батрацилина, бенфлурона, бензотрипта, препарата BIM-23015 (фирма IpsenBeaufour), бисантрена, препарата BMY-40481 (фирма Bristol-Myers), борона-10 (фирма Vestar), бромфосфамида, препаратов BW-502 (фирма Wellcome), BW-773 (фирма Wellcome), карацемида, карметизола гидрохлорида, препарата CDAF (фирма Ajinomoto), хлорсульфохиноксалона, препаратов СНХ-2053-5 005599 ТТ-82 (фирма Teijin), препаратов UCN-01 (фирма Kyowa Hakko) и UCN-1028 (фирма Kyowa Hakko), украина, препарата USB-006 (фирма Eastman Kodak), винбластинсульфата, винкристина, виндесина, винэстрамида, винорельбина, винтриптола, винзолидина, витанолидов и препарата YM-534 (фирма Yamanouchi). Примерами радиопротекторных агентов, которые могут быть применены в сочетании с соединениями, соответствующими настоящему изобретению, являются AD-5, адхнон, аналоги амифостина, детокс, димесна, 1-102, ММ-159, N-ацилированные дегидроаланины, TGF-Genentech, типротимод, амифостин, WR-151327, FUT-187, кетопрофен подкожно, набуметон, супероксиддисмутаза (фирмы Chiron) и супероксиддисмутаза (Энзон). Наряду с полезностью для лечения человека, эти соединения полезны также в ветеринарии для лечения домашних животных, экзотических животных и сельскохозяйственных животных, в том числе млекопитающих, грызунов и т.д. Более предпочтительно применение их для лечения лошадей, собак и кошек. Соединения, соответствующие настоящему изобретению, могут также использоваться при вспомогательном лечении, частично либо полностью, наряду с другими противовоспалительными лекарственными препаратами, например, вместе со стероидными лекарственными препаратами, нестероидными противовоспалительными лекарственными препаратами, ингибиторами оксид-азот-синтетазы, ингибиторами р-38, ингибиторами фактора некротизации опухолевых клеток, ингибиторами 5-липоксигеназы,антагонистами рецептора LTB4 и ингибиторами LTA4-гидролазы. Пригодные для этой цели ингибиторы LТА 4-гидролазы включают RP-64966, бензиловый эфир(S,S)-3-амино-4-(4-бензилоксифенил)-2-гидроксимасляной кислоты (Scripps Res. Inst.), N-(2(R)(циклогексилметил)-3-(гидроксикарбамоил)пропионил)-L-аланин (Searle), 7-(4-(4-уреидобензил)фенил)гептановую кислоту (Rhone-Poulenc Rorer) и литиевую соль 3-(3-(1 Е,3 Е-тетрадекадиенил)-2 оксиранил)бензойной кислоты (Searle). К пригодным для этой цели антагонистам рецепторов LTB4 относятся, наряду с другими соединениями, эбселен, линазоласт, онтазоласт и нижеперечисленные соединения, производимые фирмами, указанными в скобках: Вау-х-1005 (Bayer), CGS-25019C (Ciba Geigy), ETH-615 (Leo Denmark), MAFP(Merck), TMK-688 (Terumo), T-0757 (Tanabe), LY-213024, LY-210073, LY-223982, LY-233469 и LY255283, LY-293111, 264086 и 292728 (Lilly), ONO-LB457, ONO-4057 и ONO-LB448 (Ono), S-2474 (Shionogi), кальцитрол, SC-53228, SC-41930, SC-50605 и SC-51146 (Searle), BPC 15 (Warner Lambert), SB209247 (SmithKline Beecham) и SKF-104493 (SKF). Предпочтительно антагонисты рецепторов LTB4 выбирают из группы, включающей кальцитрол, эбселен, соединения Вау-х-1005 (Вауеr), CGS-25019C(Ciba Geigy), ETH-615 (Leo Denmark), LY-293111 (Lilly), ONO-4057 (Ono) и TMK-688 (Terumo). К пригодным для этой цели ингибиторам 5-LO относятся, наряду с другими соединениями, нижеперечисленные соединения, производимые фирмами, указанными в скобках: А-76745, 78773 и АВТ 761(Abbott), Вау-х-1005 (Вауеr), CMI-392 (Cytomed), E-3040 (Eisai), EF-40 (Scotia Pharmaceutica), F-1322 (Fujirebio), ML-3000 (Merckle), PF-5901 (Purdue Frederick), R-840 (3M Pharmaceuticals), а также рилопирокс,флобуфен, линазоласт, лонаполен, мазопрокол, онтазоласт, тенидап, зилеутон, пранлукаст, тепоксалин,флезеластингидрохлорид, эназадремфосфат и бунапропласт. Соединения в соответствии с настоящим изобретением могут также быть применены при комбинированной терапии с опиоидами и другими анальгетиками, в том числе с наркотическими анальгетиками,антагонистами мю-рецепторов, антагонистами каппа-рецепторов, ненаркотическими (т.е. не вызывающими привыкания) анальгетиками, ингибиторами усвоения моноаминов, регуляторами аденозина, производными каннабиноидов, антагонистами вещества Р, антагонистами рецепторов нейрокинина-1 и блокаторами натриевого канала. Более предпочтительным является их сочетание с соединениями, выбранными из группы, включающей морфин, меперидин, кодеин, пентазоцин, бупренофин, буторфанол, дезоцин, мептазинол, гидрокодон, оксикодон, метадон, препараты "Трамадол" [(+)-энантиомер], DuP 747,"Динорфин А", "Энадолин", RP-60180, HN-11608, Е-2078, ICI-204448, ацетоминофен (парацетамол), пропоксифен, налбуфин, препарат Е-4018, филенадол, мирфентанил, амитриптилин, DuP 631, "Трамадол"[(-)-энантиомер], GP-531, акадезин, AKI-1, AKI-2, GP-1683, GP-3269, 4030W92, трамадол-рацемат, "Динорфин А", Е-2078, АХС 3742, SNX-111, ADL2-1294, ICI-204448, СТ-3 и СР-99,994. Упомянутые соединения могут использоваться при вспомогательном лечении, вместо других традиционных противовоспалительных лекарственных препаратов, в сочетании с одним либо несколькими антигистаминными лекарственными средствами, противозастойными лекарственными средствами, мочегонными средствами, противокашлевыми средствами либо вместе с другими лекарственными средствами, обладающими, как было известно ранее, эффективностью в сочетании с противовоспалительными лекарственными препаратами. Термин "предупреждение" охватывает как предотвращение возникновения у пациента клинически очевидных сердечно-сосудистых расстройств вообще, так и предотвращение возникновения доклинически очевидных стадий сердечно-сосудистых расстройств. Он охватывает также профилактическое лечение пациентов, входящих в группы риска развития заболеваний, например, таких как сердечнососудистые расстройства, слабоумие либо рак.-6 005599 Выражение "терапевтически эффективное" применяется для обозначения количества каждого средства, которое обеспечивает достижение цели снижения тяжести расстройства и частоты возникновения его симптомов при лечении одним этим средством, при условии отсутствия отрицательных побочных эффектов, обычно связанных с альтернативными способами лечения. Настоящее изобретение предпочтительно относится к соединениям, которые селективно ингибируют циклооксигеназу-2 по сравнению с циклооксигеназой-1. Предпочтительно соединения имеют значение IC50 по циклооксигеназе-2 менее приблизительно 0,5 мкМ, а также имеют отношение селективности ингибирования циклооксигеназы-2 к ингибированию циклооксигеназы-1 не менее 50, более предпочтительно не менее 100. Еще более предпочтительно, чтобы соединения имели значение IС 50 по циклооксигеназе-1, превышающее приблизительно 5 мкМ. Такая предпочтительная селективность может служить признаком способности к снижению отрицательных побочных эффектов, вызываемых обычными нестероидными противовоспалительными средствами. Предпочтительный класс соединений включает такие соединения: 6-хлор-4-этил-2-трифторметил-2 Н-1-бензопиран-3-карбоновую кислота; 6-хлор-2-трифторметил-4-этенил-2 Н-1-бензопиран-3-карбоновая кислота; 6-хлор-2-трифторметил-4-фенил-2 Н-1-бензопиран-3-карбоновая кислота; 6-хлор-4-(2-тиенил)-2-трифторметил-2 Н-1-бензопиран-3-карбоновая кислота. Термин "водород" означает одиночный водородный атом (Н). Этот атом водорода может быть соединен, например, с атомом кислорода, образуя радикал гидроксила, или два водородных атома могут быть присоединены к атому углерода, образуя радикал метилен (-СН 2-). Термин "алкил", употребленный сам по себе или в сочетании с другими терминами, например, "галоидный алкил", "алкилсульфонил",охватывает радикалы линейного или разветвленного строения, содержащие от 1 атома до приблизительно 20 атомов углерода или, предпочтительно, от 1 атома до приблизительно 12 атомов углерода. Более предпочтительными алкильными радикалами являются "низшие алкильные" радикалы, содержащие от 1 атома до приблизительно 6 углеродных атомов. Примерами таких радикалов являются метил, этил, nпропил, изопропил, n-бутил, изобутил, втор-бутил, трет-бутил, пентил, изоамил, гексил и т.п. Еще более предпочтительными являются низшие алкильные радикалы, имеющие от 1 до 3 атомов углерода. Упомянутый термин "алкенил" обозначает неразветвленные либо разветвленные радикалы, имеющие как минимум одну углерод-углеродную двойную связь от 2 до приблизительно 20 атомов углерода либо в предпочтительном варианте от 2 до приблизительно 12 атомов углерода. Более предпочтительными алкенильными радикалами являются "низшие алкенильные" радикалы, имеющие от 2 до приблизительно 6 атомов углерода. Примерами алкенильных радикалов являются этенил, пропенил, аллил, пропенил, бутенил и 4-метилбутенил. Упомянутый термин "алкинил" обозначает неразветвленные либо разветвленные радикалы, имеющие от 2 до приблизительно 20 атомов углерода либо в предпочтительном варианте от 2 до приблизительно 12 атомов углерода. Более предпочтительными алкинильными радикалами являются "низшие алкинильные" радикалы, имеющие от 2 до приблизительно 10 атомов углерода. Наиболее предпочтительными являются низшие алкинильные радикалы, имеющие от 2 до приблизительно 6 атомов углерода. Примерами таких радикалов являются пропаргил, бутинил и т.п. Упомянутые термины"алкенил" и "низший алкенил" обозначают радикалы, имеющие "цис" и "транс" ориентации либо, согласно альтернативному варианту, "Е" и "Z" ориентации. Упомянутый термин "галоген" обозначает галогены, например атомы фтора, хлора, брома либо йода. Упомянутый термин "галогеналкил" обозначает радикалы, один либо несколько алкилуглеродных атомов которых замещены галогеном, в соответствии с определением, представленным ранее. В частности, упомянутый термин обозначает моногалогеналкильные, дигалогеналкильные и полигалогеналкильные радикалы. Моногалогеналкильный радикал, в качестве одного из примеров, может иметь в своем составе атом йода, брома, хлора либо фтора. В состав дигалоген- и полигалогеналкильных радикалов могут входить два либо несколько одинаковых атомов галогена или комбинация различных галогеновых радикалов. Упомянутый термин "низший галогеналкил" обозначает радикалы, имеющие 1-6 атомов углерода. Примерами галогеналкильных радикалов являются фторметил, дифторметил, трифторметил, хлорметил, дихлорметил, трихлорметил, пентафторэтил, гептафторпропил, дифторхлорметил, дихлорфторметил, дифторэтил, дифторпропил, дихлорэтил и дихлорпропил. Упомянутый термин "перфторалкил" обозначает алкильные радикалы, все атомы водорода в которых замещены атомами фтора. Примерами их являются трифторметил и пентафторэтил. Термин"гидроксиалкил" охватывает алкильные радикалы линейного или разветвленного строения, содержащие от 1 атома до приблизительно 10 атомов углерода, любой из которых может иметь в качестве заместителей один или несколько гидроксильных радикалов. Более предпочтительными являются "низшие гидроксиалкильные" радикалы, содержащие от 1 атома до 6 атомов углерода и один или несколько гидроксильных радикалов. Примерами таких радикалов являются гидроксиметил, гидроксиэтил, гидроксипропил, гидроксибутил и гидроксигексил. Еще более предпочтительными являются низшие гидроксиалкильные радикалы, имеющие от одного до трех атомов углерода. Термин "цианалкил" охватывает алкильные радикалы линейного или разветвленного строения, содержащие от 1 атома до приблизительно 10 атомов углерода, любой из которых может иметь в качестве заместителя радикал циан. Более предпочтительными являются "низшие цианоалкильные" радикалы, содержащие от 1 атома до 6 атомов угле-7 005599 рода и один циан. Еще более предпочтительными являются низшие цианоалкильные радикалы, имеющие от одного атома до трех атомов углерода. Примером такого радикала является цианметил. Термин "алкокси(группа)" охватывает радикалы линейного или разветвленного строения, содержащие оксигруппы,каждый из которых имеет в алкильной части от 1 атома до приблизительно 10 атомов углерода. Более предпочтительными алкоксильными радикалами являются "низшие алкоксигруппы", содержащие от 1 атома до 6 углеродных атомов. Примерами таких радикалов являются метокси-, этокси-, пропокси-, бутокси- и трет-бутоксигруппы. Еще более предпочтительными являются низшие алкоксильные радикалы,имеющие от 1 до 3 атомов углерода. Алкоксильные радикалы могут быть дополнительно замещены одним или несколькими атомами галогена, например, фтора, хлора или брома, при этом образуются галоидалкоксигруппы. Еще более предпочтительными являются низшие галогеналкоксильные радикалы,имеющие от 1 до 3 атомов углерода. Примерами таких радикалов являются фторметокси-, хлорметокси-,трифтометокси-, трифторэтокси-, фторэтокси- и фторпропоксигруппы. Термин "арил", употребленный сам по себе или в сочетании, означает карбоциклическую ароматическую систему, содержащую одно или два кольца, в которой указанные кольца могут быть соединены между собой промежуточными связями или конденсированы. Термин "арил" охватывает ароматические радикалы, например, фенил, нафтил, тетрагидронафтил, индан и бифенил. Более предпочтительным арилом является фенил. Указанная"арильная группа" может иметь от 1 заместителя до 3 заместителей, например, низших алкилов, гидроксилов, галоидов, галоидных алкилов, нитрогрупп, цианов, алкоксигрупп и низших алкиламинов. Термин "гетероциклил" охватывает насыщенные, частично ненасыщенные и ненасыщенные циклические(кольцеобразные) радикалы, содержащие гетероатомы, причем последние могут быть выбраны из группы, состоящей из азота, серы и кислорода. Примерами насыщенных гетероциклилов являются насыщенные гетеромоноциклические группы, содержащие от 3 членов до 6 членов и включающие от 1 атома до 4 атомов азота (например, пирролидинил, имидазолидинил, пиперидинил, пиперазинил); насыщенные гетеромоноциклические группы, содержащие от 3 членов до 6 членов и включающие от 1 атома до 2 атомов кислорода и от 1 атома до 3 атомов азота (например, морфолинил); насыщенные гетеромоноциклические группы, содержащие от 3 членов до 6 членов и включающие от 1 атома до 2 атомов серы и от 1 атома до 3 атомов азота (например, тиазолидинил). Примерами частично ненасыщенных гетероциклилов являются дигидротиофен, дигидропиран, дигидрофуран и дигидротиазол. Примеры ненасыщенных гетероциклилов, называемых также "гетероарилами", включают ненасыщенные гетеромоноциклические группы, содержащие 5 членов или 6 членов и включающие от 1 атома до 4 атомов азота, например, пирролил, пирролинил, имидазолил, пиразолил, 2-пиридил, 3-пиридил, 4-пиридил, пиримидил, пиразинил,пиридазинил, триазолилы (например, 4 Н-1,2,4-триазолил, 1 Н-1,2,3-триазолил, 2 Н-1,2,3-триазолил); ненасыщенные конденсированные гетероциклические группы, содержащие от 1 атома до 5 атомов азота, например, индолил, изоиндолил, индолизинил, бензимидазолил, хинолил, изохинолил, индазолил, бензотриазолил, тетразолпиридазинилы (например, тетразол[1,5-b]пиридазинил); ненасыщенные гетеромоноциклические группы, содержащие от 3 до 6 членов и включающие один атом кислорода, например, пиранил, 2-фурил, 3-фурил и т.п.; ненасыщенные гетеромоноциклические группы, содержащие 5 членов или 6 членов и включающие один атом серы, например, 2-тиенил, 3-тиенил и т.п.; ненасыщенные гетеромоноциклические группы, содержащие 5 членов или 6 членов и включающие 1 атом или 2 атома кислорода и от 1 атома до 3 атомов азота, например, оксазолил, изоксазолил, оксадиазолилы (например,1,2,4-оксадиазолил, 1,3,4-оксадиазолил, 1,2,5-оксадиазолил); ненасыщенные конденсированные гетероциклические группы, содержащие 1 атом или 2 атома кислорода и от 1 атома до 3 атомов азота (например, бензоксазолил, бензоксадиазолил); ненасыщенные гетеромоноциклические группы, содержащие 5 членов или 6 членов и включающие 1 атом или 2 атома серы и от 1 атома до 3 атомов азота, например,тиазолил, тиадиазолил (например, 1,2,4-тиадиазолил, 1,3,4-тиадиазолил, 1,2,5-тиадиазолил); ненасыщенные конденсированные гетероциклические группы, содержащие 1 атом или 2 атома серы и от 1 атома до 3 атомов азота (например, бензтиазолил, бензтиадиазолил) и другие. Этот термин охватывает также радикалы, в которых гетероциклилы конденсированы с арилами. Примерами таких конденсированных бициклических радикалов являются бензофуран, бензотиофен и другие. Упомянутые "гетероциклилы" могут нести от 1 заместителя до 3 заместителей, например, низших - алкилов, гидроксилов, оксогрупп,аминогрупп и низших алкиламиногрупп. Предпочтительные гетероциклические радикалы включают конденсированные или неконденсированные радикалы с числом членов от 5 до 10. Более предпочтительными примерами гетероарильных радикалов являются бензофурил, 2,3-дигидробензофурил, бензотиенил, индолил, дигидроиндолил, хроманил, бензопиран, тиохроманил, бензотиопиран, бензодиоксолил, бензодиоксанил, пиридил, тиенил, тиазолил, оксазолил, фурил и пиразинил. Еще более предпочтительными гетероарильными радикалами являются 5- или 6-членные гетероарилы, в состав которых входит один либо два гетероатома, которые выбирают из группы, включающей серу, азот или кислород, а также тиенил, фуранил, пирролил, тиазолил, оксазолил, имидазолил, пиразолил, изоксазолил, изотиазолил, пиридил, пиперидинил и пиразинил. Термин "сульфонил", употребленный сам по себе или в сочетании с другими терминами (например, алкилсульфонил), означает двухвалентный радикал -SO2-. Термин"алкилсульфонил" охватывает алкильные радикалы, присоединенные к сульфонильной группе, где алкил соответствует вышеприведенному определению. Более предпочтительными алкилсульфонилами являют-8 005599 ся "низшие алкилсульфонилы", содержащие от 1 атома до 6 атомов углерода. Еще более предпочтительными являются низшие алкилсульфонильные радикалы, имеющие от 1 до 3 атомов углерода. Примерами таких низших алкилсульфонилов являются метилсульфонил, этилсульфонил и пропилсульфонил. Термин "галоидалкилсульфонил" охватывает галоидалкильные радикалы, соответствующие вышеприведенному определению, присоединенные к сульфонильной группе. Более предпочтительными являются"низшие галоидалкилсульфонилы", содержащие от 1 атома до 6 атомов углерода. Еще более предпочтительными являются низшие галогеналкилсульфонильные радикалы, имеющие от 1 до 3 атомов углерода. Примером такого низшего галоидалкилсульфонила является трифторметилсульфонил. Термин "арилалкилсульфонил" охватывает арильные радикалы в соответствии с вышеприведенным определением, присоединенные к алкилсульфонильному радикалу. Примерами таких радикалов являются бензилсульфонил и фенилэтилсульфонил. Упомянутый термин "гетероциклосульфонильные" обозначает гетероциклические радикалы, в соответствии с определением, которое было приведено ранее, присоединенные к сульфонильному радикалу. В состав более предпочтительных гетероциклосульфонильных радикалов входят 5-7-членные гетероциклические радикалы, включающие 1 либо 2 гетероатома. Примерами таких радикалов являются тетрагидропирролилсульфонил, морфолинилсульфонил и азепинилсульфонил. Термины"сульфамил", "аминосульфонил" и "сульфонамидил", употребленные самостоятельно или в сочетаниях,например, "N-алкиламиносульфонил", "N-ариламиносульфонил", "N,N-диaлкилaминo-cyльфoнил" и "Nалкил-N-ариламиносульфонил", означают сульфонильный радикал, замещенный аминным радикалом с образованием сульфамидной группы (-SО 2NН 2). Термин "алкиламиносульфонил" охватывает термины"N-алкиламиносульфонил" и "N,N-диалкиламиносульфонил", где сульфамильный радикал замещен соответственно 1 или 2 алкилами. Более предпочтительными алкиламиносульфонилами являются "низшие алкиламиносульфонилы", содержащие от 1 атома до 6 атомов углерода. Еще более предпочтительными являются низшие алкиламиносульфонильные радикалы, имеющие от 1 до 3 атомов углерода. Примерами таких низших алкиламиносульфонилов являются N-метиламиносульфонил, N-этиламиносульфонил и Nметил-N-этиламиносульфонил. Термины "N-ариламиносульфонил" и "N-aлкил-N-ариламиносульфонил" означают сульфамильный радикал, замещенный соответственно одним арилом либо одним алкилом и одним арилом. Более предпочтительными N-aлкил-N-apилaминocyльфoнилaми являются "низшие Nалкил-N-ариламиносульфонилы", содержащие алкильные радикалы с числом атомов углерода от 1 до 6. Еще более предпочтительными являются низшие N-алкил-N-арилсульфонильные радикалы, имеющие от 1 до 3 атомов углерода. Примерами таких низших N-aлкил-N-apиламиносульфонилов являются N-метилN-фениламиносульфонил и N-этил-N-фениламиносульфонил. Примером N-ариламиносульфонила является N-фениламиносульфонил. Термин "арилалкиламиносульфонил" охватывает аралкильные радикалы в соответствии с вышеприведенным определением, присоединенные к аминосульфонильной группе. Более предпочтительными являются низшие арилалкиламиносульфонильные радикалы, имеющие от одного до трех атомов углерода. Термин "гетероциклиламиносульфонил" охватывает гетероциклилы в соответствии с вышеприведенным определением, присоединенные к аминосульфонильной группе. Термины"карбокси(группа)" или "карбоксил", употребленные сами по себе или в сочетаниях с другими терминами, например, "карбоксиалкил", означают группу -СО 2 Н. Термин "карбоксиалкил" охватывает группы,содержащие карбоксил в соответствии с вышеприведенным определением, присоединенный к алкильному радикалу. Термин "карбонил", употребленный сам по себе или в сочетании с другими терминами,например, "алкилкарбонил", означает группу -(С=О)-. Термин "ацил" означает радикал, образующийся как остаток после отщепления гидроксила от органической кислоты. Примерами ацильных радикалов являются алканоилы и ароилы. Примерами низших алканоилов являются формил, ацетил, пропионил,бутирил, изобутирил, валерил, изовалерил, пивалоил, гексаноил, трифторацетил. Термин "ароил" охватывает арильные радикалы, содержащие карбонил в соответствии с вышеприведенным определением. Примерами ароилов являются бензоил, нафтоил и т.п., причем арил в упомянутом ароиле может быть дополнительно замещен. Термин "алкилкарбонил" охватывает радикалы, содержащие карбонильный радикал, замещеннный алкилом. Более предпочтительными алкилкарбонильными радикалами являются"низшие алкилкарбонилы", содержащие от 1 атома до 6 атомов углерода. Еще более предпочтительными являются низшие алкилкарбонильные радикалы, имеющие от 1 до 3 атомов углерода. Примерами таких радикалов являются метилкарбонил и этилкарбонил. Термин "галоидалкилкарбонил" охватывает радикалы, содержащие карбонильную группу, замещенную галоидалкилом. Более предпочтительными галоидалкилкарбонильными радикалами являются "низшие галоидалкилкарбонилы", содержащие от 1 атома до 6 атомов углерода. Еще более предпочтительными являются низшие галогеналкилкарбонильные радикалы, имеющие от 1 атома до 3 атомов углерода. Примером такого радикала является трифторметилкарбонил. Термин "арилкарбонил" охватывает радикалы, содержащие карбонильную группу, замещенную арилом. Более предпочтительные арилкарбонилы включают фенилкарбонил. Термин "гетероарилкарбонил" охватывает радикалы, содержащие карбонильную группу, замещенную гетероарилом. Еще более предпочтительными являются 5- либо 6-членные гетероарилкарбонильные радикалы. Упомянутый термин "арилалкилкарбонильный" обозначает радикалы, карбонильный радикал которых замещен арилалкильным радикалом. Более предпочтительными радикалами являются фенил-C1-С 3-алкилкарбонил, в том числе, бензилкарбонил. Упомянутый термин "гетероарилалкилкарбонильный" обозначает радикалы,-9 005599 карбонильный радикал которых замещен гетероарилалкильным радикалом. Еще более предпочтительными являются низшие гетероарилалкилкарбонильные радикалы, имеющие 5-6-членные гетероарильные радикалы, присоединенные к алкильным составляющим, имеющим от одного до трех атомов углерода. Термин "алкоксикарбонил" означает радикал, содержащий алкоксигруппу в соответствии с вышеприведенным определением, присоединенную к карбонилу через атом кислорода. Предпочтительные "низшие алкоксикарбонилы" содержат алкоксигруппы с числом углеродных атомов от 1 до 6. Примерами таких"низших алкоксикарбонильных" сложноэфирных радикалов являются замещенные или незамещенные метоксикарбонил, этоксикарбонил, пропоксикарбонил, бутоксикарбонил и гексилоксикарбонил. Еще более предпочтительными являются низшие алкоксикарбонильные радикалы, имеющие алкоксильные составляющие, в состав которых входит от одного до трех атомов углерода. Термин "аминокарбонил",употребленный сам по себе или в сочетании с другими терминами, например, "аминокарбонилалкил","N-алкиламинокарбонил", "N-ариламинокарбонил", "N,N-диалкиламинокарбонил", "N-алкил-N-ариламинокарбонил", "N-алкил-N-гидроксиаминокарбонил" и "N-алкил-N-гидроксиаминокарбонилалкил",означает амидную группу формулы -C(=O)NH2. Термины "N-алкиламинокарбонил" и "N,N-диалкиламинокарбонил" означают аминокарбонил, замещенный соответственно 1 или 2 алкильными радикалами. Более предпочтительными являются "низшие алкиламинокарбонилы", содержащие присоединенные к аминокарбонилу низшие алкилы в соответствии с вышеприведенным определением. Термины "Nариламинокарбонил" и "N-алкил-N-ариламинокарбонил" означают аминокарбонильные радикалы, замещенные соответственно 1 арильным радикалом или 1 алкильным и 1 арильным радикалами. Термин "Nциклоалкиламинокарбонил" означает аминокарбонил, замещенный по крайней мере одним циклоалкилом. Более предпочтительны "низшие циклоалкиламинокарбонилы", содержащие присоединенный к аминокарбонилу низший циклоалкил с числом углеродных атомов от 3 до 7. Термин "аминоалкил" охватывает алкилы, замещенные аминогруппами. Термин "алкиламиноалкил" охватывает аминоалкилы, в которых атом азота замещен алкилом. Еще более предпочтительными являются низшие алкиламиноалкильные радикалы, имеющие от 1 до 3 атомов углерода. Термин "гетероциклилалкил" охватывает алкилы, замещенные гетероциклическими радикалами. Более предпочтительными гетероциклилалкилами являются "5- или 6-членные гетроарилалкилы", содержащие от 1 атома до 6 атомов углерода в алкиле и 5- или 6-членный гетероарильный радикал. Еще более предпочтительными являются низшие гетероарилалкильные радикалы, имеющие алкильные составляющие, в состав которых входит от одного атома до трех атомов углерода. К примерам относятся такие радикалы, как пиридилметил и тиенилметил. Термин"аралкил" охватывает арилзамещеннные алкилы. Предпочтительными аралкильными радикалами являются "низшие аралкилы", в которых арил просоединен к алкилу с числом атомов углерода от 1 до 6. Еще более предпочтительными являются низшие аралкильные радикалы, присоединенные с помощью фенила к алкильным составляющим, имеющим от одного до трех атомов углерода. Примерами таких радикалов являются бензил, дифенилметил и фенилэтил. Арильный фрагмент в аралкиле может быть дополнительно замещен галоидом, алкилом, алкоксигруппой, галоидным алкилом и галоидалкоксигруппой. Термин"арилалкенил" охватывает арилзамещенные алкенилы. Предпочтительными арилалкенильными радикалами являются "низшие арилалкенилы", в которых арил присоединен к алкенилу с числом углеродных атомов от 2 до 6. Примером такого радикала может служить фенилэтенил. Арильный фрагмент в арилалкениле может быть дополнительно замещен галоидом, алкилом, алкоксигруппой, галоидным алкилом и галоидалкоксигруппой. Термин "арилалкинил" охватывает арилзамещенные алкинилы. Предпочтительными арилалкинильными радикалами являются "низшие арилалкинилы", в которых арил присоединен к алкинилу с числом углеродных атомов от 2 до 6. Примером такого радикала может служить фенилэтинил. Арильный фрагмент в арилалкиниле может быть дополнительно замещен галоидом, алкилом, алкоксигруппой, галоидным алкилом и галоидалкоксигруппой. Термины "бензил" и "фенилметил" являются взаимозаменяемыми. Термин "алкилтио(группа)" охватывает радикалы, содержащие алкил линейного или разветвленного строения, содержащий от 1 до 10 углеродных атомов, присоединенный к двухвалентному атому серы. Еще более предпочтительными являются низшие алкилтиорадикалы, имеющие от 1 до 3 атомов углерода. Примером алкилтиогруппы является метилтиогруппа (СН 3S-). Термин "галоидалкилтиогруппа" охватывает радикалы, содержащие галоидалкил с числом атомов углерода от 1 до 10,присоединенный к двухвалентному атому серы. Еще более предпочтительными являются низшие галогеналкилтиорадикалы, имеющие от одного до трех атомов углерода. Примером галоидалкилтиогруппы является трифторметилтиогруппа. Термин "алкилсульфинил" охватывает радикалы, содержащие алкил линейного или разветвленного строения, содержащий от 1 атома до 10 атомов углерода, присоединенный к двухвалентной группе -S(=O)-. Более предпочтительными являются низшие алкилсульфинильные радикалы, имеющие от одного атома до трех атомов углерода. Термин "арилсульфинил" охватывает радикалы, содержащие арил, присоединенный к двухвалентной группе -S(=O)-. Еще более предпочтительными являются факультативно замещенные фенилсульфинильные радикалы. Термин "галоидалкилсульфинил" охватывает радикалы, содержащие галоидный алкил линейного или разветвленного строения, содержащий от 1 атома до 10 атомов углерода, присоединенный к двухвалентной группе -S(=O)-. Еще более предпочтительными являются низшие галогеналкилсульфинильные радикалы, имеющие от 1 до 3 атомов углерода. Термины "N-алкиламино-(группа)" и "N,N-диалкиламино(группа), означают амино-10 005599 группу, замещенную соответственно одним или двумя алкильными радикалами. Предпочтительными являются "низшие алкиламиногруппы", содержащие 1 или 2 алкильных радикала с числом атомов углерода от 1 до 6. Еще более предпочтительными являются низшие алкиламинорадикалы, имеющие от 1 до 3 атомов углерода. Предпочтительные низшие алкиламиногруппы могут представлять собой моно- или диалкиламиногруппы, например N-метиламиногруппу, N-этиламиногруппу, N,N-диметиламиногруппу,N,N-диэтиламиногруппу и т.п. Термин "ариламино(группа)" означает аминогруппу, замещенную одним или двумя арильными радикалами, например, N-фениламиногруппу. Ариламиногруппы могут иметь в арильном фрагменте дополнительные заместители. Термин "гетероариламино(группа)" означает аминогруппу, замещенную 1 или 2 гетероарильными радикалами, например, N-тиениламиногруппу. Гетероариламиногруппы могут иметь в гетероарильном фрагменте дополнительные заместители. Термин "аралкиламино(группа)" означает аминогруппу, замещенную одним или двумя аралкильными радикалами. Более предпочтительными являются фенил-C1-С 3-алкиламинорадикалы, например, N-бензиламино. Аралкиламиногруппы могут иметь в арильном фрагменте дополнительные заместители. Термины "Nалкил-N-ариламино(группа)" и "N-аралкил-N-алкиламино(группа)" означают аминогруппу, замещенную соответственно одним арильным и одним алкильным радикалами или одним аралкильным и одним арильным радикалами. Термин "арилтио(группа)" охватывает арильные радикалы с числом атомов углерода от 6 до 10, присоединенные к двухвалентному атому серы. Более предпочтительными являются фенил-C1-С 3-алкилтиорадикалы. Примером "аралкилтио" является бензилтио. Упомянутый термин "аралкилсульфонил" обозначает аралкильные радикалы, в соответствии с описанием, которое было приведено ранее, присоединенные к двухвалентному сульфонильному радикалу. Более предпочтительными являются фенил-C1-С 3-алкилсульфонильные радикалы. Упомянутый термин "арилокси" обозначает факультативно замещенные арильные радикалы, в соответствии с определением, которое было представлено ранее, присоединенные к атому кислорода. Примерами таких радикалов являются фенокси. Упомянутый термин "аралкокси" обозначает аралкильные радикалы, в состав которых входит оксигруппа, присоединенные через атом кислорода к другим радикалам. Более предпочтительными аралкоксирадикалами являются "низшие аралкокси" радикалы, имеющие факультативно замещенные фенильные радикалы, присоединенные к низшему алкоксирадикалу в соответствии с описанием, которое было приведено ранее. Семейство соединений формулы I" включает также стереоизомерные формы этих соединений. Соединения в соответствии с настоящим изобретением могут содержать один или несколько асимметрических атомов углерода и, следовательно, могут существовать в виде оптических изомеров, а также в форме рацемических или нерацемических смесей таких изомеров. Соответственно, некоторые соединения в соответствии с настоящим изобретением могут присутствовать в рацемических смесях, которые также включены в объем изобретения. Оптические изомеры можно получить путем разделения рацемических смесей с применением известных способов, например,способом получения диастереоизомерных солей путем обработки оптически активным основанием с последующим разделением смеси диастереоизомеров методом кристаллизации и выделением из полученных солей оптически активных соединений. Примерами оснований, которые можно применить для этой цели, являются бруцин, стрихнин, дегидроабиэтиламин, хинин, цинхонидин, эфедрин, -метилбензиламин, амфетамин, деоксифедрин, промежуточный продукт получения хлорамфеникола, 2-амино 1-бутанол и 1-(1-нафтил)этиламин. Другим способом разделения оптических изомеров является применение хроматографии с хиральным сорбентом, оптимально подобранным для обеспечения максимальной степени разделения энантиомеров. Еще один практически возможный способ состоит в синтезе ковалентных диастереоизомерных молекул. Синтезированные диастереоизомеры можно разделить известными способами, например, хроматографией, дистилляцией, кристаллизацией либо сублимацией, а затем гидролизовать для получения энантиомерно чистого соединения. Оптически активные соединения формулы I можно получить также, используя оптически активные исходные материалы. Эти изомеры могут иметь форму свободных кислот, свободных оснований, сложных эфиров или солей. Можно применять другие способы разделения оптических изомеров, известные специалистам, например, те, которые описаны в монографии Жака и др. (J. Jaques et al., Enantiomers, Racemates and Resolutions, John Wiley andSons, New York (1981. В семейство соединений формул I" включены те формы их, в которых кислотные группы защищены амидированием, например, эфиры, гидроксиаминопроизводные, амиды и сульфонамиды. Так, первичные и вторичные амины могут реагировать с хромен-3-карбоновыми кислотами формулы I", образуя амиды, которые могут быть полезны в качестве пролекарств. Предпочтительно использовать для этой цели гетероциклические амины, в том числе факультативно замещенные аминотиазолы, факультативно замещенные аминоизоксазолы и факультативно замещенные аминопиридины, производные анилина,сульфамиды, аминокарбоновые кислоты и др. Кроме того, 1-ацилдигидрохинолины могут служить пролекарствами для 1H-дигидрохинолинов. Упомянутые эфиры, гидроксиаминопроизводные и сульфонамиды могут быть получены из упомянутых кислот способами, известными специалисту в данной области техники. В семейство соединений формулы I" включены также их фармацевтически приемлемые соли. Термин "фармацевтически приемлемые соли" охватывает обычно применяемые соли щелочных металлов и-11 005599 соли, образующиеся при присоединении свободных кислот или свободных оснований. Природа соли не имеет существенного значения при условии, что она фармацевтически приемлема. Пригодные для целей настоящего изобретения фармацевтически приемлемые соли, образующиеся при присоединении кислот к соединениям формулы I", могут быть получены с использованием неорганических или органических кислот. Примерами таких неорганических кислот являются хлористо-водородная, бромисто-водородная,йодисто-водородная, азотная, угольная, серная и фосфорная кислоты. Пригодные органические кислоты могут быть выбраны из классов алифатических, циклоалифатических, ароматических, аралифатических,гетероциклических карбоновых и сульфоновых кислот, примерами которых являются муравьиная, уксусная, пропионовая, янтарная, гликолевая, глюконовая, молочная, яблочная, винная, лимонная, аскорбиновая, глюкуроновая, малеиновая, фумаровая, пировиноградная, аспарагиновая, глутаминовая, бензойная, антраниловая, мезиловая, 4-гидроксибензойная, фенилуксусная, миндальная, эмбоновая (памовая), метансульфоновая, этансульфоновая, бензолсульфоновая, пантотеновая, 2-гидроксиэтансульфоновая, толуолсульфоновая, сульфаниловая, циклогексиламиносульфоновая, стеариновая, альгеновая,-гидроксимасляная, салициловая, галактаровая и галактуроновая кислоты. Пригодные для целей настоящего изобретения фармацевтически приемлемые соли, образующиеся при присоединении оснований к соединениям формулы I-I", включают соли металлов, например, алюминия, кальция, лития, магния,калия, натрия и цинка или соли органических оснований, в том числе первичных, вторичных и третичных аминов, замещенных аминов, в том числе циклических аминов, например, кофеина, аргинина, диэтиламина, N-этилпиперидина, гистидина, глюкамина, изопропиламина, лизина, морфолина, Nэтилморфолина, пиперазина, пиперидина, триэтиламина, триметиламина. Все эти соли могут быть получены известными способами из соответствующих соединений в соответствии с настоящим изобретением путем реакции, например, соответствующей кислоты или основания с соединением формулы I". Общие методики синтеза Соединения в соответствии с настоящим изобретением можно синтезировать по нижеследующим методикам, представленным на схемах 1-16, в которых подразумевается, что, за исключением специально оговариваемых случаев, заместители R1-R6 соответствуют определениям, данным выше при описании формул I". Схема 1 Схема 1 иллюстрирует общий способ получения широкого разнообразия замещенных производных 3 и 4 2 Н-1-бензопирана. На стадии 1 соответствующее производное 1 орто-оксибензальдегида (салицилового альдегида) конденсируют с производным акрилата 2 в присутствии основания, например, карбоната калия, в растворителе, например, диметилформамиде, для получения сложного эфира 3 2 Н-1 бензопирана. Альтернативное сочетание основания и растворителя для этой конденсации включает органическое основание, например, триэтиламин, и диметилсульфоксид в качестве растворителя. На стадии 2 сложный эфир гидролизуют для получения соответствующей кислоты, например, путем обработки водным раствором основания (гидроксида натрия) в подходящем растворителе, например, в этаноле, с получением после подкисления замещенной 2 Н-1-бензопиран-3-карбоновой кислоты 4. Схема 2 Е, Е'=галоген, ацил, сульфонил Схема 2 иллюстрирует общий способ введения функциональных групп в 2 Н-1-бензопираны. Обработка 2 Н-1-бензопиранкарбоновой кислоты 4 или ее сложного эфира 3 электрофильным агентом дает замещенный в положении 6 2 Н-1-бензопиран 5. Существует широкое разнообразие электрофильных агентов, селективно реагирующих с 2 Н-1-бензопиранами 4 в положении 6, образуя новые аналоги с высоким выходом. Электрофильные реагенты типа галоидов (например, хлор или бром) дают 6 галоидпроизводные. Хлорсульфоновая кислота реагирует с образованием в положении 6 сульфохлорида,-12 005599 который может быть превращен в сульфамид или сульфон. Ацилирование 4 по Фриделю-Крафтсу дает 6 ацилированные 2 Н-1-бензопираны с хорошими, а иногда с отличными выходами. Для проведения селективных реакций с этими 2 Н-1-бензопиранами можно использовать аналогичным образом большое число других электрофильных соединений. Замещенный в положении 6 2 Н-1-бензопиран может реагировать с электрофильным реагентом в положении 8, для этого применяют способы, аналогичные описанным для электрофильного замещения в положении 6. При этом получают 2 Н-1-бензопираны, замещенные в обоих положениях 6 и 8. Схема 3 Схема 3 иллюстрирует второй общий метод синтеза замещенных 2 Н-1-бензопиран-3-карбоновых кислот, позволяющий вводить заместители в положение 4 2 Н-1-бензопирана. В этом случае имеющийся в продаже или специально синтезированный орто-гидроксиацетофенон 6 обрабатывают двумя или более эквивалентами сильного основания, например, бис(триметилсилил)амида лития, в растворителе, например, тетрагидрофуране (ТГФ), с последующим реагированием с диэтилкарбонатом для получения сложного бета-кетоэфира 7. Сложный эфир 7 конденсируют при нагревании с хлорангидридом или ангидридом кислоты в присутствии основания, например, карбоната калия, в растворителе, например, в толуоле,получая 4-оксо-4 Н-1-бензопиран 8. Восстановление олефина можно осуществить с применением разнообразных агентов, в том числе боргидрида натрия (NaBH4), в смесовом растворителе, например, в смеси этанола с тетрагидрофураном (ТГФ), или используя триэтилсилан в растворителе типа, например, трифторуксусной кислоты, либо каталитически с применением палладия на активном угле и газообразного водорода в растворителе типа этанола; таким образом получают новый сложный бета-кетоэфир 9 (на схеме показаны две его таутомерные структуры). Ацилирование кето-енолата по кислороду в присутствии основания, например, 2,6-ди-трет-бутил-4-метилпиридина, ацилирующего агента, например ангидрида трифторметансульфокислоты, в среде растворителя, например, хлористого метилена, дает енолтрифлат (трифторметансульфонат) 10. Трифлат 10 можно восстановить различными способами, например, действием гидрида три-n-бутилолова, хлорида лития и катализатора на основе палладия (0), например, тетракис(трифенилфосфин)палладия (0) в растворителе, например, в тетрагидрофуране, получив таким образом сложный эфир 11 2 Н-1-бензопиран-карбоновой кислоты, в котором R" - водород. Сложный эфир 11 можно омылить, используя основание, например, 2,5N раствор гидроксида натрия в смесовом растворителе, например, смеси тетрагидрофуран-этанол-вода (7:2:1), и получить требуемую замещенную 2 Н-1-бензопиран-3-карбоновую кислоту. Для введения углеводородного фрагмента R3 можно обработать трифлат 10 реагентами, известными как способные к "перекрестному сочетанию", например, трибутилэтенилоловом, хлоридом лития и катализатором на основе палладия (0), например, тетракис(трифенилфосфин)палладия (0) в растворителе,например в тетрагидрофуране, получив таким образом сложный эфир 11 2 Н-1-бензопиран-карбоновой кислоты, в котором R3 представляет собою винильную группировку. Сложный эфир 11 можно омылить,используя основание, например, 2,5N раствор гидроксида натрия в смесовом растворителе, например,смеси тетрагидрофуран-этанол-вода (7:2:1), и получить требуемую 4-винил-2 Н-1-бензопиран-3 карбоновую кислоту (12, где R" - группа СН 2 СН-). Подобным же образом трифлат 10 можно в аналогичных условиях превратить воздействием три-n-бутилфенилолова в 2 Н-1-бензопиран, где R3 представляет собою фенил, и гидролизом сложного эфира превратить последний в карбоновую кислоту 12, где R3 фенил. Применяя тот же принцип, можно вводить в качестве заместителя R3 замещенные олефины, замещенные ароматические фрагменты, замещенные гетероарилы, ацетилены и замещенные ацетилены. Схема 4 иллюстрирует альтернативный общий метод синтеза 4-оксо-4 Н-1-бензопирана 8. Обработка орто-фторбензоилхлорида соответствующим замещенным сложным бета-кетоэфиром 14 в присутствии основания, например, карбоната калия, в растворителе, например, в толуоле, дает 4-оксо-4 Н-1 бензопиран 8. Последний можно превратить в 2 Н-1-бензопиран 12 способом, описанным в cхеме 3. Схема 5Y=Br, I, CF3SO3 Схема 5 представляет общий метод введения заместителя в ароматический цикл 2 Н-1-бензопирана. Это замещение можно осуществить через палладийорганические соединения, применяя способ "перекрестного сочетания" с использованием катализатора на основе палладия (0) для сочетания бензопирана 15 в положении Y, где Y - йодид, бромид или трифлат, с ацетиленом, олефином, нитрилом или арилом. Замещенные ацетилены в качестве агентов сочетания дают соответствующие замещенные ацетиленовые производные. Замещенные арильные фрагменты можно ввести, используя арилборные кислоты или их сложные эфиры; нитрилы можно ввести, используя цианид цинка (II). Полученный сложный эфир 16 можно превратить в карбоновую кислоту 17 по способу, описанному в cхеме 1. Другой способ замещения арильного фрагмента бензопирана 15 состоит в превращении заместителя Y (где Y - йодид или бромид) в перфторалкильную группу. Примером применения такого способа является превращение 15 (где Y - йодид) в 16 (где R2' - пентафторэтил) с использованием пентафторпропионата калия и йодистой меди (I) в гексаметилфосфорамиде (ГМФА). Полученный сложный эфир 16 можно превратить в карбоновую кислоту 15 по способу, описанному в cхеме 1. Аналогичный способ обеспечивает замещение ароматического цикла в дигидрохинолин-3 карбоксилатах. Оно может быть выполнено путем сочетания палладийорганических соединений с арилиодидами, арилбромидами или арилтрифлатами и различными реагентами сочетания (см. R.F. Heck,Palladium Reagents in Organic Synthesis, Academic Press 1985). Используя в этой реакции соответствующий палладиевый катализатор, например, тетракис(трифенилфосфин)палладий (0), можно получить дизамещенные алкины, применяя алкины в качестве агентов сочетания; фенилборные кислоты дают соединения бифенила, а цианиды - цианарилы. Для селективного проведения реакции с замещенными дигидрохинолин-3-карбоксилатами можно аналогичным образом применять большое число других палладиевых катализаторов и агентов сочетания. Схема 6 Схема 6 иллюстрирует в общем виде способ превращения имеющихся в продаже или специально синтезируемых замещенных фенолов в замещенные салициловые альдегиды. Несколько различных методов, в которых используется формальдегид или химически эквивалентный ему реагент, подробнее описаны ниже. Реакция соответствующего замещенного фенола 18 в основной среде с формальдегидом (либо его химическим эквивалентом) дает замещенный салициловый альдегид 1. Промежуточный продукт - ортогидроксиметилфенол 19 - при соответствующих условиях реакции можно окислить до салицилальдегида 1 in situ. В качестве основания обычно используют этилмагнийбромид или метилат магния (1 эквивалент), в качестве растворителя - толуол, в качестве источника формальдегида -параформальдегид (2 эквивалента или более), а также гексаметилфосфорамид (ГМФА) или N,N,N',N'-тетраметилэтилендиамин(ТМЭДА) (см. Casiraghi et al., J.C.S. Perkin I, 1978, 318-321). В качестве альтернативы можно вводить в реакцию с формальдегидом соответствующий замещенный фенол 18 в водной основной среде, получая замещенный орто-гидроксибензиловый спирт 19 (см.: a)J. Leroy and С. Wakselman, J. Fluorine Chem. 40, 23-32 (1988); b) A.A. Moshfegh et al., Helv. Chim. Acta 65,1229-1332 (1982. В качестве оснований обычно применяют водные растворы гидроксида калия или гидроксида натрия. Источником формальдегида обычно служит формалин (38%-ный водный раствор-14 005599 формальдегида). Полученный орто-гидроксибензиловый спирт можно превратить в салициловый альдегид 1 действием окислителя, например, диоксида марганца (IV), в растворителе, например, хлористом метилене или хлороформе (см. R.-G. Xie et al., Synthetic Commun. 24, 53-58 (1994. Соответствующий замещенный фенол 18 можно обработать в кислой среде гексаметилентетрамином (ГМТА) и получить таким образом салициловый альдегид 1 (реакция Даффа; см. Y. Suzuki and H.Takahashi, Chem. Pharm. Bull. 31, 1751-1753 (1983. При проведении этой реакции обычно используют такие кислоты, как уксусная, борная, метансульфоновая или трифторметан-сульфоновая. Источником формальдегида является обычно гексаметилен-тетрамин. Схема 7 Схема 7 представляет реакцию Раймера-Тимана, при которой имеющийся в продаже либо специально синтезированный соответствующий замещенный фенол 18 реагирует в основной среде с хлороформом, образуя замещенный салициловый альдегид 1 (см. Cragoe E.J., Schultz E.M., патент США 3,794,734, 1974). Схема 8 Схема 8 иллюстрирует превращение имеющейся в продаже или специально синтезированной замещенной салициловой кислоты 21 в соответствующий салициловый альдегид 1 через промежуточный 2 гидроксибензиловый спирт 19. Восстановление салициловой кислоты 21 можно осуществить, используя восстановитель типа гидрида, например, бороводород, в растворителе, например, тетрагидрофуране. Обработка промежуточного продукта - 2-гидроксибензилового спирта 19 - окислителем, например, оксидом марганца (IV), в растворителе, например, в хлористом метилене или хлороформе, дает салициловый альдегид 1. Схема 9 Схема 9 иллюстрирует общий способ получения широкого разнообразия замещенных 2 трифторметил-2 Н-1-бензотиопиран-3-карбоновых кислот (25). На стадии 1 в соответствующий имеющийся в продаже или специально синтезированный замещенный тиофенол 22 вводят в орто-положение металлоорганическую группу, используя в качестве основания ТМЭДА (N,N,N',N'-тетраметилэтилендиамин), с последующей обработкой диметилформамидом для получения 2-меркаптобензальдегида 23. Конденсация 2-меркаптобензальдегида 23 с акрилатом 2 в присутствии основания дает сложный эфир 24, который можно омылить в присутствии водного раствора основания, получая замещенную 2 Н-1-бензотиопиран-3-карбоновую кислоту 25. Схема 10-15 005599 Схема 10 иллюстрирует способ получения замещенного 2-меркапто-бензальдегида из соответствующего замещенного салицилового альдегида, имеющегося в продаже либо специально синтезированного. На стадии 1 фенольный гидроксил салицилового альдегида 1 превращают в соответствующий Oарилтиокарбамат 26 путем ацилирования соответствующим замещенным тиокарбамоилхлоридом, например, N,N-диметилтиокарбамоилхлоридом, в раствоителе, например, диметилформамиде, в присутствии основания, например, триэтиламина. На стадии 2 O-арилтиокарбамат 26 подвергают перегруппировке в S-арилтиокарбамат 27 путем нагревания до достаточно высокой температуры, например, 200 С, либо без применения растворителя, либо в присутствии растворителя, например, N,N-диметиланилина (см.A. Levai and P. Sebok, Synth. Commun. 22, 1735-1750 (1992. Гидролиз S-арилтиокарбамата 27 в присутствии основания, например, 2,5N раствора гидроксида натрия, в смесовом растворителе, например, смеси тетрагидрофурана с этанолом, дает замещенный 2-меркапто-бензальдегид 23, который может быть превращен в замещенную 2 Н-1-бензопиран-3-карбоновую кислоту 25, как описано на cхеме 9. Схема 11 Схема 11 иллюстрирует общий метод получения широкого разнообразия производных 30 дигидрохинолин-3-карбоновой кислоты. На схеме R2 представляет замещение в ароматическом цикле имеющегося в продаже либо специально синтезированного 2-аминобензальдегида 28. Производное 28 2 аминобензальдегида, где R2 представляет различные заместители, конденсируют с производным 2 акрилата в присутствии основания, например, карбоната калия, триэтиламина или диазабицикло[2,2,2]ундец 7-ена, в растворителе, например, диметилформамиде, получая сложный эфир 29 дигидрохинолин-3 карбоновой кислоты. Сложный эфир 29 можно омылить до соответствующей кислоты, например, путем обработки водным раствором неорганического основания, например, 2,5N гидроксидом натрия, в соответствующем растворителе, например, в этаноле; после подкисления получают требуемую дигидрохинолин-3-карбоновую кислоту 30. Схема 12 Схема 12 иллюстрирует получение дигидрохинолин-3-карбоновой кислоты 30 из 2-аминобензойной кислоты 31. На схеме R2 представляет замещение в ароматическом цикле имеющейся в продаже либо специально синтезированной 2-аминобензойной кислоты 31. Восстановление аминобензойной кислоты 31 до необходимого 2-аминобензилового спирта 32 осуществляют с помощью восстановителя типа гидрида, например, бороводорода, в растворителе, например, в тетрагидрофуране. Обработка полученного 2-аминобензилового спирта 32 окислителем, например, оксидом марганца (IV), в растворителе, например, хлористом метилене, дает требуемый 2-аминобензальдегид 28 (см. С.Т. Alabaster et al., J. Med. Chem. 31, 2048-2056 (1988. 2-аминобензальдегид превращают в соответствующую дигидрохинолин-3 карбоновую кислоту 30, как описано на схеме 11. Схема 13 Схема 13 иллюстрирует общий способ получения широкого разнообразия производных 30 дигидрохинолин-3-карбоновой кислоты из изатинов 33. На схеме R2 представляет замещение в ароматическом-16 005599 цикле имеющегося в продаже либо специально синтезированного изатина 33. Изатин 33 обрабатывают основным пероксидом, получаемым из пероксида водорода и основания, например, гидроксида натрия,получая соответствующую 2-аминобензойную кислоту 31 (см. M.S. Newman and M.W. Lougue, J. Org.Chem. 36, 1398-1401 (1971. 2-аминобензойные кислоты 31 превращают затем в требуемые производные 30 дигидрохинолин-3-карбоновой кислоты, как описано на схеме 12. Схема 14 Схема 14 иллюстрирует другой общий способ получения производных 30 дигидрохинолин-3 карбоновой кислоты. На стадии 1 соответствующий имеющийся в продаже либо специально синтезированный замещенный анилин 34 подвергают обработке ацилирующим агентом, например, пивалоилхлоридом, получая амид 35. Орто-дианион амида 35 получают, обрабатывая амид 35 литий-органическими основаниями, например, n-бутиллитием или трет-бутиллитием, в тетрагидрофуране при пониженной температуре. Дианион нейтрализуют диметилформамидом,получая ацилированный 2 аминобензальдегид 36 (см. J. Turner, J. Org. Chem. 48, 3401-3408 (1983. Проводя реакцию этого альдегида в присутствии основания, например, гидрида лития, с акрилатом с последующей обработкой водным раствором органического основания и гидролизом, например, обработкой водным раствором гидроксида натрия, в растворителе, например, в этаноле, получают после подкисления соответствующее производное 30 дигидрохинолин-3-карбоновой кислоты. Схема 15 Схема 15 иллюстрирует общий способ алкилирования производных 29 сложных эфиров дигидрохинолин-3-карбоновой кислоты у атома азота. Стадия 1 предусматривает обработку производного 29 сложного эфира дигидрохинолин-3-карбоновой кислоты галоидным алкилом, например, йодэтаном, в присутствии катализатора фазового переноса, например, тетрабутиламмоний-йодида, и основания, например, едкого натра (50%-ного водного гидроксида натрия) в растворителе, например, хлористом метилене. В этих условиях получают N-алкилированные сложные эфиры 37 дигидрохинолин-3-карбоновой кислоты. Омыление соединений 37 водным раствором основания дает N-алкилированные производные 38 дигидрохинолин-3-карбоновой кислоты. Схема 16 На схеме синтеза 16 показан общий способ получения 7-эфир (Z1=O)- либо тиоэфир 1=S)замещенного бензопиран-3-карбонового эфира. Соответствующим образом замещенный фенол, тиофенол, гидроксильный гетероцикл, меркаптогетероцикл, спирт либо алкилтиол может конденсироваться в-17 005599 основных условиях с использованием основания, например, карбоната калия, в растворителе, например,диэтилсульфоксиде, при температуре, превышающей комнатную температуру, например, 100 С, с соответствующим образом замещенным производным 30 7-фторбензопирана с получением соответствующего эфира либо тиоэфира. Посредством гидролиза упомянутого эфира с помощью водного раствора основания, например, гидроксида лития либо гидроксида натрия, в смеси растворителей, например, тетрагидрофурана-этанола-воды, получают кислоту, после чего соответствующий тиоэфир 2=S) может оксидироваться до сульфоксида 2=SO) либо сульфона (Z2=SO2) с помощью окислителя, например, OXONE либоm-CPBA (хлорпероксибензойная кислота) до либо после гидролиза эфира. В этой схеме Rd может включать арил, гетероарил, гетероциклическую, алилциклическую, разветвленную либо неразветвленную алифатическую, разветвленную либо неразветвленную перфторалифатическую составляющую. Нижеприведенные примеры содержат подробные описания способов получения соединений формулы I". Эти подробные описания охватываются вышеописанными общими методиками синтеза, являющимися составной частью настоящего изобретения, и служат примерами их осуществления. Эти подробные описания представлены только в иллюстративных целях и не ограничивают пределы изобретения. За исключением специально оговариваемых случаев, все соотношения даны в массовых частях, а температуры - в градусах стоградусной шкалы. ЯМР-спектры всех соединений соответствуют приписанным им структурам. Использованы следующие сокращения: НСl - хлористо-водородная кислотаNa2SO4 - сульфат натрия ДМФ - диметилформамид ТГФ - тетрагидрофуранNaBH4 - боргидрид натрия ТМЭДА - тетраметилэтилендиамин ГМТА - гексаметилентетрамин ДМСО - диметилсульфоксид ГМФА - гексаметилтриамид фосфорной кислоты (гексаметилфосфорамид) 6-Хлор-2-трифторметил-4-этенил-2 Н-1-бензопиран-3-карбоновая кислота. Стадия 1. Получение этил-3-(5-хлор-2-гидроксифенил)-3-оксопропионата. Раствор гексаметилдисилазида лития (800 мл 1,0 М раствора в тетрагидрофуране, 800,0 ммоль) охлаждали до -78 С в атмосфере азота. Добавляли при перемешивании по каплям в течение 0,5 ч раствор 5 хлор-2-гидроксиацетофенона (45,493 г, 266,67 ммоль) в тетрагидрофуране (130 мл). Выдерживали реакционную массу при -78 С в течение 1 ч, нагревали до -10 С и выдерживали при этой температуре в течение 2 ч, затем нагревали до 0 С и выдерживали 1 ч, после чего вновь охлаждали до -78 С. С помощью шприца добавляли к смеси одной порцией диэтилкарбонат (35,54 мл, 34,65 г, 29,34 ммоль). Выдерживали смесь при температуре -78 С в течение 0,5 ч, затем в течение 0,5 ч нагревали до температуры помещения и перемешивали в течение 3 ч. Осторожно выливали реакционную массу в интенсивно перемешиваемую смесь льда (1200 мл) и концентрированной хлористо-водородной кислоты(222 мл). Разделяли слои и экстрагировали водный слой этилацетатом. Соединенные органические фазы промывали рассолом, сушили над сульфатом натрия, фильтровали и концентрировали в вакууме, получая масло, которое начинало кристаллизоваться. Добавляли гексан (150 мл) и продолжали кристаллизацию. Кристаллический продукт отделяли фильтрованием с отсасыванием и получали указанное в заголовке соединение (29,04 г, выход 45%) в виде желто-коричневых игольчатых кристаллов с т.пл. 71,873,1 С. 1H ЯМР (СDСl3/300 МГц) 7,63 (d, 1H, J=2,4 Гц), 7,45 (dd, 1H, J=8,9, 2,6 Гц), 6,98 (d, 1H, J=8,9 Гц),4,25 (q, 2H, J=7,3 Гц), 3,98 (s, 2H), 1,29 (t, 3H, J=7,3 Гц). FABLRMS m/z 249 (M+Li). EIHRMS m/z 242,0346 (M+, рассчитано 242,0346). Анал. рассчитано для С 11 Н 11 СlO4: С, 54,45; Н, 4,57. Установлено: С,54,48; Н, 4,62. Стадия 2. Получение этил-2-трифторметил-6-хлор-4-оксо-4 Н-1-бензопиран-3-карбоксилата. Сложный кетоэфир, полученный на стадии 1 (19,2 г, 79,1 ммоль), прибавляли к смеси трифторуксусного ангидрида (67,2 мл, 49,9 г, 475,8 ммоль), карбоната калия (44 г, 318 ммоль) и толуола (400 мл). Полученную суспензию перемешивали в течение 36 ч при температуре помещения, а затем нагревали с обратным холодильником в течение 4 ч. После охлаждения до температуры помещения суспензию выливали в интенсивно перемешиваемую (механической мешалкой) смесь льда (300 мл) и водного раствора хлористо-водородной кислоты (12N, 50 мл). Полученную органическую фазу отделяли от прозрачной смеси, промывали водой (5 х 500 мл), рассолом (1 х 500 мл), сушили над сульфатом магния, фильтровали и концентрировали в вакууме, получая твердое вещество желто-коричневого цвета, которое высушивали в глубоком вакууме. Этот продукт частично растворяли в гептане (100 мл) и этилацетате (12 мл) при нагревании на паровой бане и фильтровали для отделения нерастворимого остатка. Фильтрат оставляли для охлаждения до температуры помещения и получали требуемое производное 4-оксо-4 Н-1-бензопирана в виде легких мелких кристаллов желто-коричневого цвета (14,17 г, выход 56%) с т.пл. 106,7-108,6 С. Чистота продукта была достаточной для использования его на следующей стадии без дополнительной очистки. Стадия 3. Получение этил-2-трифторметил-4-оксодигидро-1-бензопиран-3-карбоксилата. Охлажденный до 0 С раствор кетона, полученного на стадии 2 (6,92 г, 21,58 ммоль), в тетрагидрофуране (40 мл) и этаноле (50 мл) обрабатывали при перемешивании боргидридом натрия (NaBH4 0,41 г,10,79 ммоль), прибавляемым частями. Через 3 ч прибавляли частями в течение часа дополнительное количество боргидрида натрия (0,30 г, 7,93 ммоль). Реакционную смесь выливали в интенсивно перемешиваемую охлажденную хлористо-водородную кислоту (15 мл 12N НСl, разбавленной водой до объема 300 мл). В процессе смешивания выделялся осадок, который отделяли фильтрованием с отсасыванием и сушили в глубоком вакууме. Получали требуемое производное 4-оксо-дигидро-1-бензопирана в виде белого порошка (6,92 г, выход 99%) с т.пл. 80,2-84,9 С. 1H ЯМР (СDСl3/300 МГц) 12,60 (br s, 1 Н), 7,69 (d, 1 Н,J=2,6 Гц), 7,34 (dd, 1H, J=2,6, 8,7 Гц), 6,93 (d, 1H, J=8,7 Гц), 5,59 (q, 1H, J=6,6 Гц), 4,46-4,23 (m, 2H), 1,35(t, 3H, J=7,0 Гц). FABLRMS m/z 329 (M+Li). EIHRMS m/z 322,0213 (M+, рассчитано 322,0220). Анал. рассчитано для C13H10Cl1F3O4 с 3,57% воды: С, 46,67; Н, 3,41. Установлено: С, 46,62; Н, 3,14. Стадия 4. Получение этил-6-хлор-4-(трифторметансульфокси)-2-трифторметил-2 Н-1-бензопиран-3 карбоксилата. В колбу Мортона вместимостью 50 мл, снабженную диафрагмой и капельной воронкой, загружали 2,6-ди-трет-бутилпиридин (1,782 г, 8,679 ммоль), хлористый метилен (15 мл) и ангидрид трифторметансульфокислоты (1,22 мл, 2,04 г, 7,23 ммоль), а затем по каплям прибавляли в течение 0,33 ч раствор хроман-4-она, полученного на стадии 3 (2,145 г, 5,786 ммоль) в хлористом метилене (12 мл). После перемешивания при температуре помещения в течение 16 ч реакционную массу концентрировали в вакууме и разбавляли диэтиловым эфиром (50 мл), при этом образовывалась суспензия. Суспензию фильтровали с отсасыванием, промывали фильтрат охлажденной 2N хлористо-водородной кислотой и рассолом, сушили над сульфатом магния, фильтровали и концентрировали в вакууме, получая требуемый трифлат в виде светло-желтого порошка (1,45 г, выход 55%) с чистотой, достаточной для применения без дополнительной очистки. Т.пл. 79,2-80,4 С. 1H ЯМР (СDСl3/300 МГц) 7,40 (s, 1H), 7,37 (d, 1H, J=2,4 Гц), 7,02-6,99(m, 1H), 5,92 (q, 1H; J=6,6 Гц), 4,47-4,32 (m, 2H), 1,39 (t, 3 Н, J=7,2 Гц). Стадия 5. Получение этил-6-хлор-4-этенил-2-трифторметил-2 Н-1-бензопиран-3-карбоксилата. В круглодонной колбе вместимостью 100 мл растворяли в атмосфере азота этил-6-хлор-4 трифторметансульфокси-2-трифторметил-2 Н-1-бензопиран-3-карбоксилат, полученный на стадии 4 (1,50 г, 3,30 ммоль), в безводном тетрагидрофуране (40 мл). Добавляли тетракис(трифенилфосфин)палладий(0) (0,267 г, 0,231 ммоль) и хлористый литий (0,140 г, 3,3 ммоль), а затем трибутилэтенилстаннан (1,15 г,3,6 ммоль). Полученный раствор нагревали с обратным холодильником в течение 18 ч. По истечении этого времени газохроматографический анализ с масс-спектрометрическим детектированием показал,что исходный материал полностью вступил в реакцию. Давали реакционной массе охладиться до температуры помещения и выливали ее в 20%-ный раствор фтористого аммония (50 мл). После перемешивания в течение 1 ч прибавляли диэтиловый эфир (100 мл) и промывали смесь водой (2 х 50 мл). Органическую фазу сушили над сульфатом магния, фильтровали и концентрировали в вакууме, получая масло коричневого цвета. Сырой продукт очищали флеш-хроматографией (элюент - гексан) и получали требуемый сложный эфир в виде масла желтого цвета, кристаллизующегося при стоянии (0,760 г, выходFABLRMS m/z 333,2 (M+H). ESHRMS m/z 333,0510 (М+Н, рассчитано 33,050532). Анал. рассчитано для С 15 Н 12ClF3 О 3 (1,14% (мас.) Н 2 О): С, 53,53; Н, 3,72; Сl, 10,53. Установлено: С, 53,46; Н, 3,42; Сl, 10,70. Стадия 6. Получение 6-хлор-4-этенил-2-трифторметил-2 Н-1-бензопиран-3-карбоновой кислоты. Сложный эфир, полученный на стадии 5 (0,300 г, 0,902 ммоль), растворяли в смеси тетрагидрофурана, этанола и воды (7:2:1, 10 мл), обрабатывали гидроксидом натрия (0,360 мл, 0,902 ммоль в виде 2,5N раствора) и перемешивали при температуре помещения в течение 18 ч. Выпаривали растворитель в вакууме и растворяли остаток в воде (10 мл). Добавляли диэтиловый эфир (10 мл) и подкисляли массу концентрированной хлористо-водородной кислотой. Отделяли органический слой и экстрагировали водный слой диэтиловым эфиром (2 х 10 мл). Соединенные экстракты сушили над сульфатом магния, фильтровали и концентрировали в вакууме, получая твердое вещество желтого цвета, которое перекристаллизовывали из смеси диэтилового эфира с гексаном. Получали соединение, указанное в заголовке, в виде твердого вещества белого цвета (0,163 г, выход 59%) с т.пл. 143,0-145,0 С. 1H ЯМР (CDCl3/300 МГц) 7,49 (d,1H, J=2,6 Гц), 7,33-7,17 (m, 2H), 6,99 (d, 1H, J=8,5 Гц), 5,82-5,72 (m, 2H), 5,42 (d, 1H, J=17,9 Гц). ESHRMS 303,00207 (M-H рассчитано 303,003582). Анал. рассчитано для С 13 Н 8 СlF3 О 3 (1,10% (мас.) Н 2O): С, 50,69; Н, 2,74; Сl, 11,51. Установлено: С, 50,57; Н, 2,37; Сl, 11,75. Пример 2. 6-Хлор-2-трифторметил-4-фенил-2 Н-1-бензопиран-3-карбоновая кислота. Это производное 2 Н-1-бензопиран-3-карбоновой кислоты получали из этил-6-хлор-4 трифторметансульфокси-2-трифторметил-2 Н-1-бензопиран-3-карбоксилата, полученного, как описано в примере 142, стадия 4, по методике, аналогичной описанной в примере 142, стадия 5 и стадия 6. Т.пл. полученного продукта 225,5-226,6 С. 1 Н ЯМР (диметилсульфоксид-d6/300 МГц). 7,46-7,39 (m, 4H), 7,207,13 (m, 3 Н), 6,52 (d, 1H, J=2,42 Гц), 6,12 (q, 1H, J=7,1 Гц). FABLRMS m/z 355,1 (M+H). ESHRMS m/z 353,0215 (M-H, рассчитано 353,019232). Анал. рассчитано для С 17 Н 10 СlF3 О 3: С, 57,56; Н, 2,84; Сl, 10,17. Установлено: С, 57,18; Н, 2,66; Сl, 10,17. Пример 3. 6-Хлор-4-(2-тиенил)-2-трифторметил-2 Н-1-бензопиран-3-карбоновая кислота. Это производное 2 Н-1-бензопиран-3-карбоновой кислоты получали из этил-6-хлор-4 трифторметансульфокси-2-трифторметил-2 Н-1-бензопиран-3-карбоксилата, полученного, как описано в примере 142, стадия 4, по методике, аналогичной описанной в примере 142, стадия 5 и стадия 6. Т.пл. полученного продукта 200,8-206,7 С. 1H ЯМР (CDCl3/300 МГц) 7,52 (dd, 1 Н, J=1,21, 5,04 Гц), 7,28 (dd,1H, J=2,42, 8,67 Гц), 7,15 (dd, 1H, J=1,21, 3,42 Гц), 6,98-6,93 (m, 2H), 5,83 (q, 1H, J=6,9 Гц). FABLRMS m/z 378 (M+NH4). Анал. рассчитано для C15H8ClF3O3S: С, 49,94; Н, 2,24; Cl, 9,83; S, 8,89. Установлено: С,50,02; Н, 1,98; Cl, 9,34; S, 8,89. Пример 4. 6-Хлор-4-этил-2-трифторметил-2 Н-1-бензопиран-3-карбоновая кислота. Этап 1. Получение этил-6-хлор-4-этил-2-трифторметил-2 Н-1-бензопиран-3-карбоксилата. Этил-6-хлор-4-этенил-2-трифторметил-2 Н-1-бензопиран-3-карбоксилат (пример 142, этап 5) (0,433 г, 1,30 ммоль) растворяли в метаноле (10 мл). Медленно добавляли палладий (5% (мас.) на активированном угле) (0,150 г). Реакционный сосуд заполняли водородом (25 фунтов/дюйм 2 (1,758 кг/см 2 и содержимое перемешивали в течение 25 мин. Результаты анализа посредством газовой хроматографии показали завершение реакции. Полученную реакционную смесь фильтровали через слой целита и выпаривали с получением масла оранжевого цвета. Полученное масло подвергали перегонке под вакуумом (100% гексаны) с получением необходимого продукта в виде масла желтого цвета (0,282 г, 65%): 1H ЯМР(СDСl3/300 МГц) 7,43 (d, 1H, J=2,4 Гц), 7,25 (dd, 1H, J=2,4, 8,7 Гц), 6,92 (d, 1H, J=8,7 Гц), 5,75 (q, 1H,J=7,0 Гц), 4,38-4,24 (m, 2H), 3,05-2,95 (m, 2H), 1,35 (t, 3H, 3=7,2 Гц), 1,25, (t, 3H, J=7,6 Гц). Этап 2. Получение 6-хлор-4-этил-2-трифторметил-2 Н-1-бензопиран-3-карбоновой кислоты. Эфир этапа 1 (0,282 г, 0,842 ммоль) растворяли в смеси тетрагидрофурана-ЕtOН-Н 2 О (10 мл, 7:2:1). Полученный раствор обрабатывали водным раствором гидроксида натрия (0,340 мл, 0,842 ммоль 2,5N раствора) и перемешивали при комнатной температуре в течение 18 ч. Упомянутый растворитель удаляли in vacuo и полученный остаток растворяли в воде (10 мл). Добавляли диэтиловый эфир (10 мл) и полученную смесь подкисляли посредством добавления нескольких капель концентрированной НСl. Полученный слой диэтилового эфира отделяли и полученную водную фазу экстрагировали дополнительным количеством эфира (2 х 10 мл). Полученные эфирные экстракты смешивали, сушили над MgSO4, фильтровали и выпаривали с получением прозрачного масла. Следствием добавления гексана (10 мл) явилось получение осадка белого цвета, который собирали посредством фильтрации под вакуумом с получением упомянутого целевого соединения (0,064 г, 25%) в виде порошка белого цвета: т.пл. 170,9-172,1 С. 1H ЯМР (СDСl3/300 МГц) 7,47 (d, 1H, J=2.4 Гц), 7,30 (dd, 1H, J=2,4, 8,7 Гц), 6,96 (d, 1H, J=8,7 Гц), 5,76 (q,1H, J=7,0 Гц), 3,08 (q, 2H, J=7,6 Гц), 1,27 (t, 3H, J=7,5 Гц). FABLRMS m/z 305,2 (M-H). ESHRMS m/z 305,0185 (M-H, рассчитано 305,0192). Анал. рассчитано для С 13H8ClF3 О 3: С, 50,92; Н, 3,29; Сl, 11,56. Установлено: С, 50,68; Н, 3,18; Сl, 11,64. Соединения в соответствии с настоящим изобретением могут быть введены в организм любым подходящим для этой цели путем, предпочтительно в форме фармацевтических композиций, адаптированных к конкретным путям, и в дозах, эффективных с точки зрения требуемого лечебного действия. Активные соединения и композиции могут вводиться, например, пероральным, внутрисосудистым, внутрибрюшинным, подкожным, внутримышечным или локальным (местным) способами. Выражение "котерапия" (или "комбинированная терапия") применительно к определению употребления ингибитора циклооксигеназы-2 и другого фармацевтического агента охватывает последовательное введение в организм каждого агента в режиме, обеспечивающем благоприятное влияние сочетания лекарственных средств, а также практически одновременное совместное введение этих агентов в организм,например, в одной капсуле, содержащей упомянутые активные агенты в определенном соотношении,либо в отдельных капсулах для каждого агента. Выражение "терапевтически эффективное" предназначено для определения количества каждого агента, которое обеспечивает достижение цели облегчения тяжести заболевания или частоты его приступов в процессе лечения каждым агентом в отдельности при отсутствии отрицательных побочных эффектов, связанных, как правило, с альтернативными способами лечения. Для перорального приема фармацевтическая композиция может иметь форму, например, таблетки,капсулы, суспензии или жидкости. Фармацевтическую композицию предпочтительно изготавливают в виде единицы дозирования, содержащей определенное количество активного ингредиента. Примерами таких единиц дозирования могут служить таблетки или капсулы. Активный ингредиент можно вводить в организм также путем инъекции в виде композиции, в составе которой можно использовать в качестве носителя, например, солевой раствор, декстрозу или воду. Количество терапевтически активных соединений, вводимых в организм, и режим дозирования для лечения болезненного состояния с использованием соединений и/или композиций в соответствии с настоящим изобретением зависит от множества факторов, в том числе от возраста, массы тела, пола и состояния здоровья пациента, тяжести заболевания, способа и частоты введения и конкретного применяемого соединения и, таким образом, может варьироваться в широких пределах. Фармацевтические композиции могут содержать активные ингредиенты в количествах от приблизительно 0,1 до 2000 мг, предпочтительно в диапазоне от приблизительно 0,5 до 500 мг и наиболее предпочтительно - от приблизительно 1 до 100 мг. Подходящими могут быть суточные дозы от приблизительно 0,01 до 100 мг/кг массы тела, предпочтительно от приблизительно 0,5 до приблизительно 20 мг/кг массы тела и наиболее предпочтительно - от приблизительно 0,1 до 10 мг/кг массы тела. Суточную дозу можно вводить в один прием или в несколько (до четырех) приемов. В случаях псориаза и других кожных заболеваний предпочтительным может оказаться местное нанесение препаратов соединений в соответствии с настоящим изобретением на пораженную область от 2 до 4 раз в день. Для лечения воспалений тканей глаза и других внешних тканей, например, слизистой рта и кожи,композиции предпочтительно применяют локально в виде мази или крема, либо в виде свечей, содержащих активные ингредиенты в суммарном количестве, например, от 0,075 до 30% (мас.), предпочтительно от 0,2 до 20% (мас.) и наиболее предпочтительно от 0,4 до 15% (мас.). В форме мазей активные ингредиенты можно применять в сочетании либо с парафиновой, либо с водорастворимой основой. В качестве альтернативы активные ингредиенты могут быть введены в крем на основе суспензии типа "масло в воде". При желании водная фаза основы крема может содержать, например, не менее 30% (мас.) многоатомного спирта, например, пропиленгликоля, бутан-1,3-диола, маннита, сорбита, глицерина, полиэтиленгликоля и их смесей. Композиция для местного применения может при желании содержать соединение, улучшающее всасывание или проникновение активного ингредиента через кожу или другие пора-21 005599 женные ткани. Примерами таких интенсификаторов всасывания через кожу являются диметилсульфоксид и его аналоги. Соединения в соответствии с настоящим изобретением можно вводить в организм также с помощью приспособлений для введения через кожу. Местное введение предпочтительно осуществлять с применением пластырей и т.п. либо типа резервуара с пористой мембраной, либо с разнообразными твердыми матрицами. В любом случае активный агент непрерывно поступает из резервуара или микрокапсул через мембрану в проницаемый для активного агента клей, находящийся в контакте с кожей или слизистой пациента. Если активный агент поглощается через кожу, то обеспечивается непрерывное и контролируемое поступление его в организм пациента. В случае использования микрокапсул материал оболочки капсул может одновременно действовать как мембрана. Масляная фаза эмульсий в соответствии с настоящим изобретением может быть приготовлена из известных компонентов известными способами. Хотя эта фаза может содержать только эмульгатор, она может содержать смесь, по крайней мере, одного эмульгатора с жиром или маслом, либо с обоими этими материалами. Предпочтительно в состав эмульсии вводят гидрофильный эмульгатор вместе с липофильным эмульгатором, который действует как стабилизатор. Предпочтительно также вводить в состав масляной фазы как жир, так и масло. Эмульгатор (эмульгаторы) совместно со стабилизатором (стабилизаторами) образуют так называемый эмульсионный воск, а этот воск совместно с маслом и жиром образует так называемую эмульсионную основу мази, которая образует дисперсную масляную фазу композиций типа кремов. К эмульгаторам и стабилизаторам эмульсий, пригодным для использования в композициях в соответствии с настоящим изобретением, относятся, наряду с другими материалами, твин-60, спан-80,цетостеариловый спирт, миристиловый спирт, моностеарат глицерина и лаурилсульфат натрия. Выбор подходящих масел и жиров для композиций определяется критерием обеспечения желаемых косметических свойств, поскольку активные соединения очень плохо растворяются в большинстве масел, которые пригодны для применения в составе фармацевтических эмульсий. Таким образом, крем должен представлять собой предпочтительно нежирный, не пачкающий и легко смываемый продукт соответствующей консистенции, предотвращающей вытекание из тюбиков или других контейнеров. Могут быть применены сложные эфиры одно- или двухосновных кислот, содержащие алкильные радикалы линейного или разветвленного строения, например, диизоадипат, изоцетилстеарат, диэфир пропиленгликоля и жирных кислот кокосового масла, изопропилмиристат, децилолеат, изопропилпальмитат, бутилстеарат, 2-этилгексилпальмитат или смесь сложных эфиров разветвленного строения. Эти вещества могут быть применены индивидуально или в сочетаниях, в зависимости от требуемых свойств. В качестве альтернативы могут быть применены высокоплавкие липиды, например, мягкий белый парафин и/или жидкий парафин либо другие минеральные масла. К композициям, пригодным для локального применения при лечении глаз, относятся также глазные капли, в составе которых активные соединения растворены или суспендированы в соответствующем носителе, в частности, в растворителе для активных веществ на водной основе. Активные ингредиенты противовоспалительного действия присутствуют в таких композициях предпочтительно в концентрациях от 0,5 до 20% (мас.), целесообразно от 0,5 до 10% (мас.), в частности приблизительно 1,5% (мас.). Для терапевтических целей активные соединения в соответствии с настоящим изобретением обычно сочетают с одним или несколькими адъювантами, подходящими для указанного пути введения. Для перорального приема соединения могут быть смешаны с лактозой, сахарозой, порошкообразным крахмалом, сложными эфирами целлюлозы с алканоловыми кислотами, сложными алкильными эфирами целлюлозы, тальком, стеариновой кислотой, стеаратом магния, натриевыми и кальциевыми солями фосфорной и серной кислот, желатином, гуммиарабиком, альгинатом натрия, поливинилпирролидоном и/или поливиниловым спиртом, а затем таблетированы либо капсулированы для удобства употребления. Такие капсулы или таблетки могут содержать композицию для длительного выделения, которое можно осуществить, например, путем диспергирования активного соединения в гидроксипропилметилцеллюлозе. Композиции для парентерального введения могут быть выполнены в форме водных или неводных стерильных изотонических растворов или суспензий для инъекций. Эти растворы и суспензии могут быть приготовлены из стерильных порошков или гранул, содержащих один или несколько носителей и разбавителей, упомянутых выше в качестве компонентов композиций для перорального употребления. Соединения могут быть растворены в воде, полиэтиленгликоле, пропиленгликоле, этаноле, кукурузном масле,хлопковом масле, арахисовом масле, кунжутном масле, бензиловом спирте, растворах хлористого натрия и/или различных буферных растворах. Другие добавки и способы введения в организм широко известны в фармацевтической практике. При легочном введении, фармацевтическая композиция может вводиться в виде аэрозоля либо с помощью ингалятора, в котором находится сухой порошковый аэрозоль. Все упомянутые ссылочные материалы включены в настоящее описание посредством ссылок. Приоритетные заявки ( 60/0444,485, поданная 21 апреля 1997 г., и 09/062,537, поданная 17 апреля 1998 г.) также включены посредством ссылок. Хотя настоящее изобретение описано применительно к конкретным вариантам осуществления,подробности этих вариантов не должны рассматриваться как ограничения.R2 представляет собой один или несколько радикалов, выбранных независимо друг от друга из группы, включающей водород, галоид, C1-С 6-алкил, C2-С 6-алкенил, C2-С 6-алкинил, галоид-C2-С 6 алкинил, арил-C1-С 3-алкил, арил-C2-С 6-алкинил, арил-C2-С 6-алкенил, арил-C1-С 6-алкокси-C1-С 6-алкил,где атомы цикла А-А 1, А 2, А 3 и А 4 - являются атомами углерода; или изомер или фармацевтически приемлемая соль такого соединения. 2. Соединение по п.1, представляющее собой одно из следующих соединений: 6-хлор-4-этил-2-трифторметил-2 Н-1-бензопиран-3-карбоновая кислота; 6-хлор-2-трифторметил-4-этенил-2 Н-1-бензопиран-3-карбоновая кислота; 6-хлор-2-трифторметил-4-фенил-2 Н-1-бензопиран-3-карбоновая кислота; 6-хлор-4-(2-тиенил)-2-трифторметил-2 Н-1-бензопиран-3-карбоновая кислота.
МПК / Метки
МПК: A61K 31/35, C07D 493/04, C07D 311/58, C07D 491/04
Метки: замещенные, аналоги, бензопирана
Код ссылки
<a href="https://eas.patents.su/24-5599-zameshhennye-analogi-benzopirana.html" rel="bookmark" title="База патентов Евразийского Союза">Замещенные аналоги бензопирана</a>
Предыдущий патент: Ненуклеозидные ингибиторы обратной транскриптазы
Следующий патент: Замещенные пиперидины, содержащие эти соединения лекарственные средства и способ их получения
Случайный патент: Буровая установка и способ ее монтажа




























