4-аминотетрагидробензизоксазоловые или -изотиазоловые соединения, их применение и фармацевтическая композиция на их основе
Номер патента: 380
Опубликовано: 24.06.1999
Авторы: Фрёлунн Бенте, Скоусбо Арне, Мольтсен Ленс Сибюлле, Фальк Эрик, Крогсгор-Ларсен Повл, Перрегор Енс Кристьян
Формула / Реферат
1. 4-Аминотетрагидробензизоксазоловые или -изотиазоловые соединения, имеющие общую формулу I:
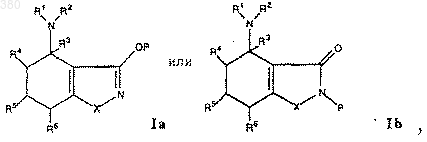
где R1 и R2, каждый, независимо выбран из группы, состоящей из
А) водорода, С3-7 циклоалкила, фенила или группы
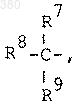
где R, R8 и R9, каждый, независимо выбран из группы, состоящей из водорода, C1-4 алкила, C2-4 алкенила, С2-4 алкинила, С1-4 алкокси- C1-4 алкила, С3-7 циклоалкила, С3-7 циклоалкил-С1-4 алкила, фенила, фенил-C1-4 алкила, фенокси-C1-4 алкила и гетероарила, выбранных из 2-тиенила, 3-тиенила, 2-фурила, 3-фурила, имидазолила, оксазолила, пиразолила, пиримидинила, пирролила, тиазолила, 1,2,4-триазолила, 2-пиридила, 3-пиридила или 4-пиридила, причем любая фенильная или гетероарильная группа, не обязательно замещена одним или более заместителями, выбранными из галогена, C1-4 алкила, C1-4 алкокси, гидрокси, нитро, C1-4 алкилтио, C1-4 алкилсульфонила, С1-4 алкил- или ди (C1-4) алкиламино, циано, трифторметила, трифторметилтио, трифторметилсульфонилокси и фенила, которые также могут быть замещены галогеном, метилом, метокси или трифторметилом; причем любая присутствующая алкильная группа не обязательно замещена от одной до трех гидроксигруппами, которые, в свою очередь, не обязательно этерифицированы C2-C18 карбоновой кислотой;
В) группы общей формулы: Y-(CH2)r-(CHR11)s-(СН2)t-, где Y выбирается из следующих групп (1) - (5):
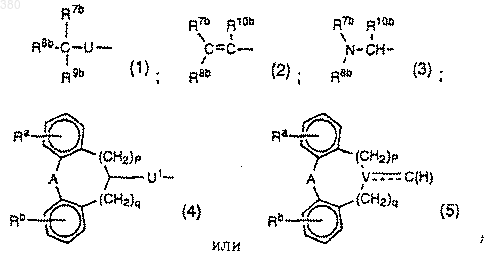
где U обозначает CHR10b, NR10b, О или S, U1 обозначает NR10b, О или S; р принимает значение 0 или 1; q принимает значения 0 или 1; V обозначает С или N, пунктирная линия обозначает связь, когда V обозначает С, и отсутствие такой связи, когда V обозначает N;
А обозначает О, S, CH2, (CH2)2, СН=СН-СН2, (СН2)3, СН=СН или O-СН2;
Ra и Rb, каждый независимо, обозначает один или более заместителей, выбранных из галогена, C1-4 алкила, C1-4 алкокси, гидрокси, нитро, C1-4 алкилтио, C1-4 алкилсульфонила, C1-4 алкил- или ди(С1-4 алкил)амино, циано, трифторметила, трифторметилсульфонилокси и трифторметилтио;
r и t независимо друг от друга принимают значение 0, 1, 2 или 3, s принимает значение 0 или 1, при условии, что когда Y обозначает группу (1), где U обозначает NR10b, О или S, или группу (4), то r+s+t равно, по крайней мере, 2;
а когда Y обозначает группу (3) или группу (5), где Y обозначает N, то r+s+t равно, по крайней мере, 1;
R7b, R8b и R9b те же, что указаны для R7, R8 и R9 в А), при условии, что они не означают одновременно водород, C1-4 алкил, C2-4 алкенил и С2-4 алкинил;
R10b и R11 обозначают независимо друг от друга водород, C1-4 алкил, С2-4 алкенил или C2-4 алкинил; и
C) группы общей формулы: YC- (CH2)n-W- (CH2)m-, где n принимает значение 1, 2 или 3, m принимает значение 2 или 3; W обозначает 0 или S; и YC обозначает группу (1)-(5), определенную в В), при условии, что n не может быть 1, когда Y обозначает группу (1) или (4), а U или U1 представляют собой, соответственно NR10b, S или О;
D) группы общей формулы:
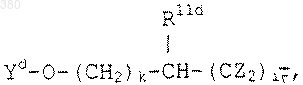
где k обозначает 0, 1, 2 или 3;
i принимает значения 0, 1, 2 или 3;
R11d тот же, что ранее указан для R11 в В) ; и
Y выбирают из групп (2) и (5), как определено ранее в В), и из приведенных ниже групп (6)-(10):
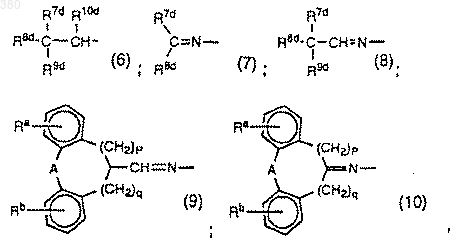
где р, q, Ra, Rb, А те же, что указаны в В) и R7d-R11d соответственно те же, что указаны для R7b-R10b и R11 в В), или
R1 и R2 вместе обозначают алкилен, образуя 4-8-членное азотсодержащее кольцо; или
один из R1 и R2 представляет группы R2'ОСО, где R2' обозначает фенил или гетероарил, как было указано ранее в А), или фенил или гетероарил, замещенный одним или более заместителями, выбранными из галогена, C1-4 алкила, C1-4 алкокси, гидрокси, нитро, C1-4 алкилтио, C1-4 алкилсульфонила, C1-4 алкил- или ди(C1-4) алкиламино, циано, трифторметила, трифторметилтио, трифторметилсульфонилокси, фенила и фенила, замещенного галогеном, метилом, метокси или трифторметилом;
R3 - R6 выбирают, независимо друг от друга, из водорода, гидрокси и C1-4 алкила, причем любая алкильная группа не обязательно замещена одной или двумя гидроксильными группами;
Х обозначает кислород или серу;
Р обозначает водород или группу ZR, где
Z представляет СО, CS, SO2 или CRtRu, где Rt и Ru обозначают водород, гидрокси или C1-4 алкил, и, если Z является СО или CS, то R выбирают из группы, состоящей из:
i) водорода, C1-C18 алкила, C2-C18 алкенила, С3-С8 циклоалкила, С3-С8 циклоалкенила или С4-С26 циклоалк(ен)ил-алк(ен)ила, необязательно замещенных одной или двумя гидроксильными группами, или фенила, необязательно замещенного одним или более заместителями, выбранными из группы, состоящей из галогена, трифторметила, C1-C4 алкила, C1-C4 алкокси, C1-C4 алкилтио, C1-C5 ацилокси или циано; или
ii) QRV, где Q обозначает О или S, RV выбирают из заместителей, указанных ранее для В в пункте i); и
iii) NRXRY, где RX и RY выбирают, независимо друг от друга, из заместителей, указанных ранее для R в пункте i), или RX и RY объединяются с образованием 4-8-членного гетероциклического кольца, содержащего от одного до трех атомов азота и от нуля до трех атомов кислорода или серы; или
если Z обозначает CRtRu, то R выбирают из групп, состоящих из:
iv) группы QRV, определенной в пункте ii);
v) группы NRXRY, определенной в пункте iii); или
vi) группы OC(O)RZ, SC(O)RZ, OC(S)RZ или SC(S)PZ, где RZ выбирают из заместителей, указанных ранее для R в пункте i);
если Z является SO2, то R выбирают из группы, определенной ранее в пункте i);
при условии, что Р не может быть водородом, когда все R1-R6 являются водородами, Х является кислородом, а соединение представляет собой рацемическую смесь;
или их фармацевтически приемлемые соли.
2. Соединение по п.1, где Х представляет кислород.
3. Соединение по п.2, где R1 представляет C1-4 алк(ен/ин)ил, не обязательно замещенный гидроксигруппой, которая может быть этерифицирована С2-С22 карбоновой кислотой, или фенил, или фенил-С1-4 алкил, необязательно замещенный галогеном, С1-4 алкилом, C1-4 алкокси или трифторметилом, при этом R1 предпочтительно является метилом, этилом или фенилбутилом.
4. Соединение по п.3, где Р эх является водородом, а Р представляет собой предпочтительно ZR группу, определенную в п.1, где Z обозначает CH2 и R обозначает группу ОС(O)Rz, определенную в vi) п.1.
5. Соединение по п.4, представленное формулой 1а.
6. Соединение по п.2, где R1 обозначает группу, определенную в В), С) или D).
7. Соединение по п.6, где R1 обозначает группу, определенную в В), где Y представляет собой группу формулы (1), (2) или (3), где R7b и R8b обозначают фенил, гетероарил или фенил или гетероарил, замещенные заместителями, определенными в п.1 для R7 и R8; предпочтительно группу формулы (1) и (2), где U обозначает СН2 или О.
8. Соединение по п.6, где R1 обозначает группу, определенную в В), где Y обозначает группу формулы (4) или (5).
9. Соединение по п.6, где R1 обозначает группу, определенную в С), предпочтительно такую группу, где YC обозначает группу формулы (1), где U обозначает СН2, или группу формулы (2), где R7b и R8b обозначают фенил, гетероарил или фенил или гетероарил, замещенные заместителями, как указано в п.1 для R7 и R8.
10. Соединение по п.6, где R1 обозначает группу, определенную в D), где Yd обозначает группу формулы (2), (5), (6), (7), (8), (9) или (10).
11. Соединение по любому п.2-10, где R2 обозначает водород, C1-4 алкил или группу R2'-O-СО-, где R2' определен в п.1.
12. Соединение по любому п.6-11, где Р является водородом.
13. Фармацевтическая композиция, отличающаяся тем, что в качестве активного соединения включает, по меньшей мере, один новый 4-аминотетрагидробензизоксазол или -изотиазол по любому из пп.1-12 в терапевтически эффективном количестве с фармацевтически приемлемым носителем или разбавителем.
14. Применение 4-аминотетрагидробензизоксазола или изотиазола по любому из пп.1-12 для приготовления фармацевтической композиции для лечения анальгезии, психоза, судорог, эпилепсии, беспокойства, мышечных и двигательных нарушений, спастических состояний или симптомов при болезни Хантингтона или болезни Паркинсона, предпочтительно судорог.
Текст
1 Настоящее изобретение относится к новым 4-аминотетра-гидробензизоксазолам или -изотиазолам, обладающим активностью, ингибирующей поглощение ГАМК и в связи с этим представляющим практический интерес для лечения анальгезии, психоза, конвульсий, беспокойств или мышечных и двигательных расстройств,таких как судорожные состояния или симптомы при болезни Хантингтона или при паркинсонизме. Наличие противосудорожной активности определяет в особенности их полезность при использовании в качестве противосудорожного препарата с широким антиэпилептическим спектром. Нейтральная аминокислота, 4-аминомасляная (ГАМК), является ингибитором медиатора в центральной нервной системе. Имеются серьезные прямые и опосредованные подтверждения того, что нарушение функции ГАМКопосредованного ингибирования в синапсах может быть важным фактором, определяющим развитие нарушений судорожного характера(P.Kroqsqaard-Larsen et al., Epilepsy Res. 1987, 1,77-93), что делает ГАМК-эргические препараты потенциальными антиэпилептическими терапевтическими средствами. Кроме того, усиление ГАМК-эргической активности может быть полезно для лечения беспокойства, болевых состояний, мышечных и двигательных расстройств, а также психических и эмоциональных расстройств (W. Lscher, Eur.J. Pharmacol. , 1985, 110, 103-108). При этом прямое стимулирование ГАМК рецепторов агонистами вряд ли можно рассматривать в качестве наиболее подходящего подхода при лечении эпилептических заболеванийMeldrum and R.Horton, Eur.J.Pharmacol. 1980, 61,231-237; Kroqsqaard-Larsen et al., J. Med. Chem. 1994, 37, 2489-2505), тогда как воздействие на нейротрансмиссию ГАМК может позволить манипулировать механизмами поглощения ГАМК. Считается, что фармакологическое ингибирование нейронального и/или глиального транспорта (перемещение)ГАМК ответственно за терминацию процессов ГАМК нейротрансмиссии и обеспечивает механизм синаптически высвобождаемых в синапсах длительно поддерживаемых уровней ГАМК и тем самым увеличивает ГАМК-опосредованную трансмиссию(P.Kroq-sqaard-Larsen et al., J.Med.Chem. 1994,37, 2489-2505). Стратегия такого фармакологического вмешательства может быть следующей: 1) эффективная блокада как нейронального, так и глиального поглощения ГАМК или 2) селективная блокада поглощения ГАМК глиальными клетками с целью повышения количества ГАМК, потребляемого нейрональными переносчиками и последующего повышения концентрации ГАМК в нервных окончаниях. Имеются 2 данные, позволяющие предположить, что ингибиторы селективного поглощения ГАМК-глией могут представлять интерес как потенциальные антиэпилептические средства (E.Falch et al.,Druq Desiqn and Delivery, 1987, 2, 9-21; Falch etal., Druq Dev.Res., 1990, 21, 169-188). Классическими примерами ингибиторов поглощения ГАМК являются нипекотиновая кислота, гувацин и ТНРО. Описаны активные при пероральном применении N-замещенные производные нипекотиновой кислоты и гувацина (F.E.Ali et al., J.Med.Chem. 1985, 28, 553-560; Патент США 4 383 999 и Патент США 4 514 414, относящийся к Корпорации СмитКляйн Бекманн (SmithKlein Beckmann Corporation); EP 236342 и ЕР 231996, относящиеся к Ново Индастри А/С (Novo Industry A/S) и H.S. White et al.,Eur. J. Pharmacol, 1993, 236, 147-149). Что касается судорог, особенно эпилептических, то несмотря на доступность антиэпилептических препаратов, у многих пациентов не удается их контролировать. В этой связи, объектом настоящего изобретения являются новые ГАМК-эргические лекарственные средства, эффективные при лечении заболеваний, связанных с нейротрансмиссией ГАМК, в частности, при купировании судорожных состояний. Было обнаружено, что соединения - представители класса новых 4-аминотетрагидробензизоксазолов или -изотиазолов ингибируют нейрональное и/или глиальное поглощение ГАМК. В этой связи, настоящее изобретение относится к новым 4-аминотетрагидробензизоксазоловым или -изотиазоловым соединениям,имеющим общую формулу Iа или Ib: 12 где R1 и R2, каждый, независимо выбран из группы, состоящей из: А) водорода, циклоалкила, фенила или группы где R7, R8 и R9, каждый, независимо выбран из группы, состоящей из водорода, C1-4 алкила, С 2-4 алкенила, С 2-4 алкинила, C1-4 алкокси-С 1-4 алкила, С 3-7 циклоалкила, С 3-7 циклоалкила-С 1-4 алкила, фенила, фенил-C1-4 алкила, фенокси-С 1-4 алкила и гетероарила, выбранных из 2-тиенила,3-тиенила, 2-фурила, 3-фурила, имидазолила,оксазолила, пиразолила, пиримидинила, пирролила, тиазолила, 1,2,4-триазолила, 2-пиридила,3-пиридила или 4-пиридила, причем любая присутствующая фенильная или гетероарильная 3 группа необязательно замещена одним или более заместителями, выбранными из галогена,С 1-4 алкила, С 1-4 алкокси, гидрокси, нитро, C1-4 алкилтио, С 1-4 алкилсульфонила, C1-4 алкил или ди (C1-4) алкиламино, циано, трифторметила,трифторметилтио, трифторметилсульфонилокси и фенила, которые также могут быть замещены галогеном, метилом, метокси или трифторметилом; причем, любая присутствующая алкильная группа, необязательно замещена от одной до трех гидрокси группами, которые в свою очередь необязательно этерифицированы C2-18 карбоновой кислотой; В) группы общей формулыY-(СН 2)к - (CHR11)s-CH2)t,где Y выбирается из следующих групп (1)V обозначает С или N, а пунктирная линия обозначает связь, когда V обозначает С и отсутствие такой связи, когда V обозначает N; А обозначает О, S, CH2, (CH2)2, СН=СНСН 2, (CH2)3, СН=СН или O-СН 2;Ra и Rb, каждый, обозначают один или более заместителей, выбранных из галогена, C1-4 алкила, С 1-4 алкокси, гидрокси, нитро, C1-4 алкилтио, C1-4 алкилсульфонила, C1-4 алкил- или ди(С 1-4 алкил)амино, циано, трифторметила,трифторметилсульфонилокси и трифторметилтио;r и t независимо друг от друга принимают значение 0, 1, 2 или 3, s принимает значение 0 или 1, при условии, что когда Y обозначает группу (1), тогда как U обозначает NR10b, О илиR7b, R8b и R9b те же, что указаны для R, R8 и 9R в А), при условии, что они не означают одновременно водород, C1-4 алкил, С 2-4 алкенил и С 2-4 алкинил;R10b и R11 обозначают независимо друг от друга водород, С 1-4, алкил, С 2-4 алкенил или C2-4 алкинил; и 4 или S; и Yc обозначает группу (1) - (5), определенную в В) , при условии, что n не может быть 1, когда Y обозначает групп (1) или (4), a U или где k обозначает 0, 1, 2 или 3; I принимает значения 0, 1, 2 или 3; R11a тот же, что ранее указан для R11 в В); иY выбирают из групп (2) и (5), как определено ранее в В), и из приведенных ниже групп где р, q, Ra, Rb, А те же, что указаны в В) и R7dR11d, соответственно, те же, что указаны для R7bR10b и R11 в В), илиR1 и R2 вместе обозначают алкилен, образующий 4-8-членное азотсодержащее кольцо; или один из R1 и R2 представляет группы R2'OCO, где R2' обозначает фенил или гетероарил,как было указано ранее в А), или фенил, или гетероарил, замещенный одним или более заместителями, выбранными из галогена, C1-4 алкила, C1-4 алкокси, гидрокси, нитро, C1-4 алкилтио, C1-4 алкилсульфонила, С 1-4 алкил- или диR3 - R6 выбирают, независимо друг от друга, из водорода, гидрокси и C1-4 алкила, причем любая алкильная группа, не обязательно замещена одной или двумя гидроксильными группами; Х обозначает кислород или серу; Р обозначает водород или группу ZR, гдеR и Ru обозначают водород, гидрокси или C1-4 алкил, и, если Z является СО или CS, то R выбирают из группы, состоящей из:I) водорода, C1-C18, алкила, С 2-С 18 алкенила, С 3-С 8 циклоалкила, С 3-С 8 циклоалкенила или С 4-С 26 циклоалк(ен)ил - алк(ен)ила, необязательно замещенных одной или двумя гидроксильными группами, или фенила, необязательного замещенного одним или более заместителями, выбранными из группы, состоящей изII) QRV, где Q обозначает О или S и R выбирают из заместителей, указанных ранее для R в пункте I); иIII) NRXRY, где RX и RY выбирают, независимо друг от друга, из заместителей, указанных ранее для R в пункте I), или RX и RY объединяются с образованием 4-8-членного гетероциклического кольца, содержащего от одного до трех атомов азота и от нуля до трех атомов кислорода или серы; или если Z обозначает CRtRu то R выбирают из групп, состоящих из:YI) группы OC(O)RZ, SС(O)RZ, ОС(S)RZ или SC(S)RZ, где R выбирают из заместителей,указанных ранее для R в пункте I) ; если Z является SO2, то R выбирают из группы, определенной ранее в пункте I); при условии, что Р не может быть водородом, когда все R1-R6 являются водородами, Х является кислородом, а соединение представляет собой рацемическую смесь; или их фармацевтически приемлемую соль. Было показано, что соединения настоящего изобретения ингибируют нейрональное и/или глиальное поглощение ГАМК, при этом некоторые из соединений преимущественно ингибируют поглощение в глие. В этой связи такие соединения могут быть полезными для лечения заболеваний, связанных с нейтротрансмиссией ГАМК, в качестве, например, анальгетических,нейролептических, противосудорожных или анксиолитических средств для лечения мышечных и двигательных расстройств, таких как спастические расстройства или симптомы при болезни Хантингтона или при паркинсонизме. В другом своем аспекте изобретение относится к фармацевтической композиции, включающей, по крайней мере, один новый 4 аминотетрагидробензизозоксазол или -изотиазол формулы I в терапевтически эффективном количестве с фармацевтически приемлемым носителем и/или разбавителем. Еще в одном своем аспекте настоящее изобретение относится к использованию 4 аминотетрагидробензизоксазолов или изотиазолов формулы I в производстве фармацевтического препарата, применяемого при лечении упомянутых выше расстройств и заболеваний. Кроме того, настоящее изобретение относится к способу получения 4-аминотетрагидробензизоксазолов или -изотиазолов формулы I. Соединения общей формулы I существуют в виде его оптических изомеров и такие оптиче 000380 6 ские изомеры, равно как и их смеси, включая рацемические смеси, охватываются рамками настоящего изобретения. В контексте настоящего описания термин С 1-4 алкил относится к прямому или разветвленному С 1-4 алкилу, такому как метил, этил, пропил, изопропил, бутил и трет-бутил. Аналогично, термины С 2-4 алкенил и С 2-4 алкинил относятся к таким группам, которые включают до 4 атомов углерода и содержат, соответственно, по крайней мере, одну двойную или тройную связь. C1-4 алкокси, С 1-4 алкилтио, C1-4 алкилсульфонил, С 1-4 алкиламино, С 1-4 диалкиламино и др. обозначают аналогично такие группы, в которых алкильная часть представлена определенной ранее С 1-4 алкильной группой. Термин С 3-7 циклоалкил обозначает насыщенное карбоциклическое кольцо, содержащее внутри кольца 3 - 7 атомов углерода, а термин галоген относится к F, Cl, Вr или I. Термин алк(ен/ин)ил обозначает, что группа может представлять собой алкильную, алкенильную или алкинильную группу, содержащую вплоть до 4-х атомов углерода. Термин гетероарил обозначает 2-тиенил, 3 тиенил, 2-фурил, 3-фурил, имидазолил, оксазолил, пиразолил, пиримидинил, пирролил, тиазолил, 1,2,4-триазолил, 2-пиридил, 3-пиридил или 4-пиридил. Соединения, в которых Р представляет собой группу ZR, являются пролекарствами для соединений, в которых Р обозначает Н. Если Р является Н, то соединение существует в виде следующих таутомерных форм: Так, при проведении реакции с соответствующим реагентом с целью введения группыZR, упомянутая группа может входить либо на атом О, внешний относительно изоксазол/ изотиазолового кольца, или в кольцо на атом N, в зависимости от условий реакции. Далее в описании соединения, в которых Р является Н, ради удобства называются соединениями, имеющими первую упомянутую форму, т.е. соединениями,имеющими формулу Iа. Аналогично, соединения, в которых R1 или 2R представляют собой группу R2'OCO, являются пролекарствами для соответствующих соединений, в которых R1 или R2 обозначают водород. Фармацевтически приемлемые аддитивные соли кислоты соединений, используемых в соответствии с настоящим изобретением, являются солями, образованными нетоксичными органическими или неорганическими кислотами. Примерами таких солей, образованных с помо 7 щью органических кислот, являются соли малеиновой, фумаровой, бензойной, аскорбиновой, эмбоновой, янтарной, щавелевой, бисметиленсалициловой, метансульфоновой, этансульфоновой, уксусной, пропионовой, винной,салициловой, лимонной, глюконовой, молочной, яблочной, миндальной, циннамовой, цитраконовой, аспарагиновой, стеариновой, пальмитиновой,итаконовой,гликолевой,паминобензойной, глютаминовой, бензолсульфоновой и теофиллинуксусной кислот, а также 8 галогентеофиллины, например, 8-бромтеофиллин. Примерами указанных выше солей, полученных с применением неорганических кислот,являются соли соляной, бромистоводородной,серной, сульфаминовой, фосфорной и азотной кислот. Предпочтительно, чтобы R1 представлял собой такую группу, как была определена вA) выше, а именно: C1-4 ал(С 2-4 ен/ил)ил,необязательно замещенный гидрокси, который может быть этерифицирован С 2-22 карбоновой кислотой, предпочтительно С 2-4 карбоновой кислотой; или фенил или фенил-С 1-4 алкил, необязательно замещенные галогеном, C1-4 алкилом,C1-4 алкокси или трифторметилом; при этом предпочтительно, чтобы R1 был метилом, этилом или фенилбутилом;B) выше, где Y обозначает группу формулы (1), (2) или (3), где R7b и R8b обозначают фенил, гетероарил или замещенный фенил или гетероарил, наиболее предпочтительно фенил,фенил, замещенный галогеном, C1-4 алкилом,C1-4 алкокси или трифторметилом, 2-тиенил, 2 тиенил, замещенный метилом, пирролил или пирролил, замещенный метилом или этилом. В частности, Y представляет собой группу формулы (1), где U обозначает СН, или О, или группу формулы (2), или Y обозначает группу формулы(4) или (5), где р и q имеют значение 0, и А является серой или -СН 2 СН 2- и Ra и Rb обозначают водород. В формулах (1), (2) или (3) R9b является водородом, предпочтительно водородом илиC) выше, где Yc является группой формулы (1), где U обозначает СH2, группу формулы(2), (3) или (5), в которых и R7b и R8b обозначают фенил, гетероарил или замещенные фенил или гетероарил, наиболее предпочтительно, фенил,фенил, замещенный галогеном, C1-1 алкилом,C1-4 алкокси или трифторметилом, 2-тиенил, 2 тиенил, замещенный метилом, пирролил или пирролил, который замещен метилом или этилом. R9b представляет собой предпочтительно,водород или C1-4 алкил, в особенности водород,R10b является водородом, a n+m, предпочтитель 000380D) выше, где Y представляет собой группу формул (6), (7) или (8), в которых R7d и R8d представляют собой, независимо друг от друга,фенил, фенил, замещенный галогеном, C1-4 алкилом, трифторметилом или C1-4 алкокси, в частности, хлором, фтором, метилом, трифторметилом или метокси, 2-тиенил, 2-тиенил, замещенный C1-4 алкилом, наиболее, предпочтительно, метилом, пирролил или пирролил, замещенный метилом или этилом. R9d - R11d, предпочтительно, обозначает галоген, k+I равно 0-4,более предпочтительно 0 - 2 и наиболее предпочтительно 1.R2 представляет собой, предпочтительно,водород, алк(ен/ин)ил или группу R2' ОСО. Наиболее предпочтительно, R является водородом или C1-4 алкилом, в частности водородом или метилом.R3 представляет собой, предпочтительно,водород или C1-4 алкил, R4-R6 обозначают водород и Х является кислородом. Р представляет собой, предпочтительно,водород или группу ZR, где Z обозначает CRtRu,Rt и Ru являются водородами, гидрокси или C1-4 алкилами, наиболее предпочтительно водородами или метилами, и R обозначает группуOC(O)R7, SC(O)R , ОС(S)R2 или SС(S)RZ, где Rz представляет собой низший алк(ен)ил, в частности т-бутил или необязательно замещенный фенил; или где Z обозначает СО или CS, a R обозначает NRXРY , где RX и RY обозначают водород или C1-4 алкил, или RX и RY образуют гетероциклическое кольцо, содержащее один или два атома N и может быть необязательно замещено в одном или двух положениях оксогруппой. Предпочтительно,соединение имеет структуру, соответствующее формуле 1 а. В частности, предпочтительно, чтобы группа Р была отлична от водорода, когда R1 представляет собой предпочтительную группу,выбранную из А), как было указано ранее, в особенности алк(ен/ин)ильную группу, а R2 обозначает водород или алк(ен/ин)ил. Когда R и/или R2 представляют собой группу, которая определена в пункте В), С) илиD), предпочтительно, чтобы Р являлся водородом. В предпочтительном подклассе соединений изобретения R обозначает группу, определенную в пункте А), а именно: алк(ен/ин)ил, необязательно замещенный гидроксигруппой, которая может быть этерифицирована С 2-22 карбоновой кислотой, или фенил,или фенил-С 1-4 алкил, необязательно замещенный галогеном, С 1-2 алкилом, С 1-4 алкокси или трифторметилом, при этом R1 представляет собой наиболее предпочтительно, метил, этил или фенилбутил;R2 обозначает водород или алк(ен/ин)ил, в частности, водород или метил;R3 является водородом или C1-4 алкилом, в частности водородом или метилом, R4-R6 обозначают водород, и Х обозначает кислород; Р обозначает группу ZR, где Z обозначает СH2 или СН(СН 3), и R является группойOC(O)R2, где R2 обозначает С 1-4 алкил или необязательно замещенный фенил или гетероарил; или где Z обозначат СО и R обозначает NRXRY,где RX и RY обозначают водород или C1-4 алкил или RX и RY образуют гетероцикл. В другом предпочтительном подклассе соединений R' обозначает группу, определенную ранее в пункте В), где S обозначает 0, и r+t равно 0 - 4, в частности 1 - 3, а Yb обозначает группу формулы (1) или (2), где R7b и R8b обозначают, независимо друг от друга, фенил, фенил,замещенный галогеном, С 1-4 алкилом, трифторметилом или C1-4 алкокси, в частности хлором,фтором, метилом, трифторметилом или метокси, 2-тиенил, 2-тиенил, замещенный C1-4 алкилом, наиболее предпочтительно метилом, пирролил или пирролил, замещенный метилом или этилом, R9b-R10b обозначают водород и U обозначает СН 2; или О, или Yb обозначает группу формулы (5), где р и q равны 0, и А обозначает серу или -CH2CH2- и Ra и Rb обозначают водород; иR2, R3, R4-R6 и Х определены выше в списке предпочтительного подкласса соединений и Р обозначает водород. В соответствии с другим предпочтительным подклассом соединений изобретения, R1 обозначает группу, определенную в пункте С) ранее, где Y обозначает группу формулы (1), гдеU обозначает CH2, или группу формулы (3) или(5), в которых R7b и R8b обозначают, независимо друг от друга, фенил, фенил, замещенный галогеном, C1-4 алкилом, трифторметилом или C1-4 алкокси, в частности хлором, фтором, метилом,трифторметилом или метокси, 2-тиенил, 2 тиенил, замещенный C1-4 алкилом, наиболее предпочтительно метилом, пирролил или пирролил, замещенный метилом или этилом, R9b иR2, R3, R4-R6 и Х определены выше в списке предпочтительного подкласса соединений и Р обозначает водород. В соответствии с другим предпочтительным подклассом соединений изобретения R1 обозначает группу, определенную в пункте D) ранее, где Y представляет собой группу формулы (6), (7) или (8), в которых R7d и R8d обозначают, независимо друг от друга, фенил, фенил,замещенный галогеном, алкилом С 1-4, трифторметилом или C1-4 алкокси, в частности, хлором,фтором, метилом, трифторметилом или метокси, 2-тиенил, 2-тиенил, замещенный C1-4 алки 000380 10 лом, наиболее предпочтительно метилом, пирролил или пирролил, замещенный метилом или этилом, R9d, R10d и R11d обозначают водород, W обозначает О, k+I равно 0 - 3, наиболее предпочтительно 1 или 2;R2, R3, R4-R6 определены выше в списке предпочтительного подкласса соединений и Р обозначает водород. Фармацевтические композиции настоящего изобретения или производимые в соответствии с настоящим изобретением препараты могут вводиться любым подходящим способом,например перорально в виде таблеток, капсул,порошков, сиропов и др., или парентерально в виде растворов для инъекций. Для изготовления таких композиций могут использоваться известные методы, при этом могут применяться любые фармацевтически приемлемые носители,разбавители, наполнители или другие обычно используемые добавки. Соединения настоящего изобретения могут с успехом вводиться в виде единичных дозированных форм, содержащих упомянутые соединения в количестве от примерно 0,1 до 1000 мг. Общая дневная доза варьирует обычно в диапазоне от примерно 0,5 до 5000 мг и наиболее предпочтительно, от примерно 1,0 до 500 мг активного соединения изобретения. Способ настоящего изобретения, применяемый для получения соединений формулы I,включает: а) для получения соединения формулы I,где R2 обозначает водород, удаление ацильной защищающей группы в соединении формулы II или III: где R1, R3-R6, Х и ZR определены выше, а Ас обозначает ацильную защищающую группу; в) алкилирование амина формулы HNR1R2,где R1 и R2 определены выше, кетоном формулы где R4-R6, X и ZR определены выше, в присутствии восстанавливающего агента; с) для получения соединения формулы I,где Р обозначает Н, удаление В группы в соединении формулы VI или VII: где R1-R6 и Х определены выше, и В обозначает С 1-4 алкил, фенил-C1-4 алкил или группу ZR, определенную ранее;d) восстановление двойной связи в шиффовом основании, оксиме или оксимном эфире приведенных ниже формул VIII или :Хe) арилирование соединения формулы Х где R1, R3-R6 и Х определены ранее, ацилирующим агентом формулы R2'-O-СО-гал, где гал обозначает Сl или Вr и R2' определен выше. Исходным материалом для получения изоксазоловых интермедиатов формул II-X является 4,5,6,7-тетрагидро-1,2-бензизоксазол-3-ол,который готовится по стандартному методу,описанному в литературе (R. Jaquier et al., Bull.Soc. Chim.Fr. 1970, 5, 1978-1985). Исходным материалом для получения соответствующих тиоизоксазолов является циклогексанон-2 карбок-самид. Более подробно процедура превращения таких интермедиатов в соединения формулы I приведена в экспериментальном разделе настоящего описания. Ацильную защищающую группу, применяемую по методу а), успешно удаляют при проведении водного гидролиза, катализируемого основаниями (гидроксид натрия или калия или карбонат калия) или кислотами (соляной или бромистоводородной), гидрирования бензилоксикарбонила или 1,1,1-трихлорэтилоксикарбонильных групп, или при проведении безводной депротекции для удаления защищающей группы , катализируемой кислотой, например тБОК группы. Гидрирование осуществляют либо путем каталитического гидрирования в устройстве Парра с использованием Pd в качестве катализатора, либо путем гидрирования в присутствии металлов, таких как цинк, в водном кислом растворе, таком как разбавленная уксусная кислота. Применяемые по методу в) для проведения восстановительного алкилирования амины являются либо коммерчески доступными, либо могут быть получены с помощью известныхE. Ali et al., J. Med. Chem. 1985, 28, 553-560; патент США 4 383 999 и патент США 4 514 414 от СмитКлайн Бекманн Корпорейшн; ЕР 236342 и ЕР 231996 от Ново Индастри А/С иH.S.White et al., Eur.j.Pharmacol. 1993, 236, 147149). В качестве восстанавливающего агента могут использоваться NaBH4 или NaCNBH3,предпочтительно, в присутствии обезвоживающего агента, такого как молекулярное сито, в протонном растворителе, таком как метанол,этанол, вода или их смеси. При этом используют соответствующие соли аминов для поддержания оптимальных значений рН. Защищающие группы В, используемые по методу с), эффективно удаляются кислотным или щелочным каталитическим гидролизом. Если В обозначает О-алкильную группу, такую как метокси или этокси, она может быть успешно удалена обработкой сильной кислотой (напр. 48% бромистоводородной кислотой в ледяной уксусной кислоте) при повышенных температурах. Шиффовы основания, оксимы или оксимные эфиры, применяемые по методу d), легко восстанавливаются до соответствующих производных амина при каталитическом гидрировании с использованием Pd или Pt в качестве катализатора или при восстановлении амальгамным алюминием или с применением LiAlH4 илиAlH3. Экспериментальный раздел Точки плавления определяют с помощью прибора Бюхи SMP-20 (Buchi SMP-20) и не корректируют их значения. Масс-спектры получают в системе Кваттро MS-MS (Qyattro MS-MS фирмы VG Виотех, Физонс Инструментс (VGBiotech Fisons Instruments). MS-MS систему соединяют с HP 1050 модульной ВЭЖХ системой. Образец объемом 20-50 мкл (10 мкг/мл) растворяют в смеси 1% уксусной кислоты в ацетонитрил /вода 1:1, и вводят с помощью аутосэмплера со скоростью 30 мкл/мин в Electr-rospray Source. Спектры получают в двух стандартных режимах. Один режим используют для получения информации о молекулярных весах (МН+) (21 эВ), а другой режим для индуцирования фрагментации (70 эВ). Вычитают значение фона. Данные по относительной интенсивности ионов получают в режиме фрагментации. Если для молекулярного иона не указана интенсивность(МН+), этот ион присутствует только в первом режиме исследования. Спектры 1 Н ЯМР были записаны для всех новых соединений при 250 МГц на спектрометре Брукер АС 250 (BrukerAC 250), при 200 МГц на спектрометре БрукерAC 200F (Bruker AC 200F) или при других значениях, что будет указано в соответствующем эксперименте. В качестве растворителей используют дейтерированный хлороформ (99,8%D) или диметилсульфоксид (99,9% D). В качестве внутреннего стандарта используют TMS. 13 Значения химических смещений выражают в ррm (частях на миллион). Для описания множественных ЯМР сигналов используют следующие сокращения: с=синглет,д=дублет,т=триплет, к=квартет, кви=квинтет, г=гептет,дд=двойной дублет, дт=двойной триплет,дк=двойной квартет, тт=триплет триплет,м=мультиплет. Сигналы ЯМР, соответствующие протонам кислоты обычно опускают. Содержание воды в кристаллических соединениях определяют титрованием по методу Карпа Фишера. Стандартные процедуры обработки включают экстрагирование указанным органическим растворителем из соответствующих водных растворов, высушивание объединенных органических экстрактов (над безводными MgSO4 илиNa2SO4, фильтрование и выпаривание растворителя в вакууме. Для проведения колоночной хроматографии используют силикагель типа Кизельгель 60, 230-400 меш ASTM. Пример 1. 3-Этокси-4,5,6,7-тетрагидро-1,2 бензизоксазол, 1 а. Исходный материал получают в соответствии с описанной в литературе методикой (R.Jaquier et al., Bull. Soc. Chim. Fr. 1970, 5, 19781985). К раствору этого изоксазолового производного (100 г) в ацетоне (3 л) добавляют карбонат калия (200 г). После нагревания при 50 С в течение 45 мин добавляют по каплям в течение 1,5 ч раствор бромэтана (170 мл) в ацетоне(300 мл). Смесь перемешивают в течение ночи при температуре 50 С. После охлаждения отфильтровывают неорганические соли, а ацетон выпаривают в вакууме. Оставшуюся смесь О- иN-алкилированного продукта разделяют с помощью колоночной хроматографии на силикагеле (элюируют смесью этилацетат/гептан,40:60). Выпаривание растворителей дает 65 г целевого продукта в виде вязкого масла. 1 Н ЯМР СDСl3:1,40 (т, 3 Н), 1,70-1,85 (м,4 Н), 2,25-2,30 (м, 2 Н), 2,50-2,60 (м, 2 Н), 4,30 (к,2 Н). Пример 2. 3-Этокси-4,5,6,7-тетрагидро-1,2 бензизоксазол-4-он, 2 а. (Метод d). К раствору 3-этокси-4,5,6,7-тетрагидро 1,2-бензизоксазола 1 а (35 г) в ледяной уксусной кислоте (500 мл) при 10 С добавляют концентрированную H2SO4 (29 мл). При температуре 20-25 С добавляют по каплям в течение часа раствор дихромата натрия (71 г) в ледяной уксусной кислоте (300 мл), хранившейся при температуре 40-45 С. Смесь перемешивают в течение 3 ч при температуре 25-30 С. Реакционную смесь впивают в лед и диэтиловый эфир (3 л). Добавлением концентрированного водногоNaOH доводят рН до значения 10. Отделяют и обрабатывают органическую фазу. Остающееся сырое целевое соединение очищают с помощью колоночной хроматографии на силикагеле(20 г), Na2CO3 (16 г) и воду (600 мл).Смесь нагревают при температуре кипения с обратным холодильником в течение 3 ч. Растворители частично выпаривают (2/3). Оставшуюся смесь оставляют при комнатной температуре на 0,5 ч,затем отфильтровывают осевший при стоянии кристаллический продукт, промывают его водой и высушивают. Выход оксимного производного составляет 7 г. Т.пл. 216-218 С. К растворуHgCl2 (200 г) в воде (4 л) добавляют нарезанную на мелкие кусочки (0,5 х 0,5 см) алюминиевую фольгу (125 г). Такие кусочки оставляют на 1 мин и затем отфильтровывают и промывают этанолом. Оксимное производное (25 г) суспендируют в метаноле (2 л) и воде (500 мл) и добавляют алюминиевую фольгу. Полученную смесь перемешивают в течение 5 дней. Осадки отфильтровывают и промывают метанолом. Объединенные метанольные растворы выпаривают в вакууме. Оставшийся сырой продукт перемешивают с диэтиловым эфиром. Нерастворившийся исходный материал (оксим) отфильтровывают, а диэтиловый эфир выпаривают в вакууме с получением целевого соединения в виде вязкого масла. Выход составляет 23 г. 1 Н ЯМР (CDCl3)1,40 (т, 3 Н), 1,40-1,75 (м,4 Н), 1,90-2,05 (м, 2 Н), 2,50-2,60 (м, 2 Н), 3,90(R,S)-4-Aмино-3-этокси-4,5,6,7-тетрагидро-1,2-бензизоксазол 3 а (17,5 г) растворяют в дихлорметане (500 мл) и добавляют триэтиламин (30 мл) при 5 С. Добавляют при температуре 5-10 С по каплям раствор (R)-(-)-метоксифенилацетилхлорид (22 г) в дихлорметане (80 мл). Полученную смесь перемешивают в течение 2 ч при комнатной температуре. Добавляют воду (2 л) и отделяют органическую фазу, которую промывают разбавленной соляной кислотой и обрабатывают далее, как было описано выше. Выход составляет 34 г. Диастереомеры из этой смеси разделяют с помощью препаративной ВЭЖХ на силикагеле (элюируют смесью гептан/этилацетат, 3:2). Выход менее полярного дистереомера В составляет 13 г в виде масла. Выход более полярного диастереомера А составляет 11,5 г. Т. пп. 96-97 С. 1 Н ЯМР СDСl31,30 (т, 3 Н) , 1,80-2,05 (м,4 Н), 2,45-2,75 (м, 2 Н), 3,30 (с, 3 Н), 4,25 (к, 2 Н), 15 4,60 (с, 1 Н), (4,95 дт, 1 Н), 6,85 (ушир. д, 1 Н),7,30-7,45 (м, 5 Н). Диастереомер А (3,7 г) растворяют в 48% водной бромистоводородной кислоте (175 мл) и воде (175 мл). Раствор нагревают при температуре кипения с обратным холодильником в течение 1,25 ч. Растворитель выпаривают в вакууме. Добавляют дихлорметан и воду. Органическую фазу отделяют, промывают водой и впоследствии отбрасывают. Объединенные водные фазы выпаривают в вакууме. Добавляют смесь этанол/эфир, 1:1, осевшие продукты отфильтровывают, а растворители выпаривают, получая неочищенную сырую бромистоводородную соль 4 а (энантиомер А) в виде масла. Выход составляет 4,0 г. В примерах 5 и 6 ниже описана очистка. Сырую бромистоводородную соль энантиомера В, 4b выделяют с использованием соответственно диастереомера В. Пример 5. 4-(Трет-бутилоксикарбониламино)-3-гидрокси-4,5,6,7-тетрагидро-1,2-бензизоксазол 5 а, энантиомер А. Смесь сырого гидробромида 4-амино-3 гидрокси-4,5,6,7-тетрагидро-1,2-бензизоксазола 4 а, энантиомер А из примера 4 (4,0 г) растворяют в смеси вода/диоксан, 1:1. После охлаждения до 10 С добавляют раствор NaOH (1,2 г в 12 мл воды). Добавляют при 15-20 С ди-трет-бутил дикарбонат (3,5 г), растворенный в диоксане (12 мл). Смесь перемешивают при комнатной температуре в течение 1,5 ч. Добавляют воду (120 мл) и подводят рН до значений 10 при добавлении небольших количество NaOH. После перемешивания еще в течение 30 мин добавляют диэтиловый эфир (200 мл). Отделяют и затем отбрасывают органическую фазу. ДобавлениемKHSO4 подводят значение рН до 3-4 и экстрагируют водную фазу диэтиловым эфиром (2 х 100 мл). Объединенные органические фазы обрабатывают, как было описано выше, получая сырое т-БОК-защищенное целевое соединение. Чистое целевое соединение 5 а получают с помощью хроматографии на колонке с силикагелем(ушир. д, 1 Н) . Соответствующий энантиомер В получают аналогичным способом: 4-(трет-бутилоксикарбониламино)-3-гидрокси-4,5,6,7-тетрагидро 1,2-бензизоксазол, 5b энантиомер В. Т.пл. 134 С. Спектр ЯМР идентичен приведенному выше спектру соединения 5 а. Пример 6. (+)-4-Амино-3-гидрокси-4,5,6,7 тетрагидро-1,2-бензизоксазола гидрохлорид, 6 а 16 ремешивают при комнатной температуре в течение 1,25 ч. Растворитель выпаривают, а оставшееся масло растворяют в смеси этанола в эфире, 1:1. Осажденное кристаллическое целевое соединение отфильтровывают. Выход: 0,5 г. Т.пл. 209-210 С. []D=+19,40 (с=1,0 М, метанол). 1(-)-(R)-4-Амино-3-гидрокси-4,5,6,7-тетрагидро-1,2-бензизоксазола гидрохпорид, 6b. Т.пл. 209-210 С. []D =-20,0 (с=1,0 М, метанол). 1 Н ЯМР и MS спектры были такими же,как для приведенного выше (+)-энантиомера. Соединение 8 а выделяют соответствующим образом, разделяя методом ВЭЖХ диастереомерные (R)-(-)метоксифенилацил карбоксамидные производные соединения 7 а. Используют модификацию метода примера 4 для расщепления защищающих групп.(+)-3-Гидрокси-4-метиламино-4,5,6,7-тетрагидро-1,2-бензизоксазола гидробромид, 6 с. К наиболее полярному диастереомеру (9 г), выделенному хроматографированием методом ВЭЖХ и растворенному в сухом ТГФ, добавляют по каплям в течение 20 мин при 0-5 С раствор 1 М литийтриэтилборгидрида в сухом ТГФ (80 мл). Затем смесь вливают в лед (500 г) и при добавлении концентрированной соляной кислоты доводят значение рН до 2. Для удаления ТГФ смесь выпаривают в вакууме. Оставшийся водный раствор дважды экстрагируют этилацетатом (50 мл). Полученный водный раствор делают щелочным добавлением концентрированного раствора NaOH (рН 11). Добавляют этилацетат (100 мл) и затем отделяют и обрабатывают, как указано выше, органическую фазу. Весь выделенный таким образом энантиомер 3-этокси-4-метиламино-4,5,6,7 тетрагидро-1,2-бензизоксазола (4,6 г) растворяют в смеси 33% НВr в ледяной уксусной кислоте (150 мл). Смесь нагревают до 90 С и перемешивают в течение часа. Раствор выпаривают в вакууме. Оставшееся вязкое масло перемешивают со смесью этанол/диэтиловый эфир, 1:1. Отфильтровывают осевшую бромистоводородную соль и высушивают ее в течение ночи в вакууме. Выход составляет 4,2 г. Т.пл. 207209 С. [а]D =+5,6 (с=1,0 М, метанол). Спектры 1 Н ЯМР и MS идентичны спектрам, полученным для рацемической смеси соединения 8 а. Энантиомерная чистота по данным ВЭЖХ составляет: ее 99. Аналогично получают гидробромид (-)-3 гидрокси-4-метил-амино-4,5,6,7-тетрагидро-1,2 бензизоксазола, 6d, из другого диастереомерного карбоксамидного производного. Т.пл. 208209 С. [а]D =-5,9 (с=1,0 М, метанол). Энантио 17 мерная чистота по данным ВЭЖХ составляет: ее 99. Пример 7. (RS)-3-Этокси-4-метиламино 4,5,6,7-тетрагидро-1,2-бензизоксазол 7 а. К раствору 3-этокси-4,5,6,7-тетрагидро 1,2-бензизоксазол-4-она, 2 а (4,5 г) в метаноле(15 г), 33% раствор метиламина (5 мл) в этаноле и порошок молекулярных сит (3). В конце добавляют цианоборгидрид натрия (7 г). Смесь перемешивают в течение ночи. Отфильтровывают неорганические соли и растворители выпаривают в вакууме. Добавляют этилацетат и воду и доводят рН до значения 10 добавлением концентрированного раствора NaOH. Затем обрабатывают органическую фазу, как было указано выше. Сырое целевое соединение используют без дальнейшей очистки. Выход составляет 4,8 г. 1 Н ЯМР (CDCl3)1,40 (т, 3 Н), 1,65-1,80 (м,3 Н), 1,85-2,00 (м, 1 Н), 2,05 (с, 1 Н), 2,45 (с, 3 Н),2,50-2,60 (м, 2 Н), 3,60 (т, 1 Н), 4,30 (к, 2 Н). Аналогичным способом синтезируют следующие 3-этоксиизоксазолы:(150 мл) нагревают при 60-75 С в течение одного ч. В вакууме выпаривают растворители и добавляют смесь этанол/эфир,1:1. Отфильтровывают кристаллическую бромистоводородную соль 8 а. Выход составляет 3,6 г. Т.пл. 184-186 С. 1 ЯМР (ДМСО-d6)1,75-2,15 (м, 4 Н), 2,65(с, 3 Н), 2,60-2,70 (м, 2 Н), 4,20 (ушир. сигнал,1 Н), 8,60 (ушир. с, 1 Н). Соответствующим образом получают следующие соединения. Гидробромид (R,S)-4-[4,4-бис (4-фторфенил)бутан-1-ил-амино]-3-гидрокси-4,5,6,7-тетрагидро-1,2-бензизоксазола, 8b. Т.пл. 205206 С. 1 ЯМР (ДМСО-d6)1,45-1,60 (м, 2 Н),1,702,10 (м, 6 Н), 2,55-2,70 (м, 2 Н), 3,05 (т, 2 Н), 4,00H ЯМР (ДМСО-d6)1,70-2,30 (м, 8 Н),2,60-2,75 (м, 2 Н), 3,10-3,70 (м, 4 Н) , 4,35 (ушир. с, 1 Н) . MS m/z (%): 209 (MH+, 5%), 138 (35%),72 (56%), 67 (100%), 41 (79%). Оксалат (R,S)-4-(2-пропен-1-иламино)-3 гидрокси-4,5,6,7-тетрагидро-1,2-бензизоксазола,(ацетон) 8f. Это соединение очищают с помощью 4-трет.-бутилоксикарбониламинового про 19 изводного, которое освобождают от защищающих групп, как было описано в примере 8 В. Т.пп. 182-183 С. 1 ЯМР (ДМСО-d6)1,75-2,20 (м, 4 Н), 2,602,75 (м, 2 Н), 3,65 (д, 2 Н), 4,15 (ушир. с, 1 Н), 5,40MS m/z (%): 349 (MH+, 5%), 138 (100%),67 (30%). Приведенные ниже соединения получают аналогичным способом, за исключением того,что проводят кристаллизацию целевых соединений из ацетона (8j, 8k, 8l, 8m, 8n, 8p) или диэтилового эфира (80). Гидробромид (R,S)-4-[N-[3-(10,11-дигидродибензо[a,d]циклогепт-5-илиден)пропан-1-ил] амино]-3-гидрокси-4,5,6,7-тетрагидро-1,2-бензизоксазола, 8j. Т.пл. 228-230 С (разпож.). 1(33%), 138 (100%), 105 (29%), 67 (44%). Пример 8 В. Гидробромид (R,S)-3 гидрокси-4-метиламино-4,5,6,7-тетрагидро-1,2 бензизоксазола, 8 а. (Метод С). Приведенный ниже метод является альтернативным по отношению к методу примера 8 А, используемого для получения соединения 8 а и аналогичных производных. Раствор ди-трет-бутил дикарбоната (3,56 г) в ТГФ (50 мл) добавляют к раствору гидробромида (R,S)-3-этокси-4-амино-4,5,6,7-тетрагидро 1,2-бензизоксазола, 3 а (2,60 г) и карбоната калия (2,07 г) в воде (25 мл). Смесь перемешивают при комнатной температуре в течение 20 ч и выпаривают. К остатку добавляют воду (30 мл) и проводят экстракцию смеси диэтиловым эфиром (3 х 50 мл). Объединенные органические экстракты высушивают и выпаривают, а остаток повторно кристаллизуют из смеси диэтиловый эфир/петролейный эфир с олучением (R,S)-3 этокси-4-(трет.бутилоксикарбониламино)-4,5,6,7-тетрагидро-1,2-бензизоксазола (2,69 г). Т.пл.(1,00 г) и метил иодида (2,18 мл) в ТГФ (45 мл) добавляют небольшими порциями гидрид натрия в минеральном масле (425 мг). Смесь перемешивают в течение ночи при комнатной температуре и добавляют метанол для разрушения избытка гидрида натрия. После выпаривания к остатку добавляют воду (25 мл). Экстракция этилацетатом (3 х 50 мл), высушивание и выпаривание приводят к получению (R,S)-3 этокси-4-(N-метил-трет.бутилоксикарбониламино)-4,5,6,7-тетрагидро-1,2-бензизоксазола (1,05 г) в виде желтого масла. 1(с, 3 Н), 4,35 (к, 2 Н), 5,20 (м, 1 Н). К (R,S)-3-этокси-4-(N-метил-трет-бутилоксикарбониламино)-4,5,6,7-тетрагидро-1,2-бензизоксазолу (1,05 г) добавляют 33% раствор бромистоводородной кислоты в ледяной уксусной кислоте (15 мл) и перемешивают полученную смесь при 80 С в течение 25 мин. После выпаривания к остатку добавляют 33% бромистоводородную кислоту в ледяной уксусной кислоте (15 мл), и смесь перемешивают при 80 С в течение 25 мин. Выпаривание и повторная кристаллизация остатка (ацетонитрилэтанолдиэтиловый эфир) приводят к получению целевого соединения (807 мг). Т.пл. 188-190 С. 1(м, 2 Н), 2,85 (с, 3 Н), 4,35 (м, 1 Н). Аналогично, но с использованием этил иодида вместо метил иодида получают следующее соединение: гидробромид (R,S)-4-этиламино-3 гидрокси-4,5,6,7-тетрагидро-1,2-бензизоксазола,8 е. Т.пл.188-191 С (из смеси ацетонитрил / этанол / диэтиловый эфир). 1(м, 4 Н), 2,70 (м, 4 Н), 3,25 (к, 2 Н), 4,35 (м, 1 Н). Пример 9. Гидробромид (R,S)-4-(2-гидроксиэтиламино)-3-гидрокси-4,5,6,7-тетрагидро 1,2-бензизоксазола, 9 а. К раствору гидробромида (R,S)-4-(2 ацетилоксиэтиламино)-3-гидрокси-4,5,6,7-тетрагидро-1,2-бензизоксазола, 8 с (1,3 г) в воде (50 мл) добавляют 48% водную НВr (7 мл). Смесь нагревают при температуре 100 С в течение часа. Растворитель выпаривают в вакууме, а оставшееся масло растворяют в этаноле. При выпаривании основной фракции этанола происходит кристаллизация бромистоводородной соли соединения 9 а,которую затем отфильтровывают и высушивают. Выход: 0,9 г. Т.пл. 172-173 С. 1 22 Пример 10. (R,S)-4-[N-[4,4-бис(4-фторфенил)бутан-1-ил]-N-метиламино]-3-этокси 4,5,6,7-тетрагидро-1,2-бензизоксазол, 10 а. К (R,S)-3-этокси-4-метиламино-4,5,6,7-тетрагидро-1,2-бензизоксазолу, 7 а (1,0 г) в метилизобутилкетоне (МИБК) (10 мл) добавляют бис 4,4-(4-фторфенил)-1-бутилхлорид (2,0 г), карбонат калия (1,0 г) и иодид калия (0,5 г). Смесь нагревают при температуре кипения с обратным холодильником в течение ночи. Отфильтровывают неорганические соли и выпаривают МИБК. Оставшееся масло очищают хроматографированием на колонке с силикагелем(элюируют смесью гептан / этилацетат, 2 : 3). Выход целевого соединения в виде масла составляет 1,6 г. 1H ЯМР (CDCl3)1,35 (т, 3 Н), 1,35-1,50 (м,2 Н), 1,60-1,75 (м, 3 Н), 1,90-2,05 (м, 3 Н), 2,20 (с,3 Н), 2,35-2,60 (м, 4 Н), 3,60 (т, 1 Н), 3,85 (т, 1 Н),4,25 (к, 2 Н), 6,95 (т, 4 Н), 7,15 (ДД, 4 Н). Соответствующим способом получают приведенное ниже 3-этокси производное: (R,S)4-[N-(4,4-дифенилбутан-1-ил)-N-метиламино]3-этокси-4,5,6,7-тетрагидро-1,2-бензизоксазол,10b. Получают алкилированием 4,4-дифенил-1 бутилиодидом, 29 а и выделяют в виде масла. 1H ЯМР (СDСl3)1,30 (т, 3 Н), 1,35-1,50 (м,2 Н), 1,60-1,70 (м, 4 Н), 1,90-2,10 (м, 2 Н), 2,15 (с,3 Н), 2,30-2,50 (м, 4 Н), 3,55 (т, 1 Н), 3,85 (т, 1 Н),4,25 (к, 2 Н), 7,10-7,30 (м,10 Н). Приведенные ниже соединения получают аналогичным способом, за исключением того,что алкилирование проводят в ацетоне без добавления иодида калия.(R,S)-4-[N-[3-(10,11-Дигидробензо[а,d] циклогепт-5-или-ден)пропан-1-ил]метиламино]3-этокси-4,5,6,7-тетрагидро-1,2-бензизоксазол,10 с. Получают посредством алкилирования 3(10,11-дигидробензо[a,d]циклогепт-5-илиден)-1 пропилбромидом (готовят по методу, описанному в J. Orq. Chem. (1962), Vol. 27, 4134-37) и выделяют в виде масла. 1(R,S)-4-[N-[4,4-Ди-(2-толил)бутан-1-ил]метиламино]-3-этокси-4,5,6,7-тетрагидро-1,2 бензизоксазол, 10d. Получают через алкилирование 4,4-ди-(2-толил)-1-бутилиодидом, 34 а, и выделяют в виде масла. 1(R,S)-4-[N-[1,1-Ди-(2-толил)бут-1-ен-4 ил]метиламино]-3-этокси-4,5,6,7-тетрагидро 1,2-бензизоксазол, 10 е. Получают через алкилирование 4,4-ди-(2-толил)-3-бутенилиодидом,36 а, и выделяют в виде масла.(1,6 г), нагревают при температуре 80 С в 33% растворе бромистого водорода в ледяной уксусной кислоте (60 мл) в течение 1 ч. Растворитель выпаривают в вакууме. Оставшийся сырой продукт повторно растворяют в этаноле и выпаривают в вакууме. Оставшееся вязкое масло растворяют в ледяной уксусной кислоте (15 мл) и добавляют воду (150 мл). После сушки при температуре ниже 0 С в течение ночи остается аморфный порошок целевого соединения 11. Этот порошок перемешивают с диэтиловым эфиром и отфильтровывают. После высушивания в вакууме при 50 С в течение 24 ч собирают чистый аморфный гидробромид. Выход составляет 1,2 г. Т.пл. 68-70 С. 1MS m/z (%): 413 (МН+, 10%), 203 (13%),138 (100%), 109 (12%), 67 (58%). Соответствующим образом получают приведенное ниже 3-гидрокси производное: гидробромид (R,S)-4-[N-(4, 4-дифенилбут-1-ил)-Nметиламино]-3-гидрокси-4,5,6,7-тетрагидро-1,2 бензизоксазола, 11b. Т.пп. 174-176 С (этанол / диэтиловый эфир, 1:1). 1(R,3)-3 гидрокси-4-метиламино-4,5,6,7-тетрагидро-1,2 бензизоксазола, 8 а (7,0 г) в смеси диоксана (50 мл) и воды (80 мл) добавляют при температуре 10 С NaOH (1,1 г) и раствор ди-третбутилдикарбоната (6,0 г) в диоксане (20 мл). Смесь перемешивают при комнатной температуре в течение 1,5 ч, добавляют воду (150 мл). После перемешивания в течение еще 20 мин добавляют диэтиловый эфир (100 мл). Отделяют и отбрасывают органическую фазу. Значение рН водной фазы доводят до 4 добавлением KHSO4. Проводят повторную экстракцию водной фазы диэтиловым эфиром (3 х 100 мл). Объединенные органические фазы обрабатывают, как было(ушир. с, 1 Н). С помощью такого же метода синтезируют(R,S)-4-(трет-бутилоксикарбониламино)-3-гидрокси-4,5,6,7-тетрагидро-1,2-бензизоксазол, 12b. Т.пл. 175-177 С (из смеси этилацетат петролейный эфир). Пример 13. (R,S)-4-(N-трет-бутилоксикарбонил-N-метиламино)-3-пивалоилоксиметилокси-4,5,6,7-тетрагидро-1,2-бензизоксазола, 13 а. К суспензии (R,S)-(N-трет-бутилоксикарбонил-N-метиламино)-3-гидрокси-4,5,6,7-тетрагидро-1,2-бензизоксазола, 12 а (5 г) в ацетоне (50 мл) осторожно добавляют (при температуре ниже 30 С) трет-бутоксид калия (2,5 г). Добавляют раствор пивалоилметилиодида (7,5 г) в ацетоне (10 мл) и смесь перемешивают в течение ночи. Отфильтровывают неорганические соли и выпаривают ацетон. После хроматографирования на колонке с силикагелем (элюируют смесью гептан / этилацетат, 3:2) получают 3,8 г целевого соединения 13 а в виде масла. 1(ушир. сигнал, 1 Н), 5,85 (дд, 2 Н). Более полярная фракция, полученная после колоночной хроматографии, содержит 2,1 гH ЯМР (CDCl3)1,20 (с, 9 Н), 1,50 (с, 9 Н),1,60-2,10 (м, 4 Н), 2,40-2,50 (м, 2 Н), 2,65 (с, 3 Н),5,00-5,10 (ушир. сигнал, 1 Н), 5,75 (с, 2 Н). Следующие соединения синтезируют соответствующим образом.(3,7 г) в дихлорметане, хранившемся при 20 С,добавляют трифторуксусную кислоту (19 мл). Смесь перемешивают при температуре 20 С в течение часа. Растворители выпаривают в вакууме при комнатной температуре. Оставшееся 25 масло растворяют в диэтиловом эфире (100 мл) и воде (100 мл). Добавляют карбонат калия до достижения значения рн 9. Отделяют органическую фазу и обрабатывают ее, как было описано выше. Выход сырого целевого соединения в виде свободного основания составляет 2,4 г. К раствору всего основания 14 а в этаноле (10 мл) добавляют щавелевую кислоту (0,7 г). Отфильтровывают выпавшую в осадок гемиоксалатную соль. Выход составляет 1,2 г. Т.пл. 201-202 С. 1(R,S)-4-(третбутилоксикарбониламино)-3-пивалоилоксиметилокси-4,5,6,7-тетрагидро-1,2-бензизоксазола,13 с 2,5 М раствором НСl в этилацетате дает гидрохлорид (R,S)-4-амино-3-пивалоилоксиметилокси-4,5,6,7-тетрагидро-1,2-бензизоксазола, 14 с. Т.пл. 157-168 С (ацетонитрилдиэтиловый эфир). 1(+)-3-гидрокси-4 метиламино-4,5,6,7-тетрагидро-1,2-бензизоксазола, 6 с, получают соответствующий энантиомер 4-(N-трет-бутилоксикарбонил-N-метиламино)-3-гидрокси-4,5,6,7-тетрагидро-1,2-бензизоксазола при взаимодействии его с ди-третбутилдикарбонатом в соответствии с процедурой примера 12. Далее взаимодействие с пивалоилметилиодидом, как в примере 13, приводит к получению чистого изомера 4-(N-третбутилоксикарбонил-N-метиламино)-3 пивалоилоксиметилокси-4,5,6,7-тетрагидро-1,2-бензизоксазола. Как уже указывалось (пример 14), БОКзащитные группы расщепляют обработкой трифторуксусной кислотой. Чистый энантиомер А соединения 14 а кристаллизуют из ацетона в виде гемиоксалатной соли. Т.пл. 211-213 С. Оптическое вращение [а]D =-5,4 (С=1, МеОН). Соответствующим способом из соединения 6d получают другой изомер: гемиоксалат 4 метиламино-3-пивалоилоксиметилокси-4,5,6,7 000380 26 тетрагидро-1,2-бензизоксазола, энантиомер В. Т.пл. 210-213 С. Оптическое вращение составляет [а]D =+5,6 (С=1, МеОН). Для подтверждения энантиомерной чистоты обоих соединений проводят их анализ с применением метода 1 Н ЯМР в присутствии R(-)-1(9-антрил)-2,2,2-трифторэтанола. В рацемате отмечается расщепление синглетов от третбутильной группы и метильной группы на два синглетных сигнала. Энантиомер А дает синглеты при(часть на миллион) 1,15 (с, 9 Н) и 2,15 (с, 3 Н). Энантиомер В дает синглеты при(часть на миллион) 1,20 (с, 9 Н) и 2,25 (с, 3 Н). В обоих соединениях не обнаруживается примесей от другого изомера. Предел обнаружения составляет 2%. Пример 15. (Метод а). Гидрохлорид (R,S)4-метиламино-2-фениламинокарбонил-4,5,6,7 тетрагидро-1,2-бензизоксазол-3-она, 15 а. К раствору (R,S)-4-(N-трет-бутилоксикарбонил-N-метиламино)-3-гидрокси-4,5,6,7 тетрагидро-1,2-бензизоксазола, 12 а (1,0 г) в дихлорметане (10 мл) добавляют фенилизоцианат(0,6 мл). Смесь перемешивают в течение ночи при комнатной температуре. Выпаривают дихлорметан. Из диэтилового эфира кристаллизуют(R,S)-4-(N-трет-бутилоксикарбонил-Nметиламино)-2-фениламинокарбонил-4,5,6,7 тетрагидро-1,2-бензизоксазол-3-он. Упомянутое выкристаллизованное соединение (0,4 г) суспендируют в насыщенном растворе хлороводорода в диэтиловом эфире. После нескольких минут перемешивания почти все соединения растворяют и солянокислая соль целевого соединения начинает выпадать в осадок. После двухчасового перемешивания осажденное целевое соединение отфильтровывают и тщательно промывают диэтиловым эфиром. Выход составляет 0,3 г. Т.пл. 168-170 С. 1(д, 2 Н). Соответствующим способом получают следующие соединения. Оксалат(%): 302 (МН+), 169 (8%), 138 (58%), 91 (97%),65 (100%). Пример 16. Натриевая соль (R,S)-4-[N[бис-(4-фторфенил)метил-2-оксиэтил]-N-метиламино]-3-гидрокси-4,5,6,7-тетрагидро-1,2 бензизоксазола, 16 а (метод С). К раствору (R,S)-4-метиламино-3-пивалоилоксиметилокси-4,5,6,7-тетрагидро-1,2-бензизоксазола, 14 а (1,1 г) в МИБК (18 мл) добавляют карбонат калия (0,7 г) и метансульфонатный эфир бис(4-фторфенил)метил-2-оксиэтанола(1,8 г). Смесь нагревают при температуре кипения с обратным холодильником в течение ночи. Отфильтровывают неорганические соли и выпаривают МИБК. После проведения хроматографии на колонке получают чистый(дт, 1 Н), 5,35 (с, 1 Н), 5,90 (дд, 2 Н), 7,00 (т, 4 Н),7,30 (дд, 4 Н), 7,55 (д, 2 Н). К защищенному производному пивалоилоксиметила (0,6 г) в этаноле (7 мл) добавляют воду (1,4 мл) и порошковый NaOH (0,7 г). Смесь перемешивают в течение ночи. Этанол выпаривают в вакууме и добавляют воду (25 мл). Отфильтровывают осевший кристаллический продукт и промывают его водой. После высушивания в течение ночи при 70-80 С в вакууме остается 350 мг чистой натриевой соли целевого соединения. Т.пл.: 178-181 С.MS m/z (%): 415 (МН+, 4%), 203 (100%),183 (63%), 138 (42%), 67 (30%). Соответствующим способом получают следующие соединения. Натриевая соль (R,S)-4-[N-[бис(4-хпорфенил)метил-2-оксиэтил)-N-метиламино]-3-гидрокси-4,5,6,7-тетрагидро-1,2-бензизоксазола, 16 и. Т.пл. 201-203 С (вода/этанол). 1MS m/z (%): 379 (МН+, 4%), 167 (100%),152 (74%), 138 (36%),67 (32%). Аналогично, при обработке (R,S)-4-[N(4,4-бис[3-метилтиен-2-ил]-3-бутенил)-N-метиламино]-3-пивалоилоксиметилокси-4,5,6,7-тетрагидро-1,2-бензизоксазола с применением NaOH в водном этаноле с последующим подкислением 4 М НСl и экстракцией метиленхлоридом получают гидрохлорид(526 мг) и 1 М гидроксида натрия (8 мл) экстрагируют метиленхлоридом (3 х 10 мл). Объединенные экстракты высушивают и выпаривают. К остатку добавляют муравьиную кислоту (3 мл), 30% формальдегид (3 мл) и формиат натрия(3 г) и перемешивают полученную смесь при 60 С в течение 3 ч и при 100 С в течение 20 ч. После выпаривания к остатку добавляют воду(20 мл) и доводят значения рН до 10 с помощью 2 М гидроксида натрия. Смесь экстрагируют метиленхлоридом (3 х 40 мл) и объединенные экстракты высушивают и выпаривают. Остаток растворяют в диэтиловом эфире (25 мл) и добавляют по каплям избыток 33% бромистоводородной кислоты в ледяной уксусной кислоте для осаждения целевого соединения (422 мг). Повторная кристаллизация из смеси ацетонитрил/диэтиловый эфир дает соединение аналогичной чистоты. Т.пл. 158-160 С. 1(R,S)-4 диметиламино-3-гидрокси-4,5,6,7-тетрагидро 1,2-бензизоксазола, 18 а. (Метод С). Раствор гидробромида (R,S)-3-этокси-4 диметиламино-4,5,6,7-тетрагидро-1,2-бензизоксазола, 17 а (250 мг) и 33% бромистоводородной кислоты в ледяной уксусной кислоте (5 мл) перемешивают при 80 С в течение 25 мин. Смесь выпаривают и добавляют к остатку 33% бромистоводородную кислоту в ледяной уксусной кислоте (5 мл). После перемешивания при 80 С в течение 25 мин смесь выпаривают и остаток повторно кристаллизуют из смеси ацетонитрилэтанолдиэтиловый эфир с получением целевого соединения (199 мг). Т.пл. 183-186 С. Соединение кристаллизуют с 0,33 моль воды.(R,S)-3-гидрокси-4-(N-метил-Nтрет-бутилоксикарбониламино)-4,5,6,7-тетрагидро-1,2-бензизоксазола, 12 а (1,20 г) и карбоната калия (1,23 г) в ДМФ (25 мл) перемешивают при 40 С в течение 45 мин. Добавляют бензилбромид (1,59 мл) и продолжают перемешивание еще в течение 20 ч. Реакционную смесь выпаривают и добавляют к остатку воду (25 мл). Экстракция метиленхлоридом (3 х 50 мл),высушивание и выпаривание приводят к получению масла. Проводят флэш-хроматографию на силикагеле (элюент: толуол, содержащий этилацетат (0-75%), эпюируют (R, S)-3 бензилокси-4-(N-метил-N-третбутилоксикарбонипамино)-4,5,6,7-тетрагидро 1,2-бензизоксазол (масло, 620 мг). Смесь указанного соединения (620 мг), 1 М НСl (15 мл) и этанола (20 мл) перемешивают при 45 С в течение 80 мин. Выпаривание и повторная кристаллизация остатка из смеси ацетонитрилдиэтиловый эфир дают целевое соединение (460 мг). Т.пп. 156-159 С. Соответствующим образом синтезируют приведенное ниже соединение. Гидрохлорид (R,S)-3-бензилокси-4-амино 4,5,6,7-тетрагидро-1,2-бензизоксазола,19b. Т.пл. 168-170 С. Пример 20. Гидрохлорид (R,S)-3-гидрокси 4-[N-(4,4-дифенил-3-бутенил)метиламино]4,5,6,7-тетрагидро-1,2-бензизоксазола, 20 а. (Метод С). Смесь соединения 19 а (442 мг), карбоната калия (622 мг), иодида натрия (50 мг) и 4,4 дифенил-3-бутенилбромида (646 мг) в ДМФ (8 мл) перемешивают при 120 С в течение 24 ч. Добавляют раствор 4,4-дифенил-3-бутенилбромида (500 мг) в ДМФ (3 мл) и продолжают перемешивание при 120 С еще в течение 24 ч. Реакционную смесь выпаривают и к остатку добавляют воду (20 мл). Экстракции диэтиловым эфиром (3 х 25 мл), высушивание и выпаривание приводят к получению масла. Флэшхроматография на силикагеле (элюент: толуолэтилацетат (0-100%),) дает (R, S)-3-бензилокси-4[N-(4,4-дифенил-3-бутенил)метиламино]-4,5,6,7-тетрагидро-1,2-бензизоксазол (590 мг) в виде масла слегка желтого цвета. Раствор указанного соединения (590 мг) в этаноле (16 мл) и концентрированную соляную кислоту (8 мл) нагревают при температуре кипения с обратным холодильником в течение 3 дней. Выпаривание и повторная кристаллизация остатка из смеси ацетонэтанол-диэтиловый эфир дают целевое соединение (212 мг). Т.пп. 119-120 С. 1 30 4,18 (м, 1 Н), 5,91 (т, 1 Н), 7,0-7,4 (м, 10 Н). Спектр 1 Н ЯМР показывает наличие 0,75 эквив. этанола. Соответствующим образом синтезируют следующие соединения. Гидрат гидрохлорида (R,S)-3-гидрокси-4[N-(4,4-дифенил-3-бутенил)амино]-4,5,6,7 тетрагидро-1,2-бензизоксазола, 20b. Т.пл. 140143 С (из ацетонитрила). 1(США 4169952 от du Pont de Nemours, 1979),бензиламина (8,4 г), толуола (35 мл) и молекулярных сит (Union Carbide 3, 2 г) нагревают при температуре кипения с обратным холодильником в течение 2 ч в сепараторе воды ДинСтарк (Dean-Stark). Реакционную смесь фильтруют и выпаривают. Остаток кристаллизуют из петролейного эфира с получением целевого соединения (16 мг) . Т.пл. 73-74 С. Пример 22. 3-Гидрокси-4,5,6,7-тетрагидро 1,2-бензизотиазол, 22 а. К раствору 2-бензиламино-3,4,5,6 тетрагидробензамида, 21 а (15 г) в ледяной уксусной кислоте (100 мл) добавляют при 80 С в течение 4 ч избыток сероводорода. Реакционную смесь выпаривают и к остатку добавляют диэтиловый эфир, что приводит к кристаллизации. Кристаллы растворяют в этилацетате (30 мл) и добавляют по каплям при комнатной температуре раствор брома (8,3 мл) в этилацетате(30 мл). Смесь перемешивают в течение 20 ч при комнатной температуре и выпаривают. Хроматография на колонке с силикагелем (элюент:этилацетатэтанол, 1:1, содержащий 1% ледяной уксусной кислоты) дает целевое соединение (3,3 г). Т.пл. 157-158 С. Пример 23. 3-Хлор-4,5,6,7-тетрагидро-1,2 бензизотиазол, 23 а. Смесь 3-гидрокси-4,5,6,7-тетрагидро-1,2 бензизотиазола, 22 а (4,74 г), гидрохлорида пиридиния (12,7 г), фосфорной кислоты (2,1 г) и оксихлорида фосфора (25 мл) перемешивают при 90 С в течение 5 ч. Реакционную смесь выпаривают и к остатку добавляют этилацетат(130 мл). Добавляют насыщенный раствор бикарбоната натрия (130 мл) и после 10 минутного перемешивания разделяют фазы. 31 Водную фазу экстрагируют этилацетатом (2 х 150 мл), и объединенные органические фазы высушивают и выпаривают с получением масла. Хроматография на колонке с силикагелем (элюент: толуол-этилацетат, 1:1) приводит к получению желтого масла (2,8 г). Пример 24. 3-Хлор-4,5,6,7-тетрагидро-1,2 бензизотиазол-4-он, 24 а. Добавляют по каплям в течение 1 ч раствор дихромата натрия (4,4 г) в ледяной уксусной кислоте (30 мл) к раствору 3-хлор-4,5,6,7 тетрагидро-1,2-бензизотиазола, 23 а (2,7 г) и концентрированную серную кислоту (1,8 мл) в ледяной уксусной кислоте (80 мл). Реакционную смесь перемешивают при комнатной температуре еще в течение 2 ч и нейтрализуют добавлением насыщенного раствора бикарбоната натрия. Экстракция диэтиловым эфиром (3 х 150 мл), высушивание и выпаривание дают масло. При хроматографировании на колонке с силикагелем (элюент: толуол-этилацетат, 1:1) первым элюируется 3-хлор-4,5,6,7-тетрагидро-1,2 бензизотиазол-7-он (680 мг). Более поздние фракции содержат целевое соединение (780 мг). Т.пл. 8485 С. Пример 25. 3-Метокси-4,5,6,7-тетрагидро 1,2-бензизотиазол-4-он, 25 а. Смесь 3-хлор-4,5,6,7-тетрагидро-1,2-бензизотиазола, 24 а (600 мг) и раствора натрия (506 мг) в метаноле (22 мл) перемешивают при 90 С в течение 1 ч. Выпаривают реакционную смесь и к остатку добавляют воду (20 мл). Экстракция метиленхлоридом (3 х 30 мл), высушивание и выпаривание дают масло. Хроматография на колонке с силикагелем (элюент : толуолэтилацетат, 4:1) дают целевое соединение (251 мг). Т.пл.45-46 С. Пример 26. (Метод С). Гидробромид (R,S)4-амино-3-гидрокси-4,5,6,7-тетрагидро-1,2 бензизотиазола, 26 а. К раствору 3-метокси-4,5,6,7-тетрагидро 1,2-бензизотиазол-4-она, 25 а (185 мг) и ацетата аммония (780 мг) в метаноле (7 мл) добавляют порциями боргидрид натрия (44 мг). Смесь перешивают при комнатной температуре в течение 48 ч и подкисляют концентрированной соляной кислотой. Смесь выпаривают и к остатку добавляют воду (3 мл). Водный раствор промывают диэтиловым эфиром (3 х 15 мл) и добавляют твердый гидроксид калия до рН 10. Экстракция диэтиловым эфиром (3 х 15 мл), высушивание и выпаривание дают масло. Масло растворяют в этаноле и добавляют избыток соляной кислоты в этилацетате для осаждения гидрохлорида(R,S)-3-метокси-4-амино-4,5,6,7 тетрагидро-1,2-бензизотиазола (68 мг). К указанному гидрохлориду (60 мг) добавляют 33% раствор бромисто-водородной кислоты в ледяной кислоте (3 мл) и перемешивают смесь при комнатной температуре в течение 48 ч. Выпаривание и повторная кристаллизация остатка (ме 000380 32 танол-эфир) дают целевое соединение (28 мг). Т.пл. 160-165 С. 1(R,S)-3-Метокси-4-метиламино-4,5,6,7 тетрагидро-1,2-бензизотиазол синтезируют по процедуре примера 7, примененной для получения соединения 7 а, с использованием соединения 25 а (200 мг) в метаноле (5 мл), 33% раствора метиламина (217 мкл) в этаноле, порошка молекулярных сит (3) и цианоборгидрида натрия (234 мг). Полученное масло растворяют в диэтиловом эфире и добавляют избыток соляной кислоты в этилацетате для осаждения гидрохлорида(R,S)-3-метокси-4-метиламино 4,5,6,7-тетрагидро-1,2-бензизотиазола (172 мг). Т.пл.146-148 С. К 100 мг добавляют раствор бромистоводородной кислоты в ледяной уксусной кислоте (33%, 6 мл) и смесь перемешивают при комнатной температуре в течение 48 ч. Выпаривание и повторная кристаллизация остатка из смеси метанол/диэтиловый эфир дают целевое соединение (53 мг). Т.пл. 192 С (разлож). 1(R,S)-3 гидрокси-N-метиламино-4,5,6,7-тетрагидро-1,2 бензизоксазола (1,0 г) и триэтиламина (1,8 мл) в сухом диметилформамиде (10 мл), находившемуся при 0 С, добавляют по каплям фенил хпорформиат (0,7 г) в ТГФ (10 мл). После перемешивания в течение ночи при комнатной температуре добавляют воду (200 мл) и этилацетат(100 мл). рН доводят до значения 1-2 добавлением соляной кислоты. Органическую фазу отделяют и обрабатывают, как было описано выше. Целевое соединение кристаллизуют при перемешивании с диэтиловым эфиром. Выход составляет 1,0 г. Т.пл. 147-149 С. 1MS m/z (%): 289 (МН+, 10%), 138 (100%),95 (24%), 67 (77%). Пример 29. 4,4-Дифенил-1-бутилиодид,29 а. К суспензии магниевой turninqs (15 г) в сухом ТГФ (75 мл) добавляют немного бромбензола (0,5 г). После начала исходной экзотермической реакции смесь нагревают до температуры кипения с обратным холодильником и добавляют по каплям в течение 30 мин раствор бромбензола (90 г) в сухом ТГФ (200 мл). Смесь 33 нагревают еще в течение 1,5 ч. Смесь охлаждают до комнатной температуры и в инертной атмосфере отфильтровывают избыток Mg. Добавляют по каплям при 15-25 С раствор метилового эфира 4-хлормасляной кислоты (40 г) в сухом ТГФ (160 мл). После перемешивания еще в течение 30 мин смесь вливают в водный раствор NH4Cl и льда. Добавляют диэтиловый эфир(500 мл). С использованием стандартной процедуры обрабатывают органическую фазу. Выход составляет 65 г сырого 4-хлор-1,1-дифенилбутан-1-ола. Сырой спирт (30 г) растворяют в смеси ледяной уксусной кислоты (60 мл) и 57% водной йодноватой кислоты (60 мл). Добавляют красный фосфор (5 г) и нагревают смесь при температуре кипения с обратным холодильником еще в течение 6 ч. После медленного охлаждения до комнатной температуры смесь вливают в воду и диэтиловый эфир. Органическую фазу обрабатывают с применением стандартной процедуры и получают 39 г целевого бутилиодида, 29 а, в виде масла, который используют без дальнейшей очистки. Пример. 30. Гидрохлорид 4,4-дифенил-1 бутиламина, 30 а. К раствору 4,4-дифенил-1-бутилиодида,29 а (20 г) в сухом ДМФ (150 мл) добавляют азид натрия (10 г). После нагревания при температуре кипения с обратным холодильником в течение 1,5 ч смесь охлаждают до комнатной температуры и затем вливают в диэтиловый эфир и воду. Органическую фазу обрабатывают по стандартной методике, приведенной выше. Выход 4,4-дифенил-1-бутилазида составляет 14 г. Сырой азид (10 г) растворяют в этаноле (150 мл), воде (10 мл) и ледяной уксусной кислоте(10 мл). Добавляют 2% палладий на черном угле и смесь гидрируют в устройстве Парра под давлением 3 атм. в течение 1,5 ч. Катализатор отфильтровывают и растворитель выпаривают в вакууме. Оставшееся вязкое масло растворяют в воде и дихлорметане. Добавляют водный раствор NaOH до подведения рН до значений 11. Отделяют органическую фазу и обрабатывают ее в соответствии с описанной выше стандартной процедурой. Солянокислую соль получают при добавлении НСl к раствору свободного аминокислотного соединения в диэтиловом эфире. Выход составляет 3,4 г. Т.пл. 172-175 С. Приведенные ниже соединения получают аналогичным способом, за исключением того,что амины не осаждают в виде гидрохлоридов. 4,4-Ди-(2-толил)-1-бутиламин, 30b. Получают через 4,4-ди-(2-толил)-1-бутилиодид, 33 а и выделяют в виде масла. 1(R,S)-3 бензоилоксиметилокси-4-метиламино-4,5,6,7 тетрагидро-1,2-бензиоксазола, 31 а. Смесь бензоилхлорида (22 г), параформальдегида (6 г) и несколько кристаллов ZnCl2 нагревают при 100-105 С в течение 2,5 ч. Сырой бензоилоксиметилхлорид выделяют при элюировании реакционной смеси с силикагеля(элюирование смесью гептан/дихлорметан, 1:1). Выход составляет 12 г. Весь сырой хлорид растворяют в ацетоне (100 мл) и добавляют иодид натрия. После нагревания при температуре кипения с обратным холодильником в течение 7 ч ацетон выпаривают в вакууме и сырой бензоилоксиметилиодид выделяют по стандартной методике экстракцией диэтиловым эфиром из воды, содержащей тиосульфат натрия. Чистое йодистое производное выделяют хроматографией на колонке с силикагелем (элюирование смесью гептан/дихлорметан, 1:1). Выход составляет 5 г. К раствору (R,S)-4-(N-трет-бутилоксикарбонил-N-метиламино)-3-гидрокси-4,5,6,7-тетрагидро-1,2-бензизоксазола, 12 а (1,5 г) в ацетоне(30 мл) в инертной атмосфере азота добавляют трет-бутоксид калия (0,8 г). Смесь охлаждают до 10 С и добавляют раствор бензоилоксиметилиодида (2,5 г). Смесь перемешивают в течение ночи при комнатной температуре в темноте. Ацетон выпаривают в вакууме и оставшийся продукт очищают методом колоночной хроматографии на силикагеле (элюирование смесью гептан/этилацетат, 7:3). Выход составляет 1,3 г в виде масла. Трет-БОК-защищающую группу удаляют, как было описано выше, обработкой трифторуксусной кислотой в дихлорметане. После выпаривания растворителей сырой продукт растворяют в ледяной воде, значение рН доводят до 9-10 добавлением разбавленного водного карбоната калия. Экстракция диэтиловым эфиром и обработка органической фазы с использованием описанной выше стандартной процедуры дают 1 г сырого целевого продукта. Гемиоксалатную соль 31 а кристаллизуют из ацетона. Выход составляет 900 мг. Т.пл. 188189 С. 1(100%). Соответствующим способом получают следующие 3-замещенные производные. Гемиоксалат (R,S)-4-метиламино-3-(2,4,6 триметилбензоилоксиметилокси)-4,5,6,7-тетрагидро-1,2-бензизоксазола. 31b. Т.пл. 217 С (ацетон).(приготовленного по методу, описанному в ЕР-А-0-200450) (1,02 г) в толуоле (130 мл) кипятят с обратным холодильником (105 С) в течение 6 ч. К кипящему раствору добавляют п-толуолсульфоновую кислоту, моногидрат (10 мг) и кипятят еще 16 ч. Затем раствор охлаждают до 5 С и при 10 С добавляют его к раствору NaCNBH4 (635 мг) в метаноле (50 мл). Полученную реакционную смесь перемешивают в течение 20 мин перед добавлением дополнительного количестваNaCNBH4 (500 мг). Реакционную смесь перемешивают еще в течение 10 мин при 10 С. Затем реакционную смесь вливают в воду и разделяют фазы. Водную фазу экстрагируют этилацетатом (3 х 250 мл). Объединенные органические фазы промывают насыщенным водным раствором NaCl,высушивают (Na2SO4) и выпаривают в вакууме. Остаток хроматографируют на колонке (нгептан/этилацетат, 1:1) с получением целевого соединения в виде масла (640 мг). 1H ЯМР (CDCl3)1,33 (т, 3 Н), 1,50-2,00 (м,7 Н), 2,40-2,60 (м, 2 Н), 2,70-2,84 (м, 2 Н), 3,65 (т,1 Н), 3,97 (т, 2 Н), 4,26 (к, 2 Н), 6,85-6,95 (м, 4 Н),7,08-7,18 (м, 4 Н). Пример 33. 2,2-Ди-(2-толил)-тетрагидрофуран, 33 а. К суспензии магниевых turnings (33 г) в сухом ТГФ (150 мл) добавляют 2-бромтолуол (4 мл). Реакционную смесь нагревают при температуре кипения с обратным холодильником, при этом начинается экзотермическая реакция. Удаляют нагревательную сетку и добавляют по каплям в течение часа при температуре кипения с 36 обратным холодильником 2-бромтолуол (137 мл) в сухом ТГФ (500 мл) (происходит экзотермическая реакция). Полученную смесь кипятят с обратным холодильником еще в течение 1,5 ч. Смесь охлаждают до комнатной температуры и отфильтровывают в инертной атмосфере избыток Mg. Добавляют по каплям при температуре 20 С раствор метилового эфира 4-хлормасляной кислоты (56,4 г) в сухом ТГФ (200 мл). Реакционную смесь перемешивают при комнатной температуре еще в течение 1 ч и затем вливают водный раствор в NH4Cl и лед. Обрабатывают органическую фазу с помощью стандартных процедур. После выпаривания органического растворителя остаток суспендируют в смеси нгептан/этилацетат = 4/1.Фильтрование полученных кристаллов приводит к получению 2,2-ди(2-толил)тетрагидрофурана, 33 а (32,5 г). 1(м, 2 Н), 2,57 (т, 2 Н), 4,02 (т, 2 Н), 7,00-7,07 (м,2 Н), 7,07-7,23 (м, 4 Н) , 7,57-7,65 (м, 2 Н). Пример 34. 4,4-Ди-(2-толил)-бутилиодид,34 а. Сырой 2,2-ди-(2-толил)-тетрагидрофуран,33 а (28 г) растворяют в уксусной кислоте (250 мл). Добавляют 5% палладий на черном угле (3 г) и смесь гидрируют в устройстве Парра при 3 атм и при 55 С в течение 5 ч. Отфильтровывают катализатор и растворитель выпаривают в вакууме. Оставшееся масло хроматографируют на колонке (н-гептан/этилацетат,15:1) с получением 4,4-ди-(2-толил)-1-бутанола (17 г). Раствор 4,4-ди-(2-толил)-1-бутанола (19 г) в уксусной кислоте (400 мл) кипятят с обратным холодильником в течение 3 ч. Охлажденный раствор выпаривают в вакууме с получением ацетата 4,4 ди-(2-толил)-1-бутила (17 г) в виде масла. Раствор ацетата 4,4-ди-(2-толил)-1-бутила (9,2 г) в 57% водной йодноватой кислоте (150 мл) кипятят с обратным холодильником в течение 3 ч. Охлажденный раствор вливают в смесь льда и воды и экстрагируют водную фазу диэтиловым эфиром. Объединенные органические фазы промывают водой и насыщенным водным раствором NaCl, высушивают (Na2SO4 и выпаривают в вакууме с получением целевого соединения 34 а (11,7 г) в виде масла, которое используют без дальнейшей очистки. 1(с, 6 Н), 3,17 (т, 2 Н), 4,26 (т, 1 Н), 7,12 (с, 8 Н). Пример 35. (R,S)-[N-[4,4-Ди-(2-толил) бутан-1-ил]амино]-3-этокси-4,5,6,7-тетрагидро 1,2-бензизоксазол, 35 а. Целевое соединение получают с применением методики, описанной в литературе (Synlett(1,0 г), изопропилата титана (IУ) (4,3 мл),NaCNBH3 (0,6 г) и этанола (20 мл). Выход целе 37 вого соединения составляет 1,0 г, которое выделяют в виде масла. 1 Н ЯМР (CDCl3)1,32 (т, 3 Н), 1,40-1,85 (м,7 Н), 1,85-2,05 (м, 3 Н), 2,27 (с, 6 Н), 2,45-2,75 (м,4 Н), 3,68 (т, 1 Н), 4,27 (к, 2 Н), 7,05-7,15 (м, 8 Н).(R,S)-[N-[1,1-Ди-(2-толил)бут-ен-4-ил]амино]-3-этокси-4,5,6,7-тетрагидро-1,2-бензизоксазол, 35b. Целевое соединение получают с применением методики, описанной в литературе (Synlett(2,0 г), изопропилата титана (IУ) (8,2 мл),NaCNBH3 (1,4 г) и этанола (40 мл). Выход целевого соединения составляет 1,9 г, которое выделяют в виде масла. 1(250 мл) кипятят с обратным холодильником в течение 30 мин. Охлажденный раствор экстрагируют диэтиловым эфиром. Объединенные органические фазы промывают водой и насыщенным водным раствором NaCl, высушивают(Na2SO4) и выпаривают в вакууме. Остаток хроматографируют на колонке(нгептан/этилацетат, 15:1) с получением целевого соединения 36 а в виде масла (44 г). 1 Н ЯМР (CDCl3)2,10 (с, 3 Н), 2,30 (с, 3 Н),2,65 (к, 2 Н) , 3,19 (т, 2 Н), 5,73 (т, 1 Н), 7,05-7,22(м, 8 Н). Пример 37. (R,S)-3-Бензолсульфонилокси 4-(N-трет-бутилоксикарбонил-N-метиламино)4,5,6,7-тетрагидро-1,2-бензизоксазол, 37 а. Раствор (R,S)-4-(N-трет-бутилоксикарбонил-N-метиламино)-3-гидрокси-4,5,6,7-тетрагидро-1,2-бензизоксазола, 12 а (9 г), триэтиламина (7,5 мл) и сухого ТГФ (350 мл) охлаждают до 0 С. Добавляют по каплям при 0 С бензолсульфонилхлорид (5,2 мл) в сухом ТГФ (100 мл). Полученную реакционную смесь перемешивают в течение 3 ч при 0 С и в течение 60 ч при 22 С. Образовавшийся осадок удаляют фильтрованием и органический растворитель выпаривают в вакууме. Остаток подвергают колоночной хроматографии (г-гептан / этилацетат, 1:1) с получением целевого соединения 37 а 38 К раствору (R,S)-3-бензолсульфонилокси 4-(N-трет-бутилоксикарбонил-N-метиламино)4,5,6,7-тетрагидро-1,2-бензизоксазола, 37 а (5,4 г), в сухом диэтиловом эфире (100 мл) добавляют насыщенный раствор НСl (г) в сухом диэтиловом эфире (50 мл) и полученную смесь перемешивают в течение 48 ч при комнатной температуре. Реакционную смесь выпаривают в вакууме и остаток суспендируют в диэтиловом эфире (100 мл). Полученные кристаллы собирают фильтрованием и высушивают с получением целевого соединения 38 а (4,0 г). Т.пл. 162163 С (разлож.). 1(R,S)-3 бензолсульфонилокси-4-метиламино-4,5,6,7 тетрагидро-1,2-бензизоксазола, 38 а (3,5 г) и К 2 СО 3 (4,2 г) в метилизобутилкетоне (200 мл) нагревают при 50 С в течение 1 ч. Добавляют по каплям при 50 С 3-бром-1-пропин (1,8 мл) в метилизобутилкетоне (50 мл). Полученную реакционную смесь перемешивают еще в течение 2 ч при 50 С и затем в течение 72 ч при 117 С(температура кипения с обратным холодильником). Охлажденную смесь фильтруют и растворитель выпаривают в вакууме. Остаток подвергают колоночной хроматографии(2,2 г). Полученную суспензию нагревают до температуры кипения с обратным холодильником. Добавляют по каплям при 65 С этоксиметилхлорид (1,5 г) в ацетоне (100 мл) и полученную смесь кипятят с обратным холодильником в течение 2 ч. Охлажденную суспензию фильтруют и органический растворитель выпаривают в вакууме. Остаток хроматографируют на колонке (н-гептан / этилацетат / метанол, 10:10:1) с получением целевого соединения 40 а (0,5 г) в виде масла. 1(R,S)-3 гидрокси-4-бензиламино-4,5,6,7-тетрагидро-1,2 бензизоксазола, 41 а. К раствору (R,S)-4-амино-3-этокси-4,5,6,7 тетрагидро-1,2-бензизоксазола, 3 а (из 0,53 г и гидробромида) в этаноле (10 мл) добавляют бензальдегид (0,31 г). Смесь перемешивают при комнатной температуре в течение 20 мин и затем охлаждают на ледяной бане. Добавляют боргидрид натрия (0,15 г) и смесь перемешивают при 0 С в течение 30 мин и при комнатной температуре в течение 20 ч. После выпаривания добавляют воду (10 мл) и смесь подкисляют добавлением 4 М НСl. Водный раствор промывают диэтиловым эфиром (2 х 10 мл) и делают щелочным, добавляя 4 М NaOH. Экстракция метиленхлоридом (3 х 15 мл), высушивание и выпаривание дают (R,S)-3-этокси-бензиламино 4,5,6,7-тетрагидро-1,2-бензизоксазол (0,31 г). Гидрохлорид получают при добавлении раствора НСl в этилацетате и последующем осаждении гидрохлорида при добавлении диэтилового эфира. Т.пл. 192-194 С. Обработка указанного соединения с помощью НВr, как было описано в примере 8 а,дает 41 а. Т.пл. 202-205 С. 1(м, 2 Н), 4,45 (с, 2 Н), 4,35-4,60 (м, 1 Н), 7,55 (с,5 Н). Соответствующим образом синтезируют также приведенное ниже соединение. Гидробромид(м, 4 Н), 2,45-2,75 (м, 2 Н) , 3,70-4,00 (м, 2 Н),4,30-4,65 (м, 2 Н), 7,50 (с, 10 Н). Фармакология Соединения настоящего изобретения исследовали с использованием следующей хорошо известной экспериментальной модели. Поглощение ГАМК синаптосомами Исследование ингибирования поглощения ГАМК было проведено по методу Фалс с соавт.(Falch et al, Druq Dev. Res., 1990, 21, 169-188). Этот метод позволяет определить общее ингибирование, т.е. ингибирование поглощения ГАМК и нейронами, и глией. В таблице 1 представлены полученные результаты. Антагонизм с изониазидом Указанное исследование является тестом на антагонизм с изониазидом, индуцирующим судороги у мышей. Исследуемое вещество вводят подкожно мышам (самцам NMRI/BOM, весом от 20 до 25 г) и через 30 мин вводят подкожно 300 мг изониазида. На каждую исследуемую дозу используют 5 мышей и включают контрольную группу, которой вводят только изониазид. Указанная доза изониазида вызывает перемежающиеся тонические судороги. 40 Животных помещают по одному в клетки Макролон типа II и отмечают время появления первых судорог. Эксперимент заканчивают через 90 мин. Животных, у которых не наблюдалось судорог в течение 60 мин, обозначают как+ (защищенные). Результат, т.е. количество защищенных мышей относительно количества исследованных мышей, указывают через косую черту следующим образом: 0/5, 1/5, 5/5. Значения ED50, вычисленные методом loq пробитанализа, показаны в таблице 1. Таблица 1 Ингибирование поглощения ГАМК в синаптосомах и антагонизм с изониазидом Изониазид, ED50 СоединениеИнгибирование Кроме того, некоторые соединения настоящего изобретения были исследованы на эффект ингибирования соответственного нейронального и глиального поглощения по методу Фалс с соавт. (Falch et al, Druq Dev.Res.,1990, 41 21, 169-188). Эти исследования показали, что некоторые соединения преимущественно ингибируют поглощение глиальными клетками. Некоторые из соединений продемонстрировали эффект и на других экспериментальных моделях. Из вышеприведенной таблицы видно, что некоторые соединения изобретения, которые не ингибируют поглощение ГАМК in vitro демонстрируют активность в тесте на антагонизм с изониазидом in vivo , что указывает на то, что эти соединения являются пролекарствами. В соответствии с этим, соединения настоящего изобретения можно рассматривать как соединения, пригодные для использования при лечении заболеваний, связанных с нейротрансмиссией ГАМК, т.е. в качестве анальгетиков,нейролептиков, противосудорожных средств или в качестве лекарств, применимых при лечении мышечных и двигательных расстройств,например, в качестве противосудорожных или антисимптоматических препаратов при болезни Хантингтона или при Паркинсонизме. Примеры фармацевтических композиций Фармацевтические композиции настоящего изобретения могут быть приготовлены с использованием известных методов. Таблетки могут быть приготовлены при смешивании активного ингредиента с обычными адъювантами и/или разбавителями и последующем прессовании смеси с применением традиционной таблетирующей машины. Примеры адъювантов или разбавителей включают: кукурузный крахмал,картофельный крахмал, тальк, стеарат магния,желатин, лактозу, камеди и др. Любые другие адъюванты или добавки, обычно применяемые для таких целей, такие как красители, вкусовые вещества, консерванты и др., могут также использоваться при условии их совместимости с активными ингредиентами. Растворы для инъекции могут быть приготовлены при растворении активного ингредиента ж возможных добавок в части растворителя для инъекций, предпочтительно, в стерильной воде, доведении объема до нужного значения,стерилизации раствора и наполнения подходящих ампул или флаконов. Могут быть добавлены любые подходящие, традиционно применяемые добавки, такие как тонизирующие средства,консерванты, антиоксиданты и др. Типичные прописи для изготовления композиции настоящего соединения включают следующие ингредиенты: 1) Таблетки, содержащие 5,0 мг соединения 20 а, вычисленного в виде свободного основания: Соединение 20 а Лактоза Кукурузный крахмал Гидроксипропилцеллюлоза Микрокристаллическая целлюлоза Натрий-кроскармеллоза тип А 2) Таблетки, содержащие 50 мг соединения 8b, вычисленного в виде свободного основания: Соединение 8b Лактоза Кукурузный крахмал Провидон Микрокристаллическая целлюлоза Натрий-кроскармеллоза тип А Стеарат магния 3) Сироп, содержащий на мл: Соединение 11 а Сорбит Гидроксипропилцеллюлоза Глицерин Метил-парабен Пропил-парабен Этанол Вкусовое вещество Натрий-сахарин Вода 4) Раствор для инъекций, содержащий на мл: Соединение 14 а Сорбит Уксусная кислота Вода для инъекции ФОРМУЛА ИЗОБРЕТЕНИЯ 1. 4-Аминотетрагидробензизоксазоловые или -изотиазоловые соединения, имеющие общую формулу I: где R1 и R2, каждый, независимо выбран из группы, состоящей из А) водорода, С 3-7 циклоалкила, фенила или группы где R, R8 и R9, каждый, независимо выбран из группы, состоящей из водорода, C1-4 алкила, C2-4 алкенила, С 2-4 алкинила, С 1-4 алкокси- C1-4 алкила, С 3-7 циклоалкила, С 3-7 циклоалкил-С 1-4 алкила, фенила, фенил-C1-4 алкила, фенокси-C1-4 алкила и гетероарила, выбранных из 2-тиенила, 3 тиенила, 2-фурила, 3-фурила, имидазолила, оксазолила, пиразолила, пиримидинила, пирролила, тиазолила, 1,2,4-триазолила, 2-пиридила, 3 пиридила или 4-пиридила, причем любая фенильная или гетероарильная группа, не обязательно замещена одним или более заместителя 43 ми, выбранными из галогена, C1-4 алкила, C1-4 алкокси, гидрокси, нитро, C1-4 алкилтио, C1-4 алкилсульфонила, С 1-4 алкил- или ди (C1-4) алкиламино, циано, трифторметила, трифторметилтио, трифторметилсульфонилокси и фенила,которые также могут быть замещены галогеном,метилом, метокси или трифторметилом; причем любая присутствующая алкильная группа не обязательно замещена от одной до трех гидроксигруппами, которые, в свою очередь, не обязательно этерифицированы C2-C18 карбоновой кислотой; В) группы общей формулы: Y-(CH2)r(CHR11)s-(СН 2)t-, где Y выбирается из следующих групп (1) - (5): где U обозначает CHR10b, NR10b, О или S, U1 обозначает NR10b, О или S; р принимает значение 0 или 1; q принимает значения 0 или 1; V обозначает С или N, пунктирная линия обозначает связь, когда V обозначает С, и отсутствие такой связи, когда V обозначает N; А обозначает О, S, CH2, (CH2)2, СН=СНСН 2, (СН 2)3, СН=СН или O-СН 2;Ra и Rb, каждый независимо обозначает один или более заместителей, выбранных из галогена, C1-4 алкила, C1-4 алкокси, гидрокси,нитро, C1-4 алкилтио, C1-4 алкилсульфонила, C1-4 алкил- или ди(С 1-4 алкил)амино, циано, трифторметила,трифторметилсульфонилокси и трифторметилтио;r и t независимо друг от друга принимают значение 0, 1, 2 или 3, s принимает значение 0 или 1, при условии, что когда Y обозначает группу (1), где U обозначает NR10b, О или S, или группу (4), то r+s+t равно, по крайней мере, 2; а когда Y обозначает группу (3) или группу (5), где Y обозначает N, то r+s+t равно, по крайней мере, 1;R7b, R8b и R9b те же, что указаны для R7, R8 9 и R в А), при условии, что они не означают одновременно водород, C1-4 алкил, C2-4 алкенил и С 2-4 алкинил;R10b и R11 обозначают независимо друг от друга водород, C1-4 алкил, С 2-4 алкенил или C2-4 алкинил; иC) группы общей формулы: YC- (CH2)n-W(CH2)m-, где n принимает значение 1, 2 или 3, m принимает значение 2 или 3; W обозначает 0 или S; и YC обозначает группу (1)-(5), определенную в В), при условии, что n не может быть 1, когда Y обозначает группу (1) или (4), а UR11d тот же, что ранее указан для R11 в В); иY выбирают из групп (2) и (5), как определено ранее в В), и из приведенных ниже групп где р, q, Ra, Rb, А те же, что указаны в В) и R7dR11d соответственно те же, что указаны для R7bR10b и R11 в В), илиR1 и R2 вместе обозначают алкилен, образуя 4-8-членное азотсодержащее кольцо; или один из R1 и R2 представляет группы 2'R ОСО, где R2' обозначает фенил или гетероарил, как было указано ранее в А), или фенил или гетероарил, замещенный одним или более заместителями, выбранными из галогена, C1-4 алкила, C1-4 алкокси, гидрокси, нитро, C1-4 алкилтио, C1-4 алкилсульфонила, C1-4 алкил- или ди(C1-4) алкиламино, циано, трифторметила,трифторметилтио, трифторметилсульфонилокси, фенила и фенила, замещенного галогеном,метилом, метокси или трифторметилом;R3 - R6 выбирают, независимо друг от друга, из водорода, гидрокси и C1-4 алкила, причем любая алкильная группа не обязательно замещена одной или двумя гидроксильными группами; Х обозначает кислород или серу; Р обозначает водород или группу ZR, гдеR и Ru обозначают водород, гидрокси или C1-4 алкил, и, если Z является СО или CS, то R выбирают из группы, состоящей из:i) водорода, C1-C18 алкила, C2-C18 алкенила, С 3-С 8 циклоалкила, С 3-С 8 циклоалкенила или С 4-С 26 циклоалк(ен)ил-алк(ен)ила, необязательно замещенных одной или двумя гидроксильными группами, или фенила, необязательно замещенного одним или более заместителями,выбранными из группы, состоящей из галогена,трифторметила, C1-C4 алкила, C1-C4 алкокси, C1C4 алкилтио, C1-C5 ацилокси или циано; илиii) QRV, где Q обозначает О или S, RV выбирают из заместителей, указанных ранее для В в пункте i); иiii) NRXRY, где RX и RY выбирают, независимо друг от друга, из заместителей, указанных ранее для R в пункте i), или RX и RY объединяются с образованием 4-8-членного гетероциклического кольца, содержащего от одного до трех атомов азота и от нуля до трех атомов кислорода или серы; или если Z обозначает CRtRu, то R выбирают из групп, состоящих из:vi) группы OC(O)RZ, SC(O)RZ, OC(S)RZ или SC(S)PZ, где RZ выбирают из заместителей,указанных ранее для R в пункте i); если Z является SO2, то R выбирают из группы, определенной ранее в пункте i); при условии, что Р не может быть водородом, когда все R1-R6 являются водородами, Х является кислородом, а соединение представляет собой рацемическую смесь; или их фармацевтически приемлемые соли. 2. Соединение по п.1, где Х представляет кислород. 3. Соединение по п.2, где R1 представляетC1-4 алк(ен/ин)ил, не обязательно замещенный гидроксигруппой, которая может быть этерифицирована С 2-С 22 карбоновой кислотой, или фенил, или фенил-С 1-4 алкил, необязательно замещенный галогеном, С 1-4 алкилом, C1-4 алкокси или трифторметилом, при этом R1 предпочтительно является метилом, этилом или фенилбутилом. 4. Соединение по п.3, где Р не является водородом, а Р представляет собой предпочтительно ZR группу, определенную в п.1, где Z обозначает CH2 и R обозначает группу ОС(O)Rz,определенную в vi) п.1. 5. Соединение по п.4, представленное формулой 1 а. 6. Соединение по п.2, где R1 обозначает группу, определенную в В), С) или D). 46 7. Соединение по п.6, где R1 обозначает группу, определенную в В), где Y представляет собой группу формулы (1), (2) или (3), где R7b иR8b обозначают фенил, гетероарил или фенил или гетероарил, замещенные заместителями,определенными в п.1 для R7 и R8; предпочтительно группу формулы (1) и (2), где U обозначает СН 2 или О. 8. Соединение по п.6, где R1 обозначает группу, определенную в В), где Y обозначает группу формулы (4) или (5). 9. Соединение по п.6, где R1 обозначает группу, определенную в С), предпочтительно такую группу, где YC обозначает группу формулы (1), где U обозначает СН 2, или группу формулы (2), где R7b и R8b обозначают фенил, гетероарил или фенил или гетероарил, замещенные заместителями, как указано в п.1 для R7 и R8. 10. Соединение по п.6, где R1 обозначает группу, определенную в D), где Yd обозначает группу формулы (2), (5), (6), (7), (8), (9) или(10). 11. Соединение по любому п.2-10, где R2 обозначает водород, C1-4 алкил или группу R2'O-СО-, где R2' определен в п.1. 12. Соединение по любому п.6-11, где Р является водородом. 13. Фармацевтическая композиция, отличающаяся тем, что в качестве активного соединения включает, по меньшей мере, один новый 4-аминотетрагидробензизоксазол или -изотиазол по любому из пп.1-12 в терапевтически эффективном количестве с фармацевтически приемлемым носителем или разбавителем. 14. Применение 4-аминотетрагидробензизоксазола или изотиазола по любому из пп.1-12 для приготовления фармацевтической композиции для лечения анальгезии, психоза, судорог,эпилепсии, беспокойства, мышечных и двигательных нарушений, спастических состояний или симптомов при болезни Хантингтона или болезни Паркинсона, предпочтительно судорог.
МПК / Метки
МПК: C07D 261/20
Метки: 4-аминотетрагидробензизоксазоловые, композиция, изотиазоловые, фармацевтическая, основе, соединения, применение
Код ссылки
<a href="https://eas.patents.su/24-380-4-aminotetragidrobenzizoksazolovye-ili-izotiazolovye-soedineniya-ih-primenenie-i-farmacevticheskaya-kompoziciya-na-ih-osnove.html" rel="bookmark" title="База патентов Евразийского Союза">4-аминотетрагидробензизоксазоловые или -изотиазоловые соединения, их применение и фармацевтическая композиция на их основе</a>




























