Соединения 4-пиридинона и их применение для лечения рака
Формула / Реферат
1. Соединение, имеющее формулу (I)
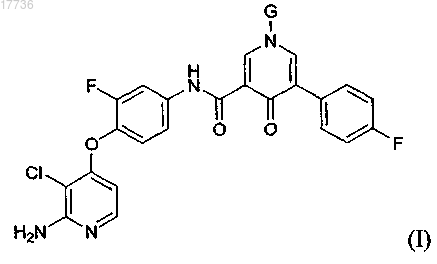
или его соль,
где G представляет собой Н, -СНХ-ОР(=О)(ОН)2 или -CHX-OC(=O)Z;
X представляет собой Н или C1-С2-алкил, возможно замещенный одним или более заместителем, выбранным из ОН, галогена, циано и/или -NR1R2;
Z представляет собой C1-С6-алкил или 5-6-членный гетероцикло, содержащий один атом азота в качестве гетероатома, возможно замещенный одним или более заместителем, выбранным из С1-С4-алкила, ОН, галогена, циано и/или -NR3R4;
R1, R2, R3 и R4 независимо являются Н и/или С1-С4-алкилом.
2. Соединение по п.1 или его соль, в котором G представляет собой Н.
3. Соединение по п.1 или его соль, в котором G представляет собой -СНХ-ОР(=О)(ОН)2.
4. Соединение по п.3 или его соль, в котором X представляет собой Н или метил.
5. Соединение по п.4 или его соль, в котором X представляет собой Н.
6. Соединение по п.1 или его соль, в котором G представляет собой -СНХ-OC(=O)Z.
7. Соединение по п.6 или его соль, в котором X представляет собой Н или метил.
8. Соединение по п.7 или его соль, в котором G представляет собой

9. Соединение по п.1 или его соль, представляющее собой
N-(4-(2-амино-3-хлорпиридин-4-илокси)-3-фторфенил)-5-(4-фторфенил)-4-оксо-1,4-дигидропиридин-3-карбоксамид;
(3-(4-(2-амино-3-хлорпиридин-4-илокси)-3-фторфенилкарбамоил)-5-(4-фторфенил)-4-оксопиридин-1-(4Н)-ил)метил дигидрофосфат;
(S)-(3-(4-(2-амино-3-хлорпиридин-4-илокси)-3-фторфенилкарбамоил)-5-(4-фторфенил)-4-оксопиридин-1-(4Н)-ил)метил 2-аминопропаноат;
(S)-(3-(4-(2-амино-3-хлорпиридин-4-илокси)-3-фторфенилкарбамоил)-5-(4-фторфенил)-4-оксопиридин-1-(4Н)-ил)метил 2-амино-3-метилбутаноат;
(S)-(3-(4-(2-амино-3-хлорпиридин-4-илокси)-3-фторфенилкарбамоил)-5-(4-фторфенил)-4-оксопиридин-1-(4Н)-ил)метил 2-амино-4-метилпентаноат;
(3-(4-(2-амино-3-хлорпиридин-4-илокси)-3-фторфенилкарбамоил)-5-(4-фторфенил)-4-оксопиридин-1-(4Н)-ил)метилпиперидин-3-карбоксилат;
(S)-(3-(4-(2-амино-3-хлорпиридин-4-илокси)-3-фторфенилкарбамоил)-5-(4-фторфенил)-4-оксопиридин-1-(4Н)-ил)метилпирролидин-2-карбоксилат;
(S)-(3-(4-(2-амино-3-хлорпиридин-4-илокси)-3-фторфенилкарбамоил)-5-(4-фторфенил)-4-оксопиридин-1-(4Н)-ил)метилпирролидин-3-карбоксилат;
(3-(4-(2-амино-3-хлорпиридин-4-илокси)-3-фторфенилкарбамоил)-5-(4-фторфенил)-4-оксопиридин-1-(4Н)-ил)метилпиперидин-4-карбоксилат;
1-(3-(4-(2-амино-3-хлорпиридин-4-илокси)-3-фторфенилкарбамоил)-5-(4-фторфенил)-4-оксопиридин-1-(4Н)-ил)этилпиперидин-4-карбоксилат;
(2S)-1-(3-(4-(2-амино-3-хлорпиридин-4-илокси)-3-фторфенилкарбамоил)-5-(4-фторфенил)-4-оксопиридин-1-(4Н)-ил)этил 2-амино-3-метилбутаноат или
(3-(4-(2-амино-3-хлорпиридин-4-илокси)-3-фторфенилкарбамоил)-5-(4-фторфенил)-4-оксопиридин-1-(4Н)-ил)метил 1-метилпиперидин-4-карбоксилат.
10. Фармацевтическая композиция, содержащая по меньшей мере одно соединение по п.1 или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель или разбавитель.
11. Фармацевтическая композиция по п.10, в которой указанным по меньшей мере одним соединением является
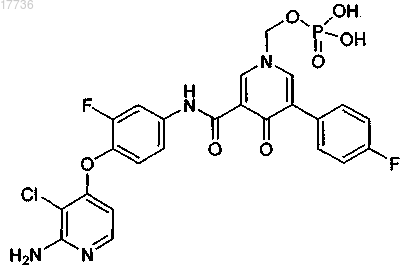
или его фармацевтически приемлемая соль.
12. Применение соединения по п.1 или его фармацевтически приемлемой соли для изготовления лекарственных препаратов для лечения рака, где указанное соединение или его фармацевтически приемлемая соль является выбранным из N-(4-(2-амино-3-хлорпиридин-4-илокси)-3-фторфенил)-5-(4-фторфенил)-4-оксо-1,4-дигидропиридин-3-карбоксамида и (3-(4-(2-амино-3-хлорпиридин-4-илокси)-3-фторфенилкарбамоил)-5-(4-фторфенил)-4-оксопиридин-1-(4Н)-ил)метил дигидрофосфата.
13. Применение по п.12, при котором раком является рак мочевого пузыря, рак молочной железы, рак ободочной и прямой кишки, рак желудка, рак органов головы и шеи, рак почки, рак печени, рак легких, рак яичников, рак поджелудочной железы/желчного пузыря, рак предстательной железы, рак щитовидной железы, остеогенная саркома, рабдомиосаркома, меланома, глиобластома/астроцитома, MFH/фибросаркома или мезотелиома.
Текст
СОЕДИНЕНИЯ 4-ПИРИДИНОНА И ИХ ПРИМЕНЕНИЕ ДЛЯ ЛЕЧЕНИЯ РАКА В изобретении раскрыты соединения формулы (I) и их соли. Также раскрыты способы применения соединений в лечении пролиферативных заболеваний, таких как рак, и фармацевтические композиции, содержащие по меньшей мере одно соединение формулы (I) или фармацевтически приемлемые соли. 017736 Область техники Настоящее изобретение в целом относится к соединениям 4-пиридинона и их солям, способам применения таких соединений в лечении заболеваний, включающих рак, и фармацевтическим композициям,содержащим по меньшей мере одно из указанных соединений или их фармацевтически приемлемые соли. Уровень техникиMet, также называемый рецептором фактора роста гепатоцитов (HGFR), экспрессируется преимущественно в эпителиальных клетках, но также был идентифицирован в эндотелиальных клетках, мышечных клетках, гемопоэтических клетках и мотонейронах. Сверхэкспрессия фактора роста гепатоцитов и активация Met связаны с возникновением и прогрессией целого ряда разных типов опухолей, а также активацией метастазирования. Американская заявка на патент 2005/0245530 А 1 раскрывает моноциклические гетероциклические соединения, которые ингибируют протеинтирозинкиназную активность рецепторов фактора роста, таких как Met, делая их эффективными в качестве противораковых агентов. Следует отметить, что все еще сохраняется потребность в противораковых соединениях, которые являются эффективными для лечения активированного Met рака и предпочтительно обладают активностью против других путей развития рака. Заявители обнаружили сильнодействующее соединение, которое обладает активностью против рака, зависимого от активации Met, и также обладает активностью против рака в качестве ингибитораVEGFR. Заявители также открыли пролекарства соединения, которые являются эффективными для введения соединения в более растворимой форме. В настоящее время стало возможным обеспечить соединения с различными фармакологическими профилями по сравнению с известными в настоящее время противораковыми соединениями для лечения активированного Met рака и такими значениями стабильности, биодоступности, растворимости, терапевтическим индексом и величиной токсичности, которые обеспечивают усвоение лекарственного препарата. Краткое описание чертежей Изобретение проиллюстрировано прилагающимися чертежами, описанными ниже. Фиг. 1 показывает противоопухолевые активности примеров 1 и 2 против GTL-16 ксенотрансплантатов карциномы желудка. Фиг. 2 показывает противоопухолевую активность примера 1, вводимого орально один раз в день в течение 14 дней (стрелки указывают дозирование) при МПК 6.25 (мг/кг), МПК 12.5 и МПК 25 против ксенотрансплантатов глиобластомы U87. Фиг. 3 показывает профили рН-растворимость примеров 1 и 2. Сущность изобретения Представлено описание соединений формулы (I)X представляет собой Н или алкил, факультативно замещенный одним или более из ОН, галогена,циано и/или -NR1R2;Z представляет собой алкил, циклоалкил, арил или гетероцикло, факультативно замещенный одним или более из алкила, ОН, галогена, циано и/или -NR3R4; иR1, R2, R3 и R4 независимо являются Н и/или алкилом. Также представлено описание фармацевтических композиций, содержащих по меньшей мере одно соединение формулы (I) или его фармацевтически премлемую соль и фармацевтически приемлемый носитель или разбавитель. Кроме того, представлено описание способов лечения рака, включающих введение млекопитающему, нуждающемуся в таком лечении по меньшей мере одного соединения формулы (I) или его фармацевтически приемлемой соли. Подробное описание изобретения Ниже приведены определения разных терминов, которые использовали для описания настоящего изобретения. Эти определения применяются к терминам в таком смысле, в котором они используются в заявке (за исключением их ограничения иным способом в определенных случаях) по отдельности или как часть большей группы. Термин "алкил" и "алк" относятся к алкановому (углеводородному) радикалу с прямой или разветв-1 017736 ленной цепью, содержащему от 1 до 12 атомов углерода, предпочтительно от 1 до 6 атомов углерода и более предпочтительно от 1 до 4 атомов углерода. Примеры "алкил" и/или "алк" групп включают, но не ограничиваются этим, метил, этил, пропил, изопропил, n-бутил, t-бутил, пентил, гексил, изогексил, гептил, октил, нонил, децил и додецил. Термин "низший алкил" относится к "алкил" и/или "алк" группе, содержащей от 1 до 4 атомов углерода и предпочтительно от 1 до 2 атомов углерода. Когда индексы используются со ссылкой на алкильную или другую группу, индексы относятся к числу атомов углерода, которое может содержать группа. Например, термин "С 0-С 4-алкил" включает связь и алкильную группу, содержащую от 1 до 4 атомов углерода, и термин "С 1-С 4-алкил" относится к алкильным группам, содержащим от 1 до 4 атомов углерода. Примеры низших алкильных групп включают, но не ограничиваются этим, метил, этил, пропил, изопропил, n-бутил, t-бутил и изобутил."Алкил" и/или "алк" группа может быть факультативно замещенной одним или более заместителями, предпочтительно от 1 до 4 заместителями, в любом доступном и замещаемом положении. Примеры заместителей включают галоген (например, единственный галогенозаместитель или множество галогенозаместителей, образующих во втором случае, группы, такие как перфторалкильная группа или алкильная группа, содержащие -CCl3 или -CF3), гидроксил, -NH2, -NH(алкил), -N(алкил)2 и циано. Термин "циклоалкил" относится к полностью насыщенной углеводородной группе, содержащей от 1 до 4 колец и от 3 до 8 атомов углерода в кольце. Примеры циклоалкильных групп включают, но не ограничиваются этим, циклопропил, циклобутил, циклопентил, циклогексил и циклогептил. Циклоалкильная группа может быть факультативно замещенной одним или более заместителями, предпочтительно от 1 до 4 заместителями в любой доступной и замещаемой точке присоединения. Примеры заместителей включают такие группы, которые перечислены для замещенного алкила. Термин "арил" относится к циклическим ароматическим углеводородным группам, которые содержат от 1 до 2 ароматических кольца, такие как, например, фенильное, бифенильное или нафтильное. В случае, когда арильная группа содержит два ароматических кольца (например, бициклические и т.п.),ароматические кольца могут быть соединенными в одной точке (например, бифенил) или конденсированными (например, нафтил и фенантренил). Арильная группа может быть факультативно замещенной одним или более заместителями, предпочтительно от 1 до 5 заместителями, в любом доступном и замещаемом положении кольца или на любых конденсированных или присоединенных к нему кольцах, где позволяет валентность. Примеры заместителей включают алкил и такие группы, которые перечислены для замещенного алкила. Термины "гетероцикл", "гетероциклик" и "гетероцикло" относятся к полностью насыщенным, частично насыщенным или полностью ненасыщенным ароматическим (например, "гетероарил") или неароматическим циклическим группам, которыми являются, например, 3-7-членные моноциклические или 711-членные бициклические кольцевые системы, содержащие по меньшей мере один гетероатом, по меньшей мере в одном углеродсодержащем кольце. Каждое кольцо гетероцикла, гетероциклика или гетероцикло, содержащее гетероатом, может содержать 1, 2, 3 или 4 гетероатомов, выбранных из атомов N,О и/или S, причем гетероатомы N и/или S факультативно могут быть окислены и гетероатомы N факультативно могут быть кватернизованы. Гетероцикл, гетероциклик или гетероцикло могут присоединяться к остатку молекулы через любой гетероатом и атом углерода кольца кольцевой системы. Гетероцикл-, гетероциклик- или гетероциклогруппа могут быть замещенной в любой доступной точке присоединения по меньшей мере одним заместителем, предпочтительно 1-4 заместителями, выбранными из алкила, и такими, которые перечислены для замещенного алкила. Примеры моноциклических гетероциклов, гетероцикликов или гетероцикло включают, но не ограничиваются этим, например, этиленоксид; азетидинил; пирролидинил; пирролил; пиразолил; оксетанил; пиразолинил; имидазолил; имидазолинил; имидазолидинил; оксазолил; оксазолидинил; изоксазолинил; изоксазолил; тиазолил; тиадиазолил; тиазолидинил; изотиазолил; изотиазолидинил; фурил; тетрагидрофурил; тиенил; оксадиазолил; пиперидинил; пиперазинил; 2-оксопиперазинил; 2-оксопиперидинил; 2 оксопирролодинил; 2-оксоазепинил; азепинил; гексагидродиазепинил; 4-пиперидонил; пиридил; пиразинил; пиримидинил; пиридазинил; триазинил; триазолил; тетразолил; тетрагидропиранил; морфолинил; тиаморфолинил; тиаморфолинилсульфоксид; тиаморфолинилсульфон; 1,3-диоксолан и тетрагидро-1,1 диоксотиенил. Примеры бициклических гетероциклов, гетероцикликов или гетероцикло включают, но не ограничиваются этим, например, индолил; изоиндолил; бензотиазолил; бензодиоксолил; бензоксазолил; бензоксадиазолил; бензотиенил; хинуклидинил; хинолинил; тетрагидроизохинолинил; изохинолинил; бензимидазолил; бензопиранил; индолизинил; бензофурил; бензофуразанил; хромонил; кумаринил; бензопиранил; циннолинил; хиноксалинил; индазолил; пирролопиридил; фуропиридинил; такие как, например, фуро[2,3-с]пиридинил, фуро[3,2-b]пиридинил и фуро[2,3-b]пиридинил; дигидробензодиоксинил; дигидродиоксидобензотиофенил; дигидроизоиндолил; дигидроиндолил; дигидрохинолинил; дигидрохиназолинил; такие как, например, 3,4-дигидро-4-оксохиназолинил; триазинилазепинил и тетрагидрохинолинил. Выражение "терапевтически эффективное" предполагает определение количества каждого агента,-2 017736 которое будет обеспечивать положительную динамику тяжести нарушения и частоты заболеваемости при воздействии каждого агента самого по себе, избегая при этом нежелательных побочных эффектов,которые обычно сопутствуют альтернативным методам лечения. Например, эффективные противораковые агенты пролонгируют выживаемость пациента, ингибируют быстрый рост пролиферирующих клеток, связанный с новообразованием или вызывают регрессию новообразования. Соединения формулы (I) образуют соли, которые также находятся в рамках данного изобретения. Использующийся здесь термин "соль(и)" означает кислые и/или основные соли, образованные с неорганическими и/или органическими кислотами и основаниями. Дополнительно, когда соединение формулы(I) содержит как основную составляющую, такую как, в качестве неограничивающего примера, пиридинильная группа, так и кислую составляющую, такую как, в качестве неограничивающего примера, дигидрофосфатная группа, могут быть образованы цвиттерионы ("внутренние соли") и включены в использующийся здесь термин "соль(и)". Фармацевтически приемлемые соли (т.е. нетоксичные, физиологически приемлемые) являются предпочтительными, хотя другие соли также являются полезными, например,на стадиях выделения или очистки, которые могут использоваться во время приготовлений. Соли соединений формулы (I) могут быть образованы, например, взаимодействием соединения формулы (I) с некоторым количеством кислоты или основания, например эквивалентным количеством, в среде, в которой соль осаждается или в водной среде с последующей лиофилизацией. Использующееся здесь выражение "фармацевтически приемлемая(ые) соль(и)", если не указано иное, означает соли, содержащие фармацевтически приемлемые анионы или катионы, такие как гидрохлорид, гидробромид, гидроиодид, нитрат, сульфат, бисульфат, фосфат, кислый фосфат, изоникотинат,ацетат, лактат, салицилат, цитрат, кислый цитрат, тартрат, пантотенат, битартрат, аскорбат, сукцинат,малеат, гентизинат, фумарат, глюконат, глюкаронат, мезилат, сахарат, формат, бензоат, глютамат, метансульфонат, этансульфонат, сульфат, бензолсульфонат, р-толуолсульфонат и памоат [т.е. 1,1'-метиленбис-(2-гидрокси-3-нафтоат)]-ные соли. Соединения формулы (I) образуют соли, которые могут, например, использоваться для выделения и/или очистки соединений формулы (I). Соль(и) соединений формулы (I) может быть образована, например, взаимодействием соединения формулы (I), например, с эквивалентным количеством кислоты или основания в среде, которая позволяет таким образом образованной соли осаждаться или выделяться с помощью лиофилизации. Примеры кислой(ых) соли(ей), которую могут образовывать соединения формулы (I) с неорганическими и/или органическими кислотами, включают, но не ограничиваются этим, например, ацетат, аскорбат, бензоат, бензолсульфонат, бисульфат, битартрат, кислый цитрат, цитрат, этансульфонат, формат,фумарат, гентизинат, глюконат, глюкаронат, глютамат, гидрохлорид, гидробромид, гидроиодид, изоникотинат, малеат, мезилат, метансульфонат, нитрат, пантотенат, фосфат, кислый фосфат, сахарат, салицилат, сукцинат, сульфат, тартрат, р-толуолсульфонат, лактат и памоат [т.е. 1,1'-метилен-бис-(2-гидрокси-3 нафтоат)]-ные соли. Такие соли могут быть образованы согласно способам, известным среднему специалисту в данной области. Примеры основной(ых) соли(ей), которые соединения формулы (I) могут образовывать с неорганическими и/или органическими основаниями, включают, но не ограничиваются этим, например, соли аммония; соли щелочных металлов, такие как, например, соли натрия, лития и калия; соли щелочноземельных металлов, такие как, например, соли кальция и магния; соли, образованные с органическими основаниями, такие как, например, бензатины, дициклогексиламины, 2-амино-2-(гидроксиметил)пропан 1,3-диол(такие как,например,N,N-бис(дегидроабиетил)этилендиамин), N-метил-D-глюкамины, N-метил-D-глюкамиды и t-бутиламины; соли,образованные с аминокислотами, такие как, например, аргинин и лизин; и соли, образованные с помощью агентов, такие как, например, низшие галоидные алкилы (например, метил, этил, пропил и бутилхлориды, бромиды и иодиды), диалкилсульфаты (например, диметил, диэтил, дибутил и диамилсульфаты), галиды с длинной цепью (например, децил, лаурил, миристил и стеарилхлориды, бромиды и иодиды) и аралкилгалогениды (например, бензил и фенетилбромиды) для кватернизированных основных азотсодержащих групп. Такие соли могут быть образованы согласно способам, известным среднему специалисту в данной области. Использующийся здесь термин "пролекарство" означает соединение, которое после введения пациенту подвергается химическому превращению с помощью метаболических или химических процессов для получения соединения формулы (I) или его соли. Разные формы пролекарств(а) хорошо известны в данной области. Примеры таких производных пролекарств можно увидеть в:c) Н. Bundgaard, Advanced Drug Delivery Reviews, 8:1-38 (1992). Использующееся здесь выражение "амплификация гена" означает селективное образование фрагмента ДНК, что приводит к множественным копиям гена Met или фрагменту хромосомы, в которой Met-3 017736 является кодированным. Использующееся здесь выражение "активированная Met мутация" означает селективное изменение в ДНК последовательности Met, что приводит к конститутивному (т.е. непрерывному) фосфорилированию Met белка. Использующееся здесь выражение "HGF стимуляция" означает способность HGF связывать его когнатный рецептор (Met) таким образом, чтобы активировать рецептор, что приводит к фенотипическому отклику. В случае Met, это может быть клеточной пролиферацией, подвижностью, дифференциацией и/или выживаемостью. Использующийся здесь термин "пациент" охватывает все разновидности млекопитающих, включая человека, коров, лошадей, собак и кошек; и предпочтительно человека. В одном варианте представлены соединения формулы (I)X представляет собой Н или алкил, факультативно замещенный одним или более из ОН, галогена,циано и/или -NR1R2;Z представляет собой алкил, циклоалкил, арил или гетероцикло, факультативно замещенный одним или более из алкила, ОН, галогена, циано и/или -NR3R4; иR1, R2, R3 и R4 независимо являются Н и/или алкилом. В одном варианте обеспечено соединение формулы (I) или его соль, где G представляет собой Н. Соединение этого варианта имеет структуру, представленную формулой (II) Использующиеся здесь термины "соединение формулы (II)" и "соединение формулы (I), где G представляет собой Н" относятся к соединению формулы (II) в кето форме, енольной форме или любой смеси, содержащей кето и енольную формы. В другом варианте соединение формулы (II) представлено в виде соли. Примеры солей соединения формулы (II) включают, но не ограничиваются этим, трифторуксусную кислоту и соли соляной кислоты. В одном варианте представлены соединения формулы (II) или их соли, в которыхX представляет собой Н или алкил, факультативно замещенный одним или более из ОН, галогена,циано и/или -NR1R2;Z представляет собой алкил, циклоалкил, арил или гетероцикло, факультативно замещенный одним или более из алкила, ОН, галогена, циано и/или -NR3R4;R1, R2, R3 и R4 независимо являются Н и/или алкилом. Предпочтительно, чтобы X являлся Н или метилом. Соединения или их соли этого варианта являются эффективными в качестве пролекарств соединения формулы (II). После введения млекопитающему соединения этого варианта или их фармацевтически приемлемые соли подвергаются химическому пре-4 017736 вращению in vivo путем метаболических или химических процессов для получения соединения формулы(II). В одном варианте представлены соединения формулы (I) или их соли, в которых G представляет собой -СНХ-ОР(=О)(ОН)2; X представляет собой Н или С 1-4 алкил, факультативно замещенный одним или более из ОН, галогена, циано и/или -NR1R2; и R1 и R2 независимо являются Н и/или алкилом. Соединения этого варианта имеют структуру формулы (III) Предпочтительно, чтобы X представлял собой Н, метил, замещенный метил, этил или замещенный этил; более предпочтительно, чтобы X представлял собой Н или метил, и более предпочтительно, чтобыX представлял собой Н. Соединения формулы (III) могут быть обеспечены в виде фармацевтически приемлемых солей, например солей этаноламина, бис-этаноламина, тризамина, бис-тризамина или N-метилD-глюкамина. Примером соединения формулы (III) является соединение формулы (IIIa) которое может быть обеспечено в виде соли. Пригодные соли соединения формулы (IIIa) включают,но не ограничиваются этим, соли этаноламина, бис-этаноламина, трисамина и бис-трисамина. Соединения формулы (III) или их соли этого варианта являются эффективными в качестве пролекарств соединения формулы (II). В одном варианте представлены соединения формулы (I) или их соли, в которых G представляет собой -CHX-OC(=O)Z; X представляет собой Н или алкил, факультативно замещенный одним или более из ОН, галогена, циано и/или -NR1R2; Z представляет собой алкил, циклоалкил, арил или гетероцикло,факультативно замещенные одним или более из алкила, ОН, галогена, циано и/или -NR3R4; и R1, R2, R3 иR4 независимо являются Н и/или алкилом. Предпочтительно, чтобы X представлял собой Н, C1-4 алкил или замещенный C1-4 алкил; более предпочтительно Н, метил, этил, замещенный метил или замещенный этил и еще более предпочтительно Н или метил. Предпочтительно, чтобы Z представлял собой C1-6 алкил,замещенный C1-6 алкил, C3-6 циклоалкил, замещенный С 3-6 циклоалкил, замещенный фенил, факультативно замещенный моноциклический или бициклический гетероцикло. Более предпочтительно, чтобы Z представлял собой C1-6 алкил, замещенный -NH2 или 5-6-членным гетероцикло, содержащим один гетероатом азота, например, пирролидинильные и пиперидинильные группы. Соединения формулы (II) или их соли этого варианта являются эффективными в качестве пролекарств соединения формулы (II). В другом варианте представлены соединения формулы (I) или их соли, в которых G представляет собой Соединения этого варианта могут быть обеспечены в виде солей. Соединения или их соли этого варианта являются эффективными в качестве пролекарств соединения формулы (II). В одном варианте соединение формулы (I) или его соль представлено следующими соединениями:(3-(4-(2-амино-3-хлорпиридин-4-илокси)-3-фторфенилкарбамоил)-5-(4-фторфенил)-4-оксопиридин 1-(4H)-ил)метил 1-метилпиперидин-4-карбоксилат (12). Фактор роста гепатоцитов (HGF), также известный как рассеивающий фактор (SF), из-за его способности разрушать колониеобразование in vitro, является мезенхинально извлеченным цитокином, который вызывает множественные плейотропные эффекты в нормальных и неопластических клетках (Sonnenberg et al., J. Cell Biol., 123:223-235 (1993); Matsumato et al., Crit. Rev. Oncog., 3:27-54 (1992) и Stoker etal., Nature, 327:239-242 (1987. Известно, что эти эффекты включают пролиферацию как в эпителиальных, так и в эндотелиальных клетках, распад эпителиальных колоний на отдельные клетки, стимуляцию подвижности (мотогенезис) эпителиальных клеток, выживаемость клеток, стимулирование морфогенеза клеток (Montesano et al., Cell, 67:901-908 (1991 и развитие инвазии (Stella et al., Int. J. Biochem. CellBiol., 12:1357-1362 (1999) и Stuart et al., Int. J. Exp. Path., 81:17-30 (2000, все критические процессы,предрасполагающие к метастазированию. Сообщалось, что HGF также стимулирует ангиогенез (Bussolino et al., J. Cell Biol., 119:629-641 (1992. Дополнительно, HGF играет критическую роль в регенерации тканей, заживлении ран и нормальных эмбриональных процессах, все из которых зависят как от клеточной подвижности, так и от пролиферации.HGF инициирует эти физиологические процессы посредством высокоаффинного связывания с его родственным рецептором, Met протеинтирозинкиназным рецептором, идентифицированным протоонкогеном (Park et al, Proc. Natl. Acad. Sci. USA, 84:6379-6383 (1987) и Bottaro et al., Science, 251:802-804(1991. Зрелая форма Met состоит из высокогликозилированной внеклеточной -субъединицы, а также-субъединицы с большим внутриклеточным доменом, трансмембранного сегмента и цитоплазматического тирозинкиназного домена. Связывание лиганда индуцирует димеризацию Met, что ведет к аутофосфорилированию и активации рецептора. Активация Met инициирует каскады сигнальной трансдукции, что определяется трансфосфорилированием ключевых цитоплазматических тирозиновых остатков,ответственных за обновление множественных эффекторных белков (Furge et al., Oncogene, 19:5582-5589(2000. Они включают р 85-субъединицу киназы PI-3, фосфолипазу С (Gaul et al., Oncogene, 19:15091518 (2000, адаптерные белки Grb2 и She, белок фосфотазу SHP2 и адаптерный белок Gab1. Последний представляет собой важную заякоривающую молекулу, которая становится фосфорилированной по тирозину в ответ на удерживание лиганда (Schaeper et al., J. Cell Biol., 149:1419-1432 (2000); Bardelli et al.,Oncogene, 18:1139-1146 (1999) и Sachs et al, J. Cell Biol., 150:1375-1384 (2000. Сообщалось об активации других сигнальных молекул в клетках, стимулированных HGF, особенно Ras, МАР-киназ, STATs, ERK1, -2 и FAK (Tanimura et al., Oncogene 17:57-65 (1998): Lai et al., J. Biol. Chem., 275:7474-7480 (2000) иFurge et al., Oncogene, 19:5582-5589 (2000. Роль многих из этих сигнальных молекул была точно установлена в клеточной пролиферации.Met, также называемый рецептором фактора роста гепатоцитов (HGFR), преимущественно экспрессируется в эпителиальных клетках, но также был идентифицирован в эндотелиальных клетках, моиобластах, гематопоэтических клетках и мотонейронах. Сверхэкспрессия фактора роста гепатоцитов и активация Met связаны с возникновением и прогрессией целого ряда разных типов опухолей, а также активацией метастазирования. Начальное доказательство связи Met с раком было подтверждено идентификацией миссенс-мутаций в киназном домене, которые предрасполагают к развитию у человека папиллярной почечноклеточной карциномы (ППК) и гепатоцеллюлярной карциномы (ГЦК) (Lubensky et al., Amer. J. Pathology, 155:517-526 (1999. Мутированные формы Met также были идентифицированы в раке яичников,-6 017736 детской ГЦК, карциноме желудка, плоскоклеточной карциноме головы и шеи, немелкоклеточной карциноме легких, метастазах колоректального рака (Christensen et al., Cancer Res., 63:7345-7355 (2003); Lee etal., Oncogene, 19:4947-4953 (2000) и Direnzo et al., Clin. Cancer Res., 1:147-154 (1995. Дополнительно,еще один признак, подтверждающий роль Met в раке, основан на сверхэкспрессии HGF и Met рецептора в разных опухолях, включающих рак щитовидной железы, карциному яичников и карциному поджелудочной железы. Также был показан его рост в метастазах колоректальных карцином в печень (Rong et al.,Cancer Res., 55:1963-1970 (1995); Rong et al., Cancer Res., 53:5355-5360 (1993); Kenworthy et al., Br. J. Cancer, 66:243-247 (1992) и Scarpino et al., J. Pathology, 189:570-575 (1999. TPR-Met (активированная форма,аналогичная BCR/Ab1 в CML) была описана и идентифицирована в карциноме желудка человека (Proc.Natl. Acad. Sci USA, 88:4892-4896 (1991. У пациентов с инвазивной карциномой молочной железы, а также у пациентов с немелкоклеточным раком легких в последнем исследовании экспрессия рецептора или лиганда является прогностическим фактором уменьшения выживаемости, и более того связи Met с прогрессированием опухоли (Camp et al., Cancer, 86:2259-2265 (1999) и Masuya et al., Br. J. Cancer,90:1555-1562 (2004. В целом, большинство человеческих опухолей и клеточных линий опухолей мезенхимального происхождения несоответственно экспрессируют HGFR и/или HGF. Многочисленные экспериментальные данные подтверждают роль HGF и Met в инвазии, росте, выживании и прогрессировании опухоли, что в конечном итоге приводит к метастазам. До появления клинических признаков трансгенная экспрессия HGF приводит к возникновению метастатического фенотипа (Takayama et al., Proc. Natl. Acad. Sci. USA, 94:701-706 (1997 и увеличенный/сверхэкспрессированный Met спонтанно трансформирует NIH-3 Т 3 клетки (Cooper et al., EMBO J.,5:2623-2628 (1986. Было показано, что биологические агенты, такие как рибозимы, антитела и направленное воздействие на антисмысловую РНК или Met ингибируют образование опухолей (Stabile et al., Gene Therapy,11:325-335 (2004); Jiang et al., Clin. Cancer Res, 9:4274-4281 (2003) и Genentech US 6214344 (2001. Таким образом, предполагается, что селективные модуляторы маленьких молекул киназ, оказывающие направленное воздействие на Met, обладают терапевтическим потенциалом для лечения рака, при этом активация Met рецептора играет критическую роль в развитии и прогрессировании первичных опухолей и вторичных метастаз. Также известно, что HGF регулирует антиогенез, процесс, который является критическим в росте опухоли и ее распространении. Следовательно, для этого класса модуляторов существует потенциал для воздействия на антиогенез-зависимые заболевания, а также такие, которые помимо прочих, включают диабетическую ретинопатию, макулярную дегенерацию, ожирение и воспалительные заболевания, таких как ревматоидный артрит. Соединение формулы (II) является эффективным для лечения рака, например рака, зависимого от активации Met. Активация Met регулируется амплификацией гена, активированной Met мутацией и/илиHGF стимуляцией. Таким образом, лечение включает введение пациенту соединения формулы (II) или его фармацевтически приемлемой соли или пролекарства. Было обнаружено, что соединение формулы(II) является особенно эффективным при лечении рака из-за более сильного действия по сравнению с известными киназными ингибиторами Met. Кроме того, соединение формулы (II) является особенно эффективными при лечении рака, поскольку также обладает активностью в качестве ингибитора VEGFR(рецептор фактора роста эндотелия сосудов), такого как ингибитор VEGFR-2. В одном варианте представлен способ лечения рака, включающий введение млекопитающему, нуждающемуся в таком лечении, соединения формулы (I) или его фармацевтически приемлемой соли. Способ этого варианта можно использовать для лечения разных видов рака, включая, но не ограничиваясь этим, рак мочевого пузыря, рак молочной железы, колоректальный рак, рак желудка, рак органов головы и шеи, рак почки, рак печени, рак легкого, рак яичников, рак поджелудочной железы/желчного пузыря,рак предстательной железы, рак щитовидной железы, остеогенную саркому, рабдомиосаркому, злокачественную фиброзную гистиоцитому (MFH), фибросаркому, глиобластому/астроцитому, меланому и мезотелиому. Предпочтительно, чтобы способ этого варианта применялся для лечения рака легкого, рака органов головы и шеи, рака желудка или рака мочевого пузыря. Соединения, пригодные для введения в способе лечения этого варианта, включают пролекарства соединения формулы (II), например соединения формулы (I), в которой G является -СНХ-ОР(=О)(ОН)2 или -СНХ-OC(=O)Z; X представляет собой Н или алкил, факультативно замещенный одним или более из ОН, галогена, циано и/или -NR1R2; Z представляет собой алкил, циклоалкил, арил или гетероцикло, факультативно замещенные одним или более из алкила, ОН, галогена, циано и/или -NR3R4, и R1, R2, R3 и R4 независимо являются Н и/или алкилом. Предпочтительно, чтобы X представлял собой Н или C1-4-алкил или замещенный C1-4-алкил; более предпочтительно Н, метил, этил, замещенный метил или замещенный этил и еще более предпочтительно Н или метил. Предпочтительно, чтобы млекопитающим являлся человек. В одном варианте обеспечен способ лечения рака, включающий введение млекопитающему, нуждающемуся в таком лечении, соединения формулы (II) или его фармацевтически приемлемой соли или пролекарства. Например, в этом способе может вводиться терапевтически эффективное количество соединения формулы (II) или его фармацевтически приемлемая соль либо пролекарство. Способ этого варианта может применяться для лечения разных видов рака, включая, но не ограничиваясь этим, рак мо-7 017736 чевого пузыря, рак молочной железы, колоректальный рак, рак желудка, рак органов головы и шеи, рак почки, рак печени, рак легкого, рак яичников, рак поджелудочной железы/желчного пузыря, рак предстательной железы, рак щитовидной железы, остеогенную саркому, рабдомиосаркому, MFH/фибросаркому,меланому, мезотелиому и глиобластому/астроцитому. Предпочтительно, чтобы способ этого варианта применялся для лечения рака легкого, рака органов головы и шеи, рака желудка или рака мочевого пузыря. Предпочтительно, чтобы млекопитающим являлся человек. В одном варианте обеспечен способ лечения рака, включающий введение млекопитающему, нуждающемуся в таком лечении, одного или более пролекарств соединения формулы (II) или фармацевтически приемлемые соли указанных пролекарств. Например, способ может применяться для введения терапевтически эффективного количества одного или более пролекарств соединения формулы (II) или фармацевтически приемлемых солей указанных пролекарств. После введения млекопитающему одно или более пролекарств соединения формулы (II) подвергается химическому превращению in vivo с помощью метаболических или химических процессов для получения соединения формулы (II). Терапевтически эффективное количество одного или более пролекарств относится к количеству(ам) введенного пролекарства(в), которое необходимо для обеспечения терапевтически эффективного количества соединения формулы (II) in vivo. Предпочтительно, чтобы в способе этого изобретения вводилось одно пролекарство. Более предпочтительно, чтобы в способе этого изобретения вводилось терапевтически эффективное количество одного пролекарства. Пригодные пролекарства включают соединения формулы (I), в которыхG является -СНХ-ОР(=О)(ОН)2 или -CHX-OC(=O)Z; X представляет собой Н или алкил, факультативно замещенный одним или более из ОН, галогена, циано и/или -NR1R2; Z представляет собой алкил, циклоалкил, арил или гетероцикло, факультативно замещенный одним или более из алкила, ОН, галогена, циано и/или -NR3R4; и R1, R2, R3 и R4 независимо являются Н и/или алкилом. Предпочтительно, чтобы X представлял собой Н или C1-4 алкил или замещенный C1-4 алкил; более предпочтительно Н, метил, этил,замещенный метил или замещенный этил и еще более предпочтительно Н или метил. Способ этого варианта может применяться для лечения разных видов рака, включая, но не ограничиваясь этим, рак мочевого пузыря, рак молочной железы, колоректальный рак, рак желудка, рак органов головы и шеи, рак почки, рак печени, рак легкого, рак яичников, рак поджелудочной железы/желчного пузыря, рак предстательной железы, рак щитовидной железы, остеогенную саркому, рабдомиосаркому, MFH/фибросаркому,меланому, мезотелиому и глиобластому/астроцитому. Предпочтительно, чтобы способ этого варианта применялся для лечения рака легкого, рака органов головы и шеи, рака желудка или рака мочевого пузыря. Предпочтительно, чтобы млекопитающим являлся человек. В одном варианте обеспечен способ лечения рака, включающий введение млекопитающему, нуждающемуся в таком лечении, соединения формулы (IIIa) или его фармацевтически приемлемой соли. Соединение формулы (IIIa) является пролекарством соединения формулы (II). В настоящем способе может вводиться терапевтически эффективное количество соединения формулы (IIIa) или его фармацевтически приемлемая соль. Терапевтически эффективное количество соединения формулы (IIIa) относится к количеству введенного пролекарства, необходимого для обеспечения терапевтически эффективного количества соединения формулы (II) in vivo. Способ этого варианта может применяться для лечения разных видов рака, включая, но не ограничиваясь этим, рак мочевого пузыря, рак молочной железы, колоректальный рак, рак желудка, рак органов головы и шеи, рак почки, рак печени, рак легкого, рак яичников, рак поджелудочной железы/желчного пузыря, рак предстательной железы, рак щитовидной железы,остеогенную саркому, рабдомиосаркому, MFH/фибросаркому, меланому, мезотелиому и глиобластому/астроцитому. Предпочтительно, чтобы способ этого варианта применялся для лечения рака легкого,рака органов головы и шеи, рака желудка или рака мочевого пузыря. Предпочтительно, чтобы млекопитающим являлся человек. Фармацевтически приемлемые соли соединения формулы (IIIa), эффективные в способе этого варианта, включают соль бис-этаноламина и соль бис-трисамина. В одном варианте обеспечено применение соединения формулы (I) или его фармацевтически приемлемой соли в производстве медицинских препаратов для лечения рака. Предпочтительно, чтобы в настоящем изобретении подлежащим лечению раком являлся рак мочевого пузыря, рак молочной железы,колоректальный рак, рак желудка, рак органов головы и шеи, рак почки, рак печени, рак легкого, рак яичников, рак поджелудочной железы/желчного пузыря, рак предстательной железы, рак щитовидной железы,остеогенная саркома,рабдомиосаркома,меланома,глиобластома/астроцитома,MFH/фибросаркома или мезотелиома. В одном варианте обеспечен способ лечения рака у млекопитающего, в котором рак зависит от Met активации, при этом Met активация регулируется амплификацией гена, активированной Met мутацией и/или HGF стимуляцией, включающий введение пациенту соединения формулы (I) или его фармацевтически приемлемой соли. Способ этого варианта можно использовать для лечения разных видов рака,включая, но не ограничиваясь этим, рак мочевого пузыря, рак молочной железы, колоректальный рак,рак желудка, рак органов головы и шеи, рак почки, рак печени, рак легкого, рак яичников, рак поджелудочной железы/желчного пузыря, рак предстательной железы, рак щитовидной железы, остеогенную саркому, рабдомиосаркому, MFH/фибросаркому, меланому, мезотелиому и глиобластому/астроцитому. Предпочтительно, чтобы способ этого варианта применялся для лечения рака легкого, рака органов го-8 017736 ловы и шеи, рака желудка или рака мочевого пузыря. Соединения, пригодные для введения в способе лечения в этом варианте, включают пролекарства соединения формулы (II), например соединения формулы (I), в которых G является -СНХ-ОР(=О)(ОН)2 или -СНХ-OC(=O)Z; X представляет собой Н или алкил, факультативно замещенный одним или более из ОН, галогена, циано и/или -NR1R2; Z представляет собой алкил, циклоалкил, арил или гетероцикло, факультативно замещенный одним или более из алкила, ОН, галогена, циано и/или -NR3R4; и R1, R2, R3 и R4 независимо являются Н и/или алкилом. Предпочтительно, чтобы X представлял собой Н или С 1-4-алкил или замещенный C1-4-алкил; более предпочтительно Н, метил, этил, замещенный метил или замещенный этил и еще более предпочтительно Н или метил. Предпочтительно, чтобы млекопитающим являлся человек. Предпочтительно, чтобы в способе этого варианта вводилось терапевтически эффективное количество соединения формулы (I) или его фармацевтически приемлемой соли. В одном варианте обеспечен способ лечения рака у млекопитающего, в котором рак зависит от Met активации, при этом Met активация регулируется амплификацией гена, активированной Met мутацией и/или HGF стимуляцией, включающий введение пациенту соединения формулы (II) или его фармацевтически приемлемой соли или пролекарств. Способ этого варианта можно использовать для лечения разных видов рака, включая, но не ограничиваясь этим, рак мочевого пузыря, рак молочной железы, колоректальный рак, рак желудка, рак органов головы и шеи, рак почки, рак печени, рак легкого, рак яичников, рак поджелудочной железы/желчного пузыря, рак предстательной железы, рак щитовидной железы,остеогенную саркому, рабдомиосаркому, MFH/фибросаркому, глиобластому/астроцитому, меланому и мезотелиому. Предпочтительно, чтобы способ этого варианта применялся для лечения рака легкого, рака органов головы и шеи, рака желудка или рака мочевого пузыря. Предпочтительно, чтобы млекопитающим являлся человек. Предпочтительно, чтобы в способе этого варианта вводилось терапевтически эффективное количество соединения формулы (II) или его фармацевтически приемлемой соли. В одном варианте обеспечен способ лечения рака у млекопитающего, в котором рак зависит от Met активации, при этом Met активация регулируется амплификацией гена, активированной Met мутацией и/или HGF стимуляцией, включающий введение пациенту одного или более пролекарств соединения формулы (II) или солей указанных пролекарств. После введения млекопитающему одно или более пролекарств соединения формулы (II) подвергается химическому превращению in vivo с помощью метаболического или химического процесса для получения соединения формулы (II). Терапевтически эффективное количество одного или более пролекарств относится к количеству(ам) введенного пролекарства(в), необходимого для обеспечения терапевтически эффективного количества соединения формулы (II)in vivo. Предпочтительно, чтобы в способе этого варианта вводилось одно пролекарство в терапевтически эффективном количестве. Пригодные пролекарства включают соединения формулы (I), в которой G является -СНХ-ОР(=О)(ОН)2 или -СНХ-OC(=O)Z; X представляет собой Н или алкил, факультативно замещенный одним или более из ОН, галогена, циано и/или -NR1R2; Z представляет собой алкил, циклоалкил, арил или гетероцикло, факультативно замещенный одним или более из алкила, ОН, галогена, циано и/или -NR3R4; и R1, R2, R3 и R4 независимо являются Н и/или алкилом. Предпочтительно, чтобы X представлял собой Н или C1-4-алкил или замещенный C1-4-алкил; более предпочтительно Н, метил, этил,замещенный метил или замещенный этил и еще более предпочтительно Н или метил. Способ этого варианта может использоваться для лечения разных видов рака, включая, но не ограничиваясь этим, рак мочевого пузыря, рак молочной железы, колоректальный рак, рак желудка, рак органов головы и шеи, рак почки, рак печени, рак легкого, рак яичников, рак поджелудочной железы/желчного пузыря, рак предстательной железы, рак щитовидной железы, остеогенную саркому, рабдомиосаркому, MFH/фибросаркому,глиобластому/астроцитому, меланому и мезотелиому. Предпочтительно, чтобы способ этого варианта применялся для лечения рака легкого, рака органов головы и шеи, рака желудка или рака мочевого пузыря. Предпочтительно, чтобы млекопитающим являлся человек. В одном варианте обеспечен способ лечения рака у млекопитающего, в котором рак зависит от Met активации, при этом Met активация регулируется амплификацией гена, активированной Met мутацией и/или HGF стимуляцией, включающий введение пациенту соединения формулы (IIIa) или его фармацевтически приемлемой соли. Соединение формулы (IIIa) представляет собой пролекарство соединения формулы (II). Терапевтически эффективное количество соединения формулы (IIIa) относится к количеству введенного пролекарства, необходимого для обеспечения терапевтически эффективного количества соединения формулы (II) in vivo. Предпочтительно, чтобы вводилось терапевтически эффективное количество соединения формулы (IIIa) или его фармацевтически приемлемой соли. Способ этого варианта может применяться для лечения разных видов рака, включая, но не ограничиваясь этим, рак мочевого пузыря, рак молочной железы, колоректальный рак, рак желудка, рак органов головы и шеи, рак почки,рак печени, рак легкого, рак яичников, рак поджелудочной железы/желчного пузыря, рак предстательной железы, рак щитовидной железы, остеогенную саркому, рабдомиосаркому, MFH/фибросаркому, глиобластому/астроцитому, меланому и мезотелиому. Предпочтительно, чтобы способ этого варианта применялся для лечения рака легкого, рака органов головы и шеи, рака желудка или рака мочевого пузыря. Предпочтительно, чтобы млекопитающим являлся человек. При лечении рака часто успешной является комбинация химиотерапевтических агентов и/или дру-9 017736 гих терапий (например, лучевая терапия). Второй (или третий) агент может иметь такой же или отличный механизм действия, чем первичный терапевтический агент. Особо полезным может быть использование цитотоксических лекарственных комбинаций, когда два или более введенных лекарственных препарата действуют по-разному, или на разных фазах клеточного цикла, и/или когда два или более препаратов имеют непересекающиеся токсичности или побочные эффекты, и/или когда каждый из комбинированных препаратов обладает подтвержденной эффективностью в лечении конкретной стадии заболевания, обнаруженной у пациента. В одном варианте обеспечен способ лечения рака, включающий введение млекопитающему, нуждающемуся в таком лечении, соединения формулы (I) или его фармацевтически приемлемой соли или пролекарства; и введение одного или более дополнительных противораковых агентов. Выражение "дополнительный противораковый агент" относится к лекарственному препарату, выбранному из одного или более следующих препаратов: алкилирующие агенты (включающие азотистый иприт, алкилсульфонаты, нитрозомочевину, этилениминовые производные и триазены); антиангиогенные препараты (включающие матричные металлопротеиназные ингибиторы); антиметаболиты (включающие ингибиторы аденозиндеаминазы, антагонисты фолиевой кислоты, пуриновые аналоги и пиримидиновые аналоги); антибиотики или антитела (включающие моноклональные антитела, CTLA-4 антитела, антрациклины); ингибиторы ароматазы; модификаторы отклика клеточного цикла; энзимы; ингибиторы фарнесилтрансферазы; гормональные и антигормональные агенты и стероиды (включающие синтетические аналоги, глюкокортикоиды, эстрогены/антиэстрогены [например, SERMs], андрогены/антиандрогены, прогестины, агонисты прогестероновых рецепторов и агонисты и антагонисты рилизинг-гормона лютеинизирующего гормона [LHRH]); инсулиноподобный фактор роста (IGF)/ рецептор инсулиноподобного фактора роста (IGFR) модуляторов системы (включающий ингибиторы IGFR1); интегрин-сигнальные ингибиторы; ингибиторы киназы (включающие мультикиназные ингибиторы и/или ингибиторы Src киназы или Src/abl, циклин-зависимые киназные ингибиторы [CDK], panHer, Her-1 иHer-2 антитела, ингибиторы VEGF, включая анти-VEGF антитела; ингибиторы EGFR, ингибиторы митоген-активированных протеиновых киназ [MAP], ингибиторы MEK, ингибиторы Aurora-киназы, ингибиторы PDGF и другие ингибиторы тирозинкиназы или серин/треонинкиназы; агенты, разрывающие микротрубочки, такие как эктеинасцидины или их аналоги и производные; агенты, стабилизирующие микротрубочки, такие как таксаны, и природные ингибиторы эпотилоны и их синтетические и полусинтетические аналоги; связывающие микротрубочки дестабилизирующие агенты (включающие винка алкалоиды); топоизомеразные ингибиторы; пренил-протеин трансферазные ингибиторы; платиновые координационные комплексы; ингибиторы сигнальной трансдукции и другие агенты, применяющиеся в качестве противораковых и цитотоксических агентов, такие как модификаторы биологического отклика, факторы роста и иммунные модуляторы. Соответственно соединения настоящего изобретения могут вводиться в комбинации с другими противораковыми терапиями, эффективными в лечении рака или других пролиферативных заболеваний. Изобретение, кроме того, включает использование соединения формулы (I) или его фармацевтически приемлемых солей и пролекарств в приготовлении лекарственных препаратов для лечения рака, и/или включает упаковку соединения формулы (I) вместе с инструкциями по применению соединения в комбинации с другими противораковыми или цитотоксичными агентами и терапиями для лечения рака. Настоящее изобретение, кроме того, включает комбинации соединения формулы (I) и один или более дополнительных агентов в виде комплекта, например, когда они упакованы вместе или помещены в отдельных упаковках для продажи в виде комплекта или когда они упакованы для составления рецептуры. Соединения настоящего изобретения можно составлять или вводить совместно с другими терапевтическими агентами, которые выбираются по их конкретной эффективности в отношении побочных эффектов, связанных с вышеупомянутыми условиями. Например, соединения изобретения могут быть составлены с агентами для предотвращения тошноты, гиперчувствительности и расстройства желудка, такими как противорвотные средства, и H1 и H2 антигистамины. Соединения настоящего изобретения могут содержать один или более дополнительных асимметричных атомов углерода и таким образом существуют в двух или более стереоизомерических формах. Настоящее изобретение включает все возможные индивидуальные стереоизомеры, их индивидуальные таутомерные формы вместе с их смесями. Разделение диастереоизомеров можно осуществить обычными методами, например фракционной кристаллизацией, хроматографией или ВЭЖХ стереоизомерной смеси соединения настоящего изобретения, или его пригодной соли или производного. Индивидуальный энантиомер соединения может быть также приготовлен из соответствующего оптически чистого промежуточного соединения или путем разделения, например, с помощью ВЭЖХ соответствующего рацемата с использованием хирального носителя или с помощью фракционной кристаллизации диастереоизомерных солей, образованных взаимодействием соответствующего рацемата с пригодной оптически активной кислотой или основанием, при необходимости. Также, это изобретение включает класс фармацевтических композиций, которые содержат соединение формулы (I) или его фармацевтически приемлемую соль и пролекарство совместно с одним или бо- 10017736 лее нетоксичными, фармацевтически приемлемыми носителями и/или разбавителями, и/или адъювантами (вместе именуемые здесь как "носитель") и, при желании, с другими активными компонентами. Соединение формулы (I) может вводиться любым пригодным способом, предпочтительно в форме фармацевтической композиции, адаптированной к такому способу введения, и в дозе, эффективной для планируемого лечения. Соединения и композиции настоящего изобретения могут вводиться, например, орально, мышечно или парентерально, включая интраваскулярный, внутривенный, интраперитонеальный,подкожный, внутримышечный, подложечный способ введения и вливание дозированной лекарственной формы, содержащей обычно используемые фармацевтически приемлемые носители, адъюванты и растворители. Например, фармацевтический носитель может содержать смесь маннитола или лактозы и микрокристаллической целлюлозы. Смесь может содержать дополнительные компоненты, такие как лубриканты, например стеарат магния и распадающееся вещество, такое как кросповидон. Смесь носителя может быть заключена в желатиновую капсулу или прессована в виде таблетки. Фармацевтически активные соединения этого изобретения можно обрабатывать в соответствии с обычными способами фармакологии для получения медицинских препаратов для введения пациентам,включая человека и других млекопитающих. Для орального введения фармацевтическая композиция может быть в форме, например, таблетки,капсулы, суспензии или жидкости. Предпочтительно, чтобы фармацевтическая композиция была приготовлена в виде стандартной лекарственной формы, содержащей определенное количество активного компонента. Примерами таких стандартных лекарственных форм являются таблетки или капсулы. Например, они могут содержать активный компонент в количестве примерно от 1 до 2000 мг, предпочтительно от 1 до 500 мг, более предпочтительно от 5 до 150 мг. Пригодная ежедневная доза для человека или другого млекопитающего может различаться в зависимости от состояния пациента и других факторов, но может определяться простыми способами. Количества вводимых соединений и режим дозирования для лечения стадии заболевания соединениями и/или композициями данного изобретения зависят от множества факторов, включающих возраст,вес, пол и медицинские показания пациента, тип заболевания, тяжесть заболевания, режим и частоту введения, а также конкретное используемое соединение. Таким образом, режим дозирования может значительно различаться, но легко определяется стандартными способами. Ежедневная доза, которая может быть назначена, составляет примерно от 0.01 до 1500 мг/кг веса тела человека, предпочтительно примерно между 0.5 и 50 мг/кг веса тела и еще более предпочтительно примерно между 0.1 и 20 мг/кг веса тела. Ежедневная доза может вводиться от одной до четырех доз в день. В терапевтических целях активные соединения данного изобретения, как правило, комбинируются с одним или более адъювантами, соответствующими назначенному курсу введения. Для орального введения соединения могут быть смешаны с лактозой, сукрозой, порошком крахмала, эфирами целлюлозы алкановых кислот, алкильными эфирами целлюлозы, тальком, стеариновой кислотой, стеаратом магния,оксидом магния, солями натрия и кальция, фосфорной и серной кислотой, желатином, аравийской камедью, альгинатом натрия, поливинилпирролидоном и/или поливиниловым спиртом, после чего таблетированы или капсулированы для удобного введения. Такие капсулы или таблетки могут содержать составы с контролируемым высвобождением, которые могут быть обеспечены в виде дисперсии активного соединения в гидроксипропилметилцеллюлозе. Масляная фаза эмульсий, содержащих соединения формулы (I), может быть составлена из известных компонентов известным способом. Несмотря на то что фаза может включать только эмульгатор, она может содержать смесь по меньшей мере одного эмульгатора с жиром или маслом, или как с жиром, так и с маслом. Предпочтительно, чтобы гидрофильный эмульгатор был включен вместе с липофильным эмульгатором, который действует как стабилизатор. Также предпочтительно, чтобы масло и жир были включены. Эмульгатор(ы), вместе со стабилизатором(ами) или без него, образует так называемый эмульгирующий воск, и воск вместе с маслом и жиром образует так называемую эмульгирующую мазевую основу, которая образует масляную дисперсную фазу в рецептурах крема. Эмульгаторы и стабилизаторы эмульсии, пригодные для использования в составах настоящего изобретения, включают Твин 60, Span 80,цетостеариловый спирт, миристиловый спирт, глицерилмоностеарат, лаурилсульфат натрия, глицерилдистеарат отдельно или с воском, или другими материалами, хорошо известными в данной области. Выбор пригодных масел или жиров для составов основан на достижении желаемых косметических свойств, так как растворимость активного соединения в большинстве масел, подобных тем, которые используются в фармацевтических эмульсионных составах, очень низкая. Таким образом, предпочтительно, чтобы крем был нежирным, не оставляющим пятен и смываемым продуктом, имеющим соответствующую консистенцию, которая позволяла бы избежать вытекания из тюбиков или других контейнеров. Можно использовать одно- или двухосновные алкиловые сложные эфиры с линейной или разветвленной цепью, такие как ди-изоадипат, изоцетил стеарат, сложный пропиленгликолевый эфир жирных кислот кокосового масла, изопропилмиристат, децилолеат, изопропилпальмитат, бутилстеарат, 2 этилгексилпалмитат или смесь сложных эфиров с разветвленной цепью. Они могут использоваться отдельно или в комбинации в зависимости от требуемых свойств. В качестве альтернативы можно использовать липиды с высокой точкой плавления, такие как белый мягкий парафин и/или жидкий парафин,- 11017736 или другие минеральные масла. Составы для парентерального введения могут быть в форме водных или неводных изотонических стерильных растворов для вливаний или суспензий. Эти растворы и суспензии могут быть приготовлены из стерильных порошков или гранул с использованием одного или более носителей или разбавителей,упомянутых для использования в составах для орального введения, или с использованием пригодных диспергирующих или смачивающих и суспендирующих агентов. Соединения могут быть растворимыми в воде, полиэтиленгликоле, пропиленгликоле, этаноле, кукурузном масле, хлопковом масле, арахисовом масле, кунжутном масле, бензиловом спирте, хлориде натрия, аравийской камеди и/или разных буферах. Другие вспомогательные вещества и режимы введения хорошо известны в фармацевтической отрасли. Также, активный компонент может вводиться вливанием в виде композиции с пригодными носителями,включающими солевой раствор, декстрозу или воду, или циклодекстрин (т.е. CAPTISOL), сорастворитель для повышения растворимости (т.е. пропиленгликоль) или мицеллярный солюбилизатор (т.е. Твин 80). Стерильный состав для вливания может также представлять собой стерильный раствор или суспензию для вливания в нетоксичном разбавителе или растворителе, пригодном для парентерального введения, например раствор в 1,3-бутандиоле. Приемлемыми носителями и растворителями, которые могут использоваться, являются вода, раствор Рингера и изотонический раствор хлорида натрия. Дополнительно в качестве растворителя или питательной взвеси обычно используются стерильные, нелетучие масла. Для этой цели может применяться любое очищенное нелетучее масло, включая синтетические моно- или диглицериды. Дополнительно в приготовлении составов для вливаний находят применение жирные кислоты, такие как олеиновая кислота. Фармацевтические композиции могут быть подвергнуты обычным фармацевтическим операциям,таким как стерилизация, и/или могут содержать обычные вспомогательные вещества, такие как консерванты, стабилизаторы, смачивающие агенты, эмульгаторы, буферы и т.п. Дополнительно таблетки и пилюли могут быть приготовлены с энтеросолюбильными покрытиями. Такие композиции могут также включать адъюванты, такие как смачивающие реагенты, подсластители, вкусовые добавки и ароматизаторы. Фармацевтические композиции данного изобретения содержат соединение формулы (I) или его фармацевтически приемлемую соль либо пролекарство и факультативно дополнительный агент, выбранный из ингибирующего киназу агента (маленькая молекула, полипептид, антитело и т.п.), иммуносупрессанта, противоракового агента, противовирусного агента, противовоспалительного агента, противогрибкового средства, антибиотика или соединения против васкулярных гиперпролиферативных заболеваний; и любой фармацевтически приемлемый носитель, адъювант или разбавитель. Альтернативные композиции данного изобретения включают описанное здесь соединение формулы (I) или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель, адъювант или разбавитель. Такие композиции могут факультативно содержать один или более дополнительных терапевтических агентов, например ингибирующие киназу агенты (маленькая молекула, полипептид, антитело и т.п.), иммуносупрессанты, противораковые агенты, противовирусные агенты, противовоспалительные агенты, противогрибковые средства, антибиотики или соединения против васкулярного гиперпролиферативного нарушения. Фармацевтически приемлемые носители, адъюванты и разбавители, которые могут применяться в фармацевтических композициях данного изобретения, включают, но не ограничиваются этим, ионообменники, оксид алюминия, стеарат алюминия, лецитин, самоэмульгирующуюся систему доставки лекарств (SEDDS), такую как D-альфа-токоферола полиэтиленгликоля 1000 сукцинат, поверхностноактивные вещества, которые применяются в фармацевтических лекарственных формах, такие как твины или другие аналогичные полимерные матрицы для доставки лекарств, сывороточные белки, такие как сывороточный альбумин человека, буферные вещества, такие как фосфаты, глицин, сорбиновую кислоту,сорбат калия, неполные глицеридные смеси насыщенных растительных жирных кислот, воду, соли или электролиты, такие как протамина сульфат, динатрийгидрофосфат, калийгидрофосфат, хлорид натрия,соли цинка, коллоидный диоксид кремния, трисиликат магния, поливинилпирролидон, соединения на основе целлюлозы, полиэтиленгликоль, натриевую соль карбоксиметилцеллюлозы, полиакрилаты, воски,блок-сополимеры полиэтилен-полиоксипропилен, полиэтиленгликоль и шерстяной жир. Для улучшения доставки соединений описанной здесь формулы могут также эффективно применяться циклодекстрины,такие как альфа-, бета- и гамма-циклодекстрин, или химически модифицированные производные, такие как гидроксиалкилциклодекстрины, включая 2- и 3-гидроксипропилциклодекстрины, или другие растворимые производные. Соединения формулы (I) могут быть приготовлены согласно следующим схемам 1-4. Соединения можно легко синтезировать синтетическими способами, известными опытным специалистам в данной области. Сольваты (например, гидраты и соли) описанных соединений также включены в настоящее изобретение. Способы образования сольватов и солей в целом известны в данной области. Соответственно соединения и примеры настоящего изобретения могут быть в свободной или гидрированной форме, и могут быть получены способами, приведенными в качестве примера на схемах ниже. Соединение формулы (II) может быть легко приготовлено с помощью синтетической последова- 12017736 тельности, показанной на схеме 1. Реакция 2,3-дихлорпиридина (2) с дифенилметанимином (3) в присутствии каталитического количества ацетата палладия(II), BINAP-рацемического (2,2'-бис(дифенилфосфино)-1,1'-бинафтилена) и карбоната цезия в THF может дать бензофенонимин 4. Металлирование-борилирование-окисление промежуточного соединения 4, как отмечено на схеме 1, может обеспечить 3-хлор-2-(дифенилметиленамино)пиридин-4(1H)-она (5), который можно немедленно обработать 1,2-дифтор-4-нитробензолом и основанием, например карбонатом цезия, для получения промежуточного соединения 6. Хемоселективное восстановление нитрозаместителя промежуточного соединения 6, например, сульфидом аммония в изопропаноле может обеспечить амин 7. Промежуточное соединение 7 может затем связываться с 5-(4-фторфенил)-4-оксо-1,4-дигидропиридин-3-карбоновой кислотой (8) с помощью стандартных связывающих пептид реагентов, таких как O-(7-азабензотриазол-1-ил)-N,N,N',N'тетраметилуроний гексафторфосфат (HATU), для получения промежуточного соединения 9. Кислотнокаталитический гидролиз имина 9 затем обеспечивает требуемое соединение (II). Схема 1(8), может быть получено с помощью реакции, описанной на схеме 2. Таким образом, 2-(4 фторфенил)ацетилхлорид (10) может быть обработан 2,2-диметил-1,3-диоксан-4,6-дионом (кислота Мелдрума) в присутствии пиридина и полученный продукт присоединения можно нагревать с обратным холодильником в этаноле для получения этил 4-(4-фторфенил)-3-оксобутаноата (12). Обработка промежуточного соединения 12 триазином и этоксидом натрия в этаноле может дать нужное промежуточное соединение эфира, которое легко гидролизуется в присутствии гидроксида натрия при повышенной температуре для получения промежуточного соединения 8. Схема 2 Фосфатное пролекарство, соединение (IIIa), которое включает присоединение фосфатной группы к азоту пиридинона соединения (II) через саморасщепляющийся гидроксиметильный линкер, может быть приготовлено с помощью синтетического режима, описанного на схеме 3. Обработка промежуточного соединения 9 ди-трет-бутилхлорметилфосфатом (13, см. РСТ WO 2005/090367) в присутствии основания,такого как карбонат калия в DMF, может обеспечить защищенное промежуточное соединение 14. Полная защита 14 в кислых условиях в этаноле может дать требуемое фосфатное пролекарство, соединение Аминокислоты также можно связать с соединением (II) посредством гидроксиметильного линкера,аналогично описанному выше с помощью синтетической последовательности, показанной на схеме 4. Хлорметиловые эфиры 16, полученные из соответствующих N-защищенных аминокислот (с помощью процессов, описанных в Synth. Commun., 14:857-864 (1984) и Synth. Commun., 24:767-772 (1994, могут вступать в реакцию с соединением (II) в присутствии основания, такого как карбонат калия, для получения промежуточного соединения 17. Удаление азотной защитной группы, в данном случае Boc (tбутилкарбамат)группы, в кислых условиях может дать требуемое пролекарство аминокислотного эфира 18. Схема 4 Примеры Изобретение также проиллюстрировано следующими примерами. Следует понимать, что примеры представлены только для иллюстрации. На основании вышеприведенных обсуждений и примеров опытный специалист может установить важные характеристики изобретения и без отступления от духа и масштаба изобретения сможет произвести различные изменения и модификации для того, чтобы адаптировать изобретение к разному применению и условиям. Таким образом, изобретение не ограничивается иллюстративными примерами, представленными здесь ниже, но скорее определяется прилагаемой к нему формулой. Все реакции проводили при непрерывном перемешивании на магнитной мешалке в атмосфере сухого азота или аргона. Все выпаривания и концентрирования проводили на роторном испарителе при пониженном давлении. Реагенты, приобретенные коммерческим путем, использовали без дополнительной очистки. Растворители являлись коммерческими, безводных марок и применялись без дополнительной сушки или очистки. Флэш-хроматографию проводили с помощью силикагеля (EMerck Kieselgel 60,0.040-0.060 мм). Аналитическую обращенно-фазовую (ОФ) ВЭЖХ выполняли с помощью колонки Phenomenex Luna С 18 S5 4.650 мм или YMC S5 ODS 4.650 мм. В каждом случае линейный градиент (4 мин) (от 100% А: от 0% В до 0% А: 100% В) использовали со следующей системой подвижной фазы: А = 90% Н 2 О/МеОН+ 0.2% Н 3 РО 4; В = 90% МеОН/Н 3 О + 0.2% Н 3 РО 4 при скорости 4 мл/мин и детектировании при 220 нм. Препаративную обращено-фазовую (ОФ) ВЭЖХ выполняли с помощью линейного градиентного элюирования с использованием 10% метанола, 90% воды, 0.1% TFA (растворитель А) и 90% метанола,10% воды, 0.1 TFA (растворитель В) и детектировании при 220 нм на одной из следующих колонок: А колонка Shimadzu S5 ODS-VP 20100 мм со скоростью потока 20 мл/мин; В - колонка YMC S5 ODS 30100 мм со скоростью потока 20 мл/мин; С - колонка Phenomonex 30250 мм со скоростью потока 10 мл/мин; D - колонка YMC S5 ODS 20250 мм со скоростью потока 10 мл/мин; Е - колонка YMC S10 ODS 50500 мм со скоростью потока 50 мл/мин или F - колонка YMC S10 ODS 30500 мм со скоростью потока 20 мл/мин.- 14017736 Конечный продукт характеризовали масс-спектрометрией в режиме 1 Н ЯМР, ОФ ВЭЖХ, ионизации электрораспылением (ESI MS) или ионизацией при атмосферном давлении (API MS). Спектры 1 Н ЯМР получали на оборудовании 400 МГц Bruker или 500 МГц JEOL. Напряженности полей выражены в 5 единицах (части на миллион, ppm) относительно пиков растворителя и мультиплетность пиков обозначена следующим образом: s, синглет; d - дуплет; dd - дуплет дуплетов; dm - дуплет мультиплетов; t - триплет; q - квартет; br s - широкий дуплет; m - мультиплет. Следующая аббревиатура применяется для широко используемых реагентов: Boc или ВОС: tбутилкарбамат; Fmoc: 9H-фторенилметилкарбамат; TEA: триэтиламин; NMM: N-метилморфолин; Ms: метансульфонил; DIEA или DIPEA: диизопропилэтиламин или основание Хунига; NMP: Nметилпирролидинон; реагент ВОР: гексафторофосфат бензотриазол-1-илокси-трис(триметиламино)фосфония; 2,3-Дихлорпиридин (105.00 г, 710 ммоль), Pd(OAc)2 (3.98 г, 17.74 ммоль), рац-BINAP (16.57 г, 26.61 ммоль), карбонат цезия (346.76 г, 1065 ммоль), THF (1.05 л) и бензофенонимин (124.67 мл, 745 ммоль) добавляли в реактор CHEMGLASS емкостью 2 л, оснащенный механической мешалкой и обратным холодильником. Смесь нагревали с обратным холодильником при перемешивании в течение 18 ч. Продукт фильтровали, промывали THF (100 мл). Полученный фильтрат концентрировали в вакууме до 1/3 об. и использовали без дальнейшей очистки. 1H ЯМР (CDCl3)6.79 (dd, 1 Н, J=4.6, 7.6 Гц), 7.19-7.60 (m, 9 Н), 7.79-7.95 (m, 2 Н), 8.16 (dd, 1 Н, J=1.5, 5.1 Гц); MS (ESI+) m/z 293.1 (М+Н)+. Приготовление 1 В. 3-Хлор-2-(дифенилметиленамино)пиридин-4(1H)-она В реактор емкостью 4 л CHEMGLASS (оснащенный капельной воронкой, в атмосфере азота) добавляли сырой 3-хлор-N-(дифенилметилен)пиридин-2-амин и триизопропилборат (196.38 мл, 852 ммоль). Полученный раствор охлаждали до 0 С. В отдельный реактор добавляли диизопропиламин(169.78 мл, 1207 ммоль) и THF (1.05 л). Этот раствор охлаждали до 0 С и медленно добавляли nбутиллития (683.22 мл, 923 ммоль). После перемешивания при 0 С этот раствор медленно добавляли в первый раствор. Реакционную смесь перемешивали в течение 30 мин без охлаждающей ванны (ВЭЖХ показала расход исходного материала). В смесь добавляли воду (1.05 л) с последующим добавлением перкарбоната натрия (336.34 г, 1065 ммоль) одной порцией. Эту смесь оставляли перемешиваться при 20 С в течение 1 ч. Медленно добавляли насыщенный раствор NaHSO3 (1 л). Водный слой удаляли и в органический слой добавляли DMF (840.00 мл) и THF отгоняли (растворитель THF заменяли на DMF).DMF использовали без дальнейшей очистки. 1H ЯМР (CDCl3)6.02 (d, 1 Н, J=7.1 Гц), 7.10 (d, 1 Н, J=7.1 Гц), 7.20-7.80 (m, 10 Н); MS (ESI+) m/z 309.07 (М+Н)+. Приготовление 1C. 3-Хлор-N-(дифенилметилен)-4-(2-фтор-4-нитрофенокси)пиридин-2-амин В реактор емкостью 2 л CHEMGLASS добавляли сырой 3-хлор-2-(дифенилметиленамино)пиридин-4(1H)-она (см. выше, здесь в DMF) и карбонат цезия (300.52 г, 923 ммоль) с последующим добавлением 3,4-дифторнитробензола (118.15 мл, 1065 ммоль). Смесь нагревали приблизительно до 90 С при перемешивании в течение 2 ч. Смесь охлаждали до 25 С при перемешивании в течение 10 мин. В этот раствор добавляли воду (1 л). Смесь экстрагировали EtOAc (1 л) и водную фазу выгружали. Органические вещества концентрировали для получения масла. Масло растворяли в EtOH (200 мл) (иногда требуется нагревание). После выдерживания раствора при 25 С в течение 4 ч твердую фазу собирали фильтрацией для получения 3-Хлор-N-(дифенилметилен)-4-(2-фтор-4-нитрофенокси)пиридин-2-амина(104.00 г, выход 32.73%) в виде желтого твердого вещества. 1 Н ЯМР (CDCl3)6.52 (d, 1H, J=5.6 Гц), 6.80 Следующие материалы добавляли в реактор емкостью 2 л CHEMGLASS: 3-хлор-N(дифенилметилен)-4-(2-фтор-4-нитрофенокси)пиридин-2-амин (110.00 г, 221 ммоль), изопропиловый спирт (990.00 мл), сульфид аммония (40% в воде, 297.00 мл, 2324 ммоль). Смесь оставляли перемешиваться при 20 С в течение 3-4 ч. 3-Хлор-N-(дифенилметилен)-4-(2-фтор-4-нитрофенокси)пиридин-2 амин не был обнаружен ВЭЖХ анализом. Реакционную смесь нагревали до 70 С и оставляли перемешиваться в течение 3-4 ч. Сразу же после завершения реакции добавляли воду (14 мл/г ЛР). Реакционную смесь охлаждали до 20 С (температура реакции) свыше 1 ч. После охлаждения твердую фазу осаждали и отфильтровывали, после чего отмывали водой (12.5 мл/г ЛР) с последующей смесью гептан:МТВЕ (4:1; 5 мл/г ЛР). После LOD (25%) получали 95.3 г сырого 4-(4-амино-2-фторфенокси)-3-хлор-N(дифенилметилен)пиридин-2-амин(90 АР). Сырой 4-(4-амино-2-фторфенокси)-3-хлор-N(дифенилметилен)пиридин-2-амин растворяли в n-BuOAc (7 мл/г ЛР) нагреванием примерно до 85 С. При 85 С по каплям добавляли гептан (7 мл/г ЛР) до тех пор, пока раствор не становился мутным. Раствор затем оставляли охлаждаться до 20 С при перемешивании. После достижения 20 С суспензию выдерживали в течение 8 ч. Твердую фазу отфильтровывали, промывали гептаном (5 мл/г ЛР), после чего высушивали в течение ночи в вакуумной печи при 60 С для получения 4-(4-амино-2-фторфенокси)-3 хлор-N-(дифенилметилен)пиридин-2-амина (62.53 г, выход 67.69%) в виде бледного желтого твердого вещества. 1 Н ЯМР (CDCl3)6.23 (dd, 1H, J=1.0, 5.6 Гц), 6.43 (m, 1H), 6.49 (dd, 1H, J=2.5, 12.1 Гц), 6.92 (t,1H, J=8.6 Гц), 7.25-7.60 (m, 8 Н), 7.87 (m, 2 Н), 7.95 (d, 1 Н, J=6.1 Гц); MS (ESI+) m/z 418.6 (М+Н)+. Приготовление 1E. Этил 4-(4-фторфенил)-3-оксобутаноат В раствор 2,2-диметил-1,3-диоксан-4,6-диона (кислота Мелдрума, 8.0 г, 56 ммоль), растворенного в безводном метиленхлориде (100 мл) и пиридине (11 мл), при 0 С в атмосфере азота медленно добавляли 2-(4-фторфенил)ацетилхлорид (7.6 мл, 9.6 г, 56 ммоль). Красный раствор перемешивали при 0 С в течение 1.5 ч. Реакционную смесь обрабатывали 1 N HCl (13 мл) и разбавляли метиленхлоридом (200 мл). Слои разделяли и органический слой отмывали насыщенным водным раствором хлорида натрия, высушивали и концентрировали в вакууме для получения 5-(2-(4-фторфенил)ацетил)-2,2-диметил-1,3 диоксан-4,6-диона. Сырой промежуточный продукт суспендировали в чистом этаноле (150 мл) и полученную смесь нагревали с обратным холодильником в течение 4 ч. Растворитель затем удаляли в вакууме и остаток очищали флэш-колоночной хроматографией (SiO2, 230-240 меш, градиентное элюирование 8:1 гексан-этилацетат) для получения требуемого продукта (4.6 г, 37%). 1 Н ЯМР (CDCl3)7.23-7.15 (m,2 Н), 7.05-6.98 (m, 2 Н), 4.18 (q, 2 Н, J=7.0 Гц), 3.81 (s, 2 Н), 3.46 (s, 2 Н), 1.26 (t, 3 Н, J=7.0 Гц); MS (ESI+) m/z 225 (М+Н)+. Приготовление 1F. 5-(4-Фторфенил)-4-оксо-1,4-дигидропиридин-3-карбоновая кислота В раствор этил 4-(4-фторфенил)-3-оксобутаноата (4.6 г, 21 ммоль) в чистом этаноле (45 мл) добавляли раствор NaOEt (21% раствор NaOEt в EtOH, 7.7 мл) и триазин (1.67 г, 21 ммоль). Полученную смесь нагревали до 85 С в течение 1.5 ч, охлаждали до комнатной температуры и обрабатывали дополнительной порцией триазина (0.08 г, 1 ммоль) и раствором NaOEt (21% раствор NaOEt в EtOH, 0.4 мл). Реакционную смесь нагревали дополнительно в течение 1 ч и концентрировали в вакууме. Остаток обрабатывали 1 N HCl до тех пор, пока уровень рН реакции не достигал примерно 2. Осадок собирали для получения требуемого промежуточного соединения эфира, этил 5-(4-фторфенил)-4-оксо-1,4-дигидропиридин-3 карбоксилата (4.5 г, 83%), в виде желтого твердого вещества. MS (ESI+) m/z 262 (М+Н)+. Вышеуказанный эфир (1.0 г, 3.8 ммоль) растворяли в 2 N NaOH (20 мл) и нагревали до 65 С в течение 2 ч. Полученную прозрачную смесь охлаждали до комнатной температуры и отфильтровывали твердую фазу. Повышали кислотность фильтрата с помощью 1 N HCl до уровня рН 1 и полученный желтый осадок собирали в качестве требуемого продукта (0.73 г, 82%). 1 Н ЯМР (DMSO-d6)13.52 (br s, 1 Н), 8.86(10 мл) при комнатной температуре добавляли HATU (913 мг, 2.4 ммоль) и DIPEA (1.05 мл, 6.0 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 3 ч перед осаждением добавлением холодной воды (50 мл). Образовавшуюся твердую фазу собирали фильтрацией и отмывали водой и эфиром. Твердую фазу растворяли в DCM и очищали флэш-колоночной хроматографией (SiO2, от DCM до 10% МеОН в DCM) для получения требуемого продукта (987 мг, 78%) в виде светло-желтого твердого вещества. MS (ESI+) m/z 633 (М+Н)+. Пример 1. В растворN-(4-(3-хлор-2-(дифенилметиленамино)пиридин-4-илокси)-3-фторфенил)-5-(4 фторфенил)-4-оксо-1,4-дигидропиридин-3-карбамида (410 мг, 0.65 ммоль) в THF (10 мл) при комнатной температуре добавляли водный раствор HCl (2 М, 0.81 мл, 1.62 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 1 ч и затем концентрировали в вакууме. Затем в остаток добавляли холодный водный 5% раствор NaHCO3 (5 мл). Образовавшуюся твердую фазу собирали фильтрацией, отмывали водой и затем эфиром, после чего сушили в вакууме для получения требуемого продуктаN-(4-(2-амино-3-хлорпиридин-4-илокси)-3-фторфенил)-5-(4 фторфенил)-4-оксо-1,4-дигидропиридин-3-карбоксамида соль HCl N-(4-(2-амино-3-хлорпиридин-4 илокси)-3-фторфенил)-5-(4-фторфенил)-4-оксо-1,4-дигидропиридин-3-карбоксамида (пример 1) получали обработкой раствора N-(4-(3-хлор-2-(дифенилметиленамино)пиридин-4-илокси)-3-фторфенил)-5-(4 фторфенил)-4-оксо-1,4-дигидропиридин-3-карбоксамида (приготовление 1G) в THF избытком воднойHCl при комнатной температуре. Летучие вещества удаляли в вакууме для обеспечения требуемого соединения. Пример 2. В раствор N-(4-(3-хлор-2-(дифенилметиленамино)пиридин-4-илокси)-3-фторфенил)-5-(4-фторфенил)-4-оксо-1,4-дигидропиридин-3-карбоксамида (5.0 г, 7.90 ммоль) в DMF (50 мл) при комнатной температуре добавляли карбонат калия (7.64 г, 55.3 ммоль) и ди-трет-бутил хлорметил фосфат (9.19 г, 35.5 ммоль, см РСТ WO 2005/090367). Реакционную смесь перемешивали при комнатной температуре в течение 2 дней. Смесь затем разбавляли EtOAc (250 мл), промывали водой (200 мл), водн. 10% LiCl (3250 мл), высушивали над Na2SO4 и фильтровали. Фильтрат концентрировали для получения остатка, который растворяли в EtOH (160 мл). В этот перемешанный раствор добавляли воду (60 мл) с последующим медленным добавлением конц. HCl (40 мл). Полученную смесь перемешивали при комнатной температуре в течение 15 мин и затем оставляли на ночь. ВЭЖХ анализ показал завершение реакции. Твердую фазу собирали фильтрацией, споласкивали 50% EtOH/Н 2 О (5), водой, EtOH и EtOAc. Твердую фазу высушивали в вакууме для получения указанного соединения (4.3 г, 93%) в виде белого твердого вещества. 1H ЯМР (TFA-d)9.60 (s, 1H), 8.79 (s, 1H), 7.80-7.90 (m, 2 Н), 7.65-7.75 (m, 2 Н), 7.57 (d, 1H, J=7.04 Гц), 7.45+Н)+. Примеры 3-11. Примеры 3-11 были приготовлены с помощью следующей общей методики. В смесь N-(4-(2-амино-3 хлорпиридин-4-илокси)-3-фторфенил)-5-(4-фторфенил)-4-оксо-1,4-дигидропиридин-3-карбоксамида (пример 1, 0.1 ммоль) и карбоната калия (0.4 ммоль) в DMF (1 мл) добавляли соответствующее производное хлорметилового эфира (0.3 ммоль, приготовление см. в Synth. Commun., 14:857-864 (1984. Реакционную смесь перемешивали при комнатной температуре в течение 1-3 ч, разбавляли DCM и отмывали водным раствором KH2PO4. Органический слой высушивали над MgSO4 и N-Boc-защищенное промежуточное соединение очищали колоночной хроматографией (SiO2, с использованием градиентного элюированияN-Boc-защищенное промежуточное соединение затем обрабатывали 30% TFA/DCM (2 мл) в течение 1 ч. Растворители удаляли в вакууме и продукт очищали препаративной ВЭЖХ для получения указанного соединения в виде TFA соли.THF (5 мл) при 0 С добавляли NaBH4 (300 мг, 7.93 ммоль). Смесь перемешивали при 0 С в течение 3 ч и затем при комнатной температуре в течение ночи. Реакцию осаждали водой, экстрагировали DCM и высушивали над MgSO4. После фильтрации и концентрирования в вакууме получали 120 мг требуемого продукта в виде белого твердого вещества. MS (ESI+) m/z 635(М+Н)+. Приготовление 12 В. 4-(3-(4-(2-(Бензгидриламино)-3-хлорпиридин-4-илокси)-3-фторфенилкарбамоил)-5-(4-фторфенил)-4-оксопиридин-1-(4H)-ил)метил 1-трет-бутилпиперидин-1,4-дикарбоксилат Смесь N-(4-(2-(бензгидриламино)-3-хлорпиридин-4-илокси)-3-фторфенил)-5-(4-фторфенил)-4-оксо 1,4-дигидропиридин-3-карбоксамида (120 мг, 0.189 ммоль), K2CO3 (104 мг, 0.756 ммоль) и 1-трет-бутил 4-хлорметилпиперидин-1,4-дикарбоксилата (157 мг, 0.567 ммоль) в DMF (2 мл) перемешивали при комнатной температуре в течение 3 ч. Реакционную смесь затем разбавляли DCM и образовавшуюся твердую фазу отфильтровывали. Остаток отмывали насыщенным водным раствором KH2PO4. Органический слой высушивали над MgSO4 и требуемый продукт очищали флэш-колоночной хроматографией (SiO2,элюируя градиентом DCM/EtOAc) для получения требуемого соединения (145 мг) в виде белого твердого вещества. MS (ESI+) m/z 876 (М+Н)+. Приготовление 12C. (3-(4-(2-(Бензгидриламино)-3-хлорпиридин-4-илокси)-3-фторфенилкарбамоил)-5-(4-фторфенил)-4-оксопиридин-1-(4H)-ил)метилпиперидин-4-карбоксилат В раствор 4-(3-(4-(2-(бензгидриламино)-3-хлорпиридин-4-илокси)-3-фторфенилкарбамоил)-5-(4 фторфенил)-4-оксопиридин-1-(4H)-ил)метил 1-трет-бутил пиперидин-1,4-дикарбоксилата (135 мг, 0.154 ммоль) в DCM (5 мл) при комнатной температуре добавляли HCl (4 N в диоксане, 1 мл). Реакционную смесь перемешивали при комнатной температуре в течение 3 ч. Растворитель удаляли в вакууме и полученный остаток очищали препаративной ВЭЖХ для получения требуемого продукта (128 мг) в виде белого твердого вещества. MS (ESI+) m/z 776 (М+Н)+. Приготовление 12D. (3-(4-(2-(Бензгидриламино)-3-хлорпиридин-4-илокси)-3-фторфенилкарбамоил)-5-(4-фторфенил)-4-оксопиридин-1-(4H)-ил)метил 1-метилпиперидин-4-карбоксилат(3-(4-(2-(бензгидриламино)-3-хлорпиридин-4-илокси)-3-фторфенилкарбамоил)-5-(4 фторфенил)-4-оксопиридин-1-(4H)-ил)метилпиперидин-4-карбоксилата (60 мг, 0.077 ммоль), формальдегида (37% в воде, 0.08 мл, 0.077 ммоль) и уксусной кислоты (0.03 мл, 0.077) в ацетонитриле (2 мл) при комнатной температуре добавляли NaCNBH3 (50 мг, 0.8 ммоль). Полученную смесь перемешивали в течение 30 мин. Растворитель удаляли в вакууме и сырой остаток продукта использовали непосредственно на следующей стадии без дальнейшей очистки. Пример 12. Приготовление (12 Е) (0.077 ммоль) обрабатывали TFA (3 мл) при комнатной температуре в течение 30 мин. Летучие вещества удаляли в вакууме и полученный остаток очищали препаративной ВЭЖХ для получения указанного соединения (32 мг) в виде белого твердого вещества. 1H ЯМРN-(4-(3-хлор-2-(дифенилметиленамино)пиридин-4-илокси)-3-фторфенил)-5-(4 фторфенил)-4-оксо-1,4-дигидропиридин-3-карбоксамида (1.0 г, 1.58 ммоль) в DMF (10 мл) при комнатной температуре добавляли Cs2CO3 (1.3 г, 3.95 ммоль), иодид калия (525 мг, 3.16 ммолъ) и затем ди-третбутил хлорметил фосфат (1.2 мл, 1.90 ммоль, 2.0 М в DMF). Реакционную смесь перемешивали при комнатной температуре в течение 26 ч перед осаждением добавлением изопропилацетата (10 мл) и холодной воды (50 мл). Органический слой отделяли и промывали водой (50 мл). Растворитель заменяли на изопропанол (10 мл) путем непрерывной дистилляции при 86 С. Раствор охлаждали до 20 С и твердую фазу осаждали. Твердую фазу собирали фильтрацией и высушивали в вакууме при 60 С в течение 12 ч для получения требуемого продукта (0.98 г, 72%) в виде грязно-белого твердого вещества. MS (ESI+) m/z 856(М+Н)+. Пример 13. В колбу с круглым дном емкостью 50 мл добавляли ди-трет-бутил (3-(4-(3-хлор-2(дифенилметиленамино)пиридин-4-илокси)-3-фторфенилкарбамоил)-5-(4-фторфенил)-4-оксопиридин-1(4H)-ил)метил фосфат (4 г, 4.68 ммоль) и CH2Cl2 (4 мл). Смесь охлаждали до 0 С и затем добавляли трифторуксусную кислоту (4 мл). Реакционную смесь оставляли нагреваться до 20 С. ВЭЖХ показала,что ди-трет-бутилфосфат гидролизовался в кислоту. Воду (0.4 мл) добавляли при 20 С и смесь оставляли перемешиваться при 20 С в течение 5-6 ч. Смесь становилась густой суспензией. Добавляли толуол (20 мл) и затем концентрировали приблизительно до 5 мл для удаления избыточной трифторуксусной кислоты, CH2Cl2 и воды. Это повторяли дважды. Суспензию разбавляли EtOAc (120 мл, 100%). В эту суспензию добавляли этаноламин до установления уровня рН примерно 8.1 при 20 С. Суспензия становилась прозрачной во время добавления. После добавления раствор нагревали до 75 С и наблюдали образование квадратных пластинчатых кристаллов. Смесь оставляли охлаждаться до 20 С и затем перемешивали в течение 24 ч. Твердую фазу удаляли фильтрацией и отмывали EtOH (100%) для получения соли бисэтаноламина в виде квадратных пластинчатых кристаллов. Твердую фазу ресуспендировали EtOH (120 мл, 100%) при 75 С этаноламином (0.1 г). Стержнеобразные игольчатые кристаллы добавляли в суспензию и перемешивали при 75 С в течение 7 ч. Смесь оставляли охлаждаться до 20 С и твердую фазу собирали фильтрацией для получения соли бис-этаноламина в виде больших стержнеобразных кристаллов. Кристаллы высушивали при 55 С в течение 14 ч. Пример 14. (3-(4-(2-Амино-3-хлорпиридин-4-илокси)-3-фторфенилкарбамоил)-5-(4-фторфенил)-4 оксопиридин-1-(4H)-ил)метил дигидрофосфат, бис-трис-аминовая соль В колбу с круглым дном емкостью 50 мл добавляли ди-трет-бутил (3-(4-(3-хлор-2(дифенилметиленамино)пиридин-4-илокси)-3-фторфенилкарбамоил)-5-(4-фторфенил)-4-оксопиридин-1(4 Н)-ил)метил фосфат (1 г, 1.17 ммоль) и CH2Cl2 (1 мл). Смесь охлаждали до 0 С и затем добавляли трифторуксусную кислоту (1 мл). Реакционную смесь оставляли нагреваться до 20 С. ВЭЖХ показала,что ди-трет-бутилфосфат гидролизовался в кислоту. Добавляли воду (0.1 мл) при 20 С и смесь перемешивали при 20 С в течение 6 ч. Смесь становилась густой суспензией. Добавляли толуол (5 мл) и затем концентрировали примерно до 1 мл для удаления избытка трифторуксусной кислоты, CH2Cl2 и воды. Это- 22017736 повторяли дважды. Добавляли EtOH (30 мл, 100%), что давало мутную суспензию. Суспензию нагревали до 75 С и добавляли концентрированный водный раствор трис-амина (2-амино-2-гидроксиметил-1,3 пропандиол) для установления рН 7.3. Раствор затем становился прозрачным и при 75 С добавляли гранулы бис-трисамина и суспензию выдерживали в течение 4 ч при 75 С. Суспензию охлаждали до 20 С и выдерживали в течение 2 ч. Кристаллическую твердую фазу собирали фильтрацией и высушивали в вакууме при 55 С для получения соли бис-трисамина. Анализы. Фармакологические свойства соединения данного изобретения могут быть подтверждены рядом фармакологических анализов. Последующие иллюстративные фармакологические анализы проводили с соединением согласно изобретению, и/или его солями, и/или пролекарствами.Met-киназный анализ. Инкубационные смеси, которые использовали для Met-киназного анализа, содержат бакуловирус,экспрессирующий GST-Met киназу, синтетический субстрат polyGlu:Tyr, (4:1), ATP, АТР 33 Р и буфер,содержащий Mn+2, DTT, BSA и Tris. Реакции инкубировали в течение 60 мин при 30 С и останавливали добавлением холодной трихлоруксусной кислоты (ТСА) до конечной концентрации 8%. Осадок ТСА собирали на планшеты GF/C UniFilter (Packard Instrument Co., Meriden, CT) с помощью универсального коллектора FILTERMATE (Packard Instrument Co., Meriden, CT) и фильтры рассчитывали с использованием TopCount 96/384-луночного жидкого сцинтилляционного счетчика (Packard Instrument Co., Meriden,CT). Кривые отклика дозы генерировали для определения концентрации, требуемой для ингибирования 50% активности киназы (IC50). Соединения растворяли при 10 мМ в диметилсульфоксиде (DMSO) и оценивали при десяти концентрациях, каждую в двух повторностях. Конечная концентрация DMSO в анализе составляла 1.7%. Значения IC50 были получены нелинейной регрессией. Таблица 2 Анализ пролиферации линии клеток GTL-16 карциномы желудка. Ингибирование роста GTL-16 клеток оценивали с помощью MTS-теста с использованием набора для нерадиоактивного анализа клеточной пролиферации CELLTITER 96 Aqueous Non-Radioactive Proliferation Assay от Promega. Набор состоит из растворов нового тетразолиевого соединения (3-(4,5 диметилтиазол-2-ил)-5-(3-карбоксиметоксифенил)-2-(4-сульфофенил)-2H-тетразолий, внутренняя соль;MTS) и переносчика электронов (феназинметосульфат, PMS). В этом колориметрическом анализе превращение MTS в водный, растворимый формазан происходит при помощи энзимов дегидрогеназы, обнаруженных в метаболически активных клетках. Количество продукта формазана, измеренное его абсорбцией при 490 нм, прямо пропорционально количеству живых клеток в культуре.GTL-16 клетки инокулировали в 96-луночные титрационные микропланшеты в 0.5% фетальную телячью сыворотку и инкубировали при 37 С, 5% СО 2, 95% воздуха и 100% относительной влажности в течение 24 ч перед добавлением соединения. При внесении лекарственного препарата один планшет с клеточной линией анализировали с помощью вышеуказанного набора для представления результатов измерения клеточной популяции в момент добавления лекарственного препарата. После внесения лекарственного препарата планшеты инкубировали дополнительно в течение 72 ч перед обработкой и измерением клеточных популяций. Каждое соединение тестировали при 8 разных концентрациях в трех повторностях, как и необработанный контрольный образец. Ингибирование роста на 50% (IC50) рассчитывали анализом данных в Excel с использованием логистического уравнения с 4 параметрами с данными,заполненными с помощью алгоритма Levenburg Marquardt. Инкубационные смеси, которые использовали для анализа VEGFR-2, содержали синтетический субстрат poly glu/tyr, (4:1), ATP, АТР 33 Р и буфер, содержащий Mn+2, DTT, BSA и Tris буфер. Реакцию инициировали добавлением энзима и через 60 мин при комнатной температуре завершали добавлением 30% ТСА до конечной концентрации 15% ТСА. Ингибиторы доводили до 10 мМ в 100% DMSO. Образцы готовили в 96-луночном формате в четырех повторностях. Соединения разбавляли 1:500 в 100%DMSO и затем 1:10 в воде для получения конечной концентрации DMSO 10%. Аликвоты (10 мкл) добавляли в ряды В-Н в 96-луночный формат 10% DMSO. Соединение (20 мкл) добавляли в ряд А при концентрации, в 5 раз превышающей рабочий режим. Аликвоты (10 мкл) переносили в каждый ряд с последующими шестью серийными разбавлениями с перемешиванием и в ряду F 10 мкл удаляли. Ряд G являлся контрольным без соединения и ряд Н не содержал соединения и контрольного энзима. Энзим и субстрат доставляли с помощью Tomtec Quadra station. Планшеты накрывали адгезионной верхней стороной пластин, инкубировали при 27 С в течение 60 мин и затем кислоту осаждали ТСА в течение 20 мин на льду. Осадок переносили в UniFilter-96, GF/C микропланшеты с помощью Tomtec или Packard FILTERMATE коллектора. Активность определяли подстчетом внедренной радиоактивности с помощью Packard TopCount Microplate Scintillation Counter с последующим добавлением Microscint-20 коктейля в каждую высушенную лунку UniFilter микропланшетов. Табл. 4 показывает активности примеров 1 и соединений А и В в МЕТ киназном анализе, VEGFR-2 анализе и/или GTL-16 анализе. Составы соединений А и В раскрыты в Американской заявке 2005/0245530 в примерах 56 и 101 соответственно.N-(4-(2-Амино-3-хлорпиридин-4-илокси)-3-фторфенил)-5-(4-фторфенил)-4-оксо-1,4-дигидропиридин-3-карбоксамид (пример 1) и 3-(4-(2-амино-3-хлорпиридин-4-илокси)-3-фторфенилкарбамоил)-5-(4 фторфенил)-4-оксопиридин-1-(4H)-ил)метил дигидрофосфат (пример 2) оценивали на эффективность invivo против человеческой ксенографтной модели линии клеток GTL-16 опухоли желудка. Пример 2 является пролекарством примера 1. Как показано на фиг. 1, примеры 1 и 2 были активными, что было определено более чем 50% ингибированием роста опухоли (TGI) за время удвоения по меньшей мере одной опухоли в модели GTL-16 карциномы желудка. Выраженной токсичности не наблюдалось ни при каких- 24017736 уровнях доз при введении один раз в день на протяжении 14 дней. В этом исследовании эквимолярные концентрации примера 1 (25 мг/кг примера 1 и 31.2 мг/кг примера 2) обеспечивали полный стаз опухоли. Пример 1 также был протестирован на модели глиобластомы U87, Met-зависимой опухоли на основе HGF аутокринного механизма активации Met. Как показано на фиг. 2, полный стаз опухоли наблюдали при 25 мг/кг, аналогично активности, наблюдаемой против GTL-16 ксенотрансплантатов опухоли. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение, имеющее формулу (I)X представляет собой Н или C1-С 2-алкил, возможно замещенный одним или более заместителем,выбранным из ОН, галогена, циано и/или -NR1R2;Z представляет собой C1-С 6-алкил или 5-6-членный гетероцикло, содержащий один атом азота в качестве гетероатома, возможно замещенный одним или более заместителем, выбранным из С 1-С 4-алкила,ОН, галогена, циано и/или -NR3R4;(3-(4-(2-амино-3-хлорпиридин-4-илокси)-3-фторфенилкарбамоил)-5-(4-фторфенил)-4-оксопиридин 1-(4 Н)-ил)метил 1-метилпиперидин-4-карбоксилат. 10. Фармацевтическая композиция, содержащая по меньшей мере одно соединение по п.1 или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель или разбавитель. 11. Фармацевтическая композиция по п.10, в которой указанным по меньшей мере одним соединением является или его фармацевтически приемлемая соль. 12. Применение соединения по п.1 или его фармацевтически приемлемой соли для изготовления лекарственных препаратов для лечения рака, где указанное соединение или его фармацевтически приемлемая соль является выбранным из N-(4-(2-амино-3-хлорпиридин-4-илокси)-3-фторфенил)-5-(4 фторфенил)-4-оксо-1,4-дигидропиридин-3-карбоксамида и (3-(4-(2-амино-3-хлорпиридин-4-илокси)-3 фторфенилкарбамоил)-5-(4-фторфенил)-4-оксопиридин-1-(4 Н)-ил)метилдигидрофосфата. 13. Применение по п.12, при котором раком является рак мочевого пузыря, рак молочной железы,рак ободочной и прямой кишки, рак желудка, рак органов головы и шеи, рак почки, рак печени, рак легких, рак яичников, рак поджелудочной железы/желчного пузыря, рак предстательной железы, рак щитовидной железы, остеогенная саркома, рабдомиосаркома, меланома, глиобластома/астроцитома,MFH/фибросаркома или мезотелиома.
МПК / Метки
МПК: C07D 401/12, C07D 401/14, A61P 35/00, A61K 31/4427
Метки: соединения, 4-пиридинона, рака, лечения, применение
Код ссылки
<a href="https://eas.patents.su/28-17736-soedineniya-4-piridinona-i-ih-primenenie-dlya-lecheniya-raka.html" rel="bookmark" title="База патентов Евразийского Союза">Соединения 4-пиридинона и их применение для лечения рака</a>
Предыдущий патент: Циклические депсипептиды
Следующий патент: Азотсодержащие бициклические соединения, активные при состояниях хронической боли
Случайный патент: Внутриротовой инструмент для обеспечения точной посадки зубных протезов












