Комбинированная терапия антикоагулирующего средства с соединением, которое действует как ингибитор фактора ха
Формула / Реферат
1. Способ лечения состояния у млекопитающего, характеризующегося нежелательным тромбозом, включающий введение указанному млекопитающему терапевтически эффективного количества соединения [2-({4-[(диметиламино)иминометил]фенил}карбониламино)-5-метоксифенил]-N-(5-хлор(2-пиридил))карбоксамида формулы
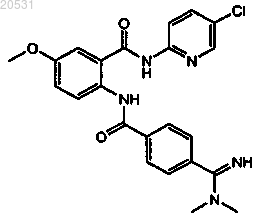
или его фармацевтически приемлемой соли и антагониста P2Y12 рецептора.
2. Способ по п.1, где антагонистом P2Y12 рецептора является клопидогрел.
3. Способ по любому из пп.1, 2, где по меньшей мере одно из [2-({4-[(диметиламино)иминометил]фенил}карбониламино)-5-метоксифенил]-N-(5-хлор(2-пиридил))карбоксамида, или его фармацевтически приемлемой соли, или антагониста P2Y12 рецептора вводят в субтерапевтической дозе.
4. Способ по любому из пп.1, 2, где как [2-({4-[(диметиламино)иминометил]фенил}карбониламино)-5-метоксифенил]-N-(5-хлор(2-пиридил))карбоксамид или его фармацевтически приемлемую соль, так и антагонист P2Y12 рецептора вводят в субтерапевтических дозах.
5. Способ по любому из пп.1-4, где [2-({4-[(диметиламино)иминометил]фенил}карбониламино)-5-метоксифенил]-N-(5-хлор(2-пиридил))карбоксамид или его фармацевтически приемлемую соль и антагонист P2Y12 рецептора вводят одновременно.
6. Способ по любому из пп.1-4, где [2-({4-[(диметиламино)иминометил]фенил}карбониламино)-5-метоксифенил]-N-(5-хлор(2-пиридил))карбоксамид или его фармацевтически приемлемую соль и антагонист P2Y12 рецептора вводят последовательно.
7. Способ по любому из пп.1-6, где фармацевтически приемлемая соль [2-({4-[(диметиламино)иминометил]фенил}карбониламино)-5-метоксифенил]-N-(5-хлор(2-пиридил))карбоксамида является солью малеиновой кислоты.
8. Способ по любому из пп.1-7, где состояние выбрано из группы, состоящей из острого коронарного синдрома, инфаркта миокарда, нестабильной стенокардии, рефрактерной стенокардии, окклюзионного коронарного тромба, наблюдающегося после тромболитической терапии или после коронарной ангиопластики, тромботически опосредованного цереброваскулярного синдрома, эмболического удара, тромботического удара, транзиторных ишемических атак, венозного тромбоза, тромбоза глубоких вен, легочных эмбол, коагулопатии, диссеминированного внутрисосудистого свертывания, тромботической тромбоцитопенической пурпуры, облитерирующего тромбоангиита, тромботического заболевания, связанного с гепарининдуцированной тромбоцитопенией, тромботических осложнений, связанных с экстракорпоральным кровообращением, тромботических осложнений, связанных с применением технических средств, и тромботических осложнений, связанных с соединительными частями протезов.
9. Фармацевтическая композиция, включающая два следующих терапевтических средства:
(1) [2-({4-[(диметиламино)иминометил]фенил}карбониламино)-5-метоксифенил]-N-(5-хлор(2-пиридил))карбоксамид формулы
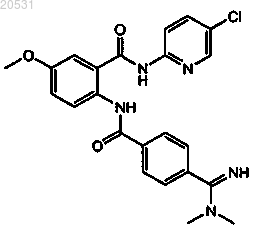
или его фармацевтически приемлемую соль и
(2) антагонист P2Y12 рецептора и фармацевтически приемлемый носитель.
10. Фармацевтическая композиция по п.9, где антагонистом P2Y12 рецептора является клопидогрел.
11. Фармацевтическая композиция по любому из пп.9, 10, где по меньшей мере одно терапевтическое средство присутствует в субтерапевтических дозах.
12. Фармацевтическая композиция по любому из пп.9, 10, где оба терапевтических средства присутствуют в субтерапевтических дозах.
13. Фармацевтическая композиция по любому из пп.9-12, где фармацевтически приемлемая соль [2-({4-[(диметиламино)иминометил]фенил}карбониламино)-5-метоксифенил]-N-(5-хлор(2-пиридил))карбоксамида является солью малеиновой кислоты.
14. Набор, включающий:
(1) первый контейнер, где указанный контейнер содержит [2-({4-[(диметиламино)иминометил]фенил}карбониламино)-5-метоксифенил]-N-(5-хлор(2-пиридил))карбоксамид формулы
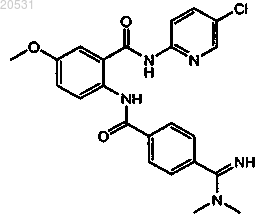
или его фармацевтически приемлемую соль и
(2) второй контейнер, где указанный контейнер содержит антагонист P2Y12 рецептора.
15. Набор по п.14, где антагонистом P2Y12 рецептора является клопидогрел.
16. Набор по любому из пп.14, 15, дополнительно включающий:
(3) вкладыш в упаковку с указанием, что [2-({4-[(диметиламино)иминометил]фенил}карбониламино)-5-метоксифенил]-N-(5-хлор(2-пиридил))карбоксамид и антагонист P2Y12 рецептора могут использоваться вместе.
17. Набор по любому из пп.14-16, где фармацевтически приемлемая соль [2-({4-[(диметиламино)иминометил]фенил}карбониламино)-5-метоксифенил]-N-(5-хлор(2-пиридил))карбоксамида является солью малеиновой кислоты.
18. Набор по любому из пп.14-17, где по меньшей мере одно из [2-({4-[(диметиламино)иминометил]фенил}карбониламино)-5-метоксифенил]-N-(5-хлор(2-пиридил))карбоксамида или его фармацевтически приемлемой соли или антагониста P2Y12 рецептора присутствует в субтерапевтической дозе.
19. Набор по любому из пп.14-17, где как [2-({4-[(диметиламино)иминометил]фенил}карбониламино)-5-метоксифенил]-N-(5-хлор(2-пиридил))карбоксамид или его фармацевтически приемлемая соли, так и антагонист P2Y12 рецептора присутствуют в субтерапевтических дозах.
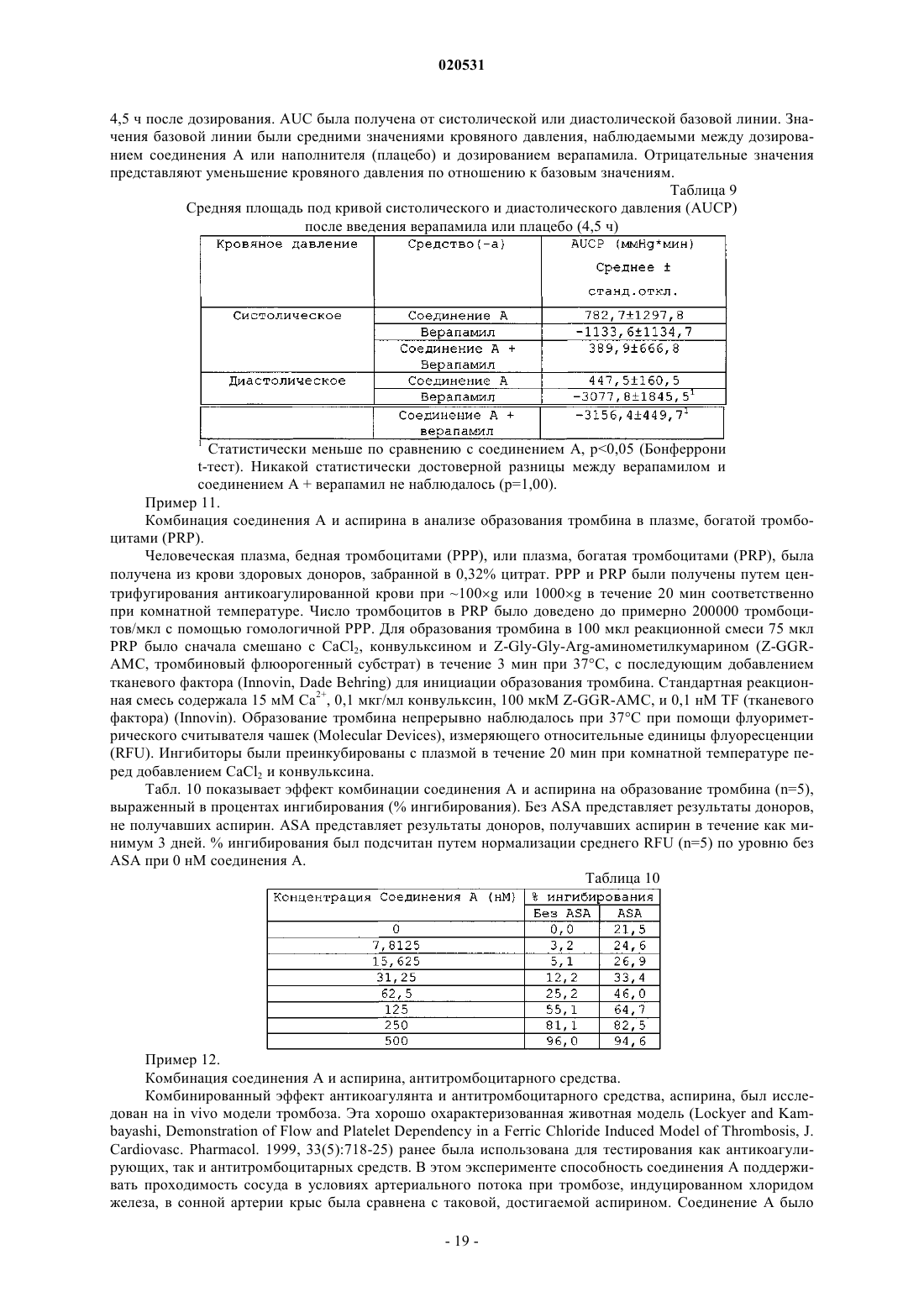
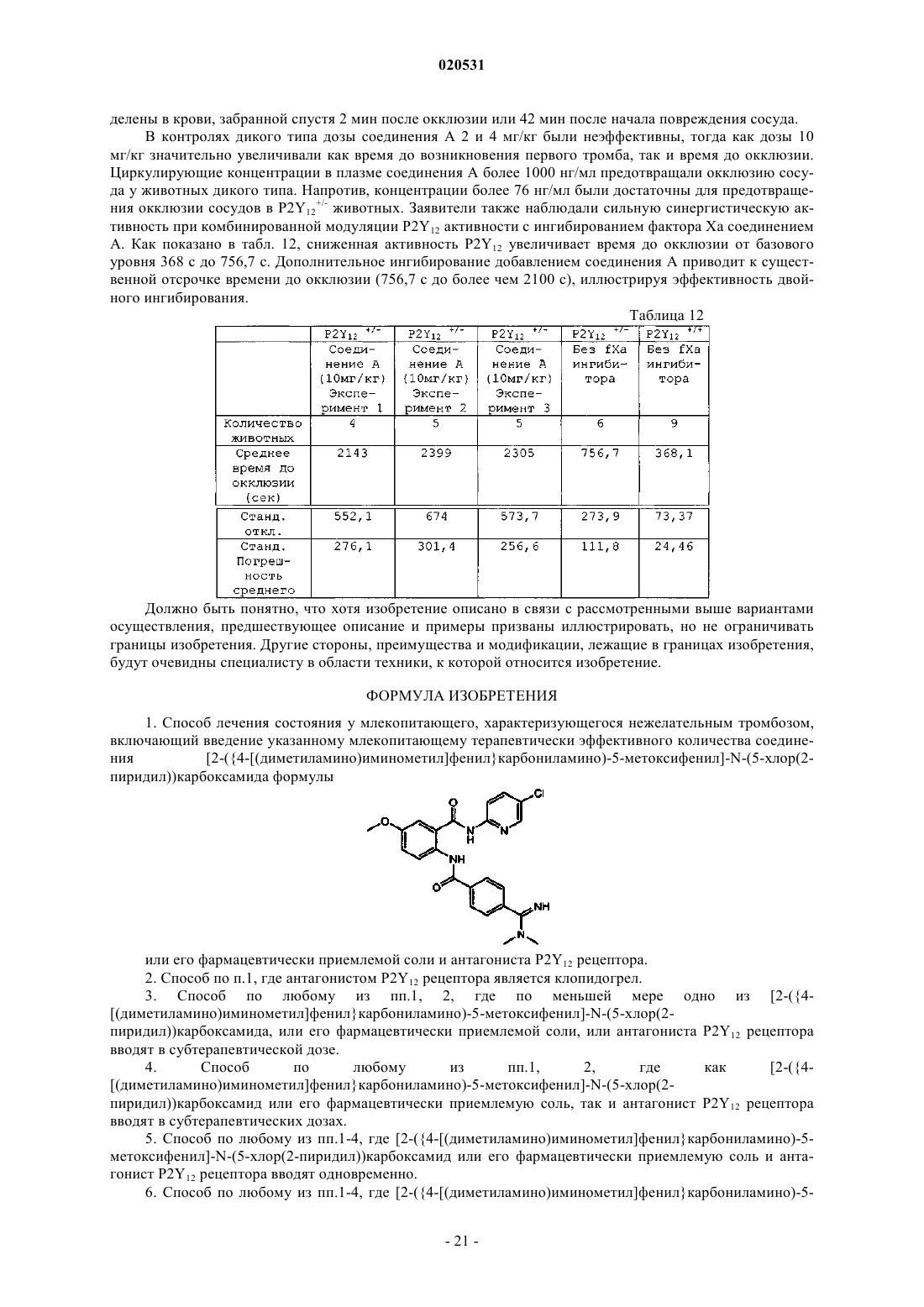
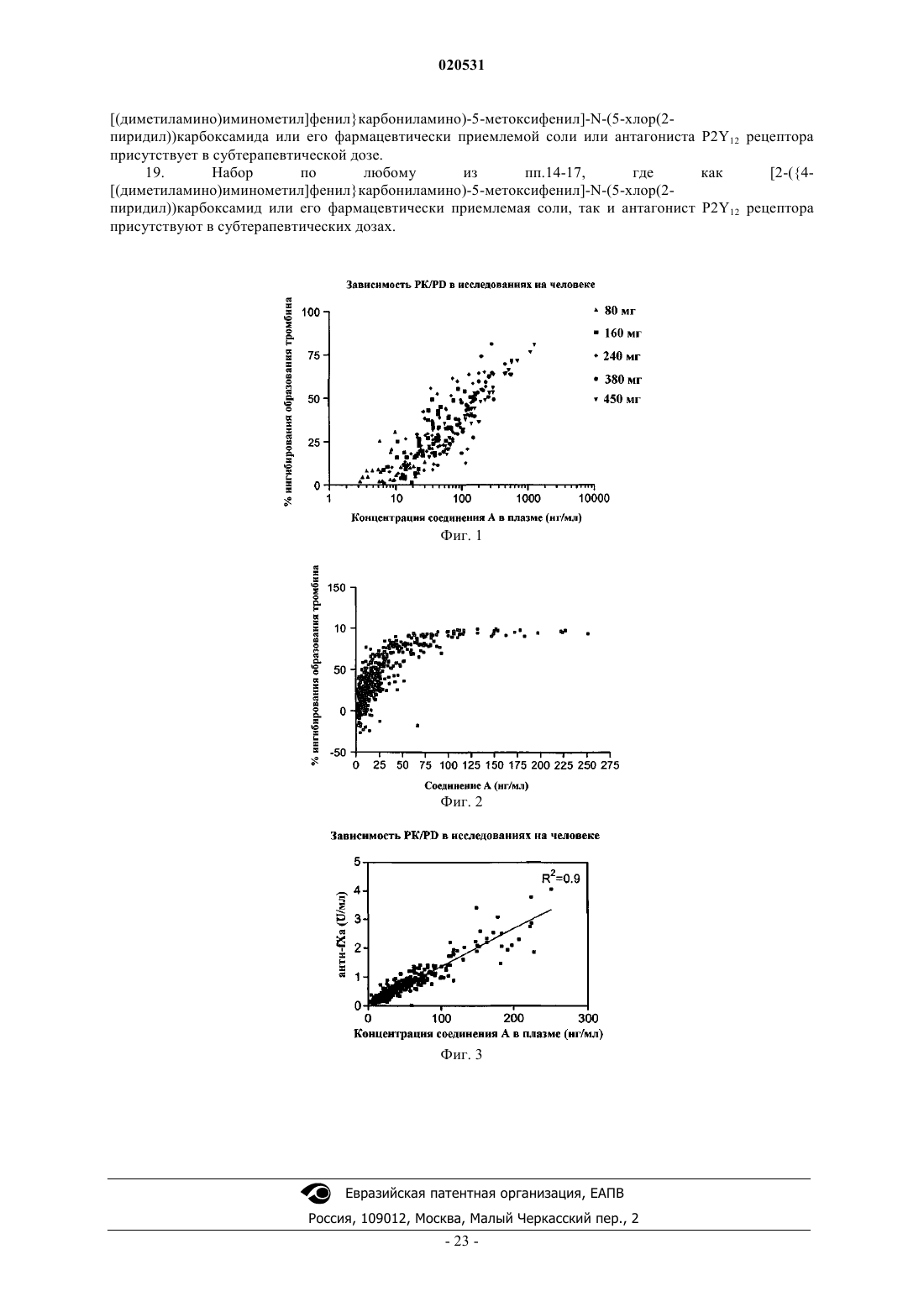
Текст
КОМБИНИРОВАННАЯ ТЕРАПИЯ АНТИКОАГУЛИРУЮЩЕГО СРЕДСТВА С СОЕДИНЕНИЕМ, КОТОРОЕ ДЕЙСТВУЕТ КАК ИНГИБИТОР ФАКТОРА Ха Настоящее изобретение относится к способу лечения состояния, характеризующегося нежелательным тромбозом,включающему введение млекопитающему или его фармацевтически приемлемой соли и антагониста P2Y12 рецептора. Изобретение также относится к фармацевтической композиции,включающей указанные соединения,и к набору,включающему первый контейнер,содержащий [2-(4-[(диметиламино)иминометил]фенилкарбониламино)-5-метоксифенил]-N-(5 хлор(2-пиридилкарбоксамид или его фармацевтически приемлемую соль, и второй контейнер,содержащий антагонист P2Y12 рецептора. Область техники, к которой относится изобретение Настоящее изобретение в основном относится к новым фармацевтическим композициям и способам лечения тромботических заболеваний с использованием комбинации ингибитора фактора Ха и других средств. Уровень техники Настоящее изобретение относится к коагуляции крови и путям, которыми коагуляция принимает участие в поддержании сохранности циркуляции у млекопитающих при повреждении, воспалении, заболевании, врожденном дефекте, дисфункции или другом нарушении. Формирование сгустка включает превращение фибриногена в фибрин, который полимеризуется в сеть для восстановления гомеостаза после повреждения. Подобный процесс происходит в закупоренных кровеносных сосудах при тромботических заболеваниях. Превращение фибриногена в фибрин катализируется тромбином, конечным продуктом серии реакций в каскаде коагуляции крови. Фактор Ха, сериновая протеаза, является единственным ферментом, ответственным за постоянное образование тромбина в сосудистой системе. Таким образом,ингибирование фактора Ха рассматривается как эффективная антикоагулирующая стратегия. В патентах US 6376515 В 2 и 6835739 В 2, содержание которых включено посредством ссылки, описано вещество[2-(4-[(диметиламино)иминометил]фенилкарбониламино)-5-метоксифенил]-N-(5 хлор(2-пиридилкарбоксамид (соединение А), специфически ингибирующее фактор Ха, которое имеет следующую структуру: Поскольку лечение таких заболеваний, как острые коронарные синдромы, может потребовать совместного введения антикоагулирующего средства и антитромбоцитарного средства, комбинация может привести к повышению эффективности, так же как и к лучшему соблюдению больным схемы и режима в течение постоянного лечения. Однако некоторые современные антикоагулирующие терапии не подходят для комбинированной терапии. Например, варфарин, доступный в настоящее время антикоагулянт для постоянного использования, нуждается в титровании дозы, с использованием анализа коагулирующей активности в соответствии с международным нормализованным отношением (MHO), для избежания чрезмерного разжижения крови и риска кровотечения. Таким образом, он не может быть использован в комбинации с антитромбоцитарным средством в фиксированной дозе. Более того, тогда как некоторые антикоагулирующие средства и антитромбоцитарные средства могут подходить для комбинированной терапии, они не обеспечивают удовлетворительного терапевтического эффекта. Например, последние клинические исследования изучали пациентов, получающих фондапаринукс (антикоагулирующее средство) и аспирин или клопидогрел. Пациенты продолжали испытывать тромботические осложнения в течение исследования. Fifth Organization to Assess Strategies in Acute Ischemic Syndromes Investigators, et al.,N. Engl. J. Med. 2006, 354(14):1464-76). Таким образом, имеется необходимость в комбинированной терапии, которая сочетает фиксированную дозу антикоагулирующего средства с антитромбоцитарным средством, которое имеет повышенную эффективность. Более того, существует необходимость в комбинированной терапии для пациентов с тромботическим заболеванием(ями) и сопутствующими заболеваниями, такими как высокое кровяное давление или воспаление. Сущность изобретения Настоящее изобретение предоставляет способы, фармацевтические композиции и наборы для комбинированных терапий, включающие ингибитор фактора Ха, имеющий следующую структуру: который имеет химическое название [2-(4-[(диметиламино)иминометил]фенилкарбониламино)-5 метоксифенил]-N-(5-хлор(2-пиридилкарбоксамид и называемый далее "соединение А". Показано, что это соединение способно лечить состояния, связанные с нежелательным тромбозом. Пациент, получающий лечение в связи с нежелательным тромбозом, часто нуждается в дополнительной сердечной и/или сосудистой терапии. Показано, что соединение А имеет предсказуемые уровни антикоагуляции при измерении методами фармакодинамики. Это более детально описывается в примерах 2 и 3. Так, рассматривается, что соединение А поразительно и неожиданно может быть использовано фиксированным, титр-независимым образом в комбинации с другими терапевтическими средствами для лечения тромботических заболеваний. Далее рассматривается, что соединение А, в комбинации с определенными другими терапевтическими средствами, показывает синергистический эффект, проиллюстрированный превосходными эффективностью или показателями безопасности. Настоящее изобретение предоставляет новый способ лечения состояния у млекопитающих, характеризующегося нежелательным тромбозом, включающий введение указанному млекопитающему терапевтически эффективного количества соединения А, [2-(4-[(диметиламино)иминометил]фенилкарбониламино)-5-метоксифенил]-N-(5-хлор(2-пиридилкарбоксамида, или его терапевтически приемлемой соли и терапевтически эффективного количества другого терапевтического средства. Другое терапевтически эффективное средство представляет собой антагонист P2Y12 рецептора. В конкретном варианте заявленного способа антагонистом P2Y12 рецептора является клопидогрел. В способе [2-(4[(диметиламино)иминометил]фенилкарбониламино)-5-метоксифенил]-N-(5-хлор(2-пиридилкарбоксамид либо его фармацевтически приемлемую соль и/или антагонист P2Y12 рецептора вводят в субтерапевтической дозе. [2-(4-[(Диметиламино)иминометил]фенилкарбониламино)-5-метоксифенил]-N-(5 хлор(2-пиридилкарбоксамид или его фармацевтически приемлемую соль и антагонист P2Y12 рецептора вводят одновременно или последовательно. Фармацевтически приемлемая соль [2-(4-[(диметиламино)иминометил]фенилкарбониламино)-5 метоксифенил]-N-(5-хлор(2-пиридилкарбоксамида может представлять собой соль малеиновой кислоты. Состояние, подлежащее лечению, выбрано из группы, состоящей из острого коронарного синдрома,инфаркта миокарда, нестабильной стенокардии, рефрактерной стенокардии, окклюзионного коронарного тромба, наблюдающегося после тромболитической терапии или после коронарной ангиопластики, тромботически опосредованного цереброваскулярного синдрома, эмболического удара, тромботического удара, транзиторных ишемических атак, венозного тромбоза, тромбоза глубоких вен, легочных эмбол, коагулопатии, диссеминированного внутрисосудистого свертывания, тромботической тромбоцитопенической пурпуры, облитерирующего тромбоангиита, тромботического заболевания, связанного с гепарининдуцированной тромбоцитопенией, тромботических осложнений, связанных с экстракорпоральным кровообращением, тромботических осложнений, связанных с применением технических средств, и тромботических осложнений, связанных с соединительными частями протезов. Изобретение также относится к фармацевтической композиции, включающей соединение следующей формулы: которое имеет химическое название [2-(4-[(диметиламино)иминометил]фенилкарбониламино)-5-2 020531 метоксифенил]-N-(5-хлор(2-пиридилкарбоксамид или его фармацевтически приемлемую соль и антагонист P2Y12 рецептора. В композиции антагонистом P2Y12 рецептора может быть клопидогрел. В фармацевтической композиции по меньшей мере одно терапевтическое средство присутствует в субтерапевтической дозе. Фармацевтически приемлемая соль[2-(4-[(диметиламино)иминометил]фенилкарбониламино)-5 метоксифенил]-N-(5-хлор(2-пиридилкарбоксамид может представлять собой соль малеиновой кислоты. Изобретение также относится к набору, включающему (1) первый контейнер, содержащий [2-(4[(диметиламино)иминометил]фенилкарбониламино)-5-метоксифенил]-N-(5-хлор(2 пиридилкарбоксамид или его фармацевтически приемлемую соль, и (2) второй контейнер, где указанный контейнер содержит антагонист P2Y12 рецептора. Антагонист P2Y12 рецептора может представлять собой клопидогрел. Набор дополнительно включает вкладыш в упаковку с указанием, что [2-(4[(диметиламино)иминометил]фенилкарбониламино)-5-метоксифенил]-N-(5-хлор(2 пиридилкарбоксамид и антагонист P2Y12 рецептора могут использоваться вместе. Фармацевтически приемлемая соль [2-(4-[(диметиламино)иминометил]фенилкарбониламино)-5-метоксифенил]-N-(5 хлор(2-пиридилкарбоксамида может представлять собой соль малеиновой кислоты. В наборе по меньшей мере одно из [2-(4-[(диметиламино)иминометил]фенилкарбониламино)-5-метоксифенил]-N-(5 хлор(2-пиридилкарбоксамида или его фармацевтически приемлемой соли или антагониста P2Y12 рецептора присутствует в субтерапевтической дозе. Краткое описание чертежей Фиг. 1 и 2 показывают корреляцию концентрации соединения А в плазме и ингибирования образования тромбина в исследованиях на людях. Фиг. 3 показывает корреляцию концентрации соединения А в плазме и количества антифактор Ха единиц в исследованиях на людях. Подробное описание изобретения Это изобретение относится к способам и композициям для лечения состояния у млекопитающего,характеризующегося нежелательным тромбозом, с использованием комбинации соединения А с антагонистом P2Y12 рецептора. Перед более подробным описанием данного изобретения будут определены нижеследующие термины.I. Определения. Должно быть отмечено, что при использовании здесь и в формуле изобретения единственного числа также подразумевается и множественное число, если только не указано обратное. Так, например, указание на "фармацевтически приемлемый носитель" в композиции включает два или более фармацевтически приемлемых носителя и т.д. Далее должно быть отмечено, что классификация определенных терапевтических средств, основанная на их предполагаемом использовании или механизмах действия, базируется на общих знаниях специалиста в данной области техники и имеет целью лишь классификацию. Имеющиеся в виду механизмы не предполагает использовать как ограничение для терапевтических средств, если только контекст прямо не указывает на обратное. Некоторые терапевтические средства могут действовать по двум и более механизмам или могут быть применены для лечения двух или более заболеваний. Также должно быть понятно, что определенные средства, названные в каждой категории, приведены в качестве примеров и не предполагаются быть ограничивающими границы настоящего изобретения. Термин "включает" означает, что композиции и способы включают перечисленные элементы, но не исключает другие. "Состоящий по существу из", когда используется для определения композиций и способов, должен обозначать исключение других каких-либо существенно значимых элементов в комбинации для предполагаемого использования. Так, композиция, состоящая по существу из элементов, как определено в описании, не будет исключать микропримеси после методов получения и очистки и фармацевтически приемлемых носителей, таких как фосфатно-буферный физиологический раствор, консерванты и т.п. "Состоящий из" должно означать исключение более чем следовых количеств других ингредиентов и существенные методические шаги для контроля композиции по настоящему изобретению. Способы осуществления, определенные каждым из этих переходных терминов, находятся в границах настоящего изобретения. Изобретение предоставляет способы для лечения заболевания у млекопитающих, характеризующегося нежелательным тромбозом, с применением комбинированной терапии соединением А и другими терапевтическими средствами. "Лечить" или "лечение" заболевания или патологического состояния у пациентов относится к 1) предотвращению заболевания или патологического состояния у млекопитающих, в частности млекопитающего, которое предрасположено или пока не обнаруживает симптомов заболевания или патологического состояния; 2) подавление заболевания или патологического состояния или торможение его развития; или 3) улучшение или вызывание регрессии заболевания или патологического состояния. Термин "млекопитающее" включает организмы, которые экспрессируют фактор Ха. Примерами"млекопитающих" являются мыши, крысы, коровы, овцы, свиньи, козы, лошади, медведи, обезьяны, собаки, кошки и преимущественно человек. Трансгенные организмы, которые экспрессируют фактор Ха,-3 020531 также включены в это определение. Термин "заболевание, характеризующееся нежелательным тромбозом" относится, но не ограничивается, к любому из: (а) тромботически опосредованный острый коронарный синдром, включая инфаркт миокарда, нестабильная стенокардия, рефрактерная стенокардия, окклюзионный коронарный тромб, возникающий после тромболитической терапии или после коронарной ангиопластики; (б) тромботически опосредованный цереброваскулярный синдром, включая эмболический инсульт, тромботический инсульт или преходящее ишемическое нарушение мозгового кровообращения; (в) тромботический синдром, возникающий в венозной системе, включая тромбоз глубоких вен или легочный эмбол, возникающий либо спонтанно, либо вследствие злокачественного новообразования, хирургического вмешательства или травмы; (г) коагулопатия, включая синдром диссеменированного внутрисосудистого свертывания(включая вызванный септическим шоком или другой инфекцией, хирургическим вмешательством, беременностью, травмой или злокачественным образованием, связанный или нет с функциональной недостаточностью многих органов), тромботическая тромбоцитопеническая пурпура, облитерирующий тромбоангиит, или тромботическое заболевание, ассоциированное с индуцированной гепарином тромбоцитопенией; (д) тромботические осложнения, связанные с экстракорпоральной циркуляцией (например, гемодиализ, искусственное кровообращение или другая процедура насыщения кислородом, плазмофорез); (е) тромботические осложнения, связанные с применением технических средств в лечении (например, сердечная или другая интраваскулярная катетеризация, внутриаортальный баллон, коронарный стент или сердечный клапан); (ж) осложнения, связанные с соединительными частями протезов."Терапевтически эффективное количество" означает количество соединения А или совместно введенного терапевтического средства по настоящему изобретению, которое является эффективным для лечения целевого заболевания или состояния, при введении в комбинации. В некоторых вариантах осуществления терапевтически эффективное количество является количеством каждого средства в комбинации, достаточного для комбинированной терапии для эффективного улучшения, лечения или предупреждения нежелательного тромбоза. Подразумевается, что в некоторых вариантах осуществления терапевтически эффективное количество одного или всех средств в комбинированной терапии является более низким, чем количество, необходимое для получения того же терапевтического эффекта, когда средства используются по отдельности. Терапевтически эффективное количество будет изменяться в зависимости от конкретной комбинации, объекта и заболевания, подлежащего лечению, веса и возраста объекта, тяжести заболевания, необходимого режима дозирования, времени введения, способа введения и т.п. факторов, которые могут быть легко определены специалистом в данной области техники."Субтерапевтическая дозировка" относится к дозировке, которая является более низкой, чем оптимальная дозировка для терапевтического средства, когда оно используется как единственное средство, но при использовании в описанных комбинациях обеспечивает терапевтический результат."Антитромбоцитарное средство" или "ингибитор тромбоцитов" - это средства, которые блокируют образование кровяного сгустка посредством предупреждения агрегации тромбоцитов. Существует несколько классов антитромбоцитарных средств на основании их активности, включая антагонисты P2Y12 рецептора, такие как клопидогрел (Plavix), тиклопидин (Ticlid), кангрелор, тикагрелор (известный также как AZD 6140) и прасугрел (известный также как CS-747 и LY640315). Термин "фармацевтически приемлемая соль" обозначает соли активных соединений, которые получены с относительно нетоксичными кислотами или основаниями, в зависимости от определенных замещающих групп, в определенных терапевтических средствах, описанных здесь. Когда описанные в изобретении терапевтические средства содержат относительно кислые функциональные группы, соли присоединения основания могут быть получены реакцией нейтральной формы такого соединения с достаточным количеством желаемого основания как в чистом виде, так и в подходящем инертном растворителе. Примеры солей, образованных из фармацевтически приемлемых неорганических оснований, включают алюминиевую, аммониевую, кальциевую, медную, железную, железистую, литиевую, магниевую,марганцевую, марганцеватистую, калийную, натриевую, цинковую и т.п. Соли, образованные из фармацевтически приемлемых органических оснований, включают соли первичных, вторичных и третичных аминов, включая замещенные амины, циклические амины, встречающиеся в природе амины и т.п., такие как аргинин, бетаин, кафеин, холин, N,N'-дибензилэтилендиамин, диэтиламин, 2-диэтиламиноэтанол, 2 диметиламиноэтанол, этаноламин, этилендиамин, N-этилморфолин, N-этилпиперидин, глюкамин, глюкозамин, гистидин, гидрабамин, изопропиламин, лизин, метилглюкамин, морфолин, пиперазин, пиперидин, полиаминовые смолы, прокаин, пурины, теобромин, триетиламин, триметиламин, трипропиламин,трометамин и т.п. Когда описанные в изобретении терапевтические средства содержат относительно основные функциональные группы, соли присоединения кислоты могут быть получены реакцией нейтральной формы такого соединения с достаточным количеством желаемой кислоты, как в чистом виде, так и в подходящем инертном растворителе. Примеры фармацевтически приемлемых солей присоединения кислоты включают соли, образованные из неорганических солей, таких как соляная, бромисто-водородная, азотная, угольная, моногидрокарбонатная, фосфорная, моногидрофосфорная, дигидрофосфорная, серная,гидройодноватая или фосфористые и т.п. кислоты, а также соли, полученные из относительно нетоксич-4 020531 ных органических кислот, таких как уксусная, пропионовая, изомасляная, малоновая, бензойная, янтарная, субериновая, фумаровая, миндальная, фталовая, бензолсульфоновая, р-толилсульфоновая, лимонная,винная, метансульфоновая и т.п. Примеры включают также соли аминокислот, такие как аргинат и т.п., и соли таких органических кислот, как глюкуроновая или галактуроновая кислоты и т.п. (см., например,Berge, S.М., et al., "Pharmaceutical Salts", Journal of Pharmaceutical Science, 1977, 66: 1-19). Определенные специфические терапевтические соединения содержат как основные, так и кислотные функциональные группы, что позволяет преобразовать эти соединения либо в щелочные, либо в соли присоединения оснований или кислот. Определенные предпочтительные формы солей для соединения А описаны в патентной заявке US 2007/0112039, в которой заявлен приоритет предварительной патентной заявки US No. 60/735224 от 8 ноября 2005 г., обе заявки включены в настоящее изобретение посредством ссылки. В частности, эти две патентные заявки описывают, что соединение А образует соли с кислотой. Кислота преимущественно выбрана из группы, включающей соляную, молочную, малеиновую, феноксиуксусную, пропионовую,янтарную, адипиновую, аскорбиновую, камфорную, глюконовую, фосфорную, винную, лимонную, метансульфоновую, фумаровую, гликолевую, нафтален-1,5-дисульфоновую, гентизиновую и бензолсульфоновую. В одном варианте осуществления кислота выбрана из группы, состоящей из соляной, молочной, малеиновой, феноксиуксусной, пропионовой и янтарной кислот. В другом варианте осуществления кислота является малеиновой. При ссылке на солевую форму соединения А применяется ионная соль. Например, если формой соединения А является соль малеиновой кислоты, соль упоминается как малеиновая соль. Один предпочтительный вариант применения малеиновой соли соединения А является формулой I Кроме того, соль по формуле I может быть в виде кристаллического полиморфа, как описано в публикации патента US 2007/0112039. Одна кристаллическая полиморфная форма формулы I демонстрирует на порошковой дифракционной рентгенограмме паттерн по крайней мере с четырьмя и преимущественно восемью из нижеследующих примерных характерных расположений пиков: 4,9, 9,7, 13,8, 14,1, 15,2,17,6, 18,5, 20,8, 21,6, 22,7, 24,1, 26,3, 26,8 градусов 2. В наиболее предпочтительной кристаллической полиморфной форме, порошковая рентгенограмма которой имеет следующее примерное характерное расположение пиков: 4,9, 9,7, 11,8, 13,8, 14,1, 15,2, 17,6, 18,5, 19,9, 20,8, 21,6, 22,7, 24,1, 25,0, 26,3, 26,8 градусов 2. Нейтральные формы этих терапевтических средств могут быть восстановлены путем осуществления контакта соли с основанием или кислотой и выделения исходного терапевтического средства обычным способом. Исходная форма терапевтического средства отличается от различных его солей некоторыми физическими свойствами, такими как растворимость в полярных растворителях, но в остальном соли эквивалентны исходной форме терапевтического средства с точки зрения целей настоящего изобретения. Некоторые терапевтические средства по настоящему изобретению могут существовать как в несольватированных, так и в сольватированных формах, включая гидратированные формы. Как правило,сольватированные формы эквивалентны несольватированным формам и подразумеваются лежащими в границах настоящего изобретения. Некоторые терапевтические средства по настоящему изобретению могут существовать как в множественно-кристаллической, так и в аморфной форме. Как правило, все физические формы эквивалентны для применений, рассматриваемых в настоящем изобретении, и подразумеваются лежащими в границах настоящего изобретения."Фармацевтически приемлемый носитель" относится к любому растворителю, наполнителю или носителю, который может быть использован в композиции по изобретению. Фармацевтически приемлемые носители включают ионообменные смолы, оксид алюминия, стеарат алюминия, лецитин, сывороточный белок, такой как человеческий сывороточный альбумин, буферные растворы, такие как фосфаты,глицин, сорбиновая кислота, сорбат калия, неполные глицеридные смеси насыщенных растительных жирных кислот, вода, соли или электролиты, такие как протаминсульфат, натрия фосфат двузамещенный, дикалийфосфат, хлорид натрия, соли цинка, коллоидный оксид кремния, трисиликат магния, поли-5 020531 винилпироллидон,субстанции на основе целлюлозы,полиэтиленгликоль,натрийкарбоксиметилцеллюлоза, полиакрилаты, воски, полимеры полиэтилен-полиоксипропилен блоков, полиэтиленгликоль и ланолин. Фармацевтически приемлемые носители описаны в Remington's PharmaceuticalSciences, Mack Publishing Company, стандартном референсном тексте для данной области техники. Они преимущественно выбираются, принимая во внимание предполагаемую форму введения, а именно, пероральные таблетки, капсулы, эликсиры, сиропы и т.п., и согласуются с общепринятой фармацевтической практикой.II. Подробное описание вариантов осуществления. Настоящее изобретение предоставляет новые способы лечения заболеваний у млекопитающих, характеризующиеся нежелательным тромбозом, включая введение указанному млекопитающему терапевтически эффективного количества соединения А, имеющего следующую химическую формулу:[2-(4-[(диметиламино)иминометил]фенилкарбониламино)-5 метоксифенил]-N-(5-хлор(2-пиридилкарбоксамид или его фармацевтически приемлемой соли и терапевтически эффективного количества другого терапевтического средства. Другое терапевтически эффективное средство является антитромбоцитарным средством антагонистом P2Y12 рецептора. В некоторых вариантах осуществления антитромбоцитарным средством является клопидогрел. В некоторых вариантах осуществления по крайней мере одно из терапевтических средств введено в субтерапевтической дозе. В некоторых вариантах осуществления оба терапевтических средства введены в субтерапевтических дозах. В некоторых вариантах осуществления оба терапевтических средства введены одновременно. В некоторых вариантах осуществления оба терапевтических средства введены последовательно. В некоторых вариантах осуществления фармацевтически приемлемая соль [2-(4[(диметиламино)иминометил]фенилкарбониламино)-5-метоксифенил]-N-(5-хлор(2 пиридилкарбоксамида является солью малеиновой кислоты. В некоторых вариантах осуществления с первой по четвертую группы вариантов осуществления патологические состояния выбраны из группы, включающей острый коронарный синдром, инфаркт миокарда, нестабильную стенокардию, рефрактерную стенокардию, окклюзионный коронарный тромб, наблюдающийся после тромболитической терапии или коронарной ангиопластики, тромботически опосредованный цереброваскулярный синдром, эмболический инсульт, тромботический инсульт, транзиторные ишемические атаки, венозный тромбоз, глубокий венозный тромбоз, легочный эмбол, коагулопатию,синдром диссеминированного внутрисосудистого свертывания, тромботическую тромбоцитопеническую пурпуру, облитерирующий тромбоангиит, тромботическое заболевание, связанное с гепарининдуцированной тромбоцитопенией, тромботические осложнения, связанные с искусственным кровообращением, тромботические осложнения связанные с применением технических средств в диагностике и лечении, и тромботические осложнения, связанные с соединительными частями протезов. Изобретение также относится к фармацевтическим композициям, включающим соединение, имеющее следующую формулу: которое имеет химическое название [2-(4-[(диметиламино)иминометил]фенилкарбониламино)-5 метоксифенил]-N-(5-хлор(2-пиридилкарбоксамид, другое терапевтическое средство, а именно антитромбоцитарное средство, которым является антагонист P2Y12 рецептора, и фармацевтически приемлемый носитель. В некоторых вариантах осуществления антитромбоцитарным средством является клопидогрел. В некоторых вариантах осуществления по крайней мере одно из терапевтических средств представлено в субтерапевтической дозе. В некоторых вариантах осуществления оба терапевтических средства представлены в субтерапевтических дозах. В некоторых вариантах осуществления фармацевтически приемлемая соль [2-(4[(диметиламино)иминометил]фенилкарбониламино)-5-метоксифенил]-N-(5-хлор(2-пиридилкарбоксамида является солью малеиновой кислоты. Изобретение также относится к набору, включающему:(1) первый контейнер, содержащий [2-(4-[(диметиламино)иминометил]фенилкарбониламино)-5 метоксифенил]-N-(5-хлор(2-пиридилкарбоксамид или его терапевтически приемлемую соль, и(2) второй контейнер, содержащий другое терапевтическое средство, представляющее собой антитромбоцитарное средство, а именно антагонист P2Y12 рецептора. В некоторых вариантах осуществления изобретение предоставляет набор, дополнительно включающий:(3) вкладыш в упаковку, сообщающий, что два терапевтических средства могут использоваться вместе. В некоторых вариантах осуществления терапевтически приемлемая соль[2-(4[(диметиламино)иминометил]фенилкарбониламино)-5-метоксифенил]-N-(5-хлор(2-пиридилкарбоксамида является солью малеиновой кислоты. В некоторых вариантах осуществления по крайней мере одно из терапевтических средств представлено в субтерапевтической дозе. В некоторых вариантах осуществления оба терапевтических средства представлены в субтерапевтических дозах.III. Комбинированная терапия. Настоящее изобретение предоставляет способы лечения заболеваний у млекопитающих, характеризующиеся нежелательным тромбозом, с использованием комбинации соединения А с другим терапевтическим средством. Было показано, что комбинация соединения А с антитромботическим средством, эптифибатидом, в концентрациях, которые сами по себе не производят значительного ингибирования тромбоза в экспериментальных условиях, имеет значительно усиленную антитромботическую активность (пример 4). Эксперименты на крысах показали более чем аддитивную антитромбротическую активность, когда применяется комбинация компонента А и антитромбоцитарного средства, такого как клопидогрел или аспирин, в субтерапевтических дозах (см. пример 5 и 11, 12). Пример 5 показывает синергизм между соединением А и клопидогрелом, антагонистом тромбоцитарного P2Y12 рецептора, в ингибировании артериального тромбоза у крыс. Пример 13 подтверждает антитромботический эффект двойного ингибирования фактора Ха и P2Y12 демонстрацией того, что значительно более низкие концентрации соединения А в плазме могли вызывать значительную отсрочку в тромбообразовании и времени окклюзии у мышей с дефицитом экспрессии P2Y12 на тромбоцитах в сравнении с концентрацией соединения А в плазме, необходимой для подобной отсрочки у мышей дикого типа. Было также предположено, что комбинация соединения А и инъекционного антикоагулирующего средства обеспечит превосходящие показатели безопасности для такого уровня антикоагуляции, приводя к лучшим клиническим результатам. Имеющиеся данные показывают, что комбинация антитромбоцитарного средства с антикоагулирующим средством (т.е. комбинация GP IIb/IIIa антагониста с нефракционированным гепарином или GPIIb/IIIa антагониста со специфическим ингибитором тромбина бивалирудином) приводит к неприемлемым уровням кровотечений у получавших лечение пациентов (Stone,G.W., et al., Bivalirudin in Patients with Acute Coronary Syndromes Undergoing Percutaneous Coronary Intervention: A Subgroup Analysis from the Acute Catheterization and Urgent Intervention Triage Strategy (ACUITY) Trial, Lancet, 2007, 369(9565):907-19). В исследовании по подбору дозы низкомолекулярного гепарина эноксапарина у пациентов с инфарктом миокарда сравнивались 1,0 и 125 мг/кг дозы этого антикоагулята. Даже небольшое изменение в дозировке (увеличение на 25%) приводит к неприемлемому уровню значительной геморрагии (Dose-ranging Trial of Enoxaparin for Unstable Angina: Results of TIMI 11A. TheThrombolysis in Myocardial Infarction (TIMI) 11A Trial Investigators, J. Am. Coll. Cardiol., 1997, 29(7):147482) и доза 1,25 мг/кг далее не исследовалась. Напротив, соединение А показало широкий диапазон дозирования (80 и 30 мг/день) в исследованиях II фазы клинических испытаний. В рандомизированном клиническом исследовании 215 пациентов ортопедической хирургии подверглись операции по замене колена, соединение А в дозах 30 и 80 мг/день было эффективным в предотвращении явлений венозной тромбоэмболии, таких как симптоматический или асимптоматический тромбоз глубоких вен и легочная эмболия. Больше о эффективных дозах соединения А может быть найдено в PCT/US2007/084887, от 15 ноября 2007 г., названной "Unit Dose Formulation and Methods of Treating Thrombosis with an Oral Factor Xa Inhibitor", ярлык поверенного 070545-1510. Уровень антитромботической эффективности был сравним в уровнем, достигаемым низкомолекулярным гепарином эноксапарином (пример 6) (Turpie, A.G., et al., AbstractP-T-652, XXIstCongress of the International Society of Thrombosis and Homeostasis, Geneva, July, 2007). В дополнение,данные клинических испытаний показали более широкие пределы безопасности, чем возможны у обычных антикоагулирующих средств. Последние данные, определяющие время кровотечения у обезьян, показывают, что терапевтические уровни соединения А (концентрация в плазме 5-25 нг/мл) не вызывают увеличения кровотечений (см. пример 7). Так, предполагается, что новая комбинация соединения А с существующим антитромбоцитарным средством ингибирует образование тромба в более широких пределах безопасности. Далее, в ситуациях, когда переходная терапия необходима для пациента, получающего парентерально антикоагулирующее средство, для перехода на пероральный антикоагулянт для постоянного приема, соединение А рассматривается как потенциальное переходное пероральное антикоагулирующее средство для применения в комбинации с низкомолекулярным гепарином или пентасахаридом. Далее предполагается, что комбинация соединения А и стандартного противовоспалительного средства обеспечивает превосходящий профиль эффективности для уменьшения уровня циркулирующих цитокинов, который может приводить к улучшенным терапевтическим ответам в заболеваниях, таких как атеросклероз, который, как известно, медиируется воспалительными стимулами. Пероральные антикоагулянты, такие как варфарин, не способны уменьшать уровень циркулирующих маркеров воспаления и обеспечивать системный эффект в сосудистой сети. Сообщалось, что фактор Ха оказывает усиливающий эффект на воспалительную активность сигнала, опосредованного цитокином (PNAS) (Hezi-Yamit, A. et al., Synergistic Induction of Tissue Factor by Coagulation Factor Xa and TNF: Evidence for Involvement of Negative Regulatory Signaling Cascades, Proc.Nat'l. Acad. Sci. USA, 2005 102 (34):12077-82). Ферменты пути свертывания крови усиливают воспалительный ответ, приводящий к эндотелиальной дисфункции, отвечающей, частично, за сосудистые осложнения, возникающие при сепсисе и сердечно-сосудистых заболеваниях. Ответы активации эндотелиальных клеток включают индукцию экспрессии тканевого фактора, мембранного гликопротеина, который усиливает тромбоз, и Е-селектина, молекулы клеточной адгезии, которая усиливает воспаление. Было показано, что синергистические взаимодействия между фактором Ха и провоспалительными цитокинами, фактором некроза опухолей, интерлейкином 1 или CD40L, усиливает экспрессию тканевого фактора и Е-селектина в эндотелиальных клетках (PNAS). Эти синергистические взаимодействия приводят к амплификации цитокин-индуцированной воспалительной активности, такой как активация эндотелиальных клеток. Однако соединение А, ингибитор фактора Ха, не оказывает статистически достоверного эффекта на уменьшение количества цитокинов, высвобожденных из клеток крови в ex vivo системе цельной крови человека при одиночном применении. Удивительно, когда соединение А было добавлено к крови доноров, получавших аспирин, оно вызвало дополнительное подавление высвобождения цитокинов по сравнению с таковой, вызванной одним аспирином, в зависимости от дозы (см. пример 9). Это показывает,что комбинация соединения А с противовоспалительным средством имеет потенциал достижения дополнительного противовоспалительного терапевтического преимущества, поскольку цитокины относятся к основным медиаторам воспаления. Далее предполагается, что у пациентов, получающих лечение в связи с мерцательной аритмией,препараты, понижающие кровяное давление, такие как бета-блокаторы или блокаторы кальциевых каналов, и соединение А могут применяться одновременно. Препараты подобные верапамилу известны как ингибиторы функции р-гликопротеина. Соединение А в in vitro экспериментах было определено как субстрат для р-гликопротеина. Как ожидалось, экспериментальные результаты по настоящему изобретению на собаках с телеметрией с использованием комбинации соединения А и верапамила показали, что концентрации соединения А в плазме у собак с двойным лечением были примерно в два раза выше, чем в случае одиночного лечения. Однако соединение А не привело к изменениям в давлении крови при совместном введении с верапамилом, что является свидетельством того, что соединение А может безопасно применяться совместно со средствами, понижающими кровяное давление, такими как верапамил. См. пример 10. Соответственно, было предположено, что способ лечения с использованием комбинации соединения А и другого терапевтического средства не произведет нежелательных взаимодействий препаратов или дополнительных побочных действий. Далее было предположено, что комбинация может предложить преимущества в эффективности или безопасности по сравнению с применением средств по одному и/или произвести синергический эффект. Синергизм может относиться к увеличению антитромботической эффективности, улучшению профиля безопасности или к другим положительным эффектам комбинации по сравнению с индивидуальными средствами. Случается, что терапевтический эффект компонентов при введении в комбинации выше, чем аддитивный эффект компонентов при введении по одному. В таком случае, терапевтически эффективное количество средств в комбинированной терапии может быть ниже,чем эффективное или оптимальное количество, необходимое, когда средства применяются по одному. Было предположено, что более низкие дозы будут минимизировать потенциальные побочные действия средств, таким образом, приводя к улучшенному профилю безопасности. Так, комбинация предпочтительно позволяет применять одно из терапевтических средств в субтерапевтической дозе. В одном варианте осуществления комбинация позволила применить оба терапевтических средства в субтерапевтических дозах. Соединение А и другое терапевтическое средство могут быть помещены в две отдельные терапевтические композиции. Они могут быть введены в одно время или последовательно в любом порядке. Предпочтительно при последовательном введении два средства должны быть введены довольно близко по времени, чтобы желаемый терапевтический эффект был достигнут. Соединение А и другое терапевтическое средство могут также быть помещены в одну фармацевтическую композицию. Соединение А и два других терапевтических средства могут также быть введены в одно время или последовательно в любом порядке. Предпочтительно при последовательном введении три средства должны быть введены довольно близко по времени, чтобы желаемый терапевтический эффект был достигнут. Они также могут быть помещены в одну фармацевтическую композицию, или любые два из них могут быть помещены в одну фармацевтическую композицию.IV. Композиция и дозировка. Настоящее изобретение дополнительно предоставляет новую композицию, включающую соединение А или его фармацевтически приемлемую соль, другое терапевтическое средство и фармацевтически приемлемый носитель. Фармацевтическая композиция по настоящему изобретению может быть произведена способами,хорошо известными специалисту в данной области техники, такими как общеупотребительные гранулирование, перемешивание, растворение, заключение в капсулу, лиофилизирование или процессы эмульгирования, в числе других. Композиции могут быть получены в различных формах, включая гранулы,осадки, аэрозоли, порошки, включая высушенные замораживанием, высушенные на роторе или распылительной сушке порошки, аморфные порошки, таблетки, капсулы, сиропы, суппозитории, инъекции,эмульсии, эликсиры, суспензии или растворы. Формулировка может опционально содержать стабилизаторы, рН модификаторы, сурфактанты, модификаторы биодоступности и их комбинации. Фармацевтические композиции могут быть приготовлены в качестве жидких суспензий или растворов с использованием стерильной жидкости, такой как масло, вода, алкоголь и их комбинации. Фармацевтически приемлемые сурфактанты, суспендирующие вещества или эмульгирующие вещества могут быть добавлены для перорального или парентерального введения. Суспензии могут содержать масла,такие как ореховое масло, кунжутное масло, льняное масло, кукурузное масло и оливковое масло. Суспензионные препараты могут также содержать эфиры жирных кислот, такие как этилолеат, изопропилмиристат, глицериды жирных кислот и ацетилированные глицериды жирных кислот. Составы суспензий могут содержать алкоголь, такой как этанол, изопропиловый спирт, гексадециловый спирт, глицерол и пропиленгликоль. Эфиры, такие как поли(этиленгликоль), углеводороды нефти, такие как минеральное масло и вазелин, и вода также могут быть использованы при изготовлении суспензий. Композиции по этому изобретению составлены для фармацевтического введения млекопитающим,преимущественно человеку. Такие фармацевтические композиции по изобретению могут быть введены перорально, парентерально, в виде игалационного спрея, местно, ректально, назально, буккально, вагинально или посредством имплантированного резервуара. Термин "парентерально", как используется здесь, включает подкожные, внутривенные, внутримышечные, внутрисуставные, внутрисиновиальные,надчревные, интратекальные, внутрипеченочные, вводимые в пораженные ткани и внутричерепные инъекции или инфузионные техники. Преимущественно, композиции вводятся перорально или внутривенно. Препаративные формы по изобретению могут быть изготовлены как быстродействующие, быстровысвобождающиеся, длительного действия, отсроченного высвобождения. Более того, соединения могут быть введены локально, а не системно, а именно введение (т.е. инъекция) как составы с отсроченным высвобождением. Стерильные инъекционные формы композиций по этому изобретению могут быть водными или масляными суспензиями. Эти суспензии могут быть сформулированы в соответствии с техниками, известными специалисту в данной области техники, с использованием подходящих диспергирующих или смачивающих средств и суспендирующих средств. Стерильные инъекционные препараты могут также быть стерильными инъекционными растворами или суспензиями в нетоксичном парентерально приемлемом разбавителе или растворителе, например как раствор в 1,3-бутандиоле. Среди приемлемых наполнителей и растворителей, которые могут быть использованы, присутствуют вода, раствор Рингера и изотонический раствор хлорида натрия. В дополнение, стерильные, нелетучие масла традиционно используются в качестве растворителя или суспендирующей среды. Для этих целей любое легкое нелетучее масло может быть использовано, включая синтетические моно- или диглицериды. Жирные кислоты, такие как олеиновая кислота и ее глицеридные производные, применяются в приготовлении инъекций,также как и натуральные фармацевтически приемлемые масла, такие как оливковое масло и касторовое масло, особенно в их полиоксиэтилированных вариантах. Эти масляные растворы или суспензии могут также содержать длинноцепочечный спиртовой растворитель или дисперсант, такой как карбоксиметилцеллюлоза или сходное диспергирующее средство, которое широко используется в фармацевтически приемлемых дозированных формах, включая эмульсии и суспензии. Другие широко приемлемые сурфактанты, такие как твины, спаны и другие эмульсифицирующие средства или усилители биологической доступности, которые широко используются в производстве фамацевтически приемлемых твердых тел,жидкостей или других дозированных форм, могут также быть использованы в препаративных формах. Соединения могут быть изготовлены для парентерального введения инъекциями, такими как инъекция болюса или непрерывная инфузия. Единицы дозированных форм могут быть ампулами или мультидозовыми контейнерами. Фармацевтические композиции по этому изобретению могут быть в любой перорально приемлемой форме, включая капсулы, таблетки, водные растворы или суспензии. В случае таблеток для перорального применения носители, которые обычно используются, включают лактозу и кукурузный крахмал. Смазывающие вещества, такие как стеарат магния, также обычно добавляются. Для капсульной формы пригодные растворители включают лактозу и высушенный кукурузный крахмал. Когда для перорального применения необходимы водные суспензии, активные ингредиенты комбинируются с эмульсифицирующими и суспендирующими средствами. По желанию, определенные подсластители, ароматизаторы и окрашивающие средства могут быть также добавлены. Альтернативно, фармацевтические композиции по этому изобретению могут быть в форме суппозиториев для ректального введения. Они могут быть приготовлены путем смешивания средства с подходящим нераздражающим инертным наполнителем, который является твердым при комнатной температуре и вследствие этого будет плавиться в прямой кишке для высвобождения лекарства. Такие материалы включают масло какао, пчелиный воск и полиэтиленгликоли. Фармацевтические композиции по этому изобретению могут также быть в форме для местного применения, особенно когда мишень включает области или органы легко доступные для местного нанесения, включая заболевания глаз, кожи или нижнего интерстинального тракта. Подходящие местные препаративные формы быстро приготавливаются для каждого из этих областей и органов. Местные аппликации для нижнего интерстициального тракта могут быть выполнены в форме ректального суппозитория (см. выше) или в подходящей форме клизмы. Местно-трансдермальные пластыри могут также применяться. Для местных аппликаций фармацевтические композиции могут быть сформулированы в виде подходящей мази, содержащей активное вещество, суспендированное или растворенное и в одном или более носителе. Носители для местного нанесения соединений по этому изобретению включают, но не лимитируются, минеральное масло, вазелиновое масло, белый вазелин, пропиленгликоль, полиоксиэтилен, полиоксипропилен, эмульгирующий воск и воду. Альтернативно, фармацевтические композиции могут быть разработаны в виде подходящего лосьона или крема, содержащего активный компонент, суспендированный или растворенный в одном или более фармацевтически приемлемых носителей. Подходящие носители включают минеральное масло, сорбитмоностеарат, полисорбат 60,сложные эфиры, воск, сложный спирт, 2-октилдодеканол, бензиловый спирт и воду. Для офтальмологического использования фармацевтические композиции могут быть разработаны как микронизированные суспензии в изотоническом, рН-доведенном стерильном физиологическом растворе, или, предпочтительно, как растворы в изотоническом, рН-доведенном стерильном физиологическом растворе, как с так и без консервантов, таких как бензилалкониум хлорид. Альтернативно, для офтальмологического использования фармацевтические композиции могут быть приготовлены в мази, такие как вазелин. Фармацевтические композиции по настоящему изобретению могут также вводиться в виде назального аэрозоля или ингаляции. Такие композиции приготовляются в соответствии с методиками, известными в области технологии приготовления лекарственных средств, и могут быть приготовлены как растворы в салине, с применением бензилового спирта или другого подходящего консерванта, активатора абсорбции для усиления биодоступности, фторуглеродов и/или других традиционных солюбилизирующих или диспергирующих средств. Любая из вышеприведенных лекарственных форм, содержащая эффективные количества, охватывается объемом настоящего изобретения. Терапевтически эффективные дозы могут варьировать в зависимости от способа введения и формы дозирования. Предпочтительная комбинация по изобретению является составом, который показывает высокий терапевтический индекс. Терапевтическим индексом является соотношение доз между токсическим и терапевтическим эффектами, которые могут быть выражены как соотношение между LD50 и ED50. Доза LD50 является летальной для 50% популяции, и дозаED50 является терапевтически эффективной для 50% популяции. LD50 и ED50 определяются в стандартных фармацевтических процедурах на культурах животных клеток или экспериментальных животных. Комбинированная терапия по настоящему изобретению может вводиться как единственная дневная доза или может быть введена дважды, трижды или четырежды в день. Обычно, около 0,5-500 мг соединения А или соли или смеси солей соединения А смешивается с физиологически приемлемым наполнителем, носителем, инертным наполнителем, связывающим веществом, консервантом, стабилизатором, красителем, ароматизатором и так далее, как предусмотрено в принятой фармацевтической практике. Когда соединение А и средство для совместного введения помещаются в единую фармацевтическую композицию, примерно 0,5-500 мг средства для совместного введения добавляется в композицию. Количество активного ингредиента(ов) в данных композициях таково, что достигается подходящая дозировка в рамках, указанных выше. Предполагается, что типичная дозировка соединения А в такой комбинированной терапии будет варьироваться от примерно 0,001 до примерно 1000 мг/кг, предпочтительно от примерно 0,01 до примерно 2,0 мг/кг и более предпочтительно от примерно 0,1 до примерно 1,5 мг/кг, еще более предпочтительно от примерно 0,4 до примерно 1,2 мг/кг. И еще более предпочтительно дозировка соединения А в комбинации ниже 0,5 мг/кг. Дозировка других терапевтических средств при использовании одних является хорошо известной или может быть легко получена специалистом в данной области техники. Предполагается, что дозировка этих средств при использовании в комбинации с соединением А не будет превышать максимальную дозировку индивидуальных средств. Предпочтительно, чтобы дозировки в комбинированной терапии были меньше максимальных дозировок, и наиболее предпочтительно, чтобы дозировки в комбинированной терапии были субтерапевтическими дозировками. Предполагается, что дозировки соединения А или других терапевтических средств могут быть отрегулированы для отражения синергизма комбинированной терапии, что может быть определено специалистом в данной области техники, основываясь на предоставленной здесь информации. В дополнение к дозированным формам, описанным ранее, фармацевтически приемлемые наполнители и носители и дозированные формы обычно известны специалисту в данной области техники и включены в изобретение. Должно быть понятно, что специфические дозировки и схемы лечения для любого конкретного пациента будут зависеть от множества факторов, включая активность специфических компонентов, включенных в комбинацию, возраст, вес тела, общее здоровье, пол и диета, функцию почек и печени пациента, время введения, уровень выделения, комбинации с другими лекарствами, суждений лечащего врача или ветеринара, и серьезности конкретного заболевания, подлежащего лечению. Количество активных ингредиентов будет также зависеть от терапевтического средства, комбинированного с соединением А.V. Наборы. Изобретение дополнительно предоставляет новый набор или упаковку. Набор по настоящему изобретению включает: (а) первый контейнер, содержащий соединение А или его фармацевтически приемлемую соль, и (б) второй контейнер, содержащий другое терапевтическое средство. В некоторых вариантах осуществления набор дополнительно содержит (в) вкладыш в упаковку, заявляющий, что два терапевтических средства могут быть использованы вместе для лечения патологических состояний, характеризующихся нежелательным тромбозом. В некоторых других вариантах осуществления набор также включает третий контейнер, содержащий третье терапевтическое средство и может дополнительно включать вкладыш в упаковку, заявляющий, что три терапевтических средства могут быть использованы вместе для лечения патологических состояний, характеризующихся нежелательным тромбозом. Первый, второй и/или третий контейнер могут быть бутылкой, банкой, пузырьком, флаконом,шприцем, пробиркой, сумкой или любым другим контейнером, применяемым в производстве, хранении и распространении фармацевтических продуктов. Вкладыш в упаковку может быть этикеткой, биркой,маркировкой и т.п., что перечисляет информацию, относящуюся к фармацевтической композиции набора. Перечисленная информация обычно определяется органами государственного регулирования, руководящими в регионе, в котором продается фармацевтическая композиция, такими как, например, Управление по контролю за продуктами и лекарствами в США. Преимущественно, вкладыш в упаковку специфически перечисляет показания, для которых фармацевтическая композиция одобрена. Вкладыш в упаковку может быть сделан из любого материала, на котором человек может прочитать содержащуюся информацию. Преимущественно, вкладыш в упаковку является печатным материалом, таким как бумага,липкая бумага, картон, пленка, пластик или т.п., на котором желаемая информация напечатана или нанесена.VI. Примеры. Если не указано обратного, сокращения, используемые на протяжении описания изобретения, имеют следующие значения: доведена до 22 С (19-25 С) и добавлен безводный пиридин (30,0 кг, 3,0 экв.). Насос и шланги были промыты ацетонитрилом (22,5 кг, 0,9 частей), реакционная смесь была доведена до температуры 19-22 С. Хлорокись фосфора (23,3 кг, 1,20 экв.) была помещена в реактор с помощью дозирующего насоса при поддержании температуры 25 С (22-28 С). Дозирующий насос и шланги были промыты ацетонитрилом(12,5 кг, 0,5 частей) при температуре 25 С (22-28 С). Реакционная смесь обычно превращается из взвеси в прозрачный раствор после добавления примерно 1/3 POCl3. В конце добавления он становится мутной. После полного добавления реакционная смесь перемешивалась при 25 С (22-28 С) в течение примерно 1 ч, это является временем, для которого завершение реакции было подтверждено ВЭЖХ анализом. Раствор был охлажден до 15 С (12-18 С) и медленно добавлена питьевая вода (156,3 кг, 6,25 частей) при поддержании температуры реакции 12-30 С. Реакционная смесь была затем доведена до 22 С (19-25 С) и перемешивалась в течение примерно 5 ч до прекращения экзотермического процесса. Образование взвеси было визуально подтверждено и содержимое реактора было отфильтровано через нутч-фильтр давления с фильтровальной бумагой. Реактор, насос и шланги были промыты в направлении нутч-фильтр давления двумя порциями питьевой воды (62,5 кг, 2,5 частей каждая). Полученный фильтрат имел рН 7. Продукт (41,8 кг) был высушен под вакуумом при максимальной температуре водяной бани 50 С (для нагрева кожуха сушки). После примерно 12 ч внутрипроцессный LOD анализ показал содержание растворителя на уровне 0,72%. Сухой продукт (3) (34,4 кг) был получен с выходом 88,2% и чистотой 99,1% по ВЭЖХ. Стадия 2. В 780-л реактор Hastelloy были добавлены соединение 3 (33 кг, 1,0 экв.), 5% платиновый углерод(сернистый, 0,33 кг, 0,010 частей) и дихлорметан (578 кг, 17,5 частей). Перемешивание было начато и содержимое реактора было доведено до 22 С (19-25 С). Ректор находился под избыточным давлением водорода примерно 30 psi, и реационная смесь медленно нагрелась до 28 С (25-31 С). Гидрогенизация содержимого реактора была проведена при примерно 30 psi и 28 С (25-31 С; максимум 31 С) до полного прекращения реакции по ВЭЖХ. После 16,5 ч реакция была признана завершенной после подтверждения исчезновения стартового материала (0,472%). Содержимое реактора прокачано через обработанный целитовый блок (0,2-0,5 кг целита обработанного 20-55 кг дихлорметана), помещенный в 8-дюймовый металлический фильтр, для удаления платинового катализатора. Реактор и целитовое основание были промыты двумя порциями дихлорметана (83 кг, 2,5 частей каждая). Фильтрат был перемещен и концентрирован в 570 л GLMS реактор при атмосферном давлении примерно до 132 л (объем 4 частей). Этанол (69 кг, 2,1 частей) был добавлен, и концентрирование продолжено при атмосферном давлении до примерно 99 л (объем 3 частей). Внутрипроцессный ЯМР показал, что содержание дихлорметана было 39%. Этанол (69 кг, 2,1 частей) загружали снова и концентрацию доводили до 99 л (3 об.ч.). Внутрипроцессный ЯМР показал, что содержание дихлорметан было 5%. Далее реакционная смесь была доведена до 3 С (06 С), перемешивалась примерно 1 ч, результирующая смесь профильтрована в нутч-фильтр давления с кожухом с фильтровальной бумагой. Реактор, насос и шланги были промыты холодным (3 С (0-6 С этанолом (26 кг, 0,8 частей). Мокрый отфильтрованный осадок (36,6 кг) был высушен под вакуумом при 40-50 С при максимальной температуре водяной бани 50 С (для нагрева кожуха сушки). LOD анализ после 12,5 ч показал 0,1% содержание растворителя. Сухой продукт (4) был получен (26,4 кг) с выходом 89,5%. ВЭЖХ показала чистоту 98,4%, с дехлорированной примесью 0,083%. Стадия 3. В 780-л реактор Hastelloy были добавлены 4-цианобензоил хлорид (5) (17,2 кг, 1,1 экв.) и THF (92 кг, 3,5 частей). Реакционная смесь перемешивалась при 22 С (19-25 С) до полного растворения твердых частиц. Результирующий раствор был перемещен в более низкий приемник и реактор был промыт THF(26 кг, 1 часть). Соединение 4 (26,4 кг, 1 экв.), THF (396 кг, 15 частей) и пиридин (2,90 кг, 0,4 экв.) было помещено в чистый реактор. Насос и шланги были промыты THF (34 кг, 1,3 частей). Через дозирующий насос 4-цианобензоил хлорид/THF раствор был добавлен в реактор, при поддержании температуры 30 С и последующей промывкой THF (примерно 10 кг). Результирующая взвесь, окрашенная в яркожелтый цвет, перемешивалась при 22 С (19-25 С) в течение примерно 2 ч. Внутрипроцессная ВЭЖХ,проведенная после 2 ч, показала содержание соединения 4 на уровне 0%, что указывает на завершение реакции. Взвесь была профильтрована через нутч-фильтр давления с фильтровальной бумагой. Реактор,насос, шланги и мокрый осадок были промыты тремя порциями этанола (примерно 15 кг каждая). Мокрый фильтровальный осадок был высушен под вакуумом при максимальной температуре теплой гликолевой бани 40 С (для нагрева кожуха сушки). После 14,5 ч сушки LOD был 0,75%. Высушенный материал был перемолот (сито 0,125 дюйм) для получения 31,8 кг соединения 6, которое сушилось под вакуумом еще 10,5 ч. LOD после сушки был 1,8%, и продукт (31,5 кг) был получен с выходом 74,8% (ожидаемый 60-90%). ВЭЖХ показала чистоту 100%. Стадия 4. Была приготовлена взвесь соединения 6 (455 г, 1,0 экв.) в THF (4,67 кг, 10,3 частей) и доведена до температуры 10 С. Диметиламид лития был получен следующим образом: литий гексил (2,3 N/гексан,2,45 л, 5,5 экв.) был добавлен к раствору диметиламина (2 N/THF, 2,8 л, 5,5 экв.) при поддержании температуры 10 С. Раствор димеиламида лития загружали в суспензию, содержащую соединение 6, под- 13020531 держивая температуру 10 С. Прогресс реакции наблюдался с помощью внутрипроцессной ВЭЖХ, которая подтвердила, что количество соединения 6 было 1,0%. Был приготовлен буферный раствор NaHCO3 (490 г, 1,1 частей, 5,7 экв.) и Na2CO3 (490 г, 1,1 частей, 4,5 экв.) в деионизированной воде (6,6 кг,14,51 частей), вышеописанная реакционная смесь была перемещена в этот водный раствор при поддержании температуры 5 С. Продукт выпал в осадок, и получившаяся взвесь была доведена до 20 С за период 12 ч. Осадок был отфильтрован, получившийся мокрый осадок был промыт 3,5 кг (7,7 частей) деионизированной воды. Осадок был отфильтрован с помощью настольного грубого фильтра из фриттированного стекла, последовательно промыт холодным (0-5 С) абсолютным этанолом (628 г, 1,4 частей). Полученное соединение А было высушено при 30-35 С. Сухой продукт был получен в количестве 458 г(выход 73%). Пример 2. Анализ ингибирования образования тромбина. В этом способе образцы плазмы человека, содержащие пептид gly-pro-arg-pro (Pefabloc FG, Centerchem) в качестве противосвертывающего средства, были обработаны тканевым фактором (Innovin, DadeBehring) для инициации образования тромбина. После 10 мин реакция была остановлена путем добавления EGTA. Хромогенный пептидный субстрат (Spectrozyme ТН, American Diagnostica), специфический для тромбина, был добавлен для измерения активности тромбина, образованного в течение периода обработки тканевым фактором. Реакция расщепления субстрата продолжалась 2 мин, а затем была подавлена путем добавления уксусной кислоты. Образцы плазмы были проанализированы в трех параллелях в формате 96-луночной плашки. Контрольные образцы, содержащие объединенную бедную тромбоцитами плазму с или без добавленным соединением А, были проанализированы в 4 параллелях на каждой чашке. Контрольные образцы были использованы для установления критериев приемлемости чашек. Абсорбция в каждой лунке с образцом была измерена при 405 нм. Образование тромбина (% ингибирования) был вычислен из абсорбции при 405 нм (А 405) по следующей формуле:% ингибирования=(1-А 405/нулевая линия)100. Нулевая линия в формуле была средней абсорбцией при 405 нм объединенной плазмы в отсутствие соединения А. Коэффициент вариаций (CV) как для контрольных, так и для клинических образцов был 20%. Поскольку значения ингибирования образования тромбина были представлены как проценты, для этого анализа нет нижних ограничений количественного подсчета. Фиг. 1 показывает % ингибирования образования тромбина для образцов плазмы человека от здоровых доноров, которым были введены единичные возрастающие дозы соединения А. Фиг. 2 показывает% ингибирования образования тромбина для образцов плазмы человека от здоровых доноров, которым были введены множественные возрастающие дозы соединения А. Эти фигуры показывают хорошую корреляцию между концентрациями соединения А в плазме и ингибированием образования тромбина. Пример 3. Анализ антифактор Ха единиц. Антифактор Ха анализ был адаптирован из коммерческого набора (Diapharma COATEST LMWHeparin) и модифицирован в 96-луночный формат. Низкомолекулярный гепарин, дальтепарин, включенный в набор, был использован для создания стандартной кривой в соответствии с рекомендациями производителя, используя объединенную бедную тромбоцитами плазму. Все образцы и стандарты были проанализированы в двух параллелях. Предел количественного определения был 0,05 U/мл и результаты ниже 0,05 U/мл считались ниже предела количественного определения. Верхний предел количественного определения для анализа на плашке был 1,0 U/мл, и образцы количеством антифактор Ха единиц выше 1,0 U/мл были проанализированы снова после разбавления. Коэффициент вариаций (CV) как для стандартов, так и для клинических образцов был 10%. Фиг. 3 показывает количество антифактор Ха единиц, образованное образцами плазмы от здоровых доноров, которым были введены множественные возрастающие дозы соединения А. Пример 4. Комбинация соединения А и эптифибатида, GP IIb/IIIa антагониста. Эксперименты в реальном времени в перфузионной камере были проведены для измерения, может ли антикоагулирование крови соединением А предоставлять дополнительную антитромботическую активность сверх той, что достигается терапевтическими дозами антитромботического средства эптифибатид, GP IIb/IIIa антагониста. Капилляры были покрыты смесью коллагена и тканевого фактора, и человеческая кровь, содержащая флуоресцентно меченный фибриноген (Alexa 546 labeled fibrinogen), была разбрызгана на покрытую поверхность с градиентом скорости сдвига 300 с-1. После разбрызгивания тромботическая активность была определена измерением образованного меченного фибрина, как результата расщепления фибриногена во время активации тромбоцитов и системы свертывания крови. Для этой серии экспериментов у пяти здоровых доноров кровь была получена пункцией вены и обработана 2,4 мкМ эптифибатида. Доза эптифибатида соответствует плазменным концентрациям, достигаемым терапевтическими концентрациями GPIIb/IIIa ингибитора. Табл. 1 показывает дозозависимое ингибирование тромбоза соединением А и эптифибатидом, анта- 14020531 гонистом тромбоцитарного GP IIb/IIIa рецептора, при разбрызгивании цельной человеческой крови на поверхность, покрытую коллагеном и тканевым фактором. Количественное определение флуоресцентно меченного фибриноген/фибрина показано для пяти доноров крови. Как показано в табл. 1, терапевтические концентрации антитромбоцитарного средства не достаточны для ингибирования тромбоза в условиях анализа. Однако ex vivo добавление ингибитора фактора Ха соединения А предоставляет дополнительную антитромботическую активность в зависимости от дозы. Таким образом, введение соединения А в качестве сопутствующего лекарственного средства во время применения антитромботических средств вероятно предоставит дополнительные преимущества в антитромботической эффективности. Таблица 1 Пример 5. Комбинация соединения А и клопидогрела, P2Y12 рецептор антагониста. Комбинированный эффект антиагреганта и антикоагулянта был исследован на in vivo модели тромбоза с использованием специфического антагониста P2Y12 рецептора, клопидогрела, который, как было показано, способен ингибировать ADP-индуцированную агрегацию тромбоцитов как для человеческих,так и для крысиных тромбоцитов. Эта хорошо охарактеризованная животная модель (Lockyer and Kambayashi, Demonstration of Flow and Platelet Dependency in a Ferric Chloride Induced Model of Thrombosis, J.Cardiovasc. Pharmacol. 1999, 33 (5):718-25) была ранее использована в тестировании и антикоагулирующих, и антитромбоцитарных средств. В этих экспериментах способность соединения А поддерживать проходимость сосудов в условиях артериального потока при тромбозе, индуцированном хлоридом железа, в сонной артерии крыс была сравнена с таковой, достигаемой с помощью клопидогрела. Соединение А было введено посредством внутривенной инфузии и клопидогрел был дозирован перорально в течение трех дней. Ex vivo агрегация тромбоцитов, индуцированная 10 мкМ ADP, и время свертывания крови(протромбиновое время, РТ и активированное частичное тромбопластиновое времена, аРРТ) были измерены в течение экспериментального времени (90 мин) у всех животных. Табл. 2 показывает, что в случае одиночного введения, соединение А производит дозозависимое ингибирование тромбоза, как измерено пропорцией животных, сонная артерия которых не закупорилась во время эксперимента. В частности, при концентрации соединения А 0,03 мкМ было достигнуто 30% ингибирование тромбоза у крыс (сонная артерия не закупорилась у 3 из 10 тестированных животных). В контрольных экспериментах с предозированием клопидогрела 1 мг/кг доза была необходима для 46% ингибирования ADP-индуцированной агрегации тромбоцитов в плазме, богатой тромбоцитами. Этот уровень ингибирования тромбоцитов примерно эквивалентен уровню, полученному в качестве эффекта клопидогрела на человеческих тромбоцитах в терапевтических дозах при клиническом применении (75 мг в день). Соответствующий уровень ингибирования тромбоза у крыс - 89% (сонная артерия не закупорилась у 8 из 9 тестированных животных). При субтерапевтических дозах клопидогрела (0,01 мг/кг), только 10% животных продемонстрировали эффективную антитромботическую активность (сонная артерия не закупорилась у 1 из 10 животных). Время до закупоривания было измерено у животных,которые продемонстрировали окклюзию. Как показано в табл. 3, комбинация 0,03 мкМ соединения А и 0,01 мг/кг клопидогрела, оба в субтерапевтических дозах, приводила к 70% ингибированию тромбоза у крыс (сонная артерия не закупорилась у 7 из 10 тестированных животных), демонстрируя больший, чем аддитивный эфект. В дополнение, у животных, подвергшихся действию соединения А или клопидогрела, маркеры коагуляции и функции тромбоцитов, такие как РТ и ADP индуцированная агрегация тромбоцитов, были минимально изменены(5% и 7% соответственно). Это показывает отсутствие системных расстройств гемостаза, которые часто приводят к таким проблемам, как кровотечения, и демонстрирует, что комбинации являются потенциально более безопасной терапией, чем терапевтические дозы каждого единичного средства, которые производят значительно большие изменения в маркерах (33 и 46% соответственно). Так, этот эксперимент показывает, что комбинация клопидогрела и соединения А обладает превосходящей активностью,чем каждое из средств отдельно. Пример 6. Эффективность и безопасность соединения А для предотвращения явлений венозной тромбоэмболии после полной замены колена. В проспективном испытании в США и Канаде 215 пациентов, подвергшихся операции полной замены колена (TKR), были отобраны случайно в пропорции 2:2:1 для получения либо 15 мг соединения А,либо 40 мг соединения А перорально дважды в день, либо 30 мг эноксапарина подкожно дважды в день в течение 10-14 дней. Исследование было слепым в отношении дозы 15 или 40 мг, но не в отношении соединение А против эноксапарина. Основным критерием эффективности была частота возникновения венозной тромбоэмболии (VTE) (симптоматический или асимптоматический тромбоз глубоких вен на обязательной односторонней флебограмме или симптоматическая эмболия легких) в течение 10-14 дней. Критерии безопасности включали возникновение значительных или клинически достоверных незначительных кровотечений в течение дня после флебографии. Все критерии эффективности и кровотечений были установлены слепым, независимым, центральным оценивающим комитетом. Все 215 пациентов были отобраны случайно. Наблюдались доза- и концентрация-зависимые эффекты соединения А на уровни ингибирования образования тромбина и антифактор Ха. Для 175 пациентов(81,4%) были оценены эффективность и безопасность. Эти данные представлены в табл. 4, которая показывает, что соединение А было эффективно в предотвращении VTE после TKR, было безопасно и хорошо переносилось. Таблица 4 Основные итоги эффективности и безопасности Пример 7. Комбинация соединения А и низкомолекулярного гепарина эноксапарин. Инъецируемые гепарины часто ограничены в дозе из-за таких последствий, как кровотечения, что приводит к узкому терапевтическому окну для эффекта лечения. Средства, такие как эноксапарин, имеют пониженное геморрагическое побочное действие в дозах, применяемых для профилактики тромбоэмболических заболеваний вен (30 мг, дозированное подкожно, 0,4 мг/кг), но приводят к геморрагическим побочным действиям в дозах, которые используются для лечения пациентов с острым коронарным синдромом (1 мг/кг). Как показано в табл. 5, соединение А, когда дозировано в сверхтерапевтических дозах(в 7-35 раз больше, чем терапевтическая доза для человека 0,21-0,57 мг/кг), не увеличивает времени кровотечения у макак резус. Таблица 5 Эффект соединения А на время кровотечения у макак резус Среднее/стандартное отклонение для всего времени.Среднее/стандартное отклонение для всех моментов времени 1-24 ч (после дозирования соединения А). Среднее/стандартное отклонение для всего времени.Среднее/стандартное отклонение для всех моментов времени 1-24 ч (после дозирования соединения А). Пример 8. Комбинация соединения А и низкомолекулярного гепарина эноксапарин. Анализ ex vivo свертывания крови был выполнен на объединенной человеческой плазме для исследования комбинированного антикоагулирующего эффекта соединения А и эноксапарина. Добавление стандартной дозы низкомолекулярного гепарина (0,5 U/мл эноксапарина, соответствующие концентрации в плазме, достигаемой дозой 30 мг) привело к активированному частичному тромбопластиновому времени (аРТТ) 55 с. Добавление от 10 до 15 нМ соединения А к плазме, обработанной эноксапарином,привело к дополнительному антикоагулирующему эффекту, что выражается как увеличение величины аРТТ на 9-13%. Пример 9. Синергизм соединения А и аспирина.Ex vivo анализ высвобождения человеческих цитокинов был использован для тестирования, будет ли ингибирование фактора Ха увеличивать эффект уменьшения воспаления, производимый широкоиспользуемыми противовоспалительными препаратами, такими как аспирин. Цельная кровь от не получавших аспирин (n=6) и получавших аспирин (n=3) доноров-добровольцев была получена путем пункции вены и собрана в Vacutainer пробирки с цитратным (3,2%) антикоагулянтом. После добавления соединения А (50-500 нМ) в образцы крови, контрольный и обработанные образцы были активированы посредством добавления коллагена (Chronolog, 4 мкг/мл) и осторожно ротировались при 37 С в течение 45 мин. В конце периода активации образцы крови были центрифугированы при 13000 об/мин (15000 g) 5 мин в Эппендорф 5415G центрифуге. Плазма была отобрана, обработана коктейлем ингибиторов протеаз (Roche) и хранилась замороженной при -80 С. Количество цитокинов, высвобожденных из клеток крови, было определено в Multiplexed Biomarker Immunoassay для Luminex Instrumentation (Millipore USA). Показательные результаты для двух цитокинов (интерлейкин 6 и 8) представлены в табл. 6 и 7. Когда образцы крови здоровых доноров были обработаны соединением А, единичная обработка не привела к статистически значимому ингибированию высвобождения цитокинов в образцах крови. Например, в образцах плазмы шести доноров среднее значение интерлейкина 4 было 28,4 пг/мл для необработанного контроля и 26,8-29,4 пг/мл для образцов, обработанных соединением А. Поразительно, когда соединение А было добавлено к образцам крови доноров, получавших аспирин, наблюдалось уменьшение уровня высвобождения цитокинов, таких как интерлейкин 6 и 8 (25% и 44% соответственно). Более того, добавление соединения А к цельной крови перед активацией коллагеном приводило к еще большему уменьшению интерлейкинов 6 и 8 на 16% и 18% соответственно. Так, в этой exvivo системе соединение А было способно производить дополнительные преимущественные эффекты перед широко используемыми противовоспалительными средствами. Таблица 6 Эффект комбинированного лечения соединением А и аспирином на высвобождение цитокина,интерлейкина 6, в цельной крови человека Таблица 7 Эффект комбинированного лечения соединением А и аспирином на высвобождение цитокина, интерлейкина 8, в цельной крови человека Пример 10. Комбинация соединения А и верапамила. Это исследование было предназначено для оценки in vivo эффекта соединения А при совместном введении селективного блокатора кальциевых каналов L-типа. Трем собакам породы "бигль" были имплантированы телеметрические передатчики научных данных (DSI modelTL11M2-D70-PCT) для измерения систолического и диастолического давления крови в состоянии бодрствования (без анестезии) и без ограничения в движении после перорального приема соединения А, верапамила или их комбинации. План исследования включал трехканальный кроссовер в одной неделей между дозами для уверенности в полной элиминации остаточных средств из циркуляторной системы собак. Данные были проанализированы для периода 12 ч, стартуя с одного часа до перорального дозирования соединения А и заканчивая одиннадцатью часами после дозирования. Получение данных и анализ были проведены с использованием LDS Life Science Suite Ponemah P3 plus V 4.20 программного обеспечения с результатами, представленными как 10-минутные средние значения для каждого животного. Введение соединения А (3 мг/кг) как единственное средства не показало статистически достоверной разницы в диастолическом кровяном давлении (DBP) по сравнению с величинами до дозирования средства в течение времени эксперимента. Верапамил (10 г/кг) как единственное средство уменьшил диастолическое давление на 33% в течение одного часа после перорального приема. Значение площади под кривой DBP для одного верапамила (-30791846 мм Hgмин) было статистически ниже, чем для группы соединения А (448161 мм Hgмин) (р 0,05). Комбинированное лечение (соединение А и верапамил) показало сходные результаты с группой с верапамилом как единственным средством с площадью под кривой -3157450 мм Hgмин. Результаты представлены в табл. 8 и 9. Эксперименты также показали, что соединение А может быть безопасно комбинировано со средствами, понижающими кровяное давление. Таблица 8 Наименьшее систолическое и диастолическое кровяное давление после дозирования соединения А и верапамила Статистически меньше по сравнению с соединением А одним, р 0,05(Бонферрони t-тест). Никакой статистически достоверной разницы между верапамилом одним и соединением А одним не наблюдалось. Площадь под кривой (AUC) была вычислена от дозирования верапамила или плацебо до примерно 4,5 ч после дозирования. AUC была получена от систолической или диастолической базовой линии. Значения базовой линии были средними значениями кровяного давления, наблюдаемыми между дозированием соединения А или наполнителя (плацебо) и дозированием верапамила. Отрицательные значения представляют уменьшение кровяного давления по отношению к базовым значениям. Таблица 9 Средняя площадь под кривой систолического и диастолического давления (AUCP) после введения верапамила или плацебо (4,5 ч) Статистически меньше по сравнению с соединением А, р 0,05 (Бонферрониt-тест). Никакой статистически достоверной разницы между верапамилом и соединением А + верапамил не наблюдалось (р=1,00). Пример 11. Комбинация соединения А и аспирина в анализе образования тромбина в плазме, богатой тромбоцитами (PRP). Человеческая плазма, бедная тромбоцитами (РРР), или плазма, богатая тромбоцитами (PRP), была получена из крови здоровых доноров, забранной в 0,32% цитрат. РРР и PRP были получены путем центрифугирования антикоагулированной крови при 100g или 1000g в течение 20 мин соответственно при комнатной температуре. Число тромбоцитов в PRP было доведено до примерно 200000 тромбоцитов/мкл с помощью гомологичной РРР. Для образования тромбина в 100 мкл реакционной смеси 75 мклPRP было сначала смешано с CaCl2, конвульксином и Z-Gly-Gly-Arg-аминометилкумарином (Z-GGRAMC, тромбиновый флюорогенный субстрат) в течение 3 мин при 37 С, с последующим добавлением тканевого фактора (Innovin, Dade Behring) для инициации образования тромбина. Стандартная реакционная смесь содержала 15 мМ Са 2+, 0,1 мкг/мл конвульксин, 100 мкМ Z-GGR-AMC, и 0,1 нМ TF (тканевого фактора) (Innovin). Образование тромбина непрерывно наблюдалось при 37 С при помощи флуориметрического считывателя чашек (Molecular Devices), измеряющего относительные единицы флуоресценции(RFU). Ингибиторы были преинкубированы с плазмой в течение 20 мин при комнатной температуре перед добавлением CaCl2 и конвульксина. Табл. 10 показывает эффект комбинации соединения А и аспирина на образование тромбина (n=5),выраженный в процентах ингибирования (% ингибирования). Без ASA представляет результаты доноров,не получавших аспирин. ASA представляет результаты доноров, получавших аспирин в течение как минимум 3 дней. % ингибирования был подсчитан путем нормализации среднего RFU (n=5) по уровню без Пример 12. Комбинация соединения А и аспирина, антитромбоцитарного средства. Комбинированный эффект антикоагулянта и антитромбоцитарного средства, аспирина, был исследован на in vivo модели тромбоза. Эта хорошо охарактеризованная животная модель (Lockyer and Kambayashi, Demonstration of Flow and Platelet Dependency in a Ferric Chloride Induced Model of Thrombosis, J.Cardiovasc. Pharmacol. 1999, 33(5):718-25) ранее была использована для тестирования как антикоагулирующих, так и антитромбоцитарных средств. В этом эксперименте способность соединения А поддерживать проходимость сосуда в условиях артериального потока при тромбозе, индуцированном хлоридом железа, в сонной артерии крыс была сравнена с таковой, достигаемой аспирином. Соединение А было введено посредством внутривенной инфузии, и аспирин был введен как внутривенный болюс примерно за 30 мин до начала эксперимента. Ex vivo агрегация тромбоцитов, индуцированная 10 мкг/мл коллагена,и время свертывания крови (протромбиновое время, РТ и активированное частичное тромбопластиновое время, аРРТ) были измерены в течение времени эксперимента (90 мин) у всех животных. Соединение А, при введении одно, демонстрировало дозозависимое ингибирование тромбоза при измерении тромбоза пропорцией животных, чья сонная артерия не закупорилась в течение эксперимента. Концентрации соединения А в плазме 0,03, 0,1 и 0,3 мкМ демонстрировали 30, 60 и 90% ингибирования тромбоза у крыс соответственно. Для сравнения 3 из 32 контрольных животных не показали окклюзии в течение эксперимента, что соответствует 9,4% ингибирования тромбоза у крыс. В экспериментах с аспирином доза 3 мг/кг демонстрировала 35% ингибирования коллагениндуцированной агрегации тромбоцитов в плазме, богатой тромбоцитами. Соответствующий уровень ингибирования тромбоза был равен 30% (3 из 10 тестированных животных не показали окклюзии). Повышение дозы аспирина до 10 мг/кг более чем удвоило % ингибирования индуцированной агрегации тромбоцитов (77%), но имело минимальный эффект на увеличение уровня ингибирования тромбоза у крыс (33,3% или 3 из 9 тестированных животных не показали окклюзии). При наиболее низкой дозе аспирина (1,0 мг/кг), антитромботическая активность была одинакова с контрольным уровнем, который наблюдался у 10% животных (1 из 10 животных не показало окклюзии). При низкой дозе аспирина коллаген-индуцированная агрегация тромбоцитов была лишь слегка ингибирована (2%). Как показано в табл. 11, комбинация соединения А в количестве 0,03 мкМ и аспирина в количестве 3 мг/кг приводит к 40% ингибированию тромбоза у крыс (4 из 10 животных не показали окклюзии), демонстрируя легкий аддитивный антитромботический эффект. В дополнение, у животных, получавших соединение А и аспирин, маркеры коагуляции (РТ) не отличались от результатов для соединения А одного. Это демонстрирует отсутствие системных нарушений гемостаза, которые часто приводят к проблемам безопасности применения, таким как кровотечения, и демонстрирует, что комбинация является потенциально более безопасной терапией для достижения большего антитромботического эффекта, чем терапевтические дозы каждого единичного средства. Так, этот эксперимент показывает, что комбинация аспирина и соединения А обладает превосходящей активностью, чем каждое из средств отдельно. Таблица 11DNO=без окклюзии. ТТО=время до окклюзии. Среднее время до окклюзии для животных с окклюзией. Пример 13. Наименьшие концентрации соединения А, необходимые для ингибирования тромбоза брызжеечной артерии у мышей, которые экспрессируют сниженный уровень P2Y12 рецептора. Широко используемые P2Y12 антагонисты, такие как клопидогрел, назначаются в дозах, которые блокируют 40-50% P2Y12 рецепторов на тромбоцитах у пациентов, получающих лечение. Было показано,что P2Y12+/- мыши, которые экспрессируют 50% рецептора на их тромбоцитах, по сравнению с диким типом (P2Y12+/+), демонстрируют фенотип со средним уровнем тромбоза между диким типом и мышами,полностью дефицитными по P2Y12 (P2Y12-/-) (Andre, P., et al., J. Clin Invest, 2003. 112(3):398-406). P2Y12 регулирует адгезию/активацию тромбоцитов, рост тромба и стабильность кровяного сгустка в поврежденных артериях. Эффект соединения А был исследован на модели тромбоза у P2Y12+/- мышей для эффективной имитации двойного дозирования ингибитора фактора Ха и P2Y12 антагониста у человека. Тромбоз в брызжеечной артерии мышей (скорость разбивания 1000-3000 с-1) был проведен и зарегистрирован как описано ранее (Andre, P., et al., J. Clin Invest, 2003. 112 (3):398-406). Тромбоциты были помечены in situ с использованием родамин 6G (0,2 мг/мл) и введены через хвостовую вену за 10 мин до визуализации артерий. Повреждение стенки сосуда было вызвано 11-мм фильтровальной бумагой, смоченной в 10% растворе FeCl3. Через 5 мин фильтровальная бумага была убрана и брызжеечная артерия промыта подогретым физиологическим раствором (37 С). Тромбоцит-стенка сосуда интеракции были регистрированы в течение 40 последующих минут или до возникновения полной окклюзии и существования более 40 с. C57B16J мышам (дикий тип контроль или P2Y12+/-) за 2 ч до повреждения сосудов были введены перорально дозы соединения А (2, 4, 10 мг/кг). Тромбоз был проанализирован в реальном времени с использованием Simple PCI программного обеспечения. Интенсивность флуоресценции была записана на уровне 2 Гц в течение 40 мин и построен график зависимости от времени. Время до окклюзии делены в крови, забранной спустя 2 мин после окклюзии или 42 мин после начала повреждения сосуда. В контролях дикого типа дозы соединения А 2 и 4 мг/кг были неэффективны, тогда как дозы 10 мг/кг значительно увеличивали как время до возникновения первого тромба, так и время до окклюзии. Циркулирующие концентрации в плазме соединения А более 1000 нг/мл предотвращали окклюзию сосуда у животных дикого типа. Напротив, концентрации более 76 нг/мл были достаточны для предотвращения окклюзии сосудов в P2Y12+/- животных. Заявители также наблюдали сильную синергистическую активность при комбинированной модуляции P2Y12 активности с ингибированием фактора Ха соединением А. Как показано в табл. 12, сниженная активность P2Y12 увеличивает время до окклюзии от базового уровня 368 с до 756,7 с. Дополнительное ингибирование добавлением соединения А приводит к существенной отсрочке времени до окклюзии (756,7 с до более чем 2100 с), иллюстрируя эффективность двойного ингибирования. Таблица 12 Должно быть понятно, что хотя изобретение описано в связи с рассмотренными выше вариантами осуществления, предшествующее описание и примеры призваны иллюстрировать, но не ограничивать границы изобретения. Другие стороны, преимущества и модификации, лежащие в границах изобретения,будут очевидны специалисту в области техники, к которой относится изобретение. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ лечения состояния у млекопитающего, характеризующегося нежелательным тромбозом,включающий введение указанному млекопитающему терапевтически эффективного количества соединения или его фармацевтически приемлемой соли и антагониста P2Y12 рецептора. 2. Способ по п.1, где антагонистом P2Y12 рецептора является клопидогрел. 3. Способ по любому из пп.1, 2, где по меньшей мере одно из [2-(4[(диметиламино)иминометил]фенилкарбониламино)-5-метоксифенил]-N-(5-хлор(2 пиридилкарбоксамида, или его фармацевтически приемлемой соли, или антагониста P2Y12 рецептора вводят в субтерапевтической дозе. 4. Способ по любому из пп.1,2,где как[2-(4[(диметиламино)иминометил]фенилкарбониламино)-5-метоксифенил]-N-(5-хлор(2 пиридилкарбоксамид или его фармацевтически приемлемую соль, так и антагонист P2Y12 рецептора вводят в субтерапевтических дозах. 5. Способ по любому из пп.1-4, где [2-(4-[(диметиламино)иминометил]фенилкарбониламино)-5 метоксифенил]-N-(5-хлор(2-пиридилкарбоксамид или его фармацевтически приемлемую соль и антагонист P2Y12 рецептора вводят одновременно. 6. Способ по любому из пп.1-4, где [2-(4-[(диметиламино)иминометил]фенилкарбониламино)-5- 21020531 метоксифенил]-N-(5-хлор(2-пиридилкарбоксамид или его фармацевтически приемлемую соль и антагонист P2Y12 рецептора вводят последовательно. 7. Способ по любому из пп.1-6, где фармацевтически приемлемая соль [2-(4[(диметиламино)иминометил]фенилкарбониламино)-5-метоксифенил]-N-(5-хлор(2 пиридилкарбоксамида является солью малеиновой кислоты. 8. Способ по любому из пп.1-7, где состояние выбрано из группы, состоящей из острого коронарного синдрома, инфаркта миокарда, нестабильной стенокардии, рефрактерной стенокардии, окклюзионного коронарного тромба, наблюдающегося после тромболитической терапии или после коронарной ангиопластики, тромботически опосредованного цереброваскулярного синдрома, эмболического удара, тромботического удара, транзиторных ишемических атак, венозного тромбоза, тромбоза глубоких вен, легочных эмбол, коагулопатии, диссеминированного внутрисосудистого свертывания, тромботической тромбоцитопенической пурпуры, облитерирующего тромбоангиита, тромботического заболевания, связанного с гепарининдуцированной тромбоцитопенией, тромботических осложнений, связанных с экстракорпоральным кровообращением, тромботических осложнений, связанных с применением технических средств, и тромботических осложнений, связанных с соединительными частями протезов. 9. Фармацевтическая композиция, включающая два следующих терапевтических средства: или его фармацевтически приемлемую соль и(2) антагонист P2Y12 рецептора и фармацевтически приемлемый носитель. 10. Фармацевтическая композиция по п.9, где антагонистом P2Y12 рецептора является клопидогрел. 11. Фармацевтическая композиция по любому из пп.9, 10, где по меньшей мере одно терапевтическое средство присутствует в субтерапевтических дозах. 12. Фармацевтическая композиция по любому из пп.9, 10, где оба терапевтических средства присутствуют в субтерапевтических дозах. 13. Фармацевтическая композиция по любому из пп.9-12, где фармацевтически приемлемая соль [2(4-[(диметиламино)иминометил]фенилкарбониламино)-5-метоксифенил]-N-(5-хлор(2 пиридилкарбоксамида является солью малеиновой кислоты. 14. Набор, включающий: или его фармацевтически приемлемую соль, и(2) второй контейнер, где указанный контейнер содержит антагонист P2Y12 рецептора. 15. Набор по п.14, где антагонистом P2Y12 рецептора является клопидогрел. 16. Набор по любому из пп.14, 15, дополнительно включающий:[(диметиламино)иминометил]фенилкарбониламино)-5-метоксифенил]-N-(5-хлор(2 пиридилкарбоксамид и антагонист P2Y12 рецептора могут использоваться вместе. 17. Набор по любому из пп.14-16, где фармацевтически приемлемая соль[(диметиламино)иминометил]фенилкарбониламино)-5-метоксифенил]-N-(5-хлор(2 пиридилкарбоксамида является солью малеиновой кислоты. 18. Набор по любому из пп.14-17, где по меньшей мере одно из[(диметиламино)иминометил]фенилкарбониламино)-5-метоксифенил]-N-(5-хлор(2 пиридилкарбоксамида или его фармацевтически приемлемой соли или антагониста P2Y12 рецептора присутствует в субтерапевтической дозе. 19. Набор по любому из пп.14-17,где как[2-(4[(диметиламино)иминометил]фенилкарбониламино)-5-метоксифенил]-N-(5-хлор(2 пиридилкарбоксамид или его фармацевтически приемлемая соли, так и антагонист P2Y12 рецептора присутствуют в субтерапевтических дозах.
МПК / Метки
МПК: A61K 45/06, A61P 9/10, A61K 31/44, A61P 7/02
Метки: средства, действует, антикоагулирующего, ингибитор, фактора, комбинированная, которое, терапия, соединением
Код ссылки
<a href="https://eas.patents.su/24-20531-kombinirovannaya-terapiya-antikoaguliruyushhego-sredstva-s-soedineniem-kotoroe-dejjstvuet-kak-ingibitor-faktora-ha.html" rel="bookmark" title="База патентов Евразийского Союза">Комбинированная терапия антикоагулирующего средства с соединением, которое действует как ингибитор фактора ха</a>
Предыдущий патент: Борсодержащие молекулы небольшого размера
Следующий патент: Способ и машиночитаемый носитель для формирования вариограммной модели свойств пласта-коллектора
Случайный патент: Аминогетероарильные соединения в качестве ингибиторов протеинкиназ