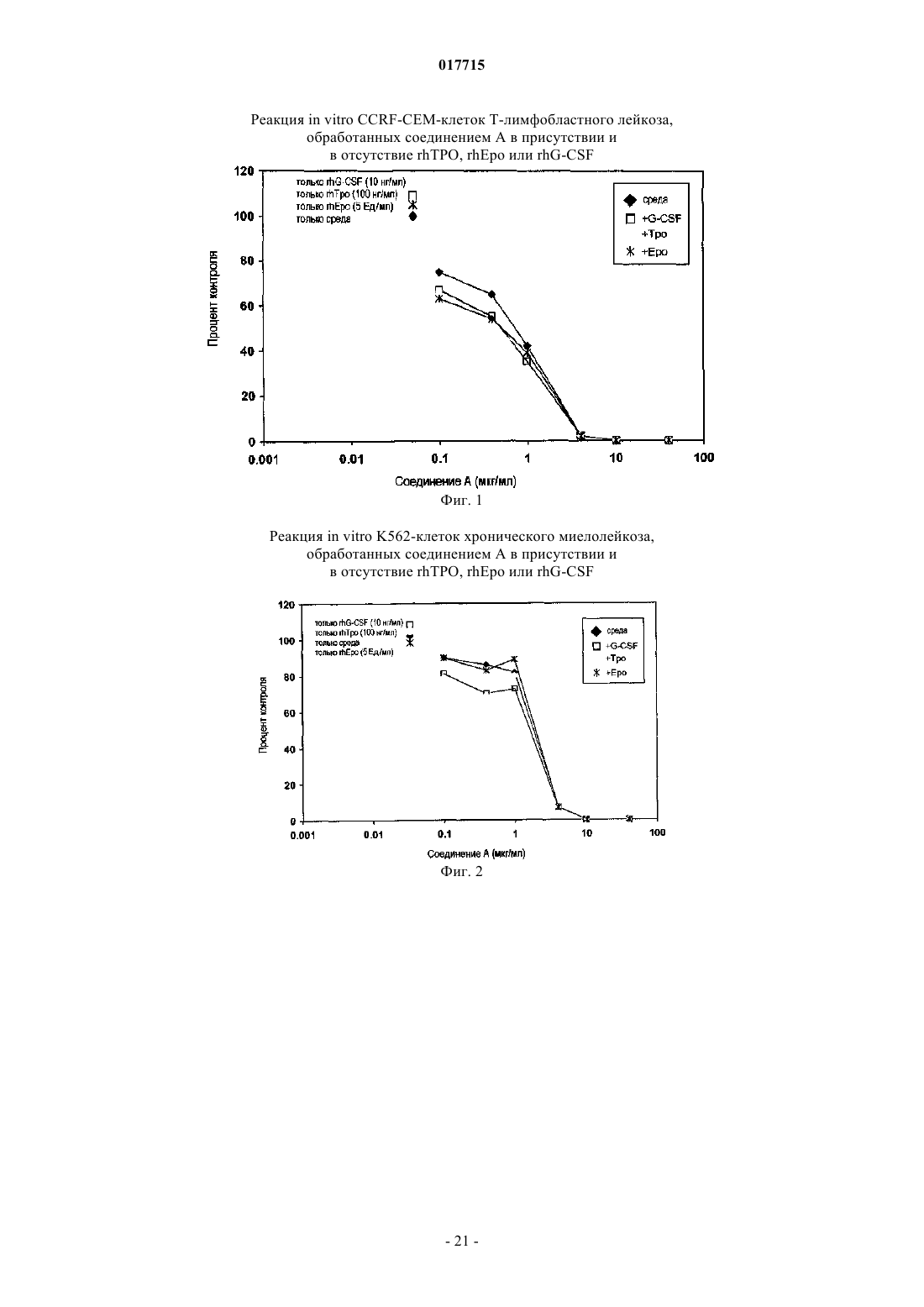
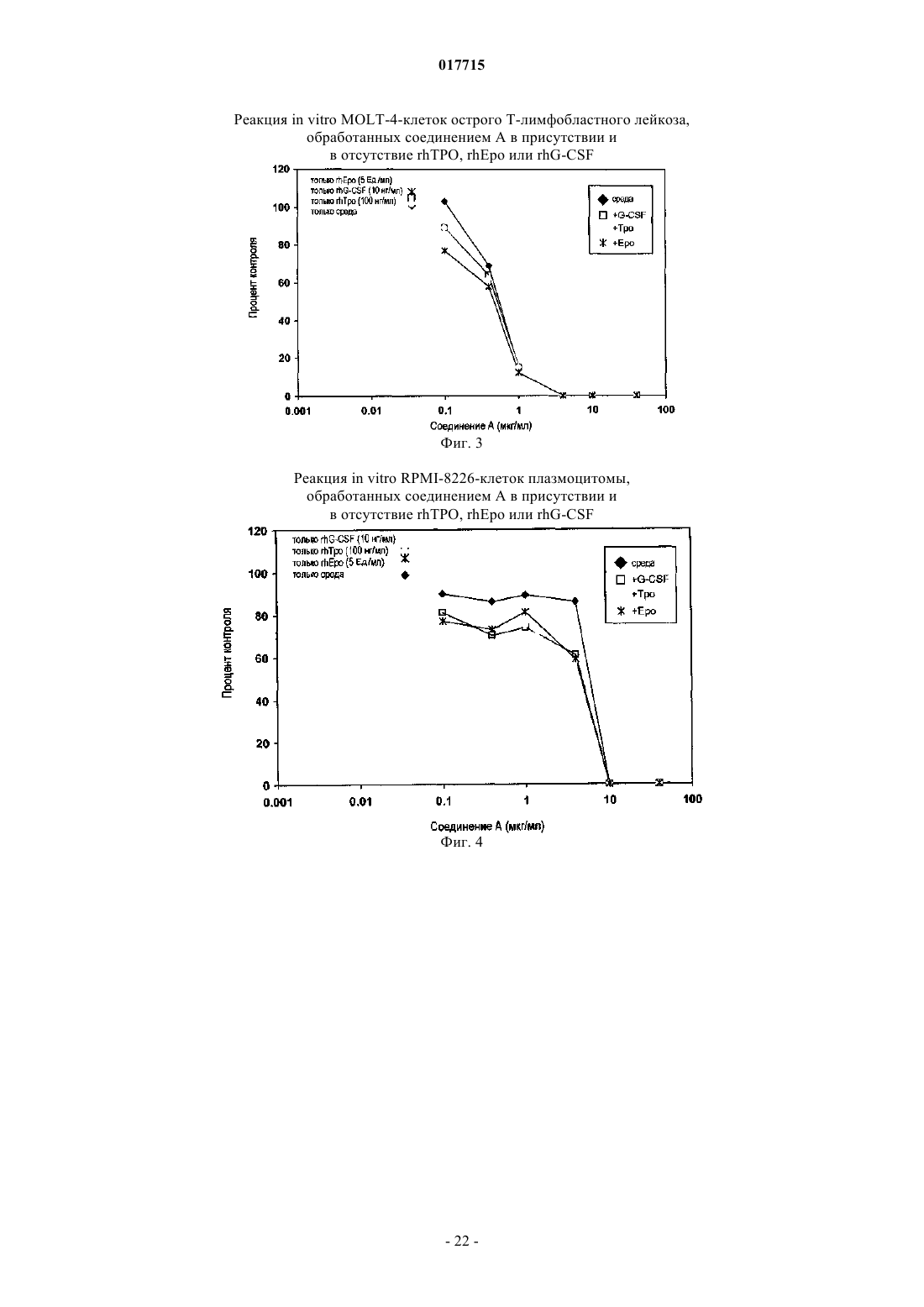
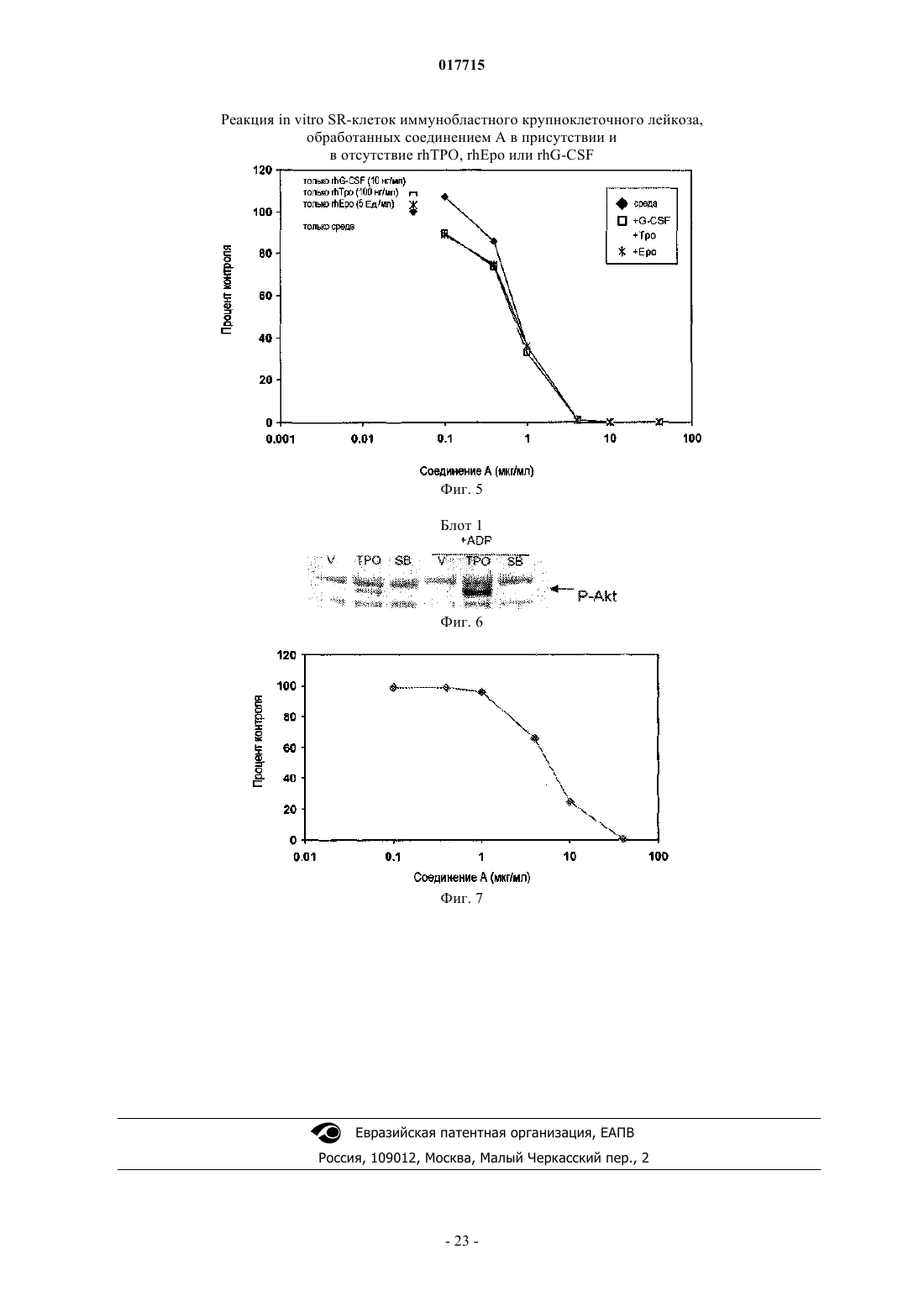
Способ лечения рака
Формула / Реферат
1. Способ лечения рака у млекопитающих, состоящий во введении in vivo терапевтически эффективного количества 3'-{N'-[1-(3,4-диметилфенил)-3-метил-5-оксо-1,5-дигидропиразол-4-илиден]гидразино}-2'-гидроксибифенил-3-карбоновой кислоты или ее фармацевтически приемлемой соли.
2. Способ по п.1, в котором млекопитающее является человеком.
3. Способ по п.2, в котором рак выбран из рака мозга (глиомы), глиобластомы, лейкемии, синдрома Банаяна-Зонана, болезни Коудена, болезни Лермитта-Дюклоса, груди, воспалительного рака груди, опухоли Вильмса, саркомы Юинга, рабдомиосаркомы, эпендимомы, медуллобластомы, толстой кишки, головы и шеи, почки, легкого, печени, меланомы, яичникового, поджелудочной железы, простаты, саркомы, остеосаркомы, гигантоклеточной опухоли кости и щитовидной железы, T-лимфобластного лейкоза, хронического миелолейкоза, хронического лимфолейкоза, волосатоклеточного лейкоза, острого лимфобластного лейкоза, хронического нейтрофильного лейкоза, острого T-лимфобластного лейкоза, плазмацитомы, иммунобластного крупноклеточного лейкоза, лимфомы из клеток мантийной зоны, мегакариобластного лейкоза, множественной миеломы, острого мегакариоцитарного лейкоза и эритролейкоза, злокачественной лимфомы, ходжкинской лимфомы, неходжскинской лимфомы, T-лимфобластной лимфомы, лимфомы Беркитта, фолликулярной лимфомы, нейробластомы, рака мочевого пузыря, карциномы уротелия, рака легкого, рака вульвы, рака шейки матки, рака эндометрия, рака почки, мезотелиомы, рака пищевода, рака слюнной железы, гепатоцеллюлярного рака, рака желудка, рака носоглотки, рака щеки, рака рта, стромальной опухоли желудочно-кишечного тракта и рака яичка.
4. Способ по п.3, в котором соединение вводят перорально.
5. Способ по п.3, в котором соединение вводят парентерально.
6. Способ лечения предраковых состояний у млекопитающих, состоящий во введении in vivo терапевтически эффективного количества 3'-{N'-[1-(3,4-диметилфенил)-3-метил-5-оксо-1,5-дигидропиразол-4-илиден]гидразино}-2'-гидроксибифенил-3-карбоновой кислоты или ее фармацевтически приемлемой соли.
7. Способ по п.6, в котором млекопитающее является человеком.
8. Способ по п.7, в котором предраковое состояние выбрано из внутриэпителиальной неоплазии шейки матки, моноклональной гаммапатии неизвестной этиологии, миелодиспластического синдрома, апластической анемии, поражения шейки матки, кожных родинок (премеланомы), внутриэпителиальной (внутрипротоковой) неоплазии предстательной железы, протоковой карциномы in situ, полипов толстой кишки, тяжелого гепатита или цирроза.
9. Способ по п.1, в котором соединение представляет собой бис-(моноэтаноламин) 3'-{N'-[1-(3,4-диметилфенил)-3-метил-5-оксо-1,5-дигидропиразол-4-илиден]гидразино}-2'-гидроксибифенил-3-карбоновой кислоты.
10. Способ по п.6, в котором соединение представляет собой бис-(моноэтаноламин) 3'-{N'-[1-(3,4-диметилфенил)-3-метил-5-оксо-1,5-дигидропиразол-4-илиден]гидразино}-2'-гидроксибифенил-3-карбоновой кислоты.
11. Способ по п.10, в котором предраковое состояние представляет собой миелодиспластический синдром.
12. Способ по п.10, в котором предраковое состояние представляет собой апластическую анемию.
Текст
Изобретение представляет способ лечения рака и предраковых состояний у млекопитающих,включая человека,при необходимости такового,который состоит в приеме терапевтически эффективной дозы непептидного агониста рецептора TPO, а именно 3'-N'-[1-(3,4-диметилфенил)-3-метил-5-оксо-1,5-дигидропиразол-4 илиден]гидразино-2'-гидроксибифенил-3-карбоновой кислоты или ее фармацевтически приемлемой соли, такими млекопитающими.(71)(73) Заявитель и патентовладелец: СМИТКЛАЙН БИЧАМ КОРПОРЕЙШН (US) 017715 Область техники Это изобретение относится к способам лечения рака и предраковых состояний у млекопитающих,включая человека, путем приема непептидных агонистов рецептора тромбопоэтина (TPO) и фармацевтических композиций, содержащих таковые. Соответственно, способ относится к способам лечения раков и предраковых состояний путем приема 3'-N'-[1-(3,4-диметилфенил)-3-метил-5-оксо-1,5-дигидропиразол 4-илиден]гидразино-2'-гидроксибифенил-3-карбоновой кислоты или ее фармацевтически приемлемой соли, в частности соли бис-(моноэтаноламина) (здесь и далее соль бис-(моноэтаноламина) - это соединение A и соответствующее бессолевое соединение - соединение B). Уровень техники Показано, что тромбопоэтин (TPO) является главным гуморальным регулятором в ситуациях, связанных с тромбоцитопенией, см., например, Metcalf Nature. 369:519-520 (1994). В нескольких исследованиях показано, что TPO повышает количество тромбоцитов, повышает размер тромбоцитов, повышает ассимиляцию изотопов в тромбоциты реципиентных животных. Поскольку тромбоциты необходимы для свертывания крови и при их слишком низкой концентрации пациент может погибнуть от катастрофического кровотечения, полагают, что использование TPO может улучшить диагностику и лечение разнообразных гематологических нарушений, например болезней, вызванных преимущественно дефектами тромбоцитов. Помимо этого, исследования обеспечили основу для планирования эффективности терапииTPO при лечении тромбоцитопении, особенно тромбоцитопении, вызванной химиотерапией, лучевой терапией или трансплантацией костного мозга при лечении рака или лимфомы. См., например, McDonald(1992). Am. J. Ped. Hematology/Oncology. 14: 8-21 (1992). Медленное восстановление уровня тромбоцитов у пациентов, страдающих тромбоцитопенией, серьезная проблема, которая приводит к поиску низкомолекулярных непептидных агонистов рецептораTPO, способных усилить регенерацию тромбоцитов (см., например, международную заявкуPCT/US01/16863, имеющую международную дату подачи 4 мая 2001 г., в которой описано именно соединение B, в примере 3, и использование непептидных агонистов рецептора TPO в комбинации с другими активными ингредиентами). Соединение А описано в международной заявкеPCT/US03/16255, имеющей международную дату подачи 21 мая 2003 г.; в международной публикации WO 03/098002 с датой международной публикации 4 декабря 2003 г. Непептидные агонисты рецептора TPO, включающие соединение A, описаны как средство для лечения дегенеративных болезней/поражений в международной заявкеPCT/US04/013468, имеющей международную дату подачи 29 апреля 2004 г.; в международной публикации WO 04/096154 с датой международной публикации 11 ноября 2004 г. Настоящее изобретение касается новых терапевтических использований известного класса соединений, непептидных агонистов рецептора TPO. Сущность изобретения Данное изобретение относится к способу лечения рака у млекопитающих, включая человека, который содержит прием этими млекопитающими терапевтически эффективных количеств непептидных агонистов рецептора TPO, а именно 3'-N'-[1-(3,4-диметилфенил)-3-метил-5-оксо-1,5-дигидропиразол-4 илиден]гидразино-2'-гидроксибифенил-3-карбоновой кислоты или ее фармацевтически приемлемой соли. Данное изобретение относится к способу лечения предраковых состояний у млекопитающих, включая человека, который содержит прием этими млекопитающими терапевтически эффективных количеств непептидных агонистов рецептора TPO, а именно 3'-N'-[1-(3,4-диметилфенил)-3-метил-5-оксо-1,5 дигидропиразол-4-илиден]гидразино-2'-гидроксибифенил-3-карбоновой кислоты или ее фармацевтически приемлемой соли. Непептидными агонистами рецептора TPO являются соединения формулы (I) где каждый из R, R1, R2 и R3 независимо выбирается из водорода, C1-6 алкила, -(CH2)pOR4, -C(O)OR4,формильной группы, нитрогруппы, цианогруппы, галогена, арила, замещенного арила, замещенного алкила, -S(O)nR4, циклоалкила, -NR5R6, защищенной ОН-группы, -CONR5R6, фосфоновой кислоты, сульфоновой кислоты, фосфиновой кислоты, -SO2NR5R6 и гетероциклического метиленового заместителя,как показано в формуле (III)n=0-2; каждый из V, W, X и Z независимо выбирается из O, S и NR16, R16 выбирается из водорода, алкила,циклоалкила, C1-C12-арила, замещенного алкила, замещенного циклоалкила и замещенного C1-C12-арила;R4 выбирается из водорода, алкила, циклоалкила, C1-C12-арила, замещенного алкила, замещенного циклоалкила и замещенного C1-C12-арила; каждый из R5 и R6 независимо выбирается из водорода, алкила, замещенного алкила,С 3-6 циклоалкила и арила илиR5 и R6 вместе с атомом азота, с которым они соединены, представляют собой 5-6-членное насыщенное кольцо, содержащее не более одного другого гетероатома, выбранного из кислорода или азота;AR является циклическим или полициклическим ароматическим кольцом, содержащим 3-16 атомов углерода и необязательно содержащим один или более гетероатом так, что, если число атомов углерода равняется 3, ароматическое кольцо содержит по меньшей мере два гетероатома, если число атомов углерода равняется 4, ароматическое кольцо содержит по меньшей мере один гетероатом, и необязательно замещенным одним или более заместителями, выбранными из группы, состоящей из алкила, замещенного алкила, арила, замещенного циклоалкила, замещенного арила, арилоксигруппы, оксогруппы, гидроксигруппы, алкоксигруппы, циклоалкила, ацилоксигруппы, аминогруппы, N-ациламиногруппы, нитрогруппы, цианогруппы, галогена, -C(O)OR4, -C(O)NR10R11, -S(О)2NR10R11, -S(O)nR4 и защищенной ОН-группы, где n=0-2;R10 и R11 являются независимо водородом, циклоалкилом, C1-C12-арилом, замещенным циклоалкилом, замещенным C1-C12-арилом, алкилом или алкилом, замещенным одним или более заместителями,выбранными из группы, состоящей из алкоксигруппы, ацилоксигруппы, арилоксигруппы, аминогруппы,N-ациламиногруппы, оксогруппы, гидроксигруппы, -C(O)OR4, -S(O)nR4, -C(O)NR4R4, -S(O)2NR4R4, нитрогруппы, цианогруппы, циклоалкила, замещенного циклоалкила, галогена, арила, замещенного арила или защищенной ОН-группы; илиR10 и R11 вместе с азотом, с которым они соединены, представляют собой 5-6-членное насыщенное кольцо, содержащее не более одного другого гетероатома, выбранного из кислорода или азота,R4 является, как описано выше; иn=0-2; и/или их фармацевтически приемлемые соли, гидраты, сольваты и сложные эфиры; так что по меньшей мере один из R, R1, R2 и R3 является замещенной арильной группой или гетероциклическим метиленовым заместителем, как изображено в формуле (III). Данное изобретение относится к способу лечения рака у млекопитающих, включая человека, который включает прием этими млекопитающими терапевтически эффективных количеств непептидных агонистов рецептора TPO, в частности 3'-N'-[1-(3,4-диметилфенил)-3-метил-5-оксо-1,5-дигидропиразол-4 илиден]гидразино-2'-гидроксибифенил-3-карбоновой кислоты или ее фармацевтически приемлемой соли. Включенными в настоящее изобретение являются фармацевтические композиции, состоящие из фармацевтического наполнителя и соединений, используемых в способах изобретения. Краткое описание чертежей На фиг. 1 показана реакция in vitro CCRF-СЕМ-клеток T-лимфобластного лейкоза на соединение A. На фиг. 2 показана реакция in vitro K562-клеток хронического миелолейкоза на соединение A. На фиг. 3 показана реакция in vitro MOLT-4-клеток острого T-лимфобластного лейкоза на соединение A. На фиг. 4 показана реакция in vitro RPMI-8226-клеток плазмоцитомы на соединение A. На фиг. 5 показана реакция in vitro SR-клеток иммунобластного крупноклеточного лейкоза на соединение A. Подробное описание изобретения Данное изобретение относится к способам лечения рака и предраковых состояний у млекопитающих, включая человека, которые включают прием этими млекопитающими терапевтически эффективных количеств непептидных агонистов рецептора TPO, включая соединения формулы (I), как описано выше. Соответственно, изобретение относится к способу лечения рака у млекопитающих, включая человека, где рак выбран из мозга (глиомы), глиобластомы, лейкемии, синдрома Банаяна-Зонана, болезни Коудена, болезни Лермитта-Дюклоса, груди, воспалительного рака груди, опухоли Вильмса, саркомы Юинга, рабдомиосаркомы, эпендимомы, медуллобластомы, толстой кишки, головы и шеи, почки, легкого, печени, меланомы, яичникового, поджелудочной железы, простаты, саркомы, остеосаркомы, гигантоклеточной опухоли кости и щитовидной железы. Соответственно, изобретение относится к способу лечения рака у млекопитающих, включая человека, при котором рак выбран из T-лимфобластного лейкоза, хронического миелолейкоза, хронического-2 017715 лимфолейкоза, волосатоклеточного лейкоза, острого лимфобластного лейкоза, хронического нейтрофильного лейкоза, острого T-лимфобластного лейкоза, плазмацитомы, иммунобластного крупноклеточного лейкоза, лимфомы из клеток мантийной зоны, мегакариобластного лейкоза, множественной миеломы, острого мегакариоцитарного лейкоза и эритролейкоза. Соответственно, изобретение относится к способу лечения рака у млекопитающих, включая человека, при котором рак выбран из злокачественной лимфомы, ходжкинской лимфомы, неходжскинской лимфомы, T-лимфобластной лимфомы, лимфомы Беркитта, фолликулярной лимфомы. Соответственно, изобретение относится к способу лечения рака у млекопитающих, включая человека, при котором рак выбран из нейробластомы, рака мочевого пузыря, карциномы уротелия, рака легкого, рака вульвы, рака шейки матки, рака эндометрия, рака почки, мезотелиомы, рака пищевода, рака слюнной железы, гепатоцеллюлярного рака, рака желудка, рака носоглотки, рака щеки, рака рта, стромальной опухоли желудочно-кишечного тракта и рака яичка. Соответственно, изобретение относится к способу лечения предраковых состояний у млекопитающих, включая человека, при котором предраковое состояние выбрано из внутриэпителиальной неоплазии шейки матки, моноклональной гаммапатии неизвестной этиологии, миелодиспластического синдрома,апластической анемии, поражения шейки матки, кожных родинок (премеланомы), внутриэпителиальной(внутрипротоковой) неоплазии предстательной железы, протоковой карциномы in situ, полипов толстой кишки, тяжелого гепатита или цирроза (особенно вирусного гепатита), каждый из которых может предшествовать раку. Включенными в соединения формулы (I), используемыми в настоящем изобретении, являются те,что имеют формулу (VI) где каждый из R, R1, R2 и R3 независимо выбирается из водорода, C1-6 алкила, С 1-6 алкокси,-(CH2)pOR4, -C(O)OR4, формильной группы, нитрогруппы, цианогруппы, галогена, арила, замещенного арила, замещенного алкила, -S(O)nR4, циклоалкила, -NR5R6, защищенной ОН-группы, -CONR5R6, фосфоновой кислоты, сульфоновой кислоты, фосфиновой кислоты, -SO2NR5R6; р=0-6;R4 является водородом, алкилом, циклоалкилом, C1-C12-арилом, замещенным алкилом, замещенным циклоалкилом, замещенным C1-C12-арилом и каждый из R5 и R6 независимо выбирается из водорода, алкила, замещенного алкила,C3-6 циклоалкила и арила илиR5 и R6 вместе с азотом, к которому они присоединены, представляют собой 5-6-членное насыщенное кольцо, содержащее не более одного другого гетероатома, выбранного из кислорода или азота;Y выбирается из алкила, замещенного алкила и циклического или полициклического ароматического кольца, содержащего 3-14 атомов углерода и необязательно содержащего от 1 до 3 гетероатомов так,что, если число атомов углерода равняется 3, ароматическое кольцо содержит по меньшей мере два гетероатома, если число атомов углерода равняется 4, ароматическое кольцо содержит по меньшей мере один гетероатом, и необязательно замещенного одним или более заместителями, выбранными из группы,состоящей из алкила, замещенного алкила, C1-C12-арила, замещенного циклоалкила и замещенногоC1-C12-арила, гидроксигруппы, арилоксигруппы, алкоксигруппы, циклоалкила, нитрогруппы, цианогруппы, галогена и защищенной ОН-группы; и ихфармацевтически приемлемые соли, гидраты, сольваты и сложные эфиры; так что по меньшей мере один из R, R1, R2 и R3 замещен арильной группой. Включенными в соединения, используемые в настоящем изобретении, являются те, что имеют формулу (VI), в которой или R является замещенным арилом и R1 является водородом; или R является водородом и R1 является замещенным арилом; и в любом случае каждый из R2 и R3 независимо выбирается из водорода, C1-6 алкила, C1-6 алкокси,нитрогруппы, цианогруппы, галогена, арила, замещенного арила, замещенного алкила, циклоалкила,фосфоновой кислоты, фосфиновой кислоты и сульфоновой кислоты;Y выбирается из фенила, пиридинила и пиримидинила, где фенил, пиридинил и пиримидинил необязательно замещены одним-тремя заместителями, выбранными из группы, состоящей из алкила, замещенного алкила, C1-C12-арила, замещенного C1-C12-арила, алкоксигруппы и галогена; и их фармацевтически приемлемые соли, гидраты, сольваты и сложные эфиры. Включенными в соединения, используемые в настоящем изобретении, являются те, что имеют формулу (VI), в которойR1 является водородом; каждый из R2 и R3 независимо выбирается из водорода, C1-6 алкила, C1-6 алкокси, нитрогруппы, цианогруппы, галогена, замещенного алкила и циклоалкила;Y выбирается из фенила, пиридинила и пиримидинила, где фенил, пиридинил и пиримидинил необязательно замещены одним-тремя заместителями, выбранными из группы, состоящей из алкила, замещенного алкила, C1-C12-арила, замещенного C1-C12-арила, алкоксигруппы и галогена; и их фармацевтически приемлемые соли, гидраты, сольваты и сложные эфиры. Включенными в соединения, используемые в настоящем изобретении, являются те, что имеют формулу (VI), в которойR является замещенным кольцом фенила или пиридинила; иR1 является водородом; каждый из R2 и R3 независимо выбирается из водорода, С 1-6 алкила, замещенного алкила или галогена;Y выбирается из фенила, пиридинила и пиримидинила, где фенил, пиридинил и пиримидинил необязательно замещены одним-тремя заместителями, выбранными из группы, состоящей из алкила, замещенного алкила, C1-C12-арила, замещенного C1-C12-арила, алкоксигруппы и галогена; и их фармацевтически приемлемые соли, гидраты, сольваты и сложные эфиры. Включенными в соединения, используемые в настоящем изобретении, являются: 3'-N'-[1-(3,4-диметилфенил)-3-метил-5-оксо-1,5-дигидропиразол-4-илиден]гидразино-2'гидроксибифенил-3-карбоновая кислота; 3-N'-[1-(3,4-диметилфенил)-3-метил-5-оксо-1,5-дигидропиразол-4-илиден]гидразино-2'-гидрокси 3'-(тетразол-5-ил)бифенил; 1-(3-хлоро-5-[4-(4-хлортиофен-2-ил)-5-(4-циклогексилпиперазин-1-ил)тиазол-2 ил]карбамоилпиридин-2-ил)пиперидин-4-карбоновая кислота; 3'-N'-[1-(3,5-диметилфенил)-2-оксо-6-трифторметил-1,2-дигидроиндол-3-илиден]гидразино-2'гидроксибифенил-3-карбоновая кислота; 2'-гидрокси-3'-N'-[2-оксо-1-(4-пропилфенил)-1,2-дигидроиндол-3-илиден]гидразинобифенил-4 карбоновая кислота; и/или их фармацевтически приемлемые соли. Включенными в непептидные агонисты рецептора TPO данного изобретения являются непептидные соединения, описанные в WO 02/59099; WO 02/59100; ЕР 1207155; ЕР 1253142 А 1; WO 01/92211 А 1;WO 01/53267 A1; WO 03/62233; WO 02/62775; ЕР 1104674 А 1 и WO 01/07423 A1. Включенными в соединения вышеперечисленных заявок и используемыми в настоящем изобретении являются:(2 Е)-3-[4-([4-(3,4-дихлорфенил)-1,3-тиазол-2-ил]аминокарбонил)фенил]-2-метил-2-акриловая кислота и/или их фармацевтически приемлемые соли. Включенными в непептидные агонисты рецептора TPO данного изобретения являются непептидные соединения, описанные в WO 99/11262. Включенными в непептидные агонисты рецептора TPO данного изобретения являются непептидные соединения, описанные в международной заявкеPCT/US05/018924, имеющей международную дату подачи 27 мая 2005 г.; международной публикации WO 05/118551 с международной датой публика-4 017715 ции 15 декабря 2005 г., международной заявкеPCT/US05/038055, имеющей международную дату подачи 21 октября 2005 г.; международной публикации WO 06/047344 с международной датой публикации 4 мая 2006 г., международной заявкеPCT/US06/045129, имеющей международную дату подачи 21 ноября 2006 г.; международной публикации WO 07/062078 с международной датой публикации 31 мая 2007 г., международной заявкеPCT/US07/006547, имеющей международную дату подачи 14 марта 2007 г.; международной публикации WO 07/106564 с международной датой публикации 20 сентября 2007 г. Соединения, являющиеся конечными продуктами в WO 05/118551, WO 06/047344, WO 07/062078 иWO 07/106564, используются в настоящем изобретении, эти соединения включены здесь посредством ссылки. Соединение, являющееся продуктом примера 4 в WO 07/106564, 3'-N'-[1-(3,5-диметилфенил)-2 оксо-6-трифторметил-1,2-дигидроиндол-3-илиден]гидразино-2'-гидроксибифенил-3-карбоновая кислота, в свободном виде или в форме фармацевтически приемлемой соли, гидрата, сольвата или сложного эфира, является соединением, используемым в настоящем изобретении. Соединение, являющееся продуктом примера 6 в WO 07/106564, 2'-гидрокси-3'-N'-[2-оксо-1-(4 пропилфенил)-1,2-дигидроиндол-3-илиден]гидразинобифенил-4-карбоновая кислота, в свободном виде или в форме фармацевтически приемлемой соли, гидрата, сольвата или сложного эфира, является соединением, используемым в настоящем изобретении. Включенными в непептидные агонисты рецептора TPO данного изобретения являются непептидные соединения, описанные в международной заявкеРСТ/JP03/012419, имеющей международную дату подачи 29 сентября 2003 г.; международной публикации WO 04/029049 с международной датой публикации 8 апреля 2004, 2005 гг. Соединение, являющееся конечным продуктом WO 04/029049, в форме соли и в несолевой форме,используется в настоящем изобретении, эти соединения включены здесь посредством ссылки. Соответственно, соединение, являющееся конечным продуктом в WO 04/029049, - это 1-(3-хлор-5-[4-(4-хлортиофен-2-ил)-5-(4-циклогексилпиперазин-1-ил)тиазол-2-ил]карбамоилпиридин 2-ил)пиперидин-4-карбоновая кислота как бессолевое соединение (далее соединение Е) или в форме фармацевтически приемлемой соли, гидрата, сольвата или сложного эфира таковой. Соответственно, соль является солью малеиновой кислоты (здесь и далее соединение F). Структура соединения F показана ниже. Непептидные агонисты рецептора TPO включены в фармацевтические композиции данного изобретения и используются в способах данного изобретения. Термин "защищенная гидроксигруппа" или "защищенная OH-группа", используемый здесь, означает спиртовую или карбоксильную ОН-группу, которая может быть защищена обычно используемыми для этого блокирующими группами, как описано в "Protective Groups In Organic Synthesis", Theodora W.Greene, Wiley-Interscience, 1981, New York. Соединения, содержащие защищенную гидроксигруппу, также могут использоваться как промежуточные соединения для приготовления фармацевтически активных соединений изобретения. Термин "арил", используемый здесь, если не указано другое, означает циклическое или полициклическое ароматическое кольцо, содержащее от 1 до 14 атомов углерода и необязательно содержащее от 1 до 5 гетероатомов так, что, если число атомов углерода равняется 1, ароматическое кольцо содержит по меньшей мере четыре гетероатома, если число атомов углерода равняется 2, ароматическое кольцо содержит по меньшей мере три гетероатома, если число атомов углерода равняется 3, ароматическое кольцо содержит по меньшей мере 2 гетероатома, если число атомов углерода равняется 4, ароматическое кольцо содержит по меньшей мере один гетероатом. Термин "C1-C12-арил", используемый здесь, если не указано другое, означает фенил, нафталин,3,4-метилендиоксифенил, пиридин, бифенил, хинолин, пиримидин, хиназолин, тиофен, фуран, пиррол,пиразол, имидазол и тетразол. При упоминании соединений формул (I) и (II) термин "замещенный", используемый здесь, если не указано другое, означает, что химические составляющие вещества имеют один или более заместитель,-5 017715 выбранный из группы, состоящей из -CO2R20, арила, -C(O)NHS(О)2R20, -NHS(O)2R20, гидроксиалкила,алкоксигруппы, -C(O)NR21R22, ацилоксигруппы, алкила, аминогруппы, N-ациламиногруппы, гидроксигруппы, -(CH2)gC(O)OR8, -S(O)nR8, нитрогруппы, тетразола, цианогруппы, оксогруппы, галогена, трифторметила, защищенной ОН-группы или гетероциклического метиленового заместителя, как показано в формуле (III)R8 является водородом или алкилом;R21 и R22 независимо выбираются из водорода, C1-4 алкила, арила и трифторметила; каждый из V, W, X и Z независимо выбираются из О, S и NR16, R16 выбирается из водорода, алкила,циклоалкила, C1-12 арила, замещенного алкила, замещенного циклоалкила и замещенного C1-12 арила;n=0-2. При упоминании соединений формул (V) и (VI) термин "замещенный", используемый здесь, если не указано другое, означает, что химические составляющие вещества имеют один или более заместитель,выбранный из группы, состоящей из -CO2R20, арила, -С(O)NHS(О)2R20, -NHS(О)2R20, гидроксиалкила,алкоксигруппы, -C(O)NR21R22, ацилоксигруппы, алкила, аминогруппы, N-ациламиногруппы, гидроксигруппы, -(CH2)gC(О)OR8, -S(O)nR8, нитрогруппы, тетразола, цианогруппы, оксогруппы, галогена,трифторметила и защищенной ОН-группы, где g=0-6, R8 является водородом или алкилом, R20 выбирается из водорода, C1-4 алкила, арила и трифторметила, R21 и R22 независимо выбираются из водорода,C1-4 алкила, арила и трифторметила и n=0-2. Термин "алкокси", используемый здесь, означает -О-алкил, где алкил соответствует описанному здесь, включая -OCH3 и -OC(CH3)2CH3. Термин "циклоалкил", используемый здесь, если не указано другое, означает неароматический, ненасыщенный или насыщенный, циклический или полициклический C3-C12. Примеры циклоалкила и замещенных циклоалкильных заместителей, используемых здесь, включают циклогексил, 4-гидроксициклогексил, 2-этилциклогексил, пропил 4-метоксициклогексил, 4-метоксициклогексил, 4-карбоксициклогексил, циклопропил и циклопентил. Термин "ацилоксигруппа", используемый здесь, означает -OC(O)алкил, где алкил соответствует описанному здесь. Примеры ацилоксизаместителей, используемых здесь, включают -OC(O)CH3,-OC(O)CH(CH3)2 и -OC(O)(CH2)3CH3. Термин "N-ациламиногруппа", используемый здесь, означает -N(Н)C(O)алкил, где алкил соответствует описанному здесь. Примеры N-ациламинозаместителей, используемых здесь, включают-N(H)C(O)CH3, -N(H)C(O)CH(CH3)2 и -N(Н)С(О)(CH2)3CH3. Термин "арилоксигруппа", используемый здесь, означает -O-арил, где арил является фенилом, нафтилом, 3,4-метилендиоксифенилом, пиридилом или бифенилом, необязательно замещенным одним или более заместителями, выбранными из группы, состоящей из алкила, гидроксиалкила, алкокси, трифторметила, ацилокси, аминогруппы, N-ациламиногруппы, гидроксигруппы, -(CH2)gC(O)OR8, -S(O)nR8, нитрогруппы, цианогруппы, галогена или защищенной ОН-группы, где g=0-6, R8 является галогеном или алкилом и n=0-2. Примеры арилоксизаместителей, используемых здесь, включают фенокси-,4-фторфенокси- и бифенилоксигруппы. Термин "гетероатом", используемый здесь, означает кислород, азот или серу. Термин "галоген", используемый здесь, означает заместитель, выбранный из бромида, йодида, хлорида или фторида. Термин "алкил" и производные такового с любой углеродной цепочкой, используемые здесь, означают линейную либо разветвленную, насыщенную или ненасыщенную углеводородную цепь, и, если не указано другое, углеводородная цепь содержит от 1 до 12 атомов углерода. Примеры алкилзаместителей,используемые здесь, включают -CH3, -CH2-CH3, -CH2-CH2-CH3, -CH(CH3)2, -C(CH3)3, -(CH2)3-CH3,-CH2-CH(CH3)2, -CH(CH3)-CH2-CH3, -CH=CH2 и -CC-CH3. Термин "лечение" и производные такового, используемые здесь, означают профилактическую и лечебную терапию. Например, профилактическая терапия необходима тогда, когда существует высокая вероятность развития рака, как в случае отягощенного семейного анамнеза рака или если пациент подвергался воздействию канцерогена. Профилактический прием соединений данного изобретения предполагается в том случае, если у пациента имеются многочисленные факторы предрасположенности. Профилактическое использование способов этого изобретения включает, но не ограничивается, лечение заядлых курильщиков с раком, который не определяется.-6 017715 Фразы "до появления лечебного эффекта", "лечение" и "эффективная лечебная доза" и производные таковых, используемые здесь, если не указано иное, означают дозу непептидного агониста рецептораTPO, которая вызывает биологическую или медицинскую реакцию ткани, системы, животного или человека, т.е. определяется, например, исследователем или клиницистом. Более того, термин "эффективная лечебная доза" означает любую дозу, улучшающую результаты лечения, восстановления, профилактики,уменьшающую тяжесть или интенсивность рака при сравнении с пациентами, не принимавшими такую же дозу. Известно, что рак имеет много этиологических факторов. Данное изобретение относится к лечению рака вне зависимости от фактора или факторов, которые вызвали данное состояние. Фармацевтически активные соединения данного изобретения также применимы при лечении рака и в тех случаях, когда этиологические факторы или факторы, которые вызвали данное состояние, известны, и если их еще предстоит выявить. Квалифицированный врач будет способен определить соответствующую ситуацию, когда пациент предрасположен или находится в группе риска, например рака легкого, для назначения в соответствии со способами настоящего изобретения. Фраза "непептидный", используемая здесь, означает химическое соединение либо протеин или пептид, состоящий преимущественно не из природных аминокислот. Соответственно, "непептид" является низкомолекулярным химическим соединением, имеющим молекулярный вес менее 1500 Да, соответственно менее 1000 Да. Термин "преимущественно", используемый выше, означает, что около 60% массы приходится на встречающиеся в природе аминокислотные остатки. Некоторые из соединений, описанных здесь, могут содержать один или более хиральных атомов,иными словами, могут существовать в виде двух энантиомеров. Таким образом, соединения этого изобретения включают смеси энантиомеров, очищенные энантиомеры или обогащенные энантиомерами смеси. Также понятно, что все таутомеры и смеси таутомеров включены в диапазон соединений данного изобретения. Некоторые описанные здесь соединения могут образовывать сольваты, которые представляют собой комплексы различной стехиометрии, образованные растворенным веществом (например, соединением формулы I или соли такового) и растворителем. Такие растворители для целей данного изобретения не должны препятствовать биологической активности растворенного вещества. Примеры подходящих растворителей включают, но не ограничиваются, воду, метанол, этанол и уксусную кислоту. Наиболее предпочтительным растворителем является вода. Соединения данного изобретения включены в фармацевтические композиции данного изобретения и используются в способах изобретения. Если присутствует COOH- или OH-группа, можно использовать фармацевтически приемлемые эфиры, например метиловый, этиловый и им подобные для COOHгруппы, уксусный, малеиновый, пивалоилоксиметиловый и им подобные для OH-группы, и другие сложные эфиры, применяемые в данной области для изменения характеристик растворяемости и гидролиза, для обеспечения замедленного высвобождения или подбора состава пролекарства. Фармацевтически приемлемые соли соединений данного изобретения легко изготавливаются квалифицированными в данной области техники специалистами. Соединения формулы (I) описаны и заявлены вместе с их фармацевтически приемлемыми солями,гидратами, сольватами и сложными эфирами, как соединения, используемые в качестве агонистов рецептора TPO, особенно для усиления образования тромбоцитов и особенно при лечении тромбоцитопении, в международной заявкеPCT/US01/16863, имеющей международную дату подачи 24 мая 2001 г.; международной публикации WO 01/89457 с международной датой публикации 29 ноября 2001 г., полная информация о которых включена здесь посредством ссылки. Соединения формулы (I) и фармацевтически приемлемые соли, гидраты, сольваты и сложные эфиры таковых готовят так, как описано в международной заявкеPCT/US01/16863. бис-Моноэтаноламиновая соль соединения, описанного в международной заявкеPCT/US01/16863, описана в международной заявкеPCT/US03/16255, имеющей международную дату подачи 21 мая 2003 г.; международный номер подачи WO 03/098992 с международной датой публикации 4 декабря 2003 г. Лечение рака, как здесь было описано, усовершенствуется приемом непептидных агонистов рецептора TPO, но не ограничивается для любого специфического механизма действия. Лечение предраковых состояний, как здесь было описано, усовершенствуется приемом непептидных агонистов рецептора TPO, но не ограничивается для любого специфического механизма действия. При упоминании лечения предраковых состояний термин "совместный прием" и производные такового, используемые здесь, означают либо совместный прием, либо любой разделенный последовательный прием непептидного агониста рецептора TPO, как здесь было описано, и дополнительного активного ингредиента или ингредиентов, применяемых при лечении предраковых состояний. Термин "дополнительный активный ингредиент или ингредиенты", используемый здесь, включает любое соединение или лечебное средство, известное или демонстрирующее эффективные свойства при приеме пациентами,нуждающимися в лечении предраковых состояний. Предпочтительно, чтобы в случае неодновременного-7 017715 приема между приемами соединений не было больших временных промежутков. Более того, лекарственная форма приема соединений необязательно должна быть одинаковой, например одно соединение может применяться местно, другое - перорально. При упоминании лечения рака термин "совместный прием" и производные такового, используемые здесь, означают либо совместный прием, либо любой разделенный последовательный прием непептидного агониста рецептора TPO, как здесь было описано, и дополнительного активного ингредиента или ингредиентов, применяемых при лечении рака, включая химиотерапию и лучевую терапию. Термин "дополнительный активный ингредиент или ингредиенты", используемый здесь, включает любое соединение или лечебное средство, известное или демонстрирующее эффективные свойства при приеме пациентами, нуждающимися в лечении предраковых состояний. Предпочтительно, чтобы в случае неодновременного приема между приемами соединений не было больших временных промежутков. Более того,лекарственная форма соединений необязательно должна быть одинаковой, например одно соединение может применяться местно, другое - перорально. Обычно противоопухолевое средство, эффективное при лечении восприимчивых опухолей, можно принимать совместно при лечении рака с помощью данного изобретения. Примеры таких средств можно найти в Cancer Principles and Practice of Oncology by V.T. Devita and S. Hellman (editors), 6th edition(February 15, 2001), Lippincott WilliamsWilkins Publishers. Специалист обычной квалификации в данной области техники способен определять эффективные комбинации соединений на основании специфических характеристик лекарств и вида рака. Обычные противоопухолевые средства, используемые в данном изобретении, включают, но не ограничиваются, препятствующие сборке микротрубочек средств,таких как дитерпеноиды и алкалоиды барвинка; координационные комплексы платины; алкилирующие агенты, такие как азотистые иприты, оксазафосфорины, алкилсульфонаты, нитрозомочевины и триазены; антибиотики, такие как антрациклины, актиномицины и блеомицины; ингибиторы топоизомеразы II,такие как эпиподофилотоксины; антиметаболиты, такие как аналоги пурина и пиримидина и антифолатные соединения; ингибиторы топоизомеразы I, такие как камптотецины; гормоны и аналоги гормонов; ингибиторы каскада реакций сигнальной трансдукции; ингибиторы ангиогенных нерецепторных тирозинкиназ; иммунотерапевтические средства; проапоптотические средства; ингибиторы передачи сигналов клеточного цикла. Примерами дополнительного активного ингредиента или ингредиентов (противоопухолевого средства) для совместного приема или использования в комбинации с непептидными агонистами рецептораTPO этого изобретения являются средства химиотерапии. Препятствующими сборке микротрубочек или антимитотическими средствами являются фазоспецифичные средства, препятствующие сборке микротрубочек опухолевых клеток во время М, т.е. фазы митоза, клеточного цикла. Примеры препятствующих сборке микротрубочек средств включают, но не исчерпываются, дитерпеноиды или алкалоиды барвинка. Дитерпеноиды, полученные из натуральных источников, являются фазоспецифичными противораковыми средствами, которые действуют во время фаз G2/M клеточного цикла. Полагают, что дитерпеноиды стабилизируют -тубулиновую субъединицу микротрубочек, связываясь с этим белком. Далее разборка белка ингибируется, митоз прекращается, и происходит гибель клетки. Примеры дитерпеноидов включают, но не ограничиваются, паклитаксел и его аналог доцетаксел. Паклитаксел,(2R,3S)-N-бензоил-3-фенилизосерин-13-5,20-эпокси-1,2,4,7,10,13-гексагидрокситакс-11-ен-9-он-4,10-диацетат-2-бензоат, является натуральным дитерпеновым продуктом, выделенным из тиса коротколистного Taxus brevifolia и коммерчески доступен как раствор для инъекций ТАКСОЛ. Это член таксанового семейства терпенов. Впервые его выделили в 1971 г. Вани с соавт.(Wani et al., J. Am. Chem., Soc., 93:2325, 1971), которые описали его структуру с помощью химических и рентгеноструктурных методов. Один из механизмов его активности связан со способностью паклитаксела связывать тубулин, таким образом угнетая рост раковых клеток. Schiff et al., Proc. Natl., Acad., Sci.USA, 77:1561-1565 (1980); Schiff et al., Nature, 277:665-667 (1979); Kumar, J. Biol., Chem., 256: 1043510441 (1981). Обзор синтеза и антиракового действия некоторых производных паклитаксела см.:Chemistry 1986", Attaur-Rahman, P.W. Le Quesne, Eds. (Elsevier, Amsterdam, 1986), p. 219-235. Паклитаксел одобрен для клинического использования при лечении рефрактерного рака яичников в США (Markman et al., Yale Journal of Biology and Medicine, 64:583, 1991; McGuire et al., Ann. Intem, Med.,111:273, 1989) и лечения рака груди (Holmes et al., J. Nat. Cancer Inst, 83:1797, 1991). Есть данные, что его целесообразно использовать при лечении неоплазм кожи (Einzig et. al., Proc. Am. Soc. Clin. Oncol., 20:46),а также карцином головы и шеи (Forastire et. al., Sem. Oncol., 20:56, 1990). Также есть перспективы для лечения данным соединением поликистозной болезни почки (Woo et. al., Nature, 368:750. 1994), рака легкого и малярии. Лечение пациентов паклитакселом приводило к подавлению деятельности костного мозга на протяжении многих поколений клеток (multiple cell lineages, Ignoff, R.J. et. al., CancerChemotherapy Pocket Guide, 1998), зависящему от длительности приема доз, превышающих пороговую концентрацию (50 нМ) (Kearns, C.M. et. al., Seminars in Oncology, 3(6), p. 16-23, 1995).-8 017715 Доцетаксел, (2R,3S)-N-карбоксифенилизосерин-N-трет-бутил-13-5,20-эпокси-1,2,4,7,10,13 гексагидрокситакс-11-ен-9-он-4-ацетат-2-бензоата тригидрат коммерчески доступен как раствор для инъекций ТАКСОТЕР. Доцетаксел показан при лечении рака груди. Доцетаксел является полусинтетическим производным паклитаксела q.v., изготавливаемым из натурального предшественника, 10 диацетил-баккатина III, экстрагируемого из хвои тиса европейского. Размер дозы доцетаксела ограничивается развитием нейтропении. Алкалоиды барвинка являются фазоспецифичными противоопухолевыми средствами, получаемыми из барвинка. Алкалоиды барвинка действуют в фазе М (фазе митоза) клеточного цикла, специфически связываясь с тубулином. В результате связанные молекулы тубулина не способны полимеризоваться и формировать микротрубочки. Показано, что митоз останавливается на стадии метафазы, после чего происходит клеточная гибель. Примеры алкалоидов барвинка включают, но не ограничиваются, винбластин,винкристин и винорелбин. Винбластин, винкалейкобластина сульфат, коммерчески доступен как раствор для инъекций ВЕЛЬБАН. Несмотря на возможные показания к использованию данного средства в качестве второстепенной терапии при лечении различных солидных опухолей, оно показано преимущественно при лечении рака яичка и различных лимфом, включая болезнь Ходжкина; и лимфоцитарных и гистиоцитарных лимфом. Миелосупрессия является ограничивающим размер дозы побочным эффектом винбластина. Винкристин, винкалейкобластин, 22-оксо-, сульфат, коммерчески доступен как раствор для инъекций ОНКОВИН. Винкристин показан для лечения острых лейкемий, его включают в схему лечения ходжкинских и неходжскинских злокачественных лимфом. Наиболее обычными побочными эффектами винкристина являются алопеция и неврологические эффекты и, в меньшей степени, миелосупрессия и желудочно-кишечные мукозиты. Винорельбин,3',4'-дидегидро-4'-деокси-С'-норвинкалейкобластин[R-(R,R)-2,3 дигидроксибутандиоат (1:2) (соль)], коммерчески доступен как раствор для инъекций НАВЕЛЬБИН,являясь полусинтетическим алкалоидом барвинка. Винорельбин показан как самостоятельное средство или в комбинации с другими химиотерапевтическими средствами, такими как цисплатин, при лечении различных солидных опухолей, особенно немелкоклеточного рака легкого, распространенного рака груди, гормоно-резистентного рака простаты. Наиболее обычным побочным эффектом винорельбина является миелосупрессия. Координационные комплексы платины являются противораковыми средствами, не обладающими фазоспецифичностью, которые взаимодействуют с ДНК. Комплексы платины проникают в клетки опухоли, претерпевают гидратацию и формируют внутри- и межнитевые поперечные сшивки ДНК, отрицательно влияя на опухоль. Примеры комплексов платины включают, но не ограничиваются, цисплатин и карбоплатин. Цисплатин, цис-диаминдихлорплатина, коммерчески доступен как раствор для инъекций ПЛАТИНОЛ. Цисплатин показан преимущественно при лечении метастатического рака яичка и яичников и распространенного рака мочевого пузыря. Ограничивающим размер дозы побочным эффектом цисплатина является преимущественно нефротоксичность, которую можно контролировать гидратацией и диурезом, и ототоксичность. Карбоплатин, диамин[1,1-циклобутан-дикарбоксилат(2-)-O,O'] платины, коммерчески доступен как раствор для инъекций ПАРАПЛАТИН. Карбоплатин показан преимущественно как средство первостепенной и второстепенной терапии при лечении распространенной карциномы яичников. Размер дозы карбоплатина ограничивается подавлением деятельности костного мозга. Алкилирующие агенты являются противораковыми средствами, не обладающими фазоспецифичностью, и сильными электрофилами. Обычно алкилирующие агенты формируют ковалентные связи с ДНК путем алкилирования нуклеофильных фрагментов молекулы ДНК, таких как фосфатные, амино-, сульфгидрил-, гидроксил-, карбоксил- и имидазольные группы. Подобное алкилирование нарушает функции нуклеиновых кислот, что приводит к гибели клетки. Примеры алкилирующих агентов включают, но не ограничиваются, азотистые иприты, такие как циклофосфамид, мелфал и хлорамбуцил; алкилсульфонаты, такие как бусульфан; нитрозомочевины, такие как кармустин; триазены, такие как дакарбазин. Циклофосфамид, 2-[бис-(2-хлорэтил)амино]тетрагидро-2 Н-1,3,2-оксазафосфорин 2-оксид моногидрат, коммерчески доступен как раствор для инъекций ЦИТОКСАН. Циклофосфамид показан как самостоятельное средство или в комбинации с другими химиотерапевтическими средствами при лечении злокачественных лимфом, множественных миелом и лейкемий. Наиболее обычными побочными эффектами циклофосфамида, ограничивающими размер дозы, являются алопеция, тошнота, рвота, лейкопения. Мелфалан, 2-[бис-(2-хлорэтил)амино]-L-фенилаланин, коммерчески доступен как раствор для инъекций АЛКЕРАН. Мелфалан показан при паллиативном лечении множественных миелом и неоперабельных карцином яичников эпителиального происхождения. Наиболее обычным побочным эффектом мелфалана, ограничивающим размер дозы, является супрессия костного мозга. Хлорамбуцил, 4-[бис-(2-хлорэтил)амино]бензолбутановая кислота, коммерчески доступен как таблетки ЛЕУКЕРАН. Хлорамбуцил показан при паллиативном лечении хронических лимфоцитарных-9 017715 лейкемий, злокачественных лимфом, таких как лимфосаркома, гигантофолликулярная лимфома, болезнь Ходжкина. Наиболее обычным побочным эффектом хлорамбуцила, ограничивающим размер дозы, является подавление деятельности костного мозга. Бусульфан, 1,4-бутандиол диметансульфонат, коммерчески доступен как таблетки МИЛЕРАН. Бусульфан показан при паллиативном лечении хронической миелогенной лейкемии. Наиболее обычным побочным эффектом бусульфана, ограничивающим размер дозы, является подавление деятельности костного мозга. Кармустин, 1,3-[бис-(2-хлорэтил)-1-нитрозомочевина, коммерчески доступен как ампулы лиофилизата БиКНУ. Кармустин показан при паллиативном лечении как самостоятельное средство или в комбинации с другими средствами для лечения опухолей мозга, множественных миелом, болезни Ходжкина и неходжскинских лимфом. Наиболее обычным побочным эффектом кармустина, ограничивающим размер дозы, является отдаленная миелосупрессия. Дакарбазин, 5-(3,3-диметил-1-триазен)имидазол-4-карбоксамид, коммерчески доступен как ампулы препарата DTIC-Dome. Дакарбазин показан при лечении метастатических злокачественных меланом и в комбинации с другими средствами для второстепенной терапии болезни Ходжкина. Наиболее обычными побочными эффектами дакарбазина, ограничивающими размер дозы, являются тошнота, рвота и анорексия. Противоопухолевые антибиотики являются противораковыми средствами, не обладающими фазоспецифичностью, связывающимися с ДНК или внедряющимися в ее структуру. Обычно этот процесс приводит к стабилизации ДНК-комплексов или разрыву цепи, что прерывает нормальное функционирование нуклеиновых кислот и приводит к гибели клетки. Примеры противоопухолевых антибиотических средств включают, но не ограничиваются, актиномицины, такие как дактиномицин; антрациклины, такие как даунорубицин и доксорубицин; блеомицины. Дактиномицин, также известный как Актиномицин D, коммерчески доступен в инъецируемой форме КОСМЕГЕН. Дактиномицин показан при лечении опухоли Вильмса и рабдомиосаркомы. Наиболее обычными побочными эффектами дактиномицина, ограничивающими размер дозы, являются тошнота,рвота и анорексия. Даунорубицин, (8S-цис)-8-ацетил-10-[(3-амино-2,3,6-тридезоксиL-ликсогексопиранозил)окси]7,8,9,10-тетрагидро-6,8,11-тригидрокси-1-метокси-5,12-нафтацендиона гидрохлорид, коммерчески доступен в липосомальной инъецируемой форме ДАУНОКСОМ или как инъецируемое средство ЦЕРУБИДИН. Даунорубицин показан для индукции ремиссии при лечении острой нелимфоцитарной лейкемии и распространенной саркомы Капоши, связанной с ВИЧ. Наиболее обычным побочным эффектом даунорубицина, ограничивающим размер дозы, является миелосупрессия. Доксорубицин, (8S,10S)-10-[(3-амино-2,3,6-тридезоксиL-ликсогексопиранозил)окси]-8-гликолоил,7,8,9,10-тетрагидро-6,8,11-тригидрокси-1-метокси-5,12-нафтацендиона гидрохлорид, коммерчески доступен в инъецируемой форме РУБЕКС или АДРИАМИЦИН RDF. Доксорубицин показан преимущественно для лечения острой лимфоцитарной лейкемии и острой миелобластной лейкемии, но также является полезным соединением при лечении некоторых солидных опухолей и лимфом. Наиболее обычным побочным эффектом доксорубицина, ограничивающим размер дозы, является миелосупрессия. Блеомицин, смесь цитотоксических гликопептидных антибиотиков, выделенных из штаммаStreptomyces verticillus, коммерчески доступен как БЛЕНОКСАН. Блеомицин показан в качестве самостоятельного средства или в комбинации с другими средствами для паллиативного лечения плоскоклеточного рака, лимфом, карцином яичка. Наиболее обычными побочными эффектами блеомицина, ограничивающими размер дозы, являются легочная и кожная токсичность. Ингибиторы топоизомеразы II включают, но не ограничиваются, эпиподофиллотоксины. Эпиподофиллотоксины являются фазоспецифичными противораковыми средствами, полученными из растения мандрагоры. Эпиподофиллотоксины обычно воздействуют на клетки в фазах S и G2 клеточного цикла, образуя тройные комплексы, состоящие из топоизомеразы II и ДНК, что приводит к разрыву нитей ДНК. Разрывы накапливаются, и происходит гибель клетки. Примеры эпиподофиллотоксинов включают, но не ограничиваются, этопозид и тенипозид. Этопозид, 4'-диметил-эпиподофиллотоксин 9[4,6-0-(R)-этилиденD-глюкопиранозид], коммерчески доступен как раствор для инъекций или капсулы ВеПЕЗИД и обычно известен как VP-16. Этопозид показан как самостоятельное средство или в комбинации с другими химиотерапевтическими средствами при лечении рака яичка и немелкоклеточного рака легкого. Наиболее обычным побочным эффектом этопозида, ограничивающим размер дозы, является миелосупрессия. Встречаемость лейкопении имеет тенденцию превышать встречаемость тромбоцитопении. Тенипозид, 4'-диметил-эпиподофиллотоксин 9[4,6-0-(R)-тенилиденD-глюкопиранозид], коммерчески доступен как раствор для инъекций ВУМОН и обычно известен как VM-16. Тенипозид показан как самостоятельное средство или в комбинации с другими химиотерапевтическими средствами при лечении острой лейкемии у детей. Наиболее обычным побочным эффектом тенипозида, ограничивающим размер дозы, является миелосупрессия. Тенипозид может вызывать и лейкопению, и тромбоцитопению.- 10017715 Антиметаболитные противоопухолевые средства являются фазоспецифичными противоопухолевыми средствами, которые действуют в фазе S (синтез ДНК) клеточного цикла, ингибируя синтез ДНК или ингибируя синтез пуриновых или пиримидиновых оснований и таким образом ограничивая синтез ДНК. Соответственно, фаза S не развивается, и происходит гибель клетки. Примеры антиметаболитных противоопухолевых средств включают, но не ограничиваются, фторурацил, метотрексат, цитарабин, меркаптопурин, тиогуанин, гемцитабин. 5-Фторурацил, 5-фтор-2,4-(1 Н,3 Н)пиримидиндион, коммерчески доступен как фторурацил. Прием 5-фторурацила приводит к ингибированию синтеза тимидилата, 5-фторурацил также встраивается в РНК и ДНК. Обычно это приводит к гибели клетки. 5-Фторурацил показан как самостоятельное средство или в комбинации с другими химиотерапевтическими средствами при лечении карцином груди, толстой кишки, прямой кишки, желудка и поджелудочной железы. Побочными эффектами 5-фторурацила, ограничивающими размер дозы, являются миелосупрессия и мукозит. Другие фторпиримидиновые аналоги включают 5-фтордезоксиуридин (флоксуридин) и 5-фтордезоксиуридина монофосфат. Цитарабин, 4-амино-1D-арабинофуранозил-2(1 Н)-пиримидиндион, коммерчески доступен как ЦИТОЗАР-U и обычно известен как Ара-С. Показано, что цитарабин демонстрирует фазоспецифичность на стадии фазы S, ингибируя элонгацию ДНК за счет терминального встраивания циторабина в синтезируемую цепь ДНК. Цитарабин показан как самостоятельное средство или в комбинации с другими химиотерапевтическими средствами при лечении острой лейкемии. Другие аналоги цитидина включают 5-азацитидин и 2',2'-дифтордезоксицитидин (гемцитабин). Цитарабин вызывает лейкопению, тромбоцитопению и мукозит. Меркаптопурин, 1,7-дигидро-6H-пурин-6-тиона моногидрат, коммерчески доступен как ПУРИНЕТОЛ. Меркаптопурин демонстрирует фазоспецифичность на стадии фазы S, ингибируя синтез ДНК,механизм чего до сих пор не выяснен. Меркаптопурин показан как самостоятельное средство или в комбинации с другими химиотерапевтическими средствами при лечении острой лейкемии. Ожидаемым побочным эффектом больших доз меркаптопурина является миелосупрессия. Используемым аналогом меркаптопурина является азатиоприн. Тиогуанин, 2-амино-1,7-дигидро-6H-пурин-6-тион, коммерчески доступен как TABLOID. Тиогуанин демонстрирует фазоспецифичность на стадии фазы S, ингибируя синтез ДНК, механизм чего до сих пор не выяснен. Тиогуанин показан как самостоятельное средство или в комбинации с другими химиотерапевтическими средствами при лечении острой лейкемии. Наиболее обычными побочными эффектами приема тиогуанина, ограничивающими размер дозы, являются миелосупрессия, включая лейкопению,тромбоцитопению и анемию. В то же время имеют место и желудочно-кишечные побочные эффекты,которые могут ограничивать размер дозы. Другие пуриновые аналоги включают пентостатин, эритрогидроксинониладенин, флюдарабин фосфат и кладрибин. Гемцитабин, 2'-дезокси-2',2'-дифторцитидина моногидрохлорид (-изомер), коммерчески доступен как ГЕМЗАР. Гемцитабин демонстрирует фазоспецифичность на стадии фазы S, блокируя развитие клетки при переходе из фазы G1 в фазу S. Гемцитабин показан в комбинации с цисплатином при лечении местно распространенного немелкоклеточного рака легкого и отдельно при лечении местно распространенного рака поджелудочной железы. Наиболее обычным побочным эффектом приема гемцитабина, ограничивающим размер дозы, является миелосупрессия, включая лейкопению, тромбоцитопению и анемию. Метотрексат, N-[4(2,4-диамино-6-птеридинил)метил]метиламино]бензоил]-L-глутаминовая кислота, коммерчески доступен как метотрексат натрия. Метотрексат демонстрирует фазоспецифичность на стадии фазы S, ингибируя синтез ДНК, репарацию и/или репликацию за счет ингибирования дигидрофолат-редуктазы, необходимой для синтеза пуриновых нуклеотидов и тимидилата. Метотрексат показан как самостоятельное средство или в комбинации с другими химиотерапевтическими средствами при лечении хориокарциномы, менингеальной лейкемии, неходжкинской лимфомы и карцином груди, головы, шеи, яичников и мочевого пузыря. Ожидаемыми побочными эффектами приема метотрексата являются миелосупрессия (лейкопения, тромбоцитопения и анемия) и мукозит. Камптотецины, включая камптотецин и производные камптотецина, доступны или находятся в разработке как ингибиторы топоизомеразы I. Показано, что цитотоксическая активность камптотецинов связана с их ингибирующей топоизомеразу I активностью. Примеры камптотецинов включают, но не ограничиваются, иринотекан, топотекан и различные оптические формы 7-(4-метилпиперазинометилен)10,11-этилендиокси-20-камптотецина, описанные ниже. Иринотекан HCl, (4S)-4,11-диэтил-4-гидрокси-9-[(4-пиперидинопиперидино)карбонилокси]-1 Нпирано[3',4',6,7]индолизино[1,2-b]хинолин-3,14(4 Н,12 Н)-дион гидрохлорид, коммерчески доступен как раствор для инъекций КАМПТОЗАР. Иринорексан является производным камптотецина, связывающимся с помощью активного метаболита SN-38 с комплексом топоизомераза I-ДНК. Показано, что цитотоксичность является результатом невосстанавливаемого двойного разрыва цепи, вызванного взаимодействием тройного комплекса топоизомераза I:ДНК:иринтекан или SN-38 с ферментами репликации. Иринорексан показан при лечении ме- 11017715 тастатического рака толстой или прямой кишки. Побочными эффектами иринорексана HCl, ограничивающими размер дозы, являются миелосупрессия, включая нейтропению, и желудочно-кишечные эффекты, включая диарею. Топотекан HCl, (S)-10-[(диметиламино)метил]-4-этил-4,9-дигидрокси-1 Н-пирано[3',4',6,7]индолизино[1,2-b]хинолин-3,14[4 Н,12 Н]-дион моногидрохлорид, коммерчески доступен как раствор для инъекций ГИКАМТИН. Топотекан является производным камптотецина, связывающимся с комплексом топоизомераза I-ДНК и препятствующим повторному лигированию разрывов отдельных цепей, внесенных топоизомеразой I в связи с напряжением скручивания молекулы ДНК. Топотекан показан в качестве второстепенной терапии при лечении метастатической карциномы яичников и мелкоклеточного рака легкого. Побочным эффектом топотекана HCl, ограничивающим размер дозы, является миелосупрессия, преимущественно нейтропения. Также представляет интерес производное камптотецина формулы А (см. ниже), находящееся в разработке, включая и форму рацемической смеси (R,S), и R- и S-энантиомеры: известное под химическим названием "7-(4-метилпиперазинометилен)-10,11-этилендиокси-20(R,S)камптотецин" (рацемическая смесь), или "7-(4-метилпиперазинометилен)-10,11-этилендиокси-20(R)камптотецин""7-(4-метилпиперазинометилен)-10,11-этилендиокси-20(S)камптотецин" (S-энантиомер). Такие соединения, также как и родственные им соединения, описаны,включая методы получения, в патентах США 6063923; 5342947; 5559235; 5491237 и в находящейся на рассмотрении патентной заявке США 08/977217, поданной 24 ноября 1997 г. Гормоны и аналоги гормонов являются соединениями, используемыми при лечении раков, в которых существует взаимосвязь между гормоном (гормонами) и развитием и/или отсутствием развития рака. Примеры гормонов и аналогов гормонов, применяемых при лечении рака, включают, но не ограничиваются, адренокортикостероиды, такие как преднизон и преднизолон, которые используют при лечении злокачественных лимфом и острых лейкозов у детей; аминоглютетимиды и другие ингибиторы ароматазы, такие как анастрозол, летрозол, воразол и экземестан, используемые при лечении адренокортикальной карциномы и гормонзависимой карциномы груди, содержащей рецепторы эстрогена; прогестагены,такие как мегестрола ацетат, используемые при лечении гормонзависимого рака груди и эндометриальной карциномы; эстрогены, андрогены и антиандрогены, такие как флутамид, нилутамид, бикалутамид,ципротерона ацетат; и 5-редуктазы, такие как финастерид и дутастерид, используемые при лечении карциномы простаты и доброкачественной гипертрофии простаты; антиэстрогены, такие как тамоксифен, торемифен, ралоксифен, дролоксифен, идоксифен, также как селективные модуляторы рецепторов эстрогена (SERM), такие как описаны в патентах США 5681835, 5877219 и 6207716, используемые при лечении гормонозависимого рака груди и других восприимчивых раков; и гонадолиберин (GnRH) и аналоги таких, которые стимулируют высвобождение лютеинизирующего гормона (LH) и/или фолликулостимулирующего гормона (FSH) для лечения карциномы простаты, например, агонистами и антагонистами люлиберина, такими как гозерелина ацетат и леупролид. Ингибиторы каскада реакций сигнальной трансдукции - это те ингибиторы, которые блокируют или ингибируют химические процессы, вызывающие внутриклеточные изменения. Обсуждаемые здесь изменения - это клеточная пролиферация или дифференциация. Ингибиторы сигнальной трансдукции, используемые в настоящем изобретении, включают ингибиторы рецепторных тирозинкиназ, нерецепторных тирозинкиназ, блокаторы SH2/SH3 доменов, серин/треониновые киназы, фосфотидил-инозитол-3 киназы, сигнальный миоинозитол, онкогены ras. Некоторые тирозиновые протеинкиназы катализируют фосфорилирование специфичных тирозиновых остатков в различных протеинах, участвующих в регуляции роста клетки. Такие тирозиновые протеинкиназы можно в широком смысле отнести к рецепторным или нерецепторным киназам. Рецепторные тирозинкиназы являются трансмембранными белками, имеющими внеклеточный домен, связывающий лиганды, трансмембранный домен и тирозинкиназный домен. Рецепторные тирозинкиназы участвуют в регуляции роста клетки и в общем смысле называются рецепторами факторов роста. Показано, что нецелесообразная или неконтролируемая активация многих из этих киназ, т.е. аберрантная активность киназного рецептора фактора роста, например, из-за сверхэкспрессии или мутации, ведет к неконтролируемому росту клетки. Соответственно, аберрантная активность таких киназ связана с ростом злокачественной ткани. Следовательно, ингибиторы таких киназ могли бы обеспечить способ лечения рака. Рецепторы факторов роста включают, например, рецептор эпидермального фактора роста (EGFr),рецептор фактор роста тромбоцитов (PDGFr), erbB2, erbB4, рецептор фактора роста эндотелия сосудов(VEGFr), тирозинкиназу с доменами, гомологичными иммуноглобулин-подобному и эпидермальному фактору роста (TIE-2), рецептор инсулинового фактора роста - I (IGFI), рецепторы стимулирующего колонии макрофагов фактора (cfms), BTK, ckit, cmet, фактора роста фибробластов (FGF), Trk-рецепторы,(TrkA, TrkB и TrkC), рецепторы эфрина (eph), RET-протоонкоген. Некоторые ингибиторы рецепторов факторов роста находятся в разработке и включают антагонисты лигандов, антитела, ингибиторы тирозинкиназы и антисмысловые олигонуклеотиды. Рецепторы факторов роста и средства, которые ингибируют функции рецепторов факторов роста, описаны, например, в Kath, John С., Ехр. Opin. Ther. Patentsreceptors as targets", New Molecular Targets for Cancer Chemotherapy, ed. Workman, Paul and Kerr, David,CRC press 1994, London. Тирозинкиназы, которые не являются киназами-рецепторами факторов роста, называются нерецепторными киназами. Нерецепторные тирозиновые киназы для использования в настоящем изобретении,являющиеся мишенями или потенциальными мишенями антираковых лекарств, включают cSrc, Lck, Fyn,Yes, Jak, cAbl, FAK (киназу фокальной адгезии), тирозинкиназу Брутона и Bcr-Abl. Такие нерецепторные тирозинкиназы и средства, которые ингибируют функции нерецепторных тирозинкиназ, описаны вSinh, S. and Corey, S.J. (1999), Journal of Hematotherapy and Stem Cell Research, 8(5):465-80 и Bolen, J.B.,Brugge, J.S. (1997), Annual review of Immunology. 15: 371-404. Блокаторы доменов SH2/SH3 являются средствами, которые прерывают SH2 и SH3 доменное связывание разнообразных энзимов или адапторных белков, включая PI3-K р 85 субъединицу, киназы семейства Scr, адапторные молекулы (Shc, Crk, Nck, Grb2) и ras-GAP. Домены SH2/SH3 как мишени для противораковых средств обсуждаются в Smithgall, Т.Е. (1995), Journal of Pharmacological andToxicological Methods. 34(3), 125-32. Ингибиторы серин/треониновых киназ, включая блокаторы каскада МАР-киназ, которые включают блокаторы Raf-киназ (rafk), митоген- или внеклеточных регуляторных киназ (MEK), внеклеточных регуляторных киназ (ERK); блокаторы протеинкиназ С, включая блокаторы PKC (альфа, бета, гамма, эпсилон, мю, лямбда, йота, зета). Семейство киназ IkB (IKKa, IKKb), семейство киназ PKB, члены семейства киназ В и TGF бета рецепторные киназы. Такие серин/треониновые киназы и ингибиторы таковых описаны в Yamamoto, Т., Taya, S., Kaibuchi, K. (1999), Journal of Biochemistry. 126(5), 799-803; Brodt, P.,Samani, A., and Navab, R. (2000), Biochemical Pharmacology, 60. 1101-1107; Massague, J., Weis-Garcia, F.(1996), Cancer Surveys. 27:41-64; Philip, P.A., and Harris, A.L. (1995), Cancer Treatment and Research. 78:327, Lackey, K. et al., Bioorganic and Medicinal Chemistry Letters, (10), 2000, 223-226; патент США 6268391 и Martinez-lacaci, L., et al., Int. J. Cancer (2000), 88(1), 44-52. Ингибиторы членов семейства фосфотидил-инозитол-3-киназ включают блокаторы PI3-киназы,ATM, DNA-PK и Ku и также могут использоваться в настоящем изобретении. Такие киназы описаны вAbraham, R.T. (1996), Current Opinion in Immunology. 8(3) 412-8; Canman, C.E., Lim, D.S. (1998),Oncogene. 17 (25), 3301-3308; Jackson, S.P. (1997), International Journal of Biochemistry and Cell Biology. 29(7):935-8 и Zhong, H. et al., Cancer res, (2000), 60(6), 1541-1545. Также представляют интерес для настоящего изобретения ингибиторы сигнального миоинозитола,такие как блокаторы фосфолипазы С и аналоги миоинозитола. Такие ингибиторы сигналов описаны вand David Kerr, CRC press 1994, London. Другая группа ингибиторов каскада реакций сигнальной трансдукции является ингибиторами онкогена ras. Такие ингибиторы включают ингибиторы фарнезилтрансферазы, геранил-геранил трансферазы,протеаз СААХ, а также антисмысловые олигонуклеотиды, рибозимы и иммунотерапию. Показано, что такие ингибиторы блокируют активацию ras в клетках, содержащих дикий тип мутантного ras, таким образом действуя как антипролиферационное средство. Ингибирование онкогенов ras обсуждается вAshby, M.N. (1998), Current Opinion in Lipidology. 9(2), 99-102 и BioChim. Biophys. Acta, (1999),1423(3):19-30. Как упомянуто выше, антитела-антагонисты к рецепторным киназам, связывающим лиганды, могут также служить ингибиторами сигнальной трансдукции. Эта группа ингибиторов каскада реакций сигнальной трансдукции включает использование гуманизированных антител для внеклеточного связывающего лиганды домена тирозинкиназ, например специфические антитела Imclone C225 EGFR (см.tumor growth in mice, Cancer Res. (2000), 60, 5117-5124). Ингибиторы ангиогенных нерецепторных киназ также могут быть использованы в настоящем изобретении. Ингибиторы ангиогенеза, родственные VEGFR и TIE2, обсуждаются выше в связи с ингибиторами сигнальной трансдукции (оба рецептора являются рецепторными тирозинкиназами). В целом ангиогенез связан с передачей сигнала erbB2/EGFR, поскольку показано, что ингибиторы erbB2 и EGFR- 13017715 ингибируют ангиогенез, преимущественно экспрессию VEGF. Соответственно, ингибиторы нерецепторных тирозинкиназ могут быть использованы в сочетании с соединениями настоящего изобретения. Например, анти-VEGF антитела, которые не узнают VEGFR (рецепторная тирозинкиназа), но связываются с лигандами; низкомолекулярные ингибиторы интегрина (v3), которые будут угнетать ангиогенез; эндостатин и ангиостатин (не-RTK) могут также быть полезны в комбинации с описанными соединениями(см. Bruns C.J. et al. (2000), Cancer Res., 60:2926-2935; Schreiber A.B., Winkler M.E., and Derynck R. (1986),Science, 232:1250-1253; Yen L. et al. (2000), Oncogene. 19:3460-3469). Средства, используемые в иммунотерапевтических схемах лечения, также могут быть полезны в комбинации с соединениями формулы (I). Есть много иммунологических стратегий вызвать иммунный ответ. В большинстве случаев эти стратегии попадают в сферу противоопухолевой вакцинации. Эффективность иммунологических подходов можно значительно расширить за счет комбинированного ингибирования сигнальных каскадов реакций с использованием низкомолекулярных ингибиторов. Обсуждение иммунологического подхода/противоопухолевых вакцин к erbB2/EGFR обнаружено в Reilly R.T. etRes. 58: 1965-1971. Средства, используемые в проапоптотических схемах лечения (например, bcl-2 антисмысловые олигонуклеотиды), также могут быть использованы в комбинации с настоящим изобретением. Члены семейства белков bcl-2 блокируют апоптоз. Повышенная регуляция bcl-2 по этой причине связана с хеморезистентностью. Показано, что эпидермальный фактор роста (EGF) стимулирует антиапоптотические члены семейства bcl-2 (а именно mcl-1). В силу этого стратегии, направленные на снижение экспрессии bcl-2 в опухолях, продемонстрировали клинические преимущества и находятся теперь в фазе испытаний II/III,именно Genta' s G3139 bcl-2 антисмысловой олигонуклеотид. Такие проапоптотические стратегии с использованием стратегии антисмысловых олигонуклеотидов для bcl-2 обсуждаются в Water J.S. et al.,(2000), J. Clin. Oncol. 18:1812-1823 и Kitada S. et al., (1994), Antisense Res. Dev. 4:71-79. Ингибиторы передачи сигналов клеточного цикла ингибируют молекулы, вовлеченные в контроль клеточного цикла. Семейство протеинкиназ, которые называются циклинзависимыми киназами (CDK), и их взаимодействие с семейством белков, называемых циклинами, контролирует последовательность клеточного цикла эукариот. Координированная активация и инактивация разных циклин/CDK-комплексов необходимы для нормальной последовательности в процессе клеточного цикла. Некоторые ингибиторы передачи сигналов клеточного цикла находятся в стадии разработки. Например, примеры циклинзависимых киназ, включая CDK2, CDK4 и CDK6 и их ингибиторы, описаны, например, в Rosania et al., Exp.Opin. Ther. Patents (2000), 10(2):215-230. В одном из вариантов выполнения способ лечения рака по заявленному изобретению включает совместный прием соединений формулы (I) и/или фармацевтически приемлемой соли, гидрата, сольвата или пролекарства таковых и по меньшей мере одного противоопухолевого средства, такого как выбранное из группы, состоящей из препятствующих сборке микротрубочек средств, координационных комплексов платины, алкилирующих агентов, антибиотических средств, ингибиторов топоизомеразы II, антиметаболитов, ингибиторов топоизомеразы I, гормонов и аналогов гормонов, ингибиторов каскада реакций сигнальной трансдукции, ингибиторов ангиогенных нерецепторных тирозинкиназ, иммунотерапевтических средств, проапоптотических средств, ингибиторов передачи сигналов клеточного цикла. Настоящее изобретение относится к использованию непептидных агонистов рецептора TPO при лечении предраковых состояний у млекопитающих, включая человека. Настоящее изобретение относится к использованию непептидных агонистов рецептора TPO при лечении рака у млекопитающих, включая человека. Известно, что TPO имеет различные эффекты, включая антиапоптотическое влияние/повышение выживаемости мегакариоцитов, тромбоцитов и стволовых клеток, и пролиферативный эффект на стволовые клетки и клетки мегакариоцитов (Kuter D.J. Seminars in Hematology, 2000, 37, 41-9). Эти виды активности TPO эффективно повышают число стволовых клеток и клеток-предшественников, поэтому при использовании TPO вместе с другими цитокинами, индуцирующими дифференциацию, имеет место синергетический эффект. Непептидные агонисты рецептора TPO настоящего изобретения также применяют при воздействии на клетки для их выживаемости и/или пролиферации вместе с другими цитокинами,которые воздействуют на выживаемость и/или пролиферацию клеток. Такого рода другие средства включают, но не ограничиваются, G-CSF, GM-CSF, TPO, М-CSF, ЕРО, Gro-beta, IL-11, SCF, FLT3 лиганд, LIF, IL-3, IL-6, IL-1, Progenipoietin, NESP, SD-01 или IL-5 или биологически активные производные любого из ранее упомянутых средств, KT6352 (Shiotsu Y. et al., Exp. Hemat. 1998, 26, 1195-1201),uteroferrin (Laurenz J.C., et al., Comp. Biochem.Phvs., Part A. Physiology, 1997, 116, 369-77), FK23(Haseqawa Т., et al., Int. J. Immunopharm., 1996, 18, 103-112) и другие молекулы, оказывающие антиапоптотическое, пролиферативное действие или повышающие выживаемость стволовых клеток, клетокпредшественников или других клеток, экспрессирующих рецепторы TPO. Квалифицированный в данной области техники специалист может с легкостью определить известными методами, является ли соединение непептидным агонистом рецептора TPO и включено ли, таким образом, в сферу настоящего изобретения.- 14017715 Например, можно использовать следующие виды анализов. Анализ люциферазной активности. Свойства соединений как непептидных агонистов рецептора TPO тестируются анализом люциферазной активности, как описано у Lamb, et al., Nucleic Acids Research, 23:3283-3289 (1995) и Seidel, et al.,Proc. Natl. Acad. Sci., USA, 92: 3041-3045 (1995) с помощью замещения TPO-чувствительных клеток линии BaF3 (Vigon et al., Proc. Natl. Acad. Sci. USA, 1992, 89, 5640-5644) на клетки HepG2, применяемый для этой цели. Клетки BaF3 мыши экспрессируют рецепторы TPO и полностью соответствуют схеме активации STAT (переносчики сигнала и активаторы транскрипции), наблюдаемой в исходных мышиных клетках и клетках костного мозга человека. Пролиферационный анализ. Соединения тестируют пролиферационным анализом in vitro, используя человеческие клетки линииUT7TPO. Клетки линии UT7TPO - это линия человеческих мегакариобластных клеток, которая экспрессирует TPO-R, их рост и выживаемость зависит от присутствия TPO (Komatsu et al., Blood, 1996, 87,4552). Дифференционный анализ. Соединения тестируют на их способность стимулировать созревание мегакариоцитов из клеток костного мозга человека. При выполнении этого анализа очищенные клетки-предшественники CD34+ человека инкубируют в жидкой среде с тестируемым соединением в течение 10 дней, после чего с помощью проточной цитометрии измеряют количество клеток, экспрессирующих трансмембранный гликопротеин CD41 (gpIIb) (см. Cwirla, S.E. et al., Science, 1997, 276, 1696). Фармацевтически активные соединения в рамках этого изобретения применяют как непептидные агонисты рецептора TPO у людей при необходимости таковых. Способность непептидных агонистов рецептора TPO лечить рак продемонстрирована их активностью в следующих видах анализа. Пролиферационный анализ раковых клеток. Для этого анализа использовали плоскодонные 96-луночные микротитровочные плашки для клеточных культур (Costar, Cambridge, MA). Для обеспечения повторности культуры клеток вносили в 4 лунки, каждая лунка содержала 1104 клеток. Шесть концентраций соединения А (от 40 мкг/мл до 100 нг/мл) анализировали отдельно в присутствии 10 нг/мл G-CSF, 100 нг/мл TPO или 5 ед/л ЕРО. Клетки также анализировали отдельно в среде, отдельно в G-CSF, отдельно в TPO, отдельно в ЕРО, чтобы установить 100% значение контроля. Конечный объем в каждой лунке составил 200 мкл. Плашки поместили в увлажненный СО 2-инкубатор при 37 С на 3 дня. Пролиферацию измеряли по поглощению меченного тритием тимидина (3H-TdR) пульсирующими лунками с 1 мк Ci 3H-TdR в течение последних 18 ч инкубации, выдерживая плашку на 96-луночном сборщике клеток (Brandel 96-well cell harvester(Gaithersburg, MD и измеряя радиоактивность на плоском фильтре сцинцилляционного счетчика(Wallac 1450 Microbeta TriLux scintillation counter (Turku, Finland. Влияние соединения A определяли при сравнении результатов, полученных на обработанных анализируемым соединением клетках и контрольных клетках (100% контроль), см. фиг. 1-5. Активация Akt в тромбоцитах человека, обработанных TPO или соединением А. Промытые тромбоциты человека, полученные от здоровых волонтеров, инкубировали в среде[0,33% DMSO], 100 нг/мл TPO [рекомбинантный тромбопоэтин человека, полученный от RD Systems,Inc., Minneapolis, MN, USA] или SB (SB=Соединение A в Блоте 1) (10 мМ) в течение 15 мин отдельно или в течение 13 мин отдельно и в течение 2 мин с 1 мМ ADP (+ADP). Экстракт протеина исследовали на активацию Akt (Ser473). Результаты представляют три независимых эксперимента. Соединение А сравнивали с TPO тробоцитов человека путем изучения каскада реакций сигнальной трансдукции, который активируется посредством стимуляции TPOR [рецептор TPO]; в частности, активации каскада Pi3K/Akt [см. Chen, J., et al., Blood, 86, 4054-4062 (1995); Kojima, H., et al., ThrombosisHaemostassis, 74, 1541-1545 (1995); Ezumi, Y., et al., FEBS Letters, 374, 48-52 (1995)]. Инкубация препаратов промытых тромбоцитов с TPO (Блот 1, фиг. 6) привела к достоверной активации Akt, что продемонстрировано путем использования антител, направленных против специфически фосфорилированных Akt.- 15017715 В то же время при использовании соединения A (названного SB в блоте 1) активации не наблюдали. К тому же, преинкубация с TPO в комбинации с ADP приводила к достоверному увеличению активацииAkt (1 мкМ) по сравнению с TPO или ADP отдельно (отсутствие активации). Более того, увеличенную активацию обнаружили при инкубации тромбоцитов с соединением A перед добавлением ADP. Эти результаты показывают, что стимуляция TPOR непептидным агонистом рецептора TPO, соединением A, не приводит к фосфорилированию Akt, тогда как стимуляция TPO приводит к фосфорилированию Akt. Поскольку активность Akt связана с некоторыми раками, эти результаты обеспечивают одно возможное объяснение для антираковой активности непептидного агониста рецептора TPO в целом и соединения A в частности. Анализ клеток рака печени.HepG2 является клеточной линией злокачественной гепатомы человека. Активная детерминация клеток была выполнена на клетках HepG2 посредством внесения 2104 клеток/мл в 96-луночную плашку в культуральной среде, содержащей 10% FBS, и инкубации в течение ночи в 5% СО 2 при 37 С. После этого клетки обработали Соединением А в концентрации 0, 0,1, 0,4, 1, 4, 10, 40 мкг/мл и инкубировали в течение 72 ч. Пролиферацию клеток измеряли с помощью реагента CellTiter Glo (Promega) в соответствии с протоколом производителя. Данные являются усредненными по 4 лункам, приведенными в процентах от контроля (0 мкг/мл соединением А). Соединение A вызывает уменьшение количества жизнеспособных клеток, IC50 составляет приблизительно 6 мкг/мл (фиг. 7). Пролиферационный анализ линий клеток солидных опухолей. Методология cell titer glo. Клетки в экспоненциальной фазе роста высевали в 96-луночную плашку, 2500 клеток/лунку в 50 мкл среды и инкубировали при 37 С в течение ночи в 5% CO2. Анализ жизнеспособности люминесцирующих клеток (The Cell Titer Glo Luminescent Cell Viability Assay (ProMega Corp выполнен в соответствии с инструкциями производителя. В течение короткого периода после 30-минутной инкубации при комнатной температуре 100 мкл реагент CELL Titer Glo добавили в каждую лунку и перемешивали в течение 2 мин. После 10-минутной инкубации при комнатной температуре измеряли люминесценцию с помощью измерителя люминесценции PerkinElmer Microbeta luminescence counter. IC50 определили с помощью EXCel Fit 4.2.1. Эффект соединения A показан в таблице. Источники, в которых описана методология Cell Titer Glo, включают следующие: Zhelev et al.,Cancer Chemother Pharmacol. 2004, 53:267-275; McCabe, et al. (2006), Cancer Res. 66, 8109-8115 иGauduchon, et al. (2005) , Clin. Cancer Res. 11, 2345-2354. Многие современные схемы лечения рака и предраковых состояний токсичны для пациента и/или вызывают побочные эффекты, требующие периодически прекращать лечение для восстановления после токсических эффектов и/или исчезновения неблагоприятных эффектов. Такой период восстановления также дает возможность восстанавливаться раку или предраковому состоянию. Одно преимущество соединений данного изобретения, непептидных агонистов рецептора TPO, соответственно соединения, выбранного из следующих: 3'-N'-[1-(3,4-диметилфенил)-3-метил-5-оксо-1,5-дигидропиразол-4-илиден]гидразино-2'гидроксибифенил-3-карбоновая кислота; 3-N'-[1-(3,4-диметилфенил)-3-метил-5-оксо-1,5-дигидропиразол-4-илиден]гидразино-2'-гидрокси 3'-тетразол-5-илбифенил; 1-(3-хлоро-5-[4-(4-хлортиофен-2-ил)-5-(4-циклогексилпиперазин-1-ил)тиазол-2-ил]карбамоилпиридин-2-ил)пиперидин-4-карбоновая кислота; 3'-N'-[1-(3,5-диметилфенил)-2-оксо-6-трифторметил-1,2-дигидроиндол-3-илиден]гидразино-2'гидроксибифенил-3-карбоновая кислота; 2'-гидрокси-3'-N'-[2-оксо-1-(4-пропилфенил)-1,2-дигидроиндол-3-илиден]гидразинобифенил-4- 16017715 карбоновая кислота; и/или их фармацевтически приемлемых солей,это то, что эти соединения считаются в целом менее токсичными, чем стандартная противораковая терапия, и допускается их прием на повседневной основе на протяжении долгого периода времени, по соответствующей схеме более 3 месяцев, по соответствующей схеме более 6 месяцев, по соответствующей схеме более 9 месяцев, по соответствующей схеме более 1 года, за счет чего обеспечивается продолжительное лечение рака или предракового состояния. Это преимущество можно реализовать при самостоятельном приеме непептидного агониста рецептора TPO или при его совместном приеме с другим противоопухолевым средством. Даже если прием другого противоопухолевого средства периодически останавливают, прием непептидного агониста рецептора TPO можно продолжать, чтобы обеспечить устойчивое лечение рака или предракового состояния. Таким образом, настоящее изобретение обеспечивает способ лечения рака у млекопитающих,включая человека, в том числе когда рак выбран из мозга (глиомы), глиобластомы, лейкемии, синдрома Банаяна-Зонана, болезни Коудена, болезни Лермитта-Дюклоса, груди, воспалительного рака груди, опухоли Вильмса, саркомы Юинга, рабдомиосаркомы, эпендимомы, медуллобластомы, толстой кишки, головы и шеи, почки, легкого, печени, меланомы, яичникового, поджелудочной железы, простаты, саркомы, остеосаркомы, гигантоклеточной опухоли кости и щитовидной железы, T-лимфобластного лейкоза,хронического миелолейкоза, хронического лимфолейкоза, волосатоклеточного лейкоза, острого лимфобластного лейкоза, хронического нейтрофильного лейкоза, острого T-лимфобластного лейкоза, плазмацитомы, иммунобластного крупноклеточного лейкоза, лимфомы из клеток мантийной зоны, мегакариобластного лейкоза, множественной миеломы, острого мегакариоцитарного лейкоза и эритролейкоза, злокачественной лимфомы, ходжкинской лимфомы, неходжскинской лимфомы, T-лимфобластной лимфомы,лимфомы Беркитта, фолликулярной лимфомы, нейробластомы, рака мочевого пузыря, карциномы уротелия, рака легкого, рака вульвы, рака шейки матки, рака эндометрия, рака почки, мезотелиомы, рака пищевода, рака слюнной железы, гепатоцеллюлярного рака, рака желудка, рака носоглотки, рака щеки, рака рта, стромальной опухоли желудочно-кишечного тракта и рака яичка, который заключается в приеме эффективной дозы непептидного агониста рецептора TPO, млекопитающими, включая человека, при необходимости такового. Таким образом, настоящее изобретение обеспечивает способ лечения предраковых состояний у млекопитающих, включая человека, в том числе когда предраковое состояние выбрано из внутриэпителиальной неоплазии шейки матки, моноклональной гаммапатии неизвестной этиологии, миелодиспластического синдрома, апластической анемии, поражения шейки матки, кожных родинок (премеланомы),внутриэпителиальной (внутрипротоковой) неоплазии предстательной железы, протоковой карциномы insitu, полипов толстой кишки, тяжелого гепатита или цирроза, который заключается в приеме эффективной дозы непептидного агониста рецептора TPO млекопитающими, включая человека, при необходимости такового. Пациент может принимать лекарство при необходимости такового любым обычным путем приема,включая, но не ограничиваясь, внутривенный, внутримышечный, пероральный, подкожный, интрадермальный и парентеральный. Непептидные агонисты рецептора TPO помещают в удобную лекарственную форму, такую как капсулы, таблетки, растворы для инъекций. Применимы твердые или жидкие фармацевтические наполнители. Твердые наполнители включают крахмал, лактозу, двуводный сульфат кальция, сульфат кальция,сахарозу, тальк, желатин, агар, пектин, камедь, стеарат магния, стеариновую кислоту. Жидкие наполнители включают сироп, ореховое масло, оливковое масло, раствор хлорида натрия и воду. Аналогично,наполнитель или растворитель может включать любой материал для замедленного высвобождения, такой как глицерил моностеарат или глицерил дистеарат, в самостоятельном виде или с воском. Количество твердого наполнителя широко варьирует, однако предпочтительно, чтобы оно составляло от около 25 мг до около 1 г на единицу дозировки. При использовании жидких носителей препарат будет в форме сиропа, эликсира, эмульсии, мягких желатиновых капсул, стерильной жидкости для инъекций, такой как ампулы или водная или неводная жидкая суспензия. Фармацевтические препараты изготавливают в соответствии с обычными технологиями химиковфармацевтов, включая смешивание, гранулирование, прессование, при необходимости, для таблетированных форм, или смешивание, наполнение и растворение ингредиентов, в случае необходимости, для получения желаемых пищевых или парентеральных препаратов. Дозы фармацевтически активных соединений в фармацевтических единицах дозировки, как описано выше, будут эффективным, нетоксичным количеством, предпочтительно выбранным из диапазона 0,001-100 мг/кг активного соединения, предпочтительно 0,002-50 мг/кг. При лечении людей непептидным агонистом рецептора TPO выбранную дозу принимают предпочтительно 1-6 раз в день, перорально или парентерально. Предпочтительные формы парентерального приема включают местную, ректальную,трансдермальную, путем инъекций и продолжительную путем инфузии. Единицы дозировки при пероральном приеме у людей по соответствующей схеме содержат от 0,05 до 3500 мг, по соответствующей схеме содержат от 0,1 до 3000 мг, по соответствующей схеме содержат от 10 до 200 мг активного соеди- 17017715 нения. Предпочтителен пероральный прием с использованием низких дозировок. Парентеральный прием высоких доз, тем не менее, тоже можно использовать, если это безопасно и удобно для пациента. Квалифицированные в данной области техники специалисты могут без труда определять оптимальные дозы для приема, которые зависят от используемого непептидного агониста рецептора TPO, концентрации препарата, режима приема и стадии заболевания. Дополнительные факторы, зависящие от пациента, которого лечат, включая его возраст, вес, диету и время приема, будут приводить к необходимости регулировать размер дозы. Способ лечения рака у млекопитающих, включая человека, по изобретению содержит прием пациентом, нуждающимся в таковом, терапевтически эффективных доз фармацевтически активного соединения настоящего изобретения. Настоящее изобретение относится к использованию соединений, являющихся непептидными агонистами рецептора TPO, при лечении рака у млекопитающих, включая человека. Настоящее изобретение относится к приему in vivo непептидного агониста рецептора TPO при лечении рака у млекопитающих, включая человека. Данное изобретение также предусматривает использование соединения формулы (I) при изготовлении медикамента для использования при лечении рака у млекопитающих, включая человека. Данное изобретение также предусматривает использование соединения формулы (I) при изготовлении медикамента для использования в терапии. Данное изобретение также предусматривает фармацевтическую композицию для использования при лечении рака, которая содержит соединение формулы (I) и фармацевтически приемлемый наполнитель. Данное изобретение также предусматривает использование соединения формулы (IV) при изготовлении медикамента для использования при лечении рака. Данное изобретение также предусматривает использование соединения формулы (I) при изготовлении медикамента для использования в терапии. Данное изобретение также предусматривает фармацевтическую композицию для использования при лечении рака, которая содержит соединение формулы (VI) и фармацевтически приемлемый наполнитель. Способ лечения предраковых состояний у млекопитающих, включая человека, по изобретению содержит прием пациентом, нуждающимся в таковом, терапевтически эффективных доз фармацевтически активного соединения настоящего изобретения. Настоящее изобретение относится к использованию соединений, являющихся непептидными агонистами рецептора TPO, при лечении предраковых состояний у млекопитающих, включая человека. Настоящее изобретение относится к приему in vivo непептидного агониста рецептора TPO при лечении предраковых состояний у млекопитающих, включая человека. Данное изобретение также предусматривает использование соединений формулы (I) при изготовлении медикамента для использования при лечении предраковых состояний у млекопитающих, включая человека. Данное изобретение также предусматривает фармацевтическую композицию для использования при лечении предраковых состояний, которая содержит соединение формулы (I) и фармацевтически приемлемый наполнитель. Данное изобретение также предусматривает использование соединения формулы (VI) при изготовлении медикамента для использования при лечении предраковых состояний. Данное изобретение также предусматривает фармацевтическую композицию для использования при лечении предраковых состояний, которая содержит соединение формулы (VI) и фармацевтически приемлемый наполнитель. Помимо этого, фармацевтически активные соединения настоящего изобретения можно принимать вместе с другими активными ингредиентами, такими как другие активные соединения, используемые для лечения рака. Помимо этого, фармацевтически активные соединения настоящего изобретения можно принимать вместе с другими активными ингредиентами, такими как другие активные соединения, используемые для лечения предраковых состояний.- 18017715 Предусмотренные эквиваленты. Специалисту обычной квалификации в данной области техники следует понимать, что соединения формул (I) и (VI) могут существовать в таутомерных формах. Например, в формуле (I) двойная связь между двумя атомами азота может находиться между нижним атомом азота и арильным заместителем. Таутомерные формы соединения формул (I) и (VI) проиллюстрированы формулой (X) где R-группы определены выше. Все такие соединения включены в сферу данного изобретения и по своему существу включены в определение соединений формул (I) и (VI). Без дальнейших уточнений можно думать, что квалифицированный в данной области техники специалист способен, используя предшествующее описание, применять настоящее изобретение в полном объеме. Следующие примеры следует, таким образом, считать просто иллюстративными и не ограничивающими сферу настоящего изобретения никоим образом. Подробности экспериментов. Пример 1. Композиция капсул. Лекарственную форму для перорального приема настоящего изобретения изготавливают с помощью наполнения стандартной двухсекционной твердой желатиновой капсулы ингредиентами в пропорциях, показанных в табл. I. Таблица I Пример 2. Парентеральная композиция для инъекций. Инъецируемую форму для приема настоящего изобретения изготавливают с помощью размешивания 1,5 вес.% 3-N'-[1-(3,4-диметилфенил)-3-метил-5-оксо-1,5-дигидропиразол-4-илиден]гидразино-2 гидрокси-3'-(тетразол-5-ил)бифенила в 10 об.% пропиленгликоля в воде. Пример 3. Композиция таблеток. Сахарозу, микрокристаллическую целлюлозу и непептидный агонист рецептора TPO, как показано в табл. II, смешивают и гранулируют в указанных пропорциях с 10%-ным раствором желатина. Влажные гранулы проверяют, высушивают, смешивают с крахмалом, тальком и стеариновой кислотой, после чего проверяют и прессуют в таблетки. Таблица II Несмотря на то что предпочтительный вариант изобретения проиллюстрирован выше, надо понимать, что данное изобретение не ограничивается описанными здесь точными инструкциями и право на все модификации, попадающие в сферу следующих пунктов формулы изобретения, защищено. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ лечения рака у млекопитающих, состоящий во введении in vivo терапевтически эффективного количества 3'-N'-[1-(3,4-диметилфенил)-3-метил-5-оксо-1,5-дигидропиразол-4 илиден]гидразино-2'-гидроксибифенил-3-карбоновой кислоты или ее фармацевтически приемлемой соли. 2. Способ по п.1, в котором млекопитающее является человеком. 3. Способ по п.2, в котором рак выбран из рака мозга (глиомы), глиобластомы, лейкемии, синдрома Банаяна-Зонана, болезни Коудена, болезни Лермитта-Дюклоса, груди, воспалительного рака груди, опухоли Вильмса, саркомы Юинга, рабдомиосаркомы, эпендимомы, медуллобластомы, толстой кишки, головы и шеи, почки, легкого, печени, меланомы, яичникового, поджелудочной железы, простаты, саркомы, остеосаркомы, гигантоклеточной опухоли кости и щитовидной железы, T-лимфобластного лейкоза,хронического миелолейкоза, хронического лимфолейкоза, волосатоклеточного лейкоза, острого лимфобластного лейкоза, хронического нейтрофильного лейкоза, острого T-лимфобластного лейкоза, плазмацитомы, иммунобластного крупноклеточного лейкоза, лимфомы из клеток мантийной зоны, мегакариобластного лейкоза, множественной миеломы, острого мегакариоцитарного лейкоза и эритролейкоза, злокачественной лимфомы, ходжкинской лимфомы, неходжскинской лимфомы, T-лимфобластной лимфомы,лимфомы Беркитта, фолликулярной лимфомы, нейробластомы, рака мочевого пузыря, карциномы уротелия, рака легкого, рака вульвы, рака шейки матки, рака эндометрия, рака почки, мезотелиомы, рака пищевода, рака слюнной железы, гепатоцеллюлярного рака, рака желудка, рака носоглотки, рака щеки, рака рта, стромальной опухоли желудочно-кишечного тракта и рака яичка. 4. Способ по п.3, в котором соединение вводят перорально. 5. Способ по п.3, в котором соединение вводят парентерально. 6. Способ лечения предраковых состояний у млекопитающих, состоящий во введении in vivo терапевтически эффективного количества 3'-N'-[1-(3,4-диметилфенил)-3-метил-5-оксо-1,5-дигидропиразол 4-илиден]гидразино-2'-гидроксибифенил-3-карбоновой кислоты или ее фармацевтически приемлемой соли. 7. Способ по п.6, в котором млекопитающее является человеком. 8. Способ по п.7, в котором предраковое состояние выбрано из внутриэпителиальной неоплазии шейки матки, моноклональной гаммапатии неизвестной этиологии, миелодиспластического синдрома,апластической анемии, поражения шейки матки, кожных родинок (премеланомы), внутриэпителиальной(внутрипротоковой) неоплазии предстательной железы, протоковой карциномы in situ, полипов толстой кишки, тяжелого гепатита или цирроза. 9. Способ по п.1, в котором соединение представляет собой бис-(моноэтаноламин) 3'-N'-[1-(3,4-диметилфенил)-3-метил-5-оксо-1,5-дигидропиразол-4-илиден]гидразино-2'гидроксибифенил-3-карбоновой кислоты. 10. Способ по п.6, в котором соединение представляет собой бис-(моноэтаноламин) 3'-N'-[1-(3,4-диметилфенил)-3-метил-5-оксо-1,5-дигидропиразол-4-илиден]гидразино-2'гидроксибифенил-3-карбоновой кислоты. 11. Способ по п.10, в котором предраковое состояние представляет собой миелодиспластический синдром. 12. Способ по п.10, в котором предраковое состояние представляет собой апластическую анемию.
МПК / Метки
МПК: A01N 33/26, A61K 31/665
Код ссылки
<a href="https://eas.patents.su/24-17715-sposob-lecheniya-raka.html" rel="bookmark" title="База патентов Евразийского Союза">Способ лечения рака</a>
Предыдущий патент: Модуляторы tgr5 и способы их применения
Следующий патент: Циклические пептиды – антагонисты cxcr4
Случайный патент: Способ и система для производства спиртов и/или кислот