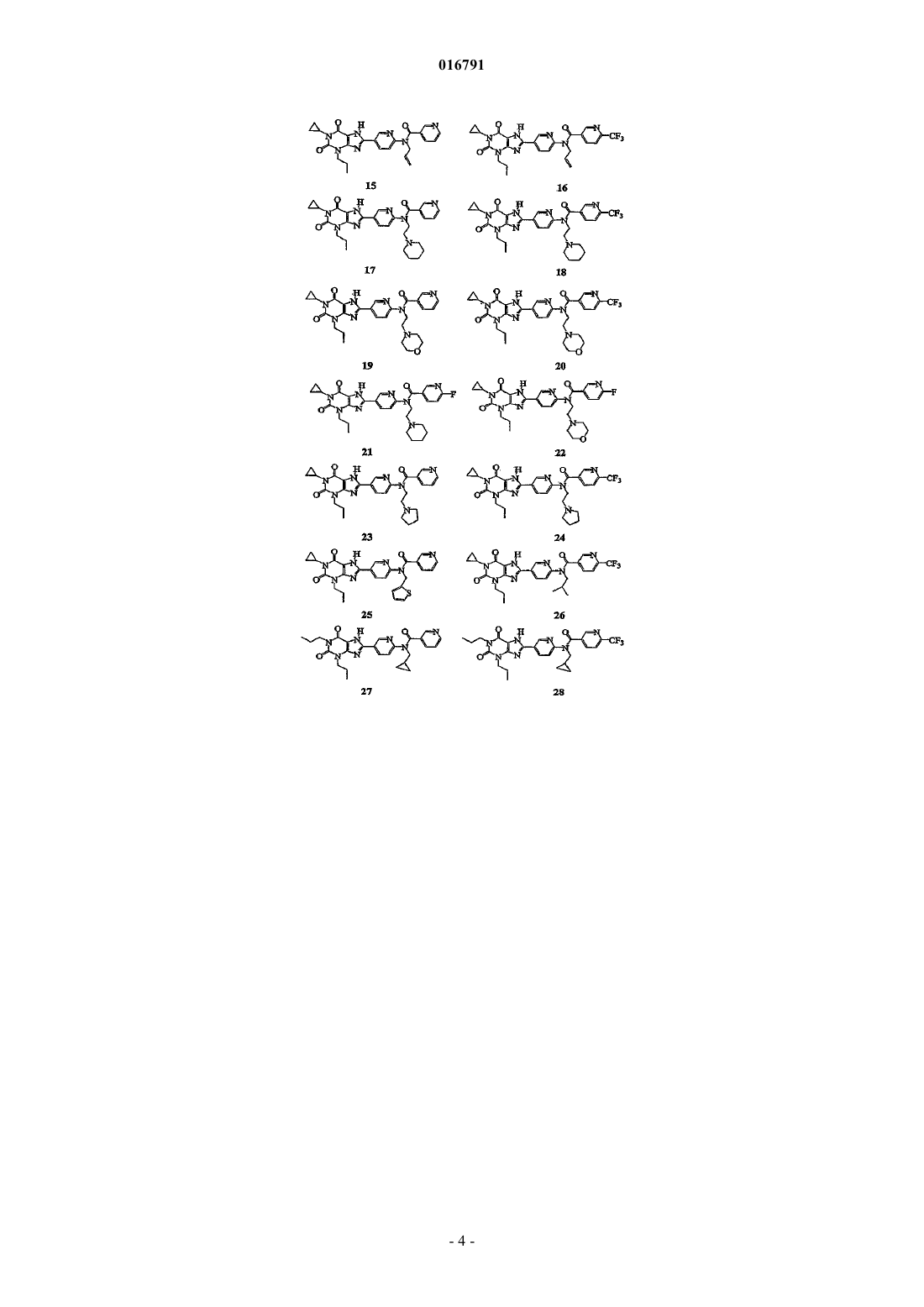Замещенные 8-[6-амино-3-пиридил]ксантины
Номер патента: 16791
Опубликовано: 30.07.2012
Авторы: Ванг Гуокван, Томпсон Роберт Д., Ригер Джейсон М.
Формула / Реферат
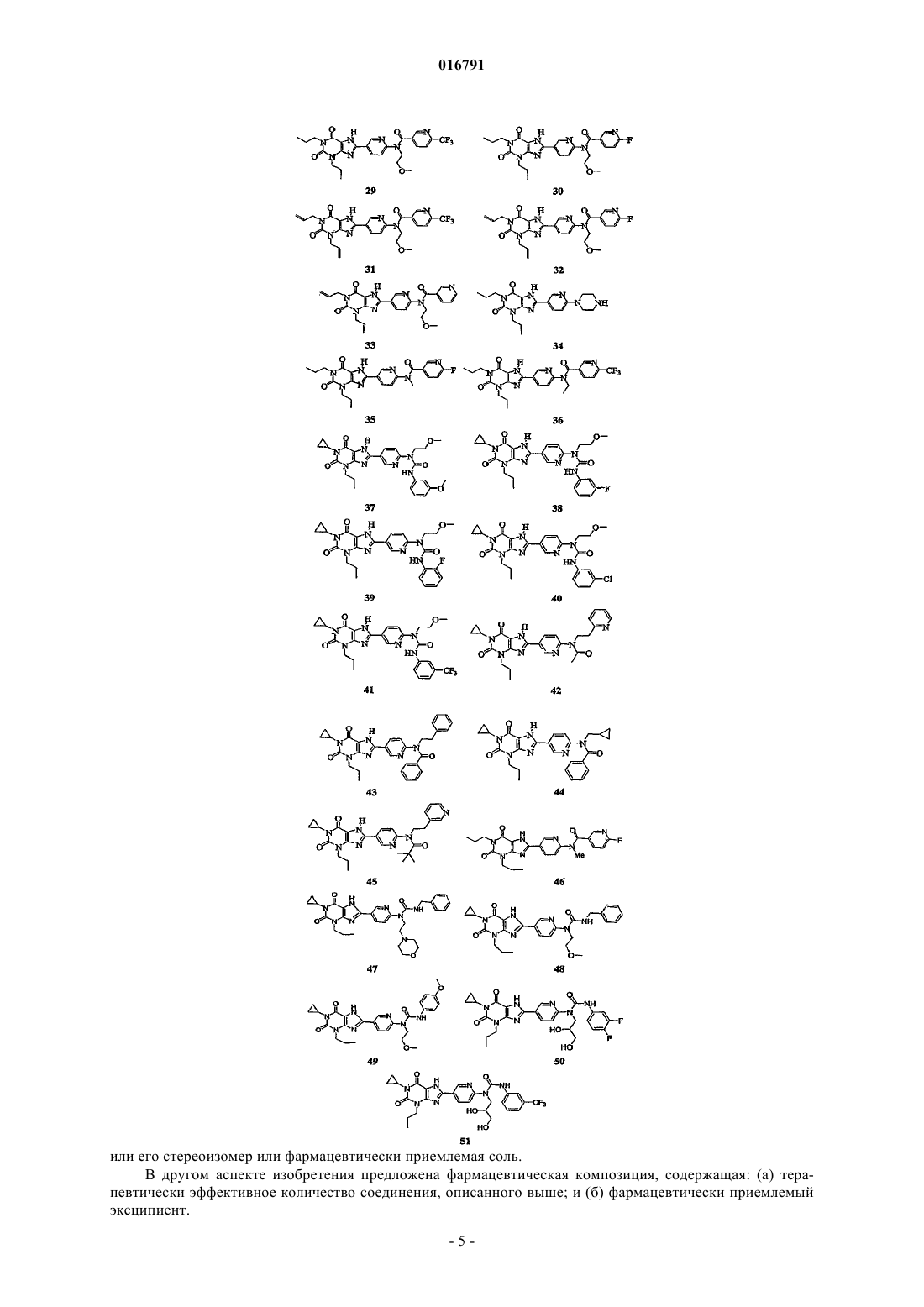
1. Соединение, выбранное из группы
или его фармацевтически приемлемая соль.
2. Соединение по п.1, где соединение представляет собой
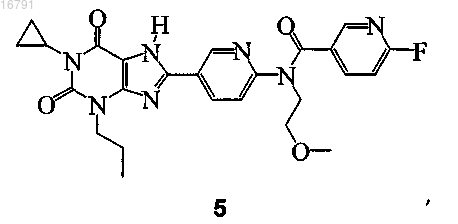
или его фармацевтически приемлемая соль.
3. Фармацевтическая композиция, содержащая:
(а) терапевтически эффективное количество соединения по п.1 или 2 и
(б) фармацевтически приемлемый эксципиент.
4. Терапевтический способ лечения патологического состояния или симптома у млекопитающего, где вовлечена активность аденозиновых A2B-рецепторов и желателен антагонизм их действия, включающий введение млекопитающему эффективного количества соединения по п.1 или 2.
5. Способ лечения астмы, аллергий, аллергических заболеваний или аутоиммунного заболевания, включающий введение эффективного количества соединения по п.1 или 2 млекопитающему, нуждающемуся в таком лечении.
6. Способ лечения диарейных заболеваний, инсулинорезистентности, диабета, рака, ишемии/реперфузионных повреждений, диабетической ретинопатии или ретинопатии, индуцированной гипербарическим кислородом, включающий введение эффективного количества соединения по п.1 или 2 или его фармацевтически приемлемой соли млекопитающему, нуждающемуся в таком лечении.
7. Применение соединения по п.1 или 2 в лечении патологического состояния или симптома, где вовлечена активность аденозиновых A2B-рецепторов.
8. Применение соединения по п.1 или 2 для изготовления лекарственного средства, полезного для лечения заболевания у млекопитающего, такого как человек, где вовлечена активность аденозиновых A2B-рецепторов.
9. Применение по п.8, где заболевание выбрано из астмы, аллергий, аллергических заболеваний и аутоиммунного заболевания.
10. Применение по п.8, где заболевание выбрано из диарейных заболеваний, инсулинорезистентности, диабета, рака, ишемии/реперфузионных повреждений, диабетической ретинопатии и ретинопатии, индуцированной гипербарическим кислородом.
11. Способ лечения астмы, включающий введение эффективного количества соединения по п.1 или 2 млекопитающему, нуждающемуся в таком лечении.
12. Способ лечения диабетической ретинопатии, включающий введение эффективного количества соединения по п.1 или 2 млекопитающему, нуждающемуся в таком лечении.
Текст
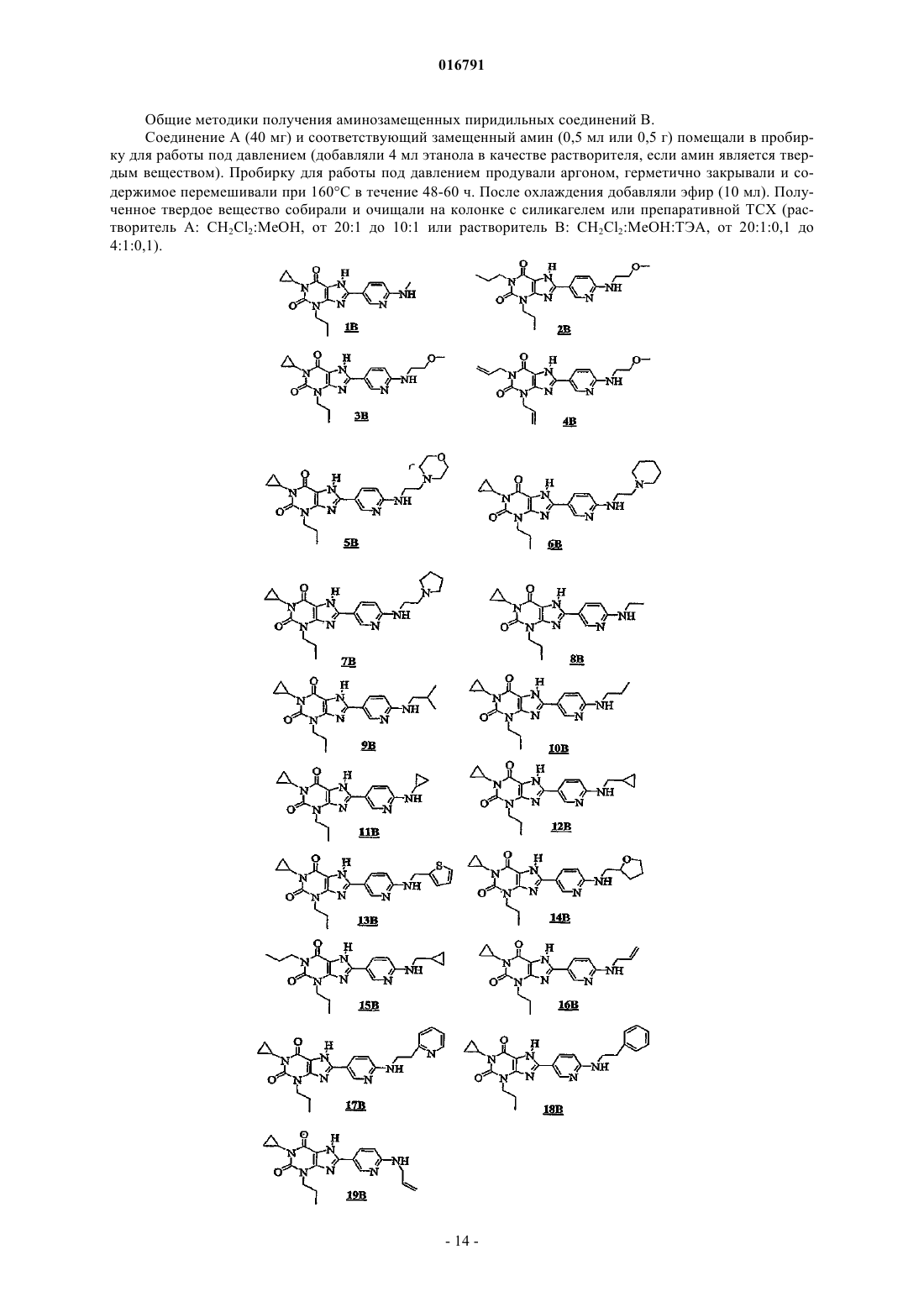
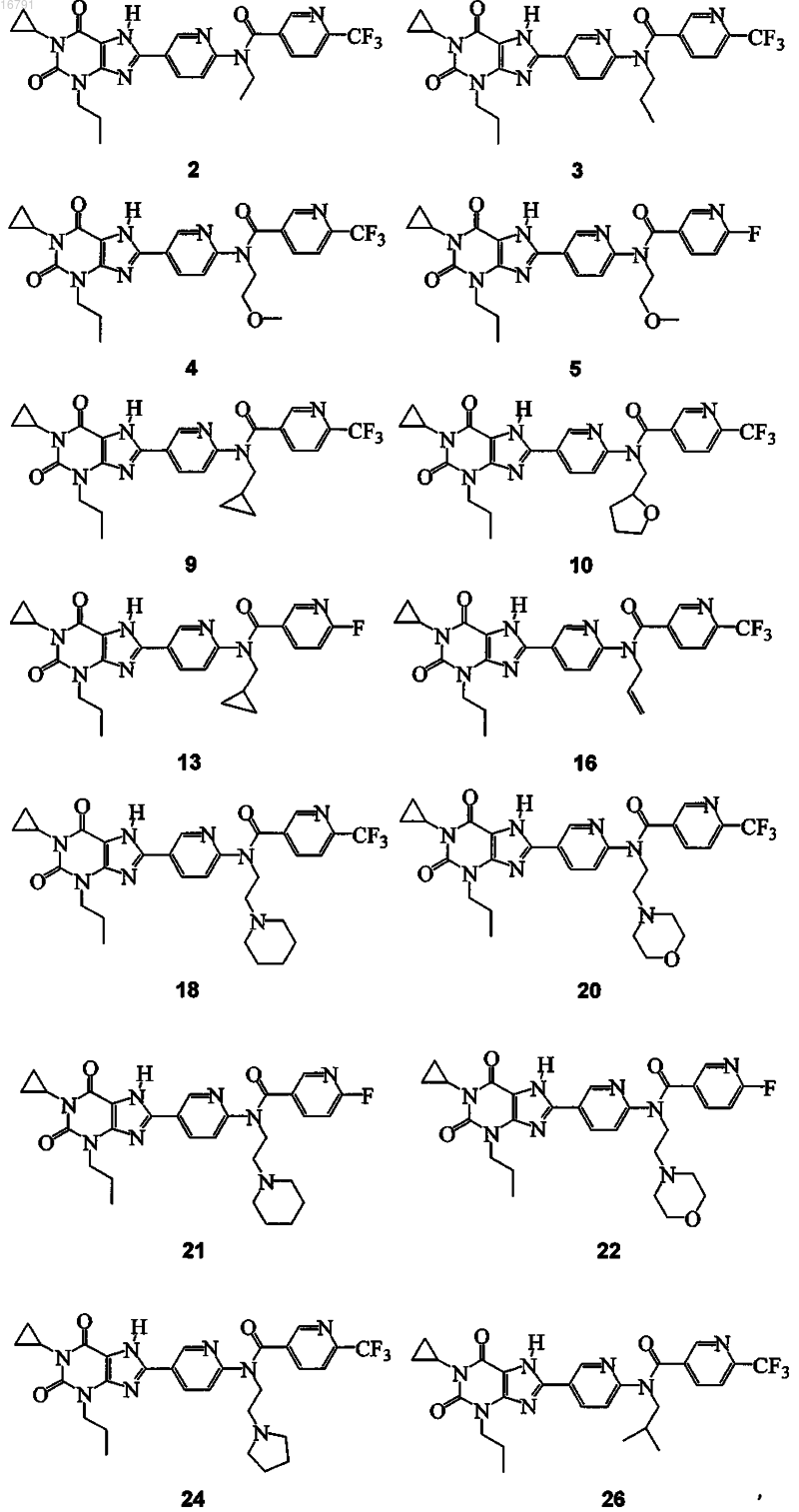
В настоящем изобретении предложены замещенные 8-[6-амино-3-пиридил]ксантины и фармацевтические композиции, которые являются селективными антагонистами A2B аденозиновых рецепторов (AP). Эти соединения и композиции полезны в качестве фармацевтических агентов.(71)(73) Заявитель и патентовладелец: ТРОВИС ФАРМАСЬЮТИКАЛЗ ЭлЭлСи (US) 016791 Сведения о родственных заявках В заявке на данное изобретение заявлены приоритетные преимущества предварительной заявки на патент США 60/805030, поданной 16 июня 2006 г., и предварительной заявки на патент США 60/805864, поданной 22 июня 2006 г., которые специально включены в описание во всей своей полноте посредством ссылки. Область изобретения Настоящее изобретение относится к замещенным 8-[6-амино-3-пиридил]ксантинам и фармацевтическим композициям, которые являются селективными антагонистами A2B аденозиновых рецепторов(AP). Эти соединения и композиции полезны в качестве фармацевтических агентов. Предшествующий уровень техники Алкилксантин-теофиллин слабый неселективный аденозиновый антагонист (см. Linden, J., et al., Cardiovascular Biology of Purines,eds. G. Burnstock, et al., 1998, p. 1-20), является терапевтически полезным для лечения астмы. Однако его применение связано с неприятными побочными эффектами, такими как бессонница и диурез. В последние годы применение теофиллина в качестве бронходилататора для облегчения астмы было вытеснено лекарственными средствами других классов, например селективными 2-адренергическими агонистами, кортикостероидами и, недавно, лейкотриеновыми антагонистами. Эти соединения также имеют ограничения. Таким образом, создание лекарственного средства, подобного теофиллину, с пониженными побочными эффектами по-прежнему является желательным. Было признано, что теофиллин и его близкородственный аналог кофеин блокируют эндогенный аденозин, действуя в терапевтически полезных дозах в качестве местного модулятора аденозиновых рецепторов в мозге и других органах. Аденозин активирует четыре подтипа аденозиновых рецепторов является другим примером ксантина, который, как было описано, блокирует A2B аденозиновые рецепторы и применяется для лечения астмы. В патенте США 6060481 (LaNoue et al.) было также показано, что селективные аденозиновыеA2B антагонисты являются полезными для улучшения у пациента чувствительности к инсулину. Было описано, что терапевтические концентрации теофиллина или энпрофиллина блокируют A2Bрецепторы человека, и предложено, что антагонисты, селективные для этого подтипа, могут обладать потенциальным применением в качестве противоастматических агентов (см. Feoktistov, I., et al.,Pharmacol. Rev. 1997, 49, 381-402 и Robeva, A.S., et al., Drug Dev. Res. 1996, 39, 243-252). Сообщается, что энпрофиллин имеет значение Ki 7 мкМ и является в некоторой степени селективным в отношении связывания с A2B AP человека (см. Robeva, A.S., et al., Drug Dev. Res. 1996, 39, 243-252 и Linden, J., et al., Mol.Pharmacol. 1999, 56, 705-713). A2B AP экспрессируются в некоторых тучных клетках, таких как BR линия клеток мастоцитомы собаки, которые, по-видимому, ответственны за запуск острой мобилизации Ca2+ и дегрануляции (см. Auchampach, J.A., et al., Mol. Pharmacol. 1997, 52, 846-860 и Forsyth, P., et al., Inflamm.Res. 1999, 48, 301-307). A2B AP также запускают мобилизацию Ca2+ и участвуют в замедленном высвобождении IL-8 (интерлейкина 8) из HMC-1 тучных клеток человека. Другими функциями, связанными сA2B AP, являются контроль роста клеток и экспрессии генов (см. Neary, J., et al., Trends Neurosci. 1996, 19,13-18), зависимая от эндотелия вазодилатация (см. Martin, P.L., et al., J. Pharmacol. Exp. Ther. 1993, 265,248-253) и секреция жидкости из кишечного эпителия (см. Strohmeier, G.R., et al., J. Biol. Chem. 1995,270, 2387-2394). Было также описано, что действие аденозина через A2B AP стимулирует хлоридную проницаемость в клетки, экспрессирующие транспортный регулятор кистозного фиброза (см. Clancy,J.P., et al., Am. J. Physiol. 1999, 276, C361-C369). Недавно Linden et al. (патент США 6545002) описали новую группу соединений и фармацевтических композиций, которые являются селективными антагонистами A2B аденозиновых рецепторов (AP). Несмотря на то что селективные образцы в отношении подтипов аденозиновых рецепторов доступны для A1, A2A и A3 AP, для A2B-рецептора известно всего лишь несколько селективных антагонистов. Следовательно, до сих пор существует необходимость в соединениях, которые являются селективными антагонистами A2B-рецепторов.-1 016791 Описание изобретения Согласно настоящему изобретению предложены замещенные 8-[6-амино-3-пиридил]ксантины или стереоизомеры или фармацевтически приемлемые соли, которые действуют в качестве антагонистов A2B аденозиновых рецепторов. Согласно изобретению также предложены фармацевтические композиции, содержащие соединение по настоящему изобретению или его стереоизомер или его фармацевтически приемлемую соль в комбинации с фармацевтически приемлемым эксципиентом. Кроме того, согласно изобретению предложен терапевтический способ лечения патологического состояния или симптома у млекопитающего, такого как человек, где в один или более чем один симптом патологии вовлечена активность, например чрезмерная активность, A2B аденозиновых рецепторов, и для улучшения таких симптомов желателен антагонизм (т.е. блокирование). Таким образом, согласно настоящему изобретению предложен способ лечения заболевания, включающий введение терапевтически эффективного количества по меньшей мере одного соединения по настоящему изобретению или его стереоизомера или его фармацевтически приемлемой соли, где заболевание выбрано из астмы, аллергий,аллергических заболеваний (например, аллергического ринита и синусита), аутоиммунных заболеваний(например, волчанки), диарейных заболеваний, инсулинорезистентности, диабета (например, типа I и типа II), предотвращения дегрануляции тучных клеток, связанной с ишемией/реперфузионными повреждениями, сердечного приступа, ингибирования ангиогенеза в неопластических тканях и ингибирования ангиогенеза при диабетической ретинопатии или ретинопатии, индуцированной гипербарическим кислородом. Согласно изобретению предложено новое соединение по настоящему изобретению для применения в медицинской терапии. Согласно изобретению также предложено применение нового соединения по настоящему изобретению для изготовления лекарственного средства для лечения патологического состояния или симптома у млекопитающего, которое связано с вредным воздействием активации или активности A2B-рецепторов. Изобретение также содержит способ, включающий контактирование соединения по настоящему изобретению, возможно имеющего радиоактивный изотоп (радионуклид), такой как, например, тритий,радиоактивный йод (например, 125I для анализов связывания или 123I для спектральной визуализации) и т.п., с сайтами-мишенями A2B аденозиновых рецепторов, включающими указанные рецепторы, in vivo или in vitro для связывания с указанными рецепторами. Клеточные мембраны, содержащие сайты связанных A2B аденозиновых рецепторов, могут быть использованы для измерения селективности анализируемых соединений в отношении подтипов аденозиновых рецепторов или могут быть использованы в качестве средства идентификации потенциальных терапевтических агентов для лечения заболеваний или состояний, связанных с опосредованием A2B-рецепторов, путем контактирования указанных агентов с указанными радиолигандами и рецепторами и измерения величины замещения радиолиганда и/или связывания агента.-2 016791 Наилучшие способы осуществления изобретения Заявители обнаружили, что приведенные ниже замещенные 8-[6-амино-3-пиридил]ксантины могут быть полезны для лечения заболеваний или состояний, связанных с вредным воздействием активации или активности A2B-рецепторов. Согласно аспекту изобретения предложено соединение, выбранное из или его стереоизомер или фармацевтически приемлемая соль. В другом аспекте изобретения предложена фармацевтическая композиция, содержащая: (а) терапевтически эффективное количество соединения, описанного выше; и (б) фармацевтически приемлемый эксципиент.-5 016791 В другом аспекте изобретения предложен терапевтический способ предотвращения или лечения патологического состояния или симптома у млекопитающего, где вовлечена активность аденозиновых A2B рецепторов и желателен антагонизм их действия, включающий введение млекопитающему терапевтически эффективного количества соединения по настоящему изобретению. В другом аспекте изобретения предложен способ лечения заболевания, включающий введение терапевтически эффективного количества по меньшей мере одного соединения по настоящему изобретению или его стереоизомера или его фармацевтически приемлемой соли, где заболевание выбрано из астмы, аллергий, аллергических заболеваний (например, аллергического ринита и синусита), аутоиммунных заболеваний (например, волчанки), диарейных заболеваний, инсулинорезистентности, диабета, предотвращения дегрануляции тучных клеток, связанной с ишемией/реперфузионными повреждениями, сердечного приступа, ингибирования ангиогенеза в неопластических тканях и ингибирования ангиогенеза при диабетической ретинопатии или ретинопатии, индуцированной гипербарическим кислородом. В другом аспекте изобретения предложено соединение по настоящему изобретению для применения в медицинской терапии. В другом аспекте предложено применение соединения по изобретению для изготовления лекарственного средства, полезного для лечения заболевания у млекопитающего. Понятно, что любой аспект или признак настоящего изобретения, характеризуемый как предпочтительный или не характеризуемый как предпочтительный, может быть объединен с любым другим аспектом или признаком изобретения, где другой такой признак или характеризуют как предпочтительный,или не характеризуют как предпочтительный. Как признано специалистом в данной области техники, имидазольное кольцо соединений по настоящему изобретению может существовать в таутомерных формах или в виде таутомеров, которые, таким образом, также включены в объем изобретения. Таутомерные изомеры представлены в виде структур (Ia) и (Ib): где R, R1, R2, X и Z являются такими, как определено в данном описании изобретения. Понятно, что, например, при указании названия одного из соединений или при ссылке на него в рамках настоящего изобретения также подразумевается его соответствующий таутомер. Термины "включают", "например", "такой как" и т.п. используются в иллюстративных целях и не предназначены для ограничения настоящего изобретения. Использованные в этом изобретении, включая формулу изобретения, термины, которые указывают на неопределенное количество, означают "по меньшей мере один" или "один или более", если конкретно не указано иное. Специалистам в данной области техники будет понятно, что соединения по изобретению, имеющие хиральный центр, могут существовать и могут быть выделены в оптически активных и рацемических формах. Некоторые соединения могут проявлять полиморфизм. Следует понимать, что настоящее изобретение охватывает любую рацемическую, оптически активную, полиморфную или стереоизомерную форму или их смеси, соединения по изобретению, которая обладает полезными свойствами, описанными здесь; причем в данной области техники хорошо известно, как получить оптически активные формы (например, разделением рацемической формы методами перекристаллизации, посредством синтеза из оптически активных исходных материалов, хирального синтеза или хроматографического разделения с использованием хиральной неподвижной фазы) и как определить терапевтическую активность с использованием стандартных тестов, описанных здесь, или с использованием других похожих тестов, хорошо известных в данной области техники. Термины "млекопитающее" и "пациент" охватывают теплокровных млекопитающих, которым обычно оказывают медицинскую помощь (например, людей и одомашненных животных). Примеры млекопитающих включают (а) кошек, собак, лошадей, коров и человека и (б) человека. Термины "лечащий" или "лечение" охватывают лечение болезненного состояния у млекопитающего и включают: (а) предотвращение болезненного состояния от протекания у млекопитающего, в частности,когда такое млекопитающее предрасположено к болезненному состоянию, но еще не диагностировано,как имеющее его; (б) ингибирование болезненного состояния, например задержку его развития; (в) ослабление болезненного состояния, например, путем вызывания регрессии болезненного состояния до достижения желаемой конечной точки и/или (г) устранение болезненного состояния, например прекращение болезненногосостояния и/или его эффектов. Лечение также включает улучшение симптома заболевания (например, уменьшение боли или дискомфорта), где такое улучшение может или не может непосредственно воздействовать на заболевание (например, причину, передачу, проявление и т.д.)."Фармацевтически приемлемые соли" относятся к производным описанных соединений, где исходное соединение модифицируют путем получения его кислых или основных солей. Примеры фармацевтически приемлемых солей включают соли основных остатков, таких как амины, с минеральными или органическими кислотами; соли кислотных остатков, таких как карбоновые кислоты, с щелочами или органическими веществами и т.п., но не ограничиваются ими. Фармацевтически приемлемые соли включают традиционные нетоксичные соли или четвертичные аммониевые соли исходного соединения, образованные, например, из нетоксичных неорганических или органических кислот. Например, такие традиционные нетоксичные соли включают соли, полученные из неорганических и органических кислот, выбранных из 1,2-этандисульфоновой, 2-ацетоксибензойной, 2-гидроксиэтансульфоновой, уксусной, аскорбиновой, бензолсульфоновой, бензойной, бикарбоновой, карбоновой, лимонной, этилендиаминтетрауксусной, этандисульфоновой, этансульфоновой, фумаровой, глюкогептоновой, глюконовой, глутаминовой,гликолевой, гликолиларсаниловой, гексилрезорциновой, гидрабаминовой, бромисто-водородной, хлористо-водородной, йодисто-водородной, гидроксималеиновой, гидроксинафтойной, изетионовой, молочной, лактобионовой, лаурилсульфоновой, малеиновой, яблочной, миндальной, метансульфоновой, напсиловой (napsylic), азотной, щавелевой, памовой, пантотеновой, фенилуксусной, фосфорной, полигалактуроновой, пропионовой, салициловой, стеариновой, субуксусной (subacetic), янтарной, сульфаминовой, сульфаниловой, серной, дубильной, винной и толуолсульфоновой, но не ограничиваются ими. Фармацевтически приемлемые соли по настоящему соединению могут быть синтезированы из исходного соединения, содержащего основную или кислотную группировку, с использованием традиционных химических методов. Как правило, такие соли могут быть получены путем взаимодействия свободных кислых или основных форм этих соединений со стехиометрическим количеством подходящего основания или кислоты в воде или органическом растворителе или в их смеси; обычно предпочтительны неводные среды, типа эфира, этилацетата, этанола, изопропанола или ацетонитрила. Списки подходящих солей представлены в Remington's Pharmaceutical Sciences, 18th ed., Mack Publishing Company, Easton, PA,1990, p. 1445, описание которого таким образом включено посредством ссылки."Терапевтически эффективное количество" включает количество соединения по настоящему изобретению, которое является эффективным, когда соединение вводят само по себе или в комбинации, для лечения симптома, перечисленного в этом описании изобретения. "Терапевтически эффективное количество" также включает количество комбинации заявленных соединений, которое является эффективным для лечения желаемого симптома. Предпочтительно комбинация соединений является синергетической комбинацией. Синергизм, как описано, например, Chou и Talalay, Adv. Enzyme Regul. 1984, 22:27-55,имеет место, когда эффект соединений, вводимых в комбинации, больше, чем суммарный эффект соединений, вводимых самих по себе в качестве отдельных агентов. В основном синергетический эффект наиболее отчетливо проявляется при субоптимальных концентрациях соединений. Синергизм может быть выражен в уменьшенной цитотоксичности, повышенном эффекте или каком-либо другом преимущественном эффекте комбинации по сравнению с индивидуальными компонентами. Конкретные и предпочтительные значения, перечисленные для радикалов, заместителей, и интервалы приведены только для иллюстрации; они не исключают другие определенные значения или другие значения в определенных интервалах для радикалов и заместителей. Синтез. Соединения по настоящему изобретению могут быть получены способами, описанными вUS2005/0065341, содержимое которого включено здесь посредством ссылки. Соединения по настоящему изобретению также могут быть получены способами, описаннымиP.J. Scammells, et al. в J. Med. Chem. 37, 2704-2712 (1994). Диамино-1,3-дизамещенный урацил ацилируют 6-хлорникотиноилхлоридом в пиридине при 5C с получением соединений формулы (5a). Полученный амид (5a) циклизуют путем нагревания с обратным холодильником в водном растворе гидроксида натрия с получением соединения A. 6-Хлорникотиноилхлорид получают путем нагревания с обратным холодильником 6-гидроксиникотиновой кислоты в тионилхлориде с использованием ДМФ(N,N-диметилформамид) в качестве катализатора, как показано на реакционной схеме 1. Соединение A может быть алкилировано алкилбромидом или алкилйодидом с получением соединений формулы A1. Соединения A или A1 взаимодействуют с замещенным амином при 150-160C в пробирке для работы под давлением с получением соединений формулы B или B1. Соединения формулы B1,где R4 является водородом, могут взаимодействовать с ацилхлоридом с получением соединений, где R4 представляет собой -C(O)R6(C). В данном описании изобретения используются следующие сокращения:DMEM - модифицированная Дульбекко среда Игла; ДМФ - N,N-диметилформамид; ДМСО - диметилсульфоксид;HEK клетки - клетки почки эмбриона человека;ZM 241385 - 4-(2-[7-амино-2-фурил 1,2,4 триазоло 2,3-a1,3,5 триазин]-5-иламиноэтил)фенол. Соединения по настоящему изобретению можно приготавливать в виде фармацевтических композиций и вводить в организм млекопитающего, такого как пациент-человек, во множестве форм, подходящих для выбранного пути введения, например перорально или парентерально, путем внутривенного,внутримышечного, местного, ингаляционного или подкожного путей. Типичные фармацевтические композиции раскрыты в "Remington: The Science and Practice of Pharmacy", A. Gennaro, ed., 20th edition,Lippincott, WilliamsWilkins, Philadelphia, PA. Таким образом, настоящие соединения можно вводить системно, например перорально, в комбинации с фармацевтически приемлемым эксципиентом, таким как инертный разбавитель или ассимилируемый пищевой носитель. Они могут быть заключены в желатиновые капсулы с твердой или мягкой оболочкой, могут быть спрессованы в таблетки или могут быть непосредственно включены в состав пищи диеты пациентов. Для перорального терапевтического введения активное соединение может быть объединено с одним или более эксципиентами и использовано в форме проглатываемых таблеток, трансбуккальных таблеток, пастилок, капсул, эликсиров, суспензий, сиропов, вафель и т.п. Такие композиции и препараты должны содержать по меньшей мере 0,1% активного соединения. Процентное содержание композиций и препаратов, конечно, можно варьировать и подходящим образом может находиться между примерно 2 и примерно 60 мас.% от заданной стандартной лекарственной формы. Количество активного соединения в таких терапевтически полезных композициях является таким, чтобы был получен эффективный уровень дозы.-8 016791 Таблетки, пастилки, пилюли, капсулы и т.п. могут также содержать следующее: связующие вещества, такие как трагакантовая камедь, гуммиарабик, кукурузный крахмал или желатин; эксципиенты, такие как дикальцийфосфат; разрыхлитель, такой как кукурузный крахмал, картофельный крахмал, альгиновая кислота и т.п.; смазывающее вещество, такое как стеарат магния; и подсластитель, такой как сахароза,фруктоза, лактоза или аспартам; или может быть добавлен корригент, такой как перечная мята, винтергриновое масло или вишневый ароматизатор. Когда стандартная лекарственная форма является капсулой, она может содержать, в дополнение к веществам, подобным вышеприведенным, жидкий носитель,такой как растительное масло или полиэтиленгликоль. Многие другие вещества могут присутствовать в виде покрытий или с целью модификации физической формы твердой стандартной лекарственной формы иным образом. Например, таблетки, пилюли или капсулы могут быть покрыты желатином, воском,шеллаком или сахаром и т.п. Сироп или эликсир может содержать активное соединение, сахарозу или фруктозу в качестве подсластителя, метил- или пропилпарабены в качестве консервантов, краситель и корригент, такой как вишневый или апельсиновый ароматизатор. Конечно, любой материал, используемый в приготовлении любой стандартной лекарственной формы, должен быть фармацевтически приемлемым и, по существу, нетоксичным в применяемых количествах. Кроме того, активное соединение может быть включено в препараты и устройства замедленного высвобождения. Активное соединение также можно вводить внутривенно или внутрибрюшинно путем инфузии или инъекции. Растворы активного соединения или его солей могут быть приготовлены в воде, возможно,смешанной с нетоксичным поверхностно-активным веществом. Дисперсии могут быть также приготовлены в глицерине, жидких полиэтиленгликолях, триацетине и их смесях и в маслах. В обычных условиях хранения и применения эти препараты содержат консервант для предотвращения роста микроорганизмов. Фармацевтические лекарственные формы, подходящие для инъекции или инфузии, могут включать стерильные водные растворы, или дисперсии, или стерильные порошки, содержащие активный ингредиент, которые приспособлены для немедленного приготовления стерильных инъецируемых или инфузируемых растворов или дисперсий, возможно, инкапсулированные в липосомы. Во всех случаях конечная лекарственная форма должна быть стерильной, текучей и стабильной в условиях изготовления и хранения. Жидким носителем или наполнителем может быть растворитель или жидкая дисперсионная среда,включающие, например, воду, этанол, высокомолекулярный спирт (например, глицерин, пропиленгликоль, жидкие полиэтиленгликоли и т.п.), растительные масла, нетоксичные сложные эфиры глицерина и их подходящие смеси. Надлежащую текучесть можно поддерживать, например, путем образования липосом, путем поддержания необходимого размера частиц в случае дисперсий или путем использования поверхностно-активных веществ. Предотвращение действия микроорганизмов может быть осуществлено с помощью различных противобактериальных и противогрибковых средств, например парабенов, хлорбутанола, фенола, сорбиновой кислоты, тимеросала и т.п. Во многих случаях предпочтительным будет включение изотонических агентов, например сахаров, буферов или хлорида натрия. Пролонгированная абсорбция инъецируемых композиций может быть осуществлена путем использования в композициях агентов, замедляющих абсорбцию, например моностеарата алюминия и желатина. Стерильные инъецируемые растворы приготавливают путем включения активного соединения в необходимом количестве в подходящий растворитель со многими другими перечисленными выше ингредиентами, по требованию, с последующей стерилизацией фильтрованием. В случае использования стерильных порошков для приготовления стерильных инъецируемых растворов предпочтительными способами приготовления являются методы вакуумной сушки и сублимационной сушки, которые приводят к порошку активного ингредиента и любого дополнительного желаемого ингредиента, присутствующего в предварительно отфильтрованных с целью стерилизации растворах. Для местного введения настоящие соединения могут быть использованы в чистой форме, т.е. когда они являются жидкостями. Однако в основном их применение по отношению к коже будет желательным в виде композиций или препаратов в комбинации с дерматологически приемлемым носителем, который может быть твердым веществом или жидкостью. Полезные твердые носители включают мелкоизмельченные твердые вещества, такие как тальк, глина, микрокристаллическая целлюлоза, диоксид кремния, оксид алюминия и т.п. Полезные жидкие носители включают воду, спирты или гликоли или смеси вода-спирт/гликоль, в которых настоящие соединения могут быть растворены или диспергированы в эффективных концентрациях, возможно, с помощью нетоксичных поверхностно-активных веществ. С целью оптимизации свойств для заданного применения могут быть добавлены адъюванты, такие как ароматизирующие вещества и дополнительные противомикробные средства. Получающиеся в результате жидкие композиции могут быть нанесены с гигроскопических прокладок, используемых для пропитки повязок и других перевязочных материалов, или могут быть распылены на пораженную область с использованием распылителей насосного типа или аэрозольных распылителей.-9 016791 С жидкими носителями также могут быть использованы загустители, такие как синтетические полимеры, жирные кислоты, соли и эфиры жирных кислот, жирные спирты, модифицированные целлюлозы или модифицированные минеральные материалы, с образованием легко намазывающихся паст, гелей,мазей, мыл и т.п. для непосредственного нанесения на кожу пациента. Примеры полезных дерматологических композиций, которые могут быть использованы для доставки соединений по настоящему изобретению на кожу, известны в данной области техники; например, см.Jacquet et al. (патент США 4608392), Geria (патент США 4992478), Smith et al. (патент США 4559157) и Wortzman (патент США 4820508). Полезные дозы соединений по настоящему изобретению могут быть определены путем сравнения их активности in vitro и активности in vivo на животных моделях. Методы экстраполяции эффективных доз для мышей и других животных в отношении людей известны в данной области техники; например, см. патент США 4938949. Обычно концентрация соединения(й) по настоящему изобретению в жидкой композиции, такой как лосьон, будет (а) примерно 0,1-25 мас.% и (б) примерно 0,5-10 мас.%. Концентрация в полутвердой или твердой композиции, такой как гель или порошок, будет (а) примерно 0,1-5 мас.% и (б) примерно 0,5-2,5 мас.%. Количество соединения или его активной соли или производного, требуемое для применения в лечении, будет варьировать не только в зависимости от конкретного соединения или выбранной соли, но также и от пути введения, природы состояния, подвергаемого лечению, и возраста и состояния пациента и, разумеется, будет на усмотрение лечащего врача или клинического врача. В основном, однако, подходящая доза будет в интервале (а) примерно 1,0-100 мг/кг массы тела в день; (б) примерно 10-75 мг/кг массы тела в день и (в) примерно 5-20 мг/кг массы тела в день. Соединение можно легко вводить в стандартной лекарственной форме; например, в таблетках, каплетах и т.д., содержащих (а) примерно 4-400 мг; (б) примерно 10-200 мг и (в) примерно 20-100 мг активного ингредиента в одной стандартной лекарственной форме. Идеально, активный ингредиент следует вводить для достижения пиковых концентраций активного соединения в плазме (а) примерно 0,02-20 мкМ; (б) примерно 0,1-10 мкМ и (в) примерно 0,5-5 мкМ. Эти концентрации могут быть достигнуты, например, путем внутривенной инъекции 0,005-0,5%-ного раствора активного ингредиента или путем перорального введения в виде болюса, содержащего примерно 4-400 мг активного ингредиента. Соединения по изобретению также можно вводить путем ингаляции из ингалятора, инсуффлятора,пульверизатора или упаковки под давлением или других средств доставки аэрозольного спрея. Упаковки под давлением могут содержать подходящий пропеллент, такой как диоксид углерода или другой подходящий газ. В случае аэрозоля под давлением единица дозы может быть установлена путем предусмотрения значения, соответствующего доставке дозированного количества. Ингаляторы, инсуффляторы, пульверизаторы полностью описаны в фармацевтических справочниках, таких как Remington's PharmaceuticalSciences, Volumes 16 (1980) или 18 (1990), Mack Publishing Co. Желаемая доза может быть легко представлена в однократной дозе или в виде разделенных доз,вводимых в подходящие интервалы времени, например в виде двух, трех, четырех или более субдоз в день. Кроме того, сама субдоза может быть разделена, например, для введения несколько раз через неопределенные интервалы, такого как многократные ингаляции из инсуффлятора или путем нанесения большого количества капель в глаз. Все патенты, патентные заявки, книги и литература, цитируемые в данном описании, включены таким образом посредством ссылки во всей их полноте. В случае каких-либо несоответствий настоящее описание, включая любые приведенные здесь определения, будет иметь преимущественную силу. Изобретение было описано со ссылкой на разнообразные конкретные и предпочтительные воплощения и методики. Однако следует понимать, что можно сделать множество вариаций и модификаций,оставаясь при этом в пределах сущности и объема изобретения.- 10016791 Примеры Фармакология. Способность соединений по изобретению действовать в качестве антагонистов A2B аденозиновых рецепторов может быть определена с использованием фармакологических моделей, хорошо известных специалистам в данной области техники, или с использованием методик анализа, описанных ниже. кДНК A2B-рецептора крысы субклонировали в экспрессионную плазмиду pDoubleTrouble, используя методики, описанные Robeva, A. et al. в Biochem. Pharmacol., 51, 545-555 (1996). Плазмиду амплифицировали в компетентных клетках JM109 и плазмидную ДНК выделяли с использованием колонокWizard Megaprep (Promega Corporation, Madison, WI). A2B аденозиновые рецепторы вводили в клеткиHEK-293 посредством липофектина, как описано Felgner, P.L. et al. в Proc. Natl. Acad. Sci. USA, 84, 74137417 (1987). Клеточная культура. Трансфицированные клетки HEK выращивали в увлажненной атмосфере 5% CO2/95% O2 при температуре 37C. Колонии отбирали по росту клеток в 0,6 мг/мл G418. Трансфицированные клетки хранили в среде DMEM с добавлением питательной смеси Hams F12 (1/1), 10% сыворотки новорожденного теленка, 2 мМ глутамина и содержащей 50 ME (международных единиц)/мл пенициллина, 50 мг/мл стрептомицина и 0,2 мг/мл генетицина (G418, Boehringer Mannheim). Клетки культивировали в круглых чашках диаметром 10 см и субкультивировали, когда достигался сплошной рост (примерно через 72 ч). Исследования связывания радиолиганда. На A2B-рецепторах: Сливающиеся монослои клеток HEK-A2B промывали PBS (фосфатно-буферный раствор), а затем охлажденным на льду буфером A (10 мМ HEPES (N-гидроксиэтилпиперазин-N-2 сульфоновая кислота), 10 мМ EDTA, pH 7,4) с ингибиторами протеаз (10 мкг/мл бензамидина, 100 мкМ фенилметансульфонилфторида и по 2 мкг/мл апротинина, пепстатина и лейпептина). Клетки гомогенизировали в гомогенизаторе Polytron (Brinkmann) в течение 20 с, центрифугировали при 30000g и осадки дважды промывали буфером HE (10 мМ HEPES, 10 мМ EDTA, pH 7,4 с ингибиторами протеаз). Конечный осадок ресуспендировали в буфере HE с добавлением 10% сахарозы и замораживали по аликвотам при -80C. Для анализов связывания мембраны оттаивали и разводили в 5-10 раз буфером HE до конечной концентрации белка приблизительно 1 мг/мл. Для определения концентраций белков, мембраны и стандарты бычьего сывороточного альбумина растворяли в 0,2% NaOH/0,01% SDS и белок определяли,используя флуоресценцию флуоресцамина. Stowell, C.P. et al Anal. Biochem. 85, 572-580 (1978). Анализы насыщения связывания для A2B аденозиновых рецепторов крысы проводили с [3H]ZM 214385 (17 Ки/ммоль, Tocris Cookson, Bristol UK) (Ji, X. et al, Drug Design Discov., 16, 216-226 (1999 или 125(20:1) добавляли к 50 мкл 100 мМ фосфатного буфера, pH 7,3. Добавляли 1 или 2 мКи Na125I, а затем 10 мкл 1 мг/мл хлорамина-T в воде. После инкубирования в течение 20 мин при комнатной температуре добавляли 50 мкл 10 мг/мл метабисульфита натрия в воде, чтобы погасить реакцию. Реакционную смесь наносили на колонку C18 для ВЭЖХ (высокоэффективная жидкостная хроматография), элюируя смесью метанола и 5 мМ фосфата, pH 6,0. После 5 мин при 35% метанола концентрацию метанола линейно увеличивали до 100% за 15 мин. Непрореагировавший АВОРХ элюировал через 11-12 мин; 125I-АВОРХ элюировал на 18-19 мин с выходом 50-60% по отношению к исходному 125I. В анализах равновесного связывания отношение 127I/125I-АВОРХ составляло 10-20/1. Эксперименты по связыванию радиолиганда проводили в трех повторениях с 20-25 мкг белка мембран в общем объеме 0,1 мл буфера HE с добавлением 1 ед./мл аденозиндеаминазы и 5 мМ MgCl2. Время инкубирования составляло 3 ч при 21C. Неспецифическое связывание измеряли в присутствии 100 мкМ NECA. Эксперименты по конкурированию проводили с использованием 0,6 нМ 125I-АВОРХ. Мембраны фильтровали на фильтрах Whatman GF/C с использованием коллектора клеток Brandel (Gaithersburg, MD) и промывали 3 раза в течение 15-20 с охлажденным на льду буфером (10 мМ Tris (тригидроксиметиламинометан), 1 мМMgCl2, pH 7,4). Значения Bmax и KD рассчитывали путем нелинейной интерполяции Марквардта по методу наименьших квадратов для единичных моделей связывания сайта. Marquardt, D.M., J. Soc. Indust.Appl. Math 11. 431-441.21 (1963). Значения Ki для различных соединений выводили из значений IC50,как описано Linden, J. в J. Cycl. Nucl. Res., 8, 163-172 (1982). Данные повторяющихся экспериментов сводятся в таблицу в виде средних величинстандартная ошибка среднего (SEM). На других аденозиновых рецепторах: [3H]CPX (Brims, R.F. et al., Naunyn-Schmiedeberq's Arch.Pharmacol 335, 59-63 (1987, 125I-ZM 241385 и 125I-ABA использовали в анализах связывания радиолиганда с мембранами, полученными из клеток HEK-293, экспрессирующих рекомбинантные A1, A2A и A3AP крысы соответственно. Связывание [3 Н]R-N6-фенилизопропиладенозина (Schwabe, U. et al.,Naunyn-Schmiedeberg's Arch. Pharmacol., 313, 179-187 (1980 ([3H]R-PIA, Amersham, Chicago, IL) с A1 рецепторами из кортикальных мембран мозга крысы и связывание [3H]CGS 21680 (Jarvis, M.F. et al., J.,Pharmacol. Exp. Therap. 251, 888-893 (1989 (Dupont NEN, Boston, MA) с A2A-рецепторами из стриарных мембран крысы проводили, как описано. Аденозиндеаминаза (3 ед./мл) присутствовала во время получения мембран мозга, во время преинкубирования в течение 30 мин при 30C и во время инкубирования с- 11016791 радиолигандами. Все нерадиоактивные соединения сначала растворяли в ДМСО и разводили буфером до конечной концентрации, где количество ДМСО никогда не превышало 2%. Инкубирования прерывали быстрым фильтрованием через фильтры Whatman GF/B с использованием коллектора клеток Brandell(Brandell, Gaithersburg, MD). Каждую пробирку ополаскивали 3 раза буфером по 3 мл. Использовали по меньшей мере шесть различных концентраций конкурента, охватывая 3 порядка значений, подобранных соответствующим образом для IC50 каждого соединения. Значения IC50, рассчитанные по методу нелинейной регрессии, выполненному в Graph-Pad Prism, San Diego, CA, превращали в кажущиеся значения Ki, как описано Linden, J. в J. Cycl. Nucl. Res., 8:163-172 (1982). Коэффициенты Хилла анализируемых соединений были в интервале от 0,8 до 1,1. Функциональный анализ. Клетки HEK-A2B из одного T75 матраса со сплошным ростом клеток ополаскивали фосфатнобуферным раствором Дульбекко (PBS) без Ca2+ и Mg2+ и затем инкубировали в HBSS (сбалансированный солевой раствор Хенка) без Ca2+ и Mg2+ с 0,05% трипсина и 0,53 мМ EDTA до тех пор, пока клетки не отделялись. Клетки ополаскивали дважды центрифугированием при 250g в PBS и ресуспендировали в 10 мл HBSS, состоящего из 137 мМ NaCl, 5 мМ KCl, 0,9 мМ MgSO4, 1,4 мМ CaCl2, 3 мМ NaHCO3,0,6 мМ Na2HPO4, 0,4 мМ KH3PO4, 5,6 мМ глюкозы и 10 мМ HEPES, pH 7,4 и чувствительного к Ca2+ флуоресцентного красителя indo-1-AM (5 мкМ), при 37C в течение 60 мин. Клетки ополаскивали один раз и ресуспендировали в 25 мл HBSS без красителя с добавлением 1 ед./мл аденозиндеаминазы и выдерживали при комнатной температуре. Добавляли антагонисты аденозиновых рецепторов, приготовленные в виде 100-кратных исходных растворов в ДМСО или наполнителе и клетки переносили в баню при 37C на 2 мин. Затем клетки (1 млн в 2 мл) переносили в кювету с перемешиванием, удерживаемую при 37C в Aminco SLM 8000 спектрофлуориметре (SML instruments, Urbana IL). Отношения флуоресценции indo-1, полученные при 400 и 485 нм (возбуждение, 332 нм), регистрировали с использованием щели с шириной 4 нм. После 100-секундного периода уравновешивания добавляли NECA. Накопление циклического АМФ (аденозинмонофосфата). Получение циклического АМФ осуществляли в буфере DMEM/HEPES (среда DMEM, содержащая 50 мМ HEPES, pH 7,4, 37C). Каждую лунку с клетками дважды промывали буфером DMEM/HEPES и затем добавляли 100 мкл аденозиндеаминазы (конечная концентрация 10 МЕ/мл) и 100 мкл растворов ролипрама и цилостамида (каждый в конечной концентрации 10 мкМ), а затем 50 мкл анализируемого соединения (в подходящей концентрации) или буфера. Через 15 мин инкубирование при 37C заканчивали путем удаления среды и добавления 200 мкл 0,1 М HCl. Кислые экстракты хранили при -20C до момента исследования. Количества циклического АМФ определяли, следуя протоколу, который использовал цАМФ-связывающий белок (PKA) [van der Wenden et al., 1995], со следующими незначительными изменениями. Буфер для анализа состоял из 150 мМ K2HPO4/10 мМ EDTA/0,2% BSA FV при pH 7,5. Образцы (20 мл) инкубировали в течение 90 мин при 0C. После инкубирования препараты фильтровали через фильтры GF/C из микростекловолокна в коллекторе клеток Brandel M-24. Фильтры дополнительно ополаскивали 4 раза 2 мл 150 мМ K2HPO4/10 мМ EDTA (pH 7,5, 4C). После 2 ч экстракции фильтры,через которые были пропущены препараты, подсчитывали на Packard Emulsifier Safe сцинцилляционной жидкости. Было показано, что репрезентативные соединения по настоящему изобретению являются активными в вышеприведенном исследовании аффинности. Синтез и определение характеристик. Протонную ядерную магнитно-резонансную спектроскопию проводили на спектрометреVarian-300 МГц; спектры снимали в ДМСО-d6. Если не отмечено особо, химические сдвиги выражены в виде млн-1 в сторону слабого поля относительно млн-1 ДМСО (2,5 млн-1). Масс-спектрометрию (MC) с ионизацией электрораспылением (ИЭР) проводили на масс-спектрометре ThermoFinnigan LCQ.- 12016791 С использованием TCX (силикагель 60 F254, 0,25 мм, основа из алюминия, EM Science, Gibbstown,NJ) и ВЭЖХ (Shimadzu) с использованием аналитической колонки Varian C18 5 мкм (4,6150 мм) с линейным градиентом системы растворителей при скорости потока 1 мл/мин был сделан вывод, что все производные ксантина были гомогенными. Использованная система растворителей представляла собойMeOH (0,1% муравьиная кислота): H2O (0,1% муравьиная кислота). Пики обнаруживали посредством поглощения в ультрафиолетовом (УФ) диапазоне при 300 и 254 нм. Было показано, что ЯМР- и массспектры согласуются с заданной структурой. Общие методики получения хлорзамещенных пиридильных соединений A. 6-Хлорникотиноилхлорид, полученный из 6-гидроксиникотиновой кислоты (1,444 г, 10,4 ммоль), вCH2Cl2 (20 мл) по каплям добавляли к раствору 5,6-диамино-1,3-дизамещенного урацила (8 ммоль) в сухом пиридине (8,2 мл), поддерживаемом при 5C. Реакционную смесь нагревали до комнатной температуры и перемешивали в течение еще 3 ч. Чтобы погасить реакцию, добавляли воду (50 мл). Растворитель выпаривали с получением масла темного цвета. Масло нагревали с обратным холодильником в течение 2 ч в 2 н. NaOH (20 мл). После охлаждения pH осторожно доводили до 7 с помощью концентрированнойHCl. Образовавшееся твердое вещество собирали и промывали водой (20 мл), эфиром (20 мл) и хлороформом (20 мл) с получением не совсем белого твердого вещества. Продукт использовали на следующей стадии без дополнительной очистки.- 13016791 Общие методики получения аминозамещенных пиридильных соединений B. Соединение A (40 мг) и соответствующий замещенный амин (0,5 мл или 0,5 г) помещали в пробирку для работы под давлением (добавляли 4 мл этанола в качестве растворителя, если амин является твердым веществом). Пробирку для работы под давлением продували аргоном, герметично закрывали и содержимое перемешивали при 160C в течение 48-60 ч. После охлаждения добавляли эфир (10 мл). Полученное твердое вещество собирали и очищали на колонке с силикагелем или препаративной TCX (растворитель A: CH2Cl2:MeOH, от 20:1 до 10:1 или растворитель B: CH2Cl2:MeOH:ТЭА, от 20:1:0,1 до 4:1:0,1).MC m/z 424 (M+H)+. Общие методики получения амидных соединений (1-33). Аминозамещенное пиридильное соединение B (50 мг) растворяли в пиридине (25 мг) при 80-100C. После охлаждения до комнатной температуры добавляли желаемый хлорангидрид (4-6 экв.) при комнатной температуре. Смесь перемешивали при комнатной температуре в течение 24-60 ч. Реакцию гасили льдом, растворитель удаляли и остаток очищали на колонке с силикагелем (CH2Cl2:MeOH = 96:4) с образованием соединений 1-36 и 46-51 с 60-80%-ным выходом. 1. 1-Циклопропил-3-пропил-8-[6-(N-[6-(трифторметил)никотиноил]-N-метиламино)-3-пиридил]ксантин. Условия ВЭЖХ: MeOH 40-95%, градиент за 10 мин, затем MeOH 95%. Время удерживания 9,77 мин. 1MC: m/z 488 (M+H)+. 34. 1,3-Дипропил-8-[6-(N-пиперазинил)-3-пиридил]ксантин. Соединение 34 может быть образовано из соединения 1A посредством конденсации с пиперазином. Условия ВЭЖХ: MeOH 20-75%, градиент за 10 мин, затем MeOH 75%. Время удерживания 9,24 мин. 1 Общие методики получения мочевина-замещенных пиридильных соединений 37-41. Соединение B (50 мг) и соответствующий замещенный изоцианат (3 экв.) помещали в сосуд для работы под давлением и растворяли в сухом ТГФ (тетрагидрофуран) (приблизительно 5-10 мл). Сосуд для работы под давлением продували азотом, герметично закрывали и содержимое перемешивали при 80C в течение 24-72 ч. После охлаждения смесь концентрировали под вакуумом и очищали градиентной хроматографией на силикагеле или препаративной ВЭЖХ. 37. 1-(5-(1-Циклопропил-2,3,6,7-тетрагидро-2,6-диоксо-3-пропил-1H-пурин-8-ил)пиридин-2-ил)-1(2-метоксиэтил)-3-(3-метоксифенил)мочевина. Условия ВЭЖХ: MeOH 40-95%, градиент за 10 мин, затем MeOH 95%. Время удерживания 12,80 мин. Общие методики получения амид-замещенных пиридильных соединений 42-45. Соединение B (50 мг) и соответствующий ангидрид или хлорангидрид (более 10 экв.) помещали в сосуд для работы под давлением и растворяли в сухом пиридине (приблизительно 5-10 мл). Для реакций с ангидридом добавляли ДМАП (4-диметиламинопиридин) в каталитических количествах. Сосуд для работы под давлением продували азотом, герметично закрывали и содержимое перемешивали при 80C в течение 24-72 ч. После охлаждения смесь концентрировали под вакуумом и очищали градиентной хроматографией на силикагеле или препаративной ВЭЖХ. 42. N-(5-(1-Циклопропил-2,3,6,7-тетрагидро-2,6-диоксо-3-пропил-1H-пурин-8-ил)пиридин-2-ил)-N(2-(пиридин-2-ил)этил)ацетамид. Условия ВЭЖХ: MeOH 40-95%, градиент за 10 мин, затем MeOH 95%. Время удерживания 12,80 мин.MC: m/z 534 (M+H)+. 50. 1-Циклопропил-3-пропил-8-[6-(3-(3,4-дифторфенил)-1-(2,3-дигидроксипропил)уреидо)-3 пиридил]ксантин: К раствору 1-аллил-1-[5-(1-циклопропил-2,6-диоксо-3-пропил-2,3,6,7-тетрагидро-1H-пурин-8-ил)пиридин-2-ил]-3-(3,4-дифторфенил)мочевины (0,102 г, 0,1956 ммоль) в ацетоне и воде (15 мл) добавляли тетраоксид осмия (0,0780 мг, 0,3068 ммоль) и 4-метилморфолин-N-оксид (0,046 мг, 0,3927 ммоль). Реакционную смесь перемешивали при 25C в течение 72 ч, после чего нагревали до 40C и реакционную смесь перемешивали в течение еще 48 ч. Продукт очищали с использованием колонки из 43 г диоксида кремния и градиента ДХМ (дихлорметан)/MeOH 0-8%. Фракции концентрировали, фильтровали и промывали MeOH с получением белого твердого вещества. Условия ВЭЖХ: MeOH 40-95%, градиент за 10 мин, затем MeOH 95% в течение 5 мин. Время удерживания 11,98 мин.- 21016791 51. 1-Циклопропил-3-пропил-8-[6-(3-трифтор-м-толил)-1-(2,3-дигидроксипропил]уреидо)-3 пиридил]ксантин. К раствору 1-аллил-1-[5-(1-циклопропил-2,6-диоксо-3-пропил-2,3,6,7-тетрагидро-1H-пурин-8-ил)пиридин-2-ил]-3-(3-трифторметилфенил)мочевины (0,098 г, 0,1770 ммоль) в ацетоне и воде (15 мл) добавляли тетраоксид осмия (0,055 г, 0,2163 ммоль) и 4-метилморфолин-N-оксид (0,036 г, 0,3073 ммоль). Реакционную смесь перемешивали при 25C в течение 72 ч, после чего нагревали до 40C и реакционную смесь перемешивали в течение еще 48 ч. Продукт очищали с использованием колонки из 43 г диоксида кремния и градиента ДХМ/MeOH 0-8%. Фракции концентрировали, фильтровали и промывалиMeOH с получением белого твердого вещества. Условия ВЭЖХ: MeOH 40-95%, градиент за 10 мин, затем MeOH 95% в течение 5 мин. Время удерживания 13,23 мин.MC: m/z 588 (M+H)+. В свете приведенного выше описания возможны многочисленные модификации и вариации настоящего изобретения. Таким образом, следует понимать, что изобретение в объеме прилагаемой формулы изобретения на практике может быть осуществлено иначе, чем конкретно описано здесь. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение, выбранное из группы или его фармацевтически приемлемая соль. 2. Соединение по п.1, где соединение представляет собой или его фармацевтически приемлемая соль. 3. Фармацевтическая композиция, содержащая:(а) терапевтически эффективное количество соединения по п.1 или 2 и- 22016791 4. Терапевтический способ лечения патологического состояния или симптома у млекопитающего,где вовлечена активность аденозиновых A2B-рецепторов и желателен антагонизм их действия, включающий введение млекопитающему эффективного количества соединения по п.1 или 2. 5. Способ лечения астмы, аллергий, аллергических заболеваний или аутоиммунного заболевания,включающий введение эффективного количества соединения по п.1 или 2 млекопитающему, нуждающемуся в таком лечении. 6. Способ лечения диарейных заболеваний, инсулинорезистентности, диабета, рака, ишемии/реперфузионных повреждений, диабетической ретинопатии или ретинопатии, индуцированной гипербарическим кислородом, включающий введение эффективного количества соединения по п.1 или 2 или его фармацевтически приемлемой соли млекопитающему, нуждающемуся в таком лечении. 7. Применение соединения по п.1 или 2 в лечении патологического состояния или симптома, где вовлечена активность аденозиновых A2B-рецепторов. 8. Применение соединения по п.1 или 2 для изготовления лекарственного средства, полезного для лечения заболевания у млекопитающего, такого как человек, где вовлечена активность аденозиновыхA2B-рецепторов. 9. Применение по п.8, где заболевание выбрано из астмы, аллергий, аллергических заболеваний и аутоиммунного заболевания. 10. Применение по п.8, где заболевание выбрано из диарейных заболеваний, инсулинорезистентности, диабета, рака, ишемии/реперфузионных повреждений, диабетической ретинопатии и ретинопатии,индуцированной гипербарическим кислородом. 11. Способ лечения астмы, включающий введение эффективного количества соединения по п.1 или 2 млекопитающему, нуждающемуся в таком лечении. 12. Способ лечения диабетической ретинопатии, включающий введение эффективного количества соединения по п.1 или 2 млекопитающему, нуждающемуся в таком лечении.
МПК / Метки
МПК: A61K 31/497
Метки: 8-[6-амино-3-пиридил]ксантины, замещенные
Код ссылки
<a href="https://eas.patents.su/24-16791-zameshhennye-8-6-amino-3-piridilksantiny.html" rel="bookmark" title="База патентов Евразийского Союза">Замещенные 8-[6-амино-3-пиридил]ксантины</a>