Способ промышленного производства биокатализаторов в форме ферментов или микроорганизмов, иммобилизованных в геле на основе поливинилового спирта, их применение и устройства для их получения
Номер патента: 15861
Опубликовано: 30.12.2011
Авторы: Реброс Мартин, Росенберг Михаль, Стлоукал Радек
Формула / Реферат
1. Способ промышленного производства биокатализаторов с биологически активным материалом в форме иммобилизованных ферментов или микроорганизмов, согласно которому биологически активный материал, образованный смесью свободного нативного или предварительно агрегированного ферментативного катализатора либо продуцирующего микроорганизма или их части и геля на основе поливинилового спирта, желатинируют и формуют в потоке осушающего воздуха при температуре от 80 до 15°С в форме полосок с геометрическим отношением поверхности к объему биокатализатора более 7 мм-1.
2. Способ по п.1, где нитрифицирующие микроорганизмы инкапсулируют в гель на основе поливинилового спирта для получения биокатализатора, предназначенного для удаления из сточных вод азотистых загрязнений, причем биокатализатор формуют в полоски и затем иммобилизаты культивируют в водной питательной среде с содержанием азотистого субстрата от 50 до 500 мг/л N-NH4при рН 7,0, при температуре от 20 до 35°С и концентрации растворенного кислорода выше 1,5 мг/л.
3. Способ по п.1, где денитрифицирующие микроорганизмы инкапсулируют в гель на основе поливинилового спирта для получения биокатализатора, предназначенного для удаления из сточных вод азотистых загрязнений, биокатализатор затем формуют в полоски и затем иммобилизаты культивируют в водной питательной среде с содержанием азотистого субстрата от 50 до 500 мг/л N-NO3, рН 7,8, при температуре от 20 до 35°С и в присутствии метанола в качестве С-субстрата в случае денитрифицирующих микроорганизмов.
4. Способ по п.1, где анаэробные бактерии Zymomonas mobilis инкапсулируют в гель на основе поливинилового спирта для изготовления биокатализатора, предназначенного для продукции этанола из сахаридных субстратов, биокатализатор затем формуют в полоски и затем иммобилизаты культивируют в водной питательной среде с содержанием сахаридного субстрата от 2 до 25 мас.% при температуре от 20 до 40°С и рН от 3,5 до 7,0 в присутствии этанола в количестве от 1 до 15 мас.%.
5. Способ по п.1, где термофильные бактерии Bacillus coagulans инкапсулируют в гель на основе поливинилового спирта для изготовления биокатализатора, предназначенного для получения молочной кислоты из сахаридных субстратов, биокатализатор формуют в полоски и затем иммобилизаты культивируют в водной питательной среде с содержанием сахаридного субстрата от 2 до 14 мас.% при температуре от 30 до 60°С и рН от 5,0 до 7,5 в присутствии молочной кислоты или ее солей в количестве от 1 до 12 мас.%.
6. Способ производства по п.5, где при производстве используют штамм Bacillus coagulans CCM 4318.
7. Способ по п.1, где фермент глюкоамилазу инкапсулируют в гель на основе поливинилового спирта для изготовления биокатализатора, предназначенного для гидролиза крахмала и целлюлозных субстратов, и биокатализатор формуют в полоски.
8. Способ по п.1, где фермент инвертазу инкапсулируют в гель на основе поливинилового спирта для изготовления биокатализатора, предназначенного для гидролиза сахарозных субстратов, и биокатализатор формуют в полоски.
9. Способ по п.1, где фермент b-галактозидазу инкапсулируют в гель на основе поливинилового спирта для получения биокатализатора, предназначенного для гидролиза лактозы и получения D-галактозы, D-глюкозы и галактоолигосахаридов, и биокатализатор формуют в полоски.
10. Применение биокатализатора на основе глюкоамилазы, полученного в соответствии со способом по п.1, при получении D-глюкозы при гидролизе высших сахаридов, полученных путем частичного гидролиза крахмала с содержанием сахаридного субстрата от 2 до 40 мас.% при температуре от 20 до 45°С и рН от 3,5 до 7.
11. Применение по п.10, где иммобилизованную глюкоамилазу применяют при осахаривании крахмалсодержащего субстрата в процессе ферментативного получения этанола.
12. Применение по п.10, где иммобилизованную глюкоамилазу применяют при осахаривании крахмалсодержащего субстрата в процессе ферментативного получения молочной кислоты.
13. Применение биокатализатора на основе b-галактозидазы, полученного в соответствии со способом по п.1, при получении D-галактозы, D-глюкозы и галактоолигосахаридов при гидролизе растворов лактозы с содержанием сахаридного субстрата от 2 до 40 мас.%, при температуре от 20 до 60°С и рН от 3,5 до 7.
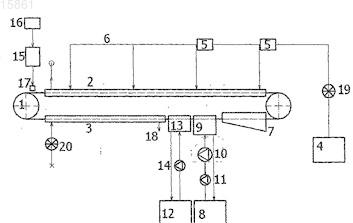
14. Устройство для промышленного производства биокатализаторов, обеспечивающее оптимизацию объема и поверхности биологического носителя в зависимости от количества биологически активного материала, состоящее из заливочного механизма (17), установленного спереди от осушительного канала (2), через который проходит непрерывная конвейерная лента (1), причем это устройство оборудовано по меньшей мере одной заливочной головкой (17) с двумя рядами заливочных игольчатых инжекторов, соединенных с контейнером под умеренным давлением (15) и компрессором (16), конвейерной лентой (1) и осушающей системой - источником (4) осушающего воздуха, который при помощи вентилятора задувают в систему распределения воздуха (6), включающую нагревательные элементы (5), которая ведет в верхний осушительный канал (2) и далее в нижний осушительный канал (3) для окончательной сушки, и контейнер для повторного набухания (7), между которыми установлено соскребающее устройство для сбора продукта (9), сконструированное на основе механического соскребания и промывания под высоким давлением, которое связано с трубопроводом со встроенным насосом высокого давления (10) и насосом низкого давления (11), ведущим в собирающий резервуар (8) с охлаждением и дополнительно с промывающим контейнером (13) для непрерывной окончательной очистки конвейерной ленты (1) при помощи форсунок, связанных с насосом низкого давления (14), который соединен с промывающим контейнером (12) при помощи трубопровода.
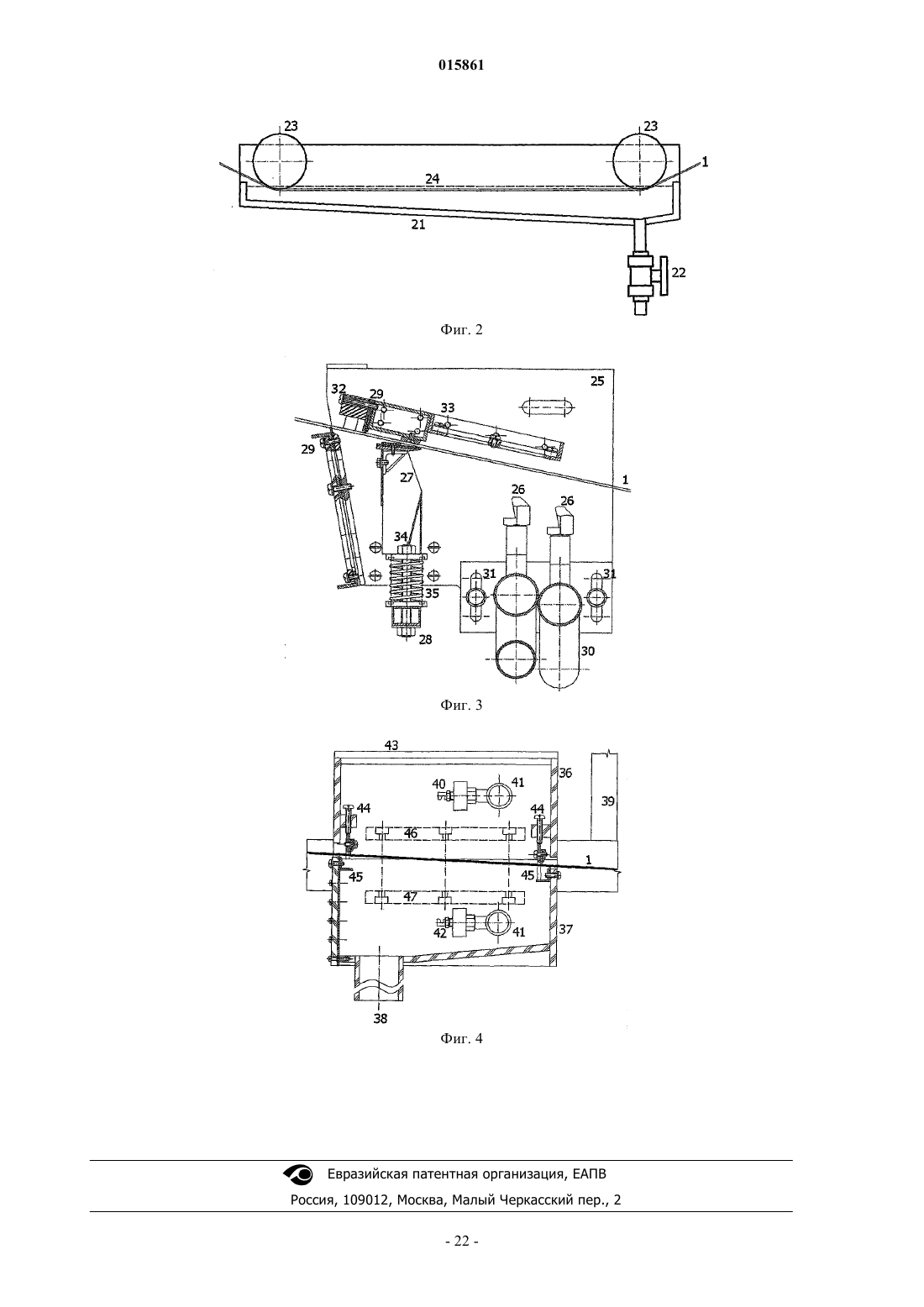
15. Устройство по п.14, в котором собирающее устройство (9) образовано рамкой (25), на которой установлены механический скребок (27) с пружинным нажимным механизмом (28) и форсунки высокого давления (26), фиксированные на рамке (25) под углом от 45 до 80°, где верхний скребок (29) со щеткой для очистки внутренней стороны конвейерной ленты (1) жестко закреплен на его внутренней стороне напротив механического скребка (27), и конвейерная лента (1) оборудована нижним скребком (29) для окончательной очистки в точке выхода ленты из рамки (25).
Текст
СПОСОБ ПРОМЫШЛЕННОГО ПРОИЗВОДСТВА БИОКАТАЛИЗАТОРОВ В ФОРМЕ ФЕРМЕНТОВ ИЛИ МИКРООРГАНИЗМОВ, ИММОБИЛИЗОВАННЫХ В ГЕЛЕ НА ОСНОВЕ ПОЛИВИНИЛОВОГО СПИРТА, ИХ ПРИМЕНЕНИЕ И УСТРОЙСТВА ДЛЯ ИХ ПОЛУЧЕНИЯ Способ промышленного производства биокатализаторов с биологически активным материалом в форме иммобилизованных ферментов или микроорганизмов, которые иммобилизованы в геле на основе поливинилового спирта, и их применения, основанный на том факте, что в промышленном производстве указанных биокатализаторов применяют биологически активный материал, образованный смесью свободного нативного или предварительно обработанного(агрегированного) ферментативного катализатора, или продуцирующего микроорганизма или его части, и геля на основе поливинилового спирта, смесь преобразовывают в гель и формуют в потоке осушающего воздуха при температуре от 80 до 15 С с учетом количества биологически активного материала, при поддержании геометрического отношения поверхности к объему биокатализатора больше 7 мм-1, и затем приготовленные таким образом биокатализаторы могут культивировать или хранить и затем применять в биотехнологических процессах в условиях, которые обеспечивают более высокую производительность данного биотехнологического процесса, более высокую продуктивную и ферментативную стабильность, длительное и повторное применение или поддающийся определению контроль над процессом с последующим легким отделением биокатализатора. Устройство для промышленного производства,обеспечивающее оптимизацию объема биологического носителя и поверхности в зависимости от количества биологически активного материала, состоящее из заливочного механизма (17),установленного спереди от осушительного канала (2), через который проходит непрерывная конвейерная лента (1), оборудованное по меньшей мере одной заливочной головкой (17) с двумя рядами заливочных игольчатых инжекторов, соединенных с контейнером под умеренным давлением (15) и компрессором (16), конвейерной лентой (1) и системой сушки - источником (4) осушающего воздуха, который при помощи вентилятора задувают в систему распределения воздуха (6), включающую нагревательные элементы (5), которая ведет в верхний осушительный канал (2) и далее в нижний осушительный канал (3) для окончательной сушки,и контейнера для повторного набухания (7), между которыми располагается соскребающее устройство для сбора (9), сконструированное на основе механического соскребания и промывания под высоким давлением, которое связано с трубопроводом со встроенным насосом высокого давления (10) и насосом низкого давления (11), ведущим в собирающий резервуар (8) с охлаждением и дополнительно промывающим контейнером (13) для непрерывной окончательной очистки конвейерной ленты (1) при помощи форсунок, связанных с насосом низкого давления (14), который соединен с промывающим контейнером (12) при помощи трубопровода. 015861 Область изобретения Настоящее изобретение относится к способу промышленного производства биокатализаторов с биологически активным материалом в форме иммобилизованных ферментов, или микроорганизмов, иммобилизованных в геле на основе поливинилового спирта, и их применению, и также к устройству для промышленного производства, которое позволяет оптимизировать объем и площадь биологического носителя в соответствии с количеством биологически активного материала, которое включает заливочный механизм, располагающийся спереди от осушительного канала, через который проходит непрерывная конвейерная лента. Предшествующий уровень техники Инкапсуляция микробактерий с использованием носителя на основе поливинилового спирта или полиуретанового носителя известна в области техники. Способ получения биокатализатора с биологически активным материалом в форме микроорганизмов, ферментов, спор и/или клеток, которые находятся в геле на основе поливинилового спирта (polyvinyl alcohol) (называемом в дальнейшем тексте "PVAгель"), раскрыт в чешском патенте 249179. PVA-гель в качестве гелевого носителя для биологически активного материала весьма подходит для получения химических или биологических катализаторов. Гелевая масса, получаемая в соответствии с этим способом, проявляет более высокую механическую стабильность по сравнению с гелевыми массами, известными ранее, в частности, с точки зрения износостойкости и прочности при растяжении. Благодаря вышеупомянутым улучшенным механическим свойствам возможно получать гелевую массу в реакционноспособной и кинетически подходящей линзовидной форме. Полученная таким образом гелевая масса является твердой и износостойкой в течение более чем нескольких месяцев, даже при более высоком вращательном перемешивании по сравнению с известными ранее. Благодаря линзовидной форме, характеризующейся большим диаметром и малой высотой,физически, химически или биологически активное вещество всегда располагается непосредственно под поверхностью, что обеспечивает его реакционноспособную и кинетически полезную конфигурацию. Биотехнологические способы, в которых в качестве носителя биологически активного материала используют PVA-гель, известны в области техники. Известны применения вышеупомянутых носителей в способе удаления азота из сточных вод. Такие применения описаны, например, в ЕР 0758680 (пористые производные целлюлозы), WO 09508513 (поливиниловый спирт, вермикулит, полиуретан) и CN 1076488 (поливиниловый спирт). Упомянутые носители используют, как правило, при иммобилизации активированного ила, часто предварительно обогащенного различными способами, в частности с помощью нитрифицирующих бактерий (см., например, способы PEGASUS или PEGAZUR), но также непосредственно при иммобилизации чистых нитрифицирующих или денитрифицирующих бактерий. Как описано в литературе, очень важной характеристикой носителя является величина удельной поверхности по отношению к объему реактора или, точнее, к объему перерабатываемых в данное время сточных вод. Таким образом, этот параметр непосредственно относится к размеру реактора и к времени удерживания сточных вод в реакторе, поскольку на него может влиять, в частности, количество (или точнее масса или объем) носителя с заданной специфической поверхностью, который помещен в реактор. Например, способ удаления азотистых загрязнений при помощи бактерий, иммобилизованных в носителе на основе полиэтиленгликоля (polyethyleneglycol - PEG) в форме таблеток с геометрическими размерами S/V 3 и 2, позволяет достигать скорости удаления азота от 0,34 до 1,14 кг/м 3 в сутки при содержании влажной биомассы активированного ила в носителе 2 мас./об.% (Т. Sumino, H. Nakamura, N. Mori, Y. Kawaguchi: Иммобилизация of Nitrifying Bacteria by Polyethylene Glycol Prepolymer, Journal of Fermentation and Bioengineering, 73(1), 37-42, 1992.). Тем не менее,величина удельной (геометрической) поверхности носителя по отношению к его объему или, точнее, по отношению к его форме и размерам также представляет собой существенный параметр, в частности, по экономическим причинам. Носители, форма которых напоминает шар или цилиндр, в котором диаметр дна (d) и высота (h) имеют приблизительно одинаковую величину, до сих пор используют для удаления азота из сточных вод с помощью иммобилизованных клеток. Минимальное значение размера носителя для удаления азота из сточных вод составляет 1 мм. Обычно используемые носители имеют размер 3 мм,что означает, что отношение поверхности к объему носителя (S/V - surface/volume) составляет приблизительно от 21 до 6 мм-1. Если использовать носитель в форме линзы или полоски, то может быть использовано меньшее количество биокатализатора по сравнению с существующими в настоящее время способами с использованием иммобилизованных клеток для удаления азотистых соединений из питьевой воды,промышленных и сточных вод, даже при той же самой или большей интенсивности процесса. Еще одно альтернативное применение гелевого носителя в биотехнологических процессах представляет собой способ получения молочной кислоты. Эта кислота широко используется, среди прочего, в частности, в пищевой, фармацевтической и химической промышленности. Молочную кислоту продуцирует большое количество микроорганизмов, но прежде всего мицелиальные грибы и бактерии. Из числа мицелиальных грибов хорошими продуцентами молочной кислоты являются Rhizopsus arrhizuz илиoryzae. Их неоспоримое преимущество по сравнению с бактериями заключается в том, что они продуцируют только L(+) кислоту. Тем не менее, тип ферментации является аэробным (требования высокой стерильности воздуха). Аэробный тип ферментации мицелиальных грибов может представлять собой пре-1 015861 имущество в случае непосредственного способа получения кальциевых солей молочной кислоты, при которых удлинение ферментации и уменьшение выходов может возникать в результате неэффективной нейтрализации (слабого перемешивания) в случае карбоната кальция (Mattey M.: Critical Reviews in Biotechnology, 12, 87-132, 1992). Преимущество бактериальной ферментации заключается в том, что она является ферментацией анаэробного типа, следствием чего является простота устройств для культивирования и меньшие требования к стерильности. Прежде всего для промышленного производства используют бактерии рода Lactobacillus, которые превращают сахарозный субстрат (глюкозу, сахарозу, лактозу) при температуре от 30 до 40 С в молочную кислоту с различным содержанием форм L(+)-, D(-)- и DL кислоты в зависимости от свойств продуцента. Иммобилизация микроорганизмов путем инкапсуляции в гелевые носители представляет собой один из способов, обеспечивающих концентрирование биомассы в реакторе без роста биомассы в полностью ферментируемой среде. Этот способ состоит во включении клеток в капсулы природных или синтетических гелей. Клетки должны быть больше пор носителя настолько, чтобы не происходило высвобождение клеток, в то же время обеспечивалась свободная диффузия субстрата и продуктов в инкапсулированные клетки. В настоящее время известна иммобилизация молочно-кислых бактерий в различных носителях. Прежде всего, они представляют собой каррагенаны, пектаты, альгинаты из числа природных гелей (Norton, S. et al.: Enzyme Microbial. Technol., 16, 457-466, 1994; Richter, K. et al.: Acta Biotechnol., 11, 229-341,1991; Yan, J. et al.: Chem. Biochem. Eng. Q., 15 (2), 59-63, 2001) и полиакриламид из числа синтетических носителей (Tuli, A. et al.: Enzyme Microbial. Technol., 7, 164-168, 1985). Иммобилизаты получают в виде шаров с диаметром от 3 до 5 мм, обычно путем капания соответствующего геля в затвердевающий раствор. Однако недостаток таких способов заключается в том, что шарообразная форма иммобилизатов вызывает ограничения диффузии внутри шаров. Весь объем геля не используется и как следствие микроорганизмы растут только непосредственно под поверхностью шара. Еще один подходящий способ иммобилизации заключается в инкапсуляции молочно-кислых бактерий в гель на основе поливинилового спирта. Последний имеет многочисленные преимущества по сравнению с другими носителями. Прежде всего, он является дешевым, не токсичным для микроорганизмов,слабо биоразрушаемым, обладает превосходными физико-механическими свойствами, не оказывает побочные действия на микроорганизмы и демонстрирует длительную стабильность (патент DE 19827552.8). Кроме того, иммобилизация клеток при помощи способа в соответствии с вышеупомянутым изобретением является щадящей для микроорганизмов-продуцентов (обеспечивает высокую жизнеспособность микроорганизма после иммобилизации и высокую степень выживания микроорганизмов после процедуры иммобилизации), поскольку поперечная сшивка матрицы происходит в потоке осушающего воздуха, что заменяет используемые в настоящее время способы поперечной сшивки путем замораживания (патент DE 4327923) или затвердевания в системе с борной кислотой (патент US 5290693). Кроме того, линзовидная форма иммобилизатов гарантирует загрузку всего объема носителя, оптимальную для роста микроорганизмов и продукции молочной кислоты. Иммобилизаты, полученные при помощи этого способа, можно повторно использовать в режиме периодической, полунепрерывной и непрерывной ферментации, как это было показано для высокотемпературного получения молочной кислоты с помощью клеток Bacillus coagulans, иммобилизованных в PVA-геле линзовидной формы (Rosenberg M. et al. Biotechnol. lett., 27, 1943-1947, 2005). В общем, известно, что для получения этанола традиционно применяют дрожжи Saccharomyces cerevisiae или другие дрожжевые микроорганизмы, способные превращать глюкозу и другие сахариды в этанол в процессе ферментации. Такая ферментация представляет собой основу получения пива и вина и также основу получения этанола для промышленных, пищевых и топливных задач. Недавно отмечен растущий интерес к технологиям с применением бактерий в качестве продуцентов этанола. Zymomonasmobilis является одним из бактериальных продуцентов этанола. Он представляет собой грамотрицательный факультативно анаэробный микроорганизм. Он обладает некоторыми преимуществами по сравнению с дрожжами: более быстрый рост биомассы (но, как правило, меньшая продукция биомассы), более высокая удельная скорость утилизации субстрата и образования продукта, для него не требуется контролируемый доступ кислорода, и он продуцирует меньше побочных метаболитов. Он метаболизирует глюкозу и фруктозу в соответствии с путем Энтнера-Дудорова, что обычно имеет место в случае анаэробных микроорганизмов. В этом метаболическом пути 1 моль глюкозы превращается в 2 моль этанола, 2 моль СО 2 и 1 моль аденозинтрифосфата (АТФ). Этот метаболический путь минимизирует количество глюкозы, потребляемое в биомассе, и таким путем увеличивает продукцию этанола. Реальный выход (1 г спирта/1 г глюкозы) увеличивается до 0,49 при использовании бактерий и обычно составляет 0,44 при использовании дрожжей. Ферментацию с помощью свободных клеток Zymomonas mobilis могут осуществлять в режиме периодической, полунеперерывной и непрерывной ферментации (Rogers P.L., Tribe D.E.: патент США 4403034; Rogers P.L., et al., патент США 4443543; Salzbrunn W., et al., патент США 4876196; Bu'lock J.D.,патент Великобритании 2075053).-2 015861 К настоящему времени исследовательский интерес сфокусирован на увеличении продуктивности микроорганизмов и на модификации системы ферментирующих устройств с различными инновациями; например возвращение клеток в оборот, применение флокулирующих микроорганизмов и т.д. (ArcuriE.J., et al., патент США 4413058; Rogers P.L., et al., патент США 4443544). Продукт ферментации (этанол) аккумулируется в жидкой среде и выделяется почти полностью путем перегонки. Желательно во время выделения продукта значительно уменьшать содержание биомассы путем осаждения, центрифугирования, фильтрации и т.д. безотносительно используемой системы и технологии. Увеличенное содержание нерастворимых веществ увеличивает энергоемкость перегонки, вызывает технологические проблемы (загрязнение аппарата для перегонки, вспенивание и т.д.), увеличивает требования к техническому обслуживанию и также может влиять на качество продукта. С другой стороны, должна быть достигнута максимальная эффективность продукции этанола. Скорость продукции этанола прямо пропорциональна количеству биомассы в ферментере. Это означает, что при постоянных условиях увеличенное содержание биомассы вызывает уменьшение времени, требующегося для получения заданного количества этанола. Один из способов, дающих возможность для концентрирования биомассы в реакторе без роста биомассы в интенсивно ферментируемой среде, заключается в иммобилизации микроорганизмов путем инкапсуляции в гелевых носителях. Этот способ основан на инкапсуляции клеток в природных или синтетических гелевых капсулах. Размер клеток должен быть больше чем размер пор носителя настолько, чтобы не происходило высвобождение клеток, но при этом обеспечивалась свободная диффузия субстрата и продуктов к инкапсулированным клеткам. В настоящее время известна иммобилизация бактерий рода Zymomonas в различных носителях. Прежде всего, они представляют собой каррагенаны и альгинаты из числа природных гелей (CheethamP.S.J., патент США 4393136; Chibata I., патент США 4350765; Kikuta M., патент США 5990191; Yamada Т., et al., патент США 4680263) и полиакриламид из числа синтетических носителей (Yamada Т., et al.,патент США 4680263; Cheetham P.S.J., патент США 4393136). Иммобилизаты обычно изготавливают в форме шаров, имеющих диаметр от 3 до 5 мм, в основном путем капания соответствующего геля в раствор затвердителя. Тем не менее, недостаток такого способа заключается в том, что шарообразная форма иммобилизатов вызывает ограничения по диффузии внутрь шаров. Для загрузки клеток используется не весь объем геля, и, следовательно, микроорганизм растет лишь непосредственно под поверхностью шара-носителя и не заполняет общий объем матрикса. Подходящий способ иммобилизации заключается в инкапсуляции бактерии Zymomonas mobilis в геле на основе поливинилового спирта. Последний имеет множество преимуществ по сравнению с другими носителями. Прежде всего, он является дешевым, не токсичным для микроорганизмов, слабо биоразрушаемым, обладает превосходными физико-механическими свойствами, не оказывает побочные действия на микроорганизмы и демонстрирует длительную стабильность (патент Германии 19827552.8). Кроме того, иммобилизация клеток при помощи способа в соответствии с вышеупомянутым изобретением является щадящей для микроорганизмов-продуцентов (обеспечивает высокую жизнеспособность микроорганизма после иммобилизации и высокую степень выживания микроорганизмов после процедуры иммобилизации), поскольку поперечная сшивка матрицы происходит в потоке осушающего воздуха и, таким образом, заменяет используемые в настоящее время способы поперечной сшивки путем замораживания (патент Германии 4327923) или затвердевания в системе с борной кислотой (патент США 5290693). Кроме того, линзовидная форма иммобилизатов гарантирует загрузку всего объема носителя,оптимальную для роста микроорганизмов и продукции этанола. Иммобилизаты, полученные при помощи этого способа, можно повторно использовать в режиме периодической, полунеперерывной и непрерывной ферментации. Путем иммобилизации Z. mobilis на частицах PVA-геля линзовидной формы получали производительность при периодическом способе ферментации в девять раз большую(43,6 гл-1 ч-1), а при непрерывном способе ферментации в три раза большую (30,7 гл-1 ч-1) по сравнению со способом, в котором используют неиммобилизованные клетки (Rebro M. et al., Lett. Appl. Microbiol.,41, 412-416, 2005). При использовании иммобилизатов шарообразной формы продукция этанола составляла 77 мгэтанола/мггеля/ч при использовании Zymomonas mobilis, иммобилизованного в каррагенане, с 10 мас.% глюкозной среды в реакторе периодического действия 500 мл, заполненном 20 мл иммобилизатов, имеющих диаметр 4 мм и температуру 30 С (Chibata I., патент США 4350765). Когда продуцент иммобилизован в альгинате натрия, причем влажная масса клеток составляет 20% мас./об. (мас./об. - влажная масса клеток,что соответствует 1/5 сухой массы клеток), воспроизводимость в тех же самых условиях составляет 0,49 гэтанола/гвлажной массы/ч в системе периодической загрузки, что после пересчета соответствует 98 мгэтанола/млгеля/ч, и в непрерывном режиме 0,47 гэтанола/гвлажной массы/ч, что после пересчета соответствует 94 мгэтанола/млгеля/ч (Cheetham P.S.J., патент США 4393136). Альтернативным применением гелевого носителя в биотехнологических процессах является способ получения глюкозы и фруктозы из сахарозы при помощи иммобилизованного фермента инвертазы. Сахароза представляет собой запасаемый дисахарид, присутствующий в основном в сахарной свекле и сахарном тростнике. Его используют в пищевой промышленности, а также в качестве субстрата в способах ферментации. Он состоит из моносахаридов глюкозы и фруктозы. Эти моносахариды образуются из са-3 015861 харозы в результате гидролиза, например путем ферментативного гидролиза, с использованием фермента инвертазы. Его применение приводит в результате к образованию смеси глюкозы и фруктозы (инвертированный сахар), которая имеет множество преимуществ по сравнению с негидролизуемой сахарозой: уменьшенное образование мутности кристалла, увеличенная сладость и пригодность для способов ферментации. В промышленной практике для гидролиза сахарозы используют ферментативные препараты инвертазы, которые не пригодны для повторного применения. По этой причине фермент становится одним из наиболее важных с точки зрения экономики составляющих получения глюкозо-фруктозных сиропов. Подходящий способ иммобилизации этого фермента обеспечивает его многократное применение и, кроме того, дает возможность сделать весь способ производства непрерывным и таким образом значительно увеличивает его эффективность. Наиболее часто используемым способом является поперечная сшивка. Наиболее широко используемыми агентами для поперечной сшивки являются полиамид (Sou M. et al. JP 58086085, Rohrbach R.P. et al. US 426842), глутаровый альдегид (Lee D.M et al. US 4749653), полимеры с несвязанными карбоксильными группами (Mauz О. US 4767620), полимеры с эпоксидными группами(Mauz О. US 4931476), иммобилизация в подвергнутых поперечной сшивке под действием света битумах(Kunihiro I. JP 55023941) и включение в различные матрицы при помощи агента для поперечной сшивки,например иммобилизация на стеклянных шариках при помощи глутарового альдегида (Toshiyuki Y. et al.JP 58179494). Другие способы представляют собой ковалентное присоединение инвертазы к частицам силикагеля при помощи глутарового альдегида (Thibault P.A. ЕР 0231668), ковалентное связывание при помощи дисульфидных связей на органических и неорганических носителях (Cormier R.A. et al. US 4176006), ковалентное связывание при помощи органосилана (Но G.H. et al. US 4384045), ковалентное связывание при помощи диальдегида на целлюлозе и лигниновых материалах (Monsan P. US 4405715) и ковалентное связывание на диалкиламиноалкилцеллюлозе (Lapins Ch. D. et al. US 4933284). Инвертазу также иммобилизовали путем адсорбции, например, на матрице из костей животного (Fihdlay Ch. J. US 5037749). Еще один способ представляет собой инкапсуляцию клеточных лизатов, обладающих высокой инвертазной активностью, в альгинатном геле (Obana H. et al. JP 57163484, Chang H.N. et al. US 5766907) или в полиуретановых полимерах (Hartdegen F.J. et al. US 4098645). Комбинированные способы, такие как, например, адсорбция фермента на хлопке, обработанном полиэтиленимином, и последующая поперечная сшивка глутаровым альдегидом (Yamazaki H. et al. CA 1203187), также имеют практическое применение. По-видимому, применение PVA (геля на основе поливинилового спирта) представляет собой очень хорошую альтернативу. Инвертазу успешно иммобилизовали в носителе с твердым центром, покрытым гелем PVA (Yamamdto Н. и Ko et al. JP 2005042037). Для осуществления ковалентного связывания и включения инвертазы также использовали поперечную сшивку PVA, смешанного с полиэтиленгликолем,с помощью света (Ichimura K. JP 58152483, Suehiro Т. et al. JP 1252285, Izumida H. et al. JP 1071491). Матрицу PVA также могут подвергать поперечной сшивке борной кислотой, как в геле инкапсулируют инвертазу (Guocheng Ch. et al. CN 1076488), или путем сушки (Ishimura F. et al. US 4727030). Способ сушки также использовали для удержания указанного фермента в PVA-геле линзовидной формы. Авторы сообщали о высокой стабильности при длительном использовании и хранении иммобилизованной инвертазы (Rebros M. et al., Food Chem., 102, 784-787, 2007). Другие способы используют в комбинации с поперечной сшивкой (Tsutsumi S. et al. JP 2046288) или с добавлением винилацетата (Moriya Т. et al., JP 56113290), виниламина (Moriya Т. et al., JP 56113292) или аминоацеталированного PVA (Yamauchi A. etal. US 4307151). Альтернативное применение гелевого носителя в биотехнологических способах осуществляют в способе получения глюкозы из крахмала при помощи иммобилизованного фермента глюкоамилазы. Крахмал, представляющий собой хранилище питательных веществ у растений, является одним из основных источников глюкозы в пищевой и бродильной промышленности. Крахмал содержит два типа молекул: амилазу и амилопектин. Амилаза в кукурузе, например, составляет 10% от общего количества крахмала. Она содержит до 1000 мономеров глюкозы, связанных -1,4-гликозидными связями. Оставшиеся 90% представляет собой амилопектин, включающий также -1,6-гликозидные связи помимо -1,4 гликозидных связей. Количество мономеров глюкозы в цепи составляет до 10000. Способ предварительной обработки сырья для применения в способе ферментации состоит из двух стадий. На первой стадии перевод крахмала в жидкое состояние осуществляют при помощи эндофермента -амилазы, который вызывает случайную диссоциацию -1,4-гликозидных связей при высокой температуре. Эта реакция приводит к образованию декстринов и низших олигосахаридов с различной длиной цепей. На второй стадии декстрины и олигосахариды диссоциируют на нередуцирующем конце экзоферментом глюкоамилазой на глюкозные мономеры. Глюкоамилаза вызывает диссоциацию как -1,4-, так и-1,6-гликозидных связей. Тем не менее, -1,6-гликозидные связи гидролизуются в гораздо меньшей степени. Степень гидролиза также зависит от длины цепи. В промышленной практике на 1 т крахмала используют от 1 л до 1,2 л препарата фермента глюкоамилазы, который не пригоден для повторного-4 015861 применения. Подобная иммобилизация этого фермента может дать возможность его многократного применения и возможность сделать весь способ непрерывным. Достигнуто значительное улучшение иммобилизации этого фермента путем поперечной сшивки с таким агентом, как полиамин (Symon et al. U.S. 4415663, Lantero et al. U.S. 5472861, DeFilippi U.S. 4343901, Rohrbach et al. U.S. 4268423), глутаровый альдегид (Lee et al. U.S. 4749653, Nishimura et al. U.S. 4888285, Rorvah et al. K.R. 8601229), акриловые или алкильные агенты (Boross et al. U.S. 4794083, Selemenev et al. RU 2204600), при помощи которых фермент заякоривается на неорганической или органической матрице. Оказывается, что подходящим является применение способов адсорбции (Abdullah et al. U.S. 4226937, Kumakura et al. JP 61060700, Motai et al.J.P. 59232092, Selemenev et al. R.U. 2181770, Kimura et al. J.P. 63056297), и также мембранных реакторов с иммобилизованной глюкоамилазой (Thomas et al. U.S. 5130237). Rebros с соавторами сообщали об успешной иммобилизации в PVA-геле (Enzyme Microb. Tech., 39, 800-804, 2006). Авторы сообщали о высокой стабильности при применении в периодическом и непрерывном режимах ферментации. Они обнаружили, что температурный максимум для применения ферментов, иммобилизованных в PVA-геле, в водных растворах составляет 55 С. Инкапсуляция, при которой биологический материал инкапсулирован в гелевую структуру и используется прежде всего для иммобилизации микроорганизмов, полностью отсутствует при иммобилизации глюкоамилазы. Тем не менее, без появления поперечных сшивок с образованием более крупных структур фермент легко вымывается из пор матрицы. Альтернативное применение гелевого носителя в биотехнологических процессах заключается в применении в способе гидролиза раствора лактозы и в получении D-галактозы, D-глюкозы и галактоолигосахаридов из растворов лактозы при помощи иммобилизованной -галактозидазы. Дисахарид лактоза синтезируется в молочной железе большинства млекопитающих. Ее коммерчески получают из коровьего молока (с содержанием лактозы от 4,5 до 5 мас.%) путем экстракции из молочной сыворотки (Baldrick and Bamford, 1997). Лактоза, присутствующая в молоке и молочных продуктах, представляет собой важную питательную составляющую. Она поддерживает рост Bifidobacteriumsp., представляет собой источник галактозы, необходимой для продукции галактолипидов и галактоолигосахаридов, способствует абсорбции кальция и т.д. (Maldonado et al., 1998). Она обладает низкой растворимостью и кристаллизуется в концентрации больше 18 мас.%. Это представляет собой проблему,поскольку кристаллы лактозы приводят к неприемлемой песочной текстуре (Zadow, 1992) при производстве молочных продуктов, таких как сгущенное молоко и мороженое. Это представляет собой причину,по которой для этих продуктов весьма желателен гидролиз лактозы. Кроме того, гидролиз лактозы также приводит к значительному уменьшению гигроскопичности сухих молочных продуктов, увеличению сладости и уменьшению протекания реакций Мэйлларда (Curda et al., 2001, Zadow, 1992, Rosenberg et al.,1995).-Галактозидаза важна не только при гидролизе лактозы в молоке, но также при переработке молочной сыворотки. Сыворотка продуцируется в достаточно больших количествах в виде побочного продукта в молочной промышленности при получении сыра, творога и казеина. При получении сыра в мире ежегодно получают более 150 млн тонн молочной сыворотки (в среднем 10 л молочной сыворотки на 1 кг сыра) и по всему миру производство сыра постоянно увеличивается. Молочную сыворотку пока перерабатывают не очень интенсивно, что представляет собой экономическую и экологическую проблему(Novalin et al., 2005). Кроме того, ее обработка включает множество ограничений и отсутствует возможность свободно ее сбрасывать в окружающую среду. Половину получающихся отходов используют при производстве концентратов белка молочной сыворотки (WPC - whey protein concentrates), но в основном при кормлении сельскохозяйственных животных (Rudolfova and Curda, 2005). Молочная сыворотка также может быть использована в качестве сырья при производстве этанола. С этой точки зрения молочная сыворотка может представлять собой привлекательный субстрат для способов ферментации в будущем(Cote et al., 2004). Например, при производстве этанола можно использовать дрожжи Kluyveromyces, которые утилизируют лактозу. Гидролиз лактозы дает возможность для применения сгущенной молочной сыворотки с более высокой концентрацией источника углерода в качестве субстрата и, таким образом,значительно увеличивает выход ферментации (Rosenberg et al., 1995). В некоторых случаях можно осуществлять способ ферментации таким путем, что микроорганизм-продуцент использует только присутствующую глюкозу, тогда как оставшаяся галактоза после этого может быть выделена, очищена или химически модифицирована (Rosenberg, 2000). Еще одно важное применение -галактозидазы в пищевой промышленности заключается в образовании галактоолигосахаридов (GOS - galactooligosaccharides). Они одновременно образуются при гидролизе лактозы благодаря трансгликозилирующей активности -галактозидазы. Трансгликозилирующая активность -галактозидазы впервые описана в 1950-х годах (Aronson, 1952). Первые опубликованные работы фокусируются на мониторинге благоприятных эффектов GOS и поиске оптимальных способов их получения (Mahoney, 1998). GOS относится к группе так называемых пробиотиков: неперевариваемые компоненты пищи, которые избирательно стимулируют рост или, точнее, активность пробиотических культур в пищеварительном тракте человека. Благодаря своей -конфигурации, GOS устойчивы к гидро-5 015861 лизу слюной и ферментами пищеварительных соков, которые избирательно гидролизуют -гликозидные связи (Sako et al., 1999). GOS проходят в толстую кишку, где они принимают участие во множестве важных процессов. Бифидогенная микрофлора метаболизирует GOS с образованием короткоцепочечных жирных кислот (уксусной, пропионовой, молочной и масляной кислот) и газов (Johnson et al., 1993). Появляющиеся кислоты стимулируют перистальтику кишечника и способствуют абсорбции кальция и железа путем уменьшения рН. GOS также известны как факторы роста бифидобактерий, известные своим благоприятным действием на здоровье. Кроме того, бифидобактерии избирательно утилизируют галактоолигосахариды, которые подавляют рост нежелательных микроорганизмов в пищеварительном тракте(Pennisin, 1997). GOS также благоприятны для здоровья полости рта, когда они не используются микрофлорой полости рта (Streptococcus mutants), и таким образом предотвращают образование кариеса зубов(Szilagyi, 1999). Отдельные -галактозидазы отличаются общим количеством и структурой образующихся GOS. Например, после выделения -галактозидаз у различных штаммов рода Bifidobacterium и их последующего использования при синтезе GOS из 30% лактозного раствора существует явное различие в продуцируемом количестве. В случае Bifidobacterium angulatum они составляют 43,8% всех сахаридов, присутствующих в растворе, тогда как в случае Bifidobacterium pseudolongum - только 26,8% (Rabiu et al., 2001). В зависимости от структуры тип вновь образуемой гликозидной связи двух моносахаридных единиц (галактоза-галактоза, галактоза-глюкоза) в случае Bifidobacterium bifidum представляет собой (1-3)Streptococcus thermophilus (Matsumoto, 1990). Фермент -галактозидазу иммобилизуют следующими путями: захват (Mammarella and Rubiolo,2005, Rodriguez-Nogales and Delgadillo, 2005), перекрестное связывание (Sungur and Akbulut, 1994), адсорбция (Carpio et al., 2000), ковалентное связывание (Hu et al., 1993, Findlay, 1991, Di Serio et al., 2003),заключение в мембраны (Novalin et al., 2005) или комбинация этих способов (подробнее описанная в разделе 1.2.1). Способ иммобилизации -галактозидазы ассоциируется с некоторыми недостатками, такими как потеря активности фермента после иммобилизации. Уменьшение активности -галактозидазы после иммобилизации составляет от 5 до 90% и зависит от используемого способа иммобилизации. Этот недостаток компенсируется возможностью повторного использования иммобилизатов. Способность сохранять ферментативную активность и стабильность иммобилизатов при повторном применении являются решающими параметрами при применении иммобилизатов в промышленном масштабе (Tanaka and Kawamoto, 1999). Полиакриламидный гель и гель на основе поливинилового спирта часто используют в способах захвата. Матрицу PVA также используют для инкапсуляции -галактозидазы, выделенной из мицелиальных грибов, вследствие чего увеличивается ее температурная стабильность. Фермент сохраняет 70% от своей предшествующей активности спустя 24 ч при 50 С и 5% от своей предшествующей активности при 60 С (Batsalova et al., 1987). Khare и Gupta (1988) иммобилизовали -галактозидазу Е. coli с использованием комбинации двух способов: перекрестное связывание и последующая инкапсуляция в полиакриламидном геле. При осуществлении того же самого способа, но с использованием диметиладипимидата в качестве агента, осуществляющего перекрестное связывание, и веществ, препятствующих ферментативной активности: бычьего сывороточного альбумина, цистеина и лактозы, измеряемая активность составляет 190% от предшествующей активности иммобилизатора. Сравнение различных способов иммобилизации -галактозидазы термофильной бактерии Thermus aquaticus продемонстрировало, что перекрестное связывание и последующий захват в агарозные гранулы представляет собой предпочтительный способ иммобилизации высоких концентраций фермента, обеспечивающий преимущество, заключающееся в высокой ферментативной активности (Berger et al., 1995). Способ иммобилизации дает возможность увеличения стабильности фермента в различных условиях реакции. Захват -галактозидазы A.oryzae в пористом криогеле PVA увеличивает устойчивость фермента к температуре, величине рН и ионной силе (Rossi et al., 1999). Адсорбция представляет собой технически нетребовательный способ иммобилизации. Гидрофобное хлопковое волокно может служить, например, в качестве носителя, на котором фермент сохраняет 50% своей предшествующей активности (Sharma and Yamazaki, 1984). Bakken et al. использовали -галактозидазу A. oryzae путем ее абсорбции на поливинилхлориде и силикагеле в форме мембраны (1990) во время лактозного гидролиза в молоке в реакторе с продольным потоком. -Галактозидаза, иммобилизованная путем адсорбции на костной муке, сохраняла 83% ранее имевшей место активности, но в процессе гидролиза в четырех партиях иммобилизат постепенно терял свою активность. После четвертого гидролиза активность иммобилизатов составляла лишь 24% от исходной (Carpio et al., 2000). Этот эксперимент продемонстрировал недостаток способа иммобилизации, при которой происходит небольшая десорбция. Этот эффект может быть устранен путем добавления подходящего агента, осуществляющего поперечную сшивку (Szczodrak, 2000).Piettaa et al. (1989) иммобилизовали -галактозидазу, выделенную из А. oryzae в двух различных носителях с использованием ковалентной связи. Первый представлял собой цеолит; но он не удобен, по-6 015861 скольку он связывается лишь с небольшим количеством фермента. В противоположность этому, порошкообразный нейлон-6 ковалентно связывается с большим количеством фермента и образует стабильный комплекс. Peters и Rehm (2006) иммобилизовали -галактозидазу путем ковалентного связывания на полигидроксиалканоатных гранулах. Получающиеся иммобилизаты стабильны длительное время в процессе их хранения в различных условиях, что свидетельствует о сильной связи между носителем и иммобилизованным ферментом. Глутаровый альдегид с двумя реакционноспособными функциональными группами представляет собой наиболее часто используемый агент для перекрестного связывания при иммобилизации галактозидазы (Guisan et al., 1997, Szczodrak, 2000, Zhou and Chen, 2, 2001). Тем не менее, способ иммобилизации путем перекрестного связывания, в частности, применяют в комбинации с другими способами(упомянутыми выше, Panesar et al., в печати), такими как адсорбция или захват. Например галактозидазу A. oryzae, иммобилизованную с использованием способа захвата в форме волокон, состоящих из альгината и желатина, затем подвергали перекрестному связыванию глутаровым диальдегидом, который предотвращает вымывание фермента (Tanriseven and Dogan, 2002). Этот тип перекрестного связывания также использовали при иммобилизации -галактозидазы в кобальт-альгинатном геле. Тем не менее, высвобождение кобальта во время гидролиза лактозы приводит к тому, что эти иммобилизаты невозможно применять в пищевой промышленности (Ates and Mehmetoglu, 1997). На активность и стабильность иммобилизованного фермента влияет величина рН, температура и ионная сила (Roy and Gupta, 2003). По сравнению со свободным ферментом иммобилизованный фермент обладает более широкими оптимумом рН и диапазонами температуры, что упомянуто в большей части опубликованных работ. Более высокая стабильность иммобилизованной -галактозидазы при меньшем значении рН и более высокой температуре представляет собой преимущество при гидролизе лактозы, и,кроме того, в результате уменьшения величины рН и увеличения температуры уменьшается риск загрязнения. С другой стороны, сдвиг оптимума рН и увеличение стабильности в этих условиях представляет собой преимущество при гидролизе лактозы в сладкой молочной сыворотке, рН которой находится в диапазоне от 5,5 до 6,0 (Szczodrak, 2000).-Галактозидазу из различных микробных источников также иммобилизовали с целью получения галактоолигосахаридов в режиме непрерывной работы, а также в режиме периодической работы (Chockchaisawasdee et al., 2005). По сравнению со свободным ферментом иммобилизованный фермент приводит к меньшей концентрации GOS. Это уменьшение вызвано ограничением доступа субстрата к ферменту в иммобилизованной системе (Mahoney, 1998). Концентрация и структура возникающих GOS в значительной степени зависит от исходной концентрации субстрата и происхождения фермента. Увеличение исходной концентрации лактозы с 14 до 23% приводит к удваиванию продукции GOS (Foda and LopezLeiva, 2000, Chockchaisawasdee et al., 2005).Shin et al. (1998) иммобилизовали фермент, выделенный из Bullera singularis ATTC 24193, в хитозановых гранулах. Они использовали иммобилизованный таким образом фермент при продукции GOS. Эксперимент длился в течение 15 дней, в течение которых они зарегистрировали 55 мас.% GOS от всех сахаридов (исходная концентрация субстрата составляет 100 г/л) и объемную производительность 4,4 г/л/ч. Еще один пример использования иммобилизованной -галактозидазы при производстве олигосахаридов также описан в работе Albayrak и Yang (2002). Они получили максимальную продукцию 26 мас.% всех сахаридов (с концентрацией субстрата 400 г/л) и объемную продуктивность 106 г/л/ч путем использования фермента A. oryzae, иммобилизованного на хлопковом волокне. Foda и Lopez-Leiva (2000) тестировали мембранный реактор проточного типа с иммобилизованной -галактозидазой для полученияGOS. Они достигли самой высокой продукции (31% от массы) с использованием молочной сыворотки,обработанной путем ультрафильтрации при исходной концентрации лактозы 20 мас.%. Молочная сыворотка представляет собой богатый источник лактозы; ее применение при производстве GOS, повидимому, является весьма привлекательным. Существует известное заливочное устройство, которое используют при получении иммобилизатов,представляющих собой продукты - биокатализаторы на основе носителя - поливинилового спирта обычно производимые в форме линз или небольших полосок. Смесь геля на основе поливинилового спирта и биомассы наносят на непрерывную транспортерную ленту точными заранее определенными дозами с использованием капельного заливочного механизма, причем смесь превращается в адгезивную массу в результате сушки и физического гелеобразования во время процесса производства. В данном случае заливочный механизм для получения иммобилизатов, основанных на носителе - поливиниловом спирте, состоит из заливочного механизма, располагающегося в передней части осушительного канала,внутри которого движется непрерывная конвейерная лента (изготовленная, например, из полиэтилена). Заливочный механизм, известный как заливочная головка, оборудован одним рядом заливочных игольчатых инжекторов, имеющих диаметр, варьирующий от 0,1 до 2,00 мм, которые пульсируют при помощи электромагнитов с различной частотой и различной длиной импульса и переносят или выливают смесь геля на основе поливинилового спирта и биомассы на непрерывную конвейерную ленту. Заливочное устройство дополнительно содержит блок повторного набухания, располагающийся в верхней части-7 015861 осушительного канала, который образован системой распылительных форсунок низкого давления, которые увлажняют (приводят к повторному набуханию) высушенный продукт. Кроме того, заливочное устройство оборудовано устройством для сбора, состоящим из находящегося под давлением скребка, представляющего собой пластину из нержавеющей стали, ополаскиваемую из распылительных форсунок,располагающихся выше находящегося под давлением скребка из нержавеющей стали и прикрепленных к несущей раме заливочного устройства выше приводного цилиндра ленты. В качестве источника осушающих сред используют воздух из окружающей среды или осушенный воздух, применяя непрерывное атмосферное осушение или непрерывное замораживание, который подогревают при помощи нагревательных элементов перед проникновением в осушительный канал, что обеспечивает образование геля при сушке иммобилизатов, полученных на основе носителя - поливинилового спирта. Заливочные устройства, располагающиеся таким образом, неспособны к длительному экономичному производству, в частности, ввиду сложности удаления иммобилизатов на основе носителя - поливинилового спирта с конвейерной ленты. Механический скребок из нержавеющей стали используют для соскребания и последующего сбора. Скребок является крепко прижатым к поверхности конвейерной ленты благодаря эластичности, и затем масса соскребается скребком и падает в сборочный резервуар. Такое механическое удаление продукта с ленты далеко от совершенства, в особенности принимая во внимание образование больших кластеров, агломератов носителя на основе поливинилового спирта, следствием чего является получение продукта, обладающего низкой или нулевой активностью. Также еще одним недостатком является значительный механический износ непрерывной конвейерной ленты заливочного устройства. Дополнительно было установлено, что применение солевых растворов в секции повторного набухания заливочного устройства вызывает прилипание солей к поверхности непрерывной ленты и последующее изменение поверхностного натяжения конвейерной ленты заливочного механизма, и, следовательно, изменение формы продукта. Это изменение означает, что во время удаления и отлипания иммобилизатов с конвейерной ленты в большинстве случаев не удается избежать повреждения и образования больших кластеров или агломератов. Краткое изложение сущности изобретения Вышеупомянутые недостатки устраняются при помощи способа промышленного производства биокатализаторов с биологически активным материалом в форме иммобилизованных ферментов или микроорганизмов, которые иммобилизованы в геле на основе поливинилового спирта, или их применения, основанного на том факте, что в промышленном производстве указанных биокатализаторов применяют биологически активный материал, который состоит из смеси, содержащей свободный нативный или предварительно обработанный (агрегированный) ферментативный катализатор, или микроорганизмпродуцент, или их части, и гель на основе поливинилового спирта, после чего смесь формуют и преобразовывают в гель в потоке осушающего воздуха при температуре от 80 до 15 С, с учетом количества биологического материала, поддерживая геометрическое отношение поверхности к объему больше 7 мм-1, и после этого полученные таким образом биокатализаторы могут культивировать и после этого использовать в биотехнологических процессах в условиях, которые позволяют поддерживать более высокую продуктивность, более высокую стабильность продуктов и ферментов, длительное и повторное применение или поддающийся определению контроль над процессом с последующим легким отделением биокатализатора, для данного биотехнологического способа. Основные преимущества технологий с иммобилизованными клетками заключаются в значительном уменьшении стоимости осуществления данного способа, связанном с возможностью повторного использования биокатализатора и возможностью сделать способ непрерывным, поддерживая высокую концентрацию фиксированной биомассы в системе, и меньшей стоимости отделения биомассы и выделения продукта. Если способ выполняют непрерывно, не происходит вымывания биомассы из несущей матрицы, уменьшаются непродуктивные фазы роста, увеличиваются выходы и достигаются более высокие скорости реакции. Также благоприятно, чтобы способ контроля биотехнологического процесса по изобретению приводил в результате к уменьшению необходимых объемов реакционной смеси и реакционных интервалов, что означает уменьшение стоимости работы и инвестиций. Желательно для интенсификации настоящего способа удаления азотистых соединений из питьевых,промышленных и сточных вод в форме газообразного азота при помощи иммобилизованных клеток использовать линзовидную форму носителя или, точнее, носитель в форме цилиндра, высота которого в 420 раз меньше чем радиус дна, или в форме небольшой полоски, или точнее блока, один из размеров которого в 4-20 раз меньше, чем другие два, таким образом, что отношение (геометрическое) поверхности к объему (П/О) носителя составляет более 7 мм-1. При изготовлении биокатализатора, предназначенного для удаления азотистых загрязнений из питьевых, промышленных и сточных вод, полезно инкапсулировать нитрифицирующие и денитрифицирующие бактерии в гель на основе поливинилового спирта, и затем преобразовывать в гель и формовать путем сушки при температуре от 80 до 15 С смесь носителя на основе поливинилового спирта и бактериальных клеток в форму линзы или небольшой полоски, таким образом, чтобы минимальное отношение поверхности к объему биокатализаторов составляло 7,0 мм-1, и затем проводить затвердение иммобилизатов в подходящем растворе сульфата натрия. Иммобилизаты затем культивируют в водной питатель-8 015861 ной среде, содержащей от 10 до 1000 мг/л N-NH4 и от 10 до 1500 мг/л N-NO3 азотистого субстрата при температуре от 20 до 35 С и имеющей значение рН от 6,0 до 9,5. Нитрифицирующие бактерии, содержащие биокатализатор, готовят отдельно от денитрифицирующих бактерий, содержащих биокатализатор. Последующее культивирование биомассы, содержащей оба биокатализатора, могут осуществлять непосредственно в промышленных устройствах, предназначенных для нитрификации и денитрификации. Чистую смешанную культуру нитрифицирующих бактерий (Nitrosomonas europeae и Nitrobacter winogradskiy) используют для приготовления иммобилизатов путем инкапсуляции в PVA матрице. Используемые литотрофные бактерии (медленно растущие организмы) получают энергию для своего существования из азота после окисления аммиака (N-NH3) в случае бактерий Nitrosomonas europeae и в результате окисления нитритов (N-NO2) в случае Nitrobacter winogradskiy. Денитрифицирующие бактерии (Paraccocus denitrificans), использующие азот нитратов (N-NO3) в качестве акцептора электронов вместо кислорода, используют для приготовления иммобилизатов путем инкапсуляции в PVA матрице. Денитрифицирующие бактерии представляют собой органотрофные бактерии, которым для роста нужен органический углерод. Используемые растворы для культивирования и некоторые реальные промышленные сточные воды не содержат никаких органических агентов, вследствие чего необходимо добавлять органический углерод - спирты, сахариды и т.д., предпочтительно метанол, поскольку он является дешевым, но продуцирует относительно небольшое количество биомассы. Также полезно, чтобы линзовидная форма иммобилизатов поддерживала оптимальное использование всего объема гелевого носителя (загрузку клеток) для роста микроорганизмов и, таким образом, оптимальное применение продуктивных ферментативных свойств микроорганизмов и ферментов, которые можно обнаружить по увеличению удельной производительности биотехнологического способа с использованием иммобилизатов на основе поливинилового спирта (PVA). Биокатализаторы, полученные таким путем, могут использовать повторно в режиме периодической, полунепрерывной и непрерывной ферментации. Для получения биокатализатора, предназначенного для продукции этанола из сахаридных субстратов, полезно инкапсулировать анаэробные бактерии Zymomonas mobilis в гель на основе поливинилового спирта, и затем преобразовать в гель и формовать смесь носителя на основе поливинилового спирта и клеток бактерии Zymomonas путем сушки при температуре от 80 до 15 С, и затем культивировать иммобилизаты в водной культуральной среде, содержащей от 2 до 25 мас.% сахаридного субстрата при температуре от 20 до 40 С, и рН от 3,5 до 7,0, в присутствии этанола, в диапазоне от 1 до 15 мас.%. Также при этом способе полезно, чтобы иммобилизованные клетки отделяли от жидкой части и использовали отдельно для продукции этанола, после окончания продукции. Полученные таким образом биокатализаторы могут повторно использовать в режиме периодической, полунепрерывной и непрерывной ферментации. Для получения биокатализатора, предназначенного для продукции молочной кислоты из сахаридных субстратов, полезно инкапсулировать термофильные бактерии Bacillus coagulans в гель на основе поливинилового спирта, и затем преобразовывать в гель и формовать смесь носителя на основе поливинилового спирта и клеток бактерии Bacillus coagulans путем сушки при температуре от 80 до 15 С, при отношении поверхности к объему иммобилизатов больше чем 7,0 мм-1, и затем культивировать иммобилизованные клетки в водной культуральной среде, содержащей от 2 до 14 мас.% сахаридного субстрата,при температуре от 30 до 60 С и значении рН от 5,0 до 7,5, в молочной кислоте или ее солях, присутствующих в диапазоне от 1 до 12 мас.%. Также полезно, чтобы иммобилизованные клетки отделяли от жидкой части и использовали отдельно для продукции молочной кислоты после прекращения продукции. Полученные таким образом биокатализаторы могут использовать повторно в режиме периодической, полунепрерывной и непрерывной ферментации. Для увеличения производительности продукции молочной кислоты полезно использовать штаммBacillus coagulans CCM 4318. Сам по себе этот бактериальный штамм характеризуется высокой производительностью продукции молочной кислоты, в зависимости от количества биокатализатора, при сохранении минимального отношения его объема к поверхности 7,0 мм-1, производительность продукции молочной кислоты будет еще выше. Для приготовления биокатализатора, предназначенного для получения инвертированного сахарида из сахаридных растворов, полезно инкапсулировать фермент инвертазу в гель на основе поливинилового спирта и затем превращать в гель и формовать смесь носителя на основе поливинилового спирта и фермента путем сушки при температуре от 80 до 15 С и при минимальном отношении поверхности иммобилизата к его объему 7,0 мм-1, и использовать полученный таким образом фермент для гидролиза сахаридных растворов, которые одержат от 2 до 50 мас.% сахаридного субстрата, при температуре от 20 до 50 С и значении рН от 3,5 до 7,0. Полезно отделять иммобилизованную инвертазу от жидкой части после завершения гидролиза и повторно использовать ее при продукции инвертированной сахарозы, причем гидролиз сахарозы при помощи иммобилизованной инвертазы осуществляют в периодическом, полунепрерывном и непрерывном режиме. Способ по настоящему изобретению для иммобилизации инвертазы в геле на основе поливинило-9 015861 вого спирта (PVA) основан на сушке геля в осушающем потоке воздуха при температуре от 80 до 15 С,когда может происходить взаимодействие между функциональными группами геля и инвертазой. Линзовидная форма иммобилизатов в случае, если минимальное отношение поверхности к объему иммобилизата составляет 7,0 мм-1, позволяет поддерживать оптимальное использование всего объема геля и достигать высокой удельной активности инвертазы. Иммобилизованный таким образом фермент не вымывается из матрицы и его можно использовать в режиме периодической, полунепрерывной и непрерывной ферментации. Для приготовления биокатализатора, предназначенного для получения D-глюкозы из высших сахаридов, полезно инкапсулировать фермент глюкоамилазу в гель на основе поливинилового спирта и затем преобразовывать в гель и формовать смесь носителя на основе поливинилового спирта и фермента путем сушки при температуре от 80 до 15 С и при минимальном отношении поверхности к объему иммобилизатов 7,0 мм-1, и использовать полученный таким образом фермент для гидролиза высших сахаридов,которые получают путем частичного гидролиза крахмала, содержащего от 2 до 40 мас.% сахаридного субстрата, при температуре от 20 до 45 С и значении рН от 3,5 до 7. Для предотвращения вымывания глюкоамилазы полезно осуществлять иммобилизацию фермента в геле на основе поливинилового спирта(PVA) во время сушки в воздушном потоке при температуре от 80 до 15 С, в условиях, когда могут возникать взаимодействия между функциональными группами геля и глюкоамилазой. Иммобилизованный таким образом фермент не вымывается из матрицы и его могут использовать в периодическом, полунепрерывном и непрерывном режиме. Полученный таким образом сахаридный субстрат, который содержит глюкозу, может применяться в ферментативной и пищевой промышленности. Также полезно, чтобы иммобилизованную глюкоамилазу отделяли от жидкой части после завершения гидролиза и повторно использовали при получении глюкозы. Также полезно, чтобы гидролиз при помощи иммобилизованной глюкоамилазы осуществляли в периодическом режиме, режиме с подпиткой и непрерывном режиме. Также полезно, чтобы иммобилизованную глюкоамилазу использовали для осахаривания субстрата-крахмала в ферментативном способе продукции этанола. Также полезно, чтобы иммобилизованную глюкоамилазу использовали для осахаривания субстрата-крахмала в ферментативном способе продукции молочной кислоты. При получении биокатализатора, предназначенного для гидролиза растворов лактозы, получения Dгалактозы, D-глюкозы и галактоолигосахаридов из растворов лактозы, полезно заключать фермент галактозидазу в гель на основе поливинилового спирта и затем преобразовывать в гель и формовать смесь носителя на основе поливинилового спирта и фермента путем сушки при температуре от 80 до 15 С, и при минимальном отношении поверхности к объему иммобилизатов 7,0 мм-1, причем полученный таким образом фермент используют для гидролиза растворов лактозы, содержащих от 2 до 50 мас.% сахаридного субстрата, при температуре от 20 до 60 С и значении рН от 3,0 до 7,0. Полезно, чтобы иммобилизованную -галактозидазу после завершения гидролиза отделяли от жидкой части и использовали повторно для продукции D-галактозы, D-глюкозы и галактоолигосахарида,гидролиз лактозы при помощи иммобилизованной -галактозидазы осуществляли в периодическом режиме, режиме с подпиткой и непрерывном режиме. Устройство для изготовления иммобилизованных биокатализаторов представляет собой устройство для промышленного получения, которое обеспечивает оптимизацию объема и поверхности биологического носителя в зависимости от количества биологически активного материала, включает капающий заливочный механизм, располагающийся впереди от осушающего канала, через который движется непрерывная конвейерная лента, где устройство оборудовано по меньшей мере одной заливочной головкой с двумя рядами заливочных игольчатых инжекторов, соединенных с контейнером под умеренным давлением и компрессором, конвейерной лентой и осушающей системой - источником осушающего воздуха,который продувается при помощи вентилятора в систему распределения воздуха с включенными нагревателями, которая переходит в верхний осушительный канал, и дополнительно нижний окончательный осушительный канал и контейнер для повторного набухания, между которыми располагается соскребающее и собирающее устройство, сконструированное на основе механического соскребания и ополаскивания при высоком давлении, которое соединено с трубопроводом со встроенным насосом высокого давления и насосом низкого давления, которые нагнетают в собирающий охлаждающий резервуар, и дополнительно промывающий контейнер для окончательной очистки непрерывной конвейерной ленты при помощи форсунок, соединенных с насосом низкого давления, который соединен с промывающим контейнером трубопроводом. Устройство по изобретению образует совершенно новый комплекс промышленного заливочного устройства, состоящего из одной или двух заливочных головок, оборудованных двумя рядами заливочных игольчатых инжекторов, диаметр которых составляет от 0,1 до 2,00 мм, которые пульсируют под действием электромагнитов с различной частотой и длиной импульса, конвейерной ленты с контролируемым приводом, осушительного канала с противоточным осушением, контейнера для повторного на- 10015861 бухания, независимой собирающей промывающей системы низкого давления и нижнего осушающего канала с противоточным осушением в нижней части заливочного устройства. Также полезно, чтобы в состав устройства входила независимая система промывания под высоким давлением при помощи водного солевого раствора в собирающем резервуаре, состоящая из насоса высокого давления для подачи воды под давлением в форсунки высокого давления. Таким образом достигают увеличения эффективности механического соскребания массы с конвейерной ленты. Также важно, чтобы устройство по настоящему изобретению, а именно оборудованное этим типом собирающего и промывающего устройства,было способно обеспечивать ненарушенное экономическое промышленное получение иммобилизатов,основанных на носителе - поливиниловом спирте. Для безошибочного функционирования соскребающего собирающего устройства, представляющего собой часть заливочного устройства, если оно образовано боковой рамкой, в которой механический полимерный скребок, обеспечивающий промывание под углом от 45 до 80, располагается на нажимном механизме из нержавеющей стали, с пружинным нажимным механизмом и промыванием при помощи системы форсунок под высоким давлением, фиксированных на поддерживающей трубчатой системе распределения из нержавеющей стали, которая фиксирована в рамке, для очищения внутренней и внешней сторон конвейерной ленты, полезно, чтобы присутствовали нижний и верхний скребки с полимерными щетками, фиксированные позади механического полимерного скребка в пружинном механизме, и для окончательного очищения конвейерной ленты от продукта в том месте, где она выходит из рамки,устройство было дополнительно оборудовано нижним и верхним скребками. Также благоприятно, чтобы сконструированный механизм соскребающего собирающего устройства также очищал внешнюю сторону непрерывной конвейерной ленты, даже если ее внутренняя поверхность неровная, рифленая или шероховатая. Устройство по изобретению также может быть использовано для соскребания другого адгезивного вещества с конвейерной ленты при производстве других адгезивных материалов. Краткое описание чертежей Изобретение более подробно проиллюстрировано при помощи графических материалов, где фиг. 1 иллюстрирует схему заливочного механизма; фиг. 2 - схему контейнера для повторного набухания; фиг. 3 - частичный срез собирающего устройства и фиг. 4 - схему промывающего контейнера. Описание связанной технологии Способ получения вышеописанных носителей и применения в способе удаления азота из сточных вод при помощи иммобилизованных нитрифицирующих и денитрифицирующих клеток в геле на основе поливинилового спирта описан в следующих примерах. Пример 1. Иммобилизаты - биокатализатор для нитрификации - получали путем инкапсуляции чистой смешанной культуры нитрифицирующих бактерий (Nitrosomonas europeae и Nitrobacter winogradskiy) в PVAгидрогеле. Иммобилизаты - биокатализатор для денитрификации - получали путем инкапсуляции денитрифицирующих бактерий (Paraccocus denitrificans). Иммобилизацию осуществляли следующим образом: готовили раствор PVA, содержащий 100 г PVA (поливиниловый спирт), 60 г PEG (полиэтиленгликоль),790 г дистиллированной воды. В приготовленный таким образом раствор добавляли по 50 мл гомогенной суспензии биомассы таким образом, что получающаяся в результате концентрация клеток составляла 0,60 г клеток на 1 дм 3 геля. Приготовленную таким образом смесь в растворе PVA капали на твердую пластину и затем подвергали перекрестному связыванию и формовали в потоке сухого воздуха при температуре от 80 до 15 С. Иммобилизаты, минимальное отношение поверхности к объему которых составляло 7 мм-1, затем переносили в раствор сульфата натрия (0,01 моль/л) и хлорида аммония (0,1 моль/л) в течение 60 мин. Иммобилизаты культивировали или хранили после фильтрации в среде для хранения при температуре 4 С. В случае нитрифицирующих микроорганизмов культивирование партии осуществляли в водной культуральной среде с постепенным увеличением содержания азотистого субстрата с 50 до 500 мг/л N-NH4, в течение чего осуществляли культивирование бактерий при рН 7,0 и концентрации растворенного кислорода более 1,5 мг/л. В случае денитрифицирующих микроорганизмов культивирование партии осуществляли в водной культуральной среде с содержанием азотистого субстрата, выключающего N-NO3 и других питательных вещества, 200 мг/л, при температуре от 20 до 35 С и рН 7,8 в присутствии метанола в качестве Ссубстрата. Содержание биомассы в обоих биокатализаторах составляло приблизительно от 60 до 80 мг сухого материала биомассы на 1000 мл PVA после культивирования. Полученные таким образом иммобилизаты подвергали повторным периодическим процессам ферментации. Нитрификация (удаление азота из аммиака) в реакторе с эффективным объемом 17 л с содержанием 15 л синтетической сточной воды (СВ), содержащей приблизительно 800 мг/л N-NH4 и 2000 г биокатализатора с инкапсулированными нитрифицирующими бактериями, завершалась через 4 ч, что показало скорость нитрификации приблизительно 1500 мг N-NH4/чкг биокатализатора, соответственно- 11015861 приблизительно 4,8 кг N-NH4/м 3 СВсутки и 36 кг N-NH4/м 3 биокатализаторасутки. Денитрификация (удаление азота из нитратов) в реакторе с эффективным объемом 15,8 л, с содержанием 15 л синтетической сточной воды с концентрацией 800 мг/л N-NO3 и 800 г биокатализатора с инкапсулируемыми нитрифицирующими бактериями, завершалась через 3 ч в присутствии метанола в качестве С-субстрата, что показывает скорость денитрификации приблизительно 2000 мг N-NO3/чкг биокатализатора, соответственно приблизительно 6 кг N-NO3/м 3 СВсутки и 45 кг N-NO3/м 3 биокатализаторасутки. Пример 2. Иммобилизаты, приготовленные и культивировавшиеся, как описано выше в примере 1, использовали для удаления азотистых загрязнений из реальных сточных вод с высокой концентрацией азотистых загрязнений от 200 до 1000 мг/л N-NH4 и фактически нулевым количестве дихромата при непрерывном контроле нитрификации и денитрификации. Непрерывное модельное устройство использовали для тестирования одновременной нитрификации и денитрификации, причем эффективный объем в перемешивающем нитрифицирующем реакторе составлял 17 л и эффективный объем в перемешивающем денитрифицирующем реакторе составлял 3,8 л. Скорость потока реальных промышленных сточных вод составляла 35 л/сутки при содержании приблизительно 1600 мг/л N-NH4. 2000 г биокатализатора с инкапсулированными динитрифицирующими бактериями добавляли в нитрифицирующий реактор. 800 г биокатализатора с инкапсулированными денитрифицирующими бактериями добавляли в денитрифицирующий реактор. В течение эксперимента, длящегося несколько недель, достигалась средняя скорость нитрификации, составляющая приблизительно 1000 мг N-NH4/чкг биокатализатора при 95% эффективности нитрификации, и средней скорости денитрификации в присутствии метанола в качестве С-субстрата приблизительно 1600 мг N-NO3/чкг биокатализатора. Скорость удаления азотистых загрязнений составляла приблизительно 1,5 кг/м 3 СВсутки. Пример 3. Иммобилизаты, приготовленные и культивировавшиеся, как описано выше в примере 1, использовали для удаления азотистых загрязнений из реальных сточных вод с высокой концентрацией азотистых загрязнений от 200 до 1000 мг/л N-NH4 и высоким значением дихромата (1000 мг/л) при непрерывном контроле нитрификации и денитрификации. Полученные таким образом иммобилизаты подвергали периодическим процессам ферментации. Нитрификация (удаление азота из аммиака) в реакторе с эффективным объемом 17 л с содержанием 15 л синтетической сточной воды (СВ), содержащей приблизительно 800 мг/л N-NH4 и 2000 г биокатализатора с инкапсулированными нитрифицирующими бактериями, завершалась через 12 ч, что показало скорость нитрификации приблизительно 500 мг N-NH4/чкг биокатализатора, соответственно приблизительно 1,6 кг N-NH4/м 3 СВсутки и 12 кг N-NH4/м 3 биокатализаторасутки. Денитрификация (удаление азота из нитратов) в реакторе с эффективным объемом 15,8 л, с содержанием 15 л синтетической сточной воды с концентрацией 800 мг/л N-NO3 и 800 г биокатализатора с инкапсулируемыми нитрифицирующими бактериями, завершалась через 6 ч в присутствии метанола в качестве С-субстрата, что показывает скорость денитрификации приблизительно 1000 мг N-NO3/чкг биокатализатора, соответственно приблизительно 3 кг N-NO3/м 3 СВ в сутки и 22,5 кг N-NO3/м 3 биокатализатора в сутки. Способ продукции и применения вышеупомянутых носителей при производстве молочной кислоты из сахаридных субстратов при помощи клеток Bacillus coagulans, иммобилизованных в геле на основе поливинилового спирта, проиллюстрирован в следующих примерах. Пример 4. Суспензию спор Bacillus coagulans CCM 4318 готовили путем инокуляции 0,2 см 3 культуры для хранения на поверхность агара MRS со стерильным СаСО 3 (3 ч, 160 С) в чашках Петри (диаметр 9 см). Инкубацию осуществляли в течение 72 ч при температуре 50 С в лабораторном термостате. Затем спорулированную культуру покрывали 5 см 3 стерильной дистиллированной воды и переносили в колбу Эрленмейера. Полученную таким образом суспензию инкубировали в течение 25 мин при температуре 70 С и затем использовали при иммобилизации в геле на основе поливинилового спирта (PVA). Готовили раствор PVA, содержащий 100 г PVA (поливиниловый спирт), 60 г PEG (полиэтиленгликоль) и 790 г дистиллированной воды. 50 мл гомогенной суспензии биомассы добавляли в приготовленный таким образом раствор, таким образом, что конечная концентрация клеток составила 0,67 г клеток(сухой материал) на 1 дм 3 геля. Приготовленную таким образом смесь клеток в растворе PVA капали на твердую пластину и затем подвергали перекрестному связыванию и формовали в потоке сухого воздуха при градиенте температуры: от 80 до 15 С. Иммобилизаты, отношение поверхности к объему для которых минимально составляет 7 мм-1, затем переносили в раствор сульфата натрия (0,1 моль/л) в течение 60 мин. Иммобилизаты использовали в периодических процессах ферментации или после фильтрации хранили в стерильной питьевой воде при температуре 4 С. Размножение биомассы проводили в повторных периодических процессах ферментации в лабора- 12015861 торном ферментере объемом 5 л с 2,6 л продуцирующей среды. Продуцирующая среда содержала 60 г сахарозы, 10 г дрожжевого экстракта, 1 г (NH4)2HPO4, 0,2 г MgSO47 Н 2 О, 0,05 г MnSO44 Н 2 О, 0,01 гFeSO47 Н 2 О в 1 л дистиллированной воды. Продуцирующую среду кипятили в течение короткого времени, охлаждали до температуры 60 С и затем добавляли 400 г влажных иммобилизатов. Температуру постепенно уменьшали до 45 С в течение 1 ч, рН спонтанно уменьшали с 6,9 до 5,0 и затем поддерживали на уровне 5,8 во время следующей ферментации путем добавления 26% водного раствора аммиака. Ферментацию осуществляли в периодическом режиме при непрерывном перемешивании (200 об/мин). Иммобилизаты выделяли из ферментирующей среды после усвоения сахаридного субстрата и использовали в новой ферментации. Аналогично в следующих условиях осуществляли серии из 9 процессов периодической ферментации: со второго по пятое превращение осуществляли при температуре 50 С и рН 6,0, а с шестого по десятое при температуре 52 С и значении рН 6,3. Общая длительность ферментации сокращалась в течение повторных ферментации с 48 ч (первое превращение) до 12 ч (десятое превращение) при выходе молочной кислоты от 91 до 93%. Концентрация биомассы в PVA геле увеличивалась до 0,065 гклеток/гиммобилизата после десятого превращения. Пример 5. Состав среды, приготовление иммобилизата и периодическая ферментация аналогичны упомянутым выше в примере 4, за исключением использования в продуцирующей среде глюкозы вместо сахарозы (60 г/л). В десятом превращении после 14 ч ферментации содержались 55,2 г/л молочной кислоты и 1,2 г/л глюкозы. Пример 6. 350 г влажных иммобилизатов, приготовленных, как описано выше в примере 4, переносили в ферментер на 6 л и добавляли 2 дм 3 продуцирующей среды, содержащей: 60 г сахарозы, 5,0 г дрожжевого экстракта, 0,8 г (NH4)2HPO4, 0,2 г MgSO47 Н 2 О, 0,05 г MnSO44 Н 2 О, 0,01 г FeSO47 Н 2 О в 1 л дистиллированной воды. Ферментацию осуществляли партиями, постоянно перемешивали (200 об/мин) при температуре 52 С, рН поддерживали на уровне 6,3 путем добавления аммиачного раствора (26%). Затем 2 л продуцирующей среды, имеющей такой же состав, с содержанием сахарозы 140 г/л, после уменьшения концентрации сахарозы до 20 гдм-3, перемешивали со скоростью, при которой концентрация в ферментере может поддерживаться в диапазоне от 15 до 30 г/л. Содержание молочной кислоты в среде составляло 93,5 гдм-3 спустя 15 ч, остаточное содержание сахарозы составило 2,6 г/л. Пример 7. Композиция среды и приготовление иммобилизатов идентично упомянутым выше в примере 5. 350 г иммобилизатов переносили в 6-л ферментер после 10 превращения и добавляли 2,5 дм 3 продуцирующей среды, содержащей: 60 г глюкозы, 5,0 г дрожжевого экстракта, 0,8 г (NH4)2HPO4, 0,2 г MgSO47 Н 2 О, 0,05 г MnSO44 Н 2 О, 0,01 г FeSO47 Н 2 О в 1 л дистиллированной воды. Ферментационную среду постоянно перемешивали (200 об/мин) при температуре 52 С, рН поддерживали на уровне 6,3. Продуцирующую среду постепенно перемешивали после уменьшения концентрации глюкозы до 20 гдм-3 и ферментируемую среду, имеющую такой же состав, отбирали таким образом, чтобы поддерживать остаточную концентрацию сахарозы в реакторе в диапазоне от 15 до 30 г/л, с поддержанием остаточной концентрации глюкозы в диапазоне от 10 до 15 г/дм 3 и фактической концентрации молочной кислоты в диапазоне от 40 до 48 г/дм-3. Ферментацию осуществляли непрерывно в течение 40 дней, средняя объемная производительность в устройстве в ходе процесса составляла от 13,5 до 17,0 (г молочной кислотыдм-3 ч-1). Способ получения и применения вышеупомянутых носителей в процессе производства этанола из сахаридных субстратов при помощи клеток Zymomonas mobilis, иммобилизованных в геле на основе поливинилового спирта, проиллюстрирован в следующих примерах. Пример 8. Готовили 100 мл культуральной среды в колбе для культивирования объемом 250 мл (стерилизованной в течение 20 мин при температуре 121 С). Культуральная среда содержала 5 г дрожжевого экстракта, 1 г (NH4)2SO4, 0,5 г MgSO47 Н 2 О, 1 г KH2PO4, 100 г глюкозы (рН от 5 до 5,5) в 1 л дистиллированной воды. Приготовленную таким образом среду инокулировали культурой Zymomonas mobilis CCM 2770, которую культивировали на твердой культуральной среде и статически культивировали в течение 24-48 ч при температуре 30 С. Приготовленную таким образом биомассу использовали в качестве инокулята (10 об.%) в 100 мл культуральной среды, имеющей вышеописанный состав, в колбах для культивирования объемом 250 мл. Микроорганизм вновь переносили в культуральную среду (5 об.%) после статического культивирования в течение 12 ч при температуре 30 С. Культивирование осуществляли при температуре 30 С до концентрации сухой биомассы 1,2 гдм-3, причем полезно слегка перемешивать среду. Биомассу отделяли путем центрифугирования (5500 об/мин, 25 мин) после завершения культивирования и использовали при иммобилизации. Готовили раствор PVA, содержащий 100 г PVA (поливиниловый спирт), 60 г PEG (полиэтиленгликоль) и 790 г дистиллированной воды. В приготовленный таким образом раствор добавляли 50 мл гомогенной суспензии биомассы таким образом, что получающаяся в результате концентрация клеток состав- 13015861 ляла 0,56 г клеток на 1 дм 3 геля. Приготовленную таким образом смесь клеток в растворе PVA капали на твердую пластину, затем подвергали перекрестному связыванию и формовали в потоке сухого воздуха при градиенте температуры от 80 до 15 С. Иммобилизаты, для которых минимальное отношение поверхности к объему составляло 7 мм-1, затем переносили в раствор сульфата натрия (0,1 моль/л) на 30-60 мин. Биомассу бактерий в иммобилизатах наращивали в лабораторном ферментере объемом 6 дм 3 в ходе процесса ферментации, каждый раз с использованием 3 дм 3 стерильной культуральной среды, затем 23 об.% иммобилизата в культуральной среде культивировали в партии при постоянном перемешивании (80 об./мин) таким образом, что рН культуральной среды доходил до 6,5 и спонтанно уменьшался до рН 4,0 при температуре 25 С. Жидкую фазу удаляли, к иммобилизатам добавляли свежую среду и процесс повторяли один раз. Жидкую фазу затем удаляли, к иммобилизатам добавляли свежую среду и величину рН доводили до 6,5 (при помощи 1 М раствора NaOH). Величина рН затем уменьшалась до рН 5 в результате спонтанной ферментации при постоянном перемешивании (80 об/мин), и затем осуществляли ферментацию до истощения глюкозы. Жидкую фазу удаляли, к иммобилизованным клеткам добавляли свежую среду и процесс повторяли 6 раз. Клеточный сухой материал в приготовленных таким образом иммобилизатах увеличивали до 65,8 г клеток/дм 3 геля. К приготовленным таким образом иммобилизованным клеткам добавляли 2,2 дм 3 стерильной продуцирующей среды с содержанием глюкозы 150 г на 1 дм-3 и рН 5,5 (450 г влажного биокатализатора). Ферментация происходила в 5-л биореакторе при постоянном перемешивании (80 об/мин), рН поддерживали на уровне 5,0 путем добавления раствора NaOH (2 моль/дм 3) при температуре 30 С. Эта среда содержала 73,8 г на 1 дм-3 этанола спустя 11 ч ферментации, тогда как остаточная концентрация глюкозы составляла 1,8 г на 1 дм-3. Удельная продуктивность по этанолу Zymomonas mobilis, иммобилизованных в носителе PVA, достигала 202 мгэтанола/млгеля/ч. Пример 9. 450 г влажных иммобилизатов, приготовленных, как описано выше в примере 8, добавляли к 2,2 дм 3 продуцирующей среды с содержанием глюкозы 200 г на 1 дм-3 (рН 5,0). Ферментацию осуществляли партиями при постоянном перемешивании (80 об/мин), рН поддерживали при 5,0 путем добавления раствора NaOH (2 моль на 1 дм-3) при температуре 30 С. Таким образом осуществляли шесть ферментаций. Минимальное содержание этанола в среде составляло от 94,0 г на 1 дм-3 до 98,0 г на 1 дм-3 после каждого превращения через 13 ч, и остаточная концентрация глюкозы составляла от 3 г на 1 дм-3 до 8 г на 1 дм-3(т.е. от 94 до 98% теоретического выхода). Пример 10. Использовали иммобилизаты, приготовленные и размноженные, как описано выше в примере 9. 1050 мл продуцирующей среды с концентрацией глюкозы 150 г на 1 дм-3 (иммобилизаты составляют 30% от объема ферментирующей среды) добавляли к 450 г иммобилизата. Ферментацию осуществляли партиями, постоянно перемешивали (80 об/мин), рН поддерживали при 5,0 путем добавления раствораNaOH (2 моль/дм 3) при температуре 30 С: 1500 мл культуральной среды с концентрацией глюкозы 320 г на 1 дм-3 постепенно смешивали после уменьшения концентрации глюкозы до 20 г на 1 дм-3 при такой скорости для поддержания остаточной концентрации глюкозы в ферментере от 15 до 30 г на 1 дм-3. Содержание этанола в среде составляло 113,5 г на 1 дм-3, т.е. 91% от теоретического выхода, через 20 ч остаточная концентрация глюкозы составляла 4,6 г на 1 дм-3. Пример 11. Использовали иммобилизаты Z. mobilis CCM 2770, приготовленные и размноженные, как описано выше в примере 8. 450 г влажных иммобилизатов переносили в 2,2 дм 3 культуральной среды с 150 г на 1 дм-3 глюкозы, рН доводили до 5,0. Ферментацию осуществляли при рН 5,0 и при температуре 30 С. Культуральную среду с содержанием глюкозы 50 г на 1 дм-3 постоянно перемешивали после уменьшения содержания глюкозы в ферментере до величины от 10 г на 1 дм-3 до 20 г на 1 дм-3, и ферментируемую среду удаляли с такой скоростью, что остаточная концентрация глюкозы в ферментере находилась в диапазоне от 17 г на 1 дм-3 до 30 г на 1 дм-3, а фактическая концентрация этанола в диапазоне от 58 г на 1 дм-3 до 65 г на 1 дм-3. Ферментацию осуществляли непрерывно в течение 50 дней, причем объемная производительность устройства составляла 30 гэтанолдм-3 ч-1, что соответствует специфической продукции этанола 140 мгэтнола/млгеля/ч. Пример 12. Способ является таким же как в примере 8, Zymomonas mobilis подвид pomacii CCM 2771 использовали в качестве микроорганизма-продуцента. Среда содержала 68,3 г на 1 дм-3 этанола после ферментации в течение 15 часов, тогда как остаточная концентрация глюкозы составила 6,8 г на 1 дм-3. Способ получения и применения вышеупомянутых носителей при получении инвертированного сахара из растворов сахарозы при помощи инкапсулированной инвертазы в геле на основе поливинилового спирта проиллюстрирован в следующих примерах. Пример 13. Готовили раствор PVA, содержащий 100 г PVA (поливиниловый спирт), 60 г PEG (полиэтиленгликоль), 790 г дистиллированной воды. 50 мл препарата фермента инвертазы (Sigma) (концентрация фер- 14015861 мента 100 г/л) добавляли к приготовленном таким образом раствору. Полученную таким образом смесь фермента в растворе PVA капали на твердую пластину, затем подвергали перекрестному связыванию и формовали в потоке сухого воздуха при градиенте температуры от 80 до 15 С. Иммобилизаты, для которых минимальное отношение поверхности к объему составляет 7 мм-1, переносили в раствор сульфата натрия (0,1 моль/л) в течение 10-120 мин. Приготовленные иммобилизаты можно хранить в 10-мМ ацетатном буферном растворе (рН 4,5) при температуре 4 С. Приготовленный таким образом иммобилизованный фермент может быть использован при гидролизе сахарозы, растворенной в 10-мМ ацетатном буфере при рН 4,5. 120 г иммобилизованной инвертазы добавляли к 1000 мл раствора сахарозы (100 г/л). Гидролиз осуществляли при постоянном перемешивании (80 об/мин) в партии при температуре 30 С. Сахароза полностью гидролизовалась после 50 мин гидролиза до глюкозы и фруктозы. Пример 14. 120 г влажных иммобилизатов, приготовленных, как описано выше в примере 13, добавляли в 1000 мл раствора сахарозы с концентрацией 450 г/л (рН 4,5, ацетатный буфер 10 мМ) при температуре 30 С. Гидролиз осуществляли партиями при непрерывном перемешивании. Остаточная концентрация сахарозы спустя 360 мин, таким образом, составляла 10,1 г/л. Пример 15. 120 г влажных иммобилизатов, приготовленных, как описано выше в примере 13, добавляли в 1000 мл раствора сахарозы с концентрацией 280 г/л (рН 4,5, ацетатный буфер 10 мМ) при температуре 30 С. Гидролиз осуществляли партиями при постоянном перемешивании. Остаточная концентрация сахарозы спустя 360 мин, таким образом, составляла 1,8 г/л. Жидкую фазу удаляли после гидролиза и иммобилизованную инвертазу использовали в повторном гидролизе партиями в соответствии с вышеописанным способом. Остаточная концентрация сахарозы после 6 превращений через 240 мин гидролиза составляла 3 г/л. Пример 16. Иммобилизаты готовили, как описано выше в примере 13. 25 г влажных иммобилизатов переносили в 0,5 л мелассы с концентрацией сахарозы 120 г/л, рН 4,5 (доводят с помощью H2SO4). Гидролиз осуществляли при рН 4,5, 30 С и перемешивали при 200 об/мин. Мелассу с концентрацией 120 г/л непрерывно перемешивали в ферментере и гидролизуемую среду удаляли с такой скоростью, чтобы достичь концентрации сахарозы от 30 до 40 г/л (66-75% превращение) после уменьшения количества сахарозы в ферментере до 30-40 г/л. Удельная активность иммобилизата при таком режиме составляет 0,35 г/гч-1 (г известной сахарозы на 1 г иммобилизатора в час). Пример 17. Использовали иммобилизаты, приготовленные, как описано выше в примере 13. 25 г влажных иммобилизатов переносили в 0,5 л мелассы с концентрацией сахарозы 120 г/л, рН 4,5. Гидролиз осуществляли при рН 4,5, температуре 45 С и перемешивании 200 об/мин. Мелассу с концентрацией 120 г/л непрерывно перемешивали в ферментере и гидролизуемую среду удаляли с такой скоростью, чтобы достичь концентрации сахарозы от 30 до 40 г/л (66-75% превращение) после уменьшения количества сахарозы в ферментере до 30-40 г/л. Удельная активность иммобилизата при таком режиме гидролиза, который осуществляют непрерывно в течение 500 ч, составляет от 0,55 г /гч-1 до 0,60 г /гч-1 (г известной сахарозы на 1 г иммобилизатора в час). Способ получения и применение вышеописанных носителей в способе продукции глюкозы из крахмальных гидролизатов при помощи инкапсулированной глюкоамилазы в геле на основе поливинилового спирта проиллюстрирован в следующих примерах. Пример 18. Готовили раствор PVA, содержащий 100 г PVA (поливиниловый спирт), 60 г PEG (полиэтиленгликоль), 790 г дистиллированной воды. 50 мл препарата фермента SUN Ultra L (Novozymes) добавляли в приготовленный таким образом раствор. Приготовленную таким образом смесь фермента в раствореPVA капали на твердую пластину, затем подвергали перекрестному связыванию и формовали в потоке сухого воздуха при градиенте температуры от 80 до 15 С. Иммобилизаты, минимальное отношение поверхности к объему для которых составляет 7 мм-1, затем переносили в раствор сульфата натрия (0,1 моль/л) в течение 10-120 мин. Приготовленные иммобилизаты можно хранить в 30 мас.% глюкозы, растворенной в 10 мМ ацетатном буферном растворе (рН 4,5) при температуре 4 С. Полученный таким образом иммобилизованный фермент использовали в гидролизе крахмального гидролизата, например мальтозной мелассы (состав 33 мас.% высших сахаридов, 20 мас.% мальтотриозы, 53 мас.% мальтозы, 4 мас.% глюкозы), растворенной в 10 мМ ацетатном буферном растворе с рН 4,5. 120 г иммобилизованной глюкоамилазы добавляли к 1000 мл полученного таким образом раствора с концентрацией сахаридов 100 г/л. Гидролиз осуществляли при постоянном перемешивании (200 об/мин) периодическим способом при температуре 30 С. Среда содержала от 70 до 80 г/л глюкозы спустя 60 мин гидролиза.- 15015861 Пример 19. 5000 мл мальтозной среды с концентрацией 250 г сахаридов/л (рН 4,5) при температуре 40 С добавляли к 200 г влажных иммобилизатов, приготовленных, как описано выше в примере 18. Гидролиз осуществляли партиями при постоянном перемешивании. Таким образом, в течение 6 ч получали 180 г/л глюкозы. Жидкую фазу удаляли после гидролиза и иммобилизованную глюкоамилазу использовали в повторных процессах периодического гидролиза в вышеупомянутом способе. Концентрация образовавшейся глюкозы составляла 178 г/л после 6 ч гидролиза после шестого превращения. Пример 20. Использовали иммобилизаты, полученные, как описано выше в примере 18. 25 г влажных иммобилизатов помещали в 0,5 л мальтозной мелассы с концентрацией сахаридов 100 г/л, рН 4,5. Гидролиз осуществляли при рН 4,5, температуре 30 С и перемешивании 200 об/мин. Мальтозную мелассу с концентрацией сахаридов 100 г/л непрерывно перемешивали в ферментере и гидролизованную среду удаляли с такой скоростью, чтобы достичь концентрации глюкозы от 50 до 60 г/л (50-60% превращение) после увеличения концентрации глюкозы в ферментере от 55 до 65 г/л. Удельная активность иммобилизата при таком режиме гидролиза, непрерывно проводимом в течение 900 ч, составляет от 0,3 г/г на 1 ч-1 до 0,4 г/г на 1 ч-1 (г продуцированной глюкозы на 1 г иммобилизата в час). Пример 21. Использовали иммобилизаты, приготовленные, как описано выше в примере 18. 25 г влажных иммобилизатов помещали в 0,5 л мальтозной мелассы с концентрацией сахаридов 100 г/л, рН 4,5. Гидролиз осуществляли при рН 4,5, температуре 45 С и перемешивании 200 об/мин. Мальтозную мелассу с концентрацией сахаридов 100 г/л непрерывно перемешивали в ферментере и гидролизованную среду удаляли с такой скоростью, чтобы достичь концентрации глюкозы от 50 до 60 г/л (60-70% превращение) после увеличения концентрации глюкозы в ферментере до величины от 55 до 65 г/л. Удельная активность иммобилизата при таком режиме гидролиза, непрерывно проводимого в течение 1500 ч, составляет от 0,55 г/г на ч-1 до 0,6 г/г на ч-1 (г продуцированной глюкозы на 1 г иммобилизата в час). Пример 22. Использовали иммобилизаты, приготовленные, как описано выше в примере 18. Среда имеет следующий состав: мальтозная меласса с концентрацией сахаридов 195 г/л, дрожжевой экстракт 5 г/л,(NH4)2SO4, 1 г/л, MgSO47 Н 2 О, 0,5 г/л, KH2PO4 1 г/л, все растворены в дистиллированной воде, рН 4,5. 50 г иммобилизата с иммобилизованной глюкоамилазой добавляли к 1 л приготовленной таким образом стерильной среды. Суспензию затем инокулировали 10 об.% инокулятом Zymomonas mobilis в период экспоненциального роста микроорганизма. В процессе гидролиза происходит одновременная утилизация возникающей глюкозы и продукция этанола микроорганизмами. Таким образом, в течение 13,5 ч продуцировали 70 г/л этанола. Пример 23. Использовали иммобилизаты, приготовленные, как описано выше в примере 18. В превращениях использовали среду, имеющую состав: мальтозная меласса с концентрацией сахаридов 80 г/л, 10 г/л дрожжевого экстракта, 1 г/л (NH4)2SO4, 0,2 г/л MgSO47 Н 2 О, 0,05 г MnSO44 Н 2 О, 0,01 г FeSO47 Н 2 О,все растворены в дистиллированной воде, рН 6,0. 50 г иммобилизата с иммобилизованной глюкоамилазой добавляли к 1 л приготовленной таким образом стерильной среды. Суспензию инокулировали 5 об.% суспензией спор Bacillus coagulans. В процессе гидролиза происходит одновременное использование возникающей глюкозы и продукция молочной кислоты микроорганизмами. После 24 ч ферментации в среде находится 55,2 г/л молочной кислоты и 1,2 г/л глюкозы. Способ продукции и применение вышеупомянутых носителей при гидролизе растворов лактозы при получении D-галактозы, D-глюкозы и галактоолигосахаридов при помощи -галактозидазы, инкапсулированной в гель на основе поливинилового спирта, проиллюстрирован в следующих примерах. Пример 24. Готовили раствор PVA, содержащий 100 г PVA (поливиниловый спирт), 60 г PEG (полиэтиленгликоль), 790 г дистиллированной воды. 50 мл препарата фермента Lactozyme (Novozymes) добавляли в приготовленный таким образом раствор. Приготовленную таким образом смесь фермента в раствореPVA капали на твердую пластину, затем подвергали перекрестному связыванию и формовали в потоке сухого воздуха при градиенте температуры от 80 до 15 С. Иммобилизаты, минимальное отношение поверхности к объему для которых составляет 7 мм-1, затем переносили в буфер с фосфатом калия (рН 6,5) в течение 10-120 мин. Приготовленные иммобилизаты можно хранить в фосфатном буферном растворе(рН 6,5) с добавлением 5-10% этанола при температуре 4 С. Приготовленный таким образом иммобилизованный фермент имел начальную активность 900100 Едсм-3. Пример 25. Использовали иммобилизаты, приготовленные, как описано выше в примере 24. При гидролизе использовали раствор лактозы в 0,1 М фосфатном буфере с рН 6,5 и с добавлением 2 мМ MgCl2. 130 г иммобилизованной -галактозидазы добавляли в 1000 мл приготовленного таким образом раствора с кон- 16015861 центрацией лактозы 100 г/л. Гидролиз осуществляли при постоянном перемешивании (200 об/мин) партиями при температуре 30 С. Жидкую фазу после гидролиза удаляли и иммобилизованную галактозидазу использовали в повторных периодических процессах гидролиза в вышеупомянутом способе. Среда содержала от 13 до 2 г/л лактозы спустя 210 мин гидролиза. Пример 26. Использовали иммобилизаты, приготовленные, как описано выше в примере 24. В гидролизе использовали раствор лактозы в 0,1 М фосфатном буфере с рН 6,5 и с добавлением 2 мМ MgCl2. 130 г иммобилизованной -галактозидазы с исходной активностью 786 Едсм-3 добавляли в 1000 мл приготовленного таким образом раствора с концентрацией лактозы 100 г/л. Гидролиз осуществляли при непрерывном перемешивании (200 об/мин) партиями при температуре 30 С. Длительность превращения была постоянной. После 25 партий гидролиза, который, как правило, длится 160 ч, обнаружили уменьшение активности иммобилизата на 5-10%. Конструкция заливочного устройства для получения иммобилизатов, основанных на носителе - поливиниловом спирте, которые упомянуты в предшествующих примерах, поясняется в следующем тексте. Очевидно, что следующее описание лишь иллюстрирует принципы применения изобретения. На фиг. 1 представлен вариант конструкции заливочного устройства для получения иммобилизатов,основанных на носителе на основе поливинилового спирта, в варианте для непрерывного промышленного получения. Вариант конструкции включает капающий заливочный комплекс, располагающийся спереди от верхнего осушительного канала 2, который образован капающей двухрядной заливочной головкой или головками 17, которая(ые) оборудована(ы) двумя рядами заливочных инжекторов и связана с контейнером под умеренным давлением 15 и компрессором или резервуаром с воздухом под давлением 16. Верхний осушительный канал 2, внутри которого движется непрерывная конвейерная лента 1 с контролирующим приводом, оборудован осушающей системой - источником 4 осушающего воздуха, из которого обезвоженный воздух переносится через первый вспомогательный вентилятор 19 в систему распределения воздуха 6 со встроенными нагревательными элементами 5, который в нескольких точках выходит в верхний осушительный канал 2. Непрерывная конвейерная лента 1 после того, как покидает верхний осушительный канал, проходит через контейнер для повторного набухания 7 и канал для окончательной сушки 3, который располагается с противоположной стороны - со дна заливочного механизма,с одной стороны которого трубопроводы оборудованы вторым вспомогательным вентилятором 20 для транспорта осушающего воздуха из верхнего осушительного канала, используемого для окончательной сушки конвейерной ленты после выхода из промывочной камеры 13, и с другой стороны от которой располагается выход 18 влажного воздуха. Соскребающее устройство для сбора 9, сконструированное на основе принципа механического соскребания и промывания под высоким давлением, которое связано с собирающим контейнером 8, содержащим раствор солей для повторного набухания 24 и оборудованным охладителем, трубопроводом со встроенным насосом высокого давления 10 и насосом низкого давления 11, и промывающей камерой 13, для очистки непрерывной конвейерной ленты при помощи форсунок,присоединенных к насосу низкого давления 14, который связан трубопроводом с промывающим контейнером 12, содержащим деионизированную воду, встроенных между контейнером для повторного набухания 7, содержащим растворы солей для повторного набухания 24, и каналом для окончательной сушки 3. Устройство для получения иммобилизатов, основанных на носителе - поливиниловом спирте, функционирует следующим образом: смесь геля на основе поливинилового спирта и биологического материала переносят или выливают из капающего заливочного комплекса, образованного двумя заливочными головками 17 с двумя рядами заливочных игл, диаметр которых составляет от 0,1 до 2,00 мм, пульсирующих при помощи электромагнитов с различной частотой и длиной импульса, на непрерывную конвейерную ленту 1 с контролируемой скоростью, которая проходит через верхний осушительный канал 2. Смесь для заливки капанием перемешивают в контейнере под умеренным давлением 15, который связан с компрессором или контейнером под воздушным давлением 16. Смесь, высушенную на конвейерной ленте 1, сохраняют в обезвоженном воздухе, получаемом из устройства для непрерывного обезвоживания атмосферного воздуха 4, который подается через первый вспомогательный вентилятор 19 и нагревательные элементы 5, располагающиеся в трубопроводе для распределения воздуха 6, который контролирует градиент температуры в верхнем осушающем канале и который ведет к каждому сегменту верхнего осушающего канала 2. Высушенную прилипшую к непрерывной конвейерной ленте 1 смесь затем пропускают через контейнер для повторного набухания 7 с солевым раствором для повторного набухания,после чего продукт, т.е. иммобилизаты, основанные на носителе - поливиниловом спирте, отсоединяют в собирающем соскребающем устройстве 9. Это устройство оборудовано системой подачи воды под высоким давлением, образованной насосом высокого давления 10 и форсунками, и эта система связана с независимой петлей. Продукт отсоединяют от конвейерной ленты при помощи полимерного ножа и подвергают воздействию потока водного солевого раствора, подаваемого насосом высокого давления 10. Конвейерную ленту 1, наконец, обрабатываются при помощи форсунок, располагающихся в контейнере для промывки 13, насоса низкого давления 14 и промывающую деионизированную воду собирают в контей- 17015861 нер 12, в который она попадает из контейнера для промывки 13. Система подачи воды под низким давлением для промывки конвейерной ленты соединена с независимой петлей. Влажная конвейерная лента 1 затем, наконец, сушится в нижнем осушительном канале 3, в который осушающий воздух подается из верхнего осушительного канала через трубопровод, в который встроен второй вспомогательный вентилятор 20, тогда как влажный воздух отводится из нижнего осушительного канала 3 через вывод 18. На фиг. 2 показана конструкция контейнера для повторного набухания. Контейнер для повторного набухания 7 в этом варианте состоит из контейнера 21 со скошенным дном, в нижней точке которого располагается выходной клапан 22 для выпуска продукта и солевого раствора для повторного набухания. Конвейерная лента 1, приводимая в движение парой задающих натяжение валиков 23, которые одновременно определяют погружение конвейерной ленты в водный солевой раствор для повторного набухания 24, которым заполнен контейнер 21, проходит через контейнер 21. На фиг. 3 показана конструкция соскребающего собирающего устройства 9. Соскребающее собирающее устройство 9 в этом варианте состоит из боковой рамки 25, в которой механический полимерный скребок располагается на нажимном комплексе 27, из нержавеющей стали с пружинным нажимным комплексом 28. Этот пружинный нажимный комплекс 28 образован опорным регулировочным винтом 34 с промывателем, на котором располагается пружина 35. Соскребающее собирающее устройство 9 дополнительно оборудовано форсунками под высоким давлением 26, соединенными с трубчатой распределяющей системой из нержавеющей стали, фиксированной в рамке 25, что дает возможность для промывки под углом 45-80. Трубчатая распределительная система из нержавеющей стали 30 оборудована регулировкой по высоте, которая задается регулирующими винтами 31. Нижний и верхний скребки 29 с полимерными щетками 32, которые фиксированы на верхней раме 33, когда конвейерная лента 1 проходит между скребками, плотно располагается между их внутренней и также внешней стороной сзади механического скребка 27, для очистки внутренней стороны конвейерной ленты. Конвейерная лента оборудована нижним и также верхним полимерным скребком 29 для окончательной обработки внутренней и внешней стороны конвейерной ленты 1 в тот момент, когда лента выходит из рамки 25. Соскребающее собирающее устройство 9 установлено в производственной линии позади контейнера для повторного набухания 7, из которого конвейерная лента 1 выходит в нижней части устройства, то есть, следовательно, в противоположном направлении. Очевидно, что продукт, нанесенный на конвейерную ленту 1 в верхней части устройства, перевернут в вертикальном положении. Способ его удаления с конвейерной ленты основан на том, что механический скребок 27 и также форсунки под высоким давлением 26 в кооперации действуют на продукт, прикрепленный к внешней части конвейерной ленты 1. Продукт на конвейерной ленте 1 сначала направляют для промывания под высоким давлением, которое обеспечивается системой распределения давления водного солевого раствора через форсунки под давлением 26, которые действуют под углом 40-80 относительно механического скребка 27 с пружинным давящим механизмом 28, наклон в отношении конвейерной ленты 1 которого также контролируется в диапазоне от 5 до 15. Нижний и верхний прочно фиксированные скребки 29 с полимерными щетками,которые одновременно окончательно обрабатывают конвейерную ленту 1 с внутренней и внешней сторон, располагаются позади подпружиненного механического полимерного скребка 27 на устройстве привода давления из нержавеющей стали 28. Конвейерная лента 1 выходит из рамки 25 между нижней и верхним полимерными скребками 29, которыми она в итоге обрабатывается с двух сторон. На фиг. 4 показана конструкция промывающего контейнера 13. Промывающий контейнер 13 в этом варианте оборудован верхней частью 36 с крышкой 43 и нижней частью 37 с выходом 38, связанными друг с другом, между которыми движется конвейерная лента 1, где эти части связаны с рамкой заливочного механизма 39. Кроме того, верхняя промывающая форсунка 40, связанная с трубкой, подающей промывающую воду 41, располагается в верхней части 36 и таким же образом нижняя промывающая форсунка 42, соединенная с подающей трубкой 41, располагается в нижней части 37. Регулируемые полимерные скребки 44 фиксированы на обеих сторонах верхней части 36 для вытирания воды с конвейерной ленты, и таким же образом скребки 45 располагаются на обеих сторонах в нижней части 37. Контейнер для промывки 13 фиксирован на рамке заливочного механизма 39 верхними и нижними фиксирующими сегментами 46 и 47. Промышленная применимость Настоящее изобретение может быть использовано при производстве иммобилизатов, которые предназначены для применения в пищевой промышленности, фармакологии и обработке сточных вод, в частности при биологическом удалении азотистых соединений из питьевой воды, запасов воды и сточных вод (отходы, сельскохозяйственные, муниципальные, промышленные сточные воды), присутствующие в которых различные азотистые соединения превращаются в газообразный азот за счет физиологической активности нитрифицирующих и денитрифицирующих бактерий, и дополнительно при производстве молочной кислоты, этанола, глюкозы и глюкозо-фруктозной мелассы, при гидролизе лактозы в Dгалактозу и при производстве галактоолигосахаридов. Их все получают при помощи устройства, которое обеспечивает непрерывное промышленное производство с емкостью 1-10 кг иммобилизатов торговой марки LentiKats в час. Устройство для производства иммобилизатов, предназначенное для пищевой промышленности,- 18015861 фармакологических применений и обработки сточных вод, может быть использовано в режиме непрерывного производства. Перечень использованных обозначений 1 - конвейерная лента с контролируемым приводом 2 - верхний осушительный канал 3 - нижний осушительный канал 4 - источник осушающего воздуха - осушитель с непрерывной абсорбцией 5 - нагревающие элементы на воздуховодах 6 - система распределения осушающего воздуха 7 - контейнер для повторного набухания в нижней части заливочного устройства 8 - собирающий контейнер с охлаждением 9 - собирающее устройство под высоким давлением 10 - насос высокого давления 11 - подающий насос низкого давления 12 - контейнер для промывки 13 - промывающая камера 14 - промывающий насос низкого давления 15 - 10-12-л контейнер с умеренным давлением 16 - компрессор 17 - капающая заливочная головка 18 - отвод влажного отработанного воздуха 19 - первый вентилятор 20 - второй вентилятор 21 - контейнер 22 - выходной вентиль 23 - валик-натяжитель 24 - солевой раствор для повторного набухания 25 - боковая рамка 26 - форсунки 27 - механический скребок 28 - пружинный нажимный механизм 29 - верхний, нижний скребок 30 - распределительный трубопровод 31 - регулировочные винты 32 - щетка 33 - верхняя защитная рамка 34 - нажимной регулировочный винт 35 - пружина 36 - верхняя часть контейнера 37 - нижняя часть контейнера 38 - выход 39 - рамка заливочного механизма 40 - верхняя промывающая форсунка 41 - подающий трубопровод 42 - нижняя промывающая форсунка 43 - крышка 44 - регулируемый скребок 45 - скребок 46 - верхний фиксирующий сегмент 47 - нижний фиксирующий сегмент ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ промышленного производства биокатализаторов с биологически активным материалом в форме иммобилизованных ферментов или микроорганизмов, согласно которому биологически активный материал, образованный смесью свободного нативного или предварительно агрегированного ферментативного катализатора либо продуцирующего микроорганизма или их части и геля на основе поливинилового спирта, желатинируют и формуют в потоке осушающего воздуха при температуре от 80 до 15 С в форме полосок с геометрическим отношением поверхности к объему биокатализатора более 7 мм-1. 2. Способ по п.1, где нитрифицирующие микроорганизмы инкапсулируют в гель на основе поливинилового спирта для получения биокатализатора, предназначенного для удаления из сточных вод азотистых загрязнений, причем биокатализатор формуют в полоски и затем иммобилизаты культивируют в водной питательной среде с содержанием азотистого субстрата от 50 до 500 мг/л N-NH4 при рН 7,0, при температуре от 20 до 35 С и концентрации растворенного кислорода выше 1,5 мг/л. 3. Способ по п.1, где денитрифицирующие микроорганизмы инкапсулируют в гель на основе поливинилового спирта для получения биокатализатора, предназначенного для удаления из сточных вод азотистых загрязнений, биокатализатор затем формуют в полоски и затем иммобилизаты культивируют в водной питательной среде с содержанием азотистого субстрата от 50 до 500 мг/л N-NO3, рН 7,8, при температуре от 20 до 35 С и в присутствии метанола в качестве С-субстрата в случае денитрифицирующих микроорганизмов. 4. Способ по п.1, где анаэробные бактерии Zymomonas mobilis инкапсулируют в гель на основе поливинилового спирта для изготовления биокатализатора, предназначенного для продукции этанола из сахаридных субстратов, биокатализатор затем формуют в полоски и затем иммобилизаты культивируют в водной питательной среде с содержанием сахаридного субстрата от 2 до 25 мас.% при температуре от 20 до 40 С и рН от 3,5 до 7,0 в присутствии этанола в количестве от 1 до 15 мас.%. 5. Способ по п.1, где термофильные бактерии Bacillus coagulans инкапсулируют в гель на основе поливинилового спирта для изготовления биокатализатора, предназначенного для получения молочной кислоты из сахаридных субстратов, биокатализатор формуют в полоски и затем иммобилизаты культивируют в водной питательной среде с содержанием сахаридного субстрата от 2 до 14 мас.% при температуре от 30 до 60 С и рН от 5,0 до 7,5 в присутствии молочной кислоты или ее солей в количестве от 1 до 12 мас.%. 6. Способ производства по п.5, где при производстве используют штамм Bacillus coagulans CCM 4318. 7. Способ по п.1, где фермент глюкоамилазу инкапсулируют в гель на основе поливинилового спирта для изготовления биокатализатора, предназначенного для гидролиза крахмала и целлюлозных субстратов, и биокатализатор формуют в полоски. 8. Способ по п.1, где фермент инвертазу инкапсулируют в гель на основе поливинилового спирта для изготовления биокатализатора, предназначенного для гидролиза сахарозных субстратов, и биокатализатор формуют в полоски. 9. Способ по п.1, где фермент -галактозидазу инкапсулируют в гель на основе поливинилового спирта для получения биокатализатора, предназначенного для гидролиза лактозы и получения Dгалактозы, D-глюкозы и галактоолигосахаридов, и биокатализатор формуют в полоски. 10. Применение биокатализатора на основе глюкоамилазы, полученного в соответствии со способом по п.1, при получении D-глюкозы при гидролизе высших сахаридов, полученных путем частичного гидролиза крахмала с содержанием сахаридного субстрата от 2 до 40 мас.% при температуре от 20 до 45 С и рН от 3,5 до 7. 11. Применение по п.10, где иммобилизованную глюкоамилазу применяют при осахаривании крахмалсодержащего субстрата в процессе ферментативного получения этанола. 12. Применение по п.10, где иммобилизованную глюкоамилазу применяют при осахаривании крахмалсодержащего субстрата в процессе ферментативного получения молочной кислоты. 13. Применение биокатализатора на основе -галактозидазы, полученного в соответствии со способом по п.1, при получении D-галактозы, D-глюкозы и галактоолигосахаридов при гидролизе растворов лактозы с содержанием сахаридного субстрата от 2 до 40 мас.%, при температуре от 20 до 60 С и рН от 3,5 до 7. 14. Устройство для промышленного производства биокатализаторов, обеспечивающее оптимизацию объема и поверхности биологического носителя в зависимости от количества биологически активного материала, состоящее из заливочного механизма (17), установленного спереди от осушительного канала (2), через который проходит непрерывная конвейерная лента (1), причем это устройство оборудовано по меньшей мере одной заливочной головкой (17) с двумя рядами заливочных игольчатых инжекторов, соединенных с контейнером под умеренным давлением (15) и компрессором (16), конвейерной лентой (1) и осушающей системой - источником (4) осушающего воздуха, который при помощи вентилятора задувают в систему распределения воздуха (6), включающую нагревательные элементы (5), которая- 20015861 ведет в верхний осушительный канал (2) и далее в нижний осушительный канал (3) для окончательной сушки, и контейнер для повторного набухания (7), между которыми установлено соскребающее устройство для сбора продукта (9), сконструированное на основе механического соскребания и промывания под высоким давлением, которое связано с трубопроводом со встроенным насосом высокого давления (10) и насосом низкого давления (11), ведущим в собирающий резервуар (8) с охлаждением и дополнительно с промывающим контейнером (13) для непрерывной окончательной очистки конвейерной ленты (1) при помощи форсунок, связанных с насосом низкого давления (14), который соединен с промывающим контейнером (12) при помощи трубопровода. 15. Устройство по п.14, в котором собирающее устройство (9) образовано рамкой (25), на которой установлены механический скребок (27) с пружинным нажимным механизмом (28) и форсунки высокого давления (26), фиксированные на рамке (25) под углом от 45 до 80, где верхний скребок (29) со щеткой для очистки внутренней стороны конвейерной ленты (1) жестко закреплен на его внутренней стороне напротив механического скребка (27), и конвейерная лента (1) оборудована нижним скребком (29) для окончательной очистки в точке выхода ленты из рамки (25).
МПК / Метки
МПК: B01J 2/00, A61K 9/00, F26B 17/02
Метки: промышленного, геле, производства, микроорганизмов, форме, поливинилового, ферментов, применение, иммобилизованных, получения, устройства, способ, основе, спирта, биокатализаторов
Код ссылки
<a href="https://eas.patents.su/24-15861-sposob-promyshlennogo-proizvodstva-biokatalizatorov-v-forme-fermentov-ili-mikroorganizmov-immobilizovannyh-v-gele-na-osnove-polivinilovogo-spirta-ih-primenenie-i-ustrojjstva-dlya-i.html" rel="bookmark" title="База патентов Евразийского Союза">Способ промышленного производства биокатализаторов в форме ферментов или микроорганизмов, иммобилизованных в геле на основе поливинилового спирта, их применение и устройства для их получения</a>
Предыдущий патент: Способы лечения аутоиммунных заболеваний при использовании антагониста нейтрокина-альфа
Следующий патент: Газоотборное устройство