Модифицированные полипропилениминовые дендримеры, содержащая их фармацевтическая композиция и их применение для лечения злокачественных опухолей
Номер патента: 14327
Опубликовано: 29.10.2010
Авторы: Мейер Эгберт Виллем, Так Фредерик, Брюстер Маркус Эли, Жанико Мишель Мари Франсуа, Янссен Хенрикус Мария
Формула / Реферат
1. Полипропилениминовый дендример 1, 2, 3, 4 или 5 генерации, представляющий собой модифицированный дендример, неполный модифицированный дендример или их смеси, включающий внешние концевые группы и внутренние аминогруппы, отличающийся тем, что:
а) по существу, все внешние концевые группы представляют собой группы формулы (I)
![]()
где R представляет собой радикал, выбранный из группы, состоящей из C1-10алкила, полиэтиленгликолевого радикала формулы
![]()
где n равно 3, 4, 5, 6, 7, 8, 9, 10, 11 или 12; и полиэтиленгликольгаллильного радикала формулы
![]()
где каждый из m независимо равен 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11 или 12; и
(b) по существу, все внутренние аминогруппы представляют собой катионные четвертичные аммониевые группы.
2. Полипропилениминовый дендример 1, 2, 3, 4 или 5 генерации, представляющий собой модифицированный дендример, неполный модифицированный дендример или их смеси, отличающийся тем, что он получен посредством:
(а) первой реакции полипропилениминового дендримера, содержащего внешние концевые аминогруппы и внутренние третичные аминогруппы, с ацилирующим агентом, выбранным из группы, состоящей из ангидрида уксусной кислоты, C1-10алкилгалогенида, полиэтиленгликолевой кислоты формулы
![]()
где n равно 3, 4, 5, 6, 7, 8, 9, 10, 11 или 12; и галлилгалогенида полиэтиленгликоля формулы
![]()
где каждый из m независимо равен 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11 или 12, а X представляет собой галогенид; и
(b) реакции продукта, полученного на стадии (а), с кватернизирующим агентом.
3. Дендример по п.2, отличающийся тем, что галогенидом является хлорид.
4. Фармацевтическая композиция, подходящая для введения млекопитающему, отличающаяся тем, что она содержит: (а) полипропилениминовый дендример по любому из пп.1-3 и (b) анионное биологически активное терапевтическое средство.
5. Композиция по п.4, отличающаяся тем, что анионное терапевтическое средство выбрано из группы, состоящей из фармацевтически активных соединений, нуклеиновых кислот, нуклеотидных последовательностей, олигомеров ДНК и РНК, полинуклеотидов, ДНКзимов, одноцепочечных и двухцепочечных ДНК, одноцепочечных и двухцепочечных РНК, антисмысловых РНК и ДНК, РНК типа "головки молотка", короткой интерферирующей РНК, микроРНК, рибозимов или их комбинаций.
6. Композиция по п.5, отличающаяся тем, что анионное терапевтическое средство имеет молекулярную массу 5000 Да или менее.
7. Применение дендримера по любому из пп.1-3 в качестве агента для переноса анионного биологически активного терапевтического средства.
8. Применение фармацевтической композиции по любому из пп.4-6 в генотерапии.
9. Применение фармацевтической композиции по любому из пп.4-6 для лечения раковых опухолей печени и почек, острого лимфобластного лейкоза, острого миелоидного лейкоза, саркомы Юинга, трофобластной карциномы, возникающей в период беременности, болезни Ходжкина, неходжкинской лимфомы, лимфомы Беркитта, диффузной крупноклеточной лимфомы, фолликулярной смешанной лимфомы, лимфобластной лимфомы, рабдомиосаркомы, карциномы яичек, опухоли Вильмса, карциномы заднего прохода, карциномы мочевого пузыря, карциномы молочной железы, хронического лимфоцитарного лейкоза, хронического миелогенного лейкоза, ретикулоэндотелиоза, карциномы головы и шеи, карциномы легких (мелкоклеточной), множественной миеломы, фолликулярной лимфомы, карциномы яичника, опухоли головного мозга (астроцитомы), карциномы шейки матки, карциномы ободочной кишки, гепатоцеллюлярной карциномы, саркомы Капоши, карциномы легких (немелкоклеточной), меланомы, карциномы поджелудочной железы, карциномы предстательной железы, саркомы мягких тканей, карциномы молочной железы, карциномы ободочной кишки (на стадии III), остеогенной саркомы, карциномы яичника (на стадии III) или их комбинаций.
Текст
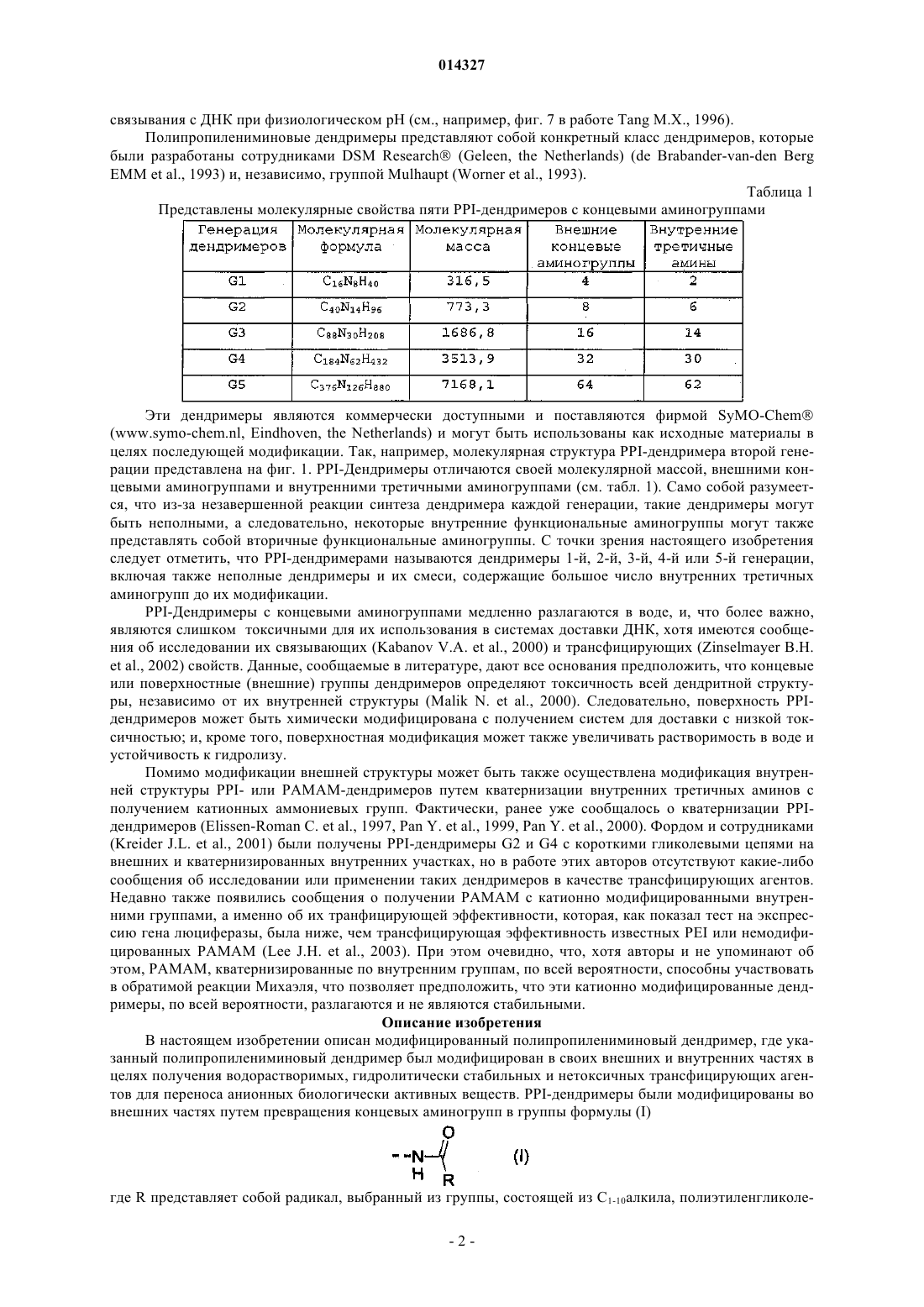
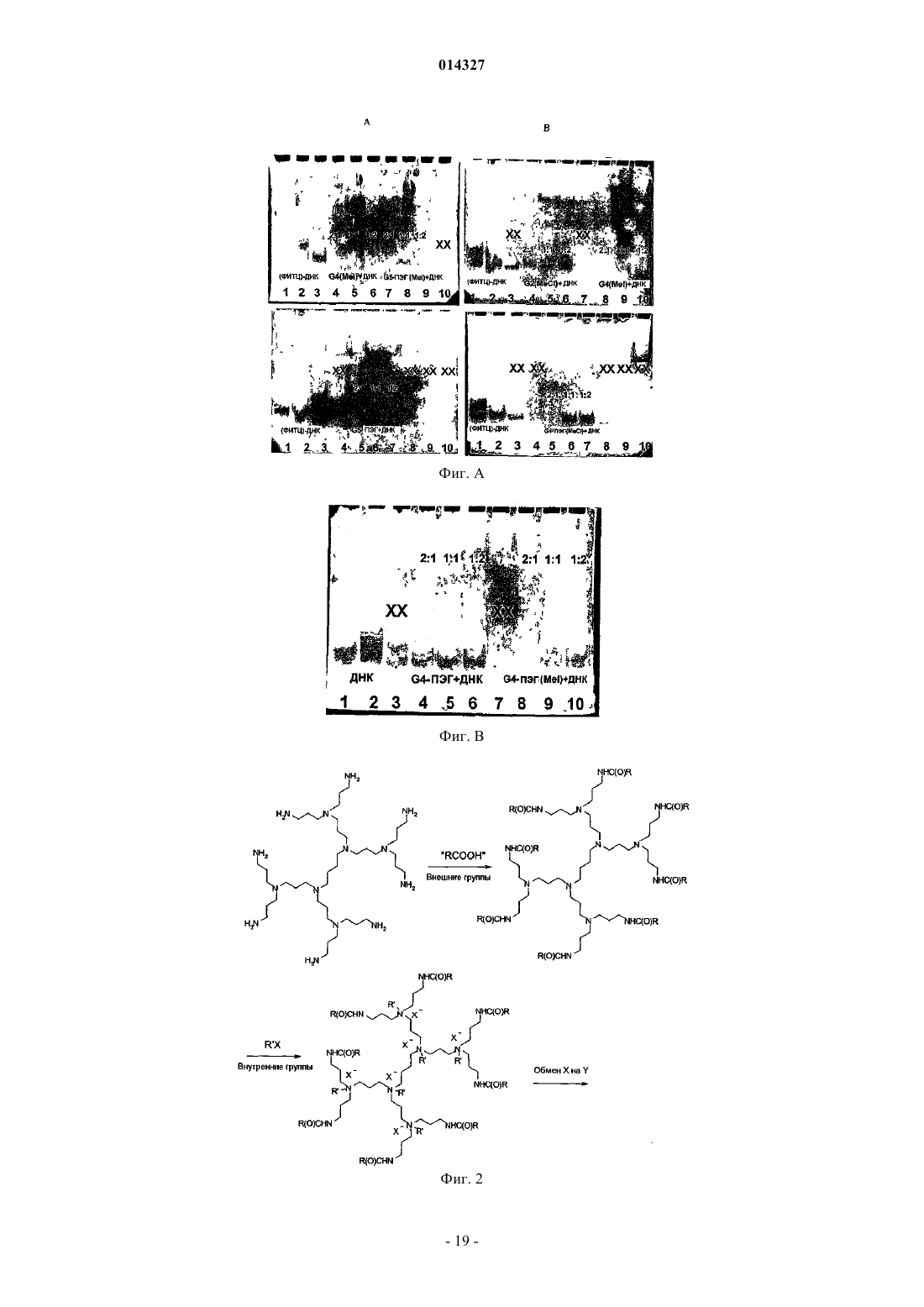
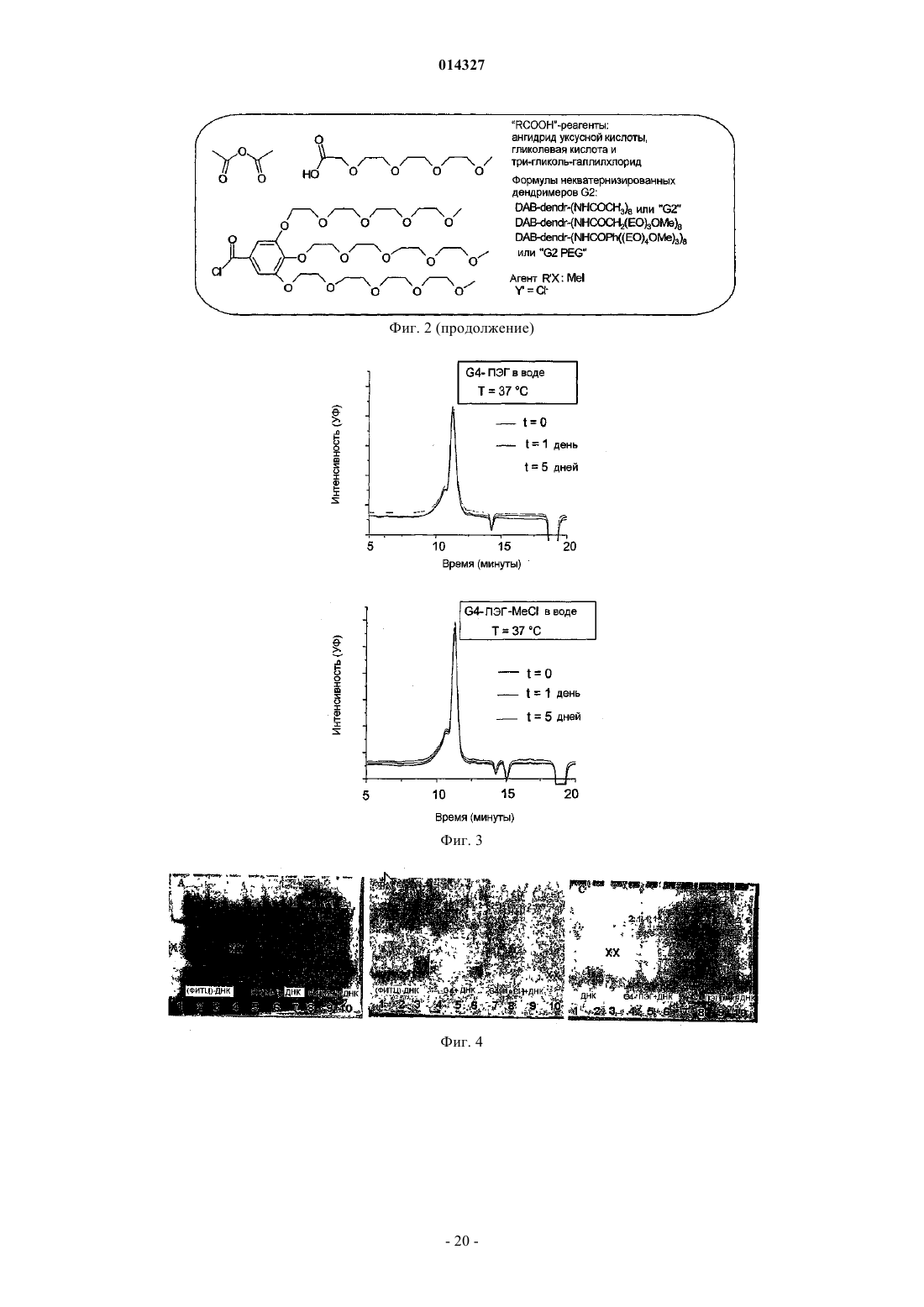
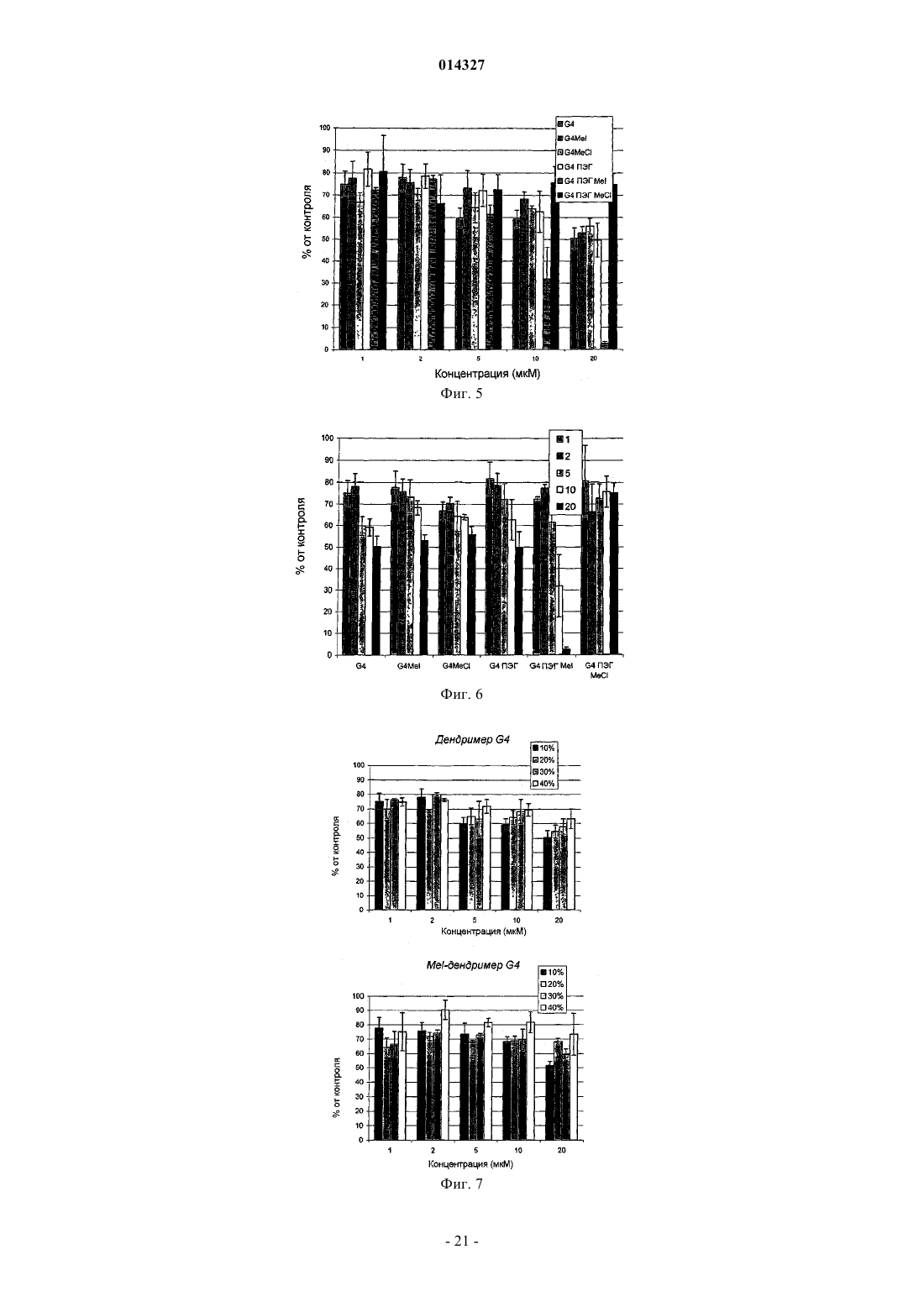
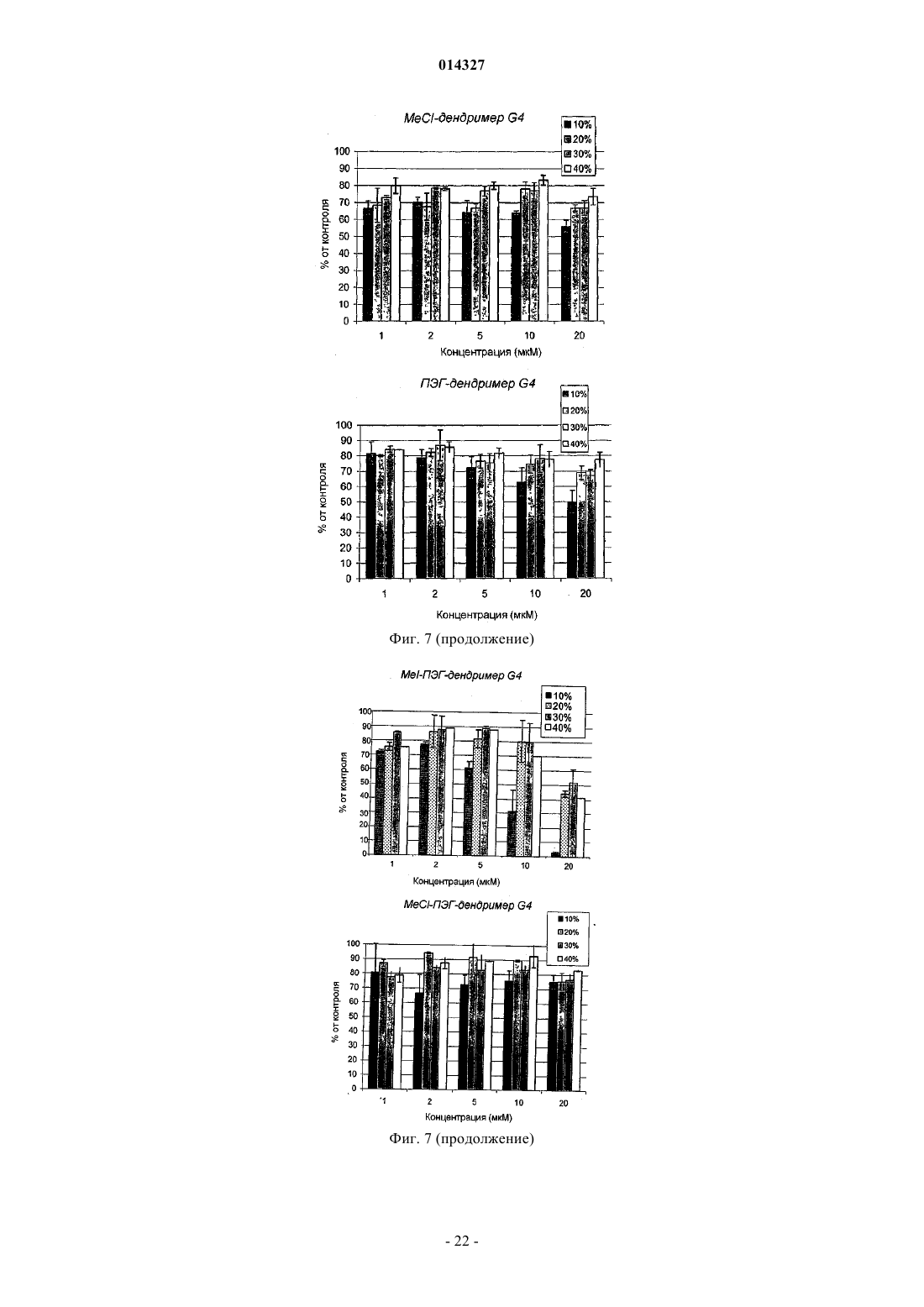
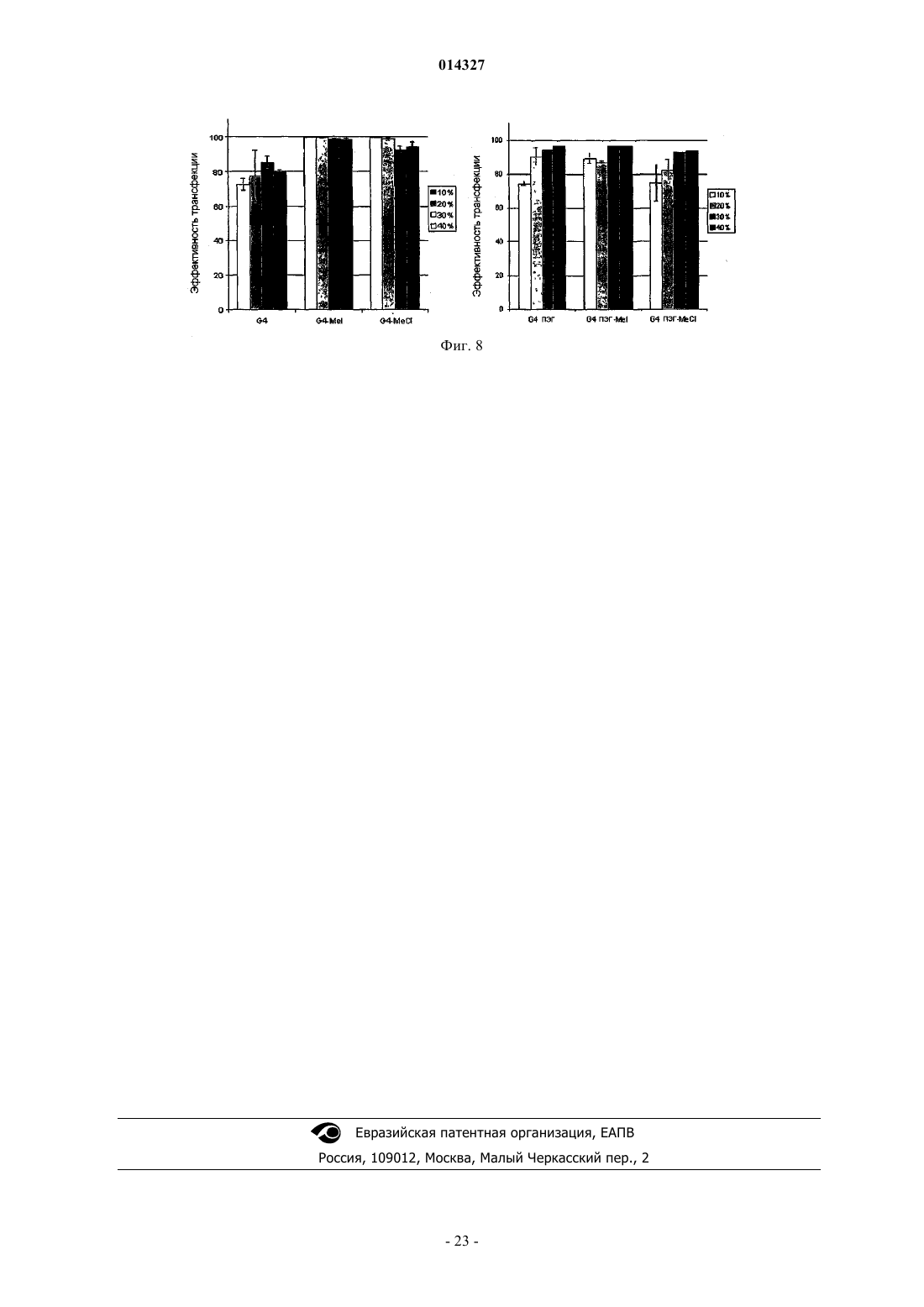
МОДИФИЦИРОВАННЫЕ ПОЛИПРОПИЛЕНИМИНОВЫЕ ДЕНДРИМЕРЫ, СОДЕРЖАЩАЯ ИХ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И ИХ ПРИМЕНЕНИЕ ДЛЯ ЛЕЧЕНИЯ ЗЛОКАЧЕСТВЕННЫХ ОПУХОЛЕЙ Настоящее изобретение относится к модифицированным полипропилениминовым дендримерам, содержащим катионные внутренние аммониевые группы и внешние нетоксичные концевые группы; к фармацевтическим композициям, содержащим указанные дендримеры; и к их применению в качестве агентов для переноса анионных биологически активных терапевтических средств, и в генотерапии, а в частности, для лечения рака. Указанный модифицированный полипропилениминовый дендример 1, 2, 3, 4 или 5 генерации, а также неполные дендримеры и их смеси, содержащие внешние концевые группы и внутренние аминогруппы, отличаются тем, что в них: а) по существу, все внешние концевые группы представляют собой группы формулы (I), где R представляет собой радикал, выбранный из группы, состоящей из C1-10 алкила, полиэтиленгликолевого радикала и полиэтиленгликольгаллильного радикала, и (b) по существу, все внутренние аминогруппы представляют собой четвертичные катионные аммониевые группы. Наиболее предпочтительными являются кватернизированные соединения DAB-dendr-(NHCOCH3)4, DAB-dendr-(NHCOCH3)8, DABDAB-dendr-(NHCOCH3)32,DAB-dendr-(NHCOCH3)64,DAB-dendrdendr-(NHCOCH3)16,(NHCOPhEO)4OMe)3)4, DAB-dendr-(NHCOPhEO)4OMe)3)8, DAB-dendr-(NHCOPhEO)4OMe)3)16, DABdendr-(NHCOPhEO)4OMe)3)32 и DAB-dendr-(NHCOPhEO)4OMe)3)64. Так Фредерик (BE), Янссен Хенрикус Мария, Мейер Эгберт Виллем (NL), Жанико Мишель Мари Франсуа, Брюстер Маркус Эли (BE) 014327 Настоящее изобретение относится к модифицированным полипропилениминовым дендримерам,содержащим внутренние катионные аминные (аммониевые) группы и внешние нетоксичные концевые группы; к фармацевтическим композициям, содержащим указанные дендримеры; и к их применению в качестве трансфицирующих агентов для доставки анионных биологически активных терапевтических веществ; и к их применению в генотерапии, а в частности для лечения рака. Предшествующий уровень техники Дендримеры представляют собой хорошо определенные синтетические макромолекулы с высокоразветвленной молекулярной структурой, которую синтезируют с использованием ступенчатого алгоритма. В каждой повторяющейся последовательности реакций продуцируется так называемая молекула"более высокой генерации" (G), которая фактически имеет вдвое большую молекулярную массу и вдвое большее (дискретное) число функциональных концевых групп. Начиная с 1985 г., было разработано большое число дендримеров различных типов, отличающихся по своей химической структуре, таких как поли(амидоамино)-РАМАМ-дендримеры Томалия (Tomalia), арборолы Ньюкома (Newkome), полиэфирные дендримеры Фречета (Frechet), полипропилениминовые (PPI)-дендримеры Мейера (Meijer) и Мюльхаупта (Mulhaupt) и фенилацетиленовые дендримеры Мура (Moore) (Schlter D.A., 1999). Дендримеры,благодаря их известной структуре, узкой полидисперсности, заданного размера наночастиц и легкости модификации концевых групп, представляют особый интерес как кандидаты для исследования возможности применения различных их функций в биологии и медицинской химии. В частности, было исследовано их действие в качестве агентов, связывающих и высвобождающих лекарственные средства, и в качестве носителей для доставки нуклеиновых кислот в генотерапии (Patri A.K. et al., 2002; Esfand R. et al.,2001, Liu M. et al., 1999, Stiriba S.E. et al., 2002, Bosraan A.W. et al., 1999, Tang M.X. et al., 1997). Основной задачей генотерапии является перенос нуклеиновых кислот (таких как ДНК) в клетки, предпочтительно в эукариотические клетки (такие как клетки человека), для достижения терапевтического эффекта. Этот эффект может быть продуцирован либо путем устранения генетических дефектов, либо(сверх)экспрессии терапевтически ценных белков. Среди дендримеров РАМАМ-дендримеры привлекают особое внимание как потенциальные трансфицирующие агенты, которые могут быть использованы для доставки генов, поскольку эти дендримеры являются положительно заряженными и могут связываться с ДНК при физиологическом значении рН. Были также исследованы и другие типы дендримеров (Loup С. et al., 1999, Choi J.S. et al., 2000, OhasakiM. et al., 2002, Shah D.S. et al 2000, Liu M.J. et al., 1999, Joester D. et al., 2003). Szoka и др. впервые продемонстрировали в in vitro тестах, что перенос ДНК успешно опосредуется РАМАМ-дендримерами(Haensler J. et al., 1993). Позднее были опубликованы и другие исследования, касающиеся характера связывания и трансфекции, опосредуемых РАМАМ-дендримерами (Kukowska-Latallo J. et al., 1996, DeLongR. et al., 1997, Bielinska A. et al., 1996, Shchepinov M.S. et al., 1997, Qin L. et al., 1998, Yoo H. et al., 1999,Cheng H. et al., 2000, Ottaviani M.F. et al., 2000, Kihara F. et al., 2003). В частности, было обнаружено, что термообработанные и подвергнутые частичной деструкции РАМАМ-дендримеры действуют более эффективно в качестве ДНК-носителей in vitro (Tang M.X. et al., 1996). Эти активированные РАМАМ являются коммерчески доступными под торговым знаком SuperFect (Qiagen). Сообщалось, что успешная трансфекция, осуществляемая РАМАМ-дендримерами, была достигнута при отношении зарядов 5-20(отношение зарядов определяется как отношение числа концевых катионных аминных групп в РАМАМ к числу фосфатных групп в ДНК), то есть использовалось избыточное количество трансфицирующего агента (Haensler J. et al., 1993, Bielinska A.U. et al., 1999). В качестве потенциальных ДНКтрансфицирующих агентов были также введены РАМАМ-дендримеры, у которых часть концевых аминов модифицирована гликолевыми цепями (Luo D. et al., 2002). Однако в этом исследовании в тестах на связывание и перенос ДНК были использованы высокие концентрации дендримера, хотя было бы желательно использовать агенты, действующие при более низких концентрациях. В недавно опубликованной работе, относящейся к РАМАМ-дендримерам, сообщаются фундаментальные сведения об их взаимодействии с клеточными мембранами (Hong S. et al., 2004), а также о получении и исследовании РАМАМ в виде конъюгатов с нацеливающими молекулами антител, синтез которых явился новым этапом в разработке конструкций для переноса генов (Thomas T.P. et al., 2004), но при этом было показано, что РАМАМ могут взаимодействовать с молекулами РНК, что приводит к ингибированию активности некоторых рибозимов (Wu J. et al., 2005). Важными факторами, определяющими ценность трансфицирующего агента, являются его токсичность и эффективность. Некоторыми исследователями (Roberts J.C. et al., 1996) было показано, что токсичность РАМАМ-дендримеров зависит от их генерации, а другими исследователями (Szoka F.C. et al.,1996) было продемонстрировано, что РАМАМ-дендримеры являются менее токсичными, чем полилизины (pLys); при этом имеются и другие данные, которые позволяют предположить, что РАМАМдендримеры, а в частности дентримеры с аминным концом, обладают гемолитическими и цитотоксическими свойствами, тогда как РАМАМ-дендримеры с концевыми карбоксилатными группами являются нетоксичными (Duncan R. et al., 1996, Malik N. et al., 2000). К сожалению, очевидно, что трансфекция является более эффективной, если используются РАМАМ-дендримеры с большим числом функциональных аминогрупп, что, вероятно, обусловлено тем, что они образуют большее число катионных сайтов-1 014327 связывания с ДНК при физиологическом рН (см., например, фиг. 7 в работе Tang M.X., 1996). Полипропилениминовые дендримеры представляют собой конкретный класс дендримеров, которые были разработаны сотрудниками DSM Research (Geleen, the Netherlands) (de Brabander-van-den BergEMM et al., 1993) и, независимо, группой Mulhaupt (Worner et al., 1993). Таблица 1 Представлены молекулярные свойства пяти PPI-дендримеров с концевыми аминогруппами Эти дендримеры являются коммерчески доступными и поставляются фирмой SyMO-Chem(www.symo-chem.nl, Eindhoven, the Netherlands) и могут быть использованы как исходные материалы в целях последующей модификации. Так, например, молекулярная структура PPI-дендримера второй генерации представлена на фиг. 1. PPI-Дендримеры отличаются своей молекулярной массой, внешними концевыми аминогруппами и внутренними третичными аминогруппами (см. табл. 1). Само собой разумеется, что из-за незавершенной реакции синтеза дендримера каждой генерации, такие дендримеры могут быть неполными, а следовательно, некоторые внутренние функциональные аминогруппы могут также представлять собой вторичные функциональные аминогруппы. С точки зрения настоящего изобретения следует отметить, что PPI-дендримерами называются дендримеры 1-й, 2-й, 3-й, 4-й или 5-й генерации,включая также неполные дендримеры и их смеси, содержащие большое число внутренних третичных аминогрупп до их модификации.PPI-Дендримеры с концевыми аминогруппами медленно разлагаются в воде, и, что более важно,являются слишком токсичными для их использования в системах доставки ДНК, хотя имеются сообщения об исследовании их связывающих (Kabanov V.A. et al., 2000) и трансфицирующих (Zinselmayer B.H.et al., 2002) свойств. Данные, сообщаемые в литературе, дают все основания предположить, что концевые или поверхностные (внешние) группы дендримеров определяют токсичность всей дендритной структуры, независимо от их внутренней структуры (Malik N. et al., 2000). Следовательно, поверхность PPIдендримеров может быть химически модифицирована с получением систем для доставки с низкой токсичностью; и, кроме того, поверхностная модификация может также увеличивать растворимость в воде и устойчивость к гидролизу. Помимо модификации внешней структуры может быть также осуществлена модификация внутренней структуры PPI- или РАМАМ-дендримеров путем кватернизации внутренних третичных аминов с получением катионных аммониевых групп. Фактически, ранее уже сообщалось о кватернизации PPIдендримеров (Elissen-Roman С. et al., 1997, Pan Y. et al., 1999, Pan Y. et al., 2000). Фордом и сотрудниками(Kreider J.L. et al., 2001) были получены PPI-дендримеры G2 и G4 с короткими гликолевыми цепями на внешних и кватернизированных внутренних участках, но в работе этих авторов отсутствуют какие-либо сообщения об исследовании или применении таких дендримеров в качестве трансфицирующих агентов. Недавно также появились сообщения о получении РАМАМ с катионно модифицированными внутренними группами, а именно об их транфицирующей эффективности, которая, как показал тест на экспрессию гена люциферазы, была ниже, чем трансфицирующая эффективность известных PEI или немодифицированных РАМАМ (Lee J.H. et al., 2003). При этом очевидно, что, хотя авторы и не упоминают об этом, РАМАМ, кватернизированные по внутренним группам, по всей вероятности, способны участвовать в обратимой реакции Михаэля, что позволяет предположить, что эти катионно модифицированные дендримеры, по всей вероятности, разлагаются и не являются стабильными. Описание изобретения В настоящем изобретении описан модифицированный полипропилениминовый дендример, где указанный полипропилениминовый дендример был модифицирован в своих внешних и внутренних частях в целях получения водорастворимых, гидролитически стабильных и нетоксичных трансфицирующих агентов для переноса анионных биологически активных веществ. PPI-дендримеры были модифицированы во внешних частях путем превращения концевых аминогрупп в группы формулы (I) где R представляет собой радикал, выбранный из группы, состоящей из С 1-10 алкила, полиэтиленгликоле-2 014327 вого радикала и полиэтиленгликоль-галлильного радикала, и поскольку эти концевые группы позволяют сохранять водорастворимость, то очевидно, что блокирование концевых аминогрупп приводит к получению нетоксичных молекул. Внутренняя часть PPI-дендримеров была модифицирована посредством реакции внутренних (преимущественно третичных) аминогрупп с кватернизирующим агентом, таким как метилиодид, метилхлорид и т.п., в результате чего было создано микроокружение с множеством четвертичных катионных групп. В зависимости от генерации PPI-дендримера количество катионных групп может варьироваться от 2 до 60 для 1-й и 5-й генерации соответственно, при условии, что реакция кватернизации протекает с количественным выходом. Предполагается, что высокая локальная концентрация катионных групп внутри дендримера образует дендритную молекулу определенного типа, обладающую хорошей способностью образовывать комплексы с анионными биологически активными веществами. Следовательно, настоящее изобретение относится к модифицированному полипропилениминовому дендримеру 1, 2, 3, 4 или 5 генерации, а также к неполным дендримерам и к их смесям, включающим внешние концевые группы и внутренние аминогруппы, где указанные дендримеры отличаются тем, что в них: а) в основном, все внешние концевые группы представляют собой группы формулы (I), где R представляет собой радикал, выбранный из группы, состоящей из C1-10 алкила, полиэтиленгликолевого радикала формулы где каждый из m независимо равен 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11 или 12; и(b) в основном, все внутренние аминогруппы представляют собой катионные четвертичные аммониевые группы. Кроме того, настоящее изобретение относится к модифицированному полипропилениминовому дендримеру 1, 2, 3, 4 или 5 генерации, а также к неполным дендримерам и к их смесям, отличающимся тем, что указанный модифицированный полипропилениминовый дендример получают посредством:(а) первой реакции полипропилениминового дендримера, содержащего, преимущественно, внешние концевые аминогруппы и внутренние третичные аминогруппы, с ацилирующим агентом, выбранным из группы, состоящей из ангидрида уксусной кислоты, С 1-10-алкилгалогенида, полиэтиленгликолевой кислоты формулы где каждый из m независимо равен 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11 или 12, а X представляет собой галогенид; и(b) реакции продукта, полученного в стадии (а), с кватернизирующим агентом. Предпочтительным C1-10 алкилом является метил, этил, изопропил, н-пропил, трет-бутил, н-бутил или пентил. Наиболее предпочтительным C1-10 алкилом является метил. Предпочтительным галогенидом является хлорид, бромид или иодид. Особенно предпочтительным является хлорид. Предпочтительно n равно 3, 4, 5 или 6, а наиболее предпочтительно 3 или 4. Предпочтительно m равно 3, 4, 5 или 6, а наиболее предпочтительно 3 или 4. В качестве кватернизирующего агента может быть использован любой агент, который, как известно специалисту, является подходящим для осуществления указанных целей, то есть для превращения третичной аминогруппы в четвертичную аммониевую группу. При этом предпочтительно использовать метилгалогенид, а наиболее предпочтительно метилиодид, а в качестве агента для межфазного переноса может быть также использован агент, содержащий С 10 алкильную группу. Термин "связывание" означает любое взаимодействие, которое приводит к обратимому присоединению химической молекулы, имеющей по меньшей мере одну анионную группу, к другой молекуле,имеющей по меньшей мере одну катионную группу. Настоящее изобретение также относится к фармацевтической композиции, подходящей для введения млекопитающему, а предпочтительно человеку, где указанная композиция отличается тем, что она содержит (а) модифицированный полипропилениминовый дендример согласно изобретению и (b) анионное биологически активное терапевтическое средство.-3 014327 Термин "анионное биологически активное вещество" означает любую химическую молекулу, способную связываться с катионным частью, а в частности с катионной частью фармацевтически активных соединений, нуклеиновых кислот, нуклеотидных последовательностей, олигомеров ДНК и РНК, полинуклеотидов, ДНКзимов, одноцепочечных и двухцепочечных ДНК, одноцепочечных и двухцепочечных РНК, антисмысловых РНК и ДНК, РНК типа "головки молотка", короткой интерферирующей РНК, микроРНК, рибозимов и т.п. или их комбинаций. Особенно предпочтительными являются анионные биологически активные молекулы с относительно низкой молекулярной массой, предпочтительно равной 5000 Да или менее, а в частности, с относительно низким числом пар оснований (например, олиго-ДНК или олиго-РНК), а предпочтительно менее чем 50 пар оснований. В настоящей заявке авторами изобретения был использован 33-мерный одноцепочечный каталитический ДНКзим в качестве модели нуклеиновой кислоты для исследования связывающей и трансфицирующей способности нового модифицированного PPI-дендримера. Тесты на трансфекцию проводили in vitro, а также in vivo. Дендримерные соединения согласно изобретению, благодаря их низкой токсичности и их стабильности в сыворотке и в крови, могут быть использованы в качестве трансфицирующих агентов, а фармацевтические композиции, содержащие указанные соединения, являются особенно подходящими для их применения в генотерапии, а наиболее предпочтительно в медицине, а в частности для лечения рака. Более предпочтительно указанным раковым заболеванием является опухоль печени и почек, острый лимфобластный лейкоз, острый миелоидный лейкоз, саркома Юинга, трофобластная карцинома, возникающая в период беременности, болезнь Ходжкина, неходжкинская лимфома, лимфома Беркитта, диффузная крупноклеточная лимфома, фолликулярная смешанная лимфома, лимфобластная лимфома, рабдомиосаркома, карцинома яичек, опухоль Вильмса, карцинома заднего прохода, карцинома мочевого пузыря, карцинома молочной железы, хронический лимфоцитарный лейкоз, хронический миелогенный лейкоз, ретикулоэндотелиоз, карцинома головы и шеи, карцинома легких (мелкоклеточная), множественная миелома, фолликулярная лимфома, карцинома яичника, опухоли головного мозга (астроцитома),карцинома шейки матки, карцинома ободочной кишки, гепатоцеллюлярная карцинома, саркома Капоши,карцинома легких (немелкоклеточная), меланома, карцинома поджелудочной железы, карцинома предстательной железы, саркома мягких тканей, карцинома молочной железы, карцинома ободочной кишки(стадии III), остеогенная саркома, карцинома яичника (стадии III) или их комбинации. Настоящее изобретение также относится к модифицированному полипропилениминовому дендримеру 1-й, 2-й, 3-й, 4-й или 5-й генерации, а также к неполным дендримерам и к их смесям, включающим внешние концевые группы и внутренние аминогруппы, где указанные дендримеры отличаются тем, что в них, в основном, все внешние концевые группы представляют собой группы формулы (I), где R представляет собой радикал, выбранный из группы, состоящей из C1-10 алкила, полиэтиленгликолевого радикала формулы где каждый из m независимо равен 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11 или 12. Кроме того, настоящее изобретение относится к модифицированному полипропилениминовому дендримеру 1-й, 2-й, 3-й, 4-й или 5-й генерации, а также к неполным дендримерам и к их смесям, отличающимся тем, что указанный модифицированный полипропилениминовый дендример получают посредством первой реакции полипропилениминового дендримера, содержащего преимущественно внешние концевые аминогруппы и внутренние третичные аминогруппы, с ацилирующим агентом, выбранным из группы, состоящей из ангидрида уксусной кислоты, С 1-10 алкилгалогенида, полиэтиленгликолевой кислоты формулы где каждый из m независимо равен 1,2, 3, 4, 5, 6, 7, 8, 9, 10, 11 или 12, а X представляет собой галогенид. Настоящее изобретение подробно проиллюстрировано ниже в описании ряда экспериментов, которые не должны рассматриваться как ограничение изобретения.-4 014327 Эксперименты 1. Синтез модифицированных полипропилениминовых дендримеров. 1.1. Общее описание. Синтез полипропилениминовых дендримеров, модифицированных группами галлата гликоля, описан в литературе (см. Baars, M.W.P.L., Kleppinger, R., Koch, M.H.J., Yeu, S.L., Meijer, E.W., Angew. Chem.Int. Ed. Engl., 2000, 39, 1285 и дополнительную информацию, прилагаемую к этой статье). В этой же работе можно найти описание синтеза галлата гликоля (то есть галловой кислоты или 3,4,5 тригидроксибензойной кислоты, имеющей три монометокситетраэтиленгликолевые группы). Кватернизированные полипропилениминовые дендримеры с ацетильными группами или с группами галлата полиэтиленгликоля ранее не были описаны в литератеруре. Полипропилениминовые дендримеры с концевыми аминогруппами поставляются компаниейSyMO-Chem (www.symo-chem.nl) и обычно обозначаются как DAB-Am-4 (1-й генерации), DAB-Am-8 (2 й генерации), DAB-Am-16 (3-й генерации), DAB-Am-32 (4-й генерации) и DAB-Am-64 (5-й генерации) для первой, второй, третьей, четвертой и пятой генерации соответственно. DAB означает 1,4 диаминобутановую сердцевину, Am означает концевые аминогруппы, а указанная цифра означает число концевых групп. Используемые растворители обычно являются фармацевтическими приемлемыми (р.а.). Используемыми растворителями и реагентами являются метиловый спирт (Biosolve, р.а.), толуол (Biosolve, p.a.),дихлорметан (Biosolve, p.a.), вода (деминерализованная на колонке), триэтиламин (Fluka, 99%, хранящийся в продаже в виде KOH-гранул), уксусный ангидрид (Acros, p.a.), оксалилхлорид (Acros) и метилиодид (Merck, хранящийся в холодильнике). Были использованы Clанионообменная смола Dowex 18-50 (Acros) с емкостью 1,2 мэкв./мл(Acros) и сильноосновная OHанионообменная смола Dowex 550A ОН (25-35 меш) (Aldrich). Эффективность ионного обмена иодида на хлорид может быть оценена путем проведения теста. Сначала несколько миллиграммов дендримерного продукта растворяли примерно в 1 мл воды и добавляли несколько капель концентрированной H2O2 (35% раствор, Merck). На этой стадии Iсодержащий раствор дендримера приобретал немного желтоватую окраску, тогда как Clсодержащий раствор дендримера оставался бесцветным (легкая окраска появлялась в результате образования I2). После добавления примерно 1 мл свежеприготовленного раствора крахмала Iсодержащий раствор дендримера становился темно-синим, тогда как Clсодержащий дендример не вызывал окрашивания раствора. Раствор крахмала получали путем добавления растворимого крахмального порошка (1 г, Merck) в кипящую воду при интенсивном перемешивании (100 мл). Через 1 мин раствор оставляли для охлаждения и сразу использовали для проведения теста. Таблица II Модифицированные полипропилениминовые дендримеры В табл. II перечислены модифицированные полипропилениминовые дендримеры, которые были синтезированы. В качестве диализных мембран были использованы пробирки Spectrum Laboratories Spectra/Por (для отсечки Mw были применены различные материалы). Реакции обычно проводили в инертной атмосфере аргона. ЯМР-анализы осуществляли на спектрометре Varian Mercury Vx 400 МГц или Varian Gemini 300 МГц. После выделения полученные дендримеры обычно хранили в темноте при -20 С или при 4 С. Полипропилениминовый дендример второй генерации с концевой аминогруппой (6,50 г; 8,40 ммоль; FW=773) растворяли в метиловом спирте (50 мл) и триэтиламине (6,8 г; 67,24 ммоль). Затем в течение 1 мин добавляли ангидрид уксусной кислоты (8,24 г; 80,8 ммоль) (при кипячении с обратным холодильником; без внешнего охлаждения). После перемешивания в течение 2,5 ч раствор упаривали на роторном испарителе и один раз отгоняли с метиловым спиртом. В колонку загружали ионообменную смолу Dowex 550 А ОН (25-35 меш), и эту смолу промывали водой, а затем метиловым спиртом (при этом наблюдалось небольшое повышение температуры). Неочищенный дендример в метаноле элюировали по каплям так, чтобы процесс обмена занимал достаточное количество времени. Продукт выделяли на роторном испарителе и отгоняли с метанолом, а затем удаляли в вакууме с использованием масляного насоса. В результате получали прозрачное бесцветное масло. 1 Н-ЯМР (CD3OD):= 8,1 (т), 3,2 (т), 2,5 (м), 1,9 (с), 1,7 (м), 1,5 (м). 13 С-ЯМР (CD3OD):= 173,1, 55,2, 53,3, 53,2, 52,7, 39,0, 27,7, 25,8, 24,9, 22,7. В идеальном случае все 6 внутренних третичных аминов. Ацилированный полипропилениминовый дендример второй генерации (725 мг) растворяли в метиловом спирте (2 мл) и метилиодиде (4,6 г). Раствор перемешивали при температуре масляной бани 50 С в течение 20 ч в атмосфере аргона. После выпаривания летучих веществ получали желтоватый тонкодисперсный порошок. 1 Н-ЯМР (CD3OD):= 8,0 (т), 3,9 (ушир.), 3,7-3,5 (ушир.), 3,3 (м), 2,5 (ушир.), 2,2 (ушир.), 2,05 В идеальном случае, все 6 внутренних третичных аминов. Ацилированный и кватернизированный метилиодидом полипропилениминовый дендример второй генерации (309 мг) растворяли в метиловом спирте (2 мл) и наносили на колонку, загруженную ионообменной смолой Dowex 18-50, которая была промыта водой и метанолом. Затем проводили элюирование метиловым спиртом. После упаривания фильтрата получали MeCl-аддукт (0,21 г). 1 Полипропилениминовый дендример четвертой генерации с концевой аминогруппой (2,02 г; 0,57 ммоль; FW=3514 г/моль) растворяли в дихлорметане (50 мл) и триэтиламине (2,05 г; 20,3 ммоль). Затем в течение 1 мин по каплям добавляли ангидрид уксусной кислоты (2,15 г; 21,06 ммоль) (экзотермическая реакция; без внешнего охлаждения). После перемешивания в течение ночи добавляли метиловый спирт(20 мл), в результате чего получали прозрачный раствор, который перемешивали еще 3 ч. Затем раствор упаривали и три раза отгоняли с метиловым спиртом. Метаноловый раствор полученного продукта элюировали на предварительно промытой колонке с ионообменной смолой Dowex 550A ОН (25-35 меш). Элюат упаривали на роторном испарителе, а затем снова отгоняли с метанолом и сушили в вакууме с получением вязкого масла (2,7 г). 1 В идеальном случае все 30 внутренних аминов. Ацилированный полипропилениминовый дендример четвертой генерации (FW=4859 г/моль; 1,0 г;-6 014327 0,206 ммоль; 6,17 ммоль внутренних третичных аминов) растворяли в метиловом спирте (2 мл) и в метилиодиде (7 мл). Смесь перемешивали в течение 60 ч при температуре масляной бани 45 С. Летучие вещества двухслойной смеси выпаривали с получением желтого порошка. Полученный продукт растворяли в метиловом спирте и осаждали тщательно перемешиваемым эфиром. В результате этой процедуры был получен тонкодисперсный желтый порошок. 1 Н-ЯМР (CD3OD):= 8,2 (ушир.), 4,1-3,5 (ушир.), 3,3 (м), 2,8-2,5 (ушир.), 2,3-2,1 (ушир.), 2,05 (с). 13 С-ЯМР (CD3OD):= 173,5, 61,8, 60,4, 59,7, 51,2, 50,2, 37,5, 23,9, 23,5, 20,5, 19,4. 1.7. DAB-dendr-(NHCOCH3)32 + 30 MeCl или G4 (MeCl). В идеальном случае все 30 внутренних аминов. Ацилированный и кватернизированный метилиодидом полипропилениминовый дендример четвертой генерации растворяли в метиловом спирте и наносили на колонку, загруженную ионообменной смолой Dowex 18-50, которая была промыта водой и метанолом. Затем проводили элюирование метиловым спиртом. После упаривания фильтрата получали MeCl-аддукт. 1 Н-ЯМР (CD3OD):= 8,3 (ушир.), 3,9-3,2 (ушир.), 2,7-2,4 (ушир.), 2,1-2,0 (ушир.), 2,0 (с). 13 С-ЯМР (CD3OD):= 173,5, 61,5, 60,4, 60,0, 59,6, 49,9, 37,4, 23,6, 22,9, 20,7, 18,4. 1.8. Структурный блок галлилхлорида гликоля, Cl(O)C-PhЕО)4 ОМе)3. Галлат гликоля (HOOC-PhЕО)4 ОМе)3) (2,05 г, 2,68 ммоль, FW=741) выдерживали в вакууме над порошкообразным Р 2 О 5. Перед использованием его два раза отгоняли с толуолом (при совместном выпаривании). После этого указанное соединение растворяли в 60 мл подвергнутого перегонке дихлорметана и добавляли 2,8 мл оксалилхлорида, а затем 3 капли ДМФ. Через 1 ч добавляли еще 0,2 мл оксалилхлорида, после чего с помощью ИК-анализа был обнаружен пик при 1714 см-1 (СООН-группа). После дополнительного перемешивания в течение 10 мин реакционная смесь полностью превращалась в хлорангидрид (ИК: 1745 см-1). Продукт Cl(O)C-PhЕО)4 ОМе)3 выделяли путем выпаривания растворителей на роторном испарителе и совместного выпаривания с толуолом. Полученный продукт сразу использовали в реакциях связывания с полипропилениминовыми дендримерами. 1.9. DAB-dendr-(NHCOPhЕО)4 ОМе)3)32 или G4-ПЭГ. Полипропилениминовый дендример четвертой генерации с концевым амином (276 мг; FW=3514 г/моль) четыре раза отгоняли с толуолом и растворяли в 6 мл дихлорметана и 1 мл триэтиламина. Полученный раствор в течение 0,5 мин добавляли к раствору хлорангидрида Cl(O)C-PhEO)4 ОМе)3 в 60 мл дихлорметана (использовали 1,1 экв. хлорангидрида). В результате получали прозрачный раствор. После перемешивания в течение ночи добавляли 30 мл воды и 550 мг порошка KOH, а затем всю смесь переносили в делительную воронку. Органический слой отделяли, а водный слой экстрагировали 50 мл дихлорметана. Объединенные дихлорметановые слои промывали раствором 200 мг KOH в 25 мл воды, а затем двумя 25-мл порциями воды. Дихлорметановый раствор сушили безводным сульфатом натрия,фильтровали и концентрировали с получением 1,85 г маслянистого продукта. Этот продукт два раза диализовали смесью метанол/вода/триэтиламин 500:60:10 (об./об./об.) и, наконец, смесью метанол/вода 500:25 (об./об.). После выпаривания и совместного выпаривания с метанолом в целях удаления остаточного триэтиламина и после сушки в вакуумной печи получали слегка желтоватый маслянистый продукт В идеальном случае, все 30 внутренних третичных аминов. Полипропилениминовый дендример четвертой генерации, модифицированный группами галлата гликоля (590 мг), перемешивали в течение 40 ч в 5 мл метанола и 2 мл метилиодида при 40-45 С (температура масляной бани) в круглодонной колбе, снабженной обратным холодильником. Раствор упаривали на роторном испарителе, после чего продукт три раза отгоняли с метанолом. Выход: 0,69 г вязкого желто-коричневого масла. 1 Н-ЯМР (CD3OD):= 7,2 (ушир.с), 4,2 (ушир.), 4,0-3,4, 3,35 (с), 3,3 (с), 2,8-2,4 (ушир.), 2,3-2,1 В идеальном случае, все 30 внутренних третичных аминов. Колонку с 3,0 г ионообменной смолы Dowex 1X8-50 (Acros) промывали деминерализованной водой и метанолом для удаления примесей. Дендример G4 с группами галлата гликоля, кватернизированнымиMeI (Iформа; 290 мг), растворяли в 5 мл метанола и загружали на колонку. Элюирование метанолом продолжали до тех пор, пока фракции не обнаруживали какой-либо УФ-активности на ТСХ-пластине с двуокисью кремния 60. Метаноловый раствор упаривали на роторном испарителе с получением 247 мг продукта (вязкого слегка желтоватого масла). 1 Полипропилениминовый дендример пятой генерации с концевым амином (251 мг; содержащий примерно 20 мас.% метанола) три раза отгоняли с толуолом для удаления метанола, а затем растворяли в смеси дихлорметана (40 мл) и триэтиламина (250 мг). Свежеприготовленный хлорангидрид (Cl(O)CPhЕО)4OMe)3; 1,2 экв. на первичный амин) в 20 мл в течение 1 мин добавляли к интенсивно перемешиваемому раствору дендримера. Полученный раствор сразу становился мутным. После перемешивания в течение ночи в атмосфере аргона смесь концентрировали на роторном испарителе. Продукт растворяли в воде (5 мл) и в растворе гидроксида натрия (300 мг в 5 мл воды). Очистку проводили путем диализа против смеси MeOH/вода/триэтиламин (400/40/40 мл), а затем против смеси MeOH/вода (500/50 мл). После выпаривания и сушки (с помощью масляного насоса) получали 1,44 г маслянистого продукта. 1 Н-ЯМР (CDCl3):= 8,2 (ушир.), 7,1 (ушир.с), 4,1 (ушир.), 3,9 (ушир.), 3,8-3,4, 3,35 (с), 3,3 (с), 2,52,3 (ушир.), 1,8-1,3 (ушир.). 13 С-ЯМР (CDCl3):= 167,1, 152,3, 141,0, 129,7, 106,8, 73-68, 59, 53-51, 38,9, 27,0, 24,0. 1.13. DAB-dendr-(NHCOPhЕО)4 ОМе)3)64 + 62 MeI или G5-ПЭГ(MeI). В идеальном случае, все 62 внутренних третичных амина. Полипропилениминовый дендример пятой генерации, модифицированный группами галлата гликоля (150 мг), растворяли в 2 мл метанола. Затем добавляли раствор метилиодида (360 мг) в метиловом спирте (0,5 мл), и полученную смесь перемешивали в течение 20 ч при 40 С (температуре масляной бани) в инертной атмосфере аргона. Летучие вещества выпаривали на роторном испарителе с получением(ушир.), 38,5 (ушир.), 24,2 (ушир.), 19,5 (ушир.). 2. Измерения стабильности с помощью 1 Н-ЯМР, 13 С-ЯМР и ЭХ в водных смесях. Дендримеры растворяли в D2O и, растворив, переносили в ЯМР-пробирки. Эти пробирки помещали в масляную баню, которую поддерживали при температуре 35-39 С в течение четырех дней. 1 Н-ЯМРспектр регистрировали каждый день, а за четыре дня до этого и через четыре дня после этого регистрировали 13 С-ЯМР-спектры. Во время измерений также определяли величины рН; при этом на протяжении всего времени измерения DAB-dendr-(NHCOCH3)8 оставался основным (рН = приблизительно 9), DABdendr-(NHCOCH3)32 + 30 MeI оставался кислотным (рН = приблизительно 2), DAB-dendr-(NHCOCH3)8 +MeCl оставался слегка кислотным (рН= прибл. 5-6), тогда как DAB-dendr-(NHCOCH3)8 + MeI, который сначала был слабокислотным (pH=5-6) становился еще более кислотным (рН = приблизительно 2). Кислотность растворов, содержащих кватернизированные метилиодидом дендримеры, вероятно, обусловлена присутствием некоторого количества HI, образующегося во время процедуры кватернизации вMeOH/MeI. рН раствора оценивали каждый день просто с помощью универсальной индикаторной бумаги для определения рН. Для ЭХ-измерений проводили аналогичную процедуру. Эту процедуру проводили на колонке TSK-GEL G3000PWx1, с использованием в качестве элюента 0,1 М лимонной кислоты и 0,05% азида натрия в воде при скорости потока 0,5 мл/мин; и с использованием рефрактометрического детектора (детекция по показателю преломления, RI). 3. Эксперименты по связыванию дендримеров и ДНК с применением электрофореза в полиакриламидном геле (PAGE). Электрофорез в полиакриламидном геле (PAGE) осуществляли с использованием камеры BIO-RADMini-PROTEAN 3. Минигели с 17% плотностью поперечных связей получали путем смешивания 5,7 мл 30% акриламидного и 2,67% бис-акриламидного раствора с 1,0 мл буферного раствора (10), 3,3 мл Н 2 О; и получения 60 мкл свежего раствора 10% персульфата аммония (APS) и 10 мкл TEMED, который приготавливали перед заливкой геля между стеклянными пластинами. Для гелей с рН=4,4 добавляли двойное количество раствора TEMED и APS. Эти растворы оставляли на геле по меньшей мере на 1 ч, а затем проводили гель-электрофорез. Во всех случаях использовали ультрачистую воду с сопротивлением 18 МОм. В экспериментах, проводимых при рН 7, использовали буфер трис/борная кислота/EDTA (ТВЕбуфер; 10), содержащий 108 г триса (890 мМ), 55 г Н 3 ВО 3 (890 мМ) и 7,5 г EDTA (20 мМ) на литр. Для измерения при рН=4,4 использовали буфер, содержащий -аланин/уксусную кислоту, а именно 12 г уксусной кислоты (197 мМ) и 71,2 г Р-аланина (800 мМ) на литр (10). Буфер для загрузки содержал 0,2 мл 1% раствора бромфенолового синего в H2O, 25 мл буфера (1) и 15 мл глицерина. Образец для нанесения на гель состоял из соответствующим образом выбранных объемов раствора ДНК в воде, раствора дендримера в воде и раствора загрузочного буфера. На каждую дорожку геля загружали 10 мкл или 12,5 мкл образца так, чтобы загрузка ДНК на дорожку составляла примерно 0,4 мкг (если это не оговорено особо),и чтобы отношение зарядов дендримера/ДНК (CR) составляла примерно 2:1, 3:2, 1:1 или 1:2 для различных исследуемых комбинаций дендример/ДНК. Отношения зарядов вычисляли путем деления количества положительного заряда в дендримере (то есть общего количества третичных и четвертичных аминов в дендримерах) на количество фосфатных групп в ДНК. В качестве ДНК использовали одноцепочечный немеченый 33-мер. На каждом геле в качестве контроля одну дорожку оставляли для немеченой оцДНК,и одну дорожку оставляли для смеси этого 33-мера оцДНК с ФИТЦ-меченным 33-мером оцДНК. Некоторые дорожки не использовали. Минигели подвергали электрофорезу в течение примерно 45 мин при напряжении 200 В. Для проявления гелей применяли окрашивание серебром (Ag) с использованием стандартного набора BIORAD в соответствии со стандартным протоколом BIORAD. Во всех случаях получали белые линии на коричневатом фоне; при этом контрастность и яркость всех изображений гелей регулировали так, чтобы получить черные линии на белом или сероватом фоне. На фиг. A проиллюстрирована способность дендримеров G2(MeCl), G4(MeI), G4-ПЭГ(MeCl), G5 ПЭГ и G5-ПЭГ(MeI) связываться с 33-мерным ДНКзимом при рН=7. На фиг. B проиллюстрирован анализ на связывание в зависимости от концентраций при рН=7: загрузка ДНК возрастала в следующем порядке: 0,10,20,40,8 мкг на дорожку (с объемом загрузки 12,5 мкл), при этом анализ проводили при указанном отношении зарядов дендримера G4-PEG(MeI) и ДНК. 4. Клетки, животные и материалы. В данном исследовании были использованы следующие человеческие клеточные линии: клеточная линия карциномы молочной железы MCF7 и клеточная линия злокачественной меланомы Malme-3 М,которые были культивированы в минимальной поддерживающей среде Дульбекко. Клеточную линию-9 014327 карциномы яичника А 2780, клеточную линию аденокарциномы ободочной кишки НТ 29 и клеточную линию лейкоза K562-C1000 культивировали в RPMI 1640. В эти культуральные среды были добавлены 5% фетальная телячья сыворотка (FCS), 50 мкг/мл гентамицина и 2 мМ L-глутамина. В среду для культивирования клеток MCF7 и в среду для культивирования клеток Malme-3 М также добавляли 1 мМ пирувата натрия. Клетки культивировали при 37 С в инкубаторе с повышенной влажностью с 5% CO2. Все среды и добавки были закуплены у Invitrogen (Paisley, UK). Самцы мышей NMRI были закуплены у Janvier (Le Genest-St-Isle, France). Для проведения всех экспериментов на животных было получено разрешение у Комитета по соблюдению этических норм содержания животных. Соблюдение этических норм должно соответствовать стандартам, установленным(5'-меткаTGAGGGGCAGGCTAGCTACAACGACGTCGCGGx-3'), где x=3'dG5' были закуплены у Eurogentec (Seraing, Belgium). Для повышения стабильности 3'-3'-инверсию гуанина вводили в 3'-конец. 5. Клеточная токсичность модифицированных PPI-дендримеров. Профили токсичности модифицированных PPI-дендримеров различных генераций (G2, G2(MeI) и(Malme-3 М, K562, НТ 29 и MCF7) с использованием МТТ-теста. Для этой цели проводили анализ на цитотоксичность, в котором за 24 ч до трансфекции клетки высевали в 96-луночные планшеты при плотности 2000 клеток/лунку. Затем к этим клеткам добавляли дендример в различных концентрациях, в зависимости от генерации дендримера. Дендример 2-й генерации добавляли при концентрациях от 500 до 1 мкМ. Дендримеры 4-й и 5-й генерации добавляли при концентрациях от 100 до 0,2 мкМ и от 12,5 мкМ до 50 нМ соответственно. Клетки обрабатывали дендримером в течение 4 ч, а затем добавляли свежую полную среду, после чего инкубировали в течение 4 дней. После такого инкубирования клетки оценивали на митохондриальный фермент дегидрогеназу, который присутствует только в живых клетках. Если этот фермент присутствует, то добавленная "желтая" MTT-соль будет восстанавливаться этим ферментом с образованием синих формазановых кристаллов, которые могут быть затем растворены в ДМСО и оценены на спектрофотометре (max=540 нМ). После этого полученную величину абсорбции делят на величину абсорбции клеток, подвергнутых той же самой экспериментальной процедуре, но не обработанных дендримером, в результате чего определяют МТТ-жизнеспособность клеток по сравнению с контролем, как проиллюстрировано на всех фигурах. Протокол с использованием MTT также применяли для более детальной оценки цитотоксичности ряда модифицированных PPI-дендримеров 4-й генерации. Были протестированы ацетилированные или ПЭГилированные дендримеры, которые были кватернизироваными (MeI или MeCl) или некватернизированными, при различных концентрациях (от 1 мкМ, 2 мкМ, 5 мкМ, 10 мкМ до 20 мкМ); причем эти исследования проводили также с возрастающими количествами сыворотки (10%, 20%, 30%, 40%). Такие МТТ-тесты проводили на клетках А 2780, которые отбирали по их пригодности для использования в качестве in vivo модели в лабораторных экспериментах, проводимых авторами изобретения. 6. In vitro доставка флуоресцентно меченных ДНКзимов. Для определения поглощения ФИТЦ-меченного ДНКзима клетками проводили анализ на клеточном сортере с возбуждением флуоресценции (FACS), где в качестве трансфицирующих агентов были использованы дендримеры 4-й генерации. 2106 клеток А 2780 на лунку высевали в 6-луночный планшет за 24 ч до трансфекции. Дендример и ДНКзим разводили в культуральной среде до конечной концентрации 1 мкМ, в результате чего получали комплекс с отношением зарядов примерно 1. Период времени инкубирования, необходимый для образования комплекса между двумя указанными компонентами, составлял 15 мин. Затем этот комплекс добавляли к клеткам и после инкубирования в течение 4 ч клетки два раза промывали PBS, собирали путем трипсинизации и два раза промывали в буфере для проведенияFACS и в буфере для соскабливания клеток (Gene Therapy Systems, San Diego, CA). После этого в тот же самый образец добавляли иодид пропидия при конечной концентрации 20 мкг/мл для определения количества погибших клеток. И, наконец, клетки анализировали на поглощение ДНКзима с помощью проточной цитометрии (FACScan, Becton Dickenson). Нетрансфицированные клетки использовали в качестве фонового контроля для определения аутофлуоресценции клеток. Клетки, обработанные лишь одним ДНКзимом, использовали в качестве негативного контроля. Таким образом, при вычислении величин эффективности трансфекции, представленных на всех фигурах, учитывалась аутофлуоресценция и трансфекция, вызываемая лишь одним ДНКзимом. 7. In vivo доставка флуоресцентно меченных ДНКзимов. 7.1. Микроскопия. Для исследования in vivo доставки флуоресцентно меченных ДНКзимов в опухоль использовали систему визуализации для сканирования всего организма (WBI). Эта система визуализации состоит из флуоресцентного стереомикроскопа (Olympus) SZX 12, снабженного набором фильтров для белка, флуоресцирующего в зеленом диапазоне спектра (GFP) (возбуждение на длине волны 485-501 нМ; излучение на длине волны 510 нМ), и белка, флуоресцирующего в красном диапазоне спектра (RFP) (возбуждение- 10014327 на длине волны 540-552 нМ; излучение на длине волны 568-643 нМ) (более подробно см. Bakker A.,Floren W., Voeten J., Janssens В., Smets G., Wouters W. and Janicot M. (2001) Automation of whole body imaging of GFP-expressing tumors in living animals. G.I.Т. Imaging and Microscopy 03/2001:52-54). Изображения (752582 пикселей) получали со скоростью 1/60 с с помощью цветовой видеокамеры CV-M90 3-CCDRGB (Jai) и анализировали с помощью прикладной программы, разработанной в лаборатории на основе компонентов программного обеспечения IMAQ Vision и Lab VIEW (National Instruments). Внутриклеточную доставку ДНКзима исследовали на опухолевых срезах с помощью флуоресцентного микроскопа. Вкратце, по окончании каждого эксперимента на животном флуоресцирующие опухоли извлекали, подвергали криофиксации и изготавливали срезы. 12-мкм срезы наблюдали на флуоресцентном микроскопе AxioPlan2 (Zeiss), подсоединенном к камере с зарядовой связью AxioCam HR(Zeiss) и получали изображения с высоким разрешением (13001030 пикселей), которые затем анализировали с помощью компьютерной программы Axio Vision (Zeiss). Внутриклеточное распределение ФИТЦ-меченного ДНКзима (флуоресцирующего в зеленом диапазоне) исследовали с использованием ядерного красителя TOPRO3 (красного). Окрашивание на -актин осуществляли с использованием фаллоидина Bodipy (синего). 7.2. Введение ДНКзима in vivo. Самцам мышей NMRI инъецировали в паховую область клетки карциномы яичника 107 А 2780/200 мкл бессывороточной среды с помощью шприца калибра 2 6GA (BD, 26 GA 3/8, 1 мл). Через 14 дней опухоль достигала размера, адекватного для проведения измерений с использованием системы WBI. Мышам первой группы, то есть контрольным мышам (n=5), внутривенно (i.v.) вводили 1 мг ФИТЦконъюгированного ДНКзима c-myc (ФИТЦ-ДНКзим), а мышам тест-группы (n=5) вводили препараты комплекса "дендример-ДНКзим", содержащие 1 мг ФИТЦ-ДНКзима и примерно 3 мг G4-ПЭГ(MeI) с получением CR=1 (то есть конечная концентрация ДНК и дендримера у мышей предположительно составляла 50 мкМ, если объем разведения в крови у мышей составляет примерно 2 мл). Внутривенные(i.v.) инъекции вводили в хвостовую вену при скорости потока 200 мкл/10 с. Через 45' (минут) мышей(n=10) умерщвляли, и опухоль сразу подвергали криофиксации в среде TissueTek (Triangle BiomedicalSciences). Помимо этих обработанных мышей (n=10) было использовано несколько необработанных мышей в качестве негативного контроля. Мышам второй группы (n=10) инъецировали тот же самый комплекс "ДНКзим-дендример" и через 24 ч проводили анализ на флуоресценцию опухоли с использованием системы WBI. Через 24 ч мышей этой второй группы умерщвляли и внутренности оценивали на флуоресценцию. Мониторинг клиренса ДНКзима проводили с помощью WBI через 5' (минут), 15' , 30' и 45' после i.v. инъекции (для мышей первой группы) и через 24 ч после инъекции (для мышей второй группы). Результаты и обсуждение 1. Синтез и характеризация дендритных агентов для переноса нуклеиновых кислот. Синтез полипропилениминовых трансфицирующих агентов схематически представлен на фиг. 2,где проиллюстрированы стадии конверсии дендримера 2-й генерации. PPI-Дендримеры других генераций были подвергнуты конверсии аналогичным образом. На первой стадии концевая группа первичного амина была амидирована посредством реакции с активированным производным карбоновой кислотыRCOOH (в данном случае были использованы либо ангидрид уксусной кислоты, либо производное галлилхлорида; причем могут быть также использованы и другие типы активированных карбоновых кислот,см., например, Kreider J.L. et al., 2001). На второй стадии внутренние третичные амины кватернизировали посредством реакции с метилиодидом. В третьей стадии иодидный противоанион был заменен хлоридом. Все полученные дендримеры растворялись в воде и в спиртах, а большинство из них также растворялись в более аполярных растворителях, таких как хлороформ. Зарегистрированные данные 1 Н-ЯМР и 13 С-ЯМР соответствовали предполагаемым структурам. В CDCl3 и в CD3OD все протоны и ядра углеродов внутренней части дендримера давали очень широкие линии, особенно у дендримеров высшей генерации. После метилирования (кватернизации) широкие линии примерно 2,2-2,5 м.д. для протонов метилена, смежного с третичными аминами, имели сдвиг сигнала до 3,5-4,0 м.д. для ацетилированных дендримеров и примерно до 2,7-2,9 м.д. для ПЭГилированных дендримеров. В спектрах 13 С-ЯМР, полученных для дендримеров обоих типов, можно видеть, что сдвиг сигналов этих атомов углерода метилена составляет примерно от 50-55 до 60 м.д., а при введении метильных групп появляются дополнительные сигналы примерно 50 м.д. В D2O линии сигналов метилена, следующие за сигналами третичных или четвертичных аминов, были менее широкими. Все ЯМР-данные соответствовали результатам, которые сообщались ранее для других кватернизированных дендримеров. Следует отметить, что эти ЯМР-данные подтвердили, что кватернизация проходила достаточно успешно, однако, не было подтверждено, что было осуществлено полное метилирование, то есть не все третичные амины были обязательно превращены в кватернизированные катионные группы. Можно получить данные о массе некватернизированных дендримеров низших генераций, а МС-анализы кватернизированных дендримеров пока остаются безуспешными, что, вероятно, обусловлено присутствием множества зарядов на дендритных молекулах. Для удобства все структуры, представленные в настоящей- 11014327 заявке, являются идеальными полностью метилированными молекулами (фиг. 2). Для окончательной характеризации может быть проведен анализ полученных дендримеров с помощью эксклюзионной хроматографии (ЭХ), то есть методом, который используется для исследования молекулярной массы (распределения) макромолекул. С использованием колонки TSK-GEL G3000PWx1 и водных элюентов при выбранном рН (например, в буфере, содержащем 0,1 М лимонную кислоту при пониженных величинах рН) могут быть проанализированы все полученные PPI-дендримеры как некватернизированные, так и кватернизированные. Этот метод был применен для оценки стабильности полученных дендримеров (см. следующий раздел). 2. Стабильность модифицированных PPI-дендримеров в воде. Сконструированные и приготовленные дендримеры могут быть использованы в качестве трансфицирующих агентов, только если будет обеспечена их стабильность в физиологических условиях. Поэтому отбор дендримеров проводили путем ежедневного мониторинга 1 Н-ЯМР- и 13 С-ЯМРспектров растворов D2O указанных дендримеров, которые выдерживали примерно при 37 С в течение 4 дней. Спектры регистрировали для дендримеров 2-й генерации G2, G2(MeI) и G2(MeCl) и дендримера 4 й генерации G4(MeI). Все дендримеры обнаруживали аналогичные спектральные характеристики до, во время и после проведения теста в течение 4 дней, а поэтому какого-либо значительного гидролиза дендримеров в имитируемых физиологических условиях не наблюдалось. Дополнительное подтверждение стабильности (кватернизированных) дендримеров было получено путем ЭХ-мониторинга водных растворов дендримеров 4-й генерации G4-ПЭГ и G4-ПЭГ(MeCl), которые выдерживали при 37 С. Все ЭХ-данные проиллюстрированы на фиг. 3. В эксперименте, проводимом в течение нескольких дней, было обнаружено, что по своей форме ЭХ-хромотограммы образцов совсем не изменялись, что указывало на отсутствие деградации, которая должна приводить к образованию вещества с более низкой молекулярной массой. ЭХ-кривая имела плечо на стороне хроматограммы с более высокой молекулярной массой (слева). Предположительно это плечо указывает на присутствие ограниченного количества димеризованных молекул дендримера. При этом следует отметить, что такое плечо также присутствует на ЭХ-хроматограмме, полученной для имеющего концевой амин дендримера четвертой генерации, который был отправной точкой синтеза. 3. Эксперименты по связыванию дендримера с ДНКзимом, проводимые с помощью электрофореза в полиакриламидном геле (PAGE). Электрофорез в полиакриламидном геле (PAGE) представляет собой метод, который часто используется в анализе белков и нуклеиновых кислот. Элюирование исследуемых молекул зависит от их размера и заряда. Так, например, электрофорез в ДСН-ПААГ (при добавлении додецилсульфата натрия в буфер для геля) применяется для анализа молекулярной массы (не подвергнутых укладке) белков. В данном случае электрофорез в полиакриламидном геле (PAGE) осуществляли для оценки способности нескольких полипропилениминовых дендримерных структур связываться с молекулой ДНКзима(более подробно см. раздел "Эксперименты"). После элюирования и окрашивания свободный ДНКзим появляется в виде одной полосы на геле. Если при смешивании ДНКзима с другими молекулами происходит связывание, то характер элюирования ДНКзима в этой смеси по сравнению со свободным ДНКзимом изменяется по мере изменения объема и/или заряда ДНК-молекул. Это приводит к появлению ДНКполосы в том же самом положении, но с более низкой интенсивностью (фракция ДНК, образующей комплекс), к появлению полосы в другом положении на геле или к полному исчезновению этой полосы. Для оценки связывающей способности серии полученных дендримеров ДНКзим и дендример смешивали в различных соотношениях, причем отношение зарядов определяли как число третичных + четвертичных аминов в данном дендримере, деленное на число отрицательно заряженных фосфатных групп на ДНК. Было проанализировано связывание молекулы ДНКзима с различными дендримерами, указанными в табл. 2. В данном случае были выбраны три геля, которые показаны ниже на фиг. 4 для иллюстрации результатов, где указанные гели были приготовлены и подвергнуты электрофорезу в ТВЕ-буфере при рН=7. В "Дополнительной информации" имеются сведения и о других известных ПААГ-гелях. Гель А был использован для сравнения ацилированных и кватернизированных метилиодидом дендримеров G2(MeI) и G4(MeI). При этом очевидно, что дендример четвертой генерации лучше связывается с ДНКзимом, чем его аналог второй генерации, который, вероятно, не обладал связывающей активностью при исследуемой концентрации. Это наблюдение можно объяснить тем фактом, что дендримерG4(MeI) имеет в два раза большее число катионных групп на молекулу (30 против 14), а поэтому такая конструкция больше соответствует присутствию 33 отрицательных зарядов в ДНКзиме. Гель В был использован для сравнения ацетилированных дендримеров четвертой генерации, кватернизированных(G4(MeCl или некватернизированных (G4). Оба дендримера обладали высокой эффективностью связывания с ДНКзимом, но кватернизированные молекулы G4(MeCl) обладали лучшей способностью к связыванию; причем даже при отношении зарядов дендример/ДНК = 1/2 происходило связывание почти всей молекулы. И, наконец, гель С был использован для сравнения модифицированных галлатом гликоля дендримеров четвертой генерации, кватернизированных (G4-ПЭГ(MeI или некватернизированных (G4 ПЭГ). И в данном случае было очевидно, что кватернизированные молекулы лучше связываются с ДНКзимом, и полученные результаты также показали, что ацилированные G4-дендримеры (см. гель В)- 12014327 обладают лучшей способностью к связыванию с ДНК, чем ПЭГилированные G4-дендримеры, поскольку для эффективного связывания с ДНКзимом требуется большее количество ПЭГилированных дендримеров. Были также исследованы связывающие свойства дендримеров при рН=4,4 с использованием буфера, содержащего уксусную кислоту/р-аланин (гели не показаны). Было обнаружено, что по сравнению с наблюдениями, проводимыми при рН=7, исследуемые некватернизированные дендримеры лучше связываются с ДНК, тогда как кватернизированные дендримеры связываются с ДНК в меньшей степени. Этот результат можно объяснить протонированием некватернизированных дендримеров при более низких величинах рН, то есть такие дендримеры также имеют множество внутренних катионных сайтов, что приводит к стимуляции связывания с ДНКзимом. В конце концов, для проведения исследований по связыванию при различных концентрациях был выбран G4-ПЭГ(MeI). ДНК загружали на дорожку в количестве 0,1, 0,2, 0,4, 0,8 и 1,6 мкг в 12,5 мкл, а отношения зарядов веществ варьировались от 2:13:21:1 (избыток дендримера). Как и следовало ожидать, ПААГ-исследования показали, что при более низких концентрациях уровень связывания снижался: при загрузке 0,1 мкг ДНК почти не связывалась, а при загрузке 0,8 мкг или выше связывалась вся ДНК, даже при наименьшем отношении зарядов, составляющем 1:1 (см. дополнительную информацию,касающуюся ПААГ-гелей, приобретенных для проведения исследования по связыванию при данной концентрации). Эти результаты продемонстрировали, что синтезированные дендримеры с множеством внутренних катионных групп могут связываться с 33-олигомером оцДНКзима при концентрациях примерно 40 мкг ДНК на мл (соответствующих молярной концентрации примерно 4 мкМ) и при отношениях зарядов примерно 2:1-1:1 (небольшой избыток дендримера). Для эффективного образования комплексов с ДНКкомпонентом обычно требуется, чтобы трансфицирующие агенты, описанные в литературе, имели более высокие концентрации, и/или чтобы отношение их заряда к заряду ДНК было более высоким (см., например, работу Haensler J., 1993, где описаны некоторые тесты на связывание, которые были проведены при концентрациях ДНК 200 мкг/мл). Кроме того, исследования по связыванию G4-ПЭГ(MeI) при различных концентрациях показали, что связывание дендримера с ДНКзимом является обратимым, что позволяет данному комплексу диссоциироваться и высвобождать ДНКзим. 5. In vitro токсичность модифицированных PPI-дендримеров. Для оценки возможности использования PPI-дендримеров в качестве агентов для переноса гена было исследовано токсическое действие отобранных модифицированных PPI-дендримеров на 4 различные клеточные линии, MCF7, Malme-3M, HT29 и K562-С 1000, с применением МТТ-теста. Ацилированные дендримеры 2-й генерации G2, G2(MeI) и G2(MeCl) не оказывали токсического воздействия на все 4 клеточные линии при концентрациях ниже 100 мкМ, а ацилированные дендримеры 4-й генерации G4,G4(MeI) и G4(MeCl) не оказывали какого-либо токсического воздействия на эти клетки при концентрации ниже 20 мкМ. И, наконец, дендримеры 5-й генерации G5-ПЭГ и G5-ПЭГ(MeI) не обнаруживали токсичности при самых высоких исследуемых концентрациях (2,5 мкМ). Эти концентрации в 20, 20 и 5 раз превышали концентрации соответствующих дендримеров 2-й, 4-й и 5-й генерации, которые были использованы в стандартных экспериментах по трансфекции in vitro. В частности, была исследована токсичность дендримеров 4-й генерации, поскольку было обнаружено, что дендримеры 4-й генерации, связывались с ДНКзимом с большей эффективностью, чем их аналоги 2-й генерации (см. ПААГ-тесты, описанные выше). Каждый из шести исследуемых дендримеров (то есть G4, G4(MeI), G4(MeCl), С 4-ПЭГ, G4-ПЭГ(MeI) и G4-ПЭГ(MeCl) оценивали на его токсичность по отношению к клеткам с применением МТТ-теста; при этом были использованы различные концентрации дендримеров (1 мкМ, 2 мкМ, 5 мкМ, 10 мкМ и 20 мкМ) и концентрации сыворотки (10%, 20%, 30% и 40% фетальная телячья сыворотка). Как можно видеть на фиг. 5, при концентрациях 1-5 мкМ все шесть дендримеров не обладали какой-либо специфической токсичностью, и после обработки в течение 4 дней выживали 70% клеток. Однако при более высоких концентрациях, в частности, G4-ПЭГ(MeI) обладал определенной токсичностью, поскольку выживаемость клеток значительно снижалась до уровня ниже 50%. Другие дендримеры все же вызывали, хотя и низкую, гибель клеток на уровне примерно 30% при концентрациях 10 мкМ, и обладали частичной токсичностью на уровне 30-60% при 20 мкМ. G4 ПЭГ(MeCl) сохранял свою низкую токсичность даже при концентрации 20 мкМ. На фиг. 6 представлены данные того же самого МТТ-теста, но в другом формате, а именно в зависимости от категории дендримера, и эти данные указывают на увеличение токсичности при более высоких концентрациях. При получении данных, представленных на фиг. 5 и 6, использовали 10% сыворотку. Каждый из шести дендримеров G4 был также протестирован на его токсичность в присутствии возрастающих уровней сыворотки, а именно от 10 до 40%. Все дендримеры обладали более низким токсическим действием на клетки при более высоких количествах используемой сыворотки (фиг. 7). Примечательно то, что при использовании 20-40% сыворотки, токсичность дендримеров, вероятно, (почти) не зависела от используемой концентрации; то есть даже при концентрации 20 мкМ, выживаемость клеток составляла значительно выше 50% для всех дендримеров, за исключением дендримера G4-ПЭГ(MeI),который становился токсичным при концентрациях выше 10 мкМ.- 13014327 Исходя из описанных здесь МТТ-тестов на токсичность, можно сделать вывод, что почти все сконструированные и синтезированные PPI-дендримеры обладали низкими уровнями токсичности. Это свойство соединений согласно изобретению имеет очень важное значение, поскольку низкая токсичность или отсутствие токсичности дендримеров является необходимыми (sine qua none) условием для их успешного применения в медицине, а в частности в генотерапии. Возможно, что в кватернизированных дендримерах некоторую степень токсичности сообщают противоанионы, отсюда очевидно, что вместо иодидов желательно использовать хлоридные противоанионы. 6. In vitro перенос ДНКзима с использованием модифицированных PPI-дендримеров G4. Перенос ДНКзима с использованием модифицированных PPI-дендримеров 4-й генерации в качестве агентов для доставки исследовали на клетках карциномы яичника А 2780 с помощью FACS-анализа. Во всех тестах по трансфекции использовали отношение зарядов дендример:ДНКзим (CR), равное 1, и концентрацию 1 мкМ для сохранения низкого уровня токсичности (см. МТТ-тесты на токсичность, описанные выше) и для поддерживания тех интервалов концентраций, при которых, предположительно,происходит связывание ДНК с дендримером (см. ПААГ-тест на связывание, описанный выше). Для имитации условий in vivo исследования проводили при возрастающих уровнях сыворотки в среде (10%, 20%,30% и 40% FCS). Все 6 дендримеров обнаруживали высокую эффективность трансфекции, которая обычно превышала 80%, причем наилучшие результаты давали ацетилированные кватернизированные дендримерыG4(MeI) и G4(MeCl) (фиг. 8). Примечательно то, что при сравнении некватернизированной системы G4 ПЭГ с кватернизированными системами G4-ПЭГ(MeI) и G4-ПЭГ(MeCl) было обнаружено, что дендримеры, принадлежащие к классу ПЭГилированных дендримеров (фиг. 8 В), почти не отличались по своей эффективности. И, наконец, тесты по трансфекции показали, что количество сыворотки в среде почти не оказывает влияния на эффективность доставки in vitro. Свободный ДНКзим, то есть не содержащий дендримера, используемого в качестве трансфицирующего агента, переносился с эффективностью только 510%, как было установлено в контрольном эксперименте. В подтверждение тестов на токсичность, в этих тестах на доставку in vitro было установлено, что токсичность по отношению к клеткам составляла примерно 15%, на что указывало окрашивание иодидом пропидия. Эффективность переноса, обнаруженная для дендримерных систем, была аналогична эффективности, наблюдаемой в тех же условиях, но с использованием катионного липосомного трансфицирующего агента DOTAP (Roche) (MW = приблизительно 700). Однако такая липосома может нейтрализовать только один отрицательный заряд на молекулу, а поэтому количество, необходимое для достиженияCR=1, должно быть таким, при котором смесь для трансфекции будет иметь высокую токсичность. Отсюда следует, что метод доставки с использованием DOTAP, очевидно, не может быть применен для доставки in vivo. 7. In vivo доставка ДНКзима с использованием модифицированных PPI-дендримеров G4. Предварительные эксперименты in vivo, описанные в настоящей заявке, были проведены с использованием дендримера G4-ПЭГ(MeI). Ацетилированные кватернизированные дендримеры G4(MeI) иG4(MeCl), которые обнаруживали наиболее убедительную способность к переносу in vitro, не были использованы для этой цели, поскольку они давали нерастворимые осадки после их смешивания с ДНКзимом в концентрациях, необходимых для получения образцов в целях их исследований in vivo (например,G4(MeI) и ДНКзим дают белый осадок при их смешивании при концентрации примерно 700 мкМ, то есть при концентрации, которая значительно превышает концентрацию, используемую в тестах на связывание, токсичность или перенос in vitro, описанных выше). После внутривенного введения мышам комплекса дендример/ФИТЦ-меченный ДНКзим флуоресценцию визуализировали с применением системы сканирования всего организма (WBI). Через 5 мин наблюдалась флуоресценция всего организма. Через 45 мин у трех из пяти мышей поверхностная флуоресценция больше не детектировалась с помощью WBI, хотя после вскрытия наблюдалась локально аккумулируемая флуоресценция в начальной части двенадцатиперстной кишки. Однако у двух из пяти мышей обнаруживалась слабодетектируемая поверхностная флуоресценция в области, примыкающей к опухоли. Для того чтобы определить, имеет ли флуоресценция, наблюдаемая с помощью WBI, действительно внутриклеточную локализацию, эти два образца были проанализированы с помощью конфокального микроскопа. При вскрытии было обнаружено, что через 24 ч после инъекции отсутствовала как внешняя, так и внутренняя флуоресценция. Из двух образцов, в которых визуально наблюдалась аккумуляция ФИТЦ-метки, приготавливали срезы опухоли, и эти срезы анализировали на конфокальном микроскопе, в результате чего была обнаружена интенсивная пятнообразная аккумуляция ФИТЦ-метки в ткани. Причина такой интенсивной пятнообразной аккумуляции в ядре пока еще не ясна. Высокая совместная локализация с красителемTOPRO3 (красным) указывала на присутствие в ядре ФИТЦ-метки. Для наблюдения уровней -актина в клетках проводили дополнительное окрашивание (фаллоидиновым Bodipy (синим. В срезах, полученных из опухолей, вырезанных у обработанных мышей, наблюдались большие полости, подобные дырам, и было видно, что они присутствовали возле большинства аккумулированных- 14014327 ФИТЦ-меток. Срезы, полученные из опухолей, взятых у необработанных мышей, не имели подобных структур с полостями. Также пока не ясно, как и почему образуются такие полости. Для того чтобы определить, служат ли эти полости в качестве ловушки для олиго-ДНК, или они создаются при образовании комплекса "дендример-ДНКзим" или части этого комплекса (одного дендримера), необходимо провести отдельное дополнительное исследование. Необработанные образцы обнаруживали гораздо лучшее окрашивание на -актин в области ядра. Однако такое окрашивание почти не обнаруживалось в обработанных образцах в областях, которые содержали ФИТЦ-метку. Выводы. С обнаружением новых молекул, например короткой интерферирующей РНК ки)РНК) и микроРНК ми)РНК), в области, относящейся к посттранскрипционному "молчанию" генов, наблюдается значительный прогресс, вызванный все возрастающим интересом к эффективной и безопасной доставке лекарственных средств с использованием трансфицирующих агентов в целях проведения олигонуклеотидной терапии. Хотя большинство коммерчески доступных агентов для доставки позволяет добиться высокой эффективности трансфекции и низкой токсичности по отношению к клеткам различных типов широкого ряда, однако, в настоящее время ни один из этих агентов не обладает свойствами, подходящими для их использования в качестве эффективного инструмента для доставки лекарственных средств invivo. В настоящей заявке были описаны модифицированные PPI-дендримеры, некоторые из которых никогда не были описаны ранее и которые могут быть легко получены и использованы в качестве трансфицирующих агентов в генотерапии. Было продемонстрировано, что сконструированные и синтезированные PPI-дендримеры являются стабильными в водных средах и способны обеспечивать in vivo доставку олигомерных оцДНКзимов в клетки карциномы яичника, оказывая при этом лишь незначительное токсическое воздействие на клетки. Такая доставка является эффективной, поскольку связывание и перенос ДНКзима может происходить при низких концентрациях и низких отношениях зарядов (то есть с низким избыточным количеством дендримера, способного к трансфекции). Кроме того, предварительные эксперименты in vivo показали, что такая доставка является вполне осуществимой. И наконец, предварительные исследования по связыванию, проводимые с помощью электрофореза в ПААГ, показали, что двухцепочечная киРНК (44 нуклеотида) также связывается с описанными здесь PPI-дендримерами, а поэтому такое описание связывания и переноса нуклеиновых кислот не ограничивается лишь оцДНКзимом, используемым в настоящей заявке в качестве модели. Описание графического материала Фиг. 1 - молекулярная структура PPI-дендримера второй генерации. Фиг. A - способность дендримеров G2(MeCl), G4(MeI), G4-ПЭГ(MeCl), G5-ПЭГ и G5-ПЭГ(MeI) связываться с 33-мерным ДНКзимом при рН=7. Фиг. B - исследование по связыванию при различных концентрациях и при рН=7. Фиг. 2 - синтез полипропилениминовых трансфицирующих агентов, где проиллюстрированы стадии конверсии дендримера 2-й генерации. Фиг. 3 - стабильность модифицированных PPI-дендримеров в воде (ЭХ-данные). Фиг. 4 - эксперименты по связыванию дендримера с ДНКзимом, проводимые с помощью электрофореза в полиакриламидном геле (ПААГ). Фиг. 5 - in vitro токсичность модифицированных PPI-дендримеров: данные МТТ-теста в зависимости от отношения зарядов. Фиг. 6 - in vitro токсичность модифицированных PPI-дендримеров: данные МТТ-теста в зависимости от категории дендримера. Фиг. 7 - in vitro токсичность модифицированных PPI-дендримеров при возрастающих концентрациях сыворотки: данные МТТ-теста в зависимости от отношения зарядов и категории дендримера. Фиг. 8 - эффективность модифицированных PPI-дендримеров с точки зрения их способности к in vitro трансфекции: FACS-анализ для различных категорий дендримеров. Список литературы 1. Bakker, A., Floren, W., Voeten, J., Janssens, В., Smets, G., Wouters, W., and Janicot, M. (2001): Automation of whole body imaging of GFP-expressing tumors in living animals. G.I.T. ImagingMicroscopy,03/2001:52-54. 2. Bielinska, A., Kukowska-Latallo, J.F., Johnson, J., Tomalia, D.A., and Baker, J.R., Jr. (1996): Regulation of in vitro gene expression using antisense oligonucleotides or antisense expression plasmids transfectedpolypropylenimine dendrimers are effective gene-transfer agents. Pharm. Res., 19:960-967. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Полипропилениминовый дендример 1, 2, 3, 4 или 5 генерации, представляющий собой модифицированный дендример, неполный модифицированный дендример или их смеси, включающий внешние концевые группы и внутренние аминогруппы, отличающийся тем, что: а) по существу, все внешние концевые группы представляют собой группы формулы (I) где каждый из m независимо равен 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11 или 12; и(b) по существу, все внутренние аминогруппы представляют собой катионные четвертичные аммониевые группы. 2. Полипропилениминовый дендример 1, 2, 3, 4 или 5 генерации, представляющий собой модифицированный дендример, неполный модифицированный дендример или их смеси, отличающийся тем, что он получен посредством:(а) первой реакции полипропилениминового дендримера, содержащего внешние концевые аминогруппы и внутренние третичные аминогруппы, с ацилирующим агентом, выбранным из группы, состоящей из ангидрида уксусной кислоты, C1-10 алкилгалогенида, полиэтиленгликолевой кислоты формулы где каждый из m независимо равен 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11 или 12, а X представляет собой галогенид; и(b) реакции продукта, полученного на стадии (а), с кватернизирующим агентом. 3. Дендример по п.2, отличающийся тем, что галогенидом является хлорид. 4. Фармацевтическая композиция, подходящая для введения млекопитающему, отличающаяся тем,что она содержит: (а) полипропилениминовый дендример по любому из пп.1-3 и (b) анионное биологически активное терапевтическое средство. 5. Композиция по п.4, отличающаяся тем, что анионное терапевтическое средство выбрано из группы, состоящей из фармацевтически активных соединений, нуклеиновых кислот, нуклеотидных последовательностей, олигомеров ДНК и РНК, полинуклеотидов, ДНКзимов, одноцепочечных и двухцепочечных ДНК, одноцепочечных и двухцепочечных РНК, антисмысловых РНК и ДНК, РНК типа "головки молотка", короткой интерферирующей РНК, микроРНК, рибозимов или их комбинаций. 6. Композиция по п.5, отличающаяся тем, что анионное терапевтическое средство имеет молекулярную массу 5000 Да или менее. 7. Применение дендримера по любому из пп.1-3 в качестве агента для переноса анионного биологически активного терапевтического средства. 8. Применение фармацевтической композиции по любому из пп.4-6 в генотерапии. 9. Применение фармацевтической композиции по любому из пп.4-6 для лечения раковых опухолей печени и почек, острого лимфобластного лейкоза, острого миелоидного лейкоза, саркомы Юинга, трофобластной карциномы, возникающей в период беременности, болезни Ходжкина, неходжкинской лимфомы, лимфомы Беркитта, диффузной крупноклеточной лимфомы, фолликулярной смешанной лимфомы, лимфобластной лимфомы, рабдомиосаркомы, карциномы яичек, опухоли Вильмса, карциномы заднего прохода, карциномы мочевого пузыря, карциномы молочной железы, хронического лимфоцитарного лейкоза, хронического миелогенного лейкоза, ретикулоэндотелиоза, карциномы головы и шеи, карциномы легких (мелкоклеточной), множественной миеломы, фолликулярной лимфомы, карциномы яичника, опухоли головного мозга (астроцитомы), карциномы шейки матки, карциномы ободочной кишки,гепатоцеллюлярной карциномы, саркомы Капоши, карциномы легких (немелкоклеточной), меланомы,карциномы поджелудочной железы, карциномы предстательной железы, саркомы мягких тканей, карциномы молочной железы, карциномы ободочной кишки (на стадии III), остеогенной саркомы, карциномы яичника (на стадии III) или их комбинаций.
МПК / Метки
МПК: A61K 31/166, C07C 233/36, A61P 35/00, A61K 31/16, C07C 235/50, C07C 235/10
Метки: применение, дендримеры, содержащая, фармацевтическая, полипропилениминовые, композиция, опухолей, модифицированные, лечения, злокачественных
Код ссылки
<a href="https://eas.patents.su/24-14327-modificirovannye-polipropileniminovye-dendrimery-soderzhashhaya-ih-farmacevticheskaya-kompoziciya-i-ih-primenenie-dlya-lecheniya-zlokachestvennyh-opuholejj.html" rel="bookmark" title="База патентов Евразийского Союза">Модифицированные полипропилениминовые дендримеры, содержащая их фармацевтическая композиция и их применение для лечения злокачественных опухолей</a>
Предыдущий патент: Способ получения углеводородных бензиновых фракций из синтез-газа
Следующий патент: Ротавирусная вакцина, индуцирующая гетеротипический перекрестный иммунитет
Случайный патент: Медицинский смесительный кислородный клапан