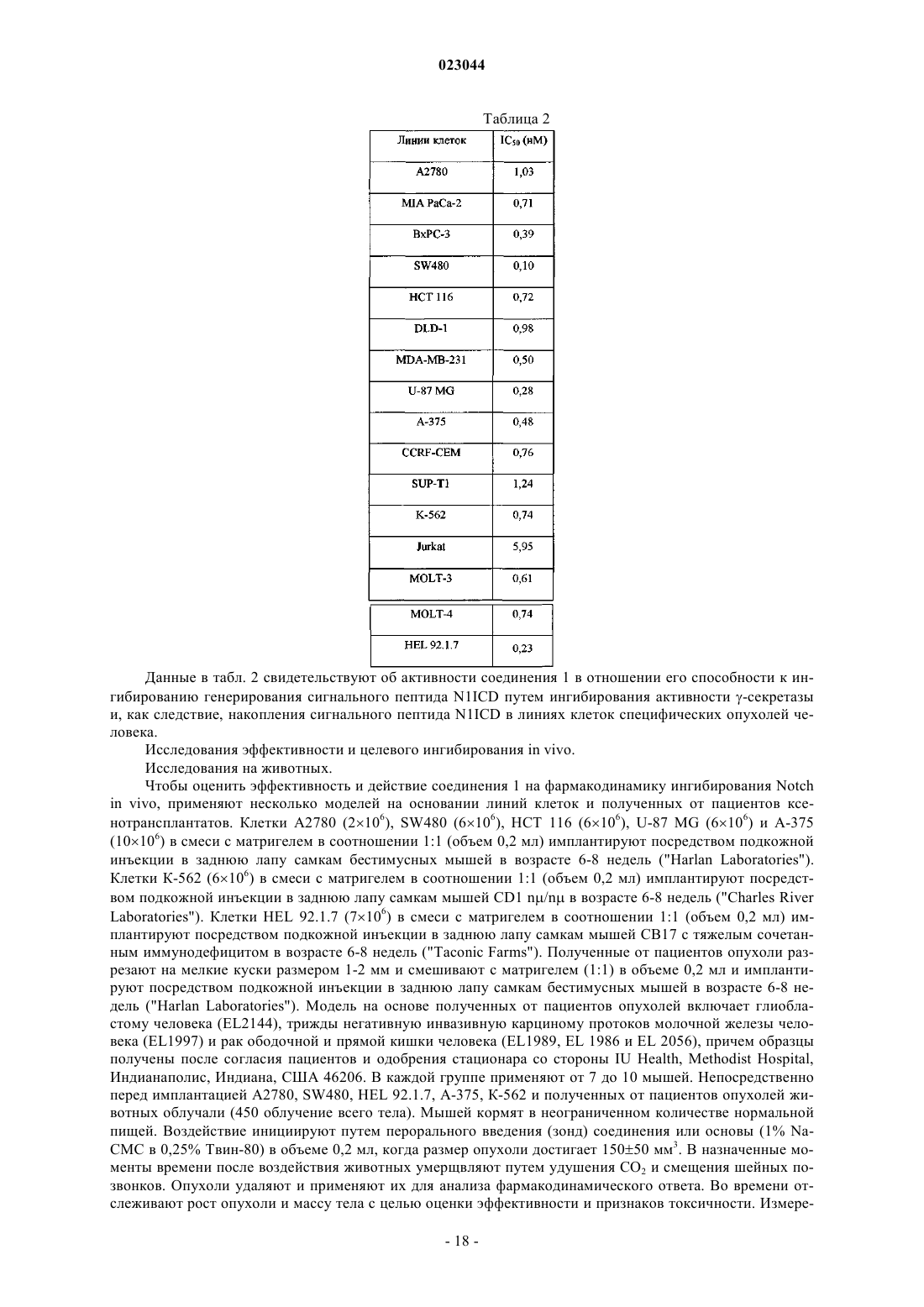
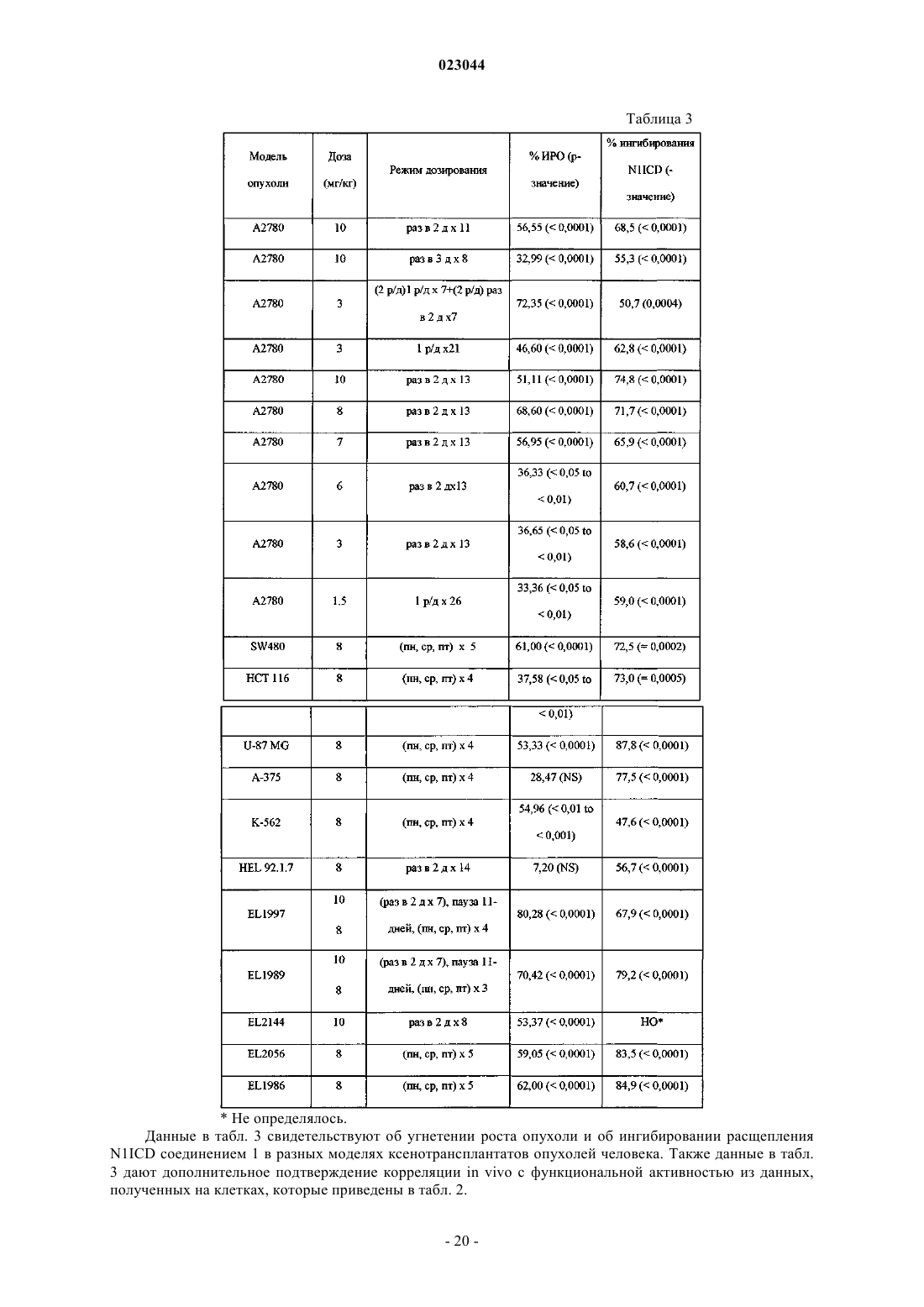
Соединения-ингибиторы сигналинга, опосредуемого рецептором notch
Формула / Реферат
1. Соединение, имеющее структуру
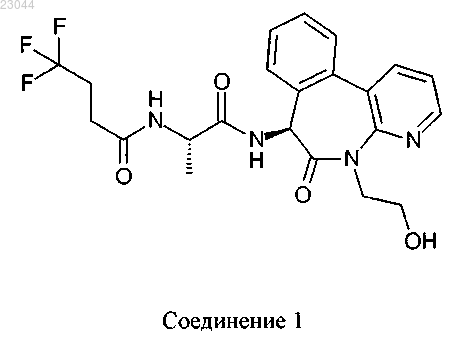
или его фармацевтически приемлемая соль или гидрат.
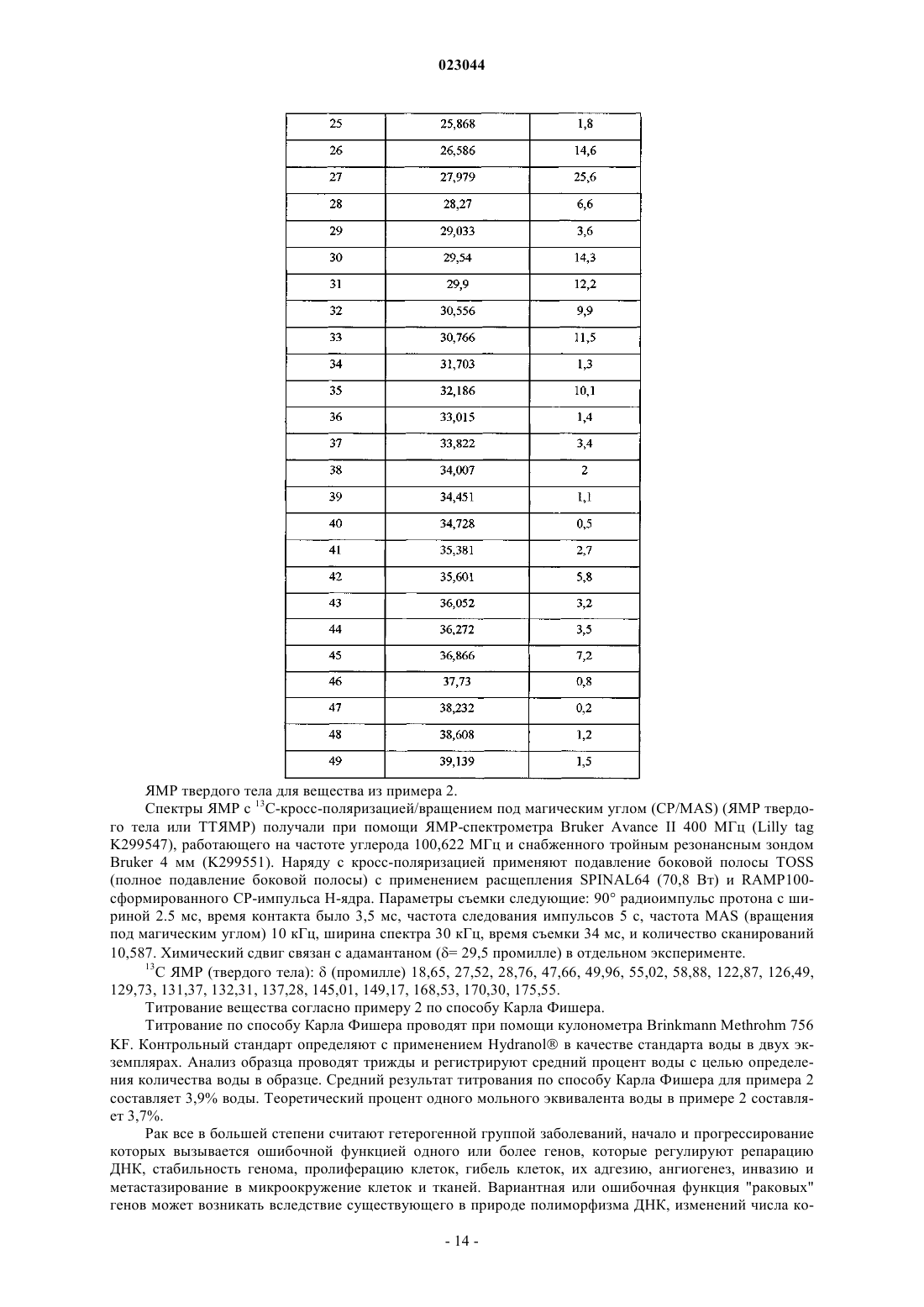
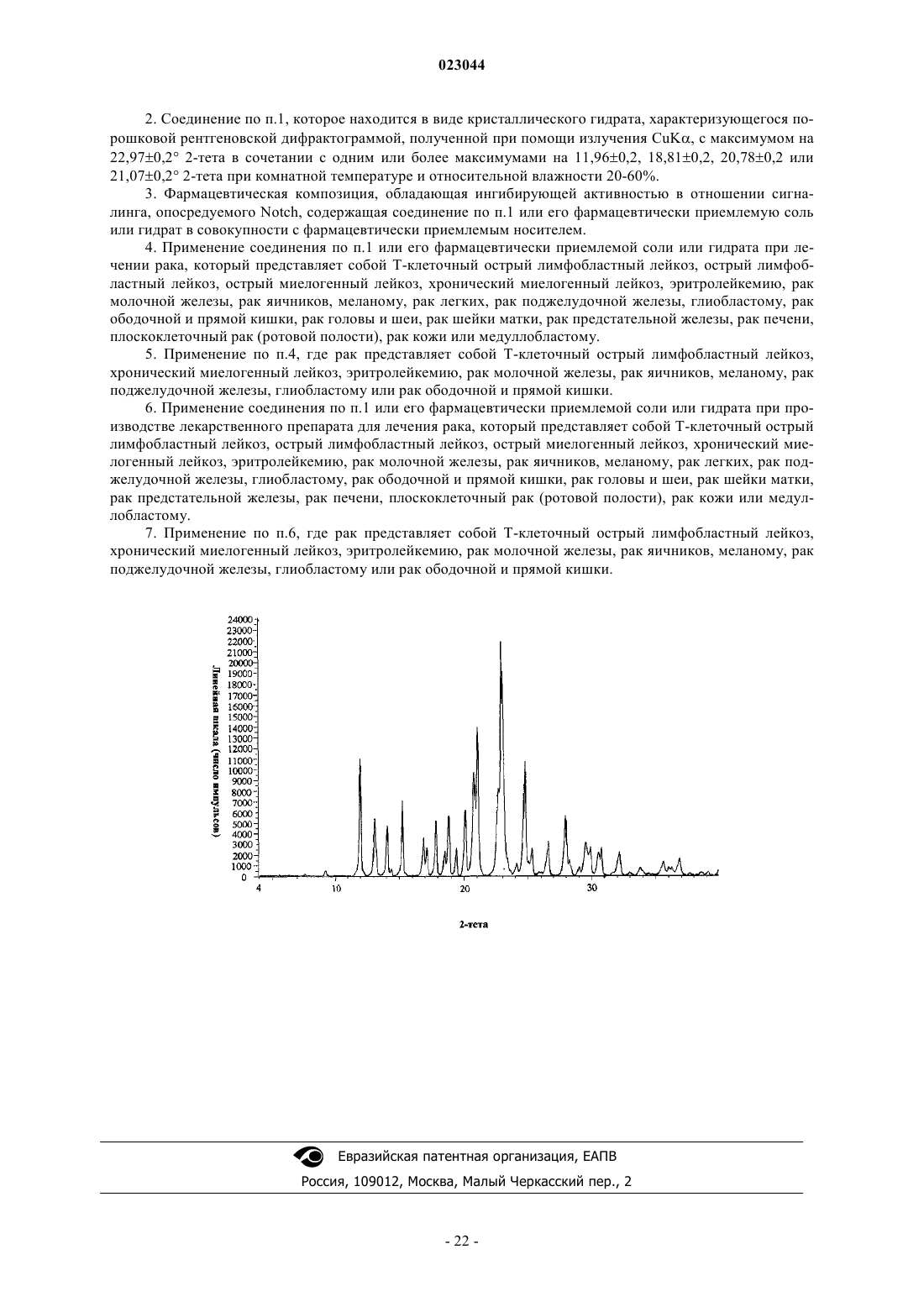
2. Соединение по п.1, которое находится в виде кристаллического гидрата, характеризующегося порошковой рентгеновской дифрактограммой, полученной при помощи излучения CuKα, с максимумом на 22,97±0,2° 2-тета в сочетании с одним или более максимумами на 11,96±0,2, 18,81±0,2, 20,78±0,2 или 21,07±0,2° 2-тета при комнатной температуре и относительной влажности 20-60%.
3. Фармацевтическая композиция, обладающая ингибирующей активностью в отношении сигналинга, опосредуемого Notch, содержащая соединение по п.1 или его фармацевтически приемлемую соль или гидрат в совокупности с фармацевтически приемлемым носителем.
4. Применение соединения по п.1 или его фармацевтически приемлемой соли или гидрата при лечении рака, который представляет собой Т-клеточный острый лимфобластный лейкоз, острый лимфобластный лейкоз, острый миелогенный лейкоз, хронический миелогенный лейкоз, эритролейкемию, рак молочной железы, рак яичников, меланому, рак легких, рак поджелудочной железы, глиобластому, рак ободочной и прямой кишки, рак головы и шеи, рак шейки матки, рак предстательной железы, рак печени, плоскоклеточный рак (ротовой полости), рак кожи или медуллобластому.
5. Применение по п.4, где рак представляет собой Т-клеточный острый лимфобластный лейкоз, хронический миелогенный лейкоз, эритролейкемию, рак молочной железы, рак яичников, меланому, рак поджелудочной железы, глиобластому или рак ободочной и прямой кишки.
6. Применение соединения по п.1 или его фармацевтически приемлемой соли или гидрата при производстве лекарственного препарата для лечения рака, который представляет собой Т-клеточный острый лимфобластный лейкоз, острый лимфобластный лейкоз, острый миелогенный лейкоз, хронический миелогенный лейкоз, эритролейкемию, рак молочной железы, рак яичников, меланому, рак легких, рак поджелудочной железы, глиобластому, рак ободочной и прямой кишки, рак головы и шеи, рак шейки матки, рак предстательной железы, рак печени, плоскоклеточный рак (ротовой полости), рак кожи или медуллобластому.
7. Применение по п.6, где рак представляет собой Т-клеточный острый лимфобластный лейкоз, хронический миелогенный лейкоз, эритролейкемию, рак молочной железы, рак яичников, меланому, рак поджелудочной железы, глиобластому или рак ободочной и прямой кишки.
Текст
Согласно настоящему изобретению предложено соединение, имеющее структуру Хипскинд Филип Артур, Стефенсон Грегори Алан (US) Лыу Т.Н., Угрюмов В.М., Кондакова Е.В., Соболев А.Ю. (RU) или его фармацевтически приемлемая соль или гидрат и фармацевтическая композиция,содержащая указанное соединение или его фармацевтически приемлемую соль или гидрат,применимые в качестве ингибитора сигналинга, опосредуемого Notch для лечения рака.(71)(73) Заявитель и патентовладелец: ЭЛИ ЛИЛЛИ ЭНД КОМПАНИ (US) Передача сигнала через рецептор Notch представляет собой эволюционно консервативный путь, который играет ключевую роль в развитии и гомеостазе тканей. Рецепторы и лиганды Notch содержат однократно пронизывающие мембрану домены, экспрессируются на поверхности клетки и, по этой причине, сигнальный путь с участием рецепторов Nothc особенно важен при опосредовании коммуникации между соседними клетками, экспрессирующими указанные рецепторы и лиганды. У грызунов и человека известно четыре типа рецепторов Notch, которые называют Notch 1 - Notch 4. Рецепторы Notch представляют собой гетеродимерные белки, состоящие из внеклеточных и внутриклеточных доменов, которые первоначально синтезируются в виде одного полипептида. Взаимодействие рецептор-лиганд запускает серию расщеплений полипептида рецептора Notch, в котором задействована активность -секретазы. Активность -секретазы приводит к расщеплению внутриклеточного домена Notch с поверхности клетки,который переносится в ядро, образуя комплекс транскрипционного фактора. Внутриклеточный доменNotch (NICD) является активной формой белка. Разные функции сигналинга, опосредуемого Notch,включают пролиферацию, дифференцировку, апоптоз, ангиогенез, миграцию и самообновление. Указанные разные функции сигналинга, опосредуемого Notch во время развития и поддержания работы здоровых тканей неадекватно активируются при разных формах рака. Онкогенные функции сигналинга, опосредуемого Notch включают угнетение апоптоза и стимуляцию пролиферации клеток.-Секретаза играет центральную роль в каскаде активации рецептора Notch. Как следствие, ингибиторы -секретазы активно исследовали в связи с их потенциалом по блокированию активации рецепторовNotch. Соединения, представленные в заявке на патент WO 98/28268, такие как 7 С-203, являются примером таких ингибиторов -секретазы. Несмотря на первоначальные надежды, ни одного коммерчески доступного химиотерапевтического агента на основе ингибитора Notch так и не появилось. Имеется потребность в поиске соединений, обладающих ингибирующей активностью в отношении сигналинга, опосредуемого Notch. Есть дополнительная потребность в поиске соединений, которые обладают ингибирующей активностью в отношении -секретазы. Также есть потребность в поиске соединений, обладающих определенными структурными особенностями, которые могли бы вносить вклад в ингибирующую активность в отношении сигналинга, опосредуемого Notch. Есть дополнительная потребность в поиске соединений, демонстрирующих ингибирующую активность в отношении сигналинга,опосредуемого Notch и желаемые свойства распределения in vivo, метаболизма и выведение. На фигуре представлена порошковая рентгеновская дифрактограмма для соединения согласно примеру 2. Согласно одному аспекту настоящего изобретения предложено соединение-ингибитор сигналинга,опосредуемого Notch со следующей структурой: или его фармацевтически приемлемая соль или гидрат. Согласно второму аспекту настоящего изобретения предложена фармацевтическая композиция, содержащая 4,4,4-трифтор-N-[(1S)-2-(7S)-5-(2-гидроксиэтил)-6-оксо-7 Н-пиридо[2,3-d][3]бензазепин-7 ил]амино]-1-метил-2-оксоэтил]бутанамид или его фармацевтически приемлемую соль или гидрат, в ассоциации с фармацевтически приемлемым носителем. Согласно конкретному варианту реализации указанная фармацевтическая композиция содержит 4,4,4-трифтор-N-[(1S)-2(7S)-5-(2-гидроксиэтил)-6-оксо 7 Н-пиридо[2,3-d][3]бензазепин-7-ил]амино]-1-метил-2-оксоэтил]бутанамид или его фармацевтически приемлемую соль или гидрат вместе с фармацевтически приемлемым носителем и, необязательно, другими терапевтическими ингредиентами. Согласно третьему аспекту настоящего изобретения предложен способ ингибирования сигналинга,опосредуемого Notch у пациентов с раковым заболеванием, нуждающихся в таком ингибировании,включающий введение указанному пациенту терапевтически эффективного количества 4,4,4-трифтор-N[(1S)-2-(7S)-5-(2-гидроксиэтил)-6-оксо-7 Н-пиридо[2,3-d][3]бензазепин-7-ил]амино]-1-метил-2 оксоэтил]бутанамида, или его фармацевтически приемлемой соли или гидрата. Согласно четвертому аспекту настоящего изобретения предложен способ лечения рака, представляющего собой Т-клеточный острый лимфобластный лейкоз, острый лимфобластный лейкоз, острый миелогенный лейкоз, хронический миелогенный лейкоз, эритролейкемию, рак молочной железы, рак яичников, меланому, рак легких, рак поджелудочной железы, глиобластому, рак ободочной и прямой кишки, рак головы и шеи, рак шейки матки, рак предстательной железы, рак печени, плоскоклеточный рак (ротовой полости), рак кожи или медуллобластому у пациента, включающий введение нуждающемуся в этом пациенту терапевтически эффективного количества 4,4,4-трифтор-N-[(1S)-2-(7S)-5-(2 гидроксиэтил)-6-оксо-7 Н-пиридо[2,3-d][3]бензазепин-7-ил]амино]-1-метил-2-оксоэтил]бутанамида или его фармацевтически приемлемой соли или гидрата. Согласно пятому аспекту настоящего изобретения предложен способ лечения рака, представляющего собой Т-клеточный острый лимфобластный лейкоз острый лимфобластный лейкоз, хронический миелогенный лейкоз, эритролейкемию, рак молочной железы, рак яичников, меланому, рак поджелудочной железы, глиобластому или рак ободочной и прямой кишки у пациентов, включающий введение нуждающемуся в этом пациенту терапевтически эффективного количества 4,4,4-трифтор-N-[(1S)-2-(7S)-5(2-гидроксиэтил)-6-оксо-7 Н-пиридо[2,3-d][3]бензазепин-7-ил]амино]-1-метил-2-оксоэтил]бутанамида или его фармацевтически приемлемой соли или гидрата. Согласно шестому аспекту настоящего изобретения предложено соединение 4,4,4-трифтор-N-[(1S)2-(7S)-5-(2-гидроксиэтил)-6-оксо-7 Н-пиридо[2,3-d][3]бензазепин-7-ил]амино]-1-метил-2 оксоэтил]бутанамид или его фармацевтически приемлемая соль или гидрат для применения в терапии. Согласно седьмому аспекту настоящего изобретения предложено соединение 4,4,4-трифтор-N[(1S)-2-(7S)-5-(2-гидроксиэтил)-6-оксо-7 Н-пиридо[2,3-d][3]бензазепин-7-ил]амино]-1-метил-2 оксоэтил]бутанамид или его фармацевтически приемлемая соль или гидрат для применения при лечении рака, представляющего собой Т-клеточный острый лимфобластный лейкоз, острый лимфобластный лейкоз, острый миелогенный лейкоз, хронический миелогенный лейкоз, эритролейкемию, рак молочной железы, рак яичников, меланому, рак легких, рак поджелудочной железы, глиобластому, рак ободочной и прямой кишки, рак головы и шеи, рак шейки матки, рак предстательной железы, рак печени, плоскоклеточный рак (ротовой полости), рак кожи или медуллобластому. Согласно восьмому аспекту настоящего изобретения предложено соединение 4,4,4-трифтор-N[(1S)-2-(7S)-5-(2-гидроксиэтил)-6-оксо-7 Н-пиридо[2,3-d][3]бензазепин-7-ил]амино]-1-метил-2 оксоэтил]бутанамид или его фармацевтически приемлемая соль или гидрат для применения при лечении рака, представляющего собой Т-клеточный острый лимфобластный лейкоз, острый лимфобластный лейкоз, хронический миелогенный лейкоз, эритролейкемию, рак молочной железы, рак яичников, меланому,рак поджелудочной железы, глиобластому или рак ободочной и прямой кишки. Согласно девятому аспекту настоящего изобретения предложено применение соединения 4,4,4 трифтор-N-[(1S)-2-(7S)-5-(2-гидроксиэтил)-6-оксо-7 Н-пиридо[2,3-d][3]бензазепин-7-ил]амино]-1 метил-2-оксоэтил]бутанамида или его фармацевтически приемлемой соли или гидрата при производстве лекарственного препарата для лечения рака, представляющего собой Т-клеточный острый лимфобластный лейкоз, острый лимфобластный лейкоз, острый миелогенный лейкоз, хронический миелогенный лейкоз, эритролейкемию, рак молочной железы, рак яичников, меланому, рак легких, рак поджелудочной железы, глиобластому, рак ободочной и прямой кишки, рак головы и шеи, рак шейки матки, рак предстательной железы, рак печени, плоскоклеточный рак (ротовой полости), рак кожи или медуллобластому. Согласно десятому аспекту настоящего изобретения предложено применение соединения 4,4,4 трифтор-N-[(1S)-2-(7S)-5-(2-гидроксиэтил)-6-оксо-7 Н-пиридо[2,3-d[3]бензазепин-7-ил]амино]-1-метил 2-оксоэтил]бутанамид или его фармацевтически приемлемой соли или гидрата при производстве лекарственного препарата для лечения рака, представляющего собой Т-клеточный острый лимфобластный лейкоз, острый лимфобластный лейкоз, хронический миелогенный лейкоз, эритролейкемию, рак молочной железы, рак яичников, меланому, рак поджелудочной железы, глиобластому или рак ободочной и прямой кишки. Термин "пациент" относится к млекопитающему, а термин "млекопитающее" включает, но без ограничений, человека. Термины "терапевтически эффективное количество" или "эффективное количество" относится к дозе соединения или его фармацевтически приемлемой соли или гидрата либо фармацевтической композиции, содержащей указанное соединение или его фармацевтически приемлемую соль или гидрат, которое необходимо для ингибирования сигналинга, опосредуемого Notch у пациентов, страдающих раковыми заболеваниями, и либо разрушения раковых клеток-мишеней, либо замедления или остановки прогрессирования указанного ракового заболевания у пациента. Прогнозируемые дозировки соединения 1 или его фармацевтически приемлемой соли или гидрата варьируют в диапазоне от 0,1 до 200 мг/пациент/день. Предпочтительные дозировки, как предполагается, должны варьировать в диапазоне от 1 до 175 мг/пациент/день. Наиболее предпочтительные дозировки, как предполагается, должны варьировать в диапазоне от 5 до 150 мг/пациент/день. Точная дозировка, которая требуется для лечения пациента, и продолжительность лечения, должны определяться врачом в зависимости от стадии и степени тяжести заболевания, а также специфических потребностей и реакции индивидуального пациента. Хотя дозировку выражают в количестве на один день, режим дозирования можно корректировать так, чтобы добиться максимальной терапевтической пользы для пациента и борьбы и облегчения слизистой энтеропатии (гиперсекреции и скопления слизи в желудочно-кишечном тракте). Помимо с ежедневным введением доз, может быть применимо введение доз через день (раз в 2 дня), через день в течение пяти дней и два дня без введения (три раза в неделю); или раз в три дня (раз в 3 дня). Режим введения препарата че-2 023044 рез день, 3 раза/нед. или раз в три дня предпочтителен при введении (предварительном, одновременном или последующем введении соединения 1 по отношению к введению дексаметазона для борьбы или облегчения слизистой энтеропатии). Предполагается, что термины "лечение" и "лечить" включают весь спектр вмешательств в связи с раковым заболеванием, которым страдает пациент, таких как введение активного соединения для облегчения, замедления или обращения одного или более симптомов и для отсрочки прогрессирования рака,даже если рак фактически не устранен. Пациент, которого требуется лечить, является млекопитающим, в частности человеком. Соединение согласно настоящему изобретению предпочтительно преобразуют в фармацевтическую композицию, с применением фармацевтически приемлемого носителя, и вводят разными путями. Предпочтительно, такие композиции предназначены для перорального введения. Такие фармацевтические композиции способы их получения хорошо известны в данной области техники. См., например, REMINGTON: THE SCIENCE AND PRACTICE OF PHARMACY (A. Gennaro, et al., eds., 19th ed., Mack Publishing Co., 1995). Согласно конкретному варианту реализации указанная фармацевтическая композиция содержит 4,4,4-трифтор-N-[(1S)-2-(7S)-5-(2-гидроксиэтил)-6-оксо-7 Н-пиридо[2,3-d][3]бензазепин-7 ил]амино]-1-метил-2-оксоэтил]бутанамид или его фармацевтически приемлемую соль или гидрат вместе с фармацевтически приемлемым носителем и, необязательно, другие терапевтические ингредиенты, в частности, для лечения рака в целом или специфического типа рака. Соединение согласно настоящему изобретению способно реагировать с целым рядом неорганических и органических кислот, образуя фармацевтически приемлемые кислотно-аддитивные соли. Такие фармацевтически приемлемые соли и общая методология их получения хорошо известны в данной области техники. См., например, Р. Stahl, et al., HANDBOOK OF PHARMACEUTICAL SALTS: PROPERTIES, SELECTION AND USE (VCHA/Wiley-VCH, 2002); S.M. Berge, et al., "Pharmaceutical Salts", Journalof Pharmaceutical Sciences, Vol. 66, No. 1, January 1977. Соединение 1 или его фармацевтически приемлемую соль или гидрат можно получить посредством разных способов, известных в данной области техники, а также способов, описанных ниже. Чтобы получить соединение 1 или его фармацевтически приемлемую соль или гидрат специфические этапы синтеза можно сочетать разными путями. Соединение 1 называется 4,4,4-трифтор-N-[(1S)-2-(7S)-5-(2-гидроксиэтил)-6-оксо-7 Н-пиридо[2,3d][3]бензазепин-7-ил]амино]-1-метил-2-оксоэтил]бутанамид; и также может называться N-[(1S)-2-(7S)6,7-дигидро-5-(2-гидроксиэтил)-6-оксо-5 Н-пиридо[3,2-а][3]бензазепин-7-ил]амино]-1-метил-2-оксоэтил]4,4,4-трифторбутанамид; а также для однозначного определения соединения 1 могут применяться другие названия. Следует понимать, что соединение 1 обозначается как один стереоизомер. Существуют два хиральных центра, благодаря которым возможно существование четырех стереоизомеров. В настоящем патенте указания на соединение 1 также должны охватывать рацемические смеси, включающие соединение 1. В настоящем изобретении для указания специфических изомеров применяются обозначения (R)- и (S)- по номенклатуре Кана-Ингольда-Прелога. Специфические стереоизомеры можно получить путем стереоспецифического синтеза с применением энантомерно чистого или обогащенного сырья. Специфические стереоизомеры исходных веществ, промежуточных продуктов или рацемических смесей, включающих соединение 1, можно разделять при помощи технологий, хорошо известных в данной области техники,таких как технологии, описанные в Stereochemistry of Organic Compounds, E.I. Eliel and S.H. Wilen (Wiley 1994) и Enantiomers. Racemates. and Resolutions. J., Jacques, A. Collet, and S.H. Wilen (Wiley 1991), включая хроматографию в хиральных неподвижных фазах, ферментативное разделение или фракционную кристаллизацию или хроматографию диастереоизомеров, образованных с этой целью, таких как соли диастереоизомеров. Хотя все смеси, содержащие соединение согласно настоящему изобретению, включены в настоящее изобретение, предпочтительным вариантом реализации является соединение 1. Также было показано, что соединение 1 существует в форме атропоизомеров или специфических конформеров. В водных растворах 8-9% атропоизомера 2 (минорный атропоизомер) по данным 1H ЯМР(ядерного магнитного резонанса) или ЖХ-МС (жидкостной хроматографии - масс-спектрометрии) находится в равновесии с атропоизомером 1 (основной атропоизомер) спустя 24 ч при комнатной температуре. В органических растворителях спустя 24 ч при комнатной температуре приблизительно 1-2% аптоизомера 2 по данным 1 Н ЯМР или ЖХ-МС находится в равновесии с атропоизомером 1. Хотя аптоизомер 2 определяется посредством 1H ЯМР или ЖХ-МС, изолировать его нельзя. Соединения, применяемые в качестве исходных веществ при синтезе соединения согласно настоящему изобретению, хорошо известны и, в если они отсутствуют в продаже, их можно легко синтезировать на основании имеющихся специфических ссылок, при помощи стандартных способов, обычно применяемых специалистами в данной области техники или которые можно найти в общедоступных справочных текстах. Примеры известных процедур и способов включают процедуры и способы, описанные в общедоступных справочных текстах, таких как Comprehensive Organic Transformations, VCH Publishers Inc, 1989;Drawing Program, на основании структуры, где последовательно применяется название ИЮПАК. Препарат 1. Бензил (2S)-2-(4,4,4-трифторбутаноиламино)пропаноат Добавляют избыток L-аланин-бензилового эфира гидрохлорида (7,00 г, 32,5 ммоль), диизопропилэтиламина (28,30 мл, 162,3 ммоль), 1-гидроксибензотриазола гидрата (7,46 г, 48,7 ммоль) и 1-(3 диметиламинопропил)-3-этилкарбодиамида гидрохлорида (9,33 г, 48,7 ммоль) к раствору 4,4,4 трифтормасляной кислоты (7,131 г, 48,7 ммоль) в дигидрометане (162 мл) и оставляют при комнатной температуре под азотом при перемешивании на 20 ч. Добавляют 20% водный раствор лимонной кислоты(150 мл, 162 ммоль), перемешивают смесь в течение 5 мин и разделяют слои. Вещество экстрагируют из водной фазы при помощи дихлорметана (100 мл). Промывают объединенные органические фракции насыщенным водным раствором бикарбоната натрия (150 мл), высушивают над сульфатом магния и концентрируют. Остаток очищают при помощи флэш-хроматографии, элюируют смесью гексан этилацетат(4:1-2:1) и получают указанное в заголовке соединение в форме твердого белого вещества (9,22 г, 30,4 ммоль, 94%), МС (m/z) 304(M+1), []Na25=-44,6 (с=5,0, метанол). Препарат 2. Добавляют палладий/углерод (5%, 1,76 г, 0,8 ммоль) в одной части раствора бензил-(2S)-2-(4,4,4 трифторбутаноиламино)пропаноата (8,80 г, 29 ммоль) в метаноле (88 мл) при комнатной температуре. Дегазируют смесь (вакуум/азот), заполняют водородом (одна атмосфера) и перемешивают под водородом (29 ммоль) в течение 5 ч. Фильтруют через фильтр Celite, промывают фильтровальный осадок метанолом и концентрируют фильтрат, получая указанное в заголовке соединение в форме твердого белого вещества (6,11 г, 28,7 ммоль, 99%), МС (m/z) 214 (М+1), []Na25=-24,7 (с=5,0, метанол). Препарат 3. Метил 2-(2-бромфенил)ацетат Добавляют диметилформамид (2,1 мл, 27,3 ммоль), после чего добавляют тионила хлорид (52,3 мл,717,8 ммоль) в течение 7 мин в раствор 2-бромфенил-уксусной кислоты (150,0 г, 683,6 ммоль) в дихлорметане (1,50 л) и охлаждают на водяной бане при комнатной температуре. Смесь перемешивают в течение 5 ч. В течение 5 мин добавляют метанол (41,5 мл, 1,0 моль). Через раствор в течение ночи пропускают газообразный азот. Раствор концентрируют и получают указанное в заголовке соединение в форме бесцветной маслянистой жидкости с количественным выходом (166,0 г, 724,7 ммоль). 1 Дегазируют суспензию метил 2-(2-бромфенил)ацетата (156,6 г, 684 ммоль), би(пинаколато)дибора(194,9 г, 752 ммоль) и ацетата калия (135,6 г, 1,4 моль) в N-метилпирролидоне (940 мл) в ходе трех циклов смены ваккума/азота. Добавляют (1,1'-бис-(дифенилфосфино)ферроцен)паладия(II) хлорид (11,4 г,13,7 ммоль) и нагревают при 80C. Спустя 15 ч добавляют(1,1'-бис(дифенилфосфино)ферроцен)палладия(II) хлорид (11,4 г, 13,7 ммоль) и перемешивают при 90C в течение 24 ч. Охлаждают до комнатной температуры и выливают смесь на лед и воду (3 л), а также добавляют метил-трет-бутиловый эфир (1 л). Смесь перемешивают, фильтруют через прокладку Celite и разделяют слои. Вещество экстрагируют из водной фазы при помощи метил-трет-бутилового эфира (2500 мл). Промывают объединенные органические фракции водой (2500 мл), насыщенным раствором соли(500 мл), высушивают над сульфатом магния и концентрируют. Остаток очищают при помощи флэшхроматографии, элюируют гексан:этилацетат (9:1) и получают указанное в заголовке соединение в форме твердого белого вещества (160,6 г, 581,6 ммоль, 85%). МС (m/z): 277(M+1). Препарат 5. 5,7-Дигидропиридо[2,3-d][3]бензазепин-6-он Добавляют карбонат калия (235,7 г, 1,71 моль) к раствору 2-амино-3-бромпиридин (88,5 г, 511,7 ммоль) в 1,4-диоксане (550 мл) и воде (550 мл). Дегазируют указанную смесь в ходе трех циклов смены вакуума/азота. Добавляют ацетат палладия(II) (6,4 г, 28,4 ммоль) и три-трет-бутилфосфония тетрафторборат (16,5 г, 56,9 ммоль) и перемешивают смесь под азотом при 88C. По капле в течение 3 мин добавляют раствор метил-2-[2-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]ацетата (157,0 г, 568,5 ммоль) в 1,4-диоксане (550 мл) и смесь перемешивают в течение 20 мин при 88C. Смесь охлаждают до 50C, добавляют воду (100 мл) и разделяют слои. Вещество экстрагируют из водной фазы при помощи этилацетата (2100 мл), высушивают объединенные органические фракции над сульфатом магния и концентрируют. Растворяют концентрированное вещество в N-метилпирролидоне (314 мл), охлаждают в ледяной бане и по капле добавляют серную кислоту (314 мл, 5,9 моль), поддерживая температуру приблизительно 45C. Смесь перемешивают при 140C в течение 90 мин. Охлаждают ее до комнатной температуры, добавляют лед (4 кг) и ощелачивают путем добавления 50% водного раствора NaOH маленькими порциями до тех пор, пока pH не достигнет 7-8. Суспензию охлаждают до 10-15C, отфильтровывают твердый осадок и промывают водой (2 л), гексанами (1 л) и метил-трет-бутиловым эфиром (1 л). Высушивают под вакуумом при 40C. Обрабатывают вещество стекающей жидкостью 10% метанола/раствора дихлорметана и фильтруют раствор горячим (х 4). Концентрируют объединенные фильтраты и получают указанное в заголовке соединение в форме светло-коричневого твердого вещества (85 г,404,3 ммоль, 71%). МС (m/z): 211(M+1). Препарат 6. 5-[2-(трет-бутил(диметил)силил)оксиэтил]-7 Н-пиридо[2,3-d][3]бензазепин-6-он Добавляют карбонат цезия (186,6 г, 572,7 ммоль), (2-бромэтокси)-трет-бутилдиметилсилан (88,0 мл,409,1 ммоль) и иодид натрия (6,1 г, 40,9 ммоль) к суспензии 5,7-дигидропиридо[2,3-d][3]бензазепин-6 она (86,0 г, 409,1 ммоль) в диметилформамиде (860 мл) и перемешивают при 70C в течение 20 ч. Смесь охлаждают до комнатной температуры, переливают ко льду и воде (100 мл), добавляют этилацетат (200 мл). Смесь фильтруют через фильтр Celite, затем промывают этилацетатом (100 мл). Разделяют слои фильтрата, экстрагируют из водной фазы при помощи этилацетата (250 мл). Промывают объединенные органические фракции водой (2100 мл), раствором соли (100 мл), высушивают над сульфатом магния и концентрируют. Вещество растворяют в тетрагидрофуране (1,28 л), добавляют поглотитель палладияSilia (16,7 г) и перемешивают при комнатной температуре в течение 20 ч. Смесь профильтровывают через прокладку из оксида кремния, промывают тетрагидрофураном (200 мл) и концентрируют, получают указанное в заголовке соединение (155 г, 420,6 ммоль) в форме светло-коричневой маслянистой жидкости, которая кристаллизуется с количественным выходом. MS (m/z): 369 (М+1). Способ 2. Нагревают смесь 5,7-дигидропиридо[2,3-d][3]бензазепин-6-она (22,5 г, 106,9 ммоль) и диметилформамида (500 мл) до 100C в течение 5 мин. Охлаждают до 40C, добавляют карбонат цезия (104,3 г, 320,1 ммоль) и (2-брометокси)-трет-бутилдиметилсилан (29,9 мл, 138,9 ммоль), перемешивают при комнатной температуре в течение ночи. Нагревают до 60C приблизительно в течение 2 ч, а затем охлаждают до комнатной температуры. Дают остатку распределиться между этилацетатом (1 л) и водой (3 л), проводят обратную экстракцию из водного слоя при помощи этилацетата (2500 мл), промывают объединенные органические фракции раствором соли (2500 мл). Высушивают объединенные органические фракции над сульфатом магния и концентрируют. Остаток очищают при помощи флэш-хроматографии, элюируют смесью этилацетат:гексан (0:100-100:0) и получают указанное в заголовке соединение в форме маслянистой жидкости (39,4 г, 106,9 ммоль, 89%). MS (m/z): 369 (M+1). Препарат 7. 5-[2-(трет-Бутил(диметил)силил)оксиэтил]-7-гидроксииминопиридо[2,3-d][3]бензазепин-6-он Добавляют 2-метилпропан-2-олат калия (66,1 г, 588,8 ммоль) к раствору 5-[2-(третбутил(диметил)силил)оксиэтил]-7 Н-пиридо[2,3-d][3]бензазепин-6-она (155,0 г, 420,6 ммоль) в тетрагидрофуране (1,6 л) при -5C и перемешивают в течение 10 мин. По капле добавляют изоамилнитрит (61,9 мл, 462,6 ммоль) при -5C и перемешивают смесь в течение 10 мин. Переливают смесь ко льду/воде и экстрагируют при помощи этилацетата (3200 мл). Промывают объединенные органические фракции раствором соли (200 мл), высушивают над сульфатом магния. Добавляют толуол (1 л), концентрируют(3) и получают указанное в заголовке соединение в форме густой маслянистой коричневой жидкости Добавляют трифторуксусную кислоту (124,0 мл, 1,64 моль) несколькими порциями к раствору 5-[2(трет-бутил(диметил)силил)оксиэтил]-7-гидроксииминопиридо[2,3-d][3]бензазепин-6-она (155,0 г, 389,9 ммоль) в смеси дихлорметана (620 мл) и метанола (310 мл) на водяной бане при комнатной температуре. Несколькими порциями добавляют цинк (76,5 г, 1,2 моль), так чтобы внутренняя температура сохранялась на уровне 33-38C. Смесь перемешивают в течение 15 ч при комнатной температуре. Смесь фильтруют через фильтр Celite, промывают 10% метанолом/дихлорметаном (100 мл) и концентрируют фильтрат. Добавляют дихлорметан (0,5 л) и лед (500 г), перемешивают и ощелачивают путем добавления 50% водного раствора NaOH. Отфильтровывают твердый осадок, разделяют слои фильтрата. Из водной фазы проводят экстракцию при помощи дихлорметана (2100 мл) и концентрируют объединенные органические фракции. Твердое вещество суспендируют в гексане, а затем профильтровывают и сушат под высоким вакуумом и получают рацемат указанного в заголовке соединения в форме светло-желтого твердого вещества (74,0 г, 274,8 ммоль, 71%). Проводят очистку полученного вещества на хроматографической колонке Chiralpak AD, элюируя его смесью этанол (0,2%, диметилэтанол) ацетонитрил(0:100-100:0), получают указанное в заголовке соединение (35,0 г, 130 ммоль, 33,3%) в форме белого твердого вещества, MS (m/z): 270(М+1); []Na25=+187,83 (с=6,9, метанол). Гидрид калия (приблизительно 2 ковша, 35 мас.% в минеральном масле) промывают гексанами и отстаивают с целью удаления масла. Добавляют тетрагидрофуран (60 мл) и охлаждают до -78C. Раствор 2,4,6-трис-(1-метилэтил)бензолсульфонилазида (37,6 г, 121,6 ммоль) в тетрагидрофуране (60 мл) высушивают над сульфатом натрия в течение 45 мин. Сливают раствор азида в суспензию гидрида калия в течение 15 мин. Снимают смесь с холодной бани и дают нагреться до комнатной температуры в течение 45 мин; оставляют раствор высыхать. Охлаждают раствор диизопропиламина (17,0 мл, 121,0 ммоль) и тетрагидрофурана (50 мл) до -78C. По капле в течение 5 мин добавляют литиевую соль п-бутила (52,1 мл, 130,3 ммоль). Снимают смесь с холодной бани и дают нагреться в течение 15 мин, затем повторно охлаждают до -78C. В течение 5-10 мин в раствор 5-[2-(трет-бутил(диметил)силил)оксиэтил]-7 Нпиридо[2,3-d][3]бензазепин-6-она (34,3 г, 93,1 ммоль) в тетрагидрофуране (400 мл) при -78C опускают канюлю. Перемешивают в течение 1 ч при -78C, затем снимают раствор с холодной бани и дают нагреться в течение 15 мин (приблизительно до -45C). Охлаждают до -78C и через канюлю добавляют высушенный раствор 2,4,6-трис-(1-метилэтил)бензолсульфонилазида в течение 5-10 мин. Снимают раствор с холодной бани и дают нагреться до -5-0C в течение 1 ч. Охлаждают на льду/водяной бане и по капле в течение 13 мин добавляют уксусную кислоту. Дают нагреться до комнатной температуры в течение 65 мин и гасят насыщенным раствором карбоната натрия (1 л). Разбавляют реакционную смесь этилацетатом (600 мл) и водой (2 л), разделяют слои, проводят обратную экстракцию из водной фазы при помощи этилацетата (2400 мл). Промывают объединенные органические фракции насыщенным раствором бикарбоната натрия (500 мл) и раствором соли (500 мл), высушивают над сульфатом натрия и концентрируют. Остаток очищают при помощи флэш-хроматографии, элюируют смесью этилацетат:гексан (0:100100:0) и получают указанное в заголовке соединение в форме маслянистой жидкости (39,8 г, 92,3 ммоль,99%). MS (m/z): 410 (M+1). Препарат 10. 7-Амино-5-[2-(трет-бутил(диметил)силил)оксиэтил]-7 Н-пиридо[2,3-d][3]бензазепин-6-он Добавляют палладий/углерод (5%, 1,76 г, 0,8 ммоль) (2,2 г, 1,0 ммоль, 5% на углероде) в раствор 7 азидо-5-[2-(трет-бутил(диметил)силил)оксиэтил]-7 Н-пиридо[2,3-d][3]бензазепин-6-она (39,8 г, 92,3 ммоль) в этаноле (923 мл), предварительно продутый азотом. Три раза откачивают/закачивают водород и перемешивают под водородом (одна атмосфера) при комнатной температуре в течение ночи. Профильтровывают через фильтр Celite, промывают этанолом и этилацетатом, концентрируют и получают указанное в заголовке соединение в форме прозрачной маслянистой жидкости (36,6 г, 89,9 ммоль, 97%). MS Охлаждают смесь 7-амино-5-[2-(трет-бутил(диметил)силил)оксиэтил]-7 Н-пиридо[2,3d][3]бензазепин-6-она (36,3 г, 89,9 ммоль), дихлорметана (360 мл), триэтиламина (16,3 мл, 116,9 ммоль),3-гидрокситриазо[4,5-b]пиридина (15,9 г, 116,9 ммоль) и (2S)-2-(трет-бутоксикарбониламино)пропановой кислоты (22,5 г, 116,9 ммоль) до 0C. Добавляют 1-(3-диметиламинопропил)-3-этилкарбодиимида гидрохлорид (22,4 г, 116,9 ммоль) и спустя 5 мин оставляют смесь нагреваться до комнатной температуры в течение ночи. Промывают водой (500 мл 2), насыщенным водным раствором бикарбоната натрия (2300 мл), раствором соли (300 мл), затем высушивают над сульфатом натрия и концентрируют. Остаток очищают при помощи флэш-хроматографии, элюируют смесью изопропиловый спирт:гексан (5:95-10:90) и получают указанное в заголовке соединение в форме белой пены (43,14 г, 77,77 ммоль, 86,50%). MS В течение 5 мин добавляют трифторуксусную кислоту (30 мл, 396,76 ммоль) к раствору трет-бутилN-[(1S)-2-5-[2-(трет-бутил(диметил)силил)оксиэтил]-6-оксо-7 Н-пиридо[2,3-d][3]бензазепин-7 ил]амино]-1-метил-2-оксоэтил]карбамата (5,56 г, 10,0 ммоль) и дихлорметана (30 мл), температура которого поддерживается 0C, дают нагреться и перемешивают при комнатной температуре в течение 5 ч. Остаток очищают посредством флэш-хроматографии с применением хроматографических колонокSCX (Isolute SCX-2 6), элюируют метанолом, а затем смесью этилацетат:метанол (2N-аммиак), и получают указанное в заголовке соединение в форме твердого вещества белого цвета (3,48 г, 10,2 ммоль) в количественном выходе. MS (m/z): 341 (М+1). Пример 1. 4,4,4-Трифтор-N-[(1S)-2-(7S)-5-(2-гидроксиэтил)-6-оксо-7 Н-пиридо[2,3-d][3]бензазепин-7 ил]амино]-1-метил-2-оксоэтил]бутанамид Последовательно добавляют (2S)-2-(4,4,4-трифторбутаноиламино)пропаноевую кислоту (28,9 г,135,7 ммоль, полученную по существу так, как описано в разделе "Препарат 2), 1-(3 диметиламинопропил)-3-этилкарбодиимида гидрохлорид (29,7 г, 155,1 ммоль) к суспензии (7S)-7-амино 5-(2-гидроксиэтил)-7 Н-пиридо[2,3-d][3]бензазепин-6-она (34,8 г, 129,2 ммоль) в дихлорметане (696 мл) при 0C, перемешивают в течение 5 мин. Добавляют 1-гидроксибензотриазола моногидрат (24,7 г, 155,1 ммоль), дают смеси перемешаться в течение 1 ч, а затем нагревают до комнатной температуры. Добавляют (2S)-2-(4,4,4-трифторбутаноиламино)пропаноевую кислоту (0,6 г, 2,6 ммоль) и перемешивают в течение 15 мин при комнатной температуре. Добавляют воду (600 мл), отфильтровывают твердый белый осадок и разделяют слои фильтрата. Органический слой промывают водой (3200 мл), высушивают над сульфатом натрия и концентрируют, получая светло-коричневую пену. Вещество суспендируют в метилтрет-бутиле или в гексанах (500 мл), отфильтровывают твердый осадок, высушивают под высоким ва-8 023044 куумом и получают 65 г твердых веществ. Добавляют воду (195 мл) и бикарбонат натрия (14,0 г, 140,0 ммоль) к раствору ранее полученных твердых веществ (65,0 г, 140,0 ммоль) в метаноле (195 мл), температура которого поддерживается на уровне 10C, и перемешивают при комнатной температуре в течение 29 ч. Концентрируют раствор и экстрагируют вещества при помощи дихлорметана (350 мл). Промывают объединенные органические фракции водой (320 мл), высушивают над сульфатом натрия и концентрируют. Остаток очищают при помощи флэш-хроматографии, элюируют смесью метанол:дихлорметан (98:2, 7N в аммиаке). Вещество истирают в 50% метил-трет-бутилового эфира/гексана, затем истирают в метил-трет-бутиловом эфире(500 мл). Твердые вещества промывают метил-трет-бутиловым эфиром (200 мл) и гексаном (200 мл) и высушивают твердые вещества под высоким вакуумом, получая указанное в заголовке соединение в форме твердого вещества грязно-белого цвета (42,0 г, 90,4 ммоль, 65%). MS (m/z): 270 (M+1),[]Na25=-153, 40 (с=5,0, метанол). Способ 2. Добавляют 1-(3-диметиламинопропил)-3-этилкарбодиимида гидрохлорид (2,50 г, 13,0 ммоль) к смеси (2S)-2-амино-N-[5-(2-гидроксиэтил)-6-оксо-7 Н-пиридо[2,3-d][3]бензазепин-7-ил]пропанамида (3,4 г, 10.0 ммоль), дихлорметана (40 мл), 3-гидрокситриазол-[4,5-b]пиридина (1,8 г, 13,0 ммоль), 4,4,4 трифтормасляной кислоты (1,9 г, 13,0 ммоль) и триэтиламина (1,8 мл, 13,0 ммоль), температура которой поддерживается на уровне 0C. Смеси дают перемешаться и нагреться до комнатной температуры в течение ночи. Добавляют воду (40 мл) и джут распределения между дихлорметаном (100 мл) и водой (50 мл). Разделяют, проводят обратную экстракцию из водного слоя при помощи дихлорметана, промывают объединенные органические слои насыщенным водным раствором бикарбоната натрия (2100 мл). Проводят обратную экстракцию из слоев в бикарбонате при помощи дихлорметана (25 мл), высушивают объединенные органические слои над сульфатом натрия и концентрируют. Остаток очищают при помощи флэш-хроматографии, элюируют смесью метанол:дихлорметан (2N аммиак) (0:100-5:95) и получают 3,77 г смеси диастереомеров. Вещество очищают при помощи колонки Chiralpak AD, элюируя его смесью этанол (0,2% диметилэтиламин):ацетонитрил (0:100-100:0), и получают указанное в заголовке соединение в форме твердого вещества белого цвета (1,7 г, 3,7 ммоль, 37%). MS (m/z): 465 (M+1). Препарат 13. Метил 2-(2-бромфенил)ацетат Соединяют 2-бромфенилуксусную кислоту (500,0 г, 2,33 моль) с метанолом (5,0 л) при атмосфере с высоким содержанием азота. По капле добавляют концентрированную серную кислоту (185,8 мл) при температуре 20-35C, а затем нагревают до 60-65C при перемешивании в течение 3-4 ч. Реакционную смесь охлаждают до 45C и концентрируют при пониженном давлении при температуре ниже 45C, пока объем не составит приблизительно 750 мл. Реакционную смесь охлаждают до 10-30C и добавляют дихлорметан (2,5 л). pH корректируют до значения 7-8 гидроксидом натрия (7%, 380,0 мл) и проводят разделение слоев. Органическую фазу концентрируют до сухого состояния при пониженном давлении при температуре ниже 45C и получают указанное в заголовке соединение (516,5 г, 97,0%) в форме желтой маслянистой жидкости. Препарат 14. 5,7-Дигидропиридо[2,3-d][3]бензазепин-6-он Соединяют метил-2-(2-бромфенил)ацетат (1,0 кг, 4,36 моль), диоксан (11,0 л) и N-метил-2 пирролидон (7,0 л) при перемешивании при комнатной температуре. К смеси добавляют бис(пинаколато)дибор (1,2 кг, 4,58 моль), ацетат калия (855,9 г, 8,72 моль), а затем раствор дегазируют путем пропускания газообразного азота через раствор в течение 2-3 ч. Помещают продукт присоединения[1,1'-бис-(дифенилфосфино)ферроцен]палладия(II) дихлорида к дихлорметану (71,2 г. 97,2 ммоль) в атмосферу с высоким содержанием азота, затем нагревают реакционную смесь до 80-90C в течение 18-20 ч и получают метил-2-[2-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]ацетат в форме раствора,который применяют без дальнейшего выделения. Охлаждают реакционную смесь до 15-25C и добавляют 2-амино-3-бромпиридин (675,0 г, 3,90 моль), а также раствор ортофосфата калия (2,41 кг, 11,3 моль) в воде (3,0 л). Раствор дегазируют путем пропускания газообразного азота через раствор в течение 2-3 ч, и добавляют продукт присоединения [1,1'-бис-(дифенилфосфино)ферроцен]палладия(II) дихлорида и ди-9 023044 хлорметана (106,8 г, 130,8 ммоль), затем нагревают реакционную смесь до 80-90C в течение 18-40 ч. Реакционную смесь охлаждают до 50-60C и медленно добавляют раствор, включая насыщенный раствор бикарбоната натрия (13,0 л), насыщенный раствор хлорида натрия (13,0 л) и воду (13,0 л). Смесь перемешивают в течение 2-3 ч при 50-60C, охлаждают до 15-25C и перемешивают еще в течение 18-20 ч. Отфильтровывают образовавшиеся твердые вещества и промывают остаток на фильтре водой (22,0 л). Переносят твердые вещества в чистый реакционный сосуд, добавляют этилацетат (5,0 л) и нагревают смесь до 60-70C в течение 2-3 ч. Охлаждают раствор до 15-25C, перемешивают его в течение 1-2 ч и отфильтровывают образовавшиеся в результате твердые вещества. Промывают остаток на фильтре этилацетатом (2750 мл) и высушивают образовавшиеся твердые вещества под вакуумом, получая указанное в заголовке соединение в форме твердого вещества грязно-белого цвета (644,0 г, 68,1%). Препарат 15. 5-[2-(трет-Бутил(диметил)силил)оксиэтил]-7 Н-пиридо[2,3-d][3]бензазепин-6-он Добавляют 5,7-дигидропиридо[2,3-d][3]бензазепин-6-он (33,8 г, 0,16 моль) в ацетонитрил (340,0 мл) и перемешивают при 20-30C в течение 0,5-1 ч. Добавляют карбонат цезия (104,6 г, 0,32 моль) и (2 брометокси)-трет-бутилдиметилсилан (42,2 г, 0,18 моль) и нагревают реакционную смесь до 70-80C в течение 18-20 ч. Охлаждают реакционную смесь до 20-25C и фильтруют через диатомовую землю (50,6 г). Остаток на фильтре промывают ацетонитрилом (250,6 мл) и концентрируют фильтрат при пониженном давлении до достижения общего объема приблизительно 67,5 мл. Добавляют толуол (152 мл), активированный уголь (2,53 г) и нагревают смесь до 60-70C в течение 1-2 ч. Охлаждают смесь до 25-35C и фильтруют реакционную смесь через диатомовую землю (50,6 г). Ополаскивают остаток на фильтре толуолом (17,0 мл) и концентрируют при пониженном давлении, получая указанное в заголовке соединение в форме светло-коричневой маслянистой жидкости, которая кристаллизуется при отстаивании (56,8 г, 92,2%). Препарат 16. 5-[2-(трет-бутил(диметил)силил)оксиэтил]-7-гидроксииминопиридо[2,3-d][3]бензазепин-6-он Соединяют 5-[2-(трет-бутил(диметил)силил)оксиэтил]-7 Н-пиридо[2,3-d][3]бензазепин-6-он (30,0 г,0,08 моль) и толуол (300,0 мл), охлаждают реакционную смесь до -10-0C, добавляют трет-бутоксид калия (18,2 г, 0,16 моль), изоамил нитрит (13,34 г, 0,11 моль), а затем перемешивают в течение 3-5 ч. Переносят реакционную смесь к охлажденному (0-5C) двухфазному раствору этилацетата (210 мл) и воды(510 мл) и перемешивают в течение 15-30 мин. Реакционную смесь нагревают до 15-25C и разделяют слои. Водный слой экстрагируют при помощи дополнительного этилацетата (120 мл) и метил-третбутилового эфира (120 мл), и органические слои объединяют. Органические фракции концентрируют при пониженном давлении, пока объем раствора не достигнет приблизительно 60-90 мл, и затем добавляют толуол (240 мл) и этилацетат (75 мл). Раствор профильтровывают через силикатный гель (45,0 г),прополаскивают силикатный гель толуолом (210 мл) и этилацетатом (60 мл), и концентрируют фильтрат при пониженном давлении, пока объем раствора не достигнет приблизительно 75 мл. Добавляют гептан(120 мл) и концентрируют смесь приблизительно до объема 60 мл, образовавшиеся в результате твердые вещества фильтруют. Остаток на фильтре промывают гептаном (25 мл) и высушивают под вакуумом,получая указанное в заголовке соединение (28,3 г, 72,5%) в форме твердого вещества желтого цвета. Соединяют 5-[2-(трет-бутил(диметил)силил)оксиэтил]-7-гидроксииминопиридо[2,3d][3]бензазепин-6-он (206,0 г, 0,52 моль) и тетрагидрофуран (2,3 л) в автоклаве при атмосфере с высоким содержанием азота. К реакционной смеси добавляют никель Ренея (232,0 г, 1,13 мас.экв.) и вводят атмосферу водорода (87 фунтов/кв.дюйм). Реакционную смесь перемешивают при 60-65C в течение 24 ч. Смесь фильтруют через диатомовую землю и промывают вспомогательное фильтровальное вещество тетрагидрофураном (500 мл). Концентрируют фильтрат и получают указанное в заголовке соединение(196,0 г, 93,2%) в форме коричневой маслянистой жидкости. MS (m/z): 384 (M+1). Препарат 18. трет-Бутил(166,0 г, 0,43 моль), дихлорметан (2,2 л) и L-трет-бутоксикарбонил-аланин (106,4 г, 0,56 моль) при атмосфере с высоким содержанием азота. Добавляют гидроксибензотриазол (1,46 г, 10,8 ммоль) и триэтиламин (102,5 мл, 0,74 моль), поддерживая внутреннюю температуру ниже 30C. Порциями добавляют 1 этил-3-(3-диметиламинопропил)карбодиимид (128,2 г, 0,67 моль) и перемешивают в течение 16-18 ч при 20-30C. Очищают реакционную смесь при помощи хроматографии на силикатном геле (300 г силикатного геля), элюируя вещество при помощи дихлорметана (498 мл 2). Соединяют раствор дихлорметана и промывают его водой (23,3 л). Органическую фазу концентрируют при пониженном давлении, пока не будет достигнут объем 300-400 мл и добавляют этилацетат (664,0 мл). Концентрируют смесь при пониженном давлении, пока не будет достигнут объем 300-400 мл, и добавляют этилацетат (664 мл). Концентрируют смесь при пониженном давлении, пока не будет достигнут объем 300-400 мл, и добавляют этилацетат (1,3 л). Добавляют тетра-n-бутиламмоний фторид тригидрат (149,4 г, 0,47 моль) и перемешивают в течение 16-18 ч при 20-30C. Добавляют водный раствор хлорида натрия (20%, 1,6 л), разделяют слои и промывают органическую фазу повторно водным раствором хлорида натрия (20%, 1,6 л). Органическую фазу концентрируют, пока объем не составит приблизительно 800-900 мл и перемешивают смесь в течение 12-16 ч при 20-30C. Образовавшиеся в результате твердые вещества отфильтровывают, остаток на фильтре промывают этилацетатом (91,3 мл). Очищают реакционную смесь при помощи хроматографии на силикатном геле (300 г силикатного геля), элюируя вещество при помощи дихлорметана (2500 мл) и получают указанное в заголовке соединение (82,6 г, выход 85,2% de, 100% э.и., 51,2%) в форме желтой маслянистой жидкости. MS (m/z): 441 (M+1). Препарат 19. вышенным содержанием азота. По капле добавляют соляную кислоту (317,5 мл, 4N, 1,27 моль), поддерживая внутреннюю температуру ниже 30C, и перемешивают в течение 16-18 ч при 20-30C. Добавляют воду (324,0 мл) и дихлорметан (430 мл) и разделяют слои. Избавляются от органического слоя, а к водной фазе добавляют дихлорметан (645 мл) и корректируют pH приблизительно до 10 при помощи водного раствора гидроксида натрия (20%, 252 мл). Разделяют слои, экстрагируют водный слой при помощи дополнительного дихлорметана (2430 мл) и объединяют органические фазы. Органическую фракцию концентрируют при пониженном давлении и температуре ниже 45C, пока объем раствора не достигнет приблизительно 130-150 мл, и добавляют тетрагидрофуран (322 мл). Раствор концентрируют при пониженном давлении и температуре ниже 45C, пока объем раствора не достигнет приблизительно 200-220 мл, и добавляют дополнительное количество тетрагидрофурана (213 мл). Реакционную смесь концентрируют при пониженном давлении, пока объем раствора не достигнет приблизительно 250-270 мл, и нагревают до 60-65C в течение 2-3 ч. Медленно охлаждают реакционную смесь до 5-15C и перемешивают в течение 5-8 ч. Образовавшиеся в результате твердые вещества отфильтровывают, остаток на фильтре промывают этилацетатом (56 мл). Переносят твердые вещества в чистый реакционный сосуд, добавляют этилацетат (150 мл) и нагревают до 60-65C в течение 2-3 ч, затем медленно охлаждают до 5-15C. При указанной температуре перемешивают в течение 2-3 ч и образовавшиеся твердые вещества собирают путем фильтрации. Остаток на фильтре промывают этилацетатом (45 мл) и высушивают твердые вещества в сушильном шкафу при пониженном давлении и температуре ниже 60C, получая указанное в заголовке соединение (21,0 г, выход 99,2% de, 100% э.и., 51.0%) в форме твердого вещества грязно-белого цвета. MS (m/z): 341 (M+1). Пример 2. 4,4,4-Трифтор-N-[(1S)-2-(7S)-5-(2-гидроксиэтил)-6-оксо-7 Н-пиридо[2,3-d][3]бензазепин-7 ил]амино]-1-метил-2-оксоэтил]бутанамид гидрат(2S)-2-амино-N-[(7S)-5-(2-гидроксиэтил)-6-оксо-7 Н-пиридо[2,3-d][3]бензазепин-7 ил]пропанамид (45,0 г, 132,2 ммоль) и диметилформамид (452,9 мл) при атмосфере с высоким содержанием азота. Охлаждают смесь до 0-5C и добавляют N-этилдиизопропиламин (77,4 мл, 444,0 ммоль),4,4,4-трифтормасляную кислоту (19,9 г, 139,3 ммоль) и гидроксибензотриазол моногидрат (22,3 г, 153,1 ммоль). Раствор перемешивают в течение 5-10 мин и добавляют 1-этил-3-(3 диметиламинопропил)карбодиимида гидрохлорид (30,6 г, 159,6 ммоль) одной порцией. Реакционную смесь нагревают до 20-25C и перемешивают в течение 1-2 ч. Добавляют этилацетат (1,4 л) и воду (1,8 л) и перемешивают в течение 0,5-1 ч. Разделяют фазы, органический слой промывают водным раствором бикарбоната натрия (5%, 1,0 л) и концентрируют раствор при пониженном давлении, пока не будет достигнут объем 200-300 мл. Добавляют этанол (522 мл) и концентрируют раствор при пониженном давлении, пока не будет достигнут объем 200-300 мл. Процедуру повторяют три раза. Добавляют этанол (180 мл) и 5% раствор карбоната калия (34,6 мл) и перемешивают в течение 0,5-1 ч при 20-25C. Добавляют воду (667 мл) и затравочные кристаллы 4,4,4-трифтор-N-[(1S)-2-(7S)-5-(2-гидроксиэтил)-6-оксо-7 Нпиридо[2,3-d][3]бензазепин-7-ил]амино]-1-метил-2-оксоэтил]бутанамида гидрата (0,4 г, 0,86 ммоль) (затравочные кристаллы можно создать из твердых веществ, полученных из предыдущих партий продукта,или можно получить при помощи других способов, широко известных и применяемых специалистами в данной области техники, такими как перекристаллизация малых аликвот) и перемешивают в течение 2-3 ч при 20-25C. Фильтруют смесь и дважды промывают остаток на фильтре смесью этанола (63 мл) и воды (42 мл). Высушивают образовавшиеся твердые вещества в сушильном шкафу при пониженном давлении и температуре ниже 40C и получают указанное в заголовке соединение (41,9 г, выход 99,6% de,100% э.и., 65,3%) в форме твердого вещества грязно-белого цвета. MS (m/z): 465 (M-H2O+1). Порошковый рентгеноструктурный анализ (XRPD) вещества, полученного в примере 2. Типовые варианты XRPD кристаллических твердых веществ получены на порошковом рентгеновском дифрактометре Bruker D4 Endeavor, оснащенном источником CuK (=1.54060 ) и детекторомVantec, работающим при 35 кВ и 50 мА. Образец подвергают сканированию от 4 до 40 при 2, с шагом 0,0087 при 2 и скорости сканирования 0,5 с/шаг и с расходимостью 0,6 мм, фиксированным антирассеянием 5,28 мм и щелями детектора 9,5 мм. Сухой порошок упаковывают в кварцевый держатель для образца, и при помощи предметного стекла создают гладкую поверхность. В кристаллографии уста- 12023044 новленным является тот факт, что при любой конкретной форме кристалла относительные интенсивности дифракционных максимумов могут варьировать в зависимости от предпочтительной ориентации, что является следствием таких факторов, как морфология и форма кристалла. Там, где присутствует влияние предпочтительной ориентации, максимальные интенсивности изменяются, но положения характерных максимумов полиморфной формы не изменяется (например, см.: US Pharmacopia 33 - National Formulary 28 Chapter941 Characterization of Crystalline Solids by X-ray Powder Diffraction (XRPD) Official October 1, 2010-February 1, 2011). Кроме того, в кристаллографии установленным является тот факт, что при любой конкретной форме кристалла могут незначительно варьировать угловые положения максимумов. Например, положения максимумов могут сдвигаться в связи с колебаниями температуры или влажности,при которых проводят анализ образца, смещением образца или наличием или отсутствием внутреннего стандарта. В данном случае изменчивость положения максимума 0,2 при 2 позволит учесть данные потенциальные колебания, не препятствуя однозначному определению идентифицируемой формы кристалла. Подтверждение формы кристалла можно получить на основании уникальной комбинации различающихся максимумов (в единицах 2), как правило, наиболее выраженных максимумов. Дифракционную картину, соответствующую форме кристалла, регистрируют при комнатной температуре (19-25C) и относительной влажности (20-60%). Таким образом, приготовленный образец соединения согласно примеру 2 характеризуется типовым вариантом XRPD, полученным при помощи излучения CuK, имеющим дифракционные максимумы(значения 2-тета), перечисленные в табл. 1 ниже. Форма является кристаллической, и содержит максимум на 22,97 в сочетании с одним или более максимумами, выбранными из группы, состоящей из 11,96,18,81, 20,78 и 21,07 2-тета, с допуском на углы дифракции 0,2. Таблица 1 Максимумы на порошковой рентгеновской дифрактограмме для примера 2 ЯМР твердого тела для вещества из примера 2. Спектры ЯМР с 13 С-кросс-поляризацией/вращением под магическим углом (CP/MAS) (ЯМР твердого тела или ТТЯМР) получали при помощи ЯМР-спектрометра Bruker Avance II 400 МГц (Lilly tagK299547), работающего на частоте углерода 100,622 МГц и снабженного тройным резонансным зондомBruker 4 мм (K299551). Наряду с кросс-поляризацией применяют подавление боковой полосы TOSS(полное подавление боковой полосы) с применением расщепления SPINAL64 (70,8 Вт) и RAMP100 сформированного CP-импульса H-ядра. Параметры съемки следующие: 90 радиоимпульс протона с шириной 2.5 мс, время контакта было 3,5 мс, частота следования импульсов 5 с, частота MAS (вращения под магическим углом) 10 кГц, ширина спектра 30 кГц, время съемки 34 мс, и количество сканирований 10,587. Химический сдвиг связан с адамантаном (= 29,5 промилле) в отдельном эксперименте. 13 С ЯМР (твердого тела):(промилле) 18,65, 27,52, 28,76, 47,66, 49,96, 55,02, 58,88, 122,87, 126,49,129,73, 131,37, 132,31, 137,28, 145,01, 149,17, 168,53, 170,30, 175,55. Титрование вещества согласно примеру 2 по способу Карла Фишера. Титрование по способу Карла Фишера проводят при помощи кулонометра Brinkmann Methrohm 756KF. Контрольный стандарт определяют с применением Hydranol в качестве стандарта воды в двух экземплярах. Анализ образца проводят трижды и регистрируют средний процент воды с целью определения количества воды в образце. Средний результат титрования по способу Карла Фишера для примера 2 составляет 3,9% воды. Теоретический процент одного мольного эквивалента воды в примере 2 составляет 3,7%. Рак все в большей степени считают гетерогенной группой заболеваний, начало и прогрессирование которых вызывается ошибочной функцией одного или более генов, которые регулируют репарацию ДНК, стабильность генома, пролиферацию клеток, гибель клеток, их адгезию, ангиогенез, инвазию и метастазирование в микроокружение клеток и тканей. Вариантная или ошибочная функция "раковых" генов может возникать вследствие существующего в природе полиморфизма ДНК, изменений числа ко- 14023044 пий в геноме (в результате амплификации, делеции, потери хромосомы или дупликации), изменений структуры хромосом (в результате хромосомной транслокации, инверсии или другой перестройки, которая ведет к нерегулируемой экспрессии генов) и точечных мутаций. Раковые новообразования могут быть вызваны ошибочной функцией одного гена, и поддерживаются той же ошибочной функцией гена,или же сохранение и прогрессирование усугубляются вследствие дополнительных ошибочных функций генов. Кроме генетических хромосомных аберраций, упомянутых выше, каждый из типов рака может также включать эпигенетические модификации генома, включая метилирование ДНК, геномный импринтинг и модификацию гистонов посредством ацетилирования, метилирования или фосфорилирования. Эпигенетическая модификация может играть определенную роль в индукции и/или поддержании злокачественного новообразования. Были составлены подробные каталоги цитогенетических аберраций при раке у человека, они поддерживаются и регулярно обновляются он-лайн (см. The Mitelman Database of Chromosome Aberrations inhttp://cgap.nci.nih.gov). Указанная база данных включает хромосомные аберрации, по меньшей мере, для некоторых злокачественных новообразований согласно настоящему изобретению. В рамках проекта Института Сенгера поддерживается подробная он-лайн база данных "Cancer Gene Census" всех генов человека, для которых была установлена причинно-следственная связь с онкогенезом (см. http.//www, sanger.ac.uk/genetics/CGP/Census), а также база данных COSMIC (каталог соматических мутаций при раке) соматических мутаций при раке у человека (см. http://www.sanger ac.uk/genetics/CGP/cosmic). Еще одним источником, содержащим обильную информацию о цитогенетических изменениях, причинно связанных с разными типами рака, является Атлас генетики и цитогенетики в онкологии и гематологии(http://atlasgeneticsoncologv.org//Anomalies/Anomliste.htmlMDS). Указанные базы данных также включают хромосомные аберрации, характерные, по меньшей мере, для некоторых злокачественных новообразований согласно настоящему изобретению. Известна и в повседневной практике применяется диагностика злокачественных новообразований при помощи биопсии, иммунофенотипирования и других диагностических исследований. Помимо дифференциального окрашивания хромосом с высоким разрешением и современных технологий визуализации хромосом, хромосомные аберрации в предполагаемых случаях рака можно определять посредством цитогенетического анализа, такого как флуоресцентная гибридизация in situ (FISH), кариотипирование,спектральное кариотипирование (SKY), мультиплексная FISH (M-FISH), сравнительная геномная гибридизация (CGH), матрицы однонуклеотидных полиморфизмов (чипы SNP) и других диагностических и аналитических исследований, известных и применяемых специалистами в данной области техники. Онкогенная роль Notch была впервые описана в клетках Т-клеточного лейкоза человека, включая транслокацию внутриклеточного домена Notch1 в область промотора рецептора- Т-лимфоцитов, которая приводит к гиперэкспрессии внутриклеточного домена Notch1 (Grabher et al. Nature Review Cancer. 2006(6)347-359; Weng et al. Science. 2004(306):269-271). Гиперэкспрессия внутриклеточного доменаNotch1 в гемапоэтических клетках-предшественниках мышей приводила к появлению у мышей Тклеточного острого лимфобластного лейкоза, сходного с лейкозом у людей. Помимо Т-клеточного острого лимфобластного лейкоза все увеличивается объем данных, свидетельствующих о том, что сигналы с рецепторов Notch являются онкогенными при других типах рака за счет множественных механизмов,включая амплификацию рецепторов и гиперэкспрессию лигандов и/или рецепторов, включая острый лимфобластный лейкоз, острый миелогенный лейкоз, хронический миелогенный лейкоз и эритролейкемию. Ошибочная конститутивная передача сигнала с рецепторов Notch вследствие мутации или гиперэкспрессии лигандов и/или рецепторов также непосредственно связана с многими солидными опухолями, включая рак молочной железы, рак яичника (Park et al. Cancer Research, 2006(66): 6312-6318), меланому (Gast et al. Genes. ChromosomesCancer. 2010(49): 733-745), рак легких, немелкоклеточный рак легких (Westhoff et al. PNAS, 2009(106):22293-22298), рак поджелудочной железы, глиобластому, рак ободочной и прямой кишки, рак головы и шеи, рак шейки матки, рак предстательной железы, рак печени,плоскоклеточный рак (ротовой полости), рак кожи или медуллобластому (Ranganathan et al., Nature Review Cancer. 2011(11):338-351 и Supplementary information S1 (table. Подавление передачи сигнала с рецепторов Notch представляется важной задачей для достижения терапевтической пользы для пациентов, страдающих раковым заболеванием, заболевание которых было вызвано ошибочной активацией конститутивных путей передачи сигнала с рецепторов Notch. Shih et al. Cancer Research. 2007(67)18791882. Следующие исследования in vitro и in vivo демонстрируют ингибирующую активность в отношении сигнальных путей, опосредуемых Notch, и эффективность соединения 1 для линий клеток разных специфических типов рака. Указанные исследования, как правило, считаются специалистами в данной области техники показательными в том, что касается клинической химиотерапевтической активности у человека. Предполагается, что ингибирование отщепления внутриклеточного домена Notch ферментом секретазой эффективно в отношении каждого из рецепторов Notch 1, Notch 2, Notch 3 и Notch 4. Пробы,свидетельствующие в пользу ингибирующей активности в отношении сигналинга, опосредуемого Notch,- 15023044 можно проводить следующим образом или можно проводить сходные пробы для получения аналогичных данных. Исследование с визуализацией накопления Notch1 в ядре клеток N1ICD. Клетки HEK293AE12 (клетки HEK293 модифицированы таким образом, чтобы стабильно экспрессировать кДНК Notch1 мыши, кодирующую аминокислоты 1703-2183, NP032740.3, с последовательностью сигнального пептида из 23 аминокислот MPRLLTPLLCLTLLPALAARGLR (SEQ ID NO: 1), на егоN-конце) засевают на лунки с плотностью 5000 клеток/лунку в планшетах на 96 лунок и инкубируют в среде Игла, модифицированной по способу Дульбекко, с высоким содержанием глюкозы и 5% эмбриональной бычьей сывороткой при 37C, 5% CO2 в течение 24 ч. Клетки обрабатывают тестируемым соединением в 10 разных дозах путем разведения 1:3 в диапазоне от 1000 до 0,05 нМ и с конечной концентрацией диметилсульфоксида (ДМСО) 0,2%. После воздействия в течение 24 ч планшеты с клетками последовательно подвергают следующим этапам: клетки фиксируют фиксатором PREFER в количестве 100 мкл/лунку в течение 30 мин при комнатной температуре (КТ); пермиабилизируют клетки 0,1% ТРИТОНОМ X100 в фосфатно-солевом буфере (ФСБ) в количестве 100 мкл/лунку в течение 20 мин при КТ; промывают 3 раза ФСБ в количестве 100 мкл/лунку на один раз; добавляют 50 мкл/лунку антиNHCD (внутриклеточный домен рецептора Notch1) антитела кролика, в разведении 1:2000 в ФСБ с 1% бычьим сывороточным альбумином и инкубируют 1,5 ч при 37C; промывают 3 раза ФСБ в количестве 100 мкл/лунку на один раз; инкубируют с 50 мкл/лунку антителом козы к IgG кролика Alexa 488 в разведении 1:1000 в ФСБ с 1% бычьим сывороточным альбумином в течение 1 ч при 37C; промывают 3 раза ФСБ в количестве 100 мкл/лунку на один раз; и добавляют 100 мкл/лунку 15 мкМ пропидиума иодида с 50 мкг/мл РНКазы, оставляя на 30 мин, чтобы окрасились ядра. Планшеты сканируют на лазерном сканирующем флуоресцентном цитометре для микропланшетов ACUMEN EXPLORER (TTP LABTECHLTD) с целью подсчета общего количество клеточных ядер/лунку и общей площади ядер/лунку с флуоресценцией на 655-705 нм (эмиссия связанного с ДНК пропидия иодида) и с флуоресценцией антитела,связывающегося с N1ICD в области ядра на 505-530 нм. Основным результатом данной пробы является отношение общей флуоресценции ядерного N1ICD к общей площади ядер - нормированный сигнал ядерного N1ICD. Анализ профиля относительной цитотоксичности определяли как % количества клеток к количеству контрольных клеток в ДМСО. На пептид человека, соответствующий N-концевому сайту расщепления Notch1 в положении Val1744, образуется антитело, которое распознает Notch1 или N1ICD. В необработанных контрольных клетках N1ICD, сгенерированный из Notch1, будет транслоцироваться и накапливаться в ядрах. Когда клетки обрабатывают соединением, ингибирующим расщепление Notch 1,сигнал от ядерного N1ICD будет уменьшаться. Зависимость "ответ-концентрация" и IC50 (концентрация 50% ингибирования) определяют по кривой, аппроксимирующей сигнал ядерного N1ICD по логистической функции с четырьмя параметрами, а % количества клеток откладывают на том же графике для анализа профиля цитотоксичности. При проведении анализа по существу, как описано выше, средняя IC50 для соединения 1 составляет 0,41 нМ (n=7). Соединение не влияет на количество клеток до концентрации 1000 нМ. Указанные данные свидетельствуют о том, что соединение 1 обладает сродством к Notch 1 и ингибирует внутриклеточное накопление сигнального пептида внутриклеточного домена Notch 1. Ингибирование расщепления N1ICD в линиях клеток опухолей человека. Чтобы оценить активность соединения 1 в отношении его способности к ингибированию расщепления N1ICD, применяют несколько линий клеток опухолей человека. А 2780 является линией клеток рака яичника (Sigma-Aldrich,93112519), MIA РаСа-2 является линией клеток поджелудочной железы человека (АТСС (Американская коллекция типовых культур)CRL-1420); ВхРС-3 является линией клеток поджелудочной железы человека (АТССCRL-1687); SW480 является линией клеток ободочной и прямой кишки человека (АТССCCL-228); НСТ 116 является линией клеток ободочной и прямой кишки человека (АТССCCL-247); DLD-1 является линией клеток ободочной и прямой кишки человека(АТССCCL-221); MDA-MB-231 является линией клеток молочной железы человека (АТССНТВ 26); U-87 MG является линией клеток глиобластомы человека (АТССНТВ-14); А 375 является линией клеток злокачественной меланомы человека (АТССCRL-1619); CCRF-CEM является линией клеток острого лимфобластного лейкоза (ОЛЛ) человека (АТССCCL-119); SUP-T1 является линией клеток Т-клеточного лимфобластного лейкоза человека (АТССCRL-1942); K-562 является линией клеток хронического миелогенного лейкоза (ХМЛ) человека, характеризующейся наличием гибридного транскрипта, состоящего из генов Bcr и Abl1 (ATCCCCL-243); Jurkat, клон Е 6-1, является линией клеток Тклеточного острого лейкоза человека (АТССTIB-152); MOLT-3 является линией клеток острого лимфобластного лейкоза (ОЛЛ) человека (АТССCRL-1552); MOLT-4 является линией клеток острого лимфобластного лейкоза (ОЛЛ) человека (АТССCRL-1582); HEL 92.1.7 является линией клеток эритролейкемии человека (АТССTIB-180). Каждую из линий клеток получают из Американской коллекции типовых культур (АТСС) под установленным номером АТСС, за исключением линии клеток А 2780,которую получают от компании "Sigma-Aldrich" под установленным каталожным номером. Клетки выращивают на соответствующих им питательных средах при 37C в 5% CO2 с влажностью в атмосфере. Питательной средой для клеток карциномы яичника А 2780 является среда RPMI-1640 (без фенолового красного) с 2,05 мМ L-глутамина, с добавлением 2 мМ L-глутамина, 0,01 мг/мл инсулина и 10% эмбриональной бычьей сыворотки (ЭБС); питательной средой для клеток рака ободочной и прямой кишки человека НСТ 116 является среда McCoy's 5 А с 1,5 мМ L-глутамина, 0,075% Na бикарбоната и 10% ЭБС; для клеток рака ободочной и прямой кишки человека применяют среду RPMI-1640 с 2,05 мМ L-глутамина,20 мМ HEPES и 10% ЭБС; для клеток глиобластомы человека U-87 MG применяют минимальную питательную среду/ сбалансированный солевой раствор Эрла с 2 мМ L-глутамина, 0,1 мМ заменимых аминокислот (NEAA), 1 мМ пирувата Na и 10% ЭБС; для клеток рака поджелудочной железы MIA РаСа-2 применяют среду Игла, модифицированную по способу Дульбекко (DMEM) без пирувата Na, с высоким содержанием глюкозы (4500 мг/мл), 4 мМ L-глутамина, 2.5% лошадиной сыворотки и 10% ЭБС; для клеток ХМЛ человека K-562 применяют DMEM с высоким содержанием глюкозы (4500 мг/мл), 4 мМ Lглутамина, 10 мМ HEPES, 0,1 мМ NEAA, 1 мМ пирувата Na и 10% ЭБС; для клеток острого Тклеточного лейкоза человека Jurkat, клон Е 6-1, применяют RPMI-1640 с 2,05 мМ L-глутамин, 2,5 г/л глюкозы, 10 мМ HEPES, 1 мМ пирувата Na, 0,075% бикарбоната Na и 10% ЭБС; для клеток злокачественной меланомы человека А-375 и клеток аденокарциномы молочной железы человека MDA-MB-231 применяют DMEM с высоким содержанием глюкозы (4500 мг/мл), 4 мМ L-глутамина и 10% ЭБС; для клеток аденокарциномы поджелудочной железы человека ВхРС-3, клеток аденокарциномы ободочной и прямой кишки DLD-1, клеток лимфобластного лейкоза человека SUP-T1, клеток ОЛЛ человека MOLT-3,клеток ОЛЛ человека Molt-4, клеток ОЛЛ человека CCRF-СЕМ и клеток эритролейкемии человека HEL 92.1.7 применяют среду RPMI-1640 с 2,05 мМ L-глутамина, 2,5 г/л глюкозы, 20 мМ HEPES, 1 мМ пирувата Na и 10% ЭБС. Когда непрерывный слой клеток охватывает 80-90%, клетки обрабатывают соединением, в 10 разных дозах путем разведения 1:3 в диапазоне от 50 до 0,0025 нМ, и с конечной концентрацией диметилсульфоксида (ДМСО) 0,01%. После воздействия в течение 24 ч планшеты с клетками последовательно подвергают следующим этапам: клетки собирают после трипсинизации, один раз промывают ледяным ФСБ и проводят лизис при помощи 100 мкл ледяного лизирующего буфера XY (25 мМ Трис pH 7,5, 10 мг/мл ингибитора трипсина/хемотрипсина, 10 мг/мл апротинина, 60 мМ бета-глицеринфосфата, 1% Тритона Х-100, 10 мМ NaF, 2,5 мМ пирофосфата, 150 мМ NaCl, 15 мМ этилендиаминтетрауксусной кислоты (EDTA) pH 8,0, 5 мМ этиленгликоль-бис-(2-аминоэтил-эфир)-N,N,N',N'тетрауксусной кислоты (EGTA) pH 8,0, 1 мМ ванадата Na, 10 мг/мл лейпептина, 1 мМ дитиотреитола, 1 мкМ микроцистина-LR, 10 мг/мл N-p-тозил-L-фенилаланин-хлорметил-кетона (ТРСК), 2 мМ N-р-тозилL-аргинин-метилого эфира гидрохлорида (TAME), 15 мМ соли 4-нитрофенил-фосфат-ди(трис) (PNPP),0,1 мМ 4-(2-аминоэтил)бензолсульфамид-фторид гидрохлорида (AEBSF), 5 мМ бензамидина, 1 мкМ окадаиковой кислоты), включающего 1 х таблетку Complete (Roche Complete11697498001) и 1 х коктейль ингибиторов протеаз ("Sigma Aldrich" P8340). Лизат инкубируют на льду в течение 15 мин с кратковременным встряхиванием каждые 5 мин и подвергают действию ультразвука в течение 1 мин на льду. Пробы центрифугируют при 4C в центрифуге для эппендорфов при 30000 об/мин в течение 30 мин, и для анализа отбирают 80 мкл надосадочной жидкости. Общую концентрацию белка определяют при помощи набора Pierce BCA Protein Assay Kit ("Thermo Scientific", Рокфорд, Иллинойс) с применением планшетного ридера Thermomax ("Molecular Devices", г. Саннивейл, Калифорния). УровеньN1ICD определяют при помощи изготовленного на заказ набора для твердофазного иммуноферментного анализа (ELISA) N1ICD. Анализируемое вещество захватывается созданным на заказ моноклональным расщепленный Notch1 (Val1744)-специфичным антителом кролика, и его определяют при помощи метки на С-конце Notch1 SULFO-TAG ("Meso Scale Diagnostics", Гейтерсберг, Мэриленд), состоящей из антитела овцы ("RD Systems", Миннеаполис, Миннесота). Лизаты разводят до концентрации 1 мкг/мл в ледяном лизирующем трис-буфере R60TX для ELISA ("Meso Scale Diagnostics", Гейтерсберг, Мэриленд),включающем 1 х таблетку Complete (Roche Complete11836153001) и 1 х коктейль ингибиторов протеаз ("Sigma Aldrich" P8340). И 25 мкл добавляют в планшет для ELISA. Инкубацию 25 мг белкового лизата проводят при КТ в течение 1 ч для каждого для захвата анализируемого вещества и с антителом,применяемым для определения. Показатели с планшетов считывают на устройстве для визуализации 6000 ("Meso Scale Discovery", Гейтерсберг, Мэриленд). Показатель N1ICD после вычитания фонового сигнала нормируют на общий белок и выражают в % ингибирования относительно группы, обработанной основой. Значение IC50 определяют путем аппроксимации данных "концентрация-ответ" с применением "сигмовидной модели зависимости "доза-ответ" с 4 параметрами (переменный наклон) при помощи программы GraphPad Prism 4. Значение IC50 для соединения 1 в линиях клеток разных типов рака представлены в табл. 2. Данные в табл. 2 свидетельствуют об активности соединения 1 в отношении его способности к ингибированию генерирования сигнального пептида N1ICD путем ингибирования активности -секретазы и, как следствие, накопления сигнального пептида N1ICD в линиях клеток специфических опухолей человека. Исследования эффективности и целевого ингибирования in vivo. Исследования на животных. Чтобы оценить эффективность и действие соединения 1 на фармакодинамику ингибирования Notchin vivo, применяют несколько моделей на основании линий клеток и полученных от пациентов ксенотрансплантатов. Клетки А 2780 (2106), SW480 (6106), НСТ 116 (6106), U-87 MG (6106) и А-375(10106) в смеси с матригелем в соотношении 1:1 (объем 0,2 мл) имплантируют посредством подкожной инъекции в заднюю лапу самкам бестимусных мышей в возрасте 6-8 недель ("Harlan Laboratories"). Клетки К-562 (6106) в смеси с матригелем в соотношении 1:1 (объем 0,2 мл) имплантируют посредством подкожной инъекции в заднюю лапу самкам мышей CD1 n/n в возрасте 6-8 недель ("Charles RiverLaboratories"). Клетки HEL 92.1.7 (7106) в смеси с матригелем в соотношении 1:1 (объем 0,2 мл) имплантируют посредством подкожной инъекции в заднюю лапу самкам мышей СВ 17 с тяжелым сочетанным иммунодефицитом в возрасте 6-8 недель ("Taconic Farms"). Полученные от пациентов опухоли разрезают на мелкие куски размером 1-2 мм и смешивают с матригелем (1:1) в объеме 0,2 мл и имплантируют посредством подкожной инъекции в заднюю лапу самкам бестимусных мышей в возрасте 6-8 недель ("Harlan Laboratories"). Модель на основе полученных от пациентов опухолей включает глиобластому человека (EL2144), трижды негативную инвазивную карциному протоков молочной железы человека (EL1997) и рак ободочной и прямой кишки человека (EL1989, EL 1986 и EL 2056), причем образцы получены после согласия пациентов и одобрения стационара со стороны IU Health, Methodist Hospital,Индианаполис, Индиана, США 46206. В каждой группе применяют от 7 до 10 мышей. Непосредственно перед имплантацией А 2780, SW480, HEL 92.1.7, А-375, К-562 и полученных от пациентов опухолей животных облучали (450 облучение всего тела). Мышей кормят в неограниченном количестве нормальной пищей. Воздействие инициируют путем перорального введения (зонд) соединения или основы (1% NaCMC в 0,25% Твин-80) в объеме 0,2 мл, когда размер опухоли достигает 15050 мм 3. В назначенные моменты времени после воздействия животных умерщвляют путем удушения CO2 и смещения шейных позвонков. Опухоли удаляют и применяют их для анализа фармакодинамического ответа. Во времени отслеживают рост опухоли и массу тела с целью оценки эффективности и признаков токсичности. Измере- 18023044 ния опухоли по двум координатам проводят два раза в неделю и рассчитывают объем опухоли по следующей формуле: (объем опухоли)=[(L)(W2)(П/6)], где L - длина по средней оси, a W - ширина по средней оси. Данные об объеме опухоли переводят в логарифмическую шкалу, чтобы уравнять колебание по времени и группам воздействия. Данные об объеме опухоли анализируют при помощи двустороннего дисперсионного анализа для повторных измерений по времени и применяемому воздействию с применением процедур MIXED в программе SAS (версия 8.2). Корреляционная модель для повторных измерений обладает пространственной мощностью. Группы, перенесшие воздействие, сравнивают с контрольной группой в каждый момент времени. Также процедуру MIXED применяют отдельно для каждый группы воздействия для расчета приведенного среднего и среднеквадратичной ошибки. Оба типа анализа учитывают автокорреляцию в пределах каждого животного и потерю данных, которая возникает, когда у животного развивается большая опухоль, и его рано исключают из исследования Приведенное среднее и среднеквадратичные ошибки строят на графиках для каждой группы воздействия от времени. Противоопухолевую активность выражают в проценте ингибирования роста опухоли (%ИРО) и рассчитывают ее путем сравнения объема опухоли в группе воздействия и в контрольной группе, получавшей основу. Процент ингибирования роста опухоли (%ИРО) и показатель статистической значимости(р-значение) для соединения 1 измеряют по существу, как описано выше, и они в в обобщенном виде приведены в табл. 3. Анализ N1ICD. Чтобы оценить уровень N1ICD в опухолях, от замороженной опухоли отрезают приблизительно 75 мг и разрезают на мелкие куски перед гомогенизацией (регистрируют фактическую массу). Пробы замороженной опухоли переносят в пробирки для лизиса Matrix-D и повторно суспендируют в ледяном лизирующем буфере XY (25 мМ Трис pH 7,5, 10 мг/мл ингибитора трипсина/хемотрипсина, 10 мг/мл апротинина, 60 мМ бета-глицерин-фосфата, 1% Тритона Х-100, 10 мМ NaF, 2,5 мМ пирофосфата, 150 мМ NaCl, 15 мМ этилендиаминтетрауксусной кислоты (EDTA) pH 8,0, 5 мМ этиленгликоль-бис-(2 аминоэтил-эфир)-N,N,N',N'-тетрауксусной кислоты (EGTA) pH 8,0, 1 мМ ванадата Na, 10 мг/мл лейпептина, 1 мМ дитиотреитола, 1 мкМ микроцистина-LR, 10 мг/мл N-p-тозил-L-фенилаланин-хлорметилкетона (ТРСК), 2 мМ N-р-тозил-L-аргинин-метилого эфира гидрохлорида (TAME), 15 мМ соли 4 нитрофенил-фосфат-ди(трис) (PNPP), 0,1 мМ 4-(2-аминоэтил)бензолсульфамид-фторид гидрохлоридаComplete11697498001) и 1 х коктейль ингибиторов протеаз ("Sigma Aldrich" P8340) в отношении масса: объем 75 мг/мл буфера Ткани гомогенизируют в гомогенизаторе Fast Prep FP120 ("Thermo Scientific", Рокфорд, Иллинойс) со скоростью 6,0 в течение 30 с при 4C, а затем инкубируют 15 мин на льду. Данную процедуру повторяют всего 2-3 цикла, пока гомогенизация не будет полной. Лизат центрифугируют при 4C в центрифуге для эппендорфов при 30000 об/мин в течение 15 мин, чтобы удалить обломки клеток. Отбирают 400 мкл надосадочной жидкости и переносят их в новый эппендорф и подвергают циклу замораживания/размораживания. Пробы повторно центрифугируют при 4C в центрифуге для эппендорфов при 30000 об/мин в течение 30 мин, и для анализа отбирают 120 мкл надосадочной жидкости. Общую концентрацию белка определяют при помощи набора Pierce BCA Protein Assay Kit ("ThermoScientific", Рокфорд, Иллинойс), с применением планшетного ридера Thermomax ("Molecular Devices",г. Саннивейл, Калифорния). Уровень N1ICD определяют при помощи изготовленного на заказ набора для ELISA N1ICD. Анализируемое вещество захватывается созданным на заказ моноклональным расщепленный Notch 1 (Val1744)-специфичным антителом кролика, и его определяют при помощи метки на Сконце Notch1 SULFO-TAG ("Meso Scale Discovery", Гейтерсберг, Мэриленд), состоящей из антитела овцы ("RD Systems", Миннеаполис, Миннесота). Лизаты разводят до концентрации 2 мкг/мл в ледяном лизирующем трис-буфере R60TX для ELISA ("Meso Scale Discovery", Гейтерсберг, Мэриленд), включающем 1 х таблетку Complete (Roche Complete mini11836153001) и 1 х коктейль ингибиторов протеаз ("Sigma Aldrich" P8340), и 25 мл добавляют в планшет для ELISA. Инкубацию 50 мг белкового лизата проводят при КТ в течение 1 ч для каждого для захвата анализируемого вещества и с антителом, применяемым для определения. Показатели с планшетов считывают на устройстве для визуализации 6000("Meso Scale Discovery", Гейтерсберг, Мэриленд). Показатель N1ICD после вычитания фонового сигнала нормируют на общий белок и выражают в % ингибирования относительно группы, обработанной основой. Процент ингибирования N1ICD и показатель статистической значимости (р-значение), определенный по способу Даннета в опухолях, отобранных через 4 ч после введения последней дозы соединения 1,анализируют по существу, как описано выше, и они в обобщенном виде приведены в табл. 3. Не определялось. Данные в табл. 3 свидетельствуют об угнетении роста опухоли и об ингибировании расщепленияN1ICD соединением 1 в разных моделях ксенотрансплантатов опухолей человека. Также данные в табл. 3 дают дополнительное подтверждение корреляции in vivo с функциональной активностью из данных,полученных на клетках, которые приведены в табл. 2. Метаболизм и выведение. Соединения, которые демонстрируют малую степень метаболизма и модуляции с участием цитохрома Р 450 (CYP450) или их отсутствие, обладают пониженной вероятностью возникновения нежелательных взаимодействий с другими лекарственными препаратами, принимаемыми пациентом, которые могут приводить к изменению доз или необходимости полностью прекратить прием лекарственных препаратов. Когда метаболизм с участием CYP450 приводит к заметному воздействию на пациента активного метаболита, возникают проблемы эффективности и безопасности вследствие более высокой вариабельности, ассоциированной с вкладом множества активных продуктов; следовательно, как правило,предпочтителен лекарственный препарат с отсутствием активных метаболитов. Желательны терапевтические агенты, демонстрирующие низкий уровень метаболизма и модуляции на CYP450, и они могут обладать более благоприятным профилем безопасности в организме человека и для пациентов. Lynch etal., Am. Fam. Physician. 76, 391 (2007). Потенциал взаимодействий через ферменты CYP450 нельзя прогнозировать исключительно на основании структуры активного фармацевтического ингредиента. Соединение 1 не является ингибитором или индуктором основных ферментов CYP450, и не было выявлено его метаболизма в какой-либо заметной степени в микросомах печени, оптимизированных по окислительному метаболизм CYP450. У крыс и собак in vivo, ни в кровяном русле, ни в экскретах основные окислительные метаболиты выявлены не были. Следовательно, соединение 1 обладает низкой вероятностью к проявлению CYP450-опосредуемых взаимодействий с другими лекарственными препаратами, которые могли бы приводить к корректировке доз или необходимости ограничить или прекратить прием дополнительных лекарственных препаратов у пациентов, лечащихся от рака. Исследование in vivo с соединением 1 проводили на крысах с канюлированным желчным протоком и оценивали системную фармакокинетику (ФХ), выведение и метаболизм. В условиях in vivo 51% в/в дозы выводилось в неизменном виде, преимущественно с мочой, и имело место низкое системное воздействие (2% от исходного вещества) активного N-деалкилированного метаболита - 4,4,4-трифтор-N[(1S)-1-метил-2-оксо-2-(7S)-6-оксо-5,7-дигидропиридо[2,3-d][3]бензазепин-7 ил]амино]этил]бутанамида. Анализ профиля метаболитов в плазме крыс продемонстрировал отсутствие дополнительных циркулирующих метаболитов. Дополнительные исследования на собаках с интактным желчным протоком также подтвердили, что существенный клиренс происходит за счет выведения исходного вещества, а также подтвердили отсутствие основных циркулирующих активных метаболитов. В целом данные о метаболизме и выведении соединения 1 свидетельствуют о благоприятных механизмах клиренса (выведение с мочой исходного вещества и амидный гидролиз с образованием неактивных и нециркулирующих фрагментов, которые не образуются при инкубации с микросомами печени,оптимизированными по метаболизму на CYP450), а также об отсутствии значимых активных циркулирующих метаболитов. В клинических условиях свойства клиренса соединения 1, наблюдаемые в доклинических исследованиях, являются желательными. Известно, что соединения, элиминируемые преимущественно посредством окислительного метаболизма, проявляют вариабельное воздействие вследствие лекарственных взаимодействий с сопутствующими лекарственными препаратами и соками определенных фруктов/травами, заболеваний печени и различий в активности ферментов у разных пациентов. Предпочтительны множественные механизмы клиренса, поскольку это уменьшает влияние лекарственных взаимодействий, возникающих при любом пути элиминации. Следовательно, клиренс соединения 1 как путем выведения (51%), так и путем метаболизма (амидный гидролиз) без образования значимых активных циркулирующих метаболитов является благоприятным для пациента. В целом данные свойства клиренса снижают вероятность корректировки дозы в клинических условиях, а также минимизируют проблемы безопасности и эффективности, ассоциированные со значимыми активными циркулирующими метаболитами, введением сопутствующих лекарственных препаратов и различиями в активности CYP450 у разных пациентов. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение, имеющее структуру или его фармацевтически приемлемая соль или гидрат. 2. Соединение по п.1, которое находится в виде кристаллического гидрата, характеризующегося порошковой рентгеновской дифрактограммой, полученной при помощи излучения CuK, с максимумом на 22,970,2 2-тета в сочетании с одним или более максимумами на 11,960,2, 18,810,2, 20,780,2 или 21,070,2 2-тета при комнатной температуре и относительной влажности 20-60%. 3. Фармацевтическая композиция, обладающая ингибирующей активностью в отношении сигналинга, опосредуемого Notch, содержащая соединение по п.1 или его фармацевтически приемлемую соль или гидрат в совокупности с фармацевтически приемлемым носителем. 4. Применение соединения по п.1 или его фармацевтически приемлемой соли или гидрата при лечении рака, который представляет собой Т-клеточный острый лимфобластный лейкоз, острый лимфобластный лейкоз, острый миелогенный лейкоз, хронический миелогенный лейкоз, эритролейкемию, рак молочной железы, рак яичников, меланому, рак легких, рак поджелудочной железы, глиобластому, рак ободочной и прямой кишки, рак головы и шеи, рак шейки матки, рак предстательной железы, рак печени,плоскоклеточный рак (ротовой полости), рак кожи или медуллобластому. 5. Применение по п.4, где рак представляет собой Т-клеточный острый лимфобластный лейкоз,хронический миелогенный лейкоз, эритролейкемию, рак молочной железы, рак яичников, меланому, рак поджелудочной железы, глиобластому или рак ободочной и прямой кишки. 6. Применение соединения по п.1 или его фармацевтически приемлемой соли или гидрата при производстве лекарственного препарата для лечения рака, который представляет собой Т-клеточный острый лимфобластный лейкоз, острый лимфобластный лейкоз, острый миелогенный лейкоз, хронический миелогенный лейкоз, эритролейкемию, рак молочной железы, рак яичников, меланому, рак легких, рак поджелудочной железы, глиобластому, рак ободочной и прямой кишки, рак головы и шеи, рак шейки матки,рак предстательной железы, рак печени, плоскоклеточный рак (ротовой полости), рак кожи или медуллобластому. 7. Применение по п.6, где рак представляет собой Т-клеточный острый лимфобластный лейкоз,хронический миелогенный лейкоз, эритролейкемию, рак молочной железы, рак яичников, меланому, рак поджелудочной железы, глиобластому или рак ободочной и прямой кишки.
МПК / Метки
МПК: A61K 38/05, C07D 401/04, A61P 35/00, A61P 35/02, C07K 5/06
Метки: сигналинга, notch, соединения-ингибиторы, рецептором, опосредуемого
Код ссылки
<a href="https://eas.patents.su/23-23044-soedineniya-ingibitory-signalinga-oposreduemogo-receptorom-notch.html" rel="bookmark" title="База патентов Евразийского Союза">Соединения-ингибиторы сигналинга, опосредуемого рецептором notch</a>
Предыдущий патент: Огнестойкий материал для покрытий adina
Следующий патент: Новые замещенные производные индола в качестве модуляторов гамма-секретазы
Случайный патент: Способ определения дисбаланса барабана стиральной машины в режиме отжима, приводное устройство и стиральная машина с таким приводным устройством