Способ получения уплотненного промежуточного продукта дималеата bibw 2992 и твердые таблетки, полученные из такого продукта
Формула / Реферат
1. Способ получения уплотненного промежуточного продукта дималеата 4-[(3-хлор-4-фторфенил)амино]-6-{[4-(N,N-диметиламино)-1-оксо-2-бутен-1-ил]амино}-7-((S)-тетрагидрофуран-3-илокси)хиназолина (дималеат BIBW 2992) в форме порошка, включающий стадию ротационного уплотнения с последующей по крайней мере одной стадией просеивания, где стадию ротационного уплотнения проводят с использованием следующих материалов: дималеат BIBW 2992, в отдельности или с предварительно полученной смесью, содержащей дималеат BIBW 2992 со смазывающим веществом в количестве до 1,0 мас.% в гравитационном смесителе или барабанном смесителе для предотвращения прилипания к уплотняющим роликам.
2. Способ по п.1, где стадию ротационного уплотнения проводят на роликовом прессе
с расположением уплотняющих роликов горизонтально, вертикально или под углом 45°, причем поверхность уплотняющих роликов может быть гладкой или определенной формы;
с использованием силы уплотнения в интервале от 1 до 20 кН/см, при скорости вращения ротационных роликов в интервале от 1 до 30 об/мин и при ширине зазора между уплотняющими роликами от 1 до 10 мм.
3. Уплотненный промежуточный продукт, содержащий дималеат 4-[(3-хлор-4-фторфенил)амино]-6-{[4-(N,N-диметиламино)-1-оксо-2-бутен-1-ил]амино}-7-((S)-тетрагидрофуран-3-илокси)хиназолина (дималеат BIBW 2992), в форме порошка, полученный способом по п.1 или 2.
4. Уплотненный промежуточный продукт, содержащий дималеат 4-[(3-хлор-4-фторфенил)амино]-6-{[4-(N,N-диметиламино)-1-оксо-2-бутен-1-ил]амино}-7-((S)-тетрагидрофуран-3-илокси)хиназолина (дималеат BIBW 2992) и смазывающее вещество в количестве до 1,0 мас.% в расчете на массовое количество дималеата BIBW 2992, в форме порошка, полученный способом по п.1 или 2.
5. Уплотненный промежуточный продукт по п.3 или 4, характеризующийся следующим распределением частиц по размерам:
´10 < 200 мкм, 1мкм < ´50 < 300 мкм, 75 мкм < ´90 < 600 мкм.
6. Уплотненный промежуточный продукт по пп.3, 4 или 5, характеризующийся насыпной плотностью (ρp) в интервале 0,2 г/мл < ρp < 1,0 г/мл и/или фактором Хауснера (HF) в интервале 1,00 < HF < 1,30, измеренные в соответствии с параграфом 2.9.15 Европейской фармакопеи (4-е изд.).
7. Твердая пероральная таблетка, полученная из уплотненного промежуточного продукта дималеата BIBW 2992 по любому из пп.3-6, содержащая
от 1 до 150 мг BIBW 2992,
от 50 до 500 мг носителя, связующего вещества или их комбинации,
от 0,1 до 5 мг скользящего вещества,
от 1 до 15 мг дезинтегрирующего агента и
от 1 до 15 мг смазывающего вещества.
8. Таблетка по п.7, содержащая
от 20 до 70 мг BIBW 2992,
от 120 до 500 мг носителя, связующего вещества или их комбинации,
от 0,5 до 5 мг скользящего вещества,
от 2,5 до 15 мг дезинтегрирующего агента и
от 2,5 до 15 мг смазывающего вещества.
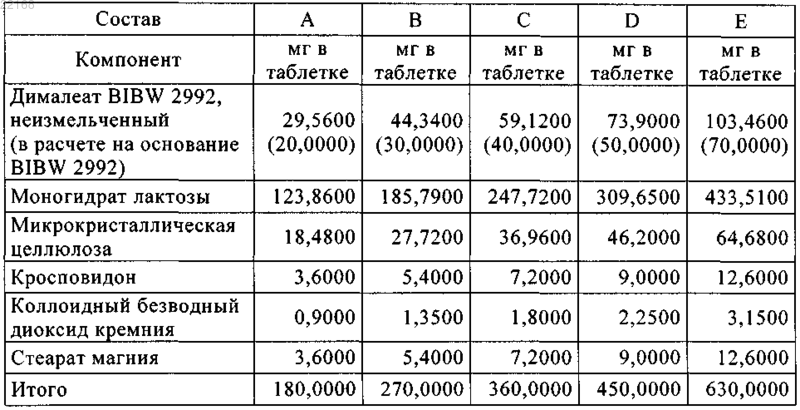
9. Таблетка по п.7 или 8, характеризующаяся следующими композициями, выбранными из составов А, В, С, D и Е:
10. Таблетка по п.9, покрытая пленочным покрытием, характеризующимся следующими композициями, выбранными из составов А, В, С, D и Е:
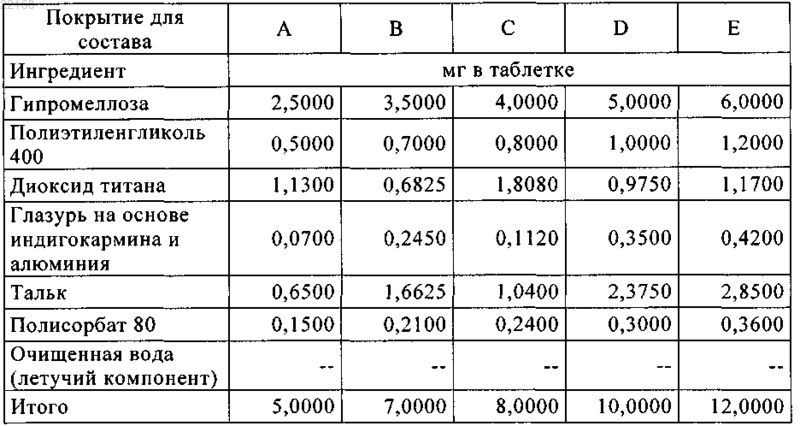
11. Таблетка по п.7, характеризующаяся следующими композициями, выбранными из составов F, G, H, I, J и K:
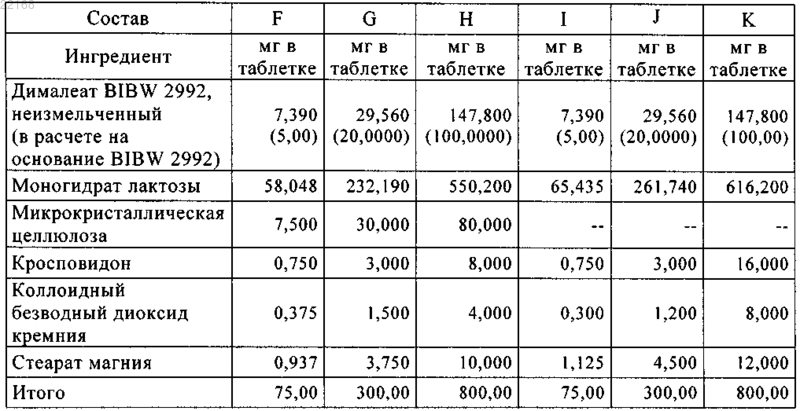
12. Таблетка по п.11, где составы F, G и Н покрыты пленочным покрытием, характеризующимся следующими композициями:
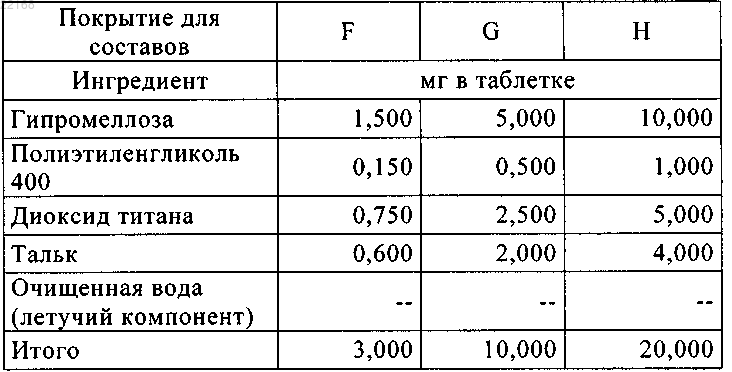
Текст
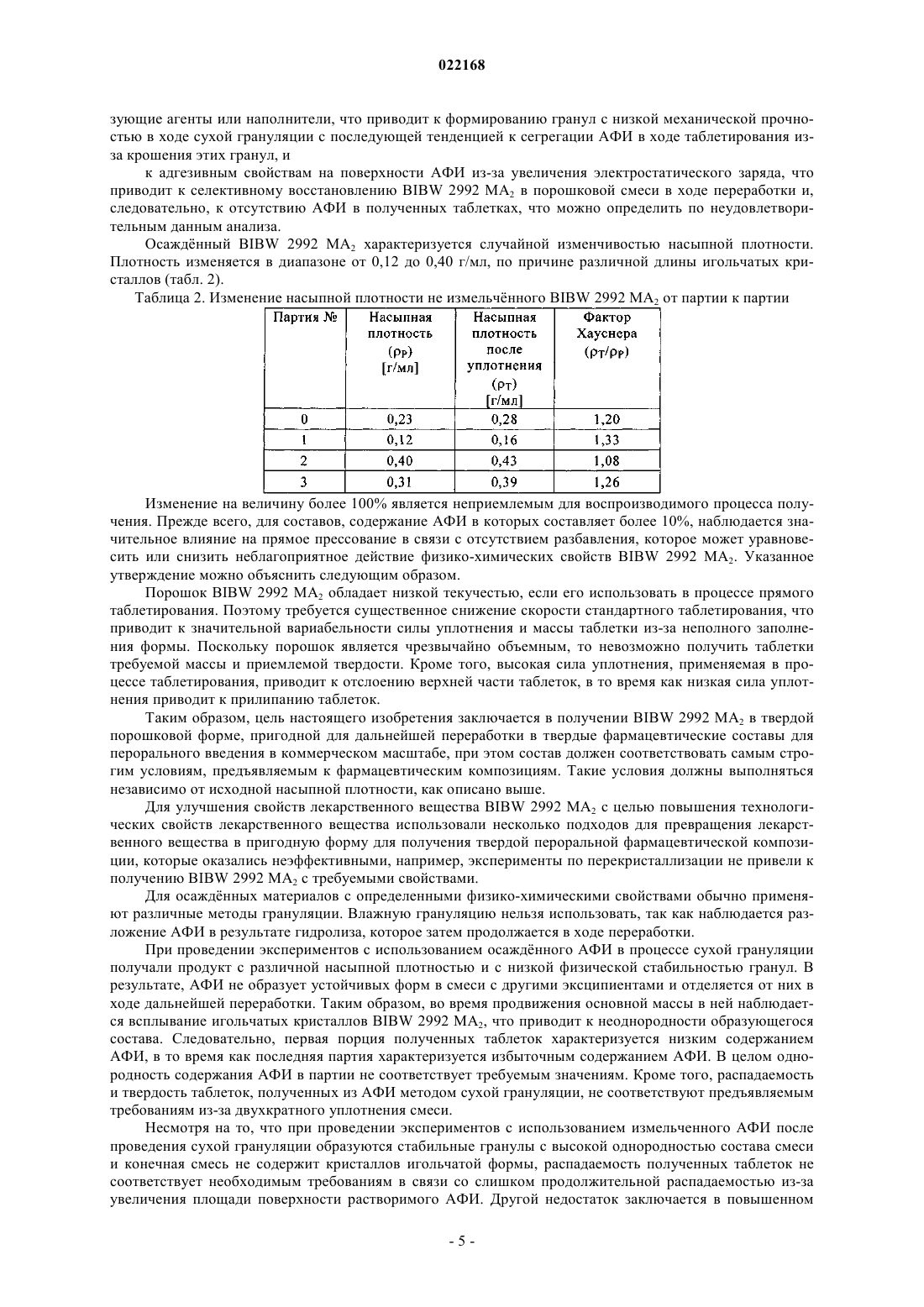
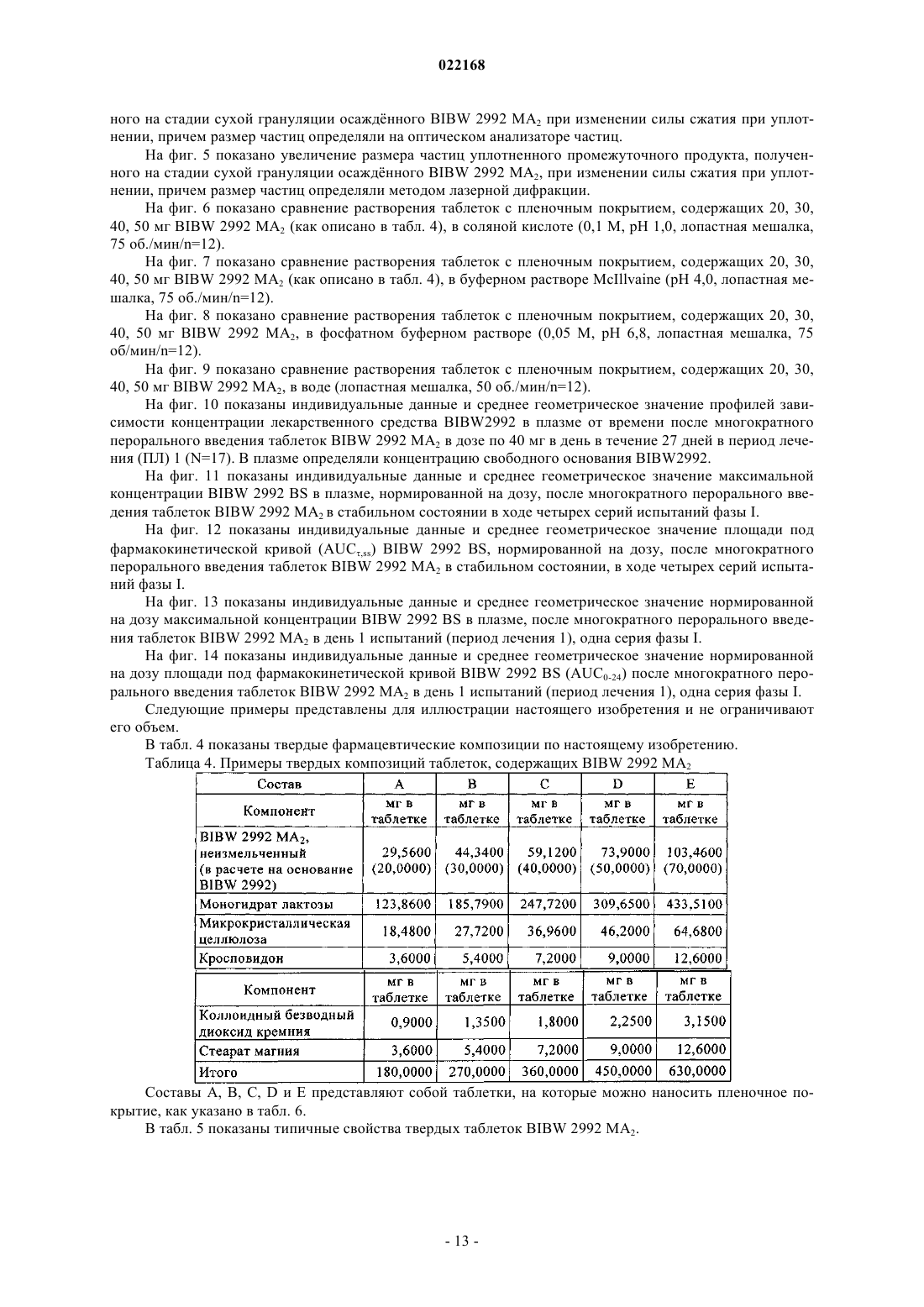
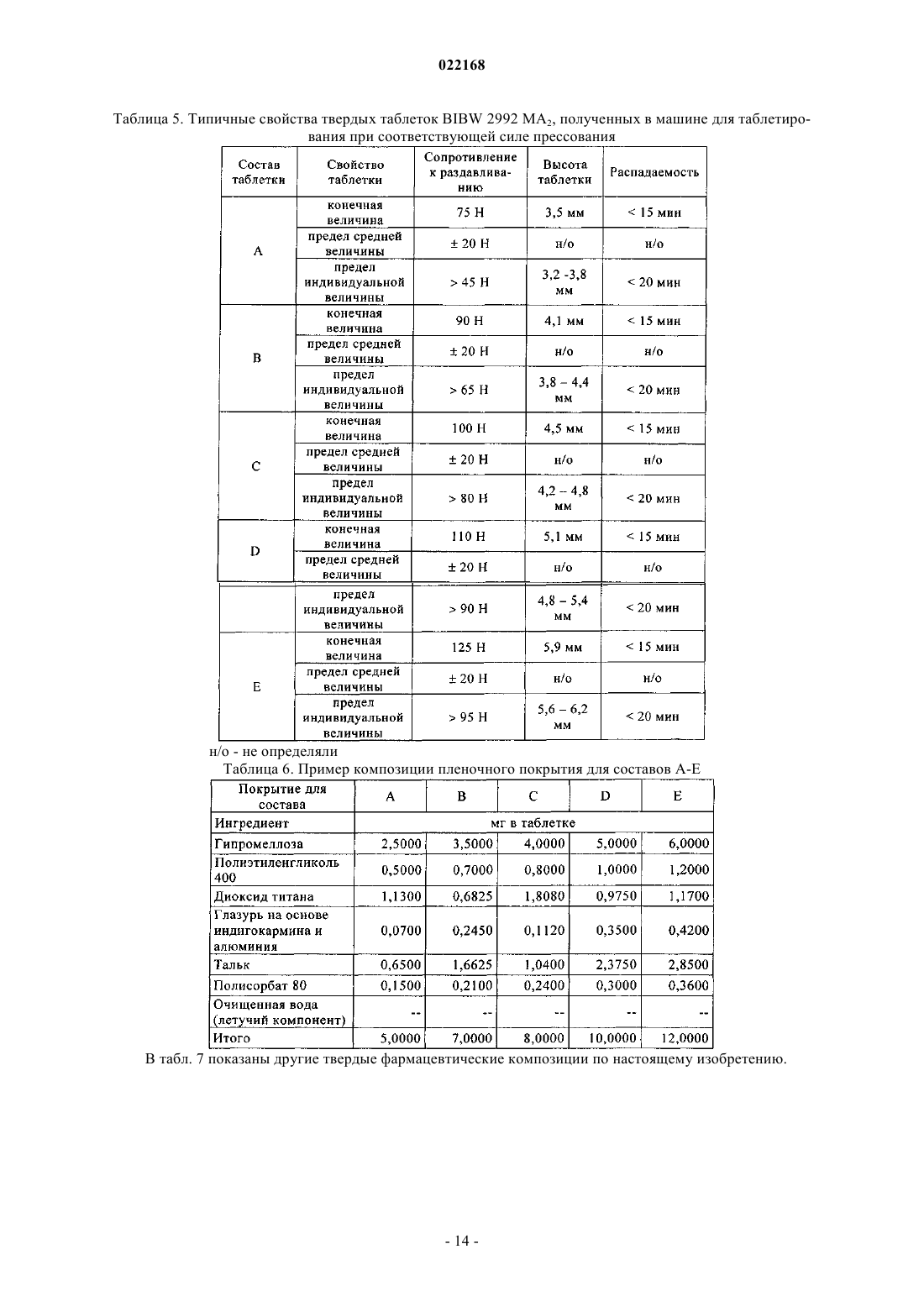
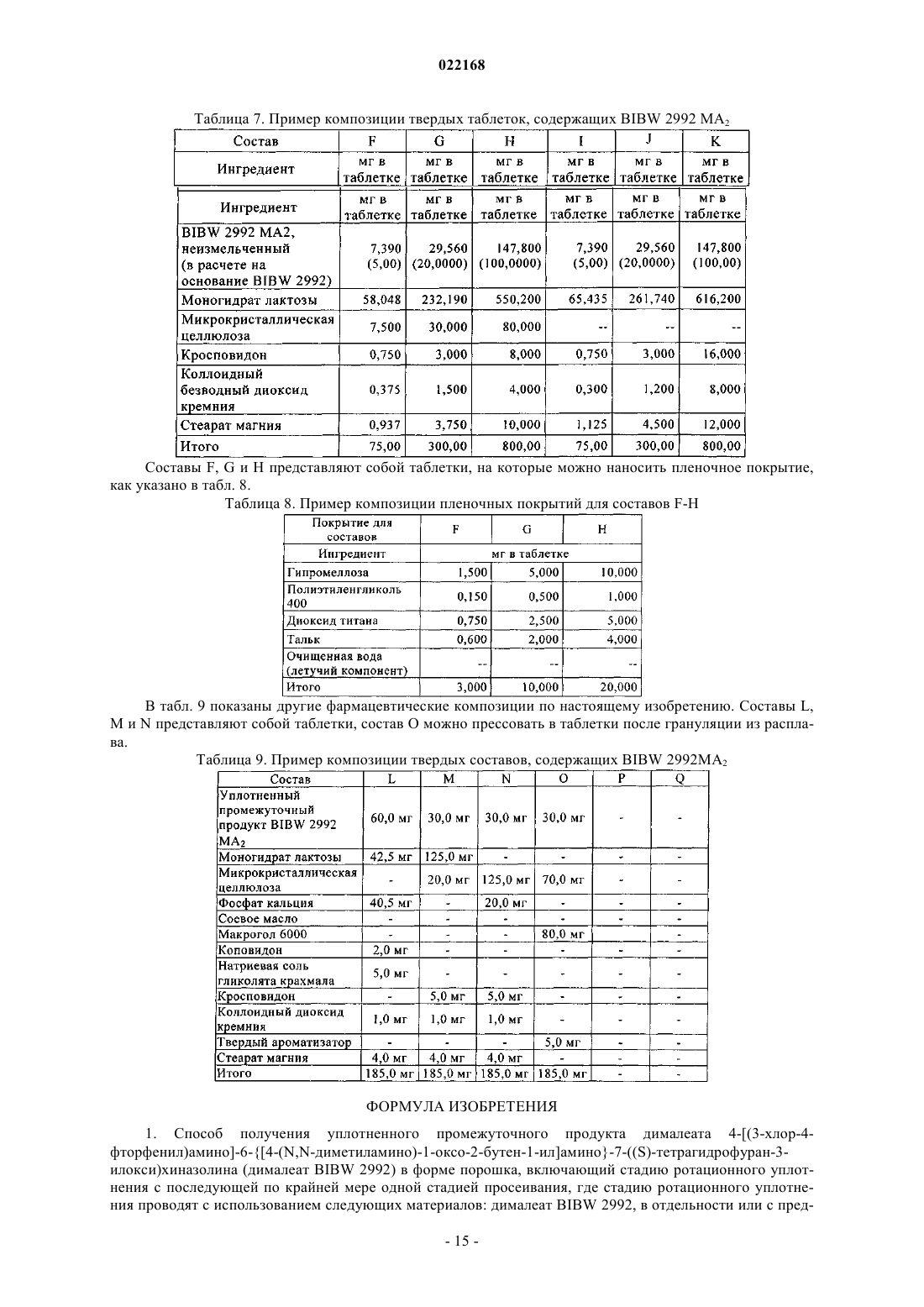
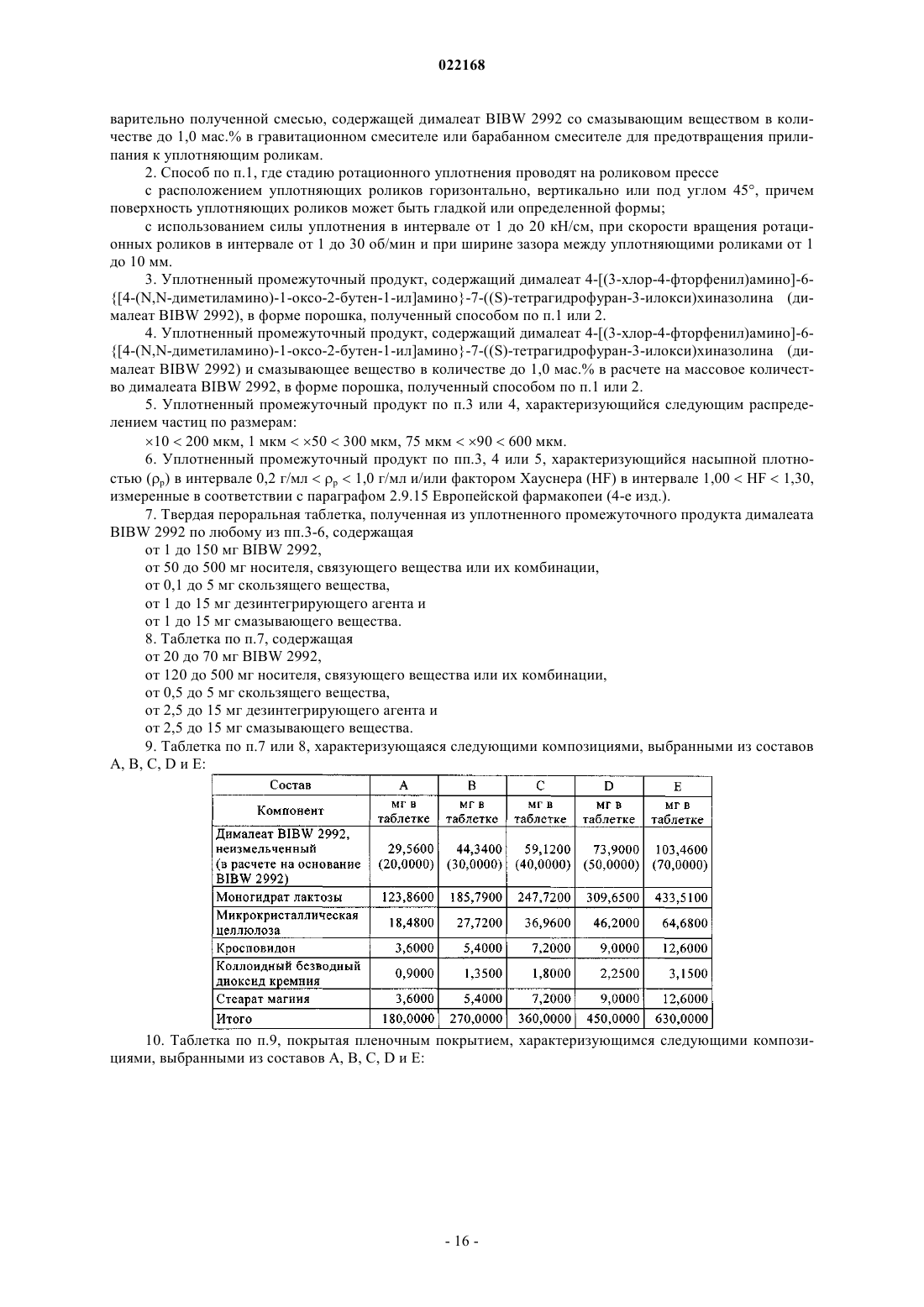
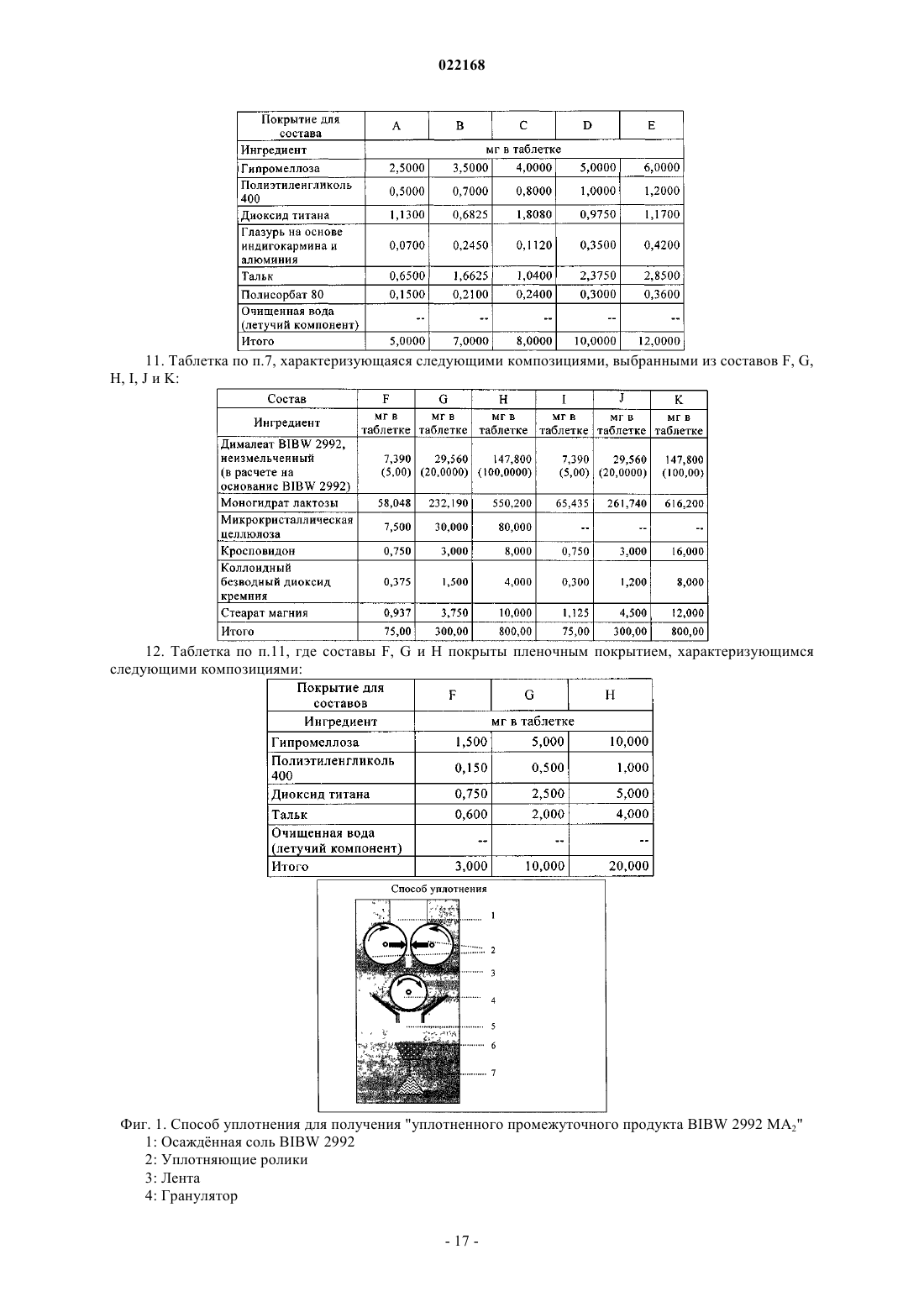
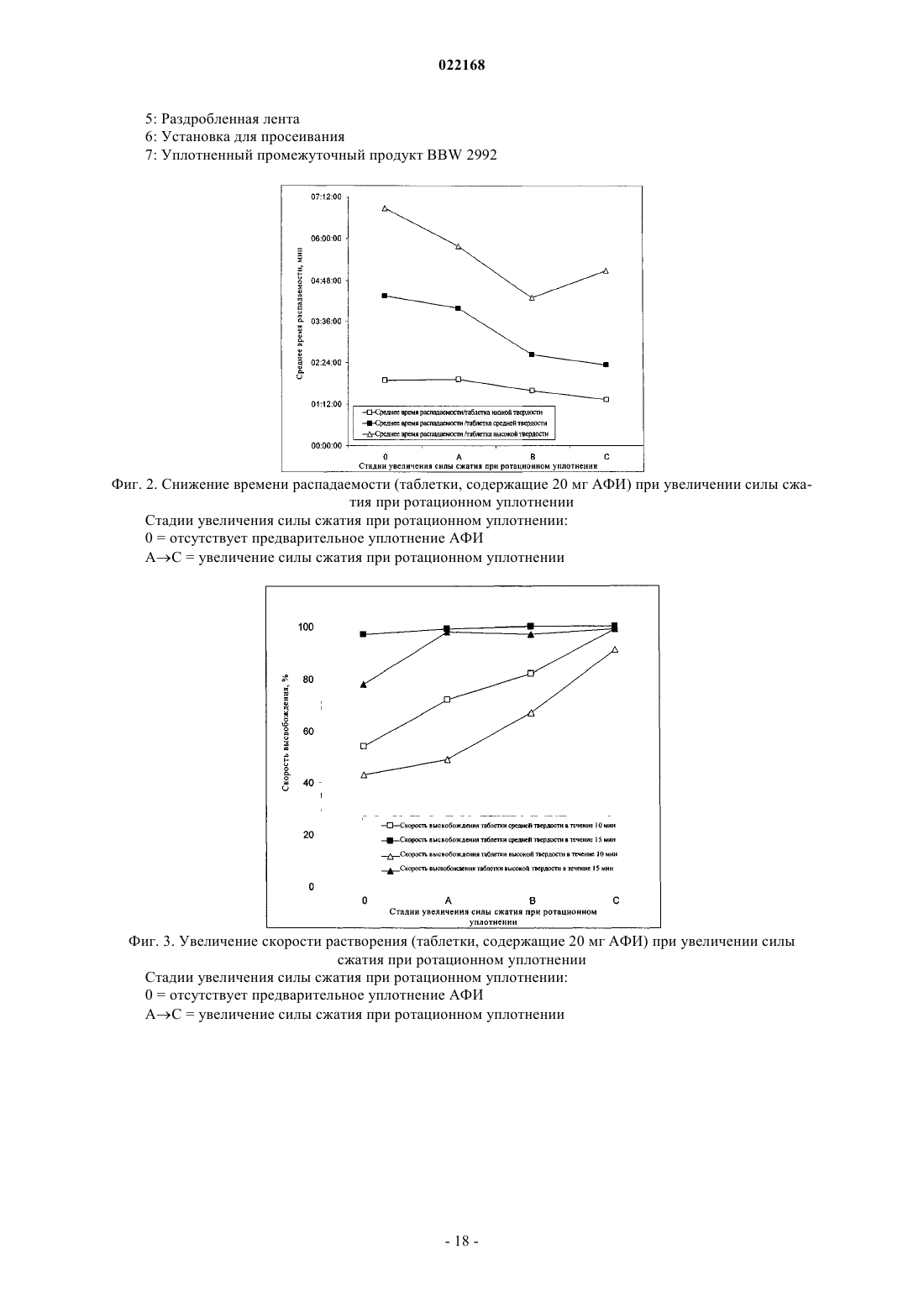
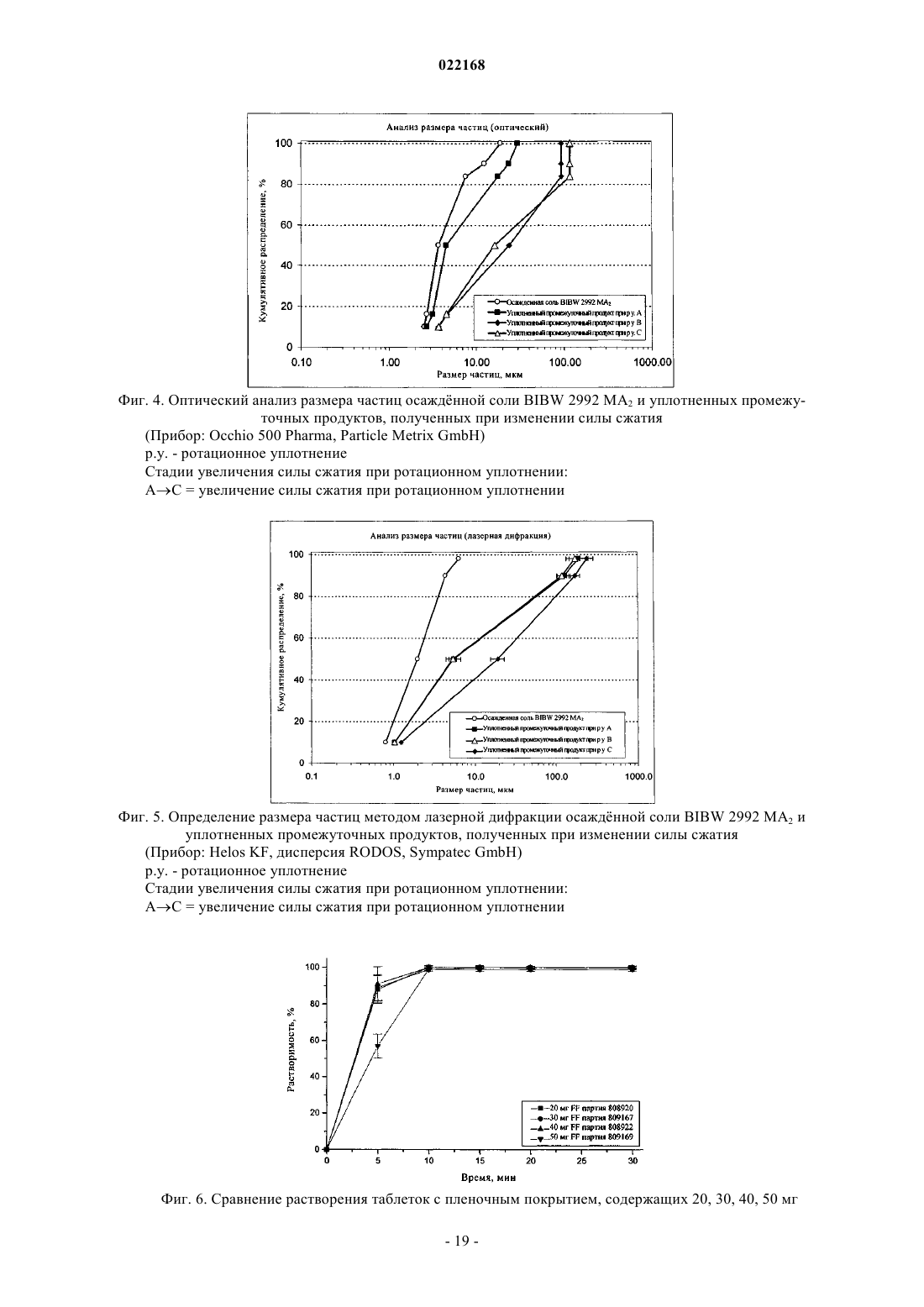
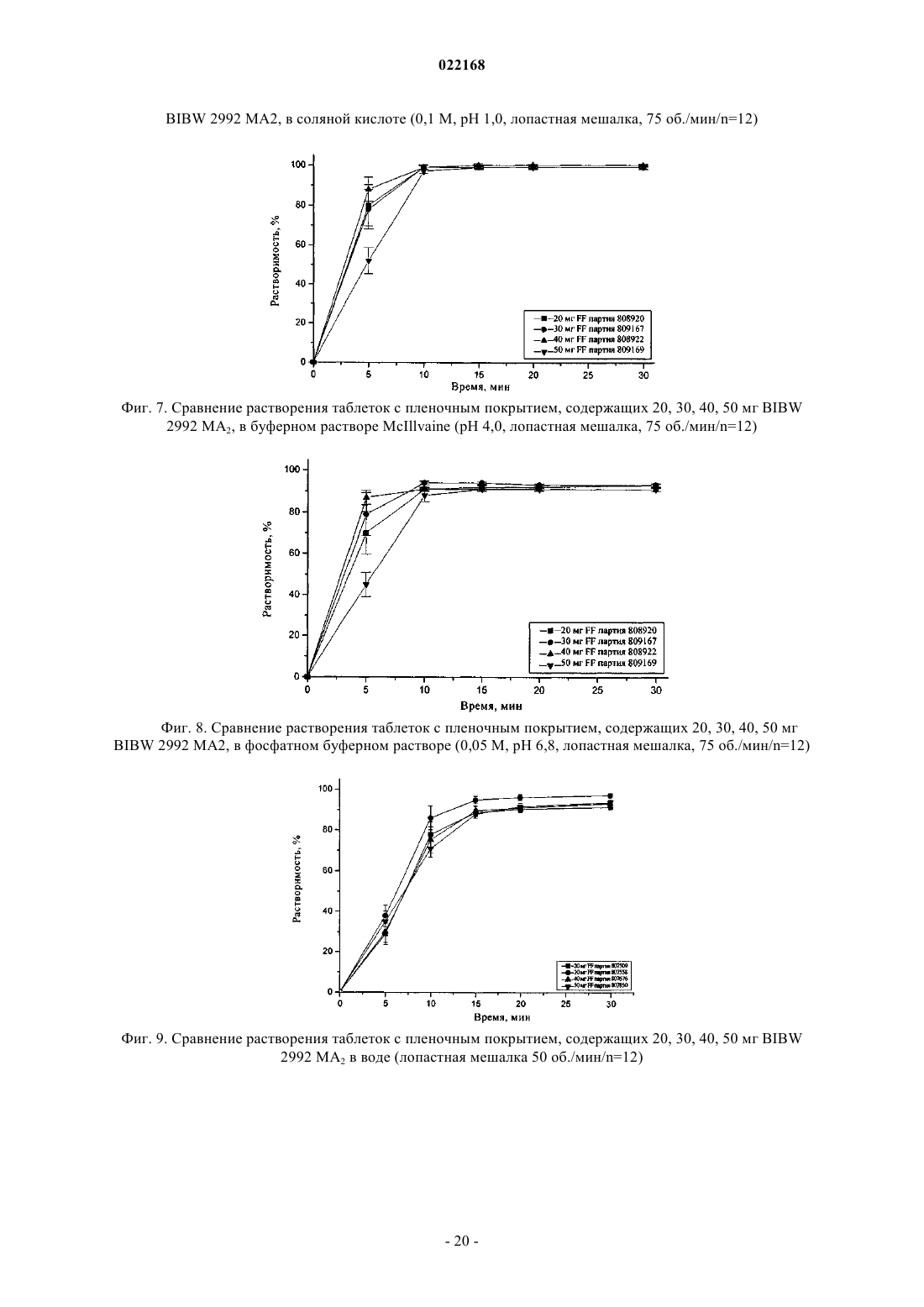
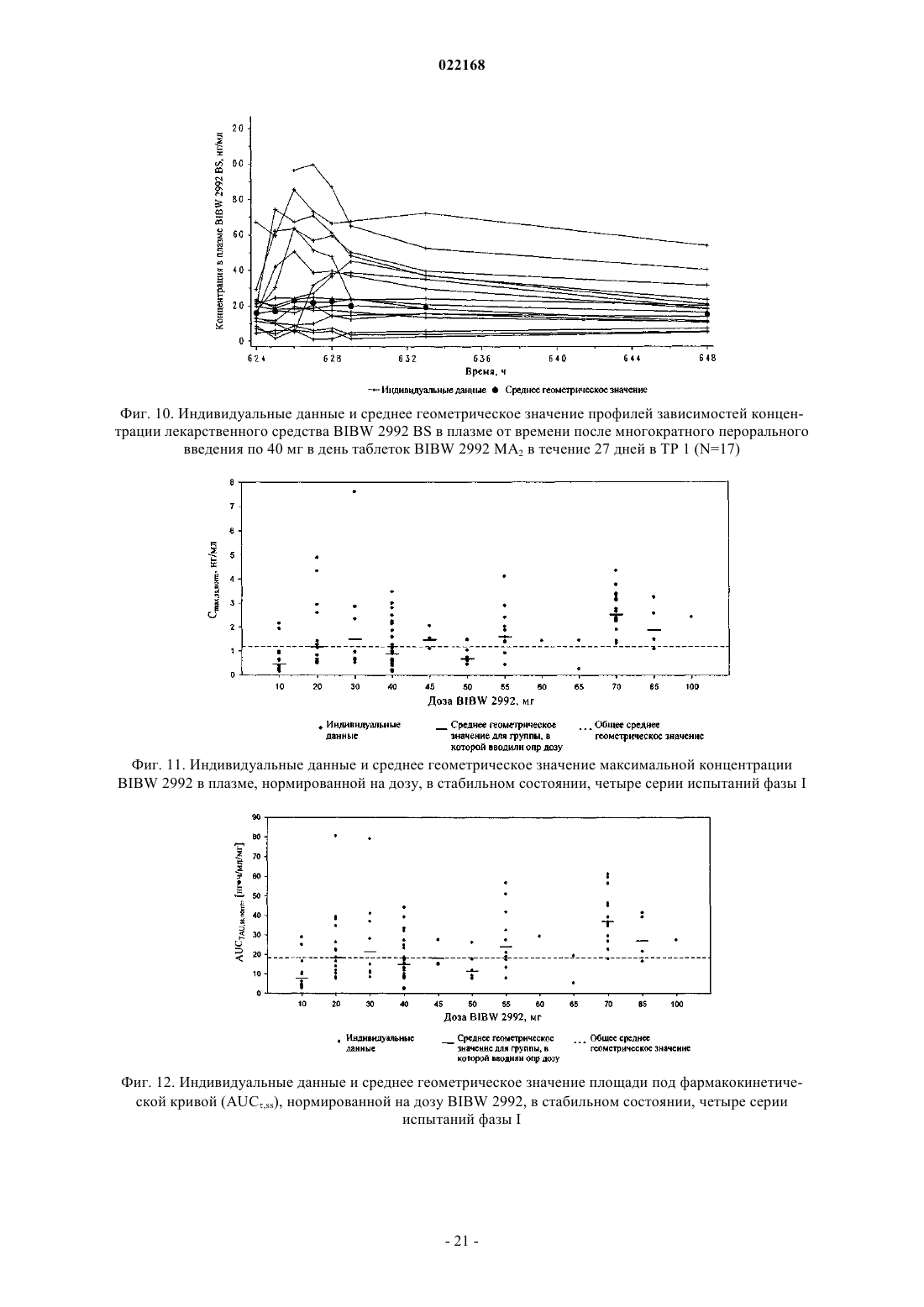
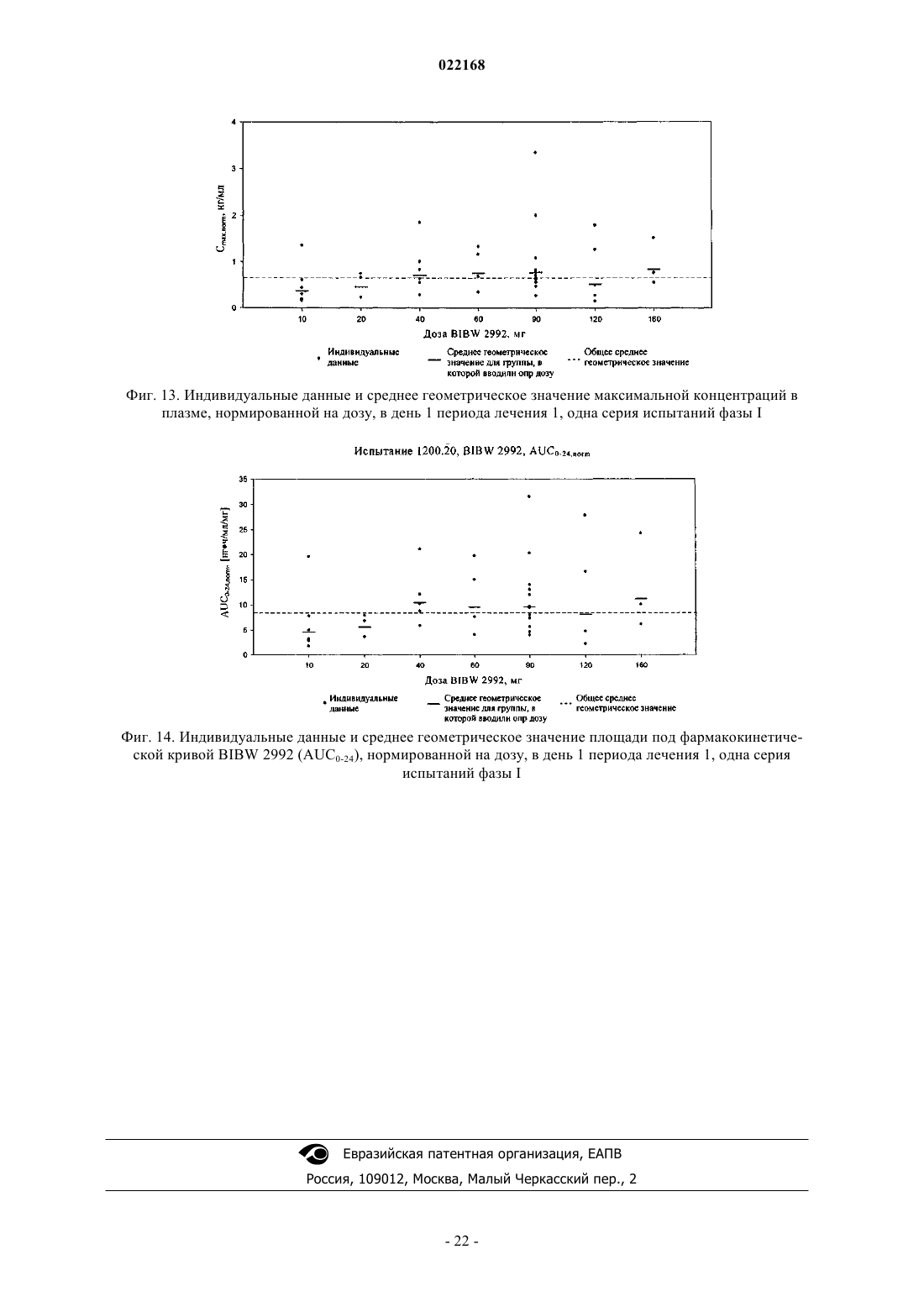
СПОСОБ ПОЛУЧЕНИЯ УПЛОТНЕННОГО ПРОМЕЖУТОЧНОГО ПРОДУКТА ДИМАЛЕАТА BIBW 2992 И ТВЕРДЫЕ ТАБЛЕТКИ, ПОЛУЧЕННЫЕ ИЗ ТАКОГО ПРОДУКТА В изобретении описаны уплотненные промежуточные продукты, содержащие дималеат BIBW 2992 (BIBW 2992 МА 2) в форме порошка, полученные при ротационном уплотнении в комбинации с последующим просеиванием из BIBW 2992 МА 2, также описаны твердые пероральные составы таблеток, обеспечивающие профиль немедленного высвобождения активного вещества, которые получают из указанного уплотненного промежуточного продукта,готовые к применению/проглатыванию, такие как таблетки без покрытия или таблетки с пленочным покрытием.(71)(73) Заявитель и патентовладелец: БРИНГЕР ИНГЕЛЬХАЙМ ИНТЕРНАЦИОНАЛЬ ГМБХ (DE) Область настоящего изобретения Настоящее изобретение относится к способу получения уплотненного промежуточного продукта,содержащего осажднный дималеат BIBW 2992, обозначенный в настоящем описании BIBW 2992 МА 2, в форме порошка, с использованием комбинированного ротационного уплотнения с последующим просеиванием на одной или более стадиях, необязательно в смеси с до 1,0 мас.% смазывающего вещества,такого как стеарат магния, а также к твердым пероральным составам, обеспечивающим профиль немедленного растворения-высвобождения, полученным из указанного уплотненного продукта, готовым к применению/проглатыванию, в форме таблеток для перорального введения, таких как таблетки без покрытия или таблетки с пленочным покрытием. Предпосылки создания настоящего изобретения Биодоступность - это скорость и степень, с которой активный компонент абсорбируется из фармацевтической лекарственной формы и становится доступным в участке действия лекарственного вещества(Chen M. L. и др., Bioavailability и bioequivalence: an FDA regulatory overview, Pharm. Res., 18, с. 16451648 (2001. Однако практически невозможно измерить концентрацию лекарственного средства в участке его действия. Следовательно, биодоступность оценивают по концентрациям лекарственного средства в основном кровотоке. Системное воздействие оценивают при измерении концентрации активного лекарственного средства в крови или в плазме через различные периоды времени после введения лекарственного средства, а затем рассчитывают площадь под кривой зависимости концентрации от времени(AUC). Профили зависимости концентрации лекарственного средства в крови/плазме от времени зависят от динамики растворения, растворимости, абсорбции, метаболизма, распределения и выведения. В принципе абсорбция лекарственного средства из твердой пероральной лекарственной формы после введения может зависеть от растворения твердой пероральной лекарственной формы, которое происходит в результате серий одновременных и последовательных процессов, и от проницаемости лекарственного средства через стенки кишечника желудочно-кишечного тракта. В зависимости от биофармацевтической системы классификации (BCS) растворение лекарственного вещества in vitro можно использовать для предсказания концентраций в плазме in vivo и, следовательно, биодоступности (Guidance forHuman Services, Food and Drug Administration, Center for Drug Evaluation и Research (CDER), август 1997). В связи с указанным выше, для оценки качества лекарственного продукта использовали данные по растворению in vitro твердых пероральных лекарственных форм с немедленным высвобождением, таких как таблетки и капсулы. Продукт с немедленным высвобождением обеспечивает растворение ингредиента или активного компонента в желудочно-кишечном тракте, при этом исключается любое замедление или пролонгирование растворения или абсорбции лекарственного средства. Требования к проведению испытаний по растворению продуктов с немедленным высвобождением приведены в справочнике Guidance for Industry, "Dissolution testing for immediate relese solid oral dosage forms", "Immediate release solidand Acceptance Criteria For New Drug Substances and New Drug Products (CDER 1997). Наиболее распространенные методы испытаний по растворению, которые описаны в Европейской фармакопее 6.3 (6-ое издание), включают метод вращающейся корзинки (аппарат 1) и метод с использованием аппарата с лопастной мешалкой (аппарат 2). Описанные методы характеризуются простотой, надежностью, стандартизацией и широко используются. Они достаточно универсальны и предназначены для проведения испытаний по растворению для множества лекарственных продуктов. При проведении испытаний по растворению in vitro твердого перорального продукта с немедленным высвобождением для выбора соответствующих условий испытаний следует учитывать следующие параметры, влияющие на растворение, такие как: тип аппарата, скорость перемешивания, среда для растворения и температура растворения. Соединение 4-[(3-хлор-4-фторфенил)амино]-6-[4-(N,N-диметиламино)-1-оксо-2-бутен-1-ил]амино-7-S)-тетрагидрофуран-3-илокси)хиназолин известно под названием BIBW 2992 Соединение BIBW 2992 является сильнодействующим и селективным двойным ингибитором рецептора erbb1 (EGFR) и рецептора тирозинкиназ erbB2 (Her2/neu). Кроме того, соединение BIBW 2992 ковалентно связывается с рецепторами EGFR и HER2, и необратимо инактивирует молекулу рецептора, с которой оно связывается. Указанное соединение, его соли, такие как дималеат BIBW 2992 МА 2 и его кристаллическая форма, их получение, а также фармацевтические составы, содержащие BIBW 2992 или его соль, описаны в заявках WO 02/50043 и WO 2005/037824. Указанные документы включены в настоя-1 022168 щее описание в качестве ссылок, относящихся к указанным объектам. Соединение BIBW 2992 BS, описанное в данном контексте, обозначает соединение в виде свободного основания, идентичного соединению BIBW 2992, указанной выше формулы. Соединение BIBW 2992 можно использовать для лечения опухолевых заболеваний, гиперсекреторных заболеваний легких и дыхательных путей, заболеваний желудочно-кишечного тракта, желчного протока и желчного пузыря. Показания для лечения соединением BIBW 2992 и комбинированного лечения описаны в заявках WO 2007/054550 и WO 2007/054551. Основные объекты настоящего изобретения Наряду с фармакологической активностью активного фармацевтического ингредиента (АФИ) существует множество физических или физико-химических характеристик активного вещества, которые следует учитывать при получении твердых пероральных лекарственных форм, таких как пероральные порошки, гранулы, пеллеты, таблетки, капсулы, жевательные таблетки, диспергируемые таблетки, пастилки или лепешки. При разработке надежного, недолгосрочного и недорогостоящего процесса переработки лекарственного вещества в лекарственную форму необходимо учитывать такие характеристики состава, как соответствующий метод анализа, однородность состава и массы, химическая и физическая стабильность лекарственного продукта и скорость его растворения, а также характеристики промежуточных продуктов. Примеры указанных параметров, которые следует учитывать при переработке активного агента (лекарственного вещества) включают, но не ограничиваясь только ими: стабильность лекарственного вещества при различных условиях окружающей среды, которые могут значительно влиять на стабильность конечного фармацевтического состава (лекарственного средства), и физические характеристики лекарственного вещества, такие как объмная плотность (т.е. насыпная плотность и насыпная плотность после уплотнения) или производное фактора Хауснера (табл. 1), морфология и форма частиц, соотношение длины и ширины для игольчатых форм, распределение по размерам,электростатические и адгезивные свойства поверхности, которые могут изменяться из-за преципитации и условий сушки лекарственного вещества. Указанные характеристики значительно влияют на основные признаки переработки лекарственного вещества в конечный состав, такие как текучесть и сжимаемость. Таблица 1. Фактор Хауснера и соответствующая текучесть Фактор Хауснера является соотношением насыпного объема и объема уплотненного порошка и рассчитывается по формуле: насыпная плотность/плотность после уплотнения. Объемную плотность определяют в соответствии с параграфом 2.9.15 Европейской фармакопеи (4-ое издание) в виде насыпной плотности. Плотность после уплотнения определяют в соответствии с параграфом 2.9.15 Европейской фармакопеи (см. также Voigt R., Lehrbuch der pharmazeutischen Technologie (Руководство по фармацевтической технологии), Verlag Chemie, 5-ое издание, с. 148). Фактор Хауснера, который в идеальном случае должен приближаться к 1, является мерой текучести/сжимаемости порошков. Определение указанных характеристик необходимо для снижения сегрегации АФИ в порошкообразной смеси при ее передвижении, например, через трубы, бункер и питающую линию машины для таблетирования. Указанные характеристики обеспечивают воспроизводимость и однородность состава АФИ в одной партии лекарственного средства, прежде всего в составах с низкой дозой или в процессах прямого прессования. Кроме того, указанные характеристики в значительной степени влияют на такие параметры как текучесть, сжимаемость, липкость и смазывающая способность лекарственного вещества или его смесей с эксципиентами и таким образом являются определяющими для технологического процесса в автоматизированном производстве. При получении таблеток свободное течение материала в форму необходимо для обеспечения определенной и воспроизводимой массы и твердости таблетки. Материал должен также обладать некоторой степенью липкости, чтобы исключить крошение и рассыпание уплотненного материала при переработке. Кроме того, материал должен обладать определенной смазывающей способностью для уменьшения трения между материалом, пуансоном и формой в ходе таблетирования и для исключения проблем при извлечении таблеток из машины. В случае использования уплотненного материала для получения конечной лекарственной формы, материал должен также обладать пригодной степенью твердости, распадае-2 022168 мости и однородности. И, наконец, указанные свойства фармацевтической композиции сами по себе существенно влияют на биодоступность активного агента и, следовательно, на эффективность лекарственного средства при применении в медицине. Для улучшения указанных свойств лекарственного вещества, которые влияют на переработку активного соединения в твердый пероральный фармацевтический состав, в соответствии с критериями/стандартами, которые определены правительственным органом контроля и с учетом специфических требований, связанных с требуемым профилем терапевтического воздействия (такими, как определенная биодоступность и фармакокинетический профиль), можно использовать различные физические или физико-химические процессы, например перекристаллизацию, превращение в различные полиморфные формы, смешивание с несколькими эксципиентами или со вспомогательным материалом, измельчение для уменьшения размера частиц до пригодного уровня или превращения лекарственного вещества в промежуточные твердые формы, которые затем можно перерабатывать, например, при превращении порошков в гранулы. Измельчение в широком смысле является механическим процессом уменьшения размера частиц или агрегатов и включает множество различных методов, включая разрезание, дробление, размалывание,разрушение, помол, тонкое измельчение и растирание. Материалы часто измельчают для увеличения сжимаемости. Сжимаемость материалов значительно зависит от размера частиц или площади поверхности частиц. Так как деградацию и/или аморфизацию фармацевтически активного вещества, которые являются побочным эффектом при размалывании (или тонком измельчении), необходимо по возможности исключить, то в связи с жесткими условиями, которые требуются в процессе размалывания, очень важно, чтобы активное вещество сохраняло высокую стабильность в процессе размалывания. Только если указанное условие выполнено, можно получить гомогенный фармацевтический состав, который всегда содержит определенное количество активного вещества воспроизводимым образом. Процесс измельчения также зависит от свойств материала, таких как форма или температура плавления. Материалы, которые не соответствуют указанным условиям, могут заблокировать камеру размалывания, что приводит к необходимости прерывать процесс для очистки и, следовательно, снижает экономичность процесса. Превращение порошков в гранулы (небольшие по массе агрегаты, сформированные при склеивании множества частиц порошка) представляет собой дополнительный подход, который позволяет в большинстве случаев улучшить физико-химические свойства АФИ и обладает преимуществами, включая улучшение однородности смеси, улучшение однородности распределения частиц по размеру, снижение вредного воздействия пыли, повышение текучести продукта, улучшение однородности насыпной плотности,контроль твердости частиц и улучшение диспергируемости. Наиболее часто применяют методы грануляции, такие как влажная грануляция, сухая грануляция и грануляция из расплава. При влажной грануляции жидкий раствор связующего агента смешивают со слоем смеси порошков для формирования гранул. Влажную массу затем просеивают, сушат и измельчают до требуемого размера. Массу также можно просеивать в сухом виде, смешивать со смазывающим веществом и прессовать или подвергать экструзии через сито, а затем сушить. Во время сушки, в большинстве случаев требуется обеспечивать остаточное количество влаги при грануляции, чтобы поддерживать частицы во влажном состоянии и снизить статический электрический заряд на поверхности частиц. Влажность состава для грануляции должна быть равномерной. Влажная грануляция характеризуется множеством недостатков. Главный недостаток заключается во множестве отдельных сложных стадий, а также в трудоемкости и продолжительности процесса. Кроме того, использование водных растворителей ограничивается стабильностью продукта, предназначенного для грануляции, а применение некоторых органических растворителей ограничивается их взрывоопасностью и требованиями охраны окружающей среды. Сухую грануляцию можно использовать, если материалы характеризуются достаточными связующими или когезионными свойствами, необходимыми для формирования гранул. Сухая грануляция представляет собой процесс грануляции без использования жидкостей. Материал можно обрабатывать методом сухой грануляции, при условии, если по крайней мере один из его компонентов, активный компонент или разбавитель, обладает когезионными свойствами. Сухую грануляцию можно проводить известным методом "комкования". При "комковании" материал, предназначенный для грануляции, сначала уплотняют в большую прессованную массу или "комок", как правило, с использованием машины для таблетирования с плоским пуансоном большого размера (пример линейного пресса описан в патенте US 4880373). Можно получить довольно плотный комок, если при этом обеспечить удаление воздуха в течение достаточно длительного времени из материала, который предназначен для уплотнения. Спрессованные комки затем измельчают при пропускании через сито с требуемым размером ячеек вручную или автоматически, например, с помощью мельницы. Формирование гранул при "комковании" также известно как предварительное прессование. Если таблетки получают из гранулированного комкованием материала, то такой процесс называется "методом двойного прессования". Сухую грануляцию можно также проводить с использованием "ротационного пресса". В ротацион-3 022168 ном прессе частицы материала сжимают и уплотняют при пропускании материала между двумя роликами при высоком давлении. Уплотненный материал из ротационного пресса затем измельчают и получают гранулы равного размера. Гранулы равного размера затем смешивают с другими веществами, такими как смазывающее вещество, и получают таблетки (как, например, с использованием ротационной машины для таблетирования). Помимо фармацевтических целей, ротационное уплотнение также используют в других отраслях, таких как пищевая промышленность, производство кормов для животных и производство удобрений. Сухая грануляция АФИ в смеси с наполнителями, предпочтительно со связующими наполнителями, такими как сахара, неорганические материалы, гидрофосфат кальция, целлюлоза или ее производные, является эффективным и пригодным методом грануляции, прежде всего, если АФИ чувствителен к влаге и если стабильность конечного продукта снижается в процессе влажной грануляции. Однако сухая грануляция также характеризуется недостатками, так как сжимаемость полученных гранул уменьшается на второй стадии уплотнения в таблетки. В результате прессования сухих гранулированных порошков в таблетки, происходит снижение твердости таблетки и замедление распадаемости,в основном, в результате снижения пористости системы. Если пористость является слишком низкой, то вода не может проникать в ядро таблетки, чтобы ускорить распадение таблетки. Поэтому на стадии сухой грануляции часто используют только часть применяемых наполнителей для обеспечения необходимой твердости и скорости распадаемости таблетки. Ротационное уплотнение является наиболее распространенным способом сухой грануляции, который можно использовать для обработки большого количества материала в короткий период времени. При брикетировании (специфический метод ротационного уплотнения) используют специальные ролики,которые разрезают уплотненный порошок на куски (брикеты). Метод сухой грануляции "комкованием" является медленным, неэффективным, а во многих случаях требуется применение некоторых методик для получения эффективного состава с требуемой текучестью. При сухой грануляции большое значение имеет сила уплотнения, то есть ее равномерное распространение и распределение в отношении равномерности пористости гранул, чтобы обеспечить равномерные твердость и распадаемость конечного продукта. Грануляция из расплава представляет собой процесс, при котором порошки образуют агломераты с помощью связующего агента, как в расплавленном состоянии, так и в твердом состоянии, которые расплавляются в ходе обработки. Для этого процесса выбирают установку со смесителем с высоким сдвигом, в котором температуру порошка повышают до температуры выше температуры плавления плавких связующих агентов с использованием нагревательной рубашки или сил трения, образующихся при вращении лопастей смесителя. Определение конечной температуры грануляции является важным аспектом для процесса грануляции из расплава. Следовательно, практически невозможно осуществлять контроль за процессом. Кроме того,часть массы, предназначенной для грануляции, прилипает к стенкам емкости гранулятора, что приводит к неоднородности массы, в отношении распределения компонентов, равномерности состава АФИ и распределения частиц по размеру. В патенте ЕР 0241126 А 1 описана фармацевтическая композиция, включающая гранулы, содержащие агрегат кристаллов ибупрофена, обеспечивающая улучшенную текучесть по сравнению с кристаллическим ибупрофеном до обработки. Композицию получают при уплотнении кристаллического ибупрофена в форму гранулированного агрегата, не содержащего наполнители. Процесс, используемый для уплотнения, включает уплотнение между роликами, экструзию или уплотнение в емкости для грануляции. В патенте ЕР 0172014 А 1 описана фармацевтическая композиция в гранулированной форме, пригодная для дальнейшей переработки, содержащая от 85 до 99 мас.% ибупрофена, от 15 до 1 мас.% натриевой соли кроскармелозы и необязательно от 0,4 до 1 мас.% коллоидного диоксида кремния в качестве эксципиентов, полученная при пропускании смеси через ротационный пресс или комковании и просеивании уплотненной или полученной после комкования композиции через вибрационное сито или серию сит. Специфические объекты настоящего изобретения Соединение BIBW 2992 МА 2, описанное в заявке WO 2005/037824, характеризуется следующими особыми физико-химическими свойствами, в отношении технологичности материала при переработке в твердую пероральную лекарственную форму: чувствительность к влаге, влияющая на химическую стабильность АФИ, что приводит к снижению активности активного агента и увеличению загрязнения продуктами гидролиза в воде,игольчатая форма кристаллов осажднного активного компонента, которая приводит к высокой вариабельности низкой насыпной плотности из-за случайного расположения и длины кристаллических игл,к низкой текучести из-за повышенного сопротивления игл выравниванию в направлении потока,к расслоению таблеток или отслоению верхней части таблетки (в виде шапочки) в ходе прямого прессования в связи с захватом слишком большого количества воздуха конечной смесью,к низкой сжимаемости также в комбинации с дополнительными эксципиентами, такими как свя-4 022168 зующие агенты или наполнители, что приводит к формированию гранул с низкой механической прочностью в ходе сухой грануляции с последующей тенденцией к сегрегации АФИ в ходе таблетирования изза крошения этих гранул, и к адгезивным свойствам на поверхности АФИ из-за увеличения электростатического заряда, что приводит к селективному восстановлению BIBW 2992 МА 2 в порошковой смеси в ходе переработки и,следовательно, к отсутствию АФИ в полученных таблетках, что можно определить по неудовлетворительным данным анализа. Осажднный BIBW 2992 МА 2 характеризуется случайной изменчивостью насыпной плотности. Плотность изменяется в диапазоне от 0,12 до 0,40 г/мл, по причине различной длины игольчатых кристаллов (табл. 2). Таблица 2. Изменение насыпной плотности не измельчнного BIBW 2992 МА 2 от партии к партии Изменение на величину более 100% является неприемлемым для воспроизводимого процесса получения. Прежде всего, для составов, содержание АФИ в которых составляет более 10%, наблюдается значительное влияние на прямое прессование в связи с отсутствием разбавления, которое может уравновесить или снизить неблагоприятное действие физико-химических свойств BIBW 2992 МА 2. Указанное утверждение можно объяснить следующим образом. Порошок BIBW 2992 МА 2 обладает низкой текучестью, если его использовать в процессе прямого таблетирования. Поэтому требуетсясущественное снижение скорости стандартного таблетирования, что приводит к значительной вариабельности силы уплотнения и массы таблетки из-за неполного заполнения формы. Поскольку порошок является чрезвычайно объемным, то невозможно получить таблетки требуемой массы и приемлемой твердости. Кроме того, высокая сила уплотнения, применяемая в процессе таблетирования, приводит к отслоению верхней части таблеток, в то время как низкая сила уплотнения приводит к прилипанию таблеток. Таким образом, цель настоящего изобретения заключается в получении BIBW 2992 МА 2 в твердой порошковой форме, пригодной для дальнейшей переработки в твердые фармацевтические составы для перорального введения в коммерческом масштабе, при этом состав должен соответствовать самым строгим условиям, предъявляемым к фармацевтическим композициям. Такие условия должны выполняться независимо от исходной насыпной плотности, как описано выше. Для улучшения свойств лекарственного вещества BIBW 2992 МА 2 с целью повышения технологических свойств лекарственного вещества использовали несколько подходов для превращения лекарственного вещества в пригодную форму для получения твердой пероральной фармацевтической композиции, которые оказались неэффективными, например, эксперименты по перекристаллизации не привели к получению BIBW 2992 МА 2 с требуемыми свойствами. Для осажднных материалов с определенными физико-химическими свойствами обычно применяют различные методы грануляции. Влажную грануляцию нельзя использовать, так как наблюдается разложение АФИ в результате гидролиза, которое затем продолжается в ходе переработки. При проведении экспериментов с использованием осажднного АФИ в процессе сухой грануляции получали продукт с различной насыпной плотностью и с низкой физической стабильностью гранул. В результате, АФИ не образует устойчивых форм в смеси с другими эксципиентами и отделяется от них в ходе дальнейшей переработки. Таким образом, во время продвижения основной массы в ней наблюдается всплывание игольчатых кристаллов BIBW 2992 МА 2, что приводит к неоднородности образующегося состава. Следовательно, первая порция полученных таблеток характеризуется низким содержанием АФИ, в то время как последняя партия характеризуется избыточным содержанием АФИ. В целом однородность содержания АФИ в партии не соответствует требуемым значениям. Кроме того, распадаемость и твердость таблеток, полученных из АФИ методом сухой грануляции, не соответствуют предъявляемым требованиям из-за двухкратного уплотнения смеси. Несмотря на то, что при проведении экспериментов с использованием измельченного АФИ после проведения сухой грануляции образуются стабильные гранулы с высокой однородностью состава смеси и конечная смесь не содержит кристаллов игольчатой формы, распадаемость полученных таблеток не соответствует необходимым требованиям в связи со слишком продолжительной распадаемостью из-за увеличения площади поверхности растворимого АФИ. Другой недостаток заключается в повышенном содержании мелких частиц в гранулах, что приводит к вариабельности силы сжатия. При грануляции из расплава осажднного АФИ также образуются стабильные гранулы с высокой однородностью состава смеси и конечная смесь не содержит кристаллов игольчатой формы, тем не менее, недостатки такого метода заключаются в вариабельности силы сжатия, необходимой для таблетирования гранул, в значительной вариабельности насыпной плотности продукта и в склонности к прилипанию смеси к стенкам емкости смесителя для грануляции. Таким образом, описанные выше результаты свидетельствуют о том, что с использованием стандартных методов технологии, известных в предшествующем уровне техники, практически, не представляется возможным обеспечить надежный процесс получения и требуемое неизменное качество лекарственного препарата в связи с различными физико-химическими свойствами B1BW 2992 МА 2. Краткое описание настоящего изобретения Согласно первому объекту, цель настоящего изобретения заключается в получении фармацевтической лекарственной формы (таблетки) из указанного выше лекарственного вещества, которая соответствует необходимой биодоступности для требуемого диапазона дозировки и которая также характеризуется определенным профилем немедленного высвобождения, и пригодным профилем кривой зависимости концентрации активного вещества в плазме от времени. Такой профиль высвобождения для указанного лекарственного вещества не описан в предшествующем уровне техники. В первом объекте настоящего изобретения предлагается фармацевтическая лекарственная форма(таблетка) активного вещества BIBW 2992 МА 2, которая обеспечивает профиль немедленного растворения-высвобождения во всем диапазоне физиологически допустимых значений рН от 1 до 6,8, в воде(среда для растворения 900 мл, скорость перемешивания 50/75 об./мин и температура 37 С). Характеристики растворения соответствуют рекомендованным критериям для немедленного высвобождения твердых пероральных лекарственных форм, т.е. не менее 85% (Q = 80%) лекарственной формы растворяется в течение 60 мин или менее (Guidance for Industry, Dissolution Testing of Immediate Release Solid Oral Dosage Forms, U.S. Department of Health and Human Services, Food and Drug Administration, Center for DrugEvaluation and Research (CDER), август 1997 г.). Предпочтительно не менее 85% (Q = 80%) активного вещества BIBW 2992 МА 2 (соли АФИ) растворяется в течение 30 мин или менее, более предпочтительно в течение 15 мин. Фармацевтическая лекарственная форма (таблетка), содержащая активное вещество BIBW 2992 МА 2, согласно изобретению характеризуется профилем немедленного высвобождения, достигая максимальной концентрации активного вещества в плазме пациентов, страдающих от рака, в период от 0,75 до 7 ч, а, предпочтительно, среднее значение в период от 1 до 6 ч после однократной дозы, и в стабильном состоянии. Фармацевтическая лекарственная форма (таблетка), содержащая активное вещество BIBW 2992 МА 2, согласно изобретению характеризуется профилем немедленного высвобождения, при котором максимальная концентрация активного вещества в стабильном состоянии в плазме пациентов, страдающих от рака, с различными прогрессирующими формами солидных опухолей, составляет по крайней мере от 5 до 100 нг/мл, а среднее геометрическое значение составляет от 15 до 35 нг/мл, если лекарственную форму, содержащую 20 мг BIBW 2992 МА 2 (соли АФИ), вводят один раз в сутки ежедневно в течение по крайней мере 14 дней. Фармацевтическая лекарственная форма (таблетка), содержащая активное вещество BIBW 2992 МА 2, согласно изобретению характеризуется профилем немедленного высвобождения, при котором максимальная концентрация активного вещества в стабильном состоянии в плазме пациентов, страдающих от рака, с различными прогрессирующими формами солидных опухолей, составляет по крайней мере от 5 до 30 нг/мл, а среднее геометрическое значение от 25 до 120 нг/мл, если лекарственную форму, содержащую 30 мг BIBW 2992 МА 2 (соли АФИ), вводят один раз в сутки ежедневно, в течение по крайней мере 14 дней. Фармацевтическая лекарственная форма (таблетка), содержащая активное вещество BIBW 2992 МА 2, согласно изобретению характеризуется профилем немедленного высвобождения, при котором максимальная концентрация активного вещества в стабильном состоянии в плазме пациентов, страдающих от рака, с различными прогрессирующими формами солидных опухолей, составляет по крайней мере от 5 до 230 нг/мл, а среднее геометрическое значение от 25 до 120 нг/мл, если лекарственную форму, содержащую 40 мг BIBW 2992 МА 2 (соли АФИ), вводят один раз в сутки ежедневно, в течение по крайней мере 14 дней. Фармацевтическая лекарственная форма (таблетка), содержащая активное вещество BIBW 2992 МА 2, согласно изобретению характеризуется профилем немедленного высвобождения, при котором максимальная концентрация активного вещества в стабильном состоянии в плазме пациентов, страдающих от рака, с различными прогрессирующими формами солидных опухолей, составляет по крайней мере от 5 до 230 нг/мл, а среднее геометрическое значение от 35 до 120 нг/мл, если лекарственную форму, содержащую 50 мг BIBW 2992 МА 2 (соли АФИ), вводят один раз в сутки ежедневно в течение по крайней мере 14 дней. Фармацевтическая лекарственная форма (таблетка) согласно изобретению является пригодной в ка-6 022168 честве лекарственного средства, предназначенного для лечения заболевания или состояния, которое выбирают из онкологических заболеваний. Согласно второму варианту настоящего изобретения предлагается уплотненный промежуточный продукт, содержащий BIBW 2992 МА 2 в форме порошка, подготовленный комбинированным ротационным уплотнением с последующем просеиванием уплотненного активного вещества, необязательно в смеси с до 1 мас.% смазывающего вещества, для оптимизации и уравновешивания его объемных свойств и, следовательно, чтобы обеспечить его пригодность для дальнейшей переработки в готовую лекарственную форму. В другом объекте настоящего изобретения предлагаются твердые пероральные составы таблеток,полученные из указанных уплотненных промежуточных продуктов, готовые к применению/проглатыванию, например таблетки без покрытия или таблетки с пленочным покрытием. Подробное описание настоящего изобретения Характеристики растворения и фармакокинетические свойства Для проведения испытаний на растворение in vitro для сравнения четырех таблеток BIBW 2992 МА 2 с пленочным покрытием, содержащих 20, 30, 40, 50 мг активного вещества и описанных в примерах(табл. 4), используют аппарат 2 (с лопастной мешалкой) в соответствии с Европейской фармакопеей 6.2: Аппаратура: Аппарат 2 (с лопастной мешалкой) Скорость вращения лопастной мешалки: 50/75 об./мин Среда для растворения: 0,05 М фосфатный буферный раствор, рН 6,8 буферный раствор Me Ilvaine, рН 4,0 0,1 M HCl, рН 1 вода (50 об./мин) Объем: 900 мл Время отбора образцов: 5, 10, 15, 20, 30 мин Количество таблеток (n): 12 штук для каждой дозы Концентрацию в сосудах для растворения определяли методом ЖХВР-УФ. Профили растворения для таблеток с пленочным покрытием, содержащих 20, 30, 40, и 50 мг BIBW 2992 МА 2 по настоящему изобретению при рН 1,0, 4,0, 6,8, и воды соответственно, показаны на фиг. 6-9. Для образцов каждой партии, состоящей из 12 таблеток с пленочным покрытием, рассчитывали средние значения и стандартное отклонение (отрезки прямой) с доверительным интервалом 95%. Как показано на фиг. 6-8, через 15 мин наблюдается растворение более 85% для всех четырех типов таблеток. Следовательно, можно утверждать, что все четыре таблетки с различными дозами являются эквивалентными. С учетом аналогичного быстрого растворения in vitro таблеток с пленочным покрытием для четырех типов,содержащих 20, 30, 40 и 50 мг BIBW 2992 МА 2 можно предположить, что указанные таблетки будут также быстро растворяться in vivo. В четырех сериях испытаний фазы I при лечении пациентов, страдающих от рака с различными прогрессирующими солидными опухолями, определяли фармакокинетические (ФК) параметры BIBW 2992. Пример всех испытаний и исследуемых доз (от 10 до 100 мг) наиболее подробно описан для группы пациентов, которым вводили дозу 40 мг. Индивидуальные значения и среднее геометрическое значение для профилей зависимости концентрации BIBW 2992 в плазме от времени после введения 40 мг в день 27 (введение один раз в сутки ежедневно, период лечения 1, первые 28 дней лечения) показаны на фиг. 10. Концентрация BIBW 2992 в плазме увеличивается после перорального введения, а максимальная концентрация в плазме в основном достигается приблизительно через 2-5 ч после введения. Концентрация в плазме снижается в течение последующих часов (до 9 ч после введения), т.е. наблюдается первая фаза кинетической кривой. Вторая фаза кинетической кривой наблюдается в интервале от 9 до 24 ч после введения. На основе полученных данных можно утверждать, что BIBW 2992 характеризуется по крайней мере биэкспоненциальной кинетической кривой. На фиг. 10 показана высокая вариабельность концентрации в плазме для различных пациентов(n=17) из группы, в которой пациентам вводили дозу 40 мг. Вариабельность (gCV = геометрический коэффициент вариабельности) концентраций в плазме активного вещества в различные моменты времени составляет от 109 до 159% в период до 9 ч после введения лекарственного средства, а в следующий период (через 24 ч после введения лекарственного средства) от 66,9 до 72,9%. В четырех сериях испытаний фазы I у пациентов, страдающих от рака с различными прогрессирующими солидными опухолями, при лечении в режиме монотерапии BIBW 2992, а также в ходе испытаний в режиме комбинированного лечения BIBW 2992 совместно с доцетакселом, не наблюдали признаков отклонения от пропорционального увеличения величин AUC и Cmax активного вещества от дозы,при визуальном контроле как после однократного введения, так и в стабильном состоянии в период введения один раз в сутки. В результате, у пациентов, страдающих от рака, по данным среднего геометрического значения Cmax,ss и AUC,ss активного вещества увеличиваются пропорционально дозе как после однократного введения, так и в стабильном состоянии при введении один раз в сутки ежедневно. Пример значений всех Cmax и AUC в ходе четырех серий испытаний фазы I в режиме монотерапии, и соответствующих фармакокинетических параметров в стабильном состоянии показан на фиг. 11 и 12. Пример значений всех Cmax, a также AUC в ходе фазы I комбинированного лечения BIBW 2992 совместно с доцетакселом и соответствующих фармакокинетических параметров BIBW 2992 показан на соответствующих фармакокинетических параметров BIBW 2992 показан на фиг. 13 и 14. При визуальном контроле пациентов не наблюдается каких-либо отклонений от возрастания концентрации лекарственного вещества в плазме пропорционально дозе, измеренных до введения лекарственного средства в стабильном состоянии (Cpre,ss) у пациентов, страдающих от рака, в ходе различных клинических испытаний (данные не приведены). Твердые составы, содержащие BIBW 2992 МА 2, и способы их получения Было установлено, что цель настоящего изобретения осуществляется при применении стадии ротационного уплотнения активного ингредиента BIBW 2992 МА 2 для уплотнения материала с последующим просеиванием на одной или более стадий, для разрушения полученной ленты, а также для последующего уменьшения размера частиц и диспергирования АФИ перед его смешиванием с остальными эксципиентами и последующим прямым прессованием. Уплотненный промежуточный продукт, содержащий BIBW 2992 МА 2 В одном объекте настоящего изобретения предлагается уплотненный промежуточный продукт, содержащий BIBW 2992 МА 2, в форме порошка, подготовленный на стадии ротационного уплотнения, при комбинировании, по крайней мере, с одной стадией просеивания BIBW 2992 МА 2 после уплотнения, необязательно в смеси с до 1 мас.% смазывающего вещества. Уплотненный промежуточный продукт согласно более широкому варианту осуществления настоящего изобретения представляет собой BIBW 2992 МА 2 в форме порошка, содержащего смазывающее вещество в количестве от 0 до 1,0 %, в расчете на количество соли АФИ. Уплотненный промежуточный продукт BIBW 2992 МА 2 характеризуется следующими параметрами: Распределение частиц по размерам находится в интервалах, как указано в Европейской фармакопее 2.9.35 (издание 6.02)."x10" обозначает, что содержание частиц меньше размера ячеек сита (частицы, проходящие через сито) составляет 10%."х 50" обозначает, что содержание частиц меньше размера ячеек сита составляет 50%, а содержание частиц больше размера ячеек сита составляет 50%."х 90" обозначает, что содержание частиц меньше размера ячеек сита составляет 90%. В более широком варианте распределение частиц по размерам характеризуется интервалами x10200 мкм, 1 мкмх 50300 мкм, 75 мкмх 90600 мкм, предпочтительно характеризуется интервалами х 10100 мкм, 1 мкмх 50200 мкм, 75 мкмх 90400 мкм; и более предпочтительный пример показан на фиг. 4 и фиг. 5, в интервалах х 105 мкм, 1 мкмх 50100 мкм, 75 мкмх 90200 мкм и х 1001000 мкм. Насыпная плотность (p) находится в интервалах: 0,2 г/млp1,0 г/мл. Фактор Хауснера (HF) находится в интервалах: 1,00HF1,30. Промежуточные смеси, полученные из уплотненных продуктов BIBW 2992 МА 2 Промежуточные и конечные смеси могут быть получены из уплотненных продуктов, содержащихBIBW 2992 МА 2, пригодные для дальнейшей переработки в твердые пероральные лекарственные формы(таблетки), как определено в настоящем описании для уплотненных промежуточных продуктов. Промежуточные и конечные смеси могут быть охарактеризованы составами, которые выбирают из компонентов (a)-(g):(a) уплотненный продукт BIBW 2992 согласно изобретению в количестве приблизительно от 1 до 99 мас.%,(b) необязательно один или более носителей в количестве приблизительно от 10 до 99 мас.%,(c) один или более связующих агентов в количестве приблизительно от 0 до 99 мас.%, предпочтительно от 1 до 99 мас.%,(d) одно или более скользящих веществ в количестве приблизительно от 0 до 10 мас.%, предпочтительно от 0,1 до 10 мас.%,(e) один или более дезинтегрирующих агентов в количестве приблизительно от 0 до 10 мас.%,предпочтительно от 0,1 до 10 мас.%,(f) одно или более смазывающих веществ в количестве приблизительно от 0 до 10 мас.%, предпочтительно от 0,1 до 10 мас.% и(g) от 0 до 10 мас.% других эксципиентов и/или адъювантов, причем в промежуточных и конечных смесях обязательно присутствует наряду с компонентом (а) по крайней мере один из компонентов (b)-(g),а также допустимо присутствие от двух до практически всех шести необязательных компонентов (b)-(g),причем сумма всех добавленных компонентов составляет 100%. Очевидно, что основной функцией скользящих веществ является улучшение текучести порошка, в то время как смазывающие вещества предотвращают слипание компонентов друг с другом, например прилипание к таблеточным пуансонам или к деталям машины для заполнения капсул. Смазывающие вещества также обеспечивают низкое трение между твердым материалом и стенкой матрицы при формировании таблеток. Как известно, любые из вспомогательных вышеуказанных компонентов (a)-(g) в основном должны представлять собой пищевые и фармакологически приемлемые агенты. Компонент-носитель (b) представляет собой твердые органические вещества, такие как сахара, (например, моносахариды, такие как глюкоза, олигосахариды, такие как сахароза, или дисахариды, такие как лактоза, в различных кристаллических формах, полученных, например, при осаждении, высушивании при распылении, в барабанной сушке или при совместной переработке с другими эксципиентами,такими как микрокристаллическая целлюлоза, или сорбит, маннит, ксилит, лактит, эритрит, дульцит,рибит, эритрит), целлюлоза и ее производные (например, порошкообразная целлюлоза или микрокристаллическая целлюлоза); крахмал или модифицированные крахмалы (например, предварительно желатинизированные или частично гидролизованные), или твердые неорганические, такие как фосфат кальция, двухосновный фосфат кальция, гидроксиапатит, сульфат кальция, карбонат кальция, или полутвердые, такие как липиды или парафин. Связующие вещества (с) выбирают из целлюлозы и/или ее производных, таких как микрокристаллическая целлюлоза, этилцеллюлоза, карбоксиметилцеллюлоза, гидроксипропилметилцеллюлоза, гидроксиэтилцеллюлоза, крахмал или модифицированные крахмалы (например, предварительно желатинизированный или частично гидролизованный), полиэтиленгликоли поливинилпирролидоны (например, Kollidon K30), поливинилацетаты, поливиниловые спирты или их сополимеры (например, Коповидон). Скользящие вещества (d) выбирают из коллоидного диоксида кремния, безводной кремниевой кислоты, кристаллической целлюлозы, талька или стеарата магния. Дезинтегрирующие агенты (е) выбирают из натриевой соли гликолята крахмала, кросповидона,кроскармелозы, натриевой соли карбоксиметилцеллюлозы и сухого кукурузного крахмала. Смазывающие вещества (f) выбирают из стеариновой кислоты, стеарата магния, стеарилфумарата натрия, трибегената глицерина или полиэтиленгликоля. Другие эксципиенты и/или адъюванты выбирают из любых других компонентов, которые не включены в список компонентов (b)-(f) или не упомянуты в качестве компонентов (b)-(f). Примеры таких компонентов, не включенные в указанную категорию, включают красители, включая окрашивающие вещества и пигменты, такие как красный или желтый оксид железа и диоксид титана. Предпочтительные варианты (1) и (2) промежуточных смесей характеризуются следующим составом (количество компонентов приведено в мас.% в расчете на общую массу промежуточной смеси): Следует понимать, что другими вариантами промежуточных смесей являются любые бинарные,тройные, четвертичные или пятеричные комбинации, содержащие активный агент (1.1) и 1, 2, 3 или 4 компонентов (1.2), (1.3) (1.4), (1.5) и (1.6), причем указанные количества компонентов следует рассчитывать с учетом отсутствующих компонентов. Следует понимать, что другими вариантами промежуточных смесей являются любые бинарные,тройные, четвертичные или пятеричные комбинации, содержащие активный агент (2.1) и 1, 2, 3 или 4 компонентов (2.2), (2.3) (2.4), (2.5) и (2.6), причем указанные количества компонентов следует рассчитывать с учетом отсутствующих компонентов. Варианты (3), (4) и (5) конечных смесей могут быть охарактеризованы следующими составами (ко-9 022168 личества приведены в % в расчете на общую массу конечной смеси): Следует понимать, что другими вариантами промежуточных смесей являются любые бинарные,тройные, четвертичные или пятеричные комбинации, содержащие активный агент (3.1) и 1, 2, 3 или 4 компонентов (3.2), (3.3) (3.4), (3.5) и (3.6), причем указанные количества компонентов следует рассчитывать с учетом отсутствующих компонентов. Следует понимать, что другими вариантами промежуточных смесей являются любые бинарные,тройные, четвертичные или пятеричные комбинации, содержащие активный агент (4.1) и 1, 2, 3 или 4 компонентов (4.2), (4.3) (4.4), (4.5) и (4.6), причем указанные количества компонентов следует рассчитывать с учетом отсутствующих компонентов. Следует понимать, что другими вариантами промежуточных смесей являются любые бинарные,тройные, четвертичные или пятеричные комбинации, содержащие активный агент (5.1) и 1, 2, 3 или 4 компонентов (5.2), (5.3) (5.4), (5.5) и (5.6), причем указанные количества компонентов следует рассчитывать с учетом отсутствующих компонентов. Твердый пероральный состав таблетки, готовый к применению/проглатыванию Составы таблеток по настоящему изобретению могут представлять собой таблетки без покрытия или с покрытием, например, с пленочным покрытием, полученным с использованием пригодных покрытий, которые не оказывают отрицательного действия на растворение конечного состава. Например, на таблетки наносят защитное покрытие для защиты от окружающей среды пациентов и медицинского персонала, а также в целях защиты от влаги при нанесении на поверхность таблетки покрытия из растворенных высокомолекулярных полимеров, таких как поливинилпирролидон или гидроксипропилметилцеллюлоза в смеси с пластификаторами, смазывающими веществами и, необязательно, пигментами и ПАВ в воде или в органическом растворителе, таком как ацетон, и при распылении указанной смеси на ядра таблеток, которые помещены в поддоны для нанесения покрытия или в аппарат для нанесения покрытия в псевдоожиженном слое с вкладышем Вурстера. Кроме того, для нанесения покрытий на таблетки также можно использовать агенты, такие как пчелиный воск, шеллак, фталат ацетата целлюлозы, фталат поливинилацетата, зеин, пленкообразующие полимеры, такие как гидроксипропилцеллюлоза, этилцеллюлоза и полимерные метакрилаты, при условии,что покрытие лекарственного средства не оказывает существенного влияния на распадаемость/растворение лекарственного средства и не влияет на стабильность таблетки. После нанесения на лекарственную форму пленочного покрытия, на защищенную фармацевтическую лекарственную форму можно наносить сахарное покрытие. Сахарное покрытие включает сахарозу,декстрозу, сорбит и т.п. или их смеси. При необходимости, в раствор сахара добавляют красители или замутнители. Твердые пероральные составы по настоящему изобретению предпочтительно содержат от 1 до 150 мг, более предпочтительно от 5 до 100 мг АФИ на основе BIBW 2992 (количества, которые приведены в данном контексте, и для общей композиции таблетки пересчитаны на количество свободного основанияBIBW 2992). Полученные предпочтительные формы содержат 5, 10, 20, 30, 40, 50, 70 или 100 мг BIBW 2992 соответственно. Например, состав общей композиции таблетки по настоящему изобретению можно изменять в следующих пределах: от 1 до 150 мг BIBW 2992,от 50 до 500 мг носителя, связующего вещества или их комбинации,от 0,1 до 5 мг скользящего вещества,от 1 до 15 мг дезинтегрирующего агента,от 1 до 15 мг смазывающего вещества,предпочтительно от 20 до 70 мг BIBW 2992,от 120 до 500 мг носителя, связующего вещества или их комбинации,от 0,5 до 5 мг скользящего вещества,от 2,5 до 15 мг дезинтегрирующего агента,от 2,5 до 15 мг смазывающего вещества. Твердые составы по настоящему изобретению характеризуются низкой гигроскопичностью. Указанные составы можно упаковывать в блистеры из ПВХ, блистеры из ПВДХ или влагостойкого упаковочного материала, такого как блистерная упаковка из алюминиевой фольги, блистер alu/alu, прозрачный или непрозрачный полимерный блистер, упакованный в пакетик, полипропиленовые пробирки, стеклянные флаконы и флаконы из ПЭВП, необязательно содержащие элементы для защиты от детей или от подделок. Первичный упаковочный материал может содержать влагопоглотитель, такой как молекулярное сито или силикагель для улучшения химической стабильности АФИ. Для снижения фотодеградации АФИ и продления срока годности можно использовать непрозрачные упаковки, такие как окрашенные блистерные материалы, пробирки, флаконы из коричневого стекла или т.п. Способ получения уплотненных промежуточных продуктов, промежуточных смесей и твердых пероральных составов таблеток Способ получения уплотненных промежуточных продуктов Уплотненный промежуточный продукт, содержащий BIBW 2992 МА 2, в форме порошка, получают на стадии ротационного уплотнения при комбинировании, по крайней мере, с одной дополнительной стадией просеивания для измельчения полученной ленты или брикетов (фиг. 1), необязательно в смеси с до 1 мас.% смазывающего вещества. Стадию ротационного уплотнения применяют для уплотнения материала (см. табл. 3), который характеризуется: вариабельностью насыпной плотности от 0,10 до 0,4 мг/мл (см. табл. 1) и фактором Хауснера от 1,05 до 1,61 (см. табл. 1). Таблица 3. Характеристики порошка и таблеток, содержащих BIBW 2992 МА 2, до и после ротационного уплотнения и просеивания СО: Относительное стандартное отклонение Таблетирование не представляется возможным из-за неправильного наполнения пуансона по причине прилипания и расслоения таблеток Не получали На стадии ротационного уплотнения можно использовать следующий материал: АФИ, BIBW 2992 МА 2, в отдельности или, необязательно, предварительно полученную смесь АФИ со смазывающим веществом в количестве от 0 до 1,0% в гравитационном смесителе или барабанном смесителе в основном для предотвращения прилипания к уплотняющим роликам. Можно исключить добавление смазывающего вещества, если использовать предварительно полученную смесь при перемешивании и непрерывно ее перемешивать при подаче в ротационный уплотнитель. АФИ или предварительно полученную смесь АФИ уплотняют на стандартном ротационном уплотнителе необязательно при горизонтальном, вертикальном расположении или под углом 45 уплотняющих роликов, поверхность которых может быть гладкой или определенной формы. Сила уплотнения может изменяться в интервале: от 1 до 20 кН/см,предпочтительно от 2 до 10 кН/см,скорость вращения ротационных роликов изменяется в интервале от 1 до 30 об/мин, предпочтительно от 1 до 10 об/мин,а ширина зазора между уплотняющими роликами составляет от 1 мм до 10 мм, предпочтительно от 1 до 5 мм. Скорость распадаемости (фиг. 2), а также скорость растворения (фиг. 3) таблеток, полученных из уплотненного промежуточного продукта, можно увеличить за счет повышения силы уплотнения ротационного пресса в указанных интервалах. Уплотненный промежуточный продукт поступает из ротационного пресса в виде лент, которые затем измельчают и получают гранулы в грануляторе, снабженном ситом с размером ячеек от 0,5 до 1,6 мм. Таким образом, на стадии уплотнения по настоящему изобретению получают уплотненный промежуточный продукт в форме гранул. Затем на второй стадии гранулы просеивают на соответствующей установке, такой как, например,вибрационная или коническая установка для просеивания или молотковая дробилка, с размером ячеек от 0,5 до 2,0 мм, предпочтительно приблизительно 1,0 мм, в результате получают уплотненный промежуточный продукт в форме порошка. Необязательно проводят вторую стадию просеивания, при этом просеивание проводят с использованием сита с размером ячеек от 0,3 до 0,5 мм, предпочтительно приблизительно 0,5 мм. Способ получения промежуточных смесей и конечных смесей Промежуточные смеси Любые промежуточные смеси, содержащие АФИ BIBW 2992 МА 2 в форме порошка, получают при смешивании АФИ с носителем, связующим веществом или их комбинацией, скользящими веществами,красителями и твердыми ароматизаторами в гравитационном смесителе или барабанном смесителе. Конечные смеси Промежуточную смесь, содержащую BIBW 2992 МА 2 в форме порошка, смешивают с носителями,связующими веществами, скользящими веществами, красителями и твердыми ароматизаторами в гравитационном смесителе или барабанном смесителе. Таблетки без покрытия и таблетки с пленочным покрытием Промежуточную смесь, содержащую BIBW 2992 МА 2 в форме порошка, смешивают с наполнителями-носителями, связующими веществами, скользящими веществами и дезинтегрирующими агентами в гравитационном смесителе или барабанном смесителе. Затем к основной смеси добавляют смазывающее вещество и продолжают перемешивание. Конечные смеси прессуют на пригодной машине для таблетирования при соответствующей силе прессования и получают продукт требуемого качества: с соответствующим сопротивлением к раздавливанию, высотой таблетки и распадаемостью, как показано в табл. 5. Необязательно на ядра таблеток наносят покрытие в барабанной установке для нанесения покрытий, например, с использованием суспензии для покрытия и установки для нанесения покрытия Glatt GC 550/750. Краткое описание фигур Таблетки, содержащие BIBW 2992 МА 2, указанные на фигурах, являются фармацевтическими лекарственными формами по настоящему изобретению. На фиг. 1 показана схема способа получения уплотненного промежуточного продукта BIBW 2992 МА 2, причем указанный способ включает:(1) стадию уплотнения с использованием ротационного уплотнения и разрушения полученной ленты в грануляторе, при этом получают гранулы, и(2) стадию просеивания. На фиг. 2 показано снижение времени распадаемости таблеток, содержащих 20 мг BIBW 2992 МА 2,при увеличении силы сжатия при ротационном уплотнении. На фиг. 3 показано увеличение скорости растворения таблеток, содержащих 20 мг BIBW 2992 МА 2,при увеличении силы сжатия при ротационном уплотнении. На фиг. 4 показано увеличение размера частиц уплотненного промежуточного продукта, получен- 12022168 ного на стадии сухой грануляции осажднного BIBW 2992 МА 2 при изменении силы сжатия при уплотнении, причем размер частиц определяли на оптическом анализаторе частиц. На фиг. 5 показано увеличение размера частиц уплотненного промежуточного продукта, полученного на стадии сухой грануляции осажднного BIBW 2992 МА 2, при изменении силы сжатия при уплотнении, причем размер частиц определяли методом лазерной дифракции. На фиг. 6 показано сравнение растворения таблеток с пленочным покрытием, содержащих 20, 30,40, 50 мг BIBW 2992 МА 2 (как описано в табл. 4), в соляной кислоте (0,1 М, рН 1,0, лопастная мешалка,75 об./мин/n=12). На фиг. 7 показано сравнение растворения таблеток с пленочным покрытием, содержащих 20, 30,40, 50 мг BIBW 2992 МА 2 (как описано в табл. 4), в буферном растворе McIllvaine (рН 4,0, лопастная мешалка, 75 об./мин/n=12). На фиг. 8 показано сравнение растворения таблеток с пленочным покрытием, содержащих 20, 30,40, 50 мг BIBW 2992 МА 2, в фосфатном буферном растворе (0,05 М, рН 6,8, лопастная мешалка, 75 об/мин/n=12). На фиг. 9 показано сравнение растворения таблеток с пленочным покрытием, содержащих 20, 30,40, 50 мг BIBW 2992 МА 2, в воде (лопастная мешалка, 50 об./мин/n=12). На фиг. 10 показаны индивидуальные данные и среднее геометрическое значение профилей зависимости концентрации лекарственного средства BIBW2992 в плазме от времени после многократного перорального введения таблеток BIBW 2992 МА 2 в дозе по 40 мг в день в течение 27 дней в период лечения (ПЛ) 1 (N=17). В плазме определяли концентрацию свободного основания BIBW2992. На фиг. 11 показаны индивидуальные данные и среднее геометрическое значение максимальной концентрации BIBW 2992 BS в плазме, нормированной на дозу, после многократного перорального введения таблеток BIBW 2992 МА 2 в стабильном состоянии в ходе четырех серий испытаний фазы I. На фиг. 12 показаны индивидуальные данные и среднее геометрическое значение площади под фармакокинетической кривой (AUC,ss) BIBW 2992 BS, нормированной на дозу, после многократного перорального введения таблеток BIBW 2992 МА 2 в стабильном состоянии, в ходе четырех серий испытаний фазы I. На фиг. 13 показаны индивидуальные данные и среднее геометрическое значение нормированной на дозу максимальной концентрации BIBW 2992 BS в плазме, после многократного перорального введения таблеток BIBW 2992 МА 2 в день 1 испытаний (период лечения 1), одна серия фазы I. На фиг. 14 показаны индивидуальные данные и среднее геометрическое значение нормированной на дозу площади под фармакокинетической кривой BIBW 2992 BS (AUC0-24) после многократного перорального введения таблеток BIBW 2992 МА 2 в день 1 испытаний (период лечения 1), одна серия фазы I. Следующие примеры представлены для иллюстрации настоящего изобретения и не ограничивают его объем. В табл. 4 показаны твердые фармацевтические композиции по настоящему изобретению. Таблица 4. Примеры твердых композиций таблеток, содержащих BIBW 2992 МА 2 Составы А, В, С, D и Е представляют собой таблетки, на которые можно наносить пленочное покрытие, как указано в табл. 6. В табл. 5 показаны типичные свойства твердых таблеток BIBW 2992 МА 2. Таблица 5. Типичные свойства твердых таблеток BIBW 2992 МА 2, полученных в машине для таблетирования при соответствующей силе прессования н/о - не определяли Таблица 6. Пример композиции пленочного покрытия для составов А-Е В табл. 7 показаны другие твердые фармацевтические композиции по настоящему изобретению. Таблица 7. Пример композиции твердых таблеток, содержащих BIBW 2992 МА 2 Составы F, G и Н представляют собой таблетки, на которые можно наносить пленочное покрытие,как указано в табл. 8. Таблица 8. Пример композиции пленочных покрытий для составов F-H В табл. 9 показаны другие фармацевтические композиции по настоящему изобретению. Составы L,М и N представляют собой таблетки, состав О можно прессовать в таблетки после грануляции из расплава. Таблица 9. Пример композиции твердых составов, содержащих BIBW 2992 МА 2 ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения уплотненного промежуточного продукта дималеата 4-[(3-хлор-4 фторфенил)амино]-6-[4-(N,N-диметиламино)-1-оксо-2-бутен-1-ил]амино-7-S)-тетрагидрофуран-3 илокси)хиназолина (дималеат BIBW 2992) в форме порошка, включающий стадию ротационного уплотнения с последующей по крайней мере одной стадией просеивания, где стадию ротационного уплотнения проводят с использованием следующих материалов: дималеат BIBW 2992, в отдельности или с пред- 15022168 варительно полученной смесью, содержащей дималеат BIBW 2992 со смазывающим веществом в количестве до 1,0 мас.% в гравитационном смесителе или барабанном смесителе для предотвращения прилипания к уплотняющим роликам. 2. Способ по п.1, где стадию ротационного уплотнения проводят на роликовом прессе с расположением уплотняющих роликов горизонтально, вертикально или под углом 45, причем поверхность уплотняющих роликов может быть гладкой или определенной формы; с использованием силы уплотнения в интервале от 1 до 20 кН/см, при скорости вращения ротационных роликов в интервале от 1 до 30 об/мин и при ширине зазора между уплотняющими роликами от 1 до 10 мм. 3. Уплотненный промежуточный продукт, содержащий дималеат 4-[(3-хлор-4-фторфенил)амино]-6[4-(N,N-диметиламино)-1-оксо-2-бутен-1-ил]амино-7-S)-тетрагидрофуран-3-илокси)хиназолина (дималеат BIBW 2992), в форме порошка, полученный способом по п.1 или 2. 4. Уплотненный промежуточный продукт, содержащий дималеат 4-[(3-хлор-4-фторфенил)амино]-6[4-(N,N-диметиламино)-1-оксо-2-бутен-1-ил]амино-7-S)-тетрагидрофуран-3-илокси)хиназолина (дималеат BIBW 2992) и смазывающее вещество в количестве до 1,0 мас.% в расчете на массовое количество дималеата BIBW 2992, в форме порошка, полученный способом по п.1 или 2. 5. Уплотненный промежуточный продукт по п.3 или 4, характеризующийся следующим распределением частиц по размерам: 10200 мкм, 1 мкм 50300 мкм, 75 мкм 90600 мкм. 6. Уплотненный промежуточный продукт по пп.3, 4 или 5, характеризующийся насыпной плотностью (p) в интервале 0,2 г/млp1,0 г/мл и/или фактором Хауснера (HF) в интервале 1,00HF1,30,измеренные в соответствии с параграфом 2.9.15 Европейской фармакопеи (4-е изд.). 7. Твердая пероральная таблетка, полученная из уплотненного промежуточного продукта дималеатаBIBW 2992 по любому из пп.3-6, содержащая от 1 до 150 мг BIBW 2992,от 50 до 500 мг носителя, связующего вещества или их комбинации,от 0,1 до 5 мг скользящего вещества,от 1 до 15 мг дезинтегрирующего агента и от 1 до 15 мг смазывающего вещества. 8. Таблетка по п.7, содержащая от 20 до 70 мг BIBW 2992,от 120 до 500 мг носителя, связующего вещества или их комбинации,от 0,5 до 5 мг скользящего вещества,от 2,5 до 15 мг дезинтегрирующего агента и от 2,5 до 15 мг смазывающего вещества. 9. Таблетка по п.7 или 8, характеризующаяся следующими композициями, выбранными из составов А, В, С, D и Е: 10. Таблетка по п.9, покрытая пленочным покрытием, характеризующимся следующими композициями, выбранными из составов А, В, С, D и Е: 11. Таблетка по п.7, характеризующаяся следующими композициями, выбранными из составов F, G,H, I, J и K: Фиг. 1. Способ уплотнения для получения "уплотненного промежуточного продукта BIBW 2992 МА 2" 1: Осажднная соль BIBW 2992 2: Уплотняющие ролики 3: Лента 4: Гранулятор 5: Раздробленная лента 6: Установка для просеивания 7: Уплотненный промежуточный продукт BBW 2992 Фиг. 2. Снижение времени распадаемости (таблетки, содержащие 20 мг АФИ) при увеличении силы сжатия при ротационном уплотнении Стадии увеличения силы сжатия при ротационном уплотнении: 0 = отсутствует предварительное уплотнение АФИ АС = увеличение силы сжатия при ротационном уплотнении Фиг. 3. Увеличение скорости растворения (таблетки, содержащие 20 мг АФИ) при увеличении силы сжатия при ротационном уплотнении Стадии увеличения силы сжатия при ротационном уплотнении: 0 = отсутствует предварительное уплотнение АФИ АС = увеличение силы сжатия при ротационном уплотнении Фиг. 4. Оптический анализ размера частиц осажднной соли BIBW 2992 МА 2 и уплотненных промежуточных продуктов, полученных при изменении силы сжатияp.у. - ротационное уплотнение Стадии увеличения силы сжатия при ротационном уплотнении:AС = увеличение силы сжатия при ротационном уплотнении Фиг. 5. Определение размера частиц методом лазерной дифракции осажднной соли BIBW 2992 МА 2 и уплотненных промежуточных продуктов, полученных при изменении силы сжатия(Прибор: Helos KF, дисперсия RODOS, Sympatec GmbH) р.у. - ротационное уплотнение Стадии увеличения силы сжатия при ротационном уплотнении: АС = увеличение силы сжатия при ротационном уплотнении Фиг. 6. Сравнение растворения таблеток с пленочным покрытием, содержащих 20, 30, 40, 50 мг Фиг. 7. Сравнение растворения таблеток с пленочным покрытием, содержащих 20, 30, 40, 50 мг BIBW 2992 МА 2, в буферном растворе McIllvaine (pH 4,0, лопастная мешалка, 75 об./мин/n=12) Фиг. 8. Сравнение растворения таблеток с пленочным покрытием, содержащих 20, 30, 40, 50 мгBIBW 2992 МА 2, в фосфатном буферном растворе (0,05 М, рН 6,8, лопастная мешалка, 75 об./мин/n=12) Фиг. 9. Сравнение растворения таблеток с пленочным покрытием, содержащих 20, 30, 40, 50 мг BIBW 2992 МА 2 в воде (лопастная мешалка 50 об./мин/n=12) Фиг. 10. Индивидуальные данные и среднее геометрическое значение профилей зависимостей концентрации лекарственного средства BIBW 2992 BS в плазме от времени после многократного перорального введения по 40 мг в день таблеток BIBW 2992 МА 2 в течение 27 дней в ТР 1 (N=17) Фиг. 11. Индивидуальные данные и среднее геометрическое значение максимальной концентрацииBIBW 2992 в плазме, нормированной на дозу, в стабильном состоянии, четыре серии испытаний фазы I Фиг. 12. Индивидуальные данные и среднее геометрическое значение площади под фармакокинетической кривой (AUC,ss), нормированной на дозу BIBW 2992, в стабильном состоянии, четыре серии испытаний фазы I Фиг. 13. Индивидуальные данные и среднее геометрическое значение максимальной концентраций в плазме, нормированной на дозу, в день 1 периода лечения 1, одна серия испытаний фазы I Фиг. 14. Индивидуальные данные и среднее геометрическое значение площади под фармакокинетической кривой BIBW 2992 (AUC0-24), нормированной на дозу, в день 1 периода лечения 1, одна серия испытаний фазы I
МПК / Метки
МПК: A61K 31/517, A61K 9/00, A61P 35/00
Метки: дималеата, таблетки, промежуточного, полученные, уплотненного, способ, продукта, получения, твердые, такого
Код ссылки
<a href="https://eas.patents.su/23-22168-sposob-polucheniya-uplotnennogo-promezhutochnogo-produkta-dimaleata-bibw-2992-i-tverdye-tabletki-poluchennye-iz-takogo-produkta.html" rel="bookmark" title="База патентов Евразийского Союза">Способ получения уплотненного промежуточного продукта дималеата bibw 2992 и твердые таблетки, полученные из такого продукта</a>
Предыдущий патент: Наконечник рабочего валка машины для разработки грунта
Следующий патент: Клетка насекомого, пригодная для продуцирования рекомбинантных парвовирусных векторов, и способ получения рекомбинантных парвовирусных вирионов
Случайный патент: Стабилизированные препараты антител к бета-амилоидному пептиду и их применение