Бензодиазепиновый ингибитор бромодомена
Формула / Реферат
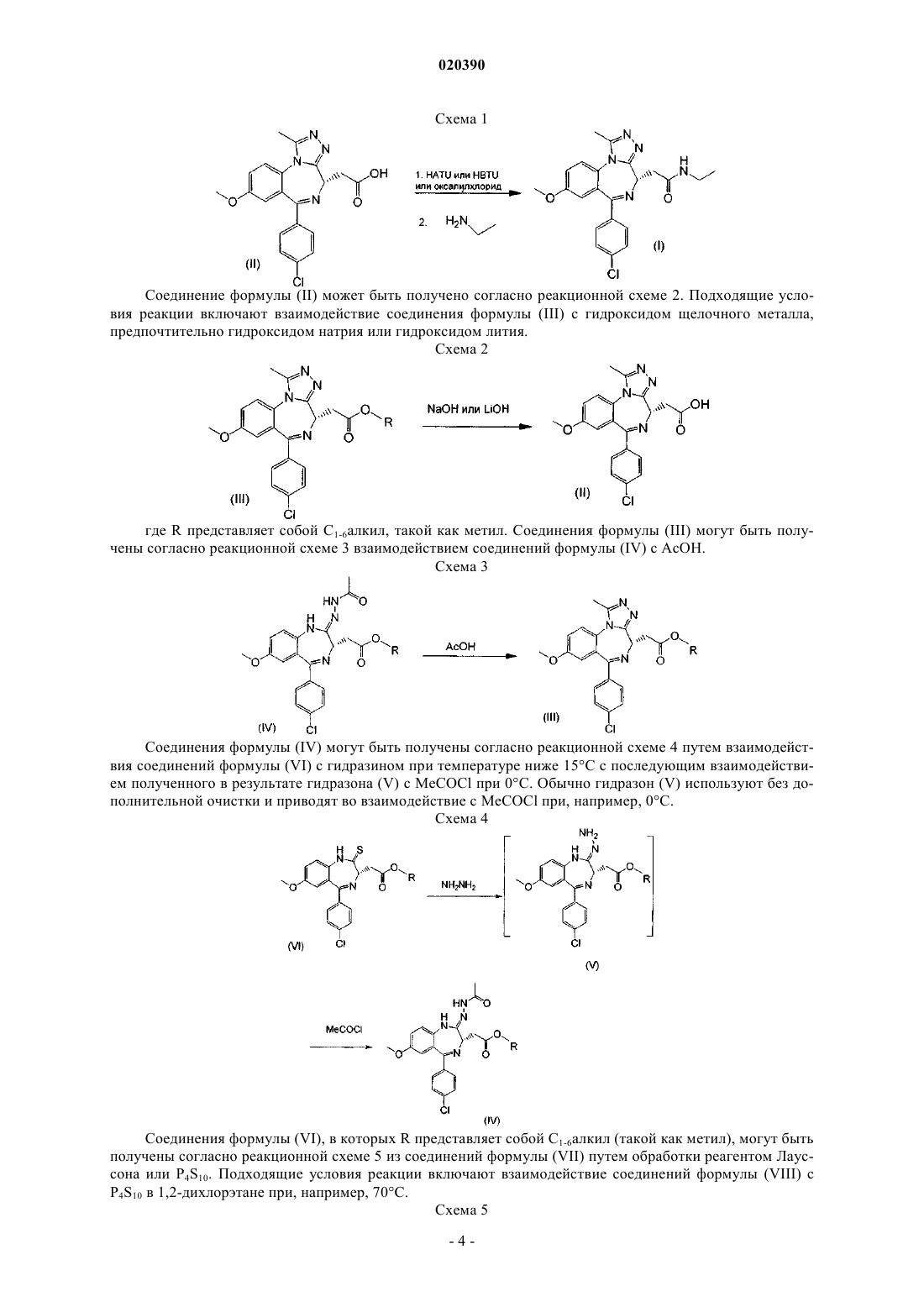
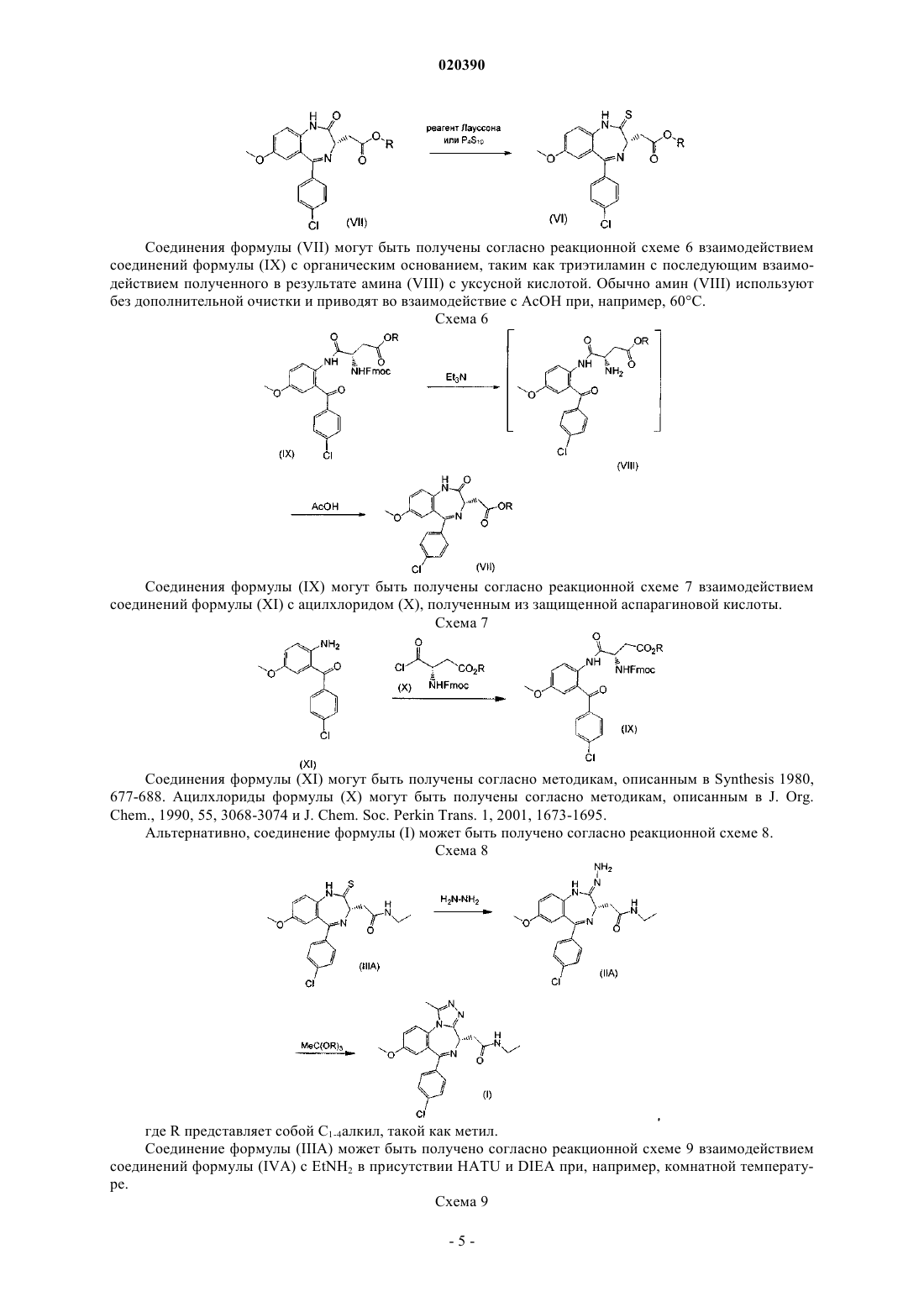
1. Соединение формулы (I), представляющее собой 2-[(4S)-6-(4-хлорфенил)-1-метил-8-(метилокси)-4H-[1,2,4]триазоло[4,3-а][1,4]бензодиазепин-4-ил]-N-этилацетамид
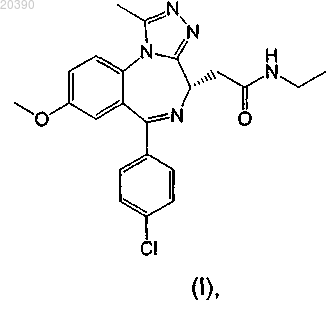
или его соль.
2. Соединение формулы (I) по п.1, представляющее собой 2-[(4S)-6-(4-хлорфенил)-1-метил-8-(метилокси)-4H-[1,2,4]триазоло[4,3-а][1,4]бензодиазепин-4-ил]-N-этилацетамид
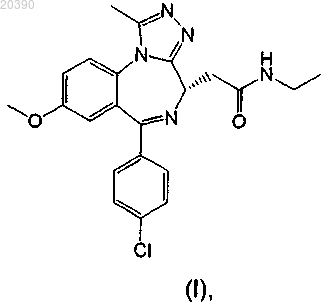
или его фармацевтически приемлемая соль.
3. Соединение формулы (I) по п.1, представляющее собой 2-[(4S)-6-(4-хлорфенил)-1-метил-8-(метилокси)-4H-[1,2,4]триазоло[4,3-а][1,4]бензодиазепин-4-ил]-N-этилацетамид

4. Фармацевтическая композиция для ингибирования связывания бромодоменов с их близкими ацетилированными белками, содержащая соединение формулы (I) или его фармацевтически приемлемую соль по п.2 и один или более чем один фармацевтически приемлемый носитель, разбавитель или эксципиент.
5. Фармацевтическая композиция для ингибирования связывания бромодоменов с их близкими ацетилированными белками, содержащая соединение формулы (I) по п.3 и один или более чем один фармацевтически приемлемый носитель, разбавитель или эксципиент.
6. Применение соединения формулы (I) или его фармацевтически приемлемой соли по п.2, или соединения формулы (I) по п.3 в изготовлении лекарственного средства для лечения рака или хронического аутоиммунного и/или воспалительного состояния.
7. Способ лечения заболевания или состояния, выбранного из рака, хронического аутоиммунного и/или воспалительного состояния у субъекта, нуждающегося в этом, включающий введение терапевтически эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли по п.2.
8. Способ лечения по п.7, где заболевание или состояние представляют собой рак.
9. Способ по п.8, где рак выбран из гематологического рака, эпителиального рака, включая карциномы легкого, молочной железы и толстой кишки, срединные карциномы, мезенхимальные, почечные и неврологические опухоли.
10. Способ по п.9, где гематологический рак представляет собой лейкемию.
Текст
Настоящее изобретение относится к бензодиазепиновому соединению формулы (I), способам его получения, фармацевтическим композициям, содержащим такое соединение, и к его применению в терапии. Госмини Ромэн Люк Мари, Миргюэ Оливье (FR) Поликарпов А.В. (RU) Область изобретения Настоящее изобретение относится к бензодиазепиновому соединению, способам его получения,фармацевтическим композициям, содержащим такое соединение, и к его применению в терапии. Предшествующий уровень техники Геномы эукариот высоко организованы в ядре клетки. Длинные нити дуплекса ДНК закручены вокруг октамера гистоновых белков (обычно содержащего две копии гистонов Н 2 А, Н 2 В, Н 3 и Н 4) с образованием нуклеосомы. Эта основная единица затем дополнительно сжимается путем агрегирования и укладки нуклеосом с образованием высоко конденсированной структуры хроматина. Возможен ряд различных состояний конденсации, и компактность этой структуры варьирует в течение клеточного цикла,являясь наиболее компактной в течение процесса клеточного деления. Структура хроматина играет важную роль в регуляции транскрипции генов, которая не может происходить эффективно с высоко конденсированного хроматина. Структура хроматина контролируется серией посттрансляционных модификаций гистоновых белков, особенно гистонов Н 3 и Н 4, и обычно в гистоновых хвостах, которые простираются за пределами структуры ядра нуклеосомы. Эти модификации включают ацетилирование, метилирование, фосфорилирование, убиквитинирование и сумоилирование. Эти эпигенетические метки записываются и стираются специальными ферментами, которые ставят метки на специфические остатки в гистоновом хвосте, таким образом, создавая эпигенетический код, который затем расшифровывается клеткой, делая возможной ген-специфичную регуляцию структуры хроматина и, таким образом, транскрипции. Ацетилирование гистонов обычно связано с активацией транскрипции генов, так как модификация ослабляет взаимодействие ДНК и гистонового октамера путем изменения электростатики. В дополнение к этому физическому изменению специальные белки связываются с ацетилированными остатками лизина в гистонах, чтобы прочитать эпигенетический код. Бромодомены представляют собой небольшие(110 аминокислот) особые домены в белках, которые связываются с ацетилированными остатками лизина, как правило, но не исключительно, в области гистонов. Существует семейство приблизительно из 50 белков, которые, как известно, содержат бромодомены, и они выполняют ряд функций в клетке.Bet семейство белков, содержащих бромодомены, включает 4 белка (BRD2, BRD3, BRD4 и BRD-t),которые содержат тандемные бромодомены, способные связываться с двумя ацетилированными остатками лизина в непосредственной близости, увеличивая специфичность взаимодействия. BRD2 и BRD3,как сообщается, связываются с гистонами вдоль активно транскрибируемых генов и могут быть вовлечены в облегченную элонгацию транскрипции (Leroy et al., Mol. Cell, 2008, 30(1): 51-60), в то время какBRD4, по-видимому, вовлечен в рекрутмент pTEF-B комплекса к индуцибельным генам, приводя к фосфорилированию РНК-полимеразы и повышенному выходу транскрипции (Hargreaves et al., Cell, 2009,138(1): 129-145). Также сообщали, что BRD4 и BRD3 сливаются с NUT (ядерный белок в семеннике),образуя новый химерный онкоген, BRD4-NUT, в крайне тяжелой форме эпителиальной неоплазии(French et al. Cancer Research, 2003, 63, 304-307 and French et al. Journal of Clinical Oncology, 2004, 22 (20),4135-4139). Данные наводят на мысль о том, что BRD-NUT химерные белки содействуют канцерогенезу(Oncogene, 2008, 27, 2237-2242). BRD-t уникально экспрессируется в семенниках и яичнике. Сообщали,что все члены семейства обладают некоторой функцией в регулировании или выполнении аспектов клеточного цикла, и, как было показано, остаются в комплексе с хромосомами в течение клеточного деления, что наводит на мысль о роли в поддержании эпигенетической памяти. Кроме того, некоторые вирусы используют эти белки для привязывания своих геномов к хроматину клетки хозяина, как часть процесса репликации вируса (You et al. Cell, 2004, 117(3): 349-60). В заявке на японский патент JP2008-156311 описано производное бензимидазола, которое, как говорят, представляет собой агент, связывающий BRD2 бромодомен, который является полезным в отношении вирусной инфекции/ пролиферации. В патентной заявке WO2009/084693A1 описана серия производных тиентриазолдиазепиена, которые, как говорят, ингибируют связывание ацетилированного гистона с белком, содержащим бромодомен,которые, как говорят, являются полезными в качестве противораковых агентов. Обнаружено соединение, которое ингибирует связывание бромодоменов с их близкими ацетилированными белками, которое в частности ингибирует связывание бромодоменов Bet семейства с ацетилированными остатками лизина. Такое соединение дальше будет называться "ингибитор бромодомена". Краткое изложение сущности изобретения В первом аспекте настоящего изобретения предложено соединение формулы (I) или его соль Во втором аспекте настоящего изобретения предложена фармацевтическая композиция, содержащая соединение формулы (I) или его фармацевтически приемлемую соль и один или более чем один фармацевтически приемлемый носитель, разбавитель или эксципиент. В третьем аспекте настоящего изобретения предложено соединение формулы (I) или его фармацевтически приемлемая соль для применения в терапии, в частности при лечении заболеваний или состояний, при которых показан ингибитор бромодомена. В четвертом аспекте настоящего изобретения предложен способ лечения заболеваний или состояний, при которых показан ингибитор бромодомена, у субъекта, нуждающегося в этом, включающий введение терапевтически эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли. В пятом аспекте настоящего изобретения предложено применение соединения формулы (I) или его фармацевтически приемлемой соли в изготовлении лекарственного средства для лечения заболеваний или состояний, при которых показан ингибитор бромодомена. Подробное описание изобретения Настоящее изобретение относится к соединению формулы (I), которое представляет собой 2-[(4S)6-(4-хлорфенил)-1-метил-8-(метилокси)-4H-[1,2,4]триазоло[4,3-а][1,4]бензодиазепин-4-ил]-Nэтилацетамид или его солям. Следует понимать, что настоящее изобретение охватывает соединения формулы (I) в виде свободного основания и в виде его солей, например, в виде его фармацевтически приемлемой соли. В одном воплощении предложено соединение, которое представляет собой 2-[(4S)-6-(4-хлорфенил)1-метил-8-(метилокси)-4H-[1,2,4]триазоло[4,3-а][1,4]бензодиазепин-4-ил]-N-этилацетамид. Из-за их возможного применения в медицине, соли соединений формулы (I) желательно представляют собой фармацевтически приемлемые соли. В другом воплощении предложено соединение, которое представляет собой 2-[(4S)-6-(4-хлорфенил)-1-метил-8-(метилокси)-4H-[1,2,4]триазоло[4,3-а][1,4]бензодиазепин-4-ил]-N-этилацетамид, или его фармацевтически приемлемая соль. Подходящие фармацевтически приемлемые соли могут включать соли присоединения кислоты или основания. Для обзора подходящих солей смотри Berge et al., J. Pharm. Sci., 66:1-19, (1977). Обычно фармацевтически приемлемая соль может быть легко получена с использованием требуемой кислоты или основания в зависимости от конкретного случая. Полученная в результате соль может осаждаться из раствора и может быть собрана фильтрацией или быть получена вновь выпариванием растворителя. Фармацевтически приемлемая соль присоединения основания может быть получена взаимодействием соединения формулы (I) с подходящим неорганическим или органическим основанием (например,триэтиламином, этаноламином, триэтаноламином, холином, аргинином, лизином или гистидином), возможно, в подходящем растворителе, с получением соли присоединения основания, которую обычно выделяют, например, кристаллизацией и фильтрацией. Фармацевтически приемлемые основные соли включают аммониевые соли, соли щелочных металлов, такие как соли натрия и калия, соли щелочноземельных металлов, такие как соли кальция и магния, и соли органических оснований, включая соли первичного, вторичного и третичного аминов, такие как изопропиламин, диэтиламин, этаноламин, триметиламин, дициклогексиламин и N-метил-D-глюкамин. Фармацевтически приемлемая соль присоединения кислоты может быть получена взаимодействием соединения формулы (I) с подходящей неорганической или органической кислотой (такой как бромоводородная, хлороводородная, серная, азотная, фосфорная, янтарная, малеиновая, уксусная, пропионовая,-2 020390 фумаровая, лимонная, винная, молочная, бензойная, салициловая, глутаминовая, аспарагиновая, паратолуолсульфоновая, бензолсульфоновая, метансульфоновая, этансульфоновая, нафталинсульфоновая,такая как 2-нафталинсульфоновая, или капроновая кислота), возможно, в подходящем растворителе, таком как органический растворитель, с получением соли, которую обычно выделяют, например, кристаллизацией или фильтрацией. Фармацевтически приемлемая соль присоединения кислоты соединения формулы (I) может содержать или представлять собой, например, гидробромид, гидрохлорид, сульфат,нитрат, фосфат, сукцинат, малеат, ацетат, пропионат, фумарат, цитрат, тартрат, лактат, бензоат, салицилат, глутамат, аспартат, пара-толуолсульфонат, бензолсульфонат, метансульфонат, этансульфонат, нафталинсульфонат (например, 2-нафталинсульфонат) или гексаноат. Другие не являющиеся фармацевтически приемлемыми соли, например формиаты, оксалаты или трифторацетаты, можно использовать, например, при выделении соединения формулы (I), и они включены в объем этого изобретения. В объем настоящего изобретения включены все возможные стехиометрические и нестехиометрические формы солей соединения формулы (I). Следует понимать, что многие органические соединения могут образовывать комплексы с растворителями, в которых они вступают в реакцию или из которых они осаждаются или кристаллизуются. Эти комплексы известны под названием "сольваты". Например, комплекс с водой известен под названием"гидрат". Растворители с высокими температурами кипения и/или способные образовывать водородные связи, такие как вода, ксилол, N-метилпирролидинон, метанол и этанол, могут быть использованы для образования сольватов. Методы для определения сольватов включают, но не ограничиваются, ЯМР и микроанализ. Сольваты соединения формулы (I) входят в объем данного изобретения. В объем настоящего изобретения включены все возможные стехиометрические и нестехиометрические формы сольватов соединения формулы (I). Настоящее изобретение охватывает все пролекарства соединения формулы (I) и его фармацевтически приемлемых солей, которые при введении реципиенту способны обеспечить (непосредственно или опосредованно) соединение формулы (I) или его фармацевтически приемлемую соль, или активный метаболит или его остаток. Специалист в данной области техники легко распознает такие производные без проведения лишних экспериментов. Тем не менее, дана ссылка на Burger's Medicinal Chemistry and DrugDiscovery, 5th Edition, vol. 1: Principles and Practice, который включен сюда посредством ссылки. Соединение формулы (I) может быть в кристаллической или аморфной форме. Далее, некоторые из кристаллических форм соединения формулы (I) могут существовать в виде полиморфов, которые включены в объем настоящего изобретения. Полиморфные формы соединения формулы (I) могут быть охарактеризованы и дифференцированы с использованием ряда традиционных аналитических методов,включая, но не ограничиваясь, картины рентгеновской дифракции на порошке (XRPD), инфракрасные(IR) спектры, Рамановские спектры, дифференциальную сканирующую калориметрию (DSC), термогравиметрический анализ (TGA) и ядерный магнитный резонанс в твердом состоянии (SSNMR). Соединение формулы (I) представляет собой индивидуальный изомер, выделенный таким образом,чтобы быть, по существу, свободным от другого изомера (т.е. энантиомерно чистым), так что присутствует менее 10%, в частности менее приблизительно 1%, например, менее приблизительно 0,1% другого энантиомера. Разделение изомеров может быть достигнуто традиционными методами, известными специалисту в данной области техники, например, фракционной кристаллизацией, хроматографией или ВЭЖХ. Соединение формулы (I) может существовать в одной из нескольких таутомерных форм. Следует понимать, что настоящее изобретение охватывает все таутомеры соединения формулы (I) как в виде индивидуальных таутомеров, так и в виде их смесей. Из сказанного выше понятно, что в объем данного изобретения включены сольваты, изомеры и полиморфные формы соединения формулы (I) и его солей. Соединение формулы (I) и его фармацевтически приемлемые соли могут быть получены множеством способов, включая классическую химию. Иллюстративные примеры общих способов синтеза изложены ниже, и затем конкретное соединение формулы (I) получено в Примерах. Эти способы образуют дополнительные аспекты настоящего изобретения. Соединение формулы (I) может быть получено согласно реакционной схеме 1 взаимодействием соединения формулы (II) с EtNH2 в присутствии HATU или HBTU и DIEA при комнатной температуре. В качестве альтернативы, соединения формулы (I) могут быть получены взаимодействием соединения формулы (II) с оксалилхлоридом с последующим добавлением EtNH2 в присутствии триэтиламина. Соединение формулы (II) может быть получено согласно реакционной схеме 2. Подходящие условия реакции включают взаимодействие соединения формулы (III) с гидроксидом щелочного металла,предпочтительно гидроксидом натрия или гидроксидом лития. Схема 2 где R представляет собой C1-6 алкил, такой как метил. Соединения формулы (III) могут быть получены согласно реакционной схеме 3 взаимодействием соединений формулы (IV) с АсОН. Схема 3 Соединения формулы (IV) могут быть получены согласно реакционной схеме 4 путем взаимодействия соединений формулы (VI) с гидразином при температуре ниже 15 С с последующим взаимодействием полученного в результате гидразона (V) с MeCOCl при 0 С. Обычно гидразон (V) используют без дополнительной очистки и приводят во взаимодействие с MeCOCl при, например, 0 С. Схема 4 Соединения формулы (VI), в которых R представляет собой C1-6 алкил (такой как метил), могут быть получены согласно реакционной схеме 5 из соединений формулы (VII) путем обработки реагентом Лауссона или P4S10. Подходящие условия реакции включают взаимодействие соединений формулы (VIII) с Соединения формулы (VII) могут быть получены согласно реакционной схеме 6 взаимодействием соединений формулы (IX) с органическим основанием, таким как триэтиламин с последующим взаимодействием полученного в результате амина (VIII) с уксусной кислотой. Обычно амин (VIII) используют без дополнительной очистки и приводят во взаимодействие с АсОН при, например, 60 С. Схема 6 Соединения формулы (IX) могут быть получены согласно реакционной схеме 7 взаимодействием соединений формулы (XI) с ацилхлоридом (X), полученным из защищенной аспарагиновой кислоты. Схема 7 Соединения формулы (XI) могут быть получены согласно методикам, описанным в Synthesis 1980,677-688. Ацилхлориды формулы (X) могут быть получены согласно методикам, описанным в J. Org.Chem., 1990, 55, 3068-3074 и J. Chem. Soc. Perkin Trans. 1, 2001, 1673-1695. Альтернативно, соединение формулы (I) может быть получено согласно реакционной схеме 8. Схема 8 где R представляет собой С 1-4 алкил, такой как метил. Соединение формулы (IIIA) может быть получено согласно реакционной схеме 9 взаимодействием соединений формулы (IVA) с EtNH2 в присутствии HATU и DIEA при, например, комнатной температуре. Схема 9 Соединение формулы (IVA) может быть получено согласно реакционной схеме 10. Подходящие условия реакции включают взаимодействие соединений формулы (VI) с гидроксидом щелочного металла,таким как гидроксид натрия. Схема 10 Специалисту в данной области будет понятно, что может быть предпочтительным защитить одну или более чем одну функциональную группу соединений в описанных выше способах. Примеры защитных групп и способов их удаления можно найти в Т. W. Greene "Protective Groups in Organic Synthesis"(4th edition, J. Wiley and Sons, 2006). Подходящие защитные группы аминов включают ацил (например,ацетил, карбамат (например, 2',2',2'-трихлорэтоксикарбонил, бензилоксикарбонил или третбутоксикарбонил) и арилалкил (например, бензил), которые могут быть удалены путем гидролиза (например, используя кислоту, такую как соляная кислота в диоксане или трифторуксусная кислота в дихлорметане) или восстановлением (например, гидрогенолиз бензильной или бензилоксикарбонильной группы или восстановительное удаление 2',2',2'-трихлорэтоксикарбонильной группы, используя цинк в уксусной кислоте) в зависимости от конкретного случая. Другие подходящие защитные группы аминов включают трифторацетил (-COCF3), который может быть удален путем гидролиза, катализируемого основанием. Следует понимать, что в любом из способов, описанных выше, точный порядок стадий синтеза, с помощью которых различные группы и функциональные группы вводятся в молекулу, может быть различным. Практикующий специалист в данной области сможет обеспечить, чтобы на группы или функциональные группы, введенные на одной стадии процесса, не оказывали влияние последующие превращения и взаимодействия, и выбрать соответствующий порядок стадий синтеза. Полагают, что определенные промежуточные соединения, описанные выше, являются новыми, и поэтому они образуют еще один дополнительный аспект настоящего изобретения. Соединение формулы (I) и его соли представляют собой ингибитор бромодомена и, таким образом,как полагают, являются полезными при лечении заболеваний или состояний, при которых показан ингибитор бромодомена. Согласно настоящему изобретению предложено соединение формулы (I) или его фармацевтически приемлемая соль для применения в терапии. Соединение формулы (I) или его фармацевтически приемлемая соль могут применяться при лечении заболеваний или состояний, при которых показан ингибитор бромодомена. В одном воплощении предложено соединение формулы (I) или его фармацевтически приемлемая соль для применения при лечении заболеваний или состояний, при которых показан бромодомен. В другом воплощении предложено соединение или его фармацевтически приемлемая соль для применения при лечении хронического аутоиммунного и/или воспалительного состояния. В дополнительном воплощении предложено соединение или его фармацевтически приемлемая соль для применения при лечении рака,такого как срединная карцинома (midline carcinoma). В одном воплощении предложено применение соединения формулы (I) или его фармацевтически приемлемой соли в изготовлении лекарственного средства для лечения заболеваний и состояний, при которых показан ингибитор бромодомена. В другом воплощении предложено применение соединения формулы (I) или его фармацевтически приемлемой соли в изготовлении лекарственного средства для лечения хронического аутоиммунного и/или воспалительного состояния. В одном из других воплощений предложено применение соединения формулы (I) или его фармацевтически приемлемой соли в изготовлении лекарственного средства для лечения рака, такого как срединная карцинома. В одном воплощении предложен способ лечения заболевания или состояния, при котором показан ингибитор бромодомена, у субъекта, нуждающегося в этом, включающий введение терапевтически эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли. В другом воплощении предложен способ лечения хронического аутоиммунного и/или воспалительного состояния у субъекта, нуждающегося в этом, включающий введение терапевтически эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли. В еще одном воплощении предложен способ лечения рака, такого как срединная карцинома, у субъекта, нуждающегося в этом, включающий введение терапевтически эффективного количества соединения формулы (1) или его фармацевтически приемлемой соли. В одном воплощении субъект, нуждающийся в этом, представляет собой млекопитающее, в частности человека. Используемый здесь термин "эффективное количество" означает такое количество лекарственного средства или фармацевтического агента, которое вызывает биологическую или медицинскую ответную реакцию ткани, системы, животного или человека, которой добивается, например, исследователь или клинический врач. Более того, термин "терапевтически эффективное количество" означает любое количество, которое приводит к улучшенному лечению, исцелению, предупреждению или облегчению заболевания, расстройства или побочного эффекта или снижению скорости развития заболевания или расстройства по сравнению с соответствующим субъектом, который не получил такого количества. Термин также включает количества, эффективные для улучшения нормальной физиологической функции. Считается, что ингибиторы бромодомена являются полезными при лечении множества заболеваний или состояний, связанных с системным воспалением или воспалением ткани, воспалительными реакциями на инфекцию или гипоксию, клеточной активацией и пролиферацией, липидным метаболизмом, фиброзом и при предупреждении и лечении вирусных инфекций. Ингибиторы бромодомена могут быть полезными при лечении различных хронических аутоиммунных и воспалительных состояний, таких как ревматоидный артрит, остеоартрит, острая подагра, псориаз,системная красная волчанка, рассеянный склероз, воспалительное заболевание кишечника (болезнь Крона и неспецифический язвенный колит), астма, хроническое обструктивное заболевание дыхательных путей, пневмонит, миокардит, перикардит, миозит, экзема, дерматит, алопеция, витилиго, буллезные заболевания кожи, нефрит, васкулит, атеросклероз, болезнь Альцгеймера, депрессия, ретинит, увеит, склерит, гепатит, панкреатит, первичный билиарный цирроз печени, склерозирующий холангит, болезнь Аддисона, гипофизит, тиреоидит, диабет I типа и острое отторжение трансплантированных органов. Ингибиторы бромодомена могут быть полезными при лечении различных острых воспалительных состояний, таких как острая подагра, гигантоклеточный артериит, нефрит, включая волчаночный нефрит,васкулит с поражением органов, такой как гломерулонефрит, васкулит, включая гигантоклеточный артериит, гранулематоз Вегенера, нодозный полиартериит, болезнь Бехчета, болезнь Кавасаки, артериит Такаясу и острое отторжение трансплантированных органов. Ингибиторы бромодомена могут быть полезны при предупреждении или лечении заболеваний или состояний, которые включают воспалительные реакции на заражения бактериями, вирусами, грибами,паразитами или их токсины, таких как сепсис, сепсисоподобный синдром, септический шок, эндотоксемия, синдром системной воспалительной реакции (SIRS), синдром мультиорганной дисфункции, синдром токсического шока, острое повреждение легких, ARDS (респираторный дистресс-синдром взрослых), острая почечная недостаточность, фульминантный гепатит, ожоги, острый панкреатит, послеоперационные синдромы, саркоидоз, реакции Герксгеймера, энцефалит, миелит, менингит, малярия, SIRS,связанный с вирусными инфекциями, такими как грипп, опоясывающий герпес, простой герпес и коронавирус. Ингибиторы бромодомена могут быть полезны при предупреждении или лечении состояний, связанных с ишемически-реперфузионным повреждением, таких как инфаркт миокарда, цереброваскулярная ишемия (удар), острые коронарные синдромы, реперфузионное повреждение почек, трансплантация органов, обходное шунтирование коронарной артерии, сердечно-легочные обходные процедуры и легочная, почечная, печеночная, желудочно-кишечная эмболия или эмболия периферических артерий. Ингибиторы бромодомена могут быть полезными при лечении нарушений липидного метаболизма через регуляцию АРО-А 1, таких как гиперхолестеринемия, атеросклероз и болезнь Альцгеймера. Ингибиторы бромодомена могут быть полезными при лечении фиброзных состояний, таких как идиопатический легочный фиброз, почечный фиброз, послеоперационная стриктура, келоидное образование, склеродермия и кардиофиброз. Ингибиторы бромодомена могут быть полезны при предупреждении и лечении вирусных инфекций, таких как вирус герпеса, вирус папилломы человека, аденовирус, поксвирус и другие ДНКсодержащие вирусы. Ингибиторы бромодомена могут быть полезны при лечении рака, включая гематологический (такой как лейкемия), эпителиальный, включая карциномы легкого, молочной железы и толстой кишки, срединные карциномы, мезенхимальные, печеночные, почечные и неврологические опухоли. Ингибиторы бромодомена могут быть полезными при лечении офтальмологических симптомов, таких как сухость глаз. В одном воплощении заболевание или состояние, при которых показан ингибитор бромодомена,выбрано из заболеваний, связанных с синдром системной воспалительной реакции, таких как сепсис,-7 020390 ожоги, панкреатит, обширная травма, кровотечение и ишемия. В этом воплощении ингибитор бромодомена вводят в месте диагностирования, чтобы уменьшить случаи возникновения: SIRS, наступления шока, синдрома мультиорганной дисфункции, который включает наступление острого повреждения легких,ARDS, острое почечное, печеночное, сердечное и желудочно-кишечное повреждение и смерть В другом воплощении ингибитор бромодомена вводят перед хирургическими или другими процедурами, связанными с высоким риском сепсиса, кровотечения, обширного тканевого повреждения, SIRS или MODS(синдром мультиорганной дисфункции). В конкретном воплощении заболевание или состояние, при котором показан ингибитор бромодомена, представляет собой сепсис, сепсисоподобный синдром, септический шок и/или эндотоксикоз. В другом воплощении ингибитор бромодомена показан для лечения острого или хронического панкреатита. В другом воплощении ингибитор бромодомена показан для лечения ожогов. В одном воплощении заболевание или состояние, при которых показан ингибитор бромодомена,выбраны из инфекций и реактиваций простого герпеса, герпетических лихорадок, инфекций и реактиваций опоясывающего герпеса, ветряной оспы, опоясывающего лишая, вируса папилломы человека, неоплазии шейки матки, аденовирусных инфекций, включая острое респираторное заболевание, и поксвирусных инфекций, таких как коровья оспа и натуральная оспа, и вирус африканской лихорадки свиней. В одном конкретном воплощении ингибитор бромодомена показан для лечения инфекций вируса папилломы человека кожи или эпителия шейки матки. Термин "заболевания или состояния, при которых показан ингибитор бромодомена" включает любое или все из болезненных состояний, описанных выше. Хотя возможно, что для применения в терапии соединение формулы (I), так же как его фармацевтически приемлемые соли, можно вводить в виде сырого химического продукта, обычно активный ингредиент представлен в виде фармацевтической композиции. Поэтому согласно настоящему изобретению, в одном из дополнительных аспектов предложена фармацевтическая композиция, содержащая соединение формулы (I) или его фармацевтически приемлемую соль и один или более чем один фармацевтически приемлемый носитель, разбавитель или эксципиент. Таким образом, предложена фармацевтическая композиция для лечения заболеваний или состояний, при которых показан ингибитор бромодомена, содержащая соединение формулы (I) или его фармацевтически приемлемую соль. Носитель(и), разбавитель(и) или эксципиент(ы), используемые в таких фармацевтических композициях, должны быть приемлемыми в смысле совместимости с другими ингредиентами композиции и безвредными для их реципиента. Согласно другому аспекту данного изобретения, также предложен способ приготовления фармацевтической композиции, включающий смешивание соединения формулы (I) или его фармацевтически приемлемой соли с одним или более чем одним фармацевтически приемлемым носителем, разбавителем или эксципиентом. Фармацевтическую композицию можно применять при лечении любого из состояний, описанных здесь. Так как соединение формулы (I) и его фармацевтически приемлемые соли предназначены для применения в фармацевтических композициях, понятно, что все они предпочтительно предоставлены в по существу чистой форме, например, имеют по меньшей мере 60% чистоты, более приемлемо по меньшей мере 75% чистоты и предпочтительно по меньшей мере 85% чистоты, особенно по меньшей мере 98% чистоты (% по массе в расчете на общую массу). Фармацевтические композиции могут быть представлены в стандартных лекарственных формах,содержащих заранее установленное количество активного ингредиента на стандартную дозу. Предпочтительными стандартными композициями являются композиции, содержащие суточную дозу, или субдозу,или ее соответствующую часть, активного ингредиента. Поэтому такие стандартные дозы могут быть введены чаще чем один раз в сутки. Предпочтительными стандартными лекарственными композициями являются те композиции, содержащие суточную дозу или субдозу (для введения чаще чем один раз в сутки), как здесь изложено выше, или соответствующую фракцию активного ингредиента. Фармацевтические композиции могут быть приготовлены для введения любым соответствующим способом, например, пероральным (включая буккальный или сублингвальный), ректальным, ингаляционным, интраназальным, местным (включая буккальный, сублингвальный или трансдермальный), вагинальным или парентеральным (включая подкожный, внутримышечный, внутривенный или интрадермальный) способом. Такие композиции могут быть приготовлены любым способом, известным в данной области фармации, например, смешиванием активного ингредиента с носителем(ями) или эксципиентом(ами). В одном воплощении фармацевтическая композиция приготовлена для перорального введения. В одном воплощении фармацевтическая композиция приготовлена для парентерального введения, в частности внутривенного введения. Фармацевтические композиции, приготовленные для парентерального введения, включают водные и неводные стерильные растворы для инъекций, которые могут содержать антиоксиданты, буферы, бактериостатические и растворенные вещества, которые приводят композицию в изотоническое состояние с кровью намеченного реципиента; и водные и неводные стерильные суспензии, которые могут включать суспендирующие агенты и загустители. Композиции могут быть представлены в однодозовых или многодозовых контейнерах, например, запаянных ампулах и виалах, и могут храниться в сублимационно высушенном (лиофилизированном) состоянии, требуя только добавления стерильного жидкого носителя,например, воды для инъекций, непосредственно перед применением. Приготовленные для немедленного использования растворы для инъекций и суспензии могут быть приготовлены из стерильных порошков,гранул и таблеток. Фармацевтические композиции, приготовленные для перорального введения, могут быть представлены в виде дискретных единиц, таких как капсулы или таблетки; порошки или гранулы; растворы или суспензии в водных и неводных жидкостях; съедобные пены или кремы; или жидкие эмульсии типа"масло-в-воде" и жидкие эмульсии "вода-в-масле". Например, для перорального введения в форме таблетки или капсулы, активный лекарственный компонент может быть соединен с пероральным, нетоксичным фармацевтически приемлемым инертным носителем, таким как этанол, глицерин, вода и тому подобное. Порошки, подходящие для включения в таблетки или капсулы, могут быть приготовлены измельчением соединения до подходящего мелкого размера (например, микронизацией) и смешиванием с приготовленным подобным образом фармацевтическим носителем, таким как съедобный углевод, как, например, крахмал или маннит. Корригент, консерванта, диспергирующий агент и краситель также могут присутствовать. Капсулы могут быть изготовлены путем приготовления порошковой смеси, как описано выше, и наполнения формованных желатиновых оболочек. Глиданты и смазывающие агенты, такие как коллоидный диоксид кремния, тальк, стеарат магния, стеарат кальция или твердый полиэтиленгликоль, могут быть добавлены к порошковой смеси перед процессом наполнения. Разрыхлитель или солюбилизирующий агент, такой как агар-агар, карбонат кальция или карбонат натрия также могут быть добавлены для улучшения доступности лекарственного средства при приеме капсулы внутрь. Более того, при желании или необходимости, подходящие связывающие вещества, глиданты, смазывающие агенты, подсластители, корригенты, разрыхлители и красители могут также быть включены в смесь. Подходящие связывающие вещества включают крахмал, желатин, природные сахара, такие как глюкоза или бета-лактоза, сахаристое вещество из кукурузы, природные и синтетические камеди, такие как акациевые, трагакантовые камеди или альгинат натрия, карбоксиметилцеллюлозу, полиэтиленгликоль, воски и тому подобное. Смазывающие агенты, используемые в этих лекарственных формах, включают олеат натрия, стеарат натрия, стеарат магния, бензоат натрия, ацетат натрия, хлорид натрия и тому подобное. Разрыхлители включают, без ограничения, крахмал, метилцеллюлозу, агар, бентонит, ксантановую камедь и тому подобное. Таблетки приготавливают в виде препарата, например, путем приготовления порошковой смеси, гранулирования или брикетирования, добавления смазывающего агента и разрыхлителя и прессования в таблетки. Порошковую смесь приготавливают путем смешивания соединения, соответствующим образом измельченного, с растворителем или основой, как описано выше, и, возможно, со связывающим веществом, таким как карбоксиметилцеллюлоза, альгинат, желатин или поливинилпирролидон, с ретардантом растворения, таким как парафин, веществом, ускоряющим всасывание,таким как четвертичная соль, и/или поглощающим агентом, таким как бентонит, каолин или дикальцийфосфат. Порошковая смесь может быть гранулирована путем увлажнения связывающим веществом, таким как сироп, крахмальный клейстер, слизь акации или растворы целлюлозных или полимерных веществ, и продавливания через сито. В качестве альтернативы гранулированию порошковую смесь можно пропускать через таблетировочную машину, и результатом является неполностью образованные комки,разрушенные на гранулы. Гранулы могут быть смазаны для предупреждения слипания с матрицами,формирующими таблетку, посредством добавления стеариновой кислоты, соли стеарата, талька или минерального масла. Смазанную смесь затем прессуют в таблетки. Соединения по настоящему изобретению могут быть также объединены со свободнотекучим инертным носителем и спрессованы в таблетки сразу без прохождения через стадии гранулирования или брикетирования. Могут быть нанесены прозрачная или непрозрачная защитная оболочка, состоящая из изолирующего слоя шеллака, оболочка сахара или полимерного вещества и глянцевая оболочка воска. К этим оболочкам могут быть добавлены красители для различения различных стандартных доз. Пероральные жидкости, такие как раствор, сиропы и эликсиры, могут быть приготовлены в стандартной лекарственной форме, так чтобы данное количество содержало заранее установленное количество соединения. Сиропы могут быть приготовлены растворением соединения в ароматизированном соответствующим образом водном растворе, в то время как эликсиры готовят с использованием нетоксичного спиртового растворителя. Суспензии можно приготовить в виде препарата диспергированием соединения в нетоксичном растворителе. Солюбилизаторы и эмульгаторы, такие как этоксилированные изостеариловые спирты и полиоксиэтиленовые эфиры сорбита, консерванты, добавки корригента, такого как мятное масло, или природные подсластители или сахарин или другие искусственные подсластители и тому подобное, также могут быть добавлены. Когда это целесообразно, композиции в виде стандартных лекарственных форм для перорального введения могут быть микроинкапсулированы. Композиция может быть также приготовлена, чтобы про-9 020390 длить или поддержать высвобождение, например, посредством покрытия оболочкой или включения частиц продуктов в полимеры, воск и тому подобное. Соединения формулы (I) и его фармацевтически приемлемые соли можно также вводить в виде липосомальных систем доставки, таких как маленькие однослойные везикулы, большие однослойные везикулы и многослойные везикулы. Липосомы могут быть получены из множества фосфолипидов, таких как холестерин, стеариламин или фосфатидилхолины. Фармацевтические композиции, приготовленные для местного введения, могут быть приготовлены в виде мазей, кремов, суспензий, лосьонов, порошков, растворов, паст, гелей, спреев, аэрозолей или масел. Для лечений глаз или других наружных тканей, например рта или кожи, композиции предпочтительно применяют в виде местной мази или крема. При приготовлении в виде препарата в форме мази активный ингредиент может быть использован с парафиновой или смешивающейся с водой основой мази. В качестве альтернативы активный ингредиент может быть приготовлен в виде крема с кремовой основой типа "масло-в-воде" или с основой типа "вода-в-масле". Фармацевтические композиции, приготовленные для местного введения в глаз, включают глазные капли, где активный ингредиент растворяют или суспендируют в подходящем носителе, особенно водном растворителе. Лекарственные формы для назального или ингаляционного введения могут быть легко приготовлены в виде препарата в форме аэрозолей, растворов, суспензий, гелей или сухих порошков. Для композиций, подходящих и/или приготовленных для ингаляционного введения, предпочтительно, чтобы соединение формулы (I) или его фармацевтически приемлемая соль находились в измельченной форме, например, полученной микронизацией. Предпочтительный размер частиц измельченного(например, микронизированного) соединения или соли определяется значением D50 приблизительно от 0,5 до приблизительно 10 мкм (например, измеренным, используя лазерную дифракцию). Аэрозольные композиции, например, для ингаляционного введения, могут содержать раствор или высокодисперсную суспензию активного вещества в фармацевтически приемлемом водном или неводном растворителе. Аэрозольные препараты могут быть представлены в разовых или многодозовых количествах в стерильной форме в запаянном контейнере, который может принимать форму картриджа или сменного баллончика для применения в пульверизаторе или ингаляторе. В качестве альтернативы запаянный контейнер может быть однократным дозирующим устройством, таким как однодозовый назальный ингалятор или аэрозольный дозатор, оснащенный дозатором (дозированный ингалятор), который предназначен для того, чтобы выделенное один раз содержимое контейнера было израсходовано. Если лекарственная форма включает аэрозольный дозатор, она предпочтительно содержит подходящий пропеллент под давлением, такой как сжатый воздух, углекислый газ или органический пропеллент, такой как гидрофторуглерод (ГФУ). Подходящие ГФУ пропелленты включают 1,1,1,2,3,3,3 гептафторпропан и 1,1,1,2-тетрафторэтан. Аэрозольные лекарственные формы могут также принимать форму насоса-распылителя. Аэрозоль под давлением может содержать раствор или суспензию активного соединения. Может потребоваться включение дополнительных эксципиентов, например сорастворителей и/или поверхностно-активных веществ, для улучшения параметров распыления и однородности суспензионных композиций. Также может быть необходимо добавить сорастворители, такие как этанол, в композиции в виде растворов. Для фармацевтических композиций, подходящих и/или приготовленных для ингаляционного введения, фармацевтическая композиция может быть сухой порошковой ингалируемой композицией. Такая композиция может содержать порошковую основу, такую как лактоза, глюкоза, трегалоза, маннит или крахмал, соединение формулы (I) или его фармацевтически приемлемую соль (предпочтительно в измельченной форме, например, в микронизированной форме), и, возможно, модификатор действия, такой как L-лейцин или другая аминокислота и/или соли металлов стеариновой кислоты, такие как стеарат магния и кальция. Предпочтительно, сухая порошковая ингалируемая композиция содержит сухую порошковую смесь лактозы, например, лактозы моногидрат, и соединения формулы (I) или его фармацевтически приемлемой соли. Такие композиции могут быть введены пациенту с использованием подходящего устройства, такого как DISKUS устройство, поставляемого GlaxoSmithKline, которое, например,описано в GB 2242134 А. Соединение формулы (I) и его фармацевтически приемлемые соли могут быть приготовлены в виде жидкого препарата для доставки из жидкостного дозатора, например, жидкостного дозатора, имеющего дозирующую насадку или дозирующее отверстие, через которое отмеренная доза жидкого препарата дозируется при приложении пользователем силы к механизму накачки жидкостного дозатора. Такие жидкостные дозаторы обычно обеспечены резервуаром для многочисленных отмеренных доз жидкого препарата, при этом дозы распыляются при последовательных срабатываниях насоса. Дозирующая насадка или отверстие могут быть настроены для введения в ноздри пользователя для распыления спрея жидкого препарата в носовой полости. Жидкостный дозатор вышеупомянутого типа описан и проиллюстрирован в WO 2005/044354 А 1. Терапевтически эффективное количество соединения формулы (I) или его фармацевтически прием- 10020390 лемой соли будет зависеть от ряда факторов, включая, например, возраст и массу животного, конкретное состояние, требующее лечения, и его тяжесть, природу препарата и способ введения, и будет в конечном счете оставаться на усмотрении лечащего врача или ветеринара. В фармацевтической композиции каждая стандартная лекарственная доза для перорального или парентерального введения предпочтительно содержит от 0,01 до 3000 мг, более предпочтительно от 0,5 до 1000 мг соединения формулы (I) или его фармацевтически приемлемой соли в пересчете на свободное основание. Каждая стандартная лекарственная доза для назального или ингаляционного введения предпочтительно содержит от 0,001 до 50 мг,более предпочтительно от 0,01 до 5 мг соединения формулы (I) или его фармацевтически приемлемой соли в пересчете на свободное основание. Соединение формулы (I) и его фармацевтически приемлемые соли могут быть введены в виде суточной дозы (для взрослого пациента), например, пероральной или парентеральной дозы от 0,01 до 3000 мг в сутки или от 0,5 до 1000 мг в сутки или назальной или ингаляционной дозы от 0,001 до 50 мг в сутки или 0,01 до 5 мг в сутки соединения формулы (I) или его фармацевтически приемлемой соли в пересчете на свободное основание. Это количество может быть дано в виде разовой дозы в сутки или чаще в виде некоторого количества (такого как две, три, четыре, пять или шесть) субдоз в сутки, так чтобы общая суточная доза была такой же. Эффективное количество его фармацевтически приемлемой соли может быть определено как доля эффективного количества соединения формулы (I) непосредственно. Таким образом, предложена фармацевтическая композиция, содержащая (а) от 0,01 до 3000 мг соединения формулы (I) или его фармацевтически приемлемой соли и b) от 0,1 до 2 г одного или более чем одного фармацевтически приемлемого носителя, разбавителя и/или наполнителя. Соединение формулы (I) и его фармацевтически приемлемые соли могут использоваться самостоятельно или в комбинации с другими терапевтическими агентами. Комбинированные терапии согласно настоящему изобретению, таким образом, включают введение по меньшей мере одного соединения формулы (I) или его фармацевтически приемлемой соли и применение по меньшей мере одного другого фармацевтически активного агента. Предпочтительно, комбинированные терапии согласно настоящему изобретению включают введение по меньшей мере одного соединения формулы (I) или его фармацевтически приемлемой соли и по меньшей мере одного другого фармацевтически активного агента. Соединение формулы (I) и его фармацевтически приемлемые соли и другой фармацевтически активный агент(ы) могут быть введены вместе в одной фармацевтической композиции или по отдельности, и, при введении по отдельности, это может происходить одновременно или последовательно в любом порядке. Количества соединения формулы (I) и его фармацевтически приемлемых солей и другого фармацевтически активного агента(ов) и соответствующее время введения будут выбраны для того, чтобы достичь желаемого совместного терапевтического эффекта. Таким образом, в другом аспекте предложена комбинация,включающая соединение формулы (I) или его фармацевтически приемлемую соль и по меньшей мере один другой фармацевтически активный агент. В одном воплощении предложен комбинированный фармацевтический продукт, содержащий соединение формулы (I) или его фармацевтически приемлемую соль вместе с одним или более чем одним другим терапевтически активным агентом. Таким образом, в одном аспекте соединение формулы (I) и фармацевтические композиции согласно данному изобретению могут быть использованы в комбинации с одним или более чем одним другим терапевтическим агентом, например, выбранным из антибиотиков, противовирусных агентов, гликокортикостероидов, антагонистов мускариновых рецепторов и бета-2 агонистов, или могут включать такой агент. Будет понятно, что когда соединение формулы (I) и его фармацевтически приемлемую соль вводят в комбинации с другими терапевтическими агентами, обычно вводимыми ингаляционным, внутривенным, пероральным или интраназальным способом, то полученная в результате фармацевтическая композиция может быть введена такими же способами. Альтернативно, отдельные компоненты композиции могут быть введены разными способами. Одно воплощение данного изобретения охватывает комбинации, содержащие один или два других терапевтических агента. Специалисту в данной области будет понятно, что, когда это целесообразно, другой терапевтический ингредиент(ы) может быть использован в форме солей, например, в виде солей щелочных металлов или аминов, или в виде солей присоединения кислоты, или пролекарств, или в виде сложных эфиров,например низших алкильных эфиров, или в виде сольватов, например, гидратов, для оптимизации активности и/или стабильности, и/или физических свойств, таких как растворимость, терапевтического ингредиента. Также следует понимать, что, когда это целесообразно, терапевтические ингредиенты могут быть использованы в оптически чистой форме. Вышеуказанные комбинации могут быть удобным образом представлены для применения в форме фармацевтической композиции и, таким образом, фармацевтические композиции, содержащие комбинацию согласно вышеприведенному определению вместе с фармацевтически приемлемым разбавителем или носителем, представляют другой аспект данного изобретения. Соединение формулы (I) может быть получено способами, описанными ниже, илипохожими способами. Таким образом, следующие Промежуточные соединения и примеры служат для иллюстрации получения соединения формулы (I), и в любом случае не должны рассматриваться как ограничивающие объем данного изобретения. Общие экспериментальные подробности Все упоминаемые температуры указаны в С. ЖХ/МС относится к анализам с помощью аналитической ВЭЖХ, которые проводили на двух видах оборудования:(растворитель В), используя следующий градиент элюирования 0-0,7 мин 0% В, 0,7-4,2 мин 0100% В,4,2-5,3 мин 100% В, 5,3-5,5 мин 1000%В при скорости потока 3 мл/мин. Масс-спектры (МС) регистрировали на масс-спектрометре Fisons VG Platform, используя положительную ионизацию электроспрея[(ES+, для получения [М+Н]+ и [M+NH4]+ молекулярных ионов] или отрицательную ионизацию электроспрея [(ES-, для получения [М-Н]- молекулярного иона]. Аналитические данные с этого оборудования приведены в следующей форме:[М+Н]+ или [М-Н]-.b) На колонке Chromolith Performance RP 18 (1004,6 мм ВД), выполняя элюирование 0,01 М ацетатом аммония в воде (растворитель А) и 100% ацетонитрилом (растворитель В), используя следующий градиент элюирования 0-4 мин 0100%В, 4-5 мин 100% В при скорости потока 5 мл/мин. Масс-спектры(МС) регистрировали на масс-спектрометре micromass Platform-LC, используя методы химической положительной ионизации при атмосферном давлении [АД+, для получения МН+ молекулярных ионов] или химической отрицательной ионизации при атмосферном давлении [АД-, для получения (М-Н)молекулярных ионов]. Аналитические данные с этого оборудования даны в следующей форме: [М+Н]+ или [М-Н]- с предшествующей аббревиатурой АДХИ для точного обозначения обоих источников массспектрометрических анализов. ЖХ/МСВР (масс-спектроскопия высокого разрешения): Аналитическую ВЭЖХ проводили на колонке Uptisphere-hsc (3 мкм 333 мм ВД), выполняя элюирование 0,01 М ацетатом аммония в воде (растворитель А) и 100% ацетонитрилом (растворитель В), используя следующий градиент элюирования 0-0,5 мин 5% В, 0,5-3,75 мин 5100% В, 3,75-4,5 100% В,- 12020390 4,5-5 1005% В, 5-5,55% В при скорости потока 1,3 мл/мин. Масс-спектры (МС) регистрировали на масс-спектрометре micromass LCT, используя положительную ионизацию электроспрея [(ES+, для получения МН+ молекулярных ионов] или отрицательную ионизацию электроспрея [(ES-, для получения [МН]-молекулярных ионов]. Масс-направленная автопрепаративная ВЭЖХ относится к методу, где материал очищали с помощью высокоэффективной жидкостной хроматографии на колонке HPLCABZ+ 5 мкм (5 см 10 мм ВД) 0,1% НСО 2 Н в воде и 95% MeCN, 5% водой (0,5% НСО 2 Н), используя следующие условия градиентного элюирования: 0-1,0 мин 5% В, 1,0-8,0 мин 530% В, 8,0-8,9 мин 30% В, 8,9-9,0 мин 3095% В, 9,0-9,9 мин 95% В, 9,9-10 мин 950% В при скорости потока 8 мл/мин. Gilson 202 коллектор фракций запускали масс-спектрометром VG Platform при определении интересующей массы. Протонные ЯМР (1 Н ЯМР) спектры регистрировали при температуре окружающей среды на спектрометре Bruker Avance 300 DPX, используя растворитель в качестве внутреннего стандарта, и протонные химические сдвиги выражены в млн-1 в указанном растворителе. Следующие аббревиатуры используются для большого количества ЯМР сигналов: s = синглет, d = дуплет, t = триплет, q = квадруплет, dd = двойной дуплет, m = мультиплет. ТСХ (тонкослойная хроматография) относится к использованию ТСХ пластин, поставляемых Merk,покрытых силикагелем 60 F254. Пример 1. 2-[(4S)-6-(4-хлорфенил)-1-метил-8-(метилокси)-4H-[1,2,4]триазоло[4,3-а][1,4]бензодиазепин-4-ил]-N-этилацетамид[(4S)-6-(4-хлорфенил)-1-метил-8-(метилокси)-4 Н-[1,2,4]триазоло[4,3 а][1,4]бензодиазепин-4-ил]уксусной кислоты (для получения см. Промежуточное соединение 1) (16,0 г,40 ммоль) в THF при КТ добавляли DIEA (14 мл, 80 ммоль), затем HATU (30,4 г, 80 ммоль). Реакционную смесь перемешивали в течение 3 ч при этой температуре, и добавляли этиламин (40 мл, 2M В THF,80 ммоль). Смесь перемешивали в течение 48 ч, затем концентрировали при пониженном давлении. Неочищенный материал суспендировали в воде и экстрагировали DCM. Органический экстракт сушили надNa2SO4, фильтровали и концентрировали в вакууме. Неочищенное твердое вещество очищали хроматографией на SiO2 (DCM/MeOH:95/5), и получившееся в результате твердое вещество перекристаллизовали в MeCN. Твердое вещество затем растворяли в DCM и осаждали с помощью изо-Pr2O с получением указанного в заголовке соединения (8 г, 47% выход) в виде белого твердого вещества. К раствору метил-[(4S)-6-(4-хлорфенил)-1-метил-8-(метилокси)-4H-[1,2,4]триазоло[4,3 а][1,4]бензодиазепин-4-ил]-ацетата (для получения смотри Промежуточное соединение 2. (28 г, 68 ммоль) в THF (450 мл) при КТ добавляли 1 н. NaOH (136 мл, 136 ммоль). Реакционную смесь перемешивали при этой температуре в течение 5 ч, затем охлаждали и гасили реакцию 1 н. HCl (136 мл). THF удаляли при пониженном давлении, и водный слой экстрагировали DCM. Объединенные органические экстракты сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Неочищенное твердое вещество перекристаллизовали в CH3CN с получением указанного в заголовке соединения (23,9 г, 89% выход) в виде бледно-желтого порошка. 1 Н ЯМР (300 МГц, CDCl3)7.55-7.48 (m, 2 Н), 7.41 (d, J = 8,9 Гц, 1 Н), 7.38-7.31 (m, 2H), 7.22 (dd, J = Неочищенный метил-[(3S)-2-[(1Z)-2-ацетилгидразин]-5-(4-хлорфенил)-7-(метилокси)-3H-1,4 бензодиазепин-3-ил]ацетат (для получения см. Промежуточное соединение 3) (34 г, 79 ммоль) суспендировали в THF (200 мл) и добавляли АсОН (200 мл) при КТ. Реакционную смесь перемешивали при этой температуре всю ночь, затем концентрировали досуха. Остаток суспендировали в насыщенном NaHCO3 и экстрагировали DCM. Органический экстракт сушили над Na2SO4, фильтровали и концентрировали в вакууме. Неочищенное твердое вещество очищали хроматографией на SiO2 (DCM/MeOH : 90/10) с получением указанного в заголовке соединения (28 г, 86% выход) в виде желтого порошка. 1 Н ЯМР (300 МГц, CDCl3)7.54-7.47 (m, 2 Н), 7.40 (d, J = 8,8 Гц, 1 Н), 7.37-7.31 (m, 2 Н), 7.22 (dd, J = 2,8 и 8,8 Гц, 1 Н), 6.89 (d, J = 2,8 Гц, 1 Н), 4.61 (dd, J = 6,4 и 7,8 Гц, 1 Н), 3.82 (s, 3 Н), 3.78 (s, 3 Н), 3.66 (dd, J = 7,8 и 16,9 Гц, 1 Н), 3.60 (dd, J = 6,4 и 16,9 Гц, 1H), 2.62 (s, ЗН). ЖХ/МС m/z 411 [M(35Cl)+H]+, Rt 2,88 мин. Промежуточное соединение 3. Метил-[(3S)-2-[2-ацетилгидразин]-5-(4-хлорфенил)-7-(метилокси)3H-1,4-бензодиазепин-3-ил]ацетат(800 мл) при 0 С добавляли по каплям гидразина моногидрат (11,3 мл, 233 ммоль). Реакционную смесь перемешивали в течение 4 ч между 0 и 15 С, затем охлаждали при 0 С. Затем медленно добавляли Et3N(32,4 мл, 230 ммоль) и по каплям добавляли AcCl (16,3 мл, 230 ммоль). Смеси давали нагреться до КТ и перемешивали в течение 1 ч, затем охлаждали водой и концентрировали при пониженном давлении. Получившийся в результате водный слой затем экстрагировали DCM, и органический экстракт сушили надNa2SO4, фильтровали и концентрировали в вакууме с получением неочищенного указанного в заголовке соединения (34 г, 100% выход), которое использовали без дополнительной очистки. ЖХ/МС: m/z 429 Суспензию P4S10 (85,8 г, 190 ммоль) и Na2CO3 (20,5 г, 190 ммоль) в 1,2-DCE (1,5 л) перемешивали при КТ в течение 1 ч, затем добавляли метил-[(3S)-5-(4-хлорфенил)-7-(метилокси)-2-оксо-2,3-дигидро 1H-1,4-бензодиазепин-3-ил]ацетат (для получения см. Промежуточное соединение 5) (40 г, 107 ммоль). Полученную в результате смесь перемешивали при 65 С в течение 4 ч, затем охлаждали и фильтровали. Твердое вещество промывали DCM, и фильтрат промывали насыщ. NaHCO3. Органический слой сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Указанное в заголовке соединение осаждали из смеси DCM/изо-Pr2O и фильтровали. Фильтрат затем концентрировали и очищали флэш-хроматографией (DCM/MeOH:98/2 для получения еще одной порции продукта. Указанное в заголовке соединение получали объединением двух фракций (30,2 г, 73%) в виде желтого порошка. ЖХ/МС:(примерно 0,2 моль) в DCM (500 мл) добавляли Et3N (500 мл, 3,65 моль), и получившуюся в результате смесь кипятили с обратным холодильником в течение 24 ч, затем концентрировали. Получившийся в результате неочищенный амин растворяли в 1,2-DCE (1,5 л) и аккуратно добавляли АсОН (104 мл, 1,8 мол). Реакционную смесь затем перемешивали при 60 С в течение 2 ч, затем концентрировали в вакууме и растворяли в DCM. Органический слой промывали 1 н. HCl, и водный слой экстрагировали DCM (3). Объединенные органические экстракты промывали дважды водой и рассолом, сушили над Na2SO, фильтровали и концентрировали при пониженном давлении. Неочищенное твердое вещество перекристаллизовали в MeCN с получением указанного в заголовке соединения (51 г) в виде бледно-желтого твердого вещества. Фильтрат могли концентрировать и перекристаллизовать в MeCN с получением еще 10 г Промежуточного соединения 9 (всего: 61 г, 69% выход на основе восстановленного Промежуточного соединения 12). Rf = 0,34 (DCM/MeOH : 95/5). ЖХ/МС m/z 373 [M(35Cl)+H]+, Rt 2,76 мин. Промежуточное соединение 6. Метил-N1-[2-[(4-хлорфенил)карбонил]-4-(метилокси)фенил]-N2[(9H-флуорен-9-илметил)окси]карбонил-Lаспарагинат Смесь метил-N-[(9H-флуорен-9-илметил)окси]карбонил-Lаспартила хлорида (полученного в соответствии с J. Org. Chem. 1990, 55, 3068-3074 и J. Chem. Soc. Perkin Trans. 1, 2001, 1673-1695) (221 г,0,57 ммоль) и [2-амино-5-(метилокси)фенил](хлорфенил)метанона (для получения см. Промежуточное соединение 7) (133 г, 0,5 моль) в CHCl3(410 мл) перемешивали при 60 С в течение 1,5 ч, затем охлаждали и концентрировали при пониженном давлении и использовали без дополнительной очистки. ЖХ/МС: К раствору 2-метил-6-(метилокси)-4H-3,1-бензоксазин-4-она (для получения см. Промежуточное соединение 8) (40,0 г, 0,21 моль) в смеси толуол (560 мл)/диэтиловый эфир (200 мл) при 0 С добавляли по каплям раствор бромистого 4-хлорфенилмагния (170 мл, 1M в Et2O, 0,17 моль). Реакционной смеси давали нагреться до КТ и перемешивали в течение 1 ч, затем реакцию гасили 1 н. HCI. Водный слой экстрагировали EtOAc (3) и объединенные органические экстракты промывали рассолом, сушили надNa2SO4, фильтровали и концентрировали при пониженном давлении. Неочищенное соединение затем растворяли в EtOH (400 мл) и добавляли 6 н. HCl (160 мл). Реакционную смесь кипятили с обратным холодильником в течение 2 ч, затем концентрировали при пониженном давлении. Полученное в результате твердое вещество фильтровали и промывали дважды диэтиловым эфиром, суспендировали в EtOAc и нейтрализовали 1 н. NaOH. Водный слой экстрагировали EtOAc (3) и объединенные органические экстракты промывали рассолом, сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Указанное в заголовке соединение получали в виде желтого твердого вещества (39 г, 88% выход),которое использовали без дополнительной очистки. Промежуточное соединение 8. 2-метил-6-(метилокси)-4H-3,1-бензоксазин-4-он Раствор 5-метоксиантраниловой кислоты (7,8 г, 46,5 ммоль) кипятили с обратным холодильником в уксусном ангидриде (60 мл) в течение 2 ч 15 мин, затем охлаждали и концентрировали при пониженном давлении. Неочищенный остаток затем концентрировали дважды в присутствии толуола, фильтровали и промывали диэтиловым эфиром с получением указанного в заголовке соединения (6,8 г, 77% выход) в виде бежевого твердого вещества; ЖХ/МС: m/z 192[М+Н]+, Rt 1,69 мин. Приготовление сравнительного соединения для применения в биологических испытаниях Экспериментальные подробности ЖХ-МС способов А и В, о которых здесь говорится, следующие: ЖХ/МС (Способ А) проводили на колонке Supelcosil LCABZ+PLUS (3 мкм, 3,3 см 4,6 мм ВД),выполняя элюирование 0,1% НСО 2 Н и 0,01 М ацетатом аммония в воде (растворитель А) и 95% ацетонитрилом и 0,05% НСО 2 Н в воде (растворитель В), используя следующий градиент элюирования 0-0,7 мин 0% В, 0,7-4,2 мин 0100% В, 4,2-5,3 мин 100% В, 5,3-5,5 мин 1000% В при скорости потока 3 мл/мин. Масс-спектры (МС) регистрировали на масс-спектрометре Fisons VG Platform, используя положительную ионизацию электроспрея [(ES+ для получения [М+Н]+ и [M+NH4]+ молекулярных ионов] или отрицательную ионизацию электроспрея [(ES-, для получения [М-Н]- молекулярного иона]. Аналитические данные с этого оборудования даны в следующей форме : [М+Н]+ или [М-Н]-. ЖХ/МС (Способ В) проводили на колонке Sunfire C18 (30 мм 4,6 мм ВД, 3,5 мкм диаметр наполнителя) при 30 градусах по стоградусной шкале, выполняя элюирование 0,1% об./об. раствором ТФУ в воде (Растворитель А) и 0,1% об./об. раствором ТФУ в ацетонитриле (Растворитель В), используя следующий градиент элюирования 0-0,1 мин 3% В, 0,1-4,2 мин 3-100% В, 4,2-4,8 мин 100% В, 4,8-4,9 мин 100-3%В, 4,9-5,0 мин 3% В при скорости потока 3 мл/мин. УФ-детектированием был получен усредненный сигнал от длины волны 210 до 350 нм, и масс-спектры регистрировали на масс-спектрометре, используя положительную ионизацию электроспрея. Данные по ионизации округляли до ближайшего целого числа. ЖХ/МСВР: Аналитическую ВЭЖХ проводили на колонке Uptisphere-hsc (3 мкм 333 мм ВД), выполняя элюирование 0,01 М ацетатом аммония в воде (растворитель А) и 100% ацетонилом (растворитель В), используя следующий градиент элюирования 0-0,5 мин 5% В, 0,5-3,75 мин 5100% В, 3,75-4,5 100% В, 4,5-5 1005% В, 5-5,55% В при скорости потока 1,3 мл/мин. Масс-спектры (МС) регистрировали на масс-спектрометре Micromass LCT, используя положительную ионизацию электроспрея [ES+, для получения МН+ молекулярных ионов] или отрицательную ионизацию электроспрея [ES-, для полученияMerck, покрытых силикагелем 60 F254. Оборудование для хроматографии на силикагеле включает автоматизированное (Flashmaster илиBiotage SP4) оборудование или хроматографию с ручным управлением на предварительно наполненных картриджах (SPE, экстракция твердой фазы) или набитых вручную флэш-колонках. Сравнительное соединение А. 2-Метил-6-(метилокси)-4H-3,1-бензоксазин-4-он Раствор 5-метоксиантраниловой кислоты (Lancaster) (41,8 г, 0,25 моль) кипятили с обратным холодильником в уксусном ангидриде (230 мл) в течение 3,5 ч, затем концентрировали при пониженном давлении Неочищенное соединение затем концентрировали дважды в присутствии толуола, фильтровали и промывали дважды диэтиловым эфиром с получением указанного в заголовке соединения (33,7 г, 71% выход) в виде коричневого твердого вещества; ЖХ/МС (Способ A): m/z 192 [М+Н]+, Rt 1,69 мин. Сравнительное соединение В. [2-Амино-5-(метилокси)фенил](4-хлорфенил)метанон К раствору 2-метил-6-(метокси)-4 Н-3,1-бензоксазин-4-она (для получения см. Сравнительное соединение А) (40,0 г, 0,21 моль) в смеси толуол/диэтиловый эфир (2/1) (760 мл) при 0 С добавляли по каплям раствор бромистого 4-хлорфенилмагния (170 мл, 1 М в Et2O, 0,17 моль). Реакционной смеси давали нагреться до комнатной температуры и перемешивали в течение 1 ч, затем гасили реакцию 1 н. HCl (200 мл). Водный слой экстрагировали EtOAc (3150 мл) и объединенные органические экстракты промывали рассолом (100 мл), сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Неочищенное соединение затем растворяли в EtOH (400 мл) и добавляли 6 н. HCl (160 мл). Реакционную смесь кипятили с обратным холодильником в течение 2 ч и концентрировали до одной трети по объему. Полученное в результате твердое вещество фильтровали и промывали дважды диэтиловым эфиро, суспендировали в EtOAc и нейтрализовали 1 н. NaOH. Водный слой экстрагировали EtOAc (3150 мл), и объединенные органические экстракты промывали рассолом (150 мл), сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Указанное в заголовке соединение получали в виде желтого твердого вещества (39 г, 88% выход); ЖХ/МС (Способ A): m/z 262 [М+Н]+, Rt 2,57 мин. Сравнительное соединение С. Метил-N1-[2-[(4-хлорфенил)карбонил]-4-(метилокси)фенил]-N2[(9H-флуорен-9-илметил)окси]карбонил-Lаспарагинат Метил-N-[(9H-флуорен-9-илметил)окси]карбонил-Lаспартилхлорид (Int. J. Peptide Protein Res. 1992, 40, 13-18) (93 г, 0,24 моль) растворяли в CHCl3 (270 мл) и добавляли [2-амино-5(метилокси)фенил](4-хлорфенил)метанон (для получения см. Сравнительное соединение В) (53 г, 0,2 моль). Полученную в результате смесь перемешивали при 60 С в течение 1 ч, затем охлаждали и концентрировали до 60% от объема. Диэтиловый эфир добавляли при 0 С и полученный в результате осадок фильтровали и отбрасывали. Фильтрат концентрировали при пониженном давлении и использовали без дополнительной очистки. Сравнительное соединение D. Метил-[(3S)-5-(4-хлорфенил-7-(метилокси)-2-оксо-2,3-дигидро-1H1,4-бензодиазепин-3-ил]ацетат К раствору метил-N1-[2-[(4-хлорфенил)карбонил]-4-(метилокси)фенил]-N2-[(9 Н-флуорен-9 илметил)окси]карбинил-Lаспарагината (для получения см. Сравнительное соединение С) (примерно 0,2 моль) в DCM (500 мл) добавляли Et3N (500 мл, 3,65 моль), и полученную в результате смесь кипятили с обратным холодильником в течение 24 ч, затем концентрировали. Полученный в результате неочищенный амин растворяли в 1,2-DCE (1,5 л) и аккуратно добавляли АсОН (104 мл, 1,8 моль). Реакционную смесь затем перемешивали при 60 С в течение 2 ч, концентрировали в вакууме и растворяли в DCM. Органический слой промывали 1 н. HCl, и водный слой экстрагировали DCM (3). Объединенные органические экстракты промывали дважды водой и рассолом, сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Неочищенное твердое вещество перекристаллизовали в MeCN с получением указанного в заголовке соединения (51 г) в виде бледно-желтого твердого вещества. Фильтрат можно было концентрировать и перекристаллизовать в MeCN для получения еще 10 г целевого продукта. Rf = 0,34 (DCM/MeOH : 95/5). МСВР (М+Н)+, вычислено C19H1835ClN2O4 373,0955; обнаружено 373,0957. Сравнительное соединение Е. Метил-[(3S)-5-(4-хлорфенил)-7-(метилокси)-2-тиоксо-2,3-дигидро 1 Н-1,4-бензодиазепин-3-ил]ацетат Суспензию P4S10 (36,1 г, 81,1 ммоль) и Na2CO3 (8,6 г, 81,1 ммоль) в 1,2-DCE (700 мл) перемешивали при комнатной температуре в течение 2 ч, затем добавляли метил-[(3S)-5-(4-хлорфенил)-7-(метилокси)2-оксо-2,3-дигидро-1H-1,4-бензодиазепин-3-ил]ацетата (для получения см. Сравнительное соединение D)(16,8 г, 45,1 ммоль). Полученную в результате смесь перемешивали при 70 С в течение 2 ч, охлаждали и фильтровали. Твердое вещество промывали дважды DCM, и фильтрат промывали насыщ. NaHCO3 и рассолом. Органический слой сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Неочищенный продукт очищали флэш-хроматографией на силикагеле (DCM/MeOH:99/1) с получением указанного в заголовке соединения (17,2 г, 98% выход) в виде желтоватого твердого вещества. ЖХ/МС (Способ A): m/z 389 [M(35Cl)+H]+, Rt 2,64 мин. МСВР (М+Н)+, вычислено C19H1835CIN2O3S 389,0727; обнаружено 389,0714. Сравнительное соединение F. Метил-[(3S)-2-[2-ацетилгидразин]-5-(4-хлорфенил)-7-(метилокси)3H-1,4-бензодиазепин-3-ил]ацетат К суспензии метил-[(3S)-5-(4-хлорфенил)-7-(метилокси)-2-тиоксо-2,3-дигидро-1 Н-1,4 бензодиазепин-3-ил]ацетата (для получения смотри Сравнительное соединение Е (9,0 г, 23,2 ммоль) вTHF (300 мл) при 0 С добавляли гидразина моногидрат (3,4 мл, 69,6 ммоль) по каплям. Реакционную смесь перемешивали в течение 5 ч между 5 и 15 С, затем охлаждали при 0 С. Затем медленно добавлялиEt3N (9,7 мл, 69,6 ммоль) и по каплям добавляли ацетилхлорид (7,95 мл, 69,6 ммоль). Затем смеси давали нагреться до комнатной температуры в течение 16 ч и концентрировали при пониженном давлении. Неочищенный продукт растворяли в DCM и промывали водой. Органический слой сушили над Na2SO4,фильтровали и концентрировали в вакууме с получением неочищенного указанного в заголовке соединения (9,7 г, 98% выход), которое использовали без дополнительной очистки. Rf = 0,49 (DCM/MeOH: 90/10). Сравнительное соединение Неочищенный метил-[(3S)-2-[(1Z)-2-ацетилгидразин]-5-(4-хлорфенил)-7-(метилокси)-3 Н-1,4 бензодиазепин-3-ил]ацетат (для получения см. Сравнительное соединение F) (примерно 9,7 г) суспендировали в THF (100 мл) и добавляли АсОН (60 мл) при комнатной температуре. Реакционную смесь перемешивали при этой температуре в течение 2 дней, затем концентрировали при пониженном давлении. Неочищенное твердое вещество растирали в порошок в изо-Pr2O и фильтровали с получением указанного в заголовке соединения (8,7 г, 91% за 3 стадии) в виде беловатого твердого вещества. МСВР(М+Н)+, вычислено C21H20ClN4O3 411,1229; обнаружено 411,1245. Сравнительное соединение Н. [(4S)-6-(4-хлорфенил)-1-метил-8-(метилокси)-4 Н-[1,2,4]триазоло[4,3 а][1,4]бензодиазепин-4-ил]уксусная кислотаTHF (130 мл) при комнатной температуре добавляли 1 н. NaOH (36,2 мл, 36,2 ммоль). Реакционную смесь перемешивали при этой температуре в течение 5 ч, затем реакцию гасили 1 н. HCl (36,2 мл) и концентрировали в вакууме. Затем добавляли воду, и водный слой экстрагировали DCM (3), и объединенные органические экстракты сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении с получением указанного в заголовке соединения (7 г, 98% выход) в виде бледно-желтого твердого вещества. Смесь [(4S)-6-(4-хлорфенил)-1-метил-8-(метилокси)-4H-[1,2,4]триазоло[4,3-а][1,4]бензодиазепин-4 ил]уксусной кислоты (для получения см. Сравнительное соединение Н) (1,0 г, 2,5 ммоль, HATU (1,9 г, 5 ммоль) и DIEA (0,88 мл, 5 ммоль) перемешивали в течение 80 мин при комнатной температуре, к этой смеси добавляли 1,1-диметилетил(4-аминобутил)карбамат (1,05 мл, 5,0 ммоль), поставляемый Aldrich. Реакционную смесь перемешивали при комнатной температуре в течение 2 ч, затем концентрировали. Остаток растворяли в дихлорметане и промывали 1 н. HCl. Водный слой экстрагировали дважды дихлорметаном. Органический экстракт промывали 1 н. гидроксидом натрия с последующим промыванием насыщенным раствором хлорида натрия, сушили над сульфатом натрия и концентрировали. Остаток очищали флэш-хроматографией на диоксиде кремния, используя смесь дихлорметан/метанол 95/5, с получением указанного в заголовке соединения в виде желтого твердого вещества (1,2 г). ЖХ/МС (Способ К раствору 1,1-диметилэтил-[5-([(4S)-6-(4-хлорфенил)-1-метил-8-(метилокси)-4 Н-[1,2,4]триазоло[4,3-а][1,4]бензодиазепин-4-ил]ацетиламино)фенил]карбамата (для получения см. Сравнительное соединение Н) (0,2 г, 0,34 ммоль) в дихлорметане (3 мл) добавляли трифторуксусную кислоту (0,053 мл,0,68 ммоль) по каплям при 0 С. Реакционную смесь перемешивали в течение 3 ч от 0 С до комнатной температуры. Реакционную смесь концентрировали досуха с получением указанного в заголовке соединения в виде гигроскопичного желтого масла (200 мг). ЖХ/МС (Способ A): rt = 2,33 мин. МСВР (М+Н)+, вычислено C25H29ClN6O2 481,2119; обнаружено 481,2162. Сравнительное соединение K. Смесь 5- и 6-изомеров of Alexa Fluor 488-N-(5-аминопентил)-2-[(4S)6-(4-хлорфенил)-1-метил-8-(метилокси)-4 Н-[1,2,4]триазоло[4,3-а][1,4]бензодиазепин-4-ил]ацетамида(7,65 мг, 0,013 ммоль) растворяли в N,N-диметилформамиде (DMF) (300 мкл) и добавляли к сукцинимидиловому эфиру Alexa Fluor 488 карбоновой кислоты (5 мг, 7,77 мкммоль, смесь 5 и 6 изомеров, поставляемых Invitrogen, номер продукта А-20100) в центрифужной пробирке Eppendorf. Добавляли основание Хунига (7,0 мкл, 0,040 ммоль) и смесь перемешивали на приборе для встряхивания и перемешивания всю ночь. Через 18 ч реакционную смесь выпаривали досуха и остаток повторно растворяли в смесиDMSO/вода (50%, всего менее 1 мл), наносили на препаративную колонку Phenomenex Jupiter C18 и элюировали, используя градиент 95% А: 5% В до 100% В (А = 0,1% ТФУ в воде, В = 0,1% ТФУ/90% ацетонитрил/10% воды) при скорости потока 10 мл/мин на протяжении 150 мин. Неочищенные фракции объединяли и повторно очищали, используя ту же систему. Фракции объединяли, выпаривали до выхода указанного в заголовке продукта (2,8 мг) в виде смеси 2 показанных региоизомеров. ЖХ/МС (Способ В):,МН+ = 999, rt = 1,88 мин. Биологические испытания Анализ связывания с использованием анизотропии флуоресценции Связывание соединения формулы (I) с Бромодоменом 2, 3 и 4 оценивали, используя анализ связывания с использованием анизотропии флуоресценции. Белок, содержащий бромодомен, флуоресцентный лиганд (Сравнительное соединение K, см. выше) и различные концентрации тестируемого соединения инкубируют совместно для достижения термодинамического равновесия в условиях, так что при отсутствии тестируемого соединения флуоресцентный лиганд в значительной степени (более 50%) связан, а в присутствии достаточной концентрации сильного ингибитора анизотропия свободного флуоресцентного лиганда заметно отличается от данной величины связанного состояния. Все данные были нормализованы к среднему из 16 высоких и 16 низких контрольных лунок на каждом планшете. Затем использовали подбор кривой с четырьмя параметрами следующего вида: где а представляет собой минимум, b представляет собой угол наклона кривой, с представляет собой pIC50 и d представляет собой максимум. Рекомбинантные бромодомены человека (Бромодомен 2 (1-473), Бромодомен 3 (1-435) и Бромодомен 4 (1-477 экспрессировались в клетках E.coli (в рЕТ 15b векторе) с 6-His меткой на N-конце. Hisмеченный бромодомен экстрагировали из клеток E.coli, используя 0,1 мг/мл лизоцим и разрушение ультразвуком. Бромодомен затем очищали аффинной хроматографией на колонке HisTRAP HP, выполняя элюирование с линейным градиентом концентрации имидазола 10-500 мМ, за 20 Cv. Дополнительную очистку выполняли на колонке для гель-фильтрации Superdex 200 prep. Очищенный белок хранили при 80C в 20 мМ HEPES рН 7,5 и 100 мМ NaCl. Протокол для Бромодомена 2: Все компоненты растворяли в буферной смеси из 50 мМ HEPES рН 7,4, 150 мм NaCl и 0,5 мМ CHAPS с конечными концентрациями Бромодомена 2, 75 нМ, флуоресцентного лиганда 5 нМ. Используя диспенсер micro multidrop, 10 мкл этой реакционной смеси добавляли в лунки, содержащие 100 нл различных концентраций тестируемого соединения или растворителя DMSO(1% конечная концентрация) в 384-луночном черном титрационном микропланшете малого объемаGreiner и уравновешивали в темноте 60 мин при комнатной температуре. Анизотропию флуоресценции измеряли на Envision (ех= 485 нм, ЕМ = 530 нм; дихроичное зеркало - 505 нМ). Протокол для Бромодомена 3. Все компоненты растворяли в буфере состава 50 мМ HEPES pH7,4, 150 мм NaCl и 0,5 мМ CHAPS с конечными концентрациями Бромодомена 3,75 нМ, флуоресцентного лиганда 5 нМ. Используя micromultidrop, 10 мкл этой реакционной смеси добавляли в лунки, содержащие 100 нл различных концентраций тестируемого соединения или растворителя DMSO (1% конечная концентрация) в 384-луночном черном титрационном микропланшете малого объема Greiner и уравновешивали в темноте 60 мин при комнатной температуре. Анизотропию флуоресценции измеряли на Envision (ех= 485 нм, ЕМ = 530 нм; дихроичное зеркало - 505 мМ). Протокол для Бромодомена 4. Все компоненты растворяли в буфере состава 50 мМ HEPES рН 7,4, 150 мм NaCl и 0,5 мМ CHAPS с конечными концентрациями Бромодомена 4 75 нМ, флуоресцентного лиганда 5 нМ. Используя micromultidrop, 10 мкл этой реакционной смеси добавляли в лунки, содержащие 100 нл различных концентраций тестируемого соединения или растворителя DMSO (1% конечная концентрация) в 384-луночном черном титрационном микропланшете малого объема Greiner и уравновешивали в темноте 60 мин при комнатной температуре. Анизотропию флуоресценции измеряли на Envision (ех= 485 нм, ЕМ = 530 нм; дихроичное зеркало -505 мМ). Пример 1 имел pIC50 6,0 или более в каждом из BRD2, BRD3 и BRD4 анализов, описанных выше. Определение уровней TNF- в цельной крови при стимуляции ЛПС Активация моноцитов агонистами толл-подобных рецепторов, такими как бактериальный липополисахарид (ЛПС), приводит к образованию ключевых медиаторов воспаления, включая TNF-. Считается, что такие пути являются центральными в патофизиологии ряда аутоиммунных и воспалительных расстройств. Тестируемые соединения растворяют для получения ряда соответствующих концентраций, и 1 мкл маточных растворов добавляют в лунки 96-луночного планшета. После добавления цельной крови (130 мкл) планшеты инкубируют при 37C (5% СО 2) в течение 30 мин перед добавлением 10 мкл 2,8 мкг/мл ЛПС, разведенного в полном RPMI 1640 (конечная концентрация 200 нг/мл) для получения общего объема 140 мкл на лунку. После дополнительного инкубирования в течение 24 ч при 37C в каждую лунку добавляют 140 мкл PBS. Планшеты плотно закрывают, встряхивают в течение 10 мин и затем центрифугируют (2500 об/мин 10 мин). Отбирают 100 мкл супернатанта и определяют уровни TNF- с помощью иммуноанализа (обычно с помощью методики MesoScale Discovery), сразу или после хранения при - 20020390 20C. Кривые дозовой зависимости для каждого соединения строили по полученным данным и вычисляли величину IC50. Как было показано, пример 1 имеет pIC50 более 6,0 в описанном выше анализе. Эти данные показывают, что пример 1, тестируемый в описанном выше анализе, ингибировал образование ключевого медиатора воспаления TNF-. Это говорит о том, что такое соединение обладает сильным противовоспалительным профилем, который вероятно является благоприятным при клиническом использовании при воспалительных расстройствах. Модель эндотоксемии мышей in vivo Высокие дозы эндотоксина (бактериального липополисахарида), вводимые животным, вызывают сильный шок, включая сильную воспалительную реакцию, нарушение сердечно-сосудистой функции,поражение органов и, в конце концов, смерть. Этот система ответа очень похожа на сепсис человека и септический шок, где реакция организма на значительную бактериальную инфекцию может быть в такой же степени опасной для жизни. Чтобы протестировать соединение формулы (I) и его фармацевтически приемлемые соли, группам из восьми самцов мышей линии Balb/c вводили летальную дозу 15 мг/кг ЛПС путем интраперитонеальной инъекции. 90 мин спустя животным внутривенно вводили растворитель (20% циклодекстрин, 1% этанол в апирогенной воде) или соединение (10 мг/кг). За выживаемостью животных наблюдали 4 дня. Количество животных, выживших за 4 дня (суммировано по экспериментам с многими повторностями) Растворитель 4/66 (6%) Пример 1 24/56 (52%) Эти данные показывают, что тестируемый пример 1 в описанной выше модели оказал существенный эффект в отношении выживаемости животных после внутривенного введения. Это говорит о том,что соединение формулы (I) обладает сильным потенциалом в отношении воспалительных реакций у людей. Все публикации, включая, но не ограничиваясь, патенты и патентные заявки, цитированные в этом описании, включены сюда посредством ссылки, как если бы каждая отдельная публикация была конкретно и отдельно указана как включенная сюда посредством ссылки во всей полноте. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение формулы (I), представляющее собой 2-[(4S)-6-(4-хлорфенил)-1-метил-8-(метилокси)4H-[1,2,4]триазоло[4,3-а][1,4]бензодиазепин-4-ил]-N-этилацетамид или его фармацевтически приемлемая соль. 3. Соединение формулы (I) по п.1, представляющее собой 2-[(4S)-6-(4-хлорфенил)-1-метил-8(метилокси)-4H-[1,2,4]триазоло[4,3-а][1,4]бензодиазепин-4-ил]-N-этилацетамид 4. Фармацевтическая композиция для ингибирования связывания бромодоменов с их близкими ацетилированными белками, содержащая соединение формулы (I) или его фармацевтически приемлемую соль по п.2 и один или более чем один фармацевтически приемлемый носитель, разбавитель или эксципиент. 5. Фармацевтическая композиция для ингибирования связывания бромодоменов с их близкими ацетилированными белками, содержащая соединение формулы (I) по п.3 и один или более чем один фармацевтически приемлемый носитель, разбавитель или эксципиент. 6. Применение соединения формулы (I) или его фармацевтически приемлемой соли по п.2, или соединения формулы (I) по п.3 в изготовлении лекарственного средства для лечения рака или хронического аутоиммунного и/или воспалительного состояния. 7. Способ лечения заболевания или состояния, выбранного из рака, хронического аутоиммунного и/или воспалительного состояния у субъекта, нуждающегося в этом, включающий введение терапевтически эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли по п.2. 8. Способ лечения по п.7, где заболевание или состояние представляют собой рак. 9. Способ по п.8, где рак выбран из гематологического рака, эпителиального рака, включая карциномы легкого, молочной железы и толстой кишки, срединные карциномы, мезенхимальные, почечные и неврологические опухоли. 10. Способ по п.9, где гематологический рак представляет собой лейкемию.
МПК / Метки
МПК: C07D 487/04, A61K 31/55, A61P 35/00, A61P 43/00
Метки: бромодомена, ингибитор, бензодиазепиновый
Код ссылки
<a href="https://eas.patents.su/23-20390-benzodiazepinovyjj-ingibitor-bromodomena.html" rel="bookmark" title="База патентов Евразийского Союза">Бензодиазепиновый ингибитор бромодомена</a>
Предыдущий патент: Фармацевтический состав, содержащий натрий, железо, цинк и обладающий метаболическим, противокатарактным, ретинопротекторным действием (варианты)
Следующий патент: Спиропиперидиновые соединения в качестве антагонистов рецептора orl-1
Случайный патент: Устройство, способ и компьютерный носитель информации для анализа состояния машины