Производные 1-(пиридин-3-ил)-3-метиламинометил-5-фенилсульфонилпиразола
Формула / Реферат
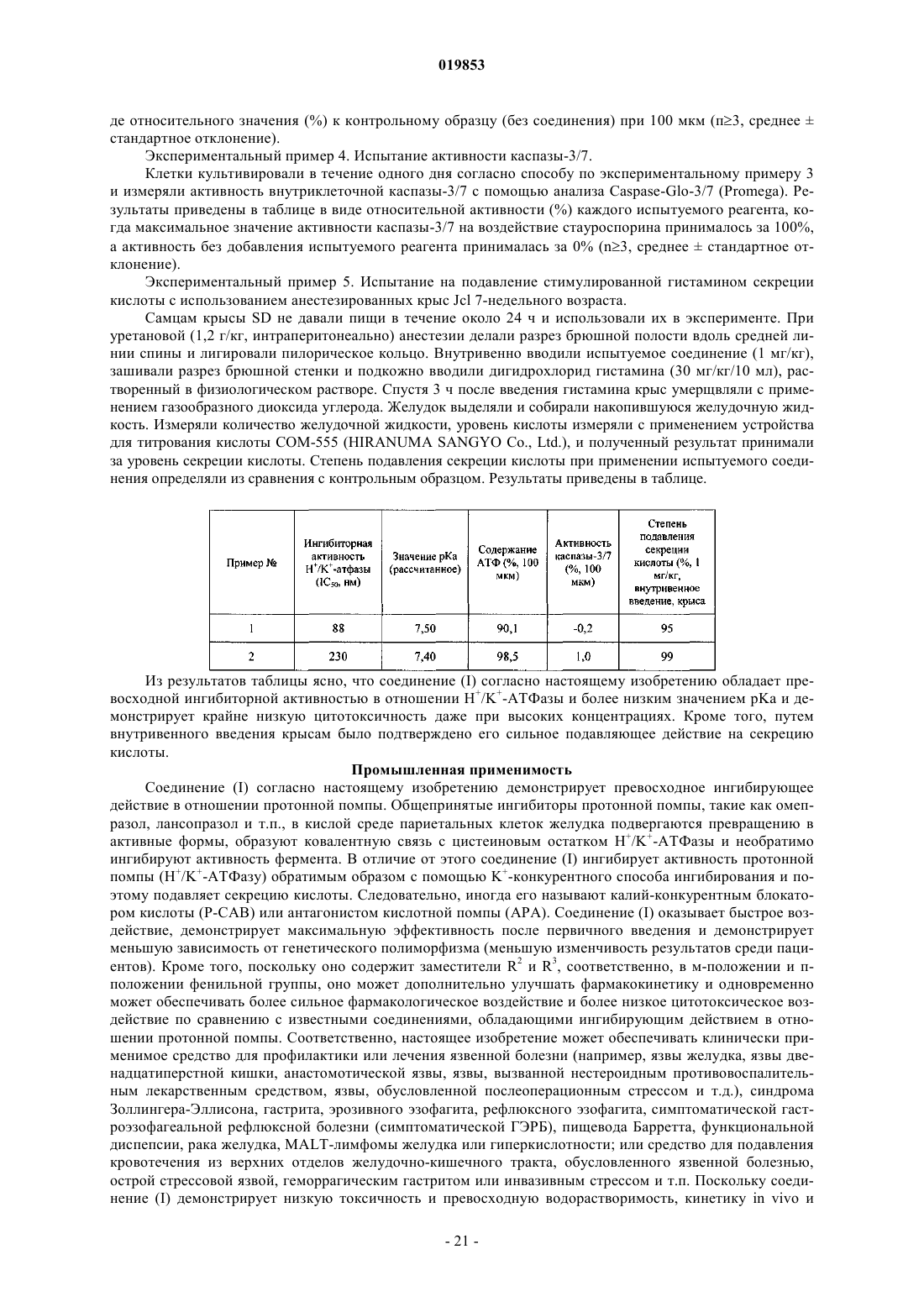
1. Соединение, представленное формулой (I)
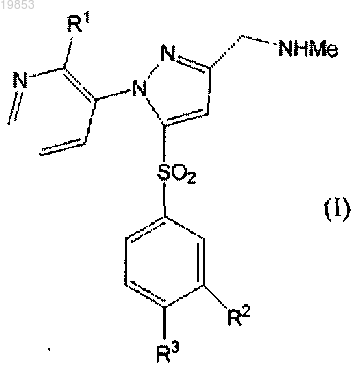
где R1 представляет собой атом фтора, R2 представляет собой метильную группу или цианогруппу и R3 представляет собой атом водорода, или его соль.
2. 1-{1-(2-Фторпиридин-3-ил)-5-[(3-метилфенил)сульфонил]-1Н-пиразол-3-ил}-N-метилметанамин или его соль.
3. 3-({1-(2-Фторпиридин-3-ил)-3-[(метиламино)метил]-1Н-пиразол-5-ил}сульфонил)бензонитрил или его соль.
4. Лекарственное средство, содержащее соединение по п.1 или его соль.
5. Лекарственное средство по п.4, которое представляет собой ингибитор секреции кислоты.
6. Лекарственное средство по п.4, которое представляет собой калий-конкурентный блокатор кислоты.
7. Лекарственное средство по п.4, которое представляет собой средство для профилактики или лечения язвенной болезни, синдрома Золлингера-Эллисона, гастрита, рефлюксного эзофагита, симптоматической гастроэзофагеальной рефлюксной болезни (симптоматической ГЭРБ), пищевода Барретта, функциональной диспепсии, рака желудка, MALT-лимфомы желудка, язвы, вызванной нестероидным противовоспалительным лекарственным средством, или гиперкислотности или язвы, обусловленной послеоперационным стрессом; или представляет собой средство для подавления кровотечения из верхних отделов желудочно-кишечного тракта, обусловленного язвенной болезнью, острой стрессовой язвой, геморрагическим гастритом или инвазивным стрессом.
8. Способ профилактики или лечения язвенной болезни, синдрома Золлингера-Эллисона, гастрита, рефлюксного эзофагита, симптоматической гастроэзофагеальной рефлюксной болезни (симптоматической ГЭРБ), пищевода Барретта, функциональной диспепсии, рака желудка, MALT-лимфомы желудка, язвы, вызванной нестероидным противовоспалительным лекарственным средством, или гиперкислотности или язвы, обусловленной послеоперационным стрессом; или способ подавления кровотечения из верхних отделов желудочно-кишечного тракта, обусловленного язвенной болезнью, острой стрессовой язвой, геморрагическим гастритом или инвазивным стрессом, включающий в себя введение млекопитающему эффективного количества соединения по п.1 или его соли.
9. Применение соединения по п.1 или его соли для производства средства, предназначенного для профилактики или лечения язвенной болезни, синдрома Золлингера-Эллисона, гастрита, рефлюксного эзофагита, симптоматической гастроэзофагеальной рефлюксной болезни (симптоматической ГЭРБ), пищевода Барретта, функциональной диспепсии, рака желудка, MALT-лимфомы желудка, язвы, вызванной нестероидным противовоспалительным лекарственным средством, или гиперкислотности или язвы, обусловленной послеоперационным стрессом; или средства для подавления кровотечения из верхних отделов желудочно-кишечного тракта, обусловленного язвенной болезнью, острой стрессовой язвой, геморрагическим гастритом или инвазивным стрессом.
Текст
где R1 представляет собой атом фтора, R2 представляет собой (i) метильную группу или (ii) цианогруппу, a R3 представляет собой атом водорода, или его соль.(71)(73) Заявитель и патентовладелец: ТАКЕДА ФАРМАСЬЮТИКАЛ КОМПАНИ ЛИМИТЕД (JP) Область техники, к которой относится изобретение Настоящее изобретение относится к пиразольному соединению, обладающему подавляющей активностью в отношении секреции кислоты. Уровень техники В клинической практике широко применяются ингибиторы протонной помпы, представленные омепразолом, которые подавляют секрецию кислоты желудочного сока и предназначаются для лечения язвенной болезни, рефлюксного эзофагита и т.п. Однако существующие ингибиторы протонной помпы связаны с проблемами с точки зрения целевого и побочных эффектов. Более конкретно, поскольку существующие ингибиторы протонной помпы нестабильны в кислотных условиях, их часто производят в виде кишечнорастворимых препаратов, которым требуется несколько часов до появления эффекта и приблизительно 5 дней для проявления максимальной эффективности после повторного введения. Кроме того, поскольку существующие ингибиторы протонной помпы демонстрируют изменчивость результатов лечения, обусловленную полиморфизмом метаболических ферментов и межлекарственным взаимодействием с такими средствами, как диазепам и т.п., желательно было провести их усовершенствование. В патентном документе 1 в качестве соединений, обладающих ингибирующим действием в отношении протонной помпы, описано соединение, представленное формулой в которой цикл А представляет собой насыщенную или ненасыщенную 5- или 6-членную циклическую группу, необязательно содержащую в качестве циклообразующего атома, помимо атомов углерода, от 1 до 4 гетероатомов, выбранных из атома азота, атома кислорода и атома серы; где каждый из циклобразующих атомов X1 и Х 2 представляет собой атом углерода или атом азота; R1 представляет собой необязательно замещенную арильную группу или необязательно замещенную гетероарильную группу; R2 представляет собой необязательно замещенную алкильную группу, необязательно замещенную арильную группу или необязательно замещенную гетероарильную группу; и R3 представляет собой заместитель на циклообразующем атоме, но не на Х 1, Х 2 и Х 3, который необязательно содержит заместитель (заместители), выбранный из низшей алкильной группы, атома галогена, цианогруппы и оксо. Список документов и патентных документов. Патентный документ 1: WO 2007/114338. Сущность изобретения Ожидалось, что лекарственное средство, которое подобно известным ингибиторам протонной помпы эффективно подавляет секрецию кислоты желудочного сока и для которого будет уменьшена нестабильность в кислотных условиях, изменчивость результатов лечения, обусловленная полиморфизмом метаболических ферментов и межлекарственным взаимодействием, которые представляют собой проблемы известных ингибиторов протонной помпы, будет демонстрировать более хороший результат лечения язвенной болезни, рефлюксного эзофагита и т.п. Следовательно, целью настоящего изобретения является получение соединения, обладающего превосходным эффектом в отношении подавления секреции кислоты (в частности, обладающее ингибирующим эффектом в отношении протонной помпы). Авторы настоящего изобретения провели различные исследования и обнаружили, что соединение,представленное формулой (I) где R1 представляет собой атом фтора, R2 представляет собой (i) метильную группу или (ii) цианогруппу,a R3 представляет собой атом водорода или его соль [в дальнейшем иногда сокращаемое как соединение(I)], неожиданно обладает очень сильным ингибирующим эффектом в отношении протонной помпы и в полной мере удовлетворяет требованиям в качестве лекарственного средства, что привело к выполнению настоящего изобретения. Соответственно, в настоящем изобретении предлагается: 1) соединение, представленное формулой (I) где R1 представляет собой атом фтора, R2 представляет собой (i) метильную группу или (ii) цианогруппу,a R3 представляет собой атом водорода, или его соль; 2) 1-1-(2-фторпиридин-3-ил)-5-[(3-метилфенил)сульфонил]-1 Н-пиразол-3-ил-N-метилметанамин или его соль; 3) 3-(1-(2-фторпиридин-3-ил)-3-[(метиламино)метил]-1 Н-пиразол-5-илсульфонил)бензонитрил или его соль; 4) лекарственное средство, содержащее соединение по вышеупомянутому п.1 или его соль; 5) лекарственное средство по вышеупомянутому п.4, которое представляет собой ингибитор секреции кислоты; 6) лекарственное средство по вышеупомянутому п.4, которое представляет собой калийконкурентный блокатор кислоты; 7) лекарственное средство по вышеупомянутому п.4, которое представляет собой средство для профилактики или лечения язвенной болезни, синдрома Золлингера-Эллисона, гастрита, рефлюксного эзофагита, симптоматической гастроэзофагеальной рефлюксной болезни (симптоматической ГЭРБ), пищевода Барретта, функциональной диспепсии, рака желудка, MALT-лимфомы желудка, язвы, вызванной нестероидным противовоспалительным лекарственным средством, или гиперкислотности или язвы, обусловленной послеоперационным стрессом; или представляет собой средство для подавления кровотечения из верхних отделов желудочно-кишечного тракта, обусловленного язвенной болезнью, острой стрессовой язвой, геморрагическим гастритом или инвазивным стрессом; 8) способ профилактики или лечения язвенной болезни, синдрома Золлингера-Эллисона, гастрита,рефлюксного эзофагита, симптоматической гастроэзофагеальной рефлюксной болезни (симптоматической ГЭРБ), пищевода Барретта, функциональной диспепсии, рака желудка, MALT-лимфомы желудка,язвы, вызванной нестероидным противовоспалительным лекарственным средством, или гиперкислотности или язвы, обусловленной послеоперационным стрессом; или способ подавления кровотечения из верхних отделов желудочно-кишечного тракта, обусловленного язвенной болезнью, острой стрессовой язвой, геморрагическим гастритом или инвазивным стрессом, включающий в себя введение млекопитающему эффективного количества соединения по вышеупомянутому п.1 или его соли; 9) применение соединения по вышеупомянутому п.1 или его соли для производства средства, предназначенного для профилактики или лечения язвенной болезни, синдрома Золлингера-Эллисона, гастрита, рефлюксного эзофагита, симптоматической гастроэзофагеальной рефлюксной болезни (симптоматической ГЭРБ), пищевода Барретта, функциональной диспепсии, рака желудка, MALT-лимфомы желудка,язвы, вызванной нестероидным противовоспалительным лекарственным средством, или гиперкислотности или язвы, обусловленной послеоперационным стрессом; или для производства средства для подавления кровотечения из верхних отделов желудочно-кишечного тракта, обусловленного язвенной болезнью,острой стрессовой язвой, геморрагическим гастритом или инвазивным стрессом. Эффект от изобретения Соединение (I) согласно настоящему изобретению демонстрирует превосходный ингибирующий эффект в отношении протонной помпы. Общепринятые ингибиторы протонной помпы, такие как омепразол, лансопразол и т.п., в кислотной среде париетальных клеток желудка подвергаются превращению в активные формы, образуют ковалентную связь с цистеиновым остатком Н+/K+-АТФазы и необратимо ингибируют активность фермента. В отличие от них соединение (I) ингибирует активность протонной помпы (Н+/K+-АТФазы) обратимым образом по типу K+-конкурентного ингибирования и поэтому подавляет секрецию кислоты. Поэтому иногда его называют калий-конкурентным блокатором кислоты (РСАВ) или антагонистом кислотной помпы (АРА). Соединение (I) быстро воздействует, демонстрирует максимальную эффективность после первичного введения и демонстрирует меньшую зависимость от генетического полиморфизма (меньшую изменчивость результатов среди пациентов). Кроме того, поскольку оно содержит заместители R2 и R3 в м-положении и п-положении фенильной группы, соответственно, оно может дополнительно улучшать фармакокинетику и одновременно может обеспечивать более сильное фармакологическое воздействие и более низкое цитотоксическое воздействие по сравнению с известными соединениями, обладающими ингибирующим действием в отношении протонной помпы. Соответственно, настоящее изобретение может обеспечивать клинически применимое средство для профилактики или лечения язвенной болезни (например, язвы желудка, язвы двенадцатиперстной кишки,анастомотической язвы, язвы, вызванной нестероидным противовоспалительным лекарственным средством, язвы, обусловленной послеоперационным стрессом и т.д.), синдрома Золлингера-Эллисона, гастрита, эрозивного эзофагита, рефлюксного эзофагита, симптоматической гастроэзофагеальной рефлюксной болезни (симптоматической ГЭРБ), пищевода Барретта, функциональной диспепсии, рака желудка,MALT-лимфомы желудка или гиперкислотности; или средство для подавления кровотечения из верхних отделов желудочно-кишечного тракта, обусловленного язвенной болезнью, острой стрессовой язвой,геморрагическим гастритом или инвазивным стрессом и т.п. Поскольку соединение (I) демонстрирует низкую токсичность и превосходную водорастворимость, кинетику in vivo и выраженную эффективность, оно применимо в качестве фармацевтической композиции. Поскольку соединение (I) стабильно даже в кислотных условиях, его можно вводить перорально в виде обычной таблетки и т.п. без того, чтобы использовать в составе препарата, покрытого кишечнорастворимой оболочкой. Из этого вытекает такое полезное следствие, что препарат (таблетку и т.п.) можно изготавливать более мелкого размера, и препарат может легко проглатываться пациентами, имеющими затрудненное глотание, особенно людьми пожилого возраста и детьми. Кроме того, поскольку препарат не обладает эффектом замедленного высвобождения, который предусмотрен для препаратов, покрытых кишечнорастворимой оболочкой, проявление ингибирующего действия на секрецию кислоты желудочного сока является быстрым, и можно быстро облегчать симптомы, такие как боль и т.п. Описание вариантов осуществления изобретения В формуле (I) R1 представляет собой атом фтора.R2 представляет собой метильную группу или цианогруппу.R3 представляет собой атом водорода. В настоящем изобретении особенно предпочтительными являются следующие соединения: 1-1-(2-фторпиридин-3-ил)-5-[(3-метилфенил)сульфонил]-1 Н-пиразол-3-ил-N-метилметанамин или его соль; 3-(1-(2-фторпиридин-3-ил)-3-[(метиламино)метил]-1 Н-пиразол-5-илсульфонил)бензонитрил или его соль. Примеры солей соединения (I) включают в себя соли металлов, соли аммония, соли с органическими основаниями, соли с неорганическими кислотами, соли с органическими кислотами, соли с основными или кислотными аминокислотами и т.п. Предпочтительные примеры соли металла включают в себя соли щелочных металлов, такие как соль натрия, соль калия и т.п.; соли щелочно-земельных металлов,такие как соль кальция, соль магния, соль бария т.п.; соль алюминия и т.п. Предпочтительные примеры соли с органическим основанием включают в себя соль с триметиламином, триэтиламином, пиридином,пиколином, 2,6-лутидином, этаноламином, диэтаноламином, триэтаноламином, циклогексиламином,дициклогексиламином, N,N'-дибензилэтилендиамином и т.п. Предпочтительные примеры соли с неорганической кислотой включают в себя соль с хлористо-водородной кислотой, бромисто-водородной кислотой, азотной кислотой, серной кислотой, фосфорной кислотой и т.п. Предпочтительные примеры соли с органической кислотой включают в себя соль с муравьиной кислотой, уксусной кислотой, трифторуксусной кислотой, фталевой кислотой, фумаровой кислотой, щавелевой кислотой, винной кислотой, малеиновой кислотой, лимонной кислотой, янтарной кислотой, яблочной кислотой, метансульфоновой кислотой, бензолсульфоновой кислотой, п-толуолсульфоновой кислотой и т.п. Предпочтительные примеры соли с основной аминокислотой включают в себя соль с аргинином, лизином, орнитином и т.п. Предпочтительные примеры соли с кислотной аминокислотой включают в себя соль с аспарагиновой кислотой,глутаминовой кислотой и т.п. Среди солей предпочтительными являются фармацевтически приемлемые соли. Например, когда соединение содержит кислотную функциональную группу, предпочтительными являются неорганические соли, такие как соль щелочного металла (например, соль натрия, соль калия и т.д.), соль щелочноземельного металла (например, соль кальция, соль магния, соль бария и т.д.) и т.п., соли аммония и т.п.; и когда соединение содержит основную функциональную группу, предпочтительными являются, например, соли с неорганической кислотой, такой как хлористо-водородная кислота, бромисто-водородная кислота, азотная кислота, серная кислота, фосфорная кислота и т.п., или соли с органической кислотой,такой как уксусная кислота, фталевая кислота, фумаровая кислота, щавелевая кислота, винная кислота,малеиновая кислота, лимонная кислота, янтарная кислота, метансульфоновая кислота, лтолуолсульфоновая кислота и т.п. Далее объясняются способы получения соединения (I) согласно настоящему изобретению. Соединения (Ia)-(XII) на реакционных схемах могут образовывать соли, в качестве таких солей, например, можно упомянуть соли, подобные солям соединения (I). В формуле р равно целому числу 0, 1 или 2, и когда р равно 0 или 1, соединение может подвергаться превращению в соединение, в котором р равно 2, путем окисления каждого соединения с применени-3 019853 ем подходящего окислителя (например, водного раствора пероксида водорода, 3-хлорнадбензойной кислоты и т.д.). Соединение (I) представляет собой соединение (Ia), в котором р равно 2. Хотя соединения, полученные на соответствующих стадиях, можно применять в следующей реакции в форме реакционной смеси или неочищенного продукта, их также можно выделять из реакционной смеси общепринятым способом и легко очищать способом очистки, таким как перекристаллизация, перегонка, хроматография и т.п. Соединение (II), в котором X представляет собой атом водорода; удаляемую группу, такую как атом галогена (например, атом фтора, атом хлора, атом брома, атом йода), метансульфонилокси, птолуолсульфонилокси, трифторметансульфонилокси и т.п.; гидроксигруппу; аминогруппу или меркаптогруппу; и R4 представляет собой атом водорода, формильную группу, карбоксильную группу, сложноэфирную группу, цианогруппу, метиламинокарбонильную группу и т.п., может представлять собой имеющийся в продаже продукт, или его можно получать известным per se способом, например способом,описанным в публикации Heterocycles, т. 46, стр. 489 (1997) и т.п., или аналогичным ему способом. Соединение (V), в котором значение каждого символа определено выше, можно получать, когда X в соединении (II) представляет собой атом водорода, удаляемую группу, такую как атом галогена (например, атом фтора, атом хлора, атом брома, атом йода), метансульфонилокси, п-толуолсульфонилокси,трифторметансульфонилокси и т.п., путем взаимодействия соединения (II) с соединением (III) где R2, R3 и р имеют указанные выше значения и L1 представляет собой атом водорода, удаляемую группу, такую как атом галогена (например, атом фтора, атом хлора, атом брома, атом йода) и т.п., или атом металла, такого как натрий, калий и т.п., или когда X в соединении (II) представляет собой меркаптогруппу путем взаимодействия соединения (II) с соединением (IV) где R2 и R3 имеют указанные выше значения и L2 представляет собой атом водорода или удаляемую группу, такую как атом галогена (например, атом фтора, атом хлора, атом брома, атом йода), метансульфонил, п-толуолсульфонил и т.п. Количество соединения (III), которое следует применять, составляет от приблизительно 1 до приблизительно 10 моль, предпочтительно от приблизительно 1 до приблизительно 3 моль на 1 моль соединения (II). Количество соединения (IV), которое следует применять, составляет от приблизительно 1 до приблизительно 10 моль, предпочтительно от приблизительно 1 до приблизительно 3 моль на 1 моль соединения (II). Такую реакцию предпочтительно проводят с применением растворителя, инертного по отношению к реакции. Растворитель специально не ограничивается при условии, что реакция происходит. Предпочтительные примеры растворителя включают в себя углеводороды, такие как бензол, толуол и т.п., простые эфиры, такие как тетрагидрофуран и т.п., амиды, такие как N,N-диметилформамид, N,Nдиметилацетамид и т.п., смешанный растворитель на их основе и т.п. Реакцию предпочтительно проводят с применением основания. Примеры основания включают в се-4 019853 бя неорганические основания, такие как гидрид натрия, гидроксид натрия, гидроксид калия и т.п.; основные соли, такие как карбонат натрия, карбонат калия, карбонат цезия, гидрокарбонат натрия и т.п.; основания металлов, такие как этилат калия, трет-бутилат калия, метилат натрия, этилат натрия и т.п.; ароматические амины, такие как пиридин, лутидин и т.п.; третичные амины, такие как триэтиламин, Nдиизопропилэтиламин, трипропиламин, трибутиламин, циклогексилдиметиламин, 4-диметиламинопиридин, N,N-диметиланилин, N-метилпиперидин, N-метилпирролидин, N-метилморфолин и т.п. Количество основания, которое следует применять, составляет от приблизительно 1 до приблизительно 10 моль, предпочтительно от приблизительно 1 до приблизительно 5 моль на 1 моль соединения (II). Такую реакцию также можно проводить в присутствии краун-эфира или галогенирующего средства. Примеры краун-эфира включают в себя 15-краун-5-эфир, 18-краун-6-зфир и т.п., примеры галогенирующего средства включают в себя N-йодсукцинимид, N-бромсукцинимид, N-хлорсукцинимид, бром и т.п. Количество краун-эфира или галогенирующего средства, которое следует применять, составляет от приблизительно 1 до приблизительно 10 моль, предпочтительно от приблизительно 1 до приблизительно 5 моль на 1 моль соединения (II). Такую реакцию также можно проводить в присутствии металлического катализатора, такого как палладиевый катализатор и т.п. Примеры палладиевого катализатора включают в себя тетракис(трифенилфосфин)палладий(0), трис(дибензилиденацетон)дипалладий, ацетат палладия и т.п. В таком случае, когда требуется, такую реакцию также можно проводить при совместном присутствии фосфинов. Примеры фосфинов включают в себя 9,9-диметил-4,5-бис(дифенилфосфино)ксантин (XANTPHOS), 2,2'бис(дифенилфосфино)-1,1'-бинафтил (BINAP) и т.п. Количество палладиевого катализатора или фосфина, которое следует применять, составляет от приблизительно 0,01 до приблизительно 0,5 моль, предпочтительно от приблизительно 0,01 до приблизительно 0,3 моль на 1 моль соединения (II). Хотя продолжительность реакции меняется в зависимости от реагента и растворителя, которые применяются, обычно оно составляет от приблизительно 30 мин до приблизительно 24 ч, предпочтительно от приблизительно 30 мин до приблизительно 18 ч. Температура реакции обычно составляет от приблизительно 0 до приблизительно 150 С, предпочтительно от приблизительно 10 до приблизительно 120 С. Соединение (VII), в котором каждый символ имеет указанные выше значения, может представлять собой имеющийся в продаже продукт, или его можно получать известным per se способом, например,способом, описанным в публикациях Bioorganic and Medicinal Chemistry Letters, т. 16, стр. 731 (2006),Chemical and Pharmaceutical Bulletin,31, стр. 1228 (1983), WO 2004/98589 и т.п., или аналогичным ему способом. Кроме того, его можно получать путем взаимодействия соединения (II) с соединением (VI) где каждый символ имеет указанные выше значения (или различными сложноэфирными производными соединения (VI, с помощью способа, описанного в публикации Tetrahedron Letters, т. 39, стр. 2941(1998), или аналогичным ему способом. Количество соединения (VI), которое следует применять, составляет от приблизительно 1 до приблизительно 10 моль, предпочтительно от приблизительно 1 до приблизительно 3 моль на 1 моль соединения (II). Соединение (VIII) можно получать из соединения (V) с помощью способа, подобного способу получения соединения (VII) из соединения (II), или аналогичным ему способом. Его также можно получать из соединения (VII) с помощью способа, подобного способу получения соединения (V) из соединения(II), или аналогичным ему способом. Когда R4 в соединении (VIII) представляет собой формильную группу, соединение (Ia) можно получать путем реакции восстановительного аминирования с применением соединения (IX)Kouza (Courses in Experimental Chemistry), т. 14-III, стр. 1380-1385 (Maruzen Press) или т.п. Количество соединения (IX), которое следует применять, составляет от приблизительно 1 до приблизительно 20 моль, предпочтительно от приблизительно 1 до приблизительно 10 моль на 1 моль соединения (VIII). Когда в соединении (VIII) R4 представляет собой атом водорода, соединение (Ia) можно получать,например, способом формилирования, описанного в публикации Jikken Kagaku Kouza, 4th ed. т. 21, стр. 106-124 (1991) (Maruzen Press) и т.п., или аналогичным ему способом с последующим восстановитель-5 019853 ным аминированием, упомянутым ранее. Кроме того, когда в соединении (VIII) R4 представляет собой сложноэфирную группу, соединение(Ia) можно получать путем восстановления сложноэфирной группы с помощью восстановителя, такого как гидрид литийалюминия, гидрид диизобутилалюминия, борогидрид натрия, бис(борогидрид) кальция и т.п., взаимодействия полученной гидроксигруппы с окислителем, таким как комплекс хромовой кислоты с пиридином, хлорхромат пиридиния, диоксид марганца, комплекс триоксида серы с пиридином или перрутенат тетра-н-пропиламмония и т.п., для превращения в формильную группу с последующим восстановительным аминированием, упомянутым ранее. В качестве восстановителя особенно предпочтительным является гидрид диизобутилалюминия. Количество восстановителя, которое следует применять, составляет от приблизительно 0,75 до приблизительно 10 экв., предпочтительно от приблизительно 1 до приблизительно 5 экв. на 1 моль соединения(VIII). Предпочтительные примеры окислителя включают в себя диоксид марганца, комплекс триоксида серы с пиридином и перрутенат тетра-н-пропиламмония. Количество окислителя, которое следует применять, составляет от приблизительно 0,01 до приблизительно 30 экв., предпочтительно от приблизительно 0,05 до приблизительно 10 экв. на 1 моль соединения (VIII). Реакцию окисления можно проводить, например, согласно способу, описанному в публикации Synthesis, стр. 639 (1994). Такую реакцию предпочтительно проводят с применением растворителя, инертного по отношению к реакции. Такой растворитель специально не ограничивается при условии, что реакция происходит, и предпочтительными являются углеводороды, такие как бензол, толуол и т.п., простые эфиры, такие как тетрагидрофуран, простой диэтиловый эфир и т.п., или смешанный растворитель на их основе и т.п. Хотя продолжительность реакции меняется в зависимости от реагента и растворителя, которые применяются, обычно она составляет от приблизительно 30 мин до приблизительно 24 ч, предпочтительно от приблизительно 30 мин до приблизительно 8 ч. Температура реакции обычно составляет от приблизительно -78 С до приблизительно 100 С, предпочтительно от приблизительно -78 С до приблизительно 25 С. Когда R4 в соединении (VIII) представляет собой цианогруппу, соединение (Ia) также можно получать путем восстановления с помощью восстановителя, такого как гидрид диизобутилалюминия и т.п.,до превращения в формильную группу с последующим восстановительным аминированием, упомянутым ранее. В качестве восстановителя особенно предпочтительным является гидрид диизобутилалюминия. Количество восстановителя, которое следует применять, составляет от приблизительно 0,75 до приблизительно 10 экв, предпочтительно от приблизительно 1 до приблизительно 5 экв. на 1 моль соединения(VIII). Такую реакцию предпочтительно проводят с применением растворителя, инертного по отношению к реакции. Такой растворитель специально не ограничивается при условии, что реакция происходит, и предпочтительными являются углеводороды, такие как бензол, толуол и т.п., простые эфиры, такие как тетрагидрофуран, простой диэтиловый эфир и т.п., или смешанный растворитель на их основе и т.п. Хотя продолжительность реакции меняется в зависимости от реагента и растворителя, которые применяются, обычно она составляет от приблизительно 30 минут до приблизительно 24 часов, предпочтительно от приблизительно 30 минут до приблизительно 8 часов. Температура реакции обычно составляет от приблизительно -78 С до приблизительно 100 С, предпочтительно от приблизительно -78 С до приблизительно 25 С. Кроме того, когда R4 в соединении (VIII) представляет собой метиламинокарбонильную группу, соединение (Ia) можно получать восстановлением с помощью восстановителя. В качестве восстановителя применяют гидриды металлов, такие как борогидрид натрия, гидрид литийалюминия и т.п., бораны, такие как тетрагидрофуран-борановый комплекс и т.п. Количество восстановителя, которое следует применять, составляет от приблизительно 0,5 до приблизительно 10 моль,предпочтительно от приблизительно 1 до приблизительно 5 моль на 1 моль соединения (VIII). Когда требуется, наряду с восстановителем можно добавлять кислотный катализатор. В качестве кислотного катализатора применяют кислоты Льюиса, такие как комплекс трифторборана с простым диэтиловым эфиром, хлорид алюминия и т.п. Количество кислотного катализатора, которое следует применять, составляет от приблизительно 0,5 до приблизительно 10 моль, предпочтительно от приблизительно 1,0 до приблизительно 5,0 моль относительно соединения (VIII). Такую реакцию предпочтительно проводят без растворителя или в растворителе, инертном по отношению к реакции. Такой растворитель специально не ограничивается при условии, что реакция происходит. Например, применяют спирты, такие как метанол, этанол, пропанол и т.п., углеводороды, такие как циклогексан, гексан, бензол, толуол, ксилол, мезитилен и т.п., органические кислоты, такие как муравьиная кислота, уксусная кислота и т.п., простые эфиры, такие как тетрагидрофуран, диоксан, 1,2 диметоксиэтан, простой диэтиловый эфир, диизопропиловый эфир и т.п., анилины, такие как N,Nдиметиланилин, N,N-диэтиланилин и т.п., галогенированные углеводороды, такие как дихлорметан, хло-6 019853 роформ, тетрахлорид углерода, 1,2-дихлорэтан и т.п., или смешанный растворитель на их основе и т.п. Продолжительность реакции обычно составляет от приблизительно 10 мин до приблизительно 24 ч,предпочтительно от приблизительно 30 мин до 12 ч. Температура реакции обычно составляет от приблизительно 0 до приблизительно 120 С, предпочтительно от приблизительно 25 до приблизительно 100 С. Кроме того, когда R4 в соединении (VIII) представляет собой сложноэфирную группу или карбоксильную группу, соединение (Ia) можно получать путем конденсации с соединением (IX) с последующим восстановлением, упомянутым ранее. Вышеупомянутую реакцию можно проводить в присутствии подходящего конденсирующего средства. Примеры конденсирующего средства включают в себя N,N'-карбодиимиды, такие как N,N'дициклогексилкарбодиимид, гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (WSC) и т.п.; азолиды, такие как N,N'-карбонилдиимидазол и т.п.; дегидратирующие средства, такие как Nэтоксикарбонил-2-этокси-1,2-дигидрохинолин, оксихлорид фосфора, уксусный ангидрид и т.п.; соли 2 галогенпиридиния, такие как иодид 2-хлорметилпиридиния, иодид 2-фтор-1-хлорметилпиридиния и т.п. Количество конденсирующего средства, которое следует применять, составляет от приблизительно 1 до приблизительно 5 моль, предпочтительно от приблизительно 2 до 3 моль на 1 моль соединения (VIII). Когда требуется, реакцию можно проводить при совместном присутствии основания наряду с конденсирующим средством. В качестве основания можно упомянуть основные соли, такие как ацетат калия, ацетат натрия и т.п., моногидрат 1-гидрокси-1 Н-бензотриазола (HOBt) и т.п. Количество основания,которое следует применять, составляет от приблизительно 1 до приблизительно 5 моль, предпочтительно от приблизительно 2 до приблизительно 3 моль на 1 моль соединения (VIII). Такую реакцию предпочтительно проводят с применением растворителя, инертного по отношению к реакции. Предпочтительные примеры растворителя включают в себя спирты, такие как метанол, этанол,пропанол и т.п., углеводороды, такие как циклогексан, гексан, бензол, толуол, ксилол и т.п., простые эфиры, такие как тетрагидрофуран, диоксан, 1,2-диметоксиэтан, простой диэтиловый эфир, диизопропиловый эфир и т.п., амиды, такие как N,N-диметилформамид, N,N-диметилацетамид, гексаметилфосфорный триамид и т.п., сульфоксиды, такие как диметилсульфоксид и т.п., галогенированные углеводороды,такие как дихлорметан, хлороформ, тетрахлорид углерода, 1,2-дихлорэтан и т.п., ангидриды кислот, такие как уксусный ангидрид и т.п., или смешанный растворитель на их основе и т.п. Продолжительность реакции обычно составляет от приблизительно 30 мин до приблизительно 48 ч,предпочтительно от приблизительно 30 мин до приблизительно 24 ч. Температура реакции обычно составляет от приблизительно 0 до приблизительно 120 С, предпочтительно от приблизительно 25 до приблизительно 100 С. Соединение (X), в котором значение X определено выше, может представлять собой имеющийся в продаже продукт или его можно получать с помощью известного per se способа, например способа, описанного в публикации: Journal of American Chemical Society, т. 72, стр. 745 (1950) и т.п., или аналогичного ему способа. Соединение (XI) можно получать из соединения (X) согласно способу, подобному способу получения соединения (V) из соединения (II), или аналогичным ему способом. Соединение (XII) можно получать из соединения (X) согласно способу, подобному способу получения соединения (VII) из соединения (II), или аналогичным ему способом. Альтернативно, соединение (X) можно получать из соединения (II) согласно способу, подобному способу получения соединения (Ia) из соединения (VIII), или аналогичным ему способом; соединение(XI) можно получать из соединения (V) согласно способу, подобному способу получения соединения (Ia) из соединения (VIII), или аналогичным ему способом, и соединение (XII) можно получать из соединения(VII) согласно способу, подобному способу получения соединения (Ia) из соединения (VIII), или аналогичным ему способом. Соединение (Ia) можно получать из соединения (XI) согласно способу, подобному способу получе-7 019853 ния соединения (VII) из соединения (II), или аналогичным ему способом или можно получать из соединения (XII) согласно способу, подобному способу получения соединения (V) из соединения (II), или аналогичным ему способом. В каждой из вышеупомянутых реакций, когда исходное соединение содержит в качестве заместителя аминогруппу, карбоксильную группу или гидроксильную группу, в такие группы можно вводить защитную группу, обычно применяемую в химии пептидов и т.п. Целевое соединение можно получать путем удаления, при необходимости, защитной группы после реакции. Введение или удаление таких защитных групп можно проводить согласно известному per se способу, например, согласно способу, описанному в публикации Theodora W. Greene и Peter G.M. Wuts "Protective Groups in Organic Synthesis, 3rdEd.", Wiley-Interscience (1999) или т.п. Из любого из соединений (Ia)-(XII) на схеме, когда требуется, можно синтезировать соединение (I) путем осуществления защиты-снятия защиты, реакции ацилирования, реакции алкилирования, реакции гидрирования, реакции окисления, реакции восстановления, реакции удлинения углеродной цепи и реакции замены заместителя, проводя каждую реакцию по отдельности или сочетая два или более вида таких реакций. Любое из соединений (Ia)-(XII) на схеме, когда соединение получают в виде свободного соединения, можно подвергать превращению в целевую соль с помощью известного per se способа или аналогичного ему способа. И наоборот, когда соединение получают в виде соли, его можно подвергать превращению в свободную форму или другую целевую соль с помощью известного per se способа или аналогичного ему способа. Соединение (I) можно выделять и очищать с помощью известного способа, например межфазного переноса, концентрирования, экстракции растворителем, фракционирования, превращения в жидкое состояние, кристаллизации, перекристаллизации, хроматографии и т.п. Когда соединение (I) получают в виде свободного соединения, его можно подвергать превращению в требуемую соль с помощью известного per se способа или аналогичного ему способа; и наоборот, когда соединение (I) получают в виде соли, его можно подвергать превращению в свободную форму или другую требуемую соль с помощью известного per se способа или аналогичного ему способа. Когда соединение (I) имеет изомер, такой как оптический изомер, стереоизомер, региоизомер или ротамер, соединение (I) также охватывает любой изомер или смесь таких изомеров. Например, когда соединение (I) имеет оптический изомер, соединение (I) также охватывает оптический изомер, выделенный из рацемической смеси. Такие изомеры можно получать в виде отдельных продуктов согласно известным per se способам синтеза и выделения (концентрирование, экстракция растворителем, колоночная хроматография, перекристаллизация и т.д.) Соединение (I) может представлять собой кристалл, и как отдельный кристалл, так и смеси кристаллов охватываются соединением (I). Кристаллы можно получать путем кристаллизации согласно известным per se способам кристаллизации. Соединение (I) может представлять собой сольватированную (например, гидрат и т.д.) или несольватированную форму, обе из которых охватываются соединением (I). Соединение (I) также охватывает соединение, меченное изотопом (например, 3 Н, 14 С, 35S, 125I и т.п.),и дейтериевую форму, получаемую в результате конверсии, где 1 Н превращен в 2H(D). Соединение (I) согласно настоящему изобретению (в дальнейшем иногда сокращенно упоминаемое как соединение согласно настоящему изобретению) обладает ингибирующим эффектом в отношении протонной помпы и эффективно подавляет секрецию кислоты желудочного сока. Кроме того, поскольку оно проявляет низкую токсичность (например, острую токсичность, хроническую токсичность, наследственную токсичность, репродуктивную токсичность, кардиотоксичность, лекарственное взаимодействие, канцерогенное действие и т.п.), высокую водорастворимость, превосходную стабильность, кинетикуin vivo (всасываемость, распределение, метаболизм, экскрецию и т.п.) и выраженную эффективность, оно применимо в качестве лекарственных средств. Соединение согласно настоящему изобретению применимо для профилактики или лечения язвенной болезни (например, язвы желудка, язвы двенадцатиперстной кишки, анастомотической язвы, язвы,вызванной нестероидным противовоспалительным лекарственным средством, язвы, обусловленной послеоперационным стрессом и т.д.); синдрома Золлингера-Эллисона; гастрита; эрозивного эзофагита; рефлюксного эзофагита, такого как эрозивный рефлюксный эзофагит и т.п.; симптоматической гастроэзофагеальной рефлюксной болезни (симптоматической ГЭРБ), такой как неэрозивный гастроэзофагеальный рефлюкс, гастроэзофагеальный рефлюкс, не сопровождающийся эзофагитом и т.п.; пищевода Барретта; функциональной диспепсии; рака желудка (включая рак желудка, ассоциированный с повышенной выработкой интерлейкина-1, обусловленной полиморфизмом гена интерлейкина-1); MALT-лимфомы желудка; гиперкислотности; кровотечения из верхних отделов желудочно-кишечного тракта, вызванного язвенной болезнью, острой стрессовой язвой, геморрагическим гастритом, инвазивным стрессом (например, стрессом, вызванным обширным хирургическим вмешательством, требующим интенсивного послеоперационного лечения, или цереброваскулярным расстройством, травмой головы, полиорганной недостаточностью или обширным ожогом, требующим интенсивного лечения) и т.п.; заболеваний дыхатель-8 019853 ных путей; астмы и т.п. у млекопитающих (например, у человека, обезьяны, овцы, крупного рогатого скота, лошади, собаки, кошки, кролика, крысы, мыши и т.д.), для введения, предшествующего анестезии,уничтожения или помощи при уничтожении бактерии Helicobacter pylori и т.п. Применяемые здесь термины, связанные с вышеупомянутым рефлюксным эзофагитом (эрозивным эзофагитом) и симптоматической гастроэзофагеальной рефлюксной болезнью (симптоматической ГЭРБ), иногда обобщенно упоминаются как просто ГЭРБ. Содержание соединения согласно настоящему изобретению в фармацевтической композиции по настоящему изобретению составляет от приблизительно 0,01 до 100 мас.% относительно композиции в целом. Хотя доза подлежит уточнению в зависимости от цели введения, способа введения, установленного заболевания и т.п., вводимая доза составляет от приблизительно 0,5 до 1500 мг/день, предпочтительно от приблизительно 5 до 150 мг/день в расчете на активный ингредиент, когда, например, соединение перорально вводится взрослому человеку (60 кг) в качестве противоязвенного средства. Соединение согласно настоящему изобретению можно вводить один раз в день или делить на порции для введения 2 или 3 раза в день. Соединение согласно настоящему изобретению демонстрирует низкую токсичность и может безопасно вводиться перорально или парентерально (например, с помощью местного, ректального, внутривенного способов введения и т.п.) в чистом виде или в виде препарата, содержащего фармацевтическую композицию, содержащую фармакологически приемлемый носитель, примешанный согласно известномуper se способу, такого как таблетки (включая таблетки, покрытые сахаром, и таблетки с пленочной оболочкой), порошок, гранула, капсула (включая мягкую капсулу), таблетка, растворяющаяся во рту, пленка, растворяющаяся во рту, жидкость, инъекция, суппозиторий, препарат с замедленным высвобождением, пластырь и т.п. В частности, соединение согласно настоящему изобретению предпочтительно вводят в виде препарата для перорального введения в форме таблетки, гранулы, капсулы и т.п. Примеры фармакологически приемлемого носителя, который можно применять для получения фармацевтической композиции согласно настоящему изобретению, включают в себя различные органические или неорганические вещества-носители, повсеместно принятые в качестве фармацевтических материалов, включая эксципиенты, смазывающие вещества, связующие, разрыхлители, водорастворимые полимеры и основные неорганические соли для твердых препаратов; и растворители, солюбилизирующие средства, суспендирующие средства, изотонизирующие средства, буферы и смягчающие средства для жидких препаратов и т.п. При необходимости также можно применять общепринятые фармацевтические добавки, такие как консерванты, антиоксиданты, красители, подсластители, подкислители, средства,образующие пузырьки газа, и корригенты вкуса и запаха. Примеры "эксципиентов" включают в себя лактозу, сахарозу, D-маннит, крахмал, кукурузный крахмал, кристаллическую целлюлозу, легкую безводную кремниевую кислоту, оксид титана и т.п. Примеры "смазывающих веществ" включают в себя стеарат магния, сложный эфир сахарозы и жирных кислот, полиэтиленгликоль, тальк, стеариновую кислоту и т.п. Примеры "связующих" включают в себя гидроксипропилцеллюлозу, гидроксипропилметилцеллюлозу, кристаллическую целлюлозу, крахмал, поливинилпирролидон, порошок гуммиарабика, желатин, пуллулан, гидроксипропилцеллюлозу с низкой степенью замещения и т.п. Примеры "разрыхлителей" включают в себя (1) кроссповидон, (2) так называемые суперразрыхлители, такие как натриевая соль кросскармеллозы (производимая компанией FMC-Asahi Chemical), кальциевая соль кармеллозы (производимая компанией GOTOKU CHEMICAL CO., LTD.) и т.д., (3) натриевую соль карбоксиметилкрахмала (например, продукт компании Matsutani Chemical), (4) гидроксипропилцеллюлозу с низкой степенью замещения (например, продукт компании Shin-Etsu Chemical), (5) кукурузный крахмал, и т.д. Указанный"кроссповидон" может представлять собой поливинилпирролидон (PVPP), любой сшитый полимер, который имеет химическое название гомополимер 1-этенил-2-пирролидинона, включая гомополимер 1 винил-2-пирролидинона, и примером которого является Colidon CL (производимый компанией BASF),Polyplasdon XL (производимый компанией ISP), Polyplasdon XL-10 (производимый компанией ISP), Polyplasdon INF-10 (производимый компанией ISP) и т.п. Примеры "водорастворимых полимеров" включают в себя растворимые в этаноле водорастворимые полимеры [например, производные целлюлозы, такие как гидроксипропилцеллюлоза (в дальнейшем также упоминаемая как ГПЦ) и т.д., поливинилпирролидон и т.п.], не растворимые в этаноле водорастворимые полимеры [например, производные целлюлозы,такие как гидроксипропилметилцеллюлоза (в дальнейшем также упоминаемая как ГПМЦ) и т.п., метилцеллюлоза, натриевая соль карбоксиметилцеллюлозы и т.п., полиакрилат натрия, поливиниловый спирт,альгинат натрия, гуаровая камедь и т.п.] и т.п. Примеры "основных неорганических солей" включают в себя основные неорганические соли натрия, калия, магния и/или кальция. Предпочтительными являются основные неорганические соли магния и/или кальция. Более предпочтительными являются основные неорганические соли магния. Примеры основных неорганических солей натрия включают в себя карбонат натрия, гидрокарбонат натрия, гидрофосфат динатрия и т.п. Примеры основных неорганических солей калия включают в себя карбонат калия, гидрокарбонат калия и т.п. Примеры основных неорганических солей магния включают в себя "тяжелый" карбонат магния, карбонат магния, оксид магния, гидроксид магния, алюмометасиликат магния, силикат магния, алюминат магния, синтетический гидротальцит карбонат магния, карбонат магния, оксид магния, гидроксид магния и т.п. Примеры основных неорганических солей кальция включают в себя осажденный карбонат кальция, гидроксид кальция и т.п. Примеры"растворителей" включают в себя воду для инъекции, спирт, пропиленгликоль, макрогол, кунжутное масло, кукурузное масло, оливковое масло и т.п. Примеры "солюбилизирующих средств" включают в себя полиэтиленгликоль, пропиленгликоль, D-маннит, бензилбензоат, этанол, трисаминометан, холестерин, триэтаноламин, карбонат натрия, цитрат натрия и т.п. Примеры "суспендирующих средств" включают в себя поверхностно-активные вещества, такие как стеарилтриэтаноламин, лаурилсульфат натрия,лауриламинопропионовую кислоту, лецитин, хлорид бензалкония, хлорид бензетония, глицерилмоностеарат и т.д.; гидрофильные полимеры, такие как поливиниловый спирт, поливинилпирролидон, натриевая соль карбоксиметилцеллюлозы, метилцеллюлоза, гидроксиметилцеллюлоза, гидроксиэтилцеллюлоза, гидроксипропилцеллюлоза и т.п. Примеры "изотонизирующих средств" включают в себя глюкозу, D-сорбит, хлорид натрия, глицерин, D-маннит и т.п. Примеры "буферов" включают в себя буферные растворы фосфатов, ацетатов, карбонатов, цитратов и т.п. Примеры "смягчающих средств" включают в себя бензиловый спирт и т.п. Примеры "консервантов" включают в себя сложные эфиры поксибензойной кислоты, хлорбутанол, бензиловый спирт, фенетиловый спирт, дегидроуксусную кислоту, сорбиновую кислоту и т.п. Примеры "антиоксидантов" включают в себя сульфиты, аскорбиновую кислоту, -токоферол и т.п. Примеры "красителей" включают в себя пищевые красители, такие как пищевой краситель желтый 5, пищевой краситель красный 2, пищевой краситель синий 2 и т.п.; пищевые красочные лаки, красный оксид железа (III) и т.п. Примеры "подсластителей" включают в себя натриевую соль сахарина, глициризинат дикалия, аспартам, стевию, тауматин и т.п. Примеры "подкислителей" включают в себя лимонную кислоту (лимонный ангидрид), винную кислоту, яблочную кислоту и т.п. Примеры "средств, образующих пузырьки газа" включают в себя бикарбонат натрия и т.п. "Корригенты вкуса и запаха" могут представлять собой синтетические вещества или встречающиеся в природе вещества, и их примеры включают в себя лимон, лайм, апельсин, ментол, клубнику и т.п. Соединение согласно настоящему изобретению можно получать в виде препарата для перорального введения в соответствии с общеизвестным способом, например, путем формования-прессования с носителем, таким как эксципиент, разрыхлитель, связующее, смазывающее вещество или т.п., и затем, при необходимости, нанесение на препарат покрытия общеизвестным способом для маскировки вкуса, придания энтеральной растворимости или замедленного высвобождения. Общеизвестным способом кишечнорастворимый препарат можно обеспечивать промежуточным слоем, находящимся между кишечнорастворимым слоем и слоем, содержащим лекарственное средство, с целью разделения двух слоев. Для получения соединения согласно настоящему изобретению в виде таблетки, растворяющейся во рту, доступные способы включают в себя способ, при котором ядро, содержащее кристаллическую целлюлозу и лактозу, покрывают соединением согласно настоящему изобретению и, в случае необходимости, основной неорганической солью и затем дополнительно покрывают слоем, содержащим водорастворимый полимер, получая при этом композицию, которую покрывают кишечнорастворимым слоем, содержащим полиэтиленгликоль, дополнительно покрывают кишечнорастворимым слоем, содержащим триэтилцитрат, дополнительно еще покрывают кишечнорастворимым слоем, содержащим полиэтиленгликоль, и в заключение покрывают маннитом, получая при этом тонкодисперсные гранулы, которые смешивают с добавками и формуют. Примеры вышеупомянутого "кишечнорастворимого слоя" включают в себя слой, состоящий из смеси одного или более видов водорастворимых, кишечнорастворимых полимерных субстратов, таких как ацетат фталат целлюлозы (САР), фталат гидроксипропилметилцеллюлозы, сукцинат ацетата гидроксиметилцеллюлозы, сополимеры метакриловой кислоты (например, Eudragit L30D-55 (торговая марка; производимый компанией Rohm), Colicoat MAE30DP (торговая марка; производимый компанией BASF),Polyquid PA30 (торговая марка; производимый компанией Sanyo Chemical) и т.д.), карбоксиметилэтилцеллюлоза, шеллак и т.п.; субстратов для замедленного высвобождения, таких как сополимеры метакриловой кислоты (например, Eudragit NE30D (торговая марка), Eudragit RL30D (торговая марка), EudragitRS30D (торговая марка) и т.д.) и т.п.; водорастворимых полимеров; пластификаторов, таких как триэтилцитрат, полиэтиленгликоль, ацетилированные моноглицериды, триацетин, касторовое масло и т.п. Примеры вышеупомянутой "добавки" включают в себя водорастворимые сахарные спирты (например, сорбит, маннит, мальтит, сахариды с уменьшенным содержанием крахмала, ксилит, восстановленную палатинозу, эритрит и т.д.), кристаллическую целлюлозу (например, Ceolas KG 801, Avicel PH 101,Avicel PH 102, Avicel PH 301, Avicel PH 302, Avicel RC-591 (кристаллическая целлюлоза-натриевая соль кармеллозы) и т.д.), гидроксипропилцеллюлозу с низкой степенью замещения (например, LH-22, LH-32,LH-23, LH-33 (Shin-Etsu Chemical), их смеси и т.д.) и т.п. Кроме того, также применяют связующие, подкислители, средства, образующие пузырьки газа, подсластители, корригенты вкуса и запаха, смазывающие вещества, красители, стабилизаторы, эксципиенты, разрыхлители и т.п. Соединение согласно настоящему изобретению можно применять в комбинации с 1-3 другими активными ингредиентами. Примеры таких "других активных ингредиентов" включают в себя активные вещества против Helicobacter pylori, имидазольные соединения, соли висмута, хинолоновые соединения и т.д. Примеры "активных веществ против Helicobacter pylori" включают в себя антибиотик пеницилли- 10019853 нового ряда (например, амоксициллин, бензилпенициллин, пиперациллин, мециллинам, ампициллин,темоциллин, бакампициллин, аспоксициллин, сультамициллин, ленампициллин и т.д.), антибиотик цефемового ряда (например, цефиксим, цефаклор и т.д.), макролидный антибиотик (например, эритромицин, кларитромицин, рокситромицин, рокитамицин, флуритромицин, телитромицин и т.д.), антибиотик тетрациклинового ряда (например, тетрациклин, миноциклин, стрептомицин и т.д.), аминогликозидный антибиотик (например, гентамицин, амикацин и т.д.), имипенем и т.п. Среди них предпочтительными являются антибиотик пенициллинового ряда, макролидный антибиотик и т.п. Примеры "имидазольных соединений" включают в себя метронидазол, миконазол и т.п. Примеры "солей висмута" включают в себя ацетат висмута, цитрат висмута, субсалицилат висмута и т.п. Примеры "хинолоновых соединений" включают в себя офлоксацин, циплоксацин и т.п. Для уничтожения бактерии Helicobacter pylori предпочтительно применяют соединение (I) согласно настоящему изобретению с антибиотиком пенициллинового ряда (например, амоксициллином и т.п.) и антибиотиком эритромицинового ряда (например, кларитромицином и т.п.). Хотя соединение согласно настоящему изобретению само по себе обладает активностью против Н.pylori (бактериостатическим действием или уничтожающим действием), с целью уничтожения бактерииHelicobacter pylori оно может усиливать антибактериальное действие других антибиотиков, основанное на регулирующем воздействии на рН в желудке и т.п., а также обеспечивать сопутствующий эффект,такой как эффект уничтожения, основанный на действии антибиотиков, применяемых в комбинации."Другие активные ингредиенты" и соединение (I) согласно настоящему изобретению можно смешивать,получать в виде единичной фармацевтической композиции [например, таблеток, порошков, гранул, капсул (включая мягкие капсулы), жидкостей, препаратов для инъекций, суппозиториев, препаратов с замедленным высвобождением и т.д.], согласно общеизвестному способу и применять в комбинации, а также можно получать в виде отдельных препаратов и вводить тому же самому субъекту одновременно или с интервалами во времени. Кроме того, соединение согласно настоящему изобретению можно применять в комбинации с усилителем перистальтики желудка, лекарственным средством, воздействующим на нижний пищеводный сфинктер (например, средство для подавления кратковременного расслабления нижнего пищеводного сфинктера и т.д.), активатором хлорных ClC-2-каналов (усилителем секреции кишечного сока), антагонистом гистаминовых Н 2-рецепторов, антацидом, седативным средством, желудочным средством, стимулирующим пищеварение или нестероидным противовоспалительным лекарственным средством(НПВС). Примеры "усилителя перистальтики желудка" включают в себя домперидон, метоклопрамид,мосаприд, итоприд, тегасерод и т.п. Примеры "лекарственного средства, воздействующего на нижний пищеводный сфинктер" включают в себя агонистов GABA-B-рецепторов, таких как баклофен, его оптически активную форму и т.п., антагонистов глутаминовых рецепторов и т.п. Примеры "активатора ClC-2 каналов (усилителя секреции кишечного сока)" включают в себя лубипростон и т.п. Примеры "антагониста гистаминовых Н 2-рецепторов" включают в себя циметидин, ранитидин, фамотидин, роксатидин, низатидин, лафутидин и т.п. Примеры "антацида" включают в себя гидрокарбонат натрия, гидроксид алюминия и т.п. Примеры "седативных средств" включают в себя диазепам, хлордиазепоксид и т.п. Примеры"желудочного средства, стимулирующего пищеварение" включают в себя горечавку, свертию японскую,диастазу и т.п. Примеры "нестероидного противовоспалительного лекарственного средства" включают в себя аспирин, индометацин, ибупрофен, мефенамовую кислоту, диклофенак, этодолак, пироксикам, целекоксиб и т.п. Усилитель перистальтики желудка, лекарственное средство, воздействующее на нижний пищеводный сфинктер, активатор хлорных ClC-2-каналов (усилитель секреции кишечного сока), антагонист гистаминовых Н 2-рецепторов, антацид, седативное средство, желудочное средство, стимулирующее пищеварение, или нестероидное противовоспалительное лекарственное средство и соединение (I) согласно настоящему изобретению можно смешивать, получать в виде единой фармацевтической композиции[например, таблеток, порошков, гранул, капсул (включая мягкие капсулы), жидкостей, препаратов для инъекций, суппозиториев, препаратов с замедленным высвобождением и т.д.] согласно известному per se способу для совместного применения или также можно получать в виде отдельных препаратов и вводить тому же самому субъекту одновременно или ступенчатым образом. Соединение согласно настоящему изобретению можно применять в комбинации со следующими лекарственными средствами:(ii) комбинированным антацидом для перорального введения, например Маалоксом, Алюдроксом и Гевисконом;(iv) противогастритным средством, например вакциной от гастрита, итриглумидом и Z-360;(xiii) ингибитором синтазы моноксида азота, например GW-274150, тиларгинином, Р 54, гуанидиоэтилдисульфидом и нитрофлурбипрофеном;(xvi) стимулятором высвобождения AchE, например Z-338 и Kwio 5092. Вышеупомянутые лекарственные средства (i)-(xvi) и соединение (I) согласно настоящему изобретению можно смешивать, получать в виде единичной фармацевтической композиции [например, в виде таблеток, порошков, гранул, капсул (включая мягкие капсулы), жидкостей, препаратов для инъекций,суппозиториев, препаратов с замедленным высвобождением и т.д.] согласно известному per se способу для совместного применения, или можно также получать в виде отдельных препаратов и вводить тому же самому субъекту одновременно или ступенчатым образом. Примеры Более подробно настоящее изобретение объясняется со ссылкой на следующие справочные примеры, примеры и экспериментальные примеры, которые не должны рассматриваться как ограничивающие. В следующих справочных примерах и примерах выражение "при комнатной температуре" обычно означает температуру от приблизительно 10 до приблизительно 35 С, хотя она ограничивается не особенно строго. Соотношение компонентов в жидких смесях соответствует объемному отношению. Если не указано иначе, % означает мас.%. Выход указывается в мол./мол.%. Колоночную хроматографию на силикагеле проводили с применением силикагеля 60 (0,063-0,200 мм) производства компании MERCK,Fuji Silysia Chemical Ltd., Chromatorex (торговая марка) NH (описан как силикагель для колоночной хроматографии на основном силикагеле) или силикагеля Purif-Pack, производимого компанией MORITEX(описан как силикагель для колоночной хроматографии на силикагеле или колоночной хроматографии на основном силикагеле). Точку плавления измеряли с применением записывающего устройства Yanagimoto для определения точки плавления или записывающего устройства Buechi (В-545) для определения точки плавления и указывали без учета поправки на ошибку измерения. При измерении спектра 1 Н-ЯМР в качестве внутреннего стандарта применяли тетраметилсилан, и для измерения спектров применяли спектрометры: Varian Gemini-200 (200 МГц), Mercury-300 (300 МГц), Bruker AVANCE AV300 (300 МГц) и установку для ядерного магнитного резонанса JNM-AL400 (400 М Гц) производства компании JEOLDATUM (JEOL DATUM LTD.). Для показа результатов измерений применяли следующие сокращения: с синглет, д - дублет, дд - двойной дублет, ддд - тройной дублет, дт - двойной триплет, т - триплет, кв квартет, дкв - двойной квартет, м - мультиплет, ушир. - уширенный, ушир.с - уширенный синглет, J константа взаимодействия, Гц - герц. Справочный пример 1. Этил-1-(2-фторпиридин-3-ил)-5-гидрокси-1 Н-пиразол-3-карбоксилат(65,2 г) и диэтилбут-2-индиоат (40,2 г). После кипячения с обратным холодильником в течение 18 ч смесь охлаждали до комнатной температуры, обрабатывали раствором (2 моль/л) хлористо-водородной кислоты и дважды экстрагировали этилацетатом. Экстракт сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток суспендировали в простом диэтиловом эфире, по- 12019853 лученное твердое вещество собирали при фильтровании и сушили при пониженном давлении, получая при этом указанное в заголовке соединение в виде желтого твердого вещества (выход 20,0 г, 34%). 1 Н-ЯМР (ДМСО-d6) : 1,28 (3 Н, т, J=7,2 Гц), 4,23 (2 Н, кв, J=7,2 Гц), 5,94 (1 Н, с), 7,57 (1 Н, ддд, J=7,6,4,8, 1,2 Гц), 7,49 (1 Н, ддд, J=9,6, 7,6, 1,6 Гц), 8,39 (1 Н, дт, J=4,8, 1,6 Гц), 12,3 (1 Н, ушир.с). Справочный пример 2. Этил-1-(2-фторпиридин-3-ил)-5-[(трифторметил)сульфонил]окси-1 Нпиразол-3-карбоксилат К раствору этил-1-(2-фторпиридин-3-ил)-5-гидрокси-1 Н-пиразол-3-карбоксилата (2,0 г) в тетрагидрофуране (20 мл) добавляли триэтиламин (966 мг) и N-фенилбис(трифторметансульфонимид) (3,1 г). После перемешивания при комнатной температуре в течение 15 мин в реакционную смесь добавляли воду и смесь экстрагировали этилацетатом. Экстракт промывали насыщенным раствором соли, сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (элюент: гексан-этилацетат = 19:19:1), получая при этом указанное в заголовке соединение в виде желтого масла (выход 2,1 г, 70%). 1 Н-ЯМР (CDCl3) : 1,43 (3 Н, т, J=7,2 Гц), 4,46 (2 Н, кв, J=7,2 Гц), 6,88 (1 Н, с), 7,40-7,45 (1 Н, м), 7,998,06 (1 Н, м), 8,40-8,43 (1 Н, м). Справочный пример 3. Этил-5-[(4-фторфенил)сульфанил]-1-(2-фторпиридин-3-ил)-1 Н-пиразол-3 карбоксилат Раствор этил-1-(2-фторпиридин-3-ил)-5-[(трифторметил)сульфонил]окси-1 Н-пиразол-3 карбоксилата (353 мг), 4-фторбензолтиола (130 мг) и карбоната натрия (146 мг) в толуоле (5 мл) деаэрировали в достаточной степени. Добавляли трис(дибензилиденацетон)дипалладий(0) (8,4 мг) и 4,5 бис(дифенилфосфино)-9,9-диметилксантен (11 мг) и смесь дополнительно деаэрировали. Смесь перемешивали в атмосфере аргона при 110 С в течение 3 ч, давали охладиться до комнатной температуры, добавляли этилацетат и смесь фильтровали через рыхлый слой силикагеля. Органический слой фильтрата промывали насыщенным раствором соли, сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток подвергали колоночной хроматографии на силикагеле (элюент: гексан-этилацетат=19:12:1), получая при этом указанное в заголовке соединение в виде неочищенного желтого масла (выход 203 мг). Справочный пример 4. Этил-5-[(4-фторфенил)сульфонил]-1-(2-фторпиридин-3-ил)-1 Н-пиразол-3 карбоксилат К раствору неочищенного этил-5-[(4-фторфенил)сульфанил]-1-(2-фторпиридин-3-ил)-1 Н-пиразол-3 карбоксилата (203 мг) в этилацетате (3 мл) добавляли 3-хлорнадбензойную кислоту (596 мг). Смесь перемешивали при комнатной температуре в течение 2 ч, обрабатывали насыщенным водным раствором тиосульфата натрия и экстрагировали этилацетатом. Экстракт промывали водой, насыщенным водным раствором гидрокарбоната натрия и насыщенным раствором соли, сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на основном силикагеле (элюент: гексан-этилацетат = 9:12:1), получая при этом указанное в заголовке соединение в виде бесцветного масла (выход 171 мг, выход по 2 стадиям 47%). 1(170 мг) в тетрагидрофуране (2,5 мл) охлаждали до -78 С и по каплям добавляли 1,5 моль/л раствор (1,2 мл) гидрида диизобутилалюминия в толуоле. Реакционную смесь перемешивали при комнатной температуре в течение 1 ч, обрабатывали раствором (1 моль/л) хлористо-водородной кислоты и экстрагировали этилацетатом. Экстракт промывали водой, насыщенным водным раствором гидрокарбоната натрия и насыщенным раствором соли, сушили над безводным сульфатом натрия и концентрировали при пониженном давлении, получая при этом указанное в заголовке соединение в виде твердого желтого вещества 5-[(4-Фторфенил)сульфонил]-1-(2-фторпиридин-3-ил)-1 Н-пиразол-3-илметанол (135 мг) растворяли в толуоле (2 мл), добавляли диоксид марганца (167 мг) и смесь перемешивали при 100 С в течение 42 ч. Реакционной смеси давали охладиться до комнатной температуры и фильтровали через целит. Фильтрат концентрировали при пониженном давлении и остаток очищали колоночной хроматографией на силикагеле (элюент: гексан-этилацетат=19:13:1), получая при этом указанное в заголовке соединение в виде бесцветного масла (выход 108 мг, 80%). 1 Н-ЯМР (CDCl3) : 7,11-7,21 (2 Н, м), 7,45 (1 Н, ддд, J=7,8, 4,9, 0,9 Гц), 7,53 (1 Н, с), 7,55-7,64 (2 Н, м),7,98 (1 Н, ддд, J=9,1, 7,6, 1,9 Гц), 8,45 (1 Н, дт, J=4,9, 1,5 Гц), 10,00 (1 Н, с). Справочный пример 7. трет-Бутил-(5-[(4-фторфенил)сульфонил]-1-(2-фторпиридин-3-ил)-1 Нпиразол-3-илметил)метилкарбамат К раствору 5-[(4-фторфенил)сульфонил]-1-(2-фторпиридин-3-ил)-1 Н-пиразол-3-карбальдегида (108 мг) в метаноле (2 мл) добавляли хлорид метиламмония (23 мг), безводный сульфат магния (56 мг) и триэтиламин (34 мг). После перемешивания в течение 3 ч при комнатной температуре при охлаждении льдом добавляли борогидрид натрия (14 мг). Растворитель выпаривали при пониженном давлении, к остатку добавляли воду и этилацетат и затем ди-трет-бутилбикарбонат (101 мг). Реакционную смесь распределяли между органическим слоем и водным слоем и отделенный водный слой снова экстрагировали этилацетатом. Экстракт промывали насыщенным раствором соли, сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (элюент: гексан-этилацетат=9:12:1), получая при этом указанное в заголовке соединение в виде бесцветного масла (выход 132 мг, 93%). 1 Н-ЯМР (CDCl3) : 1,49 (9 Н, с), 2,89 (3 Н, ушир.с), 4,45 (2 Н, ушир.с), 7,03 (1 Н, ушир.с), 7,08-7,18 Раствор этил-1-(2-фторпиридин-3-ил)-5-[(трифторметил)сульфонил]окси-1 Н-пиразол-3 карбоксилата (351 мг), 4-метоксибензолтиола (141 мг) и карбоната натрия (146 мг) в толуоле (5 мл) деаэрировали в достаточной степени, добавляли трис(дибензилиденацетон)дипалладий(0) (17 мг) и 4,5 бис(дифенилфосфино)-9,9-диметилксантен (21 мг) и смесь дополнительно деаэрировали. Смесь перемешивали в течение 13 ч в атмосфере аргона при 110 С и давали охладиться до комнатной температуры. Добавляли этилацетат и смесь фильтровали через рыхлый слой силикагеля. Органический слой фильтрата промывали насыщенным раствором соли, сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (элюент: гексан-этилацетат=9:12:1), получая при этом указанное в заголовке соединение в виде неочищенного желтого масла. Справочный пример 9. Этил-1-(2-фторпиридин-3-ил)-5-[(4-метоксифенил)сульфонил]-1 Н-пиразол 3-карбоксилат Соединение синтезировали согласно способу по справочному примеру 4 с применением неочищенного этил-1-(2-фторпиридин-3-ил)-5-[(4-метоксифенил)сульфанил]-1 Н-пиразол-3-карбоксилата вместо неочищенного этил-5-[(4-фторфенил)сульфанил]-1-(2-фторпиридин-3-ил)-1 Н-пиразол-3-карбоксилата Соединение синтезировали согласно способу по справочному примеру 5 с применением этил 1-(2 фторпиридин-3-ил)-5-[(4-метоксифенил)сульфонил]-1 Н-пиразол-3-карбоксилата вместо этил-5-[(4 фторфенил)сульфонил]-1-(2-фторпиридин-3-ил)-1 Н-пиразол-3-карбоксилата (выход 97%). 1 Н-ЯМР (CDCl3) : 1,97-2,05 (1 Н, м), 3,86 (3 Н, с), 4,76 (2 Н, д, J=5,8 Гц), 6,84-6,92 (2 Н, м), 7,08 (1 Н,с), 7,36 (1 Н, ддд, J=7,7, 5,0, 1,1 Гц), 7,43-7,50 (2 Н, м), 7,91 (1 Н, ддд, J=9,2, 7,6, 1,9 Гц), 8,35 (1 Н, дт, J=4,8,1,4 Гц). Справочный пример 11. 1-(2-Фторпиридин-3-ил)-5-[(4-метоксифенил)сульфонил]-1 Н-пиразол-3 карбальдегид Соединение синтезировали согласно способу по справочному примеру 6 с применением 1-(2 фторпиридин-3-ил)-5-[(4-метоксифенил)сульфонил]-1 Н-пиразол-3-илметанола вместо 5-[(4-фторфенил)сульфонил]-1-(2-фторпиридин-3-ил)-1 Н-пиразол-3-илметанола (выход 91%). 1 Н-ЯМР (CDCl3) : 3,87 (3 Н, с), 6,86-6,95 (2 Н, м), 7,39-7,53 (4 Н, м), 7,94-8,05 (1 Н, м), 8,43 (1 Н, д,J=5,0 Гц), 9,99 (1 Н, с). Справочный пример 12. Этил-1-(2-фторпиридин-3-ил)-5-[(3-метилфенил)сульфанил]-1 Н-пиразол-3 карбоксилат Раствор этил-1-(2-фторпиридин-3-ил)-5-[(трифторметил)сульфонил]окси-1 Н-пиразол-3-карбоксилата (575 мг), 3-метилбензолтиола (224 мг) и карбоната натрия (238 мг) в толуоле (7,5 мл) деаэрировали в достаточной степени, добавляли трис(дибензилиденацетон)дипалладий(0) (41 мг) и 4,5 бис(дифенилфосфино)-9,9-диметилксантен (52 мг) и смесь дополнительно деаэрировали. Смесь перемешивали в течение 28 ч в атмосфере аргона при 130 С и давали охладиться до комнатной температуры. Добавляли этилацетат и смесь фильтровали через рыхлый слой основного силикагеля. Фильтрат концентрировали при пониженном давлении и полученный остаток очищали колоночной хроматографией на силикагеле (элюент: гексан-этилацетат=9:12:1), получая при этом указанное в заголовке соединение в виде неочищенного желтого масла (выход 334 мг). Справочный пример 13. Этил-1-(2-фторпиридин-3-ил)-5-[(3-метилфенил)сульфонил]-1 Н-пиразол-3 карбоксилат К раствору неочищенного этил-1-(2-фторпиридин-3-ил)-5-[(3-метилфенил)сульфанил]-1 Н-пиразол 3-карбоксилата (334 мг) в этилацетате (7,5 мл) добавляли 3-хлорнадбензойной кислоты (1,59 г). Смесь перемешивали при комнатной температуре в течение 3 ч, обрабатывали насыщенным водным раствором тиосульфата натрия и экстрагировали этилацетатом. Экстракт промывали водой, насыщенным водным раствором гидрокарбоната натрия и насыщенным раствором соли, сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (элюент: гексан-этилацетат=9:12:1), получая при этом указанное в заголовке соединение в виде бесцветного масла (выход 384 мг, выход по 2 стадиям 62%). 1 Н-ЯМР (CDCl3) : 1,41 (3 Н, т, J=7,2 Гц), 2,35 (3 Н, с), 4,44 (2 Н, кв, J=6,9 Гц), 7,29 (1 Н, с), 7,32-7,41(384 мг) в тетрагидрофуране (5 мл) охлаждали до -78 С, по каплям добавляли раствор 1,5 моль/л (2,6 мл) гидрида диизобутилалюминия в толуоле. Реакционную смесь перемешивали в течение 1 ч при 0 С, обрабатывали раствором (1 моль/л) хлористо-водородной кислоты и смесь экстрагировали этилацетатом. Экстракт промывали водой, насыщенным водным раствором гидрокарбоната натрия и насыщенным раствором соли, сушили над безводным сульфатом натрия и концентрировали при пониженном давлении,получая при этом указанное в заголовке соединение в виде бесцветного масла (выход 320 мг, 94%). 1 Н-ЯМР (CDCl3) : 2,00 (1 Н, ушир.с), 2,34 (3 Н, с), 4,77 (2 Н, д, J=4,2 Гц), 7,15 (1 Н, с), 7,28 (1 Н, с),7,30-7,45 (4 Н, м), 7,91 (1 Н, ддд, J=9,2, 7,5, 1,9 Гц), 8,35 (1 Н, дт, J=4,9, 1,5 Гц). Справочный пример 15. 1-(2-Фторпиридин-3-ил)-5-[(3-метилфенил)сульфонил]-1 Н-пиразол-3 карбальдегидl-(2-Фторпиридин-3-ил)-5-[(3-метилфенил)сульфонил]-1 Н-пиразол-3-илметанол (320 мг) растворяли в толуоле (5 мл), добавляли диоксид марганца (802 мг) и смесь перемешивали при 90 С в течение 4 ч. Реакционной смеси давали охладиться до комнатной температуры и фильтровали через целит. Фильтрат концентрировали при пониженном давлении и остаток очищали колоночной хроматографией на силикагеле (элюент: гексан-этилацетат=9:12:1), получая при этом указанное в заголовке соединение в виде бесцветного масла (выход 266 мг, 83%). 1 Н-ЯМР (CDCl3) : 2,35 (3 Н, с), 7,30 (1 Н, с), 7,32-7,39 (2 Н, м), 7,39-7,49 (2 Н, м), 7,53 (1 Н, с), 7,98(265 мг) в метаноле (4 мл) добавляли хлорид метиламмония (57 мг), безводный сульфат магния (139 мг) и триэтиламин (85 мг). После перемешивания в течение 2 ч при комнатной температуре при охлаждении льдом добавляли борогидрид натрия (35 мг) и смесь перемешивали при комнатной температуре в течение 1 ч. Растворитель выпаривали при пониженном давлении. К остатку добавляли воду и этилацетат и затем ди-трет-бутилбикарбонат (251 мг). Реакционную смесь распределяли между органическим слоем и водным слоем и отделенный водный слой снова экстрагировали этилацетатом. Экстракт промывали насыщенным раствором соли, сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на основном силикагеле (элюент: гексанэтилацетат=9:12:1), получая при этом указанное в заголовке соединение в виде бесцветного масла (выход 302 мг, 85%). 1 Н-ЯМР (CDCl3) : 1,49 (9 Н, с), 2,34 (3 Н, с), 2,90 (3 Н, ушир.с), 4,45 (2 Н, ушир.с), 7,03 (1 Н, ушир.с),7,22-7,48 (5 Н, м), 7,85-7,97 (1 Н, м), 8,34 (1 Н, дт, J=3,3, 1,6 Гц). Справочный пример 17. Этил-5-[(3-бромфенил)сульфанил]-1-(2-фторпиридин-3-ил)-1 Н-пиразол-3 карбоксилат Раствор этил-1-(2-фторпиридин-3-ил)-5-[(трифторметил)сульфонил]окси-1 Н-пиразол-3 карбоксилата (767 мг), 3-бромбензолтиола (567 мг) и карбоната натрия (424 мг) в толуоле (10 мл) деаэрировали в достаточной степени, добавляли трис(дибензилиденацетон)дипалладий(0) (92 мг) и 4,5 бис(дифенилфосфино)-9,9-диметилксантен (116 мг) и смесь дополнительно деаэрировали. Реакционную смесь перемешивали в течение 16 ч в атмосфере аргона при 110 С и давали охладиться до комнатной температуры. Добавляли этилацетат и смесь фильтровали через рыхлый слой основного силикагеля. Фильтрат концентрировали при пониженном давлении и остаток очищали колоночной хроматографией на силикагеле (элюент: гексан-этилацетат=9:12:1), получая при этом указанное в заголовке соединение в виде неочищенного желтого масла (выход 869 мг). Справочный пример 18. Этил-5-[(3-бромфенил)сульфонил]-1-(2-фторпиридин-3-ил)-1 Н-пиразол-3 карбоксилат К раствору неочищенного этил-5-[(3-бромфенил)сульфанил]-1-(2-фторпиридин-3-ил)-1 Н-пиразол 3-карбоксилата (869 мг) в этилацетате (10 мл) добавляли 3-хлорнадбензойную кислоту (2,73 г). Смесь перемешивали при комнатной температуре в течение 3 ч, обрабатывали насыщенным водным раствором тиосульфата натрия и экстрагировали этилацетатом. Экстракт промывали водой, насыщенным водным раствором гидрокарбоната натрия и насыщенным раствором соли, сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на основном силикагеле (элюент: гексан-этилацетат=19:14:1), получая при этом указанное в заголовке соединение в виде бесцветного масла (выход 410 мг, выход по 2 стадиям 45%). 1 Н-ЯМР (CDCl3) : 1,41 (3 Н, т, J=7,2 Гц), 4,45 (2 Н, кв, J=6,9 Гц), 7,31-7,46 (2 Н, м), 7,49-7,55 (1 Н, м),7,60 (1 Н, т, J=1,7 Гц), 7,63 (1 Н, с), 7,77 (1 Н, дкв, J=8,0, 1,0 Гц), 7,90 (1 Н, ддд, J=9,1, 7,6, 1,9 Гц), 8,43 (1 Н,дт, J=4,7, 1,6 Гц). Справочный пример 19. 5-[(3-Бромфенил)сульфонил]-1-(2-фторпиридин-3-ил)-1 Н-пиразол-3 илметанол(467 мг) в тетрагидрофуране (5 мл) охлаждали до -78 С и по каплям добавляли 1,5 моль/л раствор (2,7 мл) гидрида диизобутилалюминия в толуоле. Реакционную смесь перемешивали при 0 С в течение 2 ч,обрабатывали раствором (1 моль/л) хлористо-водородной кислоты и экстрагировали этилацетатом. Экстракт промывали водой, насыщенным водным раствором гидрокарбоната натрия и насыщенным раствором соли, сушили над безводным сульфатом натрия и концентрировали при пониженном давлении, получая при этом указанное в заголовке соединение в виде желтого масла (выход 371 мг, 88%). 1 Н-ЯМР (CDCl3) : 2,19 (1 Н, ушир.с), 4,77 (2 Н, ушир.с), 7,19 (1 Н, с), 7,29-7,43 (2 Н, м), 7,50 (1 Н, дкв,J=8,0, 1,0 Гц), 7,60 (1 Н, т, J=1,9 Гц), 7,69-7,79 (1 Н, м), 7,88 (1 Н, ддд, J=9,1, 7,6, 1,9 Гц), 8,39 (1 Н, дт, J=4,7,1,6 Гц). Справочный пример 20. 5-[(3-Бромфенил)сульфонил]-1-(2-фторпиридин-3-ил)-1 Н-пиразол-3 карбальдегид 5-[(3-Бромфенил)сульфонил]-1-(2-фторпиридин-3-ил)-1 Н-пиразол-3-илметанол (371 мг) растворяли в толуоле (5 мл), добавляли диоксид марганца (626 мг) и смесь перемешивали при 90 С в течение 5 ч. Реакционной смеси давали охладиться до комнатной температуры и фильтровали через целит. Фильтрат концентрировали при пониженном давлении и остаток очищали колоночной хроматографией на силикагеле (элюент: гексан-этилацетат=19:13:1), получая при этом указанное в заголовке соединение в виде бесцветного твердого вещества (выход 280 мг, 76%). 1 Н-ЯМР (CDCl3) : 7,32-7,42 (1 Н, м), 7,42-7,49 (1 Н, м), 7,53 (1 Н, дт, J=7,9, 1,3 Гц), 7,57-7,63 (2 Н, м),7,78 (1 Н, дкв, J=7,9, 1,0 Гц), 7,96 (1 Н, ддд, J=9,1, 7,6, 2,1 Гц), 8,47 (1 Н, дт, J=4,9, 1,5 Гц), 10,01 (1 Н, с). Справочный пример 21. трет-Бутил-(5-[(3-бромфенил)сульфонил]-1-(2-фторпиридин-3-ил)-1 Нпиразол-3-илметил)метилкарбамат К раствору 5-[(3-бромфенил)сульфонил]-1-(2-фторпиридин-3-ил)-1 Н-пиразол-3-карбальдегида (270 мг) в метаноле (3,5 мл) добавляли хлорид метиламмония (49 мг), безводный сульфат магния (119 мг) и триэтиламин (73 мг). После перемешивания в течение 3 ч при комнатной температуре при охлаждении льдом добавляли борогидрид натрия (37 мг) и смесь дополнительно перемешивали при комнатной температуре в течение 1 ч. Растворитель выпаривали при пониженном давлении. К остатку добавляли воду и этилацетат и затем ди-трет-бутилбикарбонат (215 мг). Реакционную смесь разделяли на органический слой и водный слой и отделенный водный слой снова экстрагировали этилацетатом. Экстракт промывали насыщенным раствором соли, сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (элюент: гексанэтилацетат=9:12:1), получая при этом указанное в заголовке соединение в виде бесцветного масла (выход 315 мг, 91%). 1 Н-ЯМР (CDCl3) : 1,49 (9 Н, с), 2,90 (3 Н, ушир.с), 4,46 (2 Н, ушир.с), 7,08 (1 Н, ушир.с), 7,30-7,43 Раствор трет-бутил-(5-[(3-бромфенил)сульфонил]-1-(2-фторпиридин-3-ил)-1 Н-пиразол-3 илметил)метилкарбамата (315 мг) и цианида цинка (107 мг) в диметилформамиде (3 мл) деаэрировали в достаточной степени, добавляли тетракис(трифенилфосфин)палладий(0) (138 мг) и смесь дополнительно деаэрировали. После перемешивания в атмосфере аргона при 110 С в течение 2 ч реакционной смеси давали охладиться до комнатной температуры, промывали водой и насыщенным раствором соли, сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (элюент: гексан-этилацетат=9:12:1), получая при этом указанное в заголовке соединение в виде желтого масла (выход 247 мг, 87%). 1 Н-ЯМР (CDCl3) : 1,50 (9 Н, с), 2,91 (3 Н, ушир.с), 4,47 (2 Н, ушир.с), 7,13 (1 Н, ушир.с), 7,42 (1 Н, дд,J=7,9, 4,9 Гц), 7,57-7,67 (1 Н, м), 7,70-7,83 (2 Н, м), 7,85-8,00 (2 Н, м), 8,41 (1 Н, дт, J=4,9, 1,3 Гц). Пример 1. Гидрохлорид 1-1-(2-фторпиридин-3-ил)-5-[(3-метилфенил)сульфонил]-1 Н-пиразол-3 ил-N-метилметанамина трет-Бутил-(1-(2-фторпиридин-3-ил)-5-[(3-метилфенил)сульфонил]-1 Н-пиразол-3-илметил)метилкарбамат (302 мг) растворяли в этилацетате (2 мл) и 2-пропаноле (1 мл), добавляли раствор (4 моль/л) хлористого водорода в этилацетате (3 мл). После перемешивания при комнатной температуре в течение 2 ч реакционную смесь концентрировали при пониженном давлении. Остаток перекристаллизовывали из этанола, получая при этом указанное в заголовке соединение в виде бесцветных кристаллов (выход 216 мг, 83%). Точка плавления 202-205 С. 1 Н-ЯМР (ДМСО-d6) : 2,32 (3 Н, с), 2,59 (3 Н, с), 4,25 (2 Н, с), 7,25 (1 Н, с), 7,34-7,41 (1 Н, м), 7,46-7,53 трет-Бутил-(5-[(3-цианофенил)сульфонил]-1-(2-фторпиридин-3-ил)-1 Н-пиразол-3-илметил)метилкарбамат (247 мг) растворяли в этилацетате (2 мл) и 2-пропаноле (1 мл) и добавляли раствор (4 моль/л) хлористого водорода в этилацетате (3 мл). После перемешивания при комнатной температуре в течение 3 ч реакционную смесь концентрировали при пониженном давлении и остаток перекристаллизовывали из смешанного растворителя этанола с водой, получая при этом указанное в заголовке соединение в виде бесцветных кристаллов (выход 184 мг, выход 86%). Точка плавления 237-240 С. 1 Н-ЯМР (ДМСО-d6) : 2,60 (3 Н, с), 4,26 (2 Н, с), 7,58-7,67 (2 Н, м), 7,79-7,88 (1 Н, м), 7,88-7,96 (1 Н, м),8,04 (1 Н, т, J=1,7 Гц), 8,14 (1 Н, ддд, J=9,6, 7,7, 2,1 Гц), 8,28 (1 Н, дт, J=7,6, 1,3 Гц), 8,47-8,58 (1 Н, м), 9,25(2 Н, ушир.с). Экспериментальный пример 1. Испытание ингибиторной активности в отношении водороднокалиевой аденозинтрифосфатазы (Н+, K+-АТФазы). Согласно способу, описанному в публикации Wallmark и др. [Biochim. Biophys. Acta, 728, 31(1983)], микросомальную фракцию слизистой оболочки желудка получали из желудка свиньи. Сначала желудок удаляли, промывали водопроводной водой, окунали в раствор (3 моль/л) хлорида натрия и протирали поверхность слизистой оболочки бумажным полотенцем. Слизистую оболочку желудка удаляли,измельчали и гомогенизировали в растворе (0,25 моль/л) сахарозы (рН 6,8), содержащем 1 ммоль/л ЭДТК и 10 ммоль/л буферного раствора трис-хлористо-водородная кислота, с применением гомогенизатора тканей Polytron (Kinematica). Полученный гомогенат центрифугировали при 20000g в течение 30 мин и в течение 90 мин центрифугировали надосадочную жидкость при 100000g. Осадок суспендировали в растворе (0,25 моль/л) сахарозы, суспензию добавляли в раствор (0,25 моль/л) сахарозы, содержащий 7,5% Фиколла, и центрифугировали при 100000g в течение 5 ч. Фракцию, содержащую поверхность раздела между обоими слоями, извлекали и промывали раствором (0,25 моль/л) сахарозы при центрифугировании. Полученную микросомальную фракцию применяли в качестве препаратов водородно-калиевой аденозинтрифосфатазы. К 50 ммоль/л буфера HEPES-Трис (5 ммоль/л хлорида магния, 10 ммоль/л хлорида калия, 10 мкмоль/л валиномицина, рН 6,5, 40 мкл), содержащего 2,5 мкг/мл ферментного препарата на основе концентрированного белка, добавляли испытуемое соединение (5 мкл), растворенное в 10%-м растворе диметилсульфоксида, и инкубировали смесь при 37 С в течение 30 мин. К исходной ферментсодержащей реакционной смеси добавляли солевой раствор (2 ммоль/л) Трис-аденозинтрифосфата (50 ммоль/л буфера HEPES-Трис (5 ммоль/л хлорида магния, рН 6,5), 5 мкл). Ферментативную реакцию проводили при 37 С в течение 20 мин и затем для прекращения реакции добавляли раствор малахитового зеленого(смесь 0,12%-ного сульфатного раствора малахитового зеленого (2,5 моль/л), 7,5% молибдата аммония и 11% Tween 20 в отношении 100:25:2, 15 мкл). Реакционную смесь выдерживали при комнатной температуре в течение 15 мин и полученный продукт реакции, содержащий неорганический фосфор и малахитовый зеленый, измеряли с помощью колориметрического количественного анализа при длине волны 610 нм. Кроме того, в реакционном растворе, не содержащем хлорида калия, также аналогичным образом измеряли количество неорганической фосфорной кислоты, такое же значение получали в присутствии хлорида калия, тем самым, измеряя активность водородно-калиевой аденозинтрифосфатазы. Степень ингибирования (%) определяли из значения активности контрольного образца и активности образца испытуемого соединения при каждой концентрации и определяли 50% ингибирующую концентрацию(IC50) в отношении водородно-калиевой аденозинтрифосфатазы. Результаты приведены в таблице. Экспериментальный пример 2. Значение pKa рассчитывали с применением пакета программ Physchem Batch (Ver. 10) компании Advanced Chemistry Development, Inc. Результаты приведены в таблице. Экспериментальный пример 3. Испытание на содержание АТФ. Линию клеток HepG2 гепатоцеллюлярной карциномы человека (АТСС No.HB-8065) выдерживали и пересевали при 5% СО 2, 37 С в модифицированной по способу Дульбекко среде Игла (DMEM;Invitrogen), содержащей 10% фетальной бычьей сыворотки (FBS; TRACE SCIENTIFIC LTD.), 1 ммоль/л пирувата натрия (Invitrogen), 2 ммоль/л L-глутамина (Invitrogen), 50 IU/мл пенициллина (Invitrogen), 50 мкг/мл стрептомицина (Invitrogen). Испытуемый реагент готовили в ДМСО до содержания 10 мМ и разбавляли средой DMEM, содержащей 0,5% FBS, 1 ммоль/л пирувата натрия, 2 ммоль/л L-глутамина, 50IU/мл пенициллина, 50 мкг/мл стрептомицина, до конечной концентрации ДМСО 0,1%. Клетки HepG2(2104 клеток/лунку) культивировали в 96-луночном белом планшете (Costar) вместе с испытуемым реагентом при 5% СО 2 и 37 С. После культивирования в течение одного дня измеряли внутриклеточное содержание АТФ с помощью ATPLite (PerkinElmer Life Sciences). Результаты приведены в таблице в ви- 20019853 де относительного значения (%) к контрольному образцу (без соединения) при 100 мкм (п 3, среднеестандартное отклонение). Экспериментальный пример 4. Испытание активности каспазы-3/7. Клетки культивировали в течение одного дня согласно способу по экспериментальному примеру 3 и измеряли активность внутриклеточной каспазы-3/7 с помощью анализа Caspase-Glo-3/7 (Promega). Результаты приведены в таблице в виде относительной активности (%) каждого испытуемого реагента, когда максимальное значение активности каспазы-3/7 на воздействие стауроспорина принималось за 100%,а активность без добавления испытуемого реагента принималась за 0% (n3, среднеестандартное отклонение). Экспериментальный пример 5. Испытание на подавление стимулированной гистамином секреции кислоты с использованием анестезированных крыс Jcl 7-недельного возраста. Самцам крысы SD не давали пищи в течение около 24 ч и использовали их в эксперименте. При уретановой (1,2 г/кг, интраперитонеально) анестезии делали разрез брюшной полости вдоль средней линии спины и лигировали пилорическое кольцо. Внутривенно вводили испытуемое соединение (1 мг/кг),зашивали разрез брюшной стенки и подкожно вводили дигидрохлорид гистамина (30 мг/кг/10 мл), растворенный в физиологическом растворе. Спустя 3 ч после введения гистамина крыс умерщвляли с применением газообразного диоксида углерода. Желудок выделяли и собирали накопившуюся желудочную жидкость. Измеряли количество желудочной жидкости, уровень кислоты измеряли с применением устройства для титрования кислоты СОМ-555 (HIRANUMA SANGYO Co., Ltd.), и полученный результат принимали за уровень секреции кислоты. Степень подавления секреции кислоты при применении испытуемого соединения определяли из сравнения с контрольным образцом. Результаты приведены в таблице. Из результатов таблицы ясно, что соединение (I) согласно настоящему изобретению обладает превосходной ингибиторной активностью в отношении Н+/K+-АТФазы и более низким значением pKa и демонстрирует крайне низкую цитотоксичность даже при высоких концентрациях. Кроме того, путем внутривенного введения крысам было подтверждено его сильное подавляющее действие на секрецию кислоты. Промышленная применимость Соединение (I) согласно настоящему изобретению демонстрирует превосходное ингибирующее действие в отношении протонной помпы. Общепринятые ингибиторы протонной помпы, такие как омепразол, лансопразол и т.п., в кислой среде париетальных клеток желудка подвергаются превращению в активные формы, образуют ковалентную связь с цистеиновым остатком Н+/K+-АТФазы и необратимо ингибируют активность фермента. В отличие от этого соединение (I) ингибирует активность протонной помпы (Н+/K+-АТФазу) обратимым образом с помощью K+-конкурентного способа ингибирования и поэтому подавляет секрецию кислоты. Следовательно, иногда его называют калий-конкурентным блокатором кислоты (Р-САВ) или антагонистом кислотной помпы (АРА). Соединение (I) оказывает быстрое воздействие, демонстрирует максимальную эффективность после первичного введения и демонстрирует меньшую зависимость от генетического полиморфизма (меньшую изменчивость результатов среди пациентов). Кроме того, поскольку оно содержит заместители R2 и R3, соответственно, в м-положении и пположении фенильной группы, оно может дополнительно улучшать фармакокинетику и одновременно может обеспечивать более сильное фармакологическое воздействие и более низкое цитотоксическое воздействие по сравнению с известными соединениями, обладающими ингибирующим действием в отношении протонной помпы. Соответственно, настоящее изобретение может обеспечивать клинически применимое средство для профилактики или лечения язвенной болезни (например, язвы желудка, язвы двенадцатиперстной кишки, анастомотической язвы, язвы, вызванной нестероидным противовоспалительным лекарственным средством, язвы, обусловленной послеоперационным стрессом и т.д.), синдрома Золлингера-Эллисона, гастрита, эрозивного эзофагита, рефлюксного эзофагита, симптоматической гастроэзофагеальной рефлюксной болезни (симптоматической ГЭРБ), пищевода Барретта, функциональной диспепсии, рака желудка, MALT-лимфомы желудка или гиперкислотности; или средство для подавления кровотечения из верхних отделов желудочно-кишечного тракта, обусловленного язвенной болезнью,острой стрессовой язвой, геморрагическим гастритом или инвазивным стрессом и т.п. Поскольку соединение (I) демонстрирует низкую токсичность и превосходную водорастворимость, кинетику in vivo и выраженную эффективность, оно применимо в виде фармацевтической композиции. Поскольку соединение (I) стабильно даже в кислотных условиях, его можно вводить перорально в виде обычной таблетки и т.п. без того, чтобы использовать в составе препарата, покрытого кишечнорастворимой оболочкой. Из этого вытекает такое полезное следствие, что препарат (таблетку и т.п.) можно изготавливать более мелкого размера, и препарат может легко проглатываться пациентами, имеющими затрудненное глотание,особенно людьми пожилого возраста и детьми. Кроме того, поскольку препарат не обладает эффектом замедленного высвобождения, который предусмотрен для препаратов, покрытых кишечнорастворимой оболочкой, проявление ингибирующего действия на секрецию кислоты желудочного сока является быстрым, и можно быстро облегчать симптомы, такие как боль и т.п. Данная заявка основана на патентной заявке 2009-077078, поданной в Японии, содержание которой включено в настоящий документ в полном объеме. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение, представленное формулой (I) где R1 представляет собой атом фтора, R2 представляет собой метильную группу или цианогруппу и R3 представляет собой атом водорода, или его соль. 2. 1-1-(2-Фторпиридин-3-ил)-5-[(3-метилфенил)сульфонил]-1 Н-пиразол-3-ил-N-метилметанамин или его соль. 3. 3-(1-(2-Фторпиридин-3-ил)-3-[(метиламино)метил]-1 Н-пиразол-5-илсульфонил)бензонитрил или его соль. 4. Лекарственное средство, содержащее соединение по п.1 или его соль. 5. Лекарственное средство по п.4, которое представляет собой ингибитор секреции кислоты. 6. Лекарственное средство по п.4, которое представляет собой калий-конкурентный блокатор кислоты. 7. Лекарственное средство по п.4, которое представляет собой средство для профилактики или лечения язвенной болезни, синдрома Золлингера-Эллисона, гастрита, рефлюксного эзофагита, симптоматической гастроэзофагеальной рефлюксной болезни (симптоматической ГЭРБ), пищевода Барретта,функциональной диспепсии, рака желудка, MALT-лимфомы желудка, язвы, вызванной нестероидным противовоспалительным лекарственным средством, или гиперкислотности или язвы, обусловленной послеоперационным стрессом; или представляет собой средство для подавления кровотечения из верхних отделов желудочно-кишечного тракта, обусловленного язвенной болезнью, острой стрессовой язвой,геморрагическим гастритом или инвазивным стрессом. 8. Способ профилактики или лечения язвенной болезни, синдрома Золлингера-Эллисона, гастрита,рефлюксного эзофагита, симптоматической гастроэзофагеальной рефлюксной болезни (симптоматической ГЭРБ), пищевода Барретта, функциональной диспепсии, рака желудка, MALT-лимфомы желудка,язвы, вызванной нестероидным противовоспалительным лекарственным средством, или гиперкислотности или язвы, обусловленной послеоперационным стрессом; или способ подавления кровотечения из верхних отделов желудочно-кишечного тракта, обусловленного язвенной болезнью, острой стрессовой язвой, геморрагическим гастритом или инвазивным стрессом, включающий в себя введение млекопитающему эффективного количества соединения по п.1 или его соли. 9. Применение соединения по п.1 или его соли для производства средства, предназначенного для профилактики или лечения язвенной болезни, синдрома Золлингера-Эллисона, гастрита, рефлюксного эзофагита, симптоматической гастроэзофагеальной рефлюксной болезни (симптоматической ГЭРБ), пищевода Барретта, функциональной диспепсии, рака желудка, MALT-лимфомы желудка, язвы, вызванной нестероидным противовоспалительным лекарственным средством, или гиперкислотности или язвы, обусловленной послеоперационным стрессом; или средства для подавления кровотечения из верхних отделов желудочно-кишечного тракта, обусловленного язвенной болезнью, острой стрессовой язвой, геморрагическим гастритом или инвазивным стрессом. Евразийская патентная организация, ЕАПВ Россия, 109012, Москва, Малый Черкасский пер., 2
МПК / Метки
МПК: A61K 31/4439, A61P 1/04, C07D 401/04
Метки: производные, 1-(пиридин-3-ил)-3-метиламинометил-5-фенилсульфонилпиразола
Код ссылки
<a href="https://eas.patents.su/23-19853-proizvodnye-1-piridin-3-il-3-metilaminometil-5-fenilsulfonilpirazola.html" rel="bookmark" title="База патентов Евразийского Союза">Производные 1-(пиридин-3-ил)-3-метиламинометил-5-фенилсульфонилпиразола</a>
Предыдущий патент: Надувное изделие, образуемое газонепроницаемым слоем на основе двух термопластичных эластомеров
Следующий патент: Универсальная кроватная вставка, содержащая надувной матрас, соединенный с герметичными клапанами, и способ ее изготовления
Случайный патент: Способ и устройство получения информации о внутренней структуре объекта и способ создания изображения объекта