Способ получения пирролидиноксимов
Формула / Реферат
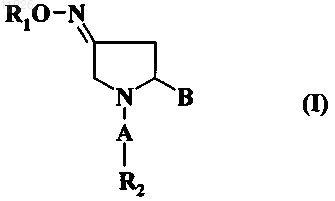
1. Способ получения соединения формулы (I)
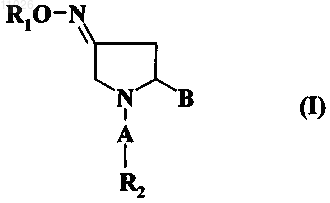
в которой А обозначает карбонильную группу -(С=O)-;
В выбран из группы, включающей оксадиазольное кольцо, амидогруппу формулы -(C=O)-NR3R4 и
-(CH2)n-X-R8;
в которой оксадиазольное кольцо описывается любой из формул
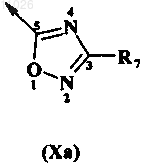
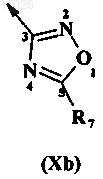
R1 обозначает Н или C1-C6-алкил;
R2 выбран из группы, включающей арил, гетероарил и насыщенный или ненасыщенный 3-8-членный циклоалкил;
R3 и R4 независимо выбраны из группы, включающей водород, C1-C6-алкил, С2-C6-алкенил, C2-C6-алкинил, алкоксигруппу, сульфанил, ацил, алкоксикарбонил, аминокарбонил, насыщенный или ненасыщенный 3-8-членный циклоалкил, который может содержать 1-3 гетероатома, выбранных из группы, включающей N, О, S, арил, гетероарил, C1-C6-алкиларил и C1-C6-алкилгетероарил;
X обозначает О или NR9;
R8 выбран из группы, включающей водород, C1-C6-алкил, C1-C6-алкиларил, гетероарил, C1-C6-алкилгетероарил, C2-C6-алкенил, C2-C6-алкениларил, C2-C6-алкенилгетероарил, C2-C6-алкинил, C2-C6-алкиниларил, C2-C6-алкинилгетероарил, C3-C8-циклоалкил, гетероциклоалкил, C1-C6-алкилциклоалкил, C1-C6-алкилгетероциклоалкил, C1-C6-алкилкарбоксигруппу, ацил, C1-C6-алкилацил, C1-C6-алкилацилоксигруппу, C1-C6-алкилалкоксигруппу, алкоксикарбонил, C1-C6-алкилалкоксикарбонил, аминокарбонил, C1-C6-алкиламинокарбонил, C1-C6-алкилациламиногруппу, C1-C6-алкилуреидогруппу, аминогруппу, C1-C6-алкиламиногруппу, сульфонилоксигруппу, C1-C6-алкилсульфонилоксигруппу, сульфонил, C1-C6-алкилсульфонил, сульфинил, C1-C6-алкилсульфинил, C1-C6-алкилсульфанил и C1-C6-алкилсульфониламиногруппу;
R7 выбран из группы, включающей водород, сульфонил, аминогруппу, C1-C6-алкил, C2-C6-алкенил, C2-C6-алкинил, где указанные алкильные, алкенильные, алкинильные цепи необязательно включают гетероатом, выбранный из группы, включающей N, О и S, арил, гетероарил, насыщенный или ненасыщенный 3-8-членный циклоалкил, гетероциклоалкил, где указанные циклоалкильные, гетероциклоалкильные, арильные или гетероарильные группы необязательно сконденсированы еще с 1-2 циклоалкильными, гетероциклоалкильными, арильными или гетероарильными группами, ацильный фрагмент, C1-C6-алкиларил, C1-C6-алкилгетероарил, C1-C6-алкениларил, C1-C6-алкенилгетероарил, C1-C6-алкиниларил, C1-C6-алкинилгетероарил, C1-C6-алкилциклоалкил, C1-C6-алкилгетероциклоалкил, C1-C6-алкенилциклоалкил, C1-C6-алкенилгетероциклоалкил, C1-C6-алкинилциклоалкил, C1-C6-алкинилгетероциклоалкил, алкоксикарбонил, аминокарбонил, C1-C6-алкилкарбоксигруппу, C1-C6-алкилацил, C1-C6-алкилацилоксигруппу, C1-C6-алкилалкоксигруппу, C1-C6-алкилалкоксикарбонил, C1-C6-алкиламинокарбонил, C1-C6-алкилациламиногруппу, C1-C6-алкилуреидогруппу, C1-C6-алкиламиногруппу, C1-C6-алкиламмониевую группу, C1-C6-алкилсульфонилоксигруппу, C1-C6-алкилсульфонил, C1-C6-алкилсульфинил, С1-C6-алкилсульфанил, C1-C6-алкилсульфониламиногруппу, C1-C6-алкиламиносульфонил, гидроксигруппу, галоген и цианогруппу;
R9 выбран из группы, включающей водород, C1-C6-алкил, C1-C6-алкиларил, С1-C6-алкилгетероарил, арил и гетероарил;
R8 и R9 совместно с атомом N, с которым они связаны, могут образовать пяти-восьмичленное насыщенное или ненасыщенное гетероциклоалкильное кольцо; и
n является целым числом, равным от 1 до 3;
где "арил" означает ненасыщенную ароматическую карбоциклическую группу, содержащую от 6 до 14 атомов углерода, включающую одно кольцо или несколько конденсированных колец,
"гетероарил" означает моноциклическую гетероароматическую группу или бициклическую или трициклическую гетероароматическую группу, содержащую конденсированные кольца,
"гетероциклоалкил" означает C3-C8-циклоалкильную группу, в которой вплоть до 3 атомов углерода заменены гетероатомами, выбранными из группы, включающей О, S, NR, где R обозначает водород или метил,
"ацил" означает группу -C(O)R, в которой R означает "C1-C6-алкил", "арил", "гетероарил", "C3-C8-циклоалкил", "гетероциклоалкил", "C1-C6-алкиларил" или "C1-C6-алкилгетероарил",
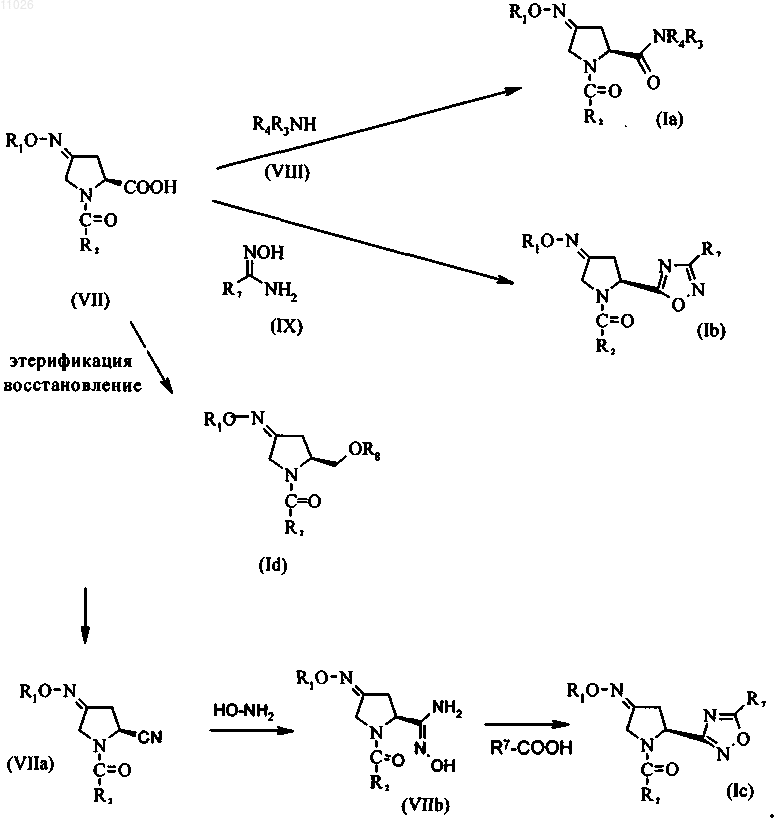
указанный способ включает следующие стадии:
стадия 1: превращение пирролидина формулы (II) в ацилпроизводное формулы (IV) с использованием ацилирующего реагента (III)
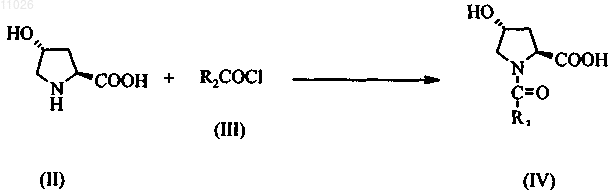
стадия 2: окисление ацилпроизводного (IV) окислительным реагентом с получением пирролидона формулы (V)

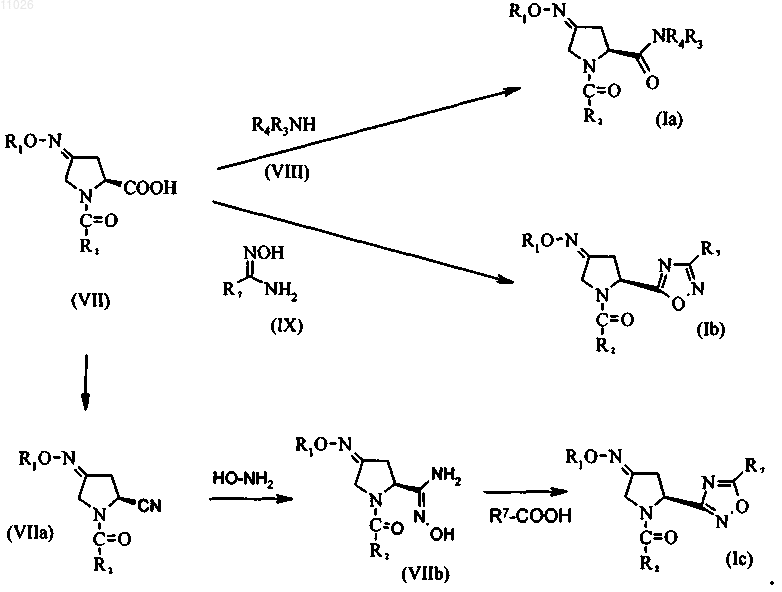
стадия 3: превращение пирролидона формулы (V) в соединение (VII) с использованием подходящего алкоксиламина, арилоксиламина или гидроксиламина общей формулы (VI)

стадия 4: превращение соединения (VII) с помощью амина общей формулы (VIII) или N-гидроксиамидина общей формулы (IX) с получением соединений (Ia) и (Ib) или превращение соединения (VII) сначала в нитрил (VIIa), который затем превращают в гидроксиамидин (VIIb), который затем вводят в реакцию с карбоновой кислотой R7-СООН и получают соединение (Ic), или сначала проведение этерификации и последующего восстановления соединения (VII) с использованием подходящего этерифицирующего или восстановительного реагента соответственно с получением соединения (Id)
2. Способ получения соединения формулы (I) по п.1
в которой А обозначает карбонильную группу -(С=O)-;
В обозначает амидогруппу формулы -(C=O)-NR3R4 или оксадиазольное кольцо, описываемое любой из формул
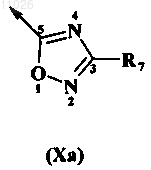
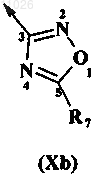
R7 выбран из группы, включающей водород, сульфонил, аминогруппу, C1-C6-алкил, C2-C6-алкенил, C2-C6-алкинил, где указанные алкильные, алкенильные, алкинильные цепи необязательно включают гетероатом, выбранный из группы, включающей N, О и S, арил, гетероарил, насыщенный или ненасыщенный 3-8-членный циклоалкил, гетероциклоалкил, уфх указанные циклоалкильные, гетероциклоалкильные, арильные или гетероарильные группы необязательно сконденсированы еще с 1-2 циклоалкильными, гетероциклоалкильными, арильными или гетероарильными группами, ацильный фрагмент, C1-C6-алкиларил, C1-C6-алкилгетероарил, C1-C6-алкениларил, C1-C6-алкенилгетероарил, C1-C6-алкиниларил, C1-C6-алкинилгетероарил, C1-C6-алкилциклоалкил, C1-C6-алкилгетероциклоалкил, C1-C6-алкенилциклоалкил, C1-C6-алкенилгетероциклоалкил, C1-C6-алкинилциклоалкил, C1-C6-алкинилгетероциклоалкил, алкоксикарбонил, аминокарбонил, C1-C6-алкилкарбоксигруппу, C1-C6-алкилацил, C1-C6-алкилацилоксигруппу, C1-C6-алкилалкоксигруппу, C1-C6-алкилалкоксигруппу-карбонил, C1-C6-алкиламинокарбонил, C1-C6-алкилациламиногруппу, C1-C6-алкилуреидогруппу, C1-C6-алкиламиногруппу, C1-C6-алкиламмониевую группу, C1-C6-алкилсульфонилоксигруппу, C1-C6-алкилсульфонил, C1-C6-алкилсульфинил, С1-C6-алкилсульфанил, C1-C6-алкилсульфониламиногруппу, C1-C6-алкиламиносульфонил, гидроксигруппу, галоген и цианогруппу;
R1 обозначает Н или C1-C6-алкил;
R2 выбран из группы, включающей арил, гетероарил и насыщенный или ненасыщенный 3-8-членный циклоалкил;
R3 и R4 независимо выбраны из группы, включающей водород, C1-C6-алкил, C2-C6-алкенил, C2-C6-алкинил, алкоксигруппу, сульфанил, ацил, алкоксикарбонил, аминокарбонил, насыщенный или ненасыщенный 3-8-членный циклоалкил, который может содержать 1-3 гетероатома, выбранных из группы, включающей N, О, S, арил, гетероарил, C1-C6-алкиларил и C1-C6-алкилгетероарил;
указанный способ включает следующие стадии:
стадия 1: превращение пирролидина формулы (II) в ацилпроизводное формулы (IV) с использованием ацилирующего реагента (III)
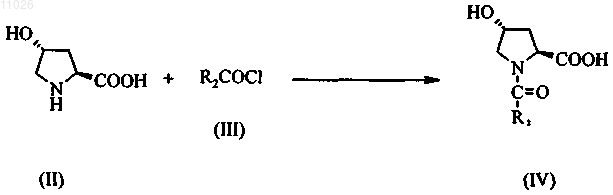
стадия 2: окисление ацилпроизводного (IV) окислительным реагентом с получением пирролидона формулы (V)

стадия 3: превращение пирролидона формулы (V) в соединение (VII) с использованием подходящего алкоксиламина, арилоксиламина или гидроксиламина общей формулы (VI)

стадия 4: превращение соединения (VII) с помощью амина общей формулы (VIII) или N-гидроксиамидина общей формулы (IX) с получением соединений (Ia) и (Ib), или превращение соединения (VII) сначала в нитрил (VIIa), который затем превращают в гидроксиамидин (VIIb), который затем вводят в реакцию с карбоновой кислотой R7-СООН и получают соединение (Ic)
3. Способ по п.1 или 2, в котором ацилхлорид, применяющийся на стадии 1, представляет собой 1'1-бифенил-4-карбонилхлорид или 2'-метил-1'1-бифенил-4-карбонилхлорид.
4. Способ по любому из пп.1-3, в котором окислительный реагент, применяющийся на стадии 2, представляет собой комплекс пиридин-триоксид серы (Ру-SO3) в комбинации с ДМСО.
5. Способ по любому из пп.2-4, в котором реакцию проводят в присутствии триэтиламина.
6. Способ по любому из пп.1-5, в котором алкоксиламин, применяющийся на стадии 3, представляет собой О-метилгидроксиламингидрохлорид.
7. Способ по любому из пп.1-6, в котором R1 обозначает метильную группу, R2 обозначает бифенил.
8. Способ по любому из пп.1-7, в котором В обозначает амидогруппу формулы -(C=O)NHR5, где R5 обозначает C1-C6-алкиларильную группу.
9. Способ по п.8, в котором R5 обозначает фенилэтильную группу, которая замещена аминогруппой или гидроксигруппой.
10. Способ по любому из пп.1-7, в котором В обозначает 1,2,4-оксадиазольный заместитель
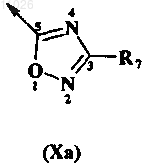
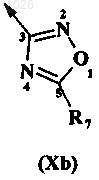
где R7 обозначает C1-C6-алкил или циклоалкил, необязательно содержащий 1 или 2 гетероатома.
11. Способ по любому из пп.1, 3, 4 или 6, 7, в котором В обозначает -(CH2)n-X-R8, где X обозначает О, R8 обозначает водород и n равно 1.
12. Способ по любому из пп.1-11, в котором соединение выбрано из группы, включающей
(2S,4E и 4Z)-N-[(2S)-2-гидрокси-2-фенилэтил]-4-(метоксиимино)-1-[(2'-метил[1,1'-бифенил]-4-ил) карбонил]-2-пирролидинкарбоксамид,
(3E,5S)-1-([1,1'-бифенил]-4-илкарбонил)-5-[3-(2-гидроксиэтил)-1,2,4-оксадиазол-5-ил]-3-пирролидинон-O-метилоксим,
(3Z,5S)-1-([1,1'-бифенил]-4-илкарбонил)-5-[3-(2-гидроксиэтил)-1,2,4-оксадиазол-5-ил]-3-пирролидинон-O-метилоксим,
(3E,5S)-5-[3-(2-гидроксиэтил)-1,2,4-оксадиазол-5-ил]-1-[(2'-метилбифенил-4-ил)карбонил]пирролидин-3-он-O-метилоксим,
(3E,5S)-5-[3-(2-гидроксиэтил)-1,2,4-оксадиазол-5-ил]-1-[(2'-метилбифенил-4-ил)карбонил]пирролидин-3-он-O-метилоксим,
(3EZ,5S)-1-([1,1'-бифенил]-4-илкарбонил)-5-{5-[(диметиламино)метил]-1,2,4-оксадиазол-3-ил-3-пирролидинон-О-метилоксим,
(3Z,5S)-1-([1,1'-бифенил]-4-илкарбонил)-5-{5-[(диметиламино)метил]-1,2,4-оксадиазол-3-ил}-3-пирролидинон-О-метилоксим,
(3E,5S)-1-([1,1'-бифенил]-4-илкарбонил)-5-{5-[(диметиламино)метил]-1,2,4-оксадиазол-3-ил}-3-пирролидинон-О-метилоксим,
(3EZ,5S)-5-{5-[(диметиламино)метил]-1,2,4-оксадиазол-3-ил}-1-[(2'-метилбифенил-4-ил)карбонил]пирролидин-3-он-O-метилоксим,
(3Z,5S)-5-{5-[(диметиламино)метил]-1,2,4-оксадиазол-3-ил}-1-[(2'-метилбифенил-4-ил)карбонил]пирролидин-3-он-О-метилоксим,
(3E,5S)-5-{5-[(диметиламино)метил]-1,2,4-оксадиазол-3-ил}-1-[(2'-метилбифенил-4-ил)карбонил]пирролидин-3-он-O-метилоксим и
(3Z/E,5S)-1-(бифенил-4-илкарбонил)-(5-гидроксиметил)пирролидин-3-он-О-метилоксим.
Текст
011026 Краткое содержание изобретения Настоящее изобретение относится к новому способу синтеза пирролидиноксимов общей формулы(I). Соединения применимы при лечении и/или предупреждении преждевременных родов, рождения недоношенного ребенка и дисменореи. Область техники, к которой относится изобретение Настоящее изобретение относится к новому способу синтеза пирролидиноксимов общей формулы где А обозначает карбонильную группу -(С=O)-; В выбран из группы, включающей замещенное и незамещенное оксадиазольное кольцо, амидогруппу формул -(C=O)-NR3R4 и -(CH2)n-X-R8;R2 выбран из группы, включающей или содержащей незамещенный или замещенный арил, незамещенный или замещенный гетероарил, незамещенный или замещенный насыщенный или ненасыщенный 3-8-членный циклоалкил. Более предпочтительной является арильная, в особенности фенильная группа,которая необязательно замещена, например, другой фенильной группой (с образованием бифенильного фрагмента);R3 и R4 независимо выбраны из группы, включающей или содержащей водород, незамещенный или замещенный C1-C6-алкил, незамещенный или замещенный C2-C6-алкенил, незамещенный или замещенный C2-C6-алкинил, незамещенную или замещенную алкоксигруппу, незамещенный или замещенный сульфанил, ацил, алкоксикарбонил, аминокарбонил, незамещенный или замещенный насыщенный или ненасыщенный 3-8-членный циклоалкил, который может содержать 1-3 гетероатома, выбранных из группы, включающей N, О, S, незамещенный или замещенный арил, незамещенный или замещенный гетероарил, незамещенный или замещенный C1-C6-алкиларил, незамещенный или замещенный C1-C6 алкилгетероарил;R8 и R9 совместно с атомом N, с которым они связаны, могут образовать 5-8-членное насыщенное или ненасыщенное гетероциклоалкильное кольцо;n является целым числом, равным от 1 до 3. Предпочтительными производными пирролидина являются такие соединения формулы (I), в которых R1 обозначает метильную группу, R2 обозначает замещенный или незамещенный бифенил. В контексте одного предпочтительного варианта осуществления В обозначает амидогруппу формулы -(C=O)NHR5, в которой R5 обозначает незамещенную или замещенную C1-C6-алкиларильную группу,например, фенилэтильную группу, которая необязательно замещена гидрофильными фрагментами,включая аминогруппу и гидроксигруппу. В контексте другого предпочтительного варианта осуществления заместитель В обозначает 1,2,4 оксадиазольный заместитель, который может быть присоединен к пирролидиновому кольцу по приведенным ниже схемам (Ха) или (Xb) В указанных формулах (Ха) и (Xb) R7 выбран из группы, включающей или содержащей водород,сульфонил, аминогруппу, незамещенный или замещенный C1-C6-алкил, незамещенный или замещенныйC2-C6-алкенил, незамещенный или замещенный C2-C6-алкинил, где указанные алкильные, алкенильные,алкинильные цепи могут включать гетероатом, выбранный из группы, включающей N, О и S, незамещенный или замещенный арил, незамещенный или замещенный гетероарил, незамещенный или замещенный насыщенный или ненасыщенный 3-8-членный циклоалкил, незамещенный или замещенный гетероциклоалкил, где указанные циклоалкильные, гетероциклоалкильные, арильные или гетероарильные группы могут быть сконденсированы еще с 1-2 циклоалкильными, гетероциклоалкильными, арильными или гетероарильными группами, ацильный фрагмент, незамещенный или замещенный C1-C6-алкиларил,незамещенный или замещенный C1-C6-алкилгетероарил, незамещенный или замещенный C1-C6 алкениларил, незамещенный или замещенный C1-C6-алкенилгетероарил, незамещенный или замещенныйC1-C6-алкиниларил, незамещенный или замещенный C1-C6-алкинилгетероарил, незамещенный или замещенный C1-C6-алкилциклоалкил, незамещенный или замещенный C1-C6-алкилгетероциклоалкил, незамещенный или замещенный C1-C6-алкенилциклоалкил, незамещенный или замещенный C1-C6 алкенилгетероциклоалкил, незамещенный или замещенный C1-C6-алкинилциклоалкил, незамещенный или замещенный C1-C6-алкинилгетероциклоалкил, замещенный или незамещенный алкоксикарбонил,замещенный или незамещенный аминокарбонил, замещенную или незамещенную C1-C6 алкилкарбоксигруппу, замещенный или незамещенный С 1-C6-алкилацил, незамещенную или замещенную C1-C6-алкилацилоксигруппу, незамещенную или замещенную C1-C6-алкилалкоксигруппу, незамещенный или замещенный C1-C6-алкилалкоксикарбонил, незамещенный или замещенный С 1-C6 алкиламинокарбонил, незамещенную или замещенную C1-C6-алкилациламиногруппу, незамещенную или замещенную C1-C6-алкилуреидогруппу, незамещенную или замещенную C1-C6-алкиламиногруппу, незамещенную или замещенную C1-C6-алкиламмониевую группу, незамещенную или замещенную C1-C6 алкилсульфонилоксигруппу, незамещенный или замещенный C1-C6-алкилсульфонил, незамещенный или замещенный C1-C6-алкилсульфинил, незамещенный или замещенный C1-C6-алкилсульфанил, незамещенную или замещенную C1-C6-алкилсульфониламиногруппу, незамещенный или замещенный C1-C6 алкиламиносульфонил, гидроксигруппу, галоген, цианогруппу. В предпочтительном варианте осуществления R7 обозначает незамещенную или замещенную C1-C6 алкильную группу, например, метильную или этильную группу, которая необязательно может быть замещена гидрофильными фрагментами, включая аминогруппу и гидроксигруппу, или R7 обозначает 38-членный циклоалкил, необязательно содержащий 1 или 2 гетероатома, например, пирролидин, фуранил, тиенил, пиперидин, морфолин или пиперазин. В контексте другого предпочтительного варианта осуществления заместитель В обозначает группу формулы -(CH2)n-X-R8, в которой X обозначает О, R8 обозначает водород и n равно 1. В способе используются имеющиеся в продаже или легко получаемые исходные соединения. Уровень техники Схема синтеза пирролидиноксимов формулы (I) хорошо известна. В нескольких документах описан синтез таких соединений. Например, в WO 01/72705 раскрыт синтез амидопроизводного пирролидиноксима, представленный ниже (схема 1).WO 01/72705, является содержащее защитную группу Boc производное пирролидина (например, 1-(третбутоксикарбонил)-4-гидрокси-2-пирролидинкарбоновая кислота или продукт ее обработки, 1-(третбутоксикарбонил)-4-оксо-2-пирролидинкарбоновая кислота; см. синтез промежуточного продукта 7). Другой заявкой, относящейся к производным пирролидина, является WO 04/005249. Эта заявка на патент также относится к применению 1-(трет-бутоксикарбонил)-4-гидрокси-2-пирролидинкарбоновой кислоты в качестве исходного вещества и в ней описана следующая специальная схема синтеза производных 2-гидроксиалкилпирролидиноксима (см. схему 1 а). Исходным веществом также является содержащий защитную группу Boc пирролидин (например, 1-(трет-бутоксикарбонил)-4-оксо-2 пирролидинкарбоновая кислота). Схема 1 а Другой заявкой, относящейся к пирролидиноксимам, является WO 02/102799. Эта заявка на патент относится к применению содержащего защитную группу производного пирролидина в качестве исходного вещества и в ней описана следующая специальная схема синтеза оксадиазолпирролидиноксимов (см. схему 2).PG обозначает подходящую защитную группу. И в этом случае исходным веществом является содержащий защитную группу Boc пирролидин (например, 1-(трет-бутоксикарбонил)-4-оксо-2 пирролидинкарбоновая кислота). Еще одной заявкой является WO 99/52868 (ProcterGamble), в которой раскрыт синтез гидроксамидных производных пирролидиноксима. Эта схема не включает содержащего защитную группу исходного вещества (см. схему 3), но приводит к обладающим другой структурой конечным продуктам (гидроксамидам). Схема 3 Настоящее изобретение относится к новому способу синтеза пирролидиноксима формулы (I), в котором не требуется применение содержащего защитную группу Boc производного пирролидина. Описание изобретения Настоящее изобретение позволяет преодолеть указанные выше затруднения путем синтеза, который включает 4 стадии и в котором, кроме того, в качестве исходных применяются соединения, которые легко синтезировать или которые имеются в продаже. В последующих абзацах приведены определения различных химических фрагментов, которые содержатся в соединениях, предлагаемых в настоящем изобретении, и они относятся ко всему описанию и формуле изобретения, если не приведены явные определения, содержащие более широкие определения."C1-C6-Алкил" означает одновалентные алкильные группы, содержащие от 1 до 6 атомов углерода. Примером значений этого термина являются такие группы, как метил, этил, н-пропил, изопропил, нбутил, изобутил, трет-бутил, н-гексил и т.п."Арил" означает ненасыщенную ароматическую карбоциклическую группу, содержащую от 6 до 14 атомов углерода, включающую одно кольцо (например, фенил) или несколько конденсированных колец(например, нафтил). Предпочтительные арилы включают фенил, нафтил, фенантренил и т.п."Гетероарил" означает моноциклическую гетероароматическую или бициклическую или трициклическую содержащую конденсированные кольца гетероароматическую группу. Конкретные примеры гетероароматических групп включают необязательно замещенный пиридил, пирролил, фурил, тиенил,имидазолил, оксазолил, изоксазолил, тиазолил, изотиазолил, пиразолил, 1,2,3-триазолил, 1,2,4-триазолил,1,2,3-оксадиазолил, 1,2,4-оксадиазолил, 1,2,5-оксадиазолил, 1,3,4-оксадиазолил, 1,3,4-триазинил, 1,2,3 триазинил, бензофурил, [2,3-дигидро]бензофурил, изобензофурил, бензотиенил, бензотриазолил, изобензотиенил, индолил, изоиндолил, 3H-индолил, бензимидазолил, имидазо[1,2-а]пиридил, бензотиазолил,бензоксазолил, хинолизинил, хиназолинил, фталазинил, хиноксалинил, циннолинил, нафтиридинил, пиридо[3,4-b]пиридил, пиридо[3,2-b]пиридил, пиридо[4,3-b]пиридил, хинолил, изохинолил, тетразолил,5,6,7,8-тетрагидрохинолил, 5,6,7,8-тетрагидроизохинолил, пуринил, птеридинил, карбазолил, ксантенил и бензохинолил."C3-C8-Циклоалкил" означает насыщенную карбоциклическую группу, содержащую от 3 до 8 атомов углерода, включающую одно кольцо (например, циклогексил) или несколько конденсированных колец (например, норборнил). Предпочтительные циклоалкилы включают циклопентил, циклогексил,норборнил и т.п."Гетероциклоалкил" означает C3-C8-циклоалкильную группу, соответствующую приведенному выше определению, в которой вплоть до 3 атомов углерода заменены гетероатомами, выбранными из группы, включающей О, S, NR, R определяется, как водород или метил. Предпочтительные гетероциклоалкилы включают пирролидин, пиперидин, пиперазин, 1-метилпиперазин, морфолин и т.п."C2-C6-Алкенил" означает алкенильные группы, предпочтительно содержащие от 2 до 6 атомов углерода и включающие одну или большее количество алкенильных ненасыщенных фрагментов. Предпочтительные алкенильные группы включают этенил (-СН=CH2), н-2-пропенил (аллил, -СН 2 СН=СН 2) и т.п."C2-C6-Алкинил" означает алкинильные группы, предпочтительно содержащие от 2 до 6 атомов углерода и включающие одну или большее количество алкинильных ненасыщенных фрагментов. Предпочтительные алкинильные группы включают этинил (-ССН), пропинил (-CH2CСН) и т.п."C1-C6-Алкиламинокарбонил" означает группу -C(O)NRR', в которой все R, R' независимо обозначают водород или "C1-C6-алкил"."C1-C6-Алкилациламиногруппа" означает группу -NR(CO)R', в которой все R, R' независимо обозначают водород или "C1-C6-алкил"."Сульфонил" означает группу "-SO2-R", в которой R выбран из группы, включающей Н, "C1-C6 алкил", "C1-C6-алкил", необязательно замещенный атомами галогена, такую как, например, группа -SO2CF3, "арил", "гетероарил", "C1-C6-алкиларил" или "C1-C6-алкилгетероарил"."Сульфоксигруппа" означает группу "-S(O)-R", в которой R выбран из группы, включающей Н,"C1-C6-алкил", "C1-C6-алкил", необязательно замещенный атомами галогена, такую как, например, группа"Сульфинил" означает группу "-SO-R'R", в которой R выбран из группы, включающей Н, "C1-C6 алкил", "C1-C6-алкил", необязательно замещенный атомами галогена, такую как, например, группа -SOCF3, "арил", "гетероарил", "C1-C6-алкиларил" или "C1-C6-алкилгетероарил"."Аминогруппа" означает группу -NRR', в которой все R, R' независимо обозначают водород, "C1-C6 алкил", "C2-C6-алкенил", "C2-C6-алкинил", "С 3-C8-циклоалкил", "гетероциклоалкил", "арил", "гетероарил", "C1-C6-алкиларил" или "C1-C6-алкилгетероарил", "C2-C6-алкениларил", "C2-C6-алкенилгетероарил","С 2-C6-алкиниларил", "C2-C6-алкинилгетероарил", "C1-C6-алкилциклоалкил", "C1-C6-алкилгетероциклоалкил", и в которой R и R' совместно с атомом азота, с которым они связаны, необязательно могут образовать 3-8-членное гетероциклоалкильное кольцо."Уреидогруппа" означает группу -NRC(O)NR'R", в которой все R, R', R" независимо обозначают водород, "C1-C6-алкил", "C2-C6-алкенил", "C2-C6-алкинил", "С 3-С 8-циклоалкил", "гетероциклоалкил","арил", "гетероарил", "C1-C6-алкиларил" или "C1-C6-алкилгетероарил", "C2-C6-алкениларил", "C2-C6 алкенилгетероарил", "C2-C6-алкиниларил", "C2-C6-алкинилгетероарил", "C1-C6-алкилциклоалкил", "C1-C6 алкилгетероциклоалкил" и где R' и R" совместно с атомом N, с которым они связаны, необязательно могут образовать 3-8-членное гетероциклоалкильное кольцо."Замещенный или незамещенный". Если иное ограничение не налагает определение конкретного заместителя, перечисленные в указанном выше наборе группы, такие как "алкил", "арил" и "гетероарил" и т.п. необязательно могут содержать от 1 до 5 заместителей, выбранных из группы, включающей "C1-C6 алкил", "аминогруппу", "арил", "гетероарил", "сульфинил", "сульфонил", "алкоксигруппу", "сульфанил",-5 011026"галоген", "карбоксигруппу", цианогруппу, гидроксигруппу, меркапогруппу, нитрогруппу и т.п. Способ, предлагаемый в настоящем изобретении, включает следующие 4 стадии. В контексте настоящего изобретения соединения формулы (I) получают с использованием в качестве исходного вещества не содержащую защитную группу 4-гидроксипирролидинкарбоновую кислоту формулы (II). Соединение (II) имеется в продаже или его можно получить по известным методикам. Стадия 1. На первой стадии (см. схему 4) пирролидин формулы (II) превращают в ацилпроизводное формулы (IV) с помощью подходящего ацилирующего реагента (III), например, ацилхлорида, ангидрида,карбоновой кислоты или сложного эфира. Предпочтительным ацилирующим реагентом является 1,1'бифенил-4-карбонилхлорид или 2'-метил-1,1'-бифенил-4-карбонилхлорид. Получение таких соединений раскрыто, например, в WO 01/72705. Схема 4 Реакцию предпочтительно проводят в присутствии основания, например гидроксида натрия или гидроксида калия (условия Шоттена-Баумана), или с использованием органического основания, включая триэтиламин, N,N-диизопропилэтиламин или пиридин. Стадия 2. Затем ацилпроизводное (IV) окисляют подходящим окислительным реагентом и получают пирролидон формулы (V). Одним подходящим окислительным реагентом является комплекс пиридин-триоксид серы (Ру-SO3), с которым используется ДМСО (диметилсульфоксид) в качестве растворителя. Реакцию предпочтительно проводят в присутствии триэтиламина. Дополнительные примеры подходящих окислительных реагентов включают, например, оксалилхлорид/ДМСО, ангидрид трифторуксусной кислоты/ДМСО, дициклогексилкарбодиимид/ДМСО, пиридинийдихромат, пиридинийхлорхромат, окисление по Джону и периодинан Десса-Мартина, 1,1,1 трис(ацетокси)-1-5,2-бензйодоксол-3(1 Н)-он. Схема 5 Стадия 3. Затем соединение формулы (V) превращают в соединение (VII) с использованием подходящего алкоксиламина, арилоксиламина или гидроксиламина общей формулы (VI), например, Ометилгидроксиламингидрохлорида (такое соединение имеется в продаже) в присутствии органического основания, такого как триэтиламин или N,N-диизопропилэтиламин. Схема 6 Стадия 4. Затем соединение (VII) превращают в соединения (Ia) или (Ib) с использованием амина общей формулы (VIII) или N-гидроксиамидоксима общей формулы (IX). Получение Nгидроксиамидоксима общей формулы (IX) раскрыто, например, в WO 02/102799. В случае, если необходимо получить конечный продукт (Ic), стадию 4 необходимо изменить, так чтобы сначала получить N-гидроксиамидоксим (VIIb) путем превращения соединения (VII) в нитрил(VIIa) (например, непосредственно из кислоты (это известно из литературы) или через амид), который затем дополнительно вводят в реакцию с карбоновой кислотой формулы R7-COOH или, например, соответствующим ацилхлоридом и в заключение получают соединение (Ic) после нагревания промежуточного продукта, например, с избытком пиридина. Для реакции амидоксима (VIIb) с карбоновой кислотой предпочтительно использовать реагенты реакции сочетания, например N-(3-диметиламинопропил)-N'этилкарбодиимидгидрохлорид, карбонилдиимидазол, дициклогексилкарбодиимид, пивалоилхлорид, изобутилхлорформиат (или любой другой из обычных реагентов, применяющихся при образовании пептидной связи). В случае, если необходимо получить конечный продукт (Id), в котором R6 обозначает водород, для превращения карбоксигруппы в гидроксиалкильную группу можно использовать различные хорошо известные этерифицирующие и восстановительные реагенты. Примерами этерифицирующих реагентов являются диметилсульфат, метилйодид, метилтозилат, производные диазометана, такие как триметилсилилдиазометан, которые все являются этерифицирующими реагентами, действующими в слабощелочной или нейтральной среде. Примерами восстановительных реагентов являются борогидрид лития, алюмогидрид лития, натрий-бис-(2-метоксиэтокси) алюмогидрид лития, (Red-A1), диизобутилалюминийгидрид(ДИБАЛ) и т.п. Конечные продукты формул (Ia), (Ib), (Ic) и (Id) можно дополнительно превратить, в частности, по фрагменту R1, R2, R7 и R8. Таким образом, в конечном продукте (Ic), в котором R7 содержит функциональную группу, указанный фрагмент можно превратить в другой фрагмент с помощью подходящих средств, включая гидролиз, этерификацию, омыление, алкилирование и т.п. Кроме того, соединения,предлагаемые в настоящем изобретении, можно подвергнуть дополнительным стадиям очистки, включая хроматографию и перекристаллизацию. Новый способ синтеза для получения соединения формулы (I) не включает применение относительно дорогостоящего содержащего защитную группу Boc пирролидин, а в нем используется недорогой и легко доступный 3-гидроксипролин. Другое преимущество нового способа синтеза относится к получению соединений, содержащих по-7 011026 лярные фрагменты, присоединенные в положения 2 карбоксамида или оксадиазола, например, если R3,R4, R7 являются фрагментом (например, алкилом или арилом), который содержит, например, гидроксильный или аминный заместитель, включая циклический амин. Предлагаемый новый способ исключает конечную стадию образования N-концевой группы (как показано на схеме 2), включающую использование нуклеофила (например, ацилхлорида), который может взаимодействовать как с пирролидинамином, так и с указанным вторым полярным фрагментом, например гидроксильным или аминным заместителем. В одном варианте осуществления новый способ синтеза можно применять для промышленного изготовления соединений формулы (I). Настоящее изобретение иллюстрируется приведенными ниже примерами. Пример 1. Получение (2S,4 Е и 4Z)-N-[(2S)-2-гидрокси-2-фенилэтил]-4-(метоксиимино)-1-[(2'метил[1,1'-бифенил]-4-ил)карбонил]-2-пирролидинкарбоксамида. Стадия 1. Получение (4R)-4-гидрокси-1-[(2'-метил-1,1'-бифенил-4-ил)карбонил]-L-пролина (соединение (IV) на схеме 4). 4-Гидрокси-L-пролин (0,625 мас.ч.) и воду (3,3 об.ч.) помещали в колбу с отводом объемом 20 л. К содержимому по каплям прибавляли триэтиламин (2,42 об.ч.), так чтобы температура поддерживалась в диапазоне от 10 до 20 С. Прибавляли тетрагидрофуран (5,0 об.ч.) и реакционную смесь охлаждали до температуры, равной от 0 до 5 С. Хлорангидрид 2'-метил-1,1'-бифенил-4-карбоновой кислоты(1,0 мас.ч.) и тетрагидрофуран (5,0 об.ч.) помещали в отдельную колбу, перемешивали в течение от 5 до 10 мин и затем прибавляли к реакционной смеси, так чтобы температура поддерживалась в диапазоне от 0 до 10 С. Реакционную смесь нагревали при температуре, равной от 15 до 25 С, в течение 60-120 мин и поддерживали при температуре, равной от 15 до 25 С, пока по данным анализа с помощью ТСХ (тонкослойная хроматография) реакция не завершалась. Полученную смесь концентрировали в вакууме при температуре, равной от 35 до 40 С, к остатку прибавляли воду (10,0 об.ч.) и этилацетат (5,0 об.ч.) и содержимое перемешивали в течение от 5 до 10 мин. Слои разделяли, водную фазу подкисляли до pH 1 водным раствором хлористо-водородной кислоты (6 М, примерно 3,0 об.ч.) и полученную взвесь охлаждали и выдерживали при температуре, равной от 0 до 10 С, в течение от 25 до 40 мин. Осадок собирали фильтрованием, отделенное твердое вещество переносили в подходящую колбу с отводом и суспендировали в теплой (от 35 до 60 С) воде(5,0 об.ч.) в течение от 10 до 25 мин. Твердое вещество собирали фильтрованием и повторяли суспендирование в горячей воде, описанное выше. После второго суспендирования твердое вещество подвергали азеотропной сушке с помощью толуола (25,0 об.ч.) при температуре, равной от 40 до 50 С. К остатку прибавляли этилацетат (2,5 об.ч.) и гептаны (2,5 об.ч.), полученную взвесь охлаждали и выдерживали при температуре, равной от 0 до 5 С, в течение от 30 до 40 мин, фильтровали, собранное твердое вещество промывали предварительно охлажденной смесью (от 0 до 5 С) этилацетат:гептаны (1:1, 2,0 об.ч.) и сушили в вакууме при температуре, равной от 30 до 40 С, до постоянной массы и получали (4R)-4 гидрокси-1-[(2'-метил-1,1'-бифенил-4-ил)карбонил]-1-пролин в виде белого твердого вещества. Выход: 85,9%. Стадия 2. Получение 1-[(2'-метил-1,1'-бифенил-4-ил)карбонил]-4-оксо-1-пролина (соединение (V) на схеме 5).(4R)-4-Гидрокси-1-[(2'-метил-1,1'-бифенил-4-ил)карбонил]-L-пролин (продукт, полученный на стадии 1, 1,0 мас.ч.) и диметилсульфоксид (2,5 об.ч.) помещали в колбу с отводом объемом 20 л. Содержимое нагревали до температуры, равной от 35 до 40 С, и поддерживали при этой температуре до полного растворения. Раствор охлаждали до температуры, равной от 5 до 10 С, в атмосфере азота и прибавляли триэтиламин (3,0 об.ч.), так чтобы температура поддерживалась в диапазоне от 5 до 20 С. Комплекс пиридин-триоксид серы (1,47 мас.ч.) и диметилсульфоксид (4,9 об.ч.) помещали в отдельную колбу, перемешивали в течение от 5 до 10 мин и затем прибавляли к реакционной смеси, так чтобы температура поддерживалась в диапазоне от 15 до 25 С. Реакционную смесь перемешивали при температуре, равной от 15 до 25 С, пока по данным анализа с помощью ВЭЖХ (высокоэффективная жидкостная хроматография) реакция не завершалась (обычно от 1 до 3 ч). Содержимое сосуда охлаждали до температуры, равной от 0 до 10 С, и реакцию останавливали водным раствором хлористо-водородной кислоты (3 М,8 об.ч.), поддерживая температуру ниже 30 С. Затем прибавляли тетрагидрофуран (5,0 об.ч.) и гептаны(1,0 об.ч.), слои разделяли, водную фазу экстрагировали тетрагидрофураном (25,0 об.ч.) и объединенные органические фазы промывали водным раствором хлористо-водородной кислоты (1 М, 22,0 об.ч.) и насыщенным рассолом (22,0 об.ч.). Водные промывочные растворы объединяли и подвергали обратной экстракции тетрагидрофураном (21,0 об.ч.), органические фазы объединяли, сушили над сульфатом магния (3 мас.ч.) и фильтровали. Осадок на фильтре промывали тетрагидрофураном (1,0 об.ч.) и фильтраты концентрировали в вакууме при температуре, равной от 40 до 45 С, и получали бледно-коричневое вспененное вещество. К остатку прибавляли этилацетат (10,0 об.ч.), содержимое перемешивали в течение от 5 до 10 мин и растворитель удаляли в вакууме при температуре, равной от 40 до 45 С. Остаток переносили в колбу, прибавляли этилацетат (8,0 об.ч.) и содержимое кипятили с обратным холодильни-8 011026 ком. Прибавляли взвесь активированного угля (0,14 мас.ч.) в этилацетате (5,0 об.ч.) и кипячение с обратным холодильником возобновляли и продолжали в течение от 20 до 30 мин. Содержимое охлаждали до температуры, равной от 40 до 45 С, фильтровали, осадок на фильтре промывали этилацетатом (2,5 об.ч.) и фильтраты концентрировали до 2,5-3,0 об.ч. в вакууме при температуре, равной от 40 до 45 С. Взвесь разбавляли этилацетатом (0,5 об.ч.) и кипятили с обратным холодильником. Прибавляли гептан (3,0 об.ч.) и содержимому давали охладиться до температуры, равной от 15 до 25 С, в течение от 1 до 2 ч. Взвесь дополнительно охлаждали до температуры, равной от 0 до 5 С, в течение от 2 до 3 ч, фильтровали и осадок на фильтре промывали смесью этилацетат:гептан [(1:1), 1,0 об.ч.], предварительно охлажденной до температуры, равной от 0 до 5 С, затем гептаном (5,0 об.ч.). Выделенное твердое вещество сушили в вакууме при температуре, равной от 40 до 45 С, и получали 1-[(2'-метил-1,1'-бифенил-4 ил)карбонил]-4-оксо-L-пролина в виде почти белого твердого вещества. Выход: 60,3%. Стадия 3. Получение 4-метоксиимино-1-[(2'-метил-1,1'-бифенил-4-ил)карбонил]-L-пролина (соединение (VII) на схеме 6). 1-[(2'-Метил-1,1'-бифенил-4-ил)карбонил]-4-оксо-1-пролин (полученный на стадии 2, 1,0 мас.ч.), Ометилгидроксиламингидрохлорид (0,285 мас.ч.) и дихлорметан (20 об.ч.) помещали в колбу с отводом объемом 20 л и охлаждали до температуры, равной от 0 до 5 С. В колбу прибавляли триэтиламин(0,91 об.ч.), так чтобы температура поддерживалась в диапазоне от 0 до 10 С, реакционную смесь нагревали до температуры, равной от 15 до 25 С, и поддерживали в этом температурном диапазоне в течение от 16 до 20 ч. Реакционную смесь концентрировали в вакууме при температуре, равной от 40 до 45 С,остаток растворяли в этилацетате (10,0 об.ч.) и промывали водным раствором хлористо-водородной кислоты (1 М, 25,0 об.ч.). Водные промывочные растворы объединяли и подвергали обратной экстракции этилацетатом (5,0 об.ч.), органические экстракты объединяли и промывали насыщенным рассолом(10,0 об.ч.), сушили над сульфатом магния (0,5 мас.ч.), фильтровали и осадок на фильтре промывали этилацетатом (5,0 об.ч.). Фильтраты концентрировали в вакууме при температуре, равной от 40 до 45 С,и получали 4-метоксиимино-1-[(2'-метил-1,1'-бифенил-4-ил)карбонил]-L-пролин в виде ожидаемой смесиE:Z. Выход: 95,6%. Стадия 4. Получение N-[2-гидрокси-2-фенилэтил]-4-(метоксиимино)-1-[(2'-метил[1,1'-бифенил]-4 ил)карбонил]-2-пирролидинкарбоксамида (соединение (Ia) на схеме 7). 4-Метоксиимино-1-[(2'-метил-1,1'-бифенил-4-ил)карбонил]-L-пролин (полученный на стадии 3,1,0 мас.ч.) и дихлорметан (10,0 об.ч.) помещали в колбу с отводом объемом 20 л и охлаждали до температуры, равной от 0 до 5 С, в атмосфере азота. N-Метилморфолин (0,78 об.ч.) прибавляли при температуре, равной от 0 до 5 С, а затем пивалоилхлорид (0,37 об.ч.) при температуре, равной от 0 до 5 С. Содержимое сосуда перемешивали при температуре, равной от 0 до 5 С, пока не завершалось образование смешанного ангидрида (обычно от 30 до 60 мин). В отдельную колбу с отводом объемом 20 л помещали(S)-2-амино-1-фенилэтанол (0,47 мас.ч., 1,2 экв.) и дихлорметан (3,0 об.ч.) и полученную смесь перемешивали в течение от 5 до 25 мин. Затем раствор охлаждали до температуры, равной от 10 до 15 С, и прибавляли смешанный ангидрид, так чтобы температура поддерживалась в диапазоне от 5 до 15 С. Реакционную смесь нагревали до температуры, равной от 15 до 25 С, и поддерживали в этом температурном диапазоне, пока по данным анализа с помощью ВЭЖХ реакция не завершалась. Полученную смесь концентрировали в вакууме при температуре, равной от 35 до 45 С, остаток подвергали распределению между трет-бутилметиловым эфиром (ТБМЭ, 10,0 об.ч.) и водным раствором лимонной кислоты (0,1 М,5,0 об.ч.), слои разделяли и органическую фазу дополнительно промывали водным раствором лимонной кислоты (0,1 М, 25,0 об.ч.), насыщенным водным раствором гидрокарбоната натрия (25,0 об.ч.) и насыщенным рассолом (5,0 об.ч.). Органическую фазу сушили над сульфатом магния (1 мас.ч.), фильтровали и осадок на фильтре промывали с помощью ТБМЭ (2,0 об.ч.). Фильтраты концентрировали в вакууме при температуре, равной от 35 до 45 С, и получали коричневое полужидкое вещество. К остатку прибавляли дихлорметан (5,0 об.ч.) и содержимое концентрировали в вакууме при температуре, равной от 35 до 45 С, и получали смолу. Процедуру повторяли со второй порцией дихлорметана (1,0 об.ч.) и неочищенный конечный продукт получали в виде ожидаемой смеси E:Z. Выход: 84,4%. Пример 2. (3E,5S)-1-([1,1'-бифенил]-4-илкарбонил)-5-[3-(2-гидроксиэтил)-1,2,4-оксадиазол-5-ил]-3 пирролидинон-O-метилоксим;(3,30 л, 3,3 об.ч.) помещали в колбу с отводом объемом 20 л. По каплям прибавляли триэтиламин(2,570 л, 2,57 об.ч.), так чтобы температура поддерживалась в диапазоне от 10 до 15 С, и полученную смесь охлаждали до температуры, равной от 0 до 5 С. 1,1'-Бифенил-4-карбонилхлорид (1,00 кг,3,78 моль, 1,0 мас.ч.) и тетрагидрофуран (5,00 л, 5,0 об.ч.) помещали в отдельную колбу, перемешивали в виде взвеси в течение от 5 до 10 мин и прибавляли к реакционной смеси в течение от 40 до 50 мин, так чтобы температура поддерживалась в диапазоне от 0 до 10 С. Реакционную смесь нагревали от 15 до-9 011026 25 С, в течение от 60 до 120 мин и поддерживали при температуре, равной от 15 до 25 С, пока по данным анализа с помощью ТСХ реакция не завершалась (дихлорметан:метанол:уксусная кислота 90:10:1; визуализация УФ-излучением; Rf продукта равен 0,13). Реакционную смесь концентрировали при пониженном давлении при температуре, равной от 35 до 40 С, к остатку прибавляли воду (8,00 л, 8,0 об.ч.) и этилацетат (5,00 л, 5,0 об.ч.) и содержимое перемешивали в течение от 5 до 10 мин. Слои разделяли, водную фазу подкисляли до pH 1 путем быстрого прибавления водного раствора хлористо-водородной кислоты (6 М, примерно 900 мл, 0,9 об.ч.) и полученную взвесь охлаждали до температуры, равной от 0 до 10 С, в течение от 40 до 50 мин. Осадок собирали фильтрованием, отделенное твердое вещество суспендировали в теплой воде (от 35 до 60 С, 5,00 л, 5,0 об.ч.) в течение от 10 до 25 мин и твердое вещество собирали фильтрованием. Суспендирование в воде повторяли, как это описано выше. Собранные твердые вещества объединяли с полученным из такой же порции, помещали в колбу с отводом объемом 20 л,прибавляли ацетон (10,00 л, 5,0 об.ч.) и реакционную смесь нагревали и продолжали кипячение с обратным холодильником возобновляли (примерно 65 С) в течение от 10 до 20 мин. Полученной смеси давали охладиться до температуры, равной от 15 до 25 С, перемешивали при температуре, равной от 15 до 25 С, в течение от 12 до 18 ч, и дополнительно охлаждали и выдерживали при температуре, равной от 0 до 5 С, в течение 60 мин. Осадок собирали фильтрованием и промывали смесью этилацетат:ацетон (1:1,4,00 л, 2 об.ч.). Твердое вещество сушили досуха на фильтре и дополнительно сушили в вакууме при температуре, равной от 40 до 45 С, до постоянной массы и получали (2S,4R)-1-(бифенил-4-илкарбонил)4-гидроксипирролидин-2-карбоновую кислоту в виде бежевого твердого вещества. Фильтраты концентрировали примерно до 3,00 л при пониженном давлении и получали вторую порцию материала, который собирали фильтрованием, промывали смесью этилацетат:гептаны (1:1, 24,00 л, 22 об.ч.) и высушивали на фильтре. Сушка в вакууме при температуре, равной от 40 до 45 С, до постоянной массы давала искомое соединение в виде бежевого твердого вещества. Полное количество полученного вещества: 2,616 кг. Выход: 91,9%. Стадия 2. Получение (2S)-1-(бифенил-4-илкарбонил)-4-оксо-пирролидин-2-карбоновой кислоты(2S,4R)-1-(Бифенил-4-илкарбонил)-4-гидроксипирролидин-2-карбоновую кислоту (0,806 кг,1,0 мас.ч.) и диметилсульфоксид (5,00 л, 6,25 об.ч.) помещали в колбу с отводом объемом 20 л и перемешивали в атмосфере азота до полного растворения. Раствор охлаждали до температуры, равной от 10 до 15 С, и прибавляли триэтиламин (2,40 л, 3,0 об.ч.), так чтобы внутренняя температура поддерживалась в диапазоне от 10 до 20 С. К реакционной смеси порциями прибавляли комплекс пиридин-триоксид серы(1,224 кг, 1,53 мас.ч.), так чтобы внутренняя температура поддерживалась в диапазоне от 10 до 25 С. Перемешивание при температуре, равной от 15 до 25 С продолжали, пока по данным анализа с помощью ТСХ реакция не завершалась (дихлорметан:метанол:уксусная кислота 90:10:1; Rf продукта равен 0,28),обычно в течение от 1 до 3 ч. Реакционную смесь охлаждали до температуры, равной от 0 до 10 С, и реакцию останавливали водным раствором хлористо-водородной кислоты (3 М, 6,460 л, 8,0 об.ч.) поддерживая температуру ниже 30 С. Прибавляли тетрагидрофуран (2,00 л, 2,5 об.ч.) и этилацетат (2,00 л,2,5 об.ч.), слои разделяли, водную фазу экстрагировали тетрагидрофураном:этилацетат (1:1, 4,00 л,5,0 об.ч.) и объединенные экстракты промывали водным раствором хлористо-водородной кислоты (1 М,21,60 л, 22,0 об.ч.) и насыщенным рассолом (1,60 л, 2,0 об.ч.). К органической фазе прибавляли активированный уголь (160 г, 0,2 мас.ч.) и полученную взвесь нагревали и продолжали кипячение с обратным холодильником (от 65 до 70 С) в течение 0,5 ч. Реакционную смесь охлаждали до температуры,равной от 20 до 30 С, прибавляли сульфат магния (375 г, 0,5 мас.ч.), перемешивание продолжали в течение 10 мин и смесь фильтровали через целит. Собранные твердые вещества промывали этилацетатом(20,800 л, 21,0 об.ч.) и объединенные фильтраты концентрировали при пониженном давлений при температуре, равной от 40 до 45 С, и получали искомое соединение, (2S)-1-(бифенил-4-илкарбонил)-4 оксо-пирролидин-2-карбоновую кислоту в виде вязкого оранжевого масла (0,769 кг, Выход: 96,0%). Вещество использовали на следующей стадии без дополнительной очистки. Стадия 3. Получение (2S)-1-(бифенил-4-илкарбонил)-4-(метоксиимино)пирролидин-2-карбоновой кислоты (соединение (VII) на схеме 6). Неочищенную (2S)-1-(бифенил-4-илкарбонил)-4-оксопирролидин-2-карбоновую кислоту (1,550 кг,5,01 моль, 1,0 мас.ч.), О-метилгидроксиламингидрохлорид (0,620 кг, 7,42 моль, 0,40 мас.ч.) и дихлорметан (12,40 л, 8,0 об.ч.) помещали в колбу с отводом объемом 20 л и охлаждали до температуры, равной от 0 до 5 С. К реакционной смеси в течение от 45 до 60 мин прибавляли триэтиламин (1,752 л, 1,13 об.ч.),так чтобы внутренняя температура поддерживалась в диапазоне от 0 до 10 С. Реакционную смесь нагревали до температуры, равной от 15 до 25 С, и поддерживали в этом температурном диапазоне (обычно от 12 до 18 ч), пока по данным анализа с помощью ТСХ реакция не завершалась (дихлорметан:метанол:уксусная кислота 90:10:1, визуализация УФ-излучением; Rf продукта равен 0,27, 0,35 Z, Е). Реакционную смесь концентрировали при пониженном давлении при температуре, равной от 40 до 45 С,остаток растворяли в этилацетате (12,40 л, 8,0 об.ч.) и промывали водным раствором хлористоводородной кислоты (2 М, 24,650 л, 23,0 об.ч.). Водные промывочные растворы объединяли и подвер- 10011026 гали обратной экстракции этилацетатом (4,650 л, 3,0 об.ч.). Органические экстракты объединяли, промывали насыщенным рассолом (4,650 л, 3,0 об.ч.), сушили над сульфатом магния (770 г, 0,5 мас.ч.), фильтровали и осадок на фильтре промывали этилацетатом (4,650 л, 3,0 об.ч.). Фильтраты концентрировали при пониженном давлений при температуре, равной от 40 до 45 С, и получали бежевое твердое вещество. Неочищенный продукт суспендировали в этилацетате (3,10 л, 2,0 об.ч.) при температуре, равной от 15 до 20 С, в течение 15 мин прибавляли циклогексан (12,40 л, 8,0 об.ч.) и полученную взвесь охлаждали и выдерживали при температуре, равной от 0 до 5 С, в течение 1 ч. Осадок собирали фильтрованием, промывали смесью этилацетат:циклогексан (1:2; 4,650 л, 3,0 об.ч.) и сушили в вакууме при температуре,равной от 40 до 45 С, до постоянной массы и получали искомый продукт в виде бежевого твердого вещества (1,132 кг, Выход: 66,8%). Выделенные фильтраты (из 9 циклов указанной выше реакции) объединяли и концентрировали при пониженном давлении при температуре, равной от 40 до 45 С. Остаток (примерно 1,00 кг) суспендировали в горячем виде (от 70 до 75 С) в этилацетате (7,00 л), охлаждали и выдерживали при температуре,равной от 0 до 5 С, в течение 2 ч, фильтровали и собранные твердые вещества сушили в вакууме при температуре, равной от 40 до 45 С, до постоянной массы и получали вторую порцию (2S)-1-(бифенил-4 илкарбонил)-4-(метоксиимино)пирролидин-2-карбоновой кислоты (0,732 кг, 4,9% от теоретического выхода). Стадия 4 а. Получение(2S)-1-(Бифенил-4-илкарбонил)-4-(метоксиимино)пирролидин-2-карбоновую кислоту (0,560 кг,1,0 мас.ч.) и тетрагидрофуран (8,40 л, 15,0 об.ч.) помещали в колбу с отводом объемом 20 л и охлаждали до температуры, равной от 0 до 5 С. Порциями прибавляли карбонилдиимидазол (0,280 кг, 0,5 мас.ч.),так чтобы внутренняя температура поддерживалась в диапазоне от 0 до 10 С. Реакционную смесь нагревали и перемешивали при температуре, равной от 15 до 20 С (от 1 до 2 ч), пока по данным анализа с помощью ТСХ реакция не завершалась (этилацетат, визуализация УФ-излучением). Затем одной порцией прибавляли N-гидрокси-3-триэтилсиланилоксипропионамидин (0,381 кг, 0,68 мас.ч., 1,0 экв., скорректировано на содержание силанола) в виде раствора в тетрагидрофуране (2,80 л, 5,0 об.ч.) и перемешивание продолжали при температуре, равной от 15 до 25 С, и за протеканием реакций следили на основании анализа с помощью ТСХ (этилацетат, визуализация УФ-излучением). Завершение реакции отмечено через 1 ч. Реакционную смесь концентрировали при пониженном давлении при температуре, равной от 40 до 45 С, и остаток объединяли с двумя порциями, полученными при таком же количестве исходных веществ. К объединенному веществу прибавляли пиридин (5,040 л, 3 об.ч.) и полученную смесь нагревали и поддерживали при температуре, равной от 85 до 90 С, пока по данным анализа с помощью ВЭЖХ циклизация не завершалась. Реакционную смесь концентрировали при пониженном давлении при температуре, равной от 40 до 45 С, темный маслообразный остаток обрабатывали этилацетатом (16,80 л,10 об.ч.) и промывали 25% водным раствором лимонной кислоты (35,00 л, 33,0 об.ч.). Водные экстракты объединяли и проводили обратную экстракцию этилацетатом (5,00 л, 3 об.ч.), объединенные органические фазы промывали рассолом (5,00 л, 3,0 об.ч.), сушили над сульфатом магния (1,680 кг,1 мас.ч.), фильтровали и осадок на фильтре промывали этилацетатом (1,70 л). Объединенные фильтраты концентрировали при пониженном давлении при температуре, равной от 40 до 45 С, и получали неочищенный (2S)-1-(бифенил-4-карбонил)-5-[3-(2-триэтилсиланилоксиэтил)-1,2,4-оксадиазол-5-ил]пирролидин-3-он-O-метилоксим в виде коричневого масла, которое использовали без дополнительной очистки(2,796 кг, 108%). Стадия 4b. Получение (2S)-1-(бифенил-4-карбонил)-5-[3-(2-гидроксиэтил)-1,2,4-оксадиазол-5 ил]пирролидин-3-он-O-метилоксима. Неочищенный (2S)-1-(бифенил-4-карбонил)-5-[3-(2-триэтилсиланилоксиэтил)-1,2,4-оксадиазол-5 ил]пирролидин-3-он-O-метилоксим (1,398 кг, 1,0 мас.ч.) в виде раствора в тетрагидрофуране (6,990 л,5,0 об.ч.) обрабатывали 1% водным раствором трифторуксусной кислоты (3,495 л, 2,5 об.ч.). Анализ с помощью ТСХ (этилацетат; визуализация УФ-излучением; Rf продукта равен 0,35, 0,48 Z, Е) указывал на завершение реакции через 30 мин. Значение pH реакционной смеси доводили до pH 7 насыщенным водным раствором гидрокарбоната натрия (1,00 л, 0,72 об.ч.) и прибавляли этилацетат (6,990 л, 5 об.ч.). Слои разделяли, органическую фазу промывали насыщенным водным раствором гидрокарбоната натрия(2,796 л, 2,0 об.ч.), водные промывочные растворы объединяли и проводили обратную экстракцию этилацетатом (2,796 л, 2,0 об.ч.). Органические фазы объединяли, промывали рассолом (4,794 л, 3 об.ч.), сушили над сульфатом магния (1,164 кг, 0,75 мас.ч.), фильтровали и осадок на фильтре промывали этилацетатом (20,699 л, 20,5 об.ч.). Объединенные фильтраты концентрировали при пониженном давлении при температуре, равной от 40 до 45 С, и получали маслообразный остаток, который объединяли с остатком от второй порции, полученной при таком же количестве исходных веществ. Полное количество неочищенного вещества: 2,592 кг. Неочищенное вещество растворяли в ацетонитриле (2,592 л, 1 об.ч.),прибавляли гептаны (26,00 л, 10 об.ч.) и полученную смесь нагревали и поддерживали при температуре,равной от 45 до 55 С, в течение 30 мин. Нижнюю ацетонитрильную фазу отделяли, при энергичном пе- 11011026 ремешивании прибавляли к трет-бутилметиловому эфиру (56,00 л, 22 об.ч.), смесь охлаждали и выдерживали при температуре, равной от 0 до 5 С, в течение от 1 до 2 ч, фильтровали и концентрировали при пониженном давлении при температуре, равной от 40 до 45 С, и получали искомое соединение в виде бледно-желтого твердого вещества (2,037 кг, 93,3%). Пример 2 а. (3E,5S)-5-[3-(2-гидроксиэтил)-1,2,4-оксадиазол-5-ил]-1-[(2'-метилбифенил-4-ил)карбонил]пирролидин-3-он-O-метилоксим; (3Z,5S)-5-[3-(2-гидроксиэтил)-1,2,4-оксадиазол-5-ил]-1-[(2'-метилбифенил-4-ил)карбонил]пирролидин-3-он-О-метилоксим. Стадия 1. Получение (4R)-4-гидрокси-1-[(2'-метил-1,1'-бифенил-4-ил)карбонил]-L-пролина (соединение (IV) на схеме 4). 4-Гидрокси-L-пролин (0,625 мас.ч.) и воду (3,3 об.ч.) помещали в колбу с отводом объемом 20 л. К содержимому по каплям прибавляли триэтиламин (2,42 об.ч.), так чтобы температура поддерживалась в диапазоне от 10 до 20 С. Прибавляли тетрагидрофуран (5,0 об.ч.) и реакционную смесь охлаждали до температуры, равной от 0 до 5 С. Хлорангидрид 2'-метил-1,1'-бифенил-4-карбоновой кислоты (1,0 мас.ч.) и тетрагидрофуран (5,0 об.ч.) помещали в отдельную колбу, перемешивали в течение от 5 до 10 мин и затем прибавляли к реакционной смеси, так чтобы температура поддерживалась в диапазоне от 0 до 10 С. Реакционную смесь нагревали при температуре, равной от 15 до 25 С, в течение 60-120 мин и поддерживали при температуре, равной от 15 до 25 С, пока по данным анализа с помощью ТСХ реакция не завершалась. Полученную смесь концентрировали в вакууме при температуре, равной от 35 до 40 С, к остатку прибавляли воду (10,0 об.ч.) и этилацетат (5,0 об.ч.) и содержимое перемешивали в течение от 5 до 10 мин. Слои разделяли, водную фазу подкисляли до pH 1 водным раствором хлористо-водородной кислоты (6 М, примерно 3,0 об.ч.) и полученную взвесь охлаждали и выдерживали при температуре,равной от 0 до 10 С, в течение от 25 до 40 мин. Осадок собирали фильтрованием, отделенное твердое вещество переносили в подходящую колбу с отводом и суспендировали в теплой (от 35 до 60 С) воде(5,0 об.ч.) в течение от 10 до 25 мин. Твердое вещество собирали фильтрованием и повторяли суспендирование в горячей воде, описанное выше. После второго суспендирования твердое вещество подвергали азеотропной сушке с помощью толуола (25,0 об.ч.) при температуре, равной от 40 до 50 С. К остатку прибавляли этилацетат (2,5 об.ч.) и гептаны (2,5 об.ч.), полученную взвесь охлаждали и выдерживали при температуре, равной от 0 до 5 С, в течение от 30 до 40 мин, фильтровали, собранное твердое вещество промывали предварительно охлажденной смесью (от 0 до 5 С) этилацетат:гептаны (1:1, 2,0 об.ч.) и сушили в вакууме при температуре, равной от 30 до 40 С, до постоянной массы и получали (4R)-4 гидрокси-1-[(2'-метил-1,1'-бифенил-4-ил)карбонил]-1-пролин в виде белого твердого вещества. Выход: 85,9%. Стадия 2. Получение 1-[(2'-метил-1,1'-бифенил-4-ил)карбонил]-4-оксо-L-пролина (соединение (V) на схеме 5).(4R)-4-Гидрокси-1-[(2'-метил-1,1'-бифенил-4-ил)карбонил]-L-пролин (продукт, полученный на стадии 1, 1,0 мас.ч.) и диметилсульфоксид (2,5 об.ч.) помещали в колбу с отводом объемом 20 л. Содержимое нагревали до температуры, равной от 35 до 40 С, и поддерживали при этой температуре до полного растворения. Раствор охлаждали до температуры, равной от 5 до 10 С, в атмосфере азота и прибавляли триэтиламин (3,0 об.ч.), так чтобы температура поддерживалась в диапазоне от 5 до 20 С. Комплекс пиридин-триоксид серы (1,47 мас.ч.) и диметилсульфоксид (4,9 об.ч.) помещали в отдельную колбу, перемешивали в течение от 5 до 10 мин и затем прибавляли к реакционной смеси, так чтобы температура поддерживалась в диапазоне от 15 до 25 С. Реакционную смесь перемешивали при температуре, равной от 15 до 25 С, пока по данным анализа с помощью ВЭЖХ реакция не завершалась (обычно от 1 до 3 ч). Содержимое сосуда охлаждали до температуры, равной от 0 до 10 С и реакцию останавливали водным раствором хлористо-водородной кислоты (3 М, 8 об.ч.), поддерживая температуру ниже 30 С. Затем прибавляли тетрагидрофуран (5,0 об.ч.) и гептаны (1,0 об.ч.), слои разделяли, водную фазу экстрагировали тетрагидрофураном (25,0 об.ч.) и объединенные органические фазы промывали водным раствором хлористо-водородной кислоты (1 М, 22,0 об.ч.) и насыщенным рассолом (22,0 об.ч.). Водные промывочные растворы объединяли и подвергали обратной экстракции тетрагидрофураном (21,0 об.ч.), органические фазы объединяли, сушили над сульфатом магния (3 мас.ч.) и фильтровали. Осадок на фильтре промывали тетрагидрофураном (1,0 об.ч.) и фильтраты концентрировали в вакууме при температуре,равной от 40 до 45 С, и получали бледно-коричневое вспененное вещество. К остатку прибавляли этилацетат (10,0 об.ч.), содержимое перемешивали в течение от 5 до 10 мин и растворитель удаляли в вакууме при температуре, равной от 40 до 45 С. Остаток переносили в колбу, этилацетат (8,0 об.ч.) прибавляли и содержимое кипятили с обратным холодильником, взвесь активированного угля (0,14 мас.ч.) в этилацетате (5,0 об.ч.) прибавляли и кипячение с обратным холодильником возобновляли и продолжали в течение от 20 до 30 мин. Содержимое охлаждали до температуры, равной от 40 до 45 С, фильтровали,осадок на фильтре промывали этилацетатом (2,5 об.ч.) и фильтраты концентрировали до 2,5-3,0 об.ч. в вакууме при температуре, равной от 40 до 45 С. Взвесь разбавляли этилацетатом (0,5 об.ч.) и кипятили с обратным холодильником. Прибавляли гептан (3,0 об.ч.) и содержимому давали охладиться до температуры, равной от 15 до 25 С, в течение от 1 до 2 ч. Взвесь дополнительно охлаждали до температуры,- 12011026 равной от 0 до 5 С, в течение от 2 до 3 ч, фильтровали и осадок на фильтре промывали смесью этилацетат:гептан [(1:1), 1,0 об. частей] предварительно охлажденной до температуры, равной от 0 до 5 С, затем гептаном (5,0 об.ч.). Выделенное твердое вещество сушили в вакууме при температуре, равной от 40 до 45 С, и получали 1-[(2'-метил-1,1'-бифенил-4-ил)карбонил]-4-оксо-L-пролин в виде почти белого твердого вещества. Выход: 60,3%. Стадия 3. Получение 4-метоксиимино-1-[(2'-метил-1,1'-бифенил-4-ил)карбонил]-L-пролина (соединение (VII) на схеме 6). 1-[(2'-Метил-1,1'-бифенил-4-ил)карбонил]-4-оксо-L-пролин (полученный на стадии 2, 1,0 мас.ч.), Oметилгидроксиламингидрохлорид (0,285 мас.ч.) и дихлорметан (20 об.ч.) помещали в колбу с отводом объемом 20 л и охлаждали до температуры, равной от 0 до 5 С. Триэтиламин (0,91 об.ч.) в колбу прибавляли так, чтобы температура поддерживалась в диапазоне от 0 до 10 С, реакционную смесь нагревали до температуры, равной от 15 до 25 С, и поддерживали в этом температурном диапазоне в течение от 16 до 20 ч. Реакционную смесь концентрировали в вакууме при температуре, равной от 40 до 45 С, остаток растворяли в этилацетате (10,0 об.ч.) и промывали водным раствором хлористо-водородной кислоты(1 М, 25,0 об.ч.). Водные промывочные растворы объединяли и подвергали обратной экстракции этилацетатом (5,0 об.ч.), органические экстракты объединяли и промывали насыщенным рассолом(10,0 об.ч.), сушили над сульфатом магния (0,5 мас.ч.), фильтровали и осадок на фильтре промывали этилацетатом (5,0 об.ч.). Фильтраты концентрировали в вакууме при температуре, равной от 40 до 45 С,и получали 4-метоксиимино-1-[(2'-метил-1,1'-бифенил-4-ил)карбонил]-L-пролин в виде ожидаемой смесиE:Z. Стадия 4 а. Получение (3EZ,5S)-1-[1-[(2'-метилбифенил-4-ил)карбонил]-5-3-[2-(триэтилсилил)окси]этил-1,2,4-оксадиазол-5-ил]пирролидин-3-он-O-метилоксима (соединение (Ib) на схеме 7). Раствор 4-метоксиимино-1-[(2'-метил-1,1'-бифенил-4-ил)карбонил]-L-пролина (80,0 г, 227,02 ммоль,1,00 экв.) в тетрагидрофуране (1,00 л) охлаждали до внутренней температуры, равной от 0 до 5 С. Порциями прибавляли карбонилдиимидазол (38,65 г, 238,37 ммоль, 1,05 экв.), так чтобы температура поддерживалась в диапазоне от 0 до 5 С. Реакционную смесь нагревали и перемешивали при температуре,равной от 20 до 25 С, пока по данным анализа с помощью ВЭЖХ реакция не завершалась (от 2 до 3 ч)(реакцию останавливали 2,0 М аммиаком в метаноле). Затем по каплям прибавляли N-гидрокси-3 триэтилсиланилоксипропионамидин (81,25 г, 238,37 ммоль, 1,05 экв., скорректировано на содержание силанола) в виде раствора в тетрагидрофуране (330 мл), так чтобы внутренняя температура поддерживалась в диапазоне от 20 до 25 С, и перемешивание продолжали при температуре, равной от 20 до 25 С, и за протеканием реакции следили на основании анализа с помощью ВЭЖХ. Завершение реакции отмечено через 18 ч. Реакционную смесь концентрировали при пониженном давлении при температуре, равной от 40 до 45 С. К веществу прибавляли пиридин (500 мл) и полученный раствор нагревали и поддерживали при температуре, равной от 85 до 90 С, пока по данным анализа с помощью ВЭЖХ циклизация не завершалась (от 2 до 3 ч). Реакционную смесь концентрировали при пониженном давлении при температуре, равной от 40 до 45 С, темный маслообразный остаток обрабатывали этилацетатом (1,00 л) и промывали 25% водным раствором лимонной кислоты (3400 мл). Водные экстракты объединяли и проводили обратную экстракцию этилацетатом (250 мл), объединенные органические фазы промывали рассолом (1,00 л), сушили над сульфатом магния, фильтровали и осадок на фильтре промывали этилацетатом. Объединенные фильтраты концентрировали при пониженном давлении при температуре, равной от 40 до 45 С, и получали неочищенный (3EZ,5S)-1-1-[(2'-метилбифенил-4-ил)карбонил]-5-(3-[2-(триэтилсилил)окси]этил)-1,2,4-оксадиазол-5-илпирролидин-3-он-O-метилоксим в виде коричневого масла, которое использовали без какой-либо дополнительной очистки (126,04 г, 104%). Стадия 4b. Получение (3Z,5S)-5-[3-(2-гидроксиэтил)-1,2,4-оксадиазол-5-ил]-1-[(2'-метилбифенил-4 ил)карбонил]-3-пирролидинон-O-метилоксима. Неочищенный (3EZ,5S)-1-[1-[(2'-метил-1,1'-бифенил-4-ил)карбонил]-5-3-[2'-(триэтилсилил)окси]этил-1,2,4-оксадиазол-5-ил]пирролидин-3-он-O-метилоксим (126,04 г) объединяли с другой порцией,полученной при таком же количестве исходных веществ (полное количество: 257,8 г, 482,11 ммоль,1,0 экв.). Прибавляли ацетонитрил (1,29 л, 5,0 об.ч.) и полученный раствор обрабатывали 5% водным раствором трифторуксусной кислоты (1,065 л). Анализ с помощью ЖХМС (жидкостная хроматография масс-спектроскопия) указывал на завершение реакции после перемешивания в течение ночи. Прибавляли гидрокарбонат натрия (48,5 г, 1,2 экв.) и реакционную смесь перемешивали в течение 5 мин. Продукт экстрагировали этилацетатом (3500 мл), объединенные экстракты промывали разбавленным вдвое насыщенным рассолом (3300 мл), сушили над сульфатом магния, фильтровали и концентрировали при пониженном давлении при температуре, равной от 40 до 45 С, и получали двухфазный маслообразный/твердый остаток. Остаток повторно растворяли в ацетонитриле (1,00 л), промывали гептаном(3200 мл), разделяли и концентрировали при пониженном давлении при температуре, равной от 40 до 45 С, и получали искомое соединение в виде коричневого масла (183,9 г, 90,7% от теоретического выхода). Очистку продукта E/Z проводили на колонке (Novasep, с использованием диоксида кремния,- 13011026 40-63 мкм; EtOAc/циклогексан = 2:3, затем чистый этилацетат), а затем с помощью дополнительной хроматографии (Novasep, с использованием диоксида кремния, 15-25 мкм; EtOAc/циклогексан = 1:1). Эти две очистки позволили удалить большую часть побочных продуктов и получить бледно-желтое масло. Третью очистку проводили при таких же условиях, как и вторую хроматографию, и получали чистый Z изомер в виде бесцветного масла, содержащий 5-10% соответствующего кетона. Растворение в смеси ТГФ/ДХМ (тетрагидрофуран/дихлорметан)=1:4 (всего: 7 об.ч.), обработка связанным с полимером трисамином (1 г на 4,5 г Z изомера) в течение от 24 до 48 ч, фильтрование и концентрировали при пониженном давлении при температуре, равной от 40 до 45 С, давали (3Z,5S)-5-[3-(2-гидроксиэтил)-1,2,4 оксадиазол-5-ил]-1-[(2'-метилбифенил-4-ил)карбонил]-3-пирролидинон-O-метилоксим в виде почти белого твердого вещества (выход в диапазоне: 30-35%). Пример 3. (3EZ,5S)-1-([1,1'-Бифенил]-4-илкарбонил)-5-5-[(диметиламино)метил]-1,2,4-оксадиазол 3-ил-3-пирролидинон-O-метилоксим; (3Z,5S)-1-([1,1'-бифенил]-4-илкарбонил)-5-5-[(диметиламино)метил]-1,2,4-оксадиазол-3-ил-3-пирролидинон-О-метилоксим; (3E,5S)-1-([1,1'-бифенил]-4-илкарбонил)5-5-[(диметиламино)метил]-1,2,4-оксадиазол-3-ил-3-пирролидинон-О-метилоксим. В этом примере стадии 1, 2 и 3 являются такими же, как и в примере 2. Стадия 4 а. Получение (2S,4Z)-1-([1,1'-бифенил]-4-илкарбонил)-4-(метоксиимино)-2-пирролидинкарбонитрила (соединение (VIIa) на схеме 7). Трехгорлую колбу объемом 6 л в атмосфере азота, содержащую (2S)-1-(бифенил-4-илкарбонил)-4(метоксиимино)пирролидин-2-карбоновую кислоту (151,95 г; 449,39 ммоль; 1,00 экв.) в сухом ТГФ(2500,00 мл), охлаждали до -20 С и затем прибавляли триэтиламин (62,46 мл; 449,39 ммоль; 1,00 экв.)-35 С. К раствору в течение 10 мин прибавляли этилхлорформиат (42,78 мл; 449,39 ммоль; 1,00 экв.),поддерживая температуру равной -35 С. Реакционную смесь перемешивали в течение 2 ч, давая температуре повыситься вплоть до -20 С. В течение 5 мин по каплям прибавляли еще 4 мл этилхлорформиата и реакционную смесь перемешивали при -20 С, в течение 30 мин. Насыщенный раствор аммиака в ТГФ получали пропусканием аммиака через 500 мл сухого ТГФ в течение 20 мин при -60 С в атмосфере азота в трехгорлой колбе объемом 2 л. Раствор аммиака прибавляли в колбу для проведения реакций через капельную воронку, поддерживая температуру ниже -25 С. Раствору давали нагреться до комнатной температуры в течение 3 ч и реакционную смесь перемешивали при в течение ночи. Реакционную смесь охлаждали до 10 С и в течение 10 мин при -60 С по каплям прибавляли еще 250 мл насыщенного раствора аммиака в ТГФ. Затем реакционную смесь перемешивали, давая температуре повыситься до комнатной. Непосредственно через реакционную смесь при 15 С пропускали аммиак в течение 10 мин, а затем перемешивали в течение 3 ч. Реакционную смесь концентрировали в вакууме до объема, равного 1 л. Полученную взвесь фильтровали и полученный остаток промывали с помощью 0,1 н. NaOH. Твердое вещество промывали водой и сушили и получали (2S,4Z)-1-([1,1'-бифенил]-4-илкарбонил)-4-(метоксиимино)-2 пирролидинкарбоксамид (102,10 г; 67,34%). В трехгорлую колбу объемом 3 л помещали (2S,4Z)-1-([1,1'бифенил]-4-илкарбонил)-4-(метоксиимино)-2-пирролидинкарбоксамид (102,10 г; 302,63 ммоль; 1,00 экв.) и толуол-4-сульфонилхлорид (86,54 г; 453,94 ммоль; 1,50 экв.) в пиридине (1 500,00 мл) и перемешивали при 80 С в течение ночи до завершения реакции. Летучие компоненты удаляли в вакууме и остаток растворяли в ДХМ (1 л). Органическую фазу промывали с помощью 1 н. HCl (2500 мл), затем насыщенным раствором NaHCO3 (1500 мл). Органическую фазу сушили над MgSO4, фильтровали и концентрировали и получали черный остаток (масса=178 г). Этот остаток растворяли в ДХМ 350 мл полученную суспензию фильтровали и получали порошок кремового цвета. Для очистки фильтрат вводили в хроматографическую колонку (Novasep) (дихлорметан). Необходимые фракции объединяли и концентрировали и получали коричневый остаток, который объединяли с выделенным ранее твердым веществом (порошок кремового цвета). Объединенные твердые вещества разбавляли метил-трет-бутиловым эфиром (500 мл), суспензию фильтровали и промывали метил-трет-бутиловым эфиром и получали(2S,4Z)-1-([1,1'-бифенил]-4-илкарбонил)-4-(метоксиимино)-2-пирролидинкарбонитрил (60,00 г; 62,08%). Стадия 4b. Получение (3EZ,5S)-1-([1,1'-бифенил]-4-илкарбонил)-5-5-[(диметиламино)метил]-1,2,4 оксадиазол-3-ил-3-пирролидинон-O-метилоксима; (3Z,5S)-1-([1,1'-бифенил]-4-илкарбонил)-5-5-[(диметиламино)метил]-1,2,4-оксадиазол-3-ил-3-пирролидинон-O-метилоксима; (3E,5S)-1-([1,1'-бифенил]-4 илкарбонил)-5-5-[(диметиламино)метил]-1,2,4-оксадиазол-3-ил-3-пирролидинон-О-метилоксима. В двухгорлую колбу объемом 2 л, содержащую (2S,4Z)-1-([1,1'-бифенил]-4-илкарбонил)-4(метоксиимино)-2-пирролидинкарбонитрил (59,10 г; 185,06 ммоль; 1,00 экв.) и гидроксиламингидрохлорид (15,43 г; 222,07 ммоль; 1,20 экв.) в EtOH (1 200,00 мл) при комнатной температуре в течение 5 мин по каплям прибавляли триэтиламин (30,87 мл; 222,07 ммоль; 1,20 экв.). Затем реакционную смесь перемешивали при 80 С в течение ночи, пока не обнаруживалось завершение реакции. Смеси давали охладиться до комнатной температуры и EtOH удаляли в вакууме. Прибавляли воду (1 л) и суспензию фильтровали. Для удаления всех побочных продуктов твердое вещество дважды промывали ацетонитрилом(2100 мл), затем диэтиловым эфиром (1100 мл) и получали продукт чистоты 75%. После сушки в вакууме при комнатной температуре получали (2S,4Z)-1-(бифенил-4-карбонил)-N'-гидрокси-4- 14011026(2S,4Z)-1-(бифенил-4-карбонил)-N'-гидрокси-4-(метоксиимино)пирролидин-2 карбоксамида (11,5 г; 32,63 ммоль; 1,00 экв.), 4-диметиламинопиридина (4,78 г; 39,16 ммоль; 1,20 экв.),N,N-диметилглицина (=R7-COOH; 4,04 г; 39,16 ммоль; 1,20 экв.) в 1000 мл смеси ДХМ/ДМФ (диметилформамид) (1:1) прибавляли N-(3-диметиламинопропил)-N'-этилкарбодиимидгидрохлорид (6,88 г; 35,90 ммоль; 1,10 экв.). Полученную бежевую суспензию перемешивали при комнатной температуре. Перемешивание продолжали в течение ночи. Растворитель удаляли при пониженном давлении, оставшийся коричневый маслообразный остаток растворяли в дихлорметане, дважды промывали 5% лимонной кислотой (для разрушения эмульсии требовалось прибавление рассола) и дважды насыщенным раствором NaHCO3, органический слой сушили над MgSO4 и концентрировали при пониженном давлений и получали 12,45 г желто-коричневатого твердого вещества. Указанное твердое вещество разделяли на 3 одинаковые порции (4,15 г), каждую порцию растворяли в 500 мл пиридина и полученные растворы нагревали при внешней температуре, равной 120 С, до завершения реакции. Порции объединяли, пиридин удаляли в вакууме, полученный остаток растворяли в ДХМ, дважды промывали 5% лимонной кислотой (вследствие образования эмульсии разделение фаз происходило только после прибавления рассола), сушили над MgSO4 и выпаривали при пониженном давлении и получали 12,9 г черного масла. Неочищенный продукт предварительно очищали путем фильтрования через слой (диоксид кремния; дихлорметан/МеОН = 95:5) и получали 10,67 г коричневого масла. Очистку E/Z продукта проводили на колонке (с использованием обычного диоксида кремния;EtOAc/циклогексан=9:1). Первая очистка позволила полностью удалить все побочные продукты и выделить продукт в виде почти белого твердого вещества (масса=6,73 г). Вторая очистка, проведенная при таких же условиях, дала чистый Z изомер: (3Z,5S)-1-([1,1'-бифенил]-4-илкарбонил)-5-5[(диметиламино)метил]-1,2,4-оксадиазол-3-ил-3-пирролидинон-О-метилоксим (4,937 г; 36%). Пример 3 а. (3EZ,5S)-5-5-[(Диметиламино)метил]-1,2,4-оксадиазол-3-ил-1-[(2'-метилбифенил-4 ил)карбонил]-пирролидин-3-он-O-метилоксим; (3Z,5S)-5-5-[(диметиламино)метил]-1,2,4-оксадиазол-3 ил-1-[(2'-метилбифенил-4-ил)карбонил]-пирролидин-3-он-O-метилоксим;(3E,5S)-5-5-[(диметиламино)метил]-1,2,4-оксадиазол-3-ил-1-[(2'-метилбифенил-4-ил)карбонил]-пирролидин-3-он-Oметилоксим. В этом примере стадии 1, 2 и 3 являются такими же, как и в примере 2 а. Стадия 4 а. Получение (2S,4EZ)-4-(метоксиимино)-1-[(2'-метилбифенил-4-ил)карбонил]пирролидин 2-карбонитрила (соединение (VIIa) на схеме 7). Трехгорлую колбу объемом 6 л в атмосфере азота, содержащую 4-метоксиимино-1-[(2'-метил-1,1'бифенил-4-ил)карбонил]-1-пролин (150,00 г; 425,66 ммоль; 1,00 экв.) в сухом ТГФ (2,5 л), охлаждали до-25 С и затем прибавляли триэтиламин (80,11 мл; 576,30 ммоль; 1,63 экв.) (температура повышалась до-23 С). Раствор перемешивали в течение 10 мин и температуру доводили до -40 С. К раствору в течение 30 мин прибавляли этилхлорформиат (54,86 мл; 576,30 ммоль; 1,63 экв.), поддерживая температуру ниже-35 С. Реакционную смесь перемешивали в течение 2,5 ч, давая температуре повыситься вплоть до-19 С. Получали оранжевую суспензию. Насыщенный раствор аммиака в ТГФ получали пропусканием аммиака через 500 мл сухого ТГФ в течение 20 мин при -40 С в атмосфере азота в трехгорлой колбе объемом 1 л. Раствор аммиака (400 мл) прибавляли в колбу для проведения реакции через капельную воронку, поддерживая температуру ниже -25 С. Полученному раствору давали нагреться до -20 С в течение 1 ч, после чего обнаружено завершение реакции и смеси давали нагреться до комнатной температуры в течение ночи. Реакционную смесь концентрировали в вакууме до объема, равного 200 мл, и полученный остаток разбавляли с помощью 600 мл МТБЭ (метил-трет-бутиловый эфир). Полученную суспензию фильтровали, осадок на фильтре промывали с помощью МТБЭ (2200 мл), объединенные фильтраты дополнительно разбавляли этилацетатом (400 мл) и промывали водой (2500 мл). Водную фазу подвергали обратной экстракции этилацетатом (300 мл), объединенные органические фазы сушили над сульфатом магния, фильтровали и концентрировали при пониженном давлении и получали (2S,4EZ)-4(метоксиимино)-1-[(2'-метилбифенил-4-ил)карбонил]-L-пролинамид (163,64; 109,4% от теоретического выхода). Затем продукт использовали без очистки. В трехгорлую колбу объемом 3 л помещали (2S,4EZ)4-(метоксиимино)-1-[(2'-метилбифенил-4-ил)карбонил]-L-пролинамид (149,56 г; 425,61 ммоль; 1,00 экв.,расчет основан на равном 100% выходе для предыдущей стадии) и толуол-4-сульфонилхлорид (121,71 г; 638,41 ммоль; 1,50 экв.) в пиридине (1,5 л) и перемешивали при 80 С до завершения реакции (4,5 ч). Летучие компоненты удаляли в вакууме при температуре, равной от 40 до 45 С, и остаток растворяли в ДХМ (1 л). Органическую фазу промывали с помощью 1 н. HCl (2500 мл), затем насыщенным раствором NaHCO3 (1 500 мл). Органическую фазу сушили над сульфатом магния, фильтровали и концентрировали и получали черный остаток. Этот остаток растворяли в ДХМ (350 мл) и для очистки вводили в хроматографическую колонку (Novasep) (дихлорметан). Необходимые фракции объединяли и концентрировали и получали коричневый остаток, который использовали без какой-либо дополнительной очистки. Выход:(3EZ,5S)-5-5-[(диметиламино)метил]-1,2,4-оксадиазол-3-ил-1-(2'метилбифенил-4-ил)карбонилпирролидин-3-он-O-метилоксима; (3Z,5S)-5-5-[(диметиламино)метил]1,2,4-оксадиазол-3-ил-1-[(2'-метилбифенил-4-ил)карбонил]пирролидин-3-он-O-метилоксима; (3E,5S)-55-[(диметиламино)метил]-1,2,4-оксадиазол-3-ил-1-[(2'-метилбифенил-4-ил)карбонил]пирролидин-3-онO-метилоксима. В двухгорлую колбу объемом 2 л, содержащую (2S,4EZ)-4-(метоксиимино)-1-[(2'-метилбифенил-4 ил)карбонил]пирролидин-2-карбонитрил (136,38 г; 278,70 ммоль; 1,00 экв.) и гидроксиламингидрохлорид (27,11 г; 390,18 ммоль; 1,40 экв.) в этаноле (1,5 л), при комнатной температуре в течение 5 мин по каплям прибавляли триэтиламин (54,23 мл; 390,18 ммоль; 1,40 экв.). Затем реакционную смесь перемешивали при 80 С в течение ночи, пока не обнаруживалось завершение реакции. Смеси давали охладиться до комнатной температуры и этанол удаляли в вакууме. Прибавляли воду (1 л) и суспензию фильтровали. Оставшееся твердое вещество дважды промывали ацетонитрилом (2150 мл) и сушили в вакууме при комнатной температуре и получали (2S,4EZ)-N'-гидрокси-4-(метоксиимино)-1-[(2'-метилбифенил-4 ил)карбонил]пирролидин-2-карбоксамид (52,00 г; 50,92%). К суспензии(2S,4EZ)-N'-гидрокси-4-(метоксиимино)-1-[(2'-метилбифенил-4-ил)карбонил]пирролидин-2-карбоксамида (19,00 г; 51,85 ммоль; 1,00 экв.), 4-диметиламинопиридина (7,60 г; 62,22 ммоль; 1,20 экв.), N,N-диметилглицина (=R7-COOH; 6,42 г; 62,22 ммоль; 1,20 экв.) в 1,8 л смеси ДХМ/ДМФ (1:1) прибавляли N-(3-диметиламинопропил)-N'-этилкарбодиимидгидрохлорид (10,93 г; 57,04 ммоль; 1,10 экв.). Полученную суспензию перемешивали при комнатной температуре в течение ночи, после чего образовывался раствор. Растворитель удаляли при пониженном давлении, полученный остаток растворяли в дихлорметане, дважды промывали 5% лимонной кислотой и дважды насыщенным раствором NaHCO3, органический слой сушили над сульфатом магния и концентрировали при пониженном давлении и получали 24,57 г коричневатого аморфного твердого вещества. Указанное твердое вещество разделяли на 5 одинаковых порций (4,91 г), каждую порцию растворяли в 200 мл пиридина и полученные растворы нагревали при внешней температуре, равной 120 С , до завершения реакции. Порции объединяли, пиридин удаляли в вакууме и полученный остаток предварительно очищали с помощью хроматографии (Novasep, 100% этилацетат) и получали коричневое масло (масса=10,28 г). Очистка с помощью флэш-хроматографии, проведенная при таких же условиях, дала желтое масло (масса=2,62 г),которое несколько раз очищали при таких же условиях и получали искомое соединение в виде чистого Z изомера: (3Z,5S)-5-5-[(диметиламино)метил]-1,2,4-оксадиазол-3-ил-1-[(2'-метилбифенил-4-ил)карбонил]пирролидин-3-он-O-метилоксим (3,54 г; 15%). Пример 4. (3Z/E,5S)-1-(Бифенил-4-илкарбонил)-(5-гидроксиметил)пирролидин-3-он-О-метилоксим. В этом примере стадии 1, 2 и 3 являются такими же, как и в примере 1. Стадия 4. (4Z/E,2S) Метил-1-(бифенил-4-илкарбонил)-(4-метоксиимино)пирролидин-2-карбоксилат(этерификация на схеме 7). 4-Метоксиимино-1-[(2'-метил-1,1'-бифенил-4-ил)карбонил]-L-пролин (1 мас.ч.), ацетон (10 об.ч.) и карбонат калия (1 мас.ч.) в атмосфере азота помещали в колбу подходящего объема. Содержимое охлаждали до температуры, равной от 0 до 10 С, и прибавляли диметилсульфат, поддерживая температуру ниже 10 С. Реакционную смесь нагревали до температуры, равной от 16 до 25 С, и поддерживали в этом температурном диапазоне до завершения реакции (ожидаемое время: от 1 до 2 ч). Содержимое концентрировали в вакууме при температуре, равной от 40 до 45 С. К остатку прибавляли этилацетат (8 об.ч.) и воду (8 об.ч.) и слои разделяли. Органическую фазу промывали насыщенным рассолом (8 об.ч.) и затем сушили над сульфатом натрия (2 мас.ч.). Содержимое фильтровали, осадок на фильтре промывали этилацетатом (1 об.ч.) и фильтраты концентрировали в вакууме при температуре, равной от 40 до 45 С. Остаток растворяли в дихлорметане (1 об.ч.) и полученный раствор разделяли на 2 порции для проведения хроматографии. Каждый раствор очищали с помощью флэш-хроматографии на "сухой" колонке с использованием диоксида кремния (1,8 мас.ч.) при элюировании с помощью 25 об./об.% этилацетата в гептанах (12 об.ч.), а затем с помощью 50 об./об.% этилацетат/гептаны (12 об.ч.) для удаления содержащихся в небольшом количестве примесей. Фракции, содержащие продукт, полученный из 2 колонок, объединяли и концентрировали в вакууме при температуре, равной от 40 до 45 С. Остаток растворяли в ТГФ(2,5 об.ч.) и повторно концентрировали в вакууме при температуре, равной от 40 до 45 С, и получали искомый продукт (от 80 до 100%, от 83 до 104 мас./мас.%). Стадия 5. Получение (3Z/E,5S)-1-(бифенил-4-илкарбоннл)-(5-гидроксиметил)пирролидин-3-он-Oметилоксима (восстановление в соединение (Id) на схеме 7).(4Z/E,2S) Метил-1-(бифенил-4-илкарбонил)-(4-метоксиимино)пирролидин-2-карбоксилат (1 мас.ч.),ТГФ (4,7 об.ч.) и метанол (4,7 об.ч.) помещали в колбу подходящего объема. Раствор охлаждали до температуры, равной от 0 до 10 С, в атмосфере азота и порциями прибавляли борогидрид лития (0,1 мас.ч.),поддерживая температуру ниже 20 С. Реакционную смесь перемешивали при температуре, равной от 16 до 25 С, до завершения реакции по данным ТСХ (ожидаемое время: от 2 до 3 ч). Реакцию останавливали путем прибавления воды (0,8 об.ч.) и концентрировали в вакууме при температуре, равной от 40 до 45 С. К остатку прибавляли этилацетат (10 об.ч.) и воду (5 об.ч.) и слои разделяли. Водную фазу подвергали обратной экстракции этилацетатом (2 об.ч.). Органические фазы объединяли и промывали с помощью(5 об.ч.). Органический раствор сушили над сульфатом магния (2 мас.ч.). Содержимое фильтровали и фильтрат концентрировали в вакууме при температуре, равной от 40 до 45 С, и получали искомый продукт (от 80 до 100%, от 74 до 92 мас./мас.%). Затем неочищенный продукт очищали. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения соединения формулы (I) в которой А обозначает карбонильную группу -(С=O)-; В выбран из группы, включающей оксадиазольное кольцо, амидогруппу формулы -(C=O)-NR3R4 и-(CH2)n-X-R8; в которой оксадиазольное кольцо описывается любой из формулR2 выбран из группы, включающей арил, гетероарил и насыщенный или ненасыщенный 3-8 членный циклоалкил;R3 и R4 независимо выбраны из группы, включающей водород, C1-C6-алкил, С 2-C6-алкенил, C2-C6 алкинил, алкоксигруппу, сульфанил, ацил, алкоксикарбонил, аминокарбонил, насыщенный или ненасыщенный 3-8-членный циклоалкил, который может содержать 1-3 гетероатома, выбранных из группы,включающей N, О, S, арил, гетероарил, C1-C6-алкиларил и C1-C6-алкилгетероарил;R7 выбран из группы, включающей водород, сульфонил, аминогруппу, C1-C6-алкил, C2-C6-алкенил,C2-C6-алкинил, где указанные алкильные, алкенильные, алкинильные цепи необязательно включают гетероатом, выбранный из группы, включающей N, О и S, арил, гетероарил, насыщенный или ненасыщенный 3-8-членный циклоалкил, гетероциклоалкил, где указанные циклоалкильные, гетероциклоалкильные, арильные или гетероарильные группы необязательно сконденсированы еще с 1-2 циклоалкильными,гетероциклоалкильными, арильными или гетероарильными группами, ацильный фрагмент, C1-C6 алкиларил, C1-C6-алкилгетероарил, C1-C6-алкениларил, C1-C6-алкенилгетероарил, C1-C6-алкиниларил, C1C6-алкинилгетероарил, C1-C6-алкилциклоалкил, C1-C6-алкилгетероциклоалкил, C1-C6-алкенилциклоалкил, C1-C6-алкенилгетероциклоалкил, C1-C6-алкинилциклоалкил, C1-C6-алкинилгетероциклоалкил, алC1-C6-алкилацил,C1-C6-алкилкоксикарбонил,аминокарбонил,C1-C6-алкилкарбоксигруппу,ацилоксигруппу, C1-C6-алкилалкоксигруппу, C1-C6-алкилалкоксикарбонил, C1-C6-алкиламинокарбонил,C1-C6-алкилациламиногруппу, C1-C6-алкилуреидогруппу, C1-C6-алкиламиногруппу, C1-C6-алкиламмониевую группу, C1-C6-алкилсульфонилоксигруппу, C1-C6-алкилсульфонил, C1-C6-алкилсульфинил, С 1-C6 алкилсульфанил, C1-C6-алкилсульфониламиногруппу, C1-C6-алкиламиносульфонил, гидроксигруппу,галоген и цианогруппу;R8 и R9 совместно с атомом N, с которым они связаны, могут образовать пяти-восьмичленное насыщенное или ненасыщенное гетероциклоалкильное кольцо; иn является целым числом, равным от 1 до 3; где "арил" означает ненасыщенную ароматическую карбоциклическую группу, содержащую от 6 до 14 атомов углерода, включающую одно кольцо или несколько конденсированных колец,"гетероарил" означает моноциклическую гетероароматическую группу или бициклическую или трициклическую гетероароматическую группу, содержащую конденсированные кольца,"гетероциклоалкил" означает C3-C8-циклоалкильную группу, в которой вплоть до 3 атомов углерода заменены гетероатомами, выбранными из группы, включающей О, S, NR, где R обозначает водород или метил,"ацил" означает группу -C(O)R, в которой R означает "C1-C6-алкил", "арил", "гетероарил", "C3-C8 циклоалкил", "гетероциклоалкил", "C1-C6-алкиларил" или "C1-C6-алкилгетероарил",указанный способ включает следующие стадии: стадия 1: превращение пирролидина формулы (II) в ацилпроизводное формулы (IV) с использованием ацилирующего реагента (III) стадия 2: окисление ацилпроизводного (IV) окислительным реагентом с получением пирролидона формулы (V) стадия 3: превращение пирролидона формулы (V) в соединение (VII) с использованием подходящего алкоксиламина, арилоксиламина или гидроксиламина общей формулы (VI) стадия 4: превращение соединения (VII) с помощью амина общей формулы (VIII) или Nгидроксиамидина общей формулы (IX) с получением соединений (Ia) и (Ib) или превращение соединения(VII) сначала в нитрил (VIIa), который затем превращают в гидроксиамидин (VIIb), который затем вводят в реакцию с карбоновой кислотой R7-СООН и получают соединение (Ic), или сначала проведение этерификации и последующего восстановления соединения (VII) с использованием подходящего этерифицирующего или восстановительного реагента соответственно с получением соединения (Id) 2. Способ получения соединения формулы (I) по п.1 в которой А обозначает карбонильную группу -(С=O)-; В обозначает амидогруппу формулы -(C=O)-NR3R4 или оксадиазольное кольцо, описываемое любой из формулR7 выбран из группы, включающей водород, сульфонил, аминогруппу, C1-C6-алкил, C2-C6-алкенил,C2-C6-алкинил, где указанные алкильные, алкенильные, алкинильные цепи необязательно включают гетероатом, выбранный из группы, включающей N, О и S, арил, гетероарил, насыщенный или ненасыщенный 3-8-членный циклоалкил, гетероциклоалкил, где указанные циклоалкильные, гетероциклоалкильные, арильные или гетероарильные группы необязательно сконденсированы еще с 1-2 циклоалкильными,гетероциклоалкильными, арильными или гетероарильными группами, ацильный фрагмент, C1-C6 алкиларил, C1-C6-алкилгетероарил, C1-C6-алкениларил, C1-C6-алкенилгетероарил, C1-C6-алкиниларил, C1C6-алкинилгетероарил, C1-C6-алкилциклоалкил, C1-C6-алкилгетероциклоалкил, C1-C6-алкенилциклоалкил, C1-C6-алкенилгетероциклоалкил, C1-C6-алкинилциклоалкил, C1-C6-алкинилгетероциклоалкил, алкоксикарбонил, аминокарбонил, C1-C6-алкилкарбоксигруппу, C1-C6-алкилацил, C1-C6-алкилацилоксигруппу, C1-C6-алкилалкоксигруппу, C1-C6-алкилалкоксигруппу-карбонил, C1-C6-алкиламинокарбонил,C1-C6-алкилациламиногруппу,C1-C6-алкилуреидогруппу,C1-C6-алкиламиногруппу,C1-C6-алкиламмониевую группу, C1-C6-алкилсульфонилоксигруппу, C1-C6-алкилсульфонил, C1-C6-алкилсульфинил,С 1-C6-алкилсульфанил, C1-C6-алкилсульфониламиногруппу, C1-C6-алкиламиносульфонил, гидроксигруппу, галоген и цианогруппу;R2 выбран из группы, включающей арил, гетероарил и насыщенный или ненасыщенный 3-8 членный циклоалкил;R3 и R4 независимо выбраны из группы, включающей водород, C1-C6-алкил, C2-C6-алкенил, C2-C6 алкинил, алкоксигруппу, сульфанил, ацил, алкоксикарбонил, аминокарбонил, насыщенный или ненасыщенный 3-8-членный циклоалкил, который может содержать 1-3 гетероатома, выбранных из группы,включающей N, О, S, арил, гетероарил, C1-C6-алкиларил и C1-C6-алкилгетероарил;- 19011026 указанный способ включает следующие стадии: стадия 1: превращение пирролидина формулы (II) в ацилпроизводное формулы (IV) с использованием ацилирующего реагента (III) стадия 2: окисление ацилпроизводного (IV) окислительным реагентом с получением пирролидона формулы (V) стадия 3: превращение пирролидона формулы (V) в соединение (VII) с использованием подходящего алкоксиламина, арилоксиламина или гидроксиламина общей формулы (VI) стадия 4: превращение соединения (VII) с помощью амина общей формулы (VIII) или Nгидроксиамидина общей формулы (IX) с получением соединений (Ia) и (Ib), или превращение соединения (VII) сначала в нитрил (VIIa), который затем превращают в гидроксиамидин (VIIb), который затем вводят в реакцию с карбоновой кислотой R7-СООН и получают соединение (Ic) 3. Способ по п.1 или 2, в котором ацилхлорид, применяющийся на стадии 1, представляет собой 1'1 бифенил-4-карбонилхлорид или 2'-метил-1'1-бифенил-4-карбонилхлорид. 4. Способ по любому из пп.1-3, в котором окислительный реагент, применяющийся на стадии 2,представляет собой комплекс пиридин-триоксид серы (Ру-SO3) в комбинации с ДМСО. 5. Способ по любому из пп.2-4, в котором реакцию проводят в присутствии триэтиламина. 6. Способ по любому из пп.1-5, в котором алкоксиламин, применяющийся на стадии 3, представляет собой О-метилгидроксиламингидрохлорид. 7. Способ по любому из пп.1-6, в котором R1 обозначает метильную группу, R2 обозначает бифенил. 8. Способ по любому из пп.1-7, в котором В обозначает амидогруппу формулы -(C=O)NHR5, где R5 обозначает C1-C6-алкиларильную группу. 9. Способ по п.8, в котором R5 обозначает фенилэтильную группу, которая замещена аминогруппой или гидроксигруппой. 10. Способ по любому из пп.1-7, в котором В обозначает 1,2,4-оксадиазольный заместитель где R7 обозначает C1-C6-алкил или циклоалкил, необязательно содержащий 1 или 2 гетероатома. 11. Способ по любому из пп.1, 3, 4 или 6, 7, в котором В обозначает -(CH2)n-X-R8, где X обозначает О, R8 обозначает водород и n равно 1. 12. Способ по любому из пп.1-11, в котором соединение выбрано из группы, включающей
МПК / Метки
МПК: C07D 207/22, C07D 413/04
Метки: пирролидиноксимов, получения, способ
Код ссылки
<a href="https://eas.patents.su/22-11026-sposob-polucheniya-pirrolidinoksimov.html" rel="bookmark" title="База патентов Евразийского Союза">Способ получения пирролидиноксимов</a>
Предыдущий патент: Новые соединения
Следующий патент: Фанера и способ ее изготовления
Случайный патент: Способ обновления и использования баз географических данных и пространственно-распределенная гибридная навигационная система для его реализации












