Молекулы, ингибирующие ангиогенез, и их применение в лечении и диагностике рака
Формула / Реферат
1. Ингибирующая ангиогенез молекула, выбранная из группы, состоящей из антитела H33, продуцируемого гибридомой 13H33, депонированной 22 октября 2003 г. в Немецкой коллекции микроорганизмов и клеточных культур GmbH под регистрационным номером DSM ACC2622, а также его фрагментов и производных, имеющих ту же специфичность, что и H33.
2. Ингибирующая ангиогенез молекула по п.1, выбранная из группы, состоящей из:
a) гуманизированного антитела на основе антитела H33, имеющего ту же специфичность, что и H33;
b) химерного антитела на основе антитела H33, имеющего ту же специфичность, что и H33;
c) фрагмента H33, выбранного из
(i) Fab-фрагмента;
(ii) Fv-фрагмента;
(iii) однодоменного антигенсвязывающего фрагмента;
(iv) scFv, димера scFv, тримера scFv и более крупных агрегатов scFv;
(v) VHH;
d) рекомбинантного антитела, имеющего специфичность H33; и
e) человеческого моноклонального антитела, имеющего ту же специфичность, что и H33.
3. Ингибирующая ангиогенез молекула по п.1 или 2, где указанная молекула
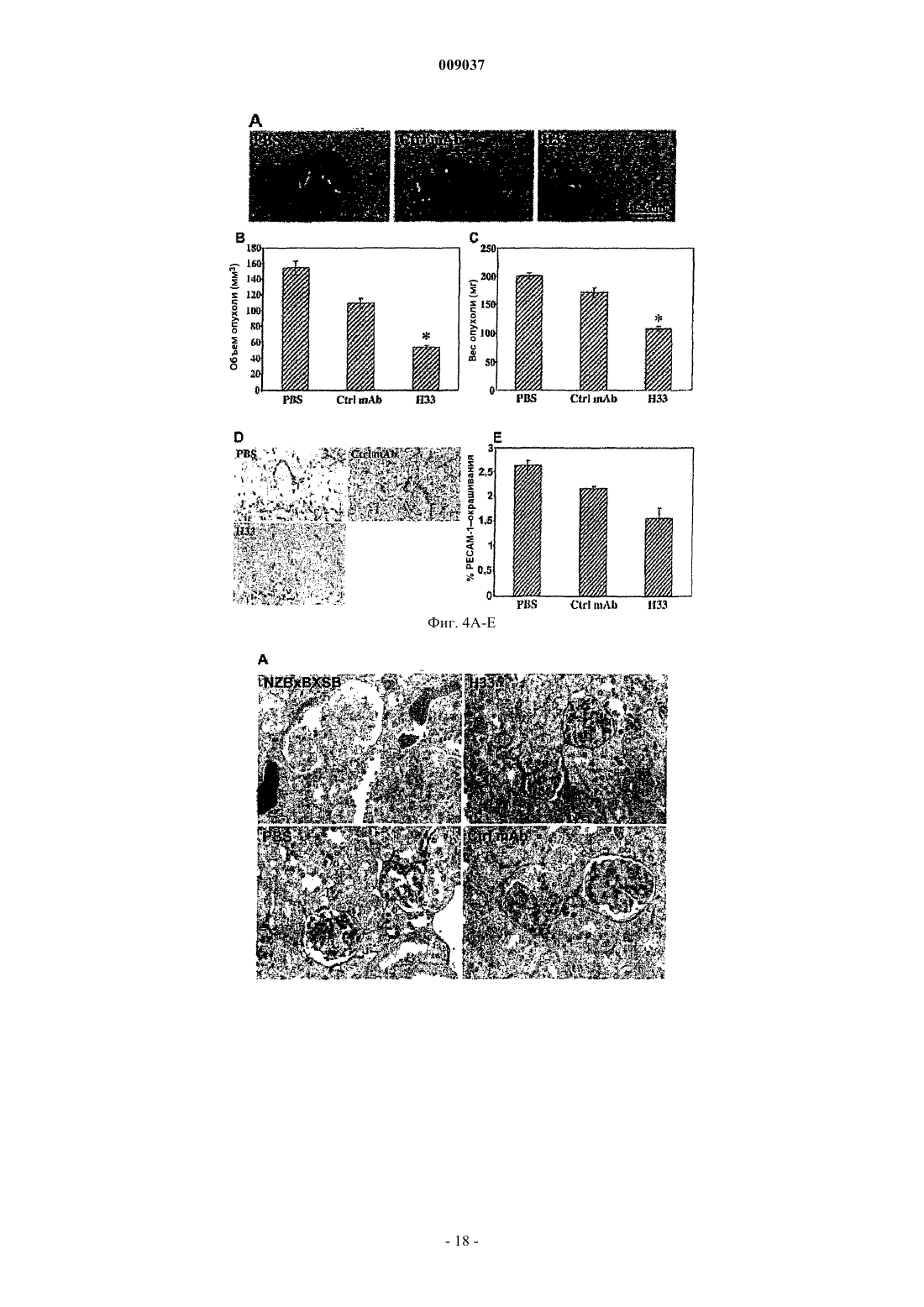
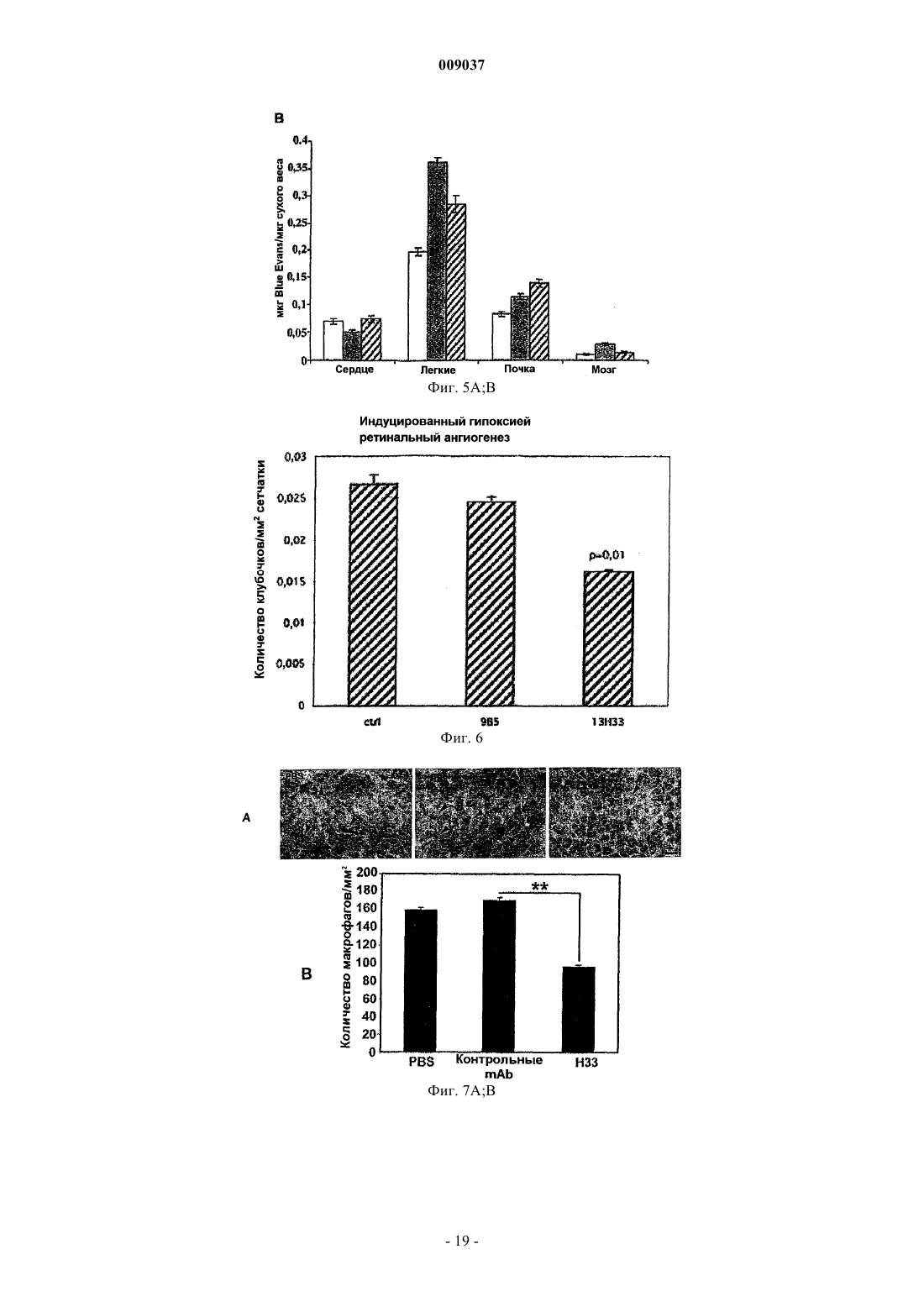
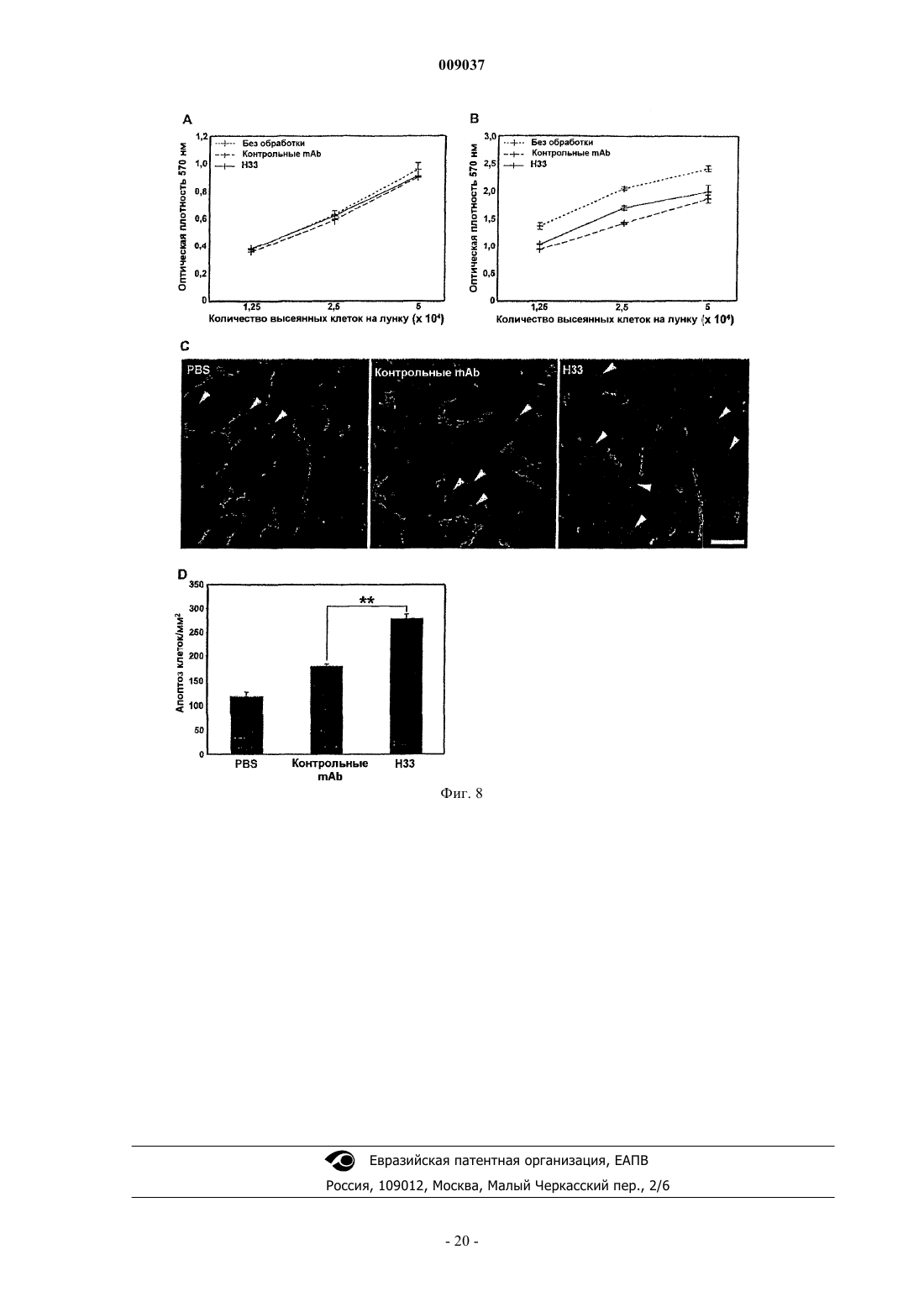
a) блокирует ангиогенез in vitro и in vivo;
b) предотвращает опухолевый рост in vivo;
c) снижает рекрутинг макрофагов в опухолях; и
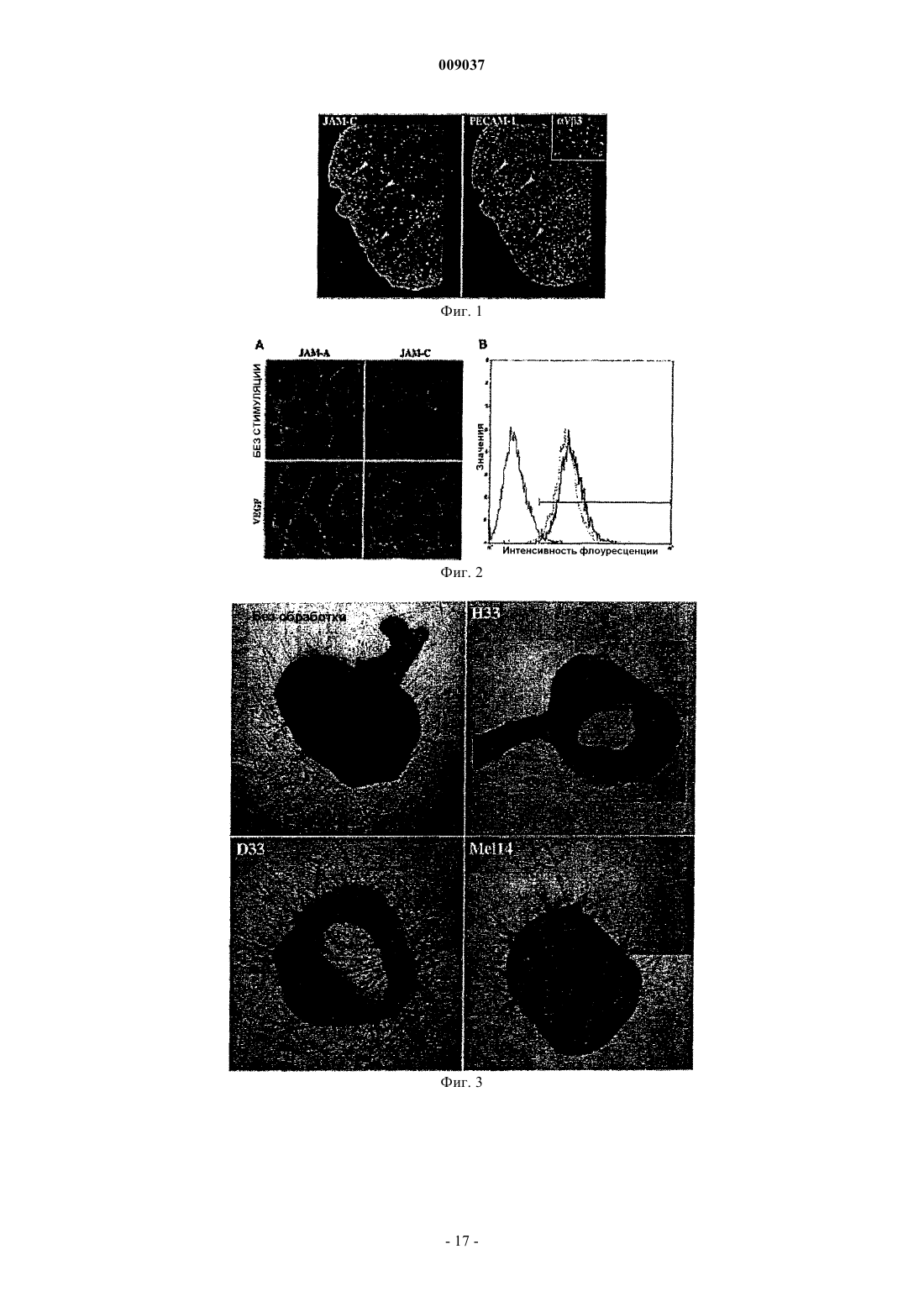
d) блокирует взаимодействие JAM-C с JAM-B.
4. Слитый белок, включающий в себя (а) ингибирующую ангиогенез молекулу по любому из пп.1-3 и (b) одну или две неиммуноглобулиновые части.
5. Применение ингибирующей ангиогенез молекулы по любому из пп.1-4 в качестве лекарственного средства.
6. Гибридома 13H33, депонированная в Немецкой коллекции микроорганизмов и клеточных культур GmbH под регистрационным номером DSM ACC2622.
7. Полинуклеотид, который кодирует ингибирующую ангиогенез молекулу по любому из пп.1-4.
8. Экспрессирующая кассета, содержащая полинуклеотид по п.7, связанный с соответствующими контрольными последовательностями, обеспечивающими регуляцию транскрипции и трансляции в выбранной хозяйской клетке.
9. Рекомбинантный вектор, содержащий экспрессирующую кассету по п.8.
10. Хозяйская клетка, содержащая вектор по п.9.
11. Способ получения ингибирующей ангиогенез молекулы по любому из пп.1-4, включающий в себя:
a) введение в эукариотическую или прокариотическую хозяйскую клетку рекомбинантного экспрессирующего вектора, кодирующего указанную ингибирующую ангиогенез молекулу; и
b) культивирование хозяйской клетки в течение времени, достаточного для экспрессии продукта в хозяйской клетке.
12. Способ по п.11, где хозяйская клетка представляет собой клетку млекопитающего.
13. Способ по п.12, где хозяйская клетка представляет собой клетку СНО, клетку NS/0 миеломы, COS, HEK293 или клетку SP2.0.
14. Применение ингибирующей ангиогенез молекулы по любому из пп.1-4 для получения терапевтической или диагностической композиции для лечения или диагностики рака.
15. Применение по п.14, где рак представляет собой солидную опухоль.
16. Применение ингибирующей ангиогенез молекулы по любому из пп.1-4 для получения лекарственного средства для предотвращения у пациентов взаимодействия JAM-B/JAM-C.
17. Фармацевтическая композиция, включающая в себя ингибирующую ангиогенез молекулу по любому из пп.1-4 наряду с подходящим наполнителем, носителем или разбавителем.
18. Диагностическая композиция, включающая в себя ингибирующую ангиогенез молекулу по любому из пп.1-4 наряду с подходящим наполнителем, носителем или разбавителем.
19. Диагностическая композиция по п.18, где ингибирующая ангиогенез молекула является меченой.
20. Применение ингибирующей ангиогенез молекулы по любому из пп.1-4 в диагностике in vivo.
21. Применение диагностической композиции по любому из пп.18-19 в диагностике in vivo.
Текст
009037 Настоящее изобретение относится к молекулам, способным ингибировать ангиогенез, к терапевтическим композициям и диагностическим наборам, включающим в себя одну или более из подобных молекул, и к применению указанных молекул в медицине, в частности, в лечении и диагностике рака, в частности, солидных опухолей. Изложенное далее представляет собой открытый авторами изобретения способ получения подобных молекул. Ангиогенез, то есть формирование новых кровеносных сосудов из предсуществующей сосудистой сети, является фундаментальным процессом в заживлении ран, размножении и эмбриональном развитии. Ангиогенез также является важнейшим процессом в формировании опухолей. Новые кровеносные сосуды снабжают опухоль веществами, необходимыми для осуществления неконтролируемого митоза. В процессе ангиогенеза эндотелиальные клетки пролиферируют, мигрируют в новую ткань и формируют интерэндотелиальные соединения, что приводит к образованию сосудистой трубки. Данный процесс инициируется и управляется ангиогенными факторами. VEGF- и ангиопоэтин-опосредованная передача сигнала приводит к потере контакта перицитов и эндотелиальных клеток, приводя к пролиферации последних и их интеграции с внеклеточным матриксом, опосредованной интегринами. Было показано, что интегрины v3 и v5 принимают участие в развитии кровеносных сосудов и ангиогенезе путем сигнальных кросс-взаимодействий с ангиогенными факторами. Помимо взаимодействий эндотелиальных клеток с внеклеточным матриксом, важным для формирования сосудистой трубки является регуляция межэндотелиальных контактов. Так, адгезивная молекулаVE-кадхерин играет роль в ремоделировании сосудистой сети и поддержании целостности кровеносных сосудов. В исследовании, давшем начало настоящему изобретению, были открыты соединительные адгезивные молекулы JAM-B и JAM-C. Эти молекулы локализованы в сосудах в области межклеточных контактов и вовлечены в трансэндотелиальную миграцию лейкоцитов. Далее было обнаружено, что взаимодействие между JAM-B и JAM-C также играет важную роль в ангиогенезе. На основании данных результатов заявители предприняли попытку обнаружить новые молекулы,способные ингибировать ангиогенез. Для этого они воспользовались способом, состоящим из следующих этапов:b) тестирования указанных молекул на их способность блокировать связывание JAM-B с JAM-C;c) тестирования позитивных молекул на их способность блокировать ангиогенез in vivo; иd) отбора молекул, позитивных в тестах in vivo, в качестве молекул, ингибирующих ангиогенез. Для тестирования молекул на их способность ингибировать ангиогенез in vivo можно воспользоваться тестом на реваскуляризацию сетчатки согласно примеру 4. Согласно данному изобретению было найдено, что не все молекулы, способные блокировать связывание JAM-B и JAM-C между собой, способны также ингибировать ангиогенез. Таким образом, дополнительный тест по пункту (d) (смотрите выше) необходим для идентификации целевых молекул. Для идентификации подмножества молекул, подходящих для использования в целях, заявленных в настоящем изобретении, вышеописанный способ может быть дополнен этапом тестирования позитивных молекул на их способность ингибировать опухолевый рост in vivo. Пример теста на ингибирование опухолевого роста in vivo изложен в примере 5. Результатом этапа, соответствующего изоляции или продуцированию ингибирующих ангиогенез молекул, является фактическое получение желаемых молекул. Набор молекул, которые могут быть протестированы в данном способе, может быть разнообразным. Это может быть, к примеру, популяция анти-JAM-B- или анти-JАМ-С-антител. Получение антител отличается простотой методологии, не требующей каких-либо навыков, выходящих за рамки традиционных способов, и обсуждается, к примеру, в работе KohlerMilstein, Nature 256: 495-497 (1975). Таким образом, специалист в данной области способен получить указанный набор молекул без дополнительного привлечения нежелательной методологической нагрузки. Тестирование молекул на их способность блокировать связывание JAM-B и JAM-C между собой может быть проведено, к примеру, путем инкубации клеток, экпрессирующих JAM-B или JAM-C на своей поверхности, с мечеными растворимыми формами JAM-С или JAM-B, соответственно, в присутствии тестируемых молекул, и последующей оценки снижения эффективности мечения клеток по отношению к контрольным клеткам, инкубировавшимся в отсутствие тестируемых молекул. Молекулы, в присутствии которых наблюдается снижение количества визуализируемой метки по отношению к контрольным клеткам, экспрессирующим молекулы JAM-B или JAM-C и связывающим меченые JAM-B или JAM-C, но лишенным поверхностно-связанной тестируемой молекулы, отбираются как позитивные. Подходящими метками могут быть флуоресцентные, радиоактивные или биотиновые метки, и все они известны специалистам в данной области. Подходящими способами визуализации метки, снижения ее количества или ее исчезновения являются проточная цитометрия, биохимические способы или ферментный иммуносорбентный анализ (ELISA). Молекулы, способные ингибировать связывание JAM-B и JAM-C, далее тестируются на их способность ингибировать ангиогенез in vivo. Для решения этой задачи могут быть использованы различные-1 009037 способы. Тем не менее, приведенный в примере 4 тест на реваскуляризацию сетчатки подходит в особенности хорошо, поскольку в данной модели ремоделирование сосудистой сети зависит в первую очередь от эндотелиальных клеток, а не от факторов микроокружения. Альтернативными тестами являются анализ на хорио-аллантоисной мембране, тест ишемия-реперфузия либо трансплантация нагруженного ангиогенными факторами матригеля. Эти тесты хорошо известны специалистам в данной области. В дополнение либо вместо тестирования способности ингибировать ангиогенез in vivo, кандидатные молекулы могут быть протестированы на их способность ингибировать опухолевый рост in vivo. Пример подходящей методики выполнения подобного теста приведен в примере 5. Применение вышеописанного способа привело в конечном счете к идентификации антитела Н 33,продуцируемого гибридомой 13 Н 33, депонированной 22 октября 2003 г. в Немецкой коллекции микроорганизмов и клеточных культур GmbH под регистрационным номером DSM ACC2622 как ингибирующей ангиогенез молекулы согласно изобретению. Было показано, что анти-JАМ-С-антитела H33 могут блокировать ангиогенез in vitro и in vivo и опухолевый рост in vivo. Они также уменьшают рекрутирование макрофагов в опухолевую ткань. Они также способны блокировать связывание JAM-B с JAM-C. H33 не влияет на процессы пролиферации или апоптоза. Таким образом, изобретение относится к применению антитела H33 в качестве лекарственного средства, в частности, для лечения рака, в частности, солидных опухолей. Дополнительно изобретение относится к фрагментам и производным H33, используемым в качестве лекарственных средств. Подобными фрагментами и производными могут быть, в частности, Fab-фрагменты, Fv-фрагменты, однодоменные антигенсвязывающие фрагменты, рекомбинантные антитела со специфичностью H33, scFvфрагменты и их агрегаты, VHH-фрагменты, гуманизированные производные H33, химерные антитела, как минимум имеющие специфичность H33, либо имеющие таковую специфичность человеческие антитела. Подходящим способом получения последних является продуцирование в организме трансгенных мышей или иных животных, как будет описано ниже. Далее, изобретение относится к фрагментам и производным антител, сохраняющим антигенсвязывающую способность антитела в целом. Такие фрагменты и производные не были описаны ранее и являются, таким образом, новыми. Функциональные антигенсвязывающие фрагменты могут быть получены путем протеолиза антител(расщепление папаином или пепсином, а также другие энзиматические подходы) с образованием Fabфрагментов, Fv-фрагментов либо отдельных доменов. В качестве альтернативной методики может быть использована рекомбинантная технология. Fabфрагменты (Fragment antigen binding, антигенсвязывающие фрагменты) - это антигенсвязывающие домены молекулы антитела, содержащие VH+CH1 и CL+VL. Домены CL и СH1 связаны межцепочечной дисульфидной связью. Молекулярный вес гетеродимера составляет обычно около 50 кДа. Fab-фрагменты могуть быть получены путем расщепления нативной молекулы антитела папаином. Минимальным фрагментом, целиком сохраняющим антигенсвязывающий сайт полного антителаIgG, является 30-кДа гетеродимер, состоящий из вариабельных доменов легкой и тяжелой цепей (VL иVH, соответственно). Этот гетеродимер, называемый Fv (Fragment variable, вариабельный фрагмент), еще сохраняет способность связывать антиген. Другой фрагмент представляет собой однодоменный антигенсвязывающий фрагмент (dAb) или VH. Одноцепочечные Fv-фрагменты могут быть получены путем рекомбинантной технологии. В scFvфрагменте домены VH и VL соединены гидрофильным гибким пептидным линкером.ScFv-фрагменты могут быть собраны в комплексы: димеры (диантитела), тримеры (триантитела) или более крупные агрегаты, мономерные единицы которых могут иметь одну и ту же или разные специфичности. Следующим типом фрагментов антител являются VHH-фрагменты, содержащие наименьшие доступные интактные антигенсвязывающие фрагменты. VHH могут быть получены путем протеолиза тяжелых цепей антител иммунизированных животных семейства верблюдовых либо с использованием рекомбинантной технологии. При использовании технологии рекомбинантной ДНК, по существу, полинуклеотид, кодирующийV-домен Н- или L-цепи антитела H33, может быть слит с полинуклеотидом, кодирующим константную область предпочтительно человеческой Н- или L-цепи. Для экспресии полученных таким образом полноразмерных Н- или L-цепей также может быть добавлена последовательность, кодирующая сигнальный пептид, необходимый для секреции белка. Для продукции ингибирующих ангиогенез молекул согласно изобретению используются экспрессирующие кассеты, в которых слитый нуклеотид согласно изобретению связан с подходящей контрольной последовательностью, обеспечивающей регуляцию транскрипции и трансляции в хозяйских клетках,а также рекомбинантные векторы, содержащие полинуклеотид, кодирующий подобную экспрессирующую кассету. Полинуклеотиды согласно изобретению, т.е. молекулы, ингибирующие ангиогенез и имеющие специфичность H33, таким образом, могут быть легко получены как широко известными способами технологии рекомбинантной ДНК, так и путем химического синтеза ДНК.-2 009037 Рекомбинантные ДНК-конструкты могут быть получены и введены в хозяйские клетки широко известными способами технологии рекомбинантной ДНК и генной инженерии. Подходящими хозяйскими клетками в рамках данного изобретения могут быть прокариотические или эукариотические клетки. Среди подходящих эукариотических клеток можно назвать, к примеру, растительные клетки, клетки дрожжей, таких как Saccharomyces, клетки насекомых, таких как Drosophila или Spodoptera, и клетки млекопитающих, такие как HeLa, СНО, 3 Т 3, С 127, ВНК, COS и т.д. Существует ряд способов трансфекции прокариотических или эукариотических клеток векторами,содержащими химерный ДНК-конструкт, кодирующий химерную Ig-цепь. Предпочтительный способ введения вектора в лимфоидные клетки - сферобластное слияние (см. Gillies et al. (1989) Biotechnol. 7: 798-804). Альтернативными способами являются электропорация или кальций-фосфатная преципитация. Другие подходящие способы продуцирования иммуноконъюгатов включают в себя получение последовательности РНК, кодирующей конструкт, и ее трансляцию в подходящей системе in vitro или in vivo. После экспрессии белки согласно изобретению могут быть выделены с использованием стандартных способов очистки белков (см., к примеру, патент США 5650150). В том случае, когда тяжелую и легкую цепи комбинируют в молекуле согласно изобретению, тяжелая цепь вариабельной области предпочтительно коэкспрессируется с соответствующей легкой цепью. Для слитых белков, содержащих несколько полипептидных цепей, может быть использовано более одного экспрессирующего вектора. Котрансфекционные способы, в которых используется, к примеру, более одного вектора, часто позволяют добиться доставки обоих векторов в целевую клетку. В качестве альтернативы, иногда полезно использование единого вектора, кодирующего несколько полипептидов для коэкспрессии в одной и той же клетке. Далее, может быть удобно экспрессировать белки согласно изобретению как одноцепочечные молекулы. К примеру, вариабельная область антитела может быть экспрессирована как одноцепочечное антитело или sFv-фрагмент, факультативно слитый с неиммуноглобулиновым белком. В другом воплощении тяжелую цепь (слитую с цитокином или нативную) комбинируют с легкой (или тяжелой) цепьюVL и VH-области могут быть связаны дисульфидной или пептидной связью, в зависимости от того,как сконструированы соответствующие им нуклеотидные последовательности. Как правило, V-области связаны дисульфидной связью, если они кодируются нуклеотидной последовательностью из различных ДНК-конструктов. Напротив, V-области связаны пептидной связью, если они представляют собой единую полипептидную цепь, кодируемую единой нуклеотидной последовательностью. В некоторых воплощениях согласно изобретению, вариабельные области легких и тяжелых цепей могут быть соединены с константными областями легкой и тяжелой цепей, соответственно. Могут быть использованы как каппа, так и лямбда-типы константных областей легких цепей. Конструкция экспрессирующих векторов согласно изобретению и трансформация хозяйских клеток могут быть выполнены с использованием стандартных способов молекулярной биологии. Ингибирующие ангиогенез молекулы согласно изобретению, полученные с использованием подобных прокариотических и эукариотических экспрессирующих систем, могут быть выделены и очищены из клеток или культуральных супернатантов с использованием протеин А-сефарозы и протестированы наJAM-C-связывающую активность путем измерения их ингибиторной активности, выражающейся в способности конкурировать с H33 за связывание с растворимым JAM-C, нанесенным на микротитровальные планшеты, хорошо известными способами конкурентного ELISA-анализа. Оставшиеся вариабельные домены иммуноглобулинов крысы могут быть иммуногенными для человека, и вследствие этого эффективность терапии антителами может быть снижена. Для снижения иммуногенности может быть использован ряд хорошо известных способов, таких как маскировка и гуманизация, предполагающая внесение ряда аминокислотных замен согласно тому, как описано в патенте WO2004055056. Далее может быть выполнен скрининг на аффинность связывания согласно описанному выше тестированию на способность конкурировать с H33. В качестве альтернативы, нечеловеческие Т-клеточные эпитопы могут быть подвергнуты мутированию таким образом, чтобы они соответствовали собственным человеческим эпитопам, присутствующим в человеческих антителах (см., к примеру, патент США 5712120). Представляющие собой часть изобретения VL и VH-содержащие антитела H33 включают в себя, как минимум, одну гуманизированную последовательность, снижающую, таким образом, иммуногенность антитела при введении человеку. Дальнейшее продуцирование антител в хозяйских клетках и их очистка могут быть выполнены согласно изложенному выше. В соответствии с другим аспектом изобретения вариабельная область антитела H33 или подобная молекула может быть конъюгирована с неиммуноглобулиновой частью, либо непосредственно, либо через Fc-фрагмент. В частности, неиммуноглобулиновым фрагментом может быть цитокин, такой как интерлейкин, какой-либо гемопоэтический фактор, лимфокин, интерферон или хемокин. Интерлейкином может быть, к примеру, интерлейкин-2 или интерлейкин-12. Гемопоэтическим фактором и лимфокином могут быть, к примеру, гранулоцитарно-макрофагальный колониестимулирующий фактор (ГМ-КСФ) и лимфотоксин, соответственно. Интерфероном может быть, к примеру, интерферон-, интерферон- или-3 009037 интерферон-. В некоторых воплощениях данного изобретения слитый белок включает в себя вторую неиммуноглобулиновую часть, такую как второй цитокин. В настоящем изобретении предусмотрено также применение антитела H33 или его фрагментов или производных для получения лекарственных средств для блокировки связывания JAM-B/JAM-C в организме пациента. Подобная блокировка может включать в себя нацеливание на клетки, экспрессирующие JAM-C на своей поверхности, путем введения пациенту антител, имеющих вариабельные области согласно изобретению. В одном из воплощений клеткой-мишенью является опухолевая клетка. В соответствии с дальнейшими аспектами изобретения блокировка JAM-C/JAM-B-взаимодействия может быть достигнута при использовании нуклеиновой кислоты, кодирующей вариабельную область,или клеток, содержащих эту нуклеиновую кислоту - любой из этих объектов может быть введен пациенту. Для клинического использования на человеке может быть полезно модифицировать крысиные антитела H33 для снижения или минимизации их иммуногенности. Также как и в случае мышиных антител, ряд способов для достижения этой цели был описан в литературе. Подобные способы включают в себя получение химерных антител, содержащих мышиные или крысиные вариабельные области и человеческие константные области, получение одноцепочечных антител, содержащих различные связывающие последовательности, полученные из мышиных или крысиных антител, получение антигенсвязывающих фрагментов мышиных или крысиных антител, которые из-за их малого размера потенциально менее иммуногенны, получение человеческих моноклональных антител и получение гуманизированных антител. В результате гуманизирования получают неиммуногенные антитела с полным сохранением антигенсвязывающих способностей родительской нечеловеческой молекулы антитела. Отсутствие иммуногенности позволяет многократно вводить препарат антител без нежелательных иммунологических реакций на него. В литературе описаны различные способы получения гуманизированных антител. К примеру, гуманизированные антитела могут быть получены (а) путем введения только нечеловеческих CDRобластей при сохранении человеческого каркаса вариабельных и константных областей (Jones et al., Nature 321: 522-25 (1986); Verhoeyen et al., Science 239: 1534-1536 (1988; или (b) путем введения целых нечеловеческих вариабельных доменов (для сохранения лигандсвязывающей активности) под маской подобных человеческим последовательностей, получаемой путем замены экспонируемых остатков таким образом, что полученная антигенная структура напоминает соответствующую человеческую, что и приводит к снижению иммуногенности полученного продукта (подобный подход также называют маскировкой антител (Padlan, Molec. Immun. 28: 489-498 (1991); Padlan, Molec. Immun. 31 (3): 169-217 (1994. Сохранение нечеловечесих мышиных или крысиных остатков в каркасе человеческих вариабельных доменов позволяет сохранить правильные связывающие функции полученного гуманизированного антитела. Было показано, что использование гуманизированных антител потенциально снижает или полностью элиминирует иммуногенность вводимого антитела в ксено-реципиенте, таким образом увеличивая биодоступность антител и снижая вероятность связанных с нежелательными иммунологическими реакциями побочных эффектов, что, в свою очередь, позволяет вводить препарат антитела многократно. Помимо этого, синтез вышеописанных scFv-фрагментов, а также других фрагментов антител, таких как Fv,Fd, Fab, Fab' и F(ab)'2-фрагментов, полученных из антител с желаемой специфичностью, представляет собой другой известный способ получения целевых фрагментов, имеющих меньшую иммуногенность,чем интактные антитела. Существенным является то, что одноцепочечные антитела и фрагменты антител могут быть в силу меньшего размера менее иммуногенны, чем интактные антитела. Также известным фактом является и то, что рекомбинантные белки, в том числе антитела, гликозилируются по-разному, в зависимости от хозяйской клеточной системы. Гликозилирование антител H33 может увеличивать их время полужизни и/или снижать иммуногенность, что важно для их клинического использования. Антитела H33 также могут быть использованы в конкурентном скрининге для изоляции человеческих моноклональных антител или рекомбинантных человеческих антител, имеющих такую же либо близкую к H33 специфичность. В своей основе источником человеческих антител может быть гибридома, трансфектома или трансгенное животное, в том числе трансгенная мышь, способная продуцировать различные изотипы антител против JAM-C (в том числе анти-JAM-C IgG, IgA и/или IgE) путем V-D-Jрекомбинации и переключения изотипа (например, согласно изложенному в патентах ЕР 1471938 иUS2004208873). Подобным трансгенным животным может быть также трансгенный кролик, способный продуцировать поликлональные антитела согласно описанному в патенте США 2003/0017534. Термин человеческое моноклональное антитело относится к антителам, имеющим единственную антигенную специфичность и состоящим из вариабельных и константных областей, кодируемых иммуноглобулиновыми генами зародышевой линии человека. В одном из воплощений моноклональное человеческое антитело с идентичной H33 специфичностью продуцируется гибридомой, полученной путем слияния иммортализованных клеток с В-клетками, полученными из трансгенного животного, отличного-4 009037 от человека (к примеру, из трансгенной мыши), зародышевая линия которого содержит трансгены человеческих тяжелых и легких цепей. Предпочтительной животной системой для получения гибридом является мышиная система. Продуцирование гибридом в организме мышей является распространенной процедурой. Протоколы иммунизации и способы выделения спленоцитов иммунизированных животных хорошо известны в данной области. Клетки-партнеры слияния (к примеру, клетки мышиной миеломы) и технология слияния также хорошо известны. В предпочтительном воплощении человеческие моноклональные антитела против JAM-C, имеющие идентичную H33 специфичность, могут быть получены с использованием трансгенных мышей, частично обладающих человеческой иммунной системой, что является предпочтительным по сравнению с мышиной системой, известной под названием HuMAb-мыши (Lonberg, et al. (1994) Nature 368 (6474): 856859). В соответствии с этим у мышей наблюдается пониженная экспрессия мышиных IgM или мышиных каппа-легких цепей, и, в ответ на иммунизацию, введенные трансгены человеческих легких и тяжелых цепей претерпевают переключение изотипа и соматическое мутирование, что приводит к синтезу высокоаффинных человеческих IgG-каппа (Lonberg, N. et al. (1994), см. выше; ревьюировано в книге Lonberg,N. (1994) Handbook of Experimental Pharmacology 113: 49-101; Lonberg, N. and Huszar, D. (1995) Intern.Biotechnology 14: 845-851. Смотрите далее следующие патенты США: Lonberg, N., Kay, R. M. и GenPharn International:5545806; 5569825; 5625126; 5633425; 5789650; 5877397; 5661016; 5814318; 5874299 и 5770429; Surani et al.: патент США 5545807; международные публикацииWO 98/24884, опубликовано 11 июня 1998 г.; WO 94/25585, опубликовано 10 ноября 1994 г.; WO 93/1227, опубликовано 24 июня 1993 г.;(1993) EMBO J. 12: 821-830), CMD-разрыв в эндогенных локусах тяжелых цепей (согласно описанному в примере 1 международной заявки WO 01/14424, Korman et al.), КСо 5-трансген человеческих легких каппа-цепей (согласно Fishwild et al. (1996) Nature Biotechnology 14:845-851), а также НСо 7-трансген человеческих тяжелых цепей (согласно патенту США 5770429, Lonberg, N. and Kay, R. M.) или НСо 12 трансген (согласно описанному в примере 2 патента WO01/14424, Korman et al.). В качестве альтернативы, для получения анти-JAM-С-антитела со специфичностью H33 могут быть использованы мыши, несущие человеческие иммуноглобулиновые гены на транс-хромосомном фрагменте. Получение подобных транс-хромосомных мышей было описано в патенте W097/07671, Tomizuka etal. Предпочтительно используемыми животными для этих целей являются мыши, у которых некоторые человеческие иммуноглобулиновые гены доставляются в качестве трансгена, тогда как другие - в качестве транс-хромосомы, такие, к примеру, как мыши, несущие трансген человеческих легких цепей (например, КСо 5-трансген каппа-цепей) и транс-хромосому человеческих тяжелых цепей (например, SC20 транс-хромосому), согласно описанному в патенте WO02/43478, Ishida et al. Для получения полностью человеческих моноклональных антител против JAM-C, имеющих специфичность H33, мыши HuMAb могут быть иммунизированы очищенным антигеном JAM-C, составом,обогащенным JAM-C, и/или клетками, продуцирующими JAM-C, и/или рекомбинантным JAM-C согласно описанному Lonberg, N. et al. (1994) Nature 368 (6474): 856-859; Fishwild, D. et al. (1996) Nature Biotechnology 14: 845-851 and WO98/24884. Предпочтительным является использование мышей, ко времени первой инъекции достигших возраста 6-16 недель. К примеру, для иммунизации может быть использована внутрибрюшинная инъекцияJAM-C. Для продуцирования человеческих моноклональных антител против JAM-C мышиные спленоциты могут быть выделены и подвергнуты процедуре слияния с клетками линии мышиной миеломы полиэтиленгликолем (ПЭГ), в соответствии со стандартными протоколами. Полученные гибридомы затем подвергают скринингу на их способность продуцировать антигенспецифические антитела согласно хорошо известным методикам. Человеческие антитела согласно изобретению, имеющие специфичность H33, могут быть получены в выбранных для экспрессии клетках трансфектомы с использованием, к примеру, хорошо известного в данной области сочетания технологии рекомбинантной ДНК и генной трансфекции (Morrison, S. (1985)Science 229: 1202). В данном изобретении могут быть использованы антитела H33, а также их фрагменты и производ-5 009037 ные, обладающие способностью блокировать связывание JAM-B и JAM-C и ингибировать ангиогенез invivo. Обзор по вопросам получения фрагментов антител и содержащих антитела слитых белков приведен у Joosten, V. et al., Microb. Cell Fact. 2(1):1 (2003). Способы получения фрагментов и производных антител широко известны и могут быть воспроизведены специалистом в данной области без привлечения нежелательной дополнительной методологической нагрузки. К примеру, для экспрессии антитела H33 или его фрагментов кодирующие частичные или полноразмерные последовательности легких и тяжелых цепей ДНК могут быть получены в соответствии со стандартными молекулярно-биологическими протоколами (в том числе, с помощью амплификации способом ПЦР, сайт-направленного мутагенеза) и вставлены в экспрессирующие векторы таким образом,что клонированные гены будут оперативно связаны с последовательностями, обеспечивающими транскрипционный и трансляционный контроль. В данном контексте под словосочетанием оперативно связаны подразумевается, что гены антител лигированы в вектор таким образом, что регулирующие транскрипцию и трансляцию регуляторные последовательности вектора способны выполнять свои функции регуляции транскрипции и трансляции генов антител. Экспрессирующий вектор и контрольные последовательности выбирают таким образом, чтобы они были совместимы с выбранными для экспрессии хозяйскими клетками. Гены легкой и тяжелой цепей молекулы антитела могут быть клонированы в различные векторы или, что более распространено, в один экспрессирующий вектор. Гены антитела клонируют в экспрессирующий вектор согласно стандартным протоколам (таким как лигирование по комплементарным между геном антитела и экспрессирующим вектором липким концам одноименных рестрикционных сайтов,либо затупление концов и лигирование в том случае, если подходящих рестрикционных сайтов нет). Тяжелые и легкие цепи обсуждаемых здесь антител могут быть использованы для создания полноразмерных генов антител любого из изотипов путем клонирования соответствующих фрагментов в экспрессирующие векторы, уже содержащие константные области легких и тяжелых цепей желаемого изотипа, таким образом, что в упомянутом векторе VH-сегмент оперативно связан с СН-сегментом, а VLсегмент оперативно связан с CL-сегментом. В дополнение к этому или в качестве альтернативы рекомбинантный экспрессирующий вектор может кодировать сигнальную последовательность, облегчающую секрецию цепей антитела из хозяйских клеток. Ген цепи антитела может быть клонирован в вектор таким образом, что сигнальный пептид в рамке связан с N-концом цепи антитела. Сигнальным пептидом может быть иммуноглобулиновый сигнальный пептид либо гетерологичный сигнальный пептид (то есть сигнальный пептид из неиммуноглобулинового белка). В дополнение к генам цепей иммуноглобулинов, рекомбинантные экспрессирующие векторы согласно изобретению кодируют сигнальные последовательности, контролирующие экспрессию генов иммуноглобулиновых цепей в хозяйских клетках. Терминологическое словосочетание регуляторная последовательность включает в себя промоторы, энхансеры и другие элементы контроля экспрессии (такие, к примеру, как сигналы полиаденилирования), контролирующие транскрипцию или трансляцию генов цепей антител. Подобные регуляторные последовательности описаны, к примеру, в книге Goeddel;Gene Expression Technology. Methods in Enzymology 185, Academic Press, San Diego, Calif. (1990). Специалисты в данной области должны принимать во внимание, что дизайн экспрессирующего вектора, включая выбор регуляторных последовательностей, может зависеть от таких факторов, как хозяйские клетки, выбранные для трансформации, желаемый уровень экспрессии белка и т.д. Предпочтительными регуляторными элементами для клеток млекопитающих являются вирусные элементы, обеспечивающие высокий уровень экспрессии белка, такие как промоторы и/или энхансеры,полученные из цитомегаловируса (ЦМВ), Simian Virus 40 (SV40), аденовирусов (к примеру, главный поздний аденовирусный промотор (AdMLP) и полиомавирусов. В качестве альтернативы, могут быть использованы невирусные промоторы, такие как убиквитиновый промотор или -глобиновый промотор. В дополнение к генам иммуноглобулиновых цепей и регуляторным последовательностям рекомбинантные экспрессирующие векторы для экспрессии ангиогенез-ингибирующих молекул согласно изобретению могут содержать дополнительные последовательности, такие как последовательности, регулирующие репликацию вектора в хозяйских клетках (к примеру, точки начала репликации) и гены селективных маркеров. Введение последних облегчает селекцию хозяйских клеток, в которых трансфекция вектором прошла эффективно (см., к примеру, патенты США (Axel et al.)4399216, 4634665 и 5179017). Так, обычно введение гена селективного маркера обеспечивает хозяйским клеткам, в которых трансфекция (введение вектора) прошла успешно, резистентность к различным препаратам, таким какG418, гигромицин или метотрексат. Предпочтительные гены селективных маркеров включают в себя ген дигидрофолатредуктазы (DHFR) (для использования в dhfr-клетках с селекцией/амплификацией на основе метотрексата) и neo-ген (для селекции на основе G418). Для экспресии легких и тяжелых цепей, экспрессирующий вектор (векторы), кодирующий легкие и тяжелые цепи, соответственно, трансфицируются в хозяйские клетки по стандартным методикам. Различные формы термина трансфекция подразумевают широкий спектр методик, широко используемых для введения экзогенной ДНК в прокариотическую или эукариотическую хозяйскую клетку, таких как-6 009037 электропорация, кальций-фосфатная преципитация, DEAE-декстрановая трансфекция и т.д. Несмотря на то, что молекулы согласно изобретению могут быть экспрессированы как в прокариотических, так и в эукариотических хозяйских клетках, экспрессия в эукариотических клетках, наиболее предпочтительно в хозяйских клетках млекопитающих, более предпочтительна, поскольку подобные эукариотические клетки, наиболее предпочтительно клетки млекопитающих, с большей, нежели прокариотические клетки,вероятностью, смогут синтезировать, обеспечить правильный фолдинг и секретировать иммунологически активное антитело, его фрагмент или производное. Предпочтительные для экспрессии рекомбинантных антител согласно изобретению хозяйские клетки млекопитающих включают в себя СНО-клетки (включая dhfr-CHO клетки, описанные в публикацииBiol. 159 :601-621), миеломные клетки NS/0, клетки COS, НЕК 293 и SP2.0. В частности, в сочетании с миеломными клетками NS/0 используется другая предпочтительная экспрессирующая система GS (глутаминсинтетаза), описанная в патентах WO 87/04462, WO 89/01036 и ЕР 338 841. Когда рекомбинантные экспрессирующие векторы, кодирующие гены антител, вводят в хозяйские клетки млекопитающих, продукты экспрессии получают путем культивировния хозяйских клеток в течение периода, достаточного для экспрессии продукта в хозяйских клетках или более предпочтительно для секретирования продукта в культуральную среду, в которой растут клетки-хозяева. Продукты экспрессии могут быть выделены из культуральной среды по стандартным протоколам очистки белков. В качестве альтернативы, клонированные гены антитела могут быть экспрессированы в других экспрессирующих системах, включая прокариотические клетки, такие как микроорганизмы, в том числе E.coli, и для продуцирования scFv-антител, algi, а также клетки насекомых. Далее антитела могут быть получены с использованием трансгенных животных, к примеру, с использованием молока овец и кроликов или яиц кур, либо с использованием трансгенных растений. См., к примеру, Verma, R., et al. (1998). Antibody engineering: Comparison of bacterial, yeast, insect and mammalian expression systems. J. Immunol. Meth. 216: 165-181; Pollock, et al. (1999). Transgenic milk as a method for the production of recombinant antibodies.plants. Biol. Chem. 380: 825-839. Антитела связываются со своими антигенами преимущественно посредством определенных аминокислотных остатков, локализованных в шести областях легких и тяжелых цепей областях, определяющих комплементарность (Complementarity Determining Regions, CDR). В соответствии с этим аминокислотный состав CDR-областей обладает большим разнообразием аминокислотных остатков, чем аминокислотный состав антител за пределами CDR-областей. Поскольку CDR-области отвечают за большую часть взаимодействий антиген-антитело, можно экспрессировать рекомбинантные антитела, мимикрирующие возможности естественных антител, путем конструирования экспрессирующих векторов, включающих в себя CDR-кодирующие последовательности ДНК природного антитела, в данном случае H33,помещенных в каркас последовательностей другого антитела с другими свойствами (смотрите, к примеру, Riechmann, L. et al., 1998, Nature 332: 323-327; Jones, P. et al., 1986, Nature 321: 522-525; and Queen, Сet al., 1989, Proc. Natl. Acad. See. U. S. A. 86: 10029-10033). Подобные каркасные последовательности могут быть получены на основе имеющихся в публичных базах данных последовательностей ДНК, включающих в себя иммуноглобулиновые гены зародышевой линии. Данные последовательности зародышевой линии будут отличаться от зрелых последовательностей соответствующей геномной ДНК, поскольку не содержат полностью собранных генов вариабельных областей, формируемых путем V (D) Jрекомбинации в процессе созревания В-клеток. Последовательности ДНК зародышевой линии также будут отличаться от последовательностей, кодирующих высокоаффинные антитела вторичного репертуара, содержащие соматические мутации на протяжении всей вариабельной области, как правило, однако, кластеризованные в CDR-областях. К примеру, соматические мутации относительно редки на Nконце каркасной области 1 и на С-конце каркасной области 4. Более того, многие соматические мутации не оказывают значительного влияния на связывающие свойства антитела. Таким образом, для получения интактного рекомбинантного антитела, обладающего схожими с естественным антителом связывающими способностями, получение полной последовательности ДНК данного антитела не является необходимым (смотрите патент WO 99/45962). Для данной цели обычно достаточно частичной последовательности легкой и тяжелой цепей, полностью покрывающей CDR-области. Частичная последовательность используется для определения того, какие из V- и J-сегментов соответствуют рекомбинантным генам антитела. Далее, последовательность ДНК зародышевой линии используется для заполнения отсутствующих областей вариабельных областей. В процессе созревания белка лидерные последовательности легкой и тяжелой цепей расщепляются и не влияют на свойства образующегося антитела. Для добавления отсутствующих последовательностей клонированную кДНК можно комбинировать с синтетическими олигонуклеотидами путем лигирования или ПЦР-амплификации. В качестве альтернативы, вся вариабельная область может быть синтезирована на основе набора коротких перекрывающихся олигонуклеотидов, скомбинированных путем ПЦР-амплификации, с образованием полностью синтетического клона вариабельной области. Данный процесс обладает рядом преимуществ, таких как-7 009037 элиминация или включение определенных рестрикционных сайтов или оптимизация определенных кодонов. В данной заявке словосочетание ингибирующие ангиогенез молекулы относится к H33 и всем его фрагментам и производным, сохраняющим идентичную или сходную специфичность согласно заявленному. Изобретение также относится к применению ингибирующих ангиогенез молекул, таких как H33, их фрагментов и производных для составления терапевтических или диагностических композиций для лечения или диагностики рака, в частности, солидных опухолей. Изобретение также относится к терапевтическим или диагностическим композициям для лечения или диагностики рака, в частности, солидных опухолей, содержащим терапевтически или диагностически эффективные количества одной или нескольких ингибирующих ангиогенез молекул согласно изобретению, и подходящий наполнитель, носитель, растворитель или другую добавку. Специалист в области терапии рака будет способен подобрать упомянутые терапевтически или диагностически эффективные количества. Композиция может также содержать комбинацию двух и более ингибирующих ангиогенез молекул согласно изобретению. Фармацевтические композиции согласно изобретению могут также быть включены в состав комбинированной терапии, то есть скомбинированы с другими препаратами. К примеру, комбинированный терапевтический режим может включать в себя как минимум один химиотерапевтический препарат, как минимум один противовоспалительный препарат или как минимум один иммуносупрессант. В другом воплощении ингибирующие ангиогенез молекулы могут быть использованы в сочетании с радиотерапией. В другом воплощении ингибирующие ангиогенез молекулы могут быть использованы в сочетании с препаратами (одним или более) других антител, в частности, с препаратами (одним или более) человеческих антител, таких, к примеру, как анти-VEGF-антитела. Режимы дозировки подбираются таким образом, чтобы обеспечить оптимум желаемого ответа (к примеру, оптимум терапевтического ответа). Так, может быть введен единичный болюс, либо доза может быть разделена на несколько меньших, вводимых через некоторый временной интервал, либо доза может быть пропорционально уменьшена или увеличена в зависимости от особенностей терапевтической ситуации. В особенности важным является составление парентеральных композиций в лекарственной дозированной форме для простоты введения и стандартизации дозировки. Используемое здесь словосочетание лекарственная дозированная форма относится к физически дискретным единицам, подходящим в качестве универсальных дозированных форм для введения пациентам; каждая единица содержит определенное количество активного компонента, подобранного таким образом, чтобы добиться желаемого терапевтического эффекта при введении активного компонента в виде лекарственной формы, также содержащей требуемый фармацевтический носитель. Спецификация единиц дозированных форм согласно изобретению диктуется и напрямую зависит от (а) уникальных характеристик активного компонента и желаемого терапевтического эффекта, и (b) ограничений, характерных собственно для данной области,таких как активный компонент для лечения чувствительности. Словосочетания парентеральное введение и введен(а,о,ы) парентерально, используемые в настоящей заявке, означают способы введения, отличные от энтерального и топического, обычно представляющие собой инъекции или инфузии, и включают в себя, без ограничений, внутривенные, внутримышечные, внутриартериальные, интратекальные, интракапсулярные, интраорбитальные, внутрисердечные, внутрикожные, внутрибрюшинные, транстрахеальные, подкожные, субкутикулярные, внутрисуставные, субкапсулярные, субарахноидальные, интраспинальные, эпидуральные и интрастернальные инъекции и инфузии. Ингибирующие ангиогенез молекулы согласно изобретению могут быть включены в фармацевтическую композицию вместе с подходящим наполнителем, носителем или растворителем. Примеры подходящих водных и неводных носителей, которые могут быть включены в фармацевтические композиции согласно изобретению, включают в себя воду, этанол, полиолы (такие как глицерин, пропиленгликоль, полиэтиленгликоль и т.д.), подходящие смеси вышеназванных компонентов, растительные масла, такие как оливковое масло, и пригодные для инъекций органические сложные эфиры,такие как этилолеат. Данные композиции могут содержать также различные добавки, такие как консерванты, увлажняющие агенты, эмульгаторы и диспергирующие агенты. Предотвращение микробного заражения композиции может быть достигнуто как стерилизационными процедурами, так и при помощи включения в состав композиции различных антибактериальных и противогрибковых средств, таких как парабен,хлорбутанол, фенол, сорбиновая кислота и т.д. Также может быть желательно включение в композицию изотонических агентов, таких как сахара, хлорид натрия и т.д. В дополнение к этому пролонгированное всасывание может быть достигнуто путем включения агентов, ингибирующих всасывание, таких как моностеарат алюминия и желатин. В том случае, если препараты согласно изобретению используются как фармацевтические агенты,-8 009037 вводимые человеку или животному, они могут быть введены отдельно либо в составе фармацевтической композиции, содержащей, к примеру, от 0,01 до 99,5% (более предпочтительно от 0,1 до 90%) активного ингредиента, в комбинации с фармацевтически приемлемым носителем. Вне зависимости от типа введения для ингибирующих ангиогенез молекул согласно изобретению,которые могут использоваться в подходящей гидратированной форме, и/или фармацевтических композиций согласно изобретению, могут быть подобраны фармацевтически приемлемые дозированные формы при помощи известных специалистам в данной области общепринятых способов. Реальные уровни дозировки активных ингредиентов фармацевтических композиций согласно изобретению можно варьировать таким образом, чтобы достичь желаемого терапевтического эффекта у данного пациента в данной композиции и при данном способе введения без нежелательных токсических эффектов. Выбранный уровень дозировки будет зависеть от различных фармакокинетических факторов,включая активность конкретных композиций согласно изобретению или сложных эфиров, солей или амидов соединений, их составляющих, типа введения, времени введения, скорости выведения данного компонента, длительности лечения, других препаратов, веществ и/или материалов, используемых в комбинации с данной композицией, возраста, пола, состояния, общего статуса здоровья и анамнеза пациента,а также других факторов, известных в различных областях медицины. Лечащий врач или ветеринар, имеющий базовый опыт в своей области, может легко определить эффективные количества требуемой фармацевтической композиции. К примеру, врач или ветеринар может начать терапию препаратами согласно изобретению с доз, меньших по отношению к необходимым для достижения желаемого терапевтического эффекта, постепенно увеличивая дозировку до тех пор, пока желаемый эффект не будет достигнут. Как правило, подходящей суточной дозой композиции является минимальная доза, необходимая для достижения терапевтического эффекта. Подобная эффективная доза,как правило, зависит от указанных выше факторов. Подходящим типом введения может быть внутривенное, внутримышечное, внутрибрюшинное или подкожное, предпочтительно осуществляемое в области тела, проксимальной к сайту-мишени. Также эффекторная суточная доза терапевтической композиции может быть введена в виде одной, двух, трех,четырех, пяти, шести или более субдоз в течение суток через определенные промежутки времени, необязательно в лекарственной дозированной форме. Несмотря на то, что препарат согласно изобретению может быть введен сам по себе, предпочтительным является его введение в составе фармацевтической композиции. К примеру, при использовании H33 в качестве ингибирующей ангиогенез молекулы дозировка может быть определена или подобрана путем измерения количества циркулирующих H33 в биологической пробе в различные моменты времени после введения при помощи анти-идиотипических антител противH33 или с использованием других специфических способов для детекции H33, например, при помощиELISA-анализа с использованием покрытия плашек JAM-C. Терапевтические композиции могут быть введены также при помощи медицинского оборудования,известного в данной области. К примеру, в предпочтительном воплощении терапевтические композиции согласно изобретению могут быть введены при помощи безыгольного гиподермического инъекционного аппарата, такого как приборы, описанные в патентах США 5399163; 5383851; 5312335; 5064413; 4941880; 4790824; 4596556. Примеры широко известных имплантантов и модулей, которые могут быть полезны в контексте согласно изобретению, изложены в следующих патентах: патенте США 4487603,описывающем имплантируемую микроинфузионную помпу для обеспечения высвобождения лекарства с контролируемой скоростью; патенте США 4486194, описывающем терапевтическое устройство для введения лекарственных средств через кожу; патенте США 4447233, описывающем инфузионную помпу для доставки лекарственных средств с точной скоростью инфузии; патенте США 4447224, описывающем различные имплантационные инфузионные аппараты для непрерывной доставки; патенте США 4439196, описывающем осмотическую систему доставки. Специалистам в данной области известно множество других подобных имплантантов, систем доставки и модулей. В некоторых воплощениях ингибирующие ангиогенез молекулы согласно изобретению могут использоваться в виде лекарственных форм, обепечивающих необходимое распределение активного компонента in vivo. К примеру, многие высокогидрофильные компоненты не способны преодолеть гематоэнцефалический барьер (ВВВ). Для обеспечения проникновения терапевтических препаратов согласно изобретению через гематоэнцефалический барьер (в случае необходимости) они могут быть доставлены при помощи липосом. Способы получения липосом описаны, к примеру, в патентах США 4522811,5374548 и 5399331. Липосомы могут включать в себя одно или несколько веществ, селективно транспортируемых в специфические органы или ткани, тем самым улучшая направленную доставку лекарства(смотрите, к примеру, V. V. Ranade (1989) J. Clin. Pharmacol. 29: 685). Примеры подобных веществ включат в себя фолат или биотин (смотрите, к примеру, патент США 5416016, Low et al.); маннозидыFEBS Lett. 357: 140; M. Owais et al. (1995) Antimicrob. Agents Chemother. 39: 180); рецептор к поверхностному белку A (Briscoe et al. (1995) Am. J. Physiol. 1233: 134), различные формы которого могут быть использованы для доставки активных препаратов согласно изобретению, равно как последние могут со-9 009037 держать их сами по себе в составе своей структуры; р 120 (Schreier et al. (1994) J. Biol. Chem. 269:9090); смотрите также К. Keinanen; M. L. Laukkanen (1994) FEBS Lett. 346:123; J. J. Killion; I. J. Fidler (1994)Immunomethods 4: 273. В одном из воплощений согласно изобретению, для доставки ингибирующих ангиогенез молекул используются липосомы; в более предпочтительном воплощении липосомы включают в себя вещества,селективно транспортируемые в специфические органы или ткани. В наиболее предпочтительном воплощении терапевтические препараты в липосомах доставляются путем болюсной инъекции в область тела, проксимальной по отношению к целевому сайту, например, к области локализации опухоли. Композиция должна быть жидкой, обладая вязкостью, позволяющей вводить композицию при помощи шприца. Композиция должна быть стабильной в условиях получения и хранения, а также должна быть защищена от контаминирующего воздействия микроорганизмов, таких как бактерии и грибы. Эффективные дозировки и режимы дозирования для ингибирующих ангиогенез молекул согласно изобретению зависят от заболевания или состояния, подлежащего лечению, и могут быть определены специалистами в данной области. Терапевтически эффективная дозировка в противоопухолевой терапии может быть определена на основании объективного опухолевого ответа, который может быть полным или частичным. Полный ответ (complete response, CR) подразумевает отсутствие клинических, радиологических и каких-либо иных признаков заболевания. Частичный ответ (partial response, PR) подразумевает уменьшение размера опухоли более чем на 50%. Среднее время до прогрессии - величина, характеризующая длительность объективного опухолевого ответа. Терапевтически эффективная дозировка в противоопухолевой терапии также может быть определена на основании способности стабилизировать прогрессию заболевания. Способность соединения ингибировать рост опухоли может быть оценена при помощи животных модельных систем, позволяющих предсказывать эффективность препарата для лечения человеческих опухолей. Терапевтически эффективное количество терапевтического соединения может уменьшить размер опухоли либо иным способом улучшить состояние пациента. Специалист, владеющий основными навыками в данной области, способен определить данное количество, исходя из таких факторов, как масса тела пациента, тяжесть симптомов заболевания, конкретной композиции или выбранного типа введения. В соответствии с этим пациенты, получившие лечение композициями согласно изобретению, могут дополнительно получать лечение другими терапевтическими агентами (до, одновременно или после введения препаратов согласно изобретению) для повышения терапевтического эффекта молекул согласно изобретению. Далее, настоящее изобретение относится к применению препаратов данного изобретения в диагностике. Меченые антитела, к примеру, могут использоваться для установления локализации опухолевых очагов в организме пациента. Способы мечения антител с использованием радиоактивных, парамагнитных или иных меток хорошо известны в данной области. В особом воплощении данное изобретение связано со способом диагностики заболеваний, ассоциированных с JAM-C, при помощи ех vivo или in vitro детекции JAM-C в биологических пробах, таких как пробы тканей, пробы клеток или пробы биологических жидкостей организма. Это может быть выполнено, к примеру, при помощи способов, обеспечивающих контакт тестируемой пробы, факультативно вместе с контрольной пробой, с антителами H33, их фрагментами или производными, в условиях, обеспечивающих возможность образования комплекса между H33 и JAM-C. Далее, образование комплекса может быть детектировано (к примеру, с использованием ELISA). В случае параллельного использования контрольной пробы комплекс может быть детектирован в обеих пробах, и любая статистически значимая разница в уровне формирования комплексов между двумя пробами будет указывать на присутствие JAM-C в тестируемой пробе. Настоящее изобретение будет далее описано с помощью нижеследующих примеров. Данные примеры имеют лишь иллюстративные цели и никоим образом не ограничивают соответствующих аспектов изобретения. В данных примерах используется следующий иллюстративный материал. На фиг. 1 показано, что JAM-C экспрессируется в кровеносных сосудах человеческой опухоли печени. Экспрессию JAM-C анализировали на панели ангиогенных опухолей. Транскрипты, кодирующиеJAM-C, не обнаруживаются в нормальной печени. Иммуноокрашивание замороженных срезов антиJАМ-С-антителом выявляет экспрессию JAM-C в субпопуляции кровеносных сосудов (указано на рисунке стрелками). Окрашивание поликлональным антителом против РЕСАМ-1, позволяющее визуализировать сосудистые структуры, показано на правой панели; ангиогенные характеристики опухоли контролировали с помощью анти-v3-окрашивания. На фиг. 2 показано, что JAM-C рекрутируется в область межэндотелиальных контактов клеток HUVEC после стимуляции VEGF. (А) Клетки HUVEC стимулировали рекомбинантным VEGF-165, фиксировали формальдегидом и визуализировали локализацию JAM-C анти-JАМ-С-моноклональными антителами. В качестве контроля использовалось анти-JАМ-А-окрашивание. После VEGF-165-стимуляции области, богатые JAM-C, локализовались в области межклеточных контактов, тогда как упомянутая стимуляция не оказывала влияния на локализацию JAM-A. (В) В результате проведенного FACS-анализа было- 10009037 показано, что подобное обогащение областей межклеточных контактов молекулами JAM-C происходит в результате их релокализации, поскольку уровень экспрессии JAM-C не изменялся после VEGFопосредованной (тонкая линия - негативный контроль; пунктирная линия - необработанные клетки; толстая линия - клетки, обработанные VEGF). На фиг. 3 показано, что анти-JАМ-С-моноклональное антитело блокирует ангиогенез in vitro. Кольца из мышиных аорт растили между двумя слоями матригеля в присутствии или в отсутствие анти-JAMC-моноклональных антител (50 мкг/мл), и неоваскуляризация визуализировалась 12 дней спустя. Иллюстрации представляют собой световые микрофотографии репрезентативных микрососудов колец аорт,либо необработанных (А, n=11), либо обработанных анти-JAМ-С-моноклональными антителами H33 (В,n=11) и D33 (С, n=6), либо обработанных подобранными по изотипу контрольными антителами Ме 114(D, n=6). Только антитела H33 блокировали рост кровеносных сосудов. На фиг. 4 показано, что aнти-JAM-C-антитела тормозят опухолевый рост и снижают опухолевую васкуляризацию. Мышам однократно подкожно вводили клетки LLC1 и далее каждый второй день-антиJАМ-С-антитела либо подобранные по изотипу контрольные антитела (150 мкг). (А) Макроскопический вид 12-дневной опухоли LLC1, выросшей у контрольных мышей (PBS либо подобранные по изотипу контрольные антитела), либо у мышей, которым вводили анти-JАМ-С-антитела H33. Опухоли мышей,которым вводили анти-JAМ-С-антитела H33, демонстрировали сниженный объем (В) и вес (С). Микрососуды визуализировали путем иммуноокрашивания на РЕСАМ-1 (D) и подсчитывали с помощью компьютерного анализа (Е). р 0,01. Каждая колонка демонстрирует среднее значение в группе из десяти животных sem (стандартное отклонение). На фиг. 5 показано, что анти-JAM-C-антитела H33 не токсичны in vivo. Для того, чтобы убедиться в том, что противоопухолевый эффект анти-JAМ-С-антител H33 не связан с общим токсическим эффектом антител in vivo, мышам вводили антитела согласно фиг. 4, после чего мышиные органы извлекали и подвергали анализу. (А) Почки этих мышей, подвергнутые PAS (periodic anti-Schiff)-окрашиванию, не содержат никаких признаков гломерулонефрита. В качестве контроля приведены срезы почек мышейNZBxBXSB, подверженных развитию аутоиммунных заболеваний (Merino R. et al., J Clin Invest. 94 (2): 521-5 (1994. (В) In vivo проницаемость кровеносных сосудов была изучена при помощи Evans blueанализа проницаемости. Антитела H33 не оказывали эффекта на проницаемость сосудов в репрезентативных пробах ткани сердца, легких, почек и мозга. Каждая колонка демонстрирует среднее значение в группе из семи животныхsem (стандартное отклонение). На фиг. 6 показаны результаты подсчета сосудистых клубочков, формирующихся в процессе реваскуляризации сетчатки. Подсчет количества клубочков проводили для сопоставления ретинальной неоваскуляризации у мышей, подвергнутых введению H33, и контрольных мышей. Было обнаружено снижение количества клубочков в группе мышей, подвергнутых введению H33 (13H33) по сравнению с контрольными мышами (ctrl), которым вводили подобранные по изотипу контрольные антитела (9 В 5). Это указывает на снижение неоваскуляризации сетчатки животных, получавших H33. На фиг. 7 показано, что анти-JАМ-С-антитело H33 снижает количество макрофагов в опухолях. Криосрезы опухолей LLC1 из мышей, получавших PBS, контрольные антитела или H33, окрашивали на кислую фосфатазу для детектирования макрофагов (А, указано стрелками). Плотность сети микрососудов расчитывали путем подсчета числа меченых макрофагов на мм 2 среза опухоли (В). Опухоли мышей,получавших H33, демонстрировали сниженную инфильтрацию макрофагов по сравнению с контрольными животными. Каждая колонка демонстрирует среднее значениеsem результатов, полученных путем анализа срезов n мышей в группе (PBS, n=6; контрольные антитела, n=6; H33, n=9), по 4 среза на каждую мышь. р 0,01. Масштаб: (А) 160 мм, (В) 20 мм. На фиг. 8 показано, что антитела H33 не оказывают влияния на пролиферацию и апоптоз эндотелиальных клеток. Эндотелиальные клетки (А) или клетки опухоли LLC1 (В) высевали в культуральные планшеты в диапазоне концентраций от 1,25x104 до 5x104 клеток на лунку в присутствии или в отсутствие антител H33 либо контрольных антител. Пролиферацию анализировали с помощью МТТ-анализа. Антитела H33 не оказывают влияния на пролиферацию эндотелиальных и опухолевых клеток. (С) Криосрезы опухолей LLC1 мышей, получавших подобранные по изотипу контрольные антитела либо H33, окрашивали на РЕСАМ-1 (зеленый цвет), и TUNEL-окрашиванием на апоптоточеские клетки (красный цвет,указано на рисунке стрелками). Авторами не было обнаружено увеличение апоптоза эндотелиальных клеток в опухолях мышей, получавших антитела H33. Напротив, опухолевые клетки в опухолях данной группы мышей подвергались усиленному апоптозу, что было показано путем подсчета апоптотических клеток внутри опухоли (D). Примеры Пример 1. Получение популяции антител против JAM-B или JAM-C Получение популяции антител, тестируемых способом согласно изобретению, проводили согласноKohlerMilstein, Nature 256: 495-497 (1975). Источниками антигена для получения подобной популяции антител являлись рекомбинантные JAM-B или JAM-C согласно описанному в примере 3.- 11009037 Пример 2. Получение растворимых JAM-B и JAM-C Авторами было обнаружено, что JAM-C гетерофильно связывается с JAM-B посредством своего Vдомена, и что растворимого V-домена JAM-C достаточно для связывания с JAM-B. Растворимый JAM-B и растворимый V-домен JAM-C были получены с использованием способа ПЦР при помощи одной и той же стратегии клонирования. Праймеры были предоставлены Microsynth(Microsynth GmbH, Balgach, Switzerland), и рестрикционные сайты, добавленные для последующего клонирования, подчеркнуты. кДНК, кодирующая внеклеточный V-домен JAM-C, была амплифицирована с использованием плазмиды, кодирующей полноразмерную последовательность мышиного JAM-C, Pfuполимеразы, Т 7 и (5'-gctctagacagtgttgccgtcttgcctacag-3')-олигонуклеотидов в качестве прямого и обратного праймеров. ПЦР-продукт подвергали HindIII/XbaI-опосредованной рестрикции и клонировали в pcDNA3,содержащую последовательность FLAG-tag. Растворимый JAM-B получали следующим образом: кДНК, кодирующую JAM-B, получали с помощью реакции ПЦР с использованием (5'-tcagctaggcagccagct-3') и (5'-gctctagaatctacttgcattcgcttcc-3') в качестве прямого и обратного праймеров. ПЦР-продукт подвергали XbaI-опосредованной рестрикции и клонировали в рамке с FLAG-tag-последовательностью в pcDNA3 по затупленному EcoRI и XbaI-сайтам. Пример 3. Тест на способность блокировать связывание JAM-B и JAM-С Клетки, экспрессирующие на поверхности JAM-B или JAM-C, были получены согласно AurrandLions et al., J Biol Chera 276: 2733-41 (2001a); Aurrand-Lions et al., Blood 98: 3699-707 (2001b); JohnsonLeger et al., Blood 100: 2479- 2486 (2002). Растворимые JAM-B и JAM-C, полученные согласно примеру 21, метили сульфосукцинимидильными сложными эфирами Alexa 488 (Molecular Probes Inc.) или сульфо-NHS-биотином (Pierce) согласно инструкциям производителей. Клетки, экспрессирующие JAM-B или JAM-C, приводили в контакт с JAM-C или JAM-B, соответственно, в присутствии тестируемых молекул. Мониторинг флуоресценции проводили с помощью проточной цитометрии, и снижение интенсивности флуоресценции по отношению к необработанному контролю служило индикатором снижения эффективности связывания JAM-C и JAM-B. Пример 4. Тест на способность блокировать ангиогенез in vivo На седьмой день после рождения (Р 7) мышей помещали в атмосферу 75% кислорода на пять дней для индукции центральной деваскуляризации сетчатки (Reynolds et al., Nature Medicine 8: 27-34 (2002. После этого мышей помещали на пять дней (до Р 17) в нормоксическую атмосферу. Мышей подвергали внутрибрюшинным инъекциям 50 мкг моноклональных антител в постнатальные дни Р 12, Р 14 и Р 16. Неоваскуляризацию детектировали путем перфузии всей сосудистой сети недиффундируемым флуоресцеин-декстрановым раствором. В сетчатке детектируются сосудистые клубочки и очаги неоваскуляризации. Сосудистые клубочки представляют собой интенсивно пролиферирующие кластеры извитых сосудов, образующиеся в ответ на ангиогенные стимулы и выпячивающиеся за пределы внутренней ограничивающей мембраны. Количество сосудистых клубочков подсчитывали для сравнения ретинальной неоваскуляризации у мышей, получавших тестируемый препарат, и у контрольных мышей. Одной из тестируемых молекул являлось моноклональное антитело H33, вызывавшее снижение неоваскуляризации. Пример 5. Моноклональное антитело H33 против JAM-C является ингибитором ангиогенеза и опухолевого роста Материалы и способы Антитела Крысиные моноклональные антитела (CRAM) против человеческого и мышиного JAM-C (H33, Н 36 и D33), а также крысиные антитела против мышиных молекул PECAM-1/CD31 (GC51) и bселектина/CD62L (Ме 114) были описаны ранее (Aurrand-Lions et al., 2001 а, см. выше; Gallatin et al., Nature 330:30-34(1983); Piali et al., Eur J Immunol. 23: 2464-71 (1993); Springer et al., Eur. J. Immunol. 9: 301(1979. Антитела против человеческого CD44 (9B5), используемые в качестве иррелевантного контрольного крысиного антитела IgG2a, были любезно предоставлены доктором Энгельгардтом (Laschinger andEngelhardt, 2000). Любые другие иррелевантные антитела также могут быть использованы в качестве негативного контроля. Поликлональные антитела против человеческого JAM-В были получены согласно Palmeri et al., JBiol Chem. 275: 19139-45 (2000). Использовались также моноклональные антитела против человеческогоv3-интегрина (LM609) производства Chemicon (Temecula, CA). Эндотелиальные клетки Эндотелиальные клетки человеческой пупочной вены (HUVEC) были получены путем обработки пупочных вен коллагеназой (Wall R.T. et al., J Cell Physiol. 96: 203-213 (1978. Клетки HUVEC культивировали в среде М 199, дополненной 20% фетальной телячьей сыворотки (РАА Laboratories), 25 мМHEPES (N-2-гидроксиэтилпиперазин-N'-2-этансульфоновая кислота), ненезаменимыми аминокислотами,пируватом натрия, ростовой добавкой для эндотелиальных клеток (ECGS, 15 мкг/мл; Upstate Biotechnology, Lake Placid, NY) и гепарином (4 мкг/мл; Sigma, Buchs, Switzerland). Для экспериментов использова- 12009037 ли клетки между третьим и пятым пассажем.VEGF-стимуляция 1105 клеток HUVEC помещали на матригель с дефицитом фактора роста (Becton Dickinson, Bedford, MA, USA). Через 48 ч клетки проинкубировали со 100 нг/мл рекомбинантного человеческого(проточная цитометрия). Проточная цитометрия Клетки HUVEC инкубировали с анти-JAМ-С-моноклональными антителами Н 36 во льду. После промывания PBS, BSA 0,2%, связывание антител Н 36 обнаруживали при помощи связанных с фикоэритрином противокрысиных антител (Jackson Immunoresearch Laboratories, Inc., West Grove, PA, USA). В качестве контроля первичное антитело отсутствовало. Анализ проводили на приборе FACSCalibur с использованием Cellquest Software (Becton Dickinson, Mountain View, CA, USA). Иммуноокрашивание Для выполнения иммуногистохимического исследования с использованием моноклональных антиJAM-C-антител (Н 36) и поликлональных анти-JAM-B/VE-JAM-антител, замороженные срезы фиксировали смесью ацетон/метанол 1:1 в течение 5 мин при -20 С, сушили и регидратировали в растворе 0,2% желатин/0,05% Tween 20 в PBS. Для выполнения иммуноцитохимического исследования клетки 15 мин фиксировали раствором 4% параформальдегида в PBS и пермеабилизировали последующей обработкой 0,01% TritonX100 в PBS в течение 10 мин. Клетки промывали раствором 0,2% BSA в PBS, инкубировали с первичными антителами в течение одного часа, снова промывали, и далее инкубировали со вторичными антителами, связанными с Texas Red, FITC либо пероксидазой (Jackson Immunoresearch Laboratories,Inc., West Grove, PA, USA). Изображения получали при помощи конфокального микроскопа ZeissLSM510. Гломерулонефрит детектировали путем PAS (periodic acid-Schiff)-окрашивания срезов почек. Ех vivo-анализ на кольцах аорты Анализ на мышиных кольцах аорты был выполнен согласно Nicosia, R. F.Ottinetti, In Vitro CellDev Biol. 26 (2): 119-28 (1990). Краткое описание 1-мм кольца грудных аорт помещали между двумя слоями 50 мкл матригеля с дефицитом фактора роста (Becton Dickinson, Bedford, MA, USA), необязательно содержащими тестируемое антитело и покрывали 100 мкл среды DMEM, дополненной 20 Ед/мл гепарина (Sigma-Aldrich corporation, Saint-Louis,MOl USA) и ECGS (Upstate biotechnology, Lake Placid, NY, USA). Рост микрососудов визуализировали путем фазовой микроскопии с использованием микроскопа Zeiss Axioskop. Эксперименты по имплантации опухолей Самкам мышей линии C56BL6/J (Charles River laboratories, L'Arbresle, France) в возрасте 8-10 недель подкожно инокулировали 1106 клеток легочной карциномы мышей Льюис (LLC1). Далее, каждый второй день мыши получали внутрибрюшинные инъекции 150 мкг моноклональных антител H33, подобранных по изотипу контрольных антител Ме 114, или PBS. Когда контрольные опухоли (мыши, получавшие PBS) достигали размера 1-1,5 см 3, мышей умерщвляли, опухоли удаляли и анализировали. Подсчет сосудов Криосрезы опухолей окрашивали моноклональными анти-РЕСАМ-1-антителами согласно описанному в разделе Иммуноокрашивание настоящей заявки. Изображения полных криосрезов (4 криосреза на опухоль) были получены при помощи микроскопа Zeiss Axioskop. РЕСАМ-1-окрашивание и общая зона опухоли были подсчитаны с помощью программы Zeiss KS400.Evans blue - пермеабилизационный анализ Мышей анестезировали, после чего вводили в ретроорбитальную вену 150 мкг анти-JАМ-С-антител либо подобранных по изотипу контрольных антител. Через 15 мин таким же способом вводили 100 мкл 30 мг/кг солевого раствора красителя Evans blue (Sigma-Aldrich corporation, Saint-Louis, MO, USA), который далее находился в циркуляции в течение одного часа. Затем мышей перфузировали 1% раствором параформальдегида в цитратном буфере, рН 4,2, 37 С, для высвобождения красителя из просвета сосудов. Немедленно после перфузии изолировали органы (почки, легкие, сердце и мозг). После высушивания тканей с использованием Speed-Vac измеряли их сухой вес. Краситель Evans blue экстрагировали путем последующей инкубации ткани в 500 мкл формамида в течение 18 ч при 70 С. Экстракт центрифугировали, и спектрофотометрически измеряли поглощение супернатанта на длине волны 620 нм. Концентрацию красителя рассчитывали с использованием стандартной кривой красителя Evans blue в формамиде и относили к весу сухой ткани. Статистический анализ Плотность сосудистой сети, объем и вес опухоли анализировали с использованием Mann-Whitney'st-теста и компьютерного анализа при помощи компьютерной программы StatView (Abacus Concepts Inc,Berkeley, CA, USA).JAM-C экпрессируется сосудами опухоли, и его экспрессия чувствительна к ангиогенным стимулам В ангиогенной опухоли человеческой печени анти-JAM-C-антитело Н 36 окрашивает кровеносные сосуды (фиг. 1). Напротив, транскрипты, кодирующие JAM-C, не присутствуют в нормальной печени.VEGF-опосредованная стимуляция клеток HUVEC приводит к немедленной и массированной аккумуляции JAM-C в области эндотелиальных межклеточных контактов в течение 15 мин (фиг. 2 А). Столь быстрый эффект является результатом релокализации JAM-C, в то время как уровень экспрессии JAM-С не изменяется при VEGF-опосредованной стимуляции (фиг. 2 В). Такие же результаты были получены приIn vitro рост сосудов ингибируется анти-JAM-C-моноклональными антителамиIn vitro неоваскуляризация была изучена при помощи ex vivo анализа на кольцах аорты. Свежеудаленные мышиные аорты рассекали на маленькие кольца и помещали в матригель в присутствии или в отсутствие анти-JАМ-С-антител. Рост эндотелиальных сосудов из колец аорты анализировали в течение 12 дней. В то время как присутствие контрольных анти-JAM-C либо иррелевантных подобранных по изотипу антител не оказывало эффекта на рост микрососудов, анти-JAM-C-антитела H33 полностью блокировали неоваскуляризацию (фиг. 3). Анти-JAМ-С-моноклональные антитела ингибируют опухолевый рост и ангиогенез in vivo Поскольку анти-JAM-C-антитела H33 блокируют ангиогенез in vitro, авторы провели эксперименты с целью выяснения эффекта данных антител на рост опухоли и опухолевый ангиогенез in vivo. Мышам подкожно вводили клетки легочной карциномы Льюис. Далее, анти-JAM-C-антитела и контрольные антитела вводили внутрибрюшинно каждый второй день. Когда контрольные опухоли достигали 1-1,5 см 3,животных умерщвляли и опухоли вырезали. Размер опухоли (фиг. 4 А), объем опухоли (фиг. 4 В) и вес опухоли (фиг. 4 С) были значительно ниже у мышей, получавших анти-JAM-C-антитела H33 по сравнению с мышами, получавшими подобранные по изотипу контрольные антитела или PBS. Репрезентативные примеры удаленных опухолей показаны на фиг. 4 А. Клетки легочной карциномы Льюис не экспрессируют JAM-C (данные не приведены). Эффект антител H33 на опухолевый рост опосредован ингибированием ангиогенеза. Для визуализации сосудистой сети опухоли, криосекции были подвергнуты иммуноокрашиванию антителами против эндотелиального маркера РЕСАМ-1 (фиг. 4D). Плотность сети кровеносных сосудов была расчитана на основе % РЕСАМ-1-окрашивания по зоне опухоли (фиг. 4 Е). Антитела H33 снижали число кровеносных сосудов в опухоли по сравнению с контролем. Анти-JAM-C-антитела H33 нетоксичны in vivo Известно, что антитела могут быть токсичны при введении in vivo. Для подтверждения того, что наблюдаемый эффект, оказываемый анти-JАМ-С-антителами H33, не является результатом общего токсического эффекта на организм мыши, авторы изучили возможность инъецированных антител вызывать патологию у животных. Поскольку JAM-C экспрессируется эндотелием почек, в первую очередь проверяли способность антител вызывать гломерулонефрит. Для выполнения данного анализа секции почек животных, которым вводили антитела H33, были подвергнуты PAS (periodic acid-Schiff)-окрашиванию. Авторами не было обнаружено аномального накопления белка в почечных клубочках (фиг. 5 А). Поскольку молекулы JAM-C вовлечены в контроль проницаемости сосудов, авторы также проверяли возможность антител вызывать подтекание кровеносных сосудов. Данного эффекта не было обнаружено в проанализированных пробах сердца, легких, печени и почек (фиг. 5 В). В сетчатках мышей, которым вводили антитела H33, наблюдали снижение числа сосудистых клубочков по сравнению с контрольными (ctrl) мышами или мышами, которым вводили подобранные по изотипу контрольные антитела. Это указывает на сниженную неоваскуляризацию сетчатки у мышей,получавших антитела H33 (фиг. 6). Пример 6. Анти-JAM-C-антитела H33 снижают количество макрофагов в опухоли, однако не оказывают влияния ни на пролифирацию, ни на апоптоз эндотелиальных клеток Материалы и способы Гистология и подсчет плотности сосудистой сети, апоптотических клеток и количества макрофагов в опухолях Для выполнения иммуногистохимического исследования с использованием моноклональных антиРЕСАМ-1-антител (GC51) срезы фиксировали смесью ацетон/метанол 1:1 в течение 5 мин при -20 С,сушили и гидратировали в растворе 0,2% желатин/0,05% Tween 20 в PBS. Срезы инкубировали с антителами в течение 1 ч при комнатной температуре, 3 раза промывали PBS и затем инкубировали со вторичными антителами, конъюгированными с пероксидазой (Jackson Immunoresearch Laboratories, Inc., WestGrove, PA, USA). Для выполнения иммуногистохимического анализа на фиксированных параформальдегидом залитых в парафин срезах глаз поликлональными анти-РЕСАМ-1- и анти-JАМ-С-антителами срезы депарафинировали по классической методике. Далее тканевые срезы обрабатывали 0,3% Н 2O2 в метаноле в течение 10 мин, промывали PBS и блокировали раствором 3% BSA/0,1% Tween20/PBS в течение 30 мин.- 14009037 Срезы инкубировали с поликлональными антителами в течение 1 ч при комнатной температуре и после нескольких промывок PBS инкубировали 30 мин с EnVision system (DakoCytomation AG, Zg, Switzerland). Активность кислой фосфатазы на криосрезах опухоли определяли с помощью способа, описанного у Kindler, V. et al., Cell, 56: 731-740, 1989. Детектирование апоптотических клеток на криосрезах опухоли проводили на основе мечения разрывов цепей ДНК (способ TUNELfluorescence) с использованием Терминальной Трансферазы и биотин-16-дУТФ, в соответствии с инструкциями производителя (Roche diagnostics AG, Rotkreuz, Switzerland). Связанный биотин-16-дУТФ определяли с помощью стрептавидина, конъюгированного с красителем Texas Red (Jackson Immunoresearch Laboratories, Inc., West Grove, PA, USA). Изображения были получены при помощи конфокального микроскопа Zeiss LSM510 либо микроскопа Zeiss Axiophot 1, снабженного цветной фотокамерой Axiocam color CCD. Изображения записывали и обрабатывали при помощи программы AxioVisionTM (Zeiss, Oberkochen, Germany). Для подсчета количества клеток, позитивных по кислой фосфатазе (макрофагов), и количестваTUNEL-позитивных клеток (апоптотических клеток) в опухолях, изображения четырех криосрезов на каждую опухоль анализировали при помощи программы Zeiss KS400 или Openlab (Zeiss, Oberkochen,Germany). МТТ-анализ для определения клеточной пролиферации Пролиферативный индекс первичных мышиных эндотелиальных клеток (LMEC) и опухолевых клеток (LLC1) определяли при помощи МТТ (3-(4,5-диметилтиазол-2-ил)-2,5-дифенилтетразолийбромид)анализа, согласно Hansen, MB et al., J Immunol Methods, 119: 203-210, 1989. Краткое описание - клетки в трех повторах помещали в 96-луночные планшеты при плотности засева от 1,25104 до 1105 клеток на лунку и культивировали в полной культуральной среде в присутствии или в отсутствие 50 мг/мл антиJАМ-С-антител H33 либо контрольных антител 9 В 5. После 24 ч культивирования в каждую лунку добавляли по 25 мл раствора МТТ (5 мг/мл в стерильном PBS), и после 2 ч инкубации при 37 С добавляли 100 мл экстракционного буфера (20% вес/объем SDS, растворенный в деминерализованном воднодиметилформамидном растворе; рН доводили до 4,7 путем добавления 2,5% 80%-ой уксусной кислоты и 2,5% 1 н. НСl). Смесь инкубировали в течение ночи при 37 С, после чего измеряли оптическую плотность при 570 нм на микропланшет-ридере (Molecular devices corporation, CA, USA). РезультатыAнти-JAM-C-антитела H33 снижают рекрутирование макрофагов в опухоли Опухолевый ангиогенез часто сопровождается воспалением, и макрофаги представляют собой известные опухолеассоциированные воспалительные клетки (Crowther, M et al., JLeukoc Biol 70: 478-490,2001). В действительности макрофаги принимают участие в ангиогенезе, секретируя ангиогенные факторы, такие как VEGF, преимущественно в условиях гипоксии (Murdoch, С et al., Blood 104 (8): 2224-34,2004). JAM-C вовлечен в лейкоцитарную адгезию и трансмиграцию через эндотелиальные и эпителиальные клетки (Zen, К et al., Mol Biol Cell 15: 3926-3937, 2004; Chavakis, T et al., J Biol Chem, 2004; JohnsonLeger, CA et al., Blood 100: 2479-2486, 2002; Cunningham, SA et al., J Biol Chem 275: 34750-34756, 2000). Таким образом, авторы исследовали возможность того, что антитела H33 оказывают влияние на рекрутирование макрофагов в опухолях. Как показано на фиг. 7 В и 7D, у мышей, которым вводили антитела H33, обнаруживали пониженное содержание макрофагов в опухолях по сравнению с контрольными мышами. Это указывает на то, что эффект, оказываемый антителами H33 на процесс ангиогенеза, отчасти опосредован воздействием на рекрутирование макрофагов. Анти-JАМ-С-антитела H33 не оказывают влияния на пролиферацию и апоптоз эндотелиальных клеток. Ангиогенез - это комплексный процесс, координируемый пролиферацией и структурной реаорганизацией эндотелиальных клеток в ответ на ангиогенные стимулы. В первую очередь была протестирована возможность антител H33 блокировать ангиогенез путем ингибирования пролиферации эндотелиальных клеток in vitro, однако выяснилось, что данные антитела не оказывают подобного эффекта (фиг. 8 А). Для исключения любого непосредственного действия H33 на пролиферацию опухолевых клеток был проведен in vitro эксперимент на опухолевых клетках, показавший отсутствие подобных эффектов (фиг. 8 В). Данные результаты указывают на то, что ингибирование ангиогенеза в результате введения H33 не является результатом воздействия на пролиферацию эндотелиальных или опухолевых клеток. Стимуляция апоптоза может являться другим объяснением ингибирования ангиогенеза антителами H33. Данная гипотеза была протестирована способом TUNEL, представляющим собой идентификацию апоптоза по стандартному протоколу мечения апоптотических клеток, на срезах опухоли. В результате проведенного эксперимента было показано, что антитела H33 не оказывают влияния на апоптоз эндотелиальных клетокin vivo и in vitro (фиг. 8 С и данные не приведены). Однако было обнаружено повышенное TUNELмечение опухолевых клеток in vivo, что свидетельствует о том, что апаптоз возникает в результате снижения опосредованной антителами васкуляризации (фиг. 8 С и D).- 15009037 ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Ингибирующая ангиогенез молекула, выбранная из группы, состоящей из антитела H33, продуцируемого гибридомой 13H33, депонированной 22 октября 2003 г. в Немецкой коллекции микроорганизмов и клеточных культур GmbH под регистрационным номером DSM ACC2622, а также его фрагментов и производных, имеющих ту же специфичность, что и H33. 2. Ингибирующая ангиогенез молекула по п.1, выбранная из группы, состоящей из:a) гуманизированного антитела на основе антитела H33, имеющего ту же специфичность, что иb) химерного антитела на основе антитела H33, имеющего ту же специфичность, что и H33;(iv) scFv, димера scFv, тримера scFv и более крупных агрегатов scFv;e) человеческого моноклонального антитела, имеющего ту же специфичность, что и H33. 3. Ингибирующая ангиогенез молекула по п.1 или 2, где указанная молекулаb) предотвращает опухолевый рост in vivo;c) снижает рекрутинг макрофагов в опухолях; иd) блокирует взаимодействие JAM-C с JAM-B. 4. Слитый белок, включающий в себя (а) ингибирующую ангиогенез молекулу по любому из пп.1-3 и (b) одну или две неиммуноглобулиновые части. 5. Применение ингибирующей ангиогенез молекулы по любому из пп.1-4 в качестве лекарственного средства. 6. Гибридома 13H33, депонированная в Немецкой коллекции микроорганизмов и клеточных культур GmbH под регистрационным номером DSM ACC2622. 7. Полинуклеотид, который кодирует ингибирующую ангиогенез молекулу по любому из пп.1-4. 8. Экспрессирующая кассета, содержащая полинуклеотид по п.7, связанный с соответствующими контрольными последовательностями, обеспечивающими регуляцию транскрипции и трансляции в выбранной хозяйской клетке. 9. Рекомбинантный вектор, содержащий экспрессирующую кассету по п.8. 10. Хозяйская клетка, содержащая вектор по п.9. 11. Способ получения ингибирующей ангиогенез молекулы по любому из пп.1-4, включающий в себя:a) введение в эукариотическую или прокариотическую хозяйскую клетку рекомбинантного экспрессирующего вектора, кодирующего указанную ингибирующую ангиогенез молекулу; иb) культивирование хозяйской клетки в течение времени, достаточного для экспрессии продукта в хозяйской клетке. 12. Способ по п.11, где хозяйская клетка представляет собой клетку млекопитающего. 13. Способ по п.12, где хозяйская клетка представляет собой клетку СНО, клетку NS/0 миеломы,COS, HEK293 или клетку SP2.0. 14. Применение ингибирующей ангиогенез молекулы по любому из пп.1-4 для получения терапевтической или диагностической композиции для лечения или диагностики рака. 15. Применение по п.14, где рак представляет собой солидную опухоль. 16. Применение ингибирующей ангиогенез молекулы по любому из пп.1-4 для получения лекарственного средства для предотвращения у пациентов взаимодействия JAM-B/JAM-C. 17. Фармацевтическая композиция, включающая в себя ингибирующую ангиогенез молекулу по любому из пп.1-4 наряду с подходящим наполнителем, носителем или разбавителем. 18. Диагностическая композиция, включающая в себя ингибирующую ангиогенез молекулу по любому из пп.1-4 наряду с подходящим наполнителем, носителем или разбавителем. 19. Диагностическая композиция по п.18, где ингибирующая ангиогенез молекула является меченой. 20. Применение ингибирующей ангиогенез молекулы по любому из пп.1-4 в диагностике in vivo. 21. Применение диагностической композиции по любому из пп.18-19 в диагностике in vivo.
МПК / Метки
МПК: C12N 15/63, C12N 5/16, C12P 21/00, C07K 19/00, C12N 15/13, A61P 35/00, C12N 15/62, C07K 16/28, G01N 33/566, A61K 39/395
Метки: ангиогенез, лечении, диагностике, рака, ингибирующие, молекулы, применение
Код ссылки
<a href="https://eas.patents.su/21-9037-molekuly-ingibiruyushhie-angiogenez-i-ih-primenenie-v-lechenii-i-diagnostike-raka.html" rel="bookmark" title="База патентов Евразийского Союза">Молекулы, ингибирующие ангиогенез, и их применение в лечении и диагностике рака</a>
Предыдущий патент: Новая кристаллическая форма натриевой соли 3-пиридил-1-гидроксиэтилиден-1,1-бисфосфоновой кислоты
Следующий патент: Замещенные имидазопиримидины для предупреждения и лечения рака
Случайный патент: Электрохимическое восстановление оксидов металлов