Рекомбинантные антитела и фрагменты, узнающие n-гликолил gm3 ганглиозид и их применение в диагностике и лечении злокачественных опухолей
Номер патента: 8353
Опубликовано: 27.04.2007
Авторы: Рохас Дорантес Гертрудис, Родригес Гонсалес Мабель, Роке Наварро Лоудес Татьяна, Морено Фриас Эрнесто, Талавера Перес Арьель, Матео Де Акоста Дель Рио Кристина Мария
Формула / Реферат
1. Рекомбинантное антитело, полученное из мышиного моноклонального антитела 14F7, продуцируемое гибридомой с инвентарным номером ЕСАСС 98101901, характеризуемое последовательностями гипервариабельных областей (CDR) тяжелой и легкой цепей, приведенных ниже.
ТЯЖЕЛАЯ ЦЕПЬ
CDR1: SYWIH
CDR2: YIDPATAYTESNQKFKD
CDR3: ESPRLRRGIYYYAMDY
ЛЕГКАЯ ЦЕПЬ
CDR1: RASQSISNNLH
CDR2: YASQSIS
CDR3: QQSNRWPLT
2. Антитело по п.1, отличающееся тем, что является химерным вариантом антитела 14F7, содержащим CDR и каркасные области (FR) тяжелой и легкой цепей указанного антитела 14F7, константную область тяжелой цепи человеческого IgG1, константную область Сk человеческой легкой цепи с указанными ниже последовательностями каркасных областей (FR) тяжелой и легкой цепей:
ТЯЖЕЛАЯ ЦЕПЬ
FR1: QVQLQQSGNELAKPGASMKMSCRASGYSFT
FR2: WLKQRPDQGLEWIG
FR3 : KAILTADRSSNTAFMYLNSLTSEDSAVYYCAR
FR4: WGQGTTVTVSS
ЛЕГКАЯ ЦЕПЬ
FR1: DLVLTQSPATLSVTPGDSVSFSC
FR2: WYQQRTHESPRLLIK
FR3: GIPSRFSGSGSGTDFTLSIISVETEDFGMYFC
FR4: FGAGTKLELKRA
3. Антитело по пп.1 и 2, отличающееся тем, что является гуманизированным вариантом моноклонального антитела 14F7, содержащим точечные мутации в каркасных областях (FR) тяжелой и легкой цепей для снижения иммуногенности.
4. Антитело по п.3, отличающееся тем, что является гуманизированным вариантом моноклонального антитела 14F7, каркасные области тяжелых и легких цепей которого содержат любые из указанных ниже мутаций:
ТЯЖЕЛАЯ ЦЕПЬ:
| Позиция 5 | Q вместо V |
| Позиция 9 | N вместо А |
| Позиция 11 | L вместо V |
| Позиция 12 | А вместо V |
| Позиция 18 | М вместо V |
| Позиция 19 | K вместо R |
| Позиция 20 | М вместо V |
| Позиция 40 | R вместо А |
| Позиция 42 | D вместо G |
ЛЕГКАЯ ЦЕПЬ:
| Позиция 39 | R вместо K |
| Позиция 40 | Т вместо Р |
| Позиция 41 | Н вместо G |
| Позиция 42 | Е вместо Q |
5. Одноцепочечный фрагмент Fv, полученный из мышиного моноклонального антитела 14F7, продуцируемого гибридомой с инвентарным номером ЕСАСС 98101901, отличающийся тем, что содержит последовательность вариабельной области тяжелой цепи мышиного моноклонального антитела 14F7 и вариабельную область легкой цепи мышиного антитела.
6. Одноцепочечный фрагмент Fv по п.5, отличающийся тем, что вариабельная область легкой цепи представляет собой само антитело 14F7.
7. Одноцепочечный фрагмент Fv по п.6, отличающийся тем, что последовательности гипервариабельных областей (CDR) тяжелой и легкой цепей представляют собой последовательности, указанные ниже:
ТЯЖЕЛАЯ ЦЕПЬ
CDR1: SYWIH
CDR2: YIDPATAYTESNQKFKD
CDR3: ESPRLRRGIYYYAMDY
ЛЕГКАЯ ЦЕПЬ
CDR1: RASQSISNNLH
CDR2: YASQSIS
CDR3: QQSNRWPLT
8. Одноцепочечный фрагмент Fv по п.7, отличающийся тем, что содержит гипервариабельные области (CDR) и каркасные области (FR) тяжелой и легкой цепей указанного антитела 14F7, последовательности каркасных областей (FR) тяжелой и легкой цепей которого представляют собой указанное ниже:
ТЯЖЕЛАЯ ЦЕПЬ
FR1: QVQLQQSGNELAKPGASMKMSCRASGYSFT
FR2: WLKQRPDQGLEWIG
FR3 : KAILTADRSSNTAFMYLNSLTSEDSAVYYCAR
FR4: WGQGTTVTVSS
ЛЕГКАЯ ЦЕПЬ
FR1: DLVLTQSPATLSVTPGDSVSFSC
FR2: WYQQRTHESPRLLIK
FR3: GIPSRFSGSGSGTDFTLSIISVETEDFGMYFC
FR4: FGAGTKLELKRA
9. Одноцепочечный фрагмент Fv по п.8, который содержит точечные мутации каркасных областей (FR) тяжелой и легкой цепей для снижения иммуногенности.
10. Одноцепочечный фрагмент Fv по п.9, каркасные области тяжелой и легкой цепей которого содержат любые из указанных ниже мутаций:
ТЯЖЕЛАЯ ЦЕПЬ:
| Позиция 5 | Q вместо V |
| Позиция 9 | N вместо А |
| Позиция 11 | L вместо V |
| Позиция 12 | А вместо R |
| Позиция 18 | М вместо V |
| Позиция 19 | K вместо R |
| Позиция 20 | М вместо V |
| Позиция 40 | R вместо А |
| Позиция 42 | D вместо G |
ЛЕГКАЯ ЦЕПЬ:
| Позиция 39 | R вместо K |
| Позиция 40 | Т вместо Р |
| Позиция 41 | Н вместо G |
| Позиция 42 | Е вместо Q |
11. Одноцепочечный фрагмент Fv по п.5, полученный из мышиного моноклонального антитела 14F7, продуцируемого гибридомой с инвентарным номером ЕСАСС 98101901, отличающийся тем, что содержит последовательность вариабельной области тяжелой цепи моноклонального антитела 14F7 и вариабельную область легкой цепи, последовательность которых представляют собой указанное ниже:

12. Одноцепочечный фрагмент Fv по п.5, полученный из мышиного моноклонального антитела 14F7, продуцируемого гибридомой с инвентарным номером ЕСАСС 98101901, отличающийся тем, что содержит последовательность вариабельной области тяжелой цепи мышиного моноклонального антитела 14F7 и вариабельную область легкой цепи, последовательности которых представляют собой указанное ниже:

13. Одноцепочечный фрагмент Fv, полученный из мышиного моноклонального антитела 14F7, продуцируемого гибридомой с инвентарным номером ЕСАСС 98101901, отличающийся тем, что содержит последовательность вариабельной области тяжелой цепи мышиного моноклонального антитела 14F7 и вариабельную область легкой цепи антитела человека.
14. Одноцепочечный фрагмент Fv по п.13, отличающийся тем, что содержит последовательность вариабельной области тяжелой цепи мышиного моноклонального антитела 14F7 и вариабельную область легкой цепи, последовательность которого представляет собой указанное ниже:


15. Одноцепочечэыщ фрагмент Fv по п.13, отличающийся тем, что содержит последовательность вариабельной области тяжелой цепи мышиного моноклонального антитела 14F7 и вариабельную область легкой цепи, последовательность которого представляет собой указанное ниже:

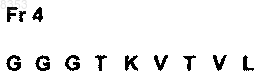
16. Одноцепочечный фрагмент Fv по п.13, отличающийся тем, что содержит последовательность вариабельной области тяжелой цепи мышиного моноклонального антитела 14F7 и вариабельную область легкой цепи, последовательность которого представляет собой указанное ниже:

17. Клеточная линия, отличающаяся тем, что экспрессирует рекомбинантное антитело по любому из пп.1-4.
18. Клеточная линия, отличающаяся тем, что экспрессирует одноцепочечный фрагмент Fv по любому из пп.5-16.
19. Фармацевтическая композиция для лечения злокачественных опухолей, отличающаяся тем, что содержит рекомбинантное антитело по любому из пп.1-4.
20. Фармацевтическая композиция для лечения злокачественных опухолей, отличающаяся тем, что содержит одноцепочечный фрагмент Fv по любому из пп.5-16 и соответствующий наполнитель.
21. Применение фармацевтической композиции по п.19 для лечения злокачественных опухолей молочной железы, и меланом, и их метастазов и рецидивов.
22. Применение фармацевтической композиции по п.20 для лечения злокачественных опухолей молочной железы, и меланом, и их метастазов и рецидивов.
23. Реагент для определения локализации и идентификации in vivo злокачественных опухолей, отличающийся тем, что содержит рекомбинантное антитело по любому из пп.1-4 и соответствующий маркер.
24. Реагент по п.23, отличающийся тем, что может использоваться для определения локализации и идентификации in vivo злокачественных опухолей молочной железы, и меланом, и их метастазов и рецидивов.
25. Реагент для определения локализации и идентификации in vivo злокачественных опухолей, отличающийся тем, что содержит одноцепочечный фрагмент Fv по любому из пп.5-16 и соответствующий маркер.
26. Реагент по п.25, отличающийся тем, что может использоваться для определения локализации и идентификации in vivo злокачественных опухолей молочной железы, и меланом, и их метастазов и рецидивов.
Текст
008353 Область техники, к которой относится изобретение Настоящее изобретение относится к области иммунологии, и в частности к получению менее иммуногенных иммуноглобулинов, с применением технологий генной инженерии, которые могут использоваться при лечении рака. Конкретно, настоящее изобретение относится к пептидным последовательностям, кодирующим моноклональные антитела или их фрагменты, которые распознают антигены, содержащие N-гликолилганглиозид GM3 ганглиозид, не распознают другие связанные ганглиозиды, такие какN-гликолил или N-ацетил, и сулъфатированные гликолипиды. Уровень техники Ганглиозиды представляют собой гликосфинголипиды, содержащие сиаловую кислоту. Они представлены в плазматических мембранах позвоночных (Stults C.L.M. et al., Methods Enzymology 179:167214, 1989). В литературе были описаны некоторые из этих молекул как ассоциированные с опухолями антигены или маркеры опухолей (Hakamori S.H.: Curr. Opin. Immunol. 3:646-653, 1991), также было описано применение антител против ганглиозидов в диагностике и лечении рака (Hougton A.N. et al., NASUSA 82:1242-1246, 1985; Zhang S. et al., Int. J. Cancer 73:42-49, 1997). Чаще всего в клетках млекопитающих сиаловые кислоты представлены N-ацетилом (NAc) и N-гликолилом (NGc) (Corfield А.Р. et al., Cell. Biol.Monogr. 10:5-50, 1982). Обычно NGc не экспрессируются в нормальных тканях человека и кур, но широко распространены у других позвоночных (Leeden R.W. et al., Biological Role of Sialic Acid. Rosemberg A.and Shengtrund C.L. (Eds). Plenum Press, New York, 1-48, 1976, Kawai T. et al., Cancer Research 51:12421246, 2001). Однако в литературе было показано, что антитела против NGc распознают некоторые злокачественные опухоли человека и клеточные линии опухолей (Higashi H. et al., Jpn J. Cancer Res. 79:952956, 1988, Fukui Y. et al., Biochem. Biophys. Res. Commun. 160:1149-1154, 1989). При раке молочной железы человека было обнаружено повышение уровня GM3 (NGc) ганглиозидов (Marquina G. et al., CancerResearch 56:5165-5171, 1996), что делает эту молекулу очень эффективной в качестве мишени при лечении рака. В патенте данной области ЕР 0972782 А 1 описано мышиное моноклональное антитело, продуцируемое гибридомой, и гибридома депонирована в соответствии с Будапештским соглашением под инвентарным номером ЕСАСС 98101901. Это моноклональное антитело относится к изотипу IgG1 и образуется при иммунизации мышей Balb/c ганглиозидом NGcGM3, гидрофобно-конъюгированным с липопротеинами низкой плотности (VLDL) и в присутствии адъюванта Фрейнда, указанное антитело преимущественно направлено против ганглиозида NGcGM3 и распознает антигены, экспрессированные опухолевыми клетками молочной железы и клетками меланомы человека (Carr A. et al., Hybridoma 19:3:241-247,2000). Это антитело обладает сильной цитолитической активностью в отношении клеток, несущих указанную последовательность, свойство, которое могло бы сделать его терапевтическим инструментом. Кроме того, известно, что неоваскуляризация, индуцированная опухолями, составляет один из главных параметров в контроле опухолевого роста. Поэтому исследования направлены на поиск новых терапевтических средств, имеющих отношение к ингибированию антигенного процесса. Существуют экспериментальные доказательства эффекта антител 14F7 на этот процесс. Указанные доказательства были обнаружены в исследованиях матриксного геля (Angiogenesis. Vol. 4, Pags. 113-121, 2001; AntiCancer Res. Vol. 18, Pags. 783-790, 1988). Матриксный гель представляет собой смесь белков базальной мембраны и экстрацеллюлярного матрикса, который окружает эндотелиальные клетки. Его значимость в процессе неоваскуляризации заключается в физиологической необходимости взаимодействия эндотелия с матриксом при развитии новых кровеносных сосудов. Также полагают, что важными маркерами этого процесса являются такие компоненты этого геля, как ламинин. Эту модель также применяли при изучении механизмов, связанных с индуцированным опухолями ангиогенезом, что позволяет оценить фармацевтические возможности модулирования событий, непосредственно связанных с опухолью, таким образом, влияя на ее рост и метастазирование. Применение нечеловеческих моноклональных антител, таких как мышиные 14F7, имеет ряд недостатков при лечении человека, особенно при повторных схемах лечения. Например, мышиные моноклональные антитела обладают относительно коротким временем полужизни антитела в кровотоке. Кроме того, при применении у человека они теряют важные иммунологические свойства, такие как эффекторные функции. И, еще более важно, мышиные моноклональные антитела содержат значительное количество аминокислотных последовательностей, являющихся иммуногенными при введении человеку. Многочисленные исследования показали, что после введения чужеродного антитела вызванный иммунный ответ у пациента может быть значительно сильнее и, по существу, элиминирует терапевтический эффект антитела после первоначального введения. Кроме того, даже после лечения пациента мышиными моноклональными антителами последующее лечение неродственными мышиными антителами могло бы быть неэффективным или даже опасным вследствие возникновения перекрестной реакции, известной как ответ НАМА (Khazaeli, M.B., et al., Journal of Immunotherapy 15:42-52, 1994).Mateo et al. (патент СШАUS 5712120) описали способ снижения иммуногенности мышиных антител. Антитело, модифицированное способом, описанным Mateo et al. (Mateo C. et al., Hybridoma 19:6:463-471, 2000), сохраняет способность исходного антитела распознавать и связываться с антигеном-1 008353 и является менее иммуногенным, что повышает его терапевтическую применимость. Данная процедура является процедурой, в которой, посредством небольшого ряда мутаций, получают модифицированные антитела со сниженной иммуногенностью по сравнению с химерными антителами. На основании указанного выше можно предположить необходимость получения вариантов терапевтических антител, которые являются менее иммуногенными, получают простым экономным путем и являются адекватными для получения терапевтических препаратов для применения у человека. Также известно, что применение фрагментов антител также может быть очень эффективным при иммунодиагностике заболеваний. Ira Pastan и другие (заявка на езропейский патент ЕР 07 96334 А 1) описывают конструкцию одноцепочечных фрагментов типа Fv с применением вариабельных областей антител, которые специфически распознают углевод, связанный с антигеном Y Льюиса. На основании указанных фрагментов авторы разработали способ обнаружения клеток, несущих указанный антиген, а также привели доказательства ингибирующего эффекта, который эти фрагменты оказывают на клетки, несущие антиген. Данные об участке связывания моноклонального антитела 14F7 позволили сформировать интересную практическую и теоретическую точку зрения о возможности применения этого антигена в иммунотерапии различных заболеваний. Souriau, С. et al. в Expert Opin. Biol. Ther. 1, 845-855, 2001 и Chester, K.A., et al. в Dis. Markers. 16, 53-62, 2000, показали, что применение фрагментов антител типа scF'v может иметь широкое терапевтическое применение, учитывая преимущества таких их фармакологических свойств, например более эффективное проникновение в опухолевую ткань. Конструирование мини-библиотек фрагментов антител из гибридом, экспонированных на нитевидных фагах, позволяет провести селекцию в пределах данного спектра молекул, способных к специфическому распознаванию антигена. Целью является быстрое получение фрагментов антител, сочетающих в себе возможность распознавать исходное антитело с меньшим молекулярным размером и способностью к продукции бактериальным хозяином. Эта методика позволяет исключить множество вариантов фрагментов антител, получаемых при выделении или манипуляции с генами вариабельных областей гибридомы посредством обычных технологий клонирования, которые не являются функциональными или которые не могут быть получены из бактерий (Roovers, R.С. et al., Br. J. Cancer. 78, 1407-1416, 1998). С помощью технологии представления фрагмента антитела в нитевидных фагах можно получить уникальную возможность доступа к участку связывания антитела, а также возможность внесения модификаций в антитело с целью повышения его аффинности (Chames, P. et al., J. Immunol. 161, 5421-5429,1998, Lamminmaki, U. et al., J. Mol. Biol. 291, 589-602, 1999, Parhami-Seren et al., J. Immunol. Methods 259,43-53, 2002) или модулирования его специфичности (Iba, Y. et al., Prot. Engn., 11, 361-370, 1998, Miyazaki,С. et al., Prot. Engn. 12, 407-415, 1999, Darveau, R.P. et al., J. Clin. Immunoassay 15, 25-29, 1992). Благодаря экспрессии фрагментов антител в нитевидных фагах можно осуществить обмен цепями(Lantto, J. et al., Methods Mol. Biol. 178, 303-316, 2002), которые представляют собой сочетание различных VL и VH исходного антитела, или, наоборот, что, таким образом, позволяет изучать роль каждой цепи в распознавании антигена и ее влияния на аффинность антитела (Kabat, E.A., Wu, Т.Т., J. Immunol. 147, 1709-1719, 1991, Barbas III, С.F., Lerner, R.A. Methods: A companion to Methods in Enzymology 2, 119124, 1991). Обмен цепей позволяет модифицировать свойства участка связывания, а также сочетать последовательности иммуноглобулинов разных видов и отбирать те варианты, которые сохраняют специфичность распознавания (Klimka, A. et al., Br. J. Cancer. 83, 252-260, 2000, Steinberger, P. et al., J. Biol.Chem. 275, 36073-36078, 2000, Rader, С. et al., Proc. Natl. Acad. Sci. USA 95, 8910-8915, 1998, Beiboer,S.W.H. et al., J. Mol. Biol. 296,833-849, 2000). Настоящее изобретение относится к модифицированному антителу, полученному из мышиного моноклонального антитела 14F7, распознающего исходный антиген с такой же аффинностью и которое обладает меньшей иммуногенностью при введении пациентам. Еще одним открытием настоящего изобретения явилось получение фрагментов, полученных из указанного антитела, которые содержат вариабельные области легких цепей, отличающиеся от исходной, но сохраняющие ее свойства специфичности,аффинности и распознавания, и которые могут быть экспрессированы бактериальным хозяином в виде растворимых молекул, а также быть представлены на поверхности нитевидных фагов. Фрагменты, полученные из антитела 14F7, могут использоваться в качестве терапевтических средств. Кроме того, экспрессия фрагментов антитела 14F7 типа scFv на поверхности нитевидного фага М 13 позволяет совершать манипуляции с участком связывания и получать варианты с более высокой аффинностью в терапевтических целях. Одной из целей настоящего изобретения является характеристика фрагментов антител, только частично сохраняющих последовательность 14F7, но сохраняющих его специфичность, аффинность и распознающие свойства. Полученное модифицированное антитело и фрагменты специфически распознают опухолевые клетки, которые экспрессируют антиген NGcGM3, что, таким образом, делает возможным их применение для диагностики и терапии указанных опухолей, и они обладают преимуществом меньшей иммуногенности по сравнению с мышиными антителами, из которого они были получены. Объектами настоящего изобретения являются новые терапевтические композиции, содержащие мо-2 008353 дифицированные антитела 14F7 или одноцепочечные фрагменты Fv, где указанные антитела или фрагменты могут быть связаны с радиоактивным изотопом, который может использоваться для определения локализации или лечения опухолей, экспрессирующих антиген. Также объектом настоящего изобретения является способ радиоиммунодиагностики или радиоиммунотерапии опухолей, экспрессирующих ганглиозид NGcGM3, с применением фармацевтических композиций, содержащих модифицированные антитела 14F7 или их фрагменты, связанные с радиоактивным изотопом. Подробное описание изобретения В настоящем изобретении описано химерное антитело, полученное из мышиного моноклонального антитела 14F7, продуцируемого гибридомой с инвентарным номером ЕСАСС 98101901, характеризующееся следующими последовательностями гипервариабельных областей (CDR) тяжелой и легкой цепей: ТЯЖЕЛАЯ ЦЕПЬCDR3: QQSNRWPLT Предпочтительно указанное химерное антитело характеризуется следующими последовательностями каркасных областей (FR) тяжелой и легкой цепей: ТЯЖЕЛАЯ ЦЕПЬFR4: FGAGTKLELKRA Кроме того, химерное антитело характеризуется содержанием константной области тяжелой цепиIgG1 человека и константной области легкой цепи Сk человека. В предпочтительном варианте осуществления настоящее изобретение относится к модифицированному антителу, полученному из мышиного моноклонального антитела 14F7, продуцируемого гибридомой с инвентарным номером ЕСАСС 98101901, характеризующегося тем, что каркасные области тяжелой и легкой цепей содержат любую из следующих мутаций: ТЯЖЕЛАЯ ЦЕПЬ: Позиция 5I для V Предпочтительно указанное модифицированное антитело характеризуется содержанием константной области тяжелой цепи IgG1 человека и константной области легкой цепи Сk человека. Еще один аспект настоящего изобретения относится к одноцепочечным фрагментам Fv типа, полученным из антитела 14F7, содержащего последовательность вариабельной области тяжелой цепи, полученной из гибридомы (инвентарный номер ЕСАСС 98101901), и сохраняющим специфичность распознавания 14F7. Предпочтительно указанные фрагменты Fv содержат вариабельные области легких цепей, получен-3 008353 ные от неиммунизированных мышей или человека, отличающиеся от вариабельной области легкой цепи,продуцируемой указанной выше гибридомой, что делает возможным ее продукцию бактериальным хозяином в виде фрагментов антитела, представленных на нитевидных фагах, или растворимых молекул. Настоящее изобретение также относится к клеточным линиям, которые экспрессируют химерные и гуманизированные антитела, и бактериальным клонам, которые продуцируют фрагменты, полученные из 14F7. Кроме того, настоящее изобретение относится к фармацевтическим композициям для лечения и/или определения локализации и идентификации злокачественных опухолей молочной железы и меланом, их метастазов и рецидивов, характеризуемых содержанием одного из рекомбинантных моноклональных антител по настоящему изобретению или их фрагментов, а также наполнителя, подходящего для их применения. Указанное антитело или фрагмент могут быть связаны с радиоактивным изотопом, который может использоваться для обнаружения локализации и/или терапии злокачественных опухолей. Наконец, настоящее изобретение относится к применению описанных рекомбинантных антител для получения фармацевтической композиции, которая может использоваться для лечения и/или определения локализации и идентификации злокачественных опухолей. Подробное описание того, как выполнять и применять настоящее изобретение, приводится ниже. 1. Синтез ADNc и амплификация посредством ПЦР (полимеразной цепной реакции) вариабельных областей мышиного антитела 14F7. Мышиное антитело 14F7 получали иммунизацией мышей Balb/c ганглиозидом GM3 (NeuGc), гидрофобно конъюгированным с липопротеинами низкой плотности и в присутствии адъюванта Фрейнда(ЕР 0972782 A1, Carr A. et al., Hybridoma 19:3:241-247, 2000). РНК получали из 106 клеток гибридомы,продуцирующей моноклональное антитело 14F7 (мышиный IgGl Mab), распознающее ганглиозидNGcGM3, применяя способ экстракции с тризолом (GIBCO BRL, NY) в соответствии с инструкциями производителя. Синтез комплементарной ДНК (кДНК) и амплификацию вариабельных областей VH и VL осуществляли, с применением набора реагентов: Access RT-PCR (Promega, USA) в соответствии с рекомендациями производителя. В кратком изложении: реакцию проводили с 5 мкг РНК в присутствии 25 пМ олигонуклеотида dT, предназначенного для связывания с поли-А хвостом РНК и олигонуклеотидов, соответствующих концам каждой вариабельной области: VH и VL. Инкубировали 10 мин при 60 С, после чего добавляли смесь, содержащую 0,2 мМ каждого дезоксирибонуклеотида (dNTP), 1 мМ MgSO4, 5AMV-обратной транскриптазы, 5 ДНК-полимеразы в реакционном буфере до общего объема 50 мкл. Образцы инкубировали в течение 45 мин при 48 С, 2 мин при 94 С, затем проводили 40 циклов ПЦР при температурах 94 С (30 с), 60 С (1 мин), 68 С (2 мин), а конечную инкубацию в течение 7 мин при 68 С. 2. Конструирование химерных генов и определение последовательности нуклеотидов амплифицированной кДНК. Продукты ПЦР VH и VK обрабатывали рестрикционными ферментами Eco RV-Nhe I для VH и EcoRV-Sal I для VK и клонировали в соответствующие экспрессирующие векторы (Coloma M.J. et al., J. Immunol. Methods 152:89-104, 1992). Область VH клонировали в вектор РАН 4 604, содержащий константную область IgG1 человека, а в качестве селективного маркера ген устойчивости к L-гистидинолу. Область VK клонировали в вектор PAG4622, несущий ген устойчивости к микофенольной кислоте и константную область человеческой каппа. Полученные генетические конструкции обозначили 14F7VHPAH4604 и 14F7VK-PAG4622, соответственно. Обе конструкции секвенировали способом с применением дидезоксинуклеотидов (Sanger F. et al.,PNAS USA 74:5463-5470, 1979), применяя коммерческий набор реагентов для определения последовательности с ДНК-полимеразой Т 7 (Amershan-Pharmacia) в соответствии с протоколом, описанным производителем. 3. Экспрессия химерного антитела. Клетки NSO подвергали электропорации 10 мкг 14F7VH-РАН 4604, а 10 мкг 14F7VK-PAG4622 преобразовывали в линейную форму ферментом PvuI. ДНК выделяли с применением этанола, перемешивали и растворяли в 50 мкл PBS (раствор фосфатно-солевого буфера). Приблизительно 107 клеток растили до неполной конфлюэнтности и собирали центрифугированием. Затем клетки ресуспендировали в 0,5 млPBS вместе с ДНК в кювете для электропорации. Клетки выдерживали 10 мин на льду, затем подвергали импульсу 200 В и 960 Ф, после чего помещали в лед на 10 мин. Клетки культивировали в 96-луночном планшете в модифицированной Дульбекко селективной культуральной среде (DMEM-F12) с добавлением 10% фетальной телячьей сыворотки (FCS) и 10 мМ L-гистидинола. Трансфицированные клоны становились видимыми через 10 суток после добавления селективной среды. Продукцию химерного иммуноглобулина определяли способом ELISA в супернатантах клонов. Для этого полистироловые планшеты(High binding, Costar) покрывали сывороточным козьим IgG против иммуноглобулинов человека в 100 мМ карбонатно-бикарбонатного буфера, рН 9,8 в течение ночи при 4 С. Затем планшеты отмывали вPBS-Tween (раствор фосфатно-солевого буфера, 0,5% Tween-20, рН 7,5) и добавляли и инкубировали в течение часа при 37 С образцы супернатантов культур, разведенные PBS-Tween-FCS. Планшеты снова-4 008353 отмывали в PBS-Tween, после чего инкубировали с сывороткой, содержащей козью цепь каппа против иммуноглобулинов человека, конъюгированной с пероксидазой (Jackson), в течение часа при 37 С. После этого планшеты отмывали в тех же условиях и инкубировали с раствором цитратно-фосфатного буфера,рН 4,2, содержащего субстрат о-фенилендиамин. Спустя 15 мин измеряли поглощение при 492 нм. Способность химерного антитела распознавать антиген проверяли посредством конкурентного ELISA, применяя ганглиозиды NGcGM3 и NacGM3. В кратком изложении: полистироловые планшеты (Polysorp,Nunc) покрывали 50 мкл раствора с 4 мкг/мл NGcGM3 или NAcGM3 в метаноле и инкубировали в течение часа при 37 С. Затем планшеты блокировали 200 мкл 1% раствора бычьего сывороточного альбумина (BSA) в буфере Tris-НСl, рН 7,8-8,0 в течение часа при 37 С. После трех отмывок в PBS в присутствии 1 мг/мл биотинилированного мышиного антитела 14F7 на 2 ч при 37 С добавляли разведенные в 1% TrisHCl-BSA образцы в диапазоне концентраций 2-0,01 мкг/мл. Затем планшеты отмывали в PBS, и реакция развивалась в присутствии конъюгата стрептавидин-пероксидаза (Jackson) при 37 С в течение 1 ч. Поглощение измеряли при 492 нм. 4. Конструирование гуманизированного антитела 14F7hT посредством гуманизирования Т-эпитопов. Прогнозирование Т-эпитопов. Последовательности вариабельных доменов 14F7 анализировали при помощи программного обеспечения AMPHI Program (Margalit H. et al., J. Immunol. 138: 2213-2229, 1987), которое позволяет идентифицировать сегменты из 7-11 аминокислот с амфипатической спиральной структурой, связанные с иммуногенностью Т-клеток. В данном случае такие алгоритмы предсказывают фрагменты, связанные с представлением Т-эпитопов в вариабельных областях тяжелых и легких цепей мышиного моноклонального антитела 14F7. Анализ гомологии с иммуноглобулинами человека. Аминокислотные последовательности вариабельных доменов 14F7 сравнивали с последовательностями вариабельных областей описанных иммуноглобулинов человека для того, чтобы определить человеческий иммуноглобулин, обладающий наибольшей гомологией с анализируемой мышиной молекулой. Для этого можно применять базу данных SWISSPROT, доступную в Internet посредством программного обеспечения BLAST (Altschul S.F. et al., Nucleic Acids Res. 25:3389-3402, 1997). Анализ для снижения иммуногенности. Сущность способа состоит в достижении снижения иммуногенности посредством разрушения или гуманизирования возможных Т-эпитопов с минимальным количеством мутаций в FR, в особенности в тех сегментах, которые содержат амфипатические спиральные структуры, за исключением положений,вовлеченных в трехмерную структуру распознающей антиген области. По данному способу последовательности вариабельных областей VH и VL мышиного иммуноглобулина сравнивают с последовательностями вариабельных областей VH и VL человеческого иммуноглобулина с наибольшей гомологией, а различающиеся между мышиной и человеческой последовательностями остатки идентифицируют только в амфипатических областях в пределах областей FR (Kabat Е., Sequences of proteins of immunologicalinterest, Fifth Edition, National Institute of Health, 1991). Такие "мышиные" остатки являются остатками,восприимчивыми к замене теми остатками, которые находятся в том же положении человеческой последовательности. Остатки, присутствующие в положениях FR, соответствующих канонической структуре, т.е. остатки, присутствующие в зоне Вернера или участвующие во взаимодействиях на поверхности раздела VHVL, нельзя подвергать мутациям, так как это может воздействовать на трехмерную структуру вариабельного домена антитела и, таким образом, воздействовать на связывание с антигеном. Дополнительную информацию о действии замен, основанных на третичной структуре, можно получить посредством молекулярного моделирования вариабельных областей. Так как при анализе элементов мутаций, таких как присутствие пролиновых остатков в амфипатической спирали или тот факт, что определенный мышиный остаток не обнаруживается в том же положении в большинстве гомологичных человеческих последовательностей, но часто встречается в других человеческих иммуноглобулинах, можно рассматривать, что возможно получить вариант, содержащий максимальное количество мутаций, то есть такой, где все мышиные остатки, отличающиеся от человеческой последовательности, являются мутированными, но другие варианты можно получить с другими сочетаниями мутаций. После определения в мышиной последовательности 14F7 возможных Т-эпитопов, и установив в пределах этих сегментов остатки, отличающиеся от человеческих, конструировали замены посредством стандартных способов направленного мутагенеза. Клонирование и экспрессия гуманизированного 14F7hT антитела в клетках NSO. После получения описанным ранее способом генетических конструкций, соответствующие областям VH и VL антитела 14F7hT, клонировали в соответствующие экспрессирующие векторы так же, как описано выше в случае химерной конструкции антитела, с получением следующих генетических конструкций: 14F7hTVK-PAG4622 и 14F7hTVH-PAH4604. Трансфекцию этих генов в клетки NSO проводили в тех же условиях, которые описаны для химерного антитела. Клоны, продуцирующие гуманизированное антитело, также определяли посредством ELISA.-5 008353 Способность специфического распознавания антигена гуманизированным антителом подтверждали посредством конкурентного ELISA, применяя ганглиозиды NGcGM3 и NAcGM3. Процедура идентична процедуре для химерного антитела. 5. Конструкция библиотек фрагментов антител из гибридомы 14F7 на нитевидных фагах. Информационную РНК выделяли из клеток гибридомы 14F7, синтезировали комплементарную ДНК, а соответствующие вариабельным областям тяжелых и легких цепей последовательности амплифицировали отдельно, применяя два набора олигонуклеотидов, предназначенных для гибридизации с широким диапазоном мышиных вариабельных областей. Вариабельные области каждой амплифицированной тяжелой цепи очищали, обрабатывали соответствующими ферментами и связывали с фагмидным вектором pHG-1m (сделан для представления одноцепочечных антител на поверхности нитевидных фагов), расщепленным ранее тем же ферментом. Продукты реакции связывания очищали и посредством электропорации вводили в бактериальный штамм Е. coli TG1. Трансформированные бактерии составляют неполную библиотеку вариабельных областей тяжелой цепи с ограниченным разнообразием (все из них получены из гибридомы 14F7). ДНК, соответствующую этой неполной библиотеке, очищали и по отдельности связывали с коллекциями вариабельных областей легкой цепи (очищенными ранее и обработанными соответствующими ферментами). Наконец, эти генетические конструкции вводили посредством электропорации в бактериальный штамм TG1 для согласования различные типов независимых библиотек. Одна из них представляет собой мини-библиотеку с ограниченным разнообразием, сконструированную из вариабельной области легкой цепи, также полученной из клеток гибридомы 14F7. Также получали библиотеки замены цепей, в которых вариабельные области тяжелых цепей из гибридомы сочетали с разными коллекциями вариабельных областей легких цепей, полученными из мышиных и человеческих лимфоцитов. 6. Выделение и характеристика клонов, продуцирующих фрагменты антител против N-гликолил GM3. Колонии из каждой библиотеки брали случайным образом для получения из них фагов с применением вспомогательного фага М 13 K07. Распознавание N-гликолил GM3 фагами, несущими фрагменты антител,сразу анализировали посредством твердофазного иммуноферментного анализа (ELISA). Таким образом,определяли продуцирующие функциональные фрагменты клоны. Несущие фрагменты антител фаги выделяли из общей смеси трансформированных бактерий, формирующих каждую библиотеку, чтобы получить препарат с высоким содержанием функциональных фрагментов антител, и исследовали разнообразие библиотек. Полученную фаговую смесь приводили в контакт с антигеном N-гликолил GM3, связанным с твердой поверхностью фаги, несущие фрагменты антител со связывающей способностью, удерживались,а остаток удаляли истощающими отмывками. Связанные фаги элюировали посредством изменения рН,размножали с получением новой фаговой смеси, которая служила исходным материалом для нового цикла отбора на антигене. После различных циклов селекции анализировали распознавание фрагментов антител, представленных на поверхности фагов из колоний. Таким образом, идентифицировали дополнительные клоны, продуцирующие функциональные фрагменты, растворенные в исходной библиотеке. Характеристика фрагментов антител, продуцируемых клонами, включала в себя анализ специфичности посредством ELISA против панели связанных ганглиозидов, изучение распознавания опухолей посредством иммуногистохимии, оценку их способности вырабатываться в виде растворимых функциональных фрагментов антител, вне контекста их представления в фагах, и полного секвенирования их вариабельных областей. Примеры В следующих ниже примерах, если не указано иначе, все применяемые ферменты рестрикции или модификации, а также реагенты и материалы получали из коммерческого источника. Пример 1. Получение химерного моноклонального антитела 14F7. Синтез ДНК и амплификацию посредством ПЦР мышиных вариабельных областей VH и VK проводили с применением фермента полимеразы Vent, применяя специфические олигонуклеотиды с областями рестрикции Eco RV-Nhe I для VH и Eco RV-Sal I для VK. Переключающие олигонуклеотиды являлись следующими. Для VН: Олигонуклеотид 1 (гибрид в сигнальном пептиде): 5' ggg gatatc cacc atg gaa agg cac tgg atc ttt ctc ttc ctg 3' Олигонуклеотид 2 (гибрид в JH1): 5' ggg gctagc tga gga gac ggt gac cgt ggt 3' Для VК: Олигонуклеотид 1 (гибрид в сигнальном пептиде): 5' ggg gatatc cacc atg gt(at) t(tc)c (ta)ca cct cag (at)t(ac) ctt gga ctt 3' Олигонуклеотид 2 (гибрид в VLJ5): 5' agc gtcgac tta cgt ttc agc tcc agc ttg gtc cc 3' Продукты ПЦР VH и VK расщепляли ферментами рестрикции Есо RV-Nhe I для VH и Есо RV-Sal I для VK и клонировали их в соответствующие экспрессирующие векторы, РАН 4604 и PAG4622, для VH иVK, соответственно. Данные векторы применяют для экспрессии иммуноглобулинов в клетках млекопитающих, и они подарены Sherie Morrison (UCLA, California, USA). Вектор PAH4604 содержит констант-6 008353 ную область человеческого IgG1, a PAG4622 - константную область человеческой каппа (Coloma J. et al.,J. Immunol. Methods 152:89-104, 1992). После того, как области VH и VK 14F7 клонировали в предшествующие векторы, формируют конструкции 14F7VH-PAH4604 и 14F7VK-PAG4622. Двенадцать независимых клонов секвенировали посредством дидезоксинуклеотидного способа(Sanger F. et al., DNA sequencing with chain-terminating inhibitors. PNAS USA 1979;74:5463-5470), с применением коммерческого набора для секвенирования с ДНК-полимеразой Т 7 (Amersham-Pharmacia) в соответствии с протоколом, описанным производителем. Последовательности VH и VK обладают высоким родство с подгруппами IIB и V, соответственно (фиг. 1 А и В), в соответствии с классификацией Kabat(Kabat E., Sequences of proteins of inmunological interest, Fifth Edition, National Institute of Health, 1991). Проводили электропорацию клеток NSO с 10 мкг 14F7VH-РАН 4604 и 10 мкг 14F7VK-PAG4622,преобразованными в линейную форму ферментом PvuI. ДНК выделяли с применением этанола, перемешивали и растворяли в 50 мкл PBS (раствор фосфатно-солевого буфера). Приблизительно 107 клеток растили до неполной конфлюэнции и собирали посредством центрифугирования. Затем клетки ресуспендировали в 0,5 мл PBS вместе с ДНК в кювете для электропорации. Клетки выдерживали 10 мин на льду,затем подвергали импульсу 200 В и 960 Ф, после чего помещали в лед на 10 мин. Клетки культивировали в 96-луночном планшете в модифицированной Дульбекко селективной культуральной среде (DMEMF12) с добавлением 10% фетальной телячьей сыворотки (FCS) и 10 мМ L-гистидинола. Трансфицированные клоны становились видимыми через 10 суток после добавления селективной среды. Продукцию химерного иммуноглобулина определяли посредством способа ELISA из супернатанта клонов. Для этого полистироловые планшеты (High binding, Costar) покрывали сывороточным козьим IgG против иммуноглобулинов человека в 100 мМ карбонатно-бикарбонатного буфера, рН 9,8 в течение ночи при 4 С. Затем планшеты отмывали в PBS-Tween (раствор фосфатно-солевого буфера, 0,5% Tween-20, рН 7,5), добавляли и инкубировали в течение часа при 37 С культуру супернатантов образцов, растворенных в PBS-TweenFCS. Планшеты снова отмывали в PBS-Tween, после чего инкубировали с сывороткой, содержащей козью цепь каппа против иммуноглобулинов человека, конъюгированной с пероксидазой (Jackson), в течение часа при 37 С. Далее планшеты отмывали в тех же условиях и инкубировали с раствором цитратно-фосфатного буфера, рН 4,2, содержащего субстрат о-фенилендиамин. Через 15 мин измеряли поглощение при 492 нм. Пример 2. Реактивность антитела 14F7Q против антител NGcGM3 и NAcGM3. Реактивность химерного антитела 14F7 (Аb) определяли посредством конкурентного ELISA. На фиг. 2 показана специфичность химерного 14F7 по сравнению с мышиным 14F7 в распознавании полистироловых планшетов (Polysorp, Nunc), покрытых GM3 N-гликолилированным ганглиозидом. Оба антитела показали сходную концентрацию 50%-ного ингибирования распознавания антигена биотинилированным мышиным Ab 14F7. При покрытии планшетов N-ацетилированным вариантом GM3 или антителами иммунореактивность не отмечали. Мышиное С 5 Mab применяли в качестве несоответствующего Аb. Пример 3. Получение различных вариантов гуманизированного антитела. Последовательности VH и VK сравнивали с базой данных человеческих последовательностей с получением наиболее гомологичной антителу 14F7 человеческой последовательности для областей VH иVK (фиг. 1 А и В). Дополнительно в обеих последовательностях определяли амфипатические области или потенциальные Т-эпитопы. Далее мутации, необходимые для преобразования мышиных последовательностей VH и VK в человеческие последовательности, определяли указанным ниже способом гуманизирования Т-эпитопов. Ниже авторы приводят максимальное количество возможных мутаций, которые можно проводить. В случае области VH мутации вводили в положения 5, 9, 11, 12, 18, 19, 20, 38, 40, 42 и 48, где аминокислоты Q, N, L, А, М, K, М, K, R, D и I заменяли на V, А, V, V, V, R, V, R, A, G и V, соответственно. Эти мутации проводили перекрыванием продуктов ПЦР (Kamman M. et al., Nucleic Acids Research 17:5404-5410, 1989), с применением олигонуклеотидов 1 и 2, и 3 и 4, в первом ПЦР, а результаты перекрывали в другой ПЦР, с применением только олигонуклеотидов 2 и 4. Последовательности применяемых олигонуклеотидов показаны ниже. Олигонуклеотиды для мутаций 5, 9, 11 и 12 тяжелой цепи: Олигонуклеотид 1: 5' gtc саg ctt gtg саg tct ggg gct gaa gtg gta aaa cct ggg 3' Олигонуклеотид 2: 5' ggg gctagc tga gga gac ggt gac cgt ggt 3' Олигонуклеотид 3: 5' ccc agg ttt tac cac ttc agc ccc aga ctg cac aag ctg gac 3' Олигонуклеотид 4: 5' ggg gatatc cacc atg gaa agg cac tgg atc ttt ctc ttc ctg 3' После секвенирования и проверки предшествующих мутаций в положениях 18, 19 и 20 вносили мутации в содержащую их ДНК, где аминокислоты М, К, М заменяли на V, R, V, соответственно. Ниже показаны олигонуклеотиды 1 и 2 и 3 и 4, описанные для указанных мутаций. Перекрывание продуктов ПЦР проводили, как описано выше. Олигонуклеотиды для мутаций 18, 19 и 20 тяжелой цепи: Олигонуклеотид 1: 5' ggg gcc tca gtg agg gtg tcc tgc agg 3' Олигонуклеотид 2: 5' ggg gctagc tga gga gac ggt gac cgt ggt 3' Олигонуклеотид 3: 5' cct gca gga cac cct cac tga ggc ccc 3' Олигонуклеотид 4: 5' ggg gatatc cacc atg gaa agg cac tgg atc ttt ctc ttc ctg 3'-7 008353 Подобным образом после секвенирования и проверки предшествующих мутаций в положениях 38,40 и 42 вводили мутации R, A, G в содержащую их ДНК, заменяя аминокислоты K, R, D, соответственно. Ниже представлены олигонуклеотиды 1 и 2 и 3 и 4, описанные для этих мутаций. Перекрывание продуктов ПЦР выполняли, как описано выше. Олигонуклеотиды для мутаций 38, 40 и 42 тяжелой цепи: Наконец, после проверки посредством сиквенса предшествующих мутаций вводили мутацию в положении 48 в содержащую ее ДНК, замещая аминокислоту I на V. Ниже указаны олигонуклеотиды 1 и 2 и 3 и 4, применяемые для этой мутации. Перекрывание продуктов ПЦР проводили, как описано выше. Олигонуклеотиды для мутации 48 тяжелой цепи: Все эти мутации проверяли посредством определения последовательности. Полученную генетическую конструкцию обозначили 14F7hTVH. В случае тяжелой цепи между VH 14F7 и большинством сходных человеческих VH существуют различные замены аминокислот, которые не проводили, так как эти замены включали в себя аминокислоты из зоны Вернера или ключевые положения в распознавании антигена. Для легкой цепи проводили мутации в положениях 39, 40, 41, 42 и 58, заменяя R, Т, Н, Е, I на К, Р,G, Q, и V, соответственно. Мутации вводили тем же путем, что в тяжелой цепи. Ниже представлены последовательности применяемых олигонуклеотидов. Олигонуклеотиды для мутаций 39, 40, 41, 42 легкой цепи: После подтверждения посредством сиквенса предшествующих мутаций вводили мутацию в положении 58 в содержащую ее ДНК, заменяя аминокислоту I на V. Ниже указаны олигонуклеотиды 1 и 2 и 3 и 4, применяемые для этой мутации. Перекрывание продуктов ПЦР проводили, как описано выше. Олигонуклеотид для мутации 58 легкой цепи: После проведения мутации ее проверяли посредством определения последовательности. Полученную генетическую конструкцию обозначили 14F7hTVK. Гуманизированные области VK и VH клонировали в векторы PAG4622 и РАН 4604 с формированием конструкций 14F7hTVH-PAH4604 и 14F7hTVK-PAG4622, соответственно. Проводили электропорацию клеток NSO в присутствии 10 мкг каждого вектора, несущего гуманизированные вариабельные области, 14F7hTVH-PAH4604 и 14F7hTVK-PAG4622, ранее преобразованные в линейную форму посредством обработки PvuI. Процесс электропорации и детекция клонов, экспрессирующих гуманизированное антитело 14F7hT, являлись идентичными процессу электропорации и детекции клонов, описанному для химерного антитела. Пример 4. Эффект Ab 14F7 на снижение опухолевого роста в модели ангиогенеза in vivo. В качестве модели ангиогенеза in vivo применяли меланомную опухолевую клеточную линию В 16,смешанную с матриксным гелем в качестве индуктора ангиогенеза. Индукцию процессов опухолевого ангиогенеза измеряли с применением подкожной имплантации опухолевой линии (В 16) матриксного геля в срединную брюшную линию самцов мышей C57/BL6. Для этого меланомные клетки В 16 смешивали только с 0,5 мл матриксного геля и 64 Ед/мл гепарина в контрольной группе или в сочетании с другими антителами для введения посредством подкожной инъекции в брюшную область животных. Через 15 суток после введения животных умерщвляли, и гранулы геля экстрагировали вместе с остатками дермы и эпидермиса, и макроскопически оценивали размер опухоли. На фиг. 3 показано, насколько радикально уменьшался размер опухолевой массы опухолей мышей, обработанных 14F7.-8 008353 Для выявления новых сосудов проводили гистопатологический анализ, для чего гели окрашивали гематоксилин/эозином и проводили иммунное окрашивание в присутствии Mab PECAM (эндотелиальный маркер). Фиг. 4 А и В в срезах ткани животных, обработанных 14F7, по сравнению с опухолевыми срезами необработанных животных наблюдали уменьшение количества кровеносных сосудов. Пример 5. Создание библиотек фрагментов антител из гибридомы 14F7 на нитевидных фагах. Матричную РНК выделяли с применением TriPure Isolation Reagent (Boehringer Mannheim, Germany) из 5,0x106 гибридомных клеток 14F7, а комплементарную ДНК синтезировали при помощи коммерческого набора Pro-STAR First Strand RT-PCR reagent kit (Stratagene, USA). Вариабельные области тяжелой и легкой цепей получали из гибридомы, амплифицировали в 26 циклах посредством полимеразной цепной реакции при следующих условиях: 50 с при 94 С, 1 мин при 55 С, 1 мин при 12 С. Для этого применяли все возможные комбинации вырожденных олигонуклеотидов набора (предназначены для гибридизации с широким спектром мышиных вариабельных областей), указанные в приведенной ниже таблице. Олигонуклеотиды, применяемые для амплификации VH и VL. Вырожденные положения указаны в скобках в последовательности олигонуклеотидов. Последовательности рестрикционных областей подчеркнуты. Вариабельные области амплифицированных тяжелых цепей очищали и последовательно обрабатывали рестрикционными ферментами SfiI и ApaLI. Продукты расщепления очищали и связывали с ДНК фагмидного вектора pHG-1m (Heber Biotec S.A., Cuba) (фиг. 5). Полученными в результате генетическими конструкциями посредством электропорации трансформировали бактерии штамма Е. coli TG1. Группа трансформированных бактерий соответствовала неполной библиотеке вариабельных областей тяжелых цепей, полученной из гибридомы 14F7 со средним размером 2,3 х 104 представителей. Плазмидную ДНК неполной библиотеки очищали и последовательно обрабатывали ферментами NotI и SalI. ДНК по отдельности связывали с четырьмя коллекциями вариабельных областей легкой цепи, расщепленных ранее теми же ферментами. Бактерии штамма TG1 трансформировали в присутствии этих новых генетических конструкций и получили четыре независимых библиотеки. Одной из них была мини-библиотека с ограниченным разнообразием содержащихся вариабельных областей обеих тяжелой и легкой цепей, полученных из гибридомы 14F7 с размером 1,6 х 106 представителей. Тремя другими являлись библиотеки с заменой цепей, содержащие разные коллекции вариабельных областей легких цепей, полученных ранее от мышей (изотип каппа) и людей (изотипы каппа и лямбда), и их размер составлял 1,0 х 107, 1,4 х 106 и 1,2 х 106 представителей, соответственно. Пример 6. Выделение клонов, продуцирующих фрагменты антител против N-гликолил GM3. В лунках планшета для микротитрования в соответствии с описанным ранее способом (Marks, J.D.et al., J. Mol. Biol. 222,581-597. 1991) получали фаги, несущие фрагменты антител из 92 случайно взятых клонов из каждой библиотеки. Их специфичность оценивали при помощи ELISA в поливинилхлоридных планшетах (Costar, USA), покрытых N-гликолил GM3 и N-ацетил GM3 в концентрации 1 мкг/мл. Связанные фаги определяли при помощи моноклональных антител против М 13, конъюгированных с пероксидазой (Amersham, Sweden). Кроме характеристики отдельных случайно выбранных клонов проводили отбор фагов со способностью к связыванию N-гликолил GM3 из смеси фагов при помощи группы бактерий, которые соответствовали каждой полученной библиотеке. Для этого получали фаги с применением вспомогательного фага М 13 K07, их очищали посредством преципитации полиэтиленгликолем в соответствии с указанным выше способом и приводили в контакт с N-гликолил GM3, связанным с поверхностью пластика (Inmuno tubes, Nunc, Denmark). Пробирки интенсивно отмывали и фаги элюировали в-9 008353 присутствии 100 мМ/л триэтиламина. Элютат нейтрализовали и применяли для инфицирования бактерий штамма Е. coli TG1. Из группы инфицированных бактерий получали фаги, несущие антитело, и снова очищали, что применяли в качестве исходного материала для нового цикла селекции, в условиях, идентичных описанным. После четырех циклов селекции 92 колонии бактерий инфицировали фагами из каждой случайно взятой библиотеки и проводили распознавание N-гликолил GM3 в условиях, сходных описанным, для определения клонов, случайно взятых из библиотек. После прямого анализа клонов библиотек продуцирующие клоны выделяли из несущих фрагменты антител, распознающих N-гликолил GM3,фагов, которые с переменной частотой находили в трех библиотеках с заменой цепей. Положительных клонов в минибиблиотеке, сформированной только посредством вариабельных областей, полученных из гибридомы 14F7, не обнаружили. После циклов селекции из библиотек с заменой цепей выделили дополнительные клоны, а в минибиблиотеке исходных последовательностей не нашли ни одного. В приведенной ниже таблице указаны количество продуцирующих фрагменты антител клонов, распознающих N-гликолилGM3, и частота, представляющая собой общее количество клонов, проанализированных в каждой библиотеке. Только один клон продуцировал фаги, проявляющие перекрестную реактивность с N-ацетил GM3. Частота положительных клонов Частота положительных клонов Библиотека(четыре цикла селекции) Гибридома 14F7 из мини 0/92 0/92 библиотеки Замена мышиных легких цепей 31/92 (33,70%) 52/92 (56,52%) каппа Замена человеческих легких 2/92 (2,17%) 8/92 (17,39%) цепей каппа Замена человеческих легких 4/92 (4,35%) 12/92 (13,04%) цепей лямбдаОдин клон с перекрестной реактивностью с N-ацетил GM3. Пример 7. Характеристика полученных из 14F7 фрагментов антител, распознающих N-гликолил GM3. Вариабельные области 11 фрагментов антител полностью секвенировали на автоматическом секвенаторе ALF Express II (Pharmacia, Sweden), применяя олигонуклеотиды, гибридизующиеся с областью вектора pHG-1m, фланкированного концевыми 5'- и 3'-последовательностями, кодирующими фрагменты представляющего интерес антитела. Подтвердили, что последовательность вариабельной области всех тяжелых цепей соответствует вариабельной области тяжелой цепи, опубликованной для 14F7, изменения представлены только в каркасных областях 1 и 4, вероятно, внесенные посредством применения вырожденных олигонуклеотидов при ПЦР. Перестановка последовательностей, включающих в себя три CDR,не имела вариаций. Наоборот, все последовательности вариабельных областей легких цепей 11 клонов отличались от вариабельных областей легких цепей 14F7 и были разбиты на 5 групп различающихся последовательностей, две мышиного происхождения, и одна человеческого происхождения (изотип каппа),и две другие человеческого происхождения, но изотипа лямбда. Один клон, представляющий собой каждую группу последовательностей, брали для последующей характеристики. В указанной ниже таблице приведены различия между вариабельными областями легких цепей отобранных клонов по отношению к их исходной идентичности, их происхождению и изотипу и классификация на подгруппы в соответствии с классификацией Kabat. Различия между вариабельными областями легких цепей клонов и вариабельными областями легких цепей, исходно описанными для антитела 14F7, локализованы на всей последовательности, содержащей три определяющие комплементарность области, указанные ниже (фиг. 6).- 11008353 Специфичность связывания подтверждали посредством ELISA в соответствии с описанным способом с применением в качестве покрывающего слоя в дополнение к N-гликолил GM3 и N-ацетил GM3 панели связанных ганглиозидов, включающую в себя различные N-ацетилированные ганглиозиды и один N-гликолилированный ганглиозид. На фиг. 7 показано распознавание различных антигенов 5 клонами, продуцирующими охарактеризованные фрагменты антитела. Обнаружили связывание только с антигеном-мишенью N-гликолил GM3. Продукцию клонами растворимых фрагментов антител (вне контекста фагов) индуцировали в присутствии изопропил-тиогалактопиранозида в концентрации 1 мМ/л. Собирали супернатант и получали периплазматические фракции в соответствии с установленными процедурами (de Haard, H. J. Biol. Chem. 274, 18218-18230, 1999). Распознающую активность N-гликолил GM3 определяли в супернатантах культур и в периплазматических фракциях при помощи ELISA на планшетах, покрытых вышеупомянутым антигеном, сходным с описанным антигеном, но с последующей модификацией. Фрагменты связывающих антител определяли с применением моноклонального антитела 1 Е 10 (направленное против пептида с-mус, слитого с фрагментами антител в генетическую конструкцию) в концентрации 10 мкг/мл и конъюгата иммуноглобулинов против мышиных иммуноглобулинов (Sigma, USA). Фрагменты антител из периплазматических фракций очищали с применением одной аффинной хроматографии с ионами металлов, применяя в качестве матрикса HIS-Select НС Nickel Affinity Gel (Sigma, USA) в соответствии с инструкциями производителя. На фиг. 8 показана активность очищенных растворимых фрагментов, определенная посредством ELISA. Краткое описание фигур Фиг. 1: показана аминокислотная последовательность вариабельных областей VH (а) и VK (b) Mab 14F7 и соответствующая человеческая последовательность с наибольшей степенью гомологии. CDR подчеркнуты, а амфипатические области и потенциальные Т-эпитопы затенены. Также приведена полученная в результате гуманизирования последовательность вариабельных областей с произведенными мутациями. Фиг. 2: распознавание антитела 14F7Q мерили посредством конкурентного ELISA. Ось X: отображены концентрации антител. Ось Y: поглощение, измеренное при 492 нм. В качестве отрицательного контроля применяли моноклональное антитело iorC5. Фиг. 3: эффект моноклонального антитела 14F7 на рост мышиных опухолей (меланомная опухолевая клеточная линия В 16). Фиг. 4: А) иммуногистохимическое исследование эффекта моноклонального антитела 14F7 на формирование кровеносных сосудов, стрелки указывают сосуды с иммунным окрашиванием; В) ингибирование ангиогенеза, индуцированное моноклональным антителом 14F7. Фиг. 5: диаграмма вектора pHG-1m. Фиг. 6: белковая последовательность областей VL моноклонального антитела 14F7 и отобранные одноцепочечные фрагменты Fv. Точки указывают гомологию с последовательностью VL 14F7. Фиг. 7: специфичность распознавания фагами, несущими фрагменты антител. Наблюдали ингибирование связывания Ab 14F7 с ганглиозидом экспонированными на фагах фрагментами. Планшеты покрывали N-гликолил GM3, фаги инкубировали с вирусными частицами и различными концентрациями 14F7. Фиг. 8: распознавание N-гликолил GM3 очищенными растворимыми фрагментами. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Рекомбинантное антитело, полученное из мышиного моноклонального антитела 14F7, продуцируемое гибридомой с инвентарным номером ЕСАСС 98101901, характеризуемое последовательностями гипервариабельных областей (CDR) тяжелой и легкой цепей, приведенных ниже. ТЯЖЕЛАЯ ЦЕПЬCDR3: QQSNRWPLT 2. Антитело по п.1, отличающееся тем, что является химерным вариантом антитела 14F7, содержащим CDR и каркасные области (FR) тяжелой и легкой цепей указанного антитела 14F7, константную область тяжелой цепи человеческого IgG1, константную область Сk человеческой легкой цепи с указанными ниже последовательностями каркасных областей (FR) тяжелой и легкой цепей: ТЯЖЕЛАЯ ЦЕПЬFR4: FGAGTKLELKRA 3. Антитело по пп.1 и 2, отличающееся тем, что является гуманизированным вариантом моноклонального антитела 14F7, содержащим точечные мутации в каркасных областях (FR) тяжелой и легкой цепей для снижения иммуногенности. 4. Антитело по п.3, отличающееся тем, что является гуманизированным вариантом моноклонального антитела 14F7, каркасные области тяжелых и легких цепей которого содержат любые из указанных ниже мутаций: ТЯЖЕЛАЯ ЦЕПЬ: Позиция 5N вместо А Позиция 11 L вместо V Позиция 12 А вместо V Позиция 18 М вместо V Позиция 19 K вместо R Позиция 20 М вместо V Позиция 40 R вместо А Позиция 42 D вместо G ЛЕГКАЯ ЦЕПЬ: Позиция 39 R вместо K Позиция 40 Т вместо Р Позиция 41 Н вместо G Позиция 42 Е вместо Q 5. Одноцепочечный фрагмент Fv, полученный из мышиного моноклонального антитела 14F7, продуцируемого гибридомой с инвентарным номером ЕСАСС 98101901, отличающийся тем, что содержит последовательность вариабельной области тяжелой цепи мышиного моноклонального антитела 14F7 и вариабельную область легкой цепи мышиного антитела. 6. Одноцепочечный фрагмент Fv по п.5, отличающийся тем, что вариабельная область легкой цепи представляет собой само антитело 14F7. 7. Одноцепочечный фрагмент Fv по п.6, отличающийся тем, что последовательности гипервариабельных областей (CDR) тяжелой и легкой цепей представляют собой последовательности, указанные ниже: ТЯЖЕЛАЯ ЦЕПЬCDR3: QQSNRWPLT 8. Одноцепочечный фрагмент Fv по п.7, отличающийся тем, что содержит гипервариабельные области (CDR) и каркасные области (FR) тяжелой и легкой цепей указанного антитела 14F7, последовательности каркасных областей (FR) тяжелой и легкой цепей которого представляют собой указанное ниже: ТЯЖЕЛАЯ ЦЕПЬFR4: FGAGTKLELKRA 9. Одноцепочечный фрагмент Fv по п.8, который содержит точечные мутации каркасных областей(FR) тяжелой и легкой цепей для снижения иммуногенности. 10. Одноцепочечный фрагмент Fv по п.9, каркасные области тяжелой и легкой цепей которого содержат любые из указанных ниже мутаций:N вместо А Позиция 11 L вместо V Позиция 12 А вместо R Позиция 18 М вместо V Позиция 19 K вместо R Позиция 20 М вместо V Позиция 40 R вместо А Позиция 42 D вместо G ЛЕГКАЯ ЦЕПЬ: Позиция 39 R вместо K Позиция 40 Т вместо Р Позиция 41 Н вместо G Позиция 42 Е вместо Q 11. Одноцепочечный фрагмент Fv по п.5, полученный из мышиного моноклонального антитела 14F7, продуцируемого гибридомой с инвентарным номером ЕСАСС 98101901, отличающийся тем, что содержит последовательность вариабельной области тяжелой цепи моноклонального антитела 14F7 и вариабельную область легкой цепи, последовательность которых представляют собой указанное ниже: 12. Одноцепочечный фрагмент Fv по п.5, полученный из мышиного моноклонального антитела 14F7, продуцируемого гибридомой с инвентарным номером ЕСАСС 98101901, отличающийся тем, что содержит последовательность вариабельной области тяжелой цепи мышиного моноклонального антитела 14F7 и вариабельную область легкой цепи, последовательности которых представляют собой указанное ниже: 13. Одноцепочечный фрагмент Fv, полученный из мышиного моноклонального антитела 14F7, продуцируемого гибридомой с инвентарным номером ЕСАСС 98101901, отличающийся тем, что содержит последовательность вариабельной области тяжелой цепи мышиного моноклонального антитела 14F7 и вариабельную область легкой цепи антитела человека. 14. Одноцепочечный фрагмент Fv по п.13, отличающийся тем, что содержит последовательность вариабельной области тяжелой цепи мышиного моноклонального антитела 14F7 и вариабельную область легкой цепи, последовательность которого представляет собой указанное ниже: 15. Одноцепочечный фрагмент Fv по п.13, отличающийся тем, что содержит последовательность вариабельной области тяжелой цепи мышиного моноклонального антитела 14F7 и вариабельную область легкой цепи, последовательность которого представляет собой указанное ниже: 16. Одноцепочечный фрагмент Fv по п.13, отличающийся тем, что содержит последовательность вариабельной области тяжелой цепи мышиного моноклонального антитела 14F7 и вариабельную область легкой цепи, последовательность которого представляет собой указанное ниже: 17. Клеточная линия, отличающаяся тем, что экспрессирует рекомбинантное антитело по любому из пп.1-4. 18. Клеточная линия, отличающаяся тем, что экспрессирует одноцепочечный фрагмент Fv по любому из пп.5-16. 19. Фармацевтическая композиция для лечения злокачественных опухолей, отличающаяся тем, что содержит рекомбинантное антитело по любому из пп.1-4. 20. Фармацевтическая композиция для лечения злокачественных опухолей, отличающаяся тем, что содержит одноцепочечный фрагмент Fv по любому из пп.5-16 и соответствующий наполнитель. 21. Применение фармацевтической композиции по п.19 для лечения злокачественных опухолей мо- 16008353 лочной железы, и меланом, и их метастазов и рецидивов. 22. Применение фармацевтической композиции по п.20 для лечения злокачественных опухолей молочной железы, и меланом, и их метастазов и рецидивов. 23. Реагент для определения локализации и идентификации in vivo злокачественных опухолей, отличающийся тем, что содержит рекомбинантное антитело по любому из пп.1-4 и соответствующий маркер. 24. Реагент по п.23, отличающийся тем, что может использоваться для определения локализации и идентификации in vivo злокачественных опухолей молочной железы, и меланом, и их метастазов и рецидивов. 25. Реагент для определения локализации и идентификации in vivo злокачественных опухолей, отличающийся тем, что содержит одноцепочечный фрагмент Fv по любому из пп.5-16 и соответствующий маркер. 26. Реагент по п.25, отличающийся тем, что может использоваться для определения локализации и идентификации in vivo злокачественных опухолей молочной железы, и меланом, и их метастазов и рецидивов.
МПК / Метки
МПК: C07K 16/46, A61K 39/395
Метки: ганглиозид, фрагменты, лечении, узнающие, злокачественных, опухолей, рекомбинантные, n-гликолил, диагностике, антитела, применение
Код ссылки
<a href="https://eas.patents.su/30-8353-rekombinantnye-antitela-i-fragmenty-uznayushhie-n-glikolil-gm3-gangliozid-i-ih-primenenie-v-diagnostike-i-lechenii-zlokachestvennyh-opuholejj.html" rel="bookmark" title="База патентов Евразийского Союза">Рекомбинантные антитела и фрагменты, узнающие n-гликолил gm3 ганглиозид и их применение в диагностике и лечении злокачественных опухолей</a>












