Замещенные имидазопиримидины для предупреждения и лечения рака
Номер патента: 9038
Опубликовано: 26.10.2007
Авторы: Фарреронс Гальеми Карлес, Фернандес Серрат Анна, Сальседо Рока Каролина, Катена Руис Хуан Лоренсо, Серра Комас Кармен, Фернандес Гарсия Андрес, Бальса Лопес Долорс, Лагунас Арналь Кармен
Формула / Реферат
1. Соединение общей формулы (I)
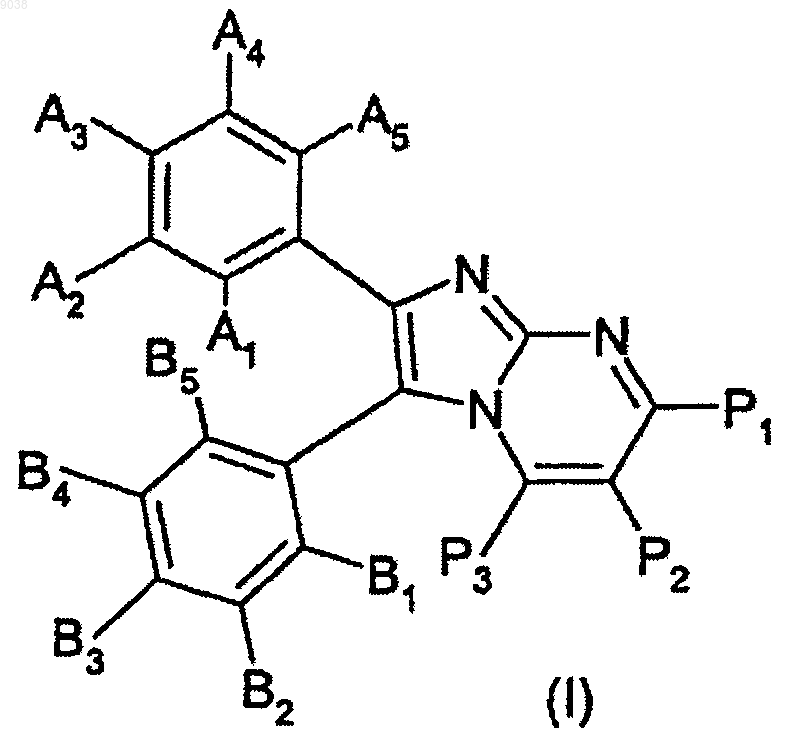
его стереоизомеры и их смеси, его полиморфы и их смеси, и всех их фармацевтически приемлемые сольваты и аддитивные соли,
где А1, А2, A3, А4, А5, В1, В2, B3, В4 и В5 означают радикалы, независимо выбираемые из группы, состоящей из Н, (С1-С4)алкила, (С3-С7)циклоалкила, CF3, OCF3, CN, (CH2)nOR1, (CH2)nNR1R2, CONR1R2, F, Cl, Br, I, NR1R2, NR2COR1, OR1, COR1, COOR1, COSR1, OCOR1, SR1, SOR1, S(O)OH, SO2R1, SO2NR2R3, SO2NHCOR1 и SCOR1, где
n означает целое число от 1 до 3;
R1 означает радикал, выбираемый из группы, состоящей из Н, CH2OCOR2, CF3, (С1-С4)алкила, (С3-С7)циклоалкилметила и (С3-С7)циклоалкила;
R2 означает радикал, выбираемый из Н и (С1-С4)алкила;
R3 означает радикал, выбираемый из COR1 и SO2R1;
альтернативно А2, A3, В2 или B3 могут означать NO2;
альтернативно, или А2 и A3, или В2 и B3 могут образовывать R4-(С1-С3)алкил-R5-бирадикал,
где R4 и R5 неависимо выбирают из CR1R2, О, NR1, S; и
P1, P2 и P3 означают радикалы, независимо выбираемые из группы, состоящей из Н, NR1R2, NR2COR1, CF3, F, Cl, Br, ОН, SH, (С1-С4)алкила, (С1-С4)алкоксила и (С1-С4)алкилсульфанила;
при условии, что формула (I) не удовлетворяет никакому из следующих случаев:
одновременно, B3 означает SO2NH2 или SO2CH3; A3, А4 или А5 означают Н, F, Cl, Br, (C1-C3)алкил, CF3, (С1-С3)алкоксил или OCF3, и Р1 или Р2 означает Н, СН3, Cl, Br или CH3O;
одновременно B3 означает CH3O или Н, A3 означает CH3O или Н, и P1, P2 и P3 означают Н;
одновременно B3 означает F, A3 означает SO2CH3 и Р1 означает метил;
одновременно А1, А2, A3, А4, А5, В1, В2, B3, В4, В5 означают Н, Р1 означает метил, Р2 означает Н и P3 означает ОН;
одновременно A3 и B3 означают CH3O; А1, А2, А4, А5, В1, В2, В4 и В5 означают Н, и одна из групп P1, P2 или P3 означает Н, ОН, (С1-С4)алкил или (С1-С4)алкоксил, причем остальные две группы P1, P2 или P3 означают Н; или
одновременно A3 и B3 означают CH3O; А1, А2, А4, А5, В1, В2, В4 и В5 означают Н, Р1 означает ОН или (С1-С4)алкоксил, Р2 означает Н и P3 означает (С1-С4)алкил.
2. Соединение по п.1, где A3 и B3 означают радикалы, выбираемые из группы, состоящей из Н, (С1-С4)алкила или (С3-С7)циклоалкила, CF3, OCF3, CN, CONR1R2, F, Cl, Br, I, NR1R2, NR2COR1, OR1, COR1, COOR1, COSR1, OCOR1, SR1, SOR1 и SCOR1.
3. Соединение по п.2, где B3 означает радикал, выбираемый из SR1 и SOR1.
4. Соединение по п.1, выбираемое из группы, состоящей из
2-(4-метоксифенил)-3-(4-метилсульфанилфенил)имидазо[1,2-а]пиримидина;
2-(4-бромфенил)-3-(4-метилсульфанилфенил)имидазо[1,2-а]пиримидина;
2-(4-метоксифенил)-7-метил-3-(4-метилсульфанилфенил)имидазо[1,2-а]пиримидина;
2-(4-метансульфонилфенил)-7-метил-3-п-толилимидазо[1,2-а]пиримидина;
3-(3-хлор-4-метилсульфанилфенил)-2-(4-метилсульфанилфенил)имидазо[1,2-а]пиримидина;
3-(3-метил-4-метилсульфанилфенил)-2-(4-метилсульфанилфенил)имидазо[1,2-а]пиримидина;
3-(3-хлор-4-метилсульфанилфенил)-2-(4-метоксифенил)имидазо[1,2-а]пиримидина;
3-(3-хлор-4-метилсульфанилфенил)-2-(4-метоксифенил)-7-метилимидазо[1,2-а]пиримидина;
3-(3-бром-4-метилсульфанилфенил)-2-м-толилимидазо[1,2-а]пиримидина;
3-(3-бром-4-метилсульфанилфенил)-2-(4-хлорфенил)имидазо[1,2-а]пиримидина;
2-(4-метоксифенил)-3-(3-метил-4-метилсульфанилфенил)имидазо[1,2-а]пиримидина;
3-(3-хлор-4-пропилсульфанилфенил)-2-(4-метоксифенил)имидазо[1,2-а]пиримидина;
3-(4-изопропилсульфанилфенил)-2-(4-метоксифенил)имидазо[1,2-а]пиримидина;
3-(3-хлор-4-изопропилсульфанилфенил)-2-п-толилимидазо[1,2-а]пиримидина;
3-(3-хлор-4-изопропилсульфанилфенил)-2-(4-метилсульфанилфенил)имидазо[1,2-а]пиримидина и
3-(3-хлор-4-метансульфинилфенил)-2-(4-метоксифенил)имидазо[1,2-а]пиримидина.
5. Фармацевтическая композиция, содержащая в качестве активного ингредиента терапевтически эффективное количество соединения по любому из пп.1-4 вместе с подходящими количествами фармацевтически приемлемых эксципиентов.
6. Применение соединения по любому из пп.1-4 для получения лекарственного средства для химиопрофилактики и/или лечения предракового поражения.
7. Применение по п.6, где предраковым поражением является наследственный аденоматозный полипоз или актиничный кератоз.
8. Применение соединения по любому из пп.1-4 для получения лекарственного средства для химиопрофилактики и/или лечения рака.
9. Применение по п.8, где рак представляет собой колоректальный рак, рак простаты, рак молочной железы, рак мочевого пузыря или рак кожи.
10. Применение по любому из пп.6-9, где лекарственное средство вводят перорально, парентерально или локально.
11. Способ профилактического и/или радикального лечения животного, включая человека, страдающего от предракового поражения, включающий введение терапевтически эффективного количества соединения по любому из пп.1-4 вместе с подходящими количествами фармацевтически приемлемых эксципиентов.
12. Способ профилактического и/или радикального лечения животного, включая человека, страдающего от рака, включающий введение терапевтически эффективного количества соединения по любому из пп.1-4 вместе с подходящими количествами фармацевтически приемлемых эксципиентов.
Текст
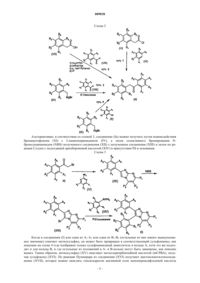
009038 Настоящее изобретение относится к новым соединениям и к их применению для химиопрофилактики и лечения как предраковых поражений (например, наследственный аденоматозный полипоз (FAP) и актиничный кератоз (АК, так и рака (например, колоректальный рак, рак простаты, рак молочной железы, рак мочевого пузыря или рак кожи). Предшествующий уровень техники Колоректальный рак (CRC) является одним из наиболее распространенных в мире видов рака с общей смертностью, превышающей 40%. Около 15% пациентов с CRC имеют семейную историю болезни. Наследственный CRC, как правило, развивается из двух синдромов: наследственного аденоматозного полипоза (FAP) и наследственного неполипозного колоректального рака (HNPCC). FAP вызывается мутациями зародышевой линии в опухолевом супрессорном гене кишечного аденоматозного полипоза(АРС) и характеризуется ранним развитием полиаденом в толстой кишке. Если не удалить эти поражения, они могут развиться в карциномы. Считают, что приблизительно 90% всех случаев и смертей от CRC являются предотвратимыми. Целью химиопрофилактических стратегий является избежание образования аденоматозных полипов и их последующего развития в CRC. Химиопрофилактические агенты могут действовать на различных уровнях путем усиления апоптоза, сокращения клеточной пролиферации и/или уменьшения ДНКповреждения, вызванного канцерогеном. Для предупреждения CRC исследовано некоторое количество фармакологических агентов, включая нестероидные противовоспалительные лекарственные средства(NSAID) и циклооксигеназа (СОХ)-2-селективные ингибиторы. Ингибирование СОХ-2-ферментативной активности составляет часть предупредительного воздействия этих соединений (происходит сверхэкспрессия СОХ-2 в опухолевых клетках), хотя также описаны СОХ-2-независимые механизмы (Hsu A.L., J.Biol. Chem., 2000, 275, 11397-403). Некоторые производные NSAID, которые не ингибируют СОХ, сохраняют свою химиопрофилактическую активность в предраковых и раковых процессах, таким образом действуя через механизм, независимый от ингибирования СОХ (Piazza G.A., Cancer Res., 1997, 57, 290915). Актиничный кератоз (АК) и рак кожи являются все более и более часто встречающимися дерматологическими заболеваниями у населения. Они возникают в регионах с постоянным солнечным облучением, как облучение лица и кистей рук. Хотя точный процент заболеваемости АК неизвестен, 40-50% австралийцев в возрасте более 40 лет подвержены АК, и заболеваемость увеличивается с возрастом. Имеется веское доказательство того, что АК может прогрессировать до сквамозной клеточной карциномы (SCC), фактически, приблизительно 60% SCC возникает из ранее существующего АК. Заболеваемость раком кожи увеличивается вследствие многих факторов, включая вероятность большей продолжительности жизни населения и усиление внешнего ультрафиолетового излучения. Ультрафиолетовый свет индуцирует молекулярные сигнальные проводящие пути и в результате происходят характерные генетические изменения (то есть, мутация р 53), которые, вероятно, являются критическими для развития рака кожи. При этом показано, что целекоксиб, ингибитор СОХ-2, уменьшает развитие мышиных кожных опухолей, вызванных УФ-излучением, несмотря на то, что точный механизм его действия полностью не выяснен. Кроме того, последние сообщения о дефицитных по циклооксигеназе фибробластах подтверждают, что некоторые из антипролиферативных и противоопухолевых эффектов NSAIDs не зависят от ингибирования или СОХ-1 или СОХ-2 (Zhang X., J. Exp. Med., 1999, 190, 451-459). Создание безопасных и эффективных NSAIDs для химиопрофилактики осложнено тем фактом, что сильная токсичность может противодействовать благоприятным воздействиям лечения с помощью этих лекарственных средств, вводимых здоровым индивидуумам, которые обладают низкой вероятностью развития заболевания. Кроме того, возрастает беспокойство вследствие риска опасных желудочнокишечных реакций, сердечно-сосудистой безопасности и возможных опасных кожных реакций и аллергических реакций, связанных с применением ингибиторов СОХ-2, которое в настоящее время ограничивает их клиническое применение для предупреждения и/или лечения предраковых поражений и рака. Таким образом, является существенным разработка новых, менее токсичных и более эффективных терапевтических агентов для этих патологий. Среди многих предложенных антипролиферативных соединений имеются некоторые, которые структурно подобны таковым, согласно настоящему изобретению, такие как соединения следующей формулы, описанные в документе WO 99/51590 и патенте США под номером 5700826, которые до сих пор находятся на стадии разработки. В WO 00/08024 раскрываются некоторые соединения, которые структурно подобны таковым, согласно настоящему изобретению. Такие соединения являются селективными ингибиторами СОХ-2 и, как таковые, пригодны для лечения воспаления и рака. По вышеупомянутым причинам необходимо получение новых соединений для химиопрофилактики и лечения как предраковых поражений, так и рака. Краткое изложение сущности изобретения Соединения согласно настоящему изобретению ингибируют пролиферацию и индуцируют апоптоз в линиях раковых клеток через СОХ-2-независимый путь, таким образом минимизируя токсичность, связанную с ингибированием СОХ-2. Настоящее изобретение относится к соединению общей формулы (I) где А 1, А 2, A3, А 4, А 5, B1, B2, В 3, В 4 и В 5 означают радикалы, независимо выбираемые из группы, состоящей из Н, (С 1-С 4)алкила, (С 3-С 7)циклоалкила, CF3, OCF3, CN, (CH2)nOR1, (CH2)nNR1R2, CONR1R2,F, Cl, Br, I, NR1R2, NR2COR1, OR1, COR1, COOR1, COSR1, OCOR1, SR1, SOR1, S(O)OH, SO2R1,SO2NR2R3, SO2NHCOR1 и SCOR1; где n означает целое число от 1 до 3;R3 означает радикал, выбираемый из COR1 и SO2R1; альтернативно, А 2, A3, В 2 или В 3 могут означать NO2; альтернативно, или А 2 и A3, или В 2 и В 3 могут образовывать R4-(С 1-С 3)алкил-R5-бирадикал,где R4 и R5 независимо выбирают из CR1R2, О, NR1, S; P1, P2 и Р 3 означают радикалы, независимо выбираемые из группы, состоящей из Н, NR1R2, NR2COR1, CF3, F, Cl, Br, ОН, SH, (C1-C4)алкила, (С 1 С 4)алкоксила и (С 1-С 4)алкилсульфанила. В некоторых документах предшествующего уровня техники (см. WO 00/08024; патент США под номером 3455924; JP 01/43978; Almansa С. и др., J. Med. Chem., 2001, 44, 350-361; Bell S.C. и др., J. Amer.(I), удовлетворяющие какому-либо из следующих случаев, исключаются из объема настоящего изобретения: одновременно, В 3 означает SO2NH2 или SO2CH3; A3, А 4 или А 5 означают Н, F, Cl, Br, (C1-C3)алкил,CF3, (С 1-С 3)алкоксил или OCF3, и Р 1 или Р 2 означает Н, СН 3, Cl, Br или CH3O; или, одновременно, В 3 означает CH3O или Н, A3 означает CH3O или Н, и P1, P2 и Р 3 означают Н; или, одновременно, В 3 означаетF, A3 означает SO2CH3, и Р 1 означает метил; или, одновременно, A1, A2, A3, А 4, А 5, В 1, В 2, В 3, В 4, В 5 означают Н, Р 1 означает метил, Р 2 означает Н и Р 3 означает ОН; или, одновременно, A3 и В 3 означают CH3O; А 1, А 2, А 4, А 5, В 1, В 2, В 4 и В 5 означают Н, и одна из групп Р 1, Р 2 или Р 3 означает Н, ОН, (С 1-С 4)алкил или(С 1-С 4)алкоксил, причем остальные две группы P1, P2 или Р 3 означают Н; или, одновременно, A3 и В 3 означают CH3O; А 1, А 2, А 4, А 5, В 1, В 2, В 4 и В 5 означают Н, Р 1 означает ОН или (С 1-С 4)алкоксил, Р 2 означает Н и Р 3 означает (С 1-С 4)алкил. В отдельном воплощении этого аспекта согласно данному изобретению, в соединениях формулы (I)A3 и В 3 означают радикалы, выбираемые из группы, состоящей из Н, (С 1-С 4)алкила, (С 3-С 7)циклоалкила,CF3, OCF3, CN, CONR1R2, F, Cl, Br, I, NR1R2, NR2COR1, OR1, COR1, COOR1, COSR1, OCOR1, SR1,SOR1 и SCOR1. В другом отдельном воплощении, В 3 означает радикал, выбираемый из SR1 и SOR1. Предпочтительные соединения согласно настоящему изобретению включают: 2-(4-метоксифенил)-3-(4-метилсульфанилфенил)имидазо[1,2-а]пиримидин; 2-(4-бромфенил)-3-(4-метилсульфанилфенил)имидазо[1,2-а]пиримидин; 2-(4-метоксифенил)-7-метил-3-(4-метилсульфанилфенил)имидазо[1,2-а]пиримидин; 2-(4-метансульфонилфенил)-7-метил-3-п-толилимидазо[1,2-а]пиримидин; 3-(3-хлор-4-метилсульфанилфенил)-2-(4-метилсульфанилфенил)имидазо[1,2-а]пиримидин; 3-(3-хлор-4-метилсульфанилфенил)-2-(4-метоксифенил)имидазо[1,2-а]пиримидин; 3-(3-метил-4-метилсульфанилфенил)-2-(4-метилсульфанилфенил)имидазо[1,2-а]пиримидин; 3-(3-хлор-4-метилсульфанилфенил)-2-(4-метоксифенил)-7-метилимидазо[1,2-а]пиримидин; 3-(3-бром-4-метилсульфанилфенил)-2-м-толилимидазо[1,2-а]пиримидин; 3-(3-бром-4-метилсульфанилфенил)-2-(4-хлорфенил)имидазо[1,2-а]пиримидин; 2-(4-метоксифенил)-3-(3-метил-4-метилсульфанилфенил)имидазо[1,2-а]пиримидин; 3-(3-хлор-4-пропилсульфанилфенил)-2-(4-метоксифенил)имидазо[1,2-а]пиримидин; 3-(4-изопропилсульфанилфенил)-2-(4-метоксифенил)имидазо[1,2-а]пиримидин; 3-(3-хлор-4-изопропилсульфанилфенил)-2-п-толилимидазо[1,2-а]пиримидин; 3-(3-хлор-4-изопропилсульфанилфенил)-2-(4-метилсульфанилфенил)имидазо[1,2-а]пиримидин; и 3-(3-хлор-4-метансульфинилфенил)-2-(4-метоксифенил)имидазо[1,2-а]пиримидин. Некоторые из соединений формулы (I) согласно настоящему изобретению могут иметь один или более хиральных центров. Настоящее изобретение включает каждый из возможных стереоизомеров и их смеси, особенно их рацемические смеси. Отдельный энантиомер можно получать любым из обычно используемых способов, например, путем хроматографического разделения рацемической смеси на стационарной хиральной фазе, путем разделения рацемической смеси с помощью методик фракционированной кристаллизации диастереомерных солей, путем хирального синтеза, путем ферментативного разделения или путем биотрансформации. Фармацевтически приемлемые соли включают, среди прочих, аддитивные соли неорганических кислот, таких как хлористо-водородная кислота, бромисто-водородная кислота, азотная кислота, серная-3 009038 кислота и фосфорная кислота, а также аддитивные соли органических кислот, таких как уксусная кислота, бензолсульфоновая кислота, бензойная кислота, камфорсульфоновая кислота, миндальная кислота,метансульфоновая кислота, щавелевая кислота, янтарная кислота, фумаровая кислота, винная кислота и малеиновая кислота. Более того, кислый протон в соединениях формулы (I) можно замещать ионом металла, например, ионом щелочного металла, ионом щелочно-земельного металла или ионом алюминия; или можно координировать с органическим или неорганическим основанием. Приемлемое органическое основание включает диэтиламин и триэтиламин. Приемлемое неорганическое основание включает гидроксид алюминия, гидроксид кальция, гидроксид калия, карбонат натрия и гидроксид натрия. Может иметься более чем один катион или анион, в зависимости от числа групп с зарядом и валентности катионов и анионов. Некоторые из соединений формулы (I) согласно настоящему изобретению могут существовать в несольватированных, а также в сольватированных формах, таких как, например, гидраты. Настоящее изобретение охватывает все такие вышеупомянутые формы, которые являются фармацевтически активными. Некоторые из соединений общей формулы (I) могут проявлять полиморфизм, причем настоящее изобретение охватывает все возможные полиморфные формы и их смеси. Соединения согласно настоящему изобретению можно синтезировать, используя методики, описанные ниже, а также другие способы, известные в области органического синтеза. Предпочтительные методики включают, но не ограничиваясь этим, общие способы, показанные на приложенных схемах. В соответствии со схемой 1, -бромдезоксибензоин (III) можно получать путем бромирования дезоксибензоина (II), используя Br2/HBr/АсОН, Br2/ССl4 или CuBr2 в этилацетате (EtOAc). Взаимодействие соединения (III) с 2-аминопиримидином (IV) в присутствии основания, такого как карбонат калия, или в избытке аминопиримидина, дает смесь соединений (Iа) и (Ib). Схема 1 Как показано на схеме 2, исходный дезоксибензоин (II) можно получать по меньшей мере одним из четырех различных путей: путь 1 заключается во взаимодействии ароматического субстрата (VI) с замещенным фенацетилхлоридом (V) по реакции Фриделя-Крафтса; путь 2 заключается в конденсации бензальдегида (VIII) с производным фенилуксусной кислоты(VII) по методу Перкина с получением 2,3-дифенилакриловой кислоты, с последующей перегруппировкой Курциуса и последующей гидролитической обработкой; путь 3 заключается в присоединении бензилмагнийбромида (IX) к бензальдегиду (VIII) и последующем окислении полученного соединения; путь 4 заключается в присоединении бензонитрила (X) к бензилмагнийбромиду (IX). Альтернативно, в соответствии со схемой 3, соединение (Iа) можно получать путем взаимодействия бромацетофенона (XI) с 2-аминопиримидином (IV), а затем селективного бромирования Nбромсукцинимидом (NBS) полученного соединения (XII) с получением соединения (XIII) и затем по реакции Сузуки с подходящей арилбороновой кислотой (XIV) в присутствии Pd и основания. Схема 3 Когда в соединении (I) или один из А 1-А 5 или один из В 1-В 5 (остальные из них имеют вышеуказанное значение) означает метилсульфид, он может быть превращен в соответствующий сульфонамид, как показано на схеме 4 (где изображен только сульфонамидный заместитель в кольце А, хотя это же подходит и для кольца В, и где остальные из положений в А- и В-кольце могут быть замещены, как описано выше). Таким образом, метилсульфид (XV) окисляют метахлорпербензойной кислотой (mСРВА), получая сульфоксид (XVI). По реакции Пуммерера из соединения (XVI) получают ацетоксиметилтиосоединение (XVII), которое можно окислять гексагидратом магниевой соли монопероксифталевой кислоты(ММРР) с получением соединения (XVIII). Обработка соединения (XVIII) с помощью NaOH (1 н) в МеОН приводит к получению сульфината (XIX). Сначала проводят обработку сульфурилхлоридом в дихлорметане (DCM), а затем - водным раствором гидроксида аммония в тетрагидрофуране (ТГФ) с получением сульфонамида (XX). Соединение (XVIII) также можно превращать в сульфонамид (XX) путем обработки с помощью В целях простоты, возможные заместители в А- и В-кольце на схеме 4, приведенной выше, не показаны. Альтернативно, сульфонамид (XX) можно получать, исходя из сульфоксида (XVI) путем последующих взаимодействий с:N-Ацетилирование сульфамоильной группы в соединении (XX) уксусным ангидридом в присутствии триэтиламина приводит к получению его соответствующего ацетильного производного (XXI). С другой стороны, соединение (XX), где В 3 означает сульфонамид, также можно получать, исходя из соединения (II), где B3 означает Н, путем хлорсульфирования и последующего аминирования. Как показано на схеме 5, некоторые замещения в пиримидиновом кольце (то есть, P1, P2 и P3), можно получать путем обработки гидроксиимидазопиримидина (XXII) оксихлоридом фосфора с получением хлорпроизводного (XXIII), которое затем можно вводить во взаимодействие или с тиомочевиной, с получением соответствующего меркаптана (XXIV), или со спиртом или амином, с получением соответствующего простого эфира (XXV) или аминопроизводного (XXVI), соответственно. Схема 5-6 009038 Соединения согласно настоящему изобретению могут индуцировать апоптоз раковых и/или предраковых клеток. Таким образом, один аспект согласно настоящему изобретению относится к применению вышеуказанных соединений для получения лекарственного средства для химиопрофилактики и лечения как предракового поражения (такого как, наследственный аденоматозный полипоз и актиничные кератозы), так и рака (особенно, колоректальный рак, рак простаты, рак молочной железы, рак мочевого пузыря или рак кожи). Следовательно, этот аспект согласно данному изобретению относится к способу профилактического и/или радикального лечения животного, включая человека, страдающего от вышеупомянутых патологий, который включает введение терапевтически эффективного количества соединения формулы (I). Другой аспект согласно данному изобретению относится к фармацевтическим композициям, содержащим терапевтически эффективное количество соединения формулы (I) в качестве активного ингредиента, вместе с подходящими количествами фармацевтически приемлемых эксципиентов. Предпочтительно соединение вводят перорально, парентерально или локально. На протяжении всего описания и формулы изобретения подразумевают, что термин содержать и его вариации, такие как содержащий, не исключает другие добавки, компоненты, элементы или стадии. Раскрытия в виде краткого изложения содержания, сопровождающего данную заявку, и в виде указания заявки, приоритет которой заявлен, включены в данный контекст посредством ссылки. На протяжении всего описания и формулы изобретения термины алкил и алкоксил нужно понимать как прямой или разветвленный. Дополнительные аспекты, преимущества и признаки новизны согласно данному изобретению будут установлены, далее, частично из данного описания и частично станут очевидными специалисту в данной области после рассмотрения данного описания или могут быть выяснены путем применения данного изобретения. Настоящее изобретение будет в дальнейшем проиллюстрировано следующими примерами. Эти примеры приведены только в целях иллюстрации и не могут быть истолкованы в качестве ограничивающих объем изобретения. Примеры Структура различных соединений согласно настоящему изобретению подтверждена или с помощью 1 Н-ЯМР (в CDCl3, если не указано иначе, и при использовании прибора VARIAN UNITY на 300 МГц, где химические сдвиги выражены в м.д.от внутреннего стандарта тетраметилсилана (TMS или путем масс-спектрометрии, получая молекулярные ионы ионизацией пробы электронным распылением на приборе Agilent 1100 VL. Все реакции при облучении микроволнами проводят в толстостенных трубках из стекла марки пирекс. Микроволновый нагрев осуществляют с помощью резонатора одиночной модыDiscover Microwave Synthesizer (корпорация СЕМ). Используемая в настоящем документе номенклатура основана на программном обеспечении AUTONOM (Automatic Nomenclature) института Beilstein, с использованием систематической номенклатуры IUPAC. Следующие примеры приведены только в целях иллюстрации и не могут быть истолкованы в качестве ограничивающих объем изобретения. Общие методики бромирования дезоксибензоинаa) К смеси производного дезоксибензоина (50 ммоль) в хлороформе (210 мл) и ССl4 (826 мл) по каплям добавляют бром (50 ммоль), растворенный в CCl4. Когда заканчивается обесцвечивание, органический слой промывают 5% раствором бикарбоната натрия и насыщенным солевым раствором. Затем его сушат над безводным сульфатом натрия и растворитель выпаривают с получением представляющего интерес -бромдезоксибензоина.b) К раствору производного дезоксибензоина (50 ммоль) в EtOAc (210 мл) добавляют бромид меди(II) (24, 5 г, 110 ммоль) и затем смесь перемешивают при 60 С в течение 3 ч. Реакционную смесь оставляют охлаждаться и отфильтровывают через целит, и растворитель выпаривают с получением представляющего интерес -бромдезоксибензоина. Общая методика получения производных 2-фенилимидазо[1,2-а]-пиримидина К раствору производного бромацетофенона (7,37 ммоль) в диметилформамиде (ДМФА, 75 мл) добавляют производное 2-аминопиримидина (18,4 ммоль). Смесь перемешивают при 70 С в течение 12 ч. Затем ее оставляют охлаждаться и разбавляют EtOAc. Раствор промывают сначала 5% раствором бикарбоната натрия, а затем водой, сушат над безводным сульфатом натрия и выпаривают досуха. Полученный остаток очищают с помощью колоночной хроматографии на силикагеле (флэш-хроматография). Общая методика получения 3-бром-2-фенилимидазо[1,2-а]пиримидинов К суспензии производного 2-фенилимидазо[1,2-а]пиримидина (4,60 ммоль) в ацетонитриле (50 мл) добавляют NBS (750 мг, 4,20 ммоль) одной порцией при 0 С. Полученный раствор перемешивают при той же температуре в течение 1 ч, после чего реакционную смесь концентрируют при пониженном давлении. Полученный остаток очищают с помощью колоночной хроматографии на силикагеле: (флэшхроматография). Примеры 1 и 2. 2-(4-этоксифенил)-3-(4-метилсульфанилфенил)имидазо[1,2-а]пиримидин и 3-(4 этоксифенил)-2-(4-метилсульфанилфенил)имидазо[1,2-а]пиримидин, соответственно К раствору 1,1 г (2,9 ммоль) 2-бром-2-(4-этоксифенил)-1-(4-метилсульфанилфенил) этанона в 30 мл ДМФА добавляют 0,7 г (7,4 ммоль) 2-аминопиримидина. Смесь нагревают при 70 С с перемешиванием в-7 009038 течение 12 ч. Затем оставляют охлаждаться и разбавляют EtOAc. Раствор сначала промывают 5% раствором бикарбоната натрия, а затем водой, сушат над безводным сульфатом натрия и выпаривают досуха. Полученный остаток очищают с помощью колоночной хроматографии на силикагеле (флэшхроматография), используя EtOAc в качестве элюента, с получением 300 мг соединения примера 1 и 70 мг соединения примера 2. Пример 3. 2-(4-метоксифенил)-5,7-диметил-3-(4-метилсульфанилфенил)имидазо[1,2-а]пиримидин К раствору 750 мг 2-бром-1-(4-метоксифенил)-2-(4-метилсульфанилфенил)этанона (2,1 ммоль) в 21 мл ацетонитрила добавляют 660 мг (5,3 ммоль) 2-амино-4,6-диметилпиримидина. Реакционную смесь кипятят с обратным холодильником при перемешивании в течение 72 ч, затем оставляют охлаждаться и разбавляют EtOAc. Раствор сначала промывают 5% раствором бикарбоната натрия, а затем водой, сушат над безводным сульфатом натрия и выпаривают досуха. Полученный остаток очищают с помощью колоночной хроматографии на силикагеле (флэш-хроматография), используя EtOAc в качестве элюента, с получением 30 мг указанного в заголовке соединения. Пример 4. 3-(4-фторфенил)-2-п-толилимидазо[1,2-а]пиримидин Раствор 150 мг 3-бром-2-п-толилимидазо[1,2-а]пиримидина (0,55 ммоль), 92 мг 4-фторбороновой кислоты (0,66 ммоль), 120 мг Na2CO3 (2,10 ммоль) и 0,5 мг тетракис(трифенилфосфина) (0,005 ммоль) в 2 мл ТГФ и 2 мл воды подвергают облучению микроволнами (60 Вт) при температуре 170 С в течение 20 мин. Давление в закрытом реакционном сосуде составляет 140-150 фунт/кв.дюйм. После облучения раствор разбавляют EtOAc и промывают водой. Органический слой сушат над безводным сульфатом натрия и выпаривают досуха. Полученный остаток очищают с помощью колоночной хроматографии на силикагеле (флэш-хроматография), используя EtOAc:DCM (1:1) в качестве элюента, с получением 100 мг указанного в заголовке соединения. Пример 73. 7-хлор-3-(4-метоксифенил)-2-(4 метилсульфанилфенил)имидазо[1,2-а]пиримидин Раствор 200 мг соединения примера 72 (0,55 ммоль) в 5 мл РОСl3 кипятят с обратным холодильником при перемешивании в течение 3 ч и затем оставляют охлаждаться. Растворитель выпаривают, полученный остаток разбавляют водой, и добавляют аммиак до основного значения рН. Раствор экстрагируют EtOAc и органические экстракты сушат над безводным сульфатом натрия и выпаривают досуха. Полученный остаток очищают с помощью колоночной хроматографии на силикагеле (флэшхроматография), используя EtOAc в качестве элюента, с получением 80 мг указанного в заголовке соединения. Пример 102. 5-метокси-2-(4-метоксифенил)-3-(4-метилсульфанилфенил)имидазо[1,2-а]пиримидин 7-ол К раствору 750 мг (2,1 ммоль) 2-бром-1-(4-метоксифенил)-2-(4-метилсульфанилфенил)этанона в 21 мл ацетонитрила добавляют 826 мг (5,3 ммоль) 2-амино-4,6-диметоксипиримидина. Смесь кипятят с обратным холодильником в течение 72 ч и оставляют охлаждаться. Затем разбавляют EtOAc и добавляют 5%-ный раствор бикарбоната натрия. Органический слой сушат над безводным сульфатом натрия и выпаривают досуха. Полученный остаток очищают с помощью колоночной хроматографии на силикагеле(флэш-хроматография), используя EtOAc в качестве элюента, с получением 40 мг указанного в заголовке соединения. Пример 220. 4-(7-метил-3-фенилимидазо[1,2-а]пиримидин-2-ил)фенилсульфанилметиловый эфир уксусной кислоты К раствору 550 мг соединения примера 166 (1,58 ммоль) в 7 мл уксусного ангидрида добавляют 700 мг ацетата калия (7,12 ммоль). Смесь кипятят с обратным холодильником в течение 10 ч и затем оставляют охлаждаться. Растворитель выпаривают, полученный остаток разбавляют EtOAc и раствор промывают насыщенным раствором NH4Cl и насыщенным солевым раствором. Органический слой сушат над безводным сульфатом натрия и выпаривают досуха с получением 610 мг указанного в заголовке соединения. Пример 221. 4-(7-метил-3-фенилимидазо[1,2-а]пиримидин-2-ил)бензолсульфонилметиловый эфир уксусной кислоты К раствору 610 мг соединения примера 220 (1,56 ммоль) в 20 мл DCM:MeOH (3:1) добавляют 1,06 г ММРР (1,72 ммоль). Смесь перемешивают при комнатной температуре в течение 10 ч. Реакционную смесь нейтрализуют насыщенным раствором бикарбоната (натрия) и растворитель выпаривают. Полученный остаток разбавляют DCM и раствор промывают 5%-ным раствором бикарбоната натрия. Органический слой сушат над безводным сульфатом натрия и выпаривают досуха. Полученный остаток очищают с помощью колоночной хроматографии на силикагеле (флэш-хроматография), используя EtOAc в качестве элюента, с получением 260 мг указанного в заголовке соединения. Пример 216. 4-(7-метил-3-фенилимидазо[1,2-а]пиримидин-2-ил)бензолсульфонамид К раствору 250 мг соединения примера 221 (0,60 ммоль) в 6 мл МеОН добавляют 460 мг ацетата калия (4,74 ммоль). Смесь перемешивают при комнатной температуре в течение 10 мин. Затем добавляют 170 мг карбоната калия (1,18 ммоль) и реакционную смесь перемешивают в течение 1,5 ч. Затем добавляют 270 мг HOSA (2,37 ммоль) и раствор далее перемешивают в течение 2 ч. Растворитель выпаривают и полученный остаток разбавляют EtOAc. Раствор промывают 5%-ным раствором бикарбоната натрия.-8 009038 Органический слой сушат над безводным сульфатом натрия и выпаривают досуха. Полученный остаток промывают МеОН с получением 90 мг указанного в заголовке соединения. Соединения следующих примеров получены с использованием некоторых из вышеописанных методик. Таблица 1
МПК / Метки
МПК: C07D 239/00, C07D 235/00, C07D 487/04, A61P 35/00, A61K 31/505
Метки: лечения, предупреждения, имидазопиримидины, рака, замещенные
Код ссылки
<a href="https://eas.patents.su/30-9038-zameshhennye-imidazopirimidiny-dlya-preduprezhdeniya-i-lecheniya-raka.html" rel="bookmark" title="База патентов Евразийского Союза">Замещенные имидазопиримидины для предупреждения и лечения рака</a>
Предыдущий патент: Молекулы, ингибирующие ангиогенез, и их применение в лечении и диагностике рака
Следующий патент: Фунгицидные смеси для борьбы с фитопатогенными грибами, в частности с патогенами риса
Случайный патент: Установка и способ для удаления твердых частиц из фильтра, предназначенного для отфильтровывания твердых частиц из выхлопных газов двигателя