Электрохимическое восстановление оксидов металлов
Номер патента: 14138
Опубликовано: 29.10.2010
Авторы: Оливарес Рене Игнасио, Мукунтхан Каннапар, Близнюков Сергей Александер, Ратчев Иван, Ригби Грегори Дэвид
Формула / Реферат
1. Способ электрохимического восстановления оксида титана в твердом состоянии в электролизере, который включает в себя анод, катод, расплавленный электролит на основе CaCl2, содержащий СаО, и загружаемый титанооксидный материал в контакте с расплавленным электролитом, причем этот электрохимический способ включает в себя подачу электрического потенциала между анодом и катодом и электрохимическое восстановление загружаемого титанооксидного материала в контакте с расплавленным электролитом и получение восстановленного материала, при этом в способе поддерживают концентрацию СаО в электролите выше нижнего предела концентрации, соответствующего концентрации, необходимой для протекания электрохимического восстановления.
2. Способ по п.1, включающий в себя поддержание концентрации СаО в электролите на уровне или выше минимальной концентрации СаО в 0,005 мас.%.
3. Способ по любому из пп.1-2, включающий в себя поддержание концентрации СаО в электролите на уровне или выше минимальной концентрации СаО в 0,05 мас.%.
4. Способ по любому из пп.1-3, включающий в себя поддержание концентрации СаО в электролите на уровне или выше минимальной концентрации СаО в 0,1 мас.%.
5. Способ по любому из предыдущих пунктов, включающий в себя регулирование концентрации СаО в электролите путем регулирования массового соотношения электролита и оксида титана в электролизере.
6. Способ по п.5, включающий в себя регулирование массового соотношения, составляющего по меньшей мере 10:1.
7. Способ по любому из предыдущих пунктов, включающий в себя регулирование концентрации СаО в электролите путем регулирования массового соотношения электролита и оксида титана в электролизере, составляющего по меньшей мере 10:1 в тех случаях, когда исходная концентрация СаО в электролите составляет менее 0,3, более предпочтительно менее 0,2 мас.%, а оксид титана находится в виде гранул и/или порошков с удельной площадью поверхности от 0,1 до 100 м2/г оксида титана.
8. Способ по любому из пп.1-6, включающий в себя поддержание концентрации СаО в электролите ниже верхнего предела концентрации, соответствующего концентрации, при которой падает выход по току электрохимического восстановления.
9. Способ по п.8, включающий в себя поддержание концентрации СаО в электролите на уровне или ниже максимальной концентрации СаО в 0,5 мас.%.
10. Способ по п.8, включающий в себя поддержание концентрации СаО в электролите на уровне или ниже максимальной концентрации СаО в 0,3 мас.%.
11. Способ по п.1, включающий в себя поддержание концентрации СаО в электролите в диапазоне 0,1-0,3 мас.%.
12. Способ по п.1, включающий в себя поддержание концентрации СаО в электролите в диапазоне 0,15-0,25 мас.%.
13. Способ по любому из предыдущих пунктов, включающий в себя регулирование концентрации СаО в электролите с учетом площади поверхности контакта оксида титана с электролитом.
14. Способ по любому из предыдущих пунктов, включающий в себя регулирование концентрации СаО в электролите с учетом площади поверхности контакта оксида титана с электролитом при рассмотрении в контексте массы электролита и массы оксида титана.
15. Способ по любому из предыдущих пунктов, включающий в себя регулирование концентрации СаО в электролите путем добавления СаО к электролиту в ходе этого способа.
16. Способ по любому из предыдущих пунктов, включающий в себя регулирование концентрации СаО в электролите путем выбора первоначальной концентрации СаО, которая является достаточно высокой.
17. Способ электрохимического восстановления оксида титана в твердом состоянии в электролизере, который включает в себя (а) анод, (b) катод, (с) расплавленный электролит на основе CaCl2, содержащий любой один или более чем один оксид металла, выбранный из группы, включающей оксиды щелочно-земельных металлов, оксиды щелочных металлов и оксиды иттрия и (d) загружаемый титанооксидный материал в контакте с расплавленным электролитом, причем этот электрохимический способ включает в себя подачу электрического потенциала между анодом и катодом и электрохимическое восстановление загружаемого титанооксидного материала в контакте с расплавленным электролитом и получение восстановленного материала, при этом в способе поддерживают концентрацию выбранного оксида металла или оксидов металлов в электролите выше нижнего предела концентрации, соответствующего концентрации, необходимой для протекания электрохимического восстановления.
18. Способ по п.17, включающий в себя поддержание концентрации выбранного оксида металла или оксидов металлов в электролите ниже верхнего предела концентрации, соответствующего концентрации, при которой падает выход по току электрохимического восстановления.
Текст
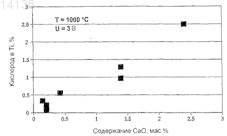
ЭЛЕКТРОХИМИЧЕСКОЕ ВОССТАНОВЛЕНИЕ ОКСИДОВ МЕТАЛЛОВ Раскрыт процесс электрохимического восстановления оксида титана в твердом состоянии в электролизере, который включает в себя анод, катод, расплавленный электролит на основе CaCl2,содержащий СаО, и загружаемый титанооксидный материал в контакте с расплавленным электролитом. Данный процесс характеризуется регулированием процесса путем регулирования концентрации СаО в электролите. Ратчев Иван, Оливарес Рене Игнасио,Близнюков Сергей Александер, Мукунтхан Каннапар, Ригби Грегори Дэвид (AU)(71)(73) Заявитель и патентовладелец: БиЭйчПи БИЛЛИТОН ИННОВЕЙШН ПТИ ЛТД. (AU) 014138 Настоящее изобретение относится к электрохимическому восстановлению оксидов металлов. Настоящее изобретение относится, в частности, но никоим образом не исключительно, к электрохимическому восстановлению оксидов металлов в виде порошков и/или гранул в электролизере, содержащем расплавленный электролит, с получением восстановленного материала, а именно металла, имеющего низкую концентрацию кислорода, обычно не более 0,2 мас.%. Настоящее изобретение касается регулирования электрохимического восстановления оксидов металлов. Настоящее изобретение применимо в тех случаях, когда процесс осуществляют на периодической основе, непрерывной основе и полунепрерывной основе. Настоящее изобретение было сделано в ходе осуществляемого заявителем исследовательского проекта в отношении электрохимического восстановления оксидов металлов. Основной целью этого исследовательского проекта явилось восстановление диоксида титана (TiO2). В ходе данного исследовательского проекта заявитель осуществил серию экспериментов вначале в лабораторном масштабе, а позднее в масштабе опытной установки, исследуя восстановление оксидов металлов в виде диоксида титана в электролизерах, включающих в себя ванну из расплавленного электролита на основе CaCl2, сформированного из графита анода и ряда катодов. Использовавшийся в экспериментах электролит на основе CaCl2 представляет собой коммерчески доступный источник CaCl2, который разлагался при нагревании и давал очень малое количество CaO. Заявитель эксплуатировал электролизеры при потенциале выше потенциала разложения CaO и ниже потенциала разложения CaCl2. В результате лабораторных работ заявитель установил, что при таких потенциалах электролизеры электрохимически восстанавливали диоксид титана до титана с очень низкими концентрациями кислорода, т.е. концентрациями менее 0,2 мас.%. Заявитель эксплуатировал лабораторные электролизеры при широком диапазоне различных рабочих параметров и условий. На начальном этапе лабораторных работ заявитель эксплуатировал лабораторные электролизеры на периодической основе с использованием диоксида титана в виде гранул и более крупных сплошных блоков, а на более позднем этапе этой работы - порошка диоксида титана. Заявитель также эксплуатировал лабораторные электролизеры на периодической основе с использованием оксидов других металлов. Последние проведенные заявителем работы на опытной установке были осуществлены на опытном электролизере, который был вначале настроен на работу на непрерывной основе, а затем - на периодической основе. В ходе этих лабораторных экспериментальных исследований заявитель установил, что концентрация CaO в электролите оказывала существенное влияние на процесс электрохимического восстановления оксидов металлов в лабораторных электролизерах. В частности, заявитель обнаружил, что для оптимизации функционирования процесса концентрацию CaO в электролите следует регулировать путем поддержания этой концентрации выше некоторой минимальной концентрации CaO и ниже некоторой максимальной концентрации CaO. Более конкретно, заявитель обнаружил, что при более высоких концентрациях CaO в электролите имели место более низкие степени восстановления и более низкие выходы по току. Кроме того, заявитель установил, что существовала минимальная концентрация CaO, ниже которой восстановления диоксида титана практически не происходит. Заявитель полагает, что в любом случае нижний предел CaO зависит от раскислителя или других реакций, на которые расходуется CaO. Например, CaO и диоксид титана реагируют спонтанно и образуют перовскит (CaTiO3). Таким образом, в зависимости от количества CaO в электролите и количества диоксида титана, введенного в электролит, количество CaO может существенно понижаться вследствие реакции образования перовскита. Кроме того, металлический кальций реагирует с диоксидом титана и образует титанаты кальция,таким образом создавая другой источник убыли CaO. Помимо того, заявитель установил, что минимальная и максимальная концентрации CaO в любой конкретной ситуации в определенной степени зависят от физических характеристик диоксида титана. Важной физической характеристикой является площадь поверхности диоксида титана в контакте с электролитом, особенно при рассмотрении данной характеристики в контексте некоторой данной массы электролита и некоторой данной массы диоксида титана. В свою очередь, площадь поверхности диоксида титана для данной массы диоксида титана зависит от физических характеристик диоксида титана, таких как форма и пористость порошка/гранул. Заявитель также полагает, что вышеупомянутая важность концентрации CaO в электролите на основе CaCl2 также касается и оксидов других щелочно-земельных металлов, оксидов щелочных металлов и оксидов иттрия. В частности, заявитель полагает, что в том случае, когда в электролите на основе CaCl2 присутствует один или более из этих оксидов металлов, регулирование концентраций оксидов металлов в пределах определенных диапазонов является средством оптимизации функционирования процесса электрохимического восстановления оксида титана в твердом состоянии в электролите.-1 014138 Оксиды металлов могут присутствовать в качестве примеси или примесей в загружаемом (исходном) материале, используемом для получения электролита на основе CaCl2, и/или в качестве специальной добавки к такому электролиту. Согласно настоящему изобретению предложен процесс электрохимического восстановления оксида титана в твердом состоянии в электролизере, который включает в себя анод, катод, расплавленный электролит на основе CaCl2, содержащий CaO, и загружаемый титанооксидный материал в контакте с расплавленным электролитом, причем этот электрохимический процесс включает в себя подачу электрического потенциала между анодом и катодом и электрохимическое восстановление загружаемого титанооксидного материала в контакте с расплавленным электролитом и получение восстановленного материала, и при этом процесс характеризуется регулированием процесса путем регулирования концентрацииCaO в электролите. Предпочтительно процесс включает в себя регулирование концентрации CaO в электролите путем поддержания концентрации CaO в электролите между нижним и верхним пределами концентрации. Предпочтительно максимальная концентрация CaO в электролите составляет 0,5 мас.%. Более предпочтительно максимальная концентрация CaO в электролите составляет 0,3 мас.%. Предпочтительно минимальная концентрация CaO в электролите составляет 0,005 мас.%. Более предпочтительно минимальная концентрация CaO в электролите составляет 0,05 мас.%. В типичном случае минимальная концентрация CaO в электролите составляет 0,1 мас.%. В типичном случае концентрация CaO в электролите находится в диапазоне 0,1-0,3 мас.%. Как правило, концентрация CaO в электролите находится в диапазоне 0,15-0,25 мас.%. Предпочтительно процесс включает в себя регулирование концентрации CaO в электролите с учетом площади поверхности контакта оксида титана с электролитом. Более предпочтительно процесс включает в себя регулирование концентрации CaO в электролите с учетом площади поверхности контакта оксида титана с электролитом, при рассмотрении в контексте массы электролита и массы оксида титана. Одним из практических вариантов регулирования концентрации CaO в электролите является регулирование массового соотношения электролита и оксида титана в электролизере. В контексте регулирования концентрации CaO в электролите выше минимального предела этой концентрации процесс предпочтительно включает в себя регулирование массового соотношения электролита и оксида титана в электролизере, составляющего по меньшей мере 10:1 в тех случаях, когда исходная концентрация CaO в электролите составляет менее 0,3, более предпочтительно менее 0,2 мас.%, а оксид титана находится в виде гранул и/или порошков с удельной площадью поверхности оксида титана от 0,1 до 100 м 2/г. Процесс может включать в себя регулирование концентрации CaO в электролите путем добавленияCaO к электролиту в ходе этого процесса. Процесс может включать в себя регулирование концентрацииCaO в электролите путем выбора первоначальной концентрации CaO, которая является достаточно высокой. Электрохимический процесс может быть осуществлен на любой из периодической основы, полунепрерывной основы или непрерывной основы. Предпочтительно загружаемый титанооксидный материал находится в виде порошка и/или в виде гранул. Предпочтительно загружаемый титанооксидный материал представляет собой диоксид титана. Предпочтительно процесс электрохимического восстановления включает в себя подачу такого потенциала между анодом и катодом, который находится выше потенциала разложения CaO и ниже разложения CaCl2. Процесс электрохимического восстановления может осуществляться в одну стадию или как многостадийный процесс. Используя более общую терминологию, согласно настоящему изобретению предложен процесс электрохимического восстановления оксида титана в твердом состоянии в электролизере, который включает в себя (а) анод; (b) катод; (с) расплавленный электролит на основе CaCl2, содержащий любой один или более оксид металла, выбранный из группы, включающей оксиды щелочно-земельных металлов,оксиды щелочных металлов и оксиды иттрия; и (d) загружаемый титанооксидный материал в контакте с расплавленным электролитом, причем этот электрохимический процесс включает в себя подачу электрического потенциала между анодом и катодом и электрохимическое восстановление загружаемого титанооксидного материала в контакте с расплавленным электролитом и получение восстановленного материала, и при этом процесс характеризуется регулированием процесса путем регулирования концентрации выбранного оксида металла или оксидов металлов в электролите. Выбранный оксид металла предпочтительно представляет собой CaO. Вышеупомянутые лабораторные экспериментальные работы, проведенные заявителем, осуществлялись в высокотемпературном лабораторном электролизере. Электролизер включал в себя реакционную емкость, печь, тигельное устройство, электродное устройство и источник питания. Реакционная емкость была изготовлена из жаростойкой (жаропрочной) нержавеющей стали и имела внутренний диаметр 110 мм и высоту 430 мм, а также охлаждаемый водой фланец.-2 014138 Эта емкость содержалась внутри печи сопротивления, способной обеспечить температуру 1400 К. Установочное основание внутри емкости позволяло соответствующим образом закрепить тигель, содержащий солевой расплав, внутри емкости. Охлаждаемая водой крышка являлась критически важной особенностью реакционной емкости и имела предусмотренное в ней смотровое окошко, которое облегчало точное размещение электродов и термопары в ванне солевого расплава. Смотровое окошко также позволяло наблюдать за поверхностью солевого расплава во время реакции. Основными побочными продуктами процесса электрохимического восстановления являются монооксид углерода и диоксид углерода. С целью наблюдения за ходом процесса восстановления и для того чтобы гарантировать, что единственным источником кислорода является диоксид титана, были предприняты особые меры по контролю над газовой атмосферой. Измеряемый поток газообразного аргона высокой чистоты пропускали через печь, содержавшую медные стружки при 873 К, затем через печь, содержавшую чешуйки магния при 673 К, перед его поступлением в емкость. После прохождения через емкость из этого потока газа удаляли любые хлорсодержащие вещества и влагу и постоянно анализировали его на СО и CO2. Анализатор кислорода на основе твердого электролита отслеживал парциальное давление О 2 в отходящем газе сразу же после печи. Регистрацию и контроль данных осуществляли при помощи программного интерфейса LabView. Отслеживали и регистрировали давление в печи, подаваемое напряжение, сравнительное напряжение, ток в электролизере, температуру электролита, содержание кислорода, монооксида углерода и диоксида углерода в отходящем газе для последующего анализа как функции от времени. Как указано выше, было обнаружено, что химический состав расплавленного электролита оказывал существенное влияние на функционирование процесса. Следовательно, заявитель обеспечивал, чтобы состав электролита в начале рабочего цикла был как следует отрегулирован. Электролит готовили из дигидрата марки "химически чистый для анализа", CaCl2H2O, полученного от APS Chemicals. Обычно в экспериментах использовали 680 г расплавленной соли. Перед плавлением осуществляли стадию дегидратации следующим образом.CaCl2H2O медленно нагревали в вакууме до 525 К и выдерживали при данной температуре в течение по меньшей мере 12 ч, в течение которых отслеживали потерю массы, вызванную удалением воды. Как только потеря массы прекращалась, безводную соль переносили из вакуумной печи в платиновый тигель и помещали в плавильную печь. Соль расплавляли при 1275 К и выдерживали при данной температуре в течение 30 мин, обеспечивая дальнейшее удаление всей остаточной воды. Расплавленную соль затем заливали в предварительно нагретую стальную литейную форму, извлекали после ее затвердения и в горячем виде переносили в сушильную печь, поддерживавшуюся при 400 К. Путем использования такой стандартизованной методики приготовления электролита CaCl2 можно было получить материал воспроизводимого качества. В основной части экспериментов гранулы диоксида титана были приготовлены из рутила (AlfaAesar) с минимальной чистотой 99,5%, хотя иногда использовали и другие источники диоксида титана. Гранулы диоксида титана приготавливали так, что путем спекания при заданной температуре проводился контроль общей пористости и размера пор. В одной серии экспериментов концентрацию CaO в электролите систематически повышали до 2,5 мас.%. В частности, эксперименты осуществляли при концентрациях CaO в электролите 0,14, 0,20, 0,42, 1,4 и 2,4 мас.% и с электролитом в расплавленном виде при 1275 К. Эксперименты осуществляли в целом 4 ч при приложенном напряжении 3 В. Было установлено, что потери на внутреннее сопротивление (IR) в электролизере составляли менее 0,2 В. Результаты экспериментов суммированы на фиг. 1-3. Фиг. 1 представляет собой график тока в электролизере (в амперах) в зависимости от времени (в секундах) для каждого из вышеупомянутых экспериментов. Из данной фигуры видно, что со временем происходило снижение тока в электролизере при каждой из этих концентраций CaO в электролите. Из данной фигуры также видно, что электролизер пропускает больше тока при более высоких концентрациях CaO в электролите. Данный факт, сам по себе, не означает, что имело место усиленное восстановление диоксида титана при повышенных концентрациях CaO. Фиг. 2 представляет собой график концентрации кислорода в титане в восстановленных гранулах в зависимости от концентрации CaO в электролите в конце экспериментальных циклов продолжительностью 4 ч. Из данной фигуры видно, что восстановление диоксида титана до титана ингибировалось по мере повышения концентрации CaO в электролите. В частности, из данной фигуры видно, что концентрации кислорода в титане, полученном в электролизере, становились выше по мере повышения концентраций CaO в электролите. Иными словами, из данной фигуры видно, что степень восстановления снижалась по мере повышения концентрации CaO в электролите.-3 014138 Кроме того, при одновременном рассмотрении фиг. 1 и 2 указывают на то, что для достижения более низких уровней восстановления диоксида титана при повышенных концентрациях CaO требовался существенно более высокий расход тока. На основании фиг. 1 и 2 важно отметить, что работа при концентрациях CaO 0,5 мас.% или менее давала высокие уровни восстановления - до менее примерно 0,5 мас.% кислорода - при разумном расходе тока. Фиг. 3 представляет собой график количества удаленного из анода углерода в граммах и общий выход по току в зависимости от концентрации CaO в электролите в конце экспериментальных циклов продолжительностью 4 ч. Из данной фигуры видно, что количества электричества и углерода, израсходованных в этом процессе, были пропорционально более высокими по мере повышения концентрации CaO в электролите. В частности, из данной фигуры видно, что выход по току снижался по мере того, как повышалась концентрация CaO в электролите. Вышеприведенные результаты и другие результаты, не приведенные здесь, и рассмотрение заявителем этих результатов указали заявителю на то, что CaO является важным параметром регулирования процесса электрохимического восстановления для получения оптимальных результатов с точки зрения степени восстановления и выхода по току, и что данный процесс может, например, регулироваться путем поддержания концентрации CaO в рамках нижнего и верхнего пределов концентрации. В частности, вышеприведенные результаты и другие результаты, не приведенные здесь, указали заявителю на то, что концентрацию CaO в электролите следует регулировать составляющей в диапазоне 0,05-0,5 мас.%. Вышеописанное настоящее изобретение может быть подвергнуто различным модификациям без отклонения от сущности и объема изобретения. В качестве примера, несмотря на то что описанные выше лабораторные работы осуществляли с электролитом на основе CaCl2, содержащим CaO, заявитель полагает, что обнаруженные в ходе этих работ факты распространяются и на другие оксиды других щелочно-земельных металлов, оксиды щелочных металлов и оксиды иттрия. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ электрохимического восстановления оксида титана в твердом состоянии в электролизере,который включает в себя анод, катод, расплавленный электролит на основе CaCl2, содержащий CaO, и загружаемый титанооксидный материал в контакте с расплавленным электролитом, причем этот электрохимический способ включает в себя подачу электрического потенциала между анодом и катодом и электрохимическое восстановление загружаемого титанооксидного материала в контакте с расплавленным электролитом и получение восстановленного материала, при этом в способе поддерживают концентрацию CaO в электролите выше нижнего предела концентрации, соответствующего концентрации, необходимой для протекания электрохимического восстановления. 2. Способ по п.1, включающий в себя поддержание концентрации CaO в электролите на уровне или выше минимальной концентрации CaO в 0,005 мас.%. 3. Способ по любому из пп.1-2, включающий в себя поддержание концентрации CaO в электролите на уровне или выше минимальной концентрации CaO в 0,05 мас.%. 4. Способ по любому из пп.1-3, включающий в себя поддержание концентрации CaO в электролите на уровне или выше минимальной концентрации CaO в 0,1 мас.%. 5. Способ по любому из предыдущих пунктов, включающий в себя регулирование концентрацииCaO в электролите путем регулирования массового соотношения электролита и оксида титана в электролизере. 6. Способ по п.5, включающий в себя регулирование массового соотношения, составляющего по меньшей мере 10:1. 7. Способ по любому из предыдущих пунктов, включающий в себя регулирование концентрацииCaO в электролите путем регулирования массового соотношения электролита и оксида титана в электролизере, составляющего по меньшей мере 10:1 в тех случаях, когда исходная концентрация CaO в электролите составляет менее 0,3, более предпочтительно менее 0,2 мас.%, а оксид титана находится в виде гранул и/или порошков с удельной площадью поверхности от 0,1 до 100 м 2/г оксида титана. 8. Способ по любому из пп.1-6, включающий в себя поддержание концентрации CaO в электролите ниже верхнего предела концентрации, соответствующего концентрации, при которой падает выход по току электрохимического восстановления. 9. Способ по п.8, включающий в себя поддержание концентрации CaO в электролите на уровне или ниже максимальной концентрации CaO в 0,5 мас.%. 10. Способ по п.8, включающий в себя поддержание концентрации CaO в электролите на уровне или ниже максимальной концентрации CaO в 0,3 мас.%. 11. Способ по п.1, включающий в себя поддержание концентрации CaO в электролите в диапазоне 0,1-0,3 мас.%. 12. Способ по п.1, включающий в себя поддержание концентрации CaO в электролите в диапазоне 0,15-0,25 мас.%.-4 014138 13. Способ по любому из предыдущих пунктов, включающий в себя регулирование концентрацииCaO в электролите с учетом площади поверхности контакта оксида титана с электролитом. 14. Способ по любому из предыдущих пунктов, включающий в себя регулирование концентрацииCaO в электролите с учетом площади поверхности контакта оксида титана с электролитом при рассмотрении в контексте массы электролита и массы оксида титана. 15. Способ по любому из предыдущих пунктов, включающий в себя регулирование концентрацииCaO в электролите путем добавления CaO к электролиту в ходе этого способа. 16. Способ по любому из предыдущих пунктов, включающий в себя регулирование концентрацииCaO в электролите путем выбора первоначальной концентрации CaO, которая является достаточно высокой. 17. Способ электрохимического восстановления оксида титана в твердом состоянии в электролизере, который включает в себя (а) анод, (b) катод, (с) расплавленный электролит на основе CaCl2, содержащий любой один или более чем один оксид металла, выбранный из группы, включающей оксиды щелочно-земельных металлов, оксиды щелочных металлов и оксиды иттрия, и (d) загружаемый титанооксидный материал в контакте с расплавленным электролитом, причем этот электрохимический способ включает в себя подачу электрического потенциала между анодом и катодом и электрохимическое восстановление загружаемого титанооксидного материала в контакте с расплавленным электролитом и получение восстановленного материала, при этом в способе поддерживают концентрацию выбранного оксида металла или оксидов металлов в электролите выше нижнего предела концентрации, соответствующего концентрации, необходимой для протекания электрохимического восстановления. 18. Способ по п.17, включающий в себя поддержание концентрации выбранного оксида металла или оксидов металлов в электролите ниже верхнего предела концентрации, соответствующего концентрации, при которой падает выход по току электрохимического восстановления.
МПК / Метки
МПК: C25C 5/00, C22B 9/14, C22B 34/12
Метки: восстановление, оксидов, металлов, электрохимическое
Код ссылки
<a href="https://eas.patents.su/7-14138-elektrohimicheskoe-vosstanovlenie-oksidov-metallov.html" rel="bookmark" title="База патентов Евразийского Союза">Электрохимическое восстановление оксидов металлов</a>
Предыдущий патент: Система и способ обнаружения радиоактивных материалов
Следующий патент: Защитное устройство для защитных подложек
Случайный патент: Ингибиторы взаимодействия между mdm2 и р53











