Конъюгат с обнаруживающим мишень лигандом и его применение
Формула / Реферат
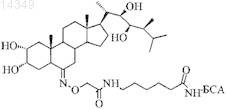
1. Конъюгат из агентного комплекса и по меньшей мере одного обнаруживающего мишень лиганда, причем агентный комплекс включает агент, покрытый оболочечным материалом, а обнаруживающий мишень лиганд представляет собой аналог простациклина.
2. Конъюгат по п.1, отличающийся тем, что аналог простациклина представляет собой илопрост или трепростинил.
3. Конъюгат по п.1 или 2, отличающийся тем, что агент представляет собой нуклеиновую кислоту или ее производное, пептид, полипептид или его производное, действующее вещество или меченый атом.
4. Конъюгат по п.3, отличающийся тем, что нуклеиновая кислота представляет собой ДНК или РНК, отсутствие или нехватка которой вызывает заболевание, или представляет собой ДНК или РНК, которая кодирует полипептид, отсутствие или нехватка которого вызывает заболевание или который действует как иммуномодулятор.
5. Конъюгат по п.3, отличающийся тем, что агент представляет собой пептид или полипептид, отсутствие или нехватка которого вызывает заболевание или который действует как иммуномодулятор.
6. Конъюгат по одному из предыдущих пунктов, отличающийся тем, что агент представляет собой средство, компенсирующее нехватку или отсутствие белка, выбранное из нуклеиновой кислоты, белка, производного белка или фрагмента белка или из действующего в легких лекарственного средства или их смеси.
7. Конъюгат по п.3, отличающийся тем, что действующее вещество представляет собой противовоспалительное действующее вещество или стероид.
8. Конъюгат по одному из предыдущих пунктов, отличающийся тем, что агент представляет собой репортерную молекулу, в особенности радиоактивный или флуоресцирующий меченый атом.
9. Конъюгат по одному из предыдущих пунктов, отличающийся тем, что оболочечный материал представляет собой встречающееся в природе, синтетическое или производное природное вещество, такое как липид или полимер или олигомер.
10. Конъюгат по одному из предыдущих пунктов, отличающийся тем, что оболочечный материал представляет собой катионный полимер, такой как способный к биологическому расщеплению азотсодержащий, предпочтительно протонируемый полимер, в особенности полиэтиленимин или биорасщепляемый полиэтиленимин, катионный олигомер, такой как спермин, или катионный липид.
11. Конъюгат по одному из предыдущих пунктов, отличающийся тем, что агентный комплекс из оболочечного материала и нуклеиновой кислоты дополнительно пегилирован.
12. Конъюгат по одному из предыдущих пунктов для применения для генной терапии или для применения для лечения легочного заболевания, в основе которого лежит дефект белка или генетический дефект, в особенности кистозного фиброза.
13. Конъюгат по одному из предыдущих пунктов, отличающийся тем, что соотношение катионного полимера к нуклеиновой кислоте, измеренное как молярное соотношение полимер-доля азота к ДНК-доле фосфата, находится в пределах от 10:1 до 1:20.
14. Конъюгат по одному из предыдущих пунктов, отличающийся тем, что покрытый оболочечным материалом агент находится в виде нанокапсул, наночастиц или липосом.
15. Терапевтическая композиция для лечения заболеваний легких, содержащая один конъюгат по любому из пп.1-14 и обычные фармацевтические вспомогательные вещества в пригодной для ингаляции форме.
Текст
КОНЪЮГАТ С ОБНАРУЖИВАЮЩИМ МИШЕНЬ ЛИГАНДОМ И ЕГО ПРИМЕНЕНИЕ Описывается конъюгат из агентного комплекса и по меньшей мере одного обнаруживающего мишень лиганда, причем агентный комплекс включает покрытый оболочечным материалом агент и причем обнаруживающий мишень лиганд представляет собой аналог простациклина, а также его применение. Изобретение относится к содержащим агент конъюгатам, которые в качестве обнаруживающей мишень структуры имеют аналог простациклина, и к применению таких конъюгатов для генной терапии,соответственно, переносу генов в клетки бронхиального и альвеолярного эпителия. Легкое представляет собой с одной стороны орган, функция которого является жизненно необходимой, и с другой стороны легкое - это орган, который по причине своей обширной поверхности и своей доступности является привлекательным для того, чтобы вводить действующие вещества или активные средства в организм. Уже давно известна доставка активных средств в легкие, как для местного, так и для системного действия посредством аэрозолей, распылителей, ингаляторов или насосных пульверизаторов. Также известно введение через легкие вирусных или невирусных средств переноса генов для генной терапии. Как вирусные, так и невирусные носители при их применении часто связаны с побочными эффектами. В частности это обусловлено тем, что доза должна быть относительно высокой, так как перенос генов, т.е. введение желаемых генов в клетки часто является недостаточно эффективным. Поэтому уже долгое время ищут средства, чтобы улучшить эффективность переноса генов. Для этого уже было предложено покрывать гены катионным липидом, так как катионные частицы могут легче фагоцитироваться. Предложенное для этого средство, которое уже тестируется в клинических исследованиях [7], представляет собой Genzyme lipid 67. Также известно применение полиэтилениминных полимеров (PEI), чтобы покрыть оболочкой нуклеиновые кислоты [8]. Несмотря на то, что PEI может защищать ДНК, это связано с таким недостатком, что эффективность переноса генов является незначительной, кроме того, было обнаружено,что в высокой дозе, которая требуется по причине низкой эффективности трансфекции, это вызывает воспаления. Поэтому также уже пытались покрытые катионными полимерами частицы снабдить лигандами, которые должны ввести частицы в клетки. Уже проводили испытания с трансферином [10], фолиевой кислотой [11], лактоферином [12], кленбутеролом [13] и факторами роста, такими как EGF [14]. Хотя с этими лигандами можно было улучшить PEI-опосредованный перенос генов, все еще существует потребность в том, чтобы доставлять активные средства в легкие целенаправленно и с высоким выходом. Далее пытались и пытаются найти новые пути для терапевтического лечения хронических заболеваний легких, для которых перенос генов является многообещающим началом. Заболевания легких, в основе которых лежат врожденные или приобретенные дефекты белков и/или генетические дефекты,можно было бы улучшить, облегчить или даже вылечить посредством предоставления отсутствующих или поврежденных белков или генных продуктов. Однако для этого необходимо осуществлять регулярное применение. Поэтому необходимо найти уравновешивание между нежелательными побочными эффектами и желаемым терапевтическим действием. Кроме того, также важным аспектом является необходимая частота дозировки для более длительной терапии. Поэтому задача изобретения состояла в том, чтобы предоставить конъюгаты, способствующие тому, чтобы действующие вещества или активные средства, пригодные для лечения или облегчения заболеваний легких, предоставить в форме, которые могут целенаправленно поглощаться клетками в легких,в особенности клетками бронхиального и альвеолярного эпителия. Эта задача решается с помощью конъюгата, как он определен в п.1 формулы изобретения. Неожиданно было обнаружено, что клетки эпителия в легких, т.е. клетки бронхиального эпителия и клетки альвеолярного эпителия, имеют IP1-рецепторы и что эти рецепторы могут быть направлены на эффективный перенос частиц, содержащих действующее вещество. С помощью конъюгатов согласно изобретению удается целенаправленно управлять клетками эпителия в бронхах и альвеолах через эти IP1 рецепторы путем применения по меньшей мере одного аналога простациклина в качестве обнаруживающей мишень структуры. В дальнейшем объект изобретения описывается подробно, и свойства и преимущества поясняются более детально. Также изобретение поясняется подробнее при помощи фигур, которые прилагаются,причем фиг. 1 показывает результаты анализа Вестерн-блот экспрессии IP1-рецептора в человеческих клетках бронхиального альвеолярного эпителия; фиг. 2 показывает интенсивность флуоресценции клеток А 549 и 16 НВЕ 14 о после инкубации сFLUO-BSA-ILO соответственно FLUO-BSA-TRP; фиг. 3 а показывает интенсивность флуоресценции FLUO-BSA по сравнению с FLUO-BSA-ILO в различных клеточных линиях;фиг. 3b и фиг. 3 с показывают среднюю интенсивность флуоресценции при повышающихся концентрациях CAY10449 соответственно ILO; фиг. 3d показывает среднюю интенсивность флуоресценции FLUO-BSA-ILO после добавления CAY10449; фиг. 3 е показывает снимки конфокальной лазерной растровой микроскопии для поверхностного связывания; фиг. 4 показывает высвобождение ДНК для конструктов PEI-g-ILO с различными соотношениямиN/P; фиг. 5 а показывает степень экспрессии для клеток, трансфицированных с помощью PEI-g-ILO генных векторов по сравнению с немодифицированным PEI; фиг. 5b показывает экспрессию генов для PEIg-ILO по сравнению с PEI; фиг. 5 с показывает степени экспрессии для PEI-g-ILO в клетках А 549 иBEAS-2B по сравнению с PEI; фиг. 6 а показывает in vivo исследования экспрессии генов люциферазы; фиг. 6b показывает экспрессию люциферазы в гомогенизированной легочной ткани, которая была получена от мышей, которые получили PEI-g-ILO FILO = 5 генных векторов, по сравнению с PEI генными векторами. фиг. 7 а показывает метаболическую активность необработанных клеток по сравнению с клетками,обработанными посредством PEI или конструкта согласно изобретению; фиг. 7b показывает изменение уровня цитокинов после введения PEI или конструкта согласно изобретению по сравнению с необработанными клетками; фиг. 8 показывает дозозависимую доставку генного вектора в клетки легких. Неожиданно было обнаружено, что конъюгаты, которые содержат аналоги простациклина в качестве обнаруживающей мишень структуры, пригодны для адресации клеток эпителия в легком, в особенности бронхиальных и альвеолярных клеток, и могут с высокой эффективностью направлять агенты в клетки. Тем самым теперь согласно изобретению предоставляется средство для введения активных ингредиентов в эпителиальные клетки легких. Это дает новые возможности для терапевтического лечения самых различных заболеваний легких. Простациклин относится к классу простагландинов и известен как простагландин I2 соответственноPGI2; он направляет и связывает рецептор простациклин-(IP1). IP1-рецептор представляет собой 7 трансмембранный-G-протеинсвязанный рецептор, который, прежде всего, был обнаружен в эндотелиальных клетках, в особенности в мышечных клетках, например, в мышечных клетках кровеносных сосудов [15-17]. Связывание простациклина с агонистом IP1-рецептора приводит к эндосомной интернализации комплексов рецептор/лиганд посредством клатрин-опосредованных процессов [18, 19]. Теперь авторы настоящего изобретения обнаружили, что это действие может быть полезным для того, чтобы улучшить целенаправленный перенос активных средств в клетки альвеолярного и бронхиального эпителия и содействовать поглощению активных веществ, которые полезны для легких или которые излечивают легочные заболевания. Поэтому согласно изобретению предоставляется конъюгат, который в качестве сопровождающей мишень структуры для бронхиальных и альвеолярных клеток эпителия имеет по меньшей мере один аналог простациклина. Сам простациклин является нестабильным и быстро распадается, чтобы его можно было применять для предусмотренной цели. Тем не менее, известны стабильные аналоги простациклина, которые равным образом связываются с IP1-рецепторами и действуют как агонисты. Как аналог простациклина в данном случае обозначается соединение, которое является производным простановой кислоты, которое обладает сравнимой с простациклином или более высокой связывающей способностью с IP1-рецепторами и имеет более высокую стабильность, чем природный простациклин. Подобные соединения являются известными. Для конъюгатов согласно изобретению пригодны известные аналоги простациклина. Предпочтительно в качестве лигандов применяют илопрост и/или трепростинил, два разрешенных в качестве лекарственных средств аналога простациклина. Равным образом могут применяться другие аналоги простациклина. Одним пригодным для изобретения аналогом простациклина является такой, который в физиологической среде и/или при хранении является стабильнее, чем встречающийся в природе простациклин. Как приведено выше простациклин распадается очень быстро, в физиологической среде, т.е. в крови его период полураспада составляет лишь несколько минут и его нельзя долго хранить. Поэтому согласно изобретению пригодны такие аналоги простациклина, которые в физиологической среде сохраняют свои свойства по меньшей мере 20 мин, предпочтительно по меньшей мере 30 мин, еще предпочтительнее по меньшей мере 45 мин, не распадаясь или инактивируясь, соответственно те, которые в физиологической среде имеют период полураспада по меньшей мере в 15 мин, предпочтительно по меньшей мере 20 мин,предпочтительнее по меньшей мере 25 мин. Здесь под периодом полураспада, в общем, понимается промежуток времени, в течение которого в физиологической среде половина исходного вещества - в данном случае аналог простациклина, была расщеплена, соответственно инактивирована или преобразована. Период полураспада можно легко установить обычным способом, например, тем, что принимаемый во внимание аналог простациклина добавляется в физиологический раствор при температуре 35-37C и определяется содержание неразложившегося простациклина к началу и после заданных промежутков времени. Далее одним пригодным для изобретения аналогом простациклина является такой, который обладает сравнимой с простациклином или более высокой способностью связывания с IP1-рецепторами. Способ, с помощью которого определяют способность связывания аналога простациклина, представляет собой конкурентный способ, при котором простациклин или известный аналог простациклина, такой как илопрост и/или трепростинил, а также кандидат в аналоги простациклина конъюгируют с флуоресцеином и альбумином бычьей сыворотки (BSA) и затем добавляют к различным клеточным линиям легких,причем тогда связывание и клеточное поглощение исследуют посредством проточной цитометрии и конфокальной лазерной растровой микроскопии. Кандидат, который связывает точно так же сильно или сильнее как простациклин или илопрост со-2 023893 ответственно трепростинил, равным образом является предпочтительным как часть конъюгата согласно изобретению. Подобная связующая способность имеет значение, если меченый флуоресцеином кандидат связывает, по меньшей мере, в той же самой мере, как и меченый флуоресцеином простациклин или меченый флуоресцеином илопрост соответственно меченый флуоресцеином трепростинил. Если доля меченого флуоресцеином кандидата является ниже, то это означает, что простациклин или илопрост соответственно трепростинил вытесняют кандидата из связывания, так что его связующая способность является не такой высокой. Известные аналоги простациклина применяют для лечения легочной артериальной гипертензии(ЛАГ) и обычно вводят внутривенно или как аэрозоль [20], часто их нужно дозировать распределенными в течение дня, чтобы соответствовать этому назначению. Однако для настоящего изобретения используется аналог простациклина в качестве обнаруживающей мишень структуры и не служит для лечения легочной артериальной гипертензии. Было обнаружено, что в комбинациях согласно изобретению с катионным обволакивающим веществом и агентом аналоги простациклина обладают противовоспалительным действием и таким образом еще улучшают действие конъюгатов согласно изобретению. Второй частью конъюгата согласно изобретению является агентный комплекс, т.е. агент, покрытый оболочечным материалом. Оболочечный материал служит для того, чтобы защищать агент и одновременно не мешать поглощению в клетку или при необходимости даже улучшать. Активным компонентом в качестве действующего принципа или действующего вещества конъюгата согласно изобретению может быть любой агент, кроме простациклина, который в адресованных от обнаруживающего мишень лиганда клетках выполняет благоприятное, целебное, облегчающее или модулирующее действие. Примерами применяемых согласно изобретению агентов в особенности являются нуклеиновые кислоты, пептиды или полипептиды, действующие вещества или меченые атомы и/или производные указанных веществ и/или их смеси. Применяемый согласно изобретению агент предпочтительно должен быть средством, которое может облегчать или вылечивать заболевания легких. Согласно изобретению аналог простациклина в данном случае применяют не как действующее вещество, а только как обнаруживающий мишень лиганд. В соответствии с одним аспектом настоящего изобретения агент является нуклеиновой кислотой,которая включает ген или фрагмент гена, дефект или недостаток которого вызывает заболевание легких или которая кодирует иммуномодулирующе действующий белок, в особенности антиген. Нуклеиновая кислота может быть ДНК или РНК, и она может иметь один или несколько генов или фрагментов. Нуклеиновая кислота может быть автономно реплицирующей или интегрирующей последовательностью,она может находиться в виде плазмиды, вектора или в другой хорошо известной специалисту в данной области техники форме. Она может быть линейной или кольцеобразной и одноцепочечной или двухцепочечной. Здесь является пригодной любая активная нуклеиновая кислота. Кроме того нуклеиновая кислота известным образом может иметь другие элементы, которые необходимы или нужны для экспрессии гена, например, промоторы, энхансеры, сигнальные последовательности и т.д. В одной другой форме осуществления активный компонент конъюгата согласно изобретению представляет собой пептид, полипептид, белок или фрагмент белка, который пригоден устранить нехватку белка или дефект белка, приводящий к заболеванию легких, или который действует как иммуномодулятор. Далее активный компонент конъюгата согласно изобретению может быть действующим веществом,которое, если оно находится в бронхиальной и/или альвеолярной эпителиальной клетке, приводит к излечению или облегчению болезненного состояния в лгком. Примерами для этого являются, например,противовоспалительные средства, такие как стероиды, использующиеся для лечения астмы. Так как лиганд также действует противовоспалительно, то эта комбинация дает очень эффективное средство. В одной другой форме осуществления агент может быть репортерной молекулой, поглощение которой может доставлять в клетку диагностически важную информацию. Репортерные молекулы, которые пригодны для диагностики, известны специалисту в данной области техники и примерами пригодных репортерных молекул являются радиоактивные или флуоресцирующие меченые молекулы, которые известны специалисту в данной области техники. Репортерные молекулы могут использоваться, например,чтобы контролировать протекание лечения или состояние лгкого. Другим существенным компонентом конъюгата согласно изобретению является оболочечный материал, который покрывает агент, чтобы защитить его от распада или изменения, и который не мешает или даже способствует введению в клетку. Оболочечный материал надлежащим образом представляет собой катионный или нейтральный материал, например, полимер или другой образующий слой материал. Важно, что оболочечный материал является биологически и физиологически совместимым, защищает агент во время переноса и в клетке распадается на физиологически совместимые молекулы и является инертным в отношении агента, т.е. не вступает в реакцию с агентом. Пригодные оболочечные материалы известны и предлагаются в разнообразном виде. Для оболочки нуклеиновых кислот предпочтительны катионные оболочечные материалы, в то время как для оболочки других агентов, таких как белки, действующие вещества или меченые атомы, могут применяться катионные или нейтральные оболочечные материалы. В одной форме осуществления настоящего изобретения, в особенности, если агент является нуклеиновой кислотой, в качестве оболочечного материала применяют катионный полимер. Было обнаружено, что катионно заряженные частицы могут легче поглощаться клеткой, чем нейтральные или анионно заряженные частицы, разумеется, они могут также промотировать скорее неспецифические присоединения. Для оболочки нуклеиновых кислот в качестве компонентов предпочтительны катионные оболочечные материалы, так как нуклеиновые кислоты можно очень легко покрыть и защитить катионными веществами. Соответствующие способы хорошо известны специалисту в данной области техники. Оболочечный материал может быть встречающимся в природе, синтетическим или катионно производным природным веществом, например, липидом, или полимером или олигомером. Примером природного олигомера является спермин. Примерами синтетических полимеров являются азотсодержащие способные к биологическому расщеплению полимеры, в особенности таковые с протонируемыми атомами азота. Особенно пригодны полиэтиленимины, в особенности, разветвленные полиэтиленимины, которые имеются в продаже. Например, пригоден разветвленный полиэтиленимин со средним молекулярным весом в 25 кДа, который доступен коммерческим путем. Было обнаружено, что этот полимер в комбинации с обнаруживающим мишень лигандом является очень совместимым. В качестве природного при необходимости производного образующего слой оболочечного материала также могут использоваться липиды, в особенности катионные или нейтральные липиды. Липиды имеются в распоряжении во многих вариантах и могут использоваться, например, для образования липосом. Особенно пригодным является катионный производный липид, который имеется в продаже под наименованием Genzyme lipid 67. Менее пригодными являются основывающиеся на сахарных молекулах полимеры, такие как крахмалы или производные крахмала, которые поэтому не применяют в качестве оболочечного материала согласно изобретению. Для других агентов, таких как белки, действующие вещества или меченые молекулы, существует количество пригодных полимеров, которые известны специалисту в данной области техники. Пригодными являются такие, которые являются биологически совместимыми, и которые, по меньшей мере, в комбинации с аналогом простациклина согласно изобретению не являются воспалительными или другим образом опасными для клетки и высвобождают агент, как только он поступает к месту назначения, в клетку. Состоящий из оболочечного материала и агента агентный комплекс может состоять, например, из известных наночастиц или нанокапсул, липосом и т.д., получение которых хорошо известно. Например,пригодным является инкапсулирование в способные к биологическому расщеплению полимеры с регулируемым высвобождением, такие как полилактид и/или полигликолид. Оболочечный материал при этом может выбираться таким образом, что высвобождение агента осуществляется предопределенным способом. Подобные оболочечные материалы неоднократно описаны в литературных источниках и специалист в данной области техники может выбрать каждый раз наиболее подходящий из большого количества материалов. Активное средство известным способом обволакивают оболочечным материалом или инкапсулируют в нем. Этот комплекс из агента и оболочечного материала в дальнейшем также обозначается как"агентный комплекс". Под "обволакиванием" в контексте настоящего изобретения понимают, что агент в известной мере отгораживается полимером от физиологической среды, что он не изменяется или не распадается, до тех пора пока он не достигнет места назначения. Оболочка может быть только одним слоем,который окружает агент, также это может быть липосома или наночастица или микрочастица, в которую внедрен или заключен агент. Также он может быть заключен посредством комплексирования. Различные формы инкапсулирования или обволакивания агентов известны специалисту в данной области техники и могут использоваться для конъюгата согласно изобретению, пока они не мешают связыванию обнаруживающего мишень лиганда с рецепторами и введению конъюгата в клетку и в клетке высвобождают агент. Обволакивание агента оболочечным материалом соответственно получение соответствующих частиц может происходить обычным способом. В самой простой форме осуществления активное средство, например, нуклеиновая кислота смешивается с оболочечным материалом, например, катионным полимером, таким как полиэтиленимин, при необходимости в растворенном виде. С обволакивающим веществом связывается или перед обволакиванием, или после него, по меньшей мере, один аналог простациклина, применяемый согласно изобретению в качестве сопровождающей мишень структуры. Посредством связывания лиганда с оболочечным материалом не нарушается активность агента. Связывание или иммобилизация лиганда соответственно лигандов может не мешать связующей способности с рецептором. Способы иммобилизации лигандов известны специалисту в данной области техники и здесь могут применяться известные способы. Специалист в данной области техники может установить пригодность комбинации обволакивающего вещества и лиганда простым способом, тем, что он получает из желаемого агентного комплекса и сравнивает связующую способность комплекса со связующей способностью свободного лиганда. Далее можно установить пригодность обволакивающего вещества относительно агента, тем, что активность агента определяется после высвобождения и сравнивается с активностью свободного агента перед обволакиванием. Лиганды могут связываться непосредственно с оболочечным материалом, до того, как он использу-4 023893 ется для оболочки агента. Эта форма осуществления, например, является предпочтительной, если оболочечный материал представляет собой катионный полимер и агент является нуклеиновой кислотой. Также возможно сначала образовать агентный комплекс и затем связать лиганды. Эта форма осуществления является предпочтительной, если агентный комплекс образуется в виде наночастиц, наношариков или липосом. При необходимости связывание лиганда с оболочечным материалом может также происходить через спейсер таким образом, что связующий активный участок лиганда является доступным для связывания. Таким образом, создается конъюгат, в котором активное средство посредством связывания не находится под влиянием, и по меньшей мере один аналог простациклина на поверхности для связывания сIP1-рецептором свободно находится в распоряжении. Лиганд, т.е. аналог простациклина, путем любого вида связи, такой как ковалентная, ионная или координационная связь, образование водородного мостика и т.д., может быть связан с оболочечным материалом, пока достаточно связи, чтобы иммобилизовать лиганд и его связующая способность с рецепторм не нарушается. Таким образом, сочетание аналога простациклина с оболочечным материалом может происходить, например, через ковалентную или ионную связь непосредственно или через спейсер. Известным специалисту в данной области техники спейсером является, например, полиэтиленгликоль (ПЭГ). Степень сочетания, т.е. объем загрузки конъюгата соответственно защищенных оболочкой частиц с лигандом, выраженный как лиганд на частицу конъюгата, оказывает влияние на высвобождение агента и тем самым на активность агента в клетке. Доля лигандов, связывающихся с покрытой оболочкой частицей, предпочтительно не должна быть слишком высокой, так как в противном случае на основании стерического затруднения могла бы быть нарушена адресация рецептора. Специалист в данной области техники может выявить приемлемую загрузку с помощью рутинных методов. Доля лигандов зависит от вида оболочечного материала и размера частиц. Также было обнаружено, что высокая степень сочетания может привести к тому, что агент высвобождается только еще не полностью. Если для оболочки применяется катионный полимер, то поэтому степень сочетания должна быть 15 лигандов на полимер или менее. С другой стороны на одну покрытую оболочкой частицу должен быть связан, по меньшей мере, один аналог простациклина, чтобы вызвать адресацию. На один конъюгат соответственно частицу может быть связан каждый раз один вид аналога простациклина. Также возможно связывать смесь двух или более аналогов простациклина, чтобы при необходимости усиливать связывающую способность и/или поглощение в клетку. Было обнаружено, что соотношение оболочечного материала к активному средству может оказывать влияние на эффективность. Если имеется слишком мало оболочечного материала, то активное средство защищается недостаточно. Если доля оболочечного материала является слишком высокой, то с одной стороны могут возникать проблемы с совместимостью, и с другой стороны слишком высокая доля оболочечного материала может привести к тому, что активное средство больше не может высвобождаться. В обоих случаях страдает эффективность переноса. Специалист в данной области техники в ходе нескольких рутинных экспериментов может обнаружить в каждом случае наиболее пригодное соотношение. В качестве особенно пригодного оказалось соотношение оболочечного материала к активному средству в пределах от 10:1 до 1:4, в пересчете на вес. Особенно предпочтительным является соотношение оболочечного материала к агенту от 4:1 до 1:4. Если конъюгат содержит нуклеиновую кислоту в качестве агента и полиэтиленимин в качестве полимера, то доля полимера может также указываться посредством молярного соотношения полимер-доля азота к ДНК-доля фосфата; предпочтительно это соотношение находится в диапазоне от 2 до 10, особенно предпочтительно от 4 до 8. Было обнаружено, что гидродинамический диаметр частиц конъюгата при молярном соотношении полимер-доля азота к ДНК-доле фосфата от 4 до 8 находится в диапазоне от 50 до 100 нм, что является оптимальным для свойств поглощения. Далее было установлено, что оптимальные конъюгаты получают тогда, когда плотность загрузки лигандов согласуется со степенью покрытия оболочкой. Если доля оболочечного материала является относительно высокой, то плотность загрузки не должна быть слишком большой, так как в противном случае агент защищается слишком сильно. Если доля оболочечного материала находится в нижнем пределе, то плотность загрузки может соответственно находиться в верхнем пределе. Было обнаружено, что конъюгат согласно изобретению является идеальным средством, чтобы вводить активные вещества в клетки бронхиального и/или альвеолярного эпителия. В то время как с описанными в уровне техники частицами без целевых лигандов соответственно сопровождающих мишень лигандов только 5% или менее достигают своей цели - клетку, и с описанными в уровне техники содержащими лиганд конъюгатами также только доля ниже 50% или менее может достичь цели и развернуть функцию, то в опытах для конъюгатов согласно изобретению можно было показать, что более чем 50%,часто 60% и боле и даже до 80% конъюгата согласно изобретению поглощаются клетками и высвобождают свой агент. Таким образом, в распоряжение предоставляется средство, с помощью которого активный компонент вводится в клетки-мишени с высокой эффективностью, причем с одной стороны активное средство во время переноса в клетку защищено хорошо, так что доля активного средства, которое поступает в клетку, является очень высокой, и с другой стороны на основании структуры конъюгата согласно изобретению очень высокой является эффективность поглощения. В одной другой форме осуществления конъюгат согласно изобретению может быть еще улучшен тем, что частица покрытая оболочечным материалом, например, катионным полимером, еще дополнительно снабжается цепями полиэтиленгликоля, чтобы еще повысить длительность выживаемости в легком. Активные молекулы, такие как нуклеиновая кислота, защищенные посредством полиэтиленгликолирования, сами по себе известны и здесь могут применяться обычные способы. Конъюгат согласно изобретению может быть применен для лечения различных заболеваний легких. В особенности конъюгат согласно изобретению пригоден для того, чтобы лечить или облегчать заболевания легких, в основе которых лежат дефекты генов или белков. Примером для этого является кистозный фиброз. Как приведено выше, возможно вводить в клетку как недостающий или отсутствующий ген,так и вводить в клетку белок, закодированный недостающим или отсутствующим геном. Другой областью применения для конъюгатов согласно изобретению является применение в качестве вакцины. В этой форме осуществления активный компонент конъюгата является или иммуномодуляторным или иммунологически активным пептидом, или белком или геном, который кодирует иммуномодуляторно или иммунологически активный белок или пептид [1, 2]. Преимуществом этой формы осуществления изобретения является то, что через легкие можно неинвазивно доставить вакцину, например,распылителем или через аэрозоль. Эта технология является несложной, делает возможным использование также там, где введение инъекций по причине санитарных условий или из-за отсутствия соответствующим образом обученного персонала является проблематичным и способствует неосложненной многократной дозировке, чтобы усилить иммунный ответ. Кроме того, легкие по причине их обширной поверхности и наличия иммунологически активных клеток являются хорошо пригодными для вакцинации. Конъюгат согласно изобретению предоставляется для введения в легкие. Для этого его можно приготовить известным образом в виде фармацевтической композиции, которую вводят в легкие путем ингаляции или посредством распыления. Соответствующие препараты известны специалисту в данной области техники. Таким образом, конъюгат может быть получен в виде суспензии или эмульсии через распылитель или в виде аэрозоля, с инертным газом в качестве носителя. Также он может быть использован в виде порошка. Далее настоящее изобретение поясняется посредством нижеследующих примеров, не ограничиваясь этими примерами. Пример 1. Получали и исследовали конъюгаты частиц, покрытых оболочечным материалом, и илопрост соответственно трепростинил в качестве обнаруживающей мишень структуры. Материалы и методы Фирмами-поставщиками химикатов и плазмидов и применяемыми концентрациями являются следующие: илопрост, трепростинил и CRY10449: Cayman Chemicals (Мичиган, США) разветвленный полиэтиленимин (средний молекулярный вес 25 кДа), N-гидроксисульфосукцинимид (сульфо-NHS), бычий сывороточный альбумин (BSA), фосфат натрия, раствор пикрилсульфоновой кислоты, 4-(2-гидроксиэтил)пиперазин-1-этансульфоновая кислота (HEPES) и гепарансульфат: Sigma Aldrich (Шнелльдорф,Германия).PEI разбавляли в дважды дистиллированной воде (вода для инъекций, В. Braun Melsungen AG,Мельзунген, Германия) и pH устанавливали соляной кислотой до 7. Фосфат натрия растворяли в дважды дистиллированной воде до концентрации в 0,5 мМ и pH устанавливали гидроксидом натрия до 7,5.HEPES растворяли в дистиллированной воде до концентрации в 0,1 М и pH устанавливали гидроксидом натрия до 7,4. Гепарансульфат растворяли в дважды дистиллированной воде до концентрации в 5 мг/мл. Этанол чистый для анализа и 3-(N-морфолино)пропансульфоновая кислота (MOPS): Merck (Дармштадт, Германия).MOPS растворяли в дважды дистиллированной воде до концентрации в 0,1 M и pH устанавливали соляной кислотой до 6. 1-Этил-3-(3-диметиламинопропил)карбодиимидгидрохлорид (EDC) и 5-(и 6-) карбоксифлуоресцеина сукцинимидиловый эфир (флуоресцеин-NHS): Pierce (Рокфорт, США). Дитиотреитол (DTT): Amersham Biosciences (Южный Сан-Франциско, США).D-люциферин: Synchem OHG (Фленсберг/Альтенбург, Германия). Плазмида pCMV-luc, которая содержала Fotinus pyralis ген люциферазы под контролем раннего промотора цитомегаловируса (CMV), и pCpG-luc размножали в Е. coli и изготавливали в высокоочищенной форме (содержание LPS0,1 E.U./мкг ДНК) от Plasmid Factory GmbH (Билефельд, Германия). Количество сверхспирали пДНК составляло 90% ссс (ковалентно непрерывная кольцевая) дляBEAS-2B (человеческие клетки бронхиального эпителия), Н 441 (человеческие клетки бронхиального эпителия): АТСС (Американская коллекция типовых культур). Клетки 16 НВЕ 14 о: человеческие клетки бронхиального эпителия. Клеточные линии А 549, BEAS-2B и 16 НВЕ 14 о выращивали в минимально обогащенной среде(MEM, Gibco-BRL, Карлсруэ, Германия), которую дополняли 10% фетальной телячьей сывороткой (FCS,Gibco-BRL, Карлсруэ, Германия), при 37C в дополненной 5% CO2 увлажненной воздушной атмосфере. Клеточную линию Н 441 выращивали в среде Roswell Park Memorial Institute Medium 1640(RPMI1640, Gibco-BRL, Карлсруэ, Германия), которую дополняли 10% фетальной телячьей сывороткой,при 37C в обогащенной 5% CO2 увлажненной воздушной атмосфере. Животные Самок мышей 14-недельного возраста BALB/c (Charles River Laboratories Sulzfeld, Германия) выдерживали при специальных беспатогенных условиях. Мыши приспосабливались, по меньшей мере, в течение 7 дней до начала испытаний. Все опыты над животными были дозволенными и контролировались местной этической комиссией, и осуществлялись в соответствии с Директивами немецкого права по защите жизни животных. Вестерн-блоттинг Клетки А 549, BEAS-2B и 16 НВЕ 14 о промывали посредством PBS и лизировали на льду в лизисбуфере, который содержал 20 мМ Tris-HCl (pH 7,5), 100 мМ NaCl, 1 мМ EDTA, 1% тритона Х-100 и 0,05% дезоксихлоата натрия. 1 мМ DTT и добавляли свежую смесь ингибиторов протеазы (Roche Diagnostics GmbH, Мангейм, Германия) непосредственно перед применением. Концентрации белка определяли с применением Biorad Proteinassays (Biorad, Мюнхен, Германия). Для каждой клеточной линии разбавляли 50 мкг белка в SDS буфере для загрузки образцов (62,5 мМ Tris-HCl (pH 6,8), 2% SDS, 10% глицерин, 2% DTT, 0,001% бромфеноловый голубой), который кипятили 5 мин, отделяли на 7,5% геле TrisHCl (Biorad, Мюнхен, Германия) и переносили на мембрану PVDF (Millipore, Швальбах, Германия). Мембраны блокировали с помощью TBS-T (20 мМ Tris-HCl (pH 7,6), 137 мМ NaCl, 0,1 % Tween-20), который содержал 5% сухое обезжиренное молоко (Sigma Aldrich, Дейзенхофен, Германия) в течение 1 ч при комнатной температуре. Первичное поликлональное антитело (разбавленное 1:500) для IP1 рецептора (Cayman Chemical, Мичиган, США) инкубировали в течение ночи в 0,5% обезжиренном молоке. Мембраны промывали посредством TBS-T и инкубировали с вторичным HRP-конъюгированным антителом анти-кролика (разбавленное 1:15.000; Biorad, Мюнхен, Германия) в течение 1,5 ч при комнатной температуре в 0,5% обезжиренном молоке. После нескольких стадий промывания посредством TBS-T осуществляли детекцию хемилюминесценцией с применением набора ECL Detection Kit (Pierce, Рокфорт,США) в соответствии с инструкцией производителя. Синтез флуоресцеин-БСА-илопроста (FLUO-BSA-ILO) и флуоресцеин-БСА-трепростинила (FLUOBSA-TRP). 20 мг (0,3 мкмоль) BSA разбавляли в 2,5 мл буфера фосфата натрия, pH 7,5, и смешивали с десятикратно молярным избытком флуоресцеин-NHS. После одночасового перемешивания при комнатной температуре смесь очищали на уравновешенной с PBS Sephadex G25 MPD-10-колонке (GE Health Care, Uppsala, Швеция). Или 0,7 мг (1,8 мкмоль) ILO, или 0,8 мг (1,8 мкмоль) TRP растворяли в 130 мкл чистого для анализа этанола и смешивали с 370 мкл MOPS буфера, 0,1 М, pH 6. Добавляли 0,5 мг (5 мМ) сульфоNHS (в MOPS буфере) и 0,2 мг (2 мМ) EDC (в MOPS буфере) и 15 мин перемешивали при комнатной температуре. После этого добавляли 5 мкл (20 мМ) DTT (в дистиллированной воде) и немедленно в реакционную смесь пипетировали 3 мг (45,2 нмоль) FLUO-BSA в 190 мкл и 210 мкл фосфатного буфера 0,5 М. После двухчасового перемешивания при комнатной температуре смесь очищали на уравновешенной сPBS Sephadex G25 MPD-10-колонке (GE Health Care, Uppsala, Швеция). Количества BSA определяли количественно с помощью Biorad Proteinassay при применении BSA стандартной кривой. Эффективность сочетания конечных и промежуточных продуктов определяли с помощью TNBS анализа [21] и измеряли экстинкцию при 495 нм. Степень сочетания BSA-ILO и BSA-TRP оказалась как 10 моль ILO или TRP на моль BSA. Синтез привитых илопростом PEI полимеров (PEI-g-ILO) Различные степени сочетания PEI-g-ILO синтезировали путем вариации количеств EDC, которые добавляли к реакционной смеси. 1 мг (2,8 мкмоль) ILO разбавляли в 100 мкл чистого для анализа этанола, смешивали с 68 нмоль PEI в 900 мл HEPES-буфере, 0,1 М, pH 7,4, и 1 мг (5 мМ) сульфо-NHS. Различные количества EDC доводили до конечной концентрации в 25 мМ, 50 мМ, 60 мМ соответственно 100 мМ и инкубировали при комнатной температуре в течение 4 ч при помешивании. Реакционную смесь очищали на уравновешенной дважды дистиллированной водой Sephadex G25 MPD-10-колонке (GEUngaro et al. [22]. 1 Н-1D-ЯМР-спектры PEI-g-ILO записаны в D2O на Brooker AV 250 MHz спектрометре. Степени сочетания PEI-g-ILO рассчитывали посредством интегрирования широкого мультиплета PEI(CH2-CH2-NH-) при 8 (1 Н) = от 2,5 до 3,1 ч./млн и синглета концевой метильной группы ILO (-CC-CH3) при(1 Н) = 1,73 ч./млн. Ковалентное сопряжение ILO с PEI приводило к четырем различным степеням сочетания (FILO (моль ILO/моль PEI) = 2, 5, 8, 16). Конструкты PEI-g-ILO разделяли на малые аликвоты,мгновенно замораживали в жидком азоте и до следующего применения удерживали до -80C. Инкубационный эксперимент с FLUO-BSA-ILO и FLUO-BSA-TRP Рецепторное связывание/поглощение FLUO-BSA-ILO исследовали в клетках А 549, Н 441,16 НВЕ 14 о и BEAS-2B. Для FACS измерительных опытов за 24 ч до добавления конъюгатов высеивали 100000 клеток/лунку в 24-луночные пластины (ТРР, Trasadingen, Швейцария). Конъюгаты FLUO-BSAILO, FLUO-BSA-TRP и FLUO-BSA разбавляли в MEM до концентрации в 0,5 мкМ и клетки инкубировали 4 ч. при 37C. После промывания клеток посредством PBS клетки извлекали из лунок обработкой трипсина и FACS измерения осуществляли с применением Beckton-Dickinson-FACS-Scans (San Jose,США). Для конфокальной лазерной растровой микроскопии опыты проводили на носителях с 4 камерами BD Falcon Culture (BD Biosciences San Jose, США) с 25000 клетками на камеру. Инкубацию FLUOBSA-ILO и FLUO-BSA осуществляли как описано ранее. Клетки промывали и фиксировали в 4% параформальдегиде и затем клеточные ядра окрашивали с помощью 0,33 мкМ DAPI (4',6-диамидино-2 фенилиндол) и F-актина с Alexafluor 568 Falloidin (Invitrogen GmbH, Карлсруэ, Германия) с применением стандартных протоколов. Носители покрывали средой (Vectashield, Vector Laboratories Inc., Берлингейм, США) и изображения снимали с помощью конфокального лазерного растрового микроскопа (Leica,Зольмс, Германия). Исследование ингибирования связывания FLUO-BSA-ILO с CAY10449 Ингибирование рецепторного связывания/поглощения FLUO-BSA-ILO исследовали на 16 НВЕ 14 о клетках. 24-луночные пластины подготавливали, как описано ранее. CAY10449 разбавляли в MEM до концентраций в 15 мкМ, 30 мкМ и 150 мкМ и инкубировали 15 мин. при 37C. Сразу после этого FLUOBSA-ILO и FLUO-BSA доводили до конечной концентрации в 25 нМ и инкубировали с клетками 4 ч при 37C. Связывание/поглощение измеряли с применением FACS. Получение частиц генного вектора Плазмиду, содержащую репортерный ген люциферазы (pCMV-luc), PEI соответственно PEI-g-ILO разбавляли отдельно в 25 мкл дважды дистиллированной воды. Проверяли различные соотношения N/P(молярное соотношение PEI-азот к ДНК-фосфату). Раствор pCMV-luc добавляли равным объемом полимерного раствора и осторожно перемешивали, восемь раз внося и отбирая пипеткой, что привело к частицам с концентрацией в 20 мкг pCMV-luc/мл. Частицы переноса генов инкубировали 20 мин при комнатной температуре. Измерение размера частиц Размер частиц (определенный динамическим светорассеянием) измеряли с применением ZetaPALS/Zeta Potential анализатора (Brookhaven Instruments Corporation, Вена, Австрия). Частицы генного вектора производили, как описано выше. Применяли следующие установки: 5 протеканий с 1 мин измерением на образец; вязкость для воды 0,89 сР; реф. показатель 1.330; температура 25C. Тест на ретардацию ДНКPEI/pCMV-luc и PEI/g-ILO/pCMV-luc частицы генного вектора с различными степенями сочетанияN/P = 4 получали в дважды дистиллированной воде, как описано выше. 5 мкл каждого раствора частиц смешивали или с 2 мкл дважды дистиллированной воды или 2 мкл раствора гепарансульфата (5 мг/мл). После 45-минутной инкубации образцы смешивали с 1 мкл буфера загрузки (0,25 % бромфеноловый голубой, 0,25% ксилолцианол FF, 30% глицерин в воде), загружали в отдельную лунку 0,8% агарозного геля и разделяли посредством агарозного гель-электрофореза с 125 V в течение 1 ч. Гель окрашивали бромидом этидиума, и полосы ДНК стали видимыми под ультрафиолетовым светом. Исследования трансфекции in-vitro Клетки А 549, 16 НВЕ 14 о и BEAS-2B за 24 ч. до трансфекции высеивали с плотностью в 100.000 клеток/лунку в 24-луночные пластины (ТРР, Trasadingen, Швейцария) и выращивали в MEM, содержащей 10% FCS и дополненной 0,1% (V/V) пенициллин/стрептомицином. Перед трансфекцией клетки промывали посредством PBS и добавляли 450 мкл свежей не содержащей сыворотку среды на лунку. Затем 50 мкл частиц генного вектора, соответственно 1 мкг pCMV-luc, пипетировали на клетки. Для опытов ингибирования добавляли CAY10449 к свежей среде с концентрацией в 150 мкМ 15 мин перед добавлением частиц генного вектора. После 4-часового инкубации трансфекционную среду заменяли на MEM,которая содержала 10% FCS и дополняли 0,1% (V/V) пеницилин/стрептомицина. Через 24 ч. после трансфекции измеряли активность люциферазы с применением счетчика Wallac Victor2 1420 MultilabelCounters (Perkin Elmer, Бостон, США) согласно Huth et al. [23]. Результаты нормализовали до общего содержания белка в клетках с применением анализа Biorad Protein assays и BSA в качестве белкового стандарта. Исследования переноса генов in-vivo Чтобы получить частицы генного вектора для аэрозольного введения мышам, pCpG-luc и PEI илиPEI-g-ILO FILO = 5 в каждом случае разбавляли с 4,0 мл воды для инъекций (В. Braun Melsungen AG,Мельзунген, Германия), что давало концентрации 250 мкг/мл pCpG-luc соответственно 130,4 мкг/мл PEI(соответственно соотношению N/P в 4). Раствор pCpG-luc пипетировали к раствору PEI, смешивали посредством восьмикратного добавления и отбора пипеткой, что дало окончательную концентрацию ДНК в 125 мкг/мл. Частицы перед применением инкубировали в течение 20 мин при комнатной температуре. Частицы распыляли с применением ингаляционного устройства PARI TurboboyN с PARI LC+ распылителем (PARI GmbH, Штарнберг, Германия), который был соединен с вертикальным цельнокорпусным аэрозольным устройством согласно Rudolph et al. [24]. Через 24 ч. Мышей подвергали анестезии и легочное введение субстрата D-люциферина (1,5 мг/50 мкл PBS на мышь) осуществляли путем вдыхания носом [25]. Через 10 мин измеряли биолюминесценцию (MS 100 Imaging System; Xenogen, Аламеда, США) с применением следующих точек съемки: поле зрения 10, F1 f-стоп, биннинг высокого разрешения и выдержка 10 мин. Чтобы подтвердить степени экспрессии репортерных генов в легких, мышей после съемки биолюминесценции in-vivo умерщвляли посредством цервикальной дислокации. После вскрытия брюшины путем разреза вдоль срединной линии легкие животных рассекали и перфузировали с PBS. Легкие мгновенно замораживали в жидком азоте и замороженном виде гомогенизировали. После добавления 400 мкл лизисного буфера (250 мМ Tris, pH 7,8, 0,1% тритон Х-100, Roche Complete смесь ингибиторов протеазы, таблетки) и 20-минутного инкубации на льду измеряли активность люциферазы в жидкой фракции с применением кюветного люминометра Lumat LB9507 (EGG Berthold, Мюнхен, Германия). Рекомбинантную люциферазу (Roche Diagnostics GmbH, Мангейм, Германия) применяли в качестве стандарта, чтобы подсчитать количество люциферазы, которое экспрессировалось в легочной ткани. Тест, основывающийся на МТТ Токсичность PEI/pCMV-luc или PEI-g-ILO FILO = 5/pCMV-luc частиц оценивали на 16 НВЕ 14 о клетках с соотношением N/P в 4. Клетки за 24 ч до эксперимента высеивали с плотностью в 80.000 клеток/лунку в 24-луночную пластину. Трансфекцию осуществляли, как описано выше. Через 4 ч. трансфекционную смесь заменяли на 400 мкл среды и проводили тест, основывающийся на МТТ, с применением набора Cell Proliferation Kit 1 (Roche Diagnostics GmbH, Мангейм, Германия) в соответствии с инструкцией производителя. Необработанные клетки применяли в качестве эталона, тем, что соответствующее поглощение устанавливали до 100% жизнеспособных клеток. Сбор сыворотки и анализ концентрации цитокинов Через 24 ч после введения аэрозоля были взяты образцы крови мышей и выдерживали при 4C в течение ночи. Кровь центрифугировали и собирали сыворотку. Количественное определение интерлейки на-12 (IL-12) и интерферона- (IFN-) происходило с применением наборов мышь-IL-12 (Р 40/Р 70) и мышь-INFELISA (Ray Biotech, Норкросс, США) согласно инструкции производителя. Необработанные мыши применялись в качестве эталона, тем, что соответствующую концентрацию устанавливали до 1. Статистический анализ Результаты указаны как среднее значениестандартное отклонение. Статистически значимые различия оценивали с помощью неспаренного T-критерия Стьюдента. p0,01 рассматривали как существенное. Результаты Подтверждение экспрессии IP1-рецептора в клетках легких с помощью анализа вестерн-блот Экспрессию IP1-рецептора в человеческих альвеолярных (А 549) и бронхиальных (BEAS-2B,16 НВЕ 14 о) клетках эпителия подтверждали с помощью анализа вестерн-блот. Полосу белка при 47 кДа можно было обнаружить (фиг. 1), что соответствует гликолизированной форме IP1-рецепторного белка,экспрессированного на клеточной мембране [26]. И поэтому исследовали, возможно ли целенаправленное наведение IP1-рецептора для доставки белков или генов. Наведение клеток легких с различными лигандами IP1-рецептора Чтобы исследовать сопровождение мишени к IP1-рецептору для рецепторопосредованного переноса генов, сочетали химически TRP и ILO с меченым флуоресцеином бычьим сывороточным альбумином(FLUO-BSA), который служил модельным веществом. В то время как инкубация А 549 и 16 НВЕ 14 о клеток с FLUO-BSA приводило к неспецефическому фоновому связыванию, инкубация с FLUO-BSA-TRP иFLUO-BSA-ILO приводило к 5,50,5% соответственно 39,30,6 % положительных А 549 и 511,8% соответственно 76,11,4 % положительных 16 НВЕ 14 о клеток (фиг. 2). Средняя интенсивность флуоресценции (MFI) A549 и 16 НВЕ 14 о клеток была существенно выше после инкубации с FLUO-BSA-ILO, чем после инкубации с FLUO-BSA-TRP. Эти результаты показывают, что TRP и ILO могут способствовать успешному связыванию модельного вещества FLUO-BSA с клетками легких, что, однако ILO является более эффективным лигандом сопровождения к мишени. Специфичность FLUO-BSA-ILO связывания с различными клеточными линиями легкихILO был далее исследован как сопровождающий к мишени лиганд на дополнительных клеточных линиях легких исходя из лучшего клеточного связывания/поглощения по сравнению с TRP. Дополнительно к А 549 и 16 НВЕ 14 о клеткам инкубация Н 441 и BEAS-2B клеток с FLUO-BSA-ILO образовало значительно более высокое количество (p0,01) положительных клеток и MFI в качестве контроля(фиг. 3 А). Это действие было более явным в человеческих бронхиальных эпителиальных клетках(16 НВЕ 14 о, BEAS-2B), чем в Clara-(Н 441) или альвеолярных (А 549) эпителиальных клетках. Эти результаты показывают разную поверхностную экспрессию клеток IP1-рецептора в человеческих типах клеток легких. Чтобы подтвердить рецепторную специфичность наблюдаемого связывания FLUO-BSA-ILO в клетках легких, 16 НВЕ 14 о клетки инкубировали с FLUO-BSA-ILO в присутствии возрастающих количеств CAY10449. Об этом соединении уже сообщалось ранее, что оно является высокоспецифическим способным антагонистом человеческого-IP1-рецептора [27, 28]. 16 НВЕ 14 о-клетки инкубировали с 25 нМFLUO-BSA-ILO вместе с повышающимися концентрациями CAY10449. Добавление CAY10449 приводило к значительному зависящему от дозы уменьшению (p0,01) как числа флуоресцентноположительных клеток, так и MFI (фиг. 3 В). В наиболее высоко применяемой концентрации CAY10449 число флуоресцентно-положительных клеток уменьшается с 95,70,7% до 7,40,9%. Клетки, которые были инкубированы с FLUO-BSA конъюгатами, применяли в качестве контроля и не проявляли никакого действия при добавлении CAY10449. Подобные результаты были получены при конкурентных исследованиях с избытком неконъюгированного ILO. Измерения FACS вместе с исследованиями ингибирования указывают на зависящую от типа клеток поверхностную экспрессию клеток IP1-рецептора на эпителиальные клетки легкого. Для того чтобы далее проверить, способствует ли ILO внутриклеточному поглощению FLUO-BSA-ILO, были проведены дополнительные исследования с применением конфокальной лазерной растровой микроскопии. Клетки 16 НВЕ 14 о инкубировали или с 0,5 мкМ FLUO-BSA или с FLUO-BSA-ILO. Визуальное выявление клеток посредством конфокальной микроскопии показало ясное поверхностное связывание клеток и последующее внутриклеточное поглощение конъюгатов FLUO-BSA-ILO (фиг. 3c), в то время как невозможно было наблюдать поглощение FLUO-BSA. Характеристика PEI и PEI-g-ILO частиц генного вектораILO сочетали с PEI, используя карбодиимидную химию с повышающейся степенью сочетания FILO= 2, 5, 8 соответственно 16 и измеряли величину образовавшихся частиц генного вектора посредством динамического светорассеяния (табл. 1). Частицы со степенью сочетания FILO = 2 и 5 с соотношениемN/P от 4 до 8 показали гидродинамические диаметры от 50 до 100 нм, которые были сравнимы с PEIгенными векторами. Частицы, которые были получены с помощью PEI N/P 2, PEI-g-ILO FILO = 2 N/P от 2 до 3 и PEI-g-ILO FILO =16 N/P 4, были нестабильными и осаждались. Частицы, которые были менее чем 150 нм, показывали полидисперсность 0,2. В качестве следующего определяли ДНК-связывающее сродство PEI-g-ILO-конструктов. Получали частицы с N/P 4 и проводили тест высвобождения ДНК (фиг. 4). Для PEI, PEI-g-ILO FILO = 2 и PEI-g-ILOFILO = 5 было полное высвобождение ДНК после добавления гепарансульфата. При высокой степени сочетания в 16 можно было наблюдать только частичное высвобождение ДНК, что указывает на более сильное связывание полимеров с плазмидой. Поэтому степень сочетания в 16 или более является менее предпочтительной. Эффективность трансфекции in-vitro Повышенное связывание и поглощение FLUO-BSA-ILO в различных клетках легких и возможность образовывать PEI-g-ILO/pCMV-luc-частицы было причиной дальнейшего исследования ILO в качестве лиганда, чтобы улучшить перенос генов in vitro. 16 НВЕ 14 о-клетки трансфицировали с PEI-g-ILOгенными векторами и сравнивали с немодифицированным PEI в качестве контроля. Эффективность переноса генов возрастает с соотношением N/P. Самая высокая степень экспрессии генов находилась приN/P 4 и FILO = 5. При этих оптимизированных условиях экспрессия генов была в 46 раз, значительно выше, чем для PEI (фиг. 5 А). Образование частиц при более высоких соотношениях N/P (4) не приводило к дальнейшему увеличению экспрессии генов. Конъюгаты PEI-g-ILO с другими степенями приводили или к незначительным или к подобным степеням трансфекции по сравнению с PEI. Осуществляли исследования конкурентного торможения с CAY10449, чтобы подтвердить рецепторопосредованный перенос генов PEI-g-ILO-генных векторов. Клетки 16 НВЕ 14 о трансфицировали или сPEI или PEI-g-ILO FILO = 5 генными векторами с N/P 4 в присутствии или отсутствии 150 мкМCAY10449. Наблюдаемая с PEI-g-ILO FILO = 5 экспрессия генов была существенно (p0,01) 33-кратно сниженной по сравнению с PEI (фиг. 5 В). В клетках, которые были трансфицированы с помощью PEI, не наблюдалось никакого действия благодаря CAY10449. Кроме того, тестировали PEI-g-ILO FILO = 5 также на А 549- и BEAS-2 В-клетках. При оптимизированных условиях посредством PEI-g-ILO FILO = 5 опосредованная экспрессия в противовес PEI в клетках А 549 соответственно BEAS-2B была в 45 раз соответственно в 14 раз выше (фиг. 5 С). Исследования высвобождения генов in-vivoPEI-g-ILO FILO = 5 и PEI частицы генного вектора доставляли в легкое BALB/C-мышей через аэрозоль и экспрессию генов анализировали через 24 ч после подачи генов. Измерение экспрессии гена люциферазы напротив in-vivo-изображения биолюминесценции показывает сильный сигнал в легких мышей, которые были обработаны с PEI-g-ILO FILO = 5 генными векторами, однако находился у предела обнаружения для PEI генных векторов (фиг. 6 А). Чтобы количественно оценить люциферазу на мг легочной ткани, мышей умерщвляли и легкие изолировали. Экспрессия люциферазы, которая была изме- 10023893 рена в гомогенизированной легочной ткани, была существенно, в 14 раз выше для PEI-g-ILO FILO = 5 генных векторов, чем для PEI генных векторов (фиг. 6 В). Токсичность in vitro и in vivo Жизнеспособность in-vitro после применения частиц генного вектора (PEI-g-ILO FILO = 5/pCMV-luc или PEI/pCMV-luc) измеряли с использованием МТТ-теста. По сравнению с PEI невозможно было наблюдать никакого увеличения цитотоксичности (86,010,1% жизнеспособность клеток для PEI-g-ILOFILO = 5 по сравнению с 89,23,2% для PEI). Для определения in-vivo токсичности и воспаления получали сыворотку обработанных мышей и измеряли цитокины воспаления, включая интерлейкин-12 (IL-12) и интерферон- (IFN-). Аналогично как при результатах in-vitro-MTT с помощью ELISA невозможно было подтвердить никакого существенного увеличения в цитокинах через 24 ч после введения генов. С помощью вышеуказанных опытов можно было показать, что аналог простагландина-I2 ILO, агонист IP1-рецептора может применяться в качестве сопровождающего к цели лиганда, чтобы улучшить перенос генов катионных полимеров, таких как PEI в клетки легких in vitro и in vivo. Было обнаружено,что с помощью конъюгатов согласно изобретению, которые содержат аналог простагландина-I2 в качестве сопровождающего к цели лиганда и катионный полимер в качестве оболочки для активного вещества,может быть существенно улучшена экспрессия генов. Таким образом, в исследовании было показано, что экспрессия репортерных генов была существенно повышена в человеческих альвеолярных (А 549) и бронхиальных эпителиальных клетках (16 НВЕ 14 о, BEAS-2B), а именно в 46 раз. Кроме того, активность люциферазы в легких мышей была существенной после аэрозольной обработки, а именно в 14 раз выше,чем при PEL ILO и TRP являются агонистами человеческого IP1-рецептора [29]. Оба являются разрешенными для лечения легочной артериальной гипертензии посредством аэрозольной ингаляции соответственно внутривенного применения [20, 30, 31]. IP1-рецепторы экспрессируются в легких людей и мышей[15, 32-34] и комплексы IP1-рецептор/лигандов интернализуются в клетку [35, 36]. Согласно изобретению эти свойства используются для того, чтобы предоставить в распоряжение улучшенную систему введения агентов в клетки легких. С помощью вестерн-блоттинга можно было подтвердить экспрессию IP1-рецептора в различных видах клеток легких. Чтобы подробнее охарактеризовать экспрессию IP1-рецептора на клеточной поверхности клеток легких, были синтезированы меченные флуоресцеином BSA-конъюгаты, которые сочетали с ILO или TRP. Затем оба конструкта инкубировали с альвеолярными (А 549) и бронхиальными(16 НВЕ 14 о) линиями эпителиальных клеток и клеточное связывание анализировали с помощью проточной цитометрии. Результаты показывают, что IP1-рецепторы присутствуют в каждой из протестированных клеточных линий. Однако ILO показывает более высокое поверхностное связывание клеток, чемTRP и поэтому ILO применяли в качестве сопровождающего к цели лиганда во всех последующих опытах. Специфичность связывания IP1-рецептора была показана посредством исследования ингибирования со специфическим антагонистом IP1-рецептора CAY10449 [27, 28, 32] и посредством избытка свободногоILO. Чтобы подтвердить эти наблюдения, осуществляли конфокальную лазерную растровую микроскопию, которая показывала связывание FLUO-BSA-ILO с поверхностью клеток и внутриклеточное поглощение в 16 НВЕ 14 о клетках. Поэтому эти результаты подтверждают, что ILO может применяться в качестве сопровождающего к цели лиганда согласно изобретению, который способствует связыванию и внутриклеточному поглощению конъюгированных веществ, таких как FLUO-BSA, что является предпосылкой для рецепторопосредованного поглощения частиц генного вектора. Для исследований трансфекции конъюгировали ILO с разветвленным PEI 25 кДа через амидную связь. Синтез приводил к конъюгатам со степенью сочетания в FILO = 2, 5, 8 и 16. Частицы PEI-gILO/pCMV-luc исследовали на 16 НВЕ 14 о клетки и наблюдали наивысшую эффективность трансфекции при N/P 4 FILO = 5, в то время как более высокая степень сочетания от 8 до 16 приводило к незначительной скорости трансфекции. Это могло основываться на неполном высвобождении pCMV-luc при более высоких степенях сочетания, что наблюдалось с помощью теста высвобождения ДНК. Высвобождение пДНК из частиц PEI/п-ДНК было установлено уже как критический параметр для успешного переноса генов [37]. Можно высказать предположение, что дополнительное гидрофобное взаимодействие ILO с пДНК может повысить связывание пДНК. Измерение размера различных частиц показало, что повышающееся количество лиганда приводит к большим гидродинамическим диаметрам для PEI-gILO/pCMV-luc частиц до 1 мкм. Подобные результаты были получены у Elfinger et al., когда кленбутерол сочетали с PEI [13]. Частицы с PEI-g-ILO FILO = 5 показывали гидродинамические диаметры менее чем в 100 нм. Частицы подобного размера могли быть интернализованы эффективнее, чем большие частицы,что уже было показано [38]. Трансфекция альвеолярных (А 549) и бронхиальных (16 НВЕ 14 О-, BEAS-2B) эпителиальных клеток с PEI-g-ILO FILO = 5/pCMV-luc-частицами с N/P 4 приводила к 46-кратному повышению экспрессии репортерных генов по сравнению с PEI/pCMV-luc-частицами с одинаковым соотношением N/P во всех протестированных клеточных линиях. Наблюдаемая улучшенная экспрессия генов не приводила к повышенному росту метаболической токсичности, что было измерено с помощью МТТтеста. Далее была подкреплена гипотеза рецепторопосредованного переноса генов посредством опытов сCAY10449 уменьшало экспрессию генов на объем, сопоставимый с PEL. Для экспериментов над животными применяли не содержащую CpG плазмиду экспрессии люциферазы (pCpG-luc). Оказалось, что не содержащие CpG плазмиды действуют менее воспалительно, чем содержащие CpG. Также было обнаружено, что они приводят к более высокой и более длительной экспрессии генов в легких [39]. Перед экспериментами над животными распыляли PEI-g-ILO FILO = 5/pCpG-luc иPEI/pCpG-luc-генные векторы и собирали различные фракции (распыленные, не распыленные), чтобы проверить стабильность частиц. Как тест на гель-ретардацию, так и измерения размеров частиц не показали никакого изменения частиц после распыления по сравнению с не распыленными частицами. Эти наблюдения подтверждают, что частицы не оказывали негативного влияния благодаря аэрозольному образованию. О подобных результатах уже сообщалось [40]. После аэрозольного введения генов в легкие мышей экспрессия генов была существенной, в 14 раз выше для PEI-g-ILO FILO = 5/pCpG-luc, чем дляPEI/pCpG-luc-генных векторов. Измерение интерлейкина-12 (IL-12) и интерферона- (IFN-) в сыворотке мышей не показало существенного повышения этих цитокинов. Это наблюдение совпадает с Gautham etal. [41], где было показано, что аэрозольное введение частиц PEI-ДНК не вызывает никакого повышенного цитокинового ответа. Обобщая, устанавливается, что согласно изобретению предоставляется новая обнаруживающая мишень структура для сопровождения веществ в легкие. Потенциал аналогов простациклина и в особенности ILO в качестве лиганда для сопровождения к мишени был обнаружен изобретателями и использовался как "паром" для введения веществ в клетки легких. В особенности аналоги простациклина ILO являются пригодными в качестве лигандов сопровождения к мишени для невирусных векторов в аэрозольном виде. С применением основывающихся на флуоресцеине молекулярных конъюгатов можно было показать, что IP1-рецептор является пригодным кандидатом для рецепторопосредованного переноса генов в клетках легких. Рецепторспецифическое связывание и поглощение молекулярных конъюгатов могло быть показано как для альвеолярных, так и для бронхиальных эпителиальных клеток и клеток Clara. Конъюгаты согласно изобретению приводят к специфическому существенному повышению экспрессии генов in vitro и in vivo. Благодаря более чем 10-кратному повышению экспрессии генов является возможным снизить количество пДНК и носителей гена, что понижает посредством ДНК или носителей опосредованные токсичность и воспаление. Результаты этого примера приведены на фиг. с 1 по 7 и в табл. 1. Табл. 1: физическая характеристика PEI/pCMV-luc и PEI-g-ILO/pCMV-luc генных векторов с применением PEI-g-ILO с различными степенями сочетания (FILO = 2, 5, 8, 16) при различных соотношенияхN/P. Измерения размера частиц и полидисперсности (в скобках). Результаты указываются как среднее значениестандартное отклонение (n = 3). Фиг. 1. Вестерн-блоттинг показывает экспрессию IP1-рецепторного белка с 67 кДа в человеческих альвеолярных (А 549) и бронхиальных (BEAS-2B, 16 НВЕ 14 о) эпителиальных клетках. Каждую полосу загружали посредством 40 мкг экстракта белка. Фиг. 2. Обнаружение мишени IP1-рецептора с TRP и ILO альвеолярных (А 549) и бронхиальных(16 НВЕ 14 о) эпителиальных клеточных линий. Инкубация FLUO-BSA, FLUO-BSA-TRP и FLUO-BSAILO осуществляли с концентрацией в 0,5 мкМ (n = 4): FACS измерения. Результаты указаны как среднее значениестандартное отклонение.означает статистическую значимость с p0,01. Фиг. 3. Распределение IP1-рецептора и рецепторное связывание в альвеолярных (А 549), бронхоальвелярных (Н 441) и бронхиальных (16 НВЕ 14 о, BEAS-2B) эпителиальных клетках. Инкубация с FLUOBSA-ILO и FLUO-BSA осуществляли с концентрацией в 0,5 мкМ (n = 4): FACS измерения (а). 16 НВЕ 14 о(b,с) и А 549 (d)-клетки инкубировали с 25 нМ FLUO-BSA-ILO и FLUO-BSA вместе с повышающимися концентрациями CAY10449 (n = 4); FACS измерения (b,c,d). Для конфокальной лазерной растровой микроскопии инкубировали 16 НВЕ 14 о клетки с 0,5 мкМ FLUO-BSA-ILO и FLUO-BSA (e). Результаты указаны как среднее значениестандартное отклонение.означает статистическую значимость с p0,01. Фиг. 4. Тест на замедление ДНК для PEI и различных конструктов PEI-g-ILO с N/P = 4. Полимеры,которые были комплексированы с pCMV-luc, инкубировали с (+) и без (-) гепарансульфата, разделяли на агарозном геле, и делали видимыми под ультрафиолетовым светом после окрашивания бромидом этидия. Фиг. 5. Эффективность трансфекции in vitro. Трансфекцию 16 НВЕ 14 о клеток с pCMV-luc комплексировали с различными конструктами PEI-g-ILO при различных соотношениях N/P (n = 4): измерение экспрессии гена люциферазы (а), эксперимент ингибирования PEI/pCMV-luc- и PEI-g-ILO FILO = 5/pCMV-luc частиц с соотношением N/P в 4 с CAY10449 (n = 3): измерение экспрессии гена люциферазы(b). Трансфекция А 549, 16 НВЕ 14 о и BEAS-2B с PEI/pCMV-luc и PEI-g-ILO FILO = 5/pCMV-luc с соотношением N/P в 4 (n = 6): измерение экспрессии гена люциферазы (с). Экспрессию гена люциферазы измеряли как люминесценцию в относительных световых единицах (RLU) во время 10 с/мг клеточного белка. Результаты указаны как среднее значениестандартное отклонение.означает статистическую значи- 12023893 мость с p0,01. Фиг. 6. Экспрессия гена люциферазы in-vivo, которая была получена с PEI/pCpG-luc и PEI-g-ILOFILO = 5/pCpG-luc частицами с соотношением в N/P = 4 в легких BALB/c-мышей после аэрозольного введения (n = 5). Изображения биолюминесценции с выдержкой в 10 мин через 24 ч (а). Измерение экспрессии люциферазы в гомогенизатах легких мышей с выдержкой в 30 с. Осуществляли через 24 ч после трансфекции (b). Результаты указаны как вертикальная точка с медианой.означает статистическую значимость с p0,01. Фиг. 7. Трансфекция альвеолярных (А 549) и бронхиальных (16 НВЕ 14 О-), BEAS-2B) эпителиальных клеток с PEI-g-ILO FILO =5/pCMV-luc-частицами с N/P 4 по сравнению с PEI/pCMV-luc-частицами соответственно по сравнению с необработанными клетками не приводила к увеличению метаболической токсичности, что было измерено с помощью МТТ-теста (а). Далее после введения PEI-g-ILO FILO=10 в легкие мышей по сравнению с введением PEI и необработанными мышами измеряли интерлейкин-12(IL-12) и интерферон- (IFN-) в сыворотке мышей. Не оказалось никакого существенного повышения этих цитокинов. Пример 2. Зависимая от дозы доставка генного вектора в клетки легких 16 НВЕ 14 о клетки трансфицировали с PEI и PEI-g-ILO частицами генного вектора, так что было снижено количество pCMV-luc с 1 мкг до 0,25 мкг (фиг. 8). Через 24 ч после трансфекции эффективность переноса генов уменьшалась дозозависимым образом. Наивысшая степень экспрессии генов была обнаружена с 1 мкг pCMV-luc. Однако 0,5 мкг pCMV-luc комплексированные с PEI-g-ILO FILO = 5 приводили к экспрессии, которая равнялась 1 мкг pCMV-luc комплексированному с немодифицированным PEI(3,3105 по сравнению с 3,2105 RLU/10 с/мг белка). Чтобы показать, что эффективность переноса генов уменьшается в зависимости от дозы, осуществляли опыт трансфекции, при котором уменьшалось количество частиц генного вектора. Здесь было показано, что уменьшение PEI-g-ILO FILO = 5 частиц генного вектора до 50% приводит к одинаковой экспрессии по сравнению с 100% PEI-частицами генного вектора. Эти данные однозначно показывают, что количество пДНК и носителей гена может быть снижено и сохраняется одинаковая степень экспрессии. Далее может быть снижена как пДНК, так и опосредованные носителем токсичность и воспаление. Результаты этого примера также представлены на фиг. 8. В дальнейшем указаны литературные источники, на которые делаются ссылки в описании. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Конъюгат из агентного комплекса и по меньшей мере одного обнаруживающего мишень лиганда,причем агентный комплекс включает агент, покрытый оболочечным материалом, а обнаруживающий мишень лиганд представляет собой аналог простациклина. 2. Конъюгат по п.1, отличающийся тем, что аналог простациклина представляет собой илопрост или трепростинил. 3. Конъюгат по п.1 или 2, отличающийся тем, что агент представляет собой нуклеиновую кислоту или ее производное, пептид, полипептид или его производное, действующее вещество или меченый атом. 4. Конъюгат по п.3, отличающийся тем, что нуклеиновая кислота представляет собой ДНК или РНК, отсутствие или нехватка которой вызывает заболевание, или представляет собой ДНК или РНК,которая кодирует полипептид, отсутствие или нехватка которого вызывает заболевание или который действует как иммуномодулятор. 5. Конъюгат по п.3, отличающийся тем, что агент представляет собой пептид или полипептид, отсутствие или нехватка которого вызывает заболевание или который действует как иммуномодулятор. 6. Конъюгат по одному из предыдущих пунктов, отличающийся тем, что агент представляет собой средство, компенсирующее нехватку или отсутствие белка, выбранное из нуклеиновой кислоты, белка,производного белка или фрагмента белка или из действующего в легких лекарственного средства или их смеси. 7. Конъюгат по п.3, отличающийся тем, что действующее вещество представляет собой противовоспалительное действующее вещество или стероид. 8. Конъюгат по одному из предыдущих пунктов, отличающийся тем, что агент представляет собой репортерную молекулу, в особенности радиоактивный или флуоресцирующий меченый атом. 9. Конъюгат по одному из предыдущих пунктов, отличающийся тем, что оболочечный материал представляет собой встречающееся в природе, синтетическое или производное природное вещество, такое как липид или полимер или олигомер. 10. Конъюгат по одному из предыдущих пунктов, отличающийся тем, что оболочечный материал представляет собой катионный полимер, такой как способный к биологическому расщеплению азотсодержащий, предпочтительно протонируемый полимер, в особенности полиэтиленимин или биорасщепляемый полиэтиленимин, катионный олигомер, такой как спермин, или катионный липид. 11. Конъюгат по одному из предыдущих пунктов, отличающийся тем, что агентный комплекс из оболочечного материала и нуклеиновой кислоты дополнительно пегилирован. 12. Конъюгат по одному из предыдущих пунктов для применения для генной терапии или для применения для лечения легочного заболевания, в основе которого лежит дефект белка или генетический дефект, в особенности кистозного фиброза. 13. Конъюгат по одному из предыдущих пунктов, отличающийся тем, что соотношение катионного полимера к нуклеиновой кислоте, измеренное как молярное соотношение полимер-доля азота к ДНКдоле фосфата, находится в пределах от 10:1 до 1:20. 14. Конъюгат по одному из предыдущих пунктов, отличающийся тем, что покрытый оболочечным материалом агент находится в виде нанокапсул, наночастиц или липосом. 15. Терапевтическая композиция для лечения заболеваний легких, содержащая один конъюгат по любому из пп.1-14 и обычные фармацевтические вспомогательные вещества в пригодной для ингаляции форме.
МПК / Метки
МПК: A61K 47/48, A61P 11/00
Метки: применение, мишень, лигандом, обнаруживающим, конъюгат
Код ссылки
<a href="https://eas.patents.su/21-23893-konyugat-s-obnaruzhivayushhim-mishen-ligandom-i-ego-primenenie.html" rel="bookmark" title="База патентов Евразийского Союза">Конъюгат с обнаруживающим мишень лигандом и его применение</a>
Предыдущий патент: Иммуногенные белки вируса человеческой папилломы и способы их применения
Следующий патент: Способ и линия изготовления технических пластин из изношенных шин
Случайный патент: Способ повышения пожароустойчивости сосновых молодняков