Пиперидиниламинопиридазины и их применение в качестве быстро диссоциирующих антагонистов рецептора допамина 2
Номер патента: 16654
Опубликовано: 30.06.2012
Авторы: Андрес-Хиль Хосе Игнасио, Ван Гол Михиль Люк Мария, Бартоломе-Небреда Хосе Мануэль, Макдональд Грегор Джеймс, Ван Ден Кейбюс Франс Альфонс Мария
Формула / Реферат
1. Соединение формулы (I)
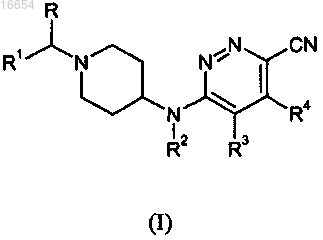
или его фармацевтически приемлемая соль, или сольват, или его стереоизомерная форма, где
R является водородом;
R1 является фенилом; фенилом, замещенным 1, 2 или 3 заместителями, каждый из которых независимо выбран из группы, состоящей из водорода, галогена, C1-4алкила, перфтор-C1-4алкила и трифторметокси;
R2 является водородом;
каждый из R3 и R4 независимо является водородом, C1-4алкилом или галогеном.
2. Соединение по п.1, где R, R3 и R4 являются водородом.
3. Соединение по п.1, где R2 является водородом.
4. Соединение по п.1, где R1 является 3,5-дифторфенилом, 3,4,5-трифторфенилом, 3-трифторметилфенилом, 3-фтор-5-трифторметилфенилом или 3-фтор-4-метилфенилом.
5. Соединение по п.1, где соединение выбрано из группы, состоящей из
6-[1-(3,5-дифторбензил)пиперидин-4-иламино]пиридазин-3-карбонитрила,
6-[1-(3-трифторметилбензил)пиперидин-4-иламино]пиридазин-3-карбонитрила,
6-[1-(3-фтор-5-трифторметилбензил)пиперидин-4-иламино]пиридазин-3-карбонитрила,
6-[1-(3,4,5-трифторбензил)пиперидин-4-иламино]пиридазин-3-карбонитрила и
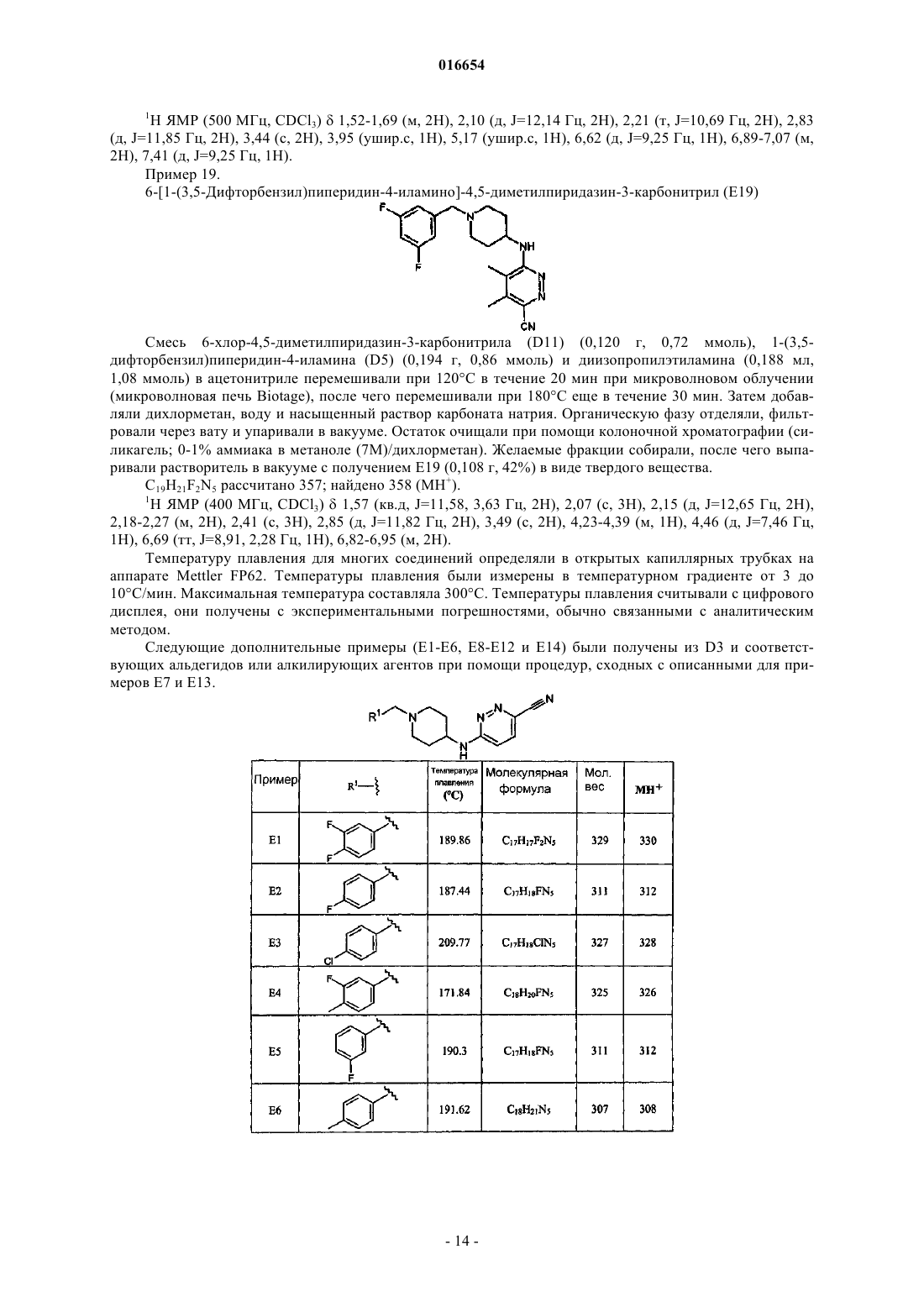
6-[1-(3-фтор-4-метилбензил)пиперидин-4-иламино]пиридазин-3-карбонитрила.
6. Фармацевтическая композиция, содержащая терапевтически эффективное количество соединения по п.1.
7. Применение соединения по п.1 в качестве лекарственного средства.
8. Применение соединения по п.1 в качестве антипсихотического средства.
9. Применение соединения по п.1 в качестве лекарственного средства для лечения или предупреждения шизофрении, шизофреноформных расстройств, шизоаффективных расстройств, бредовых расстройств, кратковременного психотического расстройства, индуцированного психотического расстройства, психотических расстройств, вызванных общим соматическим состоянием, вызванного употреблением веществ психотического расстройства, психотических расстройств без других указаний; психозов, связанных с сумасшествием; большого депрессивного расстройства, дистимического расстройства, предменструального дисфорического расстройства, депрессивного расстройства без других указаний; биполярного расстройства I типа, биполярного расстройства II типа, циклотимического расстройства, биполярного расстройства без других указаний, расстройств настроения, вызванных общим соматическим состоянием, расстройства настроения, вызванного употреблением веществ, расстройства настроения без других указаний; генерализованного тревожного расстройства, обсессивно-компульсивного расстройства, панического расстройства, расстройств, связанных с острым стрессом, расстройств, связанных с посттравматическим стрессом; врожденного слабоумия; аутистических расстройств; расстройств, связанных с недостатком внимания, расстройства, связанного с недостатком внимания и гиперактивностью, дизраптивных расстройств поведения; личностных нарушений параноидального типа, личностных нарушений шизоидного типа, шизотипических расстройств личности; судорожных расстройств, синдрома Туретта; зависимости от веществ; злоупотребления веществами; синдрома отмены веществ; трихотилломании.
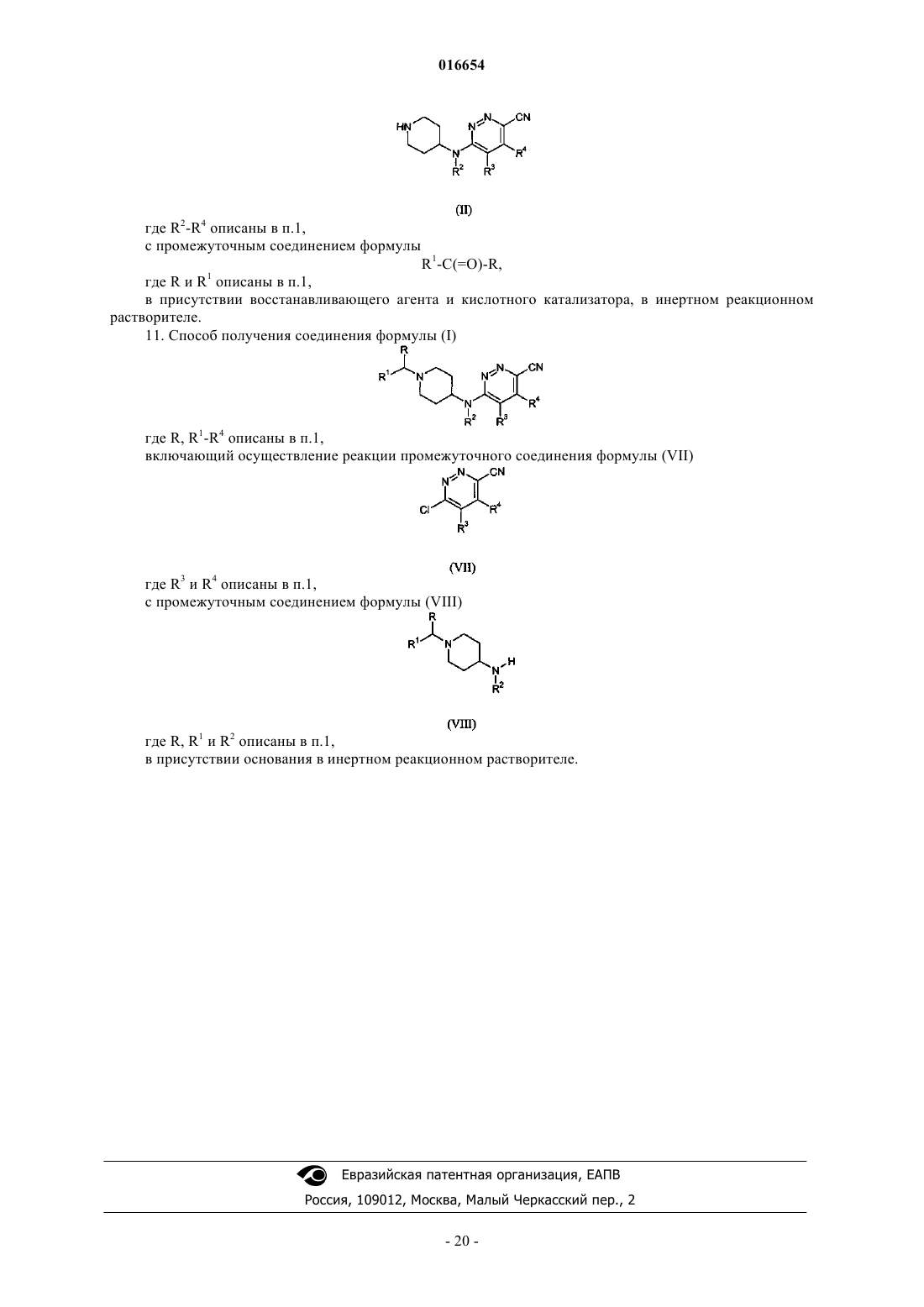
10. Способ получения соединения формулы (I)
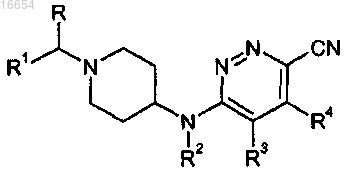
где R, R1-R4 описаны в п.1,
включающий осуществление реакции промежуточного соединения формулы (II)
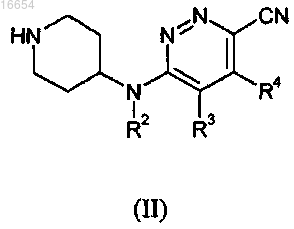
где R2-R4 описаны в п.1,
с промежуточным соединением формулы
R1-C(=O)-R,
где R и R1 описаны в п.1,
в присутствии восстанавливающего агента и кислотного катализатора, в инертном реакционном растворителе.
11. Способ получения соединения формулы (I)
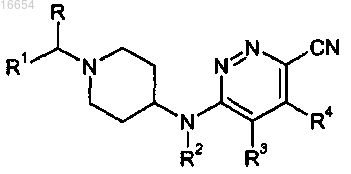
где R, R1-R4 описаны в п.1,
включающий осуществление реакции промежуточного соединения формулы (VII)
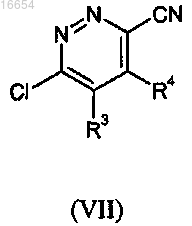
где R3 и R4 описаны в п.1,
с промежуточным соединением формулы (VIII)
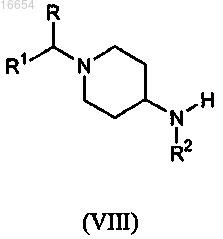
где R, R1 и R2 описаны в п.1,
в присутствии основания в инертном реакционном растворителе.
Текст
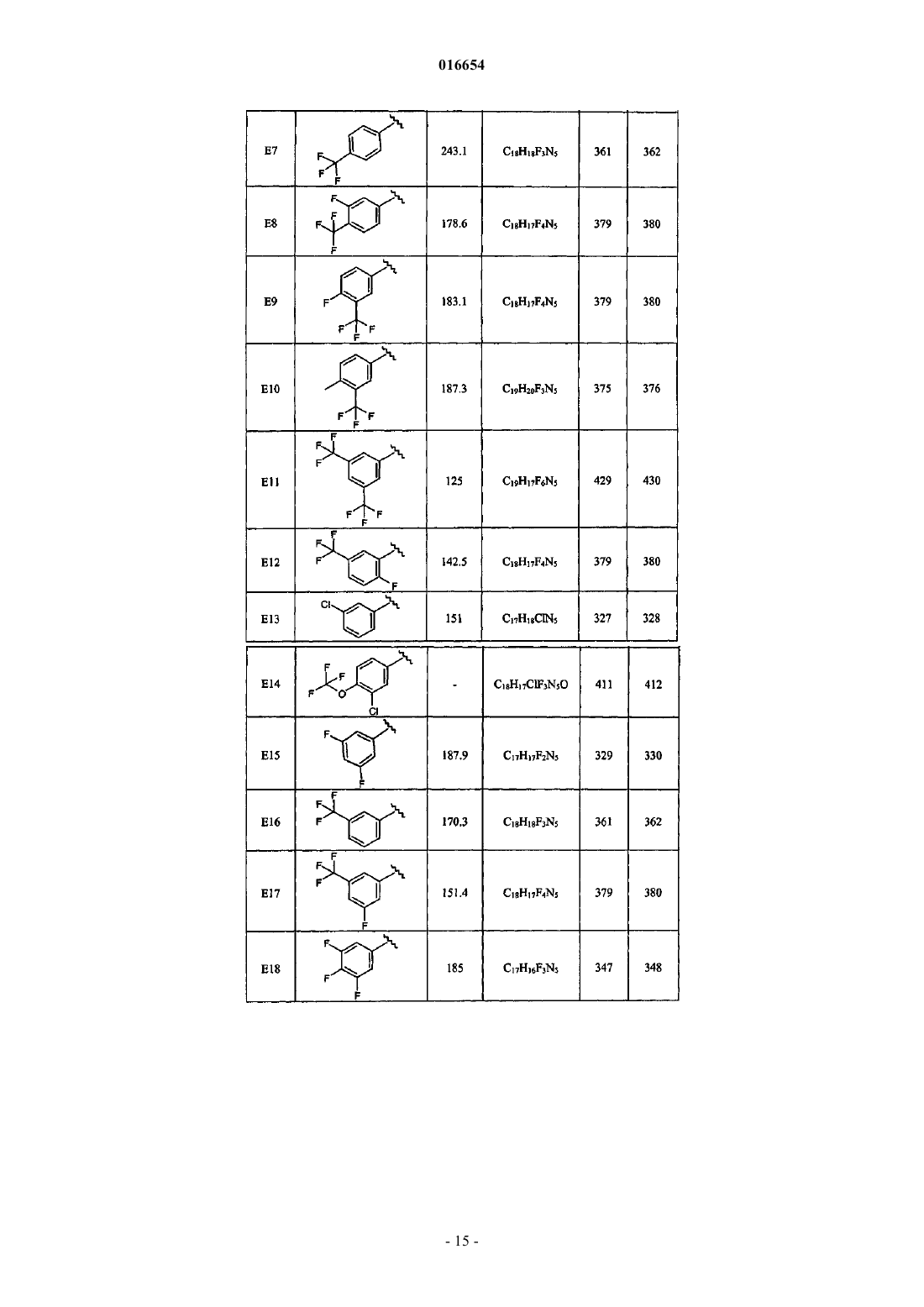
ПИПЕРИДИНИЛАМИНОПИРИДАЗИНЫ И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ БЫСТРО ДИССОЦИИРУЮЩИХ АНТАГОНИСТОВ РЕЦЕПТОРА ДОПАМИНА 2 Настоящее изобретение относится к 6-(пиперидин-4-иламино)пиридазин-3-карбонитрилам формулы (I), которые являются быстро диссоциирующими антагонистами рецепторов допамина 2, способам получения этих соединений, фармацевтическим композициям, содержащим эти соединения в качестве активного компонента. Соединения находят применение в качестве лекарственных средств для лечения или предупреждения расстройств центральной нервной системы, например шизофрении, демонстрируя антипсихотическое действие без моторных побочных эффектов. Макдональд Грегор Джеймс (BE),Андрес-Хиль Хосе Игнасио (ES),Ван Ден Кейбюс Франс Альфонс Мария (BE), Бартоломе-Небреда Хосе Мануэль, Ван Гол Михиль Люк Мария (ES) Медведев В.Н. (RU) 016654 Область техники, к которой относится изобретение Настоящее изобретение относится к 6-(пиперидин-4-иламино)пиридазин-3-карбонитрилам, представляющим собой быстро диссоциирующие антагонисты рецепторов допамина 2, способам получения этих соединений и фармацевтическим композициям, включающим в качестве активного компонента эти соединения. Эти соединения находят применение в качестве лекарственных средств для лечения или предупреждения расстройств центральной нервной системы, например шизофрении, оказывая антипсихотическое действие при отсутствии побочных моторных эффектов. Описание предшествующего уровня техники В J. Med. Chem. (1999), 42(4), 730-741 в качестве ингибиторов ацетилхолинэстеразы описаны 6 фенил-N-[1-(фенилметил)-4-пиперидинил]-3-пиридазинамин и аналогичные соединения. В Farmaco, vol. 35, no. 11, 1980, p. 951-964 описаны N-[4-пиперидинил]-2-аминопиримидины, имеющие допаминергическую активность, т.е. большинство описанных соединений являются агонистами рецептора допамина D2. Поскольку ни одно из изученных соединений не препятствовало стереотипному поведению, вызванному последующей дозой апоморфина, они могут также считаться лишенными способности блокировать рецептор допамина. Отличие соединений по настоящему изобретению заключается в присутствии пиридазина вместо пиримидиновой группы и неожиданно обнаруженном антагонистическом действии в отношении рецептора допамина D2. Описание изобретения Шизофрения является серьезным хроническим психическим заболеванием, которое поражает приблизительно 1% населения. Клинические симптомы становятся заметными в относительно раннем возрасте, обычно возникая в пубертатном периоде или в раннем детстве. Симптомы шизофрении обычно разделяются на симптомы, которые описывают как позитивные, включая галлюцинации, мании и спутанные мысли, и симптомы, которые описывают как негативные, включая социальную изоляцию, ослабление эмоций, оскудение речи и неспособность испытывать удовольствие. Кроме того, пациенты с шизофренией страдают от когнитивных нарушений, таких как повреждение внимания и памяти. Этиология заболевания остается неизвестной, но предполагается, что в основе симптомов шизофрении лежит ненормальное действие нейромедиаторов. Наиболее часто принимаемой во внимание гипотезой является допаминергическая гипотеза; она предполагает, что за позитивные симптомы, наблюдаемые у пациентов с шизофренией, отвечает гиперактивность допаминовой передачи. Эта гипотеза основывается на наблюдении того, что усиливающие допамин препараты, такие как амфетамин или кокаин, могут вызывать психозы, и на том, что существует корреляция между клиническими дозировками антипсихотических средств и их способностью блокировать рецепторы допамина D2. Все имеющиеся на рынке антипсихотические средства проявляют свое терапевтическое действие в отношении позитивных симптомов шизофрении, блокируя рецептор допамина D2. Если отвлечься от клинической эффективности, то создается впечатление, что основные побочные эффекты антипсихотических средств, такие как экстрапирамидальные симптомы (EPS) и поздняя дискинезия, также связаны с антагонизмом допамина. Эти истощающие побочные эффекты наиболее часто проявляются с типичными антипсихотическими средствами или антипсихотическими средствами первого поколения (например, галоперидол). Они являются менее выраженными для нетипичных антипсихотических средств или антипсихотических средств второго поколения (например, рисперидона, оланзапина) и могут даже практически отсутствовать у клозапина, который является прототипом нетипичного антипсихотического средства. Среди различных гипотез, предложенных для объяснения более низкой встречаемости EPS, наблюдаемой для нетипичных антипсихотических средств, большое внимание привлекла к себе в последние пятнадцать лет мультирецепторная гипотеза. Она является результатом исследований связывания рецепторов, которые показывают, что многие нетипичные антипсихотические средства в дополнение к рецепторам допамина D2 взаимодействуют с различными другими рецепторами нейромедиаторов, в частности с рецепторами серотонина 5-НТ 2, тогда как типичные антипсихотические средства, такие как галоперидол, более специфично связываются с рецепторами D2. В последние годы эта теория ставится под сомнение, поскольку все основные нетипичные антипсихотические средства в клинически значимых дозах полностью занимают рецепторы серотонина 5-НТ 2, но все равно имеют различия в том, что касается вызывания моторных побочных эффектов. В качестве альтернативы мультирецепторной гипотезе Kapur и Seeman ("Does fast dissociation from the dopamine D2 receptor explain the action of atypical antipsychotics: A new hypothesis", Am. J. Psychiatry 2001,158: 3, p. 360-369) предположили, что нетипичные антипсихотические средства могут быть отделены от типичных антипсихотических средств по скорости, с которой они диссоциируют от рецепторов допамина D2. Быстрая диссоциация от рецептора D2 делает антипсихотическое средство более приспособленным к физиологической передаче допамина, что позволяет антипсихотический эффект без моторных побочных эффектов. Гипотеза является особенно убедительной, когда дело касается клозапина и кветиапина. Эти два препарата имеют наиболее высокую скорость диссоциации от рецепторов допамина D2 и имеют наименьший риск вызвать у человека EPS. С другой стороны, типичные антипсихотические средства, соотносимые с высоким распространением EPS, представляют собой наиболее медленно диссоциирующие антагонисты рецептора допамина D2. Таким образом, поиск новых препаратов на основании скорости их диссоциации с рецептором допамина D2 кажется правомерной стратегией получения новых-1 016654 нетипичных антипсихотических средств. Дополнительной задачей является сочетание свойств быстро диссоциировать с избирательностью в отношении рецепторов допамина D2. Мультирецепторный профиль современных нетипичных антипсихотических средств считается причиной других побочных эффектов, таких как набор веса и диабет. Поиск избирательных антагонистов D2 некоторое время игнорировали в качестве подхода, но авторы изобретения считают, что применение более избирательных соединений в клинической практике может уменьшить встречаемость метаболических расстройств, связанных с существующими нетипичными антипсихотическими лекарственными средствами. Предметом настоящего изобретения является предоставление новых соединений, которые являются быстро диссоциирующими антагонистами рецептора допамина 2, имеющих благоприятный фармакологический профиль, как описано выше, в частности уменьшенные моторные побочные эффекты, и взаимодействие с другими рецепторами от среднего до незначительного, что приводит к понижению риска развития метаболических расстройств. Цель достигается представленными новыми соединениями формулы (I) их фармацевтически приемлемыми солями и сольватами, и их стереоизомерными формулами, гдеR1 является фенилом; фенилом, замещенным 1, 2 или 3 заместителями, каждый из которых независимо выбран из группы, состоящей из водорода, галогена, C1-4 алкила, перфтор-C1-4 алкила и трифторметокси;R2 является водородом; каждый из R3 и R4 независимо является водородом, C1-4 алкилом или галогеном. Соединения по изобретению представляют собой быстро диссоциирующие антагонисты рецептораD2, эта активность не приписывается ни одному из производных 6-фенил-N-[4-пиперидинил]-3 пиридазинамина из J. Med. Chem. (1999), 42(4), 730-741, ни любому из замещенных N-[4-пиперидинил]2-аминопиримидинов из Farmaco, vol. 35, no. 11, 1980, p. 951-964. Это свойство делает соединения по изобретению особенно подходящими для применения в качестве лекарственных средств для лечения или предупреждения шизофрении, шизофреноформных расстройств, шизоаффективных расстройств, бредовых расстройств, кратковременного психотического расстройства, индуцированного психотического расстройства, психотических расстройств, вызванных общим соматическим состоянием, вызванного употреблением веществ психотического расстройства, психотических расстройств без других указаний; психозов, связанных с сумасшествием; большого депрессивного расстройства, дистимического расстройства, предменструального дисфорического расстройства, депрессивного расстройства без других указаний; биполярного расстройства I типа, биполярного расстройства II типа, циклотимического расстройства, биполярного расстройства без других указаний, расстройств настроения, вызванных общим соматическим состоянием, расстройства настроения, вызванного употреблением веществ, расстройства настроения без других указаний; генерализованного тревожного расстройства, обсессивнокомпульсивного расстройства, панического расстройства, расстройств, связанных с острым стрессом,расстройств, связанных с посттравматическим стрессом; врожденного слабоумия; аутистических расстройств; расстройств, связанных с недостатком внимания, расстройства, связанного с недостатком внимания и гиперактивностью, дизраптивных расстройств поведения; личностных нарушений параноидального типа, личностных нарушений шизоидного типа, шизотипических расстройств личности; судорожных расстройств, синдрома Туретта; зависимости от веществ; злоупотребления веществами; синдрома отмены веществ; трихотилломании. Специалист может сделать выбор соединений на основании экспериментальных данных, помещенных здесь далее в экспериментальной части. Любой выбор соединений охвачен данным изобретением. Первая группа соединений формулы (I) представляет собой соединения, в которых R, R3 и R4 представляют собой водород. Вторая группа соединений формулы (I) представляет собой соединения, в которых R2 представляет собой водород. Третья группа соединений представляет собой соединения формулы (I), где R1 представляет собой 3,5-дифторфенил, 3,4,5-трифторфенил, 3-трифторметилфенил, 3-фтор-5-трифторметилфенил или 3-фтор 4-метилфенил. Соединениями формулы (I) являются, например,6-[1-(3,4-дифторбензил)пиперидин-4-иламино]пиридазин-3-карбонитрил (Е 1),6-[1-(4-фторбензил)пиперидин-4-иламино]пиридазин-3-карбонитрил (Е 2),-2 016654 6-[1-(4-хлорбензил)пиперидин-4-иламино]пиридазин-3-карбонитрил (Е 3),6-[1-(3-фтор-4-метилбензил)пиперидин-4-иламино]пиридазин-3-карбонитрил (Е 4),6-[1-(3-фторбензил)пиперидин-4-иламино]пиридазин-3-карбонитрил (Е 5),6-[1-(4-метилбензил)пиперидин-4-иламино]пиридазин-3-карбонитрил (Е 6),6-[1-(4-трифторметилбензил)пиперидин-4-иламино]пиридазин-3-карбонитрил (Е 7),6-[1-(3-фтор-4-трифторметилбензил)пиперидин-4-иламино]пиридазин-3-карбонитрил (Е 8),6-[1-(4-фтор-3-трифторметилбензил)пиперидин-4-иламино]пиридазин-3-карбонитрил (Е 9),6-[1-(4-метил-3-трифторметилбензил)пиперидин-4-иламино]пиридазин-3-карбонитрил (Е 10),6-[1-(3,5-бис-трифторметилбензил)пиперидин-4-иламино]пиридазин-3-карбонитрил (Е 11),6-[1-(2-фтор-5-трифторметилбензил)пиперидин-4-иламино]пиридазин-3-карбонитрил (Е 12),6-[1-(3-хлорбензил)пиперидин-4-иламино]пиридазин-3-карбонитрил (Е 13),6-[1-(3-хлор-4-трифторметоксибензил)пиперидин-4-иламино]пиридазин-3-карбонитрил (Е 14),6- [1-(3,5-дифторбензил)пиперидин-4-иламино]пиридазин-3-карбонитрил (Е 15),6-[1-(3-трифторметилбензил)пиперидин-4-иламино]пиридазин-3-карбонитрил (Е 16),6-[1-(3-фтор-5-трифторметилбензил)пиперидин-4-иламино]пиридазин-3-карбонитрил (Е 17),6-[1-(3,4,5-трифторбензил)пиперидин-4-иламино]пиридазин-3-карбонитрил (Е 18),6-[1-(3,5-дифторбензил)пиперидин-4-иламино]-4,5-диметилпиридазин-3-карбонитрил (Е 19),6-[1-(3,5-дифторбензил)пиперидин-4-иламино]-4-метилпиридазин-3-карбонитрил (Е 20) и 6-(1-бензилпиперидин-4-ил)пиридазин-3-карбонитрил (D2). В настоящем изобретении термин "C1-4 алкил", когда используется сам по себе или в сочетаниях, таких как "C1-4 алкилокси", "перфтор-C1-4 алкил" "ди-C1-4 алкиламино", включает, например, метил, этил,пропил, бутил, 1-метилпропил, 1,1-диметилэтил; термин "C1-6 алкил" включает метил, этил, пропил, бутил, 1-метилпропил, 1,1-диметилэтил, пентил и гексил; "перфтор-C1-4 алкил" включает, например, трифторметил, пентафторэтил, гептафторпропил и нонафторбутил; "C3-8 циклоалкил" включает циклопропил,циклобутил, циклопентил, циклогексил, циклогептил и циклооктил; "С 5-7 циклоалкенил" включает циклопентенил, циклогексенил и циклогептенил. Термин "галоген" включает фтор, хлор, бром и йод. Термин "фармацевтически приемлемые соли" определен как включающий терапевтически активные нетоксичные формы кислотно-аддитивных солей, которые могут образовывать соединения формулы(I). Указанные соли могут быть получены путем обработки основной формы соединений формулы (I) соответствующими кислотами, например неорганическими кислотами, например галогеноводородной кислотой, в частности хлористо-водородной кислотой, бромисто-водородной кислотой, серной кислотой,азотной кислотой и фосфорной кислотой; органическими кислотами, например уксусной кислотой, гликолевой кислотой, пропановой кислотой, молочной кислотой, пировиноградной кислотой, щавелевой кислотой, малоновой кислотой, янтарной кислотой, малеиновой кислотой, миндальной кислотой, фумаровой кислотой, яблочной кислотой, винной кислотой, лимонной кислотой, метансульфоновой кислотой,этансульфоновой кислотой, бензолсульфоновой кислотой, паратолуолсульфоновой кислотой, цикламовой кислотой, салициловой кислотой, парааминосалициловой кислотой, памовой кислотой и миндальной кислотой. И напротив, указанные формы солей могут быть преобразованы в свободные формы путем обработки соответствующим основанием. Термин "сольваты" относится к гидратам и алкоголятам, которые могут образовывать соединения формулы (I). Термин "стереохимически изомерные формы", использованный в настоящем описании ранее, обозначает все возможные изомерные формы, которые могут принимать соединения формулы (I). Если не подразумевается или не указано иного, химическое обозначение соединений обозначает смесь всех возможных стереохимически изомерных форм, причем указанные смеси содержат все диастереомеры и энантиомеры основной молекулярной структуры. Более детально, стереогенные центры могут иметь Rили S-конфигурацию; заместители на бивалентных циклических (частично) насыщенных радикалах могут иметь или цис- или транс-конфигурацию. Соединения, содержащие двойные связи, могут иметь на указанной двойной связи Е- или Z-стереохимическую конфигурацию. Стереохимически изомерные формы соединений формулы (I) включены в объем настоящего изобретения. Соединения формулы (I), получаемые в описанных ниже способах, могут быть синтезированы в форме рацемических смесей энантиомеров, которые могут быть отделены один от другого, следуя методикам разделения, известным из уровня техники. Рацемические соединения формулы (I) могут быть преобразованы в соответствующие диастереомерные формы соли путем реакции с подходящей хиральной кислотой. Указанные диастереомерные формы соли в дальнейшем разделяют, например, при помощи избирательной или частичной кристаллизации, и энантиомеры высвобождаются из них при помощи щелочей. Альтернативный способ разделения энантиомерных форм соединений формулы (I) вовлекает жидкостную хроматографию с использованием хиральной неподвижной фазы. Указанные чистые стереохимически изомерные формы могут также быть получены из соответствующих чистых стереохимически изомерных форм соответствующих исходных веществ при условии, что реакция протекает стереоспецифично. Предпочтительно, если желателен определенный стереоизомер, указанное соединение будет синтезировать с использованием стереоспецифичных способов получения. Эти способы извлекут-3 016654 пользу при использовании энантиомерно чистых исходных веществ. Фармакология. Для того чтобы обнаружить антипсихотические соединения, активные в отношении позитивных симптомов и имеющие улучшенный профиль безопасности (низкую встречаемость EPS и отсутствие метаболических расстройств), авторы настоящего изобретения провели скрининг соединений, избирательно взаимодействующих с рецептором допамина D2 и быстро диссоциирующих от этого рецептора. Сначала проводили скрининг соединений по отношению их сродства с рецептором допамина D2 в исследовании связывания с применением [3 Н]спиперона и мембран человеческих рецепторных клеток D2L. Соединения, показавшие IC50, меньший чем 10 мкМ, были исследованы при помощи непрямого анализа,адаптированного на основе метода, опубликованного в Josee E. Leysen and Walter Gommeren, Journal ofReceptor Research, 1984, 4(7), 817-845, для оценки скорости их диссоциации. Выбранные соединения Е 15, Е 16, Е 17 и Е 18 далее подвергали скринингу на панели из более чем 50 обычных связанных с G-белком рецепторов (CEREP) и показали чистый профиль, что свидетельствует о низком сродстве по отношению к исследованным рецепторам. Большинство соединений были далее исследованы в моделях in vivo, таких как "ингибирование вызванного апоморфином возбуждения на крысах", при подкожном и пероральном введении, и для некоторых было обнаружено, что они являются биодоступными перорально и активными. В свете вышеупомянутой фармакологии соединений формулы (I) следует, что они пригодны для применения в качестве лекарственных средств, в частности для применения в качестве антипсихотического средства. Более конкретно, соединения пригодны для применения в качестве лекарственного средства для лечения или предупреждения шизофрении, шизофреноформных расстройств, шизоаффективных расстройств, бредовых расстройств, кратковременного психотического расстройства, индуцированного психотического расстройства, психотических расстройств, вызванных общим соматическим состоянием,вызванного употреблением веществ психотического расстройства, психотических расстройств без других указаний; психозов, связанных с сумасшествием; большого депрессивного расстройства, дистимического расстройства, предменструального дисфорического расстройства, депрессивного расстройства без других указаний; биполярного расстройства I типа, биполярного расстройства II типа, циклотимического расстройства, биполярного расстройства без других указаний, расстройств настроения, вызванных общим соматическим состоянием, расстройства настроения, вызванного употреблением веществ, расстройства настроения без других указаний; генерализованного тревожного расстройства, обсессивнокомпульсивного расстройства, панического расстройства, расстройств, связанных с острым стрессом,расстройств, связанных с посттравматическим стрессом; врожденного слабоумия; аутистических расстройств; расстройств, связанных с недостатком внимания, расстройства, связанного с недостатком внимания и гиперактивностью, дизраптивных расстройств поведения; личностных нарушений параноидального типа, личностных нарушений шизоидного типа, шизотипических расстройств личности; судорожных расстройств, синдрома Туретта; зависимости от веществ; злоупотребления веществами; синдрома отмены веществ; трихотилломании. Для оптимизации лечения пациентов, страдающих от таких расстройств, как упомянутые в предшествующем параграфе, соединения формулы (I) могут быть введены вместе с другими психотропными соединениями. Таким образом, в случае шизофрении, объектом могут быть негативные и когнитивные симптомы. Настоящее изобретение также предлагает способ лечения теплокровных животных, страдающих от таких расстройств, причем указанный способ включает системное введение терапевтического количества соединения формулы (I), эффективного для лечения описанных выше расстройств. Настоящее изобретение далее предлагает способ предупреждения возникновения любого из вышеупомянутых состояний у теплокровных животных, склонных к возникновению подобных расстройств,причем указанный способ включает системное введение терапевтического количества соединения формулы (I), эффективного для лечения описанных выше расстройств. Настоящее изобретение также относится к применению соединений формулы (I), описанных здесь выше для получения лекарственного средства, в частности антипсихотического лекарственного средства,более конкретно лекарственного средства для лечения или предупреждения шизофрении, шизофреноформных расстройств, шизоаффективных расстройств, бредовых расстройств, кратковременного психотического расстройства, индуцированного психотического расстройства, психотических расстройств,вызванных общим соматическим состоянием, вызванного употреблением веществ психотического расстройства, психотических расстройств без других указаний; психозов, связанных с сумасшествием; большого депрессивного расстройства, дистимического расстройства, предменструального дисфорического расстройства, депрессивного расстройства без других указаний; биполярного расстройства I типа,биполярного расстройства II типа, циклотимического расстройства, биполярного расстройства без других указаний, расстройств настроения, вызванных общим соматическим состоянием, расстройства настроения, вызванного употреблением веществ, расстройства настроения без других указаний; генерализованного тревожного расстройства, обсессивно-компульсивного расстройства, панического расстройства, расстройств, связанных с острым стрессом, расстройств, связанных с посттравматическим стрес-4 016654 сом; врожденного слабоумия; аутистических расстройств; расстройств, связанных с недостатком внимания, расстройства, связанного с недостатком внимания и гиперактивностью, дизраптивных расстройств поведения; личностных нарушений параноидального типа, личностных нарушений шизоидного типа,шизотипических расстройств личности; судорожных расстройств, синдрома Туретта; зависимости от веществ; злоупотребления веществами; синдрома отмены веществ; трихотилломании. Специалисты в области лечения и предупреждения подобных заболеваний могут определить эффективное ежедневное терапевтическое количество на основании приведенных здесь далее исследований. Эффективное дневное терапевтическое количество составляет от приблизительно 0,01 до приблизительно 10 мг/кг веса тела, более предпочтительно от приблизительно 0,05 до приблизительно 1 мг/кг веса тела. Изобретение также относится к фармацевтическим композициям, содержащим фармацевтически приемлемый носитель и в качестве активного компонента - терапевтически эффективное количество соединения формулы (I). В зависимости от пути введения фармацевтическая композиция будет содержать от 0,05 до 99 вес.% активного компонента и от 1 до 99,95 вес.% фармацевтически приемлемого носителя. Для упрощения введения рассматриваемые соединения могут быть введены в состав различных фармацевтических форм для целей введения. Соединения по изобретению, в частности соединения формулы (I), их фармацевтически приемлемая кислотно- или основно-аддитивная соль, их стереохимически изомерная форма, их N-оксидная форма и их пролекарство, или любая их подгруппа или их сочетание,для целей введения могут быть представлены в виде различных фармацевтических форм. В качестве приемлемых композиций могут быть приведены все композиции, обычно используемые для препаратов системного применения. Для получения фармацевтических композиций по настоящему изобретению эффективное количество конкретного соединения, необязательно в виде аддитивной соли, в качестве активного компонента объединяют в виде однородной добавки с фармацевтически приемлемым носителем, который может принимать различные формы в зависимости от желаемой для введения формы препарата. Эти фармацевтические композиции желательно находятся в единичной лекарственной форме,пригодной, в частности, для перорального, ректального, подкожного введения или введения путем парентеральной инъекции или ингаляции. Например, при приготовлении композиций в пероральной лекарственной форме могут быть использованы любые обычные фармацевтические среды, такие как, например, вода, гликоли, масла, спирты и т.п. в случае таких пероральных форм, как суспензии, сиропы, эликсиры, эмульсии и растворы; или твердые носители, такие как крахмалы, сахара, каолин, разбавители,смазки, связующие вещества, дезинтегрирующие препараты, и тому подобное в виде порошков, пилюль,капсул и таблеток. По причине легкости их введения таблетки и капсулы представляют собой наиболее преимущественные пероральные единичные лекарственные формы, в которых очевидно используют твердые фармацевтические носители. Для парентеральных композиций носитель обычно будет содержать стерильную воду, по меньшей мере в большей части, хотя могут быть включены также и другие компоненты, например для увеличения растворимости. Например, могут быть изготовлены растворы для инъекций, в которых носитель включает солевой раствор, раствор глюкозы или смесь солевого раствора и раствора глюкозы. Например, могут быть изготовлены растворы для инъекций, в которых носитель содержит солевой раствор, раствор глюкозы или смесь солевого раствора и раствора глюкозы. Растворы для инъекций, содержащие соединение формулы (I), могут быть составлены на основе масла для пролонгированного действия. Подходящими маслами для этой цели являются, например, арахисовое масло,кунжутное масло, хлопковое масло, кукурузное масло, соевое масло, синтетические эфиры глицерина и жирных кислот с длинной цепью и смеси этих и других масел. Могут быть также приготовлены суспензии для инъекций, в этом случае могут применяться соответствующие жидкие носители, суспендирующие агенты и т.п. Также подразумеваются препараты в твердой форме, которые предназначены для преобразования непосредственно перед использованием в препараты в жидкой форме. В композициях,предназначенных для подкожного введения, носитель, необязательно, содержит агент, усиливающий проникновение, и/или подходящий смачивающий агент, необязательно в сочетании с подходящими добавками любой природы в небольших количествах, причем эти добавки не имеют вредного действия на кожу. Указанные добавки могут облегчать нанесение на кожу и/или могут быть полезны при приготовлении желаемых композиций. Эти композиции можно наносить различными способами, например, в виде трансдермального пластыря, точечно или как мазь. Кислотно- или основно-аддитивные соли соединений формулы (I) по причине их увеличенной растворимости в воде по сравнению с соответствующими кислотными или основными формами, более пригодны для получения водных композиций. Особенно выгодным является составление упомянутых выше фармацевтических композиций в виде единичной лекарственной формы для облегчения введения и однородности дозировки. Используемый в настоящем описании термин "единичная лекарственная форма" относится к физически дискретным единицам, применимым в качестве единичных доз, причем каждая единица содержит заранее определенное количество активного компонента, определенное для достижения желаемого терапевтического эффекта,в сочетании с необходимым фармацевтическим носителем. Примерами подобных единичных лекарственных форм являются таблетки (включая шероховатые таблетки или таблетки с покрытием), капсулы,-5 016654 пилюли, пакетики порошка, вафли, суппозитории, растворы или суспензии для инъекций и подобное и их отдельные разновидности. Поскольку соединения по изобретению являются эффективными соединениями, пригодными для перорального введения, фармацевтические композиции, содержащие указанные соединения для перорального введения, являются особенно выгодными. Для того чтобы усилить растворимость и/или стабильность соединений формулы (I) в фармацевтических композициях, может быть полезным применение -, - или -циклодекстринов или их производных, в частности замещенных гидроксиалкилом циклодекстринов, например 2-гидроксипропил-циклодекстрина. Также растворимость и/или стабильность соединений по изобретению могут увеличивать вспомогательные растворители. Получение. Соединения формулы (I) где R, R1, R2, R3 и R4 имеют значения, описанные выше,получают с помощью реакции соединения формулы (II)R1-C(=O)-R (III-а),1 где R и R описаны выше,в присутствии подходящего восстанавливающего агента, такого как триацетоксиборгидрид натрия,подходящего кислотного катализатора, такого как уксусная кислота, в подходящем инертном реакционном растворителе, таком как 1,2-дихлорэтан. Соединение формулы (I), где R, R1, R2, R3 и R4 имеют значения, описанные выше, также может быть получено путем проведения реакции соединения формулы (II), где R2, R3 и R4 имеют значения, описанные выше, с соединением формулы R1-CHX-R (III-b), где R и R1 имеют значения, описанные выше, и X представляет собой галоген или подходящую уходящую группу, в присутствии подходящего основания,такого как диизопропилэтиламин, в подходящем инертном реакционном растворителе, таком как ацетонитрил, при подходящей температуре, обычно при нагревании до 120 С при микроволновом излучении. Соединения формулы (II), где R2, R3 и R4 имеют значения, описанные выше, получают с помощью реакции производного хлорпиридазина формулы (IV) где R2, R3 и R4 имеют значения, описанные выше, и Р представляет собой подходящую защитную группу, такую как бензил,с цианистой солью, такой как цианид цинка, в присутствии палладиевого катализатора, такого как тетракис(трифенилфосфин)палладий, в подходящем инертном растворителе, таком как N,Nдиметилформамид, при подходящих условиях реакции, обычно при нагревании до 160 С при микроволновом излучении, с последующим удалением защитной группы Р, при соответствующих условиях, для бензильной группы, таких как реакция с 1-хлорэтилхлорформиатом, в присутствии подходящего основания, такого как диизопропилэтиламин, в подходящем инертном реакционном растворителе, таком как дихлорметан. Соединения формулы (IV), где R2, R3 и R4 имеют значения, описанные выше, и Р представляет собой подходящую защитную группу, получают с помощью реакции соединения формулы (V) где R2 описан ранее и Р представляет собой подходящую защитную группу, такую как бензил,с соединением формулы (VI) где R3 и R4 имеют значения, описанные выше,в присутствии подходящего катализатора, такого как иодид калия, при подходящих условиях реакции, таких как расплавленное состояние. Соединения формулы (VI) доступны коммерчески или получают при помощи методик, сходных с теми, которые описаны в WO 99/36407. Соединения формулы (I), где R, R1, R2, R3 и R4 имеют значения, описанные выше, могут быть также получены путем проведения реакции 3-хлорпиридазина формулы (VII) где R3 и R4 имеют значения, описанные выше,с производным пиперидина формулы (VIII)R1-CHX-R (III-b),где R и R имеют значения, описанные выше, и X представляет собой галоген или подходящую уходящую группу,в присутствии подходящего основания, такого как диизопропилэтиламин, в подходящем инертном реакционном растворителе, таком как дихлорметан, с последующим удалением третбутилоксикарбонильной группы в промежуточном соединении формулы (X) путем обработки кислотой,такой как трифторуксусная кислота, с получением соединения формулы (VIII), где R2=Н. Соединения формулы (VIII), где R и R1 имеют значения, описанные выше, и R2=Н, могут также быть получены путем проведения реакции трет-бутилового эфира пиперидин-4-илкарбаминовой кислотыR1-C(=O)-R (III-а),1 где R и R , имеют значения, описанные выше,в присутствии подходящего восстанавливающего агента, такого как триацетоксиборгидрид натрия,подходящего кислотного катализатора, такого как уксусная кислота, в подходящем инертном реакцион 1-7 016654 ном растворителе, таком как 1,2-дихлорэтан, с последующим удалением трет-бутилоксикарбонильной группы в промежуточном соединении формулы (X) путем обработки кислотой, такой как трифторуксусная кислота, с получением соединения формулы (VIII), где R2=Н. Соединения формулы (VIII), где R2 Н, могут быть получены путем проведения реакции соединения формулы (XI)R2-NH2 (XII),в присутствии подходящего восстанавливающего агента, такого как водород, подходящего катализатора, такого как палладий-на-углероде, и в подходящем инертном реакционном растворителе, таком как этанол. Соединения формулы (XI), где R и R1 имеют значения, описанные выше, могут быть получены путем проведения реакции 4,4-этилендиоксипиперидина (XIII)R1-C(=O)-R (III-а), где R и R описаны выше,в присутствии подходящего восстанавливающего агента, такого как триацетоксиборгидрид натрия,подходящего кислотного катализатора, такого как уксусная кислота, в подходящем инертном реакционном растворителе, таком как 1,2-дихлорэтан, с последующим удалением защитной группы из промежуточного соединения формулы (XIV) с цианистой солью, такой как цианид цинка или меди, в присутствии палладиевого катализатора,такого как тетракис(трифенилфосфин)палладий, в подходящем инертном растворителе, таком как N,Nдиметилформамид или ацетонитрил, при подходящих условиях реакции, обычно при нагревании до 160 С при помощи микроволнового излучения. Экспериментальная часть. Химия. Окончательную очистку соединений из примеров (Е 1-Е 20) проводили или при помощи колоночной хроматографии на силикагеле с применением описанного элюента, или при помощи обращенно-фазовой препаративной ВЭЖХ на колонке Hyperprep RP 18 BDS (Shandon) (8 мкм, 200 мм, 250 г). Три подвижные фазы (подвижная фаза А: 90% 0,5% ацетата аммония + 10% ацетонитрила; подвижная фаза В: метанол;-8 016654 подвижная фаза С: ацетонитрил) использовали для проведения градиентного метода, начиная с 75% А и 25% В при скорости потока 40 мл/мин (поддержание в течение 0,5 мин при одинаковых условиях с последующим увеличением скорости потока до 80 мл/мин в течение 0,01 мин), до 50% В и 50% С через 41 мин, до 100% С через 20 мин с поддержанием этих условий в течение 4 мин. Спектр 1 Н был записан на спектрометре Bruker DPX 360, DPX 400 или Bruker AV-500. Химические сдвиги выражали в м.д. по отношению к тетраметилсилану. Описание 1. Смесь из 4-амино-1-бензилпиперидина (4 г, 21 ммоль) и 3,6-дихлорпиридазина (1,56 г, 10,5 ммоль) перемешивали в течение 1 ч при 120 С, до того как добавляли н-бутанол (10 мл), и перемешивали реакционную смесь еще 1 ч при 120 С. После добавления воды и дихлорметана органическую фазу отделяли,высушивали (Na2SO4), фильтровали и упаривали растворитель в вакууме. Остаток кристаллизовали из ацетонитрила и полученное твердое вещество отделяли фильтрованием и высушивали с получением D1(2,09 г, 17,8 ммоль) и тетракис(трифенилфосфин)палладия(0) (2,74 г, 2,3 ммоль) в N,Nдиметилформамиде (30 мл) нагревали при 160 С в течение 30 мин при помощи микроволнового излучения (микроволновая печь Milestone). Растворитель затем упаривали в вакууме, после чего добавляли водный раствор карбоната калия (10%) и этилацетат. Органическую фазу отделяли, высушивали(Na2SO4), после чего растворитель упаривали в вакууме. Остаток очищали при помощи колоночной хроматографии (силикагель; от 0 до 1,5% аммиака в метаноле (7 М)/дихлорметан) а затем при помощи ВЭЖХ с получением D2 (1,06 г, 36%) в виде твердого вещества. К перемешиваемой смеси 6-(1-бензилпиперидин-4-ил)пиридазин-3-карбонитрила (D2) (1,5 г,5,1 ммоль) и диизопропилэтиламина (2,6 г, 20 ммоль) в дихлорметане (50 мл) при 0 С добавляли по каплям 1-хлорэтилхлорформиат (2,9 г, 20 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 2 ч, после чего растворитель упаривали в вакууме. К остатку добавляли метанол (50 мл) и смесь кипятили с обратным холодильником в течение 2 ч. Растворитель упаривали в вакууме и остаток очищали при помощи колоночной хроматографии (силикагель; от 5 до 12% аммиака в метаноле(7 М)/дихлорметан). Собирали желаемые фракции, после чего растворитель упаривали в вакууме с получением D3 (0,9 г, 90%) в виде твердого вещества. C10H13N5 рассчитано 203; найдено 204 (МН+).(30 мл) перемешивали в течение 30 мин при 160 С, при микроволновом излучении (микроволновая печьMilestone). Затем смесь выливали в дихлорметан (200 мл), фильтровали через целит, после чего упаривали растворитель в вакууме. Остаток затем очищали при помощи колоночной хроматографии (силикагель; дихлорметан/гептан от 1:1 до 7:3) с получением D4 (2,84 г, 89%) в виде твердого вещества. 1 Смесь трет-бутилового эфира пиперидин-4-илкарбаминовой кислоты (5 г, 24,9 ммоль), 3,5 дифторбензилбромида (2,9 мл, 22,7 ммоль) и диизопропилэтиламина (5,9 мл, 34,03 ммоль) в дихлорметане (50 мл) перемешивали при комнатной температуре в течение 2 ч. По истечении этого периода была добавлена трифторуксусная кислота (32 мл), после чего реакционную смесь перемешивали еще 2 ч. Растворитель упаривали в вакууме, затем добавляли насыщенный раствор карбоната натрия. Смесь экстрагировали дихлорметаном, отделенные органические фазы высушивали (Na2SO4), фильтровали и упаривали растворитель в вакууме с получением D5 (4,5 г, 90%) в виде твердого вещества. Смесь трет-бутилового эфира пиперидин-4-илкарбаминовой кислоты (2,5 г, 12,4 ммоль), 3(трифторметил)бензилбромида (1,7 мл, 11,3 ммоль) и диизопропилэтиламина (2,9 мл, 16,9 ммоль) в дихлорметане (25 мл) перемешивали при комнатной температуре в течение 2 ч. По окончании этого периода добавляли трифторуксусную кислоту (32 мл) и реакционную смесь перемешивали еще 2 ч. Растворитель упаривали в вакууме, затем добавляли насыщенный раствор карбоната натрия. Смесь экстрагировали дихлорметаном, отделенные органические фазы высушивали (Na2SO4), фильтровали и упаривали растворитель в вакууме. Остаток очищали при помощи колоночной хроматографии (силикагель; 5-10% аммиака в метаноле (7 М)/дихлорметан) с получением D6 (1,9 г, 60%) в виде твердого вещества. Смесь трет-бутилового эфира пиперидин-4-илкарбаминовой кислоты (4 г, 20 ммоль), 3-фтор-5(трифторметил)бензилбромида (4,6 г, 18,1 ммоль) и диизопропилэтиламина (4,7 мл, 27,1 ммоль) в дихлорметане (25 мл) перемешивали при комнатной температуре в течение 2 ч. По окончании этого периода добавляли трифторуксусную кислоту (32 мл) и реакционную смесь перемешивали в течение еще 2 ч. Растворитель упаривали в вакууме, затем добавляли насыщенный раствор карбоната натрия. Смесь экстрагировали дихлорметаном, отделяли органическую фазу, высушивали ее (Na2SO4), фильтровали, после чего упаривали растворитель в вакууме с получением D7 (4 г, 80%) в виде твердого вещества.(25 мл) перемешивали при комнатной температуре в течение 2 ч. По окончании этого периода в реакцию добавляли трифторуксусную кислоту (15,6 мл), затем смесь перемешивали еще 2 ч. Растворитель упаривали в вакууме, затем добавляли насыщенный раствор карбоната натрия. Смесь экстрагировали дихлорметаном, отделенные органические фазы высушивали (Na2SO4), фильтровали, после чего растворитель упаривали в вакууме с получением D8 (2,9 г, 96%) в виде твердого вещества. Смесь 6-гидрокси-4,5-диметил-2 Н-пиридазина-3-она (2,56 г, 18 ммоль) (полученного с помощью процедуры, сходной с той, что описана в WO 99/36407) с оксихлоридом фосфора (8 мл) и диизопропилэтиламином (4 мл) перемешивали при 160 С в течение 20 мин при микроволновом облучении (микроволновая печь Biotage). Затем растворитель частично упаривали в вакууме, оставшийся материал выливали в смесь холодной воды, насыщенного раствора гидрокарбоната натрия и дихлорметана. Затем смесь подщелачивали дозами гидрокарбоната натрия до тех пор, пока не переставал выделяться CO2. Органическую фазу отделяли, высушивали (Na2SO4), фильтровали и упаривали растворитель в вакууме. Остаток очищали методом колоночной хроматографии (дихлорметан/гептан от 1/1 до 10/0) с получением D9(57 вес.% в воде, 2 мл) перемешивали при 120 С в течение 10 мин при микроволновом облучении. Затем смесь выливали в насыщенный водный раствор карбоната натрия, Na2S2O3, воды и дихлорметана. Органическую фазу отделяли, фильтровали через вату, после чего упаривали растворитель в вакууме. Остаток очищали методом колоночной хроматографии (дихлорметан/гептан от 1:1 до 8:2) с получением D10 Смесь D10 (0,225 г, 0,84 ммоль) и цианида меди (0,15 г, 1,67 ммоль) в ацетонитриле (2 мл) перемешивали при 160 С в течение 20 мин, при микроволновом облучении. Затем добавляли дихлорметан и фильтровали смесь через целит. Растворитель упаривали в вакууме, после чего остаток очищали при помощи колоночной хроматографии (силикагель; дихлорметан/гептан от 1:1 до 7:3) с получением D11 К смеси 6-(пиперидин-4-иламино)пиридазин-3-карбонитрила (D3) (0,15 г, 0,7 ммоль) и трифтор-пара-толуальдегида (0,15 мл, 1,1 ммоль) в дихлорметане (2 мл) добавляли триацетоксиборгидрид натрия (0,232 г, 1,1 ммоль) и уксусную кислоту (0,041 мл). Затем реакционную смесь перемешивали при комнатной температуре в течение 18 ч. Затем добавляли насыщенный раствор гидрокарбоната натрия, отделяли органическую фазу, высушивали ее (Na2SO4), фильтровали и упаривали растворитель в вакууме. Остаток очищали при помощи ВЭЖХ. Желаемые фракции собирали и упаривали растворитель в вакууме с получением Е 7 (0,101 г, 38%) в виде твердого вещества. Смесь 6-(пиперидин-4-иламино)пиридазин-3-карбонитрила (D3) (0,150 г, 0,74 ммоль), 3 хлорбензилбромида (0,102 мл, 0,78 ммоль) и диизопропилэтиламина (0,196 мл, 1,11 ммоль) в ацетонитриле (2 мл) перемешивали при 120 С в течение 5 мин, при микроволновом облучении (микроволновая печь Biotage). Затем реакционную смесь разводили дихлорметаном и экстрагировали насыщенным раствором карбоната натрия. Органические фазы отделяли, высушивали (Na2SO4), фильтровали и упаривали растворитель в вакууме. Затем остаток очищали при помощи колоночной хроматографии (силикагель; 02,5% аммиака в метаноле (7 М)/дихлорметан). Желаемые фракции собирали, после чего упаривали в вакууме, остаток растирали в диизопропиловом эфире с получением Е 13 (0,095 г, 39%) в виде белого твердого вещества. Смесь 6-хлорпиридазин-3-карбонитрила (D4) (1,74 г, 12,46 ммоль), 1-(3,5-дифторбензил)пиперидин-4-иламина (D5) (2,35 г, 10,38 6 ммоль) и диизопропилэтиламина (2,71 мл, 15,58 ммоль) в ацетонитриле (30 мл) перемешивали при 120 С в течение 40 мин, при микроволновом облучении (микроволновая печь Milestone). Затем добавляли дихлорметан, воду и насыщенный раствор карбоната натрия. Органические фазы фильтровали через вату, упаривали в вакууме, осадок очищали при помощи колоночной хроматографии (силикагель; 0-1,5% аммиака в метаноле (7 М)/дихлорметан). Желаемые фракции собирали и упаривали растворитель в вакууме. Остаток осаждали в гептане с получением Е 15 (2,065 г,60%) в виде твердого вещества. Смесь 6-хлорпиридазин-3-карбонитрила (D4) (0,130 г, 0,931 ммоль), 1-(3-тиифторметилбензил)пиперидин-4-иламина (D6) (0,241 г, 0,931 ммоль) и диизопропилэтиламина (0,2 43 мл, 1,4 ммоль) в ацетонитриле (3 мл) перемешивали при 120 С в течение 30 мин при микроволновом облучении (микроволновая печь Biotage). Добавляли дихлорметан и воду, затем смесь промывали насыщенным раствором карбоната натрия. Органическую фазу фильтровали через вату, после чего растворитель упаривали в вакууме. Остаток очищали при помощи колоночной хроматографии (силикагель; 0-2% аммиака в метаноле (7 М)/дихлорметан) с получением Е 16 (0,215 г, 64%) в виде твердого вещества. Смесь 6-хлорпиридазин-3-карбонитрила (D4) (1,39 г, 9,95 ммоль), 1-(3-фтор-5-трифторметилбензил)пиперидин-4-иламина (D7) (2,5 г, 9,04 ммоль) и диизопропилэтиламина (2,63 мл, 14,92 ммоль) в ацетонитриле (2 мл) перемешивали при 120 С в течение 30 мин при микроволновом облучении (микроволновая печь Biotage). Затем смесь разводили дихлорметаном (50 мл) и экстрагировали насыщенным раствором карбоната натрия. Органическую фазу отделяли, высушивали (Na2SO4), фильтровали, упаривали в вакууме и очищали остаток при помощи колоночной хроматографии (силикагель; 0-2,5% аммиака в метаноле (7 М)/дихлорметан). Желаемые фракции собирали и упаривали в вакууме. Остаток осаждали из диизопропилового эфира с получением Е 17 (2,76 г, 73%) в виде твердого вещества. Смесь 6-хлорпиридазин-3-карбонитрила (D4) (1,32 г, 9,46 ммоль), 1-(3,4,5-трифторбензил)пиперидин-4-иламин (D8) (2,10 г, 8,6 ммоль) и диизопропилэтиламина (2,25 мл, 12,9 ммоль) в ацетонитриле (12 мл) перемешивали при 120 С в течение 20 мин, при микроволновом облучении (микроволновая печь Milestone). Затем добавляли дихлорметан, воду и насыщенный раствор карбоната натрия. Органические фазы фильтровали через вату, упаривали в вакууме, после чего остаток очищали при помощи колоночной хроматографии (силикагель; 0-2% аммиака в метаноле (7 М)/дихлорметан). Желаемые фракции собирали и упаривали в вакууме. Остаток осаждали из диизопропилового эфира с получением Е 18 (2,210 г, 74%) в виде твердого вещества. Смесь 6-хлор-4,5-диметилпиридазин-3-карбонитрила (D11) (0,120 г, 0,72 ммоль), 1-(3,5 дифторбензил)пиперидин-4-иламина (D5) (0,194 г, 0,86 ммоль) и диизопропилэтиламина (0,188 мл,1,08 ммоль) в ацетонитриле перемешивали при 120 С в течение 20 мин при микроволновом облучении(микроволновая печь Biotage), после чего перемешивали при 180 С еще в течение 30 мин. Затем добавляли дихлорметан, воду и насыщенный раствор карбоната натрия. Органическую фазу отделяли, фильтровали через вату и упаривали в вакууме. Остаток очищали при помощи колоночной хроматографии (силикагель; 0-1% аммиака в метаноле (7 М)/дихлорметан). Желаемые фракции собирали, после чего выпаривали растворитель в вакууме с получением Е 19 (0,108 г, 42%) в виде твердого вещества.C19H21F2N5 рассчитано 357; найдено 358 (МН+). 1 Н ЯМР (400 МГц, CDCl3)1,57 (кв.д, J=11,58, 3,63 Гц, 2 Н), 2,07 (с, 3H), 2,15 (д, J=12,65 Гц, 2 Н),2,18-2,27 (м, 2 Н), 2,41 (с, 3H), 2,85 (д, J=11,82 Гц, 2 Н), 3,49 (с, 2 Н), 4,23-4,39 (м, 1 Н), 4,46 (д, J=7,46 Гц,1 Н), 6,69 (тт, J=8,91, 2,28 Гц, 1 Н), 6,82-6,95 (м, 2 Н). Температуру плавления для многих соединений определяли в открытых капиллярных трубках на аппарате Mettler FP62. Температуры плавления были измерены в температурном градиенте от 3 до 10 С/мин. Максимальная температура составляла 300 С. Температуры плавления считывали с цифрового дисплея, они получены с экспериментальными погрешностями, обычно связанными с аналитическим методом. Следующие дополнительные примеры (Е 1-Е 6, Е 8-Е 12 и Е 14) были получены из D3 и соответствующих альдегидов или алкилирующих агентов при помощи процедур, сходных с описанными для примеров Е 7 и Е 13.- 15016654 Следующий пример (Е 20) был получен с использованием процедур, сходных с описанными для примера Е 19. Массу некоторых соединений записывали с применением LCMS (жидкостной хроматографической масс-спектрометрии). Способ использовали, как описано ниже. Измерения при помощи ВЭЖХ выполняли с использованием HP 1100 от Agilent Technologies,включающего насос (двойной или четверной) с дегазатором, автоматический пробоотборник, колоночный термостат, детектор на массиве диодов (DAD) и колонку, такую как описанная ниже в соответствующих методах. Поток из колонки отводили на MS-спектрометр. MS-детектор был снабжен электрораспылительным источником ионизации. В качестве газа для распылителя использовали азот. Температуру источника поддерживали равной 140 С. Данные получали при помощи программного обеспеченияMassLynx-Openlynx. ВЭЖХ в обращенной фазе проводилась на колонке АСЕ-С 18 (3,0 мкм, 4,630 мм) от Advanced Chromatography Technologies, со скоростью потока 1,5 мл/мин при 40 С. Были использованы следующие условия градиента: от 80% А (раствор ацетата аммония 0,5 г/л), 10% В (ацетонитрил), 10% С(метанол) до 50% В и 50% С в течение 6,5 мин, до 100% В через 7 мин и уравновешивание до начальных условий начиная с 7,5 мин до 9,0 мин. Объем впрыскивания 5 мкл. Масс-спектр высокого разрешения(времяпролетный, TOF) был получен только в режиме положительной ионизации, при сканировании от 100 до 750 в течение 0,5 с при использовании времени выдержки 0,1 с. Для режима положительной ионизации вольтаж капиллярной иглы составлял 2,5 кВ, конус вольтажа составлял 20 В. В качестве стандартного вещества для калибровки захвата масс был использован лейцин-энкефалин. К номерам примеров относятся следующие химические названия: 6-[1-(3,4-дифторбензил)пиперидин-4-иламино]пиридазин-3-карбонитрил (Е 1),6-[1-(4-фторбензил)пиперидин-4-иламино]пиридазин-3-карбонитрил (Е 2) 6-[1-(4-хлорбензил)пиперидин-4-иламино]пиридазин-3-карбонитрил (Е 3),6-[1-(3-фтор-4-метилбензил)пиперидин-4-иламино]пиридазин-3-карбонитрил (Е 4),6-[1-(3-фторбензил)пиперидин-4-иламино]пиридазин-3-карбонитрил (Е 5),6-[1-(4-метилбензил)пиперидин-4-иламино]пиридазин-3-карбонитрил (Е 6),6-[1-(4-трифторметилбензил)пиперидин-4-иламино]пиридазин-3-карбонитрил (Е 7),6-[1-(3-фтор-4-трифторметилбензил)пиперидин-4-иламино]пиридазин-3-карбонитрил (Е 8),6-[1-(4-фтор-3-трифторметилбензил)пиперидин-4-иламино]пиридазин-3-карбонитрил (Е 9),6-[1-(4-метил-3-трифторметилбензил)пиперидин-4-иламино]пиридазин-3-карбонитрил (Е 10),6-[1-(3,5-бис-трифторметилбензил)пиперидин-4-иламино]пиридазин-3-карбонитрил (E11),6-[1-(2-фтор-5-трифторметилбензил)пиперидин-4-иламино]пиридазин-3-карбонитрил (Е 12),6-[1-(3-хлорбензил)пиперидин-4-иламино]пиридазин-3-карбонитрил (Е 13),6-[1-(3-хлор-4-трифторметоксибензил)пиперидин-4-иламино]пиридазин-3-карбонитрил (Е 14),6-[1-(3,5-дифторбензил)пиперидин-4-иламино]пиридазин-3-карбонитрил (Е 15),6-[1-(3-трифторметилбензил)пиперидин-4-иламино]пиридазин-3-карбонитрил (Е 16),6-[1-(3-фтор-5-трифторметилбензил)пиперидин-4-иламино]пиридазин-3-карбонитрил (Е 17),6-[1-(3,4,5-трифторбензил)пиперидин-4-иламино]пиридазин-3-карбонитрил (Е 18),- 16016654 6-[1-(3,5-дифторбензил)пиперидин-4-иламино]-4,5-диметилпиридазин-3-карбонитрил (Е 19) и 6-[1-(3,5-дифторбензил)пиперидин-4-иламино]-4-метилпиридазин-3-карбонитрил (Е 20). Фармакология. Сродство связывания in vitro с человеческим рецептором D2L. Замороженные мембраны клеток СНО, трансфицированных человеческим рецептором допаминаD2L, размораживали, гомогенизировали в течение небольшого времени с использованием гомогенизатора Ultra-Turrax Т 25, после чего разбавляли буфером для анализа Tris-HCl, содержащим NaCl, CaCl2,MgCl2, KCl (50, 120, 2, 1 и 5 мМ соответственно, доведенные до рН 7,7 при помощи HCl) до соответствующей концентрации белка, оптимизированной для специфического или неспецифического связывания. Радиолиганд [3 Н]спиперон (NEN, специфическая активность 70 Кюри/ммоль) разводили в буфере для анализа до концентрации 2 нмоль/л. Подготовленный радиолиганд (50 мкл) вместе с 50 мкл контроля или 10% ДМСО, или Бутакламола (10-6 моль/л до конечной концентрации), или интересующего соединения, затем инкубировали (30 мин, 37 С) с 400 мкл подготовленного раствора мембран. Связанную с мембраной активность отфильтровывали при помощи сборщика Packard Filtermate на GF/B Unifilterplates и промывали ледяным буфером Tris-HCl (50 мМ; рН 7,7; 60,5 мл). Фильтрам позволяли высохнуть, затем добавляли сцинтилляционную жидкость и учитывали на сцинтилляционном счетчике Topcount. Процент специфических связей и кривые конкурентного связывания были вычислены с использованием программного обеспечения S-Plus (Insightful). Быстрая диссоциация. Соединения, демонстрирующие IC50 меньше чем 10 мкМ, исследовали в непрямом анализе, адаптированном на основании метода, опубликованного Josee E. Leysen and Walter Gommeren, Journal of Receptor Research, 1984, 4(7), 817-845, для оценки скорости их диссоциации. Соединения в концентрации, в 4 раза большей, чем IC50, были сначала проинкубированы в течение 1 ч с мембранами человеческих клеток-рецепторов D2L в объеме 2 мл при 25 С, после чего профильтрованы с отсосом через стекловолоконный фильтр с использованием 40-луночного multividor. Сразу после этого вакуум снимали. На фильтр наносили 0,4 мл заранее подогретого буфера (25 С), содержащего 1 нМ [3 Н]спиперона и выдерживали 5 мин. Инкубацию останавливали путем включения вакуума и немедленного смачивания 25 мл ледяного буфера. Связанную с фильтром радиоактивность измеряли при помощи жидкостного сцинтилляционного спектрометра. Принцип исследования основан на допущении, что чем быстрее соединение диссоциирует от рецептора D2, тем быстрее с рецептором D2 связывается [3 Н]спиперон. Например, когда рецепторыD2 инкубируют с клозапином в концентрации 1850 нМ (4IC50), связывание [3 Н]спиперона эквивалентно 60-70% от общей способности его связывания (измеренной в отсутствие препарата) после 5 мин инкубации на фильтре. При инкубации с другими антипсихотическими средствами связывание [3 Н]спиперона изменяется от 20 до 50%. Поскольку клозапин использовался при каждом исследовании, исследуемые соединения считали быстро диссоциирующими, если они диссоциировали с той же скоростью, что и клозапин, или быстрее. Все соединения, протестированные до настоящего времени, имели скорость диссоциации выше, чем у клозапина, т.е. 50%. Исследования подавления вызванного апоморфином возбуждения на крысах. Самцам крыс Wiga Wistar (180-280 г) вводили исследуемое вещество (sc: подкожно; ро: перорально;n=3 на дозу; дозы=0,16, 0,63 и 2,5 мг/кг) или растворитель, после чего через 30 мин подвергали их действию апоморфина (1,0 мг/кг, в/в). Действие исследуемого вещества на изменения поведения оценивалось в соответствии с критерием "все или ничего" на основании распределения результатов в большой серии контрольных данных, полученных на обработанных предварительно растворителем крысах. Вызванные апоморфином (1,0 мг/кг, в/в) возбуждение, стереотипию (навязчивое принюхивание,облизывание, жевание) учитывали каждые 5 мин в течение первого часа после инъекции апоморфина. В системе учета выделяли (3) резко выраженное, (2) среднее, (1) незначительное и (0) отсутствующее проявление. Критерии вызванного препаратом подавления возбуждения: менее 6 значений 3 (0,16% ложно положительных; n=2966), менее чем 6 значений 2 (0,0% ложно положительных) или менее чем 7 значений 1 (0,0% ложно положительных). В таблице ниже приведены наименьшие активные дозы, при которых 3 из 3 исследованных крыс соответствовали критериям индуцированного препаратом ингибирования возбуждения. или его фармацевтически приемлемая соль, или сольват, или его стереоизомерная форма, гдеR1 является фенилом; фенилом, замещенным 1, 2 или 3 заместителями, каждый из которых независимо выбран из группы, состоящей из водорода, галогена, C1-4 алкила, перфтор-C1-4 алкила и трифторметокси;R2 является водородом; каждый из R3 и R4 независимо является водородом, C1-4 алкилом или галогеном. 2. Соединение по п.1, где R, R3 и R4 являются водородом. 3. Соединение по п.1, где R2 является водородом. 4. Соединение по п.1, где R1 является 3,5-дифторфенилом, 3,4,5-трифторфенилом,3-трифторметилфенилом, 3-фтор-5-трифторметилфенилом или 3-фтор-4-метилфенилом. 5. Соединение по п.1, где соединение выбрано из группы, состоящей из 6-[1-(3,5-дифторбензил)пиперидин-4-иламино]пиридазин-3-карбонитрила,6-[1-(3-трифторметилбензил)пиперидин-4-иламино]пиридазин-3-карбонитрила,6-[1-(3-фтор-5-трифторметилбензил)пиперидин-4-иламино]пиридазин-3-карбонитрила,6-[1-(3,4,5-трифторбензил)пиперидин-4-иламино]пиридазин-3-карбонитрила и 6-[1-(3-фтор-4-метилбензил)пиперидин-4-иламино]пиридазин-3-карбонитрила. 6. Фармацевтическая композиция, содержащая терапевтически эффективное количество соединения по п.1. 7. Применение соединения по п.1 в качестве лекарственного средства. 8. Применение соединения по п.1 в качестве антипсихотического средства. 9. Применение соединения по п.1 в качестве лекарственного средства для лечения или предупреждения шизофрении, шизофреноформных расстройств, шизоаффективных расстройств, бредовых расстройств, кратковременного психотического расстройства, индуцированного психотического расстройства, психотических расстройств, вызванных общим соматическим состоянием, вызванного употреблением веществ психотического расстройства, психотических расстройств без других указаний; психозов,связанных с сумасшествием; большого депрессивного расстройства, дистимического расстройства,предменструального дисфорического расстройства, депрессивного расстройства без других указаний; биполярного расстройства I типа, биполярного расстройства II типа, циклотимического расстройства,биполярного расстройства без других указаний, расстройств настроения, вызванных общим соматическим состоянием, расстройства настроения, вызванного употреблением веществ, расстройства настроения без других указаний; генерализованного тревожного расстройства, обсессивно-компульсивного расстройства, панического расстройства, расстройств, связанных с острым стрессом, расстройств, связанных с посттравматическим стрессом; врожденного слабоумия; аутистических расстройств; расстройств,связанных с недостатком внимания, расстройства, связанного с недостатком внимания и гиперактивностью, дизраптивных расстройств поведения; личностных нарушений параноидального типа, личностных нарушений шизоидного типа, шизотипических расстройств личности; судорожных расстройств, синдрома Туретта; зависимости от веществ; злоупотребления веществами; синдрома отмены веществ; трихотилломании. 10. Способ получения соединения формулы (I) где R, R1-R4 описаны в п.1,включающий осуществление реакции промежуточного соединения формулы (II) где R2-R4 описаны в п.1,с промежуточным соединением формулы 1R1-C(=O)-R, где R и R описаны в п.1,в присутствии восстанавливающего агента и кислотного катализатора, в инертном реакционном растворителе. 11. Способ получения соединения формулы (I) где R, R1-R4 описаны в п.1,включающий осуществление реакции промежуточного соединения формулы (VII) где R3 и R4 описаны в п.1,с промежуточным соединением формулы (VIII)
МПК / Метки
МПК: C07D 401/12, A61P 25/18, A61K 31/501
Метки: применение, качестве, антагонистов, диссоциирующих, быстро, пиперидиниламинопиридазины, рецептора, допамина
Код ссылки
<a href="https://eas.patents.su/21-16654-piperidinilaminopiridaziny-i-ih-primenenie-v-kachestve-bystro-dissociiruyushhih-antagonistov-receptora-dopamina-2.html" rel="bookmark" title="База патентов Евразийского Союза">Пиперидиниламинопиридазины и их применение в качестве быстро диссоциирующих антагонистов рецептора допамина 2</a>
Предыдущий патент: Способы и композиции для ингибирования ангиогенеза
Следующий патент: Спускной клапан для смонтированной колесной системы
Случайный патент: Способ получения катализатора окисления и катализаторы, полученные данным способом