Хелатные соединения металлов с макроциклическими полиаминокарбоновыми соединениями и их использование для диагностических исследований
Номер патента: 1387
Опубликовано: 26.02.2001
Авторы: Руссо Оливье, Мейер Доминик, Порт Марк, Симоно Кристиан
Формула / Реферат
1. Хелатное соединение катиона парамагнитного металла и соединения формулы I
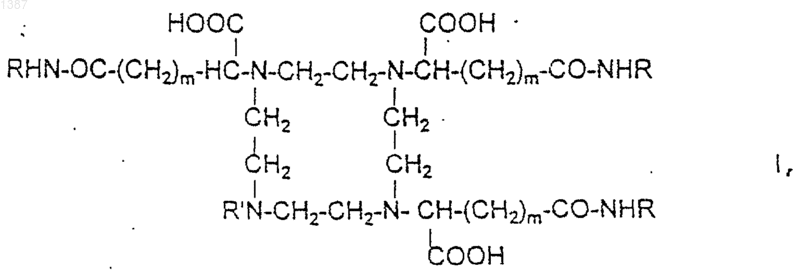
где m=1 или 2,
R' является Н, (C1-C4)алкильным или гидроксиалкильным радикалом, СН2-СООН, CH2-CONZ1Z2, причем Z1 и Z2 являются независимо друг от друга Н или (C1-C4)алкильным радикалом, возможно гидроксилированным,
или R¢ является радикалом НООС-СН-(CH2)m-CONHR,
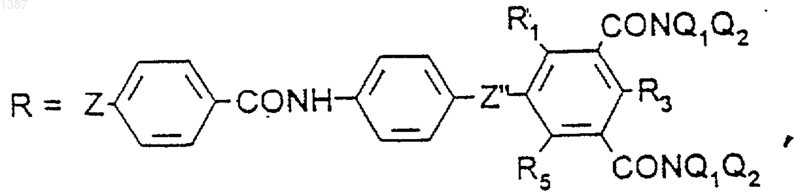
R является радикалом
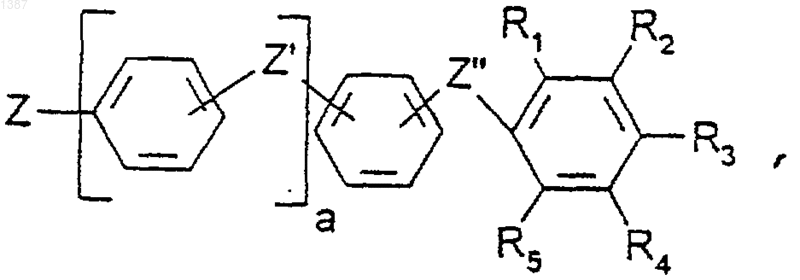
где а=1 или 2,
Z является связью, СН2, СН2 CONH или (CH2)2NHCO,
Z' является связью, О, S, NQ, СН2, СО, CO-NQ, NQ-CO, NQ-CO-NQ, CO-NQ-CH1-CONQ,
Z" является CO-NQ, NQ-CO или CO-NQ-CH2-CO-NQ, NQ-CO-CH2-NQ-CO,
где Q является Н или (C1-C4)алкильным радикалом, возможно гидроксилированным,
R1, R2, R3, R4, R5 независимо друг от друга выбирают из Н, Вr, Cl, I, CO-NQ1Q2
или N(Q1)-CO-Q2, a Q1 и Q2, одинаковые или разные, выбирают из (С2-С6)алкильных групп, возможно гидроксилированных и в которых может быть включен атом кислорода, таким образом, что Q1 и Q2 содержат вместе от 4 до 10 ОН-групп, при этом, по меньшей мере, 1, но не более 2 радикалов R1, R2, R3, R4, R5 являются амидогруппами,
и его фармакологически приемлемые соли с неорганическими или органическими основаниями.
2. Хелатное соединение катиона парамагнитного металла и соединения формулы I и его соли по п.1,
где m=2,
R' является 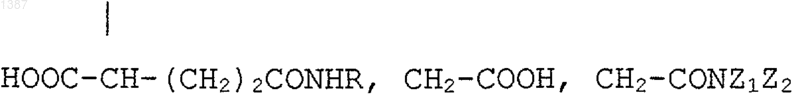
а=1,
Z является связью, СН2 или CH2CONH,
Z' является CONH, NHCO, CONH-CH2-CONH или NHCONH,
Z" является CONH, или CONH-CH2-CONH, тогда R2=R4=CONQ1Q2 или R3=CONQ1Q2, а R1, R2, R4, R5 являются Н, Вr, Cl или I, или
Z" является NHCO, тогда R2=R4=N(Q1)COQ2, а R1, R3 и R5 являются Н, Вr, I или Cl, или R3=N(Q1)COQ2, а R1, R2, R4, R5 являются Н, Вr, Cl или I.
3. Хелатное соединение катиона парамагнитного металла и соединения формулы I и его соли по п.2,
где R' является НООС-СН-(СН2)2CONHR или CH2-COOH,
Z' является CONH, NHCONH или CONH-CH2-CONH,
Z" является CONH или CONH-CH2-CONH,
R1, R3 и R5 являются все три Вr или I,
R2 и R4 являются CONQ1Q2, где Q1 и Q2 выбирают из гидроксилированных (С2-С6)алкильных групп, содержащих вместе 6-10 ОН-групп или от 4 до 8 ОН-групп, если Q1 и/или Q2 прерваны атомом кислорода.
4. Хелатное соединение катиона парамагнитного металла и соединения формулы I и его соли по п.3, где R1 является 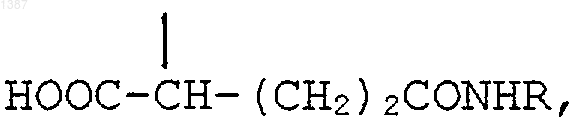
Z является СН2 или CH2CONH,
Z' является CONH или NHCONH.
5. Хелатное соединение катиона парамагнитного металла и соединения формулы I и его соли по п.4, где R' является СН2СО2Н или 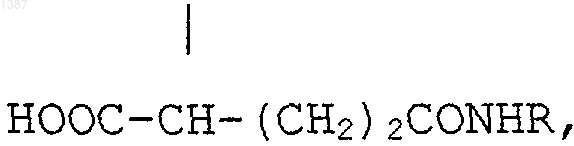
Z' и Z" являются CONH.
6. Хелатное соединение катиона парамагнитного металла и соединения формулы I и его соли по п.1, где m=2,
R' является 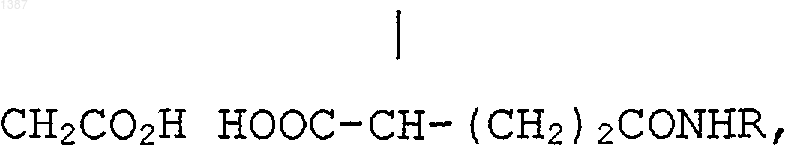
а=2,
Z является СН2 или CH2CONH,
Z' является CONH или NHCO,
Z" является CONH или CONH-CH2-CONH,
R1, R3 и R5 являются все три Вr или I,
тогда R2 и R4 являются оба CONQ1Q2,
или R3 является CONQ1Q2, тогда R1, R2, R4, R5 являются Н, Вr или I.
7. Хелатное соединение катиона парамагнитного металла и соединения формулы I и его соли по п.1, где m=1,
R' является 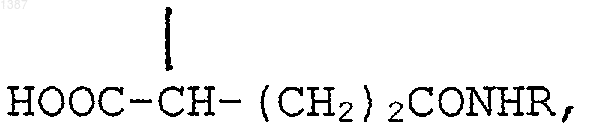
а=1,
Z является CH2 или CH2CONH,
Z' является CONH,
Z" является CONH или CONH-CH2-CONH,
R1, R3 и R5 являются Вr,
R2 и R4 являются CONQ1Q2, где Q1 и Q2 - гидроксилированные (C2-C6)алкильные группы, содержащие вместе 6-10 ОН-групп.
8. Хелатное соединение по одному из пп.1-7, где катионом металла является Gd3+.
9. Хелатное соединение гадолиния и его соли формулы I по п.1,
где m=2,
R1 является 
а R является
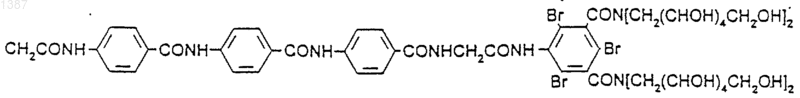
10. Хелатное соединение гадолинияи его соли формулы I по п.1,
где m=2,
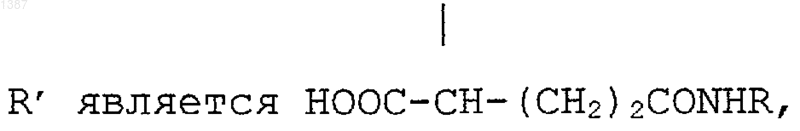
где Z" является CONH-CH2CONH, a Q1 и Q2 являются СН2(СНОН)4СН2OН, тогда или Z является СН2, a R1, R3 и R5 являются I, или Z является CH2CONH, a R1, R3 и R5 являются Вr,
или Z" является CONH, Z является CH2 или CH2CONH, a R1, R3, R5 являются Вr, Q1 является СН2(СНОН)4СН2OН, a Q2 является CH2CHOH-СН2ОН или СН2(СНОН)4СН2ОН.
11. Контрастный продукт для диагностического магнитно-резонансного исследования, содержащий эффективное количество хелатного соединения по одному из пп.1-10, в фармацевтически подходящем носителе.
12. Продукт для сцинтиграфии, содержащий меченное радиоактивным изотопом хелатное соединение катиона металла и соединения формулы
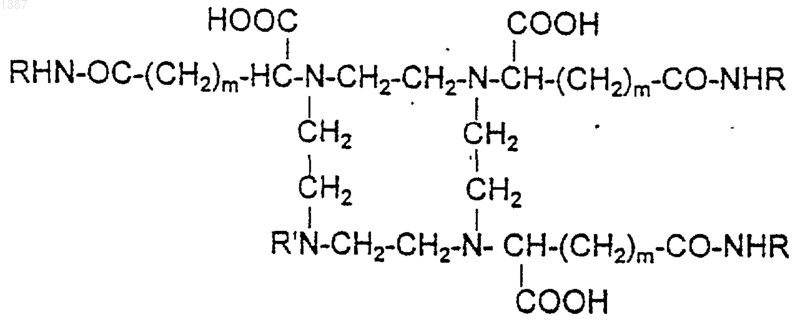
где m=1 или 2,
R' является H, (C1-C4)алкильным или гидроксиалкильным радикалом, СН2-СООН или CH2-CONZ1Z2, причем Z1 и Z2 являются независимо друг от друга Н или (C1-C4)алкильным радикалом, возможно гидроксилированным,
или R' является радикалом НООС-СН-(CH2)m-CONHR,
R является радикалом
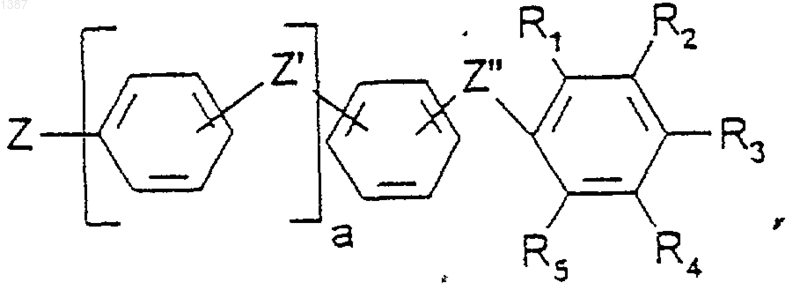
где а=1 или 2,
Z является связью, СН2, CH2 CONH или (CH2)2NHCO,
Z' является связью, О, S, NQ, CH2, СО, CO-NQ, NQ-CO, NQ-CO-NQ, CO-NQ-CH2-CONQ,
Z" является CO-NQ, NQ-CO или CO-NQ-CH2-CO-NQ, NQ-CO-CH2-NQ-CO, где Q является Н или (C1-C4)алкильным радикалом, возможно гидроксилированным,
R1, R2, R3, R4, R5 независимо друг от друур выбирают из Н, Вr, Cl, I, CO-NQ1Q2 или N(Q1)-CO-Q2, a Q1 и Q2, одинаковые или разные, выбирают из (С2-С6)алкильных групп, возможно гидроксилированных, в которые может быть включен атом кислорода, таким образом, что Q1 и Q2 содержат вместе от 4 до 10 ОН-групп, при этом, по меньшей мере, 1, но не более 2 радикалов R1, R2, R3, R4, R5 являются амидогруппами,
и его фармакологически приемлемые соли с неорганическими или органическими основаниями.
Текст
1 Настоящее изобретение касается хелатных соединений, образованных макроциклическими полиаминокарбоновыми кислотами и катионами металлов, а также их использования для диагностических исследований, в частности, для магнитно-резонансного исследования (МРИ) для магнитных катионов. Показатели релаксации r1 и r2, особенно первый, определяют магнитную эффективность такого хелатного соединения и позволяют оценить его применимость в качестве контрастного вещества. Для продуктов в настоящее время r1 не превышает 6 мМ-1c-1 (при 20 МГц и 37 С),независимо от того, являются ли хелатные соединения линейными (гадопентетат или ДТПА и гадоверсетамид) или макроциклическими (гадотерат или ДОТА и гадотеридол). Кроме того,эти соединения при внутривенном введении быстро диффундируют из области сосудов в интерстициальное внеклеточное пространство,и в настоящее время на рынке нет пока продукта, который бы оставался в достаточной мере в сосудах для обеспечения качественной оценки тканевой перфузии, капиллярной проницаемости или объема крови. Макромолекулярные производные, полученные в результате прививки классического хелатного соединения на биосовместимый полимер, полученный, например, путем фиксации гадопентетата на полиэтиленгликоле или полилизине, или гадопентетата и гадотерата на полисахариде, описанные уже более 10 лет назад и протестированные на животных, пока еще не разработаны для человека. Уже предложена прививка классических хелатных соединений (ДТПА или ДОТА) на разветвленных полимерах одинаковой молекулярной массы, так называемых "каскадных" или дендримеров, образованных pазличными повторяющимися звеньями, как описано, например, в ЕР А 430863 или ЕР А 607222. Было отмечено,что показатели релаксации этих продуктов высоки и демонстрируют некоторую сосудистую инерционность (последействие), однако, эти результаты ограничены, т.к., например, полиамины, имеющие 24 или 48 молекул гадопентетата, описанные в ЕР А 430863, несмотря на свои размеры, имеют показатель релаксации r1 порядка 13 мМ-1 с-1 при 4,8 мМ-1 с-1 только для одного гадопентетата; кроме того, оказалось сложно во время синтеза изолировать только одно соединение, а именно добиться замещения всех концевых групп такого полиамина, даже если можно получить такое соединение с равномерной молекулярной массой, что исключило бы дисперсность физико-химических и фармако-кинетических свойств компонентов вводимой дозы, известный недостаток производных классических полимеров, который ограничил их разработку. Из списка недавних работ, касающихся получения молекул с высокими показателями 2 релаксации, одинаковой молекулярной массой и содержащих только одну комплексообразующую группу, можно привести ЕР А 661279 иWO 97/01359, в которых описывается введение в известные молекулярные структуры, по меньшей мере, 3 гидрофильных боковых ветвей массой выше 200 на боковых заместителях атомовдоноров азота, которые несут другие координационные группы, независимо от того, являются ли они кислотными группами или производными; в частности, было указано, что комплексы гадолиния производных соединений гадотерата формулы имеют показатель релаксации r120 мМ-1 с-1 при 20 МГц и 37 С. В качестве соединений, имеющих высокую релаксацию и некоторую сосудистую инерционность, можно также привести соединения,описанные в WO 96/23526 и имеющие существенно отличную от предыдущих соединений структуру, одно из которых, например, MS 325 обратимо фиксируется на альбумине плазмы таким образом, что его релаксация r1 в этой среде практически равняется 10-кратной релаксации гадопентетата, производным которого он является, с периодом полужизни в 4 раза больше и объемом распределения в 2,5 раз меньше, в опытах на кроликах (Acad. Radiol). S 356 - 358(1996). В отличие от MS 325 и его гомологов,комплексы парамагнитных металлов по настоящему изобретению имеют высокие показатели релаксации даже в воде, где r1 выше 30 мМ-1 с-1(20 МГц, 37 С); кроме того, при том, что они практически не фиксируются на альбумине плазмы, они четко локализуются в сосудах и выводятся, главным образом, почками, таким образом, они могут с успехом использоваться МРИ в качестве контрастных продуктов, индикаторов системы кровообращения. 3 В первую очередь, изобретение касается хелатных соединений ионов парамагнитных металлов, или радиоактивных металлов, полиаминокарбоновых макроциклов формулыR1, R2, R3, R4, R5, независимо друг от друга, выбирают из Н, Br, Cl, I, CO-NQ1Q2 илиN(Q1)-CO-Q2, a Q1 и Q2, одинаковые или разные,выбирают из (С 2-С 6)алкильных групп, возможно гидроксилированных, и в которые включен атом кислорода таким образом, что Q1 и Q2 содержат вместе от 4 до 10 ОН-групп, при этом, по крайней мере 1, но не более 2 радикалов R1, R2, R3,R4, R5 являются амидогруппами. Комплексы с катионами металлов в хелатных соединениях по изобретению выбирают из парамагнитных катионов, обычно используемых для МРИ, в частности, трехвалентных катионов,таких, как Fe3+, Cr3+, Eu3+, Gd3+, Tb3+, особенноGd3+, или для сцинтиграфии - из катионов радиоактивных элементов, таких как 99mTc или 111In. Неорганические основания, из которых получают физиологически приемлемые соли, с возможной свободной кислотной функцией,металлического комплекса соединения формулы I предпочтительно выбирают из гидроокисей и карбонатов щелочных металлов (К+, Na+) или щелочноземельных металлов (Са, Мg), а органические основания выбирают из аминов, таких как аминоэтанол, трометамин или N 001387CONQ1Q2, a R1, R2, R4, R5 являются, независимо друг от друга, Н, Br, Cl или I, или R2 = R4 =CONQ1Q2, в этом случае R1, R3, R5 являются,независимо друг от друга, Н, Br, Cl или I, или Z" является NHCO, где R3 = N(Q1)COQ2, a R1, R2,R4, R5 являются, независимо друг от друга, Н,Br, Cl или I, или R2 = R4 = N(Q1)COQ2, в этом случае R1, R3, R5 являются, независимо друг от друга, Н, Br, Cl или I. Из этих соединений предпочтительны соединения,гдеR2 = R4 = CONQ1Q2, где Q1 и Q2 являются гидроксилированными (С 2-С 6)алкильными группами,содержащими вместе 6 - 10 ОН-групп или от 4 до 8 ОН-групп, если Q1 и/или Q2 прерваны атомом кислорода. Во втором аспекте изобретение касается способа получения хелатных соединений металлов с соединениями формулы I, который заключается в том, что проводят реакцию хелатного соединения II, катиона металла М 3+ и соединения формулы где буквы имеют те же значения, что и в формуле I, в присутствии агента связи, в частности того, который используется в синтезе пептидов,адаптированного для реакционной среды, водной или органической, в которой растворяют,по крайней мере, частично, соединения формулы II и III. В этих условиях защищенные карбоксильные группы, связанные с атомами углерода, находящимися в положениик атомам азота соединения II, в реакцию не вступают. Кроме того, изобретение касается контрастных продуктов для диагностики у человека или животных с помощью сцинтиграфии, когда хелатное соединение помечено радиоизотопами,или с помощью магнитно-резонансного исследования, когда хелатное соединение содержит парамагнитный ион, возможно, в виде соли катиона неорганического или органического со 5 единения, в фармацевтически приемлемом носителе в сочетании с совместимыми эксципиентами. Наконец, изобретение касается методик диагностики для человека или животных, которые заключаются в том, что пациенту вводят разовую эффективную дозу композиции по изобретению и на исследуемую ткань или зону наводят магнитное поле, достаточное для выявления магнитного резонанса протона, или проводят сцинтиграфию, когда хелатное соединение содержит радиоактивный элемент. Хелатные формы соединений формулы I,которые содержат 4 одинаковых заместителя на атомах азота центрального макроцикла, 1,4,7,10 тетраазациклододекан, или циклен, получают,используя меньшее число стадий, чем в случае соединений, где R' является Н, СН 2 СООН,CH2CONZ1Z2, или алкилом, или гидроксиалкилом в C1-C4, таким как СН 3, СН 2 СН 2 ОН или СН 2-СНОН-CH2OH, т.к. нужно временно выборочно блокировать один из 4 атомов азота циклена с помощью подвижного радикала или предварительно осуществить монозамещение макроцикла радикалом R'. Радикалы R соединений изобретения содержат 3 или 4 фенильных ядра, из которых самый удаленный от макроцикла замещен одной или несколькими гидрофильными группами, которые оказывают влияние на растворимость в воде и на биосовместимость хелатного соединения. Из этих гидрофильных групп предпочтительны группы третичных амидов, заместителями которых являются гидроксилированные (C2-C6)алкильные группы, возможно, прерванные атомом кислорода, и особенно, производные линейных аминоспиртов HNQ1Q2, гдеQ1 и Q2, независимо друг от друга, являются СН 2(СНОН)n(CH2 ОСН 2)r(СНОН)pСН 2 ОН,если в Q1 и Q2 r = 0, тогда р = 0, n = 0 - 4,Q1 и Q2 вместе содержат 5 - 10 ОН-групп, что соответствует, в частности, для HNQ1Q2, соединениямn = 4, р = r = 0 , или если n = 3, р = r = 0, как описано в ЕР А 558395; либо реакцией сахара с бензиламином с последующим введением второго гидроксилированного заместителя воздействием соответствующего галогенида или сульфоната, затем удалением бензила каталитической гидрогенизацией. Когда Q1 и/или Q2 содержат в цепи атом кислорода, аминоспирты, где n = p = 0, получают из 2-аминоэтоксиэтанола с помощью реакции с соответствующим эпоксидом или галогенидом гидроксилированного алкила, или же гидроксилированным алифатическим альдегидом, таким как моносахарид, с образованием имина, который затем восстанавливают каталитическим или химическим способом. Когда n = 1, аминоспирты получают воздействием эпоксида на соответствующий первичный аминоспирт,при этом эпоксиды получают путем окисления соответствующих этиленовых производных,перкислотой или пероксиимидокислотой, как описано в J. Org. Chem., 26, 659 - 663 (1961) и 48, 888 - 890 (1983). Наличие атомов галогена рядом с амидогруппами в фенильном ядре представляет преимущество, и предпочтение отдают группам R,где R1 = R3 = R5 = Br или I, a R2 = R4 = CO-NQ1Q2,в частности, из-за их устойчивости. Можно образовать мостик Z" между двумя фенильными ядрами до или после мостиков Z'. Например, соединение может быть получено, если Z является связью,из дифенильных производных V или их сложных эфиров и если r = 1 в Q1 и/или Q2, n и р равны, независимо друг от друга, 0 или 1, а Q1 и Q2 вместе содержат 4 - 8 ОН-групп, что соответствует, в частности, для NHQ1Q2, соединениям: Эти аминоспирты-предшественники могут быть куплены или получены или из соответствующих первичных аминоспиртов, например, реакцией с сахаром и восстановлением, как описано в ЕР А 675105, если где Z' имеет то же значение, что и в формуле I. Соединение V, где Z' = 0, описано в(1966); где Z' является связью, - в Synth. Comm.,24(22), 3307 - 3313 (1994); где Z' является S,описано в II Farmaco, 44(7-8), 683 - 684 (1989). Другие соединения V могут быть получены аналогичными способами, например, если Z' являетсяO2NC6H4NCO с H2NC6H4COOH в безводной среде, или если Z' является NHCO или CONH,реакцией хлорида кислоты ароматического ряда с соответствующим анилином в апротонном 7 растворителе, таком как СН 2 Сl2, С 6 Н 5 СН 3,СН 3 СОN(СН 3)2, или воздействием кислоты ароматического ряда на анилин в присутствии хлорида сульфокислоты, триэтиламина и диметиламинопиридина, как описано в Synth. Communications, 25(18), 2877 - 2881 (1995). Восстановление NO2-группы до NH2 может быть осуществлено известными методами с помощью водорода в присутствии катализатора или химическим путем. Если Z в формуле IV является CH2-CONH,проводят реакцию между активированным глицином с защищенной NН 2-груплой и соединением IV, где Z является связью, или анилином,содержащим группу-предшественник Z', возможно, защищенную. Глицин защищен, например, в виде карбамата, в частности, тбутилкарбамата (Synthesis, 48, 1986) и бензилкарбамата (Chem. Ber., 65, 1192 (1932, в виде фталимида (Tetrahedron Letters 25, 20, 2093 2096 (1984, с помощью бензила (Bull. Soc.- 349, T. W. Greene (John WileySons Inc Удаление защитной группы NH2, фиксированной на Z, как правило, осуществляют только на стадии соединения III. Классически фталимидогруппу удаляют воздействием гидразина, а бензилоксикарбонильную или бензильную группу - каталитической гидрогенацией. Когда Z = CH2 в соединении IV, a Z' =NH2-группа защищена в виде карбамата или имида, как описано в J. Org. Chem., 43, 2320 2325 (1978) или в Rec. Trav. Chim. Pays-Bas, 79,688 (1960), с защищенной бензойной кислотой,соответственно замещенной. Если Z является (CH2)2NHCO, соединениеIII может быть получено воздействием избытка этилендиамина на соответствующий сложный эфир бензойной кислоты, содержащий цепочку(Z'-фенил)а -Z"-замещенный фенил, или содержащий только группу-предшественник Z', возможно, защищенную. Кроме того, если а = 2 можно провести реакцию между соединением IV, возможно, с защищенной аминогруппой, и аминобензойной кислотой, возможно, с замещенной кислотной функцией, и получить соединения IV, где второй Z' является CONH формулы 8 где R1, R2, R3, R4, R5 являются Н, галогеном, CONQ1Q2, как в формуле I, или возможно защищены, a R" является CO-CH2-NH2 или Н, в органическом или водном растворе, действуют соединениями IV или IV, в виде хлорида кислоты,или в присутствии связующего агента, типа таких, как используются в синтезе пептидов и,например, хлороформиата, сульфохлорида или алифатического карбодиимида, возможно, несущего аминогруппы или группу четвертичного аммония, облегчающего растворение. Амид формулы VI, где R" = H, получают методами, известными специалистам, из соответствующей аминокислоты ароматического ряда, возможно галогенированной, где каждая карбоксильная группа активирована в виде хлорида кислоты или смешанного ангидрида, или из нитрокислоты ароматического ряда, которую амидируют перед восстановлением NO2-группы. Соединения VI, где R1 = R3 = R5 = Br или I,a R2 и R4 = CO-NQ1Q2, где Q1 =CH2(CHOH)4CH2 ОH, a Q2 = CH2CH2 ОH или СН 2(СНОН)1-3-СН 2 ОН, а R" = CO-CH2-NH2,описаны в WO 97/01359. Другие галогенированные или негалогенированные производные, в частности, такие, где в цепи Q1 и Q2 включен атом кислорода, могут быть получены аналогичным способом из соответствующих аминоспиртов. Если Z является связью, предпочтительно осуществляют реакцию взаимодействия нитросоединения, такого как соединение V, с анилином VI перед восстановлением. При необходимости можно осуществить реакцию между соединениями IV или IV' и предшественником соединения VI, несущим СООН-группу, возможно защищенную в виде сложного эфира, вместо CO-NQ1Q2-группы,чтобы получить затем моно- или диамид, или реакцию между соединением где Z'1 и Z'2 реагируют с образованием Z'. Для получения соединения III, где R3 илиR2 и R4 являются N(Q1)CO-Q2, a Z" = NH-CO или NH-CO-CH2-NH-CO, можно осуществить реакцию между бензойной кислотой формулы Затем на соответственно замещенное концевое фенильное ядро формулы где гидроксилы N(Q1)COQ2-группы могут быть защищены, и амином где R" является Н или COCH2-NH2, перед восстановлением нитрогруппы и получить соединение III, где Z является связью. Среди соединений формулы V можно привести соединения,полученные из СН 2(ОСОСН 3)СН(ОСОСН 3)4 СОСl, описанного в Org. Synth., 41, 79 - 82 (1961), и соответствующих аминобензойных кислот, или соединение, где R1 = R3 = R5 = I, a R2 = R4 = описаннoму в ЕР 357467. В амидные группы Z' и Z" Q может быть введен обычным способом путем воздействия соответствующего галогенида, в присутствии основания, на соединение, где Q = H, предпочтительно на стадиях промежуточных соединений. Реакция между соединениями формулы III и солями хелатных соединений формулы II осуществляется предпочтительно в водной среде, при необходимости в присутствии апротонного полярного гомогенизатора, такого как диоксан или тетрагидрофуран, в присутствии растворимого карбодиимида, такого как носители аминогруппы, описанные в J. Org. Chem., 21,439 - 441 (1956) и 26, 2525 - 2528 (1961), или US 3135748, или группы четвертичного аммония вOrg. Synth., V, 555 - 558, где описано производное 1-этил-3-(3-диметиламино)пропил карбодиимида (EDC1) или его аналог, 1-циклогексил 3-(2-морфолинэтил)карбодиимид мето-п-толилсульфонат. Такая реакция может быть также осуществлена в присутствии N-гидроксисульфосукцинимида, как описано в BioconjugateLetters, 30, 1927 - 1930 (1989). Другой способ заключается в образовании активированного промежуточного сложного эфира путем реакции, например, N-гидроксисульфосукцинимида (NHS) или гидроксибензотриазола (НОВТ), в присутствии карбодиимида, такого как EDCl, с хелатным соединением формулы II, возможно, солюбилизированным путем солеобразования с катионом неорганического вещества, например, аммония или натрия. В присутствии 2-этокси-1-этоксикарбонил 1,2-дигидрохинолина (EEDQ) реакцию можно осуществлять в водно-спиртовой среде. Соединение формулы II', где m = 1, может быть получено из циклена, который подвергают реакции взаимодействия со сложным диэфиром ацетилендикарбоновой кислоты с получением энамина, который восстанавливают обычным способом, каталитическим или химическим, с 10 последующим гидролизом сложноэфирных функций. Для сложного бензилового эфира на первой стадии предпочтительно осуществление химического восстановления энаминов, например, воздействием цианоборгидрида, с последующим дебензилированием с помощью водорода в присутствии катализатора. Хелатное соединение формулы II, где m = 2, a 4 заместителя атомов азота являются одинаковыми, а М 3+ представляет собой Gd3+, является известным соединением, описанным, в частности, в ЕР А 661279. Хелатное соединение формулы II, где m = 1, получают теми же способами. Соединения формулы II, где М 3+ является другим катионом металла, получают аналогичным способом, путем реакции соли металла, в частности, хлорида или окиси металла с водным раствором соли лиганда, как описано в US 5554748 и в указанных в нем источниках, или вHelv. Chim. Acta, 69, 2068 - 2074 (1986), или путем катионообменной реакции, если относительная устойчивость хелатных соединений это позволяет, в частности, ионообменной смолой. Для хелатных соединений с радиоактивным элементом радиоизотопный обмен может быть осуществлен путем нагрева хелатного соединения с неорганической солью радиоактивного металла в сверхчистой воде и удаления не образовавших комплексы катионов путем пропускания через комплексообразующую смолу. Катион металла может быть высвобожден из хелатного соединения другим комплексообразующим агентом, взятым в избытке, предпочтительно образующим нерастворимое хелатное соединение Gd, таким как щавелевая кислота, с получением чистого соединения формулы II, до образования комплекса другого катиона металла. Соединения формулы II', где m = 2, R' является водородом, возможно гидроксилированным алкилом, СН 2 СООН и CH2CONZ1Z2, могут быть получены из циклена, монозамещенного радикалом R' или удалимой защитной группой,причем введение R' осуществляется после триалкилирования Из способов монозамещения можно привести реакцию моноалкилирования, улучшенную выбором растворителя, описанную в J. Org. Chem.,58, 3869 - 3876 (1993), реакцию с комплексообразованием с 3 из атомов азота с участием производных бора или фосфора, описанную, соответственно, в Tetrahedron Letters, 32(5), 639 - 641(1991), или реакцию с образованием промежуточного ортоамида, описанную в US 5410043. В случае, когда R' не является водородом, предпочтительно ввести сначала R' вместо непосредственного осуществления триалкилирования циклена реактивным производным причем образованные одновременно диалкилированные и тетраалкилированные производные не могут быть удалены простыми операциями. Методы очистки различных промежуточных соединений синтеза и конечного продукта являются классическими, но, разумеется, должны быть адаптированы с учетом химической природы соединения, его молекулярной массы,растворимости и вязкости его растворов. Могут быть применены методы химического (избирательное растворение, кристаллизация) или физического разделения фильтрацией на мембране или обработкой абсорбентом, в суспензии или на колонке. В частности, для растворимых в водной среде соединений формулы III очистка может осуществляться пропусканием через анионообменные или катионообменные смолы или ультрафильтрацией, диафильтрацией или обратным осмосом на соответствующей мембране для удаления из элюата молекул небольшой массы,растворителей и солей. Для соединений формулы II' предпочтительно не осуществлять обработку, которая может изменить относительные соотношения изомеров, а промежуточные сложные эфиры, растворенные в несмешивающемся органическом растворителе, могут быть очищены перемешиванием с водной кислой фазой, затем, после отстаивания, адсорбцией на адсорбенте, таком как Silica Gel, перед их гидролизом в основной или кислой среде с получением кислот формулыII' для образования комплексов. Хелатные соединения формулы I очищают, как правило, в виде щелочной соли, растворимой в водной среде, одним из вышеописанных способов и, в частности, обработкой их водным раствором газовой сажи или двуокисью кремния, содержащей силаны. Эти хелатные соединения по изобретению отличаются наличием в центральном ядрекомплексообразователе боковых "ветвей", содержащих 3 или 4 последовательных фенильных ядра, соединенных между собой мостиками небольшой длины, причем последнее фенильное ядро имеет, по крайней мере, одну гидрофильную группу; несмотря на свою высокую молекулярную массу и наличие нескольких гидрофобных фенильных ядер, эти соединения растворимы в воде и биосовместимы, и могут вводиться внутривенно человеку. Кроме того, и это является очень важным их свойством, они мало проходимы через стенки сосудов, в отличие от продаваемых соединений, что позволяет получить при магнитнорезонансном исследовании высокую контрастность сосудов по сравнению с близлежащими тканями; это свойство, вместе с их высокой релаксацией, позволяет либо вводить пациенту меньшие дозы комплекса гадолиния, либо опре 001387 12 делять патологические состояния, которые до этого момента не могли быть четко выявлены. Парамагнитные хелатные соединения по изобретению могут составлять формы для парентерального или ентерального введения в сочетании с фармацевтическими носителями и обычными эксципиентами. Для внутривенного и внутриартериального введения соединения по изобретению представлены в виде стерильных водных растворов концентрацией от 0,001 до 0,5 моль/л, при необходимости в сочетании со стабилизатором рН до 7, например, буферным раствором TRIS или СО 2, с агентом изотонизации, таким как маннит,глицерол или глюкоза, предпочтительно с NaCl,который способен изменять растворимость и диспергируемость хелатного соединения, или с другим комплексообразующим агентом, таким как EDTA. Для удаления эндотоксинов, которые могут загрязнять конечный продукт, в частности,после очистки жидкостной хроматографией,осуществляют предпочтительно ультрафильтрацию, возможно тангенциальную, с постоянным объемом на мембранах, свойства и порог разделения которых зависят от молекулярной массы продукта и давления вязкости раствора. Такая очистка может осуществляться также на некоторых промежуточных стадиях для соединений с меньшим размером (молекул), микрофильтрацией, в частности, на мембране, с наполнителем или ультрафильтрацией. Также можно предусмотреть специфическую или неспецифическую обработку эндотоксинов абсорбентом, таким как газовая сажа. Водные растворы для вагинального введения содержат, предпочтительно, агент вязкости,такой как природная камедь, полисахарид или производное целлюлозы. Хелатное соединение для ректального введения представлено в виде суппозиториев или вязкого раствора. Наконец,хелатное соединение для перорального введения может быть представлено в виде желатиновых капсул, таблеток или сиропа, приготовленных с обычными эксципиентами. Примеры рецептур можно найти в Remington's for Pharmaceutical Science, 18e Edition (1990), Mack. Pub. Су. Разовая доза и концентрация зависят от веса пациента, от типа диагностического исследования, а также от растворимости, вязкости раствора, намагничиваемости, проницаемости капилляров и фармакокинетики соединения. Они могут быть использованы для магниторезонансного исследования с использованием экспресси обычных методов для исследования перфузии,в частности, миокарда, мозга, почек или печени,для ангиографии или для визуализации или характеристики аномалий проницаемости, в частности, новообразований, воспалений и ишемии или хрящевых аномалий. 13 Эти продукты могут также применяться в ядерной медицине после введения радиоактивного атома, например, путем изотопного обмена галогенов или комплексообразованного катиона; сцинтиграфия исследуемых зон осуществляется после введения хелатных соединений по изобретению. Далее приведены примеры соединений по изобретению, а также способы получения хелатных гадолиниевых форм соединений формулы II, гдеR' = H и R' = CH2COOH, и соединений VI предшественников фенилов. Полученные продукты характеризуются расстояниями удержания при хроматографии на тонком слое или временем удержания (tr) при высокоэффективной жидкостной хроматографии (HPLC) или при удалительной пространственной хроматографии (CES). Их молекулярные массы определяют масс-спектрометрией (электроспрей). А. Хелатное соединение гадолиния и[1,4,7,10-тетраазациклододекан]1,4,7,10-тетра(2 глутаровой) кислоты (натриевая соль). 1. В раствор 25 г 1,4,7,10-тетраазациклододекана в 280 мл ацетонитрила вводят 30 г карбоната натрия, затем 78 г 2-этилбромглутарата, полученного, например, как описано в(1964); среду выдерживают при температуре обратного холодильника в течение суток, добавляя в два приема 78 г бромированного производного с 30 г карбоната натрия. После охлаждения осадок фильтруют, и органическую фазу промывают водой с последующим экстрагированием разбавленным водным раствором соляной кислоты. Затем водную фазу, доведенную до рН 3 - 4, экстрагируют толуолом. Целевой продукт очищают хроматографией на двуокиси кремния, элюируя метиленхлоридом, при необходимости в смеси с ацетоном. 2. Гидролиз эфирных функций. 46 г сложного окта-эфира в растворе в 52 мл этанола вводят в 350 мл воды, в которую добавлено 50 г NaOH, шариками. После перемешивания в течение двух дней при 80 С вводят в охлажденный раствор 500 мл катионообменной смолы в виде слабой кислоты для нейтрализации, затем, после отделения твердой фазы, 500 мл анионообменной смолы в виде сильного основания. Смолу отделяют и вводят в 500 мл водного раствора 6N уксусной кислоты; конечный продукт в растворе изолируют в виде порошка выпариванием растворителя под вакуумом. 14 10 мин; d = 1 мл/мин; Т = 25 С; tr = 5,4; 8,7; 10,2; 14 мин (изомеры) (СН 3 СООН - tr = 4,5 мин). 3. Комплексообразование. Окисью гадолиния: в 30 мл раствора с рН 5,5 - 6 2 г вышеуказанной окта-кислоты вводят 0,47 г окиси гадолиния, смесь выдерживают при 80 С в течение 3 ч, при необходимости регулируя рН. После охлаждения при рН 6,5 вводят 2 г смолы Chelex100, выпускаемой компаниейSigma в виде Na+; после нескольких часов контакта смолу отделяют, и раствор вливают в 10 объемов этанола для осаждения хелатного соединения. Хлоридом гадолиния: добавлением водного NaOH (1N) доводят рН смеси 6,5 г октакислоты и 3,5 г GdСl3, 6 Н 2 О в 130 мл воды до 6,5 и выдерживают при 60 С в течение 2 ч, поддерживая рН 6,5 добавлением, в целом, 21 мл 1N водного NaOH. После выдержки в течение нескольких часов при комнатной температуре,концентрируют до 25 мл и осаждают конечный продукт в 10 объемах C2H5OH. Б. Хелатное соединение гадолиния и[1,4,7,10-тетраазациклододекан]1,4,7-три(2 глутаровой) кислоты (формула 1. 10-бензил-1,4,7,10-тетраазациклододекан: 30,5 г бензилхлорида вводят по каплям в раствор 50 г 1,4,7,10-тетраазациклододекана в 500 мл хлороформа. После 24 ч перемешивания при комнатной температуре реакционную среду фильтруют; фильтрат концентрируют насухо. Остаток вводят в 350 мл воды и 75 мл толуола,затем, после отстаивания фазы толуола, водную фазу экстрагируют дважды 200 мл дихлорметана. Органическую фазу сушат на сульфате натрия, затем концентрируют насухо. Получают 21 г продукта в виде масла. 2. 10-бензил-1,4,7,10-тетраазациклододекан 1,4,7-три(2-метилглутарат): раствор 56,3 г 2-метил-бромглутарата в 50 мл ацетонитрила добавляют по каплям в суспензию 18,7 г вышеуказанного продукта и 24,7 г карбоната натрия в 300 мл ацетонитрила. Реакционную среду нагревают и выдерживают с обратным холодильником в течение 36 ч; после фильтрации при комнатной температуре растворитель выпаривают, а остаток растворяют в минимальном количестве этилацетата и очищают хроматографией на колонке из двуокиси кремния, элюируя смесью этилацетата и петролейного эфира (40/60 - 70/30 об/об). Таким образом, получают 20,7 г продукта в виде масла. 3. 10-бензил[1,4,7,10-тетраазациклододекан]1,4,7-три-(2-глутаровая) кислота: 16,7 г полученного выше масла в растворе в 40 мл метанола вводят в 125 мл воды, в которых растворено 25 г NaOH; смесь перемешивают в течение 48 ч при 70 С. Затем метанол удаляют при пониженном давлении, после чего вводят 400 мл катионообменной смолы в виде 15 слабой кислоты (Amberlite-IRC 50, выпускаемой фирмой Rohm et Haas), затем, после разделения, анионообменной смолы в виде сильного основания (Amberlite-IRA 458), целевой продукт фиксируется на анионообменной смоле,затем его отделяют элюированием в 2 л водного раствора 3N уксусной кислоты, затем в 2 л 6N раствора. После удаления растворителей получают 13,5 г белых кристаллов смеси изомеров.HPLC: колонка 1: 25 см х 4 мм Lichrospher 100-RP18 - 5 мкм (Merck, DE); элюент 1; tr = 28, 30 мин (2 массива изомеров 75/25 поверхности). 4. 1,4,7,10-тетраазациклододекан 1,4,7 три(2-глутаровая) кислота: 13 г предыдущего соединения в растворе в 210 мл воды и 90 мл метанола гидрогенируют в течение 3 ч при комнатной температуре под давлением 28 х 104 Па в присутствии 10% палладия на 50% влажном угле. После удаления выпариванием катализатора и растворителей получают 11 г белого порошка.HPLC: колонка 1; элюент 1; tr = 8,9 мин (2 массива изомеров 75/25 поверхности). 5. Комплексообразование. При 60 С раствор 1,6 г предыдущего соединения и 1 г GdСl3, 6 Н 2 О в 30 мл воды выдерживают при рН 5, добавляя 3N водногоNaOH, в течение 4 ч. Концентрируют до объема 10 мл, и осаждают остаток в 100 мл этанола. Отфильтровывают 1,6 г целевого комплекса гадолиния.HPLC: колонка 1; элюент 1; tr = 24,26 мин. В. Хелатное соединение гадолиния и 1,4,7,10-тетраазациклододекан 1,4,7-три-(2-глутаровой)10-уксусной кислоты. 1. 1 г кислоты, полученной на стадии 4 получения Б, растворяют в 8 мл воды с 270 мг бромуксусной кислоты, смесь выдерживают в течение 3 ч при 70 С, рН 10 контролируют добавлением 1N водного NaOH. Затем при комнатной температуре добавляют 100 мл воды и 10 мл смолы Amberlite-IRC 50; через 1 ч смолу отделяют и в среду вводят 50 мл смолы Amberlite-IRA 458. Через 12 ч смолу отделяют и вводят в колонку. Целевой продукт экстрагируют элюированием в 500 мл водного раствора 1N уксусной кислоты. Таким образом, получают 0,8 г белых кристаллов.HPLC: колонка 2: 25 см х 4 мм Symertry-RP18- 5 мкм (Waters); элюент 1; tr = 4 мин. 2. Комплексообразование. В 13 мл воды вводят 0,45 г GdСl3, 6 Н 2 О и 0,75 г предыдущего соединения; рН доводят до 6 добавлением водного раствора NaOH (1N); реакционную среду выдерживают при 60 С в течение 5 ч, регулируя несколько раз рН добавлением раствора NaOH. После охлаждения сре 001387 16 ду вводят в 130 мл этанола, осадок изолируют с получением 0,75 г хелатного соединения. Г. N,N'-(2,3,4,5-тетрагидроксипентил)N,N'[2-(гидроксиэтокси)этил]2,4,6-триидо-5-(глициламино)изофталамид. 1. 5-[2-(гидроксиэтокси)этиламино]пентан 1,2,3,4-тетраол: 84 г 2-аминоэтоксиэтанола и 150 г Дксилозы растворяют в 2,5 л метанола; смесь гидрогенируют при комнатной температуре под давлением 6 х 105 Па в присутствии 50 г палладия на 10% угле. Катализатор отфильтровывают, а растворитель дистиллируют. Осадок, растворенный в минимальном количестве воды,хроматографируют на 100 мл смолы Amberlite(2xCH2OH) ; 71,9; 71,2; 70,6 (3 хСНОН); 72,3; 69,7 (CH2OCH2). Тем же способом можно получить производное арабинозы или рибозы. 2. бис[N-(2,3,4,5-тетрагидроксипентил)-2(гидроксиэтокси)этил)]2,4,6-трииодо-5-(фталамидоацетамид)изофталдиамид. 30 г полученного выше аминоспирта растворяют в 100 мл диметилацетамида при 45 С,затем вводят 22 г дихлорангидрида (2,4,6 трииодо-5-фталимидоацетамидо) изофталиевой кислоты и 12 г триэтиламина, среду перемешивают при этой температуре в течение 24 ч. Образовавшийся осадок изолируют при комнатной температуре, а растворитель удаляют вакуумной перегонкой. Остаток в растворе в 50 мл воды элюируют на 100 мл смолы Amberlite IMAС HP 1110(Н+); после концентрирования раствора до 10 мл его вливают в 1500 мл изопропилового спирта и через 24 ч изолируют образовавшийся осадок. 3. Высвобождение амина. При 80 С в раствор 40 мл воды и 2,7 мл гидрата гидразина вводят 42 г полученного выше продукта в растворе в 60 мл воды. Через 5 ч перемешивания при этой температуре фильтруют, затем среду подкисляют до рН 1 добавлением концентрированной соляной кислоты. Образовавшийся осадок отделяют, а фильтрат концентрируют. Остаток в растворе в 30 мл воды хроматографируют на 30 мл смолы AmberliteIMAC HP 111E (Н+), затем на 55 мл смолы Amberlite IRA 67 (ОН-). Концентрированный элюат фиксируют на 350 мл смолы Amberlite 252Na+), затем элюируют водным раствором 17 элюент 2: H2O/CF3COOH (pH 3,4) с градиентом ацетонитрила 95/5 - 50/50 об/об за 50 мин; tr = 10 - 20 мин (смесь изомеров). Д. бис[N-ди(2,3,4,5,6-пентагидроксигексил)]2,4,6-трибром-5-(глициламино)изофталдиимид. 1. 5-амино 2,4,6-трибром изофталевая кислота. 156 г брома медленно вводят в 300 мл водного раствора 50 г 5-аминоизофталиевой кислоты и 55 мл 37% соляной кислоты. После перемешивания в течение ночи избыток брома нейтрализуют добавлением водного раствора бисульфита натрия с последующим изолированием осадка. Выход: 90%. 2. 5-(фталимидоацетамид) 2,4,6-трибромизофталиевая кислота 27 мл тионилхлорида в растворе 69 г N-фталоилглицина медленно вводят в 200 мл диметилацетамида при 10 С, затем после перемешивания в течение 2 ч вводят при 15 - 20 С 100 г полученной выше кислоты. После выдержки в течение ночи при комнатной температуре смесь выливают в 800 мл теплой воды. Получают 140 г конечного продукта. 3. Хлорангидрид дикислоты, полученной выше. В раствор 100 г дикислоты в 300 мл диоксана и 50 мл диметилформамида медленно вводят при температуре 18 С 70 мл тионилхлорида. Через 3 дня перемешивания при комнатной температуре образовавшийся желтый осадок фильтруют и промывают метиловым и тбутиловым эфиром. Таким образом, получают 70 г твердого вещества бежевого цвета. 4.N,N'-[бис(2,3,4,5,6-пентагидроксигексил)]2,4,6-трибром-5-(фталимидоацетамид)изофталамид. 150 г дисорбитиламина растворяют в 600 мл N-метилпирролидона при 80 С и вводят в среду при 60 С 16 г сухого карбоната натрия,затем 96 г хлорангидрида кислоты, полученного выше. После перемешивания в течение 1 ч при этой температуре и в течение 16 ч при комнатной температуре удаляют осадок и вливают раствор в 1,6 л изопропанола. Изолированный осадок весит 200 г. 5. Гидразинолиз. 200 г полученного выше продукта и 17 мл гидрата гидразина вводят в 400 мл воды при 70 С. После перемешивания в течение 3 ч подкисляют до рН 4 добавлением 6N соляной кислоты при комнатной температуре. Образовавшийся осадок удаляют, фильтрат нейтрализуют добавлением водного раствора 1N NaOH. Избыток гидразина удаляют обратным осмосом. Остаток раствора обрабатывают 10 мл сильной катионообменной смолы, затем 65 мл слабой анионообменной смолы. Конечный продукт экстрагируют из раствора фиксацией на сильной катионообменной смоле в виде Н+, затем элюируют разбавленным водным раствором NaCl (0,1 М).HPLC: колонка 1; элюент 2; tr = 7 мин, приблизительно. Е. N,N'-[бис (2,3,4,5,6-пентагидроксигексил)]2,4,6-трииод-5-(глициламино)изофталамид. 1. Хлорангидрид 5-(фталамидоацетамид) 2,4,6-трииодоизофталевой кислоты. 149 мл SOCl2 вводят в раствор 335 г Nфталоилглицина в 1 л N-метилпирролидона при 10 С, затем через 3 ч 700 г дихлорангидрида 2,4,6-трииодо-5-аминоизофталиевой кислоты. После перемешивания в течение 3 дней при комнатной температуре среду выливают на 4,5 л водного этанола (2/1 об/об). рН доводят до 5 добавлением триэтиламина с последующим изолированием образовавшегося осадка, который может быть промыт в изопропаноле. р = 850 г. 2. Aминирование дисорбитиламином HN[CH2(CHOH)4CH2OH]2. Действуя как для аналогичного трибромистого соединения, получают целевой продукт с выходом 85%. 3. Гидразинолиз. 420 г полученного выше трииодированного фталимида в растворе в 1 л воды и 300 мл гидрата гидразина выдерживают в течение нескольких часов при 80 С. После подкисления среды до рН 3,6 избыток гидразина удаляют хроматографией на катионообменной смоле(Н+), такой, как IMAC HP111E, выпускаемой компанией Rohm et Haas, затем хлориды анионообменной смолой (ОН-). Конечный продукт может быть очищен хроматографией на катионообменной смоле(сильный Н+) и осажден из водного раствора в этаноле. Выход 50%.H-N СН 2 СНОНСН 2 ОН 27 г 3-аминопропан-1,2-диола и 50 г Дгалактозы в 140 мл метанола перемешивают при 40 С в течение 16 ч. Добавляют 60 мл воды и осуществляют в присутствии 7 г палладия на угле (10%) гидрогенирование имина в течение 7 ч при 60 С под давлением водорода 20 х 105 Па. Катализатор отфильтровывают на Celite. После удаления растворителя при пониженном давлении, остаток, растворенный в минимальном количестве воды (50 мл), медленно вводят в 600 мл изопропанола. Образовавшийся осадок изолируют. F = 132C, выход 90%. Перед осаждением в изопропаноле исходный продукт может быть очищен хроматографией в растворе в 200 мл воды на 500 мл ионообменной смолы в виде сульфоновой кислоты, 19 элюируя водным раствором разбавленнойNH4OH. В этих условиях аминоспирт является смесью, практически 50/50, двух диастереоизомеров. Смесь может быть обогащена одним или другим изомером путем перекристаллизации,фракционным осаждением или суспендированием. Так, обработкой метанолом при температуре рефлюкса (25 г аминоспирта в 500 мл растворителя) получают смесь, которая содержит избыток одного из изомеров: 65% изомера имеют самое большое время удержания по результатам измерения поверхности на хроматограммах, полученных при следующих условиях хроматография в газовой фазе (производное, полностью трифторацетилированное действием трифторуксусного ангидрида при 60 С); прибор: Varian Star 3400; колонка: DB 1701 (JW) (0,25 мкм - 30 м х 0,25 мм); векторный газ Не - Т инжектора (split/40e)= 290C; Т колонки = 150 - 280 С (5 С/мн) - объем: 1 мкл;tr = 14,5 и 14,9 мин (5,6 мн для исходного аминопропандиола); ЯМР 13 С (200 МГц - DMSO d6 - Ref.DMSOТ = 30 С);(ppm): 71,7; 71,6; 70,5; 70,1; 69,5; 68,5; 68,2 - (СНОН) 64,6; 63,2; (СН 2 ОН) - 53,4; 53; 52,9 (NCH2). Каждый диастереоизомер может быть также получен конденсацией Д-галактозы на чистом энанциомере аминопропандиола или воздействием энанциомера глицидола на(2,3,4,5,6-пентагидроксигексил)бензиламин, как описано ниже а) бензил-(2,3,4,5,6-пентагидроксигексил) амин. Растворяют в 230 мл метанола 29 г Дгалактозы, 17 мл бензиламина, и смесь выдерживают при 50 С в течение 7 ч под давлением водорода 8 х 105 Па после добавления 5 г угля,содержащего 5% палладия. После гидрогенирования в реакционную среду вводят при 40 С водный раствор хлористоводородной кислоты до кислого рН. Смесь фильтруют на Celite при комнатной температуре для удаления катализатора, и после частичной конденсации вводят водный раствор 5N NaOH до щелочного рН. Образовавшийся осадок изолируют и кристаллизуют в этаноле. ЯМР 13 С (200 МГц - DMSO d6 - Ref. 20 б) бензил-(2,3-дигидроксипроп-1 ил)(2,3,4,5,6-пентагидроксигексил)амин. 6,5 г полученного на предыдущем этапе вторичного амина растворяют в 200 мл метанола при 60 С, затем вводят в раствор при этой же температуре 2,5 г глицидола (рацемат или чистый энанциомер), и смесь перемешивают в течение 24 ч. Затем удаляют растворитель перегонкой при пониженном давлении, а остаток хроматографируют, после растворения в 200 мл воды, на колонке из смолы Amberlite IMAC 110 в виде Н+, элюируя водным раствором разбавленного NH4OH (0,1%). Таким образом, получают 5,5 г амина. в) (2,3-дигидроксипроп-1-ил)-(2,3,4,5,6-пентагидроксигексил)амин. 2 г третичного амина, полученного на предыдущем этапе, в растворе в 30 мл воды гидрогенируют при 45 С при давлении водорода 100 х 105 Па в течение 5 ч в присутствии 0,6 г содержащего палладий угля (10%). Затем раствор фильтруют на Celite для удаления катализатора и концентрируют при пониженном давлении. Остаток может быть перекристаллизован в этаноле. При конденсации (S)-глицидола получают диастереоизомерный аминоспирт с самым длительным временем удержания в условиях хроматографии в газовой фазе, см. выше. Из Д-глюкозы и Д-маннозы получают,применяя эти способы, диастереоизомеры этих аминоспиртов, тогда как другие аминоспирты могут быть получены из первичных аминоспиртов или различных сахаров. 3. Хелатное соединение гадолиния и(2-янтарной) кислоты. 1. Конденсация ацетиленбензилдикарбоксилата на 4 атомах азота циклена. 23 г ацетиленбензилдикарбоната, полученного как описано в J. C. S. Perkin I, p. 20242029 (1973) при 20 С в растворе в 25 мл ацетонитрила добавляют по каплям в раствор 2,7 г циклена в 50 мл ацетонитрила. После перемешивания в течение 3 ч при 50 С растворитель удаляют при пониженном давлении и очищают хроматографией на двуокиси кремния, элюируя смесью дихлорметан/метанол (98/2 - об/об) с получением 19 г твердого вещества желтого цвета. 2. Восстановление энамина. 7 г цианоборгидрида натрия вводят порциями, перемешивая, в раствор 19 г твердого вещества, полученного на предыдущей стадии,в 500 мл ацетонитрила и 50 мл уксусной кислоты, смесь перемешивают в течение ночи при комнатной температуре. После удаления растворителя при пониженном давлении масляный остаток растворяют в смеси дихлорметан/метанол (99/1) и фильтруют на двуокиси кремния. После выпаривания растворителя получают 19 г желтого масла. 3. Дебензилирование. 8 г полученного сложного октаэфира в смеси вода/метанол (175 мл/75 мл) гидрогенируют в течение 6 ч в присутствии 4 г 10%-ного палладия на угле (давление 3,5 х 105 Па). После отделения катализатора фильтрованием и удаления перегонкой растворителя получают 3 г окта-кислоты в виде белого порошка.HPLC: колонка 1; элюент 1; tr = 18 - 19 мин. 4. Комплексообразование. 1 г полученной окта-кислоты суспендируют в 20 мл воды, рН доводят до 5,5 добавлением водного раствора 1N NaOH и добавляют 0,285 гGd2 О 3. После перемешивания в течение 4 ч при 70 С и при регулировании рН между 5,5 и 6,5 добавлением водного раствора 1N НСl реакционную среду фильтруют, а фильтрат концентрируют насухо с получением натриевой соли хелатного соединения. Пример 1. Хелатное соединение гадолиния формулыI, где m = 2, 1. 4-[N'-(4-нитрофенил)уреидо]бензойная кислота. При 10 С при перемешивании в 80 мл тетрагидрофурана вводят 24,6 г 4-нитрофенилизоцианата, затем медленно 20,5 г 4 аминобензойной кислоты в растворе в 70 мл тетрагидрофурана. Температуру смеси повышают до комнатной и продолжают перемешивание в течение 1 ч, после чего изолируют образовавшийся осадок. р = 45 г.HPLC: колонка 1; элюент 2: Н 2 О/СF3 СООН; рН 3, 4 с градиентом ацетонитрила (95/5 - 50/50 об/oб за 50 мин); расход 1 мл/мин; tr = 44 мин. 2. 4-[N'-(4-аминофенил)уреидо]бензойная кислота. 22 г полученного выше продукта и 37 мл водного раствора 1N NaOH вводят в 280 мл воды с 3 г палладия на угле (5%). Среду выдерживают под давлением водорода 0,6 МПа в течение 6 ч при 65 С. После охлаждения до комнатной температуры рН доводят до 10, катализатор отфильтровывают на Celite с последующим подкислением до рН 5,3 добавлением водного раствора 6N НСl; полученный осадок промывают ацетоном. р = 13,2 г; 22 3. 4-[N'-[4-(фталимидоацетамид)фенил] уреидо]бензойная кислота. 5,8 г фталимидоуксусной кислоты растворяют в 26 мл диметилацетамида при 10 С и вводят, поддерживая эту температуру, 2 мл тионилхлорида, затем через 2 ч перемешивания - 7 г соединения, полученного на предыдущей стадии. Через 12 ч выдержки при комнатной температуре реакционную среду вливают в 250 мл воды, а образовавшийся осадок промывают до нейтрализации водой при 25 С, затем 95 С. р = 10,4 г;HPLC: колонка 1; элюент 2; tr = 40 мин. 4. бис[N-2,3,4,5-тетрагидроксипентил)(2(гидроксиэтокси)этил)]2,4,6-трииодо 5-[N-4-(4 фталимидоацетамидофенил)уреидо бензоил]глицил] амино изофталдиамид. В 40 мл диметилацетамида растворяют 4 г полученного выше соединения с 1,7 г НОВТ,Н 2 О и 9,3 г бис-[N-(2,3,4,5-тетрагидроксипентил)-2-(гидроксиэтокси)этил] 2,4,6-трииодо 5(глициламино)изофталдиамида, затем 2,4 гEDCl, НСl, при 0 С. После перемешивания в течение ночи при комнатной температуре среду вливают в 300 мл дихлорметана. Полученный осадок промывают диэтиловым эфиром.HPLC: колонка 1; элюент 2; tr = 30 - 33 мин (смесь изомеров). 5. Удаление фталимидогруппы. В 45 мл воды при 80 С вводят 11,5 г предыдущего соединения, затем 1,12 мл гидрата гидразина (0,023 моля). После выдерживания в течение 2 ч 45 мин при 80 С смесь охлаждают до 0 С и подкисляют до рН 1 добавлением 12N водного НСl. Затем смесь фильтруют на Celite при комнатной температуре, затем на 16 мл катионообменной смолы (Н+) IMAС HP 111E и 80 мл слабой анионообменной смолы (ОН-)IMAC HP661, выпускаемой Rohm et Naas. После последней очистки фильтрованием на силансодержащей двуокиси кремния получают 4,6 г конечного продукта.HPLC: колонка 1; элюент 2; tr = 24 - 27 мин (смесь изомеров). 6. Конденсация продуктов А и III. В 20 мл водного раствора при рН 6 и 40 С вводят 4,5 г полученного выше амина и 0,63 г хелатного соединения А, 0,057 г NHS (натриевая соль) и 0,76 г EDCl, HCl. Через 15 мин смесь вливают в воду и отделяют осадок. После удаления исходных продуктов получают соединение формулы I. Исключающая пространственная хроматография (CES); условие 1: осуществляется последовательно на 4 колонках (30 см х 8 мм) фирмы Shodex (JP) марки ОН Par SB-HQ, содержащих гель полигидроксиметакрилата и имеющих пределы удаления, определенные пуллуланом, составля 23 ют, соответственно, 106 кДа (SB-804); 105 кДаtr = 38 мин (50 - 53 мин для исходного амина);HPLC: колонка 3, 25 см х 4,6 мм Platinum EPS C18 100 ; 5 мкМ (Alltech); элюент 3: водa/CH2CN от 98/2 до 60/40 об/об за 50 мин; расход 1 мл/мин; Т = 25 С, tr = 26 мин. Пример 2. Хелатное соединение гадолиния формулы 1. 4-[4-(фталимидометил)бензамидо]бензойная кислота. В раствор, полученный из 25 г 4 аминометилбензойной кислоты, 18 г Nа 2 СО 3 и 165 мг воды, вводят 37 г N-карбетоксифталимида. Образовавшийся осадок изолируют, затем превращают в суспензию в 60 мл диметилацетамида, в который вводят медленно при 10 С 4,7 мл хлорида тионила. Выдерживают 3 ч при этой температуре и вводят 9 г 4 аминобензойной кислоты и в течение 12 ч поддерживают среду при комнатной температуре,перед тем как влить ее в 600 мл воды. Образовавшийся осадок изолируют.HPLC: колонка 1; элюент 2; tr = 48 мин. 2. бис[N-ди-(2,3,4,5,6-пентагидроксигексил)]2,4,6-трииодо-5-[4-(4 аминометилбензамидо)бензоилглициламино]изофталдиамид. а) Перемешивают до растворения 160 мл диметилацетамида с 39 г бис[N-ди-(2,3,4,5,6 пентагидроксигексил)2,4,6-трииодо-5-(глициламино)изофталдиамида, 4,6 мл триэтиламина,5,7 г НОВТ, Н 2 О и 12 г полученного выше продукта, перед тем, как охладить до 0 С и добавить 8 г EDCl, НСl. В конце реакции среду сливают на 1000 мл дихлорметана. Выделенный осадок очищают с помощью осаждения в метаноле из его водного раствора. р = 43 г. б) Гидразинолиз. 25 г предварительно полученного фталимида растворяют в 50 мл воды при 80 С, после чего добавляют 2,2 мл гидрата гидразина. После перемешивания в течение 3 ч среду охлаждают и подкисляют до рН 1 добавлением 12N НСl. Среду фильтруют на Сеlite, затем очищают хроматографией на слабой катионообменной смоле (H+), затем на слабой анионообменной смоле (ОН-). Таким образом выделяют 15 г целевого продукта. 24 элюент 2; tr = 19 мин. в) Конденсация на хелатном соединении гадолиния А. 15 г полученного таким образом амина и 1,9 г хелатного соединения А (натриевая соль) растворяют в 40 мл воды. После подкисления до рН 6 добавлением водного раствора 1N HCl,вводят 2,3 г EDCl, НСl при 40 С. После перемешивания в течение 2 ч среду вводят в 400 мл этанола; образовавшийся осадок, помещенный в водный раствор, фильтруют на саже Norit. Таким образом получают 8,5 г чистого продукта.HPLC: колонка и элюент 3; tr = 23 мин. Пример 3. Хелатное соединение гадолиния формулы 1, в которой m = 2 а) 4-[4-нитробензамидо]бензойная кислота. Понемногу вводят 100 г хлорида 4 нитробензойной кислоты в 74 г 4-аминобензойной кислоты и 360 мл диметилацетамида,поддерживая температуру ниже 25 С. После перемешивания в течение 24 ч добавляют 500 мл метиленхлорида при 10 С для осаждения целевого продукта. После промывания водой и сушки выделяют 145 г продукта. б) 4-(4-аминобензамидо)бензойная кислота. Суспензию из 136 г полученной выше кислоты в 1,8 л воды, в которую добавили 240 мл водного раствора 1N NaOH и 14 г палладия на угле (10%), помещают под давление водорода 0,6 МПа на 4 ч. рН полученной суспензии доводят до 10 перед фильтрацией на Celite для удаления катализатора. Осадок, образованный во время подкисления фильтрата до рН 5,3, изолируют и сушат. р = 106 г; F260C. в) 4-[4[фталимидоацетамидо)бензамидо]бензойная кислота. В раствор 90 г фталимидоуксусной кислоты в 400 мл диметилацетамида при 10 С вводят по каплям 32 мл хлорида тионила, затем, после перемешивания в течение 3 ч, 105 г полученной выше аминокислоты при температуре ниже 20 С. После 12 ч перемешивания среду вливают в 4 л воды, и выделенный осадок промывают теплой водой. Вес после сушки: 176 г; F260C. г) Хлорангидрид полученной выше кислоты. В суспензию 10 г кислоты в 50 мл диоксана вводят 2,5 мл хлорида тионила и 1 мл диметилформамида и перемешивают смесь при 50 С в течение 5 ч. 25 После добавления одного объема простого диизопропилового эфира выделяют 10 г осадка. Также можно приготовить суспензию кислоты в толуоле с хлоридом трикаприлилметиламмония в качестве катализатора. д) N,N'-бис(2,3,4,5,6-пентагидроксигексил) 2,4,6-трибромо-5-(4-[4-(фталимидоацетамидо) бензамидо]бензоилглициламино) изофталамид. Раствор 2,25 г хлорида кислоты с 5 г N,N'бис(2,3,4,5,6-пентагидроксигексил)-2,4,6-трибромо-5-(глициламино)изофталамида и 0,7 мл триэтиламина в 25 мл диметилацетамида или Nметилпирролидона перемешивают в течение 12 ч, затем вливают в 60 мл этанола. Таким образом выделяют 6,2 г осадка.HPLC: колонка 1; элюент 2; tr = 27 - 35 мин (смесь изомеров) е) Гидразинолиз. Раствор 0,6 мл гидрата гидразина в 10 мл воды вводят в раствор 10 г фталимида, полученного ранее, в 40 мл диметилацетамида при 80 С. После перемешивания в течение 3 ч при этой температуре охлажденную смесь вливают в 125 мл этанола. Выделяют 9 г осадка, который очищают путем обработки его водного раствора сильной анионообменной смолой (ОН-), затем слабой катионообменной смолой (Н+). р = 8 г. Также можно подкислить реакционную среду, чтобы отделить осевший фталилгидразид и удалить растворитель и молекулы с маленьким весом с помощью ультрафильтрации перед окончательным осаждением в водном растворе этанола.tr = 28 - 35 мин. ж) Присоединение к хелатному соединению А для получения соединения формулы I. Растворяют в 135 мл воды 5 г соединения,полученного на стадии (е), с 0,65 г хелатного соединения А (натриевая соль), рН среды снижают до 6 добавлением водного раствора 1NHCl перед вводом в среду 0,8 г EDCl при 40 С. После перемешивания в течение 2 ч и возврата к комнатной температуре среду вливают в 135 мл этанола. Можно также ввести 1,6 г хелатного соединения А (натриевая соль) в 25 мл водного раствора 10 г амина, полученного на стадии (е),затем при рН 6,5, последовательно, 18 мл диоксана, 1,4 г EDCl и 0,08 г НОВТ. Выдерживают 2 ч при комнатной температуре, затем вливают реакционную среду в 100 мл этанола и выделяют осадок. Вновь растворенный в 100 мл воды осадок обрабатывают два раза с помощью 1 г сажи, после чего его опять осаждают в 3 объемах этанола. Образовавшийся осадок очищают обработкой с помощью 5 мл ионообменной смолы 26 рации на мембране с порогом разрыва 5 KD,при рН 7, р = 4 г.HPLC: колонка и элюент 3; tr = 23 мин. Пример 4. Хелатное соединение формулы I, в которой Перемешивают в течение 5 ч при 40 С 0,3 г комплексного соединения гадолиния и 1,4,7,10 тетраазациклододекан-1,4,7-триглутаро-вой кислоты, полученной в соответствии со способом Б, 2 г амина, полученного в примере 3 (е), и 0,3 гEDCl, HCl в 5 мл воды, поддерживая рН равным 7 добавлением водного раствора 1N HCl. Среду вливают в 50 мл этанола, и образовавшийся осадок изолируют. Его очищают в растворе в 120 мл воды с помощью ультрафилътрации на мембране с порогом разрыва в 3 KD, чтобы удалить исходные продукты, не вступившие в реакцию. После перемешивания на саже и фильтрации раствор обезвоживают и получают 1 г белого твердого вещества.HPLC: колонка и элюент 3; tr = 31 мин. Пример 5. Хелатное соединение гадолиния формулы Действуя так же, как в примере 4, получают 0,8 г конечного продукта из 0,3 г исходного хелатного соединения С и 2 г амина, полученного в примере 3 (е).HPLC: колонка и элюент 3, tr = 22 мин. Пример 6. Хелатное соединение гадолиния формулы 1. 5-[4-(4-аминобензамидо)бензамидо]2,4,6 трибромоизофталевая кислота. а) Хлорангидрид 4-(4-нитробензамидо)бензойной кислоты. 70 г кислоты выдерживают в течение 8 ч при температуре рефлюкса в 250 мл хлорида тионила и 0,1 мл диметилформамида. Избыток хлорида тионила дистиллируют при пониженном давлении, и осадок сливают при перемеши 27 вании на 1,5 л этилацетата и 500 г измельченного льда. Конечный продукт экстрагируют в органической фазе, которую промывают водой, водным раствором бикарбоната натрия, затем сушат и концентрируют. р = 64 г. б) 5-[4-(4-нитробензамидо)бензамидо]2,4,6 трибромоизофталевая кислота. Раствор 64 г хлорида кислоты с 67 г 5 амино-2,4,6-трибромоизофталевой кислоты в 170 мл диоксана выдерживают 18 ч при температуре рефлюкса. Растворитель выпаривают, и осадок после промывания 300 мл теплого этилацетата растворяют в 600 мл воды с достаточным количеством 5N NaOH, чтобы получить рН 7, после промывания в этилацетате и подкисления выделяют осажденный целевой продукт. р = 73 г. в) Восстановление. 19 г продукта, полученного выше, в водном растворе при рН 6, поддерживают в течение 7 ч при водородном давлении в 0,5 МПа в присутствии 2 г платины на угле типа 156 (JohnsonMatthey). После фильтрации раствор выпаривают. р = 15 г. 2. N,N'-(2,3-дигидроксипропил)-N,N'-(2,3,4,5,6 пентагидроксигексил)-2,4,6-трибромо-5-[4-(4 глициламинобензамидо) бензамидо]изофталимид. а) Вводят 13 г полученного выше производного при 10 С в 10 мл раствора полученного хлорангидрида фталимидоуксусной кислоты, с 4,7 г фталоилглициновой кислоты, 1,7 мл SOCl2. После перемешивания в течение 2 ч при 20 С раствор вливают в 150 мл воды при 80 С, и осадок изолируют. р = 10,6 г. б) Хлорангидрид кислоты. Вводят 16 мл хлорида тионила в раствор 12,4 г предыдущего производного в 60 мл диоксана и 10 мл диметилформамида, поддерживая температуру ниже 10 С. После перемешивания в течение 30 мин раствор вливают в 200 мл воды, и выделенный осадок промывают с помощью 100 мл этилацетата. р = 12 г. в) Конденсация на аминоспирте. При 60 С вводят 11,6 г дихлорангидрида кислоты в 120 мл N-метилпирролидона, содержащего 13,5 г 1-деокси-1-(2,3-дигидроксипропиламино)D-галактитола, полученного по способу Ж. После перемешивания в течение 4 ч смесь вводят в 1200 мл дихлорметана, и осадок изолируют. р = 35 г. г) Удаление защитной фталимидной группы. 14 г предыдущего производного вводят в 30 мл воды с t = 80 С, содержащей 1,2 г гидрата гидразина. Раствор выдерживают 3 ч при этой температуре, после чего его подкисляют до рН 1 добавлением водного раствора 5N НСl. Через несколько часов отделяют образовавшийся осадок, и фильтрат обрабатывают последовательно смолами IMAC HP 1110 и HP 661 (Rohm et 28 элюент 2; tr = 25-28 мин (исходный продукт 32-36 мин). 3. Взаимодействие с хелатным соединением А. Вводят в 15 мл воды 0,6 г хелатного соединения гадолиния А (натриевая соль), 0,7 гEDC1, НС 1 и 4 г амина, полученного в предшествующем примере, рН доводят до 6, добавляя водный раствор 1N HCl, и смесь поддерживают в течение 2 ч при 40 С, затем ее вводят в 200 мл этанола. Образованный осадок изолируют, и его раствор в 100 мл воды подвергают ультрафильтрации на мембране из полиэфирсульфона с порогом разрыва 5 KDa.CES: условия 1; tr = 36 мин. Пример 7. Хелатное соединение гадолиния формулы 1. 4-(4-аминофенилкарбамоил)бензойная кислота. а) 4-(4-нитрофенилкарбамоил)метилбензоат. При примерно 10 С вводят понемногу 10 мл хлорида тионила в раствор 25 г сложного метилового моноэфира терефталевой кислоты в 125 мл диметилацетамида; после 1 ч 30 мин перемешивания при 15 С смесь медленно вводят в раствор 19 г 4-нитроанилина в 125 мл того же растворителя. После поддержания в течение 2 ч при температуре 50 С выделяют образовавшийся осадок. Выход продукта: 97%. б) Восстановление. 10 г полученного на предыдущей стадии нитропроизводного превращают в суспензию в 100 мл диметилацетамида в присутствии 2,5 г 10% палладия на угле (влажность 50%) и поддерживают при водородном давлении 0,5 МПа в течение 7 ч. Катализатор удаляют путем фильтрации среды на Сlагсеl, и фильтрат вводят в 500 мл воды. Образовавшийся осадок изолируют. Выход продукта: 97%. в) Гидролиз группы сложного эфира. 9 г соединения, полученного на предыдущей стадии, 50 мл водного раствора NaOH (2N) и 25 мл метанола поддерживают в течение 2 ч при 60 С. Раствор подкисляют при 20 С до рН 4,5, добавляя раствор концентрированной соляной кислоты (37%), и выделяют 7 г образовавшегося осадка.HPLC: колонка 1; элюент 2; tr = 29 мин. 2. бис[N-ди(2,3,4,5,6-пентагидроксигексил)]5[4-(4-аминофенилкарбамоил)бензоилглициламино] 2,4,6-трииодоизофталдиамид. В течение 2 ч при комнатной температуре перемешивают 25 г иодированного аминоацетамидоизофталамида, полученного в способе Е, с 29 3 мл триэтиламина, 5,8 г продукта, полученного на предыдущей стадии, 4,3 г НОВТ и 6 г EDCl,НСl, затем сливают на 700 мл дихлорметана. Образовавшийся осадок выделяют и очищают хроматографией на колонке силанизированной двуокиси кремния RP-2 (Merck), элюируя водой. Выделяют 16 г целевого продукта.HPLC: колонка 1; элюент 2; tr = 14 мин. 3. Присоединение к хелатному соединению гадолиния А. В течение нескольких дней перемешивают при 40 С 0,125 г хелатного соединения (натриевая соль), 1,8 г соединения, полученного на предыдущей стадии, 0,15 г EDCl, НСl и 100 мг сульфонового NHS, поддерживая рН, близким к 7, путем добавления водного раствора 1N HCl. Осадок, полученный при введении 50 мл этанола, выделяют и очищают ультрафильтрацией на мембране 5 кДa, чтобы получить 1 г целевого продукта.HPLC: колонка 1; элюент 2; tr = 20 мин. Пример 8. Хелатное соединение гадолиния формулы 1. 3-[3-(фталимидоэтилкарбамоил)бензамидо] бензойная кислота. а) 3-(аминоэтилкарбамоил) бензойная кислота. Раствор 9 г сложного метилового моноэфира изофталевой кислоты и 1,5 мл этилендиамина в 90 мл метанола перемешивают в течение 18 ч, затем концентрируют досуха. Осадок промывают охлажденным метанолом. Выход продукта: 91%. б) Защита NН 2 в виде фталимида. Вводят 9 г амина и 14 г Nкарбетоксифталимида в раствор 6,9 г карбоната натрия в 180 мл воды. Через 1 ч 30 мин перемешивания выделяют твердое вещество, а фильтрат подкисляют до рН 2. Фталимид осаждается в виде белых кристаллов. Выход продукта: 80%.HPLC: колонка 1; элюент 2; tr = 32 мин. в) 2,6 мл хлорида тионила добавляют по каплям при 10 С в раствор 12 г фталимида, полученного на предшествующей стадии, в 45 мл диметилацетамида. После выдерживания в течение 2 ч при 15 С оранжевый раствор медленно добавляют в раствор 5 г 3-аминобензойной кислоты в 45 мл диметилацетамида. Реакционную среду поддерживают в течение 3 ч при 30 55 С, затем вливают в 900 мл воды. Выделяют образовавшийся осадок. Выход продукта: 96%. 2 . бис[N-ди(2,3,4,5,6-пентагидроксигексил)]5[3-[3-(аминоэтилкарбамoил)бензамидо]бензамидоацетамидо]2,4,6-трииодоизофталдиамид. а) 20 г иодированного аминоацетамидоизофталамида, полученного по способу Е, 2,5 мл триэтиламина, 8,3 г соединения, полученного на предыдущей стадии, 3,4 г НОВТ и 4,9 г EDCl,НСl в 100 мл диметилацетамида перемешивают в течение 1 ч 30 мин. Затем реакционную среду вливают в 700 мл дихлорметана и выделяют 26 г образовавшегося осадка.HPLC: колонка 1; элюент 2, tr = 26 мин. б) Гидразинолиз. Вводят 3,5 мл гидрата гидразина в раствор 25 г продукта, полученного на предыдущей стадии, в 55 мл воды при 80 С. После поддержания в течение 8 ч при этой температуре среду подкисляют до рН 1 и выделяют образовавшийся осадок. Его очищают хроматографией на катионообменной смоле (Н+), затем на анионообменной смоле (ОН-). Выход продукта: 70%.HPLC: колонка 1; элюент 2; tr = 23 мин. 3. Присоединение к хелатному соединению гадолиния А. В течение 1 ч при 40 С и рН 7 перемешивают 2 г хелатного соединения А (натриевая соль), 2,3 г EDCl, НСl и 16 г соединения, полученного на предыдущей стадии, в 50 мл воды,затем добавляют 200 мг сульфонового NHS и продолжают перемешивание при 40 С в течение 3 ч. Затем среду вливают в 500 мл этанола, выделенный осадок очищают ультрафильтрацией,и получают 10 г натриевой соли целевого продукта.HPLC: колонка 3; элюент 3; tr = 21 мин. Пример 9. Хелатное соединение гадолиния формулы 1, в которой 1. 4-[4-(4-[фталимидометил]бензамидо)бензамидо] бензойная кислота. При 15 С вводят 3,5 мл хлорида тионила в раствор 19,3 г 4-[4-[фталимидометил]бензамидо] бензойной кислоты, затем, через 2 ч 45 мин перемешивания 8 г 4-аминобензойной кислоты. После поддержания в течение 12 ч при 20 С среду вливают в 500 мл воды. Образовавшийся осадок промывают диоксаном. р = 11,5 г.N,N'-(2,3,4,5,6-пентагидроксигексил)N,N'-(2-гидроксиэтил)4-[4-[4-(аминометил)бензамидо]бензамидо]бензамид. а) Перемешивают в течение одной ночи при 20 С 4,8 г 1-деокси-1-(2-гидроксиэтиламино)D-глюцита, 4 г НОВТ, Н 2 О, 11 г предыдущей кислоты и 6,7 г EDCl, НСl. Затем реакционную среду вливают в 500 мл дихлорметана, и образовавшийся осадок промывают 300 мл диэтилового эфира.HPLC: колонка 1; элюент 2, tr = 39 мин. б) Гидразинолиз. Вводят осадок, полученный на предыдущей стадии, в 60 мл диметилацетамида и при 80 С 3,2 мл гидрата гидразина в растворе в 25 мл воды. Через 3 ч среду концентрируют, и осадок растворяют в воде. Водную фазу доводят до рН 7,5, добавляя концентрированный раствор НСl, затем хроматографируют на сильной катионообменной смоле (Н+), затем на слабой анионообменной (ОН-). После отвердевания в этаноле получают 3,5 г осадка.HPLC: колонка 1; элюент 2; tr = 27 мин. 3. Присоединение к хелатному соединению гадолиния А. 1,5 г соединения, полученного на предыдущей стадии, с 0,5 г хелатного соединения А в 15 мл воды и 5 мл диметилацетамида нагревают до 40 С и вводят 0,75 г EDCl, HCl и 0,05 г сульфонового NHS (натриевая соль). Через 2 ч перемешивания при этой температуре реакционную среду сливают на 2 объема этанола и выделяют 1,3 г осадка.HPLC: колонка 3; элюент 3, tr = 31 мин. Пример 10. Хелатное соединение гадолиния формулы 1. 4-[4-[4-нитробензамидо]бензамидо] бензойная кислота. В раствор 35 г 4-(4-аминобензамидо) бензойной кислоты в 140 мл диметилацетамида при 5 С вводят 25,4 г хлорида 4-нитробензойной кислоты. После перемешивания в течение одного дня при 20 С реакционную среду сливают на 500 мл дихлорметана. р = 50 г. 2. Восстановление нитрогруппы. Суспензию 13 г предыдущей кислоты в 400 мл диметилацетамида гидрогенируют при давлении 0,15 МПа, в течение 4 ч в присутствии 32 3 г палладия на 5%-ном угле (Pd/C) и 50% воды. После фильтрации и выпаривания растворителя выделяют 12 г продукта. 3. 4-[4-[4-(фталимидоацетамидо)бензамидо]бензамидо] бензойная кислота. Раствор 16,4 г фталимидоуксусной кислоты в 40 мл хлорида тионила поддерживают в течение 4 ч при температуре рефлюкса. После концентрации реакционную среду вводят в 100 мл простого эфира диизопропила. Выделяют 10 г осадка хлорангидрида кислоты. 8,5 г его вводят в раствор 12 г анилина, полученного на стадии 2, в 50 мл диметилацетамида при 10 С. После нагревания до 20 С растворитель удаляют с помощью дистиллирования, и осадок промывают простым диэтиловым эфиром. р = 16 г. 4. Конденсация на амине, полученном в способе Е, и гидразинолиз. 18 г амина Е, 10 г кислоты, полученной на предыдущей стадии, и 3,5 г НОВТ растворяют в 80 мл диметилацетамида при 35 С, затем в реакционную среду, охлажденную до 20 С, вводят 4,9 г EDCl, НСl; через день ее сливают на 600 мл дихлорметана, и образовавшийся осадок промывают с помощью 400 мл этанола. Осадок растворяют в 90 мл диметилацетамида и 22 мл воды при 80 С, затем вводят 1,85 мл гидрата гидразина, и среду перемешивают в течение 3 ч,затем выпаривают растворители. Осадок растворяют в 800 мл воды и рН доводят до 1 добавлением водного раствора НСl (12N). После фильтрации на Celite и хроматографии на анионообменной смоле и на катионообменной смоле, а затем фильтрации элюента на саже,выделяют 13 г целевого соединения. 5. Взаимодействие продуктов формулы II и III. 1 г хелатного соединения А и 8 г вышеуказанного амина растворяют в 40 мл воды. После подкисления до рН 6 добавлением водного раствора разбавленной НСl реакционную среду нагревают до 40 С и вводят в нее 0,09 г сульфонового NHS и 1,2 г EDCl, НСl. После перемешивания в течение 2 ч при данной температуре среду вливают в 400 г этанола и выделяют осадок. После обычных очищающих обработок выделяют 6 г конечного продукта.CES: Условия предыдущие; tr = 38 мин. Пример 11. Хелатное соединение гадолиния формулы 1. 5-(4-нитробензамидо)2,4,6-трибромоизофталевая кислота. 50 г хлорида пара-нитробензойной кислоты и 75 г 5-амино-2,4,6-трибромоизофталевой кислоты в 400 мл диоксана поддерживают в течение 18 ч при температуре рефлюкса. После 33 охлаждения осадок фильтруют, промывают с помощью 50 мл диоксана и сушат. р = 115 г. 2. 5-(4-аминобензамидо)2,4,6-трибромоизофталевая кислота. рН раствора 180 г предыдущего нитропроизводного в 600 мл воды доводят до 6, добавляя водный раствор 5N NaOH и гидрогенизируют под давлением 5 х 105 Па в присутствии Pt типа 156 (Johnson Matthey) в течение 7 ч. Катализатор отделяют с помощью фильтрации, и воду испаряют при уменьшенном давлении. р = 80 г.(рН 2,8) с метанолом (99/1 - об/об); расход 1 мл/мин; tr = 3,6 мин (18,8 мин для нитропродукта). 3. 5-(4-[4-фталимидометил)бензамидо]бензамидо)2,4,6-трибромоизофталевая кислота. Смесь 10 г 4-аминометилбензойной кислоты, 14,5 г N-карбетоксифталимида и 9,2 мл триэтиламина в 140 мл тетрагидрофурана поддерживают при температуре рефлюкса в течение 72 ч. Осадок, выделенный с помощью фильтрации при комнатной температуре из реакционной среды, промывают простым диэтилэфиром и водным раствором 1N соляной кислоты. Получают 14,5 г твердого вещества, из которых 12,2 г растворяют при 10 С в 90 мл N,Nдиметилацетамида и 3,5 мл хлорида тионила,после 3 ч перемешивания вводят в среду 23,4 г анилина, полученную на стадии 2, и перемешивают в течение одной ночи, затем вливают смесь в 900 мл воды. Выделенный, промытый водой осадок перекристаллизуют в 200 мл диоксана. р = 30 г.HPLC: колонка 1; Элюент 5; вода/СН 3 СООNН 4 (0,01 М)/СН 3 СN; расход 1 мл/мин, градиент 85/15 50/50 за 20 мин. 4. Дихлорангидрид кислоты. 30,3 г изофталевого производного, полученного на предыдущей стадии, растворяют в 150 мл диоксана, содержащего 26 мл диметилформамида, и при 5 С вводят по каплям 42 мл хлорида тионила. После поддержания в течение 30 мин при 0 С смесь вливают в 550 мл воды, и образовавшийся осадок фильтруют,промывают водой и простым диизопропиловым эфиром. р = 26 г после сушки. 5. бис[N-ди(2,3,4,5,6-пентагидроксигексил)]-N,N'-(2,3-дигидроксипропил)-2,4,6-трибромо-5-[4-(4-аминометилбензамидо)бензамидо]изофталамид. а) 10 г дихлорангидрида кислоты вводят в раствор 15 г 1-деокси-1-(2,3-дигидроксипропиламино)-D-галактитола в 100 мл N-метилпирролидона при 60 С. Через 4 ч перемешивания при этой температуре среду, охладившуюся до комнатной температуры, вливают в 1 л изопропанола. Образовавшийся осадок отделяют и высушивают. 34 элюент 5; tr = 16 мин. б) Удаление фталимидной группы. 20,4 г твердого вещества, полученного на предыдущей стадии, вводят, перемешивая, в 80 мл N,N-диметилацетамида при 80 С, затем вводят 1,6 мл гидрата гидразина, растворенного в 20 мл воды. После поддержания в течение 3 ч при этой температуре реакционную среду вливают при комнатной температуре в 1 л этанола. Образовавшийся осадок отделяют, сушат, затем растворяют в 40 мл воды. При 0 С вводят примерно 2 мл водного раствора 6N НСl, чтобы снизить рН до 2, среду фильтруют на Celite,затем очищают на ионообменных смолах (анионообменная Amberlite и катионообменнаяIMAC). Таким образом получают 6 г целевого продукта.HPLC: колонка 1; элюент 5; tr = 24 - 29 мин. 6. Реакция с хелатным соединением А. 5,8 г амина, полученного на предыдущей стадии, и 1,1 г хелатного соединения (натриевая соль) растворяют в 12,5 мл воды и рН понижают до 6, добавляя водный раствор 1N HCl. Затем вводят 12,5 мл диоксана, 0,06 г НОВТ, затем 1,8 г EDCl и поддерживают среду при рН 6 в течение 4 ч, затем вливают ее в 150 мл этанола. Образовавшийся осадок собирают, затем очищают тангенциальной ультрафильтрацией на мембране с порогом разрыва 30 кДа из регенерированной целлюлозы в 50 см 2 (модуль Labscale deMillipore). Таким образом выделяют 5,6 г целевого продукта.HPLC: колонка 1; элюент 3; tr = 16 мин. Пример 12. Хелатное соединение гадолиния формулы 1, в которой m = 2 1. бис[N-ди(2,3,4,5,6-пентагидроксигексил)]2,4,6-трибромо-5-[4-(4-аминометилбензамидо)бензамид]изофталдиамид. а) В течение 4 ч при 60 С перемешивают раствор 10 г дихлорангидрида кислоты, полученной так же, как на стадии 4 примера 11, и 20,6 дисорбитиламина в 200 мл N-метилпирролидона. Реакционную среду вводят в 1,5 л изопропанола и получают 17,5 г осадка.HPLC: колонка 1; элюент 3; tr = 13 мин. Пример 13. Хелатное соединение гадолиния формулы 1. 4-(фталимидометилкарбониламино) бензойная кислота. При 10 С вводят 3,9 мл хлорида тионила в раствор 10 г фталоилглицина в 30 мл N,Nдиметилацетамида, затем через 3 ч перемешивания при этой температуре 4 г 4 аминобензойной кислоты. После поддержания в течение ночи при комнатной температуре среду вливают в 500 мл воды при 80 С. Выделяют образовавшийся осадок. 2. 5-(4-[4-(фталимидометилкарбониламино)бензамидо]бензамидо)-2,4,6-трибромоизофталевая кислота. Вводят при 10 С 4,8 мл хлорида тионила в раствор 19,5 г кислоты, полученной на предыдущей стадии, в 120 мл N,N-диметилацетамида,затем через 2 ч 30 мин 38 г 5-(4 амино)бензамидо-2,4,6-трибромоизофталевой кислоты. После поддержания в течение ночи при комнатной температуре среду сливают на 1 л воды, и образовавшийся осадок отделяют и промывают с помощью 400 мл подогретого диоксана. р = 7,4 г. 3. бис[N-ди(2,3,4,5,6-пентагидроксигексил)] 2,4,6-трибром-5-(4-(4-[фталимидометилкарбониламино]бензамидо)бензамидо)изофталдиамид. При 5 С вводят 21 мл хлорида тионила в раствор 16,5 г дикислоты, полученной на предыдущей стадии; в 90 мл диоксана и 13,6 мл диметилформамида. После перемешивания в течение 2 ч 30 мин среду сливают на 400 мл воды, и образовавшийся осадок сушат, затем вводят в раствор 29,3 г дисорбитиламина в 150 мл N-метилпирролидона при 70 С. После перемешивания при этой температуре в течение 4 ч среду охлаждают до комнатной температуры,выделяют соли, и вливают фильтрат в 1 л изопропанола. Образовавшийся осадок промывают с помощью 1,2 л этанола. р = 23 г.HPLC: колонка 1; элюент 2; tr = 28 - 33 мин. 4. Удаление фталимидной группы. 22 г фталимида, полученного на предыдущей стадии, и 1,4 мл гидрата гидразина вводят в смесь 80 мл N,N-диметилацетамида и 20 мл воды при 80 С. После поддержания в течение 3 ч при этой температуре среду охлаждают до 20 С,затем сливают в 300 мл этанола. Образовавшийся осадок высушивают, растворяют в 40 мл воды, раствор охлаждают до 0 С и добавляют 3 мл 36 6N соляной кислоты для доведения рН до 1,5. После фильтрации на Celite фильтрат элюируют на 45 мл анионообменной смолы AmberliteIRA67 (Rohm et Hass), 50 мл катионообменной смолы IMAC HPIIIE, затем на 16 мл анионообменной смолы Amberlite IRA458. После нейтрализации и фильтрации на мембране (0,22 мкм) раствор обезвоживают. р = 11,7 г.HPLC: колонка 1; элюент 2; tr = 16 - 20 мин. 5. Конденсация на хелатном соединении А. 11,2 г амина, полученного на предыдущей стадии, и 1,9 г хелатного соединения А (натриевая соль) растворяют в 24 мл воды. рН раствора доводят до 6,1 добавлением водного раствора 2N НСl. Тогда вводят 24 мл диоксана, затем 2,7 г хлоргидрата 1-(3-диметиламинопропил)-3 этилкарбодиимида и 0,094 г гидрокси бензотриазола. После перемешивания в течение 3 ч при комнатной температуре смесь вливают в 300 мл этанола и собирают образовавшийся осадок. После ультрафильтрации модулем Labscale, мембрана которого имеет порог разрыва 10 кДа, раствор лиофилизуют. р = 10,2 г.HPLC: колонка 1; элюент 7: СН 3 СN/P.I.C. A (Waters) градиент за 25 мин 25/75 - 30/70, Р.I.С. А Н 2 О/Н 3 РO4/(С 4 Н 9)4N+HSO4-; tr = 14 мин. Пример 14. Хелатное соединение гадолиния формулы 1, в которой m = 1 Растворяют 1,8 г хелатного соединения гадолиния и (1,4,7,10-тетраазациклододекан)1,4,7,10-тетра(2-янтарной) кислоты и 13,5 г бис[N-ди(2,3,4,5,6-пентагидроксигексил)]-2,4,6 трибромо-5-(4-[4-аминоацетамидобензамидо] бензоилглициламино)изофталдиамида,полученного как на стадии (е) примера 3, в 70 мл воды и вводят водный раствор 1N HCl для доведения рН до 6. После добавления 2 г EDCl смесь поддерживают в течение 2 ч при 40 С. Затем осуществляют тангенциальную ультрафильтрацию на кассете Minisette Filtron, содержащей мембрану из полиэфирсульфона с порогом разрыва 5 кДа, и получают 2 л фильтрата, затем осадок, оставшийся на мембране, оставляют на 2 ч в контакте с 15 г сажи Darco G60, выпускаемой фирмой Aldrich. После отделения сажи с помощью фильтрации и сухого обогащения,выделяют 5 г белого твердого вещества.CES: Условия 1; tr = 35 мин. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Хелатное соединение катиона парамагнитного металла и соединения формулы I 38 3. Хелатное соединение катиона парамагнитного металла и соединения формулы I и его соли по п.2, где R' является НООС-СН-(СН 2)2CONHR или CH2-COOH, где m=1 или 2,R' является Н, (C1-C4)алкильным или гидроксиалкильным радикалом, СН 2-СООН, CH2CONZ1Z2, причем Z1 и Z2 являются независимо друг от друга Н или (C1-C4)алкильным радикалом, возможно гидроксилированным,или R является радикалом(CH2)2NHCO,Z' является связью, О, S, NQ, СН 2, СО, CONQ, NQ-CO, NQ-CO-NQ, CO-NQ-CH2-CONQ,Z" является CO-NQ, NQ-CO или CO-NQCH2-CO-NQ, NQ-CO-CH2-NQ-CO,где Q является Н или (C1-C4)алкильным радикалом, возможно гидроксилированным,R1, R2, R3, R4, R5 независимо друг от друга выбирают из Н, Вr, Cl, I, CO-NQ1Q2 или N(Q1)-CO-Q2, a Q1 и Q2, одинаковые или разные, выбирают из (С 2-С 6)алкильных групп, возможно гидроксилированных и в которых может быть включен атом кислорода, таким образом, что Q1 и Q2 содержат вместе от 4 до 10 ОН-групп, при этом, по меньшей мере, 1, но не более 2 радикалов R1, R2, R3, R4, R5 являются амидогруппами,и его фармакологически приемлемые соли с неорганическими или органическими основаниями. 2. Хелатное соединение катиона парамагнитного металла и соединения формулы I и его соли по п.1,где m=2,R' является а=1,Z является связью, СН 2 или CH2CONH,Z' является CONH, NHCO, CONH-CH2CONH или NHCONH,Z" является CONH, или CONH-CH2CONH,тогдаZ' является CONH, NHCONH или CONHCH2-CONH,Z" является CONH или CONH-CH2-CONH,R1, R3 и R5 являются все три Вr или I,R2 и R4 являются CONQ1Q2, где Q1 и Q2 выбирают из гидроксилированных(С 2 С 6)алкильных групп, содержащих вместе 6-10 ОН-групп или от 4 до 8 ОН-групп, если Q1 и/или Q2 прерваны атомом кислорода. 4. Хелатное соединение катиона парамагнитного металла и соединения формулы I и его соли по п.3, где R1 являетсяZ является СН 2 или CH2CONH,Z' является CONH или NHCONH. 5. Хелатное соединение катиона парамагнитного металла и соединения формулы I и его соли по п.4, где R' является СН 2 СО 2 Н илиZ' и Z" являются CONH. 6. Хелатное соединение катиона парамагнитного металла и соединения формулы I и его соли по п.1, где m=2,R' является а=2,Z является СН 2 или CH2CONH,Z' является CONH или NHCO,Z" является CONH или CONH-CH2-CONH,R1, R3 и R5 являются все три Вr или I,тогда R2 и R4 являются оба CONQ1Q2,или R3 является CONQ1Q2, тогда R1, R2, R4,R5 являются Н, Вr или I. 7. Хелатное соединение катиона парамагнитного металла и соединения формулы I и его соли по п.1, где m=1,R' является а=1,Z является CH2 или CH2CONH,Z' является CONH,Z" является CONH или CONH-CH2-CONH,R1, R3 и R5 являются Вr,R2 и R4 являются CONQ1Q2, где Q1 и Q2 гидроксилированные (C2-C6)алкильные группы,содержащие вместе 6-10 ОН-групп. 8. Хелатное соединение по одному из пп.17, где катионом металла является Gd3+. 9. Хелатное соединение гадолиния и его соли формулы I по п.1,где m=2,R1 является а R является 10. Хелатное соединение гадолиния и его соли формулы I по п.1, где m=2, 40CH2-CONZ1Z2, причем Z1 и Z2 являются независимо друг от друга Н или (C1-C4)алкильным радикалом, возможно гидроксилированным,или R' является радикаломCH2CHOH-СН 2 ОН или СН 2(СНОН)4 СН 2 ОН. 11. Контрастный продукт для диагностического магнитно-резонансного исследования,содержащий эффективное количество хелатного соединения по одному из пп.1-10, в фармацевтически подходящем носителе. 12. Продукт для сцинтиграфии, содержащий меченное радиоактивным изотопом хелатное соединение катиона металла и соединения формулы(CH2)2NHCO,Z' является связью, О, S, NQ, CH2, СО,CO-NQ, NQ-CO, NQ-CO-NQ, CO-NQ-CH2CONQ,Z" является CO-NQ, NQ-CO или CO-NQCH2-CO-NQ, NQ-CO-CH2-NQ-CO, где Q является Н или (C1-C4)алкильным радикалом, возможно гидроксилированным,R1, R2, R3, R4, R5 независимо друг от друга выбирают из Н, Вr, Cl, I, CO-NQ1Q2 или N(Q1)CO-Q2, a Q1 и Q2, одинаковые или разные, выбирают из (С 2-С 6)алкильных групп, возможно гидроксилированных, в которые может быть включен атом кислорода, таким образом, что Q1 и Q2 содержат вместе от 4 до 10 ОН-групп, при этом, по меньшей мере, 1, но не более 2 радикалов R1, R2, R3, R4, R5 являются амидогруппами,и его фармакологически приемлемые соли с неорганическими или органическими основаниями.
МПК / Метки
МПК: C07D 257/02, A61K 49/06
Метки: металлов, макроциклическими, диагностических, соединения, хелатные, соединениями, полиаминокарбоновыми, исследований, использование
Код ссылки
<a href="https://eas.patents.su/21-1387-helatnye-soedineniya-metallov-s-makrociklicheskimi-poliaminokarbonovymi-soedineniyami-i-ih-ispolzovanie-dlya-diagnosticheskih-issledovanijj.html" rel="bookmark" title="База патентов Евразийского Союза">Хелатные соединения металлов с макроциклическими полиаминокарбоновыми соединениями и их использование для диагностических исследований</a>
Предыдущий патент: Композиции, содержащие антигрибковый агент и ацетатный буфер.
Следующий патент: Усовершенствованные композиции, содержащие креатин
Случайный патент: Каркасная система навесного вентилируемого фасада многоэтажного здания

























