Композиции слитых белков-аналогов glp-1
Формула / Реферат
1. Композиция стабильного раствора, содержащая терапевтически эффективное количество слитого белка GLP-1-Fc в интервале значений рН приблизительно от рН 6 до приблизительно рН 8,5, где слитый белок GLP-1-Fc включает в себя аналог GLP-1, содержащий последовательность, выбранную из группы, состоящей из
a) (SEQ ID NO:1)

где Xaa8 выбран из Gly и Val;
b) (SEQ ID NO:2)

где Xaa8 выбран из Gly и Val;
с) (SEQ ID NO:3)

где Xaa8 выбран из Gly и Val;
d) (SEQ ID NO:4)

где Хаа8 выбран из Gly и Val;
е) (SEQ ID NO:5)

где Хаа8 выбран из Gly и Val;
f) (SEQ ID NO:6)

где Xaa8 выбран из Gly и Val;
слитый с Fc-областью иммуноглобулина, которая включает в себя последовательность SEQ ID NO:7

где
Хаа в положении 16 представляет собой Pro или Glu; Хаа в положении 17 представляет собой Phe, Val или Ala; Хаа в положении 18 представляет собой Leu, Glu или Ala; Хаа в положении 80 представляет собой Asn или Ala; и Хаа в положении 230 представляет собой Lys или отсутствует.
2. Композиция стабильного раствора по п.1, отличающаяся тем, что значение рН заключено в интервале приблизительно от рН 6 до приблизительно рН 7,5.
3. Композиция стабильного раствора по п.2, отличающаяся тем, что значение рН заключено в интервале приблизительно от рН 6 до приблизительно рН 7.
4. Композиция стабильного раствора по п.3, отличающаяся тем, что значение рН заключено в интервале приблизительно от рН 6 до приблизительно рН 6,5.
5. Композиция стабильного раствора по п.4, отличающаяся тем, что значение рН составляет приблизительно рН 6.
6. Композиция стабильного раствора по п.4, отличающаяся тем, что значение рН составляет приблизительно рН 6,5.
7. Композиция стабильного раствора по п.1, отличающаяся тем, что дополнительно содержит Твин 20Т.
8. Композиция стабильного раствора по п.1, отличающаяся тем, что дополнительно содержит Твин 80Т.
9. Композиция стабильного раствора по п.1, отличающаяся тем, что дополнительно содержит NaCl.
10. Композиция стабильного раствора по п.1, отличающаяся тем, что дополнительно содержит м-крезол.
11. Композиция стабильного раствора по п.1, отличающаяся тем, что дополнительно содержит Твин 20Т, NaCl и м-крезол.
12. Композиция стабильного раствора по п.1, отличающаяся тем, что дополнительно содержит Твин 80Т, NaCl и м-крезол.
Текст
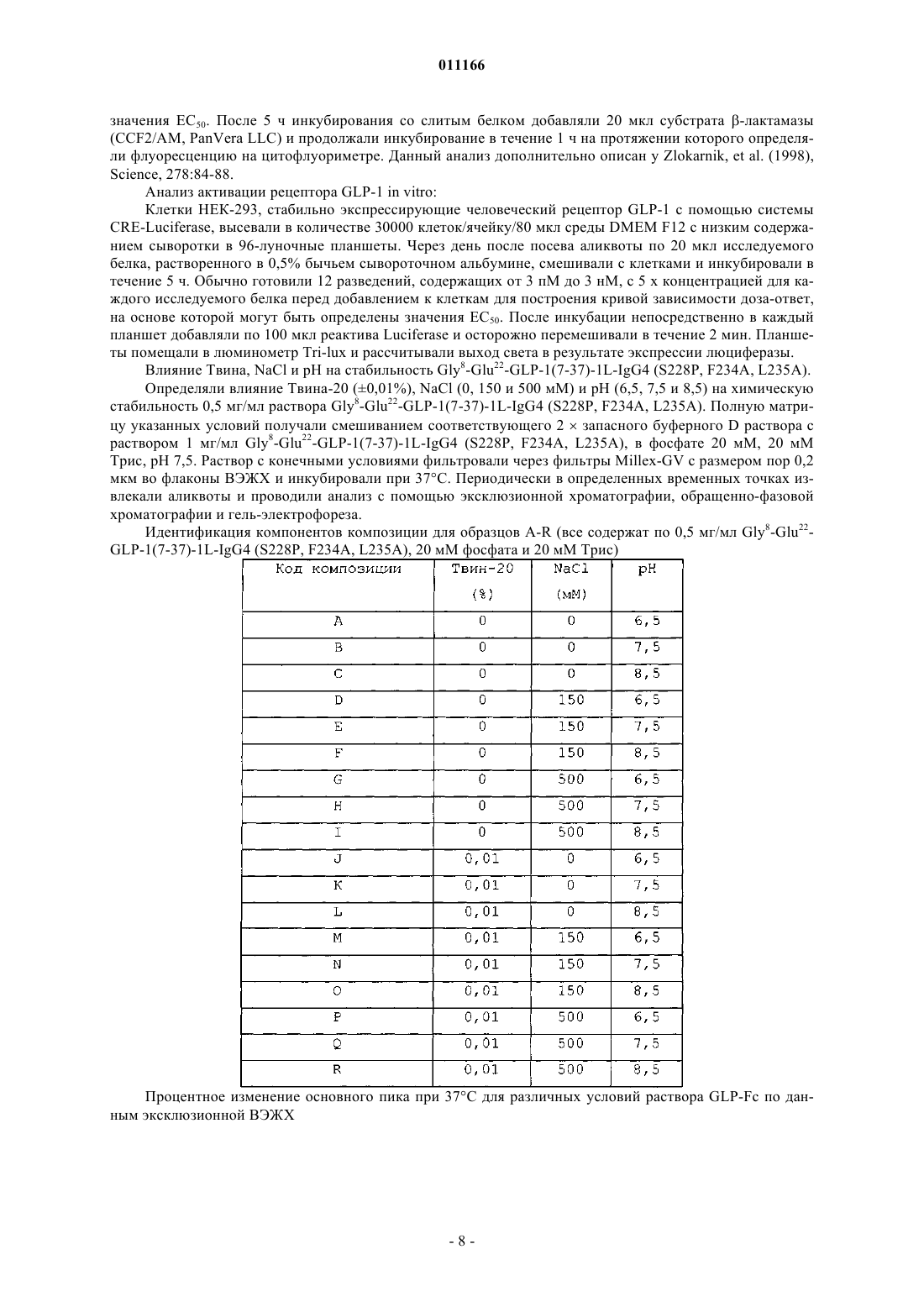
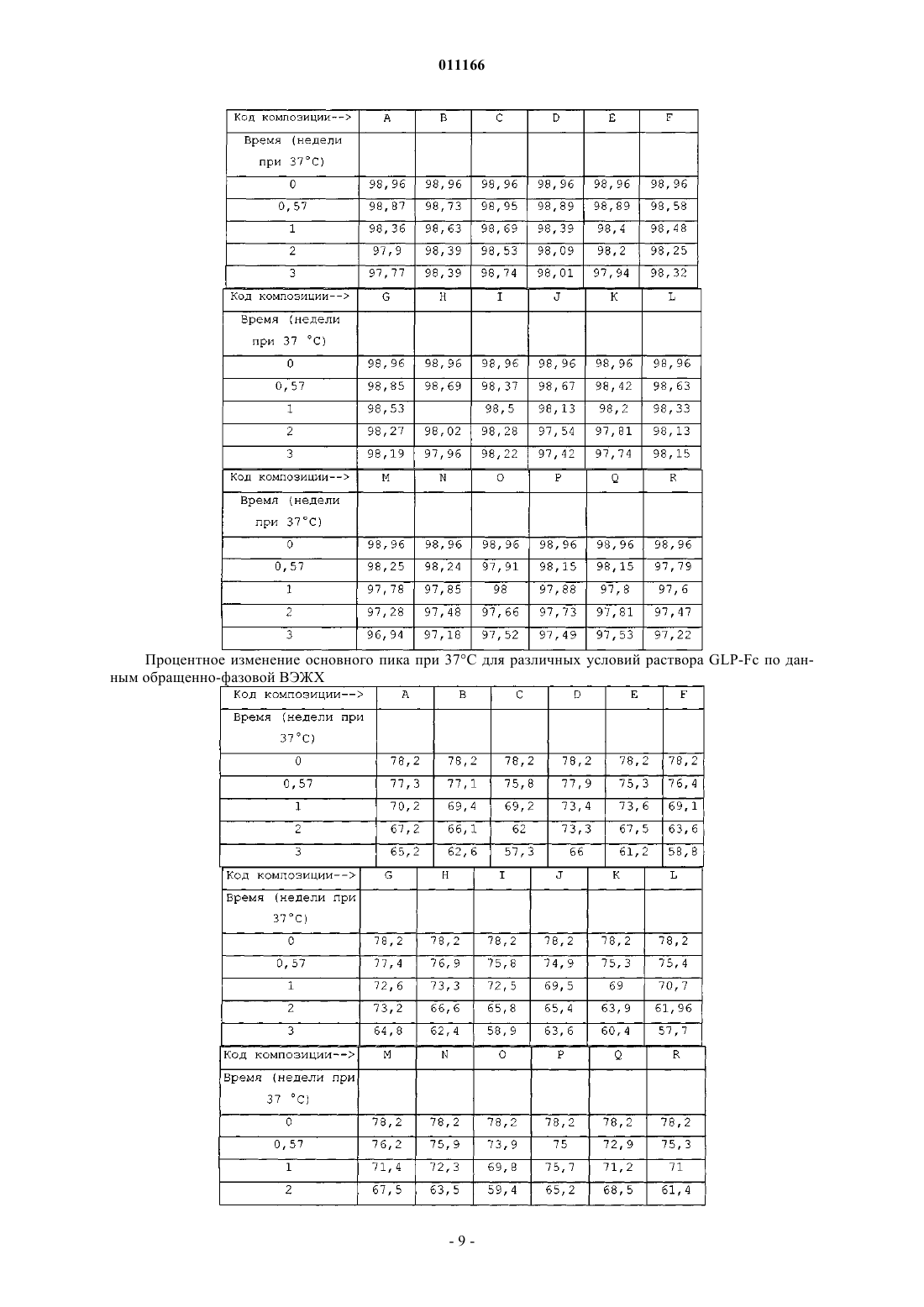
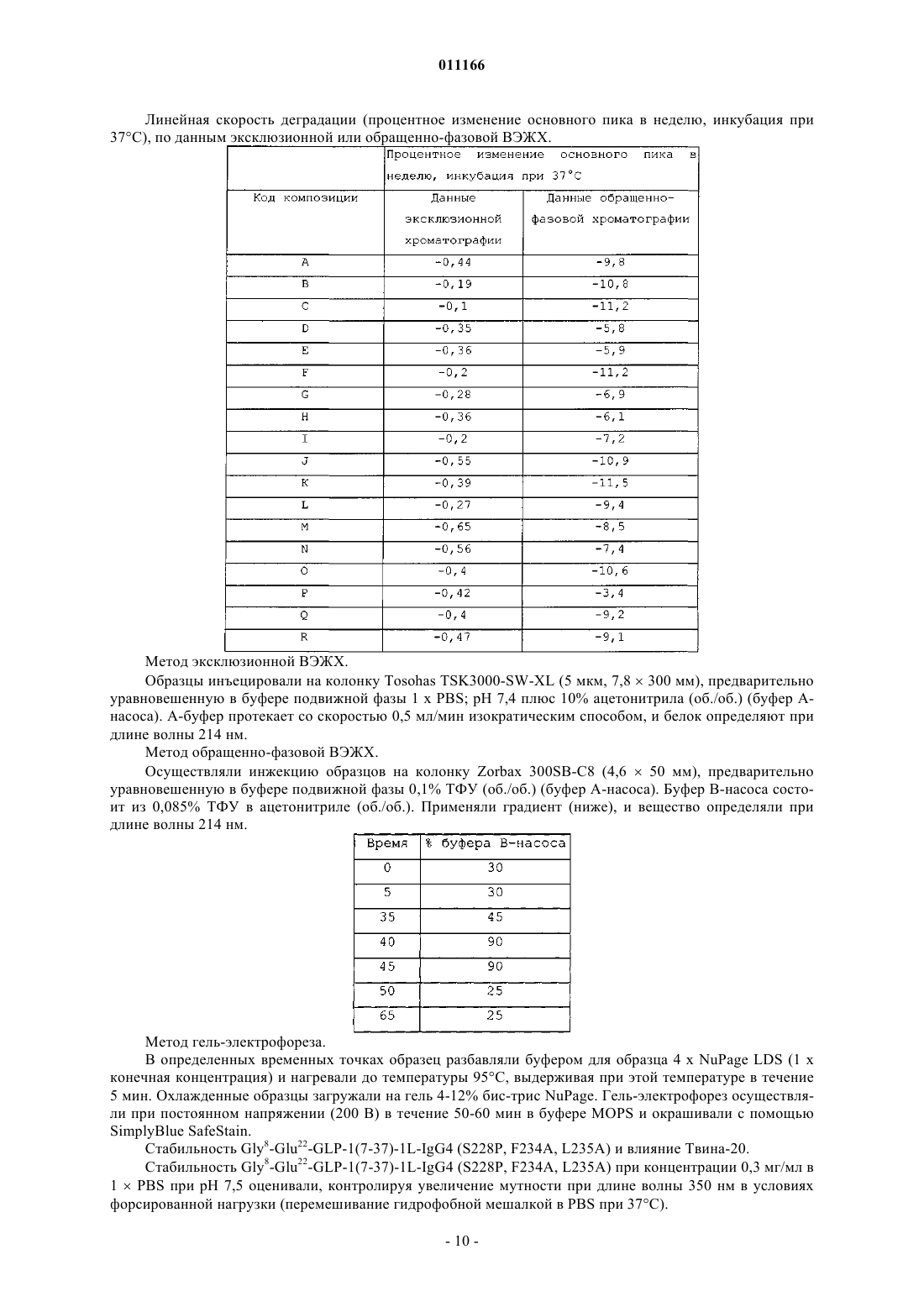
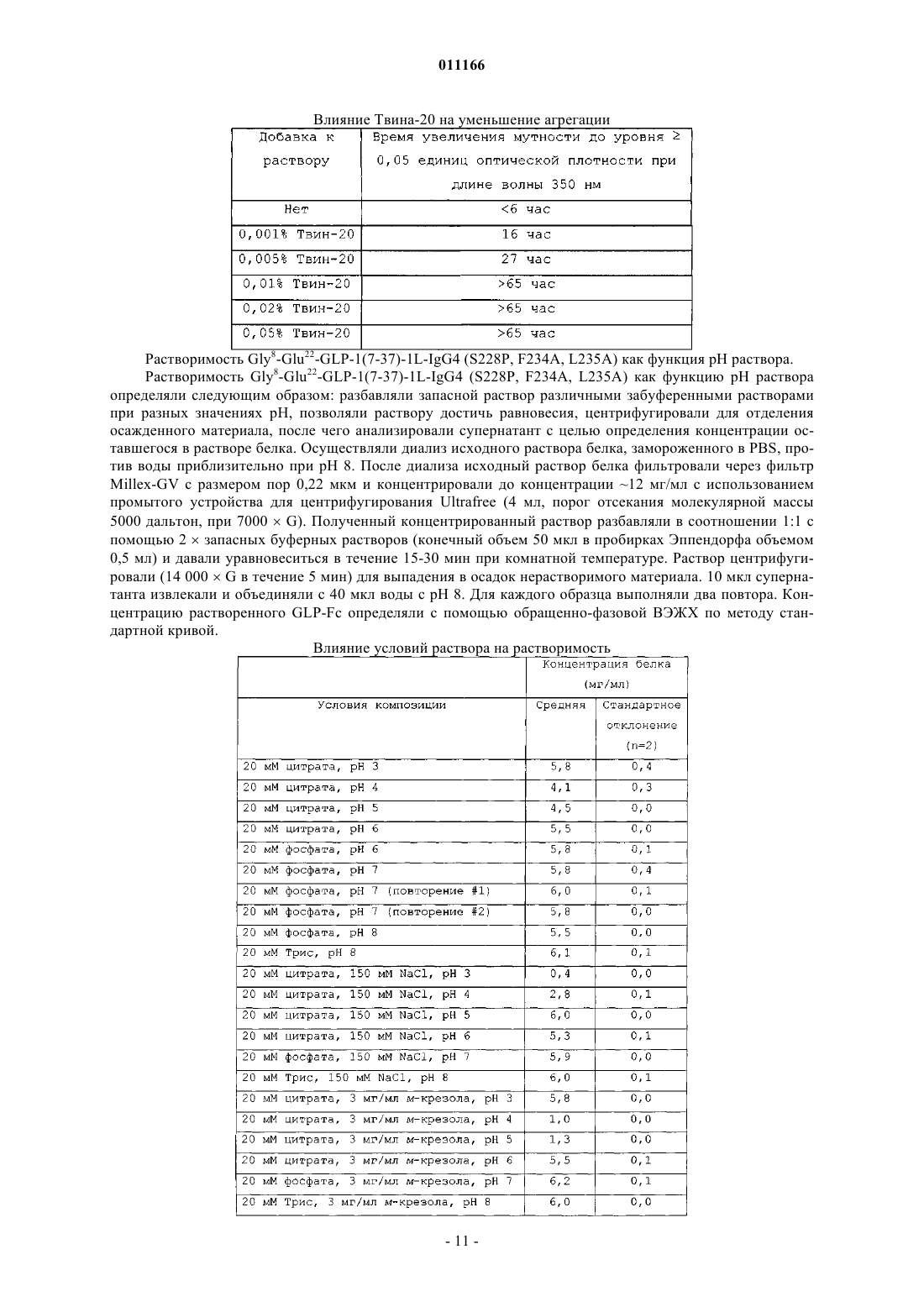
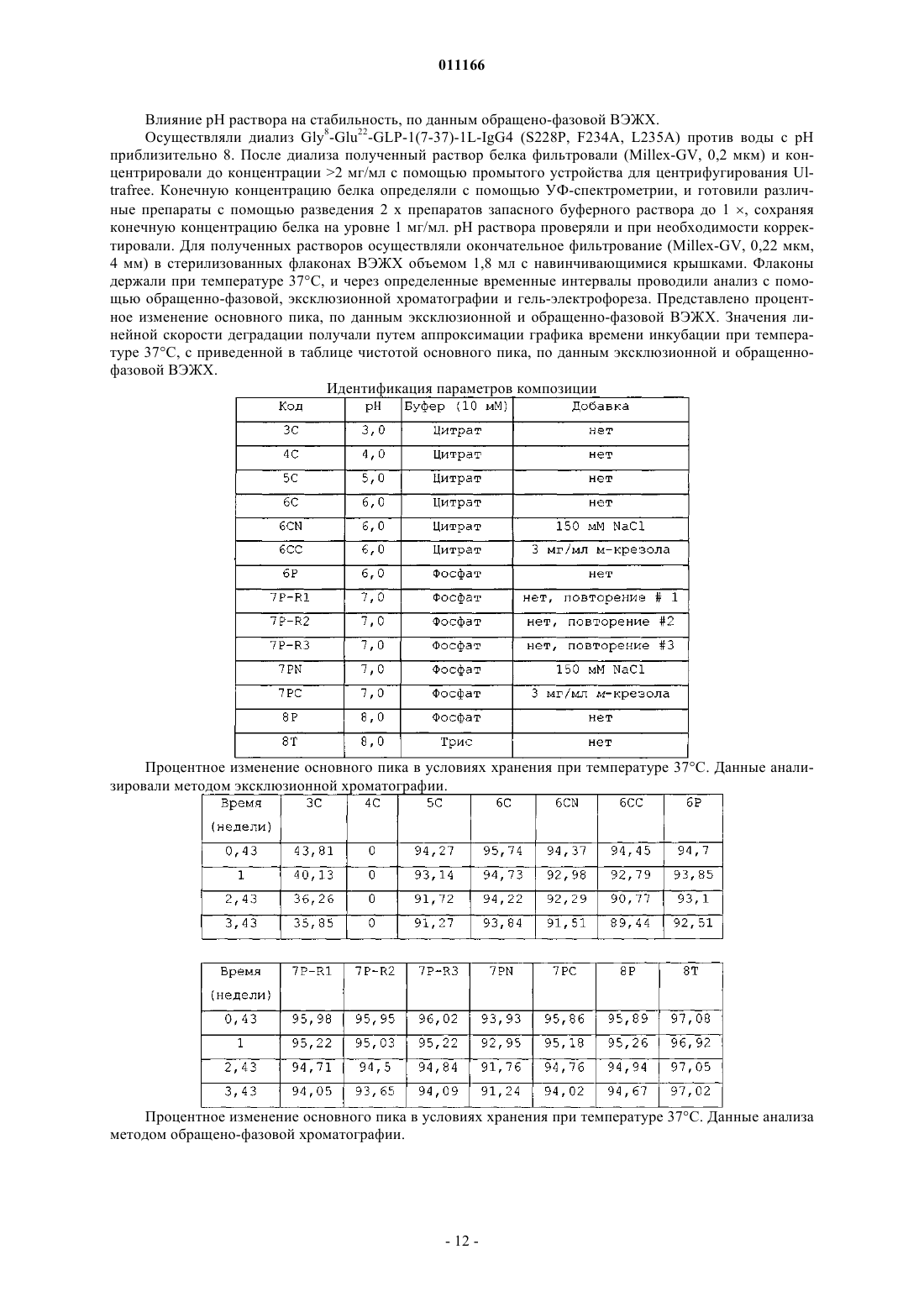
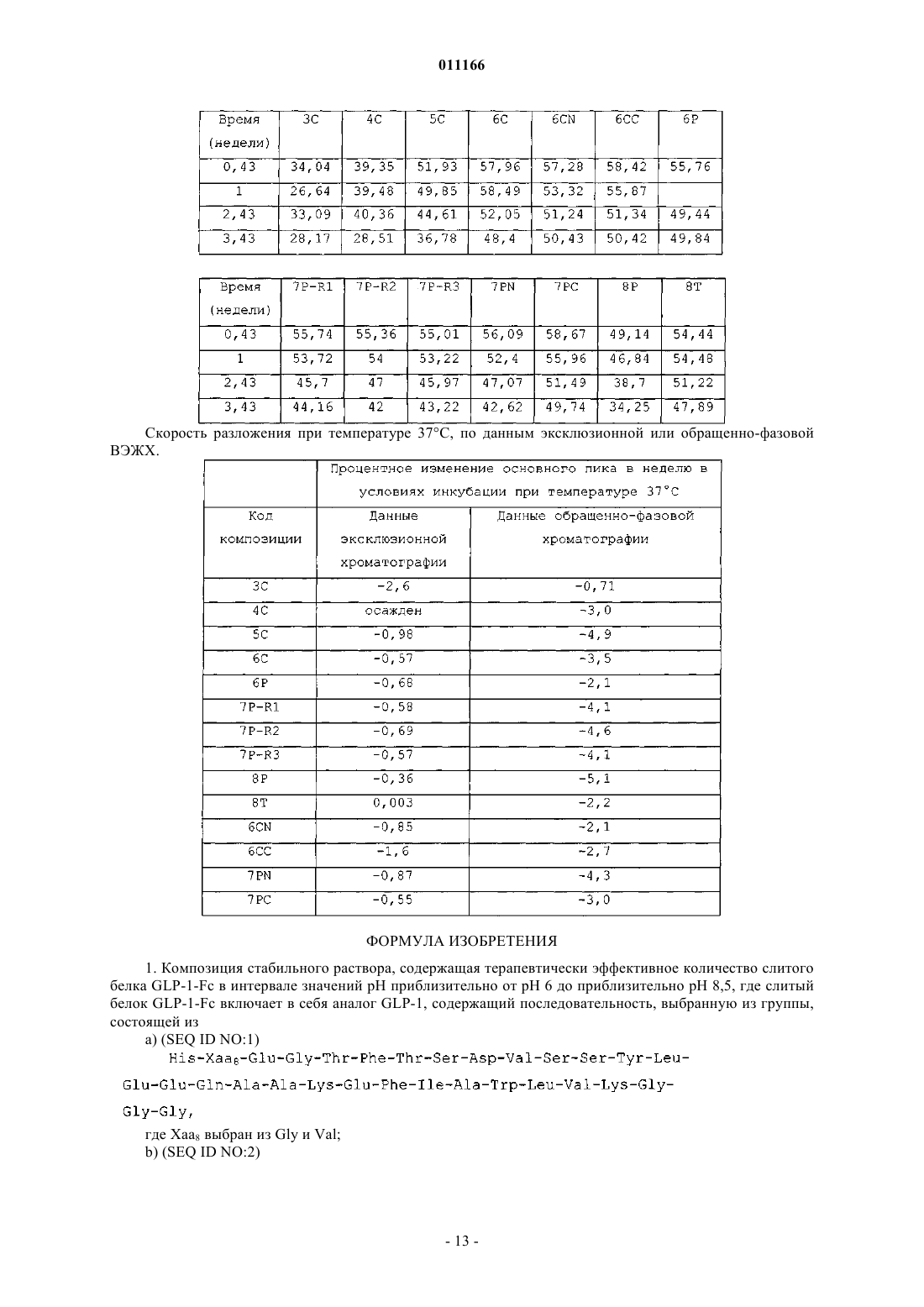
011166 Данное изобретение относится к композициям аналогов глюкагоноподобного пептида, слитых с белками, обеспечивающими стабилизацию слитых белков. Данные композиции могут применяться для лечения диабета, а также многих других состояний или расстройств. Предпосылки излбретения Аналоги и производные глюкагоноподобного пептида-1 (GLP-1) продемонстрировали свою перспективность в клинических испытаниях по лечению диабета 2 типа. GLP-1 вызывает многочисленные биологические явления, такие как стимуляция секреции инсулина, ингибирование секреции глюкагона,замедление опорожнения желудка, замедление перистальтики желудка или перистальтики кишечника, а также способствует снижению массы тела. Значимой характеристикой GLP-1 является его способность стимулировать секрецию инсулина без сопутствующего риска гипогликемии, который наблюдается при применении инсулинотерапии или некоторых видов пероральных лекарственных средств, которые оказывают свое действие путем повышения экспрессии инсулина. Пригодность терапии с применением GLP-1 пептидов ограничивалась тем фактом, что GLP-1(1-37) обладает слабой активностью, и два встречающихся в природе укороченных в результате процессинга пептида, GLP-1(7-37)ОН и GLP-1(7-36)NH2 быстро выводятся in vivo и отличаются крайне коротким периодом полувыведения in vivo. Известно, что эндогенная дипептидилпептидаза IV (DPP-IV) инактивирует циркулирующие GLP-1 пептиды путем удаления N-концевых остатков гистидина и аланина и представляет собой основную причину короткого периода полувыведения in vivo. Применялись различные подходы для удлинения элиминационного периода полувыведения пептида GLP-1 или снижения клиренса пептида из организма при сохранении биологической активности. Один из подходов включает слияние пептида GLP-1 с частью Fc иммуноглобулина. Иммуноглобулины обычно отличаются длительным периодом полувыведения из кровеносного русла in vivo. Например, молекулы IgG могут иметь период полувыведения у человека до 23 дней. Часть Fc иммуноглобулина ответственна, в частности, за такую стабильность in vivo. Слитые белки GLP-1-Fc обладают преимуществом стабильности, которая обеспечивается частью Fc иммуноглобулина, при сохранении биологической активности молекулы GLP-1. Хотя данный подход осуществим для лекарственных средств на основе GLP-1 (см. WO 02/46227),существует общая проблема, касающаяся антигенности различных слитых белков при повторном введении на протяжении длительных периодов времени. Эта проблема особенно касается лекарственных средств на основе слитых белков GLP-1-Fc, поскольку больной диабетом должен получать лечение на протяжении всей жизни с момента установления диагноза этого заболевания. Кроме того, данная проблема может касаться лекарственных средств на основе слитого белка Fc, если часть Fc сохраняет нежелательные эффекторные функции. Этот подход рассматривается в PCT/US 04/15595 (WO2005/000892),где проблемы, связанные с потенциальной иммуногенностью и эффекторной активностью, которые вызваны введением слитых белков GLP-1-Fc, преодолеваются путем идентификации специфических белков слияния GLP-1-Fc, которые обладают сниженным потенциалом развития иммунной реакции после повторного и длительного введения и больше не обладают эффекторной функцией. Слитые белки такого рода с технической точки зрения являются слишком большими и сложными для получения синтетическим или рекомбинантным путем в бактериальных клетках. Такие слитые белки обычно получают в клетках млекопитающих, таких как CHO, 293 или NS0. Обнаружено, что слитые белки, вырабатываемые клетками млекопитающих, легче подвергаются деградации под действием эндогенных протеаз и химической модификации, чем не слитые белки, вырабатываемые бактериальными клетками. Поиск решения данной проблемы является объектом данного изобретения. Обнаружено, что композиция, содержащая слитый белок GLP-1-Fc, забуференная в интервале значений рН приблизительно от рН 6 до приблизительно рН 8,5, обеспечивает повышенную химическую стабильность. Краткое описание изобретения С целью преодоления проблемы химической стабильности слитых белков GLP-1-Fc авторы данного изобретения разработали композицию стабильного раствора. В частности, авторами изобретения обнаружено, что композиция, которая содержит терапевтически эффективное количество слитого белка GLP1-Fc при значениях рН приблизительно от рН 6 до приблизительно рН 8,5, предпочтительно приблизительно от рН 6 до приблизительно рН 7,5, приблизительно от рН 6 до приблизительно рН 7, приблизительно от рН 6,5 до приблизительно рН 7,5 или приблизительно от рН 6 до приблизительно рН 6,5, и даже более предпочтительно, приблизительно рН 6 или приблизительно 6,5, обеспечивает неожиданную и значительно более высокую химическую стабильность по сравнению со слитыми белками GLP-1-Fc при значениях рН за пределами указанных интервалов. Данное изобретение также включает в себя способы лечения пациентов, страдающих инсулиннезависимым, а также инсулинзависимым сахарным диабетом, ожирением и различными другими расстройствами, включающие в себя введение композиций на основе слитых белков GLP-1-Fc. Подробное описание изобретения Слитые белки включают в себя соединение GLP-1, слитое с частью Fc иммуноглобулина, аналогом части Fc иммуноглобулина или фрагментом части Fc иммуноглобулина. С-конец соединения GLP-1 может быть слит непосредственно или через пептидный линкер с N-концом белка Fc. Такие слитые белки-1 011166 являются биологически активными и имеют увеличенный период полувыведения в сравнении с природным GLP-1. Соединения GLP-1, которые составляют часть слитого белка, включают в себя полипептиды,содержащие приблизительно от 25 до приблизительно 39 встречающихся или не встречающихся в природе аминокислот, которые обладают достаточной гомологией с природным GLP-1(7-37)ОН, так, что они демонстрируют инсулинотропную активность путем связывания с рецептором GLP-1 на -клетках поджелудочной железы. Соединение GLP-1 обычно включает в себя полипептид, который имеет аминокислотную последовательность GLP-1(7-37)ОН, аналог GLP-1(7-37)ОН, фрагмент GLP-1(7-37)ОН или фрагмент аналога GLP-1(7-37)ОН. Примеры слитых белков, пригодных для указанных композиций, включают в себя слитые белки,содержащие аналог GLP-1, включающий в себя последовательность, выбранную из группы, которая состоит из-2 011166 где Хаа в положении 16 представляет собой Pro или Glu; Хаа в положении 17 представляет собой Phe, Val или Ala; Хаа в положении 18 представляет собой Leu, Glu или Ala; Хаа в положении 80 представляет собой Asn или Ala; и Хаа в положении 230 представляет собой Lys или отсутствует. С-конец части аналога GLP-1 и N-конец части Fc слитых белков предпочтительно слиты вместе через 1, 1,5 или 2 повторяющихся фрагмента богатого глицином (G-rich) пептидного линкера, имеющего последовательность Слитые белки, пригодные для композиций согласно изобретению, включают в себя часть аналогаGLP-1 и часть Fc. Часть аналога GLP-1 и часть Fc включают в себя замены в природной последовательности GLP-1 и последовательности человеческого IgG4, соответственно, которые придают белку повышенную активность и стабильность in vivo в сравнении с природным GLP-1 или аналогами GLP-1, не слитыми с последовательностью Fc, при снижении потенциала образования антител после длительного и повторного введения человеку. Природный GLP-1 обрабатывают in vivo таким образом, что от молекулы отщепляются первые 6 аминокислот. Таким образом, аминоконцу GLP-1 был присвоен номер 7, а карбоксиконцу присвоен номер 37. Другие аминокислоты в полипептиде пронумерованы последовательно, как показано в SEQ IDN0:9. Например, положение 8 представляет собой аланин, а положение 22 представляет собой глицин. Обработанный пептид может быть далее модифицирован in vivo таким образом, что С-концевой остаток глицина удаляется и заменяется амидной группой. Таким образом, GLP-1(7-37)ОН и GLP-1(7-36)амид представляют собой две природные формы молекулы. GLP-1(7-37)ОН имеет аминокислотную последовательность SEQ ID NO:9:(SEQ ID NO:9) Часть аналога GLP-1 слитого белка включает в себя три основных замены в положениях 8, 22 и 36 по отношению к природному GLP-1(7-37). Замена в положении 8 снижает скорость, с которой эндогенный фермент дипептидилдипептидаза IV (DPP-IV) инактивирует аналог. DPP-IV расщепляет природныйGLP-1 между 2-ой и 3-ей аминокислотами (между положениями 8 и 9) , причем образующаяся молекула обладает более низкой активностью. Таким образом, слитые белки, пригодные для композиций согласно изобретению, являются устойчивыми к действию DPP-IV. Замена в положении 22 снижает потенциал молекулы к агрегации и повышает активность молекулы. Замена в положении 36 в контексте аналога с заменами в положениях 8 и 22, а также в контексте целого слитого белка снижает риск того, что слитый белок будет вызывать нейтрализующую иммунную реакцию после повторного и длительного введения человеку. С-конец аналога GLP-1 предпочтительно представляет собой одну из следующих последовательностей: Слитые белки, пригодные для композиций согласно изобретению, содержат часть Fc, происходящую из человеческого IgG4, включающую в себя одну или больше замен в сравнении с человеческой последовательностью дикого типа. В данном описании часть Fc иммуноглобулина имеет значение, которое данный термин обычно имеет в области иммунологии. Конкретно, данный термин относится к фрагменту антитела, который не содержит два антигенсвязывающих участка (Fab-фрагменты) антитела. Часть Fc состоит из константных участков антитела из обеих тяжелых цепей, которые связаны с помощью нековалентных взаимодействий и дисульфидных связей. Часть Fc может включать в себя шарнирные области и простираться через домены СН 2 и СН 3 до С-конца антитела. Часть Fc может дополнительно включать в себя один или более сайтов гликозилирования. Существует пять типов человеческих иммуноглобулинов с различными эффекторными функциями и фармакокинетическими свойствами. IgG является наиболее стабильным из пяти типов, с периодом полувыведения из сыворотки человека приблизительно 23 дня. Существует четыре подкласса IgG (G1, G2,G3 и G4), все из которых обладают различными биологическими функциями, известными как эффектор-3 011166 ные функции. Такие эффекторные функции в целом опосредованы взаимодействием с рецептором Fc(FcR) или связыванием C1q и связыванием комплемента. Связывание с FcR может вести к антителозависимому клеточно-опосредованному цитолизу, тогда как связывание с факторами комплемента может вести к опосредованному комплементом лизису клеток. В ходе проектирования слитых белков Fc, где часть Fc используется исключительно в силу его способности увеличивать период полувыведения, важно минимизировать любые эффекторные функции. Таким образом, слитые белки, пригодные для композиций согласно изобретению, происходят из участка Fc человеческого IgG4 благодаря его сниженной способности связываться с FcR и факторами комплемента по сравнению с другими подтипами IgG. Однако показано, что IgG4 истощает клетки-мишени у человека [Issacs et al., (1996) Clin. Exp. Immunol. 106:427433]. Поскольку в слитых белках, предназначенных для воздействия на бета-клетки поджелудочной железы с целью индукции экспрессии инсулина, используется происходящий из IgG4 участок, слитый белок Fc может вызывать иммунную реакцию против бета-клеток поджелудочной железы при взаимодействии слитого белка с рецептором GLP-1, присутствующим на бета-клетках поджелудочной железы. Таким образом, участок IgG4 Fc, который представляет собой часть слитых белков, содержит замены, которые устраняют эффекторную функцию. Часть Fc IgG4 в слитых белках может содержать одну или более из следующих замен: замену глутамата пролином (остаток 233), фенилаланина аланином или валином (остаток 234) и лейцина аланином или глутаматом (остаток 235) (Нумерация ЕС, Kabat, E.A. et al.(1991) Sequences of Proteins of Immunological Interest, 5th Ed. U.S. Dept. of Health and Human Services, Bethesda, MD, NIH Publication no. 91-3242). Указанные остатки соответствуют положениям 16, 17 и 18 вSEQ ID NO:7. Кроме того, удаление N-связанного сайта гликозилирования на участке Fc IgG4 путем замещения Asn на Ala (остаток 297) (нумерация ЕС), что соответствует положению 80 последовательностиSEQ ID NO:7, представляет собой другой способ, обеспечивающий устранение остаточной эффекторной активности в контексте слитого белка. Кроме того, часть слитых белков Fc IgG4 содержит замену, которая стабилизирует образование димера тяжелых цепей и предупреждает образование полу-IgG4-Fc-цепей. Слитые белки предпочтительно существуют в виде димеров, соединенных с помощью дисульфидных связей и различных нековалентных взаимодействий. IgG4 дикого типа содержит фрагмент Pro-Pro-Cys-Pro-Ser-Cys (SEQ ID NO:16), начинающийся с остатка 224 (нумерация ЕС). Данный фрагмент в одинарной цепи Fc аналога GLP-1 образует дисульфидные связи с соответствующим фрагментом в другой цепи Fc аналога GLP-1. Однако присутствие серина в фрагменте вызывает образование одноцепочечных слитых белков. Данное изобретение охватывает слитые белки Fc, где последовательность IgG4 дополнительно модифицирована таким образом,что серии в положении 228 (нумерация ЕС) заменен пролином (аминокислотный остаток 11 в SEQ IDNO:7). С-концевой остаток лизина, присутствующий в природной молекуле, может быть удален в происходящей из IgG4 части Fc слитых белков, которые обсуждаются в данном описании (положение 230 последовательности SEQ ID NO:7; удаленный лизин обозначен как des-K). Слитые белки, которые экспрессируются в некоторых видах клеток (таких как клетки NSO), где лизин кодируется C-концевым кодоном,являются гетерогенными в том смысле, что часть молекул содержит лизин в качестве С-концевой аминокислоты, тогда как в других молекулах лизин удален. Удаление происходит под действием протеазы в ходе экспрессии в некоторых видах клеток млекопитающих. Таким образом, во избежание описанной гетерогенности, предпочтительно, чтобы в конструктах, экспрессирующих слитые белки Fc, отсутствовал C-концевой кодон для лизина. Предпочтительно, если С-концевая аминокислота части аналога GLP-1, который обсуждается в данном описании, слита с N-концом части аналога IgG4 Fc через богатый глицином линкер. Функция и стабильность слитых белков in vivo могут быть оптимизированы путем добавления пептидных линкеров небольшого размера для предупреждения потенциально нежелательных взаимодействий с доменами. Кроме того, богатый глицином линкер обеспечивает определенную структурную гибкость, таким образом, что часть аналога GLP-1 может продуктивно взаимодействовать с рецептором GLP-1 на клеткахмишенях, таких как бета-клетки поджелудочной железы. Однако такие линкеры могут значительно повышать риск иммуногенности слитого белка in vivo. Таким образом, предпочтительной длиной является длина не больше той, которая необходима для предупреждения нежелательных взаимодействий с доменами и/или оптимизации биологической активности и/или стабильности. Предпочтительно богатый глицином линкер включает в себя последовательность Gly-Gly-Gly-Gly-Ser-Gly-Gly-Gly-Gly-Ser-Gly-GlyGly-Gly-Ser (SEQ ID NO:8). Хотя в слитых белках может использоваться больше копий указанного линкера, предпочтительно используется одна копия данного линкера с целью минимизации риска иммуногенности, связанной с длительным и повторным введением. Предпочтительные слитые белки GLP-1-Fc включают в себя следующие белки: а также Val8 и des-K-формы всех перечисленных выше белков. Номенклатура, которая используется в данном описании для обозначения конкретных слитых белков, определена следующим образом: конкретные замены в части GLP-1 слитого белка показаны с использованием конкретной аминокислоты, которая должна быть заменена, с последующим указанием номера остатка. GLP-1(7-37) показывает, что часть GLP-1 зрелого слитого белка начинается с His в положении 7 и заканчивается Gly в положении 37. L означает линкер с последовательностью Gly-Gly-GlyGly-Ser-Gly-Gly-Gly-Gly-Ser-Gly-Gly-Gly-Gly-Ser (SEQ ID NO:8). Числом, которое стоит непосредственно перед L, обозначается количество линкеров, отделяющих часть GLP-1 от части Fc. Линкер, обозначаемый как 1,5L, означает последовательность Gly-Ser-Gly-Gly-Gly-Gly-Ser-Gly-Gly-Gly-Gly-Ser-GlyGly-Gly-Gly-Ser-Gly-Gly-Gly-Gly-Ser (SEQ ID NO:17). IgG4 означает аналог последовательности человеческого IgG4 Fc, обозначенной как SEQ ID NO:7. Замены в части IgG4 Fc слитого белка указаны в скобках. Аминокислоты дикого типа обозначаются общепринятым сокращением с последующим указанием номера положения в контексте полной последовательности IgG4 с использованием системы нумерации ЕС с последующим указанием аминокислоты, которая заменяет природную аминокислоту в данном положении, обозначенную общепринятым сокращением. Слитые белки обладают биологической активностью. Биологическая активность относится к способности слитого белка связываться с рецептором GLP-1in vivo активизировать его, а также вызывать реакцию. Реакции включают в себя, не ограничиваясь ими,секрецию инсулина, ингибирование глюкагона, подавление аппетита, снижение массы тела, чувство насыщения, ингибирование апоптоза, индукцию пролиферации бета-клеток поджелудочной железы, а также дифференцировку бета-клеток поджелудочной железы. Активность репрезентативного количества слитых белков GLP-1 исследовали in vitro, а также in vivo. Продемонстрирована активность in vitro, которая основана на способности слитого белка взаимодействовать с человеческим рецептором GLP-1 и активировать его (см. PCT/US 04/15595 (WO2005/000892. Использовали клетки НЕК 293, в повышенном количестве экспрессирующие человеческий рецептор GLP-1. Активация рецептора GLP-1 в таких клетках вызывает активацию аденилатциклазы, которая, в свою очередь, вызывает экспрессию репортерного гена, регулируемого элементом реакции циклического АМФ (CRE). Значения рН препаратов слитых белков GLP-1-Fc корректировали таким образом, чтобы обеспечить приемлемую стабильность, сохранить растворимость и инсулинотропную активность слитого белкаGLP-1-Fc, а также сделать его пригодным для парентерального введения. Значения рН препаратов слитых белков GLP-1-Fc предпочтительно корректировали до значений в интервале приблизительно от рН 6 до приблизительно pH 8,5, предпочтительно приблизительно от рН 6 до приблизительно рН 7,5, приблизительно от рН 6 до приблизительно рН 7, приблизительно от рН 6,5 до приблизительно рН 7,5 или приблизительно от рН 6 до приблизительно рН 6,5 и даже более предпочтительно, до значений приблизительно рН 6 или приблизительно 6,5. Препараты, содержащие слитый белок GLP-1-Fc согласно изобретению, необязательно могут включать в себя фармацевтически приемлемый буфер. Однако вид и концентрация буфера должны быть такими, чтобы рН препарата можно было корректировать до указанных интервалов, которые обеспечивают приемлемую стабильность и инсулинотропную активность. Примеры фармацевтически приемлемых буферов включают в себя фосфатные буферы, такие как двухосновный натрия фосфат, ТРИС, ацетатные,например ацетат натрия, цитратные, например цитрат натрия, тартрат натрия, основные аминокислоты,например гистидин, лизин или аргинин, или нейтральные аминокислоты, например глицин и глицилглицин. Другие фармацевтически приемлемые буферы известны из уровня техники. Предпочтительно буфер выбирают из группы, которая состоит из цитрата, фосфата и ТРИС. Специалистам понятно, что выбор буфера зависит от описанных интервалов рН и pKa буфера. Предпочтительно, чтобы концентрация буфера составляла приблизительно от 1 мМ до 30 мМ. Даже более предпочтительно, чтобы концентрация составляла приблизительно от 4 до 14 мМ или приблизительно от 5 до 20 мМ. Еще более пред-5 011166 почтительно, чтобы концентрация составляла приблизительно от 10 мМ до 20 мМ. Даже еще более предпочтительно, чтобы концентрация составляла приблизительно 10 мМ или приблизительно 20 мМ. Препараты согласно изобретению необязательно могут включать в себя консервант. Однако отбор и концентрация консерванта должны быть такими, чтобы значения рН препарата можно было скоррелировать до описанных интервалов, которые обеспечивают приемлемую стабильность и инсулинотропную активность. Консервант означает соединение, которое добавляют к фармацевтическому препарату и которое действует в качестве антимикробного агента. Чтобы быть коммерчески жизнеспособным универсальным продуктом, препарат для парентерального применения должен соответствовать директивам относительно эффективности консервантов. Среди известных из уровня техники консервантов, которые являются эффективными и пригодны для применения в препаратах для парентерального введения, фенольные консерванты, алкилпарабены, бензиловый спирт, хлорбутанол, резорцин и другие подобные консерванты, а также их различные смеси. Примеры фенольных производных включают в себя крезолы и фенол или смесь крезолов и фенола. Примеры крезолов включают в себя мета-крезол, орто-крезол, пара-крезол, хлор-крезол или их смеси. Алкилпарабен означает С 1-С 4-алкилпарабены или их смеси. Примеры алкилпарабенов включают в себя метилпарабен, этилпарабен, пропилпарабен или бутилпарабен. Концентрация консерванта известна специалистам в данной области. Концентрации должны быть достаточными для того, чтобы поддерживать эффективность консерванта, задерживая рост микроорганизмов. Предпочтительным консервантом является мета-крезол или фенол. Обычно концентрация метакрезола составляет приблизительно от 2,0 до приблизительно 8,0 мг/мл, приблизительно от 2,5 мг/мл до приблизительно 4,5 мг/мл, а также приблизительно от 2,0 мг/мл до приблизительно 4,0 мг/мл. Наиболее предпочтительная концентрация консерванта в препарате составляет приблизительно 2,7 мг/мл. В другом варианте концентрация фенола составляет приблизительно от 2,0 до приблизительно 10,0 мг/мл, а также приблизительно от 4,0 до приблизительно 8,0 мг/мл. Наиболее предпочтительная концентрация консерванта в препарате составляет приблизительно 5,0 мг/мл. Препараты согласно изобретению необязательно могут включать в себя агент для обеспечения изотоничности. Однако выбор и концентрация агента для обеспечения изотоничности должны быть такими,чтобы значения рН препарата можно было корректировать до указанных интервалов, которые обеспечивают приемлемую стабильность и инсулинотропную активность. Агенты для обеспечения изотоничности относятся к соединениям, которые хорошо переносятся физиологически и придают подходящую тоничность препарату, чтобы препятствовать току воды через мембраны клеток. Примеры таких соединений включают в себя глицерин (или глицерол), соли, например NaCl, а также сахара, например глюкозу, маннит и сахарозу. Эти соединения обычно используются для таких целей в известных концентрациях. Могут быть добавлены один или более агентов для обеспечения изотоничности с целью коррекции ионной силы или тоничности. Предпочтительным агентом для обеспечения изотоничности является NaCl. Концентрация NaCl предпочтительно составляет приблизительно от 10 мМ до 500 мМ, более предпочтительно приблизительно от 50 мМ до 200 мМ и наиболее предпочтительно приблизительно 150 мМ. В другом варианте предпочтительным агентом для обеспечения изотоничности является маннит. Концентрация маннита предпочтительно составляет приблизительно от 1% (масса [мас.]/объем [об.]) до 10% (мас./об.), и более предпочтительно составляет приблизительно от 2% (мас./об.) до 8% (мас./об.). В другом варианте предпочтительным агентом для обеспечения изотоничности является глицерин. Концентрация глицерина предпочтительно составляет приблизительно от 12 мг/мл до 25 мг/мл, предпочтительно приблизительно от 12 мг/мл до 20 мг/мл и более предпочтительно составляет приблизительно 17 мг/мл. Препараты согласно изобретению необязательно могут включать в себя агент для повышения растворимости. Однако выбор и концентрация агента для повышения растворимости должны быть такими,чтобы значение рН препарата можно было корректировать до указанных интервалов, которые обеспечивают приемлемую стабильность и инсулинотропную активность. Агенты для повышения растворимости обеспечивают стабильность таким образом, что слитый белок GLP-1-Fc сохраняет растворимость на протяжении более длительного периода времени в условиях хранения. Предпочтительно агент для повышения растворимости представляет собой никотинамид. Обычно концентрация никотинамида составляет от 0,01 M до 2 M. Другие предпочтительные интервалы концентрации никотинамида: от 0,05 M до 1,5 M; от 0,1 M до 1,0 M; от 0,1 M до 0,5 M; от 0,5 M до 1,0 M; и от 0,15 M до 0,25 M. Другие добавки, например фармацевтически приемлемые солюбилизаторы, такие как Твин 20(полиоксиэтилен(20)сорбитан монолаурат), Твин 40 (полиоксиэтилен(20)сорбитан монопальмитат),Твин 80 (полиоксиэтилен(20)сорбитан моноолеат), Pluronic F68 (блок-сополимеры полиоксиэтилена полиоксипропилена), и ПЭГ (полиэтиленгликоль), необязательно могут быть добавлены в композицию. Предпочтительно солюбилизатор представляет собой Твин 20 или Твин 80. Обычно концентрация Твина 20 или Твина 80 составляет от 0,001 до 0,05%. Другие предпочтительные интервалы концентраций Твина 20 или Твина 80: от 0,005 до 0,05%; от 0,0075 до 0,05%; и от 0,01 до 0,05%. Введение препаратов может осуществляться любым способом, известным рядовому врачу как эффективный. Парентеральное периферическое введение представляет собой один из таких способов. В-6 011166 медицинской литературе под парентеральным введением обычно понимают инъецирование лекарственной формы в организм с помощью стерильного шприца или какого-либо другого механического устройства, например инфузионного насоса. Способы периферического парентерального введения могут включать в себя внутривенное, внутримышечное, подкожное и внутрибрюшинное введение. Препараты могут также быть предназначены для перорального, ректального, назального введения или введения в нижние отделы дыхательных путей, которые являются непарентеральными путями введения. Из таких непарентеральных путей введения предпочтительными являются введение в нижние отделы дыхательных путей и пероральное введение. Препараты, содержащие слитый белок GLP-1-Fc, могут применяться для лечения широкого спектра заболеваний и состояний. Слитые белки GLP-1-Fc в основном проявляют свою биологическую активность, действуя на рецептор, который обозначается как "рецептор GLP-1". Субъекты с заболеваниями и/или состояниями, которые положительно реагируют на стимулирование рецептора GLP-1 или на введение соединений GLP-1, могут, таким образом, получать лечение слитыми белками GLP-1-Fc. Говорят,что такие субъекты "нуждаются в лечении соединениями GLP-1" или "нуждаются в стимулировании рецептора GLP-1". В их число включены субъекты с инсулиннезависимым диабетом, инсулинзависимым диабетом, инсультом (см. WO 00/16797), инфарктом миокарда (см. WO 98/08531), ожирением (см. WO 98/19698), катаболическими изменениями после хирургического вмешательства (см. патент США 6006753), функциональной диспепсией и синдромом раздраженной кишки (см. WO 99/64060). Также включены субъекты, нуждающиеся в профилактическом лечении соединением GLP-1, например субъекты с риском развития инсулиннезависимого диабета (см. WO 00/07617). Субъекты с нарушенной толерантностью к глюкозе или нарушенной гликемией натощак, субъекты, у которых масса тела приблизительно на 25% превышает нормальную массу тела с учетом роста и конституции субъекта, субъекты после частичной панкреатэктомии, субъекты, имеющие одного или больше родителей с инсулиннезависимым диабетом, субъекты с гестационным диабетом в анамнезе, а также субъекты с острым или хроническим панкреатитом в анамнезе, которые подвергаются риску развития инсулиннезависимого диабета. Эффективное количество слитых белков GLP-1-Fc в контексте описанных препаратов представляет собой такое количество, которое приводит к желательному терапевтическому и/или профилактическому эффекту, не вызывая неприемлемых побочных эффектов при введении субъекту, нуждающемуся в стимулировании рецептора GLP-1. "Желательный терапевтический эффект" включает в себя один или более из следующего: 1) облегчение симптома(ов), сопровождающего состояние или заболевание; 2) задержка возникновения симптомов, сопровождающих состояние или заболевание; 3) увеличение продолжительности жизни по сравнению с отсутствием лечения; и 4) повышение качества жизни по сравнению с отсутствием лечения. Например, "эффективное количество" слитого белка GLP-1-Fc для лечения диабета представляет собой количество, которое будет приводить к лучшему контролю концентрации глюкозы в крови по сравнению с отсутствием лечения, таким образом, приводя к задержке развития диабетических осложнений, например ретинопатии, невропатии или заболевания почек. "Эффективное количество" слитого белка GLP-1-Fc для профилактики диабета представляет собой количество, которое будет задерживать, по сравнению с отсутствием лечения, возникновение повышенных уровней глюкозы крови,которые требуют лечения гипогликемическими лекарственными средствами, такими как производные сульфонилмочевины, тиазолидиндионы, инсулин и/или бигуанидины. Доза слитого белка, эффективная для нормализации глюкозы крови больного, будет зависеть от множества факторов, среди которых можно отметить, не ограничиваясь ими, пол, массу тела и возраст субъекта, выраженность неспособности регулировать глюкозу крови, способ введения и биодоступность,фармакокинетический профиль слитого белка, дозировку и лекарственную форму. Дозы могут быть заключены в интервале от 0,01 до 1 мг/кг массы тела, предпочтительно в интервале от 0,05 до 0,5 мг/кг массы тела. Предпочтительно слитые белки могут вводиться один раз в две недели или один раз в неделю. В зависимости от заболевания, которое подвергается лечению, может возникнуть необходимость в более частом введении слитого белка, например, от двух до трех раз в неделю. Данное изобретение далее будет описано с помощью неограничивающего примера со ссылкой на следующие примеры. Примеры Анализ активации рецептора GLP-1 in vitro: Клетки НЕК-293, экспрессирующие человеческий рецептор GLP-1 с помощью системы CREBLAM, высевали в количестве 20000-40000 клеток/ячейку/100 мкл модифицированной по способу Дульбекко среды Игла (DMEM) с 10% фосфатного буферного раствора (PBS) в покрытые поли-d-лизином 96 ячейковые черные планшеты с прозрачным дном. Через день после посева среду удаляли и добавляли 80 мкл свободной от плазмы среды DMEM. На третий день после посева в каждую ячейку добавляли 20 мкл свободной от плазмы среды DMEM, содержащие 0,5% бычьего сывороточного альбумина и различные концентрации разных видов слитого белка GLP-1-Fc для построения кривой зависимости доза-ответ. Обычно четырнадцать разведений, содержащих от 3 нм до 30 нм слитого белка GLP-1 Fc, было использовано для построения кривой зависимости реакции от дозы, на основе которой могут быть определены-7 011166 значения ЕС 50. После 5 ч инкубирования со слитым белком добавляли 20 мкл субстрата -лактамазы(CCF2/AM, PanVera LLC) и продолжали инкубирование в течение 1 ч на протяжении которого определяли флуоресценцию на цитофлуориметре. Данный анализ дополнительно описан у Zlokarnik, et al. (1998),Science, 278:84-88. Анализ активации рецептора GLP-1 in vitro: Клетки НЕК-293, стабильно экспрессирующие человеческий рецептор GLP-1 с помощью системыCRE-Luciferase, высевали в количестве 30000 клеток/ячейку/80 мкл среды DMEM F12 с низким содержанием сыворотки в 96-луночные планшеты. Через день после посева аликвоты по 20 мкл исследуемого белка, растворенного в 0,5% бычьем сывороточном альбумине, смешивали с клетками и инкубировали в течение 5 ч. Обычно готовили 12 разведений, содержащих от 3 пМ до 3 нМ, с 5 х концентрацией для каждого исследуемого белка перед добавлением к клеткам для построения кривой зависимости доза-ответ,на основе которой могут быть определены значения ЕС 50. После инкубации непосредственно в каждый планшет добавляли по 100 мкл реактива Luciferase и осторожно перемешивали в течение 2 мин. Планшеты помещали в люминометр Tri-lux и рассчитывали выход света в результате экспрессии люциферазы. Влияние Твина, NaCl и рН на стабильность Gly8-Glu22-GLP-1(7-37)-1L-IgG4 (S228P, F234A, L235A). Определяли влияние Твина-20 (0,01%), NaCl (0, 150 и 500 мМ) и рН (6,5, 7,5 и 8,5) на химическую стабильность 0,5 мг/мл раствора Gly8-Glu22-GLP-1(7-37)-1L-IgG4 (S228P, F234A, L235A). Полную матрицу указанных условий получали смешиванием соответствующего 2 запасного буферного D раствора с раствором 1 мг/мл Gly8-Glu22-GLP-1(7-37)-1L-IgG4 (S228P, F234A, L235A), в фосфате 20 мМ, 20 мМ Трис, рН 7,5. Раствор с конечными условиями фильтровали через фильтры Millex-GV с размером пор 0,2 мкм во флаконы ВЭЖХ и инкубировали при 37C. Периодически в определенных временных точках извлекали аликвоты и проводили анализ с помощью эксклюзионной хроматографии, обращенно-фазовой хроматографии и гель-электрофореза. Идентификация компонентов композиции для образцов A-R (все содержат по 0,5 мг/мл Gly8-Glu22GLP-1(7-37)-1L-IgG4 (S228P, F234A, L235A), 20 мМ фосфата и 20 мМ Трис) Процентное изменение основного пика при 37C для различных условий раствора GLP-Fc по данным эксклюзионной ВЭЖХ Процентное изменение основного пика при 37 С для различных условий раствора GLP-Fc по данным обращенно-фазовой ВЭЖХ-9 011166 Линейная скорость деградации (процентное изменение основного пика в неделю, инкубация при 37C), по данным эксклюзионной или обращенно-фазовой ВЭЖХ. Метод эксклюзионной ВЭЖХ. Образцы инъецировали на колонку Tosohas TSK3000-SW-XL (5 мкм, 7,8300 мм), предварительно уравновешенную в буфере подвижной фазы 1 x PBS; рН 7,4 плюс 10% ацетонитрила (об./об.) (буфер Анасоса). А-буфер протекает со скоростью 0,5 мл/мин изократическим способом, и белок определяют при длине волны 214 нм. Метод обращенно-фазовой ВЭЖХ. Осуществляли инжекцию образцов на колонку Zorbax 300SB-C8 (4,650 мм), предварительно уравновешенную в буфере подвижной фазы 0,1% ТФУ (об./об.) (буфер А-насоса). Буфер В-насоса состоит из 0,085% ТФУ в ацетонитриле (об./об.). Применяли градиент (ниже), и вещество определяли при длине волны 214 нм. Метод гель-электрофореза. В определенных временных точках образец разбавляли буфером для образца 4 х NuPage LDS (1 х конечная концентрация) и нагревали до температуры 95C, выдерживая при этой температуре в течение 5 мин. Охлажденные образцы загружали на гель 4-12% бис-трис NuPage. Гель-электрофорез осуществляли при постоянном напряжении (200 В) в течение 50-60 мин в буфере MOPS и окрашивали с помощьюSimplyBlue SafeStain. Стабильность Gly8-Glu22-GLP-1(7-37)-1L-IgG4 (S228P, F234A, L235A) и влияние Твина-20. Стабильность Gly8-Glu22-GLP-1(7-37)-1L-IgG4 (S228P, F234A, L235A) при концентрации 0,3 мг/мл в 1PBS при рН 7,5 оценивали, контролируя увеличение мутности при длине волны 350 нм в условиях форсированной нагрузки (перемешивание гидрофобной мешалкой в PBS при 37C). Растворимость Gly8-Glu22-GLP-1(7-37)-1L-IgG4 (S228P, F234A, L235A) как функция рН раствора. Растворимость Gly8-Glu22-GLP-1(7-37)-1L-IgG4 (S228P, F234A, L235A) как функцию рН раствора определяли следующим образом: разбавляли запасной раствор различными забуференными растворами при разных значениях рН, позволяли раствору достичь равновесия, центрифугировали для отделения осажденного материала, после чего анализировали супернатант с целью определения концентрации оставшегося в растворе белка. Осуществляли диализ исходного раствора белка, замороженного в PBS, против воды приблизительно при рН 8. После диализа исходный раствор белка фильтровали через фильтрMillex-GV с размером пор 0,22 мкм и концентрировали до концентрации 12 мг/мл с использованием промытого устройства для центрифугирования Ultrafree (4 мл, порог отсекания молекулярной массы 5000 дальтон, при 7000G). Полученный концентрированный раствор разбавляли в соотношении 1:1 с помощью 2 запасных буферных растворов (конечный объем 50 мкл в пробирках Эппендорфа объемом 0,5 мл) и давали уравновеситься в течение 15-30 мин при комнатной температуре. Раствор центрифугировали (14 000G в течение 5 мин) для выпадения в осадок нерастворимого материала. 10 мкл супернатанта извлекали и объединяли с 40 мкл воды с рН 8. Для каждого образца выполняли два повтора. Концентрацию растворенного GLP-Fc определяли с помощью обращенно-фазовой ВЭЖХ по методу стандартной кривой. Влияние условий раствора на растворимость- 11011166 Влияние рН раствора на стабильность, по данным обращено-фазовой ВЭЖХ. Осуществляли диализ Gly8-Glu22-GLP-1(7-37)-1L-IgG4 (S228P, F234A, L235A) против воды с рН приблизительно 8. После диализа полученный раствор белка фильтровали (Millex-GV, 0,2 мкм) и концентрировали до концентрации 2 мг/мл с помощью промытого устройства для центрифугирования Ultrafree. Конечную концентрацию белка определяли с помощью УФ-спектрометрии, и готовили различные препараты с помощью разведения 2 х препаратов запасного буферного раствора до 1 , сохраняя конечную концентрацию белка на уровне 1 мг/мл. рН раствора проверяли и при необходимости корректировали. Для полученных растворов осуществляли окончательное фильтрование (Millex-GV, 0,22 мкм,4 мм) в стерилизованных флаконах ВЭЖХ объемом 1,8 мл с навинчивающимися крышками. Флаконы держали при температуре 37C, и через определенные временные интервалы проводили анализ с помощью обращенно-фазовой, эксклюзионной хроматографии и гель-электрофореза. Представлено процентное изменение основного пика, по данным эксклюзионной и обращенно-фазовой ВЭЖХ. Значения линейной скорости деградации получали путем аппроксимации графика времени инкубации при температуре 37C, с приведенной в таблице чистотой основного пика, по данным эксклюзионной и обращеннофазовой ВЭЖХ. Идентификация параметров композиции Процентное изменение основного пика в условиях хранения при температуре 37C. Данные анализировали методом эксклюзионной хроматографии. Процентное изменение основного пика в условиях хранения при температуре 37C. Данные анализа методом обращено-фазовой хроматографии. Скорость разложения при температуре 37C, по данным эксклюзионной или обращенно-фазовой ВЭЖХ. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Композиция стабильного раствора, содержащая терапевтически эффективное количество слитого белка GLP-1-Fc в интервале значений рН приблизительно от рН 6 до приблизительно рН 8,5, где слитый белок GLP-1-Fc включает в себя аналог GLP-1, содержащий последовательность, выбранную из группы,состоящей из где Хаа в положении 16 представляет собой Pro или Glu; Хаа в положении 17 представляет собой Phe,Val или Ala; Хаа в положении 18 представляет собой Leu, Glu или Ala; Хаа в положении 80 представляет собой Asn или Ala; и Хаа в положении 230 представляет собой Lys или отсутствует. 2. Композиция стабильного раствора по п.1, отличающаяся тем, что значение рН заключено в интервале приблизительно от рН 6 до приблизительно рН 7,5.- 14011166 3. Композиция стабильного раствора по п.2, отличающаяся тем, что значение рН заключено в интервале приблизительно от рН 6 до приблизительно рН 7. 4. Композиция стабильного раствора по п.3, отличающаяся тем, что значение рН заключено в интервале приблизительно от рН 6 до приблизительно рН 6,5. 5. Композиция стабильного раствора по п.4, отличающаяся тем, что значение рН составляет приблизительно рН 6. 6. Композиция стабильного раствора по п.4, отличающаяся тем, что значение рН составляет приблизительно рН 6,5. 7. Композиция стабильного раствора по п.1, отличающаяся тем, что дополнительно содержит Твин 20. 8. Композиция стабильного раствора по п.1, отличающаяся тем, что дополнительно содержит Твин 80. 9. Композиция стабильного раствора по п.1, отличающаяся тем, что дополнительно содержит NaCl. 10. Композиция стабильного раствора по п.1, отличающаяся тем, что дополнительно содержит мкрезол. 11. Композиция стабильного раствора по п.1, отличающаяся тем, что дополнительно содержит Твин 20, NaCl и м-крезол. 12. Композиция стабильного раствора по п.1, отличающаяся тем, что дополнительно содержит Твин 80, NaCl и м-крезол. Список последовательностей
МПК / Метки
МПК: C07K 14/435, A61K 38/26, C07K 14/605, A61K 38/00, C12N 15/62, C07K 14/50, A61P 3/10
Метки: композиции, белков-аналогов, glp-1, слитых
Код ссылки
<a href="https://eas.patents.su/21-11166-kompozicii-slityh-belkov-analogov-glp-1.html" rel="bookmark" title="База патентов Евразийского Союза">Композиции слитых белков-аналогов glp-1</a>
Предыдущий патент: Соединения фенилпиридилпиперазина, способ их получения и фармацевтические композиции, содержащие их
Следующий патент: Производные сульфонамида для лечения заболеваний
Случайный патент: Силосоуборочный комбайн с установленным с возможностью перемещения между рабочим положением и не рабочим положением кондиционирующим устройством