Иммуногенные композиции, содержащие циклические пептиды, полученные из бета-амилоидного пептида
Формула / Реферат
1. Антигенный пептид формулы
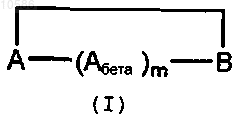
где Ab представляет собой пептид из 12-20 аминокислотных остатков, производный от b-амилоидного пептида (Ab1-26; SEQ ID NO:2), предпочтительно Ab1-16 (SEQ ID NO:3) или Ab11-26 (SEQ ID NO:4), или его аналога, содержащего консервативную аминокислотную замену;
m равно от 1 до 6;
А и B ковалентно связаны с образованием циклического пептида;
A и B представляют собой прямую связь, линкерный фрагмент или обозначают аминокислотную последовательность, содержащую от 1 до 20 аминокислот или их производных, и выбраны независимо друг от друга.
2. Пептид по п.1, где A и B представляют собой прямую связь любых двух из аминокислот Ab, где эти аминокислоты ковалентно связаны с образованием циклического пептида.
3. Пептид по п.2, где A и B представляют собой прямую связь, и N- и C-концевые аминокислоты Ab ковалентно связаны с образованием циклического пептида.
4. Пептид по п.1, где A и B вместе представляют собой линкерный фрагмент, и этот линкерный фрагмент представляет собой C5-C14моно- или полициклическое кольцо либо кольцевую систему, которая может содержать один или более гетероатом.
5. Пептид по п.4, где линкерный фрагмент представляет собой N-содержащее гетероциклическое C5-C14моно- или полициклическое кольцо либо кольцевую систему.
6. Пептид по п.1, где A и B независимо выбраны из группы, содержащей гидроксипролин, аминопролин, тироксин, орнитин, норвалин, норлейцин, b-аланин, g-аминомасляную кислоту, гомосерин, цитруллин, глицин, аланин, валин, лейцин, изолейцин, метионин, пролин, фенилаланин, тирозин, триптофан, серин, треонин, цистеин, глутамин, аспарагин, гистидин, лизин, аргинин, глутаминовую кислоту и аспарагиновую кислоту, где включены L- или D-формы каждой аминокислоты.
7. Пептид по п.6, где A представляет собой 4-аминопролин.
8. Пептид по п.6 или 7, где B представляет собой D-пролин.
9. Пептид по любому из пп.1, 6-8, где антигенный пептид формулы (I) представляет собой цикло(цис-4-амино-Pro-Asp-Ala-Glu-Phe-Arg-His-Asp-Ser-Gly-Tyr-Glu-Val-His-His-Gln-Lys-D-Pro).
10. Пептид по любому из пп.1-9, где антигенный пептид формулы (I), предпочтительно по меньшей мере один из A и B, дополнительно модифицирован липидом.
11. Пептид по п.10, где липид представляет собой фосфолипид, предпочтительно присоединенный к A или B через линкерную молекулу.
12. Пептид по п.11, где линкер представляет собой дикарбоновую кислоту, имеющую от 3 до 10 атомов углерода, предпочтительно янтарную кислоту.
13. Пептид по любому из пп.10-12, где липид представляет собой фосфатидилэтаноламин.
14. Пептид по п.13, где липид представляет собой 1,3-дипальмитоил-глицеро-2-фосфоэтаноламин, и линкерная молекула представляет собой янтарную кислоту.
15. Пептид по п.14, где антигенный пептид представляет собой цикло(цис-4-амино-Pro(сукцинил-(1,3-дипальмитоилглицеро-2-фосфоэтаноламино))-Asp-Ala-Glu-Phe-Arg-His-Asp-Ser-Gly-Tyr-Glu-Val-His-His-Gln-Lys-D-Pro).
16. Применение по меньшей мере одного антигенного пептида по любому из пп.1-15 для изготовления фармацевтической композиции для вакцинации индивидуума против заболеваний, обусловленных амилоидами.
17. Применение по меньшей мере одного антигенного пептида по любому из пп.1-15 для изготовления фармацевтической композиции для лечения индивидуума, пораженного заболеваниями, обусловленными амилоидами.
18. Применение по меньшей мере одного антигенного пептида по любому из пп.1-15 для изготовления фармацевтической композиции для диагностики заболевания, обусловленного амилоидами.
19. Иммуногенная композиция, содержащая по меньшей мере один антигенный пептид формулы (I), охарактеризованный в любом из пп.1-15.
20. Композиция по п.19, дополнительно содержащая носитель для доставки антигена, выбранный из группы, состоящей из микрочастиц, включая микросферы и наносферы, полимеров, теней бактерий, бактериальных полисахаридов, полипептидов, белков, аттенуированных бактерий, вирусоподобных частиц, аттенуированных вирусов, иммуностимулирующих комплексов (ISCOM), липосом или виросом (IRIV).
21. Композиция по п.20, где антиген присоединен к носителю для доставки или включен в него.
22. Композиция по п.20, где носитель для доставки антигена представляет собой виросому, липосому, вирусоподобную частицу, аттенуированный вирус или иммуностимулирующий комплекс (ISCOM), а антигенный пептид присоединен к поверхности через липидную группу.
23. Композиция по любому из пп.19-22, дополнительно содержащая адъювант или систему адъювантов.
24. Способ получения пептида формулы (I), включающий следующие стадии:
(а) последовательный синтез линейного пептида и
(б) циклизация линейного пептида с получением пептида формулы (I).
25. Способ по п.24, дополнительно включающий стадию модификации пептида формулы (I) липидной группой.
26. Способ получения антитела против иммуногенных пептидов формулы (I), включающий следующие стадии:
(а) иммунизация организма иммуногенной композицией, содержащей по меньшей мере один из антигенных пептидов формулы (I);
(б) выделение антител, образованных посредством заражения на стадии (а); и
(в) скрининг антител, полученных на стадии (б), на их специфичное распознавание фрагментов Ab-пептида или его вариантов.
Текст
010586 Область изобретения Настоящее изобретение относится к способам и композициям для вызова иммунного ответа, в частности, против амилоидных -пептидов, в частности, путем комбинированного использования виросом в качестве адъювантов и синтетического антигена -амилоидного пептида. Предшествующий уровень техники Общий термин "амилоид" относится к группе белковых отложений, имеющих общие морфологические свойства и характеристики окрашивания. Следовательно, амилоидоз относится к патологической аккумуляции амилоидных волокон. Одним из лучше всего известных расстройств, в которые вовлечена аккумуляция белковых агрегатов, является болезнь Альцгеймера (БА). БА представляет собой прогрессирующее дегенеративное нейронное расстройство бессимптомного возникновения, ответственное за ухудшение познавательной способности и деменции у миллионов пациентов, связанное с утратой нейронов и появлением реактивной глии. БА протекает ступенчато, постепенно разрушая память, рассудок,способность к логическому суждению, поведение, личность, язык и познавательные способности. Указанные ухудшения обусловлены утратой нейронов и передачи сигнала между ними. БА поражает примерно 20 млн чел. во всем мире, и ею могут заболеть люди столь молодые, как 40-50-летние, но подавляющее большинство находится в пожилом возрасте, причем по оценкам численность больных достигает столь высоких значений, как примерно 50% к возрасту 85-90 лет. Точное время возникновения неизвестно, поскольку наличие заболевания на ранних стадиях трудно определить без высокого риска, связанного с биопсией головного мозга, но прослежено, что БА с ранним возникновением имеет генетическое происхождение. При рассмотрении обеспечения медицинской помощи и вспомогательного ухода за пациентами БА требуемые затраты оказываются огромными. Невропатологическим признаком данного заболевания является обильное присутствие внеклеточных белковых бляшек в областях головного мозга, связанных с памятью и познавательной способностью больных индивидуумов. Эти нерастворимые отложения нейритных белков, названные амилоидными бляшками, представляют собой сложные агрегаты, образованные из пептида, отщепленного от белкапредшественника большего размера, аминокислотная последовательность которого предрасполагает его к агрегации. Частота и распределение этих бляшек коррелируют с тяжестью заболевания. Хотя ряд других неврологических нарушений связан с белковыми бляшками, болезнь Альцгеймера является наиболее распространенной и лучше всего охарактеризованной. Основным компонентом амилоидных бляшек является полипептид длиной 42 аминокислоты,-амилоидный пептид (А), который может существовать в двух различных конформационных состояниях: в большей части скрученной в -спираль и доброкачественной растворимой форме и в форме основного -листа, которая спонтанно агрегирует в нерастворимые отложения. Этот пептид образуется в результате протеолиза из большого трансмембранного гликопротеинового белка с нейротрофическими функциями, называемого амилоидным белком-предшественником (APP), экспрессируемого повсеместно из гена, локализованного на хромосоме 21, во всех тканях и преимущественно в центральной нервной системе. Протеолитическое расщепление этого предшественника секретазами следует двумя основными путями. Основной путь использует -секретазу, которая расщепляет APP вблизи его центра на два больших продукта, называемых APP и C83. Затем C83 претерпевает дальнейший гидролиз -секретазой с образованием малого пептида, известного как р 3. Второй, минорный путь процессинга APP основан наN- и C-концевом расщеплении APP - и -секретазой и приводит к -амилоидному пептиду, агрегаты которого являются токсичными для нейронов и вовлечены в распад нейронов, который лежит в основе ухудшения познавательных функций. Преобладающие данные указывают на то, что хронический дисбаланс в продуцировании и клиренсе белка А инициирует патологические ответы, включая нейритные и синаптические аномалии, нейрофибриллярные клубки и утрату нейротрансмиттеров. Хотя широко признано, что пептиды, обнаруженные в бляшках, повреждают нервную систему, в настоящее время не полностью понятно, каким механизмом эта патология направлена в действительности. В один из биохимических путей A-индуцированного повреждения нейронов могут быть вовлечены воспалительные клетки, в частности реактивная микроглия, которая, как обнаружено, связана с бляшками нейритов и ядер. Гистологические исследования показали, что почти все амилоидные бляшки в головном мозге больных индивидуумов окружены кластерами реактивной микроглии. Эти клетки высвобождают такие биоактивные агенты, как протеазы, цитокины, свободные радикалы, оксид азота и нейротоксические амины, вызывающие уничтожение нейронов, и, таким образом, вероятно, они вносят значительный вклад в иммунопатологию заболеваний, связанных с амилоидными бляшками. Исследования in vitro подтвердили предположение, что микроглия, находящаяся в покое, может активироваться посредством контакта с изолированными фрагментами амилоидных бляшек и в ответ продуцировать нейротоксин, который, как обнаружено, разрушает пирамидальные клетки гиппокампа. Эти открытия подтверждают идею, что иммунный ответ составляет важную часть патологии БА. Открытие точечных мутаций в амилоидном белке-предшественнике в некоторых редких семьях с аутосомно-доминантной формой БА предоставило доказательство, что аномалии в -амилоидном метаболизме вовлечены в развитие БА. Эти мутации появляются в непосредственной близости к точкамN- и C-концевого расщепления, необходимого для образования A-пептида из его белкапредшественника, и посредством этого влияют на протеолитическое расщепление клеточными секретазами. Однако более чем 99% пациентов БА страдают несемейной формой, при которой амилоидоз объясняется сниженным клиренсом А или усилением его агрегационных свойств. Хотя прошло 20 лет после первого сообщения об очистке и характеристике А, выделенного из головного мозга пациентов БА, не была одобрена ни одна терапия, специфичной мишенью которой является этот белок. Несколько методов, находящихся в настоящее время в разработке, с целью замедления,остановки прогрессирования БА или регрессии БА включают противовоспалительные лекарственные средства, агенты комплексообразования металлов, ингибиторы секретазы, нейротрофические агенты и даже витамины. Целью трех основных подходов является предупреждение образования бляшек и клиренс уже образовавшихся амилоидных отложений. Один из принципов направлен на секретазы и попытки модулирования их функции путем стимуляции активности -секретазы и в то же время блокирования- и -секретазы. Поскольку их биологические свойства остаются неопределенными, а их функция еще не полностью понятна, данный подход является весьма ненадежным. Второй подход сфокусирован на ингибировании образования фибрилл А или обратном развитии агрегации, которая уже имела место,путем применения специфичных ингибиторов. Третьей и наиболее перспективной стратегией предупреждения и/или лечения БА является иммунизация против А. Как аномальное вещество эндогенного пептида амилоидные бляшки вызывают огромные трудности в иммунной системе. В норме А вызывает очень низкий гуморальный иммунный ответ, т.е. его иммуногенность является очень слабой, но агрегация мономерных пептидов в фибриллы образует неоэпитоп,против которого можно получить антитела. Для элиминации амилоида система должна вызвать образование антител против этих неоэпитопов в агрегированных белках, не провоцируя аутоиммунный ответ,который может разрушить ткань, продуцирующую этот амилоидный пептид или его предшественник. Кроме того, А образует свои слаборастворимые отложения в локальной области, в головном мозге, который в значительной степени изолирован от системы приобретенного иммунитета. Это ограничивает способность бляшек к образованию гуморальной иммунной системы или взаимодействию с ней. Следовательно, разработку эффективной вакцины против A рассматривали как один из наиболее перспективных принципов в недавнем исследовании для лечения или предупреждения БА. Различные группы исследователей сообщили о преимуществах иммунизации А или его производными различных линий мышей, трансгенных по APP. С использованием данного подхода развитие амилоидных бляшек можно было предотвратить, существующие бляшки удалялись, отложение фибриллярного А было в значительной степени уменьшено и нарушение познавательной способности можно было ослабить. Даже пассивная иммунизация оказалась успешной в уменьшении патологии амилоидных бляшек и обратном развитии нарушения памяти. Несмотря на эти перспективные концепции, касающиеся иммунизации как решения, к настоящему времени все эти усилия оказались неэффективными, поскольку первоначальные исследования с людьми не были успешными. Заражение людей синтетическими A1-42 обладало тяжелым побочным эффектом воспаления головного мозга у некоторых пациентов в клинических испытаниях II фазы, причем причиной этого вредного побочного эффекта наиболее вероятно является токсичность и/или аутоиммунитетA1-42. С учетом серьезных побочных эффектов вакцинации A1-42 применение нетоксичных иммуногенных производных A, как предполагают, представляет безопасную альтернативу, учитывая, что основные иммуногенные эпитопы содержатся в N-концевом участке амилоидного пептида. Первые перспективные открытия показали, что иммунизация неамилоидогенными производными А может быть безопасным терапевтическим подходом. В этих экспериментах антитела, которым приписывали периферическое снижение системного количества растворимого A, играли центральную роль,поскольку они представляют способ обойти потенциально вредные побочные эффекты, возникающие в результате внутримозговых иммунных реакций. Кроме того, диагностика БА также обременена несколькими трудностями. По определению, БА определенно диагностируется только посредством исследования ткани головного мозга, обычно при аутопсии. Рекомендованный в настоящее время минимальный микроскопический критерий для диагностики БА основан на ряде нейритных бляшек, состоящих из A, обнаруженных в головном мозге. Пептид А можно легко идентифицировать путем окрашивания срезов головного мозга тиофлавином S или Конго красным. Окрашенный Конго красным амилоид характеризуется двухцветным видом, проявляющим желто-зеленое поляризованное окрашивание, являющееся результатом -складчатой листовой структуры амилоидных белков. Генетические тесты для диагностики БА основаны на ожидаемых факторах риска,таких как гомозиготы по аполипопротеину E эпсилон 4 (у 55% гомозигот ApoE 4/4 развивается БА к возрасту 80 лет), секретазы пресенилин 1 и 2 или сам APP, но они оказались неподходящими для общих диагностических целей. Следовательно, существует огромная необходимость в композициях и способах,позволяющих поставить точный диагноз БА и других нейродегенеративных заболеваний вследствие отложения -амилоида, не основываясь на биопсии или аутопсии головного мозга.-2 010586 Таким образом, необходимы композиции и способы для диагностики, лечения и/или предупреждения образования -амилоидных бляшек без риска вредных побочных эффектов. Сущность изобретения В настоящем изобретении предложены циклические пептиды А-происхождения, характеризующиеся тем, что они провоцируют или усиливают иммунный ответ против амилоидных пептидов в организме, где указанный организм представляет собой человека или животное. Более конкретно, синтетические иммуногенные пептидные антигены согласно признакам настоящего изобретения направлены на диагностику и лечение заболеваний, обусловленных амилоидами, например болезни Альцгеймера, но,что более важно, на вакцинацию против указанных расстройств. Композиции по изобретению могут дополнительно содержать дополнительные адъюванты и/или носители для доставки, провоцирующие продуцирование специфичных антител, которые таким образом стимулируют иммунную систему. Изобретение направлено главным образом не на белковые отложения в головном мозге, поскольку это может быть связано с вредными побочными эффектами, возникающими вследствие внутримозговых иммунных реакций, но на растворимые A, присутствующие не только в головном мозге, но также циркулирующие в периферической сосудистой системе, что, таким образом, снижает шанс аккумуляции данной молекулы и, следовательно, затрудняет образование амилоидных бляшек. В настоящем изобретении предложены циклические пептиды, имеющие значительную гомологию последовательности с A, для вакцинации против заболеваний, обусловленных амилоидами. Конформационно ограниченная структура циклических пептидов по изобретению дает возможность преодолеть противопродуцирующую гибкость и низкую метаболическую стабильность линейных пептидов. В частности, антигенные пептиды по настоящему изобретению представлены приведенной ниже формулой где Aбета (А) представляет собой пептид из 8-26 аминокислотных остатков, производный от амилоидного пептида (A1-26/SEQ ID NO:2) или его аналога, содержащего консервативную аминокислотную замену;A и B представляют собой прямую связь, линкерный фрагмент или аминокислотную последовательность, содержащую от 1 до 20 аминокислот или их производных, и выбраны независимо друг от друга;A и B ковалентно сшиты с образованием циклического пептида. В весьма предпочтительном варианте осуществления изобретения A представляет собой пептид из 12-20 аминокислотных остатков, производный от -амилоидного пептида (A1-26/SEQ ID NO:2), предпочтительно A1-16 (SEQ ID NO:3). В другом весьма предпочтительном варианте осуществления изобретения A представляет собой A11-26 (SEQ ID NO:4). В одном предпочтительном варианте осуществления изобретения m равно 1, 2 или 3, более предпочтительно 1. Антигенные пептиды по настоящему изобретению предпочтительно имеют длину от 10 до 196 аминокислот. В конкретном варианте осуществления изобретения пептиды по настоящему изобретению предпочтительно имеют длину от 10 до 40 аминокислотных остатков, предпочтительно примерно от 12 до 30 аминокислотных остатков и более предпочтительно от 14 до 20 аминокислотных остатков. Если A и B представляют собой прямую связь, любые две из аминокислот A, предпочтительноN- и C-концевая аминокислота, ковалентно связаны с образованием циклического пептида. Ковалентная связь может быть образована с использованием N-концевой аминогруппы и C-концевой карбоксигруппы,но может быть также образована путем использования любой боковой цепи любой из аминокислот A. Если A и B представляют собой линкерный фрагмент, A и B вместе образуют молекулу или химическую группу, которая осуществляет циклизацию A. Этот линкерный фрагмент фиксирует цепь A в благоприятной структуре петли и, таким образом, ограничивает гибкость антигенного пептида. В предпочтительном варианте осуществления изобретения линкерный фрагмент представляет собойC5-C14 моно- или полициклическое кольцо либо кольцевую систему, которая возможно содержит один или более гетероатом, выбранный из группы, состоящей из N, О и S. В предпочтительном варианте осуществления изобретения указанная кольцевая система может быть замещена по меньшей мере двумя функциональными группами, которые дают возможность ковалентного связывания аминокислотной цепи и предпочтительно выбраны из группы, состоящей из карбокси, гидрокси, амида, амино или имино. В одном варианте осуществления изобретения указанная иминогруппа может также составлять часть указанного кольца или кольцевой системы. Указанный линкерный фрагмент образует, предпочтительно посредством указанных функциональных групп, ковалентные связи с N-концевой аминогруппой на одном-3 010586 конце и с C-концевой карбоксигруппой на другом конце аминокислотной цепи A. В другом варианте осуществления изобретения эти заместители ковалентно связывают группы боковой цепи любой из аминокислот A. C5-C14 моно- или полициклическое кольцо либо кольцевая система могут быть дополнительно замещены C1-C6 алкилом, C1-C6 алкокси, арилом, арил-C1-C6 алкилом, ароил-C1-C6 алкилом, аллилом, галогеном, NO2 или группой формулы CH2-COOR', где R' представляет собой водород, C1-C6 алкил,замещенный C1-C6 алкил, арил-C1-C6 алкил, арил, ароил-C1-C6 алкил или аллил. Эти последние группы,если они присутствуют, предпочтительно замещены по меньшей мере двумя из указанных выше функциональных групп, так что указанное присоединение образует ковалентные связи с аминогруппой и карбоксигруппой A посредством указанных функциональных групп. В весьма предпочтительном варианте осуществления изобретения линкерный фрагмент выбран из группы, содержащей соединения приведенных ниже формул, за счет которых ковалентные связи с A образуются через группы карбокси и амино/имино (жирные линии) где R1 представляет собой водород или аминогруппу;R2 представляет собой водород или группу формулы CH2-COOR9;R9 представляет собой водород, C1-C6 алкил, замещенный C1-C6 алкил или арил-C1-C6 алкил, арил,ароил-C1-C6 алкил или аллил. Если A и B представляют собой аминокислотные остатки, тогда они могут представлять собой любую встречающуюся в природе аминокислоту, либо любую не встречающуюся в природе аминокислоту,либо ее производное. Не встречающиеся в природе аминокислоты включают гидроксипролин, аминопролин, тироксин, орнитин, норвалин, норлейцин, -аланин, -аминомасляную кислоту, гомосерин, цитруллин и т.п., но не ограничены приведенным перечнем. Встречающиеся в природе аминокислоты включают глицин, аланин, валин, лейцин, изолейцин, метионин, пролин, фенилаланин, тирозин, триптофан,серин, треонин, цистеин, глутамин, аспарагин, гистидин, лизин, аргинин, глутаминовую кислоту и аспарагиновую кислоту. В приведенный перечень также включены оба энантиомера вышеперечисленных аминокислот, т.е. L- и соответствующая D-форма. В одном предпочтительном варианте осуществления изобретения A представляет собой 4-аминопролин и B представляет собой D-пролин. Циклизация может быть достигнута посредством прямого соединения N- и C-концов с образованием пептидной связи, но может также осуществляться через боковые цепи аминокислот. Кроме того, она может быть основана на использовании других функциональных групп, включая амино, гидрокси,сульфгидрил, галоген, сульфонил, карбокси или тиокарбокси, но не ограничиваясь приведенным перечнем. Эти группы могут быть расположены при боковых цепях аминокислот или присоединены к их-4 010586 В весьма предпочтительном варианте осуществления изобретения циклический пептид формулы (I) представляет собой цикло(цис-4-амино-Pro-Asp-Ala-Glu-Phe-Arg-His-Asp-Ser-Gly-Tyr-Glu-Val-His-HisGln-Lys-D-Pro). Аминокислоты A и B могут быть независимо друг от друга модифицированы липидными группами. Указанная липидная группа представляет собой большей частью гидрофобную молекулу, состоящую из одной или более гидрофобной группы, включая липид A, холестерин, сфинголипиды, липиды на основе глицерина, диацилглицерин, ПЭГ-липиды, диэфирные липиды, 1,2-диолеоилокси-3-триметиламмонийпропан (DOTAB), 1,2-диолеоилокси-3-диметиламмоний-пропан (DODAP.CI), N,N-диолеоил-N,Nдиметиламмоний (DODAC), жирные кислоты, изопреноиды, сфингозин и его производные, но не ограничиваясь приведенным перечнем. Жирные кислоты включают капроновую, каприловую, каприновую,лауриновую, миристиновую, пальмитиновую, стеариновую, арахиновую, бегеновую, лигноцериновую,миристолеиновую, пальмитолеиновую, петразелиновую, элаидиновую, олеиновую, линолевую, линолелаидиновую, цис-вакценовую, линоленовую, арахидоновую, цис-11-эйкозеновую, эруковую, цис 4,7,10,13,16,19-докозагексаеновую и нервоновую кислоты, но не ограничены приведенным перечнем. Липиды на основе глицерина включают фосфатидилэтаноламин, фосфатидилсерии, фосфатидилхолин(лецитин), фосфатидилинозит, фосфатидилглицерин, кардиолипин, плазмалоген, фосфатидную кислоту и лизофосфатидную кислоту. Изопреноиды включают, но не ограничены, фарнезил и геранилгеранил, но не ограничены приведенным перечнем. Липидная группа может быть присоединена непосредственно или через линкер к любой или к обеим аминокислотам A и/или B. Прямая сшивка достигается посредством амидной, эфирной, тиоэфирной,сложноэфирной или сложнотиоэфирной связи. Линкер может представлять собой любое соединение, но предпочтительно выбран из группы дикарбоновых кислот, имеющих от 3 до 10 атомов углерода, и наиболее предпочтительно представляет собой янтарную кислоту. Модификация может иметь место при боковой цепи или соответствующей амино- или карбоксигруппе A или B. Липидная группа может представлять собой любой фосфолипид, предпочтительно фосфатидилэтаноламин. Он может быть связан с линкером, таким как янтарная кислота. В одном предпочтительном варианте осуществления изобретения липидная группа представляет собой диацилглицерофосфоэтаноламиносукцинат и более предпочтительно 1,3-дипальмитоилглицеро-2-фосфоэтаноламиносукцинат. В наиболее предпочтительном варианте осуществления изобретения антигенный пептид представляет собой цикло(цис-4-амино-Pro(сукцинил-(1,3-дипальмитоилглицеро-2-фосфоэтаноламино-Asp-AlaGlu-Phe-Arg-His-Asp-Ser-Gly-Tyr-Glu-Val-His-His-Gln-Lys-D-Pro). Изобретение также относится к композициям, содержащим по меньшей мере один антигенный пептид, представленный формулой (I), как определено выше. Пептидные антигены можно связывать с подходящим носителем для доставки или включать в носитель для доставки, такой как микрочастицы, включая микросферы и наносферы, полимеры, тени бактерий (опустевшие корпускулы фагов), бактериальные полисахариды, аттенуированные бактерии, вирусоподобные частицы, аттенуированные вирусы, иммуностимулирующие комплексы (ISCOM), липосома или виросома (IRIV). В частности, модифицированные липидом пептидные антигены могут быть, таким образом, заякорены на поверхности содержащих липиды носителей для доставки, таких как липосомы и виросомы. Применение виросом и/или липосом в качестве носителей для доставки антигенов или вышеупомянутых соединений и прививка ими субъекта также составляет часть настоящего изобретения. Относительно низкая иммуногенность антигена амилоидного пептида может быть повышена на несколько порядков путем комбинирования антигена и виросомы, включая продуцирование измеримых титров высокоспецифичных антител. Эти композиции в высокой степени пригодны для диагностики, лечения или предупреждения расстройств, обусловленных амилоидами. Способ получения описанной композиции антиген/виросома включает модификацию описанных пептидов липидной группой, что дает возможность присоединения к поверхности мембраны виросомы. Альтернативно антигенные пептиды можно переносить в немодифицированном виде внутри виросомы. В одном предпочтительном варианте осуществления изобретения носитель для доставки антигена представляет собой виросому, и антигенный пептид присоединен к поверхности виросомы через липидную группу. В настоящем изобретении также предложено применение антигенных пептидов, представленных формулой I, и иммуногенных композиций, содержащих указанные пептиды, для изготовления фармацевтической композиции для диагностики и лечения заболеваний, обусловленных амилоидами, а также применение указанных пептидов и композиций для изготовления фармацевтической композиции для вакцинации субъекта против указанных расстройств. В одном варианте осуществления изобретения используют комбинацию -амилоидного антигена и виросомы, чтобы способствовать повышению уровня антител, специфичных к амилоидному -пептиду, полезную при диагностике, лечении или предупреждении указанного расстройства. Иммуногенные композиции по настоящему изобретению также содержат комбинацию пептидных-5 010586 антигенов по изобретению с адъювантами, известными специалистам в данной области техники, включающими короткие фрагменты нуклеиновых кислот, пептиды или фрагменты белков и их производных,соли алюминия и олиго- или полисахариды, но не ограниченными приведенным перечнем. Все эти адъюванты можно использовать по отдельности или в комбинации, создавая систему адъювантов. Поскольку они могут дополнительно стимулировать иммунный ответ, их применение в дополнение к виросомам или вместо них составляет часть изобретения. Настоящее изобретение также включает способы получения пептидов формулы (I), включающие стадии последовательного синтеза пептида и циклизации пептида. Пептидные антигены по настоящему изобретению могут быть получены разнообразными путями, известными специалистам в данной области техники. В связи с их относительно малым размером пептид можно синтезировать в растворе или, более сложно, на твердой фазе, например на синтетической смоле. Различные автоматические синтезаторы в настоящее время имеются в продаже и могут использоваться в соответствии с хорошо исследованными протоколами синтеза. Альтернативно пептиды можно экспрессировать рекомбинантным путем из синтетических генов в подходящих организмах. Эти методики также легко доступны специалистам в данной области техники. Способы получения пептида формулы (I) могут дополнительно включать стадию модификации пептида липидной группой, как описано выше. Изобретение также относится к пептидам, которые могут быть получены вышеописанными способами, представленным приведенной ниже формулой где Aбета (A) представляет собой пептид из 8-26 аминокислотных остатков, производный от амилоидного пептида (A1-26/SEQ ID NO:2) или его аналога, содержащего консервативную аминокислотную замену;m равно от 1 до 6; А и B представляют собой прямую связь, линкерный фрагмент или независимо друг от друга представляют собой аминокислотную последовательность, содержащую от 1 до 20 аминокислот или их производных;A и B ковалентно связаны с образованием циклического пептида. В настоящем изобретении также рассмотрены антитела или их связывающие антиген фрагменты,которые связываются с соединениями по изобретению и ингибируют отложение амилоида и образование фибрилл. В изобретение включены различные типы антител, например моноклональные, поликлональные или антитела двойной специфичности и их фрагменты, распознающие эпитопы. Кроме того, антитела могут представлять собой химерные антитела, содержащие участки человеческого антитела, а также участки областей антител из других видов. Антитела по данному изобретению предпочтительно распознают человеческие A белки или пептиды, но также включают антитела, направленные против амилоидных пептидов, из других видов, предпочтительно млекопитающих. Изобретение также относится к способу получения антитела, которое специфично распознает указанные циклические пептиды, включающему следующие стадии:(а) иммунизация организма иммуногенной композицией, содержащей по меньшей мере один из антигенных пептидов формулы (I);(б) выделение антител, образованных посредством заражения на стадии (а); и(в) скрининг антител, полученных на стадии (б), на их специфичное распознавание фрагментовA-пептида или его вариантов. Изобретение также относится к антителу, которое может быть получено вышеописанным способом,и к применению указанного антитела для изготовления фармацевтического средства для диагностики,лечения или предупреждения заболевания, обусловленного амилоидом. Краткое описание графических материалов На фиг. 1 показаны средние титры антител мышей, иммунизированных дозами 20 мкг цикло(цис-4 амино-Pro(сукцинил-(1,3-дипальмитоилглицеро-2-фосфоэтаноламино-Asp-Ala-Glu-Phe-Arg-His-AspSer-Gly-Tyr-Glu-Val-His-His-Gln-Lys-D-Pro), связанного с IRIV, и мышей, иммунизированных линейной копией иммуногенного пептида, связанного с IRIV, за период времени 77 дней после иммунизации. На фиг. 2 показаны концентрации растворимого A мышей, иммунизированных цикло(цис-4 амино-Pro(сукцинил-(1,3-дипальмитоил-глицеро-2-фосфоэтаноламино-Asp-Ala-Glu-Phe-Arg-His-AspSer-Gly-Tyr-Glu-Val-His-His-Gln-Lys-D-Pro), по сравнению с необработанной контрольной группой. Подробное описание изобретения Синтетические пептидные антигены и вакцины В настоящем изобретении предложены пептиды, производные от A, которые являются эффективными при вызове или повышении иммунного ответа у человека или животного против амилоидных пеп-6 010586 тидов, и, следовательно, оно направлено на композиции и способы для диагностики, лечения и предупреждения заболеваний, обусловленных амилоидами. Термины "А", "-амилоидный пептид", "амилоидные пептиды" или "А" используют взаимозаменяемо на протяжении всего описания и относят к пептиду из 39-43 аминокислот (А 1-39, A1-40, A1-41, A1-42 или A1-43), представляющему собой основной компонент характеристических амилоидных бляшек при болезни Альцгеймера. A образуется в результате процессинга трансмембранного пептида APP значительно большего размера двумя клеточными протеазами, - и -секретазой. Пептид, преимущественно обнаруженный в бляшках, представляет собойA1-42 (SEQ ID NO:1). Более короткие варианты A1-39, A1-40 и A1-41 отличаются от A1-42 отсутствием 1-3 аминокислот с C-конца. A1-43 имеет дополнительный треонин при C-конце. Растворимые A относятся к форме пептида, который еще не агрегирован. В данном контексте термин "предупреждение" относится к вакцинации и иммунизации против указанных заболеваний. "Вакцинация" относится к процессу заражения организма антигеном, чтобы вызвать иммунный ответ, который помогает предупреждать или лечить заболевание или расстройство, связанное с этим антигеном, в дальнейшем. Термин "иммунизация" является взаимозаменяемым с вакцинацией. Пассивная иммунизация относится к введению специфичных к антигену антител, не продуцируемых организмом, подлежащим лечению. Термин "пептид" относится к небольшому числу аминокислот, связанных между собой пептидными связями. Чтобы более четко определить пептиды, используют префиксы, такие как ди-, три-, олиго- или поли-. "Антигены" по настоящему изобретению представляют собой короткие пептидные отрезки из 8-26 аминокислот,которые обладают значительной гомологией последовательности с -амилоидным пептидом A1-26(SEQ ID NO:2). Вариант пептида по настоящему изобретению включает аминокислотную замену, причем типично предпочтительными будут консервативные аминокислотные замены, т.е. замены, которые сохраняют свойство исходной аминокислоты, такое как размер, заряд, гидрофобность, конформация и т. д. Примеры консервативных замен аминокислот включают замены, полученные среди аминокислот в пределах следующих групп: (Amit, A.G., et al. 1986, Science 233:747-753) М, I, L, V; (Anders, R.F., et al. 1998, Vaccine 16:240-247) F, Y, W; (Barlow, D.J., et al. 1986, Nature 322:747-748) K, R, H; (Cheng, Q. and A. Saul. 1994,Mol. Biochem. Parasitol. 65:183-187) A, G; (Cohen, S., et al. 1961, Nature 192:733-737) S, T; (Coley, A.M., etal. 2001, Protein Eng 14:691-698) Q, N и (Collins, W.E., et al. 1994, Am. J. Trop. Med. Hyg. 51:711-719) E, D. Другие подходящие замены легко устанавливаются специалистом в данной области техники и могут быть дополнительно определены со ссылкой на публикации, такие как Voet, Biochemistry, Wiley, 1990;Stryer Biochemistry 4th Ed., Freeman New York, 1995/Peptide Chemistry. A Practical Textbook, 2nd ed., Miklos Bodanszky, Springer-Verlag, Berlin, 1993; Principles of Peptide Synthesis, 2nd ed., Miklos Bodanszky,Springer-Verlag, Berlin, 1993; Chemical Approaches to the Synthesis of Peptides and Proteins, P. LloydWilliams, F. Albericio, E. Giralt, CRC Press, Boca Raton, 1997; Bioorganic Chemistry: Peptides and Proteins,S.M. Hecht, Ed., Oxford Press, Oxford, 1998, Synthetic Peptides: A User's Guide, Gregory A. Grant (Editor),Oxford University Press, 2002, и т.п. В частности, изобретение направлено на композиции, содержащие вышеупомянутые пептиды, для вызова антител против амилоида. Эти композиции могут содержать дополнительные ингредиенты, такие как адъюванты и/или носители для доставки, чтобы дополнительно потенцировать иммунный ответ."Адъювант" относится к веществу, которое способно потенцировать иммуногенность антигена. Адъюванты могут представлять собой одно вещество или смесь веществ и функционировать путем непосредственного действия на иммунную систему или путем обеспечения медленного высвобождения антигена. Примерами адъювантов являются соли алюминия, полианионы, бактериальные гликопептиды и агенты медленного высвобождения, такие как неполный адъювант Фрейнда. "Носитель для доставки" относится к композиции, которая помогает направлять антиген к специфичным клеткам и способствует эффективному распознаванию антигена иммунной системой. Лучше всего известными носителями для доставки являются липосомы, виросомы, микрочастицы, включая микросферы и наносферы, полимеры, тени бактерий, бактериальные полисахариды, аттенуированные бактерии, вирусоподобные частицы, аттенуированные вирусы и ISCOM. Более конкретно в изобретении предложены композиции и способы усиления гуморального иммунного ответа против A, в частности, путем получения специфичных антител, которые можно применять для предупреждения или замедления невропатологии, связанной с заболеваниями, обусловленными амилоидами. Термины "гуморальный иммунитет" или "гуморальный иммунный ответ" оба относятся к иммунитету, опосредованному B-клетками, и опосредованы высокоспецифичными антителами, продуцируемыми и секретируемыми B-лимфоцитами (В-клетками). Секретируемые антитела связываются с антигенами и способствуют нейтрализации, опсонизации и активации системы комплемента и разрушению патогенов, ослабляемых этими средствами. Такие композиции полезны не только для вакцинации, но также для лечения и диагностики заболеваний, обусловленных аномалиями амилоидных белков, например болезни Альцгеймера и родственных расстройств. Цель и принцип изобретения состоит в периферическом снижении системных, растворимыхA посредством антител, направленных против этого пептида, таким образом, с одной стороны, предот-7 010586 вращая аккумуляцию этой молекулы, иначе приводящую к агрегации, и, с другой стороны, обходя потенциально вредные побочные эффекты, возникающие в результате внутримозговых иммунных реакций. Для того чтобы вызвать иммунный ответ, антигены должны захватываться и подвергаться процессингу специфичным типом клеток, так называемыми антигенпрезентирующими клетками (АПК). Три типа клеток, способных презентировать антигены, представляют собой дендритные клетки, макрофаги иB-лимфоциты. Захвату способствует фаго- или эндоцитоз, а процессинг осуществляется в везикулах или в цитозоле. Ключевую роль в презентации антигена на клеточной поверхности играет класс белков, называемых белками главного комплекса гистосовместимости (ГКГ). Эти молекулы кодируются наиболее полиморфным семейством генов в геноме человека, локализованным на хромосоме 6, и их можно подразделить на класс I и II. Топология обоих классов молекул является такой, что они могут связывать и презентировать настолько широкий спектр пептидов от 8 до 16 аминокислот в длину, насколько возможно. Таким образом, гарантирован очень эффективный иммунологический надзор. Копийность определенного антигенного пептида на поверхности антигенпрезентирующей клетки является достаточно низкой (примерно сто), учитывая, что суммарное число рецепторов пептида составляет примерно десять тысяч. Но данный признак принимает в расчет высоко гетерогенную смесь антигенных пептидов на поверхности каждой АПК. Молекулы ГКГ класса I связывают и презентируют образцы клеточных пептидов, включая эндогенные, а также транслированные и процессированные вирусные или опухолевые антигены, и активируют клеточный, цитотоксический иммунный ответ посредством CD8+ клеток (цитотоксических Т-клеток). Аутоиммунитет против эндогенных молекул в норме предотвращается процессом положительной и отрицательной селекции иммунных клеток в тимусе, костном мозге и лимфатической системе. Молекулы ГКГ класса II связывают и презентируют пептиды, которые поглощаются из непосредственной клеточной окружающей среды и подвергаются процессингу в везикулах, образующихся в результате слияния лизосом и фагосом. Молекулы класса II активируют CD4+ клетки (T-хелперные клетки), которые, в свою очередь, активируют B-клетки, индуцируя, таким образом, гуморальный иммунный ответ. Пептид является иммуногенным, если он способен к связыванию с молекулами ГКГ и обладает способностью быть распознанным CD8+ или CD4+ T-клетками. В данном контексте "иммуногенность" представляет собой способность антигена к провокации иммунного ответа. Иммуногенность антигена определяется многими переменными, включая размер, структуру, стабильность, отличие от эндогенных молекул, наличие адъюванта и состояние иммунитета организма, а также другими генетическими факторами. Только тогда он может индуцировать ответ иммунной системы, включающий антитела, которые специфично распознают антигенные детерминанты в пределах указанного антигенного пептида. Когда антиген не представляет собой чужеродный белок или пептид, он в норме не распознается Т-клетками,поскольку эти клетки претерпевают отбор не на реакцию с эндогенными белками, и его презентация в комплексе ГКГ на поверхности антигенпрезентирующей клетки недостаточна для провокации иммунного ответа. Использование белков или гликопротеинов при разработке новых и эффективных вакцин является спорным, поскольку в большинстве случаев они оказываются либо неэффективными, либо вредными для зараженного организма. Это свойство является следствием отсутствия иммуногенности, основанной на неблагоприятном размере, структуре, стабильности или гомологии с эндогенными белками, или включения незащитных эпитопов. В результате использования синтетических пептидов можно обойти множество проблем, связанных с белками рекомбинантного происхождения. Преимуществами являются специфичный отбор четко определенных эпитопов, исключение инфекционных белков или пептидов, хорошо определенная структура и последовательность, легкие методики получения и разумные цены производства. Одним из основных недостатков является слабо определенная трехмерная структура в растворе,которая может предотвратить правильную иммунизацию, поскольку пептид структурно значительно отличается от его белкового архетипа. Этот пептид конформационно менее ограничен, чем соответствующий белок, и повышенная гибкость может вызвать полностью отличные характеристики. Кроме того,нативные пептиды обладают низкой системной стабильностью и быстро разрушаются протеазами. Другим недостатком является то, что не гарантировано, что этот пептид способен связываться с белками главного комплекса гистосовместимости (ГКГ) класса I или II, что абсолютно необходимо для вызова иммунного ответа. Настоящее изобретение относится к антигенным пептидам, содержащим варианты A или его фрагменты с химическими свойствами, которые предрасполагают их к применению в качестве фармакологически активных агентов, дополнительно характеризующимся циклической природой. В природе циклопептиды встречаются в качестве природных метаболитов в форме гормонов, антибиотиков, систем транспорта ионов и токсинов. В живом организме они определенно более устойчивы к протеолитическому разрушению по сравнению с их соответствующими линейными двойниками. Кроме того, один этот признак делает их перспективными кандидатами для разработки фармакологически активных агентов. Но, в дополнение к их повышенной метаболической стабильности, они обладают дополнительными характеристиками, которые делают их лучшими по сравнению с их линейными гомологами. Их конформационная ригидность дает возможность формировать элементы вторичной структуры, такие-8 010586 как -листы или - и -петли, в относительно коротких пептидах и даже имитировать элементы третичной структуры. Таким образом, недостаток линейных пептидов, основанный на их слабо определенной конформации и их высокой гибкости, можно легко преодолеть. Сниженная конформационная гибкость,свойство презентации определенных функциональных групп определенным и предсказуемым путем и повышенная избирательность делает их высоко пригодными для использования в качестве синтетических активных компонентов лекарственных средств. Кроме указанных преимуществ, они чаще всего характеризуются очень хорошей биодоступностью. Циклопептиды можно подразделить по топологии на пептиды, циклизованные по типу головахвост, голова-боковая цепь, хвост-боковая цепь или боковая цепь-боковая цепь. Кроме того, можно делать различие между гомодет-циклопептидами, содержащими только пептидные связи, и гетеродет-циклопептидами, в дополнение содержащими дисульфидные, эфирные или тиоэфирные связи. Чтобы предотвратить рацемизацию C-концевых аминокислот во время циклизации, остатки пролина или глицина предпочтительны при C-конце. Компоненты, такие как D-аминокислоты, пролины, глицины иN-алкилированные аминокислоты, можно использовать для ускорения процесса циклизации на несколько порядков величины. Антигенные пептиды по настоящему изобретению представлены приведенной ниже формулой где Aбета (A) представляет собой пептид из 8-26 аминокислотных остатков, производный от-амилоидного пептида (А 1-26/SEQ ID NO:2) или его аналога, содержащего консервативную аминокислотную замену;m равно от 1 до 6; А и B представляют собой прямую связь, линкерный фрагмент, либо обозначают аминокислотную последовательность, содержащую от 1 до 20 аминокислот или их производных, и выбраны независимо друг от друга;A и B ковалентно связаны с образованием циклического пептида. В весьма предпочтительном варианте осуществления изобретения A представляет собой пептид из 12-20 аминокислотных остатков, производный от -амилоидного пептида (А 1-26/SEQ ID NO:2), предпочтительно A1-16 (SEQ ID NO:3). В другом весьма предпочтительном варианте осуществления изобретения A представляет собой A1-16 (SEQ ID NO:4). Антигенные пептиды по настоящему изобретению предпочтительно имеют длину от 10 до 196 аминокислот. В конкретном варианте осуществления изобретения пептиды по настоящему изобретению предпочтительно имеют длину от 10 до 40 аминокислотных остатков, предпочтительно от примерно 12 до 30 аминокислотных остатков и более предпочтительно от 14 до 20 аминокислотных остатков. В предпочтительном варианте осуществления изобретения m равно 1, 2 или 3, более предпочтительно 1. Если A и B представляют собой прямую связь, любые две из аминокислот A, предпочтительноN- и C-концевая аминокислота, ковалентно связаны с образованием циклического пептида. Ковалентная связь может быть образована, используя N-концевую амино- и C-концевую карбоксигруппу, но может быть также образована путем использования любой боковой цепи любой из аминокислот A. Если A и B представляют собой линкерный фрагмент, A и B вместе представляют собой молекулу или химическую группу, которая циклизует A. Этот линкерный фрагмент фиксирует цепь A в благоприятной структуре петли и, таким образом, ограничивает гибкость антигенного пептида. В предпочтительном варианте осуществления изобретения линкерный фрагмент представляет собой C5-C14 моно- или полициклическое кольцо или кольцевую систему, которая возможно содержит один или более чем один гетероатом, выбранный из группы, состоящей из N, О и S. В предпочтительном варианте осуществления изобретения указанная кольцевая система может быть замещена по меньшей мере двумя функциональными группами, которые дают возможность ковалентного связывания аминокислотной цепи и предпочтительно выбраны из группы, состоящей из карбокси, гидрокси, амида, амино или имино. В одном варианте осуществления изобретения указанная иминогруппа может также составлять часть указанного кольца или кольцевой системы. Указанный линкерный фрагмент образует, предпочтительно посредством указанных функциональных групп, ковалентные связи с N-концевой аминогруппой на одном конце и на другом конце с C-концевой карбоксигруппой аминокислотной цепи A. В другом варианте осуществления изобретения эти заместители ковалентно связывают группы боковой цепи любой из аминокислотA. C5-C14 моно- или полициклическое кольцо или кольцевая система может быть дополнительно замещена C1-C6 алкилом, C1-C6 алкокси, арилом, арил-C1-C6 алкилом, ароил-C1-C6 алкилом, аллилом, галогеном, NO2 или группой формулы CH2-COOR', где R' представляет собой водород, C1-C6 алкил, замещенный C1-C6 алкил, арил-C1-C6 алкил, арил, ароил-C1-C6 алкил или аллил. Если они присутствуют, последние-9 010586 группы предпочтительно замещены по меньшей мере двумя из объясненных выше функциональных групп, так что указанная сшивка образует посредством указанных функциональных групп ковалентные связи с аминогруппой и карбоксигруппой A. В весьма предпочтительном варианте осуществления изобретения линкерный фрагмент выбран из группы, содержащей соединения приведенных ниже формул где R1 представляет собой водород или аминогруппу;R2 представляет собой водород или группу формулы CH2-COOR9;R9 представляет собой водород, C1-C6 алкил, замещенный C1-C6 алкил, арил-C1-C6 алкил, арил, ароилC1-C6 алкил или аллил. Если A и B представляют собой аминокислотные остатки, тогда они могут представлять собой любую встречающуюся в природе аминокислоту, либо любую не встречающуюся в природе аминокислоту,либо их производные. Не встречающиеся в природе аминокислоты включают, но не ограничены, гидроксипролин, аминопролин, тироксин, орнитин, норвалин, норлейцин, -аланин, -аминомасляную кислоту, гомосерин, цитруллин и т.п. Встречающиеся в природе аминокислоты содержат глицин, аланин, валин, лейцин, изолейцин, метионин, пролин, фенилаланин, тирозин, триптофан, серин, треонин, цистеин, глутамин, аспарагин, гистидин, лизин, аргинин, глутаминовую кислоту и аспарагиновую кислоту. Также точно включены оба энантиомера вышеперечисленных аминокислот, т.е. L- и соответствующая D-форма. В данном контексте"производные" относятся к вышеперечисленной аминокислоте, которая модифицирована дополнительными функциональными группами, предпочтительно гидрокси, карбокси, амино, C1-C6 алкилом, амидо и гуанидо. В одном предпочтительном варианте осуществления изобретения A представляет собой 4-аминопролин и B представляет собой D-пролин. Циклизация может быть достигнута посредством прямого соединения N- и C-конца с образованием пептидной связи, но может также осуществляться через боковые цепи аминокислот. Кроме того, она может быть основана на использовании других функциональных групп, включая амино, гидрокси, сульфгидрил, галоген, сульфонил, карбокси или тиокарбокси, но не ограничиваясь приведенным перечнем. Эти группы могут быть расположены при боковых цепях аминокислот или присоединены к их N- или Cконцу. В весьма предпочтительном варианте осуществления изобретения антигенный пептид представляет собой цикло(цис-4-амино-Pro-Asp-Ala-Glu-Phe-Arg-His-Asp-Ser-Gly-Tyr-Glu-Val-His-His-Gln-Lys-D-Pro). Аминокислоты A и B могут быть независимо друг от друга модифицированы липидными группами. Указанная липидная группа представляет собой большей частью гидрофобную молекулу, состоящую из- 10010586 одной или более гидрофобной группы, включая липид A, холестерин, сфинголипиды, липиды на основе глицерина, диацилглицерин, ПЭГ-липиды, диэфирные липиды, 1,2-диолеоилокси-3-триметиламмонийпропан (DOTAB), 1,2-диолеоилокси-3-диметиламмоний-пропан (DODAP.CI), N,N-диолеоил-N,Nдиметиламмоний (DODAC), жирные кислоты, изопреноиды, сфингозин и его производные, но не ограничиваясь приведенным перечнем. Жирные кислоты включают капроновую, каприловую, каприновую,лауриновую, миристиновую, пальмитиновую, стеариновую, арахиновую, бегеновую, лигноцериновую,миристолеиновую, пальмитолеиновую, петразелиновую, элаидиновую, олеиновую, линолевую, линолелаидиновую, цис-вакценовую, линоленовую, арахидоновую, цис-11-эйкозеновую, эруковую, цис 4,7,10,13,16,19-докозагексаеновую и нервоновую кислоты, но не ограничены приведенным перечнем. Липиды на основе глицерина включают фосфатидилэтаноламин, фосфатидилсерин, фосфатидилхолин(лецитин), фосфатидилинозит, фосфатидилглицерин, кардиолипин, плазмалоген, фосфатидную кислоту и лизофосфатидную кислоту. Изопреноиды включают, но не ограничены, фарнезил и геранилгеранил, но не ограничены приведенным перечнем. Липидная группа может быть присоединена непосредственно или через линкер к любой или к обеим аминокислотам A и/или B. Прямая сшивка достигается посредством амидной, эфирной, тиоэфирной,сложноэфирной или сложнотиоэфирной связи. Линкер может представлять собой любой остаток, но предпочтительно выбран из группы C3-C10 дикарбоновых кислот и наиболее предпочтительно представляет собой янтарную кислоту. Модификация может иметь место при боковой цепи или соответствующей амино- или карбоксигруппе указанных аминокислот. Липидная группа может представлять собой фосфолипид, предпочтительно фосфатидилэтаноламин, возможно связанный с янтарной кислотой в качестве линкера. Наиболее предпочтительно липидная группа представляет собой диацилглицерофосфоэтаноламиносукцинат и более предпочтительно 1,3-дипальмитоилглицеро-2-фосфоэтаноламиносукцинат. Модифицированные липидом пептидные антигены могут быть, таким образом, заякорены на поверхности носителя для доставки, такого как липосомы и виросомы. Изобретение также относится к иммуногенным композициям, содержащим по меньшей мере один антигенный пептид, представленный формулой (I), как определено выше. Пептидные антигены по настоящему изобретению могут быть получены с помощью широкого разнообразия способов, известных специалистам в данной области техники. В связи с его относительно малым размером пептид можно синтезировать в растворе или, более сложно, на твердой фазе, например на синтетической смоле. Различные автоматические синтезаторы в настоящее время имеются в продаже и могут использоваться в соответствии с хорошо исследованными протоколами синтеза. Альтернативно пептиды можно экспрессировать рекомбинантным путем из синтетических генов в подходящих организмах. Эти методики также легко доступны специалистам в данной области техники. Указанные способы получения пептидов по изобретению также следует включать в объем настоящего изобретения, как и пептиды, полученные этими способами. В предпочтительном варианте осуществления изобретения пептид синтезируют путем использования способа получения пептида формулы (I),включающего стадии последовательного синтеза линейного пептида и циклизации этого линейного пептида с получением пептида формулы (I). В объем настоящего изобретения также включен пептид, который может быть получен указанным способом и представлен приведенной ниже формулой где Aбета (A) представляет собой пептид из 8-26 аминокислотных остатков, производный от-амилоидного пептида (A1-26/SEQ ID NO:2) или его аналога, содержащего консервативную аминокислотную замену;m равно от 1 до 6; А и B представляют собой прямую связь, линкерный фрагмент или обозначают аминокислотную последовательность, содержащую от 1 до 20 аминокислот или их производных, и выбраны независимо друг от друга; и А и B ковалентно связаны с образованием циклического пептида. В настоящем изобретении также рассмотрено применение вышеописанных антигенных пептидов и иммуногенных композиций для изготовления фармацевтических средств для диагностики, лечения и предупреждения заболеваний, обусловленных амилоидами. В данном контексте "предупреждение" относится к применению указанных фармацевтических композиций для вакцинации против указанных расстройств. Носители для доставки Антигенные пептиды можно комбинировать с совместимыми для человека носителями для доставки, включая, но не ограничиваясь, микрочастицы (например, микросферы и наносферы), полимеры, тени бактерий, бактериальные полисахариды, полипептиды, белки, аттенуированные бактерии, вирусоподоб- 11010586 ные частицы, аттенуированные вирусы, ISCOM, липосомы и предпочтительно виросомы (IRIV). Пептиды по изобретению могут быть присоединены к носителям для доставки или включены в них для эффективного получения иммунного ответа на антигенный пептид. "Связывание с" или "присоединение к" относится к присоединению антигенного пептида к носителю для доставки. Это можно осуществить путем ковалентной связывания или внутримолекулярного взаимодействия, например, водородных связей или Ван-дер-Ваальсовых сил. В частности, пептидные антигены, модифицированные липидами, могут быть,таким образом, заякорены на поверхности содержащих липиды носителей для доставки, таких как липосомы и виросомы. "Включены в" или "инкапсулированы в" относится к антигенному пептиду, который находится внутри носителя для доставки, такого как микрочастицы, тени бактерий, аттенуированные бактерии, вирусоподобные частицы, аттенуированные вирусы, ISCOM, липосомы и предпочтительно виросомы. Виросомы Дополнительно в настоящем изобретении раскрыто применение виросом, способных вызывать иммунный ответ, путем использования указанных виросом в качестве носителей для доставки антигена для вышеупомянутых соединений и прививки ими субъекта. Виросомы представляют собой оболочки вирусов и не содержат инфекционный генетический материал исходного вируса. Таким образом, виросомы являются высокоэффективными адъювантами в современной вакцинации, обладающими лучшими свойствами в качестве носителей для доставки антигена и сильным иммуногенным потенциалом, в то же время с сопутствующей минимизацией риска побочных эффектов. В настоящем изобретении раскрыты композиции, которые содержат -амилоидные антигены,включенные в иммуноадъювантную композицию, содержащую синтетические сферические виросомы,названные потенцирующими иммунитет реконструированными виросомами гриппа (ImmunopotentiatingReconstituted Influenza Virosomes, IRIV). IRIV представляют собой сферические однослойные везикулы со средним диаметром 150 нм и содержат двойную липидную мембрану, состоящую, по существу, из фосфолипидов, предпочтительно фосфатидилхолинов (ФХ) и фосфатидилэтаноламинов (ФЭ). В противоположность липосомам IRIV содержат функциональные гликопротеины вирусной оболочки гемагглютинин (ГА) и нейраминидазу (НА), включенные в фосфолипидную двухслойную мембрану. Биологически активный ГА не только придает структурную стабильность и однородность виросомным препаратам,но также вносит значительный вклад в иммунологические свойства в результате поддержания активности слияния вируса. К настоящему времени виросомы эффективно применяют в ряде вакцин. Например, в имеющихся в продаже вакцинах против гепатита A и B, вируса гриппа и сальмонеллеза использованы виросомы в качестве адъювантов и безопасных носителей для доставки антигена. Антитела, вызванные заражением антигенами, реконструированными в виросомах, показали высокое сродство к антигенам, против которых они вызваны. Инъецированный отдельно, амилоидный -пептид проявляет относительно низкую иммуногенность, как следовало бы ожидать для эндогенного белка. Но в комбинированной форме антигена и виросомы были получены измеримые титры высокоспецифичных антител против антигена. Следовательно, в настоящем изобретении также раскрыта композиция и получение антигенов амилоидных -пептидов,связанных с виросомами, для диагностики, лечения или предупреждения расстройств, обусловленных амилоидами. Для изготовления описанных композиций антигенные пептиды модифицируют липидной группой, и в процессе реконструкции виросом инкубируют с ними, давая возможность встраивания в мембрану виросомы и, следовательно, нековалентного присоединения антигенного пептида к поверхности виросомы. Альтернативно антигенные пептиды можно транспортировать немодифицированными внутри виросомы. Различие состоит в типе иммунного ответа. Когда виросомы сливаются с клеткамимишенями, они высвобождают их содержимое в цитоплазму клетки. Там это содержимое претерпевает процессинг и презентацию в комплексе с молекулами ГКГ класса I на клеточной поверхности, запуская клеточный, опосредованный CD8+ клетками, цитотоксический иммунный ответ. В противоположность этому механизму, если поверхностный антиген распознается, подвергается эндоцитозу и презентации в ГКГ класса II, вызывается гуморальный иммунный ответ и продуцирование специфичных антител. Считают, что в механизм действия виросомы после введения композиции по настоящему изобретению вовлечено активное связывание комплекса IRIV/антигенный пептид с поверхностью макрофагов, приводящее к фагоцитозу комплекса виросома/антиген или слиянию виросомной и плазматической мембраны. Встроенные антигены претерпевают процессинг, и фрагменты презентируются на поверхности макрофага. Это стимулирует активацию T-лимфоцитов, которая, в свою очередь, вызывает продуцирование антиамилоидных антител B-лимфоцитами. Пептидные антигены по настоящему изобретению могут быть присоединены к виросоме или заключены в нее. Присоединение к мембране виросомы или включение в нее достигается путем модификации пептида липидной группой, как описано выше. Для заключения антигенного пептида в виросому модификация не является необходимой. В одном предпочтительном варианте осуществления изобретения носитель для доставки антигена- 12010586 представляет собой виросому, и антигенный пептид присоединен к поверхности виросомы через липидную группу. В настоящем изобретении также предложены способы диагностики и лечения заболеваний, обусловленных амилоидами, а также способы вакцинации против указанных расстройств, используя вышеупомянутые композиции. В одном варианте осуществления изобретения иммуногенную композицию,содержащую антигенный пептид формулы (I) и виросомы, применяют для стимуляции повышения уровня антител, специфичных к -амилоидному пептиду, полезных при диагностике, лечении или предупреждении указанного расстройства. Адъюванты Антигены определяются двумя характеристическими свойствами: иммуногенностью, означающей их способность к провокации иммунного ответа в организме, и антигенностью, т.е. их способностью быть распознанными антителами, специфичными к указанному антигену. Поскольку некоторые антигены являются только слабо иммуногенными при введении самих по себе, они не способны индуцировать иммунный ответ, необходимый для обеспечения эффективной иммунотерапии или защиты для организма. Продемонстрировано, что для преодоления этого недостатка применение адъювантов является мощным инструментом при иммунизации. Адъювант функционирует путем усиления иммунного ответа на определенный антиген, вводимый в комбинации с ним. Механизм потенцирования иммунитета основан на изменении фармакокинетики антигена или на прямой стимуляции иммунной системы. Применение адъювантов хорошо известно в данной области техники, и специалист имеет в своем распоряжении разнообразие пригодных адъювантов. Композиции по настоящему изобретению также содержат комбинацию антигенов по изобретению с адъювантами, известными специалистам в данной области техники, включающими олиго- или полисахариды, адъюванты Фрейнда (полный и неполный), микобактерии, такие как BCG, M. Vaccae или липид A,либо Corynebacterium parvum, смеси Quil-сапонин, такие как QS-21 (SmithKline Beecham), MF59 (Chiron) и различные эмульсии масло/вода (например, IDEC-AF), но не ограничены приведенным перечнем. Другие адъюванты, которые можно использовать, содержат минеральные соли или минеральные гели, такие как гидроксид алюминия, фосфат алюминия и фосфат кальция; производные ЛПС, сапонины, поверхностно-активные вещества, такие как лизолецитин, плюронные полиолы, полианионы, пептиды или белковые фрагменты, гемоцианины блюдечка и динитрофенол; иммуностимулирующие молекулы, такие как сапонины, мурамилдипептидные и трипептидные производные, динуклеотиды CpG, олигонуклеотиды CpG, монофосфориллипид A и полифосфазены; адъюванты, состоящие из частиц и микрочастиц, такие как эмульсии, липосомы, виросомы, кохлеаты; или адъюванты иммуностимулирующего комплекса слизистой оболочки,но не ограничены приведенным перечнем. Цитокины также полезны в протоколах вакцинации в результате свойств, стимулирующих лимфоциты. Многие цитокины, полезные для таких целей, должны быть известны обычным специалистам в данной области техники, включая интерлейкин-2 (IL-2), IL-12, GM-CSF и многие другие. Все эти адъюванты можно использовать отдельно или в комбинации, создавая систему адъювантов. Поскольку они могут дополнительно стимулировать иммунный ответ, их применение в дополнение к виросомам или вместо них составляет часть изобретения. Антитела Настоящее изобретение также включает антитела или их связывающие антиген фрагменты, которые связываются с соединениями по изобретению и ингибируют отложение амилоида и образование фибрилл. В изобретение включены различные типы антител, например моноклональные, поликлональные или антитела двойной специфичности, а также их фрагменты, распознающие эпитопы. Кроме того, антитела могут представлять собой гуманизированные или химерные антитела, содержащие участки человеческого антитела, а также участки областей антител из других видов. Антитела по данному изобретению предпочтительно распознают человеческие белки или пептидыA, но также включают антитела, направленные против амилоидных пептидов, из других видов, предпочтительно млекопитающих, и включают как поликлональные, так и моноклональные антитела. Изобретение также относится к способу получения антитела, которое специфично распознает антигенные пептиды по изобретению, включающему следующие стадии:(а) иммунизация организма иммуногенной композицией, содержащей по меньшей мере один из антигенных пептидов, представленных формулой (I);(б) выделение антител, образованных посредством заражения на стадии (а); и(в) скрининг антител, полученных на стадии (б), на их специфичное распознавание фрагментовA-пептида или его вариантов. Изобретение также относится к антителу, которое может быть получено вышеописанным способом,и к его применению при диагностике, лечении и предупреждении заболеваний, обусловленных амилои- 13010586 дами. Введение В настоящем изобретении также предложено введение иммуностимулирующих композиций, содержащих антигены, производные от -амилоида, возможно в комбинации с адъювантами и/или носителями для доставки, в составе подходящего фармацевтического препарата. Такую иммуногенную композицию, которая содержит один или более чем один из антигенных пептидов, производных от -амилоида, и/или содержащие пептид композиции по настоящему изобретению,в качестве основного активного вещества или одного из активных ингредиентов, можно вводить в широком разнообразии терапевтических лекарственных форм в общепринятых носителях для местного, перорального, системного, локального и парентерального введения. Таким образом, в изобретении предложены композиции для парентерального введения, которые содержат раствор антигенных пептидов, растворенных или суспендированных в приемлемом носителе, предпочтительно в водном носителе, например в воде, забуференной воде, 0,4% солевом растворе, 0,3% глицине, гиалуроновой кислоте и т.п., известном специалистам в данной области техники. Эти композиции можно стерилизовать с помощью общепринятых хорошо известных методик стерилизации либо можно стерильно фильтровать. Полученные в результате водные растворы можно упаковывать для применения как таковые либо в лиофилизированном виде, где такой лиофилизированный препарат объединяют со стерильным раствором перед введением. Композиции могут содержать фармацевтически приемлемые вспомогательные вещества, которые необходимы для приближения к физиологическим условиям, такие как агенты, регулирующие рН, и буферные агенты, агенты, регулирующие тоничность, увлажняющие агенты и т.п., например ацетат натрия,лактат натрия, хлорид натрия, хлорид калия, хлорид кальция, сорбитанмонолаурат, триэтаноламинолеат,среди многих других, известных специалистам в данной области техники. Существующие способы изготовления вводимых парентерально соединений должны быть известны или очевидны специалистам в данной области техники и описаны более подробно, например, в Remington: The Science and Practice ofWilliamsWilkins PA, USA, которая включена в данное описание путем ссылки. Путь и режим введения будет варьировать в зависимости от стадии или тяжести состояния, подлежащего лечению, и должны быть определены практикующим специалистом. Например, пептиды и содержащие пептиды композиции можно вводить перорально в таких лекарственных формах, как, например, таблетки, капсулы (каждые из которых включают препараты регулируемого высвобождения и пролонгированного высвобождения), пилюли, порошки, гранулы, эликсиры, настойки, растворы, суспензии,сиропы и эмульсии, либо альтернативно путем инъекции. Подобным образом их можно также вводить во внутривенной (либо болюсным, либо инфузионным способом), внутрибрюшинной, подкожной, местной с окклюзией или без окклюзии или внутримышечной форме. В предпочтительных вариантах осуществления изобретения антигенные пептиды и содержащие пептиды композиции вводят внутрикожно или подкожно. Все эти формы хорошо известны обычным специалистам в области фармацевтики. Предпочтительно пригодные препараты по настоящему изобретению можно вводить в однократной дозе либо суммарную дозировку можно вводить в разделенных дозах, например два, три или четыре раза. Кроме того, соединения по настоящему изобретению, в частности те, которые содержат виросомы или липосомы, можно вводить в интраназальной форме или посредством чрескожных путей, известных обычным специалистам в данной области техники. Антигенные пептиды и композиции по настоящему изобретению можно вводить в фармацевтической композиции, содержащей активное соединение в сочетании с фармацевтически приемлемым носителем, адаптированным для местного введения. Местные фармацевтические композиции могут находиться, например, в форме раствора, крема, мази, геля, лосьона, шампуня или аэрозольного препарата,адаптированного для нанесения на кожу. Эти местные фармацевтические композиции, содержащие соединения по настоящему изобретению, обычно включают примерно от 0,005 до 5 мас.% активного соединения в смеси с фармацевтически приемлемым носителем. Режим дозировки с использованием композиций по настоящему изобретению выбирают в соответствии с рядом факторов, включая, например, вид, возраст, массу, пол и состояние здоровья пациента,стадию и тяжесть состояния, подлежащего лечению, и конкретное соединение, применяемое при нем. Обычный врач может легко определить и назначить эффективное количество лекарственного средства,необходимое для предупреждения заболевания, борьбы с заболеванием или остановки прогрессирования заболевания, обусловленного амилоидами. Оптимальное назначение при достижении концентрации лекарственного средства в диапазоне, который дает эффективность либо без токсичности, либо с приемлемой токсичностью требует режима на основании кинетики доступности лекарственных средств сайтаммишеням. В данный процесс включают рассмотрение распределения, равновесия и элиминации лекарственного средства, и оно находится в пределах компетенции практикующего специалиста в данной области техники. В способах по настоящему изобретению соединения, подробно описанные выше, могут образовать активный ингредиент, и типично их вводят в смеси с фармацевтическими разбавителями или эксципиен- 14010586 тами, выбранными в соответствии с предназначенной формой введения, т.е. пероральными таблетками,капсулами, эликсирами, сиропами и т.п., и соответствующими общепринятой фармацевтической практике. Например, для перорального введения в форме таблетки или капсулы активный лекарственный компонент можно комбинировать с пероральным нетоксичным фармацевтически приемлемым инертным носителем, таким как этанол, глицерин, вода и т.п. Кроме того, когда желательно или необходимо, пригодные связующие агенты, смазывающие агенты, разрыхляющие агенты и красящие агенты можно также включать в эту смесь. Пригодные связующие агенты включают без ограничения крахмал, желатин, натуральные сахара, такие как глюкоза или -лактоза, зерновые подсластители, натуральные и синтетические смолы, такие как аравийская камедь, трагакант или альгинат натрия, карбоксиметилцеллюлозу, полиэтиленгликоль, воски и т.п. Смазывающие агенты, используемые в этих лекарственных формах, включают без ограничения олеат натрия, стеарат натрия, стеарат магния, бензоат натрия, ацетат натрия, хлорид натрия и т.п. Разрыхлители включают без ограничения крахмал, метилцеллюлозу, агар, бентонит, ксантановую смолу и т.п. Жидкие формы можно пригодно корригировать суспендирующими или диспергирующими агентами, такими как синтетические и натуральные смолы, например трагакант, аравийская камедь, метилцеллюлоза и т.п. Другими диспергирующими агентами, которые можно использовать, являются глицерин и т.п. Для парентерального введения желательны стерильные суспензии и растворы. Изотонические препараты, которые обычно содержат пригодные консерванты, используют, когда желательно внутривенное введение. Местные препараты, содержащие активный лекарственный компонент, можно смешивать с рядом веществ-носителей, хорошо известных в данной области техники, таких как, например, спирты,гель алоэ вера, аллатоин, глицерин, масла витаминов A или E, минеральное масло, PPG2 миристоилпропионат и т.п., с образованием, например, спиртовых растворов, местных очистителей, очищающих кремов, гелей для кожи, лосьонов для кожи и шампуней в кремовых или гелевых препаратах. Антигенные пептиды, композиции или их препараты по настоящему изобретению можно объединять с классом биоразрушаемых полимеров, полезных при достижении регулируемого высвобождения лекарственного средства, например полимером молочной кислоты, поли-эпсилон-капролактоном, полимером гидроксимасляной кислоты, полиортоэфирами, полиацеталями, полидигидропиранами, полицианоакрилатами и сшитыми или амфипатическими блок-сополимерами гидрогелей. Как правило, субъекты могут получать внутрикожную инъекцию эффективного количества антигенных пептидов и композиций либо в комбинации с носителями для доставки, такими как виросомы, либо сами по себе. Пептиды по настоящему изобретению можно также вводить в форме липосомных систем доставки, таких как малые однослойные везикулы, большие однослойные везикулы и многослойные везикулы. Липосомы можно образовать из ряда соединений, включая, например, холестерин, стеариламин и различные фосфатидилхолины. За первоначальными дозами могут следовать бустерные дозы, следуя протоколам иммунизации,стандартным в данной области техники. Иммуностимулирующий эффект композиций и способов по настоящему изобретению можно дополнительно повысить путем комбинирования любого из вышеупомянутых антигенных пептидов, включая их комбинацию с виросомами, с дополнительным соединением,потенцирующим иммунный ответ. Соединения, потенцирующие иммунный ответ, классифицируют либо как адъюванты, либо как цитокины. Дополнительные адъюванты могут больше усиливать иммунологический ответ посредством обеспечения резервуара антигена (вне клетки или внутри макрофагов), активации макрофагов и стимуляции специфичных групп лимфоцитов. Адъюванты множества видов хорошо известны в данной области техники; конкретные примеры включают иммуногенные олигонуклеотиды и пептиды, адъюванты Фрейнда, квасцы, микобактерии, такие как BCG и М. Vaccae, смеси Quil-сапонин,такие как QS-21 (SmithKline Beecham), и различные эмульсии масло/вода (например, IDEC-AF). Также полезными в протоколах вакцинации являются цитокины благодаря их свойствам стимуляции лимфоцитов. Множество цитокинов, полезных для данной цели, должно быть известно обычным специалистам в данной области техники, включая интерлейкин-2 (IL-2), IL-12, GM-CSF и многие другие. При введении терапевтические композиции по настоящему изобретению вводят в фармацевтически приемлемых препаратах. Такие препараты могут по стандартной методике содержать фармацевтически приемлемые концентрации соли, буферных агентов, консервантов, совместимых носителей для доставки,вспомогательных агентов, потенцирующих иммунитет, таких как адъюванты и цитокины, и возможно других терапевтических агентов. Препараты по изобретению вводят в эффективных количествах. Обычно дозы иммуногенов в интервале от 1 нг/кг до 100 мг/кг в зависимости от режима введения считают эффективными. Предпочтительным интервалом считают интервал между 500 нг и 500 мкг на 1 кг. Абсолютное количество будет зависеть от ряда факторов, включая композицию, выбранную для введения, где введение осуществляется в однократной или в многократных дозах, и индивидуальные параметры пациента, включая возраст, физическое состояние, размер, массу и стадию заболевания. Эти факторы хорошо известны обычным специалистам в данной области техники и могут быть адресованы не более чем к рутинному экспериментированию. В случае лечения заболевания, обусловленного амилоидами, желаемым ответом является снижение- 15010586 амилоидных бляшек и системной концентрации A-пептида. В случае профилактики, означающей вакцинацию или иммунизацию, желаемым ответом является защитный иммунитет против вредного пептида, который измеряют на основании вторичных иммунных ответов при воздействии амилоидного пептида или его антигена. Мониторинг этих желаемых ответов можно проводить рутинными способами. Настоящее изобретение не следует ограничивать в объеме конкретными вариантами его осуществления, описанными здесь. Действительно, различные модификации изобретения в дополнение к описанным здесь будут очевидны специалистам в данной области техники на основании приведенного выше описания, а также из примеров. Такие модификации находятся в пределах объема прилагаемой формулы изобретения. Примеры Настоящее изобретение проиллюстрировано приведенными ниже примерами, которые никоим образом не следует рассматривать как налагающие ограничения на его объем. Напротив, следует четко понимать, что может быть сделан выбор различных других его вариантов, модификаций и эквивалентов,которые после прочтения приведенного здесь описания могут быть предложены специалистами в данной области техники, но все же находятся в пределах объема изобретения. Пример 1. Получение виросом. Для получения PE-миметик-IRIV раствор очищенного гемагглютинина вируса гриппа A/Сингапур(4 мг) в фосфатно-солевом буферном растворе (ФСБ) центрифугировали в течение 30 мин при 100000 g и осадок растворяли в ФСБ (1,33 мл), содержащем 100 мМ октаэтиленгликоля монодецилового эфира(ФСБ-ОЭГ). Конъюгаты амилоидный пептид - фосфатидилэтаноламин (4 мг), фосфатидилхолин (32 мг;Lipoid, Ludwigshafen, Germany) и фосфатидилэтаноламин (6 мг) растворяли в суммарном объеме 2,66 мл ФСБ-ОЭГ. Растворы фосфолипидов и гемагглютинина смешивали и озвучивали ультразвуком в течение 1 мин. Этот раствор центрифугировали в течение 1 ч при 100000 g и надосадочную жидкость стерилизовали фильтрованием. Виросомы образовались в результате удаления детергента (SM BioBeads, BioRad,Glattbrugg, Швейцария). Пример 2. Методика вакцинации. Двойных трансгенных мышей F1 в генетическом фоне FVBC57BI (n=36) выводили путем скрещивания трансгенных мышей APP [V717I] с PS1 [А 246 Е] (Moechars et al., 1999; Dewachter et al., 2000). Всех мышей генотипировали с помощью ПЦР при отлучении от матери (3 недели) и повторно генотипировали в начале исследования. Мышей рандомизировали для испытаний, распределяли слепым методом на подлежащих обработке и экспериментальных, отмечали по полу и возрасту в контрольных группах и группах обработки и давали свободный доступ к воде и пище. Мышей держали при обращенном световом цикле при 12 ч при свете и 12 ч в темноте, начиная с 7 ч утра. Всех мышей предварительно иммунизировали за три недели до начала надлежащей вакцинации в возрасте 5-6 недель внутримышечной инъекцией 100 мкл очищенного вируса гриппа (HI/NI A/Sing, 10 мкг/мл в фосфатно-солевом буферном растворе). Это было сделано для отражения человеческой ситуации, поскольку практически каждый человек тестируется положительно на антитела против вируса гриппа. Суммарно 24 двойные трансгенные мыши были вакцинированы один раз в месяц 100 мкл A виросом в течение 5 месяцев, тогда как 12 контрольных двойных трансгенных мышей были обработаны контрольными виросомами, не экспрессирующими амилоидный пептид, следуя идентичной схеме. Пример 3. Иммуногистохимия и твердофазный иммуноферментный анализ (ELISA) на A ткани головного мозга. Мышей анестезировали смесью кеталара (кетамина), ромпана (ксилазина 2%) и атропина (2:1:1). Кровь собирали путем пункции сердца, и плазму собирали с помощью центрифугирования при 14000 об/мин при 4C в течение 10 мин. Мышей перфузировали через сердце охлажденным во льду солевым раствором. Головной мозг извлекали, и левые и правые полушария обрабатывали для биохимического и иммуногистохимического анализа. Одно полушарие немедленно погружали в жидкий азот и хранили при -70C до гомогенизации для анализа A-пептидов с помощью твердофазного иммуноферментного анализа. Другое полушарие фиксировали в 4% параформальдегиде для иммуногистохимии. Все собранные образцы отмечали идентификационным номером мыши, распределяли слепым методом для анализов и без какой-либо ссылки на вид обработки. Иммуногистохимия Делали сагиттальные срезы на вибратоме (40 мкм) для свободно плавающей инкубации и хранили при 4 С до окрашивания. Было отобрано суммарно 25 последовательных срезов на один головной мозг,содержащих область гиппокампа, причем срезы 1, 6, 11, 16, 21 иммунологически окрашивали поликлональной антисывороткой кролика Pan -Amyloid (Ab-I) (Oncogene, San Diego, CA), срезы 2, 7, 12, 17, 22 окрашивали тиофлавином S, а срезы 3, 8, 13, 18, 23 - моноклональным антителом CD45 (Pharmingen, SanDiego, CA), специфичным к активированной микроглии. Срезы рандомизировали и окрашивание оценивали количественно слепым методом. Количественное определение проводили на изображениях, полученных с микроскопа Leica DMR, оборудованного- 16010586 камерой Sony DXC-9100P, и анализировали компьютерной программой (программное обеспечениеQ-Win, Leica, Leitz, Germany). Интенсивность света и установки конденсора для микроскопа поддерживали постоянными на протяжении всего процесса получения изображений. Все полученные изображения подвергали обработке одной и той же компьютерной подпрограммой во избежание отклонений исследователя. Пороги интенсивности срезов применяли однородно на протяжении всего анализа. Область подставки (гиппокампа) выбирали для автоматического количественного определения иммунологического окрашивания А и окрашивания тиофлавином S, соответственно дающего суммарную нагрузку амилоида и нагрузку сенильных бляшек с плотной сердцевиной. Срезы с механическими или структурными артефактами в области подставки исключали из анализа. Иммунологическое окрашивание Pan A проводили, используя трехступенчатый метод. Кратко,срезы инкубировали в течение ночи с антисывороткой Pan A (1:10 000), разведенной в фосфатносолевом буферном растворе, содержащем 10% фетальной сыворотки теленка. Далее срезы проявляли биотинилированной антисывороткой коза против кролика (разведение 1:500) и набором ABC (Vector,Burlingame, CA), используя диаминобензидин и перекись водорода в качестве субстратов. Окрашенные срезы монтировали на предметных стеклах (Depex). Окрашивание на активированную микроглию проводили подобным образом, за исключением того, что использовали моноклональное антитело анти-CD45(1:5000) и антисыворотку коза против IgG крысы (1:500) (Vector, Burlingame, CA). Для окрашивания тиофлавином S срезы ополаскивали в проточной воде, окрашивали в течение 8 мин раствором тиофлавина S (1% в ФСБ), фиксировали в 4% формальдегиде, ополаскивали и повторно окрашивали в течение 4 мин. Срезы фиксировали 80% этанолом и монтировали на предметных стеклах(Mowiol) с покрытием против обесцвечивания (DABCO, 1,4-диазабицикло(2.2.2)октан) (Sigma, Steinheim,Germany). Твердофазный иммуноферментный анализ растворимого и нерастворимого A Головной мозг гомогенизировали в 5 объемах 20 мМ буфера Трис/HCl (рН 8,5), содержащего смесь ингибиторов протеаз, 10 ударами (650 об/мин) в гомогенизаторе Potter. Гомогенаты центрифугировали при 4C в течение 80 мин при 135000 g. Из надосадочной жидкости выделяли растворимые A-пептиды с помощью колоночной хроматографии с обращенной фазой (картриджи C18-Seppack Vac 3 см 3, Waters,MA). Перед нанесением образцов колонки промывали 2 мл 80% ацетонитрила в 0,1% трифторуксусной кислоте (ТФУ) в воде и дважды 2 мл 0,1% ТФУ в воде. Образцы наносили и колонки промывали 1,5 мл 5% ацетонитрила/0,1% ТФУ, 1,5 мл 25% ацетонитрила/0,1% ТФУ. A-пептиды элюировали 50% ацетонитрила/0,1% ТФУ, собирали в одну фракцию, которую лиофилизировали в течение ночи. Лиофилизированный остаток ресуспендировали в Трис-буферном солевом растворе, содержащем ингибиторы протеаз, 2% NP40 и 2% Тритон Х-100, а затем центрифугировали в течение 60 мин при 98000 g при 4 С. Нерастворимые амилоидные пептиды содержались в осадках первой стадии центрифугирования после гомогенизации. Осадки ресуспендировали в 80 мМ Трис/HCl рН 8,0, содержащем 8 М гуанидинхлорид, путем смешивания в течение 3 ч при комнатной температуре, а затем соответственно разводили в буфере для образцов ELISA. Анализ с помощью твердофазного иммуноферментного анализа пептидов A40 и A42 в растворимой и нерастворимой фракции проводили с помощью предназначенных для этого специальных аналитических наборов в соответствии с инструкциями изготовителя (The Genetics Company, Цюрих, Швейцария). ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Антигенный пептид формулы где A представляет собой пептид из 12-20 аминокислотных остатков, производный от -амилоидного пептида (A1-26; SEQ ID NO:2), предпочтительно A1-16 (SEQ ID NO:3) или A11-26 (SEQ ID NO:4), или его аналога, содержащего консервативную аминокислотную замену;A и B представляют собой прямую связь, линкерный фрагмент или обозначают аминокислотную последовательность, содержащую от 1 до 20 аминокислот или их производных, и выбраны независимо друг от друга. 2. Пептид по п.1, где A и B представляют собой прямую связь любых двух из аминокислот A, где эти аминокислоты ковалентно связаны с образованием циклического пептида. 3. Пептид по п.2, где A и B представляют собой прямую связь, и N- и C-концевые аминокислоты A ковалентно связаны с образованием циклического пептида. 4. Пептид по п.1, где A и B вместе представляют собой линкерный фрагмент, и этот линкерный- 17010586 фрагмент представляет собой C5-C14 моно- или полициклическое кольцо либо кольцевую систему, которая может содержать один или более гетероатом. 5. Пептид по п.4, где линкерный фрагмент представляет собой N-содержащее гетероциклическоеC5-C14 моно- или полициклическое кольцо либо кольцевую систему. 6. Пептид по п.1, где A и B независимо выбраны из группы, содержащей гидроксипролин, аминопролин, тироксин, орнитин, норвалин, норлейцин, -аланин, -аминомасляную кислоту, гомосерин, цитруллин, глицин, аланин, валин, лейцин, изолейцин, метионин, пролин, фенилаланин, тирозин, триптофан, серин, треонин, цистеин, глутамин, аспарагин, гистидин, лизин, аргинин, глутаминовую кислоту и аспарагиновую кислоту, где включены L- или D-формы каждой аминокислоты. 7. Пептид по п.6, где A представляет собой 4-аминопролин. 8. Пептид по п.6 или 7, где B представляет собой D-пролин. 9. Пептид по любому из пп.1, 6-8, где антигенный пептид формулы (I) представляет собой цикло(цис-4-амино-Pro-Asp-Ala-Glu-Phe-Arg-His-Asp-Ser-Gly-Tyr-Glu-Val-His-His-Gln-Lys-D-Pro). 10. Пептид по любому из пп.1-9, где антигенный пептид формулы (I), предпочтительно по меньшей мере один из A и B, дополнительно модифицирован липидом. 11. Пептид по п.10, где липид представляет собой фосфолипид, предпочтительно присоединенный кA или B через линкерную молекулу. 12. Пептид по п.11, где линкер представляет собой дикарбоновую кислоту, имеющую от 3 до 10 атомов углерода, предпочтительно янтарную кислоту. 13. Пептид по любому из пп.10-12, где липид представляет собой фосфатидилэтаноламин. 14. Пептид по п.13, где липид представляет собой 1,3-дипальмитоил-глицеро-2-фосфоэтаноламин, и линкерная молекула представляет собой янтарную кислоту. 15. Пептид по п.14, где антигенный пептид представляет собой цикло(цис-4-амино-Pro(сукцинил(1,3-дипальмитоилглицеро-2-фосфоэтаноламино-Asp-Ala-Glu-Phe-Arg-His-Asp-Ser-Gly-Tyr-Glu-ValHis-His-Gln-Lys-D-Pro). 16. Применение по меньшей мере одного антигенного пептида по любому из пп.1-15 для изготовления фармацевтической композиции для вакцинации индивидуума против заболеваний, обусловленных амилоидами. 17. Применение по меньшей мере одного антигенного пептида по любому из пп.1-15 для изготовления фармацевтической композиции для лечения индивидуума, пораженного заболеваниями, обусловленными амилоидами. 18. Применение по меньшей мере одного антигенного пептида по любому из пп.1-15 для изготовления фармацевтической композиции для диагностики заболевания, обусловленного амилоидами. 19. Иммуногенная композиция, содержащая по меньшей мере один антигенный пептид формулы(I), охарактеризованный в любом из пп.1-15. 20. Композиция по п.19, дополнительно содержащая носитель для доставки антигена, выбранный из группы, состоящей из микрочастиц, включая микросферы и наносферы, полимеров, теней бактерий, бактериальных полисахаридов, полипептидов, белков, аттенуированных бактерий, вирусоподобных частиц,аттенуированных вирусов, иммуностимулирующих комплексов (ISCOM), липосом или виросом (IRIV). 21. Композиция по п.20, где антиген присоединен к носителю для доставки или включен в него. 22. Композиция по п.20, где носитель для доставки антигена представляет собой виросому, липосому, вирусоподобную частицу, аттенуированный вирус или иммуностимулирующий комплекс (ISCOM), а антигенный пептид присоединен к поверхности через липидную группу. 23. Композиция по любому из пп.19-22, дополнительно содержащая адъювант или систему адъювантов. 24. Способ получения пептида формулы (I), включающий следующие стадии:(а) последовательный синтез линейного пептида и(б) циклизация линейного пептида с получением пептида формулы (I). 25. Способ по п.24, дополнительно включающий стадию модификации пептида формулы (I) липидной группой. 26. Способ получения антитела против иммуногенных пептидов формулы (I), включающий следующие стадии:(а) иммунизация организма иммуногенной композицией, содержащей по меньшей мере один из антигенных пептидов формулы (I);(б) выделение антител, образованных посредством заражения на стадии (а); и(в) скрининг антител, полученных на стадии (б), на их специфичное распознавание фрагментов Aпептида или его вариантов.
МПК / Метки
МПК: C07K 7/64, G01N 33/68, C07K 14/47
Метки: пептида, beta;-амилоидного, композиции, содержащие, пептиды, циклические, иммуногенные, полученные
Код ссылки
<a href="https://eas.patents.su/21-10586-immunogennye-kompozicii-soderzhashhie-ciklicheskie-peptidy-poluchennye-iz-beta-amiloidnogo-peptida.html" rel="bookmark" title="База патентов Евразийского Союза">Иммуногенные композиции, содержащие циклические пептиды, полученные из бета-амилоидного пептида</a>
Предыдущий патент: Цитотоксические депсипептиды
Следующий патент: Диспергируемая во рту фармацевтическая композиция и способ ее получения
Случайный патент: Способ получения легких олефинов переработкой диметилового эфира и устройство для его осуществления












