Замещённые производные 8`-пири(ми) динилдигидроспиро [циклоалкиламин] пиримидо [1,2-а] пиримидин-6-она
Номер патента: 10419
Опубликовано: 29.08.2008
Авторы: Шерез Натали, Локхед Алистер, Саади Мурад, Иэш Филипп, Словински Франк
Формула / Реферат
1. Производное дигидроспиро[циклоалкиламин]пиримидона формулы (I), или его соль, или его сольват, или его гидрат
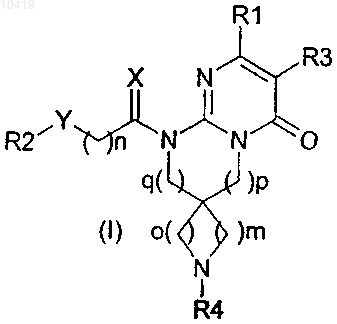
где X представляет собой два атома водорода;
Y представляет собой карбонильную группу или метиленовую группу, необязательно замещенную гидроксильной группой;
R1 представляет собой 2-, 3- или 4-пиридиновое кольцо или 2-, 4- или 5-пиримидиновое кольцо;
R2 представляет собой бензольное кольцо;
R3 представляет собой атом водорода;
R4 представляет собой атом водорода, C1-4 алкоксикарбонильную группу, С3-6 циклоалкилкарбонильную группу, бензоильную группу, C1-6 алкильную группу, группы необязательно замещены 1-4 заместителями, выбранными из атома галогена, гидроксильной группы или C1-4 алкоксигруппы;
о и m принимают значения от 1 до 2;
n принимает значения от 0 до 3;
р принимает значения от 0 до 2 и
q принимает значения от 0 до 2.
2. Производное дигидроспиро[циклоалкиламин]пиримидона, или его соль, или его сольват, или его гидрат по п.1, где R4 представляет собой атом водорода, C1-4 алкоксикарбонильную группу, C1-6 алкильную группу, необязательно замещенную 1-4 заместителями, выбранными из атома галогена, гидроксильной группы или C1-4 алкоксигруппы.
3. Производное дигидроспиро[циклоалкиламин]пиримидона, или его соль, или его сольват, или его гидрат по п.1 или 2, где R1 представляет собой незамещенную 4-пиридинильную группу или незамещенную 4-пиримидинильную группу.
4. Производное дигидроспиро[циклоалкиламин]пиримидона, или его соль, или его сольват, или его гидрат по п.3,
где R2 представляет собой бензольное кольцо;
R3 представляет собой атом водорода;
R4 представляет собой C1-4 алкоксикарбонильную группу, C3-6 циклоалкилкарбонильную группу, бензоильную группу или С1-3 алкильную группу, необязательно замещенную 1-4 заместителями, выбранными из атома галогена или гидроксильной группы;
X представляет собой два атома водорода;
Y представляет собой карбонильную группу или метиленовую группу, необязательно замещенную гидроксильной группой;
р принимает значение 2 и
q принимает значение 0.
5. Производное дигидроспиро[циклоалкиламин]пиримидона, которое выбирают из группы, включающей
этил-1'-[(2S)-2-гидрокси-2-фенилэтил]-6'-оксо-8'-(пиридин-4-ил)-1',3',4',6'-тетрагидро-1Н-спиро[пиперидин-4,2'-пиримидо[1,2-а]пиримидин]-1-карбоксилат,
этил-6'-оксо-1'-[2-оксо-2-фенилэтил]-8'-(пиридин-4-ил)-1',3',4',6'-тетрагидро-1Н-спиро[пиперидин-4,2'-пиримидо[1,2-а]пиримидин]-1-карбоксилат,
1'-[(2S)-2-гидрокси-2-фенилэтил]-1-метил-8'-(пиридин-4-ил)-3',4'-дигидроспиро[пиперидин-4,2'-пиримидо[1,2-а]пиримидин]-6'(1'Н)-он,
1-метил-1'-(2-оксо-2-фенилэтил)-8'-(пиридин-4-ил)-3',4'-дигидроспиро[пиперидин-4,2'-пиримидо[1,2-а]пиримидин]-6'(1'Н)-он,
этил-1'-[(2S)-2-гидрокси-2-фенилэтил]-6'-оксо-8'-(пиримидин-4-ил)-1',3',4',6'-тетрагидро-1Н-спиро[пиперидин-4,2'-пиримидо[1,2-а]пиримидин]-1-карбоксилат,
этил-6'-оксо-1'-[2-оксо-2-фенилэтил]-8'-(пиримидин-4-ил)-1',3',4',6'-тетрагидро-1Н-спиро[пиперидин-4,2'-пиримидо[1,2-а]пиримидин]-1-карбоксилат,
1'-[(2S)-2-гидрокси-2-фенилэтил]-1-метил-8'-(пиримидин-4-ил)-3',4'-дигидроспиро[пиперидин-4,2'-пиримидо[1,2-а]пиримидин]-6'(1'Н)-он,
1-(циклогексилкарбонил)-1'-[(2S)-2-гидрокси-2-фенилэтил]-8'-пиридин-4-ил-3',4'-дигидроспиро [пиперидин-4,2'-пиримидо[1,2-а]пиримидин]-6'(1'Н)-он,
1-(циклогексилкарбонил)-1'-(2-оксо-2-фенилэтил)-8'-пиридин-4-ил-3',4'-дигидроспиро[пиперидин-4,2'-пиримидо[1,2-а]пиримидин]-6'(1'Н)-он,
1-(3-фторбензоил)-1'-[(2S)-2-гидрокси-2-фенилэтил]-8'-пиридин-4-ил-3',4'-дигидроспиро[пиперидин-4,2'-пиримидо[1,2-а]пиримидин]-6'(1'Н)-он,
1-(3-фторбензоил)-1'-(2-оксо-2-фенилэтил)-8'-пиридин-4-ил-3',4'-дигидроспиро[пиперидин-4,2'-пиримидо[1,2-а]пиримидин]-6'(1'Н)-он,
1-(циклобутилкарбонил)-1'-[(2S)-2-гидрокси-2-фенилэтил]-8'-пиридин-4-ил-3',4'-дигидроспиро[пиперидин-4,2'-пиримидо[1,2-а]пиримидин]-6'(1'Н)-он,
1-(циклобутилкарбонил)-1'-(2-оксо-2-фенилэтил]-8'-пиридин-4-ил-3',4'-дигидроспиро[пиперидин-4,2'-пиримидо[1,2-а]пиримидин]-6'(1'Н)-он,
1-(циклопропилкарбонил)-1'-[(2S)-2-гидрокси-2-фенилэтил]-8'-пиридин-4-ил-3',4'-дигидроспиро [пиперидин-4,2'-пиримидо[1,2-а]пиримидин]-6'(1'Н)-он,
1-(циклопропилкарбонил)-1'-(2-оксо-2-фенилэтил)-8'-пиридин-4-ил-3',4'-дигидроспиро[пиперидин-4,2'-пиримидо[1,2-а]пиримидин]-6'(1'Н)-он,
1-метил-1'-(2-оксо-2-фенилэтил)-8'-(пиримидин-4-ил)-3',4'-дигидроспиро[пиперидин-4,2'-пиримидо [1,2-а]пиримидин]-6'(1'Н)-он,
этил-1-[(2S)-2-гидрокси-2-фенилэтил]-6-оксо-8-(пиридин-4-ил)-1,3,4,6-тетрагидро-1'Н-спиро[пиримидо[1,2-а]пиримидин-2,3'-пирролидин]-1'-карбоксилат,
этил-6-оксо-1-(2-оксо-2-фенилэтил)-8-(пиридин-4-ил)-1,3,4,6-тетрагидро-1'Н-спиро[пиримидо[1,2-а]пиримидин-2,3'-пирролидин]-1'-карбоксилат,
1-[(2S)-2-гидрокси-2-фенилэтил]-1'-метил-8-(пиридин-4-ил)-3,4-дигидроспиро[пиримидо[1,2-а]пиримидин-2,3'-пирролидин]-6(1Н)-он,
1'-метил-1-(2-оксо-2-фенилэтил)-8-(пиридин-4-ил)-3,4-дигидроспиро[пиримидо[1,2-а]пиримидин-2,3'-пирролидин]-6(1Н)-он,
этил-1-[(2S)-2-гидрокси-2-фенилэтил]-6-оксо-8-пиримидин-4-ил-1,3,4,6-тетрагидро-1'Н-спиро[пиримидо[1,2-а]пиримидин-2,3'-пирролидин]-1'-карбоксилат,
этил-6-оксо-1-(2-оксо-2-фенилэтил)-8-пиримидин-4-ил-1,3,4,6-тетрагидро-1'Н-спиро[пиримидо[1,2-а]пиримидин-2,3'-пирролидин]-1'-карбоксилат,
1'-(3-фторбензоил)-1-[(2S)-2-гидрокси-2-фенилэтил]-8-пиримидин-4-ил-3,4-дигидроспиро[пиримидо[1,2-а]пиримидин-2,3'-пирролидин]-6(1Н)-он,
1'-(3-фторбензоил)-1-(2-оксо-2-фенилэтил)-8-пиримидин-4-ил-3,4-дигидроспиро[пиримидо[1,2-а]пиримидин-2,3'-пирролидин]-6(1Н)-он,
1'-(3-фторбензоил)-1-[(2S)-2-гидрокси-2-фенилэтил]-8-пиридин-4-ил-3,4-дигидроспиро[пиримидо[1,2-а]пиримидин-2,3'-пирролидин]-6(1Н)-он,
1'-(3-фторбензоил)-1-(2-оксо-2-фенилэтил)-8-пиридин-4-ил-3,4-дигидроспиро[пиримидо[1,2-а]пиримидин-2,3'-пирролидин]-6(1Н)-он,
1'-(циклопропилкарбонил)-1-[(2S)-2-гидрокси-2-фенилэтил]-8-пиридин-4-ил-3,4-дигидроспиро[пиримидо[1,2-а]пиримидин-2,3'-пирролидин]-6(1Н)-он,
1'-(циклопропилкарбонил)-1-(2-оксо-2-фенилэтил)-8-пиридин-4-ил-3,4-дигидроспиро[пиримидо[1,2-а]пиримидин-2,3'-пирролидин]-6(1Н)-он,
1'-(циклопропилкарбонил)-1-[(2S)-2-гидрокси-2-фенилэтил]-8-пиримидин-4-ил-3,4-дигидроспиро [пиримидо[1,2-а]пиримидин-2,3'-пирролидин]-6(1Н)-он,
1'-(циклопропилкарбонил)-1-(2-оксо-2-фенилэтил)-8-пиримидин-4-ил-3,4-дигидроспиро[пиримидо[1,2-а]пиримидин-2,3'-пирролидин]-6(1Н)-он,
1'-(циклобутилкарбонил)-1-[(2S)-2-гидрокси-2-фенилэтил]-3-пиримидин-4-ил-3,4-дигидроспиро [пиримидо[1,2-а]пиримидин-2,3'-пирролидин]-6(1Н)-он,
1'-(циклобутилкарбонил)-1-(2-оксо-2-фенилэтил)-8-пиримидин-4-ил-3,4-дигидроспиро[пиримидо [1,2-а]пиримидин-2,3'-пирролидин]-6(1Н)-он,
1'-(циклобутилкарбонил)-1-[(2S)-2-гидрокси-2-фенилэтил]-3-пиридин-4-ил-3,4-дигидроспиро[пиримидо[1,2-а]пиримидин-2,3'-пирролидин]-6(1Н)-он,
1'-(циклобутилкарбонил)-1-(2-оксо-2-фенилэтил)-8-пиридин-4-ил-3,4-дигидроспиро[пиримидо[1,2-а]пиримидин-2,3'-пирролидин]-6(1Н)-он,
1'-(циклогексилкарбонил)-1-[(2S)-2-гидрокси-2-фенилэтил]-8-пиридин-4-ил-3,4-дигидроспиро[пиримидо[1,2-а]пиримидин-2,3'-пирролидин]-6(1Н)-он,
1'-(циклогексилкарбонил)-1-(2-оксо-2-фенилэтил)-8-пиридин-4-ил-3,4-дигидроспиро[пиримидо[1,2-а]пиримидин-2,3-пирролидин]-6(1Н)-он,
1'-(циклогексилкарбонил)-1-[(2S)-2-гидрокси-2-фенилэтил]-8-пиримидин-4-ил-3,4-[пиримидо[1,2-а]пиримидин-2,3-пирролидин]-6(1Н)-он,
1'-(циклогексилкарбонил)-1-(2-оксо-2-фенилэтил)-8-пиримидин-4-ил-3,4-дигидроспиро[пиримидо [1,2-а]пиримидин-2,3'-пирролидин]-6(1Н)-он,
или их соль, или их сольват, или их гидрат.
6. Соединение формулы (III)
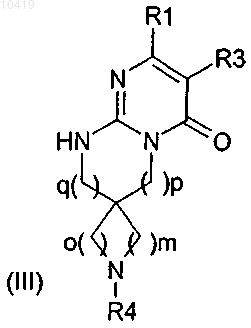
где R1, R3, R4, m, o, q и р определяют так же, как в соединении формулы (I) по п.1.
7. Лекарственный препарат, включающий в качестве активного ингредиента вещество, выбранное из группы, состоящей из производного дигидроспиро[циклоалкиламин]пиримидона формулы (I) по п.1, или его соли, или его сольвата, или его гидрата.
8. Ингибитор GSK3b, выбранный из группы, состоящей из производного дигидроспиро[циклоалкиламин]пиримидона формулы (I) по п.1, или его соли, или его сольвата, или его гидрата.
9. Применение соединения, представленного в пп.1-4, для получения лекарственного препарата для профилактики и/или терапевтического лечения болезни, вызванной аномальной активностью GSK3b.
10. Применение соединения, представленного в пп.1-4, для получения лекарственного препарата для профилактики и/или терапевтического лечения нейродегенеративного заболевания.
11. Применение соединения по п.10, где нейродегенеративное заболевание выбирают из группы, состоящей из болезни Альцгеймера, болезни Паркинсона, тауопатий, васкулярной деменции, апоплексического удара, травматических повреждений, инсультов, травмы головного мозга и травмы спинного мозга, периферических невропатий, ретинопатий и глаукомы.
12. Применение соединения, представленного в пп.1-4, для получения лекарственного препарата для профилактики и/или терапевтического лечения инсулиннезависимых диабетов, ожирения, маниакально-депрессивного психоза, шизофрении, облысения или раковых заболеваний.
13. Применение по п.12, где раковое заболевание представляет собой рак молочной железы, немелкоклеточный рак легкого, рак щитовидной железы, лейкоз Т- или В-клеток или различные новообразования, вызванные вирусами.
Текст
010419 Область техники Настоящее изобретение относится к соединениям, которые пригодны для использования в качестве активного ингредиента лекарственного препарата для профилактики и/или терапевтического лечения нейродегенеративных заболеваний, вызываемых аномальной активностью GSK3. Уровень техникиGSK3 (гликогенсинтазакиназа 3) представляет собой пролин-управляемый серин, треонинкиназу,которая играет важную роль в регуляции метаболизма, дифференцировки и выживаемости. Первоначально ее идентифицировали как фермент, способный фосфорилировать и, следовательно, ингибировать гликогенсинтазу. Позже было обнаружено, что GSK3 идентична таупротеинкиназе 1 (ТРК 1), ферменту,который фосфорилирует таубелок в эпитопах, которые, как было обнаружено, также гиперфосфолирированы при болезни Альцгеймера и при различных таупатиях. Интересно, что фосфорилирование протеинкиназы В (АКТ) GSK3 приводит к потере ее киназной активности; было предположено, что такое ингибирование может опосредовать некоторые проявления нейротрофических факторов. Более того, фосфорилирование -катенина, белка, участвующего в выживании клеток, с помощью GSK3, приводит к его деградации по зависимому от убиквитинирования протеасомному пути. Таким образом, оказалось, что ингибирование активности GSK3 может привести к нейротрофической активности. Действительно, вполне очевидно, что литий, неконкурентноспособный ингибиторGSK3, усиливает нейритогенез в некоторых моделях и также увеличивает выживаемость нейронов посредством индуцирования факторов выживания, таких как Bcl-2, и ингибирования экспрессии проапоптических факторов, таких как Р 53 и Вах. Последние исследования показали, что -амилоид увеличивает активность GSK3 и фосфорилирование таубелка. Более того, хлорид лития и антисенсорная мРНКGSK3 блокируют это гиперфосфорилирование, так же как нейротоксичные эффекты -амилоида. Эти исследования убедительно предполагают, что GSK3 может служить связью между двумя основными патологическими процессами при болезни Альцгеймера: аномальным процессингом АРР (белок предшественник амилоида) и гиперфосфорилированием таубелка. Хотя таугиперфосфорилирование приводит к дестабилизации клеточного скелета нейронов, патологические последствия аномальной активности GSK3, наиболее вероятно, происходят не только вследствие патологического фосфорилирования таубелка, потому что, как указывали выше, избыточная активность этой киназы может воздействовать на выживаемость посредством изменения экспрессии апоптических и антиапоптических факторов. Более того, было показано, что вызванное -амилоидом повышение активности GSK3 приводит к фосфорилированию и, следовательно, ингибированию пируватдегидрогеназы, основного фермента выработки энергии и синтеза ацетилхолина. В целом, эти экспериментальные наблюдения показывают, что GSK3 могут найти применение при лечении нарушения внимания и познавательной способности и нейропатологических последствий болезни Альцгеймера, так же как других острых и хронических нейродегенеративных заболеваний. Эти заболевания включают, кроме прочих, болезнь Паркинсона, тауопатии (например, лобно-височно-теменную деменцию, кортикобазальную дегенерацию, болезнь Пика, прогрессирующий супрануклеарный паралич) и другие деменции, включающие васкулярную деменцию, апоплексический удар и другие травматические повреждения, инсульты (например, возрастную дегенерацию желтого пятна), травму головного мозга и травму спинного мозга, периферические невропатии, ретинопатии и глаукому. В дополнение, GSK3 могут найти применение при лечении других болезней, таких как инсулиннезависимые диабеты (такие как диабеты типа II) и ожирение; маниакально-депрессивный психоз; шизофрения; облысение; раковые заболевания, такие как рак молочной железы, немелкоклеточный рак легкого,рак щитовидной железы, лейкоз Т- или В-клеток и различные новообразования, вызываемые вирусами. Раскрытие изобретения Задача настоящего изобретения состоит в разработке соединений, пригодных в качестве активного ингредиента лекарственного препарата для профилактики и/или терапевтического лечения болезни, вызванной аномальной активностью GSK3, более конкретно, нейродегенеративных болезней. Точнее говоря, задача состоит в разработке новых соединений, пригодных в качестве активного ингредиента лекарственного препарата, предназначенного для профилактики и/или лечения нейродегенеративных болезней, таких как болезнь Альцгеймера. Таким образом, авторы настоящего изобретения идентифицировали соединения, обладающие ингибирующей активностью по отношению к GSK3. В результате, они обнаружили, что соединения, представляемые нижеследующей формулой (I), обладают требуемой активностью и являются пригодными в качестве активного ингредиента лекарственного препарата для профилактики и/или терапевтического лечения вышеуказанных болезней. Настоящее изобретение, поэтому, предлагает производные дигидроспиро[циклоалкиламин]пиримидона, представленные формулой (I), или их соли, их сольваты или их гидратыY представляет собой карбонильную группу или метиленовую группу, необязательно замещенную гидроксильной группой;R2 представляет собой бензольное кольцо;R3 представляет собой атом водорода;R4 представляет собой атом водорода, C1-4 алкоксикарбонильную группу, C3-6 циклоалкилкарбонильную группу, бензоильную группу, C1-6 алкильную группу, группы необязательно замещены 1-4 заместителями, выбранными из атома галогена, гидроксильной группы или C1-4 алкоксигруппы; о и m принимают значения от 1 до 2;n принимает значения от 0 до 3; р принимает значения от 0 до 2 иq принимает значения от 0 до 2. Еще один объект изобретения представляют производные дигидроспиро[циклоалкиламин]пиримидона, представляемые формулой (I), или их соли, их сольваты или их гидраты, где X, Y, R1, R2,R3, о, n, p, q определены выше, a R4 представляет собой атом водорода, C1-4 алкоксикарбонильную группу, C1-6 алкильную группу, необязательно замещенную 1-4 заместителями, выбранными из атома галогена, гидроксильной группы или C1-4 алкоксигруппы. В соответствии с еще одним аспектом настоящего изобретения предложен лекарственный препарат,содержащий в качестве активного ингредиента вещество, выбранное из группы, состоящей из производных пиримидона, представляемых формулой (I), и их физиологически приемлемых солей, их сольватов и их гидратов. Вышеуказанный лекарственный препарат используют при профилактике и/или терапевтическом лечении болезней, вызванных аномальной активностью GSK3, и вышеуказанный лекарственный препарат, который используют при профилактике и/или терапевтическом лечении нейродегенеративных болезней и, дополнительно, других болезней, таких как инсулиннезависимые диабеты (такие как диабетыII типа) и ожирение, маниакально-депрессивный психоз, шизофрения, облысение, раковые заболевания,такие как рак молочной железы, немелкоклеточный рак легкого, рак щитовидной железы, Т- или Вклеточный лейкоз и различные новообразования, индуцированные вирусами. Вышеуказанный лекарственный препарат используют для лечения болезней, представляющих собой нейродегенеративные болезни, которые выбирают из группы, состоящей из болезни Альцгеймера,болезни Паркинсона, тауопатий (например, лобно-височно-теменной деменции, кортикобазальной дегенерации, болезни Пика, прогрессирующего супрануклеарного паралича) и других деменций, включающих васкулярную деменцию, апоплексический удар и другие травматические повреждения, инсульты(например, возрастную дегенерацию желтого пятна), травму головного мозга и травму спинного мозга,периферические невропатии, ретинопатии и глаукому; и вышеуказанный лекарственный препарат представлен в виде фармацевтической композиции, содержащей в качестве активного ингредиента приведенное выше вещество вместе с одной или несколькими фармацевтическими добавками. Настоящее изобретение дополнительно предлагает ингибитор активности GSK3, содержащий в качестве активного ингредиента вещество, выбраное из группы, состоящей из производных дигидроспиро[циклоалкиламин]пиримидона формулы (I) и их солей, их сольватов и их гидратов. Предложенные соединения могут быть использованы в способе профилактики и/или терапевтического лечения нейродегенеративных болезней, вызываемых аномальный активностью GSK3, который включает в себя этап введения пациенту профилактически и/или терапевтически эффективного количества вещества, выбранного из группы, состоящей из производных дигидроспиро[циклоалкиламин]пиримидона формулы (I) и их физиологически приемлемых солей, сольватов и гидратов; и применение вещества, выбранного из группы, состоящей из производных дигидроспиро[циклоалкиламин]пиримидона формулы (I) и их физиологически приемлемых солей, сольватов и гидратов для получения вышеуказанного лекарственного препарата. Используемая в данном описании C1-6 алкильная группа представляет собой неразветвленную или разветвленную алкильную группу, имеющую 1-6 атомов углерода, например метильную группу, этильную группу, н-пропильную группу, изопропильную группу, н-бутильную группу, изобутильную группу,-2 010419 втор-бутильную группу, трет-бутильную группу, н-пентильную группу, изопентильную группу, неопентильную группу, 1,1-диметилпропильную группу, н-гексильную группу, изогексильную группу и т.п.; С 3-6 циклоалкильная группа представляет собой циклическую алкильную группу, имеющую 3-6 атомов углерода, например циклопропильную группу, циклобутильную группу, циклопентильную группу, циклогексильную группу и т.п.;C1-4 алкоксигруппа представляет собой алкилоксигруппу, имеющую 1-4 атомов углерода, например метоксигруппу, этоксигруппу, пропоксигруппу, изопропоксигруппу, бутоксигруппу, изобутоксигруппу,втор-бутоксигруппу, трет-бутоксигруппу и т.п.; атом галогена представляет собой атом фтора, хлора, брома или йода;C1-2 пергалогенированная алкильная группа представляет собой алкильную группу, в которой все атомы водорода замещены галогеном, например CF3 или C2F5; С 1-3 галогенированная алкильная группа представляет собой алкильную группу, в которой по крайней мере один атом водорода не замещен атомом галогена; С 1-5 моноалкиламиногруппа представляет собой аминогруппу, замещенную одной С 1-5 алкильной группой, например метиламиногруппу, этиламиногруппу, пропиламиногруппу, изопропиламиногруппу,бутиламиногруппу, изобутиламиногруппу, трет-бутиламиногруппу, пентиламиногруппу и изопентиламиногруппу; С 2-10 диалкиламиногруппа представляет собой аминогруппу, замещенную двумя С 1-5 алкильными группами, например диметиламиногруппу, этилметиламиногруппу, диэтиламиногруппу, метилпропиламиногруппу и диизопропиламиногруппу; уходящая группа L представляет собой группу, которая может быть легко удалена и замещена, например такой группой может быть тозил, мезил, бромид и т.п. Соединения, представляемые вышеуказанной формулой (I), могут образовывать соль. Примеры соли, при наличии кислотной группы, включают в себя соли щелочных металлов и щелочно-земельных металлов, таких как литий, натрий, калий, магний и кальций; соли аммиака и аминов, таких как метиламин, диметиламин, триметиламин, дициклогексиламин, трис(гидроксиметил)аминометан, N,Nбис(гидроксиэтил)пиперазин, 2-амино-2-метил-1-пропанол, этаноламин, N-метилглюкамин и Lглюкамин или соли аминокислот, обладающих сильными основными свойствами, таких как лизин, 5 гидроксилизин и аргинин. Основно-аддитивные соли кислотных соединений получают по стандартным методикам, хорошо известным в данной области. При наличии основной группы примеры включают в себя соли минеральных кислот, таких как хлористо-водородная кислота, бромисто-водородная кислота, серная кислота, азотная кислота, фосфорная кислота; соли органических кислот, таких как метансульфоновая кислота, бензолсульфоновая кислота, птолуолсульфокислота, уксусная кислота, пропионовая кислота, винная кислота, фумаровая кислота, малеиновая кислота, яблочная кислота, щавелевая кислота, янтарная кислота, лимонная кислота, бензойная кислота, миндальная кислота, коричная кислота, молочная кислота, гликолевая кислота, глюкуроновая кислота, аскорбиновая кислота, никотиновая кислота и салициловая кислота; или соли аминокислот, обладающих выраженными кислотными свойствами, таких как аспарагиновая кислота и глутаминовая кислота. Кислотно-аддитивные соли основных соединений получают по стандартным методикам, хорошо известным в данной области, которые включают в себя, но не ограничены ими, растворение свободного основания в водном растворе спирта, содержащем соответствующую кислоту, и выделение соли посредством упаривания раствора или взаимодействием свободного основания и кислоты в органическом растворителе; в этом случае соль сразу отделяют или ее осаждают вторым органическим растворителем, или ее можно получить концентрированием раствора. Кислоты, которые можно использовать при получении кислотно-аддитивных солей, предпочтительно включают в себя такие кислоты, которые при соединении со свободным основанием образуют фармацевтически приемлемые соли, т.е. соли, анионы которых в фармацевтических дозах соли являются относительно безвредными для организма животных; так что благоприятные качества, свойственные свободному основанию, не невилируются побочными эффектами, обусловленными анионами. Хотя предпочтительными являются медицински приемлемые соли основных соединений, все кислотно-аддитивные соли включены в объем настоящего изобретения. В дополнение к производным дигидроспиро[циклоалкиламин]пиримидона, представленным вышеуказанной формулой (I), их соли, их сольваты и их гидраты также включены в объем настоящего изобретения. Производные дигидроспиро[циклоалкиламин]пиримидона, представленные вышеуказанной формулой (I), могут иметь один или несколько асимметричных атомов углерода. В соответствии со стереохимией таких асимметричных атомов углерода, они могут независимо находиться или в (R), или в (S) конфигурации; и производное может существовать в форме таких стереоизомеров, как оптические изомеры или диастереоизомеры. Любые стереоизомеры в чистом виде, любые смеси стереоизомеров, рацематы и т.п. включены в объем настоящего изобретения. Примеры предпочтительных соединений по настоящему изобретению показаны в табл. 1, приведенной ниже в настоящем описании. Однако объем настоящего изобретения не ограничен этими соеди-3 010419 нениями. Предпочтительные соединения по настоящему изобретению, представляемые формулой (I), включают в себя также соединения, где:(1) R1 представляет собой 3- или 4-пиридиновое кольцо и более предпочтительно 4-пиридиновое кольцо или 4- или 5-пиримидиновое кольцо и более предпочтительно 4-пиридиновое кольцо, которое может быть замещено С 1-2 алкильной группой, C1-2 алкоксигруппой или атомом галогена; и/или(2) R2 представляет собой бензольное кольцо или нафталиновую циклическую систему, где кольцо необязательно замещено 1-4 заместителями, выбранными из С 1-3 алкильной группы, атома галогена, гидроксильной группы или С 1-2 алкоксигруппы; и/или(3) R3 представляет собой атом водорода, С 1-3 алкильную группу или атом галогена, более предпочтительно, атом водорода; и/или(4) R4 представляет собой атом водорода, C1-4 алкоксикарбонильную группу, C3-6 циклоалкилкарбонильную группу, бензоильную группу, С 1-3 алкильную группу; группы необязательно замещены 1-4 заместителями, выбранными из атома галогена, гидроксильной группы или C1-4 алкоксигруппы; и/или(5) Y представляет собой карбонильную группу или метиленовую группу, необязательно замещенную одной или двумя группами, выбранными из С 1-3 алкильной группы, гидроксильной группы, С 1-4 алкоксигруппы и С 1-2 пергалогенированной алкильной группы, аминогруппы; и, более конкретно, где R1,R2, R3, R4 и Y определены, как указано выше в данном описании. Более предпочтительные соединения по настоящему изобретению, представляемые формулой (I),включают в себя также соединения, где:(1) R1 представляет собой незамещенный 4-пиридиновое кольцо или 4-пиримидиновое кольцо; и/или(2) R2 представляет собой бензольное кольцо, где кольцо необязательно замещено 1-4 заместителями, выбранными из С 1-3 алкильной группы, атома галогена, гидроксильной группы или С 1-2 алкоксигруппы; и/или(3) R3 представляет собой атом водорода; и/или(4) R4 представляет собой С 1-4 алкоксикарбонильную группу, С 3-6 циклоалкилкарбонильную группу, бензоильную группу или С 1-3 алкильную группу, необязательно замещенную 1-4 заместителями, выбранными из атома галогена или гидроксильной группы; и/или(5) X представляет собой два атома водорода; и/или(6) Y представляет собой карбонильную группу или метиленовую группу, необязательно замещенную гидроксильной группой; и/или(7) р принимает значение 2, и q принимает значение 0; и, более конкретно, где R1, R2, R3, X, Y, p, q,m, о и n являются такими, как определено выше. В частности, предпочтительные соединения по настоящему изобретению, представленные формулой (I), где R1 является пиридиновым кольцом или пиримидиновым кольцом, включают соединения,приведенные в табл. 1 1. этил-1'-[(2S)-2-гидрокси-2-фенилэтил]-6'-оксо-8'-(пиридин-4-ил)-1',3',4',6'-тетрагидро-1 Н-спиро[пиперидин-4,2'-пиримидо[1,2-а]пиримидин]-1-карбоксилат,2. этил-6'-оксо-1'-[2-оксо-2-фенилэтил]-8'-(пиридин-4-ил)-1',3',4',6'-тетрагидро-1 Н-спиро[пиперидин-4,2'-пиримидо[1,2-а]пиримидин]-1-карбоксилат,3. 1'-[(2S)-2-гидрокси-2-фенилэтил]-1-метил-8'-(пиридин-4-ил)-3',4'-дигидроспиро[пиперидин-4,2'пиримидо[1,2-а]пиримидин]-6'(1'Н)-он,4. 1-метил-1'-(2-оксо-2-фенилэтил)-8'-(пиридин-4-ил)-3',4'-дигидроспиро[пиперидин-4,2'-пиримидо[1,2-а]пиримидин]-6'(1'Н)-он,5. этил-1'-[(2S)-2-гидрокси-2-фенилэтил]-6'-оксо-8'-(пиримидин-4-ил)-1',3',4',6'-тетрагидро-1 Н-спиро[пиперидин-4,2'-пиримидо[1,2-а]пиримидин]-1-карбоксилат,6. этил-6'-оксо-1'-[2-оксо-2-фенилэтил]-8'-(пиримидин-4-ил)-1',3',4',6'-тетрагидро-1 Н-спиро[пиперидин-4,2-пиримидо[1,2-а]пиримидин]-1-карбоксилат,7. 1'-[(2S)-2-гидрокси-2-фенилэтил]-1-метил-8'-(пиримидин-4-ил)-3',4'-дигидроспиро[пиперидин 4,2'-пиримидо[1,2-а]пиримидин]-6'(1'Н)-он,8. 1-(циклогексилкарбонил)-1'-[(2S)-2-гидрокси-2-фенилэтил]-8'-(пиридин-4-ил)-3',4'-дигидроспиро[пиперидин-4,2'-пиримидо[1,2-а]пиримидин]-6'(1'Н)-он,9. 1-(циклогексилкарбонил)-1'-(2-оксо-2-фенилэтил)-8'-пиридин-4-ил-3',4'-дигидроспиро[пиперидин-4,2'-пиримидо[1,2-а]пиримидин]-6'(1'Н)-он,10. 1-(3-фторбензоил)-1'-[(2S)-2-гидрокси-2-фенилэтил]-8'-пиридин-4-ил-3',4'-дигидроспиро[пиперидин-4,2'-пиримидо[1,2-а]пиримидин]-6'(1'Н)-он,11. 1-(3-фторбензоил)-1'-(2-оксо-2-фенилэтил)-8'-пиридин-4-ил-3',4'-дигидроспиро[пиперидин-4,2'пиримидо[1,2-а]пиримидин]-6'(1'Н)-он,12. 1-(циклобутилкарбонил)-1'-[(2S)-2-гидрокси-2-фенилэтил]-8'-пиридин-4-ил-3',4'-дигидроспиро[пиперидин-4,2'-пиримидо[1,2-а]пиримидин]-6'(1'Н)-он,13. 1-(циклобутилкарбонил)-1'-(2-оксо-2-фенилэтил)-8'-пиридин-4-ил-3',4'-дигидроспиро[пипери-4 010419 дин-4,2'-пиримидо[1,2-а]пиримидин]-6'(1'Н)-он,14. 1-(циклопропилкарбонил)-1'-[(2S)-2-гидрокси-2-фенилэтил]-8'-пиридин-4-ил-3',4'-дигидроспиро[пиперидин-4,2'-пиримидо[1,2-а]пиримидин]-6'(1'Н)-он,15. 1-(циклопропилкарбонил)-1'-(2-оксо-2-фенилэтил)-8'-пиридин-4-ил-3',4'-дигидроспиро[пиперидин-4,2'-пиримидо[1,2-а]пиримидин]-6'(1'Н)-он,16. 1-метил-1'-(2-оксо-2-фенилэтил)-8'-(пиримидин-4-ил)-3',4'-дигидроспиро[пиперидин-4,2'-пиримидо[1,2-а]пиримидин]-6'(1'Н)-он. И соединения табл. 2 1. этил-1-[(2S)-2-гидрокси-2-фенилэтил]-6-оксо-8-(пиридин-4-ил)-1,3,4,6-тетрагидро-1'Н-спиро[пиримидо[1,2-а]пиримидин-2,3'-пирролидин]-1'-карбоксилат,2. этил-6-оксо-1-(2-оксо-2-фенилэтил)-8-(пиридин-4-ил)-1,3,4,6-тетрагидро-1'H-спиро[пиримидо[1,2-а]пиримидин-2,3'-пирролидин]-1'-карбоксилат,3. 1-[(2S)-2-гидрокси-2-фенилэтил]-1'-метил-8-(пиридин-4-ил)-3,4-дигидроспиро[пиримидо[1,2-а]пиримидин-2,3'-пирролидин]-6(1 Н)-он,4. 1'-метил-1-(2-оксо-2-фенилэтил)-8-(пиридин-4-ил)-3,4-дигидроспиро[пиримидо[1,2-а]пиримидин 2,3'-пирролидин]-6(1 Н)-он,5. этил-1-[(2S)-2-гидрокси-2-фенилэтил]-6-оксо-8-пиримидин-4-ил-1,3,4,6-тетрагидро-1'Н-спиро[пиримидо[1,2-а]пиримидин-2,3'-пирролидин]-1'-карбоксилат,6. этил-6-оксо-1-(2-оксо-2-фенилэтил)-8-пиримидин-4-ил-1,3,4,6-тетрагидро-1'Н-спиро[пиримидо[1,2-а]пиримидин-2,3'-пирролидин]-1'-карбоксилат,7. 1'-(3-фторбензоил)-1-[(2S)-2-гидрокси-2-фенилэтил]-8-пиримидин-4-ил-3,4-дигидроспиро[пиримидо[1,2-а]пиримидин-2,3'-пирролидин]-6(1 Н)-он,8. 1'-(3-фторбензоил)-1-(2-оксо-2-фенилэтил)-8-пиримидин-4-ил-3,4-дигидроспиро[пиримидо[1,2 а]пиримидин-2,3'-пирролидин]-6(1 Н)-он,9. 1'-(3-фторбензоил)-1-[(2S)-2-гидрокси-2-фенилэтил]-8-пиридин-4-ил-3,4-дигидроспиро[пиримидо[1,2-а]пиримидин-2,3'-пирролидин]-6(1 Н)-он,10. 1'-(3-фторбензоил)-1-(2-оксо-2-фенилэтил)-8-пиридин-4-ил-3,4-дигидроспиро[пиримидо[1,2-а]пиримидин-2,3'-пирролидин]-6(1 Н)-он,11. 1'-(циклопропилкарбонил)-1-[(2S)-2-гидрокси-2-фенилэтил]-8-пиридин-4-ил-3,4-дигидроспиро[пиримидо[1,2-а]пиримидин-2,3'-пирролидин]-6(1 Н)-он,12. 1'-(циклопропилкарбонил)-1-(2-оксо-2-фенилэтил)-8-пиридин-4-ил-3,4-дигидроспиро[пиримидо[1,2-а]пиримидин-2,3'-пирролидин]-6(1 Н)-он,13. 1'-(циклопропилкарбонил)-1-[(2S)-2-гидрокси-2-фенилэтил]-8-пиримидин-4-ил-3,4-дигидроспиро[пиримидо[1,2-а]пиримидин-2,3'-пирролидин]-6(1 Н)-он,14. 1'-(циклопропилкарбонил)-1-(2-оксо-2-фенилэтил)-8-пиримидин-4-ил-3,4-дигидроспиро[пиримидо[1,2-а]пиримидин-2,3'-пирролидин]-6(1 Н)-он,15. 1'-(циклобутилкарбонил)-1-[(2S)-2-гидрокси-2-фенилэтил]-8-пиримидин-4-ил-3,4-дигидроспиро[пиримидо[1,2-а]пиримидин-2,3'-пирролидин]-6(1 Н)-он,16. 1'-(циклобутилкарбонил)-1-(2-оксо-2-фенилэтил)-8-пиримидин-4-ил-3,4-дигидроспиро[пиримидо[1,2-а]пиримидин-2,3'-пирролидин]-6(1 Н)-он,17. 1'-(циклобутилкарбонил)-1-[(2S)-2-гидрокси-2-фенилэтил]-8-пиридин-4-ил-3,4-дигидроспиро[пиримидо[1,2-а]пиримидин-2,3'-пирролидин]-6(1 Н)-он,18. 1'-(циклобутилкарбонил)-1-(2-оксо-2-фенилэтил)-8-пиридин-4-ил-3,4-дигидроспиро[пиримидо[1,2-а]пиримидин-2,3'-пирролидин]-6(1 Н)-он,19. 1'-(циклогексилкарбонил)-1-[(2S)-2-гидрокси-2-фенилэтил]-8-пиридин-4-ил-3,4-дигидроспиро[пиримидо[1,2-а]пиримидин-2,3'-пирролидин]-6(1 Н)-он,20. 1'-(циклогексилкарбонил)-1-(2-оксо-2-фенилэтил)-8-пиридин-4-ил-3,4-дигидроспиро[пиримидо[1,2-а]пиримидин-2,3'-пирролидин]-6(1 Н)-он,21. 1'-(циклогексилкарбонил)-1-[(2S)-2-гидрокси-2-фенилэтил]-8-пиримидин-4-ил-3,4-[пиримидо[1,2-а]пиримидин-2,3'-пирролидин]-6(1 Н)-он,22. 1'-(циклогексилкарбонил)-1-(2-оксо-2-фенилэтил)-8-пиримидин-4-ил-3,4-дигидроспиро[пиримидо[1,2-а]пиримидин-2,3'-пирролидин]-6(1 Н)-он. В настоящем изобретении также рассматриваются способы получения соединений дигидроспиро[циклоалкиламин]пиримидона, представленных вышеуказанной формулой (I). Эти соединения могут быть получены, например, в соответствии со способами, которые описаны ниже.-5 010419 Способ получения Соединения дигидроспиро[циклоалкиламин]пиримидона, представленные вышеуказанной формулой (I), могут быть получены согласно способу, показанному на схеме 1. Схема 1(На приведенной выше схеме определения R1, R2, R3, R4, X, Y, m, n, о, р и q являются такими, как описано для соединений формулы (I).) Следуя приведенному способу, производное пиримидинона, представленное приведенной выше формулой (III), где R1, R3, R4, m, n, о, р и q являются такими, как определено для соединения формулы(I), подвергают взаимодействию с основанием, таким как гидрид натрия, карбонат натрия или карбонат калия, в растворителе, таком как N,N-диметилформамид, N-метилпирролидон, N,N-диметилацетамид или хлороформ, при соответствующей температуре, в интервале от 0 до 130 С, в обычной атмосфере,затем с соединением формулы (II), где R2, X, Y и n являются такими, как определено для соединения формулы (I), и L представляет собой уходящую группу, предпочтительно бромид или мезил, с получением соединения вышеуказанной формулы (I). Альтернативно, соединения формулы (I), где Y представляет собой карбонильную группу, могут быть получены окислением соединения формулы (I), где Y представляет собой метиленовую группу,замещенную гидроксильной группой, в соответствии со способами, хорошо известными специалисту в данной области. Соединение формулы (II) коммерчески доступно или может быть синтезировано по методикам, хорошо известным специалисту в данной области. Соединение формулы (III) может быть получено способом, представленным на схеме 2. Схема 2(На приведенной выше схеме определения R1, R3, R4, m, о, р и q являются такими, как уже описано выше.) Согласно этому способу 3-кетоэфир формулы (IV), где R1 и R3 являются такими же, как для соединения формулы (I), a R представляет собой алкильную группу, такую как, например, метил или этил,подвергают взаимодействию с соединением формулы (V). Реакцию можно осуществлять в присутствии основания, такого как карбонат калия, в спиртовом растворителе, таком как метанол, этанол и т.п., или без него, при соответствующей температуре, в интервале от 25 до 140 С в обычной атмосфере. Альтернативно, соединение формулы (III), где R3 представляет собой атом водорода, может быть галогенировано с получением соединений формулы (III), где R3 является атомом галогена, таким как атом брома или хлора. Реакцию можно осуществлять в кислой среде, такой как уксусная кислота или пропионовая кислота, в присутствии бромсукцинимида или хлорсукцинимида, или брома. В дополнение, соединения формулы (III), где R3 представляет собой атом фтора, могут быть получены по аналогии с методом, описанным в Tetrahedron Letters, vol.30, 45, рр 6113-6116, 1989.-6 010419 Соединение формулы (IV) коммерчески доступно или может быть синтезировано по методике, хорошо известной специалисту в данной области. Например, соединения формулы (IV), где R1 представляет собой пиридиновое кольцо или пиримидиновое кольцо, необязательно замещенное С 1-4 алкильной группой, С 1-4 алкоксигруппой или атомом галогена, могут быть получены взаимодействием, соответственно, изоникотиновой кислоты или пиримидинкарбоновой кислоты, необязательно замещенной С 1-4 алкильной группой, C1-4 алкоксигруппой или галогеном, с соответствующим моноэфиром малоновой кислоты. Реакцию можно осуществлять, используя способы, хорошо известные специалисту в данной области, такие как, например, осуществляемые в присутствии агента реакции сочетания, такого как 1,1'-карбонил-бис-1 Н-имидазол, в таком растворителе,как тетрагидрофуран при температуре в интервале от 20 до 70 С. Соединение формулы (V) может быть синтезировано в соответствии с методиками, хорошо известными специалисту в данной области. Например, соединение формулы (V), в случае, когда m и о принимают значение, равное 2, р принимает значение, равное 2, и q принимает значение, равное 0, может быть получено, в соответствии со способом, представленным на схеме 3, начиная с соединения (VI), где R4 определен, как описано выше для формулы (I). Условия, которые могут быть использованы, приведены в химических примерах. Схема 3(На приведенной выше схеме Pg представляет собой аминозащитную группу, и L представляет собой уходящую группу.) Соединение формулы (VI) может быть синтезировано в соответствии со способом, описанным в J.Med. Chem. 1991, 34, 90-97. Соединение формулы (VII) может быть синтезировано в соответствии со способом, описанным вSynthetic Communication 28(4), 701-712 (1998). Следующим объектом настоящего изобретения являются также соединения формулы (III) в качестве промежуточных соединений для получения соединений формулы (I). В описанных выше реакциях иногда могут быть необходимы защита функциональных групп или удаление защиты функциональных групп. Соответствующая защитная группа, Pg, может быть выбрана в зависимости от типа функциональной группы и способа, описанного в литературе, который может быть применен. Примеры защитных групп для способов защиты функциональных групп или способов удаления защиты функциональных групп приведены, например, в Protective groups in Organic Synthesis Greeneet al., 2nd Ed. (John WileySons, Inc., New York). Соединения по настоящему изобретению обладают ингибирующей активностью по отношению кGSK3. Соответственно, соединения по настоящему изобретению оказываются пригодными в качестве активного ингредиента при получении лекарственного препарата, который можно использовать для профилактики и/или терапевтического лечения болезни, вызываемой аномальной активностью GSK3, и,более конкретно, нейродегенеративных болезней, таких как болезнь Альцгеймера. В дополнение, соединения по настоящему изобретению также применимы в качестве активного ингредиента при получении лекарственного препарата для профилактики и/или терапевтического лечения нейродегенеративных болезней, таких как болезнь Паркинсона, тауопатии (например, лобно-височно-теменная деменция, кортикобазальная дегенерация, болезнь Пика, прогрессирующий супрануклеарный паралич) и другие деменции, включая васкулярную деменцию, апоплексический удар и другие травматические повреждения,инсульты (например, возрастную дегенерацию желтого пятна), травму головного мозга и травму спинного мозга, периферические невропатии, ретинопатии и глаукому; и других болезней, таких как инсулиннезависимые диабеты (такие как диабеты II типа) и ожирение, маниакально-депрессивный психоз, шизофрения, облысение, раковые заболевания, такие как рак молочной железы, немелкоклеточный рак легкого,рак щитовидной железы, лейкоз Т- или В-клеток и различные новообразования, вызываемые вирусами.-7 010419 Соединения по настоящему изобретению могут быть использованы в способе лечения нейродегенеративных болезней, вызываемых аномальной активностью GSK3, и вышеуказанных болезней; способ включает введение в организм млекопитающего, нуждающегося в лечении, эффективного количества соединения формулы (I). В качестве активного ингредиента лекарственного препарата по настоящему изобретению может быть использовано вещество, которое выбирают из группы, состоящей из соединения, представленного вышеуказанной формулой (I), и его фармакологически приемлемых солей, сольватов и гидратов. Вещество, per se, может быть введено как лекарственный препарат по настоящему изобретению, однако, желательно вводить лекарственный препарат в форме фармацевтической композиции,которая содержит в качестве активного ингредиента вышеуказанное вещество и одну или несколько фармацевтических добавок. В качестве активного ингредиента лекарственного препарата по настоящему изобретению может быть использована комбинация двух или более вышеуказанных веществ. Указанная выше фармацевтическая композиция может быть дополнена активным ингредиентом еще одного лекарственного препарата для лечения упомянутых выше болезней. Тип фармацевтической композиции ничем в особенности не ограничен, и композиция может быть получена в форме любого препарата для перорального или для парентерального введения. К примеру, фармацевтическая композиция может быть составлена, например, в форме фармацевтических композиций для перорального введения, таких как гранулы, мелкозернистые гранулы, порошки, твердые капсулы, мягкие капсулы, сиропы, эмульсии, суспензии, растворы и т.п., или в форме фармацевтических композиций для парентеральных введений, таких как инъекции для внутривенного, внутримышечного или подкожного введения, капельные инфузии(вливание), трансдермальные препараты, трансмукозальные препараты, назальные капли, летучие препараты (средства для ингаляций), суппозитории и т.п. Препараты для инъекций или капельных инфузий могут быть получены в форме порошковых препаратов, например в виде лиофилизированных препаратов, и могут быть использованы путем растворения непосредственно перед приемом в соответствующей водной среде, такой как физиологический солевой раствор. Препараты с замедленным высвобождением,такие как препараты, покрытые полимерной оболочкой, могут быть введены непосредственно интрацеребрально. Типы фармацевтических добавок, используемые при получении фармацевтической композиции,соотношения фармацевтических добавок и активного ингредиента и способы получения фармацевтической композиции могут быть соответствующим образом выбраны специалистами в данной области. В качестве фармацевтических добавок могут быть использованы неорганические или органические или твердые или жидкие вещества. Обычно фармацевтические добавки могут быть введены в соотношении от 1 до 90% мас. относительно массы активного ингредиента. Примеры наполнителей, которые используют при получении твердых фармацевтических композиций, включают, например, лактозу, сахарозу, крахмал, тальк, целлюлозу, декстрин, каолин, карбонат кальция и т.п. При получении жидких композиций для перорального введения может быть использован обычный инертный разбавитель, такой как вода или растительное масло. Жидкая композиция может содержать, в дополнение к инертному разбавителю, вспомогательные средства, такие как увлажняющие средства, средства, способствующие суспендированию, подсластители, ароматизаторы, красители и консерванты. Жидкая композиция может быть помещена в капсулы, выполненные из поглощающего материала, такого как желатин. Примеры растворителей или суспензионных сред, используемых при получении композиций для парентерального введения, например инъекционных растворов, суппозиториев,включают воду, пропиленгликоль, полиэтиленгликоль, бензиловый спирт, этилолеат, лецитин и т.п. Примеры основных материалов, используемых для суппозиториев, включают, например, масло какао, эмульгированное масло какао, лауриновый липид, витепсол. Дозу и частоту введения лекарственного препарата по настоящему изобретению не особенно ограничивают, и они могут быть соответствующим образом выбраны, в зависимости от условий, таких как профилактика и/или терапевтическое лечение, вид заболевания, масса тела, возраст больного, тяжесть заболевания и т.п. Обычно, ежедневная доза для перорального введения взрослому человеку может составлять от 0,01 до 1000 мг (масса активного ингредиента), и дозу могут вводить один раз в день или несколько раз день дробными порциями, или один раз в несколько дней. Когда лекарственный препарат используют в виде инъекций,введение предпочтительно можно осуществлять непрерывно или периодически, при дневной дозе, составляющей для взрослого пациента от 0,001 до 100 мг (масса активного ингредиента). Химические примеры Пример 1 (соединение 1 из табл. 1). Этил-1'-[(2S)-2-гидрокси-2-фенилэтил]-6'-оксо-8'-(пиридин-4-ил)-1',3',4',6'-тетрагидро-1 Н-спиро[пиперидин-4,2'пиримидо[1,2-а]пиримидин]-1-карбоксилат (1:1) (гидрохлорид). 1.1. Этиловый эфир 4-цианометиленпиперидин-1-карбоновой кислоты. На протяжении 10-минутного периода добавляли при 0 С 56,91 г (321,28 ммоль) диэтил(цианометил)фосфоната к суспензии 12,85 г (321,28 ммоль) гидрида натрия (60% суспензия в минеральном масле) в 500 мл безводного тетрагидрофурана. Реакционную смесь перемешивали в течение 2 ч при комнатной температуре и затем по каплям на протяжении 30 мин добавляли 44,05 г (292,07 ммоль) этилового эфира 4-оксопиперидин-1-карбоновой кислоты в 230 мл безводного тетрагидрофурана. Полученную-8 010419 смесь перемешивали при комнатной температуре в течение 16 ч. Смесь растворяли в 1 л диэтилового эфира и промывали насыщенным водным раствором хлорида аммония, насыщенным водным хлоридом натрия, сушили над сульфатом натрия и упаривали. Неочищенный продукт растирали с петролейным эфиром и фильтровали, получая 51,63 г чистого продукта в виде желтого твердого вещества. Т.пл.: 95-96 С. 1.2. Этиловый эфир 4-амино-4-цианометилпиперидин-1-карбоновой кислоты. Раствор 51,38 г (264,53 моль) этилового эфира 4-цианометиленпиперидин-1-карбоновой кислоты в 301 мл водного раствора аммиака (29%) и 50 мл метанола нагревали при 110 С в запаяной трубке в течение 48 ч. Реакционную смесь концентрировали и остаток хроматографировали на силикагеле, элюируя смесью дихлорметан/метанол в соотношении от 100/0 до 96/4 с получением 40 г продукта в виде белого твердого вещества. Т.пл.: 68-69 С. 1.3. Этиловый эфир 4-трет-бутоксикарбониламино-4-цианометилпиперидин-1-карбоновой кислоты. К раствору 35,44 г (167,79 ммоль) этилового эфира 4-амино-4-цианометилпиперидин-1-карбоновой кислоты в 200 мл тетрагидрофурана добавляли 4,3 мл воды, 23,58 мл (167,79 ммоль) триэтиламина и 36,61 г (167,79 ммоль) ди-трет-бутилдикарбоната в 50 мл тетрагидрофурана. Полученную смесь перемешивали при комнатной температуре в течение 16 ч. Смесь растворяли в дихлорметане и промывали насыщенным водным раствором хлорида аммония,насыщенным водным хлоридом натрия, сушили над сульфатом натрия и упаривали. Неочищенный продукт растирали с пентаном и фильтровали с получением 46,49 г чистого продукта в виде белого твердого вещества. Т.пл.: 133-135 С. 1.4. Этиловый эфир 4-(2-аминоэтил)-4-трет-бутоксикарбониламинопиперидин-1-карбоновой кислоты. К раствору 5 г (16,06 ммоль) этилового эфира 4-трет-бутоксикарбониламино-4-цианометилпиперидин-1-карбоновой кислоты в 107 мл метанола добавляли 4,71 г катализатора, никеля Ренея. Суспензию гидрировали при комнатной температуре при давлении 55 фунт/дюйм 2 в течение 3 ч. Катализатор удаляли фильтрованием и растворитель выпаривали при пониженном давлении. Очистка хроматографией на силикагеле, элюируя смесью дихлорметан/метанол/водный раствор аммиака(29%), в соотношении от 100/0/0 до 70/30/3, приводила к соединению в виде масла (2,86 г). 1.5. Этиловый эфир 4-амино-4-(2-аминоэтил)пиперидин-1-карбоновой кислоты гидрохлорид (2:1). К раствору 3,01 г (9,56 ммоль) этилового эфира 4-(2-аминоэтил)-4-трет-бутоксикарбониламинопиперидин-1-карбоновой кислоты в 19 мл изопропанола добавляли 8 мл раствора хлористоводородной кислоты (5,6 н.) в изопропаноле и полученный раствор перемешивали при комнатной температуре в течение 3 ч. Смесь охлаждали и добавляли диэтиловый эфир. Полученный осадок отфильтровывали. Продукт сушили с получением 2,49 г чистого соединения в виде белого твердого вещества. Т.пл.: 119-121 С. 1.6. Гидробромид этилового эфира 2-амино-1,3,9-триазаспиро[5,5]ундец-2-ен-9-карбоновой кислоты (1:1). К раствору 15,65 г (54,33 ммоль) гидрохлорида этилового эфира 4-амино-4-(2-аминоэтил)пиперидин-1-карбоновой кислоты (2:1) в 108 мл метанола добавляли 21,73 мл (114,09 ммоль) раствора метилата натрия в метаноле (5,55 н.). Смесь перемешивали при комнатной температуре в течение 2 ч. Осадок отфильтровывали и фильтрат упаривали. Неочищенный продукт растворяли в 108 мл воды и порциями добавляли 5,75 г (54,33 ммоль) цианбромида. Полученную смесь перемешивали при комнатной температуре в течение 16 ч, упаривали досуха, растворяли в этаноле и упаривали досуха, с получением 17,56 г чистого соединения в виде коричневого твердого вещества. 1.7. Этил-6'-оксо-8'-(пиридин-4-ил)-1',3',4',6'-тетрагидро-1 Н-спиро[пиперидин-4,2'-пиримидо[1,2-а]пиримидин]-1-карбоксилат. Смесь 3 г (15,57 ммоль) этил-3-(пиридин-4-ил)-3-оксопропионата, 5 г (15,57 ммоль) гидробромида этилового эфира 2-амино-1,3,9-триазаспиро[5.5]ундец-2-ен-9-карбоновой кислоты (1:1) и 4,52 г(32,70 ммоль) карбоната калия в 28 мл этанола нагревали при температуре кипячения с обратным холодильником в течение 12 ч. Охлажденный раствор упаривали для удаления растворителя. Смесь растворяли в дихлорметане и промывали насыщенным водным раствором хлорида аммония, сушили над сульфатом натрия и упаривали. Остаток обрабатывали водой и осадок отфильтровывали; неочищенный продукт растирали в диэтиловом эфире и фильтровали с получением 2,94 г чистого продукта в виде белого твердого вещества. Т.пл.: 209-210 С. 1.8. Этил-1'-[(2S)-2-гидрокси-2-фенилэтил]-6'-оксо-8'-(пиридин-4-ил)-1',3',4',6'-тетрагидро-1 Н-спиро[пиперидин-4,2'-пиримидо[1,2-а]пиримидин]-1-карбоксилат (1:1) (гидрохлорид). К раствору 0,6 г (1,62 ммоль) этил-6'-оксо-8'-(пиридин-4-ил)-1',3',4',6'-тетрагидро-1 Н-спиро[пипе-9 010419 ридин-4,2'-пиримидо [1,2-а]пиримидин]-1-карбоксилата в 13 мл безводного диметилформамида добавляли 0,085 г (2,11 ммоль) гидрида натрия (60% суспензия в минеральном масле). Смесь оставляли для перемешивания при 50 С в течение 1 ч. Затем добавляли 0,25 г (2,11 ммоль) (S)-фенилоксирана и смесь оставляли перемешиваться при 110 С в течение 12 ч. Добавляли 0,25 г (2,11 ммоль) (S)-фенилоксирана и смесь оставляли перемешиваться при 110 С в течение 6 ч. Добавляли воду и смесь экстрагировали дихлорметаном. Экстракты промывали насыщенным водным раствором хлорида натрия, сушили и упаривали, с получением неочищенного продукта. Очистка хроматографией на силикагеле, при элюировании смесью этилдихлорметан/метанол в соотношении от 100/0 до 90/10 приводила к соединению в форме свободного основания. Основание преобразовывали в его гидрохлоридную соль с получением 0,144 г чистого продукта. Т.пл.: 169-170 С, []D=-13,7 (c=0,99, диметилметилсульфоксид). 1 Н ЯМР (ДМСО-d6: 200 МГц)(м.д.): 8,95 (уш.д, 2 Н); 8,35 (д, 2 Н); 7,12-7,42 (м, 5 Н); 6,66 (с, 1 Н); 5,02 (м, 1 Н); 4,00 (кв, 2 Н); 3,52-3,95 (м, 6 Н); 2,78-3,11 (м, 2 Н); 1,95-2,4 (м, 4 Н); 1,65-1,90 (м, 2 Н); 71.15 (т,3H). Пример 2 (соединение 2 табл. 1). Этил-6'-оксо-1'-[2-оксо-2-фенилэтил]-8'-(пиридин-4-ил)-1',3',4',6'-тетрагидро-1 Н-спиро[пиперидин 4,2'-пиримидо[1,2-а] пиримидин]-1-карбоксилат (1:1) (гидрохлорид). 0,138 г (0,28 ммоль) этил-1'-[(2S)-2-гидрокси-2-фенилэтил]-6'-оксо-8'-(пиридин-4-ил)-1',3',4',6'тетрагидро-1 Н-спиро[пиперидин-4,2'-пиримидо[1,2-а]пиримидин]-1-карбоксилата растворяли в 2,82 мл безводного дихлорметана и смешивали с 0,049 г (0,42 ммоль) N-метилморфолин-N-оксида, 0,001 г(0,0083 ммоль) тетра-н-пропиламмонийперрутената и 1 г порошкообразных молекулярных сит (4 А). Смесь перемешивали при 20 С в атмосфере азота в течение 12 ч. Добавляли 0,049 г (0,42 ммоль) N-метилморфолин-N-оксида, 0,001 г (0,0014 ммоль) тетра-нпропиламмонийперрутената, 1 г порошкообразных молекулярных сит (4 А) и смесь перемешивали при 20 С в атмосфере азота в течение 3 ч. Очистка неочищенного продукта хроматографией на силикагеле, элюируя смесью дихлорметан/метанол в соотношении от 100/0 до 95/5, дала соединение в форме свободного основания, которое преобразовывали в его гидрохлоридную соль, с получением 0,045 г чистого продукта. Т.пл.: 227-229 С. 1 Н ЯМР (ДМСО-d6: 200 МГц)(м.д.): 8,46 (уш.д, 2 Н); 8,05 (д, 2 Н); 7,51-782 (м, 5 Н); 6,63 (с, 1 Н); 5,22 (с, 2 Н); 3,85-4,08 (м, 6 Н); 2,89-3,25 (м, 2 Н); 2,21-2,37 (м, 2 Н); 1,95 (тд, 2 Н); 1,66 (д, 2 Н); 1,15 (т, 3H). Пример 3 (соединение 3 табл. 1). 1'-[(2S)-2-Гидрокси-2-фенилэтил]-1-метил-8'-(пиридин-4-ил)-3',4'-дигидроспиро[пиперидин-4,2'пиримидо[1,2-а]пиримидин]-6'(1'Н)-он (2:1) (гидрохлорид). 3.1. 1-Метил-8'-(пиридин-4-ил)-3',4'-дигидроспиро[пиперидин-4,2'-пиримидо[1,2-а]пиримидин]6'(1'Н)-он. К раствору 0,6 г (1,62 ммоль) этил-6-оксо-(пиридин-4-ил)-1',3',4',6'-тетрагидро-1 Н-спиро[пиперидин-4,2'-пиримидо [1,2-а]пиримидин]-1-карбоксилата, растворенного в 3,25 мл тетрагидрофурана, добавляли при 0 С 0,185 г (4,87 ммоль) алюмогидрида лития. Полученную смесь перемешивали в течение 3 ч при комнатной температуре в атмосфере азота. Реакционную смесь обрабатывали избытком насыщенного водного раствора сульфата натрия. Далее добавляли твердый сульфат натрия и органическую фазу фильтровали для удаления соли. Растворитель выпаривали и очистка хроматографией на силикагеле при элюировании смесью дихлорметан/метанол в соотношении от 100/0 до 70/30 приводила к соединению в виде желтого твердого вещества(0,328 г). Т.пл.: 232-234 С. 3.2. 1'-[(2S)-2-Гидрокси-2-фенилэтил]-1-метил-8'-(пиридин-4-ил)-3',4'-дигидроспиро[пиперидин 4,2'-пиримидо[1,2-а] пиримидин]-6'(1'Н)-он (2:1) (гидрохлорид). Продукт получали по аналогии со способом, описанным на стадии 1.9, используя 1-метил-8'(пиридин-4-ил)-3',4'-дигидроспиро[пиперидин-4,2'-пиримидо[1,2-а]пиримидин]-6'(1'Н)-он. Т.пл.: 271-272 С, []D=-10,2 (c=0,829, СН 3 ОН). 1 Н ЯМР (ДМСО-d6: 200 МГц)(м.д.): 10,75 (уш.с, 1 Н); 8,91 (д, 2 Н); 8,31 (д, 2 Н); 7,20-759 (м, 5 Н); 6,71 (с, 1 Н); 5,12 (м, 1 Н); 3,58-4,50 (м, 4 Н); 3,00-3,45 (м, 4 Н); 2,85 (м, 1 Н); 2,75 (с, 3H); 2,08-2,44 (м, 3H); 1,89 (уш.д, 1 Н); 1,45 (уш.д, 1 Н). Пример 4 (соединение 5 табл. 1). Этил-1'-[(2S)-2-гидрокси-2-фенилэтил]-6'-оксо-8'-(пиримидин-4-ил)-1',3',4',6'-тетрагидро-1 Нспиро[пиперидин-4,2'-пиримидо[1,2-а]пиримидин]-1-карбоксилат. 4.1. Этил-6'-оксо-8'-(пиримидинил-4-ил)-1',3',4',6'-тетрагидро-1 Н-спиро[пиперидин-4,2'-пиримидо[1,2-а]пиримидин]-1-карбоксилат. Продукт получали по аналогии со способом, описанным в примере 1 (стадия 1.7), используя метиловый эфир 3-оксо-3-пиримидин-4-ил-пропионовой кислоты.- 10010419 Т.пл.: 231-233 С. 4.2. Этил-1'-[(2S)-2-гидрокси-2-фенилэтил]-6'-оксо-8'-(пиримидин-4-ил)-1',3',4',6'-тетрагидро-1 Нспиро[пиперидин 4,2'-пиримидо[1,2-а]пиримидин]-1-карбоксилат. Продукт получали по аналогии со способом, описанным на стадии 1.8, используя этил-6'-оксо-8'(пиримидинил-4-ил)-1',3',4',6'-тетрагидро-1 Н-спиро[пиперидин-4,2'-пиримидо[1,2-а]пиримидин]-1 карбоксилат. Т.пл.: 118-120 С, []D=-13,2 (c=1,028, СН 3 ОН). 1(с, 1 Н); 5,48 (д, 1 Н); 5,05 (м, 1 Н); 4,04 (кв, 2 Н); 3,52-4,10 (м, 5 Н); 2,92 (уш.кв, 2 Н); 1,90-2,39 (м, 3H); 1,631,90 (м, 3H); 1,15 (т, 3H). Пример 5 (соединение 7 табл. 1). 1'-[(2S)-2-Гидрокси-2-фенилэтил]-1-метил-8'-(пиримидин-4-ил)-3',4'-дигидроспиро[пиперидин-4,2'пиримидо[1,2-а]пиримидин]-6'(1'Н)-он. 5.1. 1-Метил-8'-(пиримидин-4-ил)-3',4'-дигидроспиро[пиперидин-4,2'-пиримидо[1,2-а]пиримидин]6'(1'Н)-он. Продукт получали по аналогии со способом, описанным в примере 3 (стадия 3.1), используя метиловый эфир 3-оксо-3-пиримидин-4-ил-пропионовой кислоты. Т.пл.: 194-196 С. 5.2. 1'-[(2S)-2-Гидрокси-2-фенилэтил]-1-метил-8'-(пиримидин-4-ил)-3',4'-дигидроспиро[пиперидин 4,2'-пиримидо[1,2-а]пиримидин]-6'(1'Н)-он. Продукт получали по аналогии со способом, описанным на стадии 1.8, и используя 1-метил-8'(пиримидин-4-ил)-3',4'-дигидроспиро[пиперидин-4,2'-пиримидо[1,2-а]пиримидин]-6'(1'Н)-он. Т.пл.: 180-182 С. 1 Н ЯМР (ДМСО-d6: 200 МГц)(м.д.): 9,35 (с, 1 Н); 9,05 (д, 1 Н); 8,17 (д, 1 Н); 7,25-7,45 (м, 5 Н); 6,75(уш.д, 1 Н); 1,20 (м, 1 Н). Пример 6 (соединение 1 табл. 2). Этил-1-[(2S)-2-гидрокси-2-фенилэтил]-6-оксо-8-пиридин-4-ил-1,3,4,6-тетрагидро-1'Н-спиро[пиримидо[1,2-а]пиримидин-2,3'-пирролидин]-1'-карбоксилат (1:1) (гидрохлорид). 6.1. Этиловый эфир 3-цианометиленпирролидин-1-карбоновой кислоты. Продукт получали по аналогии со способом, описанным в примере 1 (стадия 1.1), и используя этиловый эфир 3-оксо-пирролидин-1-карбоновой кислоты, полученный согласно Visconti М. et al. HelveticaChimica Ada 1967, 50(5) 1289-93. 6.2. Этил-3-амино-3-(цианометил)пирролидин-1-карбоксилат. Продукт получали по аналогии со способом, описанным в примере 1 (стадия 1.2.), и используя этиловый эфир 3-цианометиленпирролидин-1-карбоновой кислоты. 6.3. Этил-3-[(трет-бутоксикарбонил)амино]-3-(цианометил)пирролидин-1-карбоксилат. Продукт получали по аналогии со способом, описанным в примере 1 (стадия 1.3.), и используя этил-3-амино-3-(цианометил)пирролидин-1-карбоксилат. 6.4. Этил-3-(2-аминоэтил)-3-[(трет-бутоксикарбонил)амино]пирролидин-1-карбоксилат. Продукт получали по аналогии со способом, описанным в примере 1 (стадия 1.4), и используя этил 3-[(трет-бутоксикарбонил)амино]-3-(цианметил)пирролидин-1-карбоксилат. 6.5. Гидрохлорид этил-3-амино-3-(2-аминоэтил)пирролидин-1-карбоксилата (2:1). Продукт получали по аналогии со способом, описанным в примере 1 (стадия 1.5.), и используя этил-3-(2-аминоэтил)-3-[(трет-бутоксикарбонил)амино]пирролидин-1-карбоксилат. 6.6. Гидробромид этил-7-амино-2,6,8-триазаспиро[4.5]дец-6-ен-2-карбоксилата (1:1). Продукт получали по аналогии со способом, описанным в примере 1 (стадия 1.6.), и используя этил-3-амино-3-(2-аминоэтил)пирролидин-1-карбоксилат гидрохлорид (2:1). 6.7. Этил-6-оксо-8-пиридин-4-ил-1,3,4,6-тетрагидро-1'Н-спиро[пиримидо[1,2-а]пиримидин-2,3'пирролидин]-1'-карбоксилат. Продукт получали по аналогии со способом, описанным в примере 1 (стадия 1.7), используя этиловый эфир 3-оксо-3-пиридин-4-ил-пропионовой кислоты и этил-7-амино-2,6,8-триазаспиро[4.5]дец-6-ен-2 карбоксилат гидробромид (1:1). Т.пл.: 171-172 С. 6.8. Этил-1-[(2S)-2-гидрокси-2-фенилэтил]-6-оксо-8-пиридин-4-ил-1,3,4,6-тетрагидро-1'Н-спиро[пиримидо[1,2-а]пиримидин-2,3'-пирролидин]-1'-карбоксилат (гидрохлорид) (1:1). Продукт получали по аналогии со способом, описанным в примере 1 (стадия 1.8), и используя этил 6-оксо-8-пиридин-4-ил-1,3,4,6-тетрагидро-1'H-спиро[пиримидо[1,2-а]пиримидин-2,3'-пирролидин]-1'карбоксилат. Т.пл.: 194-195 С. 1 Н ЯМР (ДМСО-d6: 200 МГц)(м.д.): 8,87 (м, 2 Н); 8,26 (м, 2 Н); 7,14-7,46 (м, 5 Н); 6,65 (уш.с, 1 Н);- 11010419 5,19 (уш.с, 1 Н); 2,88-4,36 (м, 10 Н); 1,71-2,28 (м, 4 Н); 1,13 (т, 3H). Пример 7 (соединение 2 табл. 2). Этил-6-оксо-1-(2-оксо-2-фенилэтил)-8-(пиридин-4-ил)-1,3,4,6-тетрагидро-1'Н-спиро[пиримидо[1,2 а]пиримидин-2,3'-пирролидин]-1'-карбоксилат (1:1) (гидрохлорид). Продукт получали по аналогии со способом, описанным в примере 2, и используя этил-1-[(2S)-2 гидрокси-2-фенилэтил]-6-оксо-8-пиридин-4-ил-1,3,4,6-тетрагидро-1'Н-спиро[пиримидо[1,2-а]пиримидин 2,3'-пирролидин]-1'-карбоксилат. Т.пл.: 190-191 С. 1 Н ЯМР (ДМСО-d6: 200 МГц)(м.д.): 8,51 (д, 2 Н); 8,05 (д, 2 Н); 7,79 (д, 2 Н); 7,69 (д, 1 Н); 7,57 (т,2 Н); 6,59 (с, 1 Н); 5,25 (дд, 2 Н); 3,82-4,18 (м, 2 Н); 3,98 (кв, 2 Н); 3,22-3,56 (м, 4 Н); 1,85-2,46 (м, 4 Н); 1,12 (т,3H). Пример 8 (соединение 7 табл. 2). 1'-(3-Фторбензоил)-1-[(2S)-2-гидрокси-2-фенилэтил]-8-пиримидин-4-ил-3,4-дигидроспиро[пиримидо[1,2-а]пиримидин-2,3'-пирролидин]-6(1 Н)-он. 8.1. 8-Пиримидин-4-ил-3,4-[пиримидо[1,2-а]пиримидин-2,3'-пирролидин]-6(1 Н)-он. 1,0 г (2,81 ммоль) этил-6-оксо-8-пиримидин-4-ил-1,3,4,6-тетрагидро-1'Н-спиро[пиримидо[1,2 а]пиримидин-2,3'-пирролидин]-1'-карбоксилат растворяли в 25 мл раствора бромисто-водородной кислоты (33% в уксусной кислоте) и полученный раствор перемешивали при 100 С в течение 12 ч. Смесь охлаждали и добавляли диэтиловый эфир. Полученный осадок отфильтровывали. Продукт растворяли в концентрированном водном растворе гидроксида натрия (30%) и полученный раствор экстрагировали смесью дихлорметан/метанол/концентрированный водный раствор аммиака в соотношении от 100/0/0 до 70/30/3. Экстракты сушили сульфатом натрия и упаривали до получения неочищенного продукта. Неочищенный продукт растирали в диэтиловом эфире с получением 0,64 г (86%) желтого твердого вещества. Т.пл.: 226-228 С. 8.2. 1'-(3-Фторбензоил)-8-пиримидин-4-ил-3,4-дигидроспиро[пиримидо[1,2-а]пиримидин-2,3'-пирролидин]-6(1 Н)-он. К раствору 0,3 г (1,055 ммоль) 8-пиримидин-4-ил-3,4-дигидроспиро[пиримидо[1,2-а]пиримидин 2,3'-пирролидин]-6(1 Н)-она, растворенного в 5 мл тетрагидрофурана, при комнатной температуре добавляли 0,18 мл (1,27 ммоль) триэтиламина и 0,152 мл (1,27 ммоль) 3-фторбензоилхлорида. Полученную смесь перемешивали в течение 2 ч в атмосфере азота при комнатной температуре. Реакционную смесь добавляли к насыщенному водному раствору хлорида аммония, экстрагировали смесью дихлорметан/метанол в соотношении от 100/0 до 80/20, сушили и упаривали. Остаток очищали хроматографией на силикагеле, элюируя смесью дихлорметан/метанол в соотношении от 100/0 до 70/30, с получением 0,310 г (72%) чистого продукта в виде серого твердого вещества. Т.пл.: 296-298 С. 8.3. 1'-(3-Фторбензоил)-1-[(2S)-2-гидрокси-2-фенилэтил]-8-пиримидин-4-ил-3,4-дигидроспиро[пиримидо[1,2-а]пиримидин-2,3'-пирролидин]-6(1 Н)-он. Продукт получали по аналогии со способом, описанным в примере 1 (стадия 1.8), и используя 1'-(3 фторбензоил)-8-пиримидин-4-ил-3,4-дигидроспиро[пиримидо[1,2-а]пиримидин-2,3'-пирролидин ]-6(1 Н)он. Т.пл.: 180-182 С. 1 Н ЯМР (ДМСО-d6: 200 МГц)(м.д.): 9,28 (с, 1 Н); 9,01 (т, 1 Н); 8,11-8,21 (м, 1 Н); 7,02-7,63 (м, 9 Н); 6,72 (с, 1 Н); 5,53 (АВ, 1 Н); 5,04-5,31 (м, 1 Н); 3,12-4,11 (м, 8 Н); 1,65-2,33 (м, 4 Н). Пример 9 (соединение 8 табл. 2). 1'-(3-Фторбензоил)-1-(2-оксо-2-фенилэтил)-8-пиримидин-4-ил-3,4-дигидроспиро[пиримидо[1,2-а]пиримидин-2,3'-пирролидин]-6(1 Н)-он. Продукт получали по аналогии со способом, описанным в примере 2, и используя 1'-(3 фторбензоил)-1-[(2S)-2-гидрокси-2-фенилэтил]-8-пиримидин-4-ил-3,4-дигидроспиро[пиримидо[1,2-а]пиримидин-2,3'-пирролидин]-6(1 Н)-он. Т.пл.: 267-268 С. 1 Н ЯМР (ДМСО-d6: 200 МГц)(м.д.): 9,15 (с, 1 Н); 8,42 (д, 1 Н); 8,09 (т, 2 Н); 7,74 (т, 1 Н); 7,61 (т,2 Н); 7,20-7,53 (м, 5 Н); 6,60-6,75 (м, 1 Н); 5,13-5,40 (м, 2 Н); 3,87-4,25 (м, 2 Н); 3,37-3,87 (м, 4 Н); 1,84-2,52(м, 4 Н). Перечисление химических структур и физических данных для соединений вышеуказанный формулы (I), иллюстрирующих настоящее изобретение, приведено в табл. 1 и 2. Соединения были получены, в соответствии со способами, описанными в примерах. В таблицах Ph представляет собой фенильную группу, Et представляет собой этильную группу; (S),(R) или (рац.) в столбце "Y" показывает стереохимию углеродного атома:(S) означает абсолютную S-конфигурацию В табл. 1 R1 представляет собой незамещенную пиримидин-4-ильную группу или незамещенную пиридин-4-ильную группу, р, о и m означают 2, q означает 0. Пример теста. Ингибирующая активность лекарственного препарата по настоящему изобретению в отношенииGSK3. Могут быть использованы два разных протокола. В первом протоколе: 7,5 мкМ предварительно фософорилированного GS1 пептида и 10 мкМ АТР(содержащего 300000 (cpm) имп./мин 33 Р-АТР) инкубировали в 25 мкМ трис-HCl, pH 7,5, 0,6 мМ DTT,6 мМ MgCl2, 0,6 мМ EGTA, 0,05 мг/мл BSA буфере в течение 1 ч при комнатной температуре в присутствии GSK3 (общий реакционный объем составлял 100 мкл). Во втором протоколе: 4,1 мкМ предварительно фософорилированного GS1 пептида и 42 мкМ АТРMg, 0,5 мМ EGTA, 5 мМ 2-меркаптоэтанола, 0,02% Tween 20, 10% глицериновом буфере в течение 2 ч при комнатной температуре в присутствии GSK3. Ингибиторы солюбилизировали в ДМСО (конечная концентрация растворителя в реакционной среде составляла 1%). Реакцию останавливали 100 мкл раствора, составленного из 25 г полифосфорной кислоты (85%P2O5), 126 мл 85% H3PO4, H2O до 500 мл и затем перед использованием разбавленного до соотношения 1:100. Часть реакционной смеси затем переносили на катионообменные фильтры Whatman P81 и промывали раствором, описанным выше. Введенную 33 Р радиоактивность определяли посредством жидкостной сцинтилляционной спектрометрии. Фосфорилированный GS-1 пептид имел нижеследующую последовательность:(Woodgett, J.R. (1989) Analytical Biochemistry 180, 237-241). Ингибирующая активность соединений по настоящему изобретению по отношению к GSK3 выражают в IC50, и приведенный в качестве иллюстрации интервал изменения IC50 для соединений табл. 1 и 2 соответствует концентрациям от 1 наномоля до 1 микромоля. Например, значение IC50, приведенное для соединения 4 в табл. 1, составляет 0,007 мкМ, а значение IC50, приведенное для соединения 4 в табл. 2, составляет 0,006 мкМ. Примеры препаратов.(1) Таблетки. Ингредиенты, приведенные ниже, перемешивали обычными способами и прессовали, используя обычное оборудование.(2) Мягкие капсулы. Ингредиенты, приведенные ниже, перемешивали обычными способами и заполняли мягкие капсулы.(3) Парентеральные препараты. Ингредиенты, приведенные ниже, перемешивали обычными способами, для того чтобы получить инъекционный раствор, содержащийся в 1 мл ампуле. Промышленное применение Соединения по настоящему изобретению обладают ингибирующей активностью по отношению кGSK3 и применимы в качестве активного ингредиента лекарственного препарата для профилактики и/или терапевтического лечения болезней, вызываемых аномальной активностью GSK3, и, в частности,нейродегенеративных болезней. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Производное дигидроспиро[циклоалкиламин]пиримидона формулы (I), или его соль, или его сольват, или его гидрат где X представляет собой два атома водорода;Y представляет собой карбонильную группу или метиленовую группу, необязательно замещенную гидроксильной группой;R2 представляет собой бензольное кольцо;R3 представляет собой атом водорода;R4 представляет собой атом водорода, C1-4 алкоксикарбонильную группу, С 3-6 циклоалкилкарбонильную группу, бензоильную группу, C1-6 алкильную группу, группы необязательно замещены 1-4 заместителями, выбранными из атома галогена, гидроксильной группы или C1-4 алкоксигруппы; о и m принимают значения от 1 до 2;n принимает значения от 0 до 3; р принимает значения от 0 до 2 иq принимает значения от 0 до 2. 2. Производное дигидроспиро[циклоалкиламин]пиримидона, или его соль, или его сольват, или его гидрат по п.1, где R4 представляет собой атом водорода, C1-4 алкоксикарбонильную группу, C1-6 алкильную группу, необязательно замещенную 1-4 заместителями, выбранными из атома галогена, гидроксильной группы или C1-4 алкоксигруппы. 3. Производное дигидроспиро[циклоалкиламин]пиримидона, или его соль, или его сольват, или его гидрат по п.1 или 2, где R1 представляет собой незамещенную 4-пиридинильную группу или незамещенную 4-пиримидинильную группу. 4. Производное дигидроспиро[циклоалкиламин]пиримидона, или его соль, или его сольват, или его гидрат по п.3,где R2 представляет собой бензольное кольцо;R3 представляет собой атом водорода;R4 представляет собой C1-4 алкоксикарбонильную группу, C3-6 циклоалкилкарбонильную группу,- 18010419 бензоильную группу или С 1-3 алкильную группу, необязательно замещенную 1-4 заместителями, выбранными из атома галогена или гидроксильной группы;X представляет собой два атома водорода;Y представляет собой карбонильную группу или метиленовую группу, необязательно замещенную гидроксильной группой; р принимает значение 2 иq принимает значение 0. 5. Производное дигидроспиро[циклоалкиламин]пиримидона, которое выбирают из группы, включающей этил-1'-[(2S)-2-гидрокси-2-фенилэтил]-6'-оксо-8'-(пиридин-4-ил)-1',3',4',6'-тетрагидро-1 Нспиро[пиперидин-4,2'-пиримидо[1,2-а]пиримидин]-1-карбоксилат,этил-6'-оксо-1'-[2-оксо-2-фенилэтил]-8'-(пиридин-4-ил)-1',3',4',6'-тетрагидро-1 Н-спиро[пиперидин 4,2'-пиримидо[1,2-а]пиримидин]-1-карбоксилат,1'-[(2S)-2-гидрокси-2-фенилэтил]-1-метил-8'-(пиридин-4-ил)-3',4'-дигидроспиро[пиперидин-4,2'пиримидо[1,2-а]пиримидин]-6'(1'Н)-он,1-метил-1'-(2-оксо-2-фенилэтил)-8'-(пиридин-4-ил)-3',4'-дигидроспиро[пиперидин-4,2'-пиримидо[1,2-а]пиримидин]-6'(1'Н)-он,этил-1'-[(2S)-2-гидрокси-2-фенилэтил]-6'-оксо-8'-(пиримидин-4-ил)-1',3',4',6'-тетрагидро-1 Нспиро[пиперидин-4,2'-пиримидо[1,2-а]пиримидин]-1-карбоксилат,этил-6'-оксо-1'-[2-оксо-2-фенилэтил]-8'-(пиримидин-4-ил)-1',3',4',6'-тетрагидро-1 Н-спиро[пиперидин-4,2'-пиримидо[1,2-а]пиримидин]-1-карбоксилат,1'-[(2S)-2-гидрокси-2-фенилэтил]-1-метил-8'-(пиримидин-4-ил)-3',4'-дигидроспиро[пиперидин-4,2'пиримидо[1,2-а]пиримидин]-6'(1'Н)-он,1-(циклогексилкарбонил)-1'-[(2S)-2-гидрокси-2-фенилэтил]-8'-пиридин-4-ил-3',4'-дигидроспиро где R1, R3, R4, m, o, q и р определяют так же, как в соединении формулы (I) по п.1. 7. Лекарственный препарат, включающий в качестве активного ингредиента вещество, выбранное из группы, состоящей из производного дигидроспиро[циклоалкиламин]пиримидона формулы (I) по п.1,или его соли, или его сольвата, или его гидрата. 8. Ингибитор GSK3, выбранный из группы, состоящей из производного дигидроспиро[циклоалкиламин]пиримидона формулы (I) по п.1, или его соли, или его сольвата, или его гидрата. 9. Применение соединения, представленного в пп.1-4, для получения лекарственного препарата для профилактики и/или терапевтического лечения болезни, вызванной аномальной активностью GSK3. 10. Применение соединения, представленного в пп.1-4, для получения лекарственного препарата для профилактики и/или терапевтического лечения нейродегенеративного заболевания. 11. Применение соединения по п.10, где нейродегенеративное заболевание выбирают из группы,состоящей из болезни Альцгеймера, болезни Паркинсона, тауопатий, васкулярной деменции, апоплексического удара, травматических повреждений, инсультов, травмы головного мозга и травмы спинного мозга, периферических невропатий, ретинопатий и глаукомы. 12. Применение соединения, представленного в пп.1-4, для получения лекарственного препарата для профилактики и/или терапевтического лечения инсулиннезависимых диабетов, ожирения, маниакально-депрессивного психоза, шизофрении, облысения или раковых заболеваний. 13. Применение по п.12, где раковое заболевание представляет собой рак молочной железы, немелкоклеточный рак легкого, рак щитовидной железы, лейкоз Т- или В-клеток или различные новообразования, вызванные вирусами.
МПК / Метки
МПК: C07D 487/04, A61K 31/505
Метки: производные, динилдигидроспиро, 8`-пири(ми, пиримидин-6-она, пиримидо, циклоалкиламин, замещённые, 1,2-а
Код ссылки
<a href="https://eas.patents.su/21-10419-zameshhyonnye-proizvodnye-8-pirimi-dinildigidrospiro-cikloalkilamin-pirimido-12-a-pirimidin-6-ona.html" rel="bookmark" title="База патентов Евразийского Союза">Замещённые производные 8`-пири(ми) динилдигидроспиро [циклоалкиламин] пиримидо [1,2-а] пиримидин-6-она</a>
Предыдущий патент: Тризамещённые гетероарилы и способы их получения и применения
Следующий патент: Молекулы-антагонисты цитокинов
Случайный патент: Бытовой прибор с генератором озона (варианты)












