Микроорганизмы rhodococcus sp., способные превращать ацетонитрил в амид, полученый из этих микроорганизмов фермент с нитрилгидратазной активностью и способ их применения
Формула / Реферат
1. Микроорганизм, представляющий собой штамм Rhodococcus sp. FZ4, депонированный под регистрационным номером DSM 13597, и его функционально эквивалентные варианты и мутанты, способные превращать ацетонитрил в амид.
2. Нитрилгидратаза, полученная из микроорганизма по п.1 и характеризующаяся:
а) Km 2,84+1,00 мМ при использовании в качестве субстрата ацетонитрила и Km 80,5+15,0 мМ при использовании в качестве субстрата 3-цианпиридина;
б) оптимальным значением рН 6,5+1,0.
3. Экстракт, содержащий нитрилгидратазу по п.2.
4. Способ получения амидов общей формулы
| R1-CONH2 | III, |
в которой R1 обозначает С1-6алкильный остаток, С2-6алкенильную группу или группу общей формулы
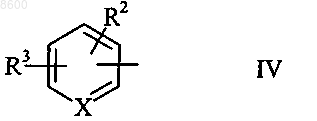
в которой X обозначает атом азота или группу -СН=, a R2 и R3 независимо друг от друга обозначают атом водорода, атом галогена, С1-6алкильную группу или С2-6алкенильную группу,
отличающийся тем, что нитрил общей формулы
| R1-CN | II, |
в которой R1 имеет указанные выше значения, подвергают превращению с помощью микроорганизма по п.1, экстракта по п.3 или фермента по п.2.
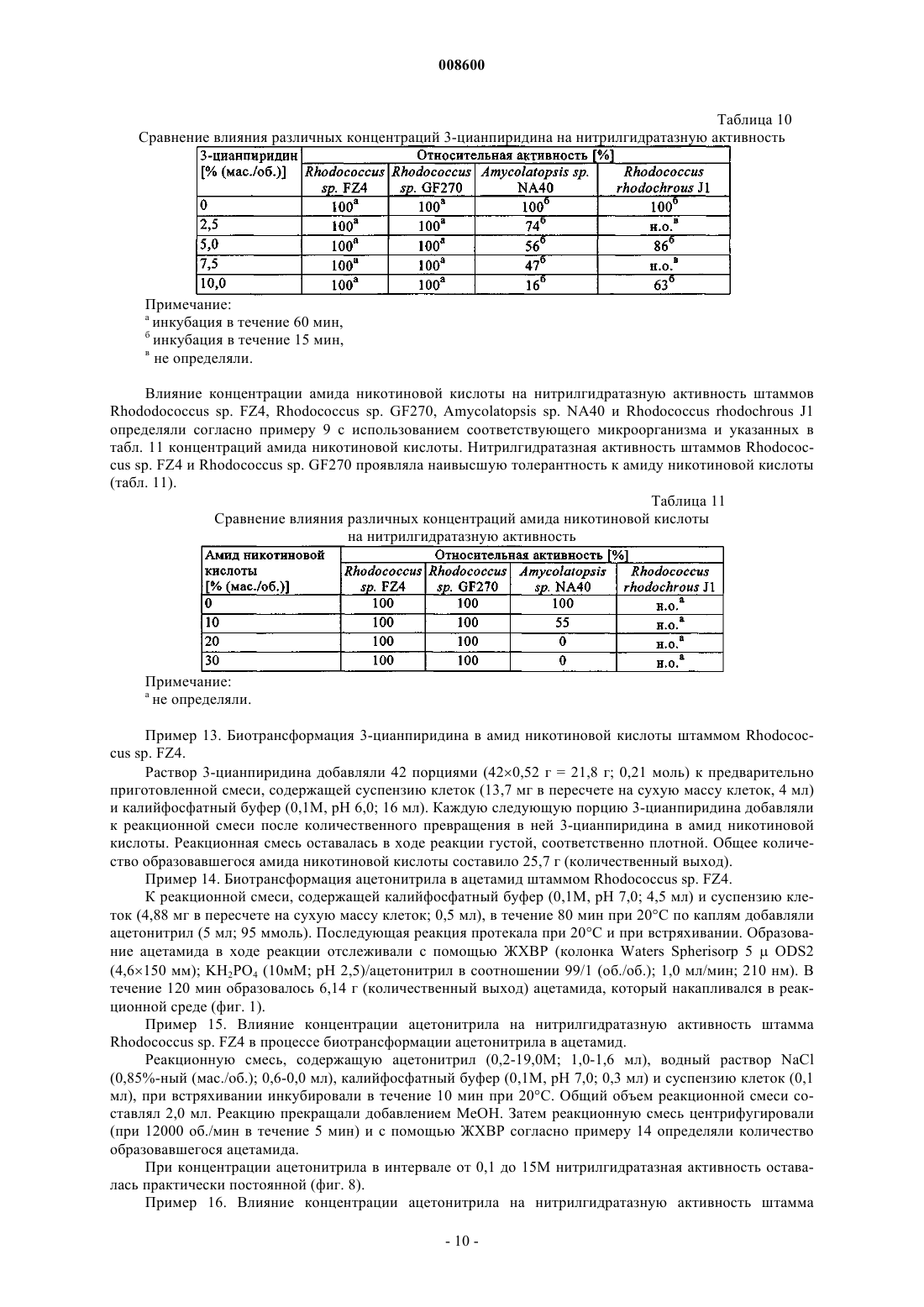
5. Способ по п.4, отличающийся тем, что в качестве нитрила используют 3-цианпиридин или ацетонитрил.
6. Способ по п.4 или 5, отличающийся тем, что превращение проводят при температуре от 5 до 50шС и значении рН от 5 до 10.
7. Применение микроорганизма по п.1 для уничтожения или утилизации отходов ацетонитрила.
Текст
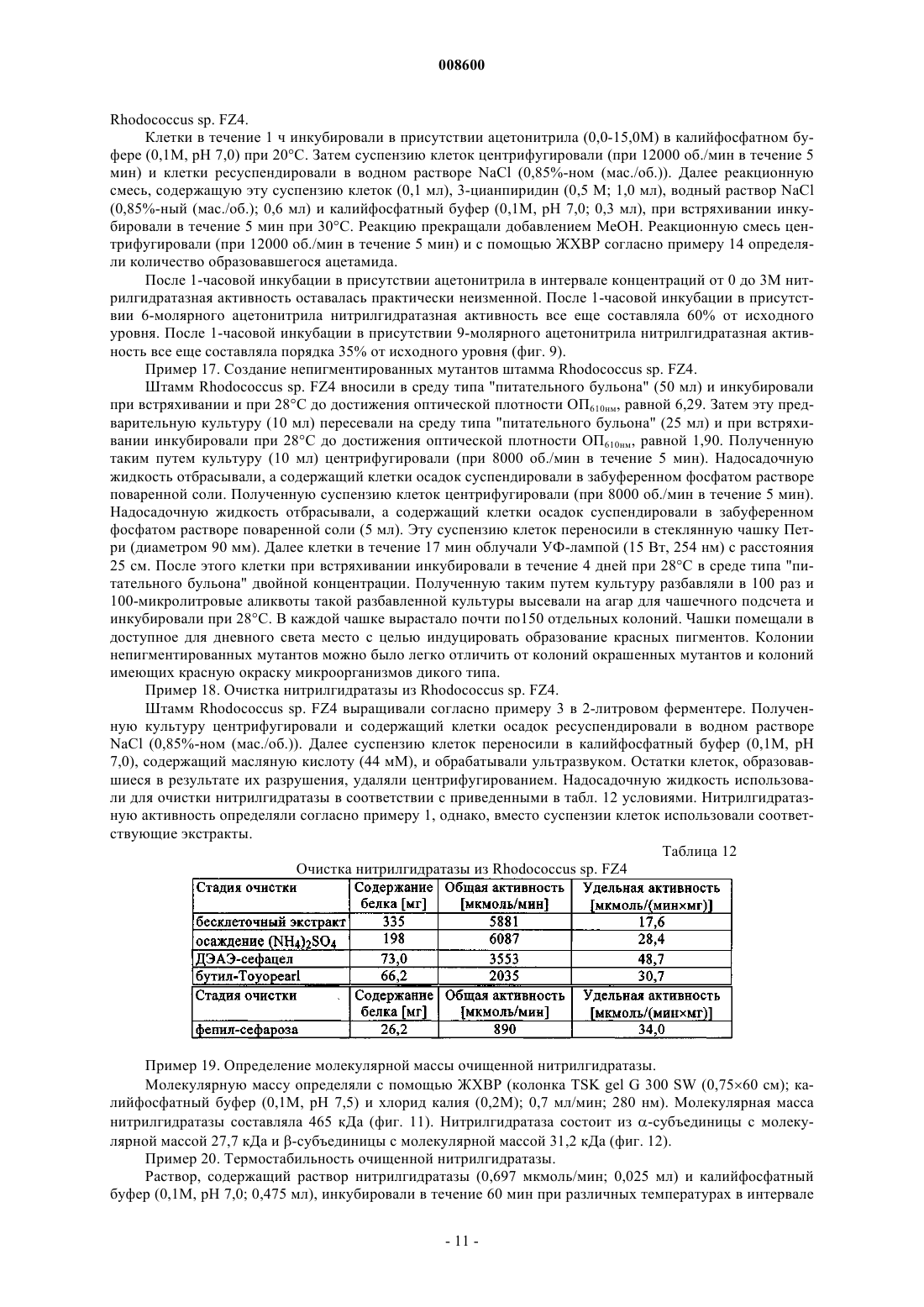
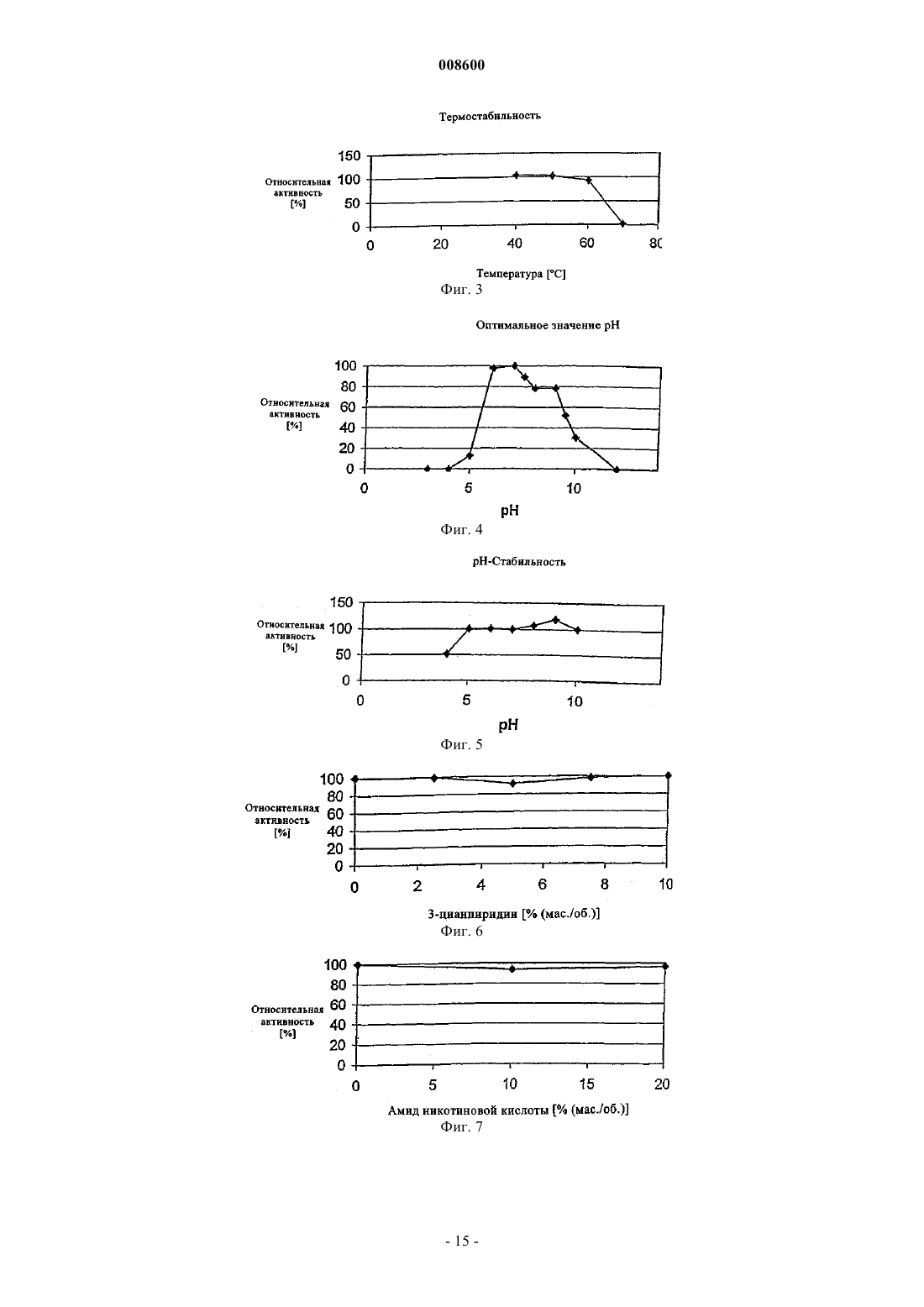
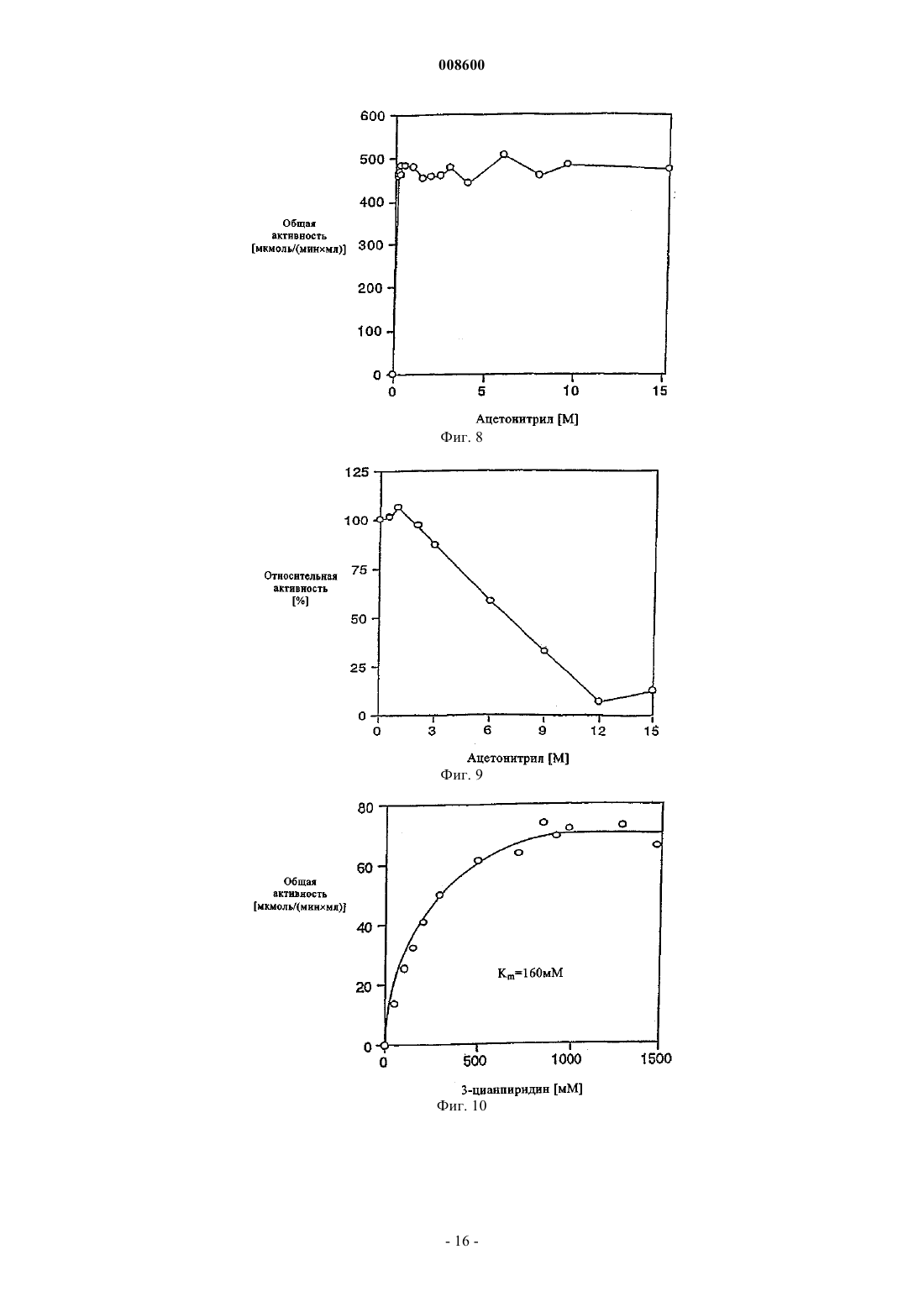
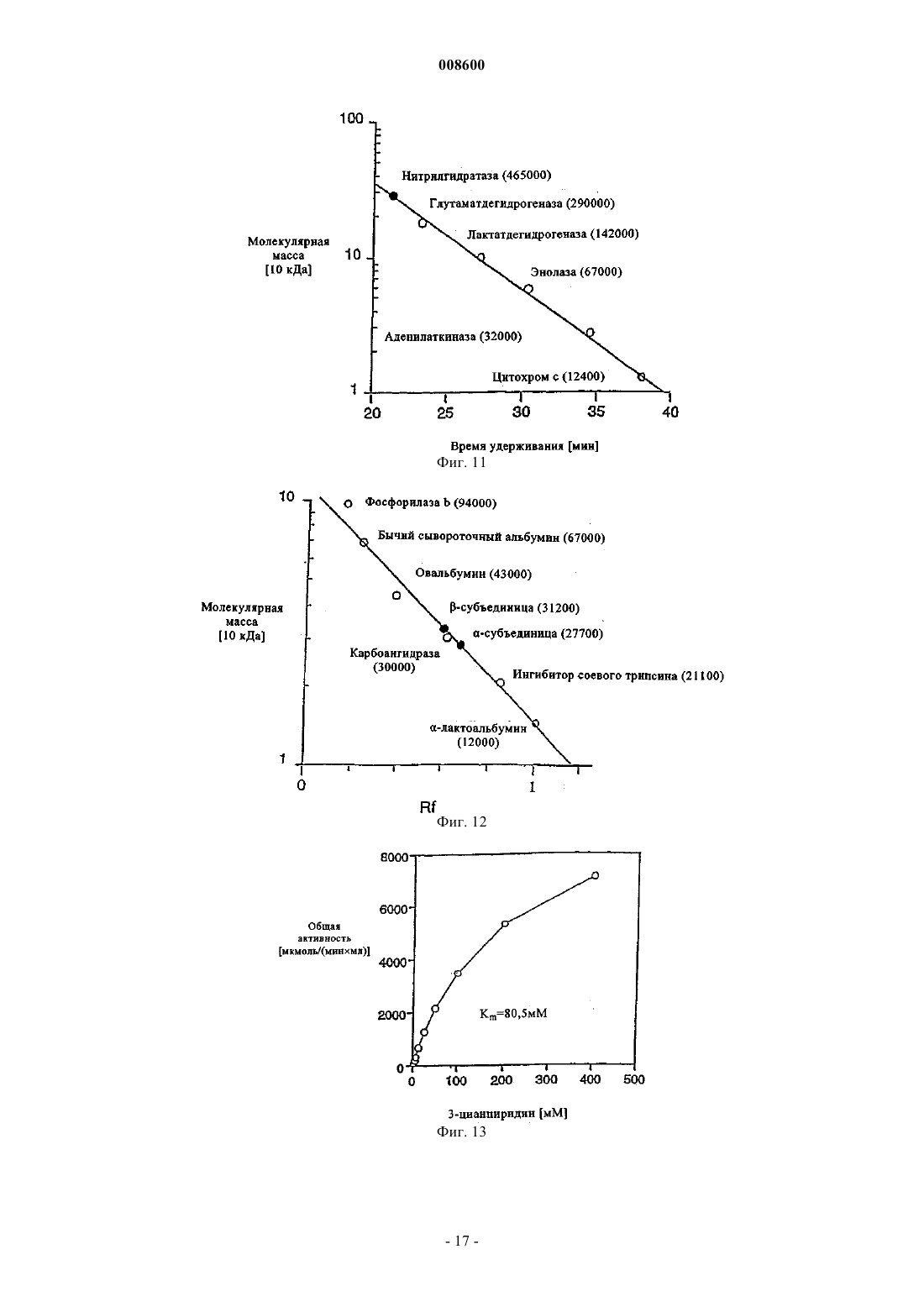
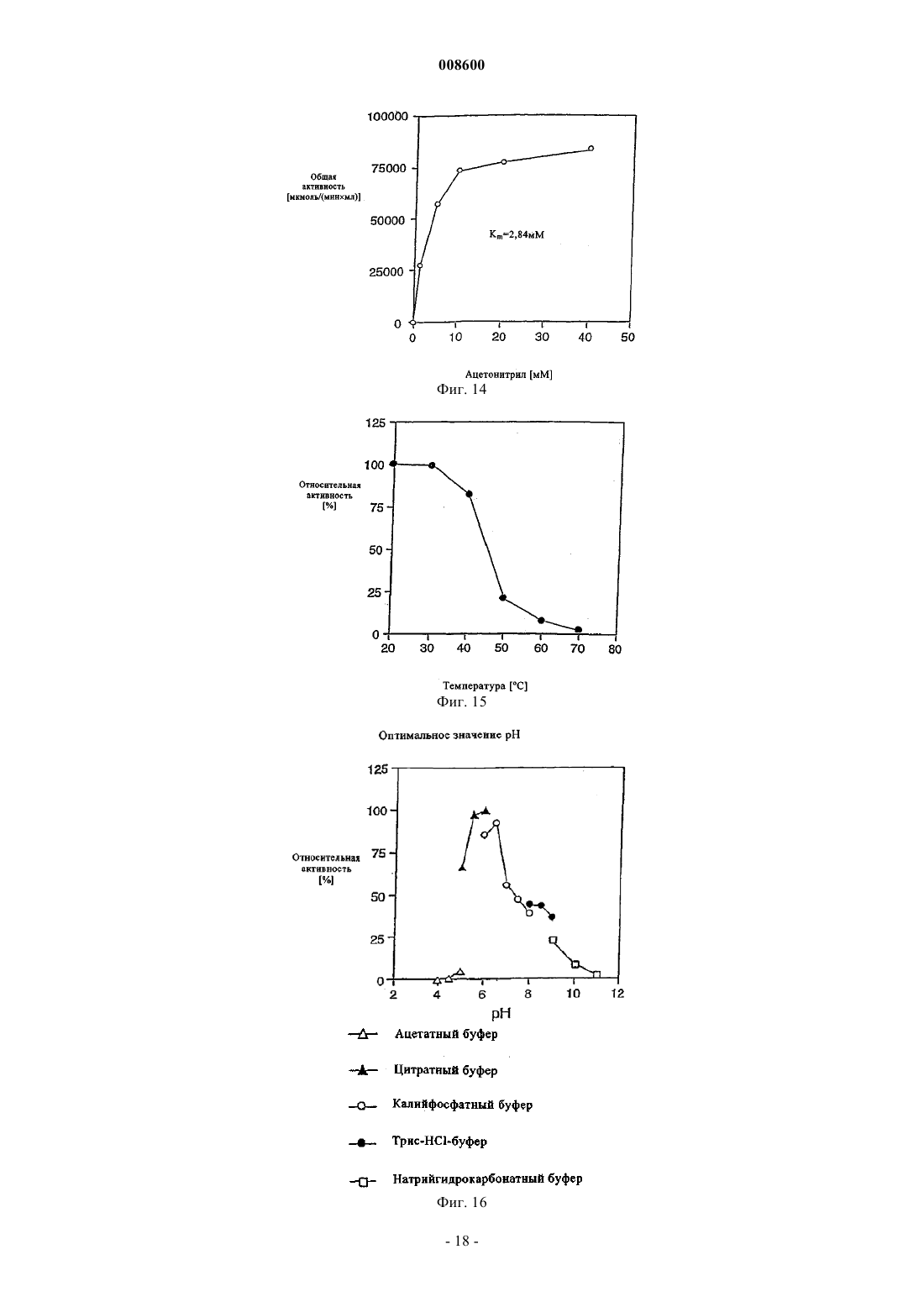
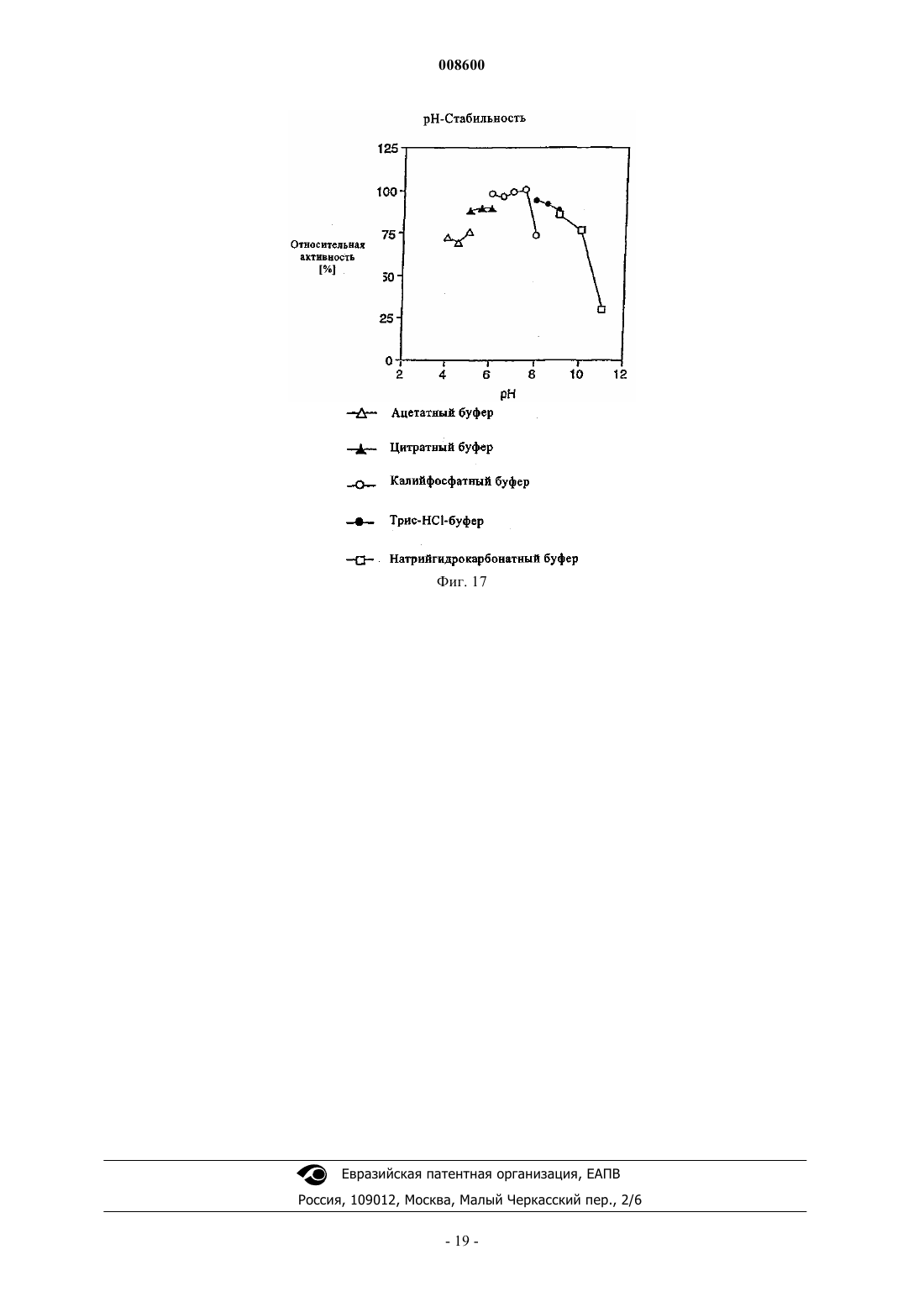
008600 Настоящее изобретение относится к микроорганизмам, которые способны оставаться толерантными к ацетонитрилу при его присутствии по меньшей мере в 3-молярных концентрациях, к ферменту с нитрилгидратазной активностью, к способу получения амидов с применением таких микроорганизмов, соответственно фермента, а также к применению этих микроорганизмов для уничтожения (утилизации) отходов ацетонитрила. В настоящее время известно уже достаточно большое число биотехнологических методов получения амидов, таких, например, как амид никотиновой кислоты, который представляет собой незаменимый для животных и человека витамин из семейства витаминов В. Так, например, в ЕР-А 0307926 описан способ превращения 3-цианпиридина в амид никотиновой кислоты с помощью микроорганизмов Rhodococcus rhodochrous J1. Недостаток этого способа состоит в том, что микроорганизмы Rhodococcus rhodochrous J1 имеют красный цвет, и поэтому конечный продукт также приобретает соответствующую окраску. Помимо этого такой микроорганизм характеризуется высоким Km-значением (константа Михаэлиса) для используемого в качестве субстрата 3-цианпиридина, а также обладает низкой толерантностью к температуре и низкой толерантностью к 3-цианпиридину. Помимо этого в заявке WO 99/05306 описан способ получения амида никотиновой кислоты, исходя из соответствующего нитрила с помощью микроорганизмов родов Rhodococcus, Amycolatopsis и Actinomadura. Недостаток этого известного способа состоит в том, что используемые при его осуществлении микроорганизмы рода Amycolatopsis инактивируются при повышенных температурах. Эти микроорганизмы обладают, кроме того, низкой толерантностью к 3-цианпиридину и амиду никотиновой кислоты. Микроорганизмы рода Rhodococcus характеризуются высоким Km-значением для 3-цианпиридина и малой теплостойкостью. Поэтому реализация описанного в указанной заявке способа в промышленном масштабе представляется экономически нецелесообразной. В основу настоящего изобретения была положена задача предложить микроорганизмы, которые были бы более устойчивыми, характеризовались бы более низким Km-значением для такого субстрата,как, например, 3-цианпиридин, и в соответствии с этим обеспечивали бы рентабельное получение амидов способом, при осуществлении которого соответствующий амид можно было бы выделять с исключительно высоким выходом и с высокой степенью чистоты. Указанная задача решается с помощью микроорганизмов согласно п.1 формулы изобретения, с помощью фермента согласно п.5 или 7 и с помощью способа согласно п.8. Предлагаемые в изобретении микроорганизмы получают путем соответствующего отбора, например, из образцов почвы, из ила (шлама) или сточных вод с помощью традиционных микробиологических методов. Подобный отбор микроорганизмов целесообразно проводить путем их выращивания или культивирования в присутствии пиридинальдоксима общей формулы или нитрилов в качестве источника углерода и в присутствии ионов кобальта и, например, дрожжевого экстракта и/или аммониевых солей. Затем из полученных культур отбирают те микроорганизмы, которые способны оставаться толерантными к ацетонитрилу при его присутствии по меньшей мере в 3-молярной концентрации и которые способны превращать нитрилы, такие, например, как 3-цианпиридин и ацетонитрил, в соответствующий амид. В качестве пиридинальдоксимов можно использовать пиридин-2-, пиридин-3- или пиридин-4 альдоксим. Для отбора соответствующих микроорганизмов могут использоваться также прежде всего те нитрилы, которые при последующей биотрансформации должны использоваться в качестве субстрата, например ацетонитрил (нитрил уксусной кислоты), пропионитрил, бутиронитрил, нитрил кротоновой кислоты, нитрил адипиновой кислоты и нитрил малоновой кислоты. В качестве источника ионов кобальта предпочтительно использовать так называемые "генерирующие ионы кобальта кобальтовые соединения", например Со 2+- или Со 3+-соли, такие как хлориды кобальта, сульфаты кобальта и ацетаты кобальта. Предпочтительно в качестве кобальтового соединения использовать Со 2+-соль, такую, например, как CoCl2. Вместе с тем микроорганизмы можно культивировать и совместно с металлическим кобальтом или иными его соединениями. Обычно кобальт или его соединения добавляют в среду для выращивания в количестве от 1 до 30 мг/л, предпочтительно от 1 до 20 мг/л. В качестве аммониевых солей можно использовать, например, фосфаты аммония, такие как(NH4)2HPO4 или (NH4)2PO4. Микроорганизмы перед использованием их собственно в процессе биотрансформации культивируют в соответствующих средах. Составы пригодных для этой цели культуральных сред приведены, например, ниже в настоящем описании в табл. 3 или 5. Обычно микроорганизмы выращивают при температуре от 20 до 40 С и при значении рН от 5 до 8,предпочтительно при температуре от 25 до 35 С и значении рН от 6 до 7,5. В процессе выращивания микроорганизмов целесообразно индуцировать активные ферменты, т.е.-1 008600 нитрилгидратазы, добавлением соответствующего индуктора ферментов. В качестве таких индукторов ферментов могут использоваться насыщенные или ненасыщенные алифатические нитрилы или соответствующие амиды. В качестве алифатических нитрилов можно применять все С 2-7 алканнитрилы, такие, например, как бутиронитрил, изобутиронитрил, нитрил валериановой кислоты либо нитрил изовалериановой кислоты, или С 3-7 алкеннитрилы, такие, например, как метакрилнитрил или нитрил кротоновой кислоты. В качестве алифатических амидов можно применять все С 2-7 алканамиды, такие, например, как бутирамид, изобутирамид, амид валериановой кислоты или амид пропионовой кислоты, или С 3-7 алкенамиды, такие, например, как метакриламид или амид кротоновой кислоты. Предпочтительными индукторами ферментов являются метакриламид, бутирамид, изобутирамид, амид валериановой кислоты, метакрилнитрил, амид кротоновой кислоты, бутиронитрил и изобутиронитрил. Наиболее предпочтительно использовать в качестве индуктора ферментов метакрилнитрил. Как уже указывалось выше, предлагаемые в изобретении микроорганизмы остаются толерантными к ацетонитрилу при его присутствии по меньшей мере в 3-молярной концентрации. Подобная способность сохранять толерантность к ацетонитрилу проявляется в том, что ферментативная активность остается стабильной после 1-часовой инкубации с 3-молярным ацетонитрилом в 0,1-молярном калийфосфатном буфере при рН, равном 7,0, и температуре 20 С, т.е. снижается максимум на 10%. Предпочтительные микроорганизмы в течение 1 ч остаются в описанных выше условиях толерантными к ацетонитрилу при его присутствии по меньшей мере в 6-молярной концентрации при уменьшении ферментативной активности максимум на 50%. Наиболее предпочтительные микроорганизмы в течение 1 ч остаются в описанных выше условиях толерантными к ацетонитрилу при его присутствии по меньшей мере в 9 молярной концентрации при уменьшении ферментативной активности максимум на 70%. У особо предпочтительных микроорганизмов их ферментативная активность остается стабильной даже после инкубации в течение нескольких минут с 15- и 19-молярным ацетонитрилом (соответственно с чистым ацетонитрилом). Так, в частности, снижение ферментативной активности при инкубации с 15 молярным ацетонитрилом составляет по истечении 10 мин менее 10%. Предлагаемые в изобретении микроорганизмы обладают высокой термостабильностью, т.е. повышенной стабильностью при высоких температурах по сравнению с известными до настоящего времени микроорганизмами. Снижение ферментативной активности предлагаемых в изобретении микроорганизмов после 1-часовой инкубации в 0,1-молярном калийфосфатном буфере с рН 7,0 при 60 С предпочтительно составляет максимум 10%, а снижение ферментативной активности после 2-часовой инкубации в указанных выше условиях составляет максимум 40%. Под ферментативной активностью в контексте настоящего изобретения подразумевается нитрилгидратазная активность, прежде всего нитрилгидратазная активность в отношении 3-цианпиридина, служащего субстратом. К числу других положительных свойств предлагаемых в изобретении микроорганизмов относятся высокая толерантность к 3-цианпиридину, который является предпочтительным для применения субстратом, и к образующемуся из него продукту, которым является амид никотиновой кислоты, а также низкое Km-значение для 3-цианпиридина. Еще одним положительным свойством предлагаемых в изобретении микроорганизмов, которое следует отметить особо, является их способность аккумулировать ацетамид в более высокой концентрации по сравнению с концентрацией, соответствующей насыщенному при 30 С раствору ацетамида (примерно 220-230 г ацетамида в 100 мл воды). Предпочтительные микроорганизмы относятся к роду Rhodococcus. К наиболее предпочтительным микроорганизмам относятся штаммы Rhodococcus sp. FZ4 и их функционально эквивалентные варианты и мутанты. Под функционально эквивалентными вариантами и мутантами при этом имеются в виду таковые, которые остаются толерантными к ацетонитрилу при его присутствии по меньшей мере в 3 молярных концентрациях. Особо предпочтительны "непигментированные" штаммы Rhodococcus, т.е. штаммы, не имеющие красной окраски, которая может привести к соответствующему изменению цвета целевого продукта. При необходимости подобные штаммы можно достаточно легко получить из пигментообразующих микроорганизмов в результате мутагенеза, инициируемого воздействием УФ-излучения или химических мутагенов. В соответствии с Будапештским договором штамм Rhodococcus sp. FZ4 был депонирован 11 июля 2000 г. в Немецкой коллекции микроорганизмов и клеточных культур (Deutsche Sammlung von Mikroorganismen und Zellkulturen GmbH (DSMZ, Mascheroder Weg 1b, D-38124 Braunschweig, под регистрационным номером DSM 13597. Этот микроорганизм на основе его идентификационных данных не удалось отнести ни к одному известному до настоящего времени виду Rhodococcus, и поэтому он был выделен в новый вид. Функционально эквивалентные варианты и мутанты штамма Rhodococcus sp. FZ4 могут возникать в результате спонтанного мутагенеза либо их можно создавать искусственно воздействием УФ-излучения или химических мутагенов. Предпочтительные варианты и мутанты штамма Rhodococcus sp. FZ4 являются "непигментированными", т.е. не имеют собственной красной окраски, которая может привести к соответствующему изменению цвета целевого продукта. Ферментативный экстракт можно получать, например, путем лизиса микроорганизмов, в частности-2 008600 с помощью ультразвука, устройства типа "френч-пресс" либо метода, основанного на использовании лизоцима. Предлагаемые в изобретении ферменты с нитрилгидратазной активностью получают из описанных выше микроорганизмов. Предпочтительно при этом получать их из микроорганизмов рода Rhodococcus,прежде всего из микроорганизмов Rhodococcus sp. FZ4 (DSM 13597). Такие ферменты обладают, в частности, следующими свойствами: а) их Km-значение для являющегося субстратом ацетонитрила составляет 2,841,00 мМ, а для являющегося субстратом 3-цианпиридина - 80,515,0 мМ, в каждом случае в 0,05-молярном калийфосфатном буфере с рН 7,0 при 20 С; б) оптимальное для них значение рН составляет 6,51,0 при 20 С в 0,05-молярном калийфосфатном буфере. Такие ферменты прежде всего имеют в) естественную молекулярную массу, составляющую по данным ЖХВР-анализа 46550 кДа. Собственно процесс биотрансформации можно проводить с использованием описанных выше микроорганизмов, полученного из этих микроорганизмов ферментативного экстракта или выделенного фермента. Предпочтительно проводить биотрансформацию с использованием микроорганизмов Rhodococcussp. FZ4. В качестве субстратов для биотрансформации могут использоваться нитрилы общей формулыII. В этой общей формуле II заместитель R1 представляет собой С 1-6 алкильную группу, С 2-6 алкенильную группу или группу общей формулы IV В такой общей формуле IV X обозначает атом азота или группу -СН=, а заместители R2 и R3 независимо друг от друга обозначают атом водорода, атом галогена, С 1-6 алкильную группу или С 2-6 алкенильную группу. В качестве С 1-6 алкильной группы может использоваться метил, этил, пропил, изопропил, бутил,трет-бутил, изобутил, пентил и его изомеры, а также гексил и его изомеры. В качестве С 2-6 алкенильной группы может использоваться, например, винил, аллил, 1-пропен-1-ил или 1-пропен-2-ил. В качестве атома галогена может использоваться атом F, Cl, Вr или I. Предпочтительными представителями нитрилов общей формулы II являются ацетонитрил, бутиронитрил, акрилонитрил, пропионитрил, нитрил кротоновой кислоты, 2-цианпиридин, 3-цианпиридин, 4 цианпиридин, бензонитрил, фторбензонитрил, хлорбензонитрил и бромбензонитрил. Предпочтительными в большинстве случаев субстратами являются ацетонитрил и 3-цианпиридин. Процесс биотрансформации предпочтительно проводить при однократном или непрерывном добавлении субстрата. Концентрация используемого субстрата зависит от его растворимости, что хорошо известно специалистам в данной области техники. Процесс биотрансформации предпочтительно далее проводить с использованием покоящихся (не растущих) клеток. В качестве сред в процессе биотрансформации могут использоваться обычно применяемые в этих целях среды, например низкомолярный фосфатный буфер, HEPES-буфер (HEPES = N-2-гидроксиэтилпиперазин-N'-2-этансульфоновая кислота), цитратный буфер и боратный буфер. Под низкомолярным фосфатным буфером имеется в виду предпочтительно 0,01-0,5-молярный фосфатный буфер, наиболее предпочтительно 0,05-0,25-молярный фосфатный буфер. Процесс биотрансформации предпочтительно проводить при температуре от 5 до 50 С, наиболее предпочтительно при температуре от 20 до 40 С. Предпочтительное значение рН составляет от 5 до 10,наиболее предпочтительно от 6 до 7,5. По завершении процесса превращения нитрила общей формулы II соответствующие образовавшиеся из него амиды общей формулыIII,1 в которой R имеет указанные выше значения, можно выделять, при необходимости после отделения клеток, переработкой по обычным методам, таким, например, как кристаллизация или распылительная сушка. Еще одним объектом настоящего изобретения является применение вышеописанных микроорганизмов, прежде всего рода Rhodococcus, для уничтожения отработанного ацетонитрила. Ацетонитрил представляет собой растворитель, который находит применение, например, в жидкостной хроматографии высокого разрешения (ЖХВР), и поэтому после его использования и направления в отход подлежит утилизации. Максимальная концентрация ацетонитрила, который после его использования в тех или иных целях и направления в отход подлежит утилизации с применением предлагаемых в изобретении микроорганизмов, может достигать 19 М, что соответствует чистому ацетонитрилу. Пред-3 008600 почтительно, однако, использовать раствор, соответственно суспензию ацетонитрила 0,25-15,0-молярной, более предпочтительно 1-10-молярной, концентрации. Процесс утилизации отработанного ацетонитрила с применением предлагаемых в изобретении микроорганизмов предпочтительно проводить при температуре от 5 до 50 С, более предпочтительно при температуре от 20 до 40 С. В ходе этого процесса значение рН предпочтительно должно составлять от 5 до 10, более предпочтительно от 6 до 8. Продолжительность переработки отработанного ацетонитрила, в ходе которой ацетонитрил превращается в ацетамид, зависит от концентрации утилизуемого ацетонитрила. Так, например, при получении раствора или суспензии ацетамида 9,5-молярной концентрации это превращение длится примерно 2 ч при значении рН, равном 7,0, и температуре около 20 С. Идентификация штамма FZ4 (DSM 13597)A) Хемотаксономические признаки ("маркеры"). 1. Диагностическая аминокислота пептидогликана: мезодиаминопимелиновая кислота. 2. Миколовые кислоты: присутствуют миколовые кислоты с цепью длиной от C40 до C48. 3. Набор жирных кислот: присутствуют линейные, насыщенные и ненасыщенные жирные кислоты,а также характерно высокое содержание туберкулостеариновой кислоты. На основе набора жирных кислот штамм FZ4 был идентифицирован как относящийся к роду Rhodococcus. Б) Обычные признаки ("маркеры"). Клетки штамма FZ4 по их макроскопическому внешнему виду и морфологии были сходны сRhodococcus rhodochrous. Колонии штамма FZ4 имеют розоватую окраску (RAL 3022), а в молодых культурах развивались ветвящиеся гифы, которые развивались в палочки и кокки. Штамм FZ4 на основе хемотаксономических и обычных признаков был идентифицирован как принадлежащий к виду Rhodococcus rhodochrous, хотя и с малым коэффициентом корреляции.B) Анализ первых 500 оснований 16S рДНК. Сходство последовательности первых 500 оснований 16S рДНК с аналогичной последовательностью штамма Rhodococcus rhodochrous DSM 43241, являющегося типичным представителем видаRhodococcus rhodochrous, составляет лишь 97,7%, а сходство с аналогичной последовательностью другого эталонного штамма Rhodococcus rhodochrous составляет 99,1%. Поскольку сходство между последовательностями первых 500 оснований 16S рДНК штамма FZ4 и штамма Rhodococcus rhodochrous DSM 43241 составляло менее 99,5%, штамм FZ4 не удалось идентифицировать как принадлежащий к видуRhodococcus rhodochrous. Поэтому штамм FZ4 был выделен в новый вид в роде Rhodococcus. Чертежи На прилагаемых к описанию чертежах показано на фиг. 1 - диаграмма, иллюстрирующая процесс биотрансформации ацетонитрила в ацетамид покоящимися клетками штамма Rhodococcus sp. FZ4,на фиг. 2 - диаграмма, отражающая влияние температуры на нитрилгидратазную активность штамма Rhodococcus sp. FZ4 в покоящихся клетках и позволяющая определить оптимальное значение температуры,на фиг. 3 - диаграмма, отражающая термостабильность нитрилгидратазной активности штаммаRhodococcus sp. FZ4 в покоящихся клетках,на фиг. 4 - диаграмма, отражающая влияние величины рН на нитрилгидратазную активность штамма Rhodococcus sp. FZ4 в покоящихся клетках и позволяющая определить оптимальное значение рН,на фиг. 5 - диаграмма, отражающая рН-стабильность нитрилгидратазной активности штаммаRhodococcus sp. FZ4 в покоящихся клетках,на фиг. 6 - диаграмма, отражающая толерантность нитрилгидратазной активности штаммаRhodococcus sp. FZ4 в покоящихся клетках к 3-цианпиридину,на фиг. 7 - диаграмма, отражающая толерантность нитрилгидратазной активности штаммаRhodococcus sp. FZ4 в покоящихся клетках к амиду никотиновой кислоты,на фиг. 8 - диаграмма, отражающая влияние концентрации ацетонитрила на нитрилгидратазную активность штамма Rhodococcus sp. FZ4 в покоящихся клетках в процессе биотрансформации ацетонитрила в ацетамид,на фиг. 9 - диаграмма, отражающая влияние концентрации ацетонитрила на нитрилгидратазную активность штамма Rhodococcus sp. FZ4 в покоящихся клетках,на фиг. 10 - диаграмма, отражающая зависимость нитрилгидратазной активности штаммаRhodococcus sp. FZ4 в покоящихся клетках от концентрации 3-цианпиридина,на фиг. 11 - диаграмма, отражающая взаимосвязь между отложенными на логарифмической шкале молекулярными массами нитрилгидратазы и эталонных белков и соответствующим временем удерживания при ЖХВР,на фиг. 12 - диаграмма, отражающая взаимосвязь между отложенными на логарифмической шкале молекулярными массами субъединиц нитрилгидратазы и эталонных белков и соответствующим Rfзначением при электрофорезе в ПААГ-ДСН,на фиг. 13 - график, отражающий зависимость активности очищенной нитрилгидратазы из штаммаRhodococcus sp. FZ4 от концентрации 3-цианпиридина,на фиг. 14 - график, отражающий зависимость активности очищенной нитрилгидратазы из штаммаRhodococcus sp. FZ4 от концентрации ацетонитрила,на фиг. 15 - график, отражающий термостабильность очищенной нитрилгидратазы из штаммаRhodococcus sp. FZ4,на фиг. 16 - диаграмма, на которой представлено оптимальное значение рН для очищенной нитрилгидратазы из штамма Rhodococcus sp. FZ4, и на фиг. 17 - диаграмма, на которой представлена рН-стабильность очищенной нитрилгидратазы из штамма Rhodococcus sp. FZ4. Пример 1. Определение нитрилгидратазной активности. Для определения нитрилгидратазной активности реакционную смесь, содержащую 3-цианпиридин(1,0 М; 1,0 мл), калийфосфатный буфер (0,1 М, рН 7,0; 0,5 мл) и суспензию клеток (0,5 мл), инкубировали при перемешивании и при 20 С в течение 5 мин. Реакцию прекращали добавлением НСl (5 М; 0,1 мл). После фильтрации реакционной смеси (через фильтр с размером пор 0,2 мкм) количество образовавшегося амида никотиновой кислоты определяли с помощью ЖХВР (колонка Waters Spherisorb 5ODS2(4,6150 мм); KН 2 РО 4/Н 3 РО 4 (10 мМ; рН 2,8)/ацетонитрил в соотношении 9:1 (об./об.); 1 мл/мин; 230 нм). Общую активность выражали как количество образовавшегося амида никотиновой кислоты в мкмолях/(минмл), а удельную активность выражали как количество образовавшегося амида никотиновой кислоты в мкмолях/(минмлОП 610 нм). Пример 2. Выделение штамма Rhodococcus sp. FZ4 (DSM 13597). Как описано в Arch. Microbiol. 170 (1998), cc. 85-90, штамм Rhodococcus sp. YH3-3 (TPU 3453) метаболизирует 3-пиридинальдоксим через 3-цианпиридин и амид никотиновой кислоты до никотиновой кислоты. В этом случае альдоксимдегидратазную активность, а также нитрилгидратазную и амидазную активность штамма Rhodococcus sp. YH3-3 (TPU 3453) индуцировали различными альдоксимами и нитрилами. Различные образцы почвы вносили в обогатительную среду, состав которой указан ниже в табл. 1, и инкубировали в течение 7-10 дней при 37 С. Полученные таким путем культуры пересевали в среду того же состава и инкубировали еще в течение 7-10 дней при 37 С. Эту процедуру повторяли трижды. Затем культуры разбавляли и высевали на чашки. После 5-дневной инкубации содержимого чашек при 37 С получали отдельные колонии. Эти отдельные колонии исследовали согласно примеру 1 на наличие нитрилгидратазной активности. Таким путем выделили штамм Rhodococcus sp. FZ4 (DSM 13597). Вместо 3 пиридинальдоксима в качестве источника углерода можно также использовать такие нитрилы, как ацетонитрил, пропионитрил, бутиронитрил, нитрил кротоновой кислоты, нитрил адипиновой кислоты и нитрил малоновой кислоты. Таблица 1 Состав обогатительной среды Объем среды добавлением воды доводят до 1 л (рН 7,0). Пример 3. Влияние кофакторов на нитрилгидратазную активность штамма Rhodococcus sp. FZ4 в процессе выращивания. Штамм Rhodococcus sp. FZ4 (DSM 13597) вносили в среду для выращивания предварительных культур, состав которой указан в табл. 2, и при встряхивании инкубировали в течение 1-2 дней при 28 С. Полученную предварительную культуру пересевали в базальную среду, состав которой указан в табл. 3 и которая содержала либо CoCl2, либо FeSO4, и при встряхивании инкубировали в течение 2-3 дней при 28 С. Нитрилгидратазную активность определяли согласно примеру 1. Полученные результаты приведены в табл. 4. Нитрилгидратазная активность проявлялась только при культивировании штамма-5 008600 Таблица 2 Состав среды для выращивания предварительных культур Объем среды добавлением воды доводят до 1 л (рН 7,0). Таблица 3 Состав базальной среды Объем среды добавлением воды доводят до 1 л (рН 6,8). Таблица 4 Влияние кофакторов на нитрилгидратазную активность штамма в процессе выращивания Пример 4. Влияние индукторов на нитрилгидратазную активность штамма Rhodococcus sp. FZ4 в процессе выращивания. Штамм Rhodococcus sp. FZ4 (DSM 13597) вносили в среду для выращивания предварительных культур, состав которой указан в табл. 2, и при встряхивании инкубировали в течение 1-2 дней при 28 С. Полученную предварительную культуру пересевали в культуральную среду, состав которой указан в табл. 5 и которая содержала различные индукторы, и при встряхивании инкубировали в течение 3 дней при 28 С. Нитрилгидратазную активность определяли согласно примеру 1. Полученные результаты приведены в табл. 5. Экспрессия нитрилгидратазы штамма Rhodococcus sp. FZ4 происходила в процессе выращивания только в присутствии одного индуктора. Таблица 5 Состав культуральной среды Объем среды добавлением воды доводят до 1 л (рН 7,0).-6 008600 Таблица 6 Влияние индукторов на нитрилгидратазную активность Пример 5. Выращивание штамма Rhodococcus sp. FZ4. Штамм Rhodococcus sp. FZ4 вносили в среду для выращивания предварительных культур, состав которой указан в табл. 2, и при встряхивании инкубировали в течение 1-2 дней при 28 С. Полученную предварительную культуру пересевали в культуральную среду, состав которой указан в табл. 5 и которая содержала в качестве индуктора метакриламид в концентрации 6 г/л, и при встряхивании инкубировали в течение 3 дней при 28 С. Через 48 ч дополнительно добавляли метакриламид (0,2% (об./об В описанных ниже примерах 6-13 использовали покоящиеся клетки штамма Rhodococcus sp. FZ4. Пример 6. Субстратная специфичность нитрилгидратазной активности штамма Rhodococcus sp.FZ4. Нитрилгидратазную активность штамма Rhodococcus sp. FZ4 при использовании различных субстратов определяли согласно примеру 1, применяя вместо 3-цианпиридина соответствующий субстрат и соответственно изменяя условия проведения ЖХВР в зависимости от используемого субстрата. Данные о субстратной специфичности нитрилгидратазной активности штамма Rhodococcus sp. FZ4 в сравнении с субстратной специфичностью нитрилгидратазной активности штамма Rhodococcus rhodochrous J1 приведены в табл. 7.-7 008600 Таблица 7 Сравнение субстратной специфичности нитрилгидратазной активности штамма Rhodococcus sp. FZ4 и штамма Rhodococcus rhodochrous J1 Пример 7. Оптимальная температура для нитрилгидратазной активности штамма Rhodococcus sp.FZ4 и ее термостабильность. Нитрилгидратазную активность определяли согласно примеру 1 при различных температурах в интервале от 20 до 70 С. Оптимальное значение температуры для нитрилгидратазной активности приходилось на 60 С (фиг. 2). Для определения термостабильности нитрилгидратазной активности суспензию клеток инкубировали в течение 15 мин при различных температурах в интервале от 40 до 70 С. После этого нитрилгидратазную активность определяли согласно примеру 1 при 20 С. После 15-минутной инкубации при температурах в интервале от 40 до 60 С нитрилгидратазная активность соответствовала исходному уровню(фиг. 3). Пример 8. Оптимальное значение рН для нитрилгидратазной активности штамма Rhodococcus sp.FZ4 и ее рН-стабильность. Нитрилгидратазную активность определяли согласно примеру 1 при различных значениях рН в интервале от 3 до 12 с использованием различных буферов (0,1-молярных). Оптимальные значения рН для нитрилгидратазной активности приходились на интервал значений от 6 до 7 (фиг. 4). Для определения рН-стабильности нитрилгидратазной активности суспензию клеток инкубировали при 20 С в течение 24 ч при различных значениях рН в интервале от 4 до 10. После этого суспензию клеток центрифугировали. Отделенные клетки промывали и ресуспендировали в калийфосфатном буфере(0,1 М, рН 7,0). Нитрилгидратазную активность определяли согласно примеру 1. После 24-часовой инкубации при различных значениях рН в интервале от 5 до 10 нитрилгидратазная активность примерно соответствовала исходному уровню (фиг. 5). Пример 9. Влияние концентрации 3-цианпиридина на нитрилгидратазную активность штаммаRhodococcus sp. FZ4. Суспензию клеток инкубировали в течение 60 мин при 20 С в присутствии различных концентраций 3-цианпиридина в интервале от 0 до 10% (мас./об.). Затем клетки отделяли, промывали и ресуспендировали в калийфосфатном буфере (0,1 М, рН 7,0). Нитрилгидратазную активность определяли согласно примеру 1. После 60-минутной инкубации в присутствии различных концентраций 3-цианпиридина в интервале от 0 до 20% (мас./об.) нитрилгидратазная активность примерно соответствовала исходному уровню (фиг. 6). Пример 10. Влияние концентрации амида никотиновой кислоты на нитрилгидратазную активность штамма Rhodococcus sp. FZ4. Суспензию клеток инкубировали в течение 24 ч при 20 С в присутствии различных концентраций амида никотиновой кислоты в интервале от 0 до 20% (мас./об.). Затем клетки отделяли, промывали и ресуспендировали в 0,1-молярном калийфосфатном буфере (0,1 М, рН 7,0). Нитрилгидратазную активность определяли согласно примеру 1. После 24-часовой инкубации в присутствии различных концентраций амида никотиновой кислоты в интервале от 0 до 20% (мас./об.) нитрилгидратазная активность примерно соответствовала исходному уровню (фиг. 7). Пример 11. Определение Km-значения для 3-цианпиридина у нитрилгидратазы штамма Rhodococcus(0,01 мл), при встряхивании инкубировали в течение 10 мин при 30 С. Общий объем реакционной смеси составлял в зависимости от концентрации 3-цианпиридина от 2,0 до 2,2 мл. Реакцию прекращали добавлением НСl (2 М; 0,1 мл). После центрифугирования реакционной смеси (при 12000 об./мин в течение 5-8 008600 мин) количество образовавшегося амида никотиновой кислоты определяли с помощью ЖХВР согласно примеру 1. Определенное таким путем Km-значение составляло 160 мМ (фиг. 10). Пример 12. Сравнение уровней нитрилгидратазной активности штамма Rhododoccus sp. FZ4 с уровнями нитрилгидратазной активности известных микроорганизмов Amycolatopsis sp. NA40, RhodococcusKm-значения для служащего субстратом 3-цианпиридина у нитрилгидратазной активности штаммов(DSM 11617, WO 99/05306) и Rhodococcus rhodochrous J1 определяли согласно примеру 11 с использованием соответствующего микроорганизма.Km-значения, полученные для штаммов Amycolatopsis sp.NA40 и Rhodococcus sp. FZ4, меньше значений, полученных для других микроорганизмов (табл. 8). Таблица 8 Сравнение Km-значений для служащего субстратом 3-цианпиридина Термостабильность нитрилгидратазной активности штаммов Rhododococcus sp. FZ4, Rhodococcussp. GF270, Amycolatopsis sp. NA40 и Rhodococcus rhodochrous J1 определяли согласно примеру 7 с использованием соответствующего микроорганизма и указанных в табл. 9 условий инкубации. Нитрилгидратазная активность штамма Rhodococcus sp. FZ4 проявляла наивысшую термостабильность по сравнению с нитрилгидратазной активностью других микроорганизмов. Таблица 9 Сравнение термостабильности нитрилгидратазной активности Влияние концентрации 3-цианпиридина на нитрилгидратазную активность штаммов Rhododococcussp. FZ4, Rhodococcus sp. GF270, Amycolatopsis sp. NA40 и Rhodococcus rhodochrous J1 определяли согласно примеру 9 с использованием соответствующего микроорганизма и указанных в табл. 10 концентраций 3-цианпиридина. Нитрилгидратазная активность штаммов Rhodococcus sp. FZ4 и Rhodococcus sp.GF270 проявляла наивысшую толерантность к 3-цианпиридину.-9 008600 Таблица 10 Сравнение влияния различных концентраций 3-цианпиридина на нитрилгидратазную активность Влияние концентрации амида никотиновой кислоты на нитрилгидратазную активность штаммовRhododococcus sp. FZ4, Rhodococcus sp. GF270, Amycolatopsis sp. NA40 и Rhodococcus rhodochrous J1 определяли согласно примеру 9 с использованием соответствующего микроорганизма и указанных в табл. 11 концентраций амида никотиновой кислоты. Нитрилгидратазная активность штаммов Rhodococcus sp. FZ4 и Rhodococcus sp. GF270 проявляла наивысшую толерантность к амиду никотиновой кислоты(табл. 11). Таблица 11 Сравнение влияния различных концентраций амида никотиновой кислоты на нитрилгидратазную активность Примечание: а не определяли. Пример 13. Биотрансформация 3-цианпиридина в амид никотиновой кислоты штаммом Rhodococcus sp. FZ4. Раствор 3-цианпиридина добавляли 42 порциями (420,52 г = 21,8 г; 0,21 моль) к предварительно приготовленной смеси, содержащей суспензию клеток (13,7 мг в пересчете на сухую массу клеток, 4 мл) и калийфосфатный буфер (0,1 М, рН 6,0; 16 мл). Каждую следующую порцию 3-цианпиридина добавляли к реакционной смеси после количественного превращения в ней 3-цианпиридина в амид никотиновой кислоты. Реакционная смесь оставалась в ходе реакции густой, соответственно плотной. Общее количество образовавшегося амида никотиновой кислоты составило 25,7 г (количественный выход). Пример 14. Биотрансформация ацетонитрила в ацетамид штаммом Rhodococcus sp. FZ4. К реакционной смеси, содержащей калийфосфатный буфер (0,1 М, рН 7,0; 4,5 мл) и суспензию клеток (4,88 мг в пересчете на сухую массу клеток; 0,5 мл), в течение 80 мин при 20 С по каплям добавляли ацетонитрил (5 мл; 95 ммоль). Последующая реакция протекала при 20 С и при встряхивании. Образование ацетамида в ходе реакции отслеживали с помощью ЖХВР (колонка Waters Spherisorp 5ODS2(4,6150 мм); KН 2 РО 4 (10 мМ; рН 2,5)/ацетонитрил в соотношении 99/1 (об./об.); 1,0 мл/мин; 210 нм). В течение 120 мин образовалось 6,14 г (количественный выход) ацетамида, который накапливался в реакционной среде (фиг. 1). Пример 15. Влияние концентрации ацетонитрила на нитрилгидратазную активность штаммаRhodococcus sp. FZ4 в процессе биотрансформации ацетонитрила в ацетамид. Реакционную смесь, содержащую ацетонитрил (0,2-19,0 М; 1,0-1,6 мл), водный раствор NaCl(0,85%-ный (мас./об.); 0,6-0,0 мл), калийфосфатный буфер (0,1 М, рН 7,0; 0,3 мл) и суспензию клеток (0,1 мл), при встряхивании инкубировали в течение 10 мин при 20 С. Общий объем реакционной смеси составлял 2,0 мл. Реакцию прекращали добавлением МеОН. Затем реакционную смесь центрифугировали(при 12000 об./мин в течение 5 мин) и с помощью ЖХВР согласно примеру 14 определяли количество образовавшегося ацетамида. При концентрации ацетонитрила в интервале от 0,1 до 15 М нитрилгидратазная активность оставалась практически постоянной (фиг. 8). Пример 16. Влияние концентрации ацетонитрила на нитрилгидратазную активность штаммаRhodococcus sp. FZ4. Клетки в течение 1 ч инкубировали в присутствии ацетонитрила (0,0-15,0 М) в калийфосфатном буфере (0,1 М, рН 7,0) при 20 С. Затем суспензию клеток центрифугировали (при 12000 об./мин в течение 5 мин) и клетки ресуспендировали в водном растворе NaCl (0,85%-ном (мас./об Далее реакционную смесь, содержащую эту суспензию клеток (0,1 мл), 3-цианпиридин (0,5 М; 1,0 мл), водный раствор NaCl(0,85%-ный (мас./об.); 0,6 мл) и калийфосфатный буфер (0,1 М, рН 7,0; 0,3 мл), при встряхивании инкубировали в течение 5 мин при 30 С. Реакцию прекращали добавлением МеОН. Реакционную смесь центрифугировали (при 12000 об./мин в течение 5 мин) и с помощью ЖХВР согласно примеру 14 определяли количество образовавшегося ацетамида. После 1-часовой инкубации в присутствии ацетонитрила в интервале концентраций от 0 до 3 М нитрилгидратазная активность оставалась практически неизменной. После 1-часовой инкубации в присутствии 6-молярного ацетонитрила нитрилгидратазная активность все еще составляла 60% от исходного уровня. После 1-часовой инкубации в присутствии 9-молярного ацетонитрила нитрилгидратазная активность все еще составляла порядка 35% от исходного уровня (фиг. 9). Пример 17. Создание непигментированных мутантов штамма Rhodococcus sp. FZ4. Штамм Rhodococcus sp. FZ4 вносили в среду типа "питательного бульона" (50 мл) и инкубировали при встряхивании и при 28 С до достижения оптической плотности ОП 610 нм, равной 6,29. Затем эту предварительную культуру (10 мл) пересевали на среду типа "питательного бульона" (25 мл) и при встряхивании инкубировали при 28 С до достижения оптической плотности ОП 610 нм, равной 1,90. Полученную таким путем культуру (10 мл) центрифугировали (при 8000 об./мин в течение 5 мин). Надосадочную жидкость отбрасывали, а содержащий клетки осадок суспендировали в забуференном фосфатом растворе поваренной соли. Полученную суспензию клеток центрифугировали (при 8000 об./мин в течение 5 мин). Надосадочную жидкость отбрасывали, а содержащий клетки осадок суспендировали в забуференном фосфатом растворе поваренной соли (5 мл). Эту суспензию клеток переносили в стеклянную чашку Петри (диаметром 90 мм). Далее клетки в течение 17 мин облучали УФ-лампой (15 Вт, 254 нм) с расстояния 25 см. После этого клетки при встряхивании инкубировали в течение 4 дней при 28 С в среде типа "питательного бульона" двойной концентрации. Полученную таким путем культуру разбавляли в 100 раз и 100-микролитровые аликвоты такой разбавленной культуры высевали на агар для чашечного подсчета и инкубировали при 28 С. В каждой чашке вырастало почти по 150 отдельных колоний. Чашки помещали в доступное для дневного света место с целью индуцировать образование красных пигментов. Колонии непигментированных мутантов можно было легко отличить от колоний окрашенных мутантов и колоний имеющих красную окраску микроорганизмов дикого типа. Пример 18. Очистка нитрилгидратазы из Rhodococcus sp. FZ4. Штамм Rhodococcus sp. FZ4 выращивали согласно примеру 3 в 2-литровом ферментере. Полученную культуру центрифугировали и содержащий клетки осадок ресуспендировали в водном раствореNaCl (0,85%-ном (мас./об Далее суспензию клеток переносили в калийфосфатный буфер (0,1 М, рН 7,0), содержащий масляную кислоту (44 мМ), и обрабатывали ультразвуком. Остатки клеток, образовавшиеся в результате их разрушения, удаляли центрифугированием. Надосадочную жидкость использовали для очистки нитрилгидратазы в соответствии с приведенными в табл. 12 условиями. Нитрилгидратазную активность определяли согласно примеру 1, однако, вместо суспензии клеток использовали соответствующие экстракты. Таблица 12 Очистка нитрилгидратазы из Rhodococcus sp. FZ4 Пример 19. Определение молекулярной массы очищенной нитрилгидратазы. Молекулярную массу определяли с помощью ЖХВР (колонка TSK gel G 300 SW (0,7560 см); калийфосфатный буфер (0,1 М, рН 7,5) и хлорид калия (0,2 М); 0,7 мл/мин; 280 нм). Молекулярная масса нитрилгидратазы составляла 465 кДа (фиг. 11). Нитрилгидратаза состоит из -субъединицы с молекулярной массой 27,7 кДа и -субъединицы с молекулярной массой 31,2 кДа (фиг. 12). Пример 20. Термостабильность очищенной нитрилгидратазы. Раствор, содержащий раствор нитрилгидратазы (0,697 мкмоль/мин; 0,025 мл) и калийфосфатный буфер (0,1 М, рН 7,0; 0,475 мл), инкубировали в течение 60 мин при различных температурах в интервале- 11008600 от 20 до 70 С. После этого раствор охлаждали с помощью ледяной бани до 20 С и добавляли 3 цианпиридин (0,5 М; 0,500 мл). Затем реакционную смесь инкубировали в течение 10 мин при 20 С. Реакцию прекращали добавлением МеОН. Количество образовавшегося амида никотиновой кислоты определяли с помощью ЖХВР согласно примеру 1. После 60-минутной инкубации при температурах выше 40 С нитрилгидратазная активность значительно снижалась, при этом после 60-минутной инкубации при 50 С нитрилгидратазная активность составляла лишь около 25% от исходного уровня (фиг. 15). Пример 21. Оптимальное значение рН для очищенной нитрилгидратазы. Реакционную смесь, содержащую 3-цианпиридин (0,5 М; 0,500 мл), раствор нитрилгидратазы (0,697 мкмоль/мин; 0,025 мл) и различные буферы с рН в интервале от 4 до 11 (0,1; 0,0475 мл), инкубировали в течение 10 мин при 20 С. Реакцию прекращали добавлением МеОН. Количество образовавшегося амида никотиновой кислоты определяли с помощью ЖХВР согласно примеру 1. Оптимальное значение рН для нитрилгидратазы приходилось на интервал от 6,0 до 6,5 (фиг. 16). Пример 22. рН-Стабильность очищенной нитрилгидратазы. Раствор, содержащий раствор нитрилгидратазы (8,36 мкмоль/мин; 0,47 мл), различные буферы с рН в интервале от 4,0 до 11,0 (0,3 М; 0,10 мл) и дистиллированную воду (0,03 мл), инкубировали в течение 30 мин при 20 С. Затем реакционную смесь, содержащую аликвотное количество инкубированного на предыдущей стадии раствора нитрилгидратазы (0,05 мл), 3-цианпиридин (0,5 М; 0,5 мл) и соответствующий буфер (0,1 М; 0,45 мл), инкубировали в течение 10 мин при 20 С. Реакцию прекращали добавлением МеОН. Количество образовавшегося амида никотиновой кислоты определяли с помощью ЖХВР согласно примеру 1. После 60-минутной инкубации при значении рН в интервале от 6 до 8 нитрилгидратазная активность примерно соответствовала исходному уровню (фиг. 17). Пример 23. Субстратная специфичность очищенной нитрилгидратазы. Реакционную смесь, содержащую раствор нитрилгидратазы (0,695 мкмоль/мин; 0,025 мл), различные субстраты (0,500 мл) и калийфосфатный буфер (0,1 М, рН 7,0; 0,475 мл), инкубировали в течение 510 мин при 20 С. Субстраты использовали в концентрациях от 0,015 до 0,250 М. Реакцию прекращали добавлением МеОН. Количество образовавшегося амида кислоты определяли с помощью ЖХВР. Полученные результаты приведены в табл. 13. Среди всех протестированных субстратов наивысшую активность нитрилгидратаза проявляет в отношении ацетонитрила. Таблица 13 Субстратная специфичность очищенной нитрилгидратазы Пример 24. Влияние потенциальных ингибиторов на очищенную нитрилгидратазу. Раствор, содержащий раствор нитрилгидратазы (0,695 мкмоль/мин; 0,025 мл), калийфосфатный буфер (0,1 М, рН 7,0; 0,475 мл), дистиллированную воду (0,150 мл) и различные потенциальные ингибиторы(0,100 мл), инкубировали в течение 5 мин при 20 С. После этого добавляли 3-цианпиридин (1,0 М; 0,250 мл). Концентрация ингибиторов в реакционной смеси составляла 1,0 мМ. Реакционную смесь инкубировали в течение 10 мин при 20 С. Реакцию прекращали добавлением МеОН. Количество образовавшегося амида никотиновой кислоты определяли с помощью ЖХВР согласно примеру 1. Полученные результаты представлены в табл. 14. Среди всех протестированных потенциальных ингибиторов наибольшее ингибирующее действие проявляют гидроксиламин и цианид калия.- 12008600 Таблица 14 Влияние потенциальных ингибиторов на очищенную нитрилгидратазу Примечания: а 0,1 мМ,б этилендиаминтетрауксусная кислота,в общая активность: 3776 мкмоль/(минмл). Пример 25. Влияние ионов металлов на активность очищенной нитрилгидратазы. Влияние ионов металлов на активность очищенной нитрилгидратазы определяли согласно примеру 24, но с использованием ионов металлов вместо потенциальных ингибиторов. Концентрация ионов металлов в реакционной смеси составляла 1,0 мМ. Полученные результаты представлены в табл. 15. Среди всех протестированных ионов металлов ингибирующее действие проявляют только катионы серебра и двухзарядные катионы ртути. Таблица 15 Влияние ионов металлов на активность очищенной нитрилгидратазы Примечания: а общая активность: 3375 мкмоль/(минмл),б 0,1 мМ. Пример 26. Определение Km-значения для 3-цианпиридина у очищенной нитрилгидратазы. К раствору, содержащему раствор нитрилгидратазы (0,0697 мкмоль/мин; 0,025 мл) и калийфосфатный буфер (0,1 М, рН 7,0; 0,475 мл), добавляли 3-цианпиридин в различных концентрациях (3,1-800 мМ; 0,500 мл). Реакционную смесь инкубировали в течение 10 мин при 20 С. Реакцию прекращали добавлением метанола и количество образовавшегося амида никотиновой кислоты определяли с помощью ЖХВР согласно примеру 1. Km-значение для 3-цианпиридина составило 80,5 мМ (фиг. 13). Пример 27. Определение Km-значения для ацетонитрила у очищенной нитрилгидратазы. К раствору, содержащему раствор нитрилгидратазы (0,0697 мкмоль/мин; 0,025 мл) и калийфосфатный буфер (0,1 М, рН 7,0; 0,475 мл), добавляли ацетонитрил в различных концентрациях (2,5-80 мМ; 0,500- 13008600 мл). Реакционную смесь инкубировали в течение 10 мин при 20 С. Реакцию прекращали добавлением метанола и количество образовавшегося ацетамида определяли с помощью ЖХВР согласно примеру 14.Km-значение для ацетонитрила составило 2,84 мМ (фиг. 14). ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Микроорганизм, представляющий собой штамм Rhodococcus sp. FZ4, депонированный под регистрационным номером DSM 13597, и его функционально эквивалентные варианты и мутанты, способные превращать ацетонитрил в амид. 2. Нитрилгидратаза, полученная из микроорганизма по п.1 и характеризующаяся: а) Km 2,841,00 мМ при использовании в качестве субстрата ацетонитрила и Km 80,515,0 мМ при использовании в качестве субстрата 3-цианпиридина; б) оптимальным значением рН 6,51,0. 3. Экстракт, содержащий нитрилгидратазу по п.2. 4. Способ получения амидов общей формулыIII,1 в которой R обозначает С 1-6 алкильный остаток, С 2-6 алкенильную группу или группу общей формулы в которой X обозначает атом азота или группу -СН=, a R2 и R3 независимо друг от друга обозначают атом водорода, атом галогена, С 1-6 алкильную группу или С 2-6 алкенильную группу,отличающийся тем, что нитрил общей формулыII,1 в которой R имеет указанные выше значения, подвергают превращению с помощью микроорганизма по п.1, экстракта по п.3 или фермента по п.2. 5. Способ по п.4, отличающийся тем, что в качестве нитрила используют 3-цианпиридин или ацетонитрил. 6. Способ по п.4 или 5, отличающийся тем, что превращение проводят при температуре от 5 до 50 С и значении рН от 5 до 10. 7. Применение микроорганизма по п.1 для уничтожения или утилизации отходов ацетонитрила.
МПК / Метки
МПК: C12N 1/20, C12P 13/02, C12N 9/78
Метки: rhodococcus, полученый, активностью, этих, превращать, микроорганизмы, фермент, ацетонитрил, амид, микроорганизмов, нитрилгидратазной, способные, применения, способ
Код ссылки
<a href="https://eas.patents.su/20-8600-mikroorganizmy-rhodococcus-sp-sposobnye-prevrashhat-acetonitril-v-amid-poluchenyjj-iz-etih-mikroorganizmov-ferment-s-nitrilgidrataznojj-aktivnostyu-i-sposob-ih-primeneniya.html" rel="bookmark" title="База патентов Евразийского Союза">Микроорганизмы rhodococcus sp., способные превращать ацетонитрил в амид, полученый из этих микроорганизмов фермент с нитрилгидратазной активностью и способ их применения</a>
Предыдущий патент: Полипептид r1, обеспечивающий устойчивость растений к патогенам, кодирующая его нуклеотидная последовательность и способы их применения
Следующий патент: Рама транспортного средства
Случайный патент: Пептидомиметик smac, применимый в качестве ингибитора iap (ингибитор белков апоптоза)