Способы детекции амилоидогенных белков
Формула / Реферат
1. Способ определения агрегационной конформации амилоидного полипептида, предусматривающий сравнение (a) спектроскопического свойства амилоидоспецифического спектроскопического зонда, образовавшего комплекс с амилоидным полипептидом, имеющим неизвестную агрегационную конформацию, и (b) предварительно определенного спектроскопического свойства амилоидоспецифического спектроскопического зонда, образовавшего комплекс с амилоидным полипептидом известной агрегационной конформации, где путем указанного сравнения определяется агрегационная конформация амилоидного полипептида, имеющего неизвестную агрегационную конформацию.
2. Способ по п.1, где указанным амилоидоспецифическим спектроскопическим зондом является связывающийся с амилоидом краситель.
3. Способ по п.2, где указанным связывающимся с амилоидом красителем является сульфированный диазокраситель или его аналог.
4. Способ по п.3, где указанным сульфированным диазокрасителем является конго красный.
5. Способ по п.1, где указанным амилоидоспецифическим спектроскопическим зондом является меченный флуорофором пептид.
6. Способ по п.1, где указанным амилоидным полипептидом является b-амилоидный (Аb) пептид.
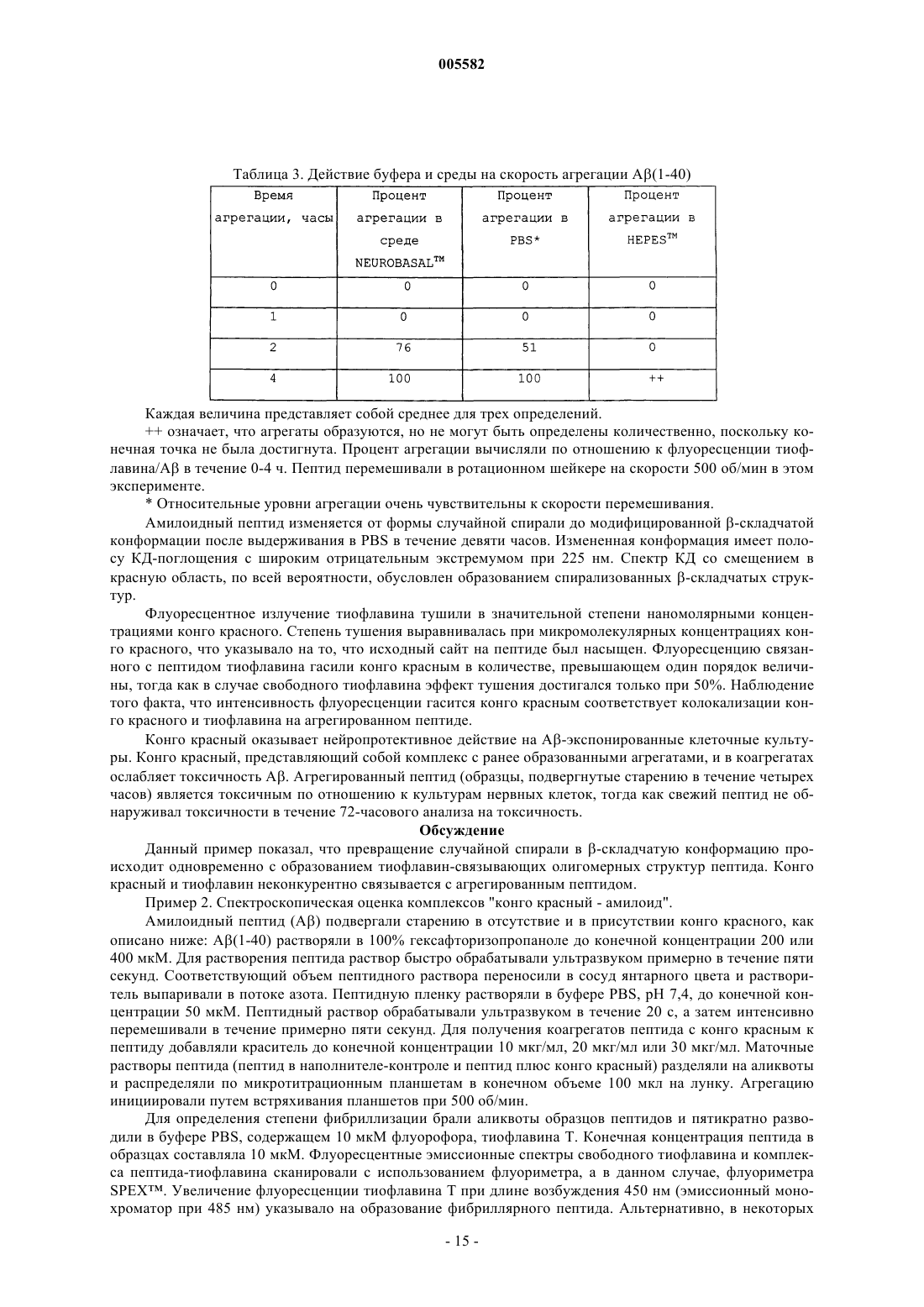
7. Способ по п.1, где указанные спектроскопические свойства оценивают по спектрам амилоидного полипептида, полученным с использованием спектроскопии кругового дихроизма (КД) в дальней УФ-области.
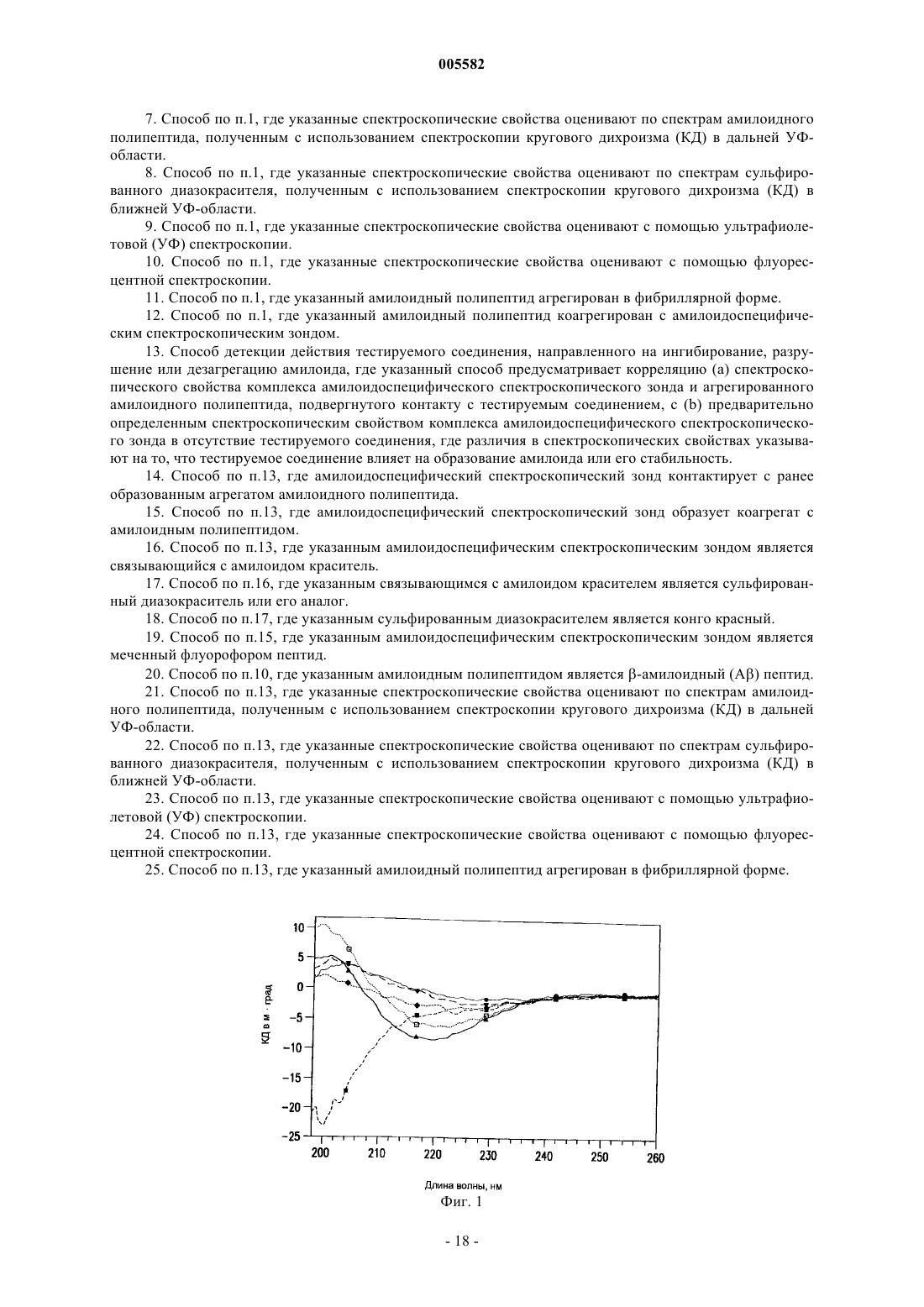
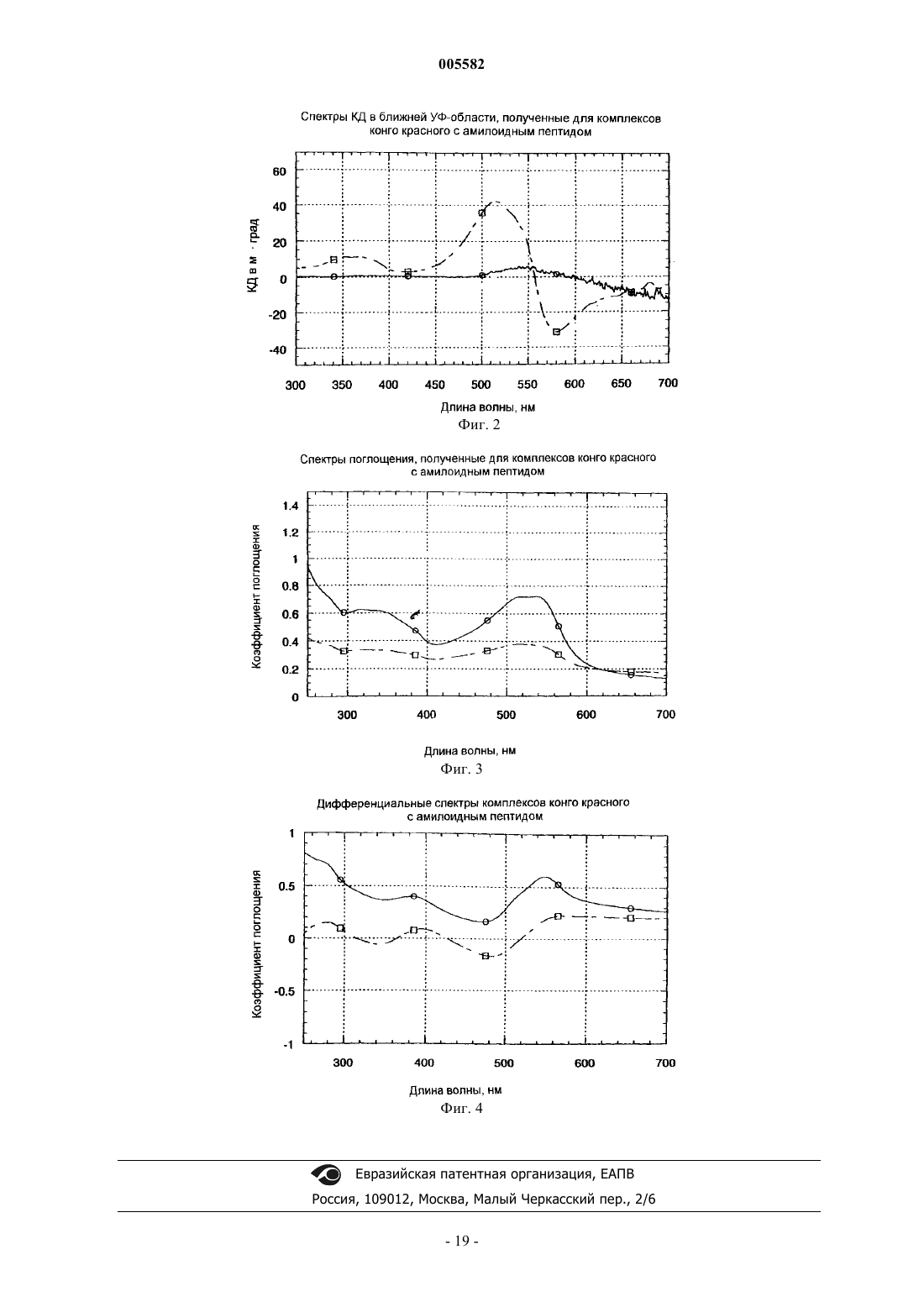
8. Способ по п.1, где указанные спектроскопические свойства оценивают по спектрам сульфированного диазокрасителя, полученным с использованием спектроскопии кругового дихроизма (КД) в ближней УФ-области.
9. Способ по п.1, где указанные спектроскопические свойства оценивают с помощью ультрафиолетовой (УФ) спектроскопии.
10. Способ по п.1, где указанные спектроскопические свойства оценивают с помощью флуоресцентной спектроскопии.
11. Способ по п.1, где указанный амилоидный полипептид агрегирован в фибриллярной форме.
12. Способ по п.1, где указанный амилоидный полипептид коагрегирован с амилоидоспецифическим спектроскопическим зондом.
13. Способ детекции действия тестируемого соединения, направленного на ингибирование, разрушение или дезагрегацию амилоида, где указанный способ предусматривает корреляцию (a) спектроскопического свойства комплекса амилоидоспецифического спектроскопического зонда и агрегированного амилоидного полипептида, подвергнутого контакту с тестируемым соединением, с (b) предварительно определенным спектроскопическим свойством комплекса амилоидоспецифического спектроскопического зонда в отсутствие тестируемого соединения, где различия в спектроскопических свойствах указывают на то, что тестируемое соединение влияет на образование амилоида или его стабильность.
14. Способ по п.13, где амилоидоспецифический спектроскопический зонд контактирует с ранее образованным агрегатом амилоидного полипептида.
15. Способ по п.13, где амилоидоспецифический спектроскопический зонд образует коагрегат с амилоидным полипептидом.
16. Способ по п.13, где указанным амилоидоспецифическим спектроскопическим зондом является связывающийся с амилоидом краситель.
17. Способ по п.16, где указанным связывающимся с амилоидом красителем является сульфированный диазокраситель или его аналог.
18. Способ по п.17, где указанным сульфированным диазокрасителем является конго красный.
19. Способ по п.15, где указанным амилоидоспецифическим спектроскопическим зондом является меченный флуорофором пептид.
20. Способ по п.10, где указанным амилоидным полипептидом является b-амилоидный (Аb) пептид.
21. Способ по п.13, где указанные спектроскопические свойства оценивают по спектрам амилоидного полипептида, полученным с использованием спектроскопии кругового дихроизма (КД) в дальней УФ-области.
22. Способ по п.13, где указанные спектроскопические свойства оценивают по спектрам сульфированного диазокрасителя, полученным с использованием спектроскопии кругового дихроизма (КД) в ближней УФ-области.
23. Способ по п.13, где указанные спектроскопические свойства оценивают с помощью ультрафиолетовой (УФ) спектроскопии.
24. Способ по п.13, где указанные спектроскопические свойства оценивают с помощью флуоресцентной спектроскопии.
25. Способ по п.13, где указанный амилоидный полипептид агрегирован в фибриллярной форме.
Текст
005582 Область, к которой относится изобретение Настоящее изобретение относится к способам оценки агрегированных форм амилоидных полипептидов. Настоящее изобретение, кроме того, относится к способам тестирования потенциальных ингибиторов амилоидоза in vitro или in vivo в целях разработки новых методов терапевтического лечения заболеваний или расстройств, ассоциированных с амилоидозом, таких как болезнь Альцгеймера. Предпосылки создания изобретения Болезнь Альцгеймера характеризуется присутствием церебральных амилоидных бляшек, которые осаждаются вокруг нервных клеток и которые, в конечном счете, приводят к разрушению головного мозга и к нарушению протекающих в нем нормальных процессов. Первичный белковый компонент таких бляшек имеет агрегированную форму, состоящую из изоформ 39-43 остатков -амилоидного белка (А). Первичным патогенным событием, приводящим к болезни Альцгеймера, является образование указанных фибриллярных амилоидных бляшек в паренхиме и сосудистой сети головного мозга. Было показано,что отложение фибриллярных агрегатов указанных амилоидных полипептидов обусловлено самосборкой полипептидов в макромолекулярные структуры, состоящие из поперечной -складчатой конформации,которая является токсичной для культивированных нервных клеток. Целью лечения болезни Альцгеймера, после ее диагностирования, является предупреждение образования агрегатов и/или терапевтическое введение ингибитора образования агрегатов в целях предотвращения токсического действия белка. Таким образом, агенты, которые блокируют образование макромолекулярных агрегатов, потенциально могут ингибировать цитотоксичность, а поэтому представляют интерес с точки зрения фармацевтики, поскольку они потенциально могут действовать в качестве лекарственных средств против болезни Альцгеймера. Сообщалось, что из нескольких небольших молекул,действующих как ингибиторы агрегации, нейропротективным соединением является конго красный, бифенилдиазосульфонированный краситель (Pollack et al., Neurosci. Lett., 1995, 197:211-214; Lorenzo et al.,Proc. Natl. Acad. Sci. USA, 1994, 91:12243-12247; и Burgevin et al., NeuroReport, 1994, 5:2429-2432). В заявке РСТ, PCT/US 93/06637 ("заявка 637") описано использование конго красного и его фармацевтически приемлемых солей или производных для лечения амилоидогенных заболеваний, в том числе болезни Альцгеймера. Конго красный, как сообщалось, препятствует развитию амилоидоза, либо дестабилизирует уже образовавшиеся амилоидные структуры. Эти свойства были положены в основу заявки '637 в целях подтверждения идеи о введении конго красного для лечения состояний, ассоциированных с отложением амилоидогенного белка в бляшки. Конго красный, используемый в качестве терапевтического агента, может быть введен in vivo в количестве, достаточном для предотвращения образования амилоидогенного белка или дестабилизации уже образовавшегося амилоида. Таким образом, конго красный, как сообщалось, не только связывается с амилоидными бляшками, но также ингибирует накопление амилоидогенного белка. Ценность и эффективность конго красного как возможного агента для лечения болезни Альцгеймера требует дополнительной проверки, поскольку конго красный не может пересекать гематоэнцефалический барьер. Производные, аналоги, соли и т.п. конго красного могут обладать таким же механизмом действия на -амилоидные пептиды, как и конго красный, т.е., указанные производные могут также обладать нейропротективным действием. В настоящее время для детекции агрегированного пептида в целях скрининга агентов против болезни Альцгеймера используются методы на основе антител и флуоресцентные методы с использованием тиофлавина Т. Для определения полимеризации амилоидного пептида был использован метод флуоресцентной корреляционной спектроскопии (Tjernberg et al., ChemistryBiology, 1999, 6:53-62). Однако эти методы не позволяют дифференцировать различные конформационные формы агрегированного полипептида. В предшествующих работах не приводится описания анализа для детекции альтернативных конформационных форм агрегированного амилоидного полипептида. Оптимально такие анализы могут быть использованы для быстрой оценки состояния агрегации данного полипептида, особенно в присутствии ингибиторов фибриллогенеза. Таким образом, необходимо разработать методы зондирования амилоидоза и амилоидных бляшек,которые, в свою очередь, направлены на исследование механизма, посредством которого амилоидогенные белки вызывают болезнь Альцгеймера. В частности, необходимо разработать анализы на основе биофизических и аналитических методов для характеристики конформации и агрегационного состояния агрегатов амилоидного полипептида и для выявления действия потенциальных ингибиторов амилоидоза,а в частности, болезни Альцгеймера. Поскольку имеется очень мало сведений о природе токсических агрегатов при болезни Альцгеймера и о механизме образования этих агрегатов в головном мозге, то необходимо разработать комбинацию анализов для того, чтобы определить, обладают ли потенциальные ингибиторы нужным эффектом в in vitro-тест-системах. Кроме того, необходимо разработать анализы для определения влияния тестируемых соединений на конформацию амилоидного полипептида в физиологических жидкостях, таких как плазма или спинно-мозговая жидкость.-1 005582 Краткое описание изобретения Настоящее изобретение относится к способам детекции различных агрегированных форм амилоидного полипептида, например, с использованием амилоидоспецифических красителей, таких как конго красный, и других родственных аналогов или меченных флуорофором амилоидных пептидов. Указанные способы могут быть использованы для определения агрегированного состояния указанного полипептида,а также для тестирования модуляторов агрегации в in vitro-моделях. Этот способ может быть использован для определения стадии, на которой вмешательство в процесс агрегации приводит к снижению токсичности, например, А-пептида по отношению к нервным клеткам. Указанные способы могут быть также использованы для определения эффектов ингибитора или средства против болезни Альцгеймера при терапевтическом лечении или профилактике амилоидоза или других ассоциированных с ним заболеваний. Таким образом, в одном из своих аспектов, настоящее изобретение относится к способу определения агрегационной конформации амилоидного полипептида. Этот способ предусматривает корреляцию спектроскопического свойства комплекса амилоидоспецифического спектроскопического зонда, такого как сульфированный диазокраситель или меченный флуорофором амилоидный пептид, контактирующего с амилоидным полипептидом в условиях, способствующих агрегации данного полипептида, с предварительно определенным спектральным свойством комплекса амилоидоспецифического зонда с агрегированным амилоидным полипептидом известной конформации. В другом своем аспекте настоящее изобретение относится к способу детекции действия тестируемого соединения, направленного на ингибирование, разрушение или дезагрегацию амилоидного образования. Указанный способ предусматривает корреляцию спектроскопических свойств (а) комплекса амилоидоспецифического спектроскопического зонда, такого как сульфированный диазокраситель или меченный флуорофором амилоидный пептид, подвергнутого контактированию с амилоидным полипептидом и тестируемым соединением в условиях, способствующих агрегации данного полипептида, и (b) комплекса амилоидоспецифического спектроскопического зонда, подвергнутого контактированию с амилоидным полипептидом в условиях, способствующих агрегации (контроль). Спектроскопический зонд может контактировать с образцом перед агрегацией, или, если он является амилоидоспецифическим красителем, то после агрегации. Если указанным спектроскопическим зондом является меченный флуорофором пептид, то он должен агрегироваться с указанным амилоидным полипептидом. Указанное тестируемое соединение может быть добавлено до или после агрегации. Различие спектроскопических свойств указывает на то, что это тестируемое соединение влияет на образование амилоида. Для лучшего понимания этих и других аспектов настоящего изобретения ниже представлены графический материал, подробное описание изобретения и примеры. Краткое описание графического материала Фиг. 1 (в цвете). Действие конго красного на конформацию А(1-40). КД-спектры в дальней УФобласти, полученные для комплексов конго красного со старым и свежим пептидом, сравнивали с КДспектрами в дальней УФ-области, полученными для коагрегатов в целях определения различий в конформации пептидного агрегата. Зеленый ромб: коагрегаты при 14,3 мкМ конго красного; пурпурный незаштрихованный квадрат: коагрегаты при 21 мкМ конго красного; красный треугольник: коагрегаты при 47 мкМ конго красного; синий перевернутый треугольник: старый амилоидный пептид; оранжевый квадрат: свежий пептид с 21 мкМ конго красным; незаштрихованный оранжевый круг: старый пептид с 21 мкМ конго красным. Фиг. 2. КД-спектры в ближней УФ-области для комплексов конго красного с уже образованными агрегатами (незаштрихованный квадрат) и коагрегатами амилоидного пептида (незаштрихованный круг). Фиг. 3. УФ-спектры поглощения, полученные для комплексов конго красного с уже образованными агрегатами (незаштрихованный круг) и коагрегатами амилоидного пептида (незаштрихованный квадрат). Спектры поглощения были измерены для старого пептида. Фиг. 4. Спектральные различия комплексов конго красного с образованными агрегатами (незаштрихованный круг) и коагрегатами АР(1-40) (незаштрихованный квадрат). Спектры поглощения были измерены для конго красного. Подробное описание изобретения В настоящем изобретении описаны анализы, которые могут быть использованы для детекции конформационных различий ряда агрегированных форм амилоидного полипептида. Настоящее изобретение частично основано на наблюдениях влияния конго красного, флуоресцентного амилоидоспецифического спектроскопического зонда, на агрегацию. Такое влияние определяли путем добавления в начале агрегации конго красного к раствору амилоидного полипептида (А-пептида) в одном эксперименте и к уже образованным агрегатам в другом эксперименте. Было обнаружено, что конго красный образует, по крайней мере, два различных комплекса с -амилоидом in vitro. Конго красный, объединенный с Апептидом перед агрегацией данного пептида в -складчатые листы, обладал спектральными свойствами,отличающимися от спектральных свойств, которыми обладал конго красный, объединенный с Апептидом уже после его агрегации в -складчатые листы (так называемым фибриллярным пептидом). Конго красный предупреждал образование фибриллярных агрегатов А-пептида и тем самым способствовал снижению токсических эффектов уже агрегированного пептида. Хотя с помощью спектроскопических анализов было показано, что полученные комплексы коагрегатов и комплексы конго красного с фибриллярными формами отличаются друг от друга, однако, в обоих случаях токсическое действие данного пептида снижалось при добавлении конго красного. Экспериментальные результаты показали, что в этих двух случаях молекулярные механизмы, приводящие к снижению токсичности, значительно отличаются. Использование этих результатов облегчает определение стадии, на которой вмешательство в процесс агрегации оптимально снижает токсичность,например, по отношению к нервным клеткам. Эти способы могут быть также использованы для идентификации различных белковых комплексов, образующихся в результате объединения различных полипептидов с небольшой ингибирующей молекулой-прототипом. Описаны анализы, которые могут быть использованы для быстрого анализа состояния агрегации амилоидного полипептида в присутствии потенциальных ингибиторов фибриллогенеза. Известно, что А-пептид опосредует токсичность и, очевидно, способствует гибели нервных клеток при болезни Альцгеймера. В настоящее время имеется огромный интерес к идентификации белков, которые опосредуют нейротоксичность А-пептида. Описанные здесь способы могут быть использованы для характеристики взаимодействий А-пептида в его агрегированной форме(ах) с указанными белками, а также для того, чтобы определить, нарушают ли потенциальные тестируемые соединения указанные взаимодействия. Применение указанных способов также дает дополнительное представление о молекулярных механизмах болезни Альцгеймера, на основе которого в настоящее время предпринимаются попытки обнаружить лекарственные средства против нейродегенерации. Обнаружение таких лекарственных средств может быть также использовано для оценки других амилоидных полипептидов. Были разработаны три различных способа, используемых в качестве инструментов для определения степени агрегации полипептида в присутствии и в отсутствие конго красного. Было также оценено действие ингибиторов на самосборку амилоидного полипептида и соответствующего действия на цитотоксичность. 1. Спектроскопию кругового дихроизма (КД) проводят в целях идентификации и дифференциации конформаций амилоидного полипептида, который был подвергнут старению в присутствии или в отсутствие конго красного. Этот способ основан на изменениях КД-поглощения амилоидного полипептида в дальней УФ-области и конго красного в ближней УФ-области. Спектры комплексов-агрегатов сканировали как в дальней УФ-области, так и в ближней УФ-области. Спектры КД в дальней УФ-области могут быть использованы для определения вторичной структуры амилоидного полипептида. Спектры КД в ближней УФ-области могут быть использованы для дифференциации комплексов конго красного. Лишь один амилоидный полипептид в буфере и свободный конго красный не продуцировали заметного сигнала КД-поглощения в ближней УФ-области. Поскольку конго красный не имеет характерного спектра КД в свободном состоянии, то спектральные изменения, индуцированные связыванием с амилоидными полипептидами, могут быть использованы для идентификации различных форм амилоидогенных белков. Эффекты индуцированного КД-поглощения имеют явные отличия у коагрегатов конго красного с амилоидным полипептидом и у комплексов конго красного с уже образованными агрегатами или с фибриллярной формой полипептида. Не претендуя на какую-либо конкретную теорию, полагают, что изменения в спектре КД ближней УФ-области для конго красного обусловлены индуцированием хирального окружения после связывания с упорядоченной фибриллярной формой данного белка. Было показано, что спектр КД ближней УФ-области, полученный для коагрегатов (амилоидного полипептида и конго красного), значительно отличается от спектра уже образованных фибриллярных комплексов, подвергнутых контакту с конго красным. Наблюдаемые различия в спектрах указанных комплексов обусловлены различными состояниями образования комплексов конго красного. Экситонный двухполосный спектр КД (куплет КД) уже образованных фибрилл являлся показателем образования комплексов конго красного с упорядоченной -складчатой конформацией пептида (т.е., вследствие образования спирализованных -складчатых структур ("твист"-структур); Woody R.W., "The Circular Dichroism of Biopolymers", Proc. F.E.C.S. Int. Conf. Circ. Dichroism, 1987 (meeting date 1985), pp. 270-295), тогда как спектр коагрегатов соответствовал образованию комплексов конго красного с промежуточными агрегированными структурами. Спектр КД агрегированного амилоидного полипептида сканировали в различные промежутки времени для установления корреляции образования тиофлавинсвязывающих макромолекулярных ансамблей(агрегатов) с появлением -складчатой конформации. Для подтверждения образования -складчатой структуры в полипептиде была использована флуоресцентная спектроскопия, основанная на связывании с тиофлавином (ThT). Индуцированная тиофлавином флуоресценция является специфичной для амилоидных -складчатых фибрилл, но не для других -складчатых структур или не для растворимых олигомерных форм полипептида. 2. Уф-спектроскопию использовали для дифференциации абсорбционных спектров конго красного,полученных для двух комплексов уже образованных фибрилл и коагрегатов. Определяли изменения в-3 005582 абсорбционном спектре конго красного в присутствии или в отсутствие амилоидного полипептида, которые отражали изменения в окружении конго красного после связывания с фибриллярными, нефибриллярными и другими альтернативными формами комплексов. 3. Флуоресцентную спектроскопию использовали для дифференциации комплексов конго красного. Конго красный связывается с уже образованными фибриллами, а также с промежуточными агрегатными формами амилоидного полипептида. Собственная флуоресценция конго красного значительно усиливается при его связывании с агрегированной формой. Спектр возбуждения флуоресценции конго красного в связанном с агрегатом состоянии также имеет смещение в "красную" область по сравнению со спектром свободной формы полипептида. Изменения в флуоресцентных свойствах конго красного зависят от агрегированного состояния конго красного. Указанные различия в наблюдаемых спектральных характеристиках коагрегатов и комплексов фибриллярного полипептида с конго красным обусловлены различиями в относительной гидрофобности сайтов связывания и числом связанных молекул конго красного в комплексах с уже образованными фибриллами и коагрегатами. В настоящем изобретении было показано, что конго красный стимулирует образование стабильной промежуточной -складчатой формой конформации при коагрегации с амилоидным полипептидом. Хотя конго красный связывается с уже образованными фибриллами, а также с промежуточными агрегированными формами амилоидного полипептида, однако, какие-либо свидетельства о взаимодействии с полипептидом, имеющим структуру случайной спирали, отсутствуют. Результаты показывают, что флуоресцентный спектр конго красного при коагрегации с амилоидным полипептидом усиливается в восемь раз по сравнению со спектром свободной формы. Было также показано, что уже образованные фибриллы также связываются с конго красным, но флуоресценция комплекса между этими уже образованными фибриллами и конго красным по отношению к флуоресценции свободной формы конго красного усиливается только в два раза. Таким образом, с использованием флуоресцентных методов, настоящее исследование показывает, что конго красный имеет дуальный характер взаимодействия с -амилоидным белком 1-40. Поскольку изоформы А 39-40 также превращаются из случайной спирали в -складчатую форму, то взаимодействия конго красного должны быть аналогичными для всех изоформ А-пептида. Результаты спектроскопии, описанные в настоящей заявке, показали, что ингибиторы, такие как конго красный, образуют с амилоидными полипептидами, по крайней мере, два различных комплекса. Было показано, что как уже образованные фибриллы, так и коагрегаты при связывании с конго красным образуют высокомолекулярные соединения (приблизительно в 50 кД или выше). Хотя конго красный связывается с промежуточными агрегатами А-пептида и тем самым снижает токсичность фибриллярного пептида, однако, при этом может происходить образование "нерастворимых" комплексов в коагрегатах, что дает основание предполагать, что тестируемые соединения, которые продуцируют такое действие на агрегацию, необходимо исследовать на их пригодность для терапевтического лечения или профилактики болезни Альцгеймера. Исходя из указанных конкретных наблюдений, которые более подробно описаны в нижеприведенных примерах, была обнаружена универсальная способность флуоресцентного зонда, т.е., сульфированного диазокрасителя или меченного флуорофором амилоидного пептида зондировать агрегационную форму агрегированного амилоидного полипептида. Этот аналитический метод был положен в основу различных методов скрининга на способность тестируемых соединений к ингибированию или реверсии амилоидоза. В настоящем описании обсуждаются различные варианты и аспекты настоящего изобретения. Для лучшего понимания настоящего изобретения его описание разделено на разделы (заголовки которых даны жирным шрифтом, подчеркнуты) и подразделы (заголовки которых даны жирным шрифтом, курсивом, подчеркнуты), однако, они не должны рассматриваться как ограничение изобретения. Общие определения Термины "амилоид", "амилоидная бляшка" и "амилоидная фибрилла" относятся, в основном, к нерастворимым белковым веществам с конкретными физическими свойствами, независимо от состава белков или других молекул, обнаруживаемых в указанном веществе. Амилоид может быть идентифицирован по его аморфной структуре, эозинофильному окрашиванию, изменениям индуцированной тиофлавином флуоресценции и по гомогенности. В данном описании белковые или пептидные компоненты амилоида означают "амилоидные полипептиды", которыми являются, но не ограничиваются ими, амилоидный пептид (А), включая синтетические АР, соответствующие первым 28, 40 или 42 аминокислотам А, т.е., А(1-28), А(1-40), А(1-42), соответственно, а также синтетический АР, соответствующий аминокислотам 25-35 А, т.е., А 25-35; предшественник белка скрепи или белка приона; иммуноглобулин, включая его тяжелую или легкую - или -цепи или их фрагменты, продуцированные миеломами; сывороточный амилоид А; 2-микроглобулин; ароА 1; гельзолин; цистатин С; (про)кальцитонин; атриальный натуроуретический фактор; амилоидный полипептид островков, также известный как амилин (см. Westermark et al., Proc. Natl. Acad. Sci., USA, 1987, 84:3881-85; Westermark et al., Am. J. Physiol,1987, 127:414-417; Cooper et al., Proc. Natl. Acad. Sci., USA, 1987, 84:8628-32; Cooper et al., Proc. Natl.Acad. Sci., USA, 1988, 85:7763-66; Amiel, Lancet, 1993, 341:1249-50) и т.п. Для их обнаружения амилоид-4 005582 ный полипептид может быть спонтанно агрегирован путем индуцирования агрегации, например, с использованием затравки, в условиях, способствующих агрегации. Следует отметить, что хотя человеческий амилин спонтанно агрегируется in vitro, однако, крысиный амилин, который отличается от человеческого амилина шестью аминокислотными остатками, является неамилоидогенным и не образует фибриллы (см. Lorenzo et al., Nature, 1994, 368:756-760). В конкретном аспекте используемый здесь термин"амилоид" означает вещество, содержащее А. Термин "амилоидоз" означает отложение или агрегациюin vivo белков с образованием амилоидных бляшек или фибрилл. Термин "амилоидоспецифический спектроскопический зонд" означает связывающееся с амилоидом соединение-краситель или конъюгат "пептид-флуорофор", которые взаимодействуют с агрегированными формами амилоида и демонстрируют различные спектроскопические свойства в зависимости от конформации указанного агрегата. Само собой разумеется, как легко понятно каждому специалисту, что флуорофор будет обязательно действовать как хромофор, т.е., он будет иметь характерный спектр поглощения. Кроме того, при его связывании с агрегированным амилоидом он будет, вероятно, иметь индуцированный спектр КД. Указанный зонд может влиять, а предпочтительно, он будет влиять на амилоидогенез. Примерами амилоидоспецифических спектроскопических зондов являются сульфированные диазокрасители и меченные флуорофором амилоидные пептиды."Меченный флуорофором амилоидный пептид" представляет собой пептид, происходящий от амилоидного полипептида, такой, как А, который конъюгирован с флуорофором (флуоресцентная молекула). Амилоидными пептидами могут быть амилоидные полипептиды или их части, способные коагрегироваться с амилоидными полипептидами. Однако меченные флуорофором амилоидные пептиды необязательно должны агрегироваться сами с собой. Примерами флуорофоров для мечения амилоидного пептида являются, но не ограничиваются ими, флуоресцеин, техасский красный, комплексы "рутений-пиридил" и родамин. Флуорофор имеет также практически используемые УФ-спектры поглощения и может также обладать практически используемыми ИК-спектральными свойствами. Предпочтительно,чтобы меченный флуорофором амилоидный пептид составлял примерно 10% или менее, более предпочтительно, примерно 1% или менее, а наиболее предпочтительно, примерно 0,1% или менее от общего количества пептида в данном образце. В наиболее широком смысле "амилоидсвязывающий" краситель представляет собой хромофор, который имеет склонность к ассоциации с амилоидом. Предпочтительно, чтобы краситель также представлял собой флуорофор, т.е., вещество, способное к флуоресценции в конкретных условиях. В целях осуществления настоящего изобретения и в исследованиях амилоидоза, образцовым красителем является сульфированный диазокраситель, а более конкретно, конго красный (см., например, патент США 5276059 и PCT/US93/06637). Однако родственные соединения или эквиваленты конго красного, такие как хризамин G, который представляет собой карбоксилированный аналог конго красного, также входят в объем настоящего изобретения. Структура конго красного и хризамина G представлена ниже. Условиями, способствующими агрегации, являются рН, ионная сила, температура и низкие концентрации, а предпочтительно, отсутствие, или, по крайней мере, необнаружимые концентрации каких-либо хаотропных или лиотропных реагентов, таких, которые могут образовывать агрегаты с амилоидными полипептидами. Присутствие амилоидных "затравок" увеличивает способность полипептида к агрегации."Агрегационный комплекс" означает комплекс, образованный в результате взаимодействия амилоидоспецифического спектроскопического зонда, такого как конго красный, с агрегированным амилоидным полипептидом. Этот комплекс может образовываться в результате коагрегации, т.е. в том случае,когда указанный амилоидоспецифический спектроскопический зонд присутствует вместе с амилоидным-5 005582 полипептидом перед индуцированием агрегации. Альтернативно, указанный комплекс может быть образован в результате взаимодействия красителя с уже образованным агрегатом амилоидного полипептида. Используемый здесь термин "агрегационная форма" означает структуру или конформацию, которую принимает амилоидный полипептид в своем агрегированном состоянии. Так, например, агрегированный А может образовывать -складчатую или спирализованную -складчатую форму. Практически вторичная и четвертичная (пептид-пептид) конформация определяется различиями спектроскопических свойств. Другими словами, не имея точных сведений о структуре агрегированного амилоидного полипептида, можно выявить структурные различия путем детекции различий в спектроскопических свойствах либо полипептида, либо амилоидоспецифического спектроскопического зонда. Эти различия, в свою очередь, могут быть оценены in vitro или in vivo на их влияние на клеточную токсичность или ассоциированную с амилоидозом патогенность. Термин "полипептидный агрегат" или "агрегат" означает самоассоциированные молекулы полипептида, которые образуют либо фибриллярные, либо нефибриллярные формы, и молекулы, которые являются токсичными или нетоксичными по отношению к культурам нервных клеток. Используемый здесь термин "спектроскопическое свойство" означает количество излучения, поглощаемого агрегированным комплексом, либо количество энергии, испускаемой указанным агрегированным комплексом, возбуждаемым путем поглощения излучения. В конкретном варианте осуществления изобретения ультрафиолетовые (УФ) спектры кругового дихроизма (КД) получают в диапазонах дальнего УФ и ближнего УФ. В другом варианте осуществления изобретения получают абсорбционные УФ-спектры. В еще одном варианте осуществления изобретения получают эмиссионные спектры флуоресценции. В еще одном варианте осуществления изобретения получают инфракрасные (ИК) спектры. В основном, спектры получают путем измерения разницы между количествами света, излучаемого или поглощаемого на данной длине волны в образце, содержащем агрегированный комплекс, по сравнению с эталонным образцом. Спектры флуоресценции получают путем детектирования мощности излучения на данной длине волны оптического возбуждения. Спектры возбуждения флуоресценции могут быть получены путем оценки интенсивности флуоресценции в зависимости от длины волны поглощения. Эти концепции хорошо известны специалистам (см., например, CantorSchimmel, Biophysical Chemistry, W.H.Freeman and Company: San Francisco, 1980; Silverstein et al., Spectrometric Identification of Organic Compounds, John WileySons: New York, 1981). Заболевание или расстройство ассоциируется с амилоидозом в том случае, когда амилоидные отложения или амилоидные бляшки присутствуют в пораженных заболеванием тканях или в непосредственной близости от этих тканей, или когда данное заболевание характеризуется сверхпродуцированием белка, который является или может стать нерастворимым. Амилоидные бляшки могут вызывать патологические эффекты как прямо, так и опосредованно, в соответствии с известными или неизвестными механизмами. Примерами амилоидных заболеваний являются, но не ограничиваются ими, системные заболевания, такие как хронические воспалительные заболевания, множественная миелома, макроглобулинемия,наследственная амилоидная полиневропатия (португальская) и кардиомиопатия (датская), системный сенильный амилоидоз, наследственная амилоидная полинефропатия (штата Айовы), наследственный амилоидоз (финский), синдром Герстмана-Штрюсслера-Шейнкера, наследственная амилоидная нефропатия, ассоциированная с крапивницей и глухотой (синдром Макла-Уэллса), медуллярная карцинома щитовидной железы, изолированный атриальный амилоидоз и ассоциированный с гемодиализом амилоидоз (НАА); и нейродегенеративные заболевания. Диабет типа II ассоциируется с амилоидными фибриллами или отложениями в поджелудочной железе, в частности, в клетках панкреатических островков, которые продуцируют инсулин. Как и в случае амилоидных бляшек при болезни Альцгеймера, амилоидные бляшки или фибриллы при диабете типа II провоцируют патологические эффекты. В частности, концентрации человеческого амилина, при которых образуются фибриллы, являются токсичными для продуцирующих инсулин -клеток панкреатических островков человека и крысы (Lorenzo et al., 1994, Nature 368:758-760). В соответствии с этим, в конкретном варианте своего осуществления настоящее изобретение относится к диабетическому амилоидозу типа II. Хронические воспалительные заболевания, такие как идиопатическая наследственная средиземноморская лихорадка, синдром Макла-Уэллса, хроническая малярийная инфекция и т.п., могут приводить к экспрессии сывороточного амилоида А, белка острой фазы заболевания, который затем может подвергаться процессингу и образовывать амилоидные отложения и бляшки. Так, например, как наблюдается в странах Третьего мира, хроническая малярия может приводить к амилоидозу селезенки и/или печени индивидуума. Возникающая в результате недостаточность органов может, в конечном счете, приводить к смерти. Множественная миелома ассоциируется со сверхпродуцированием иммуноглобулинов, где указанные иммуноглобулины или их фрагменты могут образовывать амилоидные отложения и бляшки в органах или тканях, контактирующих с кровеносной системой. Отложение транстиретина может приводить к возникновению наследственной амилоидной полиневропатии (португальской), наследственной амилоидной кардиомиопатии (датской) или системного сенильного амилоидоза. Ассоциированный с ге-6 005582 модиализом амилоидоз представляет собой осложнение, возникающее у пациентов с продолжительным гемодиализом, при котором 2-микpoглoбyлин является главным белком, составляющим указанные амилоидные фибриллы (Drueke, 1991, Miner. Electrolyte Metab. 17:261-272; Geyjo et al., 1985, Biochem. Biophys. Res. Commun. 129: 701-706; Gorevic et al., 1986, Proc. Natl. Acad. Sci. USA 83:7908-12; Shirahama etal., 1985, Lab. Invest. 53:705-709). Как указывалось выше, помимо системного амилоидоза, настоящее изобретение относится, в частности, к нейродегенеративным заболеваниям, включая амилоидоз. Термин "нейродегенеративное заболевание" означает заболевание или расстройство нервной системы, а в частности, головного мозга, которое выражается в симптомах, характеризующихся дисфункцией головного мозга или нервной ткани, например, короткими или длительными провалами или дефектами памяти, деменцией, нарушениями познавательной способности, нарушениями равновесия и координации, эмоциональной недостаточностью и поведенческим дефицитом. Указанные заболевания являются "ассоциированными с амилоидозом" в том случае, когда гистопатологические (взятые путем биопсии) образцы ткани головного мозга индивидуумов, у которых обнаруживаются такие симптомы, указывают на образование амилоидных бляшек. Поскольку образцы биопсии, взятой из головного мозга, а в частности из головного мозга человека, очень трудно, либо вообще невозможно получить от живого индивидуума, то определение взаимосвязи симптома или симптомов нейродегенеративного заболевания с амилоидозом основано на критериях, не связанных с присутствием амилоидных отложений в образце биопсии, таких как бляшки или фибриллы. В конкретном варианте осуществления изобретения нейродегенеративным заболеванием, ассоциированным с амилоидозом, является болезнь Альцгеймера (БА). В других вариантах осуществления изобретения указанным заболеванием может быть редкая Шведская болезнь, характеризующаяся двойной мутацией KMNL в амилоидном белке-предшественнике (АРР) вблизи аминоконца АР-части АРР(Levy et al., 1990 Science, 248:1124-26). Другим таким заболеванием является наследственная церебральная геморрагия, ассоциированная с амилоидозом (НСНА или HCHWA) голландского типа (Rozemuller etal., 1993, Am. J. Pathol. 142:1449-57; Roos et al., 1991, Ann. N.Y. Acad. Sci. 640:155-60; Timmers et al., 1990,Neurosci. Lett. 118:223-6; Haan et al., 1990, Arch. Neurol. 47:965-7). Другими такими известными заболеваниями, которые входят в объем настоящего изобретения, являются, но не ограничиваются ими, спорадическая церебральная амилоидная ангиопатия, наследственная церебральная амилоидная ангиопатия, синдром Дауна, деменция Паркинсона-Гама и старческая бессимптомная амилоидная ангиопатия (см., например, HaanRoos, 1990, Clin. Neurol. Neurosurg. 92:305-310; GlennerMurphy, 1989, N. Neurol. Sci. 94:1-28; Frangione, 1989, Ann. Med. 21:69-72; Haan et al., 1992, Clin. Neuro. Neurosurg. 94:317-8; Fraser etal., 1992, Biochem. 31:10716-23; Coria et al., 1988, Lab. Invest. 58:454-8). Фактически, аминокислотный состав и размер AP, присутствующего при каждом из этих заболеваний, может варьироваться, как известно специалистам (см. выше и работы Wisniewski et al., 1991, Biochem. Biophys. Res. Commun. 179:1247-54 and 1991, Biochem. Biophys. Res. Commun. 180:1528 [published erratum]; Prelli et al., 1990,Biochem. Biophys. Res. Commun. 170:301-307; Levy et al., 1990, Science 248:1124-26). В другом аспекте настоящего изобретения указанным нейродегенеративным заболеванием является подострая губчатая энцефалопатия, включая, но не ограничиваясь ими, скрэпи, болезнь КрейтцфельдаЯкоба, болезнь Герстмана-Штрюсслера, куру, хроническое истощение чернохвостого оленя и лося, губчатая энцефалопатия крупного рогатого скота у коров и трансмиссивная энцефалопатия норок. Настоящее изобретение относится к оценке агрегационной формы амилоидогенного полипептида у любого животного, а более предпочтительно у млекопитающего, включая человека, а также у млекопитающих, таких как собаки, кошки, лошади, коровы, свиньи, морские свинки, мыши и крысы. Используемый здесь термин "примерно" или "приблизительно" относится к значению, которое может составлять 50% от данной величины, предпочтительно 20%, более предпочтительно 10%, еще более предпочтительно 5%, а наиболее предпочтительно 1% от данной величины. Альтернативно, термин "примерно" или "приблизительно" означает, что данная величина может находиться в диапазоне ошибок, допустимых с научной точки зрения для величины этого типа, и эта величина зависит от качества измерения, которое может быть достигнуто с использованием имеющегося оборудования. Термин "примерно" или "приблизительно" может означать распределение средних значений величин, а не какую-либо отдельную величину. Индуцирование образования амилоида В общих чертах, агрегация амилоидного полипептида представляет собой явление, которое зависит от концентрации и времени. Амилоидный полипептид растворяют в подходящем буфере, а предпочтительно, в буферном растворе, имеющем ионную силу, сравнимую с ионной силой физиологических растворов, таком, как забуференный фосфатом физиологический раствор (PBS), буфер Трис, буферHEPES или среда NEUROBASAL. Агрегированный амилоидный полипептид детектируют рутинными методами, например, как описано ниже. Для оценки формы агрегации связывающийся с амилоидом краситель может быть подвергнут контакту с амилоидным полипептидом до или после агрегации. Амилоидоспецифический спектроскопический зонд может быть применен примерно при той же концентрации (молярной концентрации), что и-7 005582 амилоидный полипептид, или при концентрации примерно на порядок большей или меньшей, при условии, что (а) спектроскопический сигнал от данного красителя может быть детектирован на имеющихся спектрометрах и что (b) сигнал, детектируемый от красителя, образовавшего комплекс с полипептидным агрегатом, превышает сигнал от красителя, не образующего комплекса. Эти факторы легко определить экспериментально. Агрегация А. По истечении зависящего от концентрации лаг-периода во время in vitroинкубирования растворимые препараты синтетического А медленно образуют фибриллярные агрегаты,которые похожи на природный амилоид и могут быть измерены путем седиментации или флуоресценции, индуцированной тиофлавином Т. Скорость агрегации растворимого А в этих in vitro-анализах увеличивается путем добавления небольших количеств предварительно агрегированного -амилоидного"затравочного" материала. В конкретном варианте осуществления изобретения А(1-40), растворенный в 100% гексафторизопропаноле при 200 или 400 мкМ, сушат в потоке азота. Гексафторизопропанол сначала превращает конформацию пептида в структуру случайной спирали. Пептидную пленку растворяют в буфере PBS, рН 7,4, до конечной концентрации 50 мкМ с быстрой обработкой ультразвуком в течение примерно пятисорока секунд и быстрым встряхиванием в течение пяти секунд или менее. Затем этот раствор подвергают старению для стимуляции агрегации. Альтернативно, синтетические ВЭЖХ-очищенные пептиды, имеющие первые 28 (А 1-28) и первые 40 (А 1-40) аминокислот из 42 аминокислот А, могут быть получены от Bachem (Torrance, CA). Агрегация растворимого А 1-28 или А 1-40 при различных концентрациях может быть инициирована добавлением 0,1 М ацетата натрия (NaOAc) при рН 4,7-7,5. Количественное образование агрегата с субмиллимолярными концентрациями А может быть детектировано в соответствии с процедурой, описанной LeVine (Protein Science, 1992, 2:404-410). Для этого флуоресценцию агрегатов, добавленных к буферу 10 мкМ тиофлавина-Т (Aldrich)/50 мМ фосфата калия, рН 6,0, измеряют при возбуждении 4505 нм и детекции излучения при 48210 на спектрофлуориметре Perkin-Elmer LS-50B. Агрегация А при более низких (физиологических) концентрациях может быть количественно определена методом, описанным Burdick et al. (J. Biol. Chem., 1992, 267:546-554). Синтетические препараты А могут быть разведены до конечной концентрации 5 нМ, предпочтительно, в присутствии "затравок". После проведения различных периодов инкубирования при 37 С могут быть оценены реакции агрегации. Агрегация амилина. По истечении зависящего от концентрации лаг-периода во время in vitroинкубирования растворимые препараты синтетического амилина медленно образуют фибриллярные агрегаты, которые похожи на природный амилоид (Lorenzo et al., Nature, 1994, 368:756-760) и могут быть измерены на электронном микроскопе или посредством двойного лучепреломления конго красного в поляризованном свете (Fraser et al., Biophys. J. 1991, 90:1194-1201). Агрегация растворимого амилина в данных in vitro-анализах, как и ожидалось, увеличивается при добавлении небольших количеств предварительно агрегированного амилинового "затравочного" материала. В конкретном варианте осуществления изобретения синтетические ВЭЖХ-очищенные пептиды,представляющие собой 37 аминокислотных остатков человеческого или крысиного островкового амилоидного полипептида или амилина, могут быть получены стандартными методами синтеза пептидов или из коммерческого источника, такого как Bachem (Torrance, CA) или Peninsula Laboratories. Количественное образование агрегата с субмиллимолярными концентрациями амилина может быть детектировано в соответствии с процедурой, описанной LeVine (Protein Science, 1992, 2:404-410). Для этого флуоресценция агрегатов, добавленных к буферу 10 мкМ тиофлавина-Т (Aldrich)/50 мМ фосфата калия, рН 6,0, может быть измерена при возбуждении на 4505 нм и при детекции излучения на 48210 нм с использованием спектрофлуориметра Perkin-Elmer LS-50B. Альтернативно, для детекции агрегации может быть использовано двойное лучепреломление конго красного в поляризованном свете (Fraser et al., см. выше). К растворимому амилину могут быть добавлены небольшие количества ранее образованных агрегатов или "затравок нуклеации", и агрегация может быть инициирована, например, 0,1 М ацетатом натрия. Растворимый амилин (250 мкМ) и 0,2 М натриевофосфатный буфер, рН 7,5, могут быть инкубированы при 37 С для генерирования предварительно образованных агрегатов, называемых "амилиновой затравкой". После инкубирования измеряют концентрации белка в затравочных препаратах и доводят до конечной концентрации 150 мкМ добавлением буфера. Агрегация амилина при низких (физиологических) концентрациях может быть количественно определена методом, описанным Burdick et al. (J. Biol. Chem., 1992, 267:546-554). Синтетические препараты амилина разводят до конечной концентрации 5 нМ, предпочтительно, в присутствии различных "затравок". После проведения различных периодов инкубирования при 37 С могут быть оценены реакции агрегации. Оценка формы агрегации После образования комплекса амилоидоспецифического спектроскопического зонда с амилоидом этот комплекс может быть оценен спектрофотометрически. Спектроскопические свойства либо полипеп-8 005582 тида, либо красителя могут быть проанализированы, хотя для полипептида наибольшее количество нужной информации может быть получено с помощью спектроскопии КД в дальней УФ-области. Спектроскопия КД в дальней УФ-области Спектры КД в дальней УФ-области, полученные для свободного полипептида и для комплексов амилоидоспецифического спектроскопического зонда с агрегированным полипептидом, например, приблизительно в диапазоне от 200 нм до 260 нм, дают информацию о конформации данного полипептида. Действительно, этот спектр позволяет измерять дихроичную абсорбцию полипептида. Однако хотя данные предыдущих экспериментов продемонстрировали, что при агрегации А принимает вторичную складчатую конформацию, в первое время наблюдались различия в структуре агрегатов различных агрегированных форм и это различие может быть оценено. В нижеследующей таблице приводятся некоторые данные о конформации агрегированных А, образующих комплексы с конго красным, типичным сульфированным диазокрасителем, где указанные данные были получены, исходя из спектров КД в дальней УФ-области. Таблица 1. Данные о конформации А, полученные по спектрам КД в дальней УФ-области Спектроскопия КД в ближней УФ-области Спектры КД в ближней УФ-области, например, в диапазоне приблизительно от 300 до 700 нм, позволяют измерять поглощающую способность красителя, а поэтому могут быть использованы для оценки различных структур комплекса красителя и амилоида. Взятые отдельно полипептид и конго красный не продуцируют какого-либо заметного КД-сигнала в ближней УФ-области. Различия спектров КД, полученных для комплексов красителя и полипептидных агрегатов, являются очевидными при оценке интенсивности и длины волны максимального сигнала. В нижеследующей таблице, а также на фиг. 2 проиллюстрированы некоторые конформационные различия агрегированных А, образующих комплексы с конго красным, типичным сульфированным диазокрасителем, где указанные различия были обнаружены, исходя из спектров КД в ближней УФобласти. Таблица 2. Данные о конформации A, полученные исходя из спектров КД в ближней УФ-области.-9 005582 УФ-спектроскопия С помощью УФ-спектрального анализа можно дифференцировать абсорбционные спектры комплексов красителя с различными формами агрегации. Так, например, конго красный имеет различные УФ-абсорбционные свойства и различные спектральные свойства в зависимости от того, образует ли он комплекс с уже образованными агрегатами или с коагрегатами полипептида. При этом для специфического зондирования абсорбционных свойств красителя предпочтительно из спектров, полученных для комплексов, вычесть спектры, полученные для агрегированного амилоидного полипептида. Альтернативно, дифференциальные спектры УФ-поглощения красителя могут быть получены путем вычитания величины нормального поглощения красителя из величины поглощения красителя, образующего комплекс с агрегированным амилоидным полипептидом. УФ-спектры поглощения могут быть получены в диапазоне примерно от 200 до 700 нм, а предпочтительно, примерно от 250 до 700 нм. Имеющиеся различия в спектрах (см. фиг. 4), полученных для комплексов конго красного с амилоидным пептидом, по сравнению со спектрами, полученными для свободного конго красного, указывают на то, что эти комплексы являются гиперхромными; причем, их поглощающая способность в области 550 нм возрастает по сравнению со спектральной поглощающей способностью свободной формы. Спектры поглощения для обоих комплексов конго красного, связанного с ранее образованными агрегатами, и конго красного, связанного с коагрегатами, указывают на отрицательное поглощение в области 480 нм в различных спектрах. Возникновение спектральных различий обусловлено превращением свободного конго красного в его связанную форму и тем самым продуцированном батохромного смещения в его спектре поглощения. Исследование спектров, представленных на фиг. 3 и 4, также позволяет предположить, что в случае комплексов конго красного с уже образованными агрегатами, усиление поглощения в диапазоне длин волн 500-550 нм больше, чем в случае коагрегатов. Образование комплексов конго красного с амилоидным пептидом приводит к снижению поглощения света в области 480 нм, обусловленному свободной формой соединения, и к согласованному возрастанию поглощения света в спектральном диапазоне 500-550 нм, обусловленному образованием комплексов. Флуоресцентная спектроскопия Флуоресцентные спектры испускания или возбуждения красителя, например, конго красного, могут быть использованы для определения агрегированной формы амилоида. Флуоресцентные спектры комплексов конго красного с амилоидным полипептидом, по сравнению с эмиссионными спектрами свободной формы конго красного, слегка смещены в более длинноволновую область спектра ("красное" смещение). Эмиссионные спектры конго красного были зарегистрированы на длине волны возбуждения 500 нм. Максимум излучения комплексов конго красного центрирован примерно в 605 нм. Эмиссионные спектры свободного конго красного и конго красного в присутствии свежего полипептида (мономерного пептида) центрированы относительно 620 нм. Спектры возбуждения свободной и связанной форм конго красного также значительно отличаются. Максимум возбуждения связанной формы конго красного как в коагрегатах, так и в комплексах с ранее образованными агрегатами центрированы относительно 525 нм. Следовательно, эти спектры, по сравнению со свободной формой конго красного, значительно смещены в сторону "красной" области спектра. Различия в указанных флуоресцентных спектрах обусловлены изменениями в микроокружении конго красного при его связывании с амилоидным полипептидом. Помимо измерения интенсивности, для дифференциации амилоидных структур могут быть использованы и другие флуоресцентные методы, такие как (i) методы анизотропии флуоресценции и (ii) измерения флуоресцентного излучения с временным разрешением для идентификации времени затухания излучения конго красного в присутствии комплексов с коагрегатами и с уже образованными агрегатами. Метод анизотропии флуоресценции Поляризация или анизотропия флуорофоров обусловлена угловым смещением флуорофора при поглощении и излучении света. Угловое смещение зависит от скорости и степени вращательной диффузии во время возбужденного состояния флуорофора (Lakowicz, J.R., Principles of Fluorescence Spectroscopy,Plenum Press, New York, 1983). Диффузное движение зависит от нескольких параметров, причем, наиболее важным параметром для применения в настоящем изобретении является изменение размера и формы молекулы амилоидного белка. Методы флуоресцентной анизотропии могут быть использованы для определения увеличения молекулярного размера миелоидного белка, обусловленного взаимодействиями"белок-белок" после агрегации в отсутствие или в присутствии тестируемых соединений. Более конкретно, измерения поляризации основаны на том принципе, что небольшие молекулы являются "изотропными", т.е., они свободно вращаются в растворе. При их связывании с макромолекулой или присоединении к ней, вращательные и хаотичные движения замедляются, в результате чего излучение становится анизотропным. Если в качестве зондов используются самофлуоресцирующие небольшие молекулы, то после связывания с макромолекулой излучение указанных молекул становится "поляризованным" (Lee, Y.C., J.Biochem, 1997, 121(5):818-825). Изменения флуоресцентных свойств может быть использовано двумя способами. В первом способе изменения анизотропии флуоресценции небольших молекул, таких как конго красный, могут быть использованы для того, чтобы определить, являются ли размеры молекул комплексов данного белка различными. Во втором способе амилоидный полипептид может быть непо- 10005582 средственно помечен флуорофором для определения молекулярных размеров белка в двух различных случаях. В первом случае, в обычном эксперименте, поляризация флуоресценции свободного конго красного должна быть измерена в отсутствие амилоидного белка. Увеличение величины анизотропии связанной формы конго красного в комплексах коагрегатов тестируемых соединений по сравнению с его свободной формой может быть затем использовано для оценки различий в размерах и формах амилоидного белка как средства определения влияния тестируемых соединений на агрегацию полипептида. Во втором случае меченный флуорофором амилоидный пептид может быть использован для дифференциации агрегатов, образованных в присутствии конго красного или тестируемого соединения. Флуорофоры, такие как комплексы "рутений-бипиридил", флуоресцеин и родамин, являются подходящими зондами в анализах на анизотропию. Особенно подходящими для дифференциации молекулярного размера высокомолекулярных белков являются комплексы "рутений-лиганд". Комплексы рутениябипиридила имеют продолжительное время затухания порядка 400 нс по сравнению с другими флуорофорами, такими как флуоресцеиновые или родаминовые группы, у которых длительность флуоресценции обычно составляет порядка 10 нс. Более длительное время затухания рутениевых комплексов является подходящим для зондирования молекулярной массы белков с более крупными молекулами, которые хаотично движутся в растворе в более замедленном темпе. С другой стороны, флуорофоры, такие как флуоресцеин, могут быть использованы для дифференциации более мелких олигомеров А-пептида с молекулярной массой и размером, соответствующими 50000 Да. В типичном эксперименте тестируемое соединение или конго красный агрегируется в присутствии амилоидного белка. А-пептид может быть конъюгирован с флуорофорами, такими как флуоресцеин,родамин или рутений, с помощью стандартного химического взаимодействия сукцинимидиловых сложных эфиров и изотиоцианатных групп с получением меченного пептида (Szmacinski et al., Biophys. Chem. 1996, 62:109-120). В предварительным эксперименте определяют устойчивую анизотропию свободного флуорофора. Величина анизотропии меченного пептида должна быть мала вследствие быстрых хаотичных движений молекул. Старение флуоресцентного пептида в присутствии амилоидного белка должно приводить к увеличению величины анизотропии, обусловленному увеличением молекулярного размера и изменением формы амилоидного белка. Поскольку меченный пептид используется, главным образом,как флуоресцентный зонд, его концентрация должна быть приблизительно в 10-1000 раз ниже, чем концентрация амилоидного белка. Во втором эксперименте определяют величину анизотропии флуоресценции меченного пептида,контактирующего с амилоидным белком и тестируемым соединением в процессе старения. Увеличение анизотропии обусловлено увеличением молекулярной массы белка. Альтернативно, увеличение величин анизотропии может быть использовано для определения скорости образования агрегатов с более высокой молекулярной массой для идентификации эффектов тестируемых соединений. Флуоресценция с временным разрешением Кинетика затухания флуоресценции флуорофоров, таких как конго красный или флуоресцентно меченный пептид (описанный в методе анизотропии флуоресценции), может быть использована для идентификации и дифференциации комплексов тестируемых соединений с амилоидными белками. Этот метод основан на предположении, что длительность флуоресценции изменяется при связывании с белком,что обусловлено изменениями скоростей затухания излучательной и неизлучательной флуоресценции для связанных и свободных форм ингибитора. Время затухания флуоресценции конго красного может быть измерено с использованием прибора для определения частотной области или временной области. Так, например, может быть оценен параметр, среднее время жизни конго красного или флуоресцентных меченных пептидов. Среднее время жизни зависит от времени жизни и концентраций связанных и свободных форм флуорофора. Альтернативно, способ, основанный на определении времени жизни, может быть также применен к "живым" культурам нервных клеток. Распределение времени жизни может быть оценено для свободной и комплексной форм конго красного с помощью флуоресцентной визуализации клетки. Этот метод двумерной визуализации (FLIM или Fluorescence Lifetime Imaging) позволяет определить распределение конго красного, исходя из межклеточного взаимодействия путем пропускания этих форм через лазерный луч с использованием фазового проточного цитометра. Секретированные и внеклеточные формы амилоидных белков могут быть идентифицированы с использованием метода FLIM. Метод FLIM является очень эффективным для детекции амилоидного белка, секретируемого в среду клеточных культур или в образцах ткани. Инфракрасная и ЯМР-спектроскопия Инфракрасные спектры поглощения амилоидного белка являются ценным инструментом для определения структуры амилоидного белка в агрегатах при образовании комплексов с тестируемыми соединениями или конго красного. Частота полосы амида I, представляющей валентное колебание карбонила в пептидной связи, чувствительна к конформации пептидного остова, а следовательно, и ко вторичной структуре полипептида. Полоса амида I -складчатых структур соответствует поглощению при 16201640 см-1 и слабому поглощению при более высокой частоте 1680-1695 см-1. Изменения конформации- 11005582 амилоидного полипептида при агрегации указанного полипептида в отсутствие и в присутствии тестируемых соединений или сульфированных красителей могут быть интерпретированы, исходя из различий в полосе поглощения амида I. Аналогичным образом, ЯМР используют для получения информации о структуре белка при его агрегации в отсутствие и в присутствии тестируемых соединений или конго красного. Структура амилоидного полипептида может быть выявлена с использованием химических сдвигов, предпочтительно, протонов или других ядер, таких как 13 С или 15N. Для определения структур наиболее широко используются химические сдвиги протонов. В литературе сообщалось, что области -складок обнаруживают сдвиги в сторону слабого поля для Н-резонанса. С другой стороны, спиральные области обнаруживают сдвиги в сторону сильного поля. Исходя из серии данных, содержащей данные о 5000 амидных протонов и Нсдвигов, средние Н-положения в спиралях и складках отличаются почти на 0,8 м.д. с очень небольшим перекрыванием между указанными двумя распределениями (Methods in Enzymology, vol.239, Part С, pp. 363-392 (1994. Эта общая тенденция также справедлива для амидных протонов, а поэтому -складчатая форма может быть идентифицирована. Амидные протоны у N-конца спиралей, по сравнению с Сконцом, имеют тенденцию к смещению в сторону слабого поля. Поэтому такие химические сдвиги в протонных резонансах могут быть использованы для определения структурных различий полипептида в мономерах и агрегированных состояниях в присутствии и в отсутствие тестируемых соединений. Аналитическое ультрацентрифугирование В сочетании со спектроскопическими методами методы аналитического ультрацентрифугирования могут быть использованы для определения молекулярной массы в растворе и для оценки степени молекулярной гомогенности амилоидного полипептида. Методы осаждения могут быть использованы для того, чтобы быстро определить, присутствуют ли в растворе агрегаты амилоидного полипептида и является ли данный агрегат по своей природе обратимым или необратимым. Существует, в основном, два метода осаждения: метод, основанный на скорости осаждения, и метод, основанный на седиментационном равновесии. Первый метод позволяет быстро оценить размер, форму и молекулярную массу агрегированного полипептида. Последний метод может быть использован для определения молекулярной массы неосажденного полипептида ("плавучей" молекулярной массы). Различия в средней молекулярной массе полипептида, агрегированного в отсутствие и в присутствии тестируемых соединений, могут быть определены методами, основанными на скорости осаждения и седиментационном равновесии. Применение этих методов позволяет дифференцировать размер и природу агрегатов, таких как агрегаты, образованные в присутствии конго красного или других тестируемых соединений, а также оценивать эффективность тестируемых соединений в предотвращении агрегации полипептида на стадии образования агрегатов или на протяжении последующей стадии элонгации. Эта информация дополняет информацию о структурах, полученную спектроскопическими методами. Анализы Для определения способности оцениваемого тестируемого соединения к ингибированию или к реверсии амилоидоза in vitro может быть использован один или несколько вышеуказанных спектроскопических методов необязательно в сочетании с неспектроскопическим методом, таким как ультрацентрифугирование. Действительно, путем объединения данных, полученных более чем одним, а предпочтительно всеми спектроскопическими методами, описанными в данной заявке, можно с некоторой степенью точности и уверенности определить, каким образом тестируемое соединение влияет на образование амилоида. Эти данные имеют очень важное значение для скрининга и тестирования соединений, которые могут быть использованы для лечения заболеваний или расстройств, ассоциированных с амилоидозом, а в частности, с болезнью Альцгеймера. Используемый здесь термин "соединение" означает любую молекулу или комплекс нескольких молекул, которые влияют на амилоидоз. Настоящее изобретение относится к скринингу синтетических низкомолекулярных агентов, химических соединений, химических комплексов и их солей, а также к скринингу природных продуктов, таких как растительные экстракты или материалы, полученные из сбраживаемых сред. Другими молекулами, которые могут быть идентифицированы с использованием скрининга настоящего изобретения, являются фрагменты белков и пептидов, пептиды, нуклеиновые кислоты и олигонуклеотиды, углеводы, фосфолипиды и другие производные липидов, стероиды и производные стероидов, простагландины и родственные производные арахидоновых кислот и т.п. В одном из вариантов осуществления изобретения тестируемое соединение инкубируют с растворимым амилоидным полипептидом в условиях, способствующих агрегации, т.е., образованию амилоида или амилоидоза. Затем полученный материал, который может быть, а может и не быть агрегатом, подвергают контактированию с амилоидоспецифическим спектроскопическим зондом и получают один или несколько спектров. В другом варианте осуществления изобретения тестируемое соединение отделяют от полипептида перед добавлением красителя. В другом варианте осуществления изобретения краситель присутствует вместе с тестируемым соединением и растворимой формой амилоидного полипептида перед индуцированием агрегации.- 12005582 В еще одном варианте осуществления изобретения ранее образованный агрегат амилоидного полипептида обрабатывают тестируемым соединением для того, чтобы определить, какое влияние, если оно имеет место, оказывает тестируемое соединение на агрегат. Это действие может быть оценено посредством контактирования агрегата с красителем после его инкубирования с тестируемым соединением. В еще одном варианте осуществления изобретения само тестируемое соединение может представлять собой амилоидоспецифический спектроскопический зонд или родственную молекулу, обладающую хромофорными, а предпочтительно, флуорофорными свойствами. Таким образом, данное тестируемое соединение может быть использовано для зондирования агрегированной формы, а также для разрушения или ингибирования указанной агрегированной формы. Методы УФ- и флуоресцентной спектроскопии могут быть легко адаптированы для высокоэффективного скрининга, поскольку они могут быть модифицированы, чтобы основываться лишь на одном считывании данных для быстрого получения информации о структуре. Однако с использованием всех методов для всех подходящих спектров, можно идентифицировать более тонкие изменения в агрегированной форме, что должно способствовать идентификации перспективных соединений из числа тестируемых соединений-кандидатов. Хотя при осуществлении спектроскопических анализов все оценки проводили in vitro, можно использовать амилоидный полипептид из любого источника, т.е., природные или синтетические полипептиды. Так, например, может быть протестирована спинно-мозговая жидкость, которая может содержать А. В другом варианте осуществления изобретения может быть протестирована кровь, сыворотка или плазма, которые могут содержать один из различных амилоидных полипептидов. В другом варианте осуществления изобретения амилоидный полипептид может быть выделен из одного или нескольких источников и протестирован в стандартном буфере, поскольку физиологические жидкости, такие как СМЖ и кровь или продукты крови, могут препятствовать получению отчетливых спектров. Примеры Для лучшего понимания настоящего изобретения ниже представлены примеры, которые приведены лишь в иллюстративных целях и не должны рассматриваться как ограничение изобретения. Пример 1. Характеристика фибриллогенеза амилоидного пептида. Определение влияния небольших молекул-ингибиторов на самосборку амилоидогенных пептидов и соответствующего влияния на цитотоксичность все еще представляет интерес. В этих целях были разработаны методы количественной флуоресценции и КД-методы для определения степени фибриллизации пептида в присутствии или в отсутствие конго красного. В данной работе проиллюстрированы (i) одновременная оценка образования -складчатой конформации, исходя из изменений во флуоресценции тиофлавина Т и спектроскопии КД; (ii) влияние среды на скорость агрегации пептида; (iii) токсичность агрегированного пептида по отношению к клеточным культурам гиппокампа, определенная с использованием высвобождения ЛДГ в качестве индикатора; и (iv) взаимодействие конго красного с пептидом в присутствии тиофлавина. Методы Флуоресцентная спектроскопия. Тиофлавин связывается с амилоидными фибриллами с индуцировантем характерного гиперхромного флуоресцентного смещения в спектре (LeVine, J. Exp. Clin. Invest.,2:1-6, 1995). Индуцированная тиофлавином флуоресценция является специфической по отношению к амилоидным -складчатым фибриллам, но не по отношению к другим -складчатым структурам или к растворимым олигомерным формам данного пептида. Свободный тиофлавин является слабым флуорофором с максимумом возбуждения при 330 нм. После связывания с амилоидными фибриллами флуоресценция тиофлавина усиливается со сдвигом в сторону "красного" диапазона спектра возбуждения на 100 нм по сравнению с флуоресценцией его свободной формы. Для характеристики событий агрегации авторами настоящего изобретения было использовано увеличение интенсивности флуоресценции на длинах волн возбуждения и излучения 440 нм и 485 нм, соответственно. Было определено, что индуцированная флуоресценция тиофлавина подвергается значительному тушению в присутствии конго красного. В этих экспериментах стимулировали образование комплекса тиофлавина с агрегированным пептидом, а затем титровали возрастающими количествами конго красного. Происходящее в результате снижение интенсивности флуоресценции обусловлено передачей энергии флуоресцентного излучения тиофлавина конго красному. Поэтому очевидно, что в анализах, проведенных на основе лишь одного тиофлавина, генерируются ложноположительные сигналы, как это наблюдалось в первичных анализах, тогда как спектроскопические анализы, описанные в настоящем изобретении, должны идентифицировать более эффективные ингибиторы амилоидогенеза. Спектроскопия кругового дихроизма. Конформационное изменение пептида от формы случайной спирали до -складчатой формы в процессе старения прослеживали с использованием изменений молярной эллиптичности пептида при 200, 218 или 225 нм. Этот анализ был также использован для определения одновременных изменений в спектрах КД и в флуоресцентных спектрах тиофлавина. Спектр КД указанного пептида был сканирован в различные промежутки времени для корреляции образования связывающихся с тиофлавином макромолекулярных ансамблей с появлением -складчатой конформации.- 13005582 Спектроскопические анализы. Для определения степени агрегации в различные промежутки времени (вплоть до девяти часов) брали аликвоты данного пептида и разводили их в буфере PBS, содержащем 10 мкМ тиофлавина. Конечные концентрации пептида и тиофлавина в флуоресцентном анализе составляли 10 мкМ. После уравновешивания реакции в течение пяти минут интенсивности флуоресценции комплекса "пептид-тиофлавин" измеряли на длинах волн возбуждения и излучения 435 и 485 нм, соответственно. Сканирование флуоресцентных спектров проводили на длине волны возбуждения 435 нм и на длине волны излучения 485 нм с использованием спектрофлуориметра SPEX fluorolog-2 (Instruments S.A., Jobin Yvon-Spex, Edison, New Jersey). Для экспериментов на конго красном комплекс "пептид-тиофлавин" титровали конго красным в увеличивающихся концентрациях от 0,1 до 3,5 микромоль. Изменения интенсивности флуоресценции измеряли на вышеупомянутых спектральных длинах волн. При измерении интенсивности флуоресценции на планшет-ридере указанный пептид разводили в буфереPBS, содержащем 10 мкМ тиофлавина, до конечного объема 100 мкл. Спектры КД регистрировали на спектрополяриметре JASCO модели J715 (Jasco, Easton,Maryland) при комнатной температуре в ячейке с длиной пробега 0,1 см. Обычно брали аликвоты образцов пептидов через определенные интервалы времени для определения флуоресценции и спектры КД сканировали с использованием оставшегося раствора. Спектры КД указанного пептида регистрировали в дальнем УФ-диапазоне при от 190 до 260 нм. Спектральные результаты выражали как градуссм 3 дмоль-1. Анализ на нейротоксичность. Пептид агрегировали в соответствии с конечными точками, определенными в КД- и флуоресцентном анализе, и вносили в первичные культуры нервных клеток для оценки цитотоксичности агрегированного пептида. Высвобождение LDH использовали для мониторинга жизнеспособности клеток в присутствии А и конго красного. Токсичность А(1-40) оценивали in vitro с использованием культур гиппокампа (Е 18) восьмидневного плода крыс (DIV). Эти клетки культивировали в 48-луночных планшетах, предварительно сенсибилизированных 500 мкл/лунку 0,1 мг/мл поли-L-лизина (100 мкл/лунку), а затем 100 мкл/лунку 5 мкг/мл мышиного ламинина. Затем клетки высевали при плотности 92300 клеток/лунку в полном объеме 500 мкл среды NEUROBASAL, содержащей 1 х В 27 добавку, 5% термоинактивированную и высококачественную фетальную бычью сыворотку, 0,5 мМ глутамин, 50 мкг/мл пенициллина и 0,05 мг/мл стрептомицина и сначала помещали на воздух с 5% СO2 и с повышенной влажностью. Через двадцать четыре часа среду заменяли свежей средой, не содержащей пенициллина, стрептомицина и фетальной бычьей сыворотки, после чего эти культуры выдерживали на воздухе, содержащем 5% СO2 и 9% O2. На пятый день среду в каждой лунке заменяли свежей средой. На седьмой день in vitro среду заменяли средой, в которую был добавлен В 27 без антиоксиданта, и которая не содержала пенициллина, стрептомицина и фетальной бычьей сыворотки. Тест на токсичность инициировали на восьмой день in vitro путем замены в каждой лунке 500 мкл среды, используемой на седьмой день (в качестве контрольной обработки), или экспериментального раствора, полученного с использованием конечной (контрольной) среды. Каждый экспериментальный раствор тестировали на культурах, содержащихся в пяти лунках. Токсичность оценивали на одиннадцатый день in vitro с помощью анализа на (молочная кислота)-дегидрогеназу (LDH;Siqma 340-UV). Для проведения анализов на цитотоксичность агрегированный пептид пятикратно разводили до конечной концентрации 10 мкМ. Комплексы конго красного с ранее образованными агрегатами и комплексы, образованные в коагрегатах, тестировали в клеточных анализах вместе с агрегированным пептидом в носителях, используемых в качестве контроля. Получение амилоидного пептида. А (1-40) закупали у Anaspec (San Jose, California) и его химическая чистота была подтверждена методами обращенно-фазовой ВЭЖХ, ESI-MC и секвенирования белков. Для ускорения дезагрегации пептида этот лиофилизованный пептид растворяли в растворителе гексафторизопропаноле (HFIP). Пептид в растворителе HFIP хранили при -80 С. Перед использованием раствор пептида оттаивали и растворитель выпаривали в потоке азота. Для ускорения растворения пептида указанный пептид растворяли в буфере до концентрации 50 мкМ, обрабатывали ультразвуком приблизительно двадцать-сорок секунд, а затем подвергали быстрому встряхиванию в течение пяти или менее секунд. Для определения действия сред на скорости агрегации пептид растворяли в одном из следующих буферов: в PBS, в 50 мМ HEPES или в среде NEUROBASAL. Растворы пептидов распределяли по микротитрационным планшетам при конечной концентрации 45 мкМ в 100 мкл. Агрегацию инициировали путем непрерывного встряхивания планшетов на роторном шейкере. Результаты Появление связывающихся с тиофлавином структур происходит одновременно с образованием складчатой конформации пептида. Более высокие рН и ионная сила стимулируют агрегацию пептида Таблица 3. Действие буфера и среды на скорость агрегации А(1-40) Каждая величина представляет собой среднее для трех определений.означает, что агрегаты образуются, но не могут быть определены количественно, поскольку конечная точка не была достигнута. Процент агрегации вычисляли по отношению к флуоресценции тиофлавина/А в течение 0-4 ч. Пептид перемешивали в ротационном шейкере на скорости 500 об/мин в этом эксперименте.Относительные уровни агрегации очень чувствительны к скорости перемешивания. Амилоидный пептид изменяется от формы случайной спирали до модифицированной -складчатой конформации после выдерживания в PBS в течение девяти часов. Измененная конформация имеет полосу КД-поглощения с широким отрицательным экстремумом при 225 нм. Спектр КД со смещением в красную область, по всей вероятности, обусловлен образованием спирализованных -складчатых структур. Флуоресцентное излучение тиофлавина тушили в значительной степени наномолярными концентрациями конго красного. Степень тушения выравнивалась при микромолекулярных концентрациях конго красного, что указывало на то, что исходный сайт на пептиде был насыщен. Флуоресценцию связанного с пептидом тиофлавина гасили конго красным в количестве, превышающем один порядок величины, тогда как в случае свободного тиофлавина эффект тушения достигался только при 50%. Наблюдение того факта, что интенсивность флуоресценции гасится конго красным соответствует колокализации конго красного и тиофлавина на агрегированном пептиде. Конго красный оказывает нейропротективное действие на А-экспонированные клеточные культуры. Конго красный, представляющий собой комплекс с ранее образованными агрегатами, и в коагрегатах ослабляет токсичность А. Агрегированный пептид (образцы, подвергнутые старению в течение четырех часов) является токсичным по отношению к культурам нервных клеток, тогда как свежий пептид не обнаруживал токсичности в течение 72-часового анализа на токсичность. Обсуждение Данный пример показал, что превращение случайной спирали в -складчатую конформацию происходит одновременно с образованием тиофлавин-связывающих олигомерных структур пептида. Конго красный и тиофлавин неконкурентно связывается с агрегированным пептидом. Пример 2. Спектроскопическая оценка комплексов "конго красный - амилоид". Амилоидный пептид (А) подвергали старению в отсутствие и в присутствии конго красного, как описано ниже: А(1-40) растворяли в 100% гексафторизопропаноле до конечной концентрации 200 или 400 мкМ. Для растворения пептида раствор быстро обрабатывали ультразвуком примерно в течение пяти секунд. Соответствующий объем пептидного раствора переносили в сосуд янтарного цвета и растворитель выпаривали в потоке азота. Пептидную пленку растворяли в буфере PBS, рН 7,4, до конечной концентрации 50 мкМ. Пептидный раствор обрабатывали ультразвуком в течение 20 с, а затем интенсивно перемешивали в течение примерно пяти секунд. Для получения коагрегатов пептида с конго красным к пептиду добавляли краситель до конечной концентрации 10 мкг/мл, 20 мкг/мл или 30 мкг/мл. Маточные растворы пептида (пептид в наполнителе-контроле и пептид плюс конго красный) разделяли на аликвоты и распределяли по микротитрационным планшетам в конечном объеме 100 мкл на лунку. Агрегацию инициировали путем встряхивания планшетов при 500 об/мин. Для определения степени фибриллизации брали аликвоты образцов пептидов и пятикратно разводили в буфере PBS, содержащем 10 мкМ флуорофора, тиофлавина Т. Конечная концентрация пептида в образцах составляла 10 мкМ. Флуоресцентные эмиссионные спектры свободного тиофлавина и комплекса пептида-тиофлавина сканировали с использованием флуориметра, а в данном случае, флуориметраSPEX. Увеличение флуоресценции тиофлавина Т при длине возбуждения 450 нм (эмиссионный монохроматор при 485 нм) указывало на образование фибриллярного пептида. Альтернативно, в некоторых- 15005582 экспериментах был также использован планшетный флуориметр для измерения степени фибриллизации. В этих экспериментах флуоресценцию тиофлавина Т измеряли в планшетном флуориметре TECAN(Tecan U.S. Inc., Research Triangle Park, North Carolina) с использованием фильтра возбуждения на 440 нм и фильтра излучения на 490 нм. Спектроскопию КД использовали для определения времени агрегации в присутствии конго красного и превращения пептида из формы случайной спирали в свежем состоянии в -складчатую форму в состоянии старения. Старение пептида в течение девяти часов дает смещение в спектре -складчатой формы в сторону красного диапазона, что, вероятно, обусловлено образованием спирализованных складчатых структур. Для получения комплексов конго красного с ранее образованными фибриллами подвергнутый старению пептид объединяли с конго красным при конечной концентрации 10 мкг/мл, 20 мкг/мл и 30 мкг/мл. КД-анализ Спектры КД в дальней УФ-области для комплексов конго красного с ранее агрегированным пептидом и пептидными коагрегатами сканировали в диапазоне 200 нм - 260 нм (фиг. 1). Отрицательный экстремум при 200 нм указывает на конформацию случайной спирали свежего пептида. Старение индуцировало конформационное изменение с образованием -складчатой формы. Спектр КД пептида, подвергнутого старению в отсутствие конго красного, соответствует отрицательному экстремуму при 225 нм и положительному экстремуму при 205 нм. Указанное отрицательное поглощение при 225 нм со смещением в сторону красного диапазона, вероятно, обусловлено образованием спирализованных -складчатых структур. На указанное смещение в спектре КД ранее для образованных агрегатов пептида в сторону красного диапазона спектра не влияло образование комплексов с конго красным. В противоположность спектрам КД ранее образованных агрегатов спектр КД пептида, подвергнутого старению в присутствии конго красного (коагрегатов), соответствовал полосе отрицательного поглощения спектра КД при 218 нм, что обусловлено укладкой пептида в типичную -складчатую конформацию. Спектр КД также указывал на увеличение вклада, вносимого в указанные коагрегаты, формой случайной спирали, что дает основание предполагать, что скорость агрегации замедлялась в присутствии конго красного. Различия в спектрах КД указанных двух форм пептида были обусловлены увеличением вклада, вносимого формой случайной спирали в указанные коагрегаты, а также образованием измененных агрегированных структур данного пептида. Спектры КД в ближней УФ-области для пептидных образцов сканировали в диапазоне 700-330 нм. Эта область может быть использована для дифференциации комплексов конго красного. Взятый отдельно пептид в буфере и свободный конго красный не продуцировали заметного КД-сигнала в ближней УФобласти. Различия в интенсивности и длинах волн максимального поглощения в спектрах КД, полученных для коагрегатов и для образованных ранее агрегатов, были очевидны; причем, спектры КД коагрегатов были слабее, чем спектры КД ранее образованных агрегатов (фиг. 2; см. табл. 2). Спектр КД комплексов ранее агрегированного пептида с конго красным соответствует полосе отрицательного поглощения при 580 нм и полосе положительного поглощения при 516 нм. Интенсивность КД-полос была пропорциональна концентрации комплексов. Спектр КД коагрегатов соответствовал положительной линии,центрированной относительно 545 нм. Различия в спектрах указанных комплексов обусловлены образованием различных состояний образования комплексов конго красного. Экситонные двухполосные спектры КД указывают на образование комплексов конго красного с упорядоченной -складчатой конформацией пептида. УФ-спектральный анализ УФ-спектральный анализ был использован для дифференциации спектров поглощения двух комплексов ранее агрегированного пептида и коагрегатов с конго красным. На фиг. 3 проиллюстрировано различие в спектрах комплексов конго красного с полипептидом, измеренных для пептида, подвергнутого старению, где указанные комплексы в первом случае представляют собой коагрегаты амилоидного пептида с конго красным и во втором случае - комплекс конго красного с ранее образованным полипептидным агрегатом. Поскольку общая концентрация конго красного является одной и той же в обоих комплексах, то различия в интенсивностях поглощения дают основания предположить, что комплекс с ранее образованным агрегатом является гиперхромным по отношению к данному коагрегату. На фиг. 4 проиллюстрировано различие в спектрах комплексов конго красного, коагрегата и ранее образованного агрегата, измеренных при эквивалентных концентрациях свободного конго красного, где максимум центрирован относительно 480 нм, тогда как максимум поглощения образующих комплексы форм слегка смещен в сторону длинноволновой области. Поэтому пик отрицательного поглощения на фиг. 4, центрированный относительно 480 нм, обусловлен истощением свободного конго красного из-за связывания с амилоидным полипептидом. Аналогичным образом, пик положительного поглощения, центрированный относительно 530 нм, а особенно комплекса конго красного с ранее образованным агрега- 16005582 том, обусловлен изменением свойств поглощения конго красного после образования комплексов. Этот комплекс имеет максимум поглощения, центрированный относительно 530 нм, тогда как максимум поглощения для коагрегата достигает пика при 530 нм и сохраняет абсорбционные свойства за пределами 530 нм. Следовательно, спектры поглощения коагрегата и ранее образованных комплексов отличаются по существенным абсорбционным свойствам конго красного в коагрегатах и в ранее образованных комплексах и конго красного в свободном состоянии. Такие спектральные изменения конго красного, вероятно, индуцированы изменениями в электронном состоянии или в свойствах конго красного. Флуоресцентный анализ Флуоресцентные эмиссионные спектры комплексов конго красного были получены после пятикратного разведения пептида в забуференном растворе. Конго красный добавляли к свежеразведенному фибриллярному пептиду и флуоресцентный спектр сканировали при конечной концентрации 10 мкМ пептида. Концентрации пептида и конго красного в флуоресцентном анализе составляли 10 мкМ и 8,6 мкМ, соответственно. Различия в интенсивностях флуоресценции и в длинах волн излучения коагрегатов и ранее образованных агрегатов-комплексов обусловлены относительными различиями в гидрофобности сайтов связывания в обоих случаях. Обсуждение Результаты спектроскопических анализов, описанных в данном примере, показывают, что ингибиторы амилоида, такие как конго красный, образуют различимые комплексы с амилоидным пептидом. Поскольку эти комплексы способствуют аттенюации нейротоксичности данного пептида, то существует необходимость медицинского использования этих веществ в соответствии со стадией болезни. Описанные результаты показали, что конго красный связывается, и следовательно, снижает токсичность агрегированного пептида. Хотя конго красный не полностью ингибирует превращение формы случайной спирали пептида в его -складчатую форму, однако, результаты, описанные выше, показали, что конго красный стабилизирует промежуточную агрегированную форму амилоидного пептида. Ингибиторы, которые продуцируют такие эффекты, должны быть точно оценены в отношении in vitro активности в моделях болезни Альцгеймера для определения возможности введения таких веществ в терапевтических или в профилактических целях. Описанные здесь спектроскопические методы могут быть использованы для идентификации и дифференциации ингибиторов амилоидогенеза и для определения молекулярного механизма действия антиагрегационных ингибиторов, которые могут быть затем использованы в качестве средств против болезни Альцгеймера в программах разработки лекарственных средств, а также действия других потенциальных ингибиторов амилоидогенного фибриллогенеза, ассоциированного с другими заболеваниями и расстройствами. Объем настоящего изобретения не ограничен вышеописанными конкретными вариантами его осуществления. Действительно, помимо вышеописанных вариантов в настоящее изобретение могут быть внесены различные модификации, которые очевидны, исходя из приведенного выше описания изобретения и прилагаемого к нему графического материала. Такие модификации также входят в объем прилагаемой формулы изобретения. Кроме того, следует отметить, что все размеры оснований или размеры аминокислот, а также все молекулярные массы или значения молекулярных масс являются приблизительными и приводятся лишь в иллюстративных целях. Все патенты, патентные заявки, публикации и другие материалы, цитированные в настоящей заявке, во всей своей полноте вводятся в настоящее описание посредством ссылки. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ определения агрегационной конформации амилоидного полипептида, предусматривающий сравнение (а) спектроскопического свойства амилоидоспецифического спектроскопического зонда,образовавшего комплекс с амилоидным полипептидом, имеющим неизвестную агрегационную конформацию, и (b) предварительно определенного спектроскопического свойства амилоидоспецифического спектроскопического зонда, образовавшего комплекс с амилоидным полипептидом известной агрегационной конформации, где путем указанного сравнения определяется агрегационная конформация амилоидного полипептида, имеющего неизвестную агрегационную конформацию. 2. Способ по п.1, где указанным амилоидоспецифическим спектроскопическим зондом является связывающийся с амилоидом краситель. 3. Способ по п.2, где указанным связывающимся с амилоидом красителем является сульфированный диазокраситель или его аналог. 4. Способ по п.3, где указанным сульфированным диазокрасителем является конго красный. 5. Способ по п.1, где указанным амилоидоспецифическим спектроскопическим зондом является меченный флуорофором пептид. 6. Способ по п.1, где указанным амилоидным полипептидом является -амилоидный (А) пептид.- 17005582 7. Способ по п.1, где указанные спектроскопические свойства оценивают по спектрам амилоидного полипептида, полученным с использованием спектроскопии кругового дихроизма (КД) в дальней УФобласти. 8. Способ по п.1, где указанные спектроскопические свойства оценивают по спектрам сульфированного диазокрасителя, полученным с использованием спектроскопии кругового дихроизма (КД) в ближней УФ-области. 9. Способ по п.1, где указанные спектроскопические свойства оценивают с помощью ультрафиолетовой (УФ) спектроскопии. 10. Способ по п.1, где указанные спектроскопические свойства оценивают с помощью флуоресцентной спектроскопии. 11. Способ по п.1, где указанный амилоидный полипептид агрегирован в фибриллярной форме. 12. Способ по п.1, где указанный амилоидный полипептид коагрегирован с амилоидоспецифическим спектроскопическим зондом. 13. Способ детекции действия тестируемого соединения, направленного на ингибирование, разрушение или дезагрегацию амилоида, где указанный способ предусматривает корреляцию (а) спектроскопического свойства комплекса амилоидоспецифического спектроскопического зонда и агрегированного амилоидного полипептида, подвергнутого контакту с тестируемым соединением, с (b) предварительно определенным спектроскопическим свойством комплекса амилоидоспецифического спектроскопического зонда в отсутствие тестируемого соединения, где различия в спектроскопических свойствах указывают на то, что тестируемое соединение влияет на образование амилоида или его стабильность. 14. Способ по п.13, где амилоидоспецифический спектроскопический зонд контактирует с ранее образованным агрегатом амилоидного полипептида. 15. Способ по п.13, где амилоидоспецифический спектроскопический зонд образует коагрегат с амилоидным полипептидом. 16. Способ по п.13, где указанным амилоидоспецифическим спектроскопическим зондом является связывающийся с амилоидом краситель. 17. Способ по п.16, где указанным связывающимся с амилоидом красителем является сульфированный диазокраситель или его аналог. 18. Способ по п.17, где указанным сульфированным диазокрасителем является конго красный. 19. Способ по п.15, где указанным амилоидоспецифическим спектроскопическим зондом является меченный флуорофором пептид. 20. Способ по п.10, где указанным амилоидным полипептидом является -амилоидный (А) пептид. 21. Способ по п.13, где указанные спектроскопические свойства оценивают по спектрам амилоидного полипептида, полученным с использованием спектроскопии кругового дихроизма (КД) в дальней УФ-области. 22. Способ по п.13, где указанные спектроскопические свойства оценивают по спектрам сульфированного диазокрасителя, полученным с использованием спектроскопии кругового дихроизма (КД) в ближней УФ-области. 23. Способ по п.13, где указанные спектроскопические свойства оценивают с помощью ультрафиолетовой (УФ) спектроскопии. 24. Способ по п.13, где указанные спектроскопические свойства оценивают с помощью флуоресцентной спектроскопии. 25. Способ по п.13, где указанный амилоидный полипептид агрегирован в фибриллярной форме.
МПК / Метки
МПК: G01N 33/68
Метки: амилоидогенных, способы, белков, детекции
Код ссылки
<a href="https://eas.patents.su/20-5582-sposoby-detekcii-amiloidogennyh-belkov.html" rel="bookmark" title="База патентов Евразийского Союза">Способы детекции амилоидогенных белков</a>
Предыдущий патент: Полипептиды цитокина zcyto 10 человека и мыши, кодирующие их полинуклеотиды и антитела к указанным полипептидам
Следующий патент: Применение ингибиторов il-18
Случайный патент: Преобразователь колебаний