Гибридный белок, образующий гетеродимеры, способ его получения и использования
Номер патента: 2474
Опубликовано: 27.06.2002
Авторы: Чаппел Скотт К., Кэмпбелл Роберт К., Джеймсон Бредфорд А.
Формула / Реферат
1. Гибридный белок, содержащий две коэкспрессируемые аминокислотные последовательности, образующие гетеродимер, каждая из которых представляет собой:
а) по крайней мере, одну аминокислотную последовательность, выбранную из группы, состоящей из цепи гомомерного рецептора или его фрагмента, цепи гетеродимерного рецептора или его фрагмента, лиганда, другого, чем гонадотропный гормон или его фрагмент, легкой или тяжелой цепи антитела, легкой цепи антитела, которая ассоциирована с соответствующей тяжелой цепью антитела, и тяжелой цепи антитела, которая ассоциирована с соответствующей легкой цепью антитела, причем указанный лиганд или фрагмент сохраняет лиганд-рецептор-связывающую активность и указанная цепь указанного гомомерного рецептора или его фрагмента и указанная цепь указанного гетеромерного рецептора или его фрагмента сохраняют лиганд-рецептор-связывающую активность либо сами по себе, либо в ассоциации с гомологичной или гетерологичной цепью указанного рецептора; и
б) субъединицу гетеродимерного белкового гормона или ее фрагмент, который сохраняет способность образовывать гетеродимер с другими субъединицами данного гормона, причем последовательности а) и б) связаны непосредственным образом или через пептидный линкер, а последовательность б) при совместной экспрессии двух указанных последовательностей обладает способностью к агрегации с образованием гетеродимера.
2. Гибридный белок по п.1, отличающийся тем, что последовательность а) выбирают из группы, состоящей из TNF связывающего белка (ТВР1), TNF связывающего белка 2(ТВР2) или фрагмента указанных ТВР1 или ТВР2, включающего лиганд-связывающий домен, внеклеточного домена рецептора IFNa/b или IFNg, рецептора гонадотропного гормона или его внеклеточных фрагментов, легких цепей антитела или их фрагментов, необязательно ассоциированных с соответствующими тяжелыми цепями, тяжелых цепей антитела или их фрагментов, необязательно ассоциированных с соответствующими легкими цепями, Fab-доменов антитела и интерлейкина 6, интерферона-бета, тромбопоэтина или их фрагментов.
3. Гибридный белок по п.1, отличающийся тем, что указанную последовательность б) выбирают из группы, состоящей из субъединиц хорионического гонадотропина человека (ХГЧ, hCG), фолликулостимулирующего гормона (ФСГ, FSH), лютеинизирующего гормона (ЛГ, LH), тиреостимулирующего гормона (TSH) или ингибина или их фрагментов.
4. Гибридный белок по п.1, отличающийся тем, что последовательность а) присоединена либо непосредственным образом, либо через пептидный линкер к N-концу последовательности б).
5. Гибридный белок по п.1, отличающийся тем, что последовательность а) присоединена либо непосредственным образом, либо через пептидный линкер к С-концу последовательности б).
6. Гибридный белок по п.1, отличающийся тем, что последовательность а) представляет собой последовательность TNF связывающего белка 1 (ТВР1) или его фрагмента, включающего аминокислотные остатки 20-161 или 20-190, а последовательность б) представляет собой альфа- и бета-субъединицы гонадотропина.
7. Гибридный белок по п.1, отличающийся тем, что последовательность а) представляет собой внеклеточный домен гормона гонадотропного рецептора, а последовательность б) представляет собой альфа- и бета-субъединицы гонадотропина.
8. Гибридный белок по п.7, отличающийся тем, что последовательность а) представляет собой внеклеточный домен рецептора фолликулостимулирующего гормона (FSH), а последовательность б) представляет собой субъединицу FSH.
9. Гибридный белок по п.7, отличающийся тем, что указанные последовательности а) и б) соединены пептидным линкером.
10. Гибридный белок по п.9, отличающийся тем, что указанный пептидный линкер содержит расщепляемый ферментом сайт.
11. Гибридный белок по п.10, отличающийся тем, что указанный расщепляемый ферментом сайт представляет собой сайт, расщепляемый тромбином.
12. Гибридный белок по п.10, отличающийся тем, что указанный расщепляемый ферментом сайт распознается и расщепляется ферментом, который обнаруживается в яичнике.
13. Гибридный белок по п.9, отличающийся тем, что указанный пептидный линкер служит в качестве подвижного шарнира.
14. Гибридный белок по п.1, в котором добавлена одна или более связей между каждой последовательностью б), которые агрегируют с образованием гетеродимера.
15. Последовательность ДНК, кодирующая гибридный белок по п.1.
16. Экспрессирующий вектор, содержащий последовательность ДНК по п.15.
17. Линия клеток, содержащая экспрессирующий вектор по п.16 и способная экспрессировать указанный гибридный белок.
18. Способ продуцирования гибридного белка, включающий культивирование линии клеток по п.17 и выделение экспрессируемого в указанных клетках гибридного белка.
19. Фармацевтическая композиция, включающая гибридный белок по п.1 и фармацевтически приемлемый носитель и/или наполнитель.
20. Способ индуцирования созревания фолликулов, включающий введение нуждающемуся в этом субъекту фармацевтической композиции, содержащей гибридный белок по п.8.
Текст
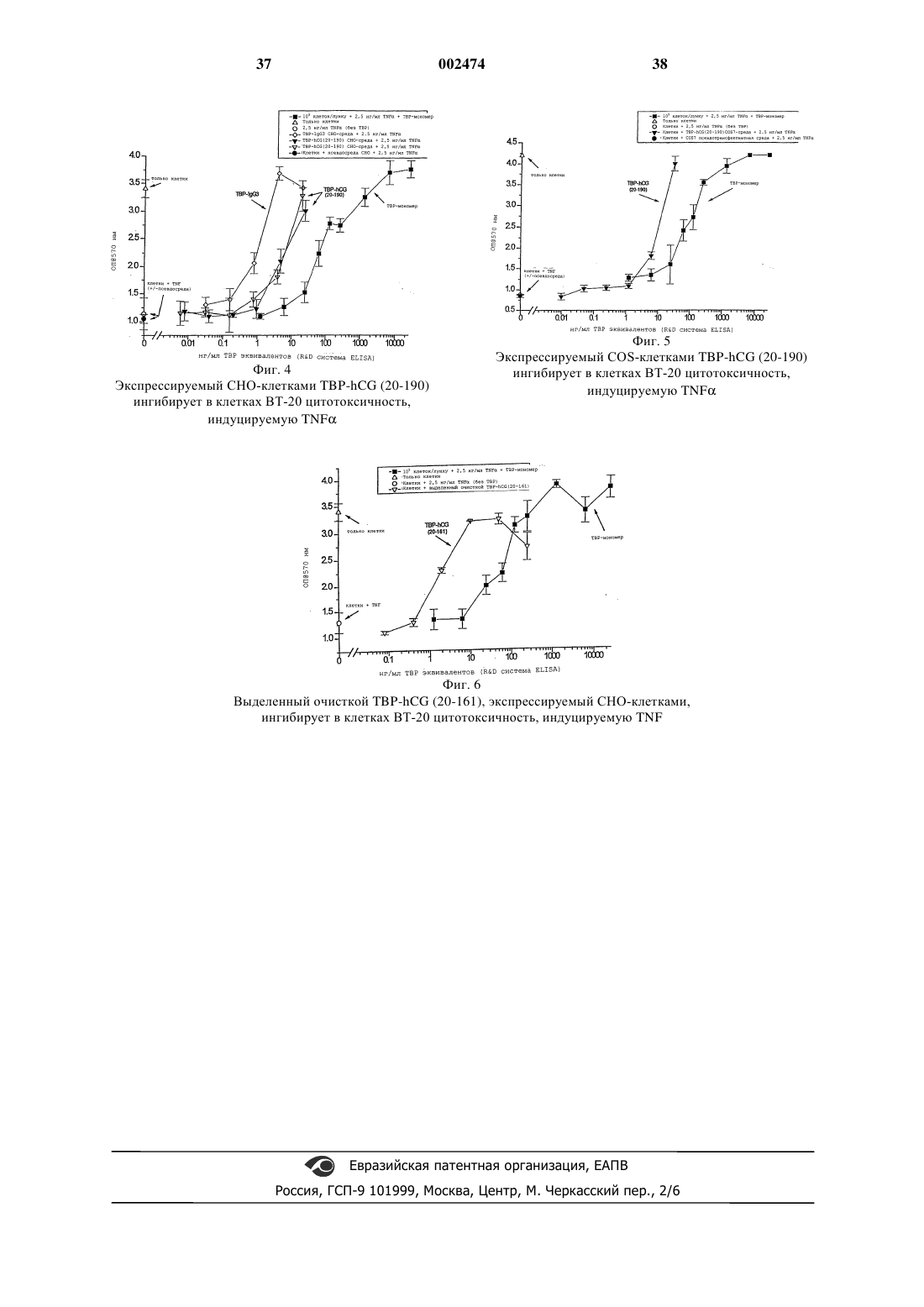
1 Область техники, к которой относится изобретение Настоящее изобретение относится к гибридному белку, содержащему две коэкспрессируемые аминокислотные последовательности,образующие гетеродимер, каждая из которых представляет собой: а) по крайней мере, одну аминокислотную последовательность, выбранную из группы, состоящей из цепи гомомерного рецептора или его фрагмента, цепи гетеродимерного рецептора или его фрагмента, лиганда другого, чем гонадотропный гормон или его фрагмент, легкой или тяжелой цепи антитела, легкой цепи антитела, которая ассоциирована с соответствующей тяжелой цепью антитела, и тяжелой цепи антитела, которая ассоциирована с соответствующей легкой цепью антитела, причем указанный лиганд или фрагмент сохраняет лиганд-рецептор связывающую активность, и указанная цепь указанного гомомерного рецептора или его фрагмента и указанная цепь указанного гетеромерного рецептора или его фрагмента сохраняют лиганд-рецептор связывающую активность либо сами по себе, либо в ассоциации с гомологичной или гетерологичной цепью указанного рецептора; и б) субъединицу гетеродимерного белкового гормона, или ее фрагмент, который сохраняет способность образовывать гетеродимер с другими субъединицами данного гормона, причем последовательности а) и б) связаны непосредственным образом или через пептидный линкер, а последовательность б) при совместной экспрессии двух указанных последовательностей обладает способностью к агрегации с образованием гетеродимера. Кроме того, изобретение раскрывает последовательность ДНК, кодирующую гибридный белок, экспрессирующий вектор,содержащий указанную ДНК, линию клеток,содержащую указанный экспрессирующий вектор, способ продуцирования гибридного белка,фармацевтическую композицию, включающую гибридный белок и способ индуцирования созревания фолликулов. Уровень техники Взаимодействия белок-белок существенны для нормальных физиологических функций клеток и многоклеточных организмов. Многие природные белки проявляют новые или оптимальные функции, при образовании комплексов с одним или несколькими иными белковыми цепями. Это можно проиллюстрировать разнообразными лиганд-рецепторными сочетаниями,которые участвуют в регуляции клеточной активности. Некоторые лиганды, такие как фактор некроза опухолей (TNF TNF или хорионический гонадотропин человека (hCG),встречаются в виде мультисубъединичных комплексов. Некоторые из этих комплексов содержат множество копий одной и той же субъеди 002474 ницы. TNF и TNF (приводимые здесь совместно в качестве hCG) представляют собой гомотримеры, формируемые с помощью трех идентичных субъединиц (1-4). Другие лиганды составлены из неидентичных субъединиц. Например, hCG представляет собой гетеродимер(5-7). Рецепторы могут также встречаться или функционировать в виде мультицепочечных комплексов. Например, рецепторы для TNF преобразуют сигнал после агрегирования с образованием димеров (8, 9). Лиганды с этими рецепторами стимулируют агрегацию двух или трех рецепторных цепей, тем самым позволяя осуществляться механизму рецепторной активации. Например, TNF-опосредованная агрегация активирует рецепторы TNF (10-12). Модуляция взаимодействий белок-белок может быть полезным механизмом для терапевтического вмешательства при различных заболеваниях и патологиях. Растворимые связывающиеся белки, которые могут взаимодействовать с лигандами, потенциально могут отделять данный лиганд от данного рецептора, тем самым снижая активацию этого отдельного рецепторного пути. И наоборот, отделение лиганда может замедлять его элиминацию или деградацию, увеличивая тем самым длительность его действия и, возможно, его явную активность inTNF поначалу ассоциировали с ингибированием активности TNF (13-17). Растворимые связывающиеся белки могут быть полезны для лечения заболеваний человека. Например, было показано, что растворимые рецепторы TNF эффективны в моделях артрита на животных (18, 19). Поскольку TNF обладает тремя участками связывания со своим рецептором (10-12), а димеризация клеточно-поверхностного рецептора является достаточной для биоактивации (8, 9),кажется вероятным, что связывание одиночного растворимого рецептора с TNF оставляет открытой возможность того, что этот комплекс,растворимый рецептор; ТNF, 1:3, (тример) может связать и активировать еще пару клеточноповерхностных рецепторов TNF. Следует ожидать, что для ингибирующего эффекта два участка связывания рецептора в данном TNFтримере должны быть заняты или блокированы растворимым связывающим белком. С другой стороны, связывающий белок мог бы блокировать надлежащую ориентацию TNF на поверхности клетки. В общем, осознавалась необходимость синтезировать белки, которые содержат две рецепторные (или лигандные) цепи, в виде димерного гибридного белка. См. Wallach с соавт. Патент США 5478925. Первоначальный подход, примененный для образования димерных или мультимерных гибридных белков, содержащих домены связы 3 вания из внеклеточных рецепторов, заключался в слиянии этих белков с константными областями тяжелой цепи антитела. Эта стратегия привела, например, к созданию СD4-иммуноадгезинов (20). Они представляют собой гибридные молекулы, состоящие из первых двух (или всех четырех) иммуноглобулиноподобных доменов из CD4, слитых с константной областью тяжелой и легкой цепей антитела. Данный способ создания гибридных молекул был адаптирован к рецепторам TNF(10, 16, 21) и привел к образованию конструктов с высшей активностью in vitro, чем у мономерных растворимых связывающих белков. Широко распространено, что наивысшая invitro эффективность при димерном слиянии белков должна преобразовываться в наивысшуюin vivo активность. В одном исследовании это подтверждается обнаружением, по крайней мере, более чем 50-кратным превышением активности слитого белка р 75 (TBP2)-ig в защите мышей от последствий внутривенной инъекцииLPS (16). Однако, несмотря на широко распространенное применение иммуноглобулиновых слитых белков, данная стратегия страдает некоторыми недостатками. Один из них состоит в том,что несколько иммуноглобулиновых Fсдоменов принимают участие в эффекторных функциях иммунной системы. Эти функции могут быть неподходящими для конкретного терапевтического назначения (22). Второе ограничение относится к специальным случаям, где желательно получить гетеромерные слитые белки, например водорастворимые аналоги гетеромерного IL-6 или рецепторы интерферона типа I. Хотя существуют многочисленные способы получения бифункциональных антител (например, путем котрансфекции или гибридомных слияний), эффективность синтеза является весьма проблематичной при смешивании гомодимеров и гетеродимеров, которые обычно получают (23). Недавно появилось несколько сообщений, описывающих использование мотивов лейциновая застежка для ориентации сборки из гетеродимеров (24-26). Она, по всей вероятности, представляется многообещающей для исследовательских целей, но используемые неприродные или внеклеточные последовательности непригодны для постоянного применения в клинике из-за антигенности. Эффективность сборки и устойчивость после сборки могут также иметь ограничения. С другой стороны, для конкретного случаяTNF-рецепторов было обнаружено, что определенные модификации рецептора р 55 TNF содействуют гомодимеризации и свидетельствуют об отсутствии лиганда (27, 28). Установлено, что цитоплазматическая область данного рецептора,называемая "доменом смерти", может действовать в качестве гомодимеризационного мотива(28, 30). В качестве альтернативы иммуноглобу 002474 4 линовому гибридному белку, слияние внеклеточного домена TNF-рецептора с его цитоплазматическим доменом смерти могло бы, предположительно, дать секретируемый белок, который может димеризоваться в отсутствие ТNF. Такие слитые белки были описаны и заявлены в международной патентной заявке WO 95/31544. Третьим, следующим подходом, используемым для образования димеров растворимыхTNF-рецепторов, явилось химическое перекрестное связывание мономерных белков с полиэтиленгликолем (31). Сущность изобретения Одну из альтернатив получения таких димерных белков, предлагающих некоторые важные преимущества, предоставляет настоящее изобретение, которое состоит в использовании природной гетеродимерной клеточной структуры, корреспондирующей с циркулирующим неиммуноглобулиновым белком с продолжительным временем полужизни. Предпочтительный пример представляет собой hCG, белок,который хорошо секретируется, обладает хорошей стабильностью и обладает продолжительным временем полужизни (32-33). С установлением выдающейся роли hCG в качестве маркера беременности, создано много реагентов для количественного анализа и изучения белка in vitro и in vivo. Кроме того, hCG широко изучали с использованием мутагенеза и стало известно,что небольшие деления в данном белке, такие как удаление пяти остатков на краю карбоксильного конца -субъединицы, могут эффективно элиминировать ее биологическую активность с сохранением ее способности к образованию гетеродимера (34, 35). Было показано, что небольшие инсерции, до 30 аминокислот, допустимы на аминном и карбоксильном концах-субъединицы, хотя слияние -субъединицы с карбоксильным концом -субъединицы также мало влияет на образование гетеродимера (37). Сообщалось также об аналоге hCG, в котором иммуноглобулинoвый Fc-домен был слит с С-концом hCG-субъединицы; однако, эта конструкция не секретировалась и попытки объединить ее с -субъединицей не предпринимались(38). По этой причине главную цель настоящего изобретения представляет гибридный белок. Гибридный белок, содержащий две коэкспрессируемые аминокислотные последовательности, образующие гетеродимер, каждая из которых представляет собой: а) по крайней мере, одну аминокислотную последовательность, выбранную из группы, состоящей из цепи гомомерного рецептора или его фрагмента, цепи гетеродимерного рецептора или его фрагмента, лиганда, другого, чем гонадотропный гормон или его фрагмент, легкой или тяжелой цепи антитела, легкой цепи антитела, которая ассоциирована с соответствующей 5 тяжелой цепью антитела, и тяжелой цепи антитела, которая ассоциирована с соответствующей легкой цепью антитела, причем указанный лиганд или фрагмент сохраняет лиганд-рецептор связывающую активность и указанная цепь указанного гомомерного рецептора или его фрагмента и указанная цепь указанного гетеромерного рецептора или его фрагмента сохраняют лиганд-рецептор связывающую активность либо сами по себе, либо в ассоциации с гомологичной или гетерологичной цепью указанного рецептора; и б) субъединицу гетеродимерного белкового гормона, или ее фрагмент, который сохраняет способность образовывать гетеродимер с другими субъединицами данного гормона, причем последовательности а) и б) связаны непосредственным образом или через пептидный линкер, а последовательность б) при совместной экспрессии двух указанных последовательностей обладает способностью к агрегации с образованием гетеродимера. В соответствии с настоящим изобретением, линкер может быть энзиматически расщепляемым. Последовательность (а) предпочтительно выбрана из внеклеточного домена рецептораTNF 1 (55 кД, называемого также TNP 1), внеклеточного домена рецептора TNF 2 (75 кД, называемого также TNP 2), или их фрагментов,содержащая, кроме того, домен связывания лиганда; внеклеточных доменов из рецепторов IL6IFN; гонадотропинового рецептора или его внеклеточных фрагментов; легких цепей антитела,или их фрагментов, необязательно ассоциированных с соответствующими тяжелыми цепями; тяжелыми цепями антитела, или их фрагментами, необязательно ассоциированных с соответствующими легкими цепями; Fab-доменов антитела; или лигандных белков, такими как цитокины, факторов роста или гормонов, иных чем гонадотропины, конкретные примеры которых включают IL-6, IFN-, ТРО, или их фрагменты. Последовательность (b) предпочтительно выбрана из hCG, FSH, LH, TSN, субъединицы ингибина, или их фрагментов. Модификации белков, такие как химическое или протеазное расщепление основной цепи, либо химическая или энзиматическая модификация некоторых аминокислотных боковых цепей, может использоваться для приведения данных компонентов гибридного белка настоящего изобретения в неактивное состояние. Это ограничение активности можно также осуществить с помощью использования методик рекомбинантной ДНК для изменения кодирующей последовательности данного гибридного белка способом, что непосредственно ведет к ограничению активности по одному из компонентов 6 или что придает данному белку большую склонность к последующей химической или энзиматической модификации. Вышеуказанные гибридные белки будут давать монофункциональные, бифункциональные или мультифункциональные молекулы, в зависимости от аминокислотных последовательностей (а), которые объединены с (b). В каждой паре (а) может соединяться с аминоконцом или с карбоксиконцом (b) или с обоими. Моноклональный гибридный белок настоящего изобретения может, например, включать внеклеточный домен гонадотропинового рецептора, присоединенный к одной из аналогичных рецептор-связывающихся субъединиц гонадотропина. В соответствии с таким вариантом осуществления настоящего изобретения,гибридный белок настоящего изобретения может быть молекулой, в которой, например, FSHрецепторный внеклеточный домен присоединен к FSH, чтобы увеличить время полужизни в плазме и улучшить биологическую активность. Этот препарат можно употребить, чтобы индуцировать фолликулярное созревание для содействия способам репродукции, таким как индукция овуляции или оплодотворения in vitro,и чтобы служить в качестве средств для резкого умножения биологической активности данного гормона, существенного для успеха данного процесса, снижая таким образом потребность и в самом гормоне и в количестве инъекций для достижения овуляции.FSH-рецептор и получение внеклеточного домена человеческого FSH-рецептора было описано, соответственно, в WO 92/16620 и WO 96/38575. В соответствии с конкретным вариантом осуществления настоящего изобретения, внеклеточный домен FSH-рецептора (ECD) можно слить в конструкцию с пептидным линкером,которая содержит сайт распознавания/ расщепления тромбина (29) и представляет собой "привязанное" плечо. Этот пептидный линкер соединяет внеклеточный домен FSH с FSHсубъединицей. Это позволяет удалять внеклеточный домен из FSH-рецептора путем отщепления в сайте расщепления тромбина в виде молекулы, находящейся в контакте с тромбином в большом круге кровообращения. В следующем варианте осуществления настоящего изобретения, вместо сайта расщепления тромбина, использовали сайт распознавания фермента для фермента, который обнаружен в наибольшем избытке в яичнике. В данном способе в качестве молекулы ECD-FSH, двигающейся к яичнику, она подвергается действию ферментов, обнаруживаемых в наивысших концентрациях в этих тканях, a ECD удаляется так,чтобы FSH мог взаимодействовать с рецептором, связанным с мембраной. В очередном варианте осуществления настоящего изобретения, вместо сайта распозна 7 вания фермента, клонировали гибкую шарнирную область между ECD и FSH так, чтобы не удалять энзиматически ECD из данного гормона. В данном способе, при появлении молекулыECD-FSH в яичнике, устанавливается конкуренция между ECD, присоединенным к шарниру, и FSH-рецептором, обнаруживаемым на мембране овариальной клетки. В следующем варианте осуществления настоящего изобретения гибридный белок состоит из ассоциации между парой аа-последовательностей, одна из которых входит в ТВР 1(или фрагменты от аа 20 до аа 161 или до аа 190) в качестве (а) и -субъединицей hCG в качестве(b), а другая всегда входит в ТВР 1 (или те же вышеуказанные фрагменты) в качестве (а) и субъединицей hCG, или ее фрагментов, в качестве (b). В соответствии с данным вариантом настоящего изобретения в зависимости от конкретной последовательности, которая выбрана как (b) (полная -субъединица hCG, или ее фрагменты или ее модификации), получающийся гибридный белок будет обладать одной активностью (только ТВР 1) или объединенными активностями (ТВР 1 и hCG). В данном последнем случае гибридный белок может использоваться, например, для совместного лечения саркомы Капоши и метаболического истощения вAIDS. В очередном варианте настоящего изобретения одну или несколько связей между двумя субъединицами (b) добавляли для усиления стабильности получаемого гибридного белка. Это может быть сделано, например, путем добавления одной или нескольких искусственных межцепочечных дисульфидных связей. Участки для этих поперечных связей могут быть установлены из известных структур гетеродимерных гормонов. Например, подходящий участок для hCG может находиться в месте цистеиновых остатков по -субъединичному остатку Lys45 и субъединичному остатку Glu21, замещая солевой мостик (не ковалентная связь) на дисульфидную связь (ковалентная связь). Другая цель настоящего изобретения заключается в ПЭГовых или других химически модифицированных формах гибридных белков. Очередной целью настоящего изобретения является молекула ДНК, включающая последовательность ДНК, кодирующая вышеуказанный гибридный белок, а также практически те же нуклеотидные последовательности. "Практически те же нуклеотидные последовательности" включают все другие последовательности нуклеиновых кислот, которые, по причине вырожденности генетического кода, кодируют также данную аминокислотную последовательность. Для получения гибридного белка настоящего изобретения ДНК-последовательность (а) получали из существующих клонов, как и (b). Последовательность ДНК, кодирующую тре 002474 8 буемую последовательность (а), лигировали с последовательностью ДНК, кодирующей требуемую последовательность (b). Два из этих слитых продукта инсерцировали и лигировали в подходящую плазмиду или каждый - в отдельную плазмиду. Сразу после формирования экспрессионный вектор или два экспрессионных вектора интродуцировали в подходящую хозяйскую клетку, которая затем экспрессирует вектор(ы) с получением гибридного белка настоящего изобретения, указанного выше. Предпочтительный способ получения белкового гибрида настоящего изобретения осуществляют посредством техники PCR с использованием олигонуклеотидов, специфичных для требуемых последовательностей, для копирования клонов кодирующих последовательности (а) и (b). Экспрессия любого из рекомбинантных белков настоящего изобретения, как указано здесь выше, может быть эффективной в эукариотических клетках (например, дрожжей, клетках насекомых или млекопитающих) или в прокариотических клетках с использованием надлежащих экспрессионных векторов. Можно применить любой способ, известный в данной области техники. К примеру, молекулы ДНК, кодирующие белки, получали любым вышеуказанным способом и инсерцировали в соответственно сконструированные экспрессионные векторы с помощью методик, хорошо известных в данной области техники (см. Sambrook с соавт., 1989). Двухцепочечную кДНК присоединяли к плазмидным векторам путем присоединения к гомополимерному хвосту или путем ограниченного присоединения с использованием синтетических ДНК-линкеров или методами лигирования по тупым концам: ДНК-лигазы, используемые для лигирования молекул ДНК и присоединяющиеся неправильно, удаляли путем обработки щелочной фосфатазой. Для того чтобы обладать способностью экспрессировать требуемый белок, экспрессионный вектор должен также включать специфические нуклеотидные последовательности, содержащие транскрипционную и трансляционную регуляторную информацию, связанную с ДНК, кодирующей требуемый белок таким образом, чтобы дать возможность экспрессироваться гену и наработать белок. Вначале, для того, чтобы данный ген транскрибировался, ему должен предшествовать промотор, распознаваемый РНК-полимеразой, с которым данная полимераза связывается и, таким образом, инициирует процесс транскрипции. Существует множество таких используемых промоторов,которые работают с разными эффективностями(сильные и слабые промоторы). Для эукариотических хозяев можно использовать разные транскрипционные и трансляционные регуляторные последовательности, в 9 зависимости от природы данного хозяина. Их можно получать из вирусных источников, таких как аденовирус, вирус папилломы крупного рогатого скота, обезьяний вирус и т.п., где эти регуляторные сигналы ассоциируются с конкретным геном, который обладает высоким уровнем экспрессии. Примерами являются ТК-промотор герпес-вируса, ранний промотор SV40, промотор дрожжевого гена gа 14 и т.д. Можно выбрать сигналы, регулирующие инициацию транскрипции, которые позволяют репрессировать и активировать так, чтобы модулировать экспрессию генов. Молекулу ДНК, включающую нуклеотидную последовательность, кодирующую гибридный белок настоящего изобретения, инсерцировали в вектор(ы), обладающий присоединенными путем сшивания транскрипционными и трансляционными регуляторными сигналами,которые обладают способностью к интегрированию требуемых генных последовательностей в хозяйскую клетку. Клетки, которые устойчиво трансформировали с помощью интродуцируемой ДНК, могут быть также отобраны путем интродуцирования одного или нескольких маркеров, которые открывают возможность для селекции хозяйских клеток, которые содержат данный экспрессионный вектор. Маркер можно создать также фототрофным для ауксотрофного хозяина, биоцидустойчивым, например, к антибиотикам или тяжелым металлам, таким как медь, или подобным. Селектируемый маркерный ген можно присоединить либо непосредственно к ДНК-овым генным последовательностям для его экспрессии, либо интродуцировать в ту же клетку котрансфекцией. Для оптимального синтеза белков настоящего изобретения могут быть также нужны дополнительные элементы. Факторы, существенные для селекции конкретной плазмиды или вирусного вектора включают: легкость, с которой реципиентные клетки,содержащие вектор, могут быть распознаны и отселектированы от других реципиентных клеток, не содержащих данный вектор; численность копий данного вектора, необходимого для конкретного хозяина; и обладание способностью быть "челночным" вектором между хозяйскими клетками разных видов. Как только для экспрессии получали вектор(ы) или последовательность ДНК, содержащие указанную конструкцию(и), эти ДНКконструкция(и) могут быть интродуцированы в надлежащую хозяйскую клетку любым подходящим образом: трансформацией, трансфекцией, конъюгацией, протопластным слиянием,электропорацией, кальцийфосфатным осаждением, прямой микроинъекцией и т.д. Хозяйские клетки могут быть либо прокариотическими, либо эукариотическими. Предпочтительными являются эукариотические хозяева, например клетки млекопитающих, такие 10 как человека, обезьяны, мыши, и яйцеклетки китайского хомячка (СНО), поскольку они обеспечивают посттрансляционные модификации белковым молекулам, в том числе правильную упаковку или гликозилирование по правильным сайтам. Дрожжевые клетки могут также нести посттрансляционные пептидные модификации, в том числе гликозилирование. Существуют многочисленные рекомбинантные методики, которые используют сильные промоторные последовательности и множество высококопийных плазмид, которые могут использоваться для получения в дрожжах нужных белков. Дрожжи распознают лидерные последовательности в клонируемых генных продуктах млекопитающих и секретируют пептиды, несущие лидерные последовательности (т.е. препептиды). После интродукции вектора(ов) клетки хозяина выращивают на селективной среде, которая в течение роста селектирует клетки, содержащие вектор. Экспрессия клонируемой генной последовательности(стей) приводит к получению требуемых белков. Выделение очисткой рекомбинантных белков осуществляют любым методом, известным для этой цели, т.е. любой удобной процедурой, включающей экстракцию, осаждение,хроматографию, электрофорез или им подобные. Последующая процедура выделения очисткой, которую можно предпочтительно принять для выделения очисткой белка настоящего изобретения, представляет собой хроматографию по сродству, с использованием моноклональных антител, которые связывают мишенный белок и которые получали и иммобилизовали в гелевую матрицу, содержащуюся в колонке. Загрязненные препараты, содержащие рекомбинантный белок, пропускают через колонку. Данный белок будет связываться в колонке с помощью специфического антитела, а примеси будут проскальзывать сквозь не. После промывки этот белок элюируют из геля путем изменения рНили ионной силы. Термин "гибридный белок", как он используется здесь, исходно относится к белку, который содержит два или несколько отличающихся белков или его фрагментов. Используемый здесь "слитой белок" относится к гибридному белку, который состоит из двух или нескольких белков или их фрагментов,соединенных вместе ковалентно. Термин "агрегирование", используемый здесь, означает образование весьма специфичных нековалентных взаимодействий между двумя полипептидными цепями, образующими комплекс, такой как комплекс, существующий междуи -субъединицей гетеродимерного гормона (такого как FSH, LH, hCG или TSH). Термины "лиганд" или "лигандный белок",используемые здесь, относятся к молекуле,иной, чем антитело или иммуноглобулин, спо 11 собной к связыванию с рецептором лигандсвязывающего домена; такая молекула может встречаться в природе или может быть химически модифицирована или химически синтезирована. Термин "лиганд-связывающий домен", используемый здесь, относится к части рецептора,который участвует в связывании лиганда и является, как правило, частью или практически всем внеклеточным доменом. Термин "рецептор", используемый здесь,относится к мембранному белку, который связывается с соответствующим лигандным, запускающим вторичные клеточные ответы, которые активируют или ингибируют внутриклеточный процесс. Другая цель в настоящем изобретении заключается в использовании данного гибридного белка в качестве лекарственного средства. Это лекарственное средство предпочтительно представлено в форме фармацевтической композиции, включающей белок настоящего изобретения вместе с одним или несколькими фармацевтически приемлемыми носителями и/или инертными наполнителями. Такие фармацевтические композиции представляют дальнейшую цель настоящего изобретения. Краткое описание чертежей Настоящее изобретение будет лучше понято при ссылке на прилагаемые чертежи. Фиг. 1(а) и 1(b) показывают, соответственно, конструкции ТВР (20-161)-hCG и ТВР (20161)-hCG и аналогичные последовательности(SEQ ID NOS:5-8). Фиг. 3 представляет собой графическую иллюстрацию дозозависимого защитного эффекта СНО-клеток, экспрессирующих TBP-hCGTNF, в клетках ВТ-20 и разные контроли. Фиг. 4 представляет собой графическую иллюстрацию дозозависимого защитного эффекта COS-клеток, экспрессирующих TBP-hCGTNF, в ВТ-клетках и разные контроли. Фиг. 5 представляет собой графическую иллюстрацию дозозависимого защитного эффекта, выделенного очисткой по сродству, TBPhCG (20-161), экспрессируемого СНО-клеткой,на индуцируемую TNF-цитотоксичность в ВТклетках и разные контроли. 12 Подробное описание предпочтительных вариантов осуществления настоящего изобретения Далее настоящее изобретение описывается при помощи нижеследующих примеров, которые не должны быть построены так, чтобы ограничивать каким-либо образом настоящее изобретение. Примеры Материалы и методы Клеточные линии, используемые в данном исследовании, если не оговорено особо, были получены из Американской коллекции типовых культур (АТСС), Rockville, Maryland. Клеточная линия CHO-DUKX была получена от L. Chasin при Колумбийском университете через D.Houseman на MIT (39). Клетки CHO-DUKX, у которых отсутствовал функциональный ген по дигидрофолатредуктазе, обычно поддерживали в -плюс модифицированной среде Игла (+)МЕМ с добавлением 10% сыворотки плода коровы (FBS). Клетки COS-7 обычно поддерживали в модифицированной Дюльбекко среде Игла (DMEM) с добавлением 10% FBS. Если не оговорено особо,клетки отделяли для поддержания их в log-фазе роста, а реагенты для культивирования получали от GIBCO (Grand Island, New York). 1. Сборка генных конструктов, кодирующих гибридные белки. Нумерация, применяемая для р 55 TNFрецептора, основывается на статье Wallach (40) по клонированию, а нумерация, используемая для hCG-субъединиц, основывается на нумерации значений из статей Fiddes по клонированию(41, 42). Наименование ТВР, или TNFсвязывающий белок, относится к внеклеточным доменным частям TNF-рецепторов, способных связывать TNF. В этих примерах ДНКконструкты именуются в качестве ТВРгибридных белков с партнером и областью ТВР,указанной в номенклатуре данного конструкта. Все TBP-hCG-конструкты содержат сигнальный пептид человеческого гормона роста (hGH) вместо природной сигнальной последовательности р 55. Кроме того, сигнальный пептид hGH помещали таким образом, чтобы он непосредственно предшествовал ТВР-остатку Asp20, который, как ожидается, сделает этот первый остаток по достижении зрелости секретируемым белком. Эти модификации несущественны для основной идеи об использовании hCG в качестве партнера данного гибридного белка. ДНК, кодирующие гибридные белки, конструировали с использованием PCR-методики(43). а. ТВР 1 (20-161)-hCG. Начальный TBP-hCG-конструкт создали биотехнологически,содержащим лигандсвязывающий домен внеклеточной области 13 остаток Cys161), слитый через короткий линкер сисубъединицами hCG (начинающихся,соответственно, с остатков Суs7 или Pro7). Этот конструкт, именуемый ниже как ТВР 1 (20161)-hCG, представляет собой гетеродимер из двух модифицированных hCG-субъединиц,ТВР 1 (20-161)-hCG и ТВР 1 (20-161)-hCG. Олигонуклеотидными праймерами, используемыми для конструкта ТВР 1 (20-161)hCG, были праймер 1 ТТТ ТСТ CGA GAT GGC ТАС AGG ТАА GCG CCC (SEQ ID NO:11) праймер 2 АСС TGG GGC AGC ACCNO:14) Эти и все другие праймеры, описываемые в этих примерах, были синтезированы на ДНКсинтезаторе Applied Biosystems Model 392 (ABI,Foster City, California), с использованием химии амидофосфитного процесса. Поскольку оба TBP-hCG-субъединичных конструкта обладают одним и тем же 5'-концомTBP-hCG-субъединичных конструктов использовали праймер 1 . Другими праймерами,используемыми для конструкта ТВР 1 (20-161)hCG были праймер 2 CCG TGG ACC AGC ACCGTG GGA GGA TCG GGG TG (SEQ ID NO:17) Праймеры 2 и 3 представляют собой обратные комплементы и покрывают и 3'-конец кодирующей области р 55 внеклеточного домена, и 5'-конец -субъединицы hCG. Аналогично,праймеры 2 и 3 также представляют собой обратные комплементы, и покрывают и 3'-конец кодирующей области внеклеточного домена р 55, и 5'-конец -субъединицы hCG. Две PCR-реакции были осуществлены для каждого из двух TBP-hCG-субъединичных конструктов. В первой использовали праймеры 1 и 2 ( или ), а в качестве матрицы использовали плазмиду, кодирующую остатки 20180 растворимого р 55, предшествующие hCGсигнальному пептидуhCMVhGHspcDNA.pA4). Во второй использовали праймеры 3 ( или ) и 4 ( или ), а в качестве матрицы использовали либо плазмидуVent(TM)полимеразы из New England Biolabs (Beverly,Massachusetts), в соответствии с рекомендациями изготовителей, используя в каждой реакции 25 циклов и нижеследующие условия: 100 мкг матричной ДНК 1 мкг каждого праймера 2 Ед. Vent (ТМ)-полимеразы (New EnglandBiolabs) денатурирация при 99 С в течение 30 с отжиг при 59 С в течение 30 с для праймеров 1 и 2 59 С в течение 30 с для праймеров 3 и 4 57 С в течение 30 с для праймеров 1 и 2 63 С в течение 30 с для праймеров 3 и 4 удлинение при 75 С в течение 75 с. Ожидаемые размеры PCR-продуктов подтверждали электрофорезом в 2%-ном агарозном геле и окрашиванием этидийбромидом. Затем полученные фрагменты выделяли очисткой путем пропускания их через Wizard-колонку (Promega), в соответствии с рекомендациями изготовителей колонки. Конечную кодирующую последовательность для ТВР 1 (20-161)-hCGa собирали слиянием, применяя PCR-праймер 1 и праймер 4, используя в качестве матрицы выделенные очисткой продукты из фрагментов р 55 и hCGa,полученных в первых PCR-реакциях. Первые две матрицы, которые связаны с перекрыванием между праймерами 2 и 3, могущие быть денатурированными и отожженными совместно,проходили 10 циклов PCR в отсутствие какихлибо добавляемых праймеров. Условия в этих циклах были практически теми же, что и ранее использованные условия, за тем исключением,что отжиг осуществляли при 67 С, а удлинение осуществляли в течение 2 мин. По окончании этих 10 циклов добавляли праймеры 1 и 4 и осуществляли следующие 10 циклов. Условия для этих заключительных реакций были теми же, которые использовали раньше, за исключением того, что использовали температуру отжига 59 С, а удлинение осуществляли в течение 75 с. Анализ продуктов этой реакции электрофорезом в 1%-ном агарозном геле подтвердил,что получен ожидаемый фрагмент - около 1100 п.н. Продукты данной реакции пропускали через Wizard-колонку для выделения очисткой фрагмента, который затем обрабатывали с помощью XbaI и BamHI и повторно выделяли очисткой в 0,7%-ном легкоплавком геле агарозы. Выделенный очисткой фрагмент субклонировали в плазмиде pSVL (Pharmacia), которую вначале обрабатывали с помощью XbaI и BamHI и выделяли очисткой в геле 0,8%-ного легко 15 плавкого агарозного геля. После лигирования с помощью Т 4-лигазы полученную смесь использовали для трансформации AG1 Е. coli, а затем помещали в LB/ампициллиновые чашки на ночное культивирование при 37 С. Плазмидные ДНК из ампициллин-резистентных колоний анализировали путем обработки с помощьюXhoI и BamHI, чтобы подтвердить присутствие вставки (которую вырезали в этой обработке). Обнаружили шесть клонов, содержащих вставки, а один (клон 7) отобрали для дальнейшей работы и обозначили(содержащий ТВР 1 (20-161)-hCG). Дидезоксисеквенирование ДНК (с использованием Sequenase, U.S. Biochemicals, Cleveland, Ohio) вставки в данном векторе подтвердило, что полученный конструкт был корректным и что нежелательные изменения не были интродуцированы. Конечную кодирующую последовательность для ТВР 1 (20-161)-hCG составляли способом, аналогичным способу, описанному для ТВР 1 (20-161)-hCG, применяя слияние с помощью PCR праймеров 1 и 4 и используя в качестве матрицы выделенные очисткой продукты из р 55 и hCG-фрагментов, полученных в первых PCR-peакциях. Результирующую pSVLплазмиду, содержащую интересующую вставку,обозначили pSVLTBPhCG.b. TBP (20-190)-hCG. Вторую группу TBP-hCG-белков получали путем модификации ТВР(20-161)-hCGконструктов с образованием аналога, содержащего ТВР, охватывающего от Asp20 до Thrl90,вместо области 20-161 в первоначальном аналоге. Это сделали путем замещения фрагмента,между сайгами BglII и XbaI в плазмидеpSVLTBPhCG, на PCR-фрагмент, содержащего данную замену. Этот PCR-фрагмент получили, используя PCR-слияние. Праймерами были праймер 1 ТТТ TAG ATC TCT TCT TGC АСА GTG GAC (SEQ ID NO:18) праймер 2 TGT GGT GCC TGA GTC CTCAGC AGC CCA TG (SEQ ID NO:21) Праймеры 1 и 2 использовали для получения последовательности, кодирующей дополнительные р 55-остатки из 161-190. PCR-реакцию осуществляли практически так же, как она описана раньше, с использованием 1 мкг каждого праймера и pUC-р 55 в качестве матрицы. Аналогично, праймеры 3 и 4 использовали для получения с помощью PCR линкера между 3'концом ТВР-кодирующей области и 5'-концом области, кодирующей -субъединицу hCG, используя в качестве матрицы плазмиду 16 из этих PCR-реакций (соответственно, около 296 п.н. и 121 п.н.) подтвердили в полиакриламидном гелевом электрофорезе (PAGE) в 8%ном геле, а затем выделили очисткой с использованием Wizard-колонки. Созданные праймеры 2 и 3 были такими, что они содержали область перекрывания так, чтобы два PCR-продукта (из праймеров 1 и 2 и из праймеров 3 и 4) могли бы быть гибридизованы в PCR-слиянии с праймерами 1 и 4. После реакции слияния полученный требуемый продукт, около 400 п.н., подтвердили и выделили очисткой с использованием 1,5%-ного агарозного геля и Wizard-колонки. Эту ДНК затем обработали с помощью BglII иXbaI и лигировали с pSVLTBPhCG, обработанной BglII/XbaI. Наличие вставки в плазмидах, выделенных из трансформированной AGI Е. coli, подтвердили путем обработки с помощью BglII и XbaI. Полученный новый конструкт обозначили pSVLTBP (20-190)-hCG. Аналогично, плазмиду pSVLTBPhCG модифицировали путем замещения BglII-XcmIфрагмента. Однако это сделали путем субклонирования единственного PCR-продукта, а не с помощью слияния PCR-продукта. Праймеры 1 и 2b (см. ниже) использовались с pUC-p55 в качестве матрицы. праймер 2b ТТТ ТСС АСА GCC AGG GTGBglII/XbaI. Наличие вставки в плазмидах, выделенных из трансформированной AGI Е. coli,подтверждали путем обработки с помощьюBglII и XcmI. Полученный новый конструкт обозначили pSVLTBP (20-190) -hCG. Впоследствии эти новые конструкты подтвердили путем секвенирования ДНК. В дополнение к получению этих новых плазмид, основанных на pSVL, эти конструкты субклонировали также в другие экспрессионные векторы, чтобы сделать их вполне подходящими для стабильной экспрессии в СНО, особенно - в вектор D, ранее описанный в качестве плазмиды CLH3AXSV2DHFR (45). Это осуществляли путем преобразования BamHI-сайта, фланкирующего вставки в векторах, основанных наpSVL, в XhoI-сайт, а затем вырезая данную вставку с XhoI и клонируя е в D, обработанный XhoI. 2. Временная и постоянная экспрессия гибридных белков. Трансфекции COS-7-клеток (АТСС CRL 1651, ссылка 46) для временной экспрессииTBP-hCG-гибридных белков осуществляли с использованием электропорации (47). Экспоненциально растущие клетки COS-7 удаляли 17 трипсинизацией, собирали мягким центрифугированием (800 об./мин, 4 мин), отмывали холодным фосфатно-солевым буферным раствором (PBS), рН 7,3-7,4, и затем переосаждали центрифугированием. Клетки ресуспендировали при концентрации 5106 клеток на 400 мкл холодного PBS и смешивали с 10 мкл плазмидной ДНК в предварительно охлажденной кювете с 2 мм промежутком для электропорации. Для контрансфекций использовали 5 мкг каждой плазмиды. Указанную кювету и клетки предварительно охлаждали на льду в течение следующих 10 мин и затем подвергали электропорации,используя прибор ВТХ Модель 600 и условия 125 В, 950 мкФ и R=8. Потом группу клеток,охлажденных в течение 10 мин на льду, переносили в 15 мл коническую пробирку, содержащую 9,5 мл полной среды (модифицированная Дюльбекко среда Игла (DMEM) с добавлением 10% сыворотки плода коровы (FBS) и 1% Lглутамина) при комнатной температуре, и оставляли при комнатной температуре на 5 мин. После осторожного смешивания в 15 мл пробирке, е содержимое полностью высевали на две Р 100-чашки и помещали в 37 С 5% СO2 инкубатор. Через 18 ч эту среду меняли, а в некоторых случаях заменяли новой средой, содержащей только 1% или 0% FBS. После следующих 72 ч собирали эту кондиционированную среду, центрифугировали для удаления из нее клеток и хранили замороженной при -70 С. Трансфекции клеток CHO-DUKX (СНО) для временной или постоянной экспрессии осуществляли с использованием кальцийфосфатного осаждения ДНК. За 24 ч до трансфекции экспоненциально растущие СНО-клетки помещали в 100 мм культуральные чашки при плотности 7,5105 клеток на чашку. В день трансфекции 10 мкг плазмидной ДНК вносили в 0,5 мл трансфекционного буфера (см. ниже),добавляли 31 мкл 2 М CaCl2, полученный раствор ДНК-СаСl2 смешивали путем встряхивания и оставляли стоять при комнатной температуре в течение 45 мин. После этого данную среду отсасывали из этих чашек, к клеткам добавляли ДНК с использованием стерильной пластиковой пипетки и эти клетки оставляли при комнатной температуре на 20 мин. В конце этого периода в эти чашки вносили 5 мл полной (+)МЕМсреды, содержащей 10% FBS, которые инкубировали при 37 С в течение 4-6 ч. Затем эту среду отсасывали из инкубированных чашек и клетки подвергали глицериновому шоку путем инкубирования их с раствором из 15% глицерола в трансфецирующем буфере при 37 С в течение 3,5 мин. После удаления глицеринового раствора клетки дважды промывали с PBS,вновь заполняли 10 мл полной питательной(+)MEM-среды, 10% FBS и возвращали в инкубатор на 37 С. Для постоянных трансфекций через 48 ч клетки снимали, 1:10, и подпитывали 18 на селективной среде (полная -минус MEM(отсутствие нуклеозидов), 10% диализированной FBS и 0,02 мкМ метотрексата). Нетрансфецированные (нерезистентные) клетки обычно элиминировались за 3-4 недели, оставляя популяцию из трансфецированных, метотрексатрезистентных клеток. 3. Количественный анализ экспрессии. Секрецию гибридных белков трансфецированными клетками определяли с использованием коммерческого набора для определения растворимого р 55 (RD Systems; Minneapolis,Minnesota), в соответствии с инструкциями изготовителей. Данный анализ дает также оценку уровня гибридных белков в стандартизованной и процессируемой среде, которая служит в качестве основы для отбора доз, используемых для биоанализа. 4. Оценка образования гетеродимера. Чтобы оценить способность TBP-hCGсубъединичных гибридов на объединение и формирование гетеродимеров, осуществляли сэндвич-иммунотест с использованием антител к hCG-субъединицам. В этом анализе моноклональными антителами к hCG-субъединице покрывали планшеты для микротитрования и использовали для аналитического связывания. Вначале детектировали поликлональные козьи антитела, направленные против человеческой субъединицы TSH ( 082422G Biodesign International; Kennenbunkport, Maine), которые, в свою очередь, определяли с использованием конъюгированных с пероксидазой хрена кроличьих антител к козьим поликлональным антителам (Cappel; Durham, North Carolina). В данной работе использовали несколько различных антител к антителам -субъединицыhCG, которые все не выявляют перекрестной реактивности со свободными -субъединицами. Одно из этих антител (3/6) используется в коммерчески доступном MAIAclone hCG аналитическом наборе (Biodata; Rome, Италия). Планшеты с высоким связыванием белка для микротитрования (Costar N3590) покрывали антителом для связывания путем инкубации (2 ч при 37 С) со 100 мкл/лунку раствора антитела 5 мкг/мл в покрывающем буфере (PBS/рН 7,4, 0,1 мМ Са, 0,1 мг Mg). После однократной промывки раствором для промывания (PBS, рН 7,4+ 0,1% Твин 20) данный планшет фиксировали путем полного заполнения лунок (400 мкл/лунку) фиксирующим раствором (3% бычий сывороточный альбумин (BSA); фракция V- А-4503 Sigma) в PBS, рН 7,4 и инкубации в течение 1 ч при 37 С или в течение ночи при 4 С. Затем планшет дважды промывали промывочным раствором и добавляли стандартный и экспериментальный образцы, разбавленные разбавителем (5 мг/мл BSA в PBS, рН 7,4) с получением объема 100 мкл. После инкубирования образцов и планшета в течение 2 ч при 37 С, 19 этот планшет снова дважды промывали промывочным раствором. Первичное детектируемое антитело, в разведении разбавителем 1:5000,вносили (100 мкл/лунку) и инкубировали в течение 1 ч при 37 С. Вносили вторичное детектируемое антитело (кроличьи антитела, конъюгированные с HRP, к козьим антителам 1g), разбавленное 1:5000 разбавителем (из расчета 100 мкл/лунку), и после инкубации в течение 1 ч при 37 С планшет трижды промывали промывочным раствором. Добавляли 100 мкл субстратного раствора ТМВ (Kirkegaard and PerryLaboratories), этот планшет инкубировали 20 мин в темноте при комнатной температуре и затем данную ферментативную реакцию останавливали добавлением 50 мкл/лунку 0,3 МH2SO4. Затем этот планшет анализировали с использованием устройства для прочтения планшета для микротитрования при длине волны 450 нм. 5. Частичное выделение очисткой. Для лучшего количественного определения активностей этих гибридных белков, TBPhCG-гибридные белки частично выделяли иммунноаффинной хроматографией. Используемое антитело было моноклональным антителом,коммерчески доступным от RD Systems (МАВ 225). Используемая колонка была наполненаCNBr-активированной сефарозой, нагруженной антителом, по прилагаемым инструкциям изготовителей (Pharmacia). Стандартизованную (кондиционную) среду собирали через конец сливной трубки матрасов Т-175 каждой линии, используя ежедневный сбор из 50 мл SFMII-среды (GIBCO), пять сборов с каждой линии. Эти сборы подвергали центрифугированию (1000 об./мин) для удаления клеточного дебриса. Затем в этом материале определяли ТВР-содержимое с применением коммерческого иммуноанализа и концентрировали так, чтобы легко различимая концентрация ТВР составляла около 50 нг/мл. 10 мл концентрированного TBP-hCG (образец 18873) переносили приблизительно в 1 М NaCl добавлением NаСl и доведения этого раствора до проводимости приблизительно 85mS/cm. Его пропускали через 0,5 мл анти-ТВР иммунно-аффинную колонку. Пропущенный через колонку раствор собирали, пропускали через колонку второй раз. После этого колонку промывали 1 М NaCl в PBS. Связавшийся ТВР(20-161)-hCG собирали после элюирования с помощью 50 мМ лимонной кислоты (рН 2,5). Полученный элюат (приблизительно 7 мл) концентрировали путем фильтрации, используя 20 циями изготовителей (Amicon), до объема приблизительно 200 мкл. Приблизительно 800 мклPBS добавляли для доведения образца до объема 1 мл, который хранили при 4 С до тестирования в биоанализе. 6. Определение анти-TNF-активности. Описано множество анализов по цитотоксичности, индуцированной TNF in vitro, для оценивания аналогов растворимых TNFрецепторов. Мы применили анализ, используя карциномную линию клеток молочной железы человека, клетки ВТ-20 (АТСС НТВ 19). Использование этих клеток в качестве основы для ТВР-биоанализа описано раньше (48). Эти клетки культивировали при 37 С в среде RPMI 1640 с добавлением 10%-ной инактивированной нагреванием FBS. Клетки растили до максимум 80-90% слияния (конфлюэнтности), снимали отслаиванием каждые 3-4 дня при плотности посева около 3106 клеток на матрас Т 175 см 2. ВТ-20-анализ использовали, включая клеточное окрашивание кристаллическим фиолетовым в качестве метода детектирования для анализа выживания клеток после обработки с помощью TNF. Мертвые клетки не способны поглощать и удерживать данный краситель. Коротко, протокол, используемый для анализа активности анти-TNF, заключается в нижеследующем. Рекомбинантный человеческийTNF (RD Systems) и экспериментальные образцы помещали в среду (RPMI 1640 с 5% инактивированной нагреванием FBS), вносили в лунки 96-луночных планшетов для культивирования. Затем в эти планшеты помещали клетки при плотности 1105 клеток/лунку. В исследованиях по титрованию заблаговременно определяли количество добавленного TNF и соответствующую дозу, при которой около 50% клеток погибало. После внесения образцов клетки культивировали в течение 48 ч при 39 С, после чего определяли долю живых клеток, используя окрашивание кристаллическим фиолетовым и устройство для считывания планшета для микротитрования (570 нм). Результаты 1. Изучение конструктов. Краткое изучение созданных гибридных белков суммировано ниже; два контрольных белка, мономерный растворимый р 55 (r-hTBP-1) и димерный ТВР-иммуноглобулиновый слитый белок (TBP-IgG3) (полученный практически,как описано в (10, были изучены в сравнительных целях. Партнер в слиянии Нет Тяжелая цепь константной области IgG3 21 Последовательности ДНК, кодирующие ТВР (20-190)-hCG и ТВР (20-161)-hCG, представлены, соответственно, на фиг. 1 и 2. 2. Секреция TBP-hCG-белков. Обнаружено, что у трансфицированных клеток млекопитающих все анализируемые конструкты продуцируются и секретируются в культуральную среду. Данные, иллюстрирующие это, показаны в табл. 1 и 2. 3. TBP-hCG(/)-слитые белки смонтированы в гетеродимеры. Объединение TBP-hCG и TBP-hCG подтверждали с использованием сандвич-анализа для hCG-гетеродимера. Только объединенная трансфекцияислитых субъединиц приводила к детекции гетеродимера (табл. 3). 4. TBP-hCG-гибридные белки проявляют большую активность, чем ТВР-мономер. Обнаружено, что гибридные белки, продуцируемые либо в COS-7, либо в СНО-клетках,являются сильными ингибиторами TNF в ВТ 20-биоанализе. Некоторые из проанализированных образцов кратко суммированы в табл. 4. Негативные контроли (стандартизованная среда из псевдотрансфекций) были включены для 1x-средовых образцов. Как проиллюстрировано на фиг. 3-5 (точки на у-оси), добавление TNF (2,5 нг/мл) приводит к четкому снижению численности живых клеток(как установлено при OD 570). В каждом случае активные образцы обладают, в качестве максимального защитного эффекта, восстановлением клеточной жизнеспособности до уровня, обнаруживаемого в отсутствие добавленного TNF(т.е. в контроле, помеченном "только клетки"). Позитивные контроли, r-hTBP-1 и TBPIgG3, оба являются защитными, показывая четкую дозовую зависимость и ED50, приблизительно 100 нг/мл для r-hTBP-1 (фиг. 3-5) и около 1,5 нг/мл для TBP-IgG3 (фиг. 3) соответственно.COS) или выделенные в иммунной очистке показывают дозозависимую защиту с приблизительными ED50 в диапазоне от 2-11 нг/мл (фиг. 3-5). Результаты по in vitro-биоанализу приведены в табл. 5. Представленные данные свидетельствуют, что гибридные белки ингибируютTNF-цитотоксичность и что они намного сильнее, чем ТВР-мономер. Негативные контроли лишены защитной активности. Помимо того, что димеризация ТВР повышает эффективность, представляется также возможным, что активность гибридных белков связана не с димерным взаимодействием ТВР, а со стерическим ингибированием и обусловлена партнером данного гибрида, вмешивающегося в связывание растворимого TBP/TNF с поверхностно-клеточными TNF-рецепторами. Все ссылки, приводимые здесь, в том числе журнальные статьи или рефераты, опублико 002474 22 ванные или аналогичные патентным заявкам США или иностранным патентным заявкам,патенты, изданные в США или иностранные,или какие-либо иные ссылки, полностью включены здесь путем ссылки, в том числе все данные, таблицы, фигуры и текст, представленные в этих приводимых ссылках. Кроме того, полное содержание ссылок, приводимых в рамках ссылок, приведенных здесь, также полностью включены путем ссылки. Ссылка на стадии известного способа, стадии традиционных способов, известные способы или традиционные способы не представляют собой, в любом случае, признания того, что любой аспект, описание или вариант осуществления настоящего изобретения является раскрытым, описанным или предполагаемым в данной,относящейся к делу, области техники. Предшествующее описание конкретных вариантов осуществления настоящего изобретения столь полно выявляет общую суть настоящего изобретения, что другие, применив знания специалиста в рамках данной области (в том числе, содержание ссылок, приводимых здесь),могут легко модифицировать и/или адаптировать для всевозможного применения такие конкретные варианты осуществления настоящего изобретения, без чрезмерного экспериментирования, не выходя за рамки общей идеи настоящего изобретения. По этой причине подразумевается, что такие адаптации и модификации ограничиваются значением и сферой, эквивалентными раскрываемым вариантам осуществления настоящего изобретения, основанным на указании и принципе, представленных здесь. Необходимо иметь в виду, что фразеология или терминология представлена здесь с целью описания, а не ограничения, так, чтобы терминология или фразеология настоящего описания интерпретировалась бы младшими специалистами в свете указаний и установки, представленных здесь, в сочетании со знанием рядового специалиста в данной области. Таблицы Таблица 1: COS-7 временная экспрессия Конструкты экспрессировали с использованием мышиного металлотионеинового промоторсодержащего вектора pD. Таблица 3: COS-7 временная экспрессия Конструкты экспрессировали с использованием мышиного металлотионеинового промоторсодержащего вектора pD. Таблица 4: Образцы, проанализированные на анти-TNF-активность Конструкт Источник Происхождение клеток образцаr-hTBP-1 СНО выделенный очисткой 1x-кондиционированTBP-lgG3 СНО ная среда выделенный иммунTBP (20-161)-hCG СНО ной очисткой (антиТВР) 1x-кондиционированTBP (20-190)-hCG СНО ная среда 1x-кондиционированTBP(20-190)-hCGCOS ная среда Таблица 5: Предварительная оценка гибридных белков в анализе на ТNF-цитотоксичность Анти-TNFПартнер слияактивность Конструкт ния ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Гибридный белок, содержащий две коэкспрессируемые аминокислотные последовательности, образующие гетеродимер, каждая из которых представляет собой: а) по крайней мере, одну аминокислотную последовательность, выбранную из группы, состоящей из цепи гомомерного рецептора или его фрагмента, цепи гетеродимерного рецептора или его фрагмента, лиганда, другого, чем гонадотропный гормон или его фрагмент, легкой или тяжелой цепи антитела, легкой цепи антитела, которая ассоциирована с соответствующей тяжелой цепью антитела, и тяжелой цепи антитела, которая ассоциирована с соответствующей 33 легкой цепью антитела, причем указанный лиганд или фрагмент сохраняет лиганд-рецепторсвязывающую активность и указанная цепь указанного гомомерного рецептора или его фрагмента и указанная цепь указанного гетеромерного рецептора или его фрагмента сохраняют лиганд-рецептор-связывающую активность либо сами по себе, либо в ассоциации с гомологичной или гетерологичной цепью указанного рецептора; и б) субъединицу гетеродимерного белкового гормона или ее фрагмент, который сохраняет способность образовывать гетеродимер с другими субъединицами данного гормона, причем последовательности а) и б) связаны непосредственным образом или через пептидный линкер, а последовательность б) при совместной экспрессии двух указанных последовательностей обладает способностью к агрегации с образованием гетеродимера. 2. Гибридный белок по п.1, отличающийся тем, что последовательность а) выбирают из группы, состоящей из TNF связывающего белка(ТВР 1), TNF связывающего белка 2(ТВР 2) или фрагмента указанных ТВР 1 или ТВР 2, включающего лиганд-связывающий домен, внеклеточного домена рецептора IFN/ или IFN,рецептора гонадотропного гормона или его внеклеточных фрагментов, легких цепей антитела или их фрагментов, необязательно ассоциированных с соответствующими тяжелыми цепями,тяжелых цепей антитела или их фрагментов,необязательно ассоциированных с соответствующими легкими цепями, Fab-доменов антитела и интерлейкина 6, интерферона-бета, тромбопоэтина или их фрагментов. 3. Гибридный белок по п.1, отличающийся тем, что указанную последовательность б) выбирают из группы, состоящей из субъединиц хорионического гонадотропина человека (ХГЧ,hCG), фолликулостимулирующего гормона(ФСГ, FSH), лютеинизирующего гормона (ЛГ,LH), тиреостимулирующего гормона (TSH) или ингибина или их фрагментов. 4. Гибридный белок по п.1, отличающийся тем, что последовательность а) присоединена либо непосредственным образом, либо через пептидный линкер к N-концу последовательности б). 5. Гибридный белок по п.1, отличающийся тем, что последовательность а) присоединена либо непосредственным образом, либо через пептидный линкер к С-концу последовательности б). 6. Гибридный белок по п.1, отличающийся тем, что последовательность а) представляет собой последовательность TNF связывающего белка 1 (ТВР 1) или его фрагмента, включающе 002474 34 го аминокислотные остатки 20-161 или 20-190, а последовательность б) представляет собой альфа- и бета-субъединицы гонадотропина. 7. Гибридный белок по п.1, отличающийся тем, что последовательность а) представляет собой внеклеточный домен гормона гонадотропного рецептора, а последовательность б) представляет собой альфа- и бета-субъединицы гонадотропина. 8. Гибридный белок по п.7, отличающийся тем, что последовательность а) представляет собой внеклеточный домен рецептора фолликулостимулирующего гормона (FSH), а последовательность б) представляет собой субъединицуFSH. 9. Гибридный белок по п.7, отличающийся тем, что указанные последовательности а) и б) соединены пептидным линкером. 10. Гибридный белок по п.9, отличающийся тем, что указанный пептидный линкер содержит расщепляемый ферментом сайт. 11. Гибридный белок по п.10, отличающийся тем, что указанный расщепляемый ферментом сайт представляет собой сайт, расщепляемый тромбином. 12. Гибридный белок по п.10, отличающийся тем, что указанный расщепляемый ферментом сайт распознается и расщепляется ферментом, который обнаруживается в яичнике. 13. Гибридный белок по п.9, отличающийся тем, что указанный пептидный линкер служит в качестве подвижного шарнира. 14. Гибридный белок по п.1, в котором добавлена одна или более связей между каждой последовательностью б), которые агрегируют с образованием гетеродимера. 15. Последовательность ДНК, кодирующая гибридный белок по п.1. 16. Экспрессирующий вектор, содержащий последовательность ДНК по п.15. 17. Линия клеток, содержащая экспрессирующий вектор по п.16 и способная экспрессировать указанный гибридный белок. 18. Способ продуцирования гибридного белка, включающий культивирование линии клеток по п.17 и выделение экспрессируемого в указанных клетках гибридного белка. 19. Фармацевтическая композиция, включающая гибридный белок по п.1 и фармацевтически приемлемый носитель и/или наполнитель. 20. Способ индуцирования созревания фолликулов, включающий введение нуждающемуся в этом субъекту фармацевтической композиции, содержащей гибридный белок по п.8. Фиг. 1(а) Слитой конструкт ТВР (20-161)-hCG Фиг. 2(а) Слитой конструкт ТВР (20-190)-hCG Фиг. 1(b) Слитой конструкт ТВР (20-190)-hCG Фиг. 2(b) Слитой конструкт ТВР (20-190)-hCG
МПК / Метки
МПК: A61P 5/00, C12N 15/62, C07K 14/59, A61K 38/24
Метки: способ, гетеродимеры, использования, белок, образующий, получения, гибридный
Код ссылки
<a href="https://eas.patents.su/20-2474-gibridnyjj-belok-obrazuyushhijj-geterodimery-sposob-ego-polucheniya-i-ispolzovaniya.html" rel="bookmark" title="База патентов Евразийского Союза">Гибридный белок, образующий гетеродимеры, способ его получения и использования</a>